Новые лиганды гистамин h3-рецептора и их терапевтические применения
Номер патента: 19594
Опубликовано: 30.04.2014
Авторы: Лёкомт Жан-Мари, Пупарден-Оливье Оливия, Левоэн Николас, Шварц Жан -Шарль, Бертран Изабель, Линьо Ксавье, Капе Марк, Лабию Оливье, Робер Филипп
Формула / Реферат
1. Соединение формулы (I)
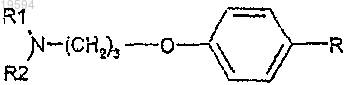
где R1 и R2, взятые вместе с атомом азота, к которому они присоединяются, образуют мононасыщенное азотсодержащее кольцо, представленное формулой
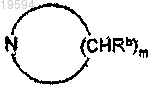
где m=4 или 5;
каждый Rb независимо является одинаковым или различным и представляет собой водород или C1-C4-алкил;
R выбирают из группы, состоящей из
пиридильной группы, где N-атом может быть в форме N-оксида (N+-O-) или С3-10циклоалкила, каждый, при необходимости, замещен одним или более атомами галогена, C1-C4-алкилом, О-C1-C4-алкилом, ОН, NR3R4; или
бициклического арила, выбранного из нафтила, при необходимости, замещенного одним или более атомами галогена, C1-C4-алкилом, О-C1-C4-алкилом, ОН, NR3R4, -С2-С4-алкенилом или -C2-C4-алкинилом,
где алкил, алкенил или алкинил являются, при необходимости, замещенными гетероциклом, функциональной основной группой, выбранной из NR3R4;
где R3, R4 независимо являются водородом, линейной или разветвленной C1-C4-алкильной группой или арильной группой или, взятые вместе с атомом азота, к которому они присоединяются, образуют насыщенный или частично ненасыщенный моноциклический или бициклический C6-C14-гетероцикл или С6-С14-гетероарил, при необходимости, содержащий один или более дополнительных гетероатомов и/или, при необходимости, замещенный одним или более атомами галогена, C1-C4-алкилом, О-C1-C4-алкилом, ОН;
или его фармацевтически приемлемая соль, гидрат или соль гидрата либо полиморфная кристаллическая структура или их оптический изомер, рацемат, диастереомер или энантиомер.
2. Соединение по п.1, где R представляет собой нафтил и по меньшей мере один Rb представляет собой C1-C4-алкил.
3. Соединение по п.1 или 2, где
R1 и R2 образуют вместе с атомом азота, к которому они присоединяются, мононасыщенное азотсодержащее кольцо формулы
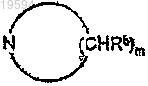
где m=4 или 5;
каждый Rb независимо является одинаковым или различным и представляет собой водород или C1-C4-алкил;
R выбирают из
пиридильной группы, где N-атом может быть в форме N-оксида (N+-O-) или С3-С10-циклоалкила, каждый, при необходимости, является замещенным одним или более атомами галогена, C1-C4-алкила, О-C1-C4-алкила, ОН, NR3R4; или
бициклического арила, выбранного из нафтила, при необходимости, замещенного одним или более атомами галогена, C1-C4-алкилом, О-C1-C4-алкилом, ОН, NR3R4, -C2-С4-алкенилом или -С2-С4-алкинилом,
где алкил, алкенил или алкинил являются, при необходимости, замещенными гетероциклом, функциональной основной группой, выбранной из NR3R4;
где R3, R4 независимо являются водородом, линейной или разветвленной C1-C4-алкильной группой или арильной группой или, взятые вместе с атомом азота, к которому они присоединяются, образуют насыщенный или частично ненасыщенный моноциклический или бициклический С6-С14-гетероцикл или С6-С14-гетероарил, при необходимости, содержащий один или более дополнительных гетероатомов и/или, при необходимости, замещенный одним или более атомами галогена, C1-C4-алкилом, О-C1-C4-алкилом, ОН;
или его фармацевтически приемлемая соль, гидрат или соль гидрата либо полиморфная кристаллическая структура или их оптический изомер, рацемат, диастереомер или энантиомер.
4. Соединение по любому из пп.1-3, где
R1 и R2 вместе с атомом азота, к которому они присоединяются, образуют мононасыщенное азотсодержащее кольцо формулы
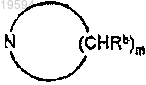
где m=4 или 5,
каждый Rb независимо является одинаковым или отличается и является водородом или С1-С4-алкилом;
R выбирают из групп, которые выбирают из
пиридильной группы, где N-атом может быть в форме N-оксида (N+-O-) или C3-C10-циклоалкила, каждый, при необходимости, является замещенным одним или более атомами галогена, C1-C4-алкила, О-C1-C4-алкила, ОН, NR3R4;
где алкил, алкенил или алкинил являются, при необходимости, замещенными гетероциклом, функциональной основной группой, выбранной из NR3R4;
где R3, R4 независимо являются водородом, линейной или разветвленной C1-C4-алкильной группой или арильной группой или, взятые вместе с атомом азота, к которому они присоединяются, образуют насыщенный или частично ненасыщенный моноциклический или бициклический C6-C14-гетероцикл или C6-C14-гетероарил, при необходимости, содержащий один или более дополнительных гетероатомов и/или, при необходимости, замещенный одним или более атомами галогена, C1-C4-алкилом, О-C1-C4-алкилом, ОН;
или его фармацевтически приемлемая соль, гидрат или соль гидрата либо полиморфная кристаллическая структура или их оптический изомер, рацемат, диастереомер или энантиомер.
5. Соединение по любому из пп.1-4, где
R представляет собой одну из пиридильных групп, где N-атом может быть в форме N-оксида (N+-O-), при необходимости, является замещенным одним или более атомами галогена или C1-С4-алкилом;
где алкил, алкенил или алкинил являются, при необходимости, замещенными гетероциклом или функциональной основной группой, выбранной из NR3R4.
6. Соединение по любому из пп.1-5, выбранное из
транс-1-{3-[4-(N,N-диметилкарбамоил)фенокси]пропил}-3,5-диметилпиперидина,
транс-1-{3-[4-(N,N-тетраметиленкарбамоил)фенокси]пропил}-3,5-диметилпиперидина,
транс-1-{3-[4-(1-гидрокси-1-метилэтил)фенокси]пропил}-3,5-диметилпиперидина,
(RS)-1-{3-[4-(1-гидрокси-1-метилэтил)фенокси]пропил}-3-метилпиперидина,
1-{3-[4-(1-гидрокси-1-пропилбутил)фенокси]пропил}пиперидина,
1-{3-[4-(1-гидроксициклопентил)фенокси]пропил}пиперидина,
1-{3-[4-(1-гидрокси-1-аллилбут-3-енил)фенокси]пропил}пиперидина,
транс-1-[3-(4-изопропенилфенокси)пропил]-3,5-диметилпиперидина,
(3S,5S)-1-{3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил}-3,5-диметилпиперидина,
транс-3,5-диметил-1-[3-(4-феноксифенокси)пропил]пиперидина,
1-{3-[4-(цис-4-диметиламиноциклогекс-1-ил)фенокси]пропил}пиперидина,
1-{3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил}пиперидина,
1-{3-[4-(цис-4-тетраметиленаминоциклогекс-1-ил)фенокси]пропил}пиперидина,
1-{3-[4-(транс-4-тетраметиламиноциклогекс-1-ил)фенокси]пропил}пиперидина,
транс-1-{3-[4-(цис-4-диметиламиноциклогекс-1-ил)фенокси]пропил}-3,5-диметилпиперидина,
транс-1-{3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил}-3,5-диметилпиперидина,
1-{3-[4-(4-пиридил)фенокси]пропил}пиперидина,
транс-3,5-диметил-1-{3-[4-(4-пиридил)фенокси]пропил}пиперидина,
1-{3-[4-(3-пиридил)фенокси]пропил}пиперидина,
(3S,5S)-1-{3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил}-3,5-диметилпиперидина,
(3S)-1-{3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил}-3-метилпиперидина,
(3S)-3-метил-1-{3-[4-(4-пиридил)фенокси]пропил}пиперидина,
(3S,5S)-1-{3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропил}-3,5-диметилпиперидина,
(3S)-1-{3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропил}-3-метилпиперидина,
1-{3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропил}пиперидина,
1-{3-[4-(цис-4-морфолиноциклогекс-1-ил)фенокси]пропил}пиперидин дигидрохлорида,
1-{3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропил}пиперидин дигидрохлорида,
(3S)-3-метил-1-{3-[4-(цис-4-морфолиноциклогекс-1-ил)фенокси]пропил}пиперидин дигидрохлорида,
(3S)-3-метил-1-{3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропил}пиперидин дигидрохлорида,
1-{3-[4-(цис-4-диметиламиноциклогекс-1-ил)метилфенокси]пропил}пиперидина,
1-{3-[4-(транс-4-диметиламиноциклогекс-1-ил)метилфенокси]пропил}пиперидина,
(3S,5S)-1-{3-[4-(транс-4-аминоциклогекс-1-ил)фенокси]пропил}-3,5-диметилпиперидина,
(3S)-4-{4-[3-(3-метилпиперидин-1-ил)пропокси]фенил}пиридин-1-оксида,
4-[4-(3-пиперидинопропокси)фенил]пиридин 1-оксида,
2-метил-4-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридин 1-оксида,
2-гидрокси-4-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридина,
1-метил-4-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридина,
2-(3-пиперидинопропокси)-4-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридина,
2-метил-4-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридина,
1-{3-[4-(4-гидроксициклогексил)фенокси]пропил}пиперидина,
(3S)-1-{3-[транс-4-(4-гидроксициклогексил)фенокси]пропил}-3-метилпиперидина,
(3S)-1-{3-[4-(4-гидроксициклогексил)фенокси]пропил}-3-метилпиперидина,
1-{3-[транс-4-(4-гидроксициклогексил)фенокси]пропил}пирролидина,
(3S)-1-{3-[4-(4-пропокси-4-метилциклогексил)фенокси]пропил}-3-метилпиперидина,
1-{3-[транс-4-(4-гидроксициклогексил)фенокси]пропил}пиперидина,
1-{3-[транс-4-(4-гидроксициклогексил)фенокси]пропил}-2-метилпирролидина
или из их фармацевтически приемлемых солей, гидратов или гидратов солей либо полиморфных кристаллических структур этих соединений.
7. Соединение по любому из пп.1-6, выбранное из
транс-1-{3-[4-(N,N-диметилкарбамоил)фенокси]пропил}-3,5-диметилпиперидина,
транс-1-{3-[4-(1-гидрокси-1-метилэтил)фенокси]пропил}-3,5-диметилпиперидина,
1-{3-[4-(1-гидрокси-1-пропилбутил)фенокси]пропил}пиперидина,
(3S,5S)-1-{3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил}-3,5-диметилпиперидина,
1-{3-[4-(цис-4-диметиламиноциклогекс-1-ил)фенокси]пропил}пиперидина,
1-{3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил}пиперидина,
1-{3-[4-(цис-4-тетраметиленаминоциклогекс-1-ил)фенокси]пропил}пиперидина,
1-{3-[4-(транс-4-тетраметиламиноциклогекс-1-ил)фенокси]пропил}пиперидина,
транс-1-{3-[4-(цис-4-диметиламиноциклогекс-1-ил)фенокси]пропил}-3,5-диметилпиперидина,
транс-1-{3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил}-3,5-диметилпиперидина,
транс-3,5-диметил-1-{3-[4-(4-пиридил)фенокси]пропил}пиперидина,
1-{3-[4-(3-пиридил)фенокси]пропил}пиперидина,
(3S)-3-метил-1-{3-[4-(4-пиридил)фенокси]пропил}пиперидина,
1-{3-[4-(цис-4-морфолиноциклогекс-1-ил)фенокси]пропил}пиперидина,
1-{3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропил}пиперидина,
(3S)-3-метил-1-{3-[4-(цис-4-морфолиноциклогекс-1-ил)фенокси]пропил}пиперидина,
(3S)-3-метил-1-{3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропил}пиперидина,
(3S)-4-{4-[3-(3-метилпиперидин-1-ил)пропокси]фенил}пиридин 1-оксида,
(3S)-1-{3-[транс-4-(4-гидроксициклогексил)фенокси]пропил}-3-метилпиперидина,
(3S)-1-{3-[4-(4-гидроксициклогексил)фенокси]пропил}-3-метилпиперидина
или из их фармацевтически приемлемых солей, гидратов или гидратов солей либо полиморфных кристаллических структур этих соединений.
8. Соединение по любому из пп.1-7, выбранное из
транс-1-{3-[4-(1-гидрокси-1-метилэтил)фенокси]пропил}-3,5-диметилпиперидина,
1-{3-[4-(1-гидрокси-1-пропилбутил)фенокси]пропил}пиперидина,
1-{3-[4-(цис-4-диметиламиноциклогекс-1-ил)фенокси]пропил}пиперидина,
1-{3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил}пиперидина,
1-{3-[4-(цис-4-тетраметиленаминоциклогекс-1-ил)фенокси]пропил}пиперидина,
1-{3-[4-(транс-4-тетраметиламиноциклогекс-1-ил)фенокси]пропил}пиперидина,
транс-1-{3-[4-(цис-4-диметиламиноциклогекс-1-ил)фенокси]пропил}-3,5-диметилпиперидина,
1-{3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил}-3,5-диметилпиперидина,
1-{3-[4-(4-пиридил)фенокси]пропил}пиперидина,
транс-3,5-диметил-1-{3-[4-(4-пиридил)фенокси]пропил}пиперидина,
1-{3-[4-(3-пиридил)фенокси]пропил}пиперидина,
(3S)-3-метил-1-{3-[4-(4-пиридил)фенокси]пропил}пиперидина,
1-{3-[4-(цис-4-морфолиноциклогекс-1-ил)фенокси]пропил}пиперидина,
1-{3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропил}пиперидина,
(3S)-3-метил-1-{3-[4-(цис-4-морфолиноциклогекс-1-ил)фенокси]пропил}пиперидина,
(3S)-3-метил-1-{3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропил}пиперидина,
(3S)-4-{4-[3-(3-метилпиперидин-1-ил)пропокси]фенил}пиридин 1-оксида,
(3S)-1-{3-[транс-4-(4-гидроксициклогексил)фенокси]пропил}-3-метилпиперидина,
(3S)-1-{3-[4-(4-гидроксициклогексил)фенокси]пропил}-3-метилпиперидина
или из их фармацевтически приемлемых солей, гидратов или гидратов солей либо полиморфных кристаллических структур этих соединений.
9. Соединение по любому из пп.1-8, выбранное из следующих:
(3S)-3-метил-1-{3-[4-(4-пиридил)фенокси]пропил}пиперидина диоксалат,
(3S)-4-{4-[3-(3-метилпиперидин-1-ил)пропокси]фенил}пиридин 1-оксида оксалат,
(3S)-4-{4-[3-(3-метилпиперидин-1-ил)пропокси]фенил}пиридин 1-оксида гидрохлорид,
(3S)-4-{4-[3-(3-метилпиперидин-1-ил)пропокси]фенил}пиридин 1-оксида дигидрохлорид.
10. Способ получения соединения по любому из предшествующих пунктов, включающий стадию проведения реакции Сузуки в присутствии Pd(PPh3) в основных условиях между соединением формулы (II)
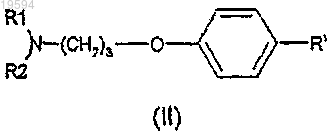
и реагентом формулы
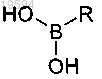
где R1, R2 и R определены в общей формуле (I), a R' представляет собой атом галогена.
11. Способ получения соединения по любому из пп.1-9, включающий стадию проведения реакции Митсуноби в основных условиях между соединением формулы (IV) и соединением формулы (V)

в которых R1 и R2 определены в общей формуле (I);
Y представляет собой ОН;
X представляет собой ОН или атом галогена;
R" представляет собой R, как определено в формуле (I).
12. Способ получения соединения по любому из пп.1-9, включающий стадию соединения соответствующих соединений формулы (VI) и формулы (VII)
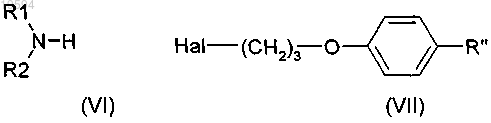
где R1 и R2 определены в формуле (I);
Hal представляет собой атом галогена;
R" представляет собой R, как определено в общей формуле (I).
13. Способ получения соединения формулы (I) по любому из пп.1-9
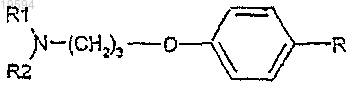
где R1 и R2 вместе с атомом азота, к которому они присоединены, образуют кольцо формулы
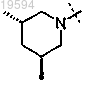
включающий стадию гидрогенизации в присутствии катализатора соединения формулы (XI)
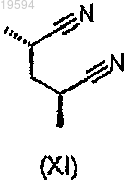
до соединения формулы (X)
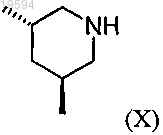
и стадию, содержащую реакцию присоединения в основных условиях, между соединением формулы (X) и соединением формулы (VII), как определено в п.12.
14. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.1-9 с фармацевтически приемлемым наполнителем или носителем.
15. Применение соединения по любому из пп.1-9 для получения медикамента, действующего как лиганд Н3-рецептора для введения пациенту, который нуждается в таком введении.
16. Применение соединения формулы (I) по любому из пп.1-9 для получения медикамента для лечения и/или предотвращения CNS заболеваний или состояний.
17. Применение по п.16 для лечения и/или предотвращения болезни Альцгеймера, нарушений внимания, бессонницы и запоминания.
18. Применение по п.16 для лечения и/или предотвращения когнитивных дефицитов при психических патологиях.
19. Применение по пп.16-18 для лечения и/или предотвращения нарушений у людей пожилого возраста, депрессивных или астенических состояний.
20. Применение соединения по любому из пп.1-9 для получения медикамента для лечения и/или предотвращения болезни Паркинсона, обструкционного апноэ во сне, деменции с тельцами Леви, васкулярной деменции.
21. Применение соединения по любому из пп.1-9 для получения медикамента для лечения и/или предотвращения эпилепсии.
22. Применение по п.16 для лечения и/или предотвращения головокружения, морской болезни, ожирения.
23. Применение соединения формулы (I) по любому из пп.1-9 для получения медикамента для лечения и/или предотвращения метаболического синдрома.
24. Применение соединения по формуле (I) по любому из пп.1-9 для получения медикамента для лечения и/или предотвращения нарушений сна, стресса, психотропных нарушений, конвульсий, депрессии, нарколепсии, нарушений гипоталамно-гипофизарной секреции, мозгового кровообращения и иммунной системы.
25. Применение соединения по формуле (I) по любому из пп.1-9 для получения медикамента для облегчения ночной работы или адаптации к временным сдвигам у здоровых людей.
Текст
НОВЫЕ ЛИГАНДЫ ГИСТАМИН H3-РЕЦЕПТОРА И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ Изобретение касается новых соединений формулы (I), процесса их получения и их терапевтического применения где R1 и R2, взятые вместе с атомом азота, к которому они присоединяются, образуют мононасыщенное азотсодержащее кольцо, представленное формулой где m=4 или 5, каждые Rb независимо являются одинаковыми или различными и представляют собой водород или C1-C4 алкил, R выбирают из группы, состоящей из пиридильной группы, где N-атом может быть в форме N-оксида (N+-O-) илиC3-10 циклоалкила, при необходимости, каждый, замещен одним или более атомом галогена, C1-C4-алкилом, О-C1-C4 алкилом, ОН, NR3R4, или бициклического арила, выбранного из нафтила, при необходимости, замещенного одним или более атомами галогена, C1-C4-алкилом, О-C1-C4-алкилом, ОН, NR3R4, -C2-С 4-алкенилом или -C2-C4-алкинилом, где алкил,алкенил или алкинил являются, при необходимости, замещенными гетероциклом, функциональной основной группой,выбранной из NR3R4, где R3, R4 независимо являются водородом, линейной или разветвленной C1-C4-алкильной группой или арильной группой, или взятые вместе с атомом азота, к которому они присоединяются, образуют насыщенный или частично ненасыщенный моноциклический или бициклический C6-C14-гетероцикл или C6-C14-гетероарил, при необходимости, содержащий один или более дополнительных гетероатомов и/или, при необходимости, замещенный одним или более атомами галогена, C1-C4-алкилом, О-C1-C4-алкилом, ОН; или их фармацевтически приемлемой соли,гидрата или соли гидрата либо полиморфной кристаллической структуры или их оптического изомера, рацемата,диастереомера или энантиомера. Область техники, к которой относится изобретение Настоящее изобретение касается новых лигандов H3-рецептора, процесса их получения и их терапевтического применения. Уровень техники Известно, что антагонисты гистамин H3-рецептора увеличивают синтез и выделение церебрального гистамина. С помощью этого механизма они индуцируют длительную бессонницу, улучшение когнитивных процессов, уменьшение приемов пищи и нормализацию вестибулярных рефлексов (Schwartz et al.,Physiol. Rev., 1991,71: 1-51). Известно, что агонисты гистамин H3-рецептора ингибируют выделение нескольких нейротрансмиттеров, включая гистамин, моноамины и нейропептиды, и, таким образом, оказывают седативное влияние на мозг и промотируют засыпание. В периферийных тканях агонисты H3-рецептора оказывают противовоспалительное, антиноцицептивное, гастроинтестинальное, антисекреторное мягкое мускулорасслабляющее влияние. Ранее известные соединения, антагонисты или агонисты H3-рецептора были подобны гистамину и имели имидазольное кольцо, обычно монозамещенное по 4(5)-положению (Ganellin et al., Ars Pharmaceutics, 1995, 36:3, 455-468; Stark et al., Drug of the Future, 1996, 21 (5), 507-520). Многочисленные патенты и патентные заявки касаются соединений антагонистов и/или агонистов,имеющих такую структуру, в частности ЕР 197840, ЕР 494010, WO 93/14070, WO 96/29315, WO 92/15567, WO 93/20061, WO 93/20062, WO 95/11894, US 5486526, WO 93/12107, WO 93/12108, WO 95/14007, WO 95/06037, WO 97/29092, EP 680960, WO 96/38141, WO 96/38142, WO 96/40126. В этом отношении также можно процитировать следующую литературу: Plazzi et al., Eur. J. Med.Chem., 1995, 30, 881, Clitherow et al., Bioorg.Med. Chem. Lett., 6 (7), 833-838 (1996) Wolin et al., Bioorg.Med. Chem. Lett., 8, 2157 (1998). Однако эти производные имидазола могут демонстрировать такие недостатки, как плохое преодоление гематоэнцефалического барьера, взаимодействие с белками цитохрома Р-450 и/или некоторую печеночную или глазную токсичности. Предполагалось, что известные нейроактивные соединения не имидазольной природы, такие как бетагистидин (J.-M. Arrang et al., Eur. J. Pharmacol., 1985, 111: 72-84), фенциклидин (J.-M. Arrang et al.,Eur. J. Pharmacol., 1988, 157: 31-35), димаприт (J.-C. Schwartz et al., Agents Actions, 1990, 30: 13-23), клозапин (M. Kathmann et al., Psychopharmacology, 1994, 116: 464-468) и сесквитерпены (М. Takigawa et al.,JP 06345642 (20 Dec. 1994 обладают H3-рецепторным антагонизмом, но все эти соединения показали очень низкий потенциал. До открытия и характеризации гистамин H3-рецептора эти соединения были известны в качестве терапевтических агентов, в частности, как нейроактивные агенты, например, как нейролептики (клозапин) или психомиметики (фенциклидин). При тестировании с H3-рецептором было показано, что эти соединения имеют значительно более низкий потенциал, чем имидазолсодержащие соединения, описанные в патентных заявках, приведенных выше. В противоположность предварительным попыткам заявителям удалось разработать потенциальные лиганды H3-рецептора, не содержащие имидазольного кольца, что уменьшает вышеупомянутые недостатки. Эти соединения, их получение и терапевтические применения описаны в WO 00/06254. Более конкретно, WO 00/06254 раскрывает, inter allia, соединения формулы (IIa) Более конкретно, формула (IIa) описывает основной фармакофор, который далее широко иллюстрируется в вышеупомянутом патенте. Для фармацевтического применения желательно иметь соединения, которые являются метаболически стабильными. Основной путь метаболизма ароматических соединений - пара-окисление. Таким образом, было важным сфокусироваться на соединениях, имеющих заместитель в этом положении. Однако заявители установили, что соединения по патенту WO 00/06254, имеющие паразамещенную фенильную группу, обычно ингибируют цитохромы 2D6 или 3 А 4. Это является особенно опасным для фармацевтических препаратов, поскольку оба этих цитохрома включаются в метаболизм ксенобиотиков и биотрансформацию эндогенных продуктов. Неожиданно, заявители установили, что некоторые специфические модификации этих структур одновременно показывают очень хорошую афинность к человеческому H3-рецептору (Ki10 нМ) и очень значительное уменьшение ингибирования цитохромов 2D6 и 3A4. Это выражается IC50, которая значительно выше микромолярного диапазона. Настоящее изобретение касается этих новых соединений, которые удовлетворяют этим требованиям. Дополнительно, предпочтительные соединения по изобретению проявляют низкую HERG активность. Соединения, показывающие хорошую бйодоступность, являются особенно предпочтительными.-1 019594 Соответственно первая цель настоящего изобретения касается новых соединений формулы (I) где R1 и R2, взятые вместе с атомом азота, к которому они присоединяются, образуют мононасыщенное азотсодержащее кольцо, представленное формулой где m=4 или 5; каждый Rb независимо является одинаковым или различным и представляет собой водород или C1C4-алкил;R выбирают из группы, состоящей из пиридильной группы, где N-атом может быть в форме N-оксида (N+-O-) или C3-10 циклоалкила, каждый, при необходимости, замещен одним или более атомами галогена, C1-C4-алкилом, О-C1-C4-алкилом,ОН, NR3R4; или бициклического арила, выбранного из нафтила, при необходимости, замещенного одним или более атомами галогена, C1-C4-алкилом, О-C1-C4-алкилом, ОН, NR3R4, -С 2-С 4-алкенилом или -C2-C4-алкинилом,где алкил, алкенил или алкинил являются, при необходимости, замещенными гетероциклом, функциональной основной группой, выбранной из NR3R4,где R3, R4 независимо являются водородом, линейной или разветвленной C1-C4-алкильной группой или арильной группой или, взятые вместе с атомом азота, к которому они присоединяются, образуют насыщенный или частично ненасыщенный моноциклический или бициклический C6-C14-гетероцикл или С 6-С 14-гетероарил, при необходимости, содержащий один или более дополнительных гетероатомов и/или, при необходимости, замещенный одним или более атомами галогена, C1-C4-алкилом, О-C1-C4 алкилом, ОН; или их фармацевтически приемлемой соли, гидрата или соли гидрата либо полиморфной кристаллической структуры или их оптического изомера, рацемата, диастереомера или энантиомера. Предпочтительно в соединении по изобретениюR представляет собой нафтил и по меньшей мере один Rb представляет собой C1-C4-алкил;R1 и R2 образуют вместе с атомом азота, к которому они присоединяются, мононасыщенное азотсодержащее кольцо формулы где m=4 или 5; каждый Rb независимо является одинаковым или различным и представляет собой водород или C1C4-алкил;R выбирают из пиридильной группы, где N-атом может быть в форме N-оксида (N+-O-) или C3-C10-циклоалкила,каждый, при необходимости, является замещенным одним или более атомами галогена, C1-C4-алкилом,O-C1-С 4-алкилом, ОН, NR3R4; или бициклического арила, выбранного из нафтила, при необходимости, замещенного одним или более атомами галогена, C1-C4-алкилом, О-C1-C4-алкилом, ОН, NR3R4, -С 2-С 4-алкенилом или -С 2-С 4-алкинилом,где алкил, алкенил или алкинил являются, при необходимости, замещенными гетероциклом, функциональной основной группой, выбранной из NR3R4,где R3, R4 независимо являются водородом, линейной или разветвленной C1-C4-алкильной группой или арильной группой или, взятые вместе с атомом азота, к которому они присоединяются, образуют насыщенный или частично ненасыщенный моноциклический или бициклический C6-C14-гетероцикл или С 6-C14-гетероарил, при необходимости, содержащий один или более дополнительных гетероатомов и/или, при необходимости, замещенный одним или более атомами галогена, C1-C4-алкилом, О-C1-C4 алкилом, ОН;R1 и R2 вместе с атомом азота, к которому они присоединяются, образуют мононасыщенное азотсодержащее кольцо формулы где m=4 или 5; каждый Rb независимо является одинаковым или отличается и является водородом или C1-C4 алкилом;R выбирают из групп, которые выбирают из пиридильной группы, где N-атом может быть в формеN-оксида (N+-O-) или C3-C10-циклоалкила, каждый, при необходимости, является замещенным одним или более атомами галогена, C1-C4-алкила, О-C1-C4-алкила, ОН, NR3R4,-2 019594 где алкил, алкенил или алкинил являются, при необходимости, замещенными гетероциклом, функциональной основной группой, выбранной из NR3R4,где R3, R4 независимо являются водородом, линейной или разветвленной C1-C4-алкильной группой или арильной группой, или взятые вместе с атомом азота, к которому они присоединяются, образуют насыщенный или частично ненасыщенный моноциклический или бициклический C6-C14-гетероцикл или С 6-C14-гетероарил, при необходимости, содержащий один или более дополнительных гетероатомов и/или, при необходимости, замещенный одним или более атомоми галогена, C1-C4-алкилом, О-C1-C4 алкилом, ОН;R представляет собой одну из пиридильных групп, где N-атом может быть в форме N-оксида(N+-O-), при необходимости, является замещенным одним или более атомами галогена или C1-C4 алкилом,где алкил, алкенил или алкинил являются, при необходимости, замещенными гетероциклом или функциональной основной группой, выбранной из NR3R4. Предпочтительными соединениями по изобретению являются соединения, выбранные из транс-1-3-[4-(N,N-диметилкарбамоил)фенокси]пропил-3,5-диметилпиперидина,транс-1-3-[4-(N,N-тетраметиленкарбамоил)фенокси]пропил-3,5-диметилпиперидина,транс-1-3-[4-(1-гидрокси-1-метилэтил)фенокси]пропил-3,5-диметилпиперидина,(RS)-1-3-[4-(1-гидрокси-1-метилэтил)фенокси]пропил-3-метилпиперидина,1-3-[4-(1-гидрокси-1-пропилбутил)фенокси]пропилпиперидина,1-3-[4-(1-гидроксициклопентил)фенокси]пропилпиперидина,1-3-[4-(1-гидрокси-1-аллилбут-3-енил)фенокси]пропилпиперидина,транс-1-3-(4-изопропенилфенокси)пропил]-3,5-диметилпиперидина,(3S,5S)-1-3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил-3,5-диметилпиперидина,транс-3,5-диметил-1-[3-(4-феноксифенокси)пропил]пиперидина,1-3-[4-(цис-4-диметиламиноциклогекс-1-ил)фенокси]пропилпиперидина,1-3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропилпиперидина,1-3-[4-(цис-4-тетраметиленаминоциклогекс-1-ил)фенокси]пропилпиперидина,1-3-[4-(транс-4-тетраметиламиноциклогекс-1-ил)фенокси]пропилпиперидина,транс-1-3-[4-(цис-4-диметиламиноциклогекс-1-ил)фенокси]пропил-3,5-диметилпиперидина,транс-1-3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил-3,5-диметилпиперидина,1-3-[4-(4-пиридил)фенокси]пропилпиперидина,транс-3,5-диметил-1-3-[4-(4-пиридил)фенокси]пропилпиперидина,1-3-[4-(3-пиридил)фенокси]пропилпиперидина,(3S,5S)-1-3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил-3,5-диметилпиперидина,(3S)-1-3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил-3-метилпиперидина,(3S)-3-метил-1-3-[4-(4-пиридил)фенокси]пропилпиперидина,(3S,5S)-1-3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропил-3,5-диметилпиперидина,(3S)-1-3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропил-3-метилпиперидина,1-3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропилпиперидина,1-3-[4-(цис-4-морфолиноциклогекс-1-ил)фенокси]пропилпиперидин дигидрохлорида,1-3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропилпиперидин дигидрохлорида,(3S)-3-метил-1-3-[4-(цис-4-морфолиноциклогекс-1-ил)фенокси]пропилпиперидин дигидрохлорида,(3S)-3-метил-1-3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропилпиперидин дигидрохлорида,1-3-[4-(цис-4-диметиламиноциклогекс-1-ил)метилфенокси]пропилпиперидина,1-3-[4-(транс-4-диметиламиноциклогекс-1-ил)метилфенокси]пропилпиперидина,(3S,5S)-1-3-[4-(транс-4-аминоциклогекс-1-ил)фенокси]пропил-3,5-диметилпиперидина,(3S)-4-4-[3-(3-метилпиперидин-1-ил)пропокси]фенилпиридин-1-оксида,4-[4-(3-пиперидинопропокси)фенил]пиридин 1-оксида,2-метил-4-(4-3-[(3S)-3-метилпиперидин-1-ил]пропоксифенил)пиридин 1-оксида,2-гидрокси-4-(4-3-[(3S)-3-метилпиперидин-1-ил]пропоксифенил)пиридина,1-метил-4-(4-3-[(3S)-3-метилпиперидин-1-ил]пропоксифенил)пиридина,2-(3-пиперидинопропокси)-4-(4-3-[(3S)-3-метилпиперидин-1-ил]пропоксифенил)пиридина,2-метил-4-(4-3-[(3S)-3-метилпиперидин-1-ил]пропоксифенил)пиридина,1-3-[4-(4-гидроксициклогексил)фенокси]пропилпиперидина,(3S)-1-3-[транс-4-(4-гидроксициклогексил)фенокси]пропил-3-метилпиперидина,(3S)-1-3-[4-(4-гидроксициклогексил)фенокси]пропил-3-метилпиперидина,1-3-[транс-4-(4-гидроксициклогексил)фенокси]пропилпирролидина,(3S)-1-3-[4-(4-пропокси-4-метилциклогексил)фенокси]пропил-3-метилпиперидина,1-3-[транс-4-(4-гидроксициклогексил)фенокси]пропилпиперидина,1-3-[транс-4-(4-гидроксициклогексил)фенокси]пропил-2-метилпирролидина-3 019594 или из их фармацевтически приемлемых солей, гидратов или гидратов солей либо полиморфных кристаллических структур этих соединений. Более предпочтительными соединениями являются соединения, выбранные из транс-1-3-[4-(1-гидрокси-1-метилэтил)фенокси]пропил-3,5-диметилпиперидина,1-3-[4-(1-гидрокси-1-пропилбутил)фенокси]пропилпиперидина,1-3-[4-(цис-4-диметиламиноциклогекс-1-ил)фенокси]пропилпиперидина,1-3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропилпиперидина,1-3-[4-(цис-4-тетраметиленаминоциклогекс-1-ил)фенокси]пропилпиперидина,1-3-[4-(транс-4-тетраметиламиноциклогекс-1-ил)фенокси]пропилпиперидина,транс-1-3-[4-(цис-4-диметиламиноциклогекс-1-ил)фенокси]пропил-3,5-диметилпиперидина,1-3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил-3,5-диметилпиперидина,1-3-[4-(4-пиридил)фенокси]пропилпиперидина,транс-3,5-диметил-1-3-[4-(4-пиридил)фенокси]пропилпиперидина,1-3-[4-(3-пиридил)фенокси]пропилпиперидина,(3S)-3-метил-1-3-[4-(4-пиридил)фенокси]пропилпиперидина,1-3-[4-(цис-4-морфолиноциклогекс-1-ил)фенокси]пропилпиперидина,1-3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропилпиперидина,(3S)-3-метил-1-3-[4-(цис-4-морфолиноциклогекс-1-ил)фенокси]пропилпиперидина,(3S)-3-метил-1-3-[4-(транс-4-морфолиноциклогекс-1-ил)фенокси]пропилпиперидина,(3S)-4-4-[3-(3-метилпиперидин-1-ил)пропокси]фенилпиридин 1-оксида,(3S)-1-3-[транс-4-(4-гидроксициклогексил)фенокси]пропил-3-метилпиперидина,(3S)-1-3-[4-(4-гидроксициклогексил)фенокси]пропил-3-метилпиперидина или из их фармацевтически приемлемых солей, гидратов или гидратов солей либо полиморфных кристаллических структур этих соединений. Особенно предпочтительны соединения, выбранные из следующих:(3S)-3-метил-1-3-[4-(4-пиридил)фенокси]пропилпиперидина диоксалат,(3S)-4-4-[3-(3-метилпиперидин-1-ил)пропокси]фенилпиридин 1-оксида оксалат,(3S)-4-4-[3-(3-метилпиперидин-1-ил)пропокси]фенилпиридин 1-оксида гидрохлорид,(3S)-4-4-[3-(3-метилпиперидин-1-ил)пропокси]фенилпиридин 1-оксида дигидрохлорид. Другой аспект изобретения касается способа получения соединения по изобретению, включающего стадию проведения реакции Сузуки в присутствии Pd(PPh3) в основных условиях между соединением формулы (II) где R1, R2 и R определены в общей формуле (I), a R' представляет собой атом галогена. Способ получения соединения по изобретению может включать стадию проведения реакции Митсуноби в основных условиях между соединением формулы (IV) и соединением формулы (V)X представляет собой ОН или атом галогена;R" представляет собой R, как определено в формуле (I). Кроме того, способ получения соединения по изобретению может включать стадию соединения соответствующих соединений формулы (VI) и формулы (VII)Hal представляет собой атом галогена;R" представляет собой R, как определено в общей формуле (I). В еще одном аспекте способ получения соединения формулы (I) по изобретению может включать стадию гидрогенизации в присутствии катализатора соединения формулы (XI) до соединения формулы (X) и стадию, содержащую реакцию присоединения в основных условиях, между соединением формулы (X) и соединением формулы (VII), как определено выше. Другим аспектом изобретения является фармацевтическая композиция, содержащая соединение формулы (I) по изобретению с фармацевтически приемлемым наполнителем или носителем. Кроме того, изобретение касается применения соединения по изобретению для получения медикамента, действующего как лиганд Н 3-рецептора для введения пациенту, который нуждается в таком введении; применения соединения формулы (I) для получения медикамента для лечения и/или предотвращения CNS заболеваний или состояний, предпочтительно для лечения и/или предотвращения болезни Альцгеймера, нарушений внимания, бессонницы и запоминания; для лечения и/или предотвращения когнитивных дефицитов при психических патологиях; для лечения и/или предотвращения нарушений у людей пожилого возраста, депрессивных или астенических состояний; для получения медикамента для лечения и/или предотвращения болезни Паркинсона, обструкционного апноэ во сне, деменции с тельцами Леви, васкулярной деменции; для получения медикамента для лечения и/или предотвращения эпилепсии; для лечения и/или предотвращения головокружения, морской болезни, ожирения; для получения медикамента для лечения и/или предотвращения метаболического синдрома; для получения медикамента для лечения и/или предотвращения нарушений сна, стресса, психотропных нарушений, конвульсий, депрессии, нарколепсии, нарушений гипоталамно-гипофизарной секреции, мозгового кровообращения и иммунной системы; для получения медикамента для облегчения ночной работы или адаптации к временным сдвигам у здоровых людей. Подробное описание изобретения Как употребляется в описании, термин "пациент" относится к теплокровному животному, такому как млекопитающее, предпочтительно человек или ребенок, который страдает от или потенциально склонен к одному или более заболеваниям или состояниям, описанным в работе. Как употребляется в описании, "терапевтически эффективным количеством" называется количество соединения по настоящему изобретению, которое является эффективным для снижения, устранения, лечения или контроля симптомов описанных здесь заболеваний и состояний. Термин "контроль" относится ко всем процессам, в которых может быть достигнуто замедление, прерывание, задержка или остановка прогрессирования заболеваний и состояний, описанных здесь, но не обязательно обозначает полное устранений всех симптомов заболеваний или состояний, и предусматривает профилактическое лечение. Как употребляется в описании, "фармацевтически приемлемыми" называются те соединения, материалы, композиции или дозированные формы, которые с медицинской точки зрения подходят для контакта с тканями человеческих существ и животных и не вызывают чрезмерной токсикации, раздражения,аллергического отклика или других осложнений, соизмеримых с разумным соотношением пользы/риска."Фармацевтически приемлемыми солями" называются производные раскрываемых соединений, в которых исходное соединение модифицируется получением его кислотных или основных солей. Фармацевтически приемлемые соли включают традиционные нетоксичные соли или четвертичные аммонийные соли, полученные из исходного соединения, например, с нетоксичными неорганическими или органическими кислотами. Например, такие традиционные нетоксичные соли включают соли, производные таких неорганических кислот, как хлороводородная, бромоводородная, серная, сульфаминовая, фосфорная, азотная и подобные; и соли, производные таких органических кислот, как уксусная, пропионовая,янтарная, винная, лимонная, метансульфокислота, бензол сульфокислота, глюкуроновая, глюконовая,глутаминовая, бензойная, салициловая, толуолсульфокислота, щавелевая, фумаровая, малеиновая и подобные. Кроме этого, дополнительно, соли включают аммонийные соли, такие как трометамин, меглумин, эполамин и т.д., соли металлов, таких как натрий, калий, кальций, цинк или магний. Предпочтительными являются оксалаты и соли хлороводородной кислоты. Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы из исходного соединения, которое содержит основной или кислотный фрагмент, с помощью традиционных-5 019594 химических методов. Обычно такие соли могут быть получены взаимодействием свободной кислотной или основной форм этих соединений с стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе либо в их смеси. Обычно предпочтительной является неводная среда, такая как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил. Список подходящих солей приводится в Remington's Pharmaceutical Sciences, 17 ed., Mack Publishing Company, Easton,PA, 1985, p. 1418 или P.H. Stahl, C.G.Wermuth, Handbook of Pharmaceutical Salts, Properties, Selection andUse, Wiley-VCH, 2002, раскрытие которых, таким образом, включаются в работу путем ссылки. Соединения общей формулы (I), имеющие геометрические или стереоизомеры, также являются частью настоящего изобретения. Должно быть понятно, что соединения и способы по настоящему изобретению могут быть реализованы различным путями, хорошо известными специалистам в данной области. Например, соединения могут быть синтезированы с применением или адаптацией способов, описанных выше или с помощью их вариаций, что будет оценено специалистами в данной области. Подходящие модификации могут быть очевидными и хорошо известными или могут быть легко получены из научной литературы специалистами в данной области. В частности, такие способы могут быть найдены в R.C. Larock, Comprehensive Organic Transformations, VCH publishers, 1989. Должно быть понятно, что соединения по настоящему изобретению могут содержать один или более асимметрически замещенных атома углерода и могут быть выделены в оптически чистой или рацемической форме. Таким образом, рассматриваются все хиральные, диастереомерные, рацемические формы и все геометрические изомерные формы, если специально не указана конкретная стереохимия или изомерная форма. Получение и выделение таких оптически активных форм хорошо известно из уровня техники. Например, смесь стереоизомеров можно разделить стандартными способами, включающими,но не ограничивающимися, разделением рацемических форм, прямой, обратно-фазовой и хиральной хроматографией, предпочтительным солеобразованием, раскристаллизацией и подобными, или хиральным синтезом либо из хиральных исходных материалов, либо целевым синтезом требуемых хиральных центров. Соединения по настоящему изобретению могут быть получены различными синтетическими путями. Реагенты и исходные материалы являются коммерчески доступными или легкосинтезируемыми с помощью хорошо известных способов любым специалистом в данной области. Все заместители, если не указано обратное, являются заранее определенными. В реакциях, описанных ниже, возникает необходимость защиты реакционных функциональных групп, например гидроксильной, амино-, имино-, тио- или карбоксигрупп, которые требуются в конечном продукте для того, чтобы избежать их нежелательного замещения в процессе реакций. Могут быть использованы традиционные защитные группы в соответствии с стандартной практикой, например, см.McOmie in Protective Groups in Organic Chemistry, Plenum Press, 1973. Некоторые реакции могут проводиться в присутствии основания. Не существует конкретных ограничений по природе применяемого основания, и, в равной степени, может использоваться любое основание, традиционно применяемое в реакциях этого типа, при условии, что оно не оказывает противоположного эффекта на другие части молекулы. Примеры подходящих оснований включают гидроксид натрия, карбонат калия, триэтиламин, гидриды щелочных металлов, такие как гидрид натрия и гидрид калия; алкилы лития, такие как метиллитий и бутиллитий, и алкоксиды щелочных металлов, такие как метоксид натрия и этоксид натрия. Обычно реакции проводят в подходящем растворителе. Могут применяться различные растворители при условии, что они не оказывают противоположного влияния на реакцию или участвующие реагенты. Примеры подходящих растворителей включают углеводороды, которые могут быть ароматическими,алифатическими или циклоалифатическими, такими как гексан, циклогексан, бензол, толуол и ксилол,амиды, такие как N,N-диметилформамид; спирты, такие как этанол и метанол, и простые эфиры, такие как диэтиловый эфир, метил трет-бутиловый эфир и тетрагидрофуран. Реакции могут проводиться в широком диапазоне температур. Обычно удобно проводить реакции при температурах от 0 до 150 С (более предпочтительной является температура от комнатной до 100 С). Временной промежуток для прохождения реакции также может варьироваться в широких пределах в зависимости от многих факторов, особенно температуры реакции и природы реагентов. Однако, если реакция протекает при вышеупомянутых предпочтительных условиях, перйод от 3 до 20 ч обычно является достаточным. Соединения, полученные таким образом, могут быть выделены из реакционной смеси традиционными способами. Например, соединения могут быть выделены удалением растворителя из реакционной смеси или, при необходимости, после удаления растворителя, выливанием остатка в воду с последующей экстракцией несмешивающимся с водой органическим растворителем и с удалением растворителя из экстракта. Дополнительно, если требуется, продукт может быть далее очищен с помощью различных, хорошо-6 019594 известных способов, таких как перекристаллизация, высаживание или различные хроматографические способы, особенно колоночная или препаративная тонкослойная хроматография. В соответствии с настоящим изобретением "исходной группой" функциональной группы называется любая группа, которая может с помощью одной или более реакций привести к требуемой функциональной группе с помощью одного или более подходящих реагентов. Такие реакции включают реакции снятия защитных групп, также как и обычные реакции присоединения, замещения или функционализации. В соответствии с первой целью соединения формулы (I) по изобретению могут быть получены из соединений формулы (II) в которой R1 и R2 определены в основной формуле (I) и R' представляет собой исходную группу для R. В общем, протекает реакция замещения или функционализации R' в требуемую функцию R. Более точно, когда R представляет собой группу со спиртовой функциональной группой, соединение формулы (I) может быть получено из соединения формулы (II), в котором R' представляет собой группу с карбонильной функциональной группой, и подходящего магнийорганического галида или, наоборот, из соединения формулы (II), где R' представляет собой атом галогена, путем образования соответствующего магнийорганического галида, за которым следует реакция Гриньяра с подходящим реагентом, представляющим карбонильную функциональную группу. Более точно, когда R представляет собой фрагмент с функциональной группой CONR3R4, соединение формулы (I) может быть получено из соответствующего соединения формулы (II), в котором R' представляет собой фрагмент с ацилгалидной группой, путем взаимодействия с подходящим реагентом,имеющим функциональную группу HNR3R4. Упомянутое соединение формулы (II), в котором R' представляет собой фрагмент с ацилгалидной группой, может, в свою очередь, получаться из соединения формулы (II), в котором R' представляет собой сложноэфирную группу. Более точно, когда R представляет собой фрагмент с алкенильной функциональной группой, соединение формулы (I) может быть получено из соответствующего соединения формулы (II), в которой R' представляет собой фрагмент со спиртовой функциональной группой, с помощью реакции дегидратации. Более точно, когда R представляет собой фрагмент с функциональной группой NR3R4, соединение формулы (I) может быть получено из соответствующего соединения формулы (II), в котором R' представляет собой фрагмент с карбонильной группой, с помощью реакции аминирования в условиях восстановления. В качестве альтернативы, когда R представляет собой фрагмент с функциональной группой NR3R4,соединение формулы (I) может быть получено из соответствующих соединений формулы (II), в которыхR' представляет собой группу с атомом галогена, с подходящим HNR3R4 реагентом. Более точно, упомянутая реакция функционализации также может содержать стадию реакции Сузуки между соединением формулы (II), в котором R' представляет собой атом галогена, с подходящим реагентом формулы (1)(OH)2-B-R (1). Предпочтительно, когда эта реакция проводится в присутствии Pd(PPh3)4 в щелочных условиях. В соответствии с второй целью соединения формулы (I) по изобретению могут быть получены из соответствующих соединений формулы (III) в которой R1 и R2 определены в общей формуле (I). Обычно проводится реакция, содержащая стадию введения или конструирования требуемой группы R. Более точно, когда R представляет собой гетероцикл, упомянутый гетероцикл может быть сконструирован в одну или более последовательных стадий с помощью общеизвестных реакций при подходящих условиях. В соответствии с еще одной целью соединения формулы (I) могут быть получены сдваиванием соединений формул (IV) и (V) в которых R1 и R2 определены в общей формуле (I), Y и X представляют нуклеофильную и уходящую группы соответственно или их предшественников, R" представляет собой R, как определено в формуле (I), или R', как определено в формуле (II). Обычно, когда X и Y представляют собой функциональные группы -ОН, упомянутая реакция является реакцией Митсуноби. Обычно, когда X представляет-7 019594 атом галогена и Y представляет функциональную группу -ОН, упомянутая реакция проводится в щелочных условиях. В соответствии с еще одной целью соединения формулы (I) могут быть получены сдваиванием соединений формул (V) и (VI) в которых R1 и R2 определены в формуле (I), Hal представляет собой атом галогена, R" представляет собой R, как определено в основной формуле (I), или R' определено в основной формуле (II). Обычно упомянутую реакцию проводят в основных условиях. Соединения формулы (VI) могут быть получены сдваиванием соединений формул (VII) и (VIII) в которых Hal и R" определены в формуле (VI), а Hal' представляет собой атом галогена. Соединения формулы (V) могут быть получены восстановлением и циклизацией соединений формулы (IX) где Ra, Rb и m определены в формуле (I). Обычно эта реакция проводится в каталитических условиях в присутствии такого катализатора, как родий или алюминий. Далее процесс по изобретению также может включать дополнительные стадии выделения соединения формулы (I). Такое выделение может быть произведено специалистом с помощью любого обычного известного способа, такого как описанные выше способы выделения. Исходные соединения являются коммерчески доступными или могут быть получены применением или адаптированием любых известных способов или способов, описанных в примерах. В частности, процесс по изобретению может проводиться с применением оптически чистых исходных соединений или интермедиатов. Более конкретно, применение следующего производного (X): является особенно полезным для процесса по изобретению. Заявители открыли новый способ получения оптически чистого (3S,5S)-диметилпиперидина. В соответствии с еще одной целью настоящее изобретение, таким образом, касается процесса получения соединения формулы (X), содержащего стадию взаимодействия соединения формулы (XI) Более точно, упомянутая стадия содержит восстановление (XI) предпочтительно в каталитических условиях с такими катализаторами, как катализатор родия и алюминия, в присутствии спирта, такого как метанол с восстанавливающим агентом, таким как водород или гидрид, такой как борогидрид или гидрид алюминия, при необходимости, в присутствии металла, такого как соль никеля. Соединение (XI), в свою очередь, получают из соединения формулы (XII) где Y представляет собой уходящую группу, такую как мезилат или атом галогена. Обычно упомянутую реакцию проводят в присутствии цианида, такого как цианид калия. Соединение (XII) получают из соединения формулы (XIII) Обычно упомянутая реакция проводится с подходящим реагентом формулы Hal-Y, таким как метан сульфонилхлорид, в присутствии основания или с агентом галогенирования, таким как сульфонил хлорид, с или без основания, такого как имидазол. Репрезентативные схемы процессов по изобретению приводятся ниже Синтез также может проводиться в одной колбе как мультикомпонентная реакция. В соответствии с еще одной целью настоящее изобретение также касается фармацевтических композиций, содержащих соединение формулы (I) вместе с фармацевтически приемлемым наполнителем или носителем. Антагонисты успешно применяются в качестве активных компонентов, в частности в медикаментах, имеющих психотропные эффекты, промотирующих бессонницу, внимание, память и улучшающих настроение, для лечения патологий, таких как болезнь Альцгеймера, и других когнитивных нарушений у лиц пожилого возраста, депрессивных или простых астенических состояний. Предпочтительно, когда- 10019594 упомянутые соединения могут применяться для лечения и/или предотвращения CNS заболеваний, таких как болезнь Альцгеймера, нарушение внимания, бессонницы, нарушений запоминания, когнитивных дефицитов при психических патологиях, в частности, у лиц пожилого возраста, депрессивных или астентичных состояний. Их ноотропические эффекты могут быть полезными для стимулирования бессонницы, внимания и способностей к запоминанию у здоровых людей. Соединения по изобретению могут быть полезными для облегчения ночной работы и адаптации людей к временным сдвигам. Дополнительно, эти агенты могут быть полезными для лечения ожирения, головокружения и морской болезни. Также может быть полезным сочетать соединения по изобретению с другими психиатрическими агентами, такими как нейролептики, для увеличения их эффективности и уменьшения их побочных эффектов. Также рассматриваются применения для лечения некоторых форм эпилепсии. Их терапевтические применения также включают воздействия на периферические органы в основном как стимуляторы секреции или желудочно-кишечной моторики. Соединения по изобретению являются особенно полезными для лечения CNS заболеваний у лиц пожилого возраста. Дополнительно упомянутые антагонисты или обратные агонисты также могут быть полезными при лечении и/или предотвращении эпилепсии. Как здесь употребляется, "эпилепсия" обозначает мозговое заболевание, в котором пучки нервных клеток или нейроны в мозге иногда подают сигналы анормально. Эпилепсия также известна как заболевание с припадками. Припадок представляет собой неожиданный подъем электрической активности мозга. Эпилепсия обычно диагностируется после того, как субъект подвергается по меньшей мере двум припадкам, которые не являются следствием некоторых известных медицинских состояний, таких как похмельный синдром или экстремально низкое содержание сахара в крови. Предпочтительно эпилепсию выбирают из группы, состоящей в отсутствие эпилепсии у детей и взрослых, из фармакорезистентных припадков при синдроме височной доли и светочувствительных припадках. Дополнительно, настоящее применение также касается использования соединений по изобретению для лечения и/или предотвращения болезни Паркинсона, обструкционного апноэ во сне (OSA), деменции с тельцами Леви и/или васкулярной деменции и, в частности, для лечения их симптомов. Как здесь употребляется, "обструкционное апноэ во сне" (также называемое здесь "OSA") обозначает дыхательное заболевание, которое протекает в основном в процессе сна и имеет последствия, которые могут продолжаться во время бодрствования и имеют форму сонливости. Это распространяющееся,хорошо известное заболевание характеризуется перйодическим коллапсом верхних дыхательных путей в процессе сна с апноэ (перйодическим прекращением дыхания), олигопноэ (повторяющиеся уменьшения глубины дыхания) или непрерывное или продолжительное снижение вентиляции и чрезмерная дневная сонливость, нейрокогнитивные дефекты и депрессия. Заболевание влияет почти на каждую систему орагнизма, приводя к увеличению процента сердечно-сосудистых заболеваний (Qureshi and Ballard, J.Allergy and Clin. Immunol, 2003, 112, 643). Для OSA не существует известного фармакологического лечения."Болезнь Паркинсона" ("PD") в основном связана с дегенерацией допаминергических нейронов в чернополосатом тракте, из-за чего происходят моторные нарушения и характеристики нейропсихиатрических нарушений данного заболевания. Несмотря на то что некоторые другие классы аминергических нейронов могут оказывать влияние на могпаркинсонический мозг, посмертное нейрохимическое и иммуногистохимическое изучение показало, что гистаминергические нейроны полностью избегают процесса дегенерации (Garbarg et al., Lancet, 1983, 1, 74; Nakamura et al., Neurology, 1996, 4, 1693). Дополнительно, у модели "паркинсонической крысы", у которой дофаминергические нейроны черно-полосатого тракта были предварительно разрушены односторонним введением нейротоксина 6-гидроксидопамина,влияние антипаркинсонического лекарственного средства леводопы на изменение поведения, как отражение его антипаркинсонической активности, не модифицируется при совместном введении тиоперамида, прототипического H3R антагониста/обратного агониста (Huotary et al., Parkinsonism Relat Disord, 2000,6, 159). Такое отсутствие эффекта не может быть приписано ни отсутствию H3R мест связывания в черно-полосатом комплексе, где они, наоборот, присутствуют (Pillot et al., Neuroscience, 2002, 114, 176), или исчезновению H3R мест связывания в результате процесса нейрональной дегенерации, так как количество этих мест связывания, наоборот, увеличивается в тех же самых животных моделях (Ryu et al., Neurosci. Letters, 1994, 178,19). Совместное рассмотрение результатов исследований объясняет недостаток терапевтического интереса к этому классу соединений при лечении PD. Дополнительно к главным признакам PD, которые выражаются в нарушениях движения и контроля,которые составляют основу заболевания, в последние десять лет стало очевидным, что большое количество (74-81%) PD пациентов имеют нарушения сна и вигильные нарушения (Garcia-Borreguero et al.,Sleep Med. Rev., 2003, 7, 115). Нарушения включают инициирование и поддержание сна, фрагментирова- 11019594 ние сна, парасомнии (включая ночные галлюцинации), нарушения дыхания во сне и чрезмерную дневную сонливость (включая "приступы сна", то есть неуместное или неожиданное засыпание в процессе дневной жизнедеятельности). Не является полностью понятным, относится ли эта группа нарушений полностью к самой PD или существует также некоторое участие и прямое или непрямое влияние дофаминергических агонистов. Лечение этого класса заболеваний, все из которых могут происходить из-за потери циркадной ритмичности, является низкоэффективным, например попытки лечения чрезмерной дневной сонливости модафинилом имели ограниченный успех, и органы здравоохранения не дали показаний для применения этого стимулирующего лекарства с совершенно неизвестным механизмом действия.PD называется идеопатической PD или идиопатическим паркинсонизмом, описанным Джеймсом Паркинсоном в 1817. Клиническая тетрада PD включает тремор в покое, брадикинезию (замедленность сознательных движений) или акинезию (снижение или отсутствие движения), жесткость "зубчатого колеса" и постуральное ухудшение, приводящее к затруднению при поворотах и наклонах. Патологическая проба представляет собой присутствие интрацитоплазматических эозинофильных включений (телец Леви) в добавление к потере нейронов в (черной субстанции) substantia nigra pars compacta. Дополнительно к главным признакам PD, которые выражаются в нарушениях движения и контроля, которые составляют основу заболевания, большое количество PD пациентов имеют нарушения сна и вигильные нарушения,включающие, в частности, инсомнию, нарушения инициирования и поддержания сна, фрагментирование сна, парасомнии, нарушения дыхания во сне и чрезмерная дневная сонливость (включая "приступы сна") и циркадную дисритмию (инверсию ритмов бодрствования и сна). Деменция с тельцами Леви (DLB) происходит из-за аккумулирования таких телец в коре головного мозга (тогда как при PD - родственном дегенеративном заболевании такое аккумулирование происходит в черно-полосатом комплексе). Заболевание характеризуется когнитивными ухудшениями, расстройством внимания, галлюцинациями, депрессией и заболеваниями сна. Васкулярная деменция (VD) является вторым наиболее распространенным видом деменции после болезни Альцгеймера и характеризуется острой потерей памяти, ориентации и организующих функций и часто ассоциируется с доказанными цереброваскулярными поражениями у пациентов, страдающих от гипертонии, диабетов, гиперлипидемии, апноэ во сне в течение нескольких лет. Соединения по изобретению также могут быть полезными для лечения и/или предотвращения головокружения, морской болезни, ожирения, диабетов и так называемого "метаболического синдрома". Метаболический синдром впервые был охарактеризован Рейвеном как синдром X (Diabetes, 1988, 37, 1595607). Так называется группа метаболических заболеваний, таких как диабет, нарушение толерантности к глюкозе, устойчивость к инсулину, гиперинсулинемия, гипертриглицеридемия, дислипидемия, низкийHDL-холестерин, гипертония, микроальбуминурия, ожирение, воспаление, сердечно-сосудистые нарушения и/или аномальности фибринолиза и коагуляции. Дополнительно, соединения по изобретению могут быть полезными для лечения и/или предотвращения нарушений сна, стресса, психотропных нарушений, конвульсий, депресии, нарколепсии, нарушений гипоталамно-гипофизарной секреции, мозгового кровообращения и имунной системы. Настоящее изобретение также касается соответствующих способов лечения, содержащих введение пациенту, нуждающемуся в лечении, соединения по изобретению вместе с фармацевтически приемлемым носителем или наполнителем. Идентификация субъектов, которые нуждаются в лечении, от описанных здесь заболеваний и состояний возлагается на способности и знания специалистов в данной области. Клиницисты, специалисты в данной области, могут легко идентифицировать с помощью клинических тестов, медицинского осмотра и медицинской/фамильной истории те субъекты, которые нуждаются в таком лечении. Терапевтически эффективное количество может быть легко определено обслуживающим диагностом или любым специалистом в данной области с применением традиционных способов и изучением результатов, полученных при аналогичных обстоятельствах. При определении терапевтически эффективного количества обслуживающим диагностом рассматривается ряд факторов, включающих, но не ограничивающихся: полом субъекта; размером, возрастом, общим состоянием здоровья; вовлечением в специфическое заболевание; степенью вовлеченности или интенсивности заболевания; откликом индивидуального субъекта; конкретным вводимым соединением; способом введения; характеристиками биодоступности введенного препарата; выбранным дозовым режимом; применением сопутствующего лечения и другими значительными обстоятельствами. Количество соединения формулы (I), которое требуется для достижения требуемого биологического эффекта, будет варьироваться в зависимости от ряда факторов, включающих вводимую дозу лекарства, химических характеристик (то есть гидрофобности) применяемого соединения, потенциала соединения, типа заболевания, состояния заболевания у пациента и способа введения лекарства."Фармацевтическими" или "фармацевтически приемлемыми" называются молекулярные объекты или композиции, которые не вызывают нежелательных, аллергических или других нежелательных реакций при введении животным или человеку, при необходимости. Как употребляется здесь, "фармацевтически приемлемый носитель" включает любые разжижители,- 12019594 адьюванты, наполнители или переносчики, такие как консерванты, наполнители, дезинтеграторы, увлажнители, эмульгаторы, суспендирующие агенты, растворители, дисперсионные среды, покрытия, антибактериальные или антигрибковые агенты, изотонические и предотвращающие абсорбцию агенты и подобные. Применение таких сред и агентов для фармацевтически активных субстанций является хорошо известным в уровне техники. Исключения составляют случаи, когда любые из традиционных сред или агентов являются несовместимыми с активным ингредиентом; тогда их применение в терапевтических композициях заранее обдумывают. Дополнительные активные ингредиенты также могут быть включены в композиции. В контексте изобретения термин "лечащий" или "лечение", как описано здесь, обозначает обратное протекание, облегчение, замедление прогрессирования или предотвращение нарушения или состояния, к которому применяется данный термин, или одного или более симптомов такого нарушения или состояния."Терапевтически эффективное количество" обозначает количество соединения/медикамента, которое в соответствии с настоящим изобретением является эффективным для произведения требуемого терапевтического эффекта. В соответствии с изобретением термин "пациент" или "пациент, который нуждается (в лечении)" подразумевает человека или млекопитающее, пораженное или имеющее вероятность быть пораженным нейропсихологическим заболеванием, предпочтительным пациентом является человек. В общих чертах, соединения по этому изобретению могут изготавливаться в виде водных физиологических буферных растворов, содержащих 0,1-10% мас./об. соединения для парентерального введения. Стандартные дозы варьируются от 1 мкг/кг до 0,1 г/кг веса тела в день; предпочтительная доза составляет от 0,01 до 10 мг/кг веса тела в день. Предпочтительная дневная доза для взрослого человека включает 5, 50, 100 и 200 мг и эквивалентна дозе для ребенка. Предпочтительная доза вводимого лекарства, вероятно, зависит от таких переменных, как тип и степень прогрессирования заболевания или нарушения,общего состояния здоровья конкретного пациента, относительной биологической эффективности выбранного соединения и состава наполнителей соединения и его способа введения. Соединения по настоящему изобретению могут вводиться в единичных дозированных формах, где термин "единичная доза" обозначает одну дозу, которая может вводиться пациенту и которая может быть легко произведена и упакована, и упоминается как физически и химически стабильная единичная доза,содержащая или само активное соединение, или фармацевтически приемлемую композицию, как описано далее. Таким образом, обычная дневная доза варьируется от 0,01 до 10 мг/кг веса тела. В качестве общего руководства единичные дозы для человека варьируются от 0,1 до 1000 мг в день. Предпочтительная единичная доза варьируется от 1 до 500 мг при введении от одного до четырех раз в день и даже более предпочтительно от 10 до 300 мг при введении два раза в день. Соединения, представленные в работе,могут быть сформулированы в фармацевтические композиции смешиванием с одним или более фармацевтически приемлемыми наполнителями. Такие композиции могут быть приготовлены для перорального введения, особенно в форме таблеток или капсул, или для парентерального введения, особенно в форме жидких растворов, суспензий или эмульсий, или интраназального введения, особенно в форме порошков, назальных капель или аэрозолей, или дермального введения, например местного или с помощью трансдермальных повязок. Композиции легко могут вводиться в единичной дозированной форме и могут быть приготовлены любым методом, хорошо известным в фармацевтическом уровне техники, например, описанном в Remington: The Science and Practice of Pharmacy, 20th ed; Gennaro, A.R., Ed.; Lippincott WilliamsWilkins:Philadelphia, PA, 2000. Фармацевтически совместимые связывающие агенты и/или вспомогательные вещества могут включаться в композиции. Пероральные композиции в основном включают инертные разжижающие носители или пищевые носители. Таблетки, пилюли, порошки, капсулы, шарики и подобные могут содержать один или более из следующих ингредиентов или соединения аналогичной природы: клеящие вещества, такие как микрокристаллическая целлюлоза или трагакантовая камедь; разжижители, такие как крахмал или лактоза; дезинтеграторы, такие как крахмал и производные целлюлозы; лубриканты, такие как магний стеарат; агенты,улучшающие скольжение, такие как коллоидный диоксид кремния; подсластители, такие как сахароза или сахарин; или отдушки, такие как перечная мята или метилсалицилат. Капсулы могут быть в форме твердых или мягких капсул, которые обычно производят из желатиновых смесей, при необходимости,смеси включают пластификаторы так же, как и в форме крахмальных капсул. Дополнительно, дозированные формы могут содержать различные другие материалы, которые модифицируют физическую форму дозированных единиц, например покрытия из сахара или шеллака, или энтеральные агенты. Другие пероральные дозированные формы: сиропы или эликсиры, могут содержать подсластители, консерванты, красители, красящие вещества и отдушки. Дополнительно, активные соединения могут быть скомбинированы в составы и препараты для быстрого растворения, модифицированного выделения или замедленного выделения, и где такие препараты замедленного выделения предпочтительно являются бимодульными. Предпочтительные препараты включают фармацевтические композиции, в которых соединение по- 13019594 настоящему изобретению формулируют для перорального или парентерального введения или более предпочтительными являются те, где соединения по настоящему изобретению сформулированы в форме таблеток. Предпочтительно, когда таблетки содержат лактозу, кукурузный крахмал, силикат магния, натрий кросскармелозу, повидон, стеарат магния или тальк в любой комбинации. Также целью настоящего раскрытия является то, что соединение по настоящему изобретению может вводиться в продукты питания или жидкости. Жидкие составы для введения включают стерильные водные растворы или неводные растворы,суспензии или эмульсии. Жидкие композиции также могут включать клеящие вещества, буферы, консерванты, хелатирующие агенты, подсластители, отдушки и красящие вещества и подобные. Неводные растворы включают спирты, пропилен гликоль, полиэтилен гликоль, растительные масла, такие как оливковое масло, и органические сложные эфиры, такие как этилолеат. Водные носители включают смеси спиртов и воды, буферную среду и раствор соли, в частности биосовместимый, биоразлагаемый полимер,лактидный/гликолидный сополимер или полиоксиэтилен-полиоксипропилен сополимеры, которые могут быть полезными наполнителями при контролируемом выделении активных соединений. Внутривенные переносчики могут включать текучие среды и питательные добавки, электролитические добавки, такие как добавки на основе декстрозы Ринджера и подобные. Другие потенциально применимые системы доставки для этих активных соединений включают частицы этиленвинил ацетатного сополимера, осмотические помпы, имплантируемые инфузионные системы и липосомы. Альтернативным способом введения препаратов является ингаляция, которая включает такие средства, как сухой порошок, аэрозоль или капли. Они могут быть в форме водных растворов, содержащих полиоксиэтилен-9-лауриловый эфир, гликохолат, или в форме масляных растворов для введения в форме назальных капель, или в форме геля для интраназального введения. Препараты для буккального введения включают, например, лепешки или пастилки и также могут включать вкусовые основания, такие как сахарозу или гуммиарабик и другие наполнители, такие как гликохолат. Препараты для ректального введения предпочтительно формулируются в виде единичных дозированных суппозиториев с твердым носителем, таким как кокосовое масло, и могут включать салицилат. Препараты для местного применения на коже предпочтительно имеют форму мазей, кремов, лосьонов, паст, гелей, спреев, аэрозолей или масел. Носители, которые могут применяться, включают вазелин, ланолин, полиэтиленгликоли, спирты или их комбинации. Препараты, подходящие для трансдермального введения, выпускаются в виде отдельных повязок и могут быть липофильными эмульсиями или буферными водными растворами, растворенными и/или диспергированными в полимере или адгезиве. Изобретение далее иллюстрируется, но не ограничивается описанием следующих примеров. Пример 1 Смесь 4-[3-(цис- и транс-3,5-диметилпиперидино)пропокси]бензоилхлорид гидрохлорида (866 мг),2 М раствора диметиламина в тетрагидрофуране (3,75 мл) и тетрагидрофурана (10 мл) перемешивают в течение 1 ч при комнатной температуре. Смесь концентрируют при пониженном давлении и очищают хроматографией на силикагеле с элюентом - диэтиловый эфир/лигроин/триэтиламин 80/20/1. Фракции,содержащие ожидаемый продукт, объединяют, концентрируют при пониженном давлении и переводят в соль с 20 мг щавелевой кислоты, получают 37 мг транс-1-3-[4-(N,N-диметилкарбамоил)фенокси]пропил-3,5-диметилпиперидин оксалата в виде розового порошка. 1 Н ЯМР основания в CDCl3: 7.38 (d, J=8.7 Hz, 2H, arom), 6.90 (d, J=8.7 Hz, 2H, arom), 4.05 (t, J=6.0 4-[3-(цис- и транс-3,5-Диметилпиперидино)пропокси]бензоилхлорид гидрохлорид может быть получен следующим образом. Оксалилхлорид (800 мкл) по каплям прибавляют к раствору 4-[3-(цис- и транс-3,5 диметилпиперидино)пропокси]бензойной кислоте (2,33 г) в дихлорометане (20 мл), содержащем одну- 14019594 каплю N,N-диметилформамида. Смесь перемешивают в течение 2 ч при комнатной температуре и концентрируют при пониженном давлении. Циклогексан прибавляют и упаривают при пониженном давлении для получения 2,55 г 4-[3-(цис- и транс-3,5-диметилпиперидино)пропокси]бензоилхлорид гидрохлорида, который применяют без дальнейшей очистки. Гидрохлорид 4-[3-(цис- и транс-3,5-диметилпиперидино)пропокси]бензойной кислоты может быть получен следующим образом. Раствор цис- и транс-1-3-[4-(метоксикарбонил)фенокси]пропил-3,5-диметилпиперидина (5,3 г) в 1N водном растворе натрия гидроксида (50 мл) и метанола (30 мл) кипятят в течение 30 мин. Метанол упаривают при пониженном давлении. Водный слой промывают с этилацетатом и подкисляют водной хлороводородной кислотой. Появившийся осадок отфильтровывают, сушат и получают гидрохлорид 4[3-(цис- и транс-3,5-диметилпиперидино)пропокси]бензойной кислоты в виде белого твердого вещества. цис- и транс-1-3-[4-(Метоксикарбонил)фенокси]пропил-3,5-диметилпиперидин может быть получен следующим образом. Смесь метил 4-(3-хлорпропокси)бензоата (4,57 г), карбоната калия (8,29 г), цис- и транс-3,5 диметилпиперидина (5,31 мл) и каталитического количества йодида калия в N,N-диметилформамиде(100 мл) перемешивают в течение ночи при 100 С. Суспензию отфильтровывают и осадок промывают этанолом. Фильтрат концентрируют при пониженном давлении и очищают хроматографией на силикагеле с градиентом дихлорметан/метанол от 98/2 до 90/10. Фракции, содержащие ожидаемое вещество, объединяют и концентрируют при пониженном давлении и получают 5,33 г цис- и транс-1-3-[4(метоксикарбонил)фенокси]пропил-3,5-диметилпиперидина. Метил 4-(3-хлорпропокси)бензоат может быть получен следующим образом. Суспензию карбоната калия (48,4 г) в смеси метил 4-гидроксибензоата (10,65 г), 1-бром-3 хлорпропана (55,1 г) и N,N-диметилформамида (100 мл) перемешивают при комнатной температуре в течение 15 ч. Твердые вещества отфильтровывают и трижды промывают этанолом (30 мл). Объединенные фильтраты концентрируют при пониженном давлении и затем растворяют в этилацетате (200 мл). Органический слой дважды промывают водой (50 мл), высушивают над сульфатом магния и концентрируют при пониженном давлении, получают 15 г метил 4-(3-хлорпропокси)бензоата, который применяют без дальнейшей очистки. транс-1-3-[4-(N,N-тетраметилкарбамоил)фенокси]пропил-3,5-диметилпиперидин оксалат. Следующая методика аналогична описанной в примере 1 А, но в качестве исходных применяются 4-[3-(цис- и транс-3,5-диметилпиперидино)пропокси]бензоилхлорид, гидрохлорид (700 мг) и пирролидин 1-[3-(4-бензоилфенил)пропокси]пиперидин оксалат. А. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются 4-(3-хлорпропокси)бензофенон (1,37 г), пиперидин (1 мл), карбонат калия (2,07 г) и каталитическое количество йодида калия в N,N-диметилформамиде (25 мл) и получают после образования соли с (55 мг) щавелевой кислоты в ацетоне (0,6 мл) 239 мг 1-[3-(4-бензоилфенил)пропокси]пиперидин оксалата в виде белого порошка. 1 Н ЯМР: оксалата (DMSO): 7.73 (d, J=8.8 Hz, 2H, arom), 7.67-7.53 (m, 5H, Ph), 7.07 (d, J=8.8 Hz, 2H,arom), 4.15 (t, J=6.0 Hz, 2H, CH2O), 3.09 (m, 6H, 3 CH2N), 2.15 (m, 2H, CH2), 1.70 (m, 4H, 2 CH2), 1.50 (m,2H, CH2). В. 4-(3-Хлорпропокси)бензофенон может быть получен следующим образом. Следующая методика аналогична описанной в примере 1 Е, но в качестве исходных применяются 4-гидроксибензофенон (0,99 г), карбонат калия (3,45 г) и 1-бром-3-хлорпропан (2,5 мл) в N,Nдиметилформамиде (7,5 мл) и получают 1,4 г 4-(3-хлорпропокси)бензофенона в виде желтого масла. 1-[3-(4-цианометилфенил)пропокси]пиперидин оксалат. А. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются 4-(3-хлорпропокси)фенилацетонитрил (698 мг), пиперидин (658 мкл) и карбонат калия (1,38 г) вN,N-диметилформамиде (16 мл) и получают после растворения в смеси диэтилового эфира (5 мл) и этанола (1 мл) и образования соли с (191 мг) щавелевой кислотой в ацетоне (0,5 мл) 493 1-[3-(4 цианометилфенил)пропокси]пиперидин оксалата в виде бежевого твердого вещества, плавящегося при 181 С. 1 Н ЯМР оксалата (DMSO): 7.24 (d, J=8.6 Hz, 2 Н, arom), 6.92 (d, J=8.6 Hz, 2H, arom), 4.00 (t, J=6.0 Hz 2H, CH2O), 3.91 (s, 2H, CH2CN), 3.05 (m, 6H, 3 CH2N), 2.07 (m, 2H, CH2), 1.70 (m, 4H, CH2), 1.50 (m, 2H,CH2). В. 4-(3-Хлорпропокси)фенилацетонитрил может быть получен следующим образом. Следующая методика аналогична описанной в примере 1 Е, но в качестве исходных применяются 4-гидроксифенилацетонитрил (4,65 г), карбонат калия (24 г) и 1-бром-3-хлорпропан (17,3 мл) в N,Nдиметилформамиде (23 мл) и получают 6,86 г 4-(3-хлорпропокси)фенилацетонитрила в виде желтого твердого вещества. А. Раствор транс-1-[3-(4-ацетилфенокси)пропил]-3,5-диметилпиперидина (289 мг) в тетрагидрофуране (1 мл) перемешивают при комнатной температуре в безводной атмосфере и по каплям прибавляют 400 мкл 2,61 М раствора метилмагний бромида в тетрагидрофуране. Смесь перемешивают при комнатной температуре в течение 3 ч и разбавляют насыщенным водным раствором хлорида аммония. Раствор экстрагируют этилацетатом и объединенные экстракты промывают водой, сушат над сульфатом магния,концентрируют при пониженном давлении и очищают хроматографией на силикагеле с дихлорметаном/метанолом 95/5 в качестве элюента. Фракции, содержащие ожидаемый продукт, объединяют, переводят в соль с 20 мг щавелевой кислоты и получают 70 мг транс-1-3-[4-(1-гидрокси-1 метилэтил)фенокси]пропил-3,5-диметилпиперидин оксалата в виде бледно-желтого твердого вещества. 1 Н ЯМР оксалата (DMSO): 7.33 (d, J=8.6 Hz, 2 Н, arom), 6.82 (d, J=8.6 Hz, 2H, arom), 3.98 (t, J=6.0 Hz,2H, CH2O), 3.1-2.5 (m, 6H, 3 CH2N), 2.05 (m, 4H, CH21 2 CH), 1.36 (m, 8H, 2 CH3, CH2), 0.96 (2d, J=6.7 Hz,J=6.7 Hz, 6H, 2 CH3).(RS)-1-3-[4-(1-гидрокси-1-метилэтил)фенокси]пропил-3-метилпиперидин оксалат. А. Следующая методика аналогична описанной в примере 5, но в качестве исходных применяются(RS)-1-3-[4-(метоксикарбонил)фенокси]пропил-3-метилпиперидин (146 мг) и 0,8 мл 2,61 М раствора метилмагний хлорида в тетрагидрофуране и после образования соли с щавелевой кислотой получают 104 мг (RS)-1-3-[4-(1-гидрокси-1-метилэтил)фенокси]пропил-3-метилпиперидин оксалата в виде твердого белого продукта. 1 Н ЯМР оксалата (DMSO): 7.34 (d, J=8.6 Hz, 2 Н, arom), 6.82 (d, J=8.6 Hz, 2H, arom), 3.98 (t, J=6,0 Hz,2H, CH2O), 3.33 (m, 2H, 2 CH2N eq.), 3.06 (m, 2H, CH2N), 2.70 (m, 1H, CH2N ax.), 2.46 (m, 1H, CH2N eq.),2.05 (m, 2H, CH2), 1.69 (m, 4H, CH2, CH, 1 CH2 eq.), 1.36 (s, 6H, 2 CH3), 1.06 (m, 1H, CH2 ax.), 0.88 (d, J=6.5Hz, 3H, CH3). В. (RS)-1-3-[4-(Метоксикарбонил)фенокси]пропил-3-метилпиперидин может быть получен следующим образом. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются метил 4-(3-хлорпропокси)бензоат (458 мг), (RS)-3-метилпиперидин (1,2 мл), карбонат калия (2,0 г) и каталитическое количество йодида калия в N,N-диметилформамиде (25 мл) и получают 433 мг (RS)-1-3[4-(метоксикарбонил)фенокси]пропил-3-метилпиперидина в виде желтого твердого вещества.Rf ТСХ (дихлорметан/метанол 90/10)=0,4. С. 4-(3-Хлорпропокси)бензоат может быть получен следующим образом. Следующая методика аналогична описанной в примере 1 Е, но в качестве исходных применяются метил 4-гидроксибензоат (15,2 г), карбонат калия (65 г) и 1-бром-3-хлорпропан (50 мл) в N,Nдиметилформамиде (100 мл) и получают 22,5 г 4-(3-хлорпропокси)бензоат в виде масла. К раствору 4-гептанона (471 мг) в тетрагидрофуране (4 мл) прибавляют раствор 4-(3 пиперидинопропокси)фенилмагний бромида в тетрагидрофуране (11 мл, 3.3 ммоль). Смесь перемешивают в течение ночи при комнатной температуре и разбавляют при 0 С насыщенным водным раствором хлорида аммония (20 мл). Раствор экстрагируют этилацетатом (20 мл) и промывают органический слой насыщенным раствором хлорида аммония (20 мл), сушат над сульфатом магния, концентрируют при пониженном давлении и чистят хроматографией на силикагеле с градиентом дихлорметан/метанол от 98/2 до 95/5 в качестве элюента. Фракции, содержащие ожидаемый продукт, объединяют и концентрируют при пониженном давлении и получают 1-3-[4-(1-гидрокси-1-пропилбутил)фенокси]пропилпиперидин в виде желтого масла. После образования соли с щавелевой кислотой в этаноле получают 1-3-[4-(1 гидрокси-1-пропилбутил)фенокси]пропилпиперидин оксалат в виде белого твердого вещества, плавящегося при 118 С. 1 Н ЯМР оксалата (DMSO): 7.23 (d, J=8.6 Hz, 2 Н, arom), 6.80 (d, J=8.6 Hz, 2H, arom), 3.98 (t, J=6.0 Hz,2H, CH2O), 3.08 (m, 6H, 3 CH2N), 2.07 (m, 2H, CH2), 1.8-1.3 (m, 10H, 5 CH2), 1.2-0.8 (m, 4H, 2 CH2), 0.72 (t,J=6.9 Hz, 6H, 2 CH3). 4-(3-Пиперидинопропокси)фенилмагний бромид может быть получен следующим образом. В круглодонную колбу помещают магниевую стружку (0,29 г). Колбу сушат воздухом, охлаждают до комнатной температуры и вводят тетрагидрофуран (3 мл). Прибавляют 3-мл порцию раствора 1-[3-(4 бромфенил)пропокси]пиперидина (2,98 г) в тетрагидрофуране (30 мл). Реакцию начинают прибавлением- 17019594 небольшого объема 1,2-дибромэтана и небольшого дополнительного количества магниевой стружки. Затем реакционную смесь нагревают и прибавляют остаток раствора 1-[3-(4 бромфенил)пропокси]пиперидина. Смесь нагревают в течение 3 ч при 70 С. Всплывающий слой отбирают шприцем и получают 33 мл (10 ммоль) 4-(3-пиперидинопропокси)фенилмагний бромида в тетрагидрофуране. 1-[3-(4-Бромфенил)пропокси]пиперидин может быть получен, как описано в ЕР 9905744. Пример 8 1-3-[4-(1-гидроксициклопентил)фенокси]пропилпиперидин. Следующая методика аналогична описанной в примере 7 А, но в качестве исходных применяются циклопентанон (365 мл), тетрагидрофуран (4 мл) и раствор 4-(3-пиперидинпропокси)фенилмагний бромида в тетрагидрофуране (11 мл, 3,3 ммоль) и получают после образования соли с щавелевой кислотой 115 мг 1-3-[4-(1-гидроксициклопентил)фенокси]пропилпиперидина. 1 Н-ЯМР основания (CDCl3): 7.41 (d, J=6.7 Hz, 2H, arom), 6.87 (d, J=6.7 Hz, 2H, arom), 4.01 (t, J=6.0 1-3-[4-(1-гидрокси-1-аллилбут-3-енил)фенокси]пропилпиперидин оксалат. Следующая методика аналогична описанной в примере 5, но в качестве исходных применяются 13-[4-(метоксикарбонил)фенокси]пропилпиперидин (560 мг) и 1 М раствор аллилмагний бромида в диэтиловом эфире (6,8 мл) и получают после образования соли с щавелевой кислотой 165 мг 1-3-[4-(1 гидрокси-1-аллилбут-3-енил)фенокси]пропилпиперидин оксалата в виде белого порошка. 1 Н ЯМР оксалата (DMSO): 7.25 (d, J=8.7 Hz, 2 Н, arom), 6.81 (d, J=8.7 Hz, 2H, arom), 5.65 (m, 2H, 2 Тионилхлорид (50 мкл) по каплям прибавляют к раствору транс-1-3-[4-(1-гидрокси-1 метилэтил)фенокси]пропил-3,5-диметилпиперидина (115 мг) в диэтиловом эфире (5 мл) и пиридина (35 мкл) при перемешивании при температуре, близкой к 0 С. Смесь перемешивают в течение 1 ч при комнатной температуре, концентрируют при пониженном давлении и разбавляют безводным тетрагидрофураном (5 мл). К этому раствору прибавляют свежеприготовленный метилат натрия (200 мг). Смесь перемешивают при комнатной температуре в течение 2 ч и чистят хроматографией на силикагеле с градиентом дихлорметан/метанол от 82/2 до 95/5. Фракции, содержащие ожидаемый продукт, объединяют, концентрируют при пониженном давлении и получают 50 мг оранжевого масла, которое растворяют в диэтиловом эфире (2 мл). К этому раствору прибавляют раствор щавелевой кислоты (16 мг) в ацетоне (0,2 мл) и после фильтрования и сушки получают 11 мг транс-1-3-(4-изопропенилфенокси)пропил]-3,5 диметилпиперидин оксалата в виде белого порошка. 1 Н ЯМР основания (CDCl3): 7.40 (d, J=8.7 Hz, 2H, arom), 6.87 (d, J=8.7 Hz, 2H, arom), 5.28 (s, 1H,CH2=), 4.99 (s, 1H, CH2=), 4.04 (t, J=6,0 Hz, 2H, CH2O), 2.40 (m, 4H, 2 CH2N), 2.13 (s, 3H, CH3O), 2.00 (m,2H, CH2N), 1.93 (m, 4H, CH2, 2 CH), 1.28 (dd, J=6.5 Hz, J=6.5 Hz, 2H, CH2), 0.96 (2d, J=6.8 Hz, J=6.8 Hz,6H, CH3). транс-1-3-(4-стирилфенокси)пропилпиперидин оксалат. А. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются 4-(3-хлорпропокси)стильбен (500 мг), пиперидин (362 мкл) и карбонат калия (760 мг) в N,Nдиметилформамиде (10 мл) и получают после образования соли с щавелевой кислотой в этаноле 426 мг транс-1-3-(4-стирилфенокси)пропил]пиперидин оксалата в виде белого твердого вещества. 1 Н ЯМР оксалата (DMSO): 7.52 (m, 4 Н, arom), 7.33 (t, J=7.2 Hz, 2 Н, arom), 7.2 (m, 1 Н, arom), 7.18 (m,1H, CH=), 7.06 (d, J=16.5 Hz, 1H, CH=) 6.92 (d, J=8.5 Hz, 2H, arom), 4.04 (t, J=5.6 Hz, 2H, CH2O), 3.11 (m,6H, 3 CH2N), 2.11 (m, 2H, CH2), 1.70 (m, 4H, CH2), 1.50 (m, 2H, CH2). В. 4-(3-Хлорпропокси)стильбен может быть получен следующим образом. Следующая методика аналогична описанной в примере 1 Е, но в качестве исходных применяются 4-гидроксистильбен (2 г), карбонат калия (7,04 г) и 1-бром-3-хлорпропан (5 мл) в N,Nдиметилформамиде (10 мл) и получают 2,06 г 4-(3-хлорпропокси)стильбена в виде белого твердого вещества.(3S,5S)-1-3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил-3,5-диметилпиперидин дигидрохлорид. А. Смесь (3S,5S)-1-(3-хлорпропил)-3,5-диметилпиперидин гидрохлорида (2,04 г), транс-N,Nдиметил-4-(4-гидроксифенил)циклогексанамина (1,98 г) и карбоната калия (5,0 г) в N,Nдиметилформамиде перемешивают при температуре, близкой к 60 С, в течение ночи. Осадок отфильтровывают. Фильтрат концентрируют при пониженном давлении, чистят хроматографией на силикагеле с градиентом дихлорметан/метанол/аммоний от 90/10/1 до 80/20/1. Фракции, содержащие ожидаемый продукт, объединяют, концентрируют при пониженном давлении и получают 2,25 г (3S,5S)-1-3-[4-(транс-4 диметиламиноциклогекс-1-ил)фенокси]пропил-3,5-диметилпиперидина. Основание растворяют в этаноле и переводят в гидрохлорид прибавлением раствора хлороводорода в этаноле. Перекристаллизация из этанола дает 1,93 г (3S,5S)-1-3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил-3,5 диметилпиперидин дигидрохлорида в виде белого порошка, плавящегося при 240 С. 1 Н ЯМР (DMSO): 10.7 (bs, 1H, NH), 9.9 (bs, 1H, NH), 7.12 (d, J=8.4 Hz, 2H, arom), 6.84 (d, J=8.4 Hz,2H, arom), 3.97 (t, J=5.9 Hz, 2H, CH2O), 3.30-3.05 (m, 6H, 3 CH2N), 2.90 (m, 1H, CHN), 2.66 (m, 6H, 2CH3N), 2.45 (m, 1H, CHAr), 2.20-1.95 (m, 6H), 1.85 (m, 2H), 1.60-1.20 (m, 6H), 1.16 (d, J=7,4 Hz, 3H, CH3C),1.85 (d, J=6,5 Hz, 3H, CH3C). В. (3S,5S)-1-(3-Хлорпропил)-3,5-диметилпиперидин гидрохлорид. Смесь (3S,5S)-1-(3-гидроксипропил)-3,5-диметилпиперидина (1,91 г), тионилхлорида (0,96 мл) и дихлорметана (10 мл) перемешивают при комнатной температуре в течение 5 ч, концентрируют при пониженном давлении и растирают с диэтиловым эфиром для получения 2,0 г (3S,5S)-1-(3-хлорпропил)3,5-диметилпиперидин гидрохлорида в виде бежевого порошка, который применяют без дальнейшей очистки. С. (3S,5S)-1-(3-Гидроксипропил)-3,5-диметилпиперидин. Смесь (3S,5S)-3,5-диметилпиперидина гидрохлорида (2,58 г), 3-хлорпропанола (1,44 мл), карбоната калия (3,58 г) и каталитического количества йодида калия в ацетоне (10 мл) перемешивают при кипячении в течение 24 ч. Осадок отфильтровывают и промывают ацетоном. Фильтрат концентрируют при пониженном давлении и чистят хроматографией на силикагеле с градиентом дихлорметан/метанол/триэтиламин от 80/20/1 до 50/50/1 и получают 1,9 г (3S,5S)-1-(3-гидроксипропил)-3,5 диметилпиперидин в виде желтого масла.D. транс-N,N-Диметил-4-(4-гидроксифенил)циклогексанамин. К раствору транс-4-(4-гидроксифенил)циклогексанамина гидрохлорида (3,42 г) в диоксане (75 мл) прибавляют водный раствор формальдегида (11,2 мл, 38%) и мононатриевой соли фосфорной кислоты(150 мл, 1 N) и прибавляют концентрированный водный раствор гидроксида натрия до тех пор, пока рН раствора не станет нейтральным. Раствор перемешивают при температуре, близкой к 60 С, в течение 1 ч,охлаждают до комнатной температуры и доводят до рН 7-8 прибавлением концентрированного водного раствора гидроксида натрия. После упаривания диоксана выпадает осадок. Осадок отфильтровывают и промывают водой. Хроматографическая очистка на силикагеле с градиентом дихлорме- 19019594 тан/метанол/аммоний от 90/10/1 до 70/30/1 и растирание с диэтиловым эфиром дает сырой продукт, который далее чистят хроматографией на силикагеле с элюентом дихлорметан/метанол/аммоний 80/20/1 и получают транс-N,N-диметил-4-(4-гидроксифенил)циклогексанамин в виде желтого порошка. Е. транс-4-(4-Гидроксифенил)циклогексанамин может быть получен, как описано в WO 01/81295(Warner-Lambert Company) или следующим образом. Суспензию транс-N-бензил-4-(4-гидроксифенил)циклогенсанамина (7,69 г) и палладия-на-угле (800 мг) в метаноле (300 мл) перемешивают при температуре, близкой к 40 С, в течение 8 ч под давлением водорода 15 бар. Фильтрование через целит и упаривание растворителя при пониженном давлении дает 4,9 г транс-4-(4-гидроксифенил)циклогексанамина в виде белого порошка. транс-N-Бензил-4-(4-гидроксифенил)циклогенсанамин может быть получен, как описано WO 01/81295 (Warner-Lambert Company).(50 мл), водному раствору формальдегида (3,7 мл, 37%) и мононатриевой соли фосфорной кислоты (49 мл, 1 N) прибавляют концентрированный водный раствор гидроксида натрия до тех пор, пока рН не станет нейтральным. Раствор перемешивают при температуре, близкой к 60 С, в течение 2 ч, охлаждают до комнатной температуры и доводят до рН 7-8 прибавлением концентрированного водного раствора гидроксида натрия. Упаривание диоксана приводит к выпадению осадка. Осадок отфильтровывают, промывают водой и диэтиловым эфиром и получают 1,78 г транс-N,N-диметил-4-(4 гидроксифенил)циклогексанамина в виде белого твердого вещества.G. транс-4-(4-Гидроксифенил)-N-метилциклогексанамин. Смесь 4-(4-гидроксифенил)циклогексанона (3 г) в тетрагидрофуране (20 мл) и раствора метиламина в тетрагидрофуране (7,9 мл, 2 М) перемешивают в течение ночи при комнатной температуре, концентрируют при пониженном давлении, растворяют в смеси дихлорометана и метанола (30 мл, 1/1) и охлаждают до температуры, близкой к 0 С. К смеси порциями прибавляют боргидрид натрия (822 мг) и смесь перемешивают при комнатной температуре в течение 1 ч. Осадок отфильтровывают, промывают диэтиловым эфиром и получают 1,1 г транс-4-(4-гидроксифенил)-N-метилциклогексанамина, который применяют без дальнейшей очистки. Пример 13 1-3-[4-(Бензилокси)фенокси]пропилпиперидин оксалат. А. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются О-бензил-4-(3-хлорпропокси)фенол (500 мг), пиперидин (357 мкл) и карбонат калия (749 мг) в N,Nдиметилформамиде (10 мл) и получают после образования соли с щавелевой кислотой в этаноле 459 мг 1-3-[4-(бензилокси)фенокси]пропилпиперидин оксалат в виде белого твердого вещества. 1 Н ЯМР оксалата (DMSO): 7.34 (m, 5H, arom), 6.91 (d, J=9.2 Hz, 2 Н, arom), 6.83 (d, J=9.2 Hz, 2H,arom), 5.00 (s, 2H, PhCH2O), 3.93 (t, J=6.0 Hz, 2 Н, CH2O), 3.07 (m, 6H, 3 CH2N), 2.05 (m, 2H, CH2), 1.69 (m,4H, CH2), 1.50 (m, 2H, CH2). В. О-Бензил-4-(3-хлорпропокси)фенол может быть получен следующим образом. Следующая методика аналогична описанной в примере 1 Е, но в качестве исходных применяются 4-бензилоксифенол (2 г), карбонат калия (6,90 г) и 1-бром-3-хлорпропан (4,94 мл) в N,Nдиметилформамиде (10 мл) и получают 2,07 О-бензил-4-(3-хлорпропокси)фенола как белое твердое вещество. транс-1-3-[4-(фенокси)фенокси]пропил-3,5-диметилпиперидин. А. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются 4-(3-хлорпропокси)-О-фенилфенол (130 мг), транс-3,5-диметилпиперидин (112 мг), карбонат калия(300 мг) и каталитическое количество йодида калия в N,N-диметилформамиде (10 мл) и получают после образования соли щавелевой кислоты в этаноле 65 мг транс-1-3-[4-(фенокси)фенокси]пропил-3,5 диметилпиперидина в виде белого твердого вещества. 1 Н ЯМР оксалата (DMSO): 7.32 (m, 2 Н, arom), 7.95 (m, 7 Н, arom), 3.99 (t, J=5.8 Hz, 2H, CH2O), 3.22.5 (m, 6 Н, 3 CH2N), 2.06 (m, 4 Н, СН 2, 2 СН), 1.35 (m, 2 Н, СН 2), 0.96 (2d, J=5.9 Hz, J=5.9 Hz, 6H, 2 СН 3).- 20019594 В. 4-(3-Хлорпропокси)-О-фенилфенол может быть получен следующим образом. Следующая методика аналогична описанной в примере 1 Е, но в качестве исходных применяются 4-феноксифенол (950 мг), карбонат калия (3,2 г) и 1-бром-3-хлорпропан (2,5 мл) в N,Nдиметилформамиде (5 мл) и получают 0,50 г 4-(3-хлорпропокси)-О-фенилфенола, который применяется без дальнейшей очистки. Пример 15 Смесь 1-(3-феноксипропил)пиперидин оксалата (0,2 г), 5-аменопентановой кислоты (0,076 г) и полифосфорной кислоты (2 г) перемешивают при температуре, близкой к 100 С, в течение 1 ч. Смесь охлаждают до комнатной температуры, разбавляют водой (25 мл), подщелачивают прибавлением концентрированного водного раствора гидроксида натрия с внешним охлаждением и дважды экстрагируют этилацетатом (25 мл). Органические слои объединяют, промывают насыщенным водным раствором хлорида натрия (25 мл), сушат над сульфатом магния и очищают хроматографией на силикагеле. Фракции,содержащие ожидаемое вещество, объединяют, концентрируют при пониженном давлении и получают 0,172 г 6-[4-(3-пиперидинпропокси)фенил]-2,3,4,5-тетрагидропиридина, который растворяют в этаноле (2 мл). К этому раствору прибавляют раствор щавелевой кислоты (0,104 г) в этаноле (0,5 мл). Осадок, который образуется при стоянии, отфильтровывают, промывают этанолом и сушат, получают 200 мг 6-[4-(3 пиперидинпропокси)фенил]-2,3,4,5-тетрагидропиридин оксалата в виде белого твердого вещества, плавящегося при 104 С. 1 Н ЯМР оксалата (DMSO): 7.88 (d, J=8.7 Hz, 2 Н, arom), 7.06 (d, J=8.7 Hz, 2H, arom), 4.11 (t, J=5.9 Hz,2H, CH2O), 3.67 (m, 2H, CH2N=), 3.3-2.8 (m, 8H, 3 CH2N, CH2C=N), 2.13 (m, 2H, CH2), 1.72 (m, 8H, 4 CH2),1.50 (m, 2H, CH2) В. 1-(3-Феноксипропил)пиперидин оксалат может быть получен следующим образом. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются О-(3-хлорпропил)фенол (382 мг), пиперидин (0,79 мл), карбонат калия (1,66 г) и каталитическое количество йодида калия в N,N-диметилформамиде (20 мл) и получают после образования соли щавелевой кислоты в этаноле 729 мг 1-(3-феноксипропил)пиперидин оксалата в виде белого твердого вещества, плавящегося при 183 С. Пример 16 транс-6-4-[3-(3,5-диметилпиперидин)пропокси]фенил-2,3,4,5-тетрагидропиридин диоксалат. А. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются 6-[4-(3-хлорпропокси)фенил]-2,3,4,5-тетрагидропиридин (755 мг), коммерчески доступная смесь цис- и транс-3,5-диметилпиперидина (0,796 мл), карбонат калия (1,24 г) и каталитическое количество йодида калия в N,N-диметилформамиде (20 мл) и получают после двух хроматографий на силикагеле: первая с градиентом дихлорметан/метанол от 98/2 до 95/5, вторая с градиентом диэтиловый эфир/лигроин/триэтиламин от 50/49/1 до 75/25/1, и образования соли с щавелевой кислотой в этаноле и диэтиловом эфире 83 мг транс-6-4-[3-(3,5-диметилпиперидин)пропокси]фенил-2,3,4,5-тетрагидропиридин диоксалата в виде белого твердого вещества, плавящегося при 72 С. 1 Н ЯМР оксалата (DMSO): 7.89 (d, J=8.7 Hz, 2 Н, arom), 7.07 (d, J=8.7 Hz 2H, arom), 4.11 (t, J=5,9 Hz 2H, CH2O), 3.68 (m, 2H, CH2N=), 3.2-2.6 (m, 8H, 3 CH2N, CH2C=N), 2.11 (m, 4H, CH2, 2 CH), 1.77 (m, 4H, 2CH2), 1.37 (m, 2H, CH2), 0.96 (2d, J=5.9 Hz, J=5.9 Hz, 6H, 2 CH3). В. 6-[4-(3-Хлорпропокси)фенил]-2,3,4,5-тетрагидропиридин может быть получен следующим образом. Следующая методика аналогична описанной в примере 15 А, но в качестве исходных применяются О-(3-хлорпропил)фенол (3,55 г), 5-аминопентановая кислота (2,39 г) и полифосфорная кислота (36 г) и получают 1,563 г 6-[4-(3-хлорпропокси)фенил]-2,3,4,5-тетрагидропиридина.O-(3-Хлорпропил)фенол может быть закуплен в Aldrich Rare Chemicals и Salor. транс-1-3-[4-(4,5-дигидро-3H-пиррол-2-ил)фенокси]пропил-3,5-диметилпиперидин диоксалат. А. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются 2-[4-(3-хлорпропокси)фенил]-4,5-дигидро-3H-пиррол (832 мг), коммерчески доступная смесь цис- и транс-3,5-диметилпиперидина (0,929 мл), карбонат калия (1,45 г) и каталитическое количество йодида калия в N,N-диметилформамиде (20 мл) и получают после двух хроматографий на силикагеле: первая с градиентом дихлорметан/метанол от 98/2 до 95/5,вторая с диэтиловым эфиром/лигроином/триэтиламином 50/49/1, и образования соли с щавелевой кислотой в этаноле и диэтиловом эфире 254 мг транс-1-3-[4-(4,5-дигидро-3H-пиррол-2-ил)фенокси]пропил-3,5-диметилпиперидин диоксалата в виде белого твердого вещества, плавящегося при 83 С. 1 Н ЯМР оксалата (DMSO): 7.87 (d, J=8.7 Hz, 2 Н, arom), 7.03 (d, J=8.7 Hz, 2H, arom), 4.09 (t, J=5.9 Hz,2H, CH2O), 3.94 (m, 2H, CH2N=), 3.2-2.5 (m, 8H, 3 CH2N, CH2ON), 2.03 (m, 6H, 2 CH21 2 CH), 1.35 (m, 2H,CH2), 0.96 (2d, J=5.6 Hz, J=5.6 Hz, 6H, 2 CH3). В. 2-[4-(3-Хлорпропокси)фенил]-4,5-дигидро-3H-пиррол может быть получен следующим образом. Следующая методика аналогична описанной в примере 1 А, но в качестве исходных применяются(9 мл) последовательно прибавляют 2,3 мл 2 М раствора диметиламина в тетрагидрофуране, уксусную кислоту (141 мкл) и триацетокси боргидрид натрия (845 мг). Смесь перемешивают в течение 3 ч при комнатной температуре. К смеси прибавляют дополнительное количество (0,7 мл) 2 М раствора диметиламина в тетрагидрофуране, триацетокси боргидрида натрия (253 мг) и уксусной кислоты (42 мкл). Смесь перемешивают в течение 1 ч при комнатной температуре, затем прибавляют 30 мл насыщенного водного раствора гидрокарбоната натрия. Смесь экстрагируют этилацетатом (три раза по 50 мл). Объединенные экстракты высушивают над сульфатом магния, концентрируют при пониженном давлении и очищают хроматографией на силикагеле с градиентом лигроин/диэтиловый эфир/триэтиламин/метанол от 80/20/1/0,1 до 20/80/1/0,1 и затем с градиентом диэтиловый эфир/триэтиламин/метанол от 100/1/0,1 до 90/1/10. Фракции, содержащие продукты, объединяют и концентрируют при пониженном давлении. Следующие продукты получают по ходу элюирования: 348 мг 1-3-[4-(цис-4 диметиламиноциклогекс-1-ил)фенокси]пропилпиперидина (изомер А) в виде желтого масла и 187 мг 13-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропилпиперидина (изомер В) в виде желтого твердого вещества. Эти два изомера отдельно переводят в соль с 182 и 98 мг щавелевой кислоты соответственно в этаноле и получают 466 мг 1-3-[4-(цис-4-диметиламиноциклогекс-1-ил)фенокси]пропилпиперидин диоксалата (изомер А) и 280 мг 1-3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропилпиперидин диоксалата (изомер В). 1 Н ЯМР оксалатов (DMSO). Изомер А: 7.19 (d, J=8.5 Hz, 2 Н, arom), 6.83 (d, J=8.5 Hz, 2H, arom), 3.96 (t, J=5.9 Hz, 2H, CH2O), 2.90 1-3-[4-(4-Оксоциклогексил)фенокси]пропилпиперидин может быть получен следующим образом. Суспензию карбоната калия (3,11 г), 4-[4-(3-хлорпропокси)фенил]циклогексанона (2 г), пиперидина(2,22 мл) и N,N-диметилформамида (40 мл) нагревают в течение 3 ч при температуре, близкой к 110 С,затем перемешивают 12 ч при комнатной температуре. Смесь концентрируют при пониженном давлении и растворяют в этилацетате (150 мл) и воде (150 мл). Органическую фазу дважды промывают водой (100 мл), сушат над сульфатом магния, концентрируют при пониженном давлении и чистят хроматографией на силикагеле с градиентом дихлорметан/метанол от 95/5 до 90/10. Фракции, содержащие продукт, объединяют и концентрируют при пониженном давлении и получают 1,94 г 1-3-[4-(4 оксоциклогексил)фенокси]пропилпиперидина в виде желтого твердого вещества, которое применяют без дальнейшей очистки. 4-[4-(3-Хлорпропокси)фенил]циклогексанон может быть получен следующим образом. Суспензию карбоната калия (12,4 г), 4-(4-гидроксифенил)циклогексанона (3,42 г) и N,Nдиметилформамида (18 мл) перемешивают 24 ч при комнатной температуре. Прибавляют 63 мл диэтилового эфира и смесь фильтруют. Нерастворимый осадок дважды промывают диэтиловым эфиром (15 мл). Органические фазы объединяют и промывают водой (50, затем 30 мл), сушат над сульфатом магния,концентрируют при пониженном давлении и получают 4,6 г 4-[4-(3-хлорпропокси)фенил]циклогексанона в виде белого твердого вещества, которое применяют без дальнейшией очистки. Пример 19 1-3-[4-(цис-4-тетраметиленаминоциклогекс-1-ил)фенокси]пропилпиперидин диоксалат и 1-3-[4(транс-4-тетраметиленаминоциклогекс-1-ил)фенокси]пропилпиперидин диоксалат. Следующая методика аналогична описанной в примере 18 А, но в качестве исходных применяются 1-3-[4-(4-оксоциклогексил)фенокси]пропилпиперидин (0,5 г), пирролидин (159 мкл), уксусная кислота(91 мкл) и триацетоксиборгидрид натрия (504 мг) в тетрагидрофуране (6 мл), следующие продукты получают по ходу элюирования, после образования соли с щавелевой кислотой: 292 мг 1-3-[4-(4 тетраметиленаминоциклогекс-1-ил)фенокси]пропилпиперидин диоксалата (изомер А) с точкой плавления 168 С и 168 мг 1-3-[4-(4-тетраметиленаминоциклогекс-1-ил)фенокси]пропилпиперидин диоксалата (изомер В) с точкой плавления 160 С. 1 Н ЯМР оксалатов (DMSO). Изомер А: 7.19 (d, J=8.5 Hz, 2 Н, arom), 6.81 (d, J=8.5 Hz, 2H, arom), 3.96 (t, J=5.9 Hz, 2H, CH2O), 3.17 транс-1-3-[4-(цис-4-диметиламиноциклогекс-1-ил)фенокси]пропил-3,5-диметилпиперидин диоксалат и транс-1-3-[4-(транс-4-диметиламиноциклогекс-1-ил)фенокси]пропил-3,5-диметилпиперидин диоксалат. А. Следующая методика аналогична описанной в примере 18 А, но в качестве исходных применяются транс-3,5-диметил-1-3-[4-(4-оксоциклогексил)фенокси]пропилпиперидин (780 мг), 2 М раствор диметиламина в тетрагидрофуране (1,36 мл), уксусная кислота (136 мкл) и триацетоксиборгидрид натрия(722 мг) в тетрагидрофуране (8 мл), следующие продукты получают по ходу элюирования после образования соли с щавелевой кислотой: 292 мг транс-1-3-[4-(4-диметиламиноциклогекс-1 ил)фенокси]пропил-3,5-диметилпиперидин диоксалата (изомер А) с точкой плавления 98 С и 393 транс- 23019594 1-3-[4-(4-диметиламиноциклогекс-1-ил)фенокси]пропил-3,5-диметилпиперидин диоксалата (изомер В) с точкой плавления 162 С. 1 Н ЯМР оксалатов (DMSO). Изомер А: 7.19 (d, J=8.5 Hz, 2 Н, arom), 6.82 (d, J=8.5 Hz, 2H, arom), 3.95 (t, J=5,9 Hz, 2H, CH2O), 3,09eq.), 1.7-1.2 (m, 6H, CH2, 4 CH2 ax.), 0.92 (2d, J= 6.8 Hz, J= 6.8 Hz, 6H, 2 CH3). В. транс-3,5-Диметил-1-3-[4-(4-оксоциклогексил)фенокси]пропилпиперидин может быть получен следующим образом. Следующая методика аналогична описанной в примере 18 В, но в качестве исходных применяются карбонат калия (1,71 г), 4-[4-(3-хлорпропокси)фенил]циклогексанон (1,5 г), транс-3,5-диметилпиперидин гидрохлорид (1,01 г) и N,N-диметилформамид (20 мл), сырой продукт очищают двумя хроматографиями с градиентом гептан/этилацетат от 4/1 до 0/1 для первой и лигроин/диэтиловый эфир/триэтиламин от 80/20/1 до 50/50/1 для второй и получают 303 мг транс-3,5-диметил-1-3-[4-(4 оксоциклогексил)фенокси]пропилпиперидина. транс-3,5-диметилпиперидин гидрохлорид может быть получен следующим образом. Суспендию 10% палладия-на-угле (1,5 г) в смеси транс-1-бензил-3,5-диметилпиперидина (7,65 г) и метанола (100 мл) перемешивают в атмосфере водорода при 15 бар при 40 С в течение 15 ч. Реакционную смесь фильтруют через слой целита и прибавляют раствор хлороводородной кислоты в эфире. Гидрохлорид отфильтровывают, сушат и получают 3,43 г транс-3,5-диметилпиперидина, который применяют без дальнейшей очистки. 1 Н ЯМР гидрохлорида (DMSO): 2.90 (m, 2 Н, CH2N), 2.63 (m, 2 Н, CH2N), 1.95 (m, 2 Н, 2 СН), 1.37 (dd транс-1-Бензил-3,5-диметилпиперидин может быть получен следующим образом. Суспензию карбоната калия (83 г) и смесь бензилхлорида (37 г), 3,5-диметилпиперидина (30 г коммерчески доступной смеси цис- и транс-изомеров) в N,N-диметилформамиде (200 мл) перемешивают 15 ч при температуре, близкой к 60 С. Смесь фильтруют, концентрируют при пониженном давлении и растворяют в этилацетате. Органическую фазу промывают водой, сушат над сульфатом магния, концентрируют при пониженном давлении и очищают хроматографией на силикагеле с элюентом диэтиловый эфир/лигроин/триэтиламин 20/80/1 и получают 8 г транс-1-бензил-3,5-диметилпиперидина в виде бесцветного масла, которое применяется без дальнейшей очистки. 1 Н ЯМР (DMSO): 7.28 (m, 5H, arom), 3.52 (d, J=13.5 Hz, 1H, CH2Ph), 3.37 (d, J=13.5 Hz, 1H, CH2Ph),2.38 (m, 2H, CH2N), 2.06 (m, 2H, CH2N), 1.90 (m, 2H, 2 CH), 1.29 (dd, J=5.7 Hz, J=5.7 Hz, 2H, CH2), 0.96 Смесь 1-(3-гидроксипропил)пирролидина (400 мг), трифенилфосфина (812 мг) в толуоле (18 мл) перемешивают в течение 5 мин при комнатной температуре, затем прибавляют 1-гидроксибифенил (493 мг). Смесь охлаждают и прибавляют диизопропил азодикарбоксилат (609 мл). Смесь перемешивают 48 ч при комнатной температуре, концентрируют при пониженном давлении и разбавляют этилацетатом. Органический слой промывают водой и экстрагируют водным 1 N раствором хлороводородной кислоты. Водную фазу промывают этилацетатом, подщелачивают с 5 N водным раствором гидроксида натрия и дважды экстрагируют этилацетатом. Эти экстракты объединяют, сушат над сульфатом магния, концентрируют при пониженном давлении, разбавляют диэтиловым эфиром и смешивают с раствором щавелевой кислоты (169 мг) в ацетоне. Осадок отфильтровывают, промывают диэтиловым эфиром и сушат, по- 24019594 лучают 480 мг 1-3-[(бифенил-4-ил)окси]пропилпирролидин оксалата в виде белого твердого вещества с точкой плавления 201 С. 1 Н ЯМР оксалата (DMSO): 7.58 (m, 4H, arom), 7.40 (m, 2H, arom), 7.27 (m, 1H, arom), 7.00 (d, J=8.7 транс-1-3-[(бифенил-4-ил)окси]пропил-3,5-диметилпиперидин оксалат. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются 1-(3-хлорпропокси)бифенил (1,23 г), коммерчески доступная смесь цис- и транс-3,5-диметилпиперидина(1,32 мл), карбонат калия (2,07 г) и каталитическое количество йодида калия в N,N-диметилформамиде(20 мл) и получают после образования соли с 85 мг щавелевой кислоты 349 мг транс-1-3-[(бифенил-4 ил)окси]пропил-3,5-диметилпиперидин оксалата в виде белого порошка с точкой плавления 176 С. 1 Н ЯМР оксалата (DMSO): 7.58 (m, 4 Н, arom), 7.40 (m, 2 Н, arom), 7.29 (m, 1 Н, arom), 7.00 (d, J=8.6(3S,5S)-1-3-[(бифенил-4-ил)окси]пропил-3,5-диметилпиперидин оксалат. А. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются 1-(3-хлорпропокси)бифенил (440 мг), (3S,5S)-3,5-диметилпиперидин (230 мг), карбонат калия (800 мг) и каталитическое количество йодида калия в N,N-диметилформамиде (10 мл) и получают после образования соли с щавелевой кислотой 34 мг (3S,5S)-1-3-[(бифенил-4-ил)окси]пропил-3,5 диметилпиперидин оксалата в виде белого порошка. 1 Н ЯМР оксалата (DMSO): 7.58 (m, 4 Н, arom), 7.40 (m, 2 Н, arom), 7.29 (m, 1H, arom), 7.00 (d, J=8.6(3S,5S)-3,5-Диметилпиперидин может быть получен следующим образом. Суспензию 5% родия на оксиде алюминия (13 г) в растворе (2S,4S)-2,4-диметилпентандинитрила(6,5 г) в 400 мл метанола перемешивают в атмосфере водорода при комнатной температуре 24 ч. Смесь фильтруют через слой целита, фильтрат концентрируют при пониженном давлении и чистят хроматографией на силикагеле с градиентом дихлорметан/метанол от 95/5 до 90/10. Фракции, содержащие ожидаемое вещество, объединяют и концентрируют при пониженном давлении и получают 650 мг (3S,5S)3,5-диметилпиперидина в виде оранжевого масла, которое применяют без дальнейшей очистки.(2S,4S)-2,4-Диметилпентандинитрил может быть получен следующим образом. Суспензию цианида калия (36 г) в растворе (2R,4R)-2,4-пентандиол диметансульфоната (36 г) в ацетонитриле (77 мл) перемешивают в течение ночи при кипячении. Смесь распределяют между дихлорометаном (200 мл) и водой (150 мл). Органический слой экстрагируют шесть раз дихлорметаном. Объедиенные органические экстракты сушат над сульфатом магния, концентрируют при пониженном давлении и очищают хроматографией на силикагеле с градиентом гептан/этилацетат от 4/1 до 2/1 и получают 8,3 г(2S,4S)-2,4-диметилпентандинитрила в виде желтого твердого вещества, которое применяют без дальнейшей очистки.(2R,4R)-2,4-Пентандиол диметансульфонат может быть получен следующим образом. Раствор (2R,4R)-2,4-пентандиола (15,0 г), триэтиламина (45,2 мл) и дихлорметана (350 мл) охлаждают до температуры, близкой к 0 С. По каплям прибавляют метан сульфонилхлорид (24,5 мл). Смесь перемешивают 3 ч при температуре, близкой к 0 С, гидролизуют с 100 мл 1,5 N водного раствора хлороводорода и экстрагируют дихлорметаном. Органические экстракты объединяют, промывают насыщенным водньм раствором гидрокабоната натрия, затем насыщенным раствором хлорида натрия, сушат над сульфатом магния, концентрируют при пониженном давлении и получают 36,06 г (2R,4R)-2,4 пентандиол диметансульфоната в виде коричневого масла, которое применяют без дальнейшей очистки. Пример 24 Суспензию карбоната калия (290 мг), тетракистрифенилфосфина палладия (49 мг), 1-[3-(4 бромфенокси)пропил]пиперидина (250 мг) и 4-метилбензолбороновой кислоты (228 мг) в толуоле (5 мл) нагревают в течение ночи при температуре, близкой к 100 С. Смесь разбавляют этилацетатом (200 мл),промывают насыщенным водным раствором дикарбоната натрия (3 мл), сушат над сульфатом магния,концентрируют при пониженном давлении и чистят хроматографией на силикагеле с дихлорметаном,затем со смесью дихлорметан/метанол/аммоний 99/1/0.5. Фракции, содержащие ожидаемый продукт,объединяют, концентрируют при пониженном давлении, переводят в соль с щавелевой кислотой и получают 70 мг 1-3-[(4'-метилбифенил-4-ил)окси]пропилпиперидин оксалата в виде белого твердого вещества с точкой плавления 195 С. 1 Н ЯМР оксалата (DMSO): 7.55 (d, J=8.7 Hz, 2 Н, arom), 7.47 (d, J=8.0 Hz, 2H, arom), 7.21 (d, J=8.0 Hz,2H, arom), 6.98 (d, J=8.7 Hz, 2H, arom), 4.02 (t, J=6.0 Hz, 2H, CH2O), 3.1 (m, 6H, 3 CH2N), 2.29 (s, 3H,ArMe), 2.08 (m, 2H, CH2), 1.71 (m, 4H, 2 CH2), 1.50 (m, 2H, CH2). 1-[3-(4-Бромфенокси)пропил]пиперидин может быть получен, как описано в ЕР 9905744. Пример 25 1-3-[(4'-метоксибифенил-4-ил)окси]пропилпиперидин оксалат. Следующая методика аналогична описанной в примере 24, но в качестве исходных применяются 1[3-(4-бромфенокси)пропил]пиперидин (250 мг), карбонат калия (696 мг), 4-метоксибензолбороновая кислота (638 мг) и тетракистрифенилфосфин палладия (194 мг) в толуоле (7 мл) и получают после образования соли с щавелевой кислотой 174 мг 1-3-[(4'-метоксибифенил-4-ил)окси]пропилпиперидин оксалата в виде белого твердого вещества с точкой плавления 188 С. 1 Н ЯМР оксалата (DMSO): 7.52 (d, J=8.4Hz, 4 Н, arom), 6.96 (d, J=8.4 Hz, 4H, arom), 4.04 (t, J=6.3 Hz,2H, CH2O), 3.75 (s, 3H, CH3O), 3.15-3.05 (m, 6H, 3 CH2N), 2.10 (m, 2H, CH2), 1.70 (m, 4H, 2 CH2), 1.50 (m,2H, CH2). Пример 26(RS)-1-3-[(бифенил-4-ил)окси]пропил-3-метилпиперидин оксалат. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются 1-(3-хлорпропокси)бифенил (493 мг), (RS)-3-метилпиперидин (470 мкл), карбонат калия (830 мг) и каталитическое количество йодида калия в N,N-диметилформамиде (10 мл) и получают после образования соли с щавелевой кислотой 478 мг (RS)-1-3-[(бифенил-4-ил)окси]пропил-3-метилпиперидин оксалата в виде белого твердого вещества с точкой плавления 173 С. транс-3,5-диметил-1-3-[(4'-метилбифенил-4-ил)окси]пропилпиперидин оксалат. А. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются 4-(3-хлорпропокси)-4'-метилбифенил (274 мг), 3,5-диметилпиперидин (280 мкл коммерчески доступной смеси цис- и транс-изомеров), карбонат калия (4,34 мг) и каталитическое количество йодида калия в N,N-диметилформамиде (6,5 мл) и получают после двух хроматографий на силикагеле с элюентом диэтиловый эфир/лигроин/триэтиламин 20/80/1 для первой хроматографии и лигроин/триэтиламин от 100/1 до 90/10/1 для второй, и после образования соли с 14,3 мг щавелевой кислоты, 47 мг транс-3,5 диметил-1-3-[(4'-метилбифенил-4-ил)окси]пропилпиперидин оксалата в виде белого твердого вещества. 1 Н ЯМР оксалата (DMSO): 7.55 (d, J=8.7 Hz, 2 Н, arom), 7.47 (d, J=8.1 Hz, 2H, arom), 7.20 (d, J=8.1 Hz,2H, arom), 6.97 (d, J=8.7 Hz, 2H, arom), 4.05 (t, J=6,0 Hz, 2H, CH2O), 3.10-2.6 (m, 6H, 3 CH2N), 2.30 (s, 3H,ArCH3), 2.07 (m, 4H, CH2, 2 CH), 1.36 (m, 2H, CH2), 0.96 (2d, J=6.5 Hz, J=6.5 Hz, 6H, 2 CH3). В. 4-(3-Хлорпропокси)-4'-метилбифенил может быть получен следующим образом. Следующая методика аналогична описанной в примере 1 Е, но в качестве исходных применяются 4-гидрокси-4'-метилбифенил (194 мг), карбонат калия (720 мг) и 1-бром-3-хлорпропан (517 мкл) в N,Nдиметилформамиде (1,5 мл) и получают 274 г 4-(3-хлорпропокси)-4'-метилбифенила. 1-3-[(2'-метилбифенил-4-ил)окси]пропилпиперидин оксалат. А. Следующая методика аналогична описанной в примере 1 D, но в качестве исходных применяются 4-(3-хлорпропокси)-2'-метилбифенил (157 мг), пиперидин (100 мкл), карбонат калия (207 мг) и каталитическое количество йодида калия в N,N-диметилформамиде (10 мл) и получают после образования соли с щавелевой кислотой 77 мг 1-3-[(2'-метилбифенил-4-ил)окси]пропилпиперидин оксалата в виде белого твердого вещества с точкой плавления 173 С. 1 Н ЯМР оксалата (DMSO): 7.20 (m, 6 Н, arom), 6.97 (d, J=8.6 Hz, 2 Н, arom), 4.05 (t, J=6.0 Hz, 2H,CH2O), 3.11 (m, 6H, 3 CH2N), 2.19 (s, 3H, ArMe), 2.10 (m, 2H, CH2), 1.70 (m, 4H, 2 CH2), 1.50 (m, 2H, CH2). В. 4-(3-Хлорпропокси)-2'-метилбифенил может быть получен следующим образом. Следующая методика аналогична описанной в примере 1 Е, но в качестве исходных применяются 4-гидрокси-2'-метилбифенил (0,55 г), карбонат калия (2,07 г) и 1-бром-3-хлорпропан (1.48 мл) в N,Nдиметилформамиде (20 мл) и получают 913 мг 4-(3-хлорпропокси)-2'-метилбифенила, который применяют без дальнейшей очистки. 1-3-[4-(3-тиенил)фенокси]пропилпиперидин оксалат. Следующая методика аналогична описанной в примере 24, но в качестве исходных применяются 1[3-(4-бромфенокси)пропил]пиперидин (250 мг), карбонат калия (695 мг), тиофен-3-бороновая кислота(536 мг) и тетракистрифенилфосфин палладия (194 мг) в толуоле (5 мл) и получают после образования соли щавелевой кислоты 161 мг 1-3-[4-(3-тиенил)фенокси]пропилпиперидин оксалата в виде белого твердого вещества с точкой плавления 217 С. 1 Н ЯМР оксалата (DMSO): 7.70 (s, 1H, thiophene), 6.58 (m, 3H, 2 arom, 1 thiophene), 7.47 (d, J=5.0 Hz,- 27019594 1H, thiophene), 6.94 (d, J=8.6 Hz, 2H, arom), 4.04 (t, J=5.8 Hz, 2H, CH2O), 3.10 (m, 6H, 3 CH2N), 2.08 (m, 2H,CH2), 170 (m, 4H, 2 CH2), 1.50 (m, 2H, CH2). Пример 30 1-3-[4-(4-пиридил)фенокси]пропилпиперидин оксалат. Следующая методика аналогична описанной в примере 24, но в качестве исходных применяются 1[3-(4-бромфенокси)пропил]пипридин (364 мг), карбонат калия (388 мг) в воде (4 мл), пиридин-4 бороновая кислота (300 мг) и тетракистрифенилфосфин палладия (141 мг) в толуоле (8 мл) и получают после образования соли с щавелевой кислотой 116 мг 1-3-[4-(4-пиридил)фенокси]пропилпиперидин оксалата. 1 Н ЯМР оксалата (DMSO): 8.56 (dd, J=4.7 Hz, J=1.4Hz, 2H, pyridine), 7.76 (d, J=8.7 Hz, 2H, arom),7.65 (dd, J=4.7 Hz, J=1.4Hz, 2H, pyridine), 7.06 (d, J=8.7 Hz, 2H, arom), 4.09 (t, J=6 Hz, 2H, CH2O), 3.5-2.8 транс-3,5-диметил-1-3-[4-(4-пиридил)фенокси]пропилпиперидин оксалат. А. Следующая методика аналогична описанной в примере 24, но в качестве исходных применяются транс-3,5-диметил-1-[3-(4-бромфенокси)пропил]пиперидин (326 мг), карбонат калия (414 мг) в воде (4 мл), пиридин-4-бороновая кислота (246 мг) и тетракистрифенилфосфин палладия (116 мг) в толуоле (8 мл) и получают после образования соли с щавелевой кислотой 80 мг транс-3,5-диметил-1-3-[4-(4 пиридил)фенокси]пропилпиперидин оксалата в виде белого твердого вещества. 1 Н ЯМР оксалат (DMSO): 8.56 (d, J=6.1 Hz, 2 Н, pyridine), 7.74 (d, J=8.7 Hz, 2H, arom), 7.61 (d, J=6.1Hz, 2H, pyridine), 7.05 (d, J=8.7 Hz, 2H, arom), 4.10 (t, J=6.1 Hz, 2H, CH2O), 2.93 (m, 4H, 2 CH2N), 2.62 (m,2H, CH2N), 2.05 (m, 4H, CH2, 2 CH), 1.35 (dd, J=5.8 Hz, J=5.8 Hz, 2H, CH2), 0.96 (2d, J=6.9 Hz, J=6.9 Hz,6H, 2 CH3). В. транс-3,5-Диметил-1-[3-(4-бромфенокси)пропил]пиперидин может быть получен следующим образом. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются 1-бром-4-(3-хлорпропокси)бензол (383 мг), транс-3,5-диметилпиперидин (663 мг), карбонат калия (1,06 г) и каталитическое количество калия йодида в ацетонитриле (10 мл) и получают после хроматографии на силикагеле с градиентом дихлорметан/метанол от 0 до 2% 585 мг транс-3,5-диметил-1-[3-(4 бромфенокси)пропил]пиперидина в виде желтого масла, которое применяют без дальнейшей очистки. 1-Бром-4-(3-хлорпропокси)бензол может быть получен, как описано в S. Yakabe et al., Organic Preparations and Procedures International (1998), 30(2), 218-222. Пример 32 1-3-[4-(3-Пиридил)фенокси]пропилпиперидин оксалат. Следующая методика аналогична описанной в примере 24, но в качестве исходных применяются 1[3-(4-бромфенокси)пропил]пиперидин (364 мг), карбонат калия (388 мг) и вода (4 мл), пиридин-3 бороновая кислота (300 мг) и тетракистрифенилфосфин палладия (141 мг) в толуоле (8 мл) и получают после образования соли с щавелевой ктслотой 75 мг 1-3-[4-(3-пиридил)фенокси]пропилпиперидин оксалата. 1 Н ЯМР оксалата (DMSO): 8.83 (d, J=1.8 Hz, 1H, pyridine), 8.49 (dd, J=4.7 Hz, J=1.4 Hz, 1H, pyridine),7.99 (dt, J=7.9 Hz, J= 1.8 Hz, 1H, pyridine), 7.66 (d, J=8.7 Hz, 2H, arom), 7.42 (dd, J=4.7 Hz, J= 7.9 Hz, 1H,pyridine), 7.05 (d, J=8.7 Hz, 2H, arom), 4.07 (t, J=5.9 Hz, 2H, CH2O), 3.11 (m, 6H, 3 CH2N), 2.10 (m, 2H,CH2), 1.70 (m, 4H, 2 CH2), 1.50 (m, 2H, CH2). транс-3,5-диметил-1-3-[4-(пиррол-1-ил)фенокси]пропилпиперидин оксалат. А. Следующая методика аналогична описанной в примере 1D, но в качестве исходных применяются 1-[4-(3-хлорпропокси)фенил]пиррол (236 мг), транс-3,5-диметилпиперидин (190 мг), каталитическое количество йодида калия и карбонат калия (600 мг) в N,N-диметилформамиде (10 мл) и получают после образования соли с щавелевой кислотой 257 мг транс-3,5-диметил-1-3-[4-(пиррол-1 ил)фенокси]пропилпиперидин оксалата в виде белого твердого вещества. 1 Н ЯМР оксалата (DMSO): 7.43 (d, J=8.8 Hz, 2H, arom), 7.19 (d, J=2 Hz, 2H, pyrrole), 7.99 (d, J=8.8Hz, 2H, arom), 6.19 (m, 2H, pyrrole), 4.04 (t, J=6.0 Hz, 2H, CH2O), 3.00 (m, 4H, 2 CH2N), 2.71 (m, 2H, CH2N),2.06 (m, 4H, CH2, 2 CH), 1.36 (dd, J=5.6 Hz, J=5.6 Hz, 2H, CH2), 0.97 (2d, J=7.0 Hz, J=7.0 Hz, 6H, 2 CH3). В. 1-[4-(3-Хлорпропокси)фенил]пиррол может быть получен следующим образом. Следующая методика аналогична описанной в примере 1 Е, но в качестве исходных применяются 1-(4-гидроксифенил)пиррол (0,8 г), карбонат калия (3,2 г) и 1-бром-3-хлорпропан (2.5 мл) в N,Nдиметилформамиде (10 мл) и получают 1,37 г 1-[4-(3-хлорпропокси)фенил]пиррола в виде коричневого твердого вещества, которое применяют без дальнейшей очистки. Пример 34 Раствор транс-3,5-диметил-1-3-[4-(3-оксопропаноил)фенокси]пропилпиперидина (200 мг) в смеси гидразин гидрата (50 мкл) и метанола (4 мл) перемешивают в течение 1 ч при комнатной температуре. Смесь разбавляют водой и дважды экстрагируют этилацетатаом, сушат над сульфатом магния, концентрируют при пониженном давлении и чистят хроматографией на силикагеле. Фракции, содержащие ожидаемый продукт, объединяют, концентрируют при пониженном давлении, переводят в соль щавелевой кислоты и получают 142 мг транс-3,5-диметил-1-3-[4-(пиразол-3-ил)фенокси]пропилпиперидина в виде бледно-желтого твердого вещества. 1 Н ЯМР оксалата (DMSO): 7.67 (m, 3H, 2 arom, 1 pyrrazole), 6.95 (m, 2 Н, arom), 6.54 (m, 1H,pyrrazole), 4.06 (m, 2 Н, CH2O), 3.07 (m, 4 Н, 2 CH2N), 2.78 (m, 2 Н, CH2N), 2.09 (m, 4 Н, СН 2, 2 СН), 1.39 (m,2 Н, СН 2), 0.98 (m, 6 Н, 2 СН 3). транс-3,5-Диметил-1-3-[4-(3-оксопропаноил)фенокси]пропилпиперидин может быть получен следующим образом. К суспензии гидрида натрия (82 мг, 60% в парафине) прибавляют метилформиат (150 мкл) и раствор транс-3,5-диметил-1-[3-(4-ацетилфенокси)пропил]пиперидина (610 мг) в тетрагидрофуране (0,4 мл). Смесь перемешивают в течение 2 ч при комнатной температуре, затем гидролизуют 1 N водным раствором хлороводородной кислоты, поддерживая щелочной рН. Раствор дважды экстрагируют этилацетатом. Экстракты объединяют, сушат над сульфатом магния и чистят хроматографией на силикагеле с градиентом дихлорметан/метанол от 100/0 до 95/5. Фракции, содержащие ожидаемый продукт, объединяют,концентрируют при пониженном давлении и получают 100 мг транс-3,5-диметил-1-3-[4-(3 оксопропаноил)фенокси]пропилпиперидина в виде бледно-желтого масла, которое применяют на следующей стадии сразу после получения без дальнейшей очистки.
МПК / Метки
МПК: A61K 31/381, A61K 31/44, C07D 295/088, A61P 25/00, A61K 31/5377, C07D 333/16, A61K 31/40, C07D 211/14, C07D 211/68, C07D 401/10, C07D 213/30
Метки: применения, h3-рецептора, новые, терапевтические, гистамин, лиганды
Код ссылки
<a href="https://eas.patents.su/30-19594-novye-ligandy-gistamin-h3-receptora-i-ih-terapevticheskie-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Новые лиганды гистамин h3-рецептора и их терапевтические применения</a>
Предыдущий патент: Способ и система для синтеза жидких углеводородных соединений
Следующий патент: Специфичные ингибиторы pdgfrβ
Случайный патент: Производные бензамида и фармацевтическая композиция на их основе












