Коагонисты глюкагонового рецептора/glp-1-рецептора
Номер патента: 19203
Опубликовано: 30.01.2014
Авторы: Димарчи Ричард Д., Смайли Девид Л., Шабенн Джозеф, Дэй Джонатан, Паттерсон Джеймс, Уорд Брайан К., Димарчи Мария
Формула / Реферат
1. Глюкагоновый пептид, содержащий аминокислотную последовательность SEQ ID NO: 1, имеющую до десяти модификаций аминокислотных остатков, и содержащий аминокислоту в положении 10, которая ацилирована либо алкилирована С4-С30 жирной кислотой, и α,α-дизамещенную аминокислоту в положении 16, причем этот глюкагоновый пептид демонстрирует повышенную активность на GLP-1-рецепторе по сравнению с нативным глюкагоновым пептидом, или его фармацевтически приемлемая соль.
2. Глюкагоновый пептид по п.1, где α,α-дизамещенная аминокислота представляет собой аминокислоту, замещенную двумя одинаковыми или различными группами, выбранными из числа метиловой, этиловой, пропиловой, н-бутиловой групп, циклооктана и циклогептана.
3. Глюкагоновый пептид по п.2, где α,α-дизамещенная аминокислота представляет собой аминоизомасляную кислоту (AIB).
4. Глюкагоновый пептид по любому из пп.1-3, где аминокислотой в положении 10 глюкагонового пептида является ацилированная или алкилированная аминокислота формул I, II или III, причем формула I имеет следующий вид:
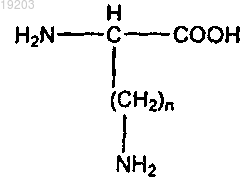
где n=от 1 до 4;
формула II имеет следующий вид:
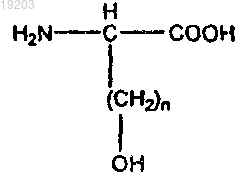
где n=от 1 до 4; и
формула III имеет следующий вид:
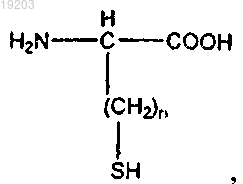
где n=от 1 до 4.
5. Глюкагоновый пептид по п.4, где аминокислотой в положении 10 является Lys.
6. Глюкагоновый пептид по любому из пп.1-5, дополнительно содержащий спейсер между аминокислотой в положении 10 глюкагонового пептида и ацильной группой либо алкильной группой.
7. Глюкагоновый пептид по п.6, где длина спейсера составляет от 3 до 10 атомов.
8. Глюкагоновый пептид по п.7, где спейсером является аминокислота, или дипептид, или трипептид.
9. Глюкагоновый пептид по п.7 или 8, где спейсер содержит одну или две отрицательно заряженные аминокислоты.
10. Глюкагоновый пептид по любому из пп.1-9, где ацильной группой является ацильная группа С8-С20 жирной кислоты.
11. Глюкагоновый пептид по п.10, где ацильной группой является ацильная группа С12-С18 жирной кислоты.
12. Глюкагоновый пептид по п.11, где ацильной группой является ацильная группа С14-С16 жирной кислоты.
13. Глюкагоновый пептид по любому из пп.1-12, имеющий аминокислотную замену в положении 1, положении 2 либо положениях 1 и 2, где аминокислотной(ые) замене(ы) придают резистентность к протеазе DPP-IV.
14. Глюкагоновый пептид по п.13, где His в положении 1 заменен аминокислотой, выбранной из группы, которую составляют D-гистидин, α,α-диметилимидазолуксусная кислота (DMIA), N-метилгистидин, α-метилгистидин, имидазолуксусная кислота, дезаминогистидин, гидроксилгистидин, ацетилгистидин и гомогистидин.
15. Глюкагоновый пептид по п.13 или 14, где Ser в положении 2 заменен аминокислотой, выбранной из группы, которую составляют D-серин, аланин, D-аланин, валин, глицин, N-метилсерин, N-метилаланин и аминоизомасляная кислота.
16. Глюкагоновый пептид по п.15, где аминокислотой в положении 2 является AIB.
17. Глюкагоновый пептид по любому из пп.1-16, содержащий одну, две или три заряженные аминокислоты в положении, расположенном ближе к С-концу относительно аминокислоты в положении 27.
18. Глюкагоновый пептид по п.17, содержащий заряженную аминокислоту в положении 28 или 29.
19. Глюкагоновый пептид по п.17 или 18, содержащий заряженную аминокислоту после положения 29.
20. Глюкагоновый пептид по любому из пп.17-19, где заряженная аминокислота является отрицательно заряженной аминокислотой.
21. Глюкагоновый пептид по п.20, где заряженная аминокислота является атипичной либо искусственной аминокислотой.
22. Глюкагоновый пептид по любому из пп.17-19, где заряженная аминокислота является положительно заряженной аминокислотой.
23. Глюкагоновый пептид по п.22, где положительно заряженная аминокислота является аргинином, лизином или гистидином.
24. Глюкагоновый пептид по п.17 или 18, где аминокислотой в положении 28 является Asp, Asn либо Lys, а аминокислотой в положении 29 является Gly либо Thr.
25. Глюкагоновый пептид по любому из пп.1-24, где α,α-дизамещенная аминокислота в положении 16 является AIB и С4-С30 жирная кислота является ацильной группой С14, С16 или С18 жирной кислоты, ковалентно присоединенной к Lys в положении 10.
26. Глюкагоновый пептид по любому из пп.1-25, дополнительно имеющий одну или несколько модификаций, выбранных из группы, которую составляют Gln в положении 17, Ala в положении 18, Glu в положении 21, Ile в положении 23 и Ala в положении 24.
27. Глюкагоновый пептид по любому из пп.1-26, содержащий С-концевой амид.
28. Глюкагоновый пептид по любому из пп.1-27, где глюкагоновый пептид содержит гидрофильную составляющую, как один из возможных вариантов - PEG.
29. Глюкагоновый пептид по п.1, имеющий до 2, до 3, до 4, до 5, до 6, до 7, до 8 или до 9 аминокислотных модификаций.
30. Глюкагоновый пептид по любому из пп.1-29, который характеризуется отношением активности глюкагона к активности GLP-1 приблизительно 1:1, 1,5:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1 либо приблизительно 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2 или 1:1,5.
31. Глюкагоновый пептид по любому из пп.1-30, который демонстрирует (i) по меньшей мере 10% активности нативного глюкагона на глюкагоновом рецепторе и по меньшей мере 50% активности нативного GLP-1 на GLP-1-рецепторе, (ii) по меньшей мере 40% активности нативного глюкагона на глюкагоновом рецепторе и по меньшей мере 40% активности нативного GLP-1 на GLP-1-рецепторе, (iii) по меньшей мере 60% активности нативного глюкагона на глюкагоновом рецепторе и по меньшей мере 60% активности нативного GLP-1 на GLP-1-рецепторе, (iv) приблизительно 0,1-10% активности нативного глюкагона на глюкагоновом рецепторе и по меньшей мере 20% активности нативного GLP-1 на GLP-1-рецепторе или (v) приблизительно 1-10% активности нативного глюкагона на глюкагоновом рецепторе и по меньшей мере 20% активности нативного GLP-1 на GLP-1-рецепторе.
32. Конъюгат, содержащий глюкагоновый пептид по любому из пп.1-31 или его фармацевтически приемлемую соль, причем этот конъюгат содержит упомянутый глюкагоновый пептид, присоединенный к конъюгатной составляющей.
33. Димер, содержащий глюкагоновый пептид по любому из пп.1-31 или его фармацевтически приемлемую соль, причем упомянутый димер содержит два глюкагоновых пептида, связанных между собой через линкер.
34. Гибридный белок, содержащий глюкагоновый пептид по любому из пп.1-31 или его фармацевтически приемлемую соль, причем упомянутый гибридный белок содержит второй пептид, присоединный к концу глюкагонового пептида.
35. Фармацевтическая композиция, содержащая глюкагоновый пептид по любому из пп.1-31 или его фармацевтически приемлемую соль, конъюгат по п.32, димер по п.33 или гибридный белок по п.34 и фармацевтически приемлемый носитель.
36. Фармацевтическая композиция по п.35, дополнительно содержащая другое противодиабетическое средство или средство от ожирения.
37. Фармацевтическая композиция по п.36, дополнительно содержащая инсулин, сульфонилмочевину, толбутамид, ацетогексамид, толазамид, хлорпропамид, глипизид, глибурид, глимепирид, гликлазид, меглитинид, репаглинид, натеглинид, бигуанид, метформин, фенформин, тиазолидиндион, розиглитазон, пиоглитазон, троглитазон, ингибитор PPARγ, ингибитор α-глюкозидазы, миглитол, акарбозу, экзенатид, прамлинтид, ингибитор дипептидилпептидазы-4, вилдаглиптин, ситаглиптин, ингибитор натрийзависимого транспортера глюкозы 1, активатор глюкокиназы, антагонист глюкагонового рецептора, ингибитор фруктоза-1,6-бисфосфатазы, средство снижения аппетита, стимулятор типа фенэтиламина, фентермин, диэтилпропион, фендиметразин, бензфетамин, сибутрамин, римонабант, антагонист каннабиноидного рецептора, оксинтомодулин, флуоксетин, топирамат и фентермин, бупропион и зонисамид, бупропион и налтрексон, ингибитор липазы, орлистат, цетилистат или GT 389-255.
38. Способ лечения диабета, включающий введение эффективного количества фармацевтической композиции по любому из пп.35-37.
39. Способ инициирования уменьшения массы тела либо снижения прироста массы тела, включающий введение эффективного количества фармацевтической композиции по любому из пп.35-37.
40. Способ по п.38 или 39, включающий введение фармацевтической композиции в сочетании с другим противодиабетическим средством или средством от ожирения.
41. Способ по п.40, включающий введение фармацевтической композиции в сочетании с одним или более из таких средств, как инсулин, сульфонилмочевина, толбутамид, ацетогексамид, толазамид, хлорпропамид, глипизид, глибурид, глимепирид, гликлазид, меглитинид, репаглинид, натеглинид, бигуанид, метформин, фенформин, тиазолидиндион, розиглитазон, пиоглитазон, троглитазон, ингибитор PPARγ, ингибитор α-глюкозидазы, миглитол, акарбоза, экзенатид, прамлинтид, ингибитор дипептидилпептидазы-4, вилдаглиптин, ситаглиптин, ингибитор натрийзависимого транспортера глюкозы 1, активатор глюкокиназы, антагонист глюкагонового рецептора, ингибитор фруктоза-1,6-бисфосфатазы, средство снижения аппетита, стимулятор типа фенэтиламина, фентермин, диэтилпропион, фендиметразин, бензфетамин, сибутрамин, римонабант, антагонист каннабиноидного рецептора, оксинтомодулин, флуоксетин, топирамат и фентермин, бупропион и зонисамид, бупропион и налтрексон, ингибитор липазы, орлистат, цетилистат или GT 389-255.
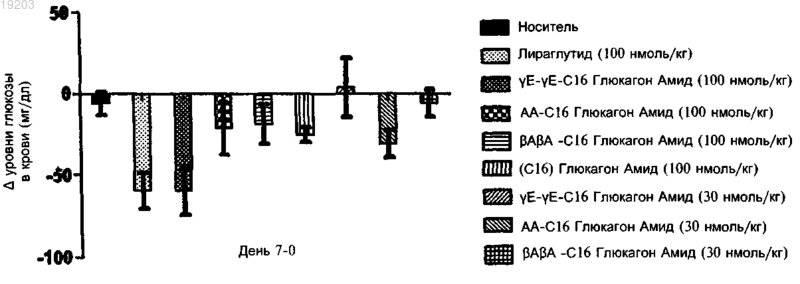
Текст
ИСПРАВЛЕННОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ В изобретении раскрыты модифицированные глюкагоновые пептиды, имеющие повышенную эффективность на глюкагоновом рецепторе по сравнению с нативным глюкагоном. Благодаря модификации глюкагоновых пептидов посредством образования внутримолекулярных мостиков или посредством замены концевой карбоновой кислоты амидной группой получают пептиды,демонстрирующие активность коагонистов на глюкагоновом рецепторе/GLP-1-рецепторе. Растворимость и стабильность этих высокоэффективных аналогов глюкагона может также быть повышена модификацией полипептидов посредством пэгилирования, ацилирования,алкилирования, замены карбоксиконцевых аминокислот, С-концевого усечения либо добавления карбоксиконцевого пептида, выбранного из группы, которую составляют последовательность SEQ Примечание: библиография отражает состояние при переиздании(71)(73) Заявитель и патентовладелец: ИНДИАНА ЮНИВЕРСИТИ РИСЕРЧ ЭНД ТЕКНОЛОДЖИ КОРПОРЕЙШН (US) Перекрестная ссылка на родственные заявки Настоящее изобретение претендует на приоритет по отношению к предварительной заявке на патент США 61/073269, поданной 17 июня 2008 года, предварительной заявке на патент США 61/078168, поданной 3 июля 2008 года, предварительной заявке на патент США 61/090412, поданной 20 августа 2008 года, и предварительной заявке на патент США 61/177476, поданной 12 мая 2009 года. Содержание каждой заявки включено в настоящее описание в полном объеме посредством ссылки. Предпосылки создания изобретения Препроглюкагон представляет собой полипептид-предшественник, состоящий из 158 аминокислот,подвергаемый процессингу в различных тканях с образованием ряда различных проглюкагоновых пептидов, в том числе глюкагона, глюкагоноподобного пептида-1 (GLP-1), глюкагоноподобного пептида-2(GLP-2) и оксинтомодулина (ОХМ), которые принимают участие в разнообразных физиологических процессах, в том числе в глюкозном гомеостазе, секреции инсулина, опорожнении желудка, развитии кишечника, а также в регулировании потребления пищи. Глюкагон представляет собой пептид, состоящий из 29 аминокислот, соответствующих аминокислотам 33-61 препроглюкагона, в то время как GLP-1 продуцируется в виде пептида длиной в 37 аминокислот, соответствующих аминокислотам 72-108 препроглюкагона. Амид GLP-1(7-36) либо кислота GLP-1(7-37) являются биологически сильнодействующими формами GLP-1, проявляющими, по сути, эквивалентную активность на GLP-1-рецепторе. Гипогликемия возникает в том случае, когда уровни глюкозы в крови падают намного ниже уровня,необходимого, чтобы обеспечивать достаточное количество энергии для жизнедеятельности организма. У взрослых или детей старше 10 лет гипогликемия является довольно редким явлением, за исключением тех случаев, когда она является побочным эффектом при лечении диабета, однако она может быть следствием применения других лекарственных средств либо заболеваний, гормональной или ферментной недостаточности либо опухолей. В том случае, когда уровень глюкозы в крови начинает падать, глюкагон, являющийся гормоном, продуцируемым поджелудочной железой, сигнализирует печени о необходимости расщепления гликогена и выделения глюкозы, что вызывает повышение содержания глюкозы в крови до нормального уровня. Таким образом, наиболее признанной ролью глюкагона в системе глюкозной регуляции является нейтрализация воздействия инсулина и поддержание уровня глюкозы в крови на постоянном уровне. Однако у больных диабетом подобная глюкагоновая реакция на гипогликемию может быть нарушена, что затрудняет возврат уровня глюкозы в нормальный диапазон значений. Гипогликемия является состоянием, представляющим угрозу для жизни, которое требует немедленной медицинской помощи. Введение глюкагона является общепринятым способом лекарственной терапии при лечении острой гипогликемии, посредством которого можно восстановить нормальный уровень глюкозы в течение нескольких минут после введения. В случае применения глюкагона при экстренном лечении гипогликемии кристаллическую форму глюкагона растворяют в разбавленном кислом буфере и раствор вводят внутримышечно. Несмотря на эффективность упомянутого лечения, методика его проведения тягостна и опасна для лица, находящегося в полубессознательном состоянии. Следовательно,существует потребность в аналоге глюкагона, который сохраняет либо превосходит биологические характеристики исходной молекулы, однако является в достаточной степени растворимым и стабильным в соответствующих физиологических условиях, чтобы его можно было заранее изготовлять в виде раствора, готового для инъекций. Кроме того, больным диабетом рекомендуется поддерживать уровень глюкозы в крови, близкий к норме, для отсрочки либо профилактики возникновения микрососудистых осложнений. Достижение этой цели требует, как правило, проведения интенсивной инсулинотерапии. В стремлении к достижению этой цели врачи столкнулись со значительным повышением частоты и тяжести гипогликемии у больных диабетом. Следовательно, имеется потребность в улучшенных фармацевтических препаратах и усовершенствованных методиках лечения диабета, которые обладают меньшей вероятностью индуцирования гипогликемии по сравнению с современными методами инсулинотерапии.GLP-1 имеет иную биологическую активность по сравнению с глюкагоном. К числу его воздействий относится стимулирование синтеза и секреции инсулина, угнетение секреции глюкагона и удерживание от потребления пищи. Было показано, что GLP-1 снижает тяжесть гипергликемии (повышенный уровень глюкозы) у больных диабетом. Экзендин-4, пептид из яда ящериц, аминокислотный состав которого почти на 50% совпадает с аминокислотным составом GLP-1, активизирует GLP-1-рецептор и так же,как было показано, снижает тяжесть гипергликемии у больных диабетом. Имеются также данные о том, что GLP-1 и экзендин-4 могут снижать потребление пищи и стимулировать снижение массы тела, т.е. оказывать эффект, являющийся благотворным не только для больных диабетом, но и для больных, страдающих ожирением. У больных, страдающих ожирением, имеется большой риск развития диабета, гипертензии, гиперлипидемии, сердечно-сосудистых заболеваний и заболеваний опорно-двигательного аппарата. Таким образом, сохраняется потребность в альтернативных и предпочтительно усовершенствованных методах лечения диабета и ожирения Сущность изобретения В соответствии с настоящим описанием предложены высокоэффективные аналоги агонистов глюкагона, которые проявляют также повышенную активность на глюкагоновом рецепторе, и в соответствии с описанными ниже вариантами осуществления настоящего изобретения проявляют повышенную биофизическую стабильность и/или растворимость в воде. Кроме того, в соответствии с другим аспектом настоящего изобретения предложены аналоги агонистов глюкагона, утратившие селективность нативного глюкагона в отношении глюкагоновых рецепторов по сравнению с GLP-1-рецепторами и, таким образом, представляющие собой коагонисты двух упомянутых рецепторов. Посредством определенных модификаций аминокислот аналогов глюкагона можно контролировать относительную активность упомянутого аналога на GLP-1-рецепторе по сравнению с относительной активностью на глюкагоновом рецепторе. Таким образом, в соответствии с еще одним аспектом настоящего изобретения предложены аналоги соагониста глюкагона, обладающие повышенной активностью на глюкагоновом рецепторе по сравнению с активностью на GLP-1-рецепторе, аналоги соагониста глюкагона, обладающие приблизительно эквивалентной активностью на обоих рецепторах, и аналоги соагониста глюкагона, обладающие повышенной активностью на GLP-1-рецепторе по сравнению с активностью на глюкагоновом рецепторе. Соагонист последней упомянутой категории может быть сконструирован методами генной инженерии для проявления незначительной активности либо полного ее отсутствия на глюкагоновом рецепторе с одновременным сохранением способности активизирования GLP-1-рецептора с такой же самой либо лучшей активностью, нежели нативный GLP-1. Любой из этих аналогов может также включать модификации,наделяющие их повышенной биофизической стабильностью и/или растворимостью в воде. Аналоги глюкагона, проявляющие соагонизм на глюкагоновых и GLP-1-рецепторах, полезны для нескольких вариантов применения. Прежде всего, применение глюкагона для лечения гипогликемии может привести к гиперкомпенсации низкого уровня глюкозы в крови, следствием чего может появиться избыточный уровень глюкозы в крови. При введении соагониста глюкагоновых/GLP-1-рецепторов дополнительная стимуляция GLP-1-рецепторов может смягчать воздействие глюкагонового агониста и предотвращать избыточный уровень глюкозы в крови, который является следствием лечения гипогликемии. Кроме того, в соответствии с приведенным описанием аналоги соагониста глюкагона, соответствующие настоящему изобретению, могут применяться для регулирования содержания глюкозы в крови при гипергликемии, инициирования уменьшения массы тела либо снижения прироста массы тела при введении отдельно либо в комбинации с другим противодиабетическим средством либо средством от ожирения. Другим соединением, стимулирующим снижение массы тела, является оксинтомодулин, природный пищеварительный гормон, обнаруживаемый в тонкой кишке (смотри Diabetes, 2005; 54:23902395). Оксинтомодулин представляет собой пептид, состоящий из 37 аминокислот, включающий последовательность глюкагона из 29 аминокислот (т.е. последовательность SEQ ID NO: 1), за которой следует карбоксиконцевой удлиняющий сегмент (последовательность SEQ ID NO: 27), состоящий из 8 аминокислот (KRNRNNIA). Настоящим изобретением предусматривается, что аналоги глюкагона, описанные в настоящем изобретении, могут факультативно соединяться с упомянутым карбоксиконцевым удлиняющим сегментом (последовательность SEQ ID NO: 27), состоящим из 8 аминокислот, однако некоторые варианты осуществления настоящего изобретения также конкретно предусматривают применение аналогов и аналоги лишенных упомянутых 8 прилегающих аминокислот карбоксильного конца последовательности SEQ ID NO: 27. Упомянутые соединения могут быть изменены для определенных вариантов применения посредством модификаций аминокислот для регулирования активности пептида на GLP-1-рецепторе, и, таким образом, аналоги глюкагона, соответствующие настоящему изобретению, могут создаваться в индивидуальном порядке для лечения конкретного состояния либо заболевания. Более конкретно, настоящее изобретение предлагает аналоги глюкагона, где каждый аналог демонстрирует характерный относительный уровень активности на соответствующих рецепторах, а именно на глюкагоновом рецепторе и GLP-1 рецепторе. Например, каждый пептид может подвергаться модификациям с получением глюкагонового пептида, обладающего по меньшей мере от приблизительно 1% (включая приблизительно 1,5, 2, 5, 7, 10,20, 30, 40, 50, 60, 75, 100, 125, 150, 175%) до приблизительно 200% или более высокой активности наGLP-1-рецепторе по сравнению с нативным GLP-1 и от приблизительно 1% (включая приблизительно 1,5, 2, 5, 7, 10, 20, 30, 40, 50, 60, 75, 100, 125, 150, 175, 200, 250, 300, 350, 400, 450%) до приблизительно 500% или более высокой активности на глюкагоновом рецепторе по сравнению с нативным глюкагоном. В некоторых вариантах осуществления настоящего изобретения глюкагоновые пептиды, описанные в настоящем изобретении, демонстрируют не более чем приблизительно 100, 1000, 10000, 100000 либо 1000000% активность нативного глюкагона на глюкагоновом рецепторе. В некоторых вариантах осуществления настоящего изобретения глюкагоновые пептиды, описанные в настоящем изобретении, демонстрируют не более чем приблизительно 100, 1000, 10000, 100000 либо 1000000% активность нативногоGLP-1 на GLP-1-рецепторе. Аминокислотная последовательность нативного глюкагона представлена последовательностью SEQ ID NO: 1, аминокислотная последовательность амида GLP-1(7-36) представлена последовательностью SEQ ID NO: 52 и аминокислотная последовательность кислоты GLP-1(7-37) представлена последовательностью SEQ ID NO: 50. В иллюстративных вариантах осуществления на-2 019203 стоящего изобретения глюкагоновый пептид может проявлять по меньшей мере 10% активности нативного глюкагона на глюкагоновом рецепторе и по меньшей мере 50% активности нативного GLP-1 наGLP-1-рецепторе, или по меньшей мере 40% активности нативного глюкагона на глюкагоновом рецепторе и по меньшей мере 40% активности нативного GLP-1 на GLP-1-рецепторе, или по меньшей мере 60% активности нативного глюкагона на глюкагоновом рецепторе и по меньшей мере 60% активности нативного GLP-1 на GLP-1-рецепторе. Селективность глюкагонового пептида в отношении глюкагонового рецептора по сравнению сGLP-1-рецептором может описываться как относительный показатель активности глюкагона к активности GLP-1 (активность пептида на глюкагоновом рецепторе относительно нативного глюкагона, деленная на активность пептида на GLP-1-рецепторе относительно нативного GLP-1). Например, глюкагоновый пептид, проявляющий 60% активности нативного глюкагона на глюкагоновом рецепторе и 60% активности нативного GLP-1 на GLP-1-рецепторе, имеет отношение активности глюкагона к активностиGLP-1 1:1. Примеры отношений активности глюкагона к активности GLP-1 включают приблизительно 1:1, 1,5:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1 либо приблизительно 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4,1:3, 1:2 или 1:1,5. В качестве примера отношение активности глюкагона к активности GLP-1 10:1 указывает на 10-кратную селективность в отношении глюкагонового рецептора по сравнению с GLP-1 рецептором. Подобным образом, отношение активности GLP-1 к активности глюкагона 10:1 указывает на 10-кратную селективность в отношении GLP-1-рецептора по сравнению с глюкагоновым рецептором. В одном из вариантов осуществления настоящего изобретения предложены аналоги глюкагона, обладающие повышенной активностью и оптимально улучшенной растворимостью и стабильностью. В одном из вариантов осуществления настоящего изобретения повышенная активность глюкагона обеспечивается модифицированием аминокислоты в положении 16 нативного глюкагона (последовательностьSEQ ID NO: 1). В качестве неограничивающего примера такая повышенная активность может обеспечиваться заменой природного серина в положении 16 глутаминовой кислотой либо другой отрицательно заряженной аминокислотой, имеющей боковую цепь длиной в 4 атома, или же альтернативно любой аминокислотой из группы, которую составляют глутамин, гомоглутаминовая кислота и гомоцистеиновая кислота, или заряженной аминокислотой, имеющей боковую цепь, содержащую по меньшей мере один гетероатом (например, N, О, S, Р), или боковую цепь длиной приблизительно 4 атома (или 3-5 атомов). В одном из вариантов осуществления настоящего изобретения агонист глюкагона повышенной активности содержит пептид, представленный последовательностями SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4,SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, либо аналог агониста глюкагона, представленный последовательностью SEQ ID NO: 5. В одном из вариантов осуществления настоящего изобретения предложен белок-аналог глюкагона, имеющий повышенную активность на глюкагоновом рецепторе относительно глюкагона дикого типа, где пептид содержит последовательности SEQ ID NO: 7, SEQID NO: 8, SEQ IDNO: 9 или SEQ ID NO: 10, и где глюкагоновый пептид сохраняет свою селективность в отношении глюкагонового рецептора по сравнению с GLP-1-рецепторами. Активность на глюкагоновом рецепторе можно снижать, поддерживать на определенном уровне либо повышать посредством модификации аминокислоты в положении 3, например замены природного глутамина в положении 3. В одном из вариантов осуществления настоящего изобретения было показано,что замена аминокислоты в положении 3 кислой, основной либо гидрофобной аминокислотой (глутаминовой кислотой, орнитином, норлейцином) существенно снижает или ликвидирует активность на глюкагоновом рецепторе. Аналоги, заменяемые, например, глутаминовой кислотой, орнитином либо норлейцином, обладают приблизительно 10% или меньшей активностью нативного глюкагона на глюкагоновом рецепторе, например приблизительно 1-10% или приблизительно 0,1-10% либо больше чем приблизительно 0,1%, но меньше чем приблизительно 10%, одновременно демонстрируя по меньшей мере 20% активности GLP-1 на GLP-1-рецепторе. Например, аналоги, описанные в настоящем изобретении, обладают приблизительно 0,5, приблизительно 1 или приблизительно 7% активности нативного глюкагона,одновременно демонстрируя по меньшей мере 20% активность GLP-1 на GLP-1-рецепторе. В другом варианте осуществления настоящего изобретения природный глутамин в положении 3 глюкагонового пептида может быть заменен аналогом глутамина без существенной потери активности на глюкагоновом рецепторе, а в некоторых случаях, с повышением активности на глюкагоновом рецепторе. Например, глюкагоновый пептид, содержащий аналог глутамина в положении 3, может демонстрировать приблизительно 5, приблизительно 10, приблизительно 20, приблизительно 50, приблизительно 85% или большую активность нативного глюкагона (например, последовательность SEQ ID NO: 1) на глюкагоновом рецепторе. В некоторых вариантах осуществления настоящего изобретения глюкагоновый пептид, содержащий аналог глутамина в положении 3, может демонстрировать приблизительно 20, приблизительно 50, приблизительно 75, приблизительно 100, приблизительно 200, приблизительно 500% или большую активность соответствующего глюкагонового пептида, имеющего такую же самую аминокислотную последовательность, что и пептид, содержащий аналог глутамина, за исключением модифицированной аминокислоты в положении 3 (например, последовательность SEQ ID NO: 601 или последовательность SEQ ID NO: 602), на глюкагоновом рецепторе. В некоторых вариантах осуществления настоящего изобретения глюкагоновый пептид, содержащий аналог глутамина в положении 3, демонстри-3 019203 рует повышенную активность на глюкагоновом рецепторе, однако упомянутая повышенная активность составляет не более чем 1000, 10000, 100000 или 1000000% активности нативного глюкагона либо соответствующего глюкагонового пептида, имеющего такую же самую аминокислотную последовательность,что и пептид, содержащий аналог глутамина, за исключением модифицированной аминокислоты в положении 3. В некоторых вариантах осуществления настоящего изобретения аналог глутамина представляет собой природную либо искусственную аминокислоту, содержащую боковую цепь структуры I, структуры где R1 - С 0-3-алкил или С 0-3-гетероалкил; R2 - NHR4 или C1-3-алкил; R3 - С 1-3-алкил; R4 - Н или C1-3 алкил; Х - NH, О или S и Y - NHR4, SR3 или OR3. В некоторых вариантах осуществления настоящего изобретения Х - NH или Y - NHR4. В некоторых вариантах осуществления настоящего изобретения R1 С 0-2-алкил либо C1-гетероалкил. В некоторых вариантах осуществления настоящего изобретения R2 NHR4 либо C1-алкил. В некоторых вариантах осуществления настоящего изобретения R4- Н либо C1 алкил. В некоторых вариантах осуществления настоящего изобретения предложена аминокислота, содержащая боковую цепь структуры I, где R1 - CH2-S, X - NH и R2 - СН 3 (ацетамидометилцистеин,C(Acm; R1 - СН 2, X - NH и R2 - СН 3 (ацетилдиаминобутановая кислота, Dab(Ac; R1 - С 0-алкил, X - NH,R2 - NHR4 и R4 - Н (карбамоилдиаминопропановая кислота, Dap(мочевина; или R1 - СН 2-СН 2, Х - NH иR2 - СН 3 (ацетилорнитин, Orn(Ас. В некоторых вариантах осуществления настоящего изобретения предложена аминокислота, содержащая боковую цепь структуры II, где R1 - СН 2, Y - NHR4 и R4 - СН 3(метилглутамин, Q(Me. В некоторых вариантах осуществления настоящего изобретения предложена аминокислота, содержащая боковую цепь структуры III, где R1 - СН 2 и R4 - Н (метионинсульфоксид,М(О. В конкретных вариантах осуществления настоящего изобретения аминокислоту в положении 3 заменяют на Dab(Ac). Например, агонисты глюкагона могут содержать аминокислотную последовательность, представленную последовательностью SEQ ID NO: 595, SEQ ID NO: 601, SEQ ID NO: 603, SEQ IDNO: 604, SEQ ID NO: 605 и SEQ ID NO: 606. В других вариантах осуществления настоящего изобретения предложены аналоги глюкагона, обладающие повышенной или сохраненной активностью на глюкагоновом рецепторе по сравнению с нативным глюкагоновым пептидом, но имеющие также значительно повышенную активность на GLP-1 рецепторе. Глюкагон, как правило, имеет приблизительно 1% активности нативного GLP-1 на GLP-1 рецепторе, в то время как GLP-1, как правило, имеет менее чем приблизительно 0,01% активности нативного глюкагона на глюкагоновом рецепторе. Повышенная активность на GLP-1-рецепторе обеспечивается посредством замены карбоксильной группы С-концевой аминокислоты нейтральной по заряду группой, такой как амид либо сложный эфир. В одном из вариантов осуществления настоящего изобретения эти аналоги глюкагона содержат последовательность SEQ ID NO: 20, где карбоксиконцевая аминокислота имеет амидную группу вместо карбоксильной группы, находящейся в нативной аминокислоте. Эти аналоги глюкагона имеют сильную активность как на глюкагоновых, так и на GLP-1-рецепторах, и,таким образом, выступают на обоих рецепторах в качестве коагонистов. В соответствии с одним из вариантов осуществления настоящего изобретения предложен коагонист глюкагонового и GLP-1-рецептора,где пептид содержит последовательность SEQ ID NO: 20, в которой аминокислотой в положении 28 является Asn или Lys и аминокислотой в положении 29 является амид Thr. Повышенная активность на GLP-1-рецепторе обеспечивается также стабилизацией альфаспиральной структуры С-концевого участка глюкагона (вблизи аминокислот 12-29) посредством образования внутримолекулярного мостика между боковыми цепями двух аминокислот, отделенных тремя расположенными между ними аминокислотами, т.е. аминокислоты в положении "i" и аминокислоты в положении "i+4", где i - любое целое число от 12 до 25, двумя расположенными между ними аминокислотами, т.е. аминокислоты в положении "j" и аминокислоты в положении "j+3", где j - любое целое число от 12 до 27, либо шестью расположенными между ними аминокислотами, т.е. аминокислоты в положении "k" и аминокислоты в положении "k+7", где k - любое целое число от 12 до 22. В некоторых вариантах осуществления настоящего изобретения мостик или линкер имеет приблизительно 8 (или приблизительно 7-9) атомов в длину и образуется между боковыми цепями аминокислот в положениях 12 и 16,или в положениях 16 и 20, или в положениях 20 и 24, или в положениях 24 и 28. Боковые цепи этих аминокислот могут связываться одна с одной посредством нековалентных связей, например, с помощью водородных связей либо ионных взаимодействий, например, путем образования солевых мостиков, или же с помощью ковалентных связей. В одном из вариантов осуществления настоящего изобретения предложен агонист глюкагона, содержащий глюкагоновый пептид с последовательностью SEQ ID NO: 20, где лактамный цикл образуется между боковыми цепями остатка лизина, находящегося в положении 12, 20 либо 28, и остатком глутаминовой кислоты, находящимся в положении 16 либо 24, где две аминокислоты глюкагонового пептида,боковые цепи которых участвуют в образовании лактамного цикла, отделены одна от другой тремя расположенными между ними аминокислотами. В соответствии с одним из вариантов осуществления настоящего изобретения лактамсодержащий аналог глюкагона содержит аминокислотную последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 11, SEQ ID NO: 12,SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18. В одном из вариантов осуществления настоящего изобретения карбоксиконцевая аминокислота лактамсодержащего пептида содержит амидную группу либо сложноэфирную группу вместо концевой карбоксильной группы. В одном из вариантов осуществления настоящего изобретения глюкагоновый пептид с последовательностями SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15,SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18 также содержит дополнительную аминокислоту, ковалентно присоединенную к карбоксильному концу последовательностей SEQ ID NO: 11, SEQ ID NO: 12,SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18. В еще одном варианте осуществления настоящего изобретения предложен глюкагоновый пептид, который содержит последовательность, выбранную из группы, которую составляют последовательности SEQ IDNO: 66, SEQ ID NO: 67, SEQ ID NO: 68 и SEQ ID NO: 69, и также содержит дополнительную аминокислоту, ковалентно присоединенную к карбоксильному концу последовательностей SEQ ID NO: 66, SEQ IDNO: 67, SEQ ID NO: 68 и SEQ ID NO: 69. В одном из вариантов осуществления настоящего изобретения аминокислотой в положении 28 является аспарагин либо лизин и аминокислотой в положении 29 является треонин. В некоторых конкретных вариантах осуществления настоящего изобретения стабилизация альфаспиральной структуры С-концевой части пептида-агониста глюкагона обеспечивается посредством образования ковалентного внутримолекулярного мостика, который отличается от лактамового мостика. Например, для стабилизации альфа-спирали применяются приемлемые способы ковалентного связывания(например, способы образования ковалентного внутримолекулярного мостика), включающие любой один или несколько из группы, которую составляют олефиновый метатезис, циклизация на основе лантионина, образование дисульфидного мостика или модифицированного серасодержащего мостика, использование ,-диаминоалкановых связей, образование мостиковых связей между атомами металла и другие способы пептидной циклизации. Повышенная активность на GLP-1-рецепторе обеспечивается также посредством стабилизации альфа-спиральной структуры на С-концевом участке глюкагонового пептида (вблизи аминокислот 12-29) посредством введения одной или нескольких ,-дизамещенных аминокислот в положения, которые сохраняют необходимую активность. В некоторых аспектах настоящего изобретения стабилизация альфа-спирали осуществляется подобным образом без направленного введения внутримолекулярного мостика, такого как солевой мостик, либо ковалентной связи. Такие пептиды могут рассматриваться в настоящем описании как пептиды, не имеющие внутримолекулярного мостика. В соответствии с конкретными аспектами настоящего изобретения стабилизация альфа-спирали осуществляется посредством введения одной либо нескольких ,-дизамещенных аминокислот без введения ковалентного внутримолекулярного мостика, например лактамового мостика, дисульфидного мостика. Такие пептиды могут рассматриваться в настоящем описании как пептиды, не имеющие внутримолекулярного мостика. В некоторых вариантах осуществления настоящего изобретения одно, два, три, четыре или несколько положений 16, 17, 18, 19, 20, 21, 24 или 29 глюкагонового пептида заменяют ,-дизамещенной аминокислотой. Например, замена аминокислоты в положении 16 глюкагонового пептида аминоизомасляной кислотой(AIB), при отсутствии солевого мостика либо лактама, повышает активность на GLP-1-рецепторе. В некоторых вариантах осуществления настоящего изобретения аминокислоту в одном, двух, трех или нескольких положениях 16, 20, 21 или 24 заменяют на AIB. Повышенная активность пептидов-аналогов глюкагона, не имеющего внутримолекулярного мостика (например, ковалентного внутримолекулярного мостика), на GLP-1-рецепторе и глюкагоновом рецепторе обеспечивается добавлением ацильной либо алкильной группы к боковой цепи аминокислоты в положении 10 упомянутого пептида. В соответствии с некоторыми аспектами настоящего изобретения ацильная либо алкильная группа не является природной для аминокислоты. В соответствии с конкретными аспектами настоящего изобретения ацильная либо алкильная группа не является нативной для любой природной аминокислоты. В некоторых вариантах осуществления настоящего изобретения ацильной группой является ацильная группа жирной кислоты, например ацильная группа С 4-С 30 жирной кислоты. Например, настоящим изобретением предложен пептид-аналог глюкагона, не имеющий ковалентного внутримолекулярного мостика, содержащий AIB в положении 16 и ацильную группу С 14, С 16 или С 18 жирной кислоты, ковалентно присоединенную к Lys остатку в положении 10. Предложен также пептид-5 019203 аналог глюкагона, не имеющий внутримолекулярного мостика (например, ковалентного внутримолекулярного мостика), содержащий AIB в положениях 2 и 16 и ацильную группу С 14, С 16 или С 18 жирной кислоты, ковалентно присоединенную к Lys остатку в положении 10. Как описано ниже, такие ацилированные пептиды-аналоги глюкагона, не имеющие внутримолекулярного мостика (например, ковалентного внутримолекулярного мостика), могут быть пэгилированы. Дальнейшее повышение активности ацилированных пептидов-аналогов глюкагона, не имеющих внутримолекулярного мостика (например, внутримолекулярного мостика), на GLP-1-рецепторе и глюкагоновом рецепторе может обеспечиваться включением спейсера между ацильной либо алкильной группой и боковой цепью аминокислоты в положении 10. В некоторых вариантах осуществления настоящего изобретения спейсер (например, аминокислота, дипептид, трипептид, гидрофильный бифункциональный спейсер либо гидрофобный бифункциональный спейсер) имеет в длину от 3 до 10 атомов (например, от 6 до 10 атомов). В соответствии с некоторыми конкретными вариантами осуществления настоящего изобретения общая длина спейсера и ацильной либо алкильной группы составляет от 14 до 28 атомов, например от 17 до 28 атомов, от 19 до 26 атомов, от 19 до 21 атома. В настоящем изобретении также описаны приемлемые спейсеры для повышения активности ацилированных либо алкилированных пептидов,не имеющих внутримолекулярного мостика (например, ковалентного внутримолекулярного мостика), наGLP-1-рецепторе и глюкагоновом рецепторе. Например, в настоящем описании предложен ненативный глюкагоновый пептид, отличающийся от последовательности SEQ ID NO: 1 не более чем 10 модификациями аминокислоты, содержащий ацильную группу либо алкильную группу, где упомянутая ацильная либо алкильная группа присоединена к спейсеру, а спейсер присоединен к боковой цепи аминокислоты в положении 10 упомянутого глюкагонового пептида, где в случае, если упомянутый глюкагоновый пептид не имеет гидрофильной составляющей, например PEG, упомянутый глюкагоновый пептид демонстрирует по меньшей мере 20% (например, по меньшей мере 30, по меньшей мере 40, по меньшей мере 50, по меньшей мере 60, по меньшей мере 75, по меньшей мере 80, по меньшей мере 90, по меньшей мере 95, по меньшей мере 98, по меньшей мере 99, приблизительно 100, приблизительно 150, приблизительно 200, приблизительно 400, приблизительно 500% или более) активности нативного GLP-1 на GLP-1-рецепторе. В некоторых вариантах осуществления настоящего изобретения глюкагоновый пептид демонстрирует по меньшей мере 0,5%(например, по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 10, по меньшей мере 20%) активности нативного глюкагона на глюкагоновом рецепторе в случае, если у упомянутого глюкагонового пептида отсутствует гидрофильная составляющая, например PEG. В некоторых вариантах осуществления настоящего изобретения вышеописанные глюкагоновые пептиды могут демонстрировать любую из вышеуказанных активностей и не более чем 1000, 10000, 100000 либо 1000000% активности нативного глюкагона на глюкагоновом рецепторе. В некоторых вариантах осуществления настоящего изобретения вышеописанные глюкагоновые пептиды могут демонстрировать любую из вышеуказанных активностей и не более чем 1000, 10000, 100000 либо 1000000% активности нативного GLP-1 на GLP-1-рецепторе. Повышенная активность на GLP-1-рецепторе обеспечивается также модифицированием аминокислоты в положении 20. В одном из вариантов осуществления настоящего изобретения глутамин в положении 20 заменяют другой гидрофильной аминокислотой, имеющей боковую цепь, которая заряжена или же обладает способностью к образованию водородной связи и имеет в длину по меньшей мере приблизительно 5 (или приблизительно 4-6) атомов, например лизином, цитруллином, аргинином либо орнитином. Любая из описанных выше модификаций, которая повышает или снижает активность глюкагонового рецептора и которая повышает активность GLP-1-рецептора, может осуществляться отдельно либо комбинированно. Комбинации модификаций, повышающих активность GLP-1-рецептора, могут обеспечивать более высокую активность GLP-1, нежели любая из таких модификаций по отдельности. Например, настоящее изобретение предлагает аналоги глюкагона, содержащие модификации в положении 16, в положении 20 и на С-концевой карбоксильной группе, факультативно с ковалентной связью между аминокислотами в положениях 16 и 20; аналоги глюкагона, содержащие модификации в положении 16 и на С-концевой карбоксильной группе; аналоги глюкагона, содержащие модификации в положениях 16 и 20,факультативно с ковалентной связью между аминокислотами в положениях 16 и 20; и аналоги глюкагона, содержащие модификации в положении 20 и на С-концевой карбоксильной группе; факультативно при условии, что аминокислотой в положении 12 не является Arg; или же факультативно при условии,что аминокислотой в положении 9 не является Glu. Другие модификации в положении 1 или положении 2, как описано в данном документе, могут повысить резистентность пептида к расщеплению дипептидилпептидазой IV (DPPIV). Например, аминокислота в положении 2 может быть заменена D-серином, D-аланином, валином, глицином, Nметилсерином, N-метилаланином или же аминоизомасляной кислотой. Альтернативно или же в дополнение, аминокислота в положении 1 может быть заменена D-гистидином, дезаминогистидином, гидроксилгистидином, ацетилгистидином, гомогистидином, N-метилгистидином, альфа-метилгистидином,имидазолуксусной кислотой или же ,-диметилимидазолуксусной кислотой (DMIA). Наблюдалось, что модификации в положении 2 (например, AIB в положении 2) и, в некоторых случаях, модификации в положении 1 могут снижать активность на глюкагоновом рецепторе, иногда значительно; неожиданно было обнаружено, что снижение активности на глюкагоновом рецепторе может быть восстановлено посредством стабилизации альфа-спиральной структуры на С-концевом участке глюкагона, например, посредством образования ковалентной связи между аминокислотами в положениях "i" и "i+4", например 12 и 16, 16 и 20 либо 20 и 24. В некоторых вариантах осуществления настоящего изобретения такая ковалентная связь представляет собой лактамовый мостик между глутаминовой кислотой в положении 16 и лизином в положении 20. В некоторых вариантах осуществления настоящего изобретения такая ковалентная связь представляет собой внутримолекулярный мостик, за исключением лактамового мостика. Например, к числу приемлемых способов ковалентного связывания относится любой один или несколько из группы, которую составляют олефиновый метатезис, циклизация на основе лантионина, образование дисульфидного мостика или модифицированного серасодержащего мостика,использование ,-диаминоалкановых связей, образование мостиковых связей между атомами металла и другие способы пептидной циклизации. Глюкагоновые пептиды с активностью GLP-1, содержащие неконсервативную замену His в положении 1 большой ароматической аминокислотой (например, Tyr), могут сохранять активность GLP-1 при условии, что альфа-спираль стабилизирована посредством внутримолекулярного мостика, например посредством ковалентной связи между аминокислотами в положениях "i" и "i+4", например 12 и 16, 16 и 20 либо 20 и 24. В некоторых вариантах осуществления настоящего изобретения такая ковалентная связь представляет собой лактамовый мостик между глутаминовой кислотой в положении 16 и лизином в положении 20. В некоторых вариантах осуществления настоящего изобретения такая ковалентная связь представляет собой внутримолекулярный мостик, за исключением лактамового мостика. Например, к числу приемлемых способов ковалентного связывания относится любой один или несколько из группы,которую составляют олефиновый метатезис, циклизация на основе лантионина, образование дисульфидного мостика или модифицированного серасодержащего мостика, использование ,-диаминоалкановых связей, образование мостиковых связей между атомами металла и другие способы пептидной циклизации. В соответствии с другими вариантами осуществления, приведенными в качестве примера, любое из вышеупомянутых соединений может подвергаться дополнительной модификации для повышения стабильности посредством модифицирования аминокислоты в положении 15 последовательности SEQ IDNO: 1 для снижения деградации пептида со временем, особенно в кислых либо щелочных буферных растворах. В другом варианте осуществления настоящего изобретения растворимость описанных в настоящем изобретении глюкагоновых пептидов повышена посредством ковалентного присоединения гидрофильной составляющей к пептиду. В одном из вариантов осуществления настоящего изобретения упомянутая гидрофильная составляющая представляет собой полиэтиленгликолевую (PEG) цепь, факультативно присоединенную к пептиду в одном или нескольких положениях 16, 17, 21, 24, 29, в пределах Сконцевого удлиняющего сегмента либо на С-концевой аминокислоте. В некоторых вариантах осуществления настоящего изобретения нативная аминокислота в этом положении заменена аминокислотой,имеющей боковую цепь, пригодную для сшивания с гидрофильными составляющими, для облегчения присоединения гидрофильной составляющей к пептиду. В других вариантах осуществления настоящего изобретения аминокислота, модифицированная для включения гидрофильной группы, добавлена к пептиду на С-концевой аминокислоте. В одном из вариантов осуществления настоящего изобретения пептид-коагонист содержит последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19, где боковая цепь аминокислотного остатка в одном из положений 16, 17, 21 либо 24 упомянутого глюкагонового пептида также содержит полиэтиленгликолевую цепь, имеющую молекулярную массу, выбранную в диапазоне от приблизительно 500 до приблизительно 40000 Да. В одном из вариантов осуществления настоящего изобретения полиэтиленгликолевая цепь имеет молекулярную массу, выбранную в диапазоне от приблизительно 500 до приблизительно 5000 Да. В другом варианте осуществления настоящего изобретения полииэтиленгликолевая цепь имеет молекулярную массу от приблизительно 10000 до приблизительно 20000 Да. В еще одном варианте осуществления настоящего изобретения полиэтиленгликолевая цепь имеет молекулярную массу от приблизительно 20000 до приблизительно 40000 Да. В соответствии с другим вариантом осуществления настоящего изобретения растворимость любого из вышеупомянутых аналогов глюкагона может быть улучшена посредством аминокислотных замен и/или добавлений, которые вводят заряженную аминокислоту в С-концевую часть пептида, предпочтительно в С-концевое положение относительно положения 27 последовательности SEQ ID NO: 1. Факультативно в С-концевую часть могут быть введены одна, две или три заряженные аминокислоты, предпочтительно в С-концевом направлении относительно положения 27. В одном из вариантов осуществления настоящего изобретения нативную(-ые) аминокислоту(-ы) в положениях 28 и/или 29 заменяют заряжен-7 019203 ными аминокислотами, и/или в соответствии с другим вариантом осуществления к С-концу пептида также добавляют от одной до трех заряженных аминокислот. В дальнейших вариантах осуществления настоящего изобретения одна, две либо все заряженные аминокислоты имеют отрицательный заряд. Глюкагоновый пептид может подвергаться дополнительным модификациям, например консервативным заменам, что, тем не менее, позволяет ему сохранять активность глюкагона. В одном из вариантов осуществления настоящего изобретения предложен пептид-аналог с последовательностью SEQ ID NO: 20, который отличается от последовательности SEQ ID NO: 20 1-2 заменами аминокислот в положениях 17-26,и в другом варианте осуществления настоящего изобретения упомянутый аналог отличается от пептида с последовательностью SEQ ID NO: 20 заменой аминокислоты в положении 20. В некоторых вариантах осуществления глюкагоновые пептиды, описанные в настоящем изобретении, модифицируют посредством срезания одного-двух аминокислотных остатков на С-конце. Такие модифицированные глюкагоновые пептиды, как показано в настоящем описании, сохраняют одинаковую активность и эффективность на глюкагоновом рецепторе и GLP-1-рецепторе. Такие глюкагоновые пептиды могут содержать аминокислоты 1-27 либо 1-28 нативного глюкагонового пептида (последовательность SEQ ID NO: 1), факультативно с любыми дополнительными модификациями, описанными в настоящем изобретении. В соответствии с одним из вариантов осуществления глюкагоновые пептиды, описанные в настоящем изобретении, модифицируют посредством добавления второго пептида к карбоксильному концу глюкагонового пептида, например последовательности SEQ ID NO: 26, SEQ ID NO: 27 либо SEQ ID NO: 28. В одном из вариантов осуществления настоящего изобретения глюкагоновый пептид, имеющий пептидную последовательность, выбранную из группы, которую составляют последовательности SEQ IDNO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17,SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68 и SEQ ID NO: 69, ковалентно соединены посредством пептидной связи со вторым пептидом, где второй пептид содержит последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 26, SEQID NO: 27 и SEQ ID NO: 28. В другом варианте осуществления настоящего изобретения у глюкагоновых пептидов, содержащих С-концевой удлиняющий сегмент, треонин в положении 29 нативного глюкагонового пептида заменяют глицином. Аналог глюкагона, имеющий замену треонина глицином в положении 29 и содержащий карбоксильный концевой удлиняющий сегмент последовательности SEQ ID NO: 26, в четыре раза активнее на GLP-1-рецепторе по сравнению с нативным глюкагоном, модифицированным с включением карбоксильного концевого удлиняющего сегмента последовательности SEQ ID NO: 26. Активность на GLP-1-рецепторе может быть также повышена посредством замены нативного аргинина в положении 18 аланином. Любой из глюкагоновых пептидов, описанный в настоящем изобретении, может быть модифицирован для включения ацильной группы либо алкильной группы, например С 4-С 30 ацильной либо алкильной группы. В соответствии с некоторыми аспектами настоящего изобретения упомянутая ацильная группа либо алкильная группа не является нативной для любой природной аминокислоты. Ацилирование либо алкилирование может увеличить полупериод существования глюкагоновых пептидов в системе кровообращения. Ацилирование либо алкилирование предпочтительно может отсрочить начало действия, и/или увеличить продолжительность действия на глюкагоновом рецепторе и/или GLP-1-рецепторе,и/или улучшить резистентность к протеазам, таким как DPP-IV. Как показано в настоящем описании,активность глюкагонового пептида на глюкагоновом рецепторе и GLP-1-рецепторе после ацилирования может сохраниться на прежнем уровне, если в значительной степени не усилиться. Кроме того, эффективность ацилированных глюкагоновых пептидов была сравнима с эффективностью неацилированных вариантов глюкагоновых пептидов, если не оказывалась в значительной степени увеличенной. Глюкагоновые пептиды можно ацилировать либо алкилировать в том же самом аминокислотном положении, к которому присоединена гидрофильная составляющая, либо в другом аминокислотном положении. В некоторых вариантах осуществления настоящее изобретение предлагает модифицированный глюкагоновый пептид, содержащий ацильную группу либо алкильную группу, ковалентно связанную с аминокислотой глюкагонового пептида в положении 10. Глюкагоновый пептид может также содержать спейсер между аминокислотой глюкагонового пептида в положении 10 и ацильной группой либо алкильной группой. В некоторых вариантах осуществления настоящего изобретения ацильная группа представляет собой жирную кислоту либо желчную кислоту или их соль, например С 4-С 30 жирную кислоту, С 8-С 24 жирную кислоту, холевую кислоту, С 4-С 30 алкил, С 8-С 24 алкил либо алкил, содержащий стероидную составляющую желчной кислоты. Спейсером является любая составляющая с приемлемыми реакционноспособными группами для присоединения ацильных либо алкильных групп. В соответствии с вариантами осуществления настоящего изобретения, приведенными в качестве примера, спейсер представляет собой аминокислоту, дипептид, трипептид, гидрофильный бифункциональный спейсер либо гидрофобный бифункциональный спейсер. В некоторых вариантах осуществления настоящего изобретения спейсер выбран из группы, включающей Trp, Glu, Asp, Cys и спейсер, содержащийNH2(CH2CH2O)n(CH2)mCOOH, где m представляет собой любое целое число от 1 до 6, а n представляет собой любое целое число от 2 до 12. Такие ацилированные либо алкилированные глюкагоновые пептиды могут также содержать гидрофильную составляющую, факультативно полиэтиленгликоль. Любой из вышеупомянутых глюкагоновых пептидов может содержать две ацильные группы либо две алкильные группы или их комбинацию. Таким образом, как описано в настоящем изобретении, предлагаются высокоэффективные аналоги глюкагона либо аналоги коагониста глюкагона, которые также проявляют повышенную растворимость и/или стабильность. Один из иллюстративных примеров высокоэффективного аналога глюкагона проявляет по меньшей мере приблизительно 200% активности нативного глюкагона на глюкагоновом рецепторе, факультативно растворим с концентрацией по меньшей мере 1 мг/мл при рН, которая составляет 68, или 6-9, или 7-9 (например, рН 7), и факультативно сохраняет по меньшей мере 95% исходного пептида (например, 5% или менее исходного пептида разлагается либо расщепляется) через 24 ч при температуре 25 С. Другой иллюстративный пример аналога коагониста глюкагона проявляет более чем приблизительно 40% либо более чем приблизительно 60% активности как на глюкагоновом рецепторе, так и наGLP-1-рецепторе (в соотношении в пределах приблизительно 1:3-3:1 либо в пределах приблизительно 1:2-2:1), факультативно растворим при концентрации по меньшей мере 1 мг/мл при рН, которая составляет 6-8, или 6-9, или 7-9 (например, рН 7), и факультативно сохраняет по меньшей мере 95% исходного пептида через 24 ч при температуре 25 С. Другой иллюстративный пример аналога коагониста глюкагона проявляет приблизительно 175% или более высокую активность нативного глюкагона на глюкагоновом рецепторе и приблизительно 20% либо более низкую активность нативного GLP-1 на GLP-1 рецепторе, факультативно растворим при концентрации по меньшей мере 1 мг/мл при рН, которая составляет 6-8, или 6-9, или 7-9 (например, рН 7), и факультативно сохраняет по меньшей мере 95% исходного пептида через 24 ч при температуре 25 С. Еще один иллюстративный пример аналога коагониста глюкагона проявляет приблизительно 10% или менее активности нативного глюкагона на глюкагоновом рецепторе и по меньшей мере приблизительно 20% активности нативного GLP-1 на GLP-1-рецепторе,факультативно растворим при концентрации по меньшей мере 1 мг/мл при рН, которая составляет 6-8,или 6-9, или 7-9 (например, рН 7), и факультативно сохраняет по меньшей мере 95% исходного пептида через 24 ч при температуре 25 С. Еще один иллюстративный аналог коагониста глюкагона проявляет приблизительно 10% или более низкую (но выше 0,1, 0,5 либо 1%) активность нативного глюкагона на глюкагоновом рецепторе и по меньшей мере приблизительно 50, 60, 70, 80, 90 или 100% либо более высокую активность нативного GLP-1 на GLP-1-рецепторе, факультативно растворим при концентрации по меньшей мере 1 мг/мл при рН, которая составляет 6-8, или 6-9, или 7-9 (например, рН 7), и факультативно сохраняет по меньшей мере 95% исходного пептида через 24 ч при температуре 25 С. В некоторых вариантах осуществления настоящего изобретения глюкагоновые пептиды демонстрируют не более чем приблизительно 100, 1000, 10000, 100000 либо 1000000% активности нативного GLP-1 на GLP-1 рецепторе. В некоторых вариантах осуществления настоящего изобретения такие аналоги глюкагона сохраняют по меньшей мере 22, 23, 24, 25, 26, 27 или 28 природных аминокислот в соответствующих положениях нативного глюкагона (например, имеют 1-7, 1-5 либо 1-3 модификаций по сравнению с природным глюкагоном). Любой из приведенных ниже пептидов исключен из соединений, соответствующих настоящему изобретению, несмотря на то, что любой из приведенных ниже пептидов, содержащий одну или несколько дополнительных модификаций, описанных в настоящем изобретении, демонстрирующий необходимую активность GLP-1 либо коагонистическую активность, фармацевтические композиции, наборы и способы лечения, использующие такие соединения, могут быть включены в настоящее изобретение: пептид (последовательность SEQ ID NO: 1) с [Arg12] заменой и с С-концевым амидом; пептид (последовательность SEQ ID NO: 1) с [Arg12, Lys20] заменами и с С-концевым амидом; пептид (последовательность SEQ ID NO: 1) с [Arg12, Lys24] заменами и с С-концевым амидом; пептид (последовательностьNO: 1) с [Glu9] заменой; пептид (последовательность SEQ ID NO: 1) с отсутствующим His1, с [Glu9,Glu16, Lys29] заменами и с С-концевым амидом; пептид (последовательность SEQ ID NO: 1) с [Glu9,Glu16, Lys29] заменами и с С-концевым амидом; пептид (последовательность SEQ ID NO: 1) с [Lys13,Glu17] заменами, присоединенными через лактамовый мостик, и с С-концевым амидом; пептид (последовательность SEQ ID NO: 1) с [Lys17, Glu21] заменами, присоединенными через лактамовый мостик, и с С-концевым амидом; пептид (последовательность SEQ ID NO: 1) с отсутствующим His1, с [Glu20,Lys24] заменами, присоединенными через лактамовый мостик. В одном из вариантов осуществления настоящего изобретения предложена фармацевтическая композиция, содержащая любой из новых глюкагоновых пептидов, описанных в настоящем изобретении,предпочтительно стерильный и предпочтительно со степенью чистоты по меньшей мере 90, 91, 92, 93,94, 95, 96, 97, 98 либо 99%, и фармацевтически приемлемый разбавитель, носитель либо наполнитель. Такие композиции могут содержать глюкагоновый пептид с концентрацией, по меньшей мере, А, где А составляет 0,001, 0,01, 0,1, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24,25 мг/мл или выше. В других вариантах осуществления настоящего изобретения такие композиции могут содержать глюкагоновый пептид с концентрацией не больше чем В, где В составляет 30, 25, 24, 23, 22,-9 019203 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 либо 0,1 мг/мл. В некоторых вариантах осуществления настоящего изобретения композиции могут содержать глюкагоновый пептид в диапазоне концентраций от А до В мг/мл, например от 0,001 до 30,0 мг/мл. В одном из вариантов осуществления настоящего изобретения фармацевтические композиции содержат водные растворы, стерилизованные и факультативно хранящиеся в различных контейнерах. Соединения, соответствующие настоящему изобретению, могут использоваться в некоторых вариантах осуществления настоящего изобретения для получения предварительно приготовленных растворов, готовых для инъекций. В других вариантах осуществления настоящего изобретения фармацевтические композиции содержат лиофилизованный порошок. Фармацевтические композиции могут дополнительно упаковываться как составная часть набора, который включает в себя одноразовое устройство для введения композиции в организм пациента. Контейнеры либо наборы могут быть снабжены ярлыком с предупреждением о хранении при комнатной температуре либо при пониженной температуре. В соответствии с одним из вариантов осуществления предложен способ ускоренного повышения уровня глюкозы или лечения гипогликемии с применением предварительно приготовленной водной композиции глюкагоновых пептидов, соответствующих настоящему изобретению. Упомянутый способ включает стадию введения эффективного количества водного раствора, содержащего новый модифицированный глюкагоновый пептид, описанный в настоящем изобретении. В одном из вариантов осуществления глюкагоновый пептид пэгилирован в положении 21 или 24 глюкагонового пептида, и полиэтиленгликолевая цепь имеет молекулярную массу от приблизительно 500 до приблизительно 5000 Да. В одном из вариантов осуществления настоящего изобретения раствор модифицированного глюкагона расфасовывается в устройство, применяемое для введения композиции больному, страдающему гипогликемией. В соответствии с одним из вариантов осуществления настоящего изобретения предложен улучшенный способ регулирования уровня глюкозы в крови у инсулинзависимых больных. Упомянутый способ включает стадии введения инсулина в количестве, терапевтически эффективном для регулирования углеводного обмена веществ при диабете, и введения нового модифицированного глюкагонового пептида,описанного в настоящем изобретении, в количестве, терапевтически эффективном для предотвращения гипогликемии, где упомянутые стадии введения осуществляются раздельно в течение промежутка времени продолжительностью 12 ч. В одном из вариантов осуществления глюкагоновый пептид и инсулин вводят одновременно в виде единой композиции, причем глюкагоновый пептид пэгилирован полиэтиленгликолевой цепью, имеющей молекулярную массу, выбранную в пределах от приблизительно 5000 до приблизительно 40000 Да. В другом варианте осуществления настоящего изобретения предложен способ вызывания временного паралича кишечника. Упомянутый способ включает стадию введения в организм пациента одного либо нескольких глюкагоновых пептидов, описанных в настоящем изобретении. Метаболический синдром, известный также как метаболический синдром X, синдром инсулинорезистентности либо синдром Ривена, представляет собой расстройство, которым поражено свыше 50 млн американцев. Метаболический синдром характеризуется, как правило, сочетанием по меньшей мере трех или более нижеследующих факторов риска: (1) брюшное ожирение (избыточная жировая ткань в и вокруг брюшной полости), (2) атерогенная дислипидемия (нарушение липидного обмена в виде повышенного содержания жиров в крови, включающее комбинацию повышенных триглицеридов, низкой концентрации холестерина в виде липопротеинов высокой плотности (HDL) и высокой концентрации холестерина в виде липопротеинов низкой плотности (LDL), что усиливает накопление бляшек на артериальных стенках), (3) повышенное кровяное давление, (4) резистентность к инсулину либо непереносимость глюкозы, (5) протромботическое состояние (например, высокое содержание фибриногена либо ингибитора активатора плазминогена-1 в крови) и (6) провоспалительное состояние (например, повышенное содержание С-реактивного белка в крови). К числу прочих факторов риска может относиться старение, гормональный дисбаланс и генетическая предрасположенность. Метаболический синдром ассоциируется с возрастанием риска возникновения ишемической болезни сердца и других расстройств, связанных с накоплением сосудистых бляшек, таких как инсульт и периферическое сосудистое заболевание, которое называют атеросклеротическим сердечно-сосудистым заболеванием (ASCVD). Метаболический синдром у пациентов может развиваться от инсулинорезистентного состояния на начальных стадиях до полностью развитого диабета II типа с дальнейшим повышением риска развития ASCVD. Не связывая себя никакой конкретной теорией, авторы считают, что взаимосвязь между резистентностью к инсулину, метаболическим синдромом и сосудистым заболеванием может включать один или несколько совместных патогенных механизмов, в том числе нарушенную инсулинстимулированную вазодилатацию, связанное с резистентностью к инсулину снижение доступности NO вследствие повышенного оксидативного стресса и отклонения от нормы гормонов адипоцитарного происхождения, таких как адипонектин (Lteif and Mather, Can. J. Cardiol. 20 (suppl. B):66B-76B(2004. Согласно Образовательной программе Национального комитета США по холестерину: терапия для взрослого населения (National Cholesterol Education Program Adult Treatment Panel (ATP III от 2001 года,- 10019203 любые три нижеследующих признака у одного индивидуума удовлетворяют критерию метаболического синдрома: (а) брюшное ожирение (окружность талии более 102 см у мужчин и свыше 88 см у женщин);(b) содержание триглицеридов в сыворотке крови (150 мг/дл или более); (с) концентрация холестерина в виде липопротеинов высокой плотности (40 мг/дл или ниже у мужчин и 50 мг/дл или ниже у женщин);(d) кровяное давление (130/85 или выше) и (е) уровень глюкозы в крови натощак (110 мг/дл или выше). Согласно данным Всемирной организации здравоохранения (ВОЗ) индивидуум, имеющий высокие уровни инсулина (повышенный уровень глюкозы в крови натощак или только повышенный уровень глюкозы после приема пищи) в сочетании по меньшей мере с двумя нижеследующими критериями, удовлетворяет критерию метаболического синдрома: (а) брюшное ожирение (соотношение талия/бедро более чем 0,9,индекс массы тела по меньшей мере 30 кг/м 2 либо объем талии более 37 дюйм (939,78 мм; (b) холестериновый набор, показывающий уровень триглицеридов по меньшей мере 150 мг/дл либо уровень HDLхолестерина ниже чем 35 мг/дл; (с) кровяное давление 140/90 или выше или же прохождение лечения по поводу высокого кровяного давления) (Mathur, Ruchi, "Metabolic Syndrome", ed. Shiel, Jr., William C.,MedicineNet.com, May 11, 2009). Для целей настоящего изобретения, если индивидуум удовлетворяет критериям Образовательной программы Национального комитета США по холестерину: терапия для взрослого населения (NationalCholesterol Education Program Adult Treatment Panel (ATP III и ВОЗ как по отдельности, так и вместе,этот индивидуум считается пораженным метаболическим синдромом. Не связывая себя никакой конкретной теорией, авторы считают, что глюкагоновые пептиды, описанные в настоящем изобретении, пригодны для лечения метаболического синдрома. Соответственно изобретение предлагает способ предотвращения либо лечения метаболического синдрома или снижения одного, двух, трех или более факторов риска упомянутого заболевания у субъекта, включающий введение упомянутому субъекту глюкагонового пептида, описанного в настоящем изобретении, в количестве,эффективном для предотвращения либо лечения метаболического синдрома или факторов риска упомянутого заболевания. Термин "безалкогольная жировая болезнь печени (NAFLD)" обозначает широкий спектр болезней печени, начиная от простой жировой инфильтрации печени (стеатоз) до безалкогольного стеатогепатита(NASH), до цирроза (необратимое запущенное сморщивание печени). Общим для всех стадий NAFLD является накопление жира (жировая инфильтрация) в клетках печени (гепатоцитах). Простая жировая инфильтрация печени представляет собой аномальное накопление жира определенного типа, триглицеридов, в клетках печени без воспаления либо сморщивания. В случае NASH, накопление жира связывается с воспалением (гепатит) и сморщиванием (фиброз) печени различной степени. Воспалительные клетки могут разрушать клетки печени (гепатоцеллюлярный некроз). В терминах "стеатогепатит" и "стеатонекроз" стеато означает жировую инфильтрацию, гепатит означает воспаление печени и некроз означает омертвение клеток печени. NASH, в конечном счете, может привести к сморщиванию печени (фиброз) с последующим необратимым запущенным сморщиванием печени (цирроз). Цирроз, вызванныйNASH, представляет собой последнюю и наиболее тяжелую стадию в спектре NAFLD (Mendler, Michel,"Fatty Liver: Nonalcoholic Fatty Liver Disease (NAFLD) and Nonalcoholic Steatohepatitis (NASH)", ed.Schoenfield, Leslie J., MedicineNet.com, August 29, 2005). Словосочетание "алкогольная болезнь печени" или "болезнь печени, вызванная потреблением алкоголя" охватывает три патологически различные заболевания печени, связанные с либо вызванные чрезмерным потреблением алкоголя: жировая инфильтрация печени (стеатоз), хронический или острый гепатит и цирроз. Алкогольный гепатит может проявляться в форме от легкого гепатита, где отклоняющиеся от нормы результаты лабораторных анализов являются единственным свидетельством заболевания, до тяжелого нарушения функции печени с осложнениями, такими как желтуха (окрашивание кожи в желтый цвет, вызванное задержкой билирубина), печеночная энцефалопатия (неврологическое расстройство,вызванное печеночной недостаточностью), асцит (накопление жидкости в брюшной полости), кровотечение из варикозных вен пищевода (варикозные вены в пищеводе), аномальная свертываемость крови и кома. В гистологическом отношении алкогольный гепатит имеет характерные внешние признаки с баллонной дистрофией гепатоцитов, воспалением с нейтрофилами и иногда с тельцами Мэллори (аномальное конденсирование промежуточных микрофиламентов цитоскелета). Цирроз в анатомическом отношении характеризуется широким распространением узелков в печени в сочетании с фиброзом (Worman,Howard J., "Alcoholic Liver Disease", Columbia University Medical Center website).He связывая себя никакой конкретной теорией, авторы считают, что глюкагоновые пептиды, описанные в настоящем изобретении, пригодны для лечения алкогольной болезни печени, NAFLD или любой их стадии, включая, например, стеатоз, стеатогепатит, гепатит, воспаление печени, NASH, цирроз либо их осложнения. Соответственно настоящим изобретением предложен способ предотвращения либо лечения алкогольной болезни печени, NAFLD или любой их стадии у субъекта, включающий введение субъекту глюкагонового пептида, описанного в настоящем изобретении, в количестве, эффективном для предотвращения или лечения алкогольной болезни печени, NAFLD или любой их стадии. Такие способы лечения включают снижение в один, два, три или более раз следующего: содержания жира в печени, количества случаев возникновения или развития цирроза, количества случаев возникновения гепатоцеллю- 11019203 лярной карциномы, признаков воспаления, например, отклоняющихся от нормы уровней ферментов печени (например, аспартатаминотрансферазы (AST) и/или аланинаминотрансферазы (ALT) или LDH),повышенного уровня сывороточного ферритина, повышенного уровня сывороточного билирубина и/или признаков фиброза, например повышенных уровней TGF-бета (трансформирующий фактор роста бета). Согласно предпочтительным примерам вариантам осуществления настоящего изобретения глюкагоновые пептиды применяют для лечения пациентов, прошедших стадию простой жировой инфильтрации печени (стеатоза) и демонстрирующих признаки воспаления или гепатита. Следствием применения таких способов может быть, например, снижение уровней AST и/или ALT. В еще одном варианте осуществления настоящего изобретения предложен способ лечения гипергликемии либо способ снижения прироста массы тела или инициирования уменьшения массы тела, который включает введение эффективного количества водного раствора, содержащего глюкагоновый пептид,соответствующий настоящему изобретению. В одном из вариантов осуществления настоящего изобретения любой способ включает введение эффективного количества композиции, содержащей агонист глюкагона, выбранный из группы, которую составляют последовательности SEQ ID NO: 11, SEQ ID NO: 12,SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ IDNO: 19. В другом варианте осуществления настоящего изобретения упомянутый способ включает введение эффективного количества композиции, содержащей агонист глюкагона, который содержит глюкагоновый пептид, выбранный из группы, которую составляют последовательности SEQ ID NO: 11, SEQ IDNO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18,SEQ ID NO: 19, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68 и SEQ ID NO: 69, где аминокислота 29 глюкагонового пептида присоединена ко второму пептиду через пептидную связь, и упомянутый второй пептид содержит последовательности SEQ ID NO: 26, SEQ ID NO: 27 или SEQ ID NO: 28. В других вариантах осуществления предложены способы лечения диабета, включающие одновременное ведение обычной дозы либо уменьшенной дозы инсулина и глюкагонового пептида, соответствующего настоящему изобретению. Предложены также способы лечения диабета с помощью глюкагонового пептида, соответствующего настоящему изобретению, без одновременного ведения инсулина. В еще одном аспекте настоящее изобретение предлагает новые способы лечения гипергликемии и новые способы снижения аппетита либо инициирования уменьшения массы тела, которые включают введение молекулы соагониста глюкагона/GLP-1 (включая их фармацевтически приемлемые соли), которая активизирует как глюкагоновые, так и GLP-1-рецепторы. Агонизм, т.е. активизация, как глюкагоновых, так и GLP-1-рецепторов обеспечивает при лечении гипергликемии неожиданное улучшение по сравнению только с агонизмом GLP-1. Таким образом, добавление глюкагонового агонизма обеспечивает неожиданный аддитивный или синергический эффект либо другое(-ие) неожиданное(-ые) благоприятное(-ые) клиническое(-ие) воздействие(-я). В соответствии с упомянутыми способами предусматривается введение с обычной дозой инсулина, уменьшенной дозой инсулина либо без инсулина. Агонизм глюкагонового рецептора также имеет неожиданное благотворное воздействие по сравнению только с агонизмом GLP-1 при инициировании уменьшения массы тела либо снижении прироста массы тела. К примерам молекул коагонистов глюкагона/GLP-1 относятся глюкагоновые пептиды, соответствующие настоящему изобретению, аналоги GLP-1, активизирующие как GLP-1-рецепторы, так и глюкагоновые рецепторы, гибриды глюкагона и GLP-1 или гибриды аналогов глюкагона и аналогов GLP-1 либо их химически модифицированные производные. Альтернативно, соединение, активизирующее глюкагоновый рецептор, можно вводить одновременно с соединением, активизирующим GLP-1 рецептор (таким как аналог GLP-1, аналог экзендина-4 либо их производные). Изобретение предусматривает также одновременное введение аналога агониста глюкагона с аналогом агониста GLP-1. Такие способы лечения гипергликемии и/или снижения аппетита либо инициирования уменьшения массы тела включают введение аналога глюкагона с модификацией в положении 12 (например, Arg12),факультативно в сочетании с модификациями в положении 16 и/или 20. Способы, соответствующие настоящему изобретению, включают также введение аналогов глюкагона, имеющих внутримолекулярный мостик между боковыми цепями двух аминокислот в пределах участка аминокислот 12 и 29, которые разделяются тремя расположенными между ними аминокислотами, например положения 12 и 16, положения 13 и 17 (например, Lys13Glu17 либо Glu13Lys17), положения 16 и 20, положения 17 и 21 (например, Lys17Glu21 либо Glu17Lys21), положения 20 и 24 либо положения 24 и 28, при факультативном условии, что аминокислота в положении 9 не является Glu, и факультативно содержащих С-концевой амид либо сложный эфир. В соответствии с одним из вариантов осуществления настоящего изобретения из числа таких молекул-коагонистов глюкагона/GLP-1 исключаются любые аналоги глюкагона либо аналоги GLP-1, которые согласно известному уровню техники пригодны для применения в таком способе. В другом варианте осуществления настоящего изобретения пептиды, описанные в патенте США 6864069, действующие как агонист GLP-1 и антагонист глюкагона при лечении диабета, также исключаются из числа молекулкоагонистов глюкагона/GLP-1. В другом варианте осуществления настоящего изобретения при лечении диабета исключается применение антагонистов глюкагона, таких как антагонисты, описанные в публикациях Unson et al., J. Biol. Chem., 264:789-794 (1989), Ahn et al., J. Med. Chem., 44:3109-3116 (2001) иSapse et al., Mol. Med., 8(5):251-262 (2002). В другом варианте осуществления настоящего изобретения оксинтомодулин или аналог глюкагона, который содержит 8 С-концевых аминокислот оксинтомодулина(последовательность SEQ ID NO: 27), также исключаются из числа молекул-коагонистов глюкагона/GLP-1. Ожидается, что такие способы лечения гипергликемии будут пригодны для лечения гипергликемии различных типов, в том числе диабета, сахарного диабета типа I, сахарного диабета типа II, диабета беременных, как инсулинозависимых, так и инсулинонезависимых, и сокращения количества осложнений,обусловленных диабетом, в том числе нефропатии, ретинопатии и сосудистых заболеваний. Предполагается, что такие способы снижения аппетита либо инициирования уменьшения массы тела будут пригодны для уменьшения массы тела, снижения прироста массы тела, лечения ожирения различной этиологии,включая ожирение, инициированное лекарственными препаратами, и сокращения количества осложнений, связанных с ожирением, в том числе сосудистых заболеваний (коронарная болезнь сердца, инсульт,заболевания периферических сосудов, ишемическая реперфузия и т.п.), гипертензии, начальной стадии диабета типа II, гиперлипидемии, болезней костно-мышечной системы. Все терапевтические способы, фармацевтические композиции, наборы и другие подобные варианты осуществления, описанные в настоящем изобретении, предусматривают, что применение термина "аналоги глюкагона" охватывает все его фармацевтически приемлемые соли либо сложные эфиры. Краткое описание чертежей Фиг. 1 - столбиковая диаграмма, представляющая стабильность глюкагона Cys21-малеимидо-PEG5K,инкубированного при 37 С в течение 24, 48, 72, 96, 144 и 166 ч соответственно. Фиг. 2 представляет данные, полученные посредством HPLC анализа глюкагона Cys21-малеимидоPEG5K при рН 5, инкубированного при 37 С в течение 24, 72 или 144 ч соответственно. Фиг. 3 представляет данные, показывающие рецептор-опосредованное индуцирование цАМФ аналогами глюкагона. Конкретнее, на фиг. 3 сравнивается индуцирование глюкагонового рецептора аналогами глюкагона Е 16, K20 , Е 15, Е 16 , Е 16, K20 , Е 15, Е 16 , Е 16 и Gluc-NH2 . Фиг. 4 А и 4 В представляют данные, показывающие рецептор-опосредованное индуцирование цАМФ аналогами глюкагона. Конкретнее, на фиг. 4 А сравнивается индуцирование глюкагонового рецептора аналогами глюкагона Gluc-NH2 , E16Gluc-NH2 , Е 3, E16Gluc-NH2 , Orn3, E16Gluc-NH2 иNle3, E16Gluc-NH2 по сравнению с нативным глюкагоном , в то время как на фиг. 4 В сравнивается индуцирование GLP-1-рецептора аналогами глюкагона Gluc-NH2 , E16Gluc-NH2 , Е 3, E16Gluc-NH2, Orn3, E16Gluc-NH2 и Nle3, E16Gluc-NH2 по сравнению с нативным GLP-1 . Фиг. 5 А и 5 В представляют данные, показывающие рецептор-опосредованное индуцирование цАМФ аналогами глюкагона. Конкретнее, на фиг. 5 А сравнивается индуцирование глюкагонового рецептора аналогами глюкагона (Е 16, K20 Gluc-NH2 (5 нМ, концентрированный раствор), Е 15, E16GlucNH2(10 нМ, концентрированный рас(10 нМ, концентрированный раствор) и Е 16 Gluc-NH2 ) по сравнению с твор), Е 15, Е 16 Gluc-NH2 глюкагоном-NH2 ( ), в то время как на фиг. 5 В сравнивается индуцирование GLP-1-рецептора аналогами глюкагона (Е 16, K20 Gluc-NH2 , Е 15, E16Gluc-NH2 и E16 Gluc-NH2 ) по сравнению с GLP-1( ) и NH2-глюкагоном ( ). Фиг. 6 А и 6 В представляют данные, показывающие рецептор-опосредованное индуцирование цАМФ аналогами глюкагона. Конкретнее, на фиг. 6 А сравнивается индуцирование глюкагонового рецептора аналогами глюкагона (Gluc-NH2 , K12 Е 16-NH2-лактам, Е 16K20-NH2-лактам , K20 Е 24NH2-лактам и Е 24K28-NH2-лактам ) по сравнению с глюкагоном ( ), в то время как на фиг. 6 В сравнивается индуцирование GLP-1-рецептора аналогами глюкагона (Gluc-NH2 , K12 Е 16-NH2-лактам, Е 16K20-NH2-лактам , K20E24-NH2-лактам и Е 24K28-NH2-лактам ) по сравнению с GLP-1 ( ). Фиг. 7 А и 7 В представляют данные, показывающие рецептор-опосредованное индуцирование цАМФ аналогами глюкагона. Конкретнее, на фиг. 7 А сравнивается индуцирование глюкагонового рецептора аналогами глюкагона (Gluc-NH2 , E16 Gluc-NH2 , K12, E16 Gluc-NH2-лактам , E16, K20Gluc-NH2 и E16, K20 Gluc-NH2-лактам ) по сравнению с глюкагоном ( ), в то время как на фиг. 7 В сравнивается индуцирование GLP-1-рецептора аналогами глюкагона (Gluc-NH2 , E16Gluc-NH2 , K12,E16 Gluc-NH3-лактам , Е 16, K20 Gluc-NH2 и E16, K20 Gluc-NH2-лактам ) по сравнению с GLP-1( ). Фиг. 8A-8F представляют данные, показывающие рецептор-опосредованное индуцирование цАМФ аналогами глюкагона на глюкагоновом рецепторе (фиг. 8 А, 8 С и 8 Е) или на GLP-1-рецепторе (фиг. 8 В,8 С и 8F), где hE - гомоглутаминовая кислота и hC - гомоцистеиновая кислота. Фиг. 9 А и 9 В представляют данные, показывающие рецептор-опосредованное индуцирование цАМФ аналогами глюкагона GLP-1 (17-26), где аминокислоты в положениях 17-26 нативного глюкагона(последовательность SEQ ID NO: 1) были заменены аминокислотами положений 17-26 нативного GLP-1(последовательность SEQ ID NO: 50). Конкретнее, на фиг. 9 А сравнивается индуцирование глюкагонового рецептора сконструированными аналогами глюкагона GLP-1 (17-26), а на фиг. 9 В сравнивается индуцирование GLP-1-рецептора сконструированными аналогами глюкагона GLP-1 (17-26). На фиг. 10 А-Е показаны диаграммы, представляющие in vivo данные, проявляющие способность глюкагоновых пептидов, соответствующих настоящему изобретению, инициировать снижение массы мышами, которым подкожным путем были введены указанные количества соответствующих соединений. Идентификаторы последовательностей для глюкагонового пептида, перечисленные на фиг. 10 А 10 Е, выглядят следующим образом, для фиг. 10 А: химера 2 Aib2 C24 40K PEG (SEQ ID NO: 486), Aib2C24 химера 2 40K лактам (SEQ ID NO: 504) и Aib2 E16 K20 Gluc-NH2 Lac 40K (SEQ ID NO: 528); фиг. 10 В: Aib2 C24 Chi 2 лактам 40K (SEQ ID NO: 504), DMIA1 C24 Chi 2 лактам 40K (SEQ ID NO: 505), химера 2 DMIA1 C24 40K (SEQ ID NO: 519) и химера 2 Aib2 C24 40K (SEQ ID NO: 486), где цифра в конце последовательности обозначает использованную дозировку, 70 либо 350 нмоль/кг; фиг. 10 С: AIB2 без лактама С 24 40K (SEQ ID NO: 504), AIB2 Е 16 K20 без лактама С 24 40K (SEQ ID NO: 528), DMIA1 Е 16(SEQ ID NO: 510) и DMIA1 E16 K20 без лактама/Сех C24 40K (SEQ ID NO: 513), где цифра в конце последовательности обозначает использованную дозировку, 14 либо 70 нмоль/кг/неделя; фиг. 10 Е: AIB2 без лактама С 24 40K (SEQ ID NO: 486), Chi 2 AIB2 С 24 CEX 40K (SEQ ID NO: 533), AIB2 E16 A18 K20CEX C40 C41-2 (SEQ ID NO: 532), AIB2 без лактама CEX C24 C40-2 (SEQ ID NO: 531) и AIB2 без лактама С 24 60K (SEQ ID NO: 498), где обозначение 40K или 60K представляет молекулярную массу полиэтиленгликолевой цепи, присоединенной к глюкагоновому пептиду. Фиг. 11-13 - графики и диаграмма, представляющие in vivo данные, демонстрирующие способность ацилированных глюкагоновых пептидов стимулировать уменьшение массы тела (фиг. 11), уменьшать потребление корма (фиг. 12) и снижать уровень глюкозы в крови (фиг. 13) у мышей, которым подкожным путем были введены указанные количества упомянутых соединений. Фиг. 14 А и 14 В иллюстрируют данные, показывающие индуцирование цАМФ аналогами глюкагона, опосредованное глюкагоновым рецептором и GLP-1-рецептором соответственно. Фиг. 15 представляет собой график уровня глюкозы в крови (мг/дл) в зависимости от времени (мин) у мышей линии DIO, которым вводили только носитель в дозе 2 нмоль/кг (треугольники), Химеру-2PEG (перевернутые треугольники) с последующей глюкозной нагрузкой через 15 мин после введения пептида. Фиг. 16 представляет собой график уровня глюкозы в крови (мг/дл) в зависимости от времени (мин) у мышей линии DIO, которым вводили только носитель в дозе 20 нмоль/кг (треугольники), Химеру-2PEG (перевернутые треугольники) с последующей глюкозной нагрузкой через 15 мин после введения пептида. Фиг. 17 представляет собой график уровня глюкозы в крови (мг/дл) в зависимости от времени (мин) у мышей линии DIO, которым вводили только носитель в дозе 70 нмоль/кг (перевернутые треугольники),Химеру-2 AIB2, K10-С 8 Cys24-40 кДа PEG (незакрашенные треугольники), Химеру-2 AIB2, K10-С 16 Cys2440 кДа PEG (ромбы) либо Химеру-2 AIB2, Cys24-40 кДа PEG (незакрашенные квадраты) с последующей глюкозной нагрузкой через 15 мин после введения пептида. Фиг. 18 представляет собой график уровня глюкозы в крови (мг/дл) в зависимости от времени (мин) у мышей линии DIO, которым вводили только носитель в дозе 70 нмоль/кг (перевернутые треугольники),Химеру-2 AIB2, K10-С 8 Cys24-40 кДа PEG (незакрашенные треугольники), Химеру-2 AIB2, K10-С 16 Cys2440 кДа PEG (ромбы) либо Химеру-2 AIB2, Cys24-40 кДа PEG (незакрашенные квадраты) с последующей глюкозной нагрузкой через 24 ч после введения пептида. Фиг. 19 представляет собой график изменения массы тела (%) в зависимости от времени (дни) у мышей линии DIO, которым вводили только носитель в дозе 15 либо 70 нмоль/кг (ромбы со сплошной линией); Химеру-2 AIB2, Cys24-40 кДа PEG (15 нмоль/кг, незакрашенные ромбы с пунктирной линией; 70 нмоль/кг, незакрашенные треугольники со сплошной линией); Химеру-2 AIB2, K10-C8 Cys24-40 кДа PEG(15 нмоль/кг, закрашенные треугольники с пунктирной линией; 70 нмоль/кг, закрашенные треугольники со сплошной линией); Химеру-2 AIB2, K10-С 16 Cys24-40 кДа PEG (15 нмоль/кг, перевернутые треугольники с пунктирной линией; 70 нмоль/кг, перевернутые треугольники со сплошной линией). Фиг. 20 представляет собой диаграмму общего изменения массы тела (%) у мышей через 14 дней после введения один раз в неделю пептида А K10-С 14 в дозе 10, 20, 40 либо 80 нмоль/кг или Химеры-2AIB2, K10-С 8 Cys24-40 кДа либо контрольного носителя в дозе 20 нмоль/кг. Фиг. 21 представляет собой график уровня глюкозы в крови (мг/дл) в ответ на введение глюкозы мышам, которым вводили пептид А K10-С 14 в дозе 10, 20, 40 либо 80 нмоль/кг, или Химеру-2 AIB2, K10 С 8 Cys24-40 кДа либо контрольный носитель в дозе 20 нмоль/кг за 24 ч до введения глюкозы. Фиг. 22 представляет собой диаграмму общего изменения массы тела (%) мышей, которым вводили контрольный носитель, лираглутид, (С 16) глюкагонамид, Е-Е-С 16 глюкагонамид, АА-С 16 глюкагонамид либо АА-С 16 глюкагонамид в указанной дозе. Фиг. 23 представляет собой диаграмму жировой массы (г) по результатам определения на 7 день эксперимента на мышах, которым вводили контрольный носитель, лираглутид, (С 16) глюкагонамид, ЕЕ-С 16 глюкагонамид, АА-С 16 глюкагонамид либо АА-С 16 глюкагонамид в указанной дозе. Фиг. 24 представляет собой диаграмму изменения уровня глюкозы в крови (мг/дл; уровень на 7 день, минус уровень в 0 день) мышей, которым вводили контрольный носитель, лираглутид, (С 16) глюкагонамид, Е-Е-С 16 глюкагонамид, АА-С 16 глюкагонамид либо АА-С 16 глюкагонамид в указанной дозе. Фиг. 25 представляет собой график изменения среднего значения остаточного коэффициента эллиптичности в зависимости от длины волны (нм) для пептида X-PEG либо пептида Y-PEG в 10 мМ фосфатном буфере (рН 5,9) либо без 10% раствора TFE. Фиг. 26 представляет собой график продуцирования цАМФ (%) в ответ на связывание глюкагона,GLP-1, пептида X, пептида X-PEG, пептида Y или пептида Y-PEG с глюкагоновым рецептором (слева) либо GLP-1-рецептором (справа) в зависимости от концентрации пептида (нМ). Фиг. 27 представляет собой график и диаграммы, демонстрирующие воздействие in vivo на А) массу тела, В) жировую массу, С) потребление корма и D) уровень глюкозы в крови натощак у мышей с ожирением, вызванным рационом, которым в течение одной недели вводили контрольный носитель,пептид X-PEG либо пептид Y-PEG. Конкретнее, фиг. 27 А представляет собой кривую % изменения массы тела (BW) в зависимости от времени (дни), фиг. 27 В представляет собой диаграмму процента изменения жировой массы, определенной на 7 день (по сравнению с результатами определения исходной жировой массы), фиг. 27 С представляет собой диаграмму общего потребления корма (г) за период проведения исследований по данным, полученным на 7 день, и фиг. 27D представляет собой диаграмму изменения уровня содержания глюкозы в крови (мг/дл) по данным, полученным на 7 день (по сравнению с исходным уровнем глюкозы в крови). Фиг. 28 представляет собой графики и диаграммы, демонстрирующие воздействие in vivo на массу тела (фиг. 28 А и 28 С) и уровень глюкозы в крови натощак (фиг. 28 В и 28D) у мышей, которым вводили пептид X-PEG (фиг. 28 А и 28 В) либо пептид Y-PEG (фиг. 28 С и 28D) в различных дозах(нмоль/кг/неделя). Фиг. 29 представляет собой графики и диаграммы, демонстрирующие воздействие in vivo на А) массу тела (BW), В) жировую массу тела, С) общее потребление корма, D) расход энергии, Е) дыхательный коэффициент, F) двигательную активность, G) уровень глюкозы в крови натощак, Н) переносимость глюкозы и I) общий уровень инсулина в плазме мышей с ожирением, вызванным рационом, которым в течение одного месяца вводили контрольный носитель, пептид X-PEG либо пептид Y-PEG. Фиг. 30 представляет собой графики и диаграммы, демонстрирующие воздействие in vivo на производившиеся в течение 3 недель калориметрические измерения А) потребления корма, В) общего расхода энергии, С) общего дыхательного коэффициента, D) двигательной активности, Е) общей двигательной активности, F) площади под кривой пробы на переносимость глюкозы, вводимой внутрибрюшинным путем (ipGTT), G) уровня пептида С в плазме, Н) уровня экспрессии PEPCK/HPRT (в кратном размере) иI) уровня экспрессии G6P/HPRT (в кратном размере) у мышей с ожирением, вызванным рационом, которым в течение одного месяца вводили контрольный носитель, пептид X-PEG либо пептид Y-PEG. Фиг. 31 представляет собой график и диаграммы, демонстрирующие воздействие in vivo на уровни А) холестерина, В) холестерина FPLC, С) триглицеридов, D) лептинов, Е) резистина и F) адипонектина в плазме крови мышей с ожирением, вызванным рационом, которым в течение одного месяца вводили контрольный носитель, пептид X-PEG либо пептид Y-PEG. Фиг. 32 представляет собой диаграммы, демонстрирующие воздействие in vivo на А) уровень экспрессии ВАТ UCP-1 и В) белую жировую ткань, определяемое по степени фосфорилирования гормончувствительной липазы (pHSL) у мышей, которым вводили контрольный носитель, пептид X-PEG либо пептид Y-PEG. Фиг. 33 представляет собой диаграммы, демонстрирующие воздействие in vivo контрольного носителя, пептида X-PEG либо пептида Y-PEG у крыс линии DIO на А) массу тела и В) жировую массу. Фиг. 33 С представляет собой диаграмму относительной экспрессии CD68/TFIIB по результатам количественного определения посредством ОТ-ПЦР в реальном масштабе времени в жировой ткани придатка яичек,полученной от мышей, которым в течение двух недель вводили пептид Y-PEG, пептид X-PEG либо носитель. Данные представлены как относительная экспрессия мРНК CD68, нормализованная по экспрессии мРНК TFIIB, и выражены в виде среднего значениясредняя квадратическая ошибка среднего. Фиг. 34A-F представляют собой графики и диаграммы, демонстрирующие воздействие in vivo на массу тела (BW; 34A и 34 В), жировую массу (34 С), потребление корма (34D) и уровень глюкозы в крови(34 Е и 34F) у мышей с блокированным GLP-1-R, которым вводили контрольный носитель, пептид XPEG либо пептид Y-PEG. Фиг. 35 А-С представляют собой график и диаграммы, демонстрирующие воздействие in vivo на массу тела (35 А), уровень глюкозы в крови (35 В) и жировую массу (35 С) у мышей линии DIO, которым вводили контрольный носитель, пептид V либо пептид U. Подробное описание Определения. В описании и формуле изобретения будет применяться следующая терминология, соответствующая определениям, приведенным ниже. Термин "фармацевтически приемлемый носитель", применяемый в настоящем описании, охватывает любой из обычных фармацевтических носителей, таких как забуференный фосфатом солевой раствор,вода, эмульсии, такие как эмульсия масло-в-воде либо эмульсия вода-в-масле, и увлажняющие средства различных типов. Упомянутый термин охватывает также любой из агентов, одобренных органом регулирования федерального правительства США или приведенных в Фармакопее США для применения на животных, включая людей. Термин "фармацевтически приемлемая соль", применяемый в настоящем описании, обозначает соли соединений, которые сохраняют биологическую активность исходного соединения и которые не являются нежелательными ни в биологическом, ни в других отношениях. Многие соединения, описанные в настоящем изобретении, способны образовывать кислые и/или основные соли вследствие присутствия аминогрупп и/или карбоксильных групп либо групп, им подобных. Фармацевтически приемлемые соли с основаниями могут быть получены из неорганических и органических оснований. К числу солей, производных неорганических оснований, относятся (только в качестве примера) соли натрия, калия, лития, аммония, кальция и магния. К числу солей, производных органических оснований, относятся (но ими не ограничиваются) соли первичных, вторичных и третичных аминов. Фармацевтически приемлемые соли с кислотами могут быть получены из неорганических и органических кислот. К числу солей, производных неорганических кислот, относятся соли хлористоводородной кислоты, бромисто-водородной кислоты, серной кислоты, азотной кислоты, фосфорной кислоты и т.п. К числу солей, производных органических кислот, относятся соли уксусной кислоты, пропионовой кислоты, гликолевой кислоты, пировиноградной кислоты, щавелевой кислоты, яблочной кислоты, малоновой кислоты, янтарной кислоты, малеиновой кислоты, фумаровой кислоты, винной кислоты, лимонной кислоты, бензойной кислоты, коричной кислоты, миндальной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, п-толуолсульфоновой кислоты, салициловой кислоты и т.п. Термин "лечение", применяемый в настоящем описании, охватывает профилактику определенного расстройства либо состояния или облегчение тяжести симптомов, связанных с определенным расстройством либо состоянием, и/или предотвращение либо ликвидацию упомянутых симптомов. Например,термин "лечение диабета", применяемый в настоящем описании, будет, в общем, относиться к изменению уровня глюкозы в крови в направлении нормального уровня и может включать повышение или снижение уровня глюкозы в крови в зависимости от конкретной ситуации. Определение "эффективное количество" или "терапевтически эффективное количество" глюкагонового пептида, применяемое в настоящем описании, обозначает нетоксическое, но достаточное количество пептида для обеспечения достижения желаемого эффекта. Например, одним из желаемых эффектов было бы предотвращение либо лечение гипогликемии, действенность которого определяют, например,по повышению уровня глюкозы в крови. Альтернативным желаемым эффектом для аналогов коагонистов, описанных в настоящем изобретении, было бы также лечение гипергликемии, действенность которого определяют, например, по незначительному отклонению уровня глюкозы в крови от нормального,либо инициирование уменьшения массы тела/снижение прироста массы тела, действенность которых определяют, например, по уменьшению массы тела, либо предотвращение или снижение прироста массы тела, или нормализация распределения жирового компонента тела. Количество, являющееся "эффективным", будет отличаться от субъекта к субъекту в зависимости от возраста и общего состояния индивида,способа введения и т.п. Таким образом, не всегда возможно определить точное "эффективное количество". Однако подходящее "эффективное количество" в любом отдельном случае может быть определено специалистом в этой области на основе общепринятой практики экспериментирования. Термин "парентерально" обозначает введение не через пищеварительный тракт, а каким-либо иным путем, например подкожным, внутримышечным, интраспинальным либо внутривенным. Термин "очищенный" и подобные термины, применяемые в настоящем описании, относятся к выделению молекулы или соединения в форме, являющейся, по существу, свободной от примесей, которые,как правило, связываются с молекулой либо соединением в нативном либо природном окружении. Термин "очищенный", применяемый в настоящем описании, не означает абсолютной чистоты; этот термин,скорее, применяется в качестве относительного определения. Словосочетание "очищенный полипептид" применяется здесь для описания полипептида, который был отделен от других соединений, в том числе(но без ограничения) от молекул нуклеиновых кислот, липидов и углеводов. Термин "выделенный" обозначает удаление эталонного материала из его естественного окружения(например, природного окружения, если он встречается в естественных условиях). Например, естествен- 16019203 но встречающийся полинуклеотид, присутствующий в живом животном, не является выделенным, но тот же самый полинуклеотид, отделенный от некоторой части либо всех сосуществующих в природной системе материалов, является выделенным. Термин "пептид", применяемый в настоящем описании, обозначает последовательность из 3 или более аминокислот, как правило, меньше чем 50 аминокислот, где упомянутые аминокислоты являются естественными либо искусственными аминокислотами. Искусственные аминокислоты означают аминокислоты, которые не встречаются in vivo в природных условиях, но которые, тем не менее, могут быть включены в пептидные структуры, описание которых приведено в этом изобретении. Термины "полипептид" и "белок", применяемые в настоящем описании, представляют собой термины, применяемые взаимозаменяемо для обозначения полимера аминокислот, независимо от длины упомянутого полимера. Длина полипептидных и белковых полимеров, как правило, превосходит длину"пептидов". Словосочетание "глюкагоновый пептид", применяемое в настоящем описании, обозначает любой пептид, содержащий либо аминокислотную последовательность SEQ ID NO: 1 или любой аналог аминокислотной последовательности SEQ ID NO: 1, включая замены аминокислот, добавления, делеции или посттрансляционные модификации (например, метилирование, ацилирование, убиквитирование, внутримолекулярное ковалентное связывание, такое как образование лактамных мостиков, пэгилирование и т.п.) пептида, где упомянутый аналог стимулирует активность глюкагонового рецептора или GLP-1 рецептора, что определяется, например, по уровню продуцирования цАМФ с помощью анализа, описание которого приведено в примере 14. Словосочетание "агонист глюкагона" обозначает комплексное соединение, содержащее глюкагоновый пептид, который стимулирует активность глюкагонового рецептора, что определяется, например, по уровню продуцирования цАМФ с помощью анализа, описание которого приведено в примере 14. Словосочетание "аналог агониста глюкагона", применяемое в настоящем описании, обозначает глюкагоновый пептид, содержащий последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 иSEQ ID NO: 15, либо аналог такой последовательности, которая была модифицирована с включением одной или нескольких консервативных аминокислотных замен в одном или нескольких положениях 2, 5,7, 10, 11, 12, 13, 14, 17, 18, 19, 20, 21, 24, 27, 28 или 29. Термин "модификация" аминокислоты, применяемый в настоящем описании, обозначает замену,добавление либо делецию аминокислоты и охватывает замену любой из 20 аминокислот либо добавление любой из 20 аминокислот, которые обычно входят в состав человеческих белков, а также атипичных либо искусственных аминокислот. Все ссылки в описании на конкретные номера положений аминокислоты (например, положение 28) относятся к аминокислоте в этом положении в нативном глюкагоне (последовательность SEQ ID NO: 1) либо к положению соответствующей аминокислоты в любом из его аналогов. Например, ссылка в описании на "положение 28" будет обозначать соответствующее положение 27 для аналога глюкагона, в котором первая аминокислота последовательности SEQ ID NO: 1 была удалена. Подобным же образом, ссылка в описании на "положение 28" будет обозначать соответствующее положение 29 для аналога глюкагона, у которого перед N-концом последовательности SEQ ID NO: 1 была добавлена одна аминокислота. К числу имеющихся на рынке источников атипичных аминокислот относятся компания Sigma-Aldrich (Milwaukee, штат Висконсин), компания ChemPep Inc. (Miami, штат Флорида) и компания Genzyme Pharmaceuticals (Cambridge, штат Массачусетс). Атипичные аминокислоты могут быть закуплены от коммерческих поставщиков, синтезированы de novo. химически модифицированы либо получены из других аминокислот. Словосочетание "коагонист глюкагона", применяемое в настоящем описании, обозначает глюкагоновый пептид, проявляющий активность на глюкагоновом рецепторе, уровень которой составляет по меньшей мере от приблизительно 10 до приблизительно 500% или более по сравнению с нативным глюкагоном, и также проявляющий активность на GLP-1-рецепторе, уровень которой составляет по меньшей мере от приблизительно 10 до приблизительно 200% или более по сравнению с нативным GLP-1. Словосочетание "молекула коагониста глюкагона/GLP-1", применяемое в настоящем описании,обозначает молекулу, проявляющую активность на глюкагоновом рецепторе, уровень которой составляет по меньшей мере приблизительно 10% по сравнению с нативным глюкагоном, и также проявляющую активность на GLP-1-рецепторе, уровень которой составляет по меньшей мере приблизительно 10% по сравнению с нативным GLP-1. Термин "нативный глюкагон", применяемый в настоящем описании, обозначает пептид, содержащий последовательность SEQ ID NO: 1; термин "нативный GLP-1" представляет собой обобщающий термин, обозначающий амид GLP-1(7-36) (содержащий последовательность SEQ ID NO: 52), кислотуGLP-1(1-37) (содержащую последовательность SEQ ID NO: 50) либо смесь двух этих соединений. Общая ссылка в этом описании на "глюкагон" либо "GLP-1", при отсутствии любых дополнительных определений, обозначает нативный глюкагон либо нативный GLP-1 соответственно. Термин "замена" аминокислоты, применяемый в настоящем описании, обозначает замену одного остатка аминокислоты другим остатком аминокислоты. Словосочетание "консервативная замена аминокислоты", применяемое в настоящем описании, определяется как замена в пределах одной из пяти приведенных ниже групп.I. Небольшие алифатические, неполярные либо немного полярные остатки: Ala, Ser, Thr, Pro, Gly.II. Полярные, отрицательно заряженные остатки и их амиды и сложные эфиры: Asp, Asn, Glu, Gln,цистеиновая кислота и гомоцистеиновая кислота.V. Большие ароматические остатки: Phe, Tyr, Trp, ацетилфенилаланин. Обобщающее словосочетание "полиэтиленгликолевая цепь" или "PEG-цепь", применяемое в настоящем описании, обозначает смеси конденсационных полимеров этиленоксида и воды, в виде разветвленной или неразветвленной цепи, представленной общей формулой H(OCH2CH2)nOH, где n равняется не менее 9. При отсутствии любых дополнительных определений упомянутое словосочетание обозначает полимеры этиленгликоля с усредненным значением молекулярной массы, выбранным в пределах от 500 до 40000 Да. Словосочетание "полиэтиленгликолевая цепь" или "PEG-цепь" применяется в сочетании с числовым индексом для обозначения ее приблизительной средней молекулярной массы. Например, PEG5000 означает полиэтиленгликолевую цепь, имеющую усредненное значение молекулярной массы приблизительно 5000 Да. Термин "пэгилированный" и подобные термины, применяемые в настоящем описании, относятся к соединению, которое было модифицировано по сравнению с его нативным состоянием посредством присоединения к упомянутому соединению полиэтиленгликолевой цепи. "Пэгилированный глюкагоновый пептид" представляет собой глюкагоновый пептид, имеющий полиэтиленгликолевую цепь, ковалентно присоединенную к упомянутому глюкагоновому пептиду. Термин "пептид", который применяется в настоящем описании, охватывает пептиды, имеющие модифицированные амино- и карбоксильные концы. Например, аминокислотная цепь, содержащая амидную группу вместо концевой карбоксильной группы, определяется аминокислотной последовательностью, состоящей из стандартных аминокислот. Термин "линкер", применяемый в настоящем описании, обозначает связь, молекулу либо группу молекул, соединяющую две отдельные составляющие одна с другой. Линкеры могут определять оптимальное пространственное размещение двух составляющих или же могут дополнительно обеспечивать лабильную связь, которая предоставляет возможность взаимного разделения двух составляющих. К числу лабильных связей относятся фоторасщепляемые группы, нестойкие к воздействию кислот группы,нестойкие к воздействию оснований группы и расщепляемые ферментами группы. Термин "димер", применяемый в настоящем описании, обозначает комплексное соединение, содержащее две субъединицы, ковалентно присоединенные одна к другой посредством линкера. Термин "димер", в случае его применения без каких-либо определений, обозначает как гомодимеры, так и гетеродимеры. Гомодимер содержит две идентичные субъединицы, в то время как гетеродимер содержит две субъединицы, которые различаются, несмотря на то, что две упомянутые субъединицы являются по сути подобными одна другой. Словосочетание "заряженная аминокислота", применяемое в настоящем описании, означает аминокислоту, которая содержит боковую цепь, отрицательно заряженную (т.е. депротонированную) или положительно заряженную (т.е. протежированную), в водном растворе при физиологическом рН. Например, к числу отрицательно заряженных аминокислот относятся аспарагиновая кислота, глутаминовая кислота, цистеиновая кислота, гомоцистеиновая кислота и гомоглутаминовая кислота, в то время как к числу положительно заряженных аминокислот относятся аргинин, лизин и гистидин. К заряженным аминокислотам относятся заряженные аминокислоты из числа 20 аминокислот, обычно обнаруживаемых в человеческих белках, а также атипичные либо искусственные аминокислоты. Словосочетание "кислая аминокислота", применяемое в настоящем описании, означает аминокислоту, которая содержит вторую кислую составляющую, включая, например, карбоксильную либо сульфокислотную группы. Термин "алкил" означает линейный либо разветвленный углеводород, содержащий конкретно указанное количество атомов углерода. К примерам алкилов относятся метил, этил и линейные пропиловые группы. Термин "гетероалкил" означает линейный либо разветвленный углеводород, содержащий конкретно указанное количество атомов углерода и по меньшей мере один гетероатом в каркасе структуры. К числу пригодных для целей настоящего изобретения гетероатомов относятся (но ими не ограничиваются) N, S и О. Варианты осуществления. Настоящее изобретение предлагает глюкагоновые пептиды с повышенной либо пониженной активностью на глюкагоновом рецепторе или на GLP-1-рецепторе либо на обоих рецепторах. Настоящее изобретение предлагает также глюкагоновые пептиды с измененной селективностью в отношении глюкагонового рецептора по сравнению с GLP-1-рецептором. Повышенная активность на глюкагоновом рецепторе обеспечивается модификацией аминокислоты в положении 16 нативного глюкагона (последовательность SEQ ID NO: 1), как описано в настоящем изобретении. Поддерживаемая на одинаковом уровне либо повышенная активность на глюкагоновом рецепторе обеспечивается также посредством модификации аминокислоты в положении 3 аналогом глутамина (например, (Dab(Ac. Пониженная активность на глюкагоновом рецепторе обеспечивается, например, посредством замены аминокислоты в положении 3 кислой, основной либо гидрофобной аминокислотой, как описано в настоящем изобретении. Повышенная активность на GLP-1-рецепторе обеспечивается посредством замены карбоновой кислоты С-концевой аминокислоты группой с нейтральным зарядом, такой как амидная или сложноэфирная группа. Повышенная активность на GLP-1-рецепторе обеспечивается модификациями, которые стабилизируют альфа-спиральную структуру С-концевого участка глюкагона (например, вблизи остатков 12-29). В некоторых вариантах осуществления настоящего изобретения такие модификации обеспечивают образование внутримолекулярного мостика между боковыми цепями двух аминокислот, которые разделены тремя расположенными между ними аминокислотами, например аминокислот, находящихся в положениях 12 и 16, или 16 и 20, или 20 и 24, как описано в настоящем изобретении. В других вариантах осуществления настоящего изобретения такие модификации включают модификации, представляющие собой вставки либо замены, посредством которых вводится одна или несколько ,-дизамещенных аминокислот, например AIB, в одном или нескольких положениях 16, 20, 21 или 24. Повышенная активность на GLP-1-рецепторе и глюкагоновом рецепторе пептидов, не имеющих внутримолекулярного мостика, например ковалентного внутримолекулярного мостика, обеспечивается посредством ковалентного присоединения ацильной либо алкильной группы к боковой цепи аминокислоты в положении 10 пептида, где упомянутая ацильная либо алкильная группа не является нативной для аминокислоты в положении 10. Дальнейшая повышенная активность на GLP-1-рецепторе и глюкагоновом рецепторе таких пептидов, не имеющих внутримолекулярного мостика, например ковалентного внутримолекулярного мостика, может быть достигнута посредством включения спейсера между ацильной либо алкильной группой и боковой цепью аминокислоты в положении 10. Подходящие спейсеры описаны в настоящем изобретении и включают (но ими не ограничиваются) спейсеры длиной от 3 до 10 атомов. Повышенная активность на GLP-1-рецепторе обеспечивается модификацией аминокислоты в положении 20, как описано в настоящем изобретении. Повышенная активность на GLP-1-рецепторе обеспечивается у глюкагоновых аналогов, содержащих С-концевой удлиняющий сегмент (последовательность SEQ ID NO: 26). Активность GLP-1 у таких аналогов, содержащих последовательность SEQ ID NO: 26, может быть дополнительно повышена посредством модифицирования аминокислоты в положении 18, 28 или 29 либо в положении 18 и 29, как описано в настоящем изобретении. Восстановление глюкагоновой активности, которая была снижена модификациями аминокислот в положениях 1 и 2, обеспечивается посредством ковалентной связи между боковыми цепями двух аминокислот, отделенных тремя расположенными между ними аминокислотами, например аминокислот, находящихся в положениях 12 и 16, или 16 и 20, или 20 и 24, как описано в настоящем изобретении. Дальнейшее незначительное повышение эффективности GLP-1 обеспечивается посредством модифицирования аминокислоты в положении 10, представляющей собой Trp. Любая из описанных выше модификаций, которая повышает или снижает активность на глюкагоновом рецепторе и которая повышает активность на GLP-1-рецепторе, может применяться отдельно либо в комбинации. Любая из описанных выше модификаций может также комбинироваться с другими модификациями, которые придают другие желаемые свойства, такие как повышенная растворимость, и/или стабильность, и/или продолжительность действия. Альтернативно, любая из описанных выше модификаций может комбинироваться с другими модификациями, которые не оказывают существенного влияния на растворимость, стабильность либо активность. Модификации, приведенные в качестве примера,включают (но ими не ограничиваются):(А) улучшение растворимости, например, посредством введения одной заряженной аминокислоты,двух, трех или более заряженных аминокислот в состав С-концевого участка нативного глюкагона, предпочтительно в положении, расположенном ближе к С-концу относительно положения 27. Такая заряженная аминокислота может вводиться посредством замены нативной аминокислоты на заряженную аминокислоту, например, в положениях 28 или 29, либо же альтернативно посредством добавления заряженной аминокислоты, например, после положения 27, 28 или 29. В некоторых вариантах осуществления настоящего изобретения одна, две, три либо все заряженные аминокислоты имеют отрицательный заряд. В других вариантах осуществления настоящего изобретения одна, две, три либо все заряженные аминокислоты имеют положительный заряд. Такие модификации повышают растворимость, например обеспечивают повышение растворимости по меньшей мере в 2, 5, 10, 15, 25, 30 раз или более по сравнению с на- 19019203 тивным глюкагоном при значении рН, которое составляет от приблизительно 5,5 до 8, например рН 7,при определении через 24 ч при температуре 25 С;(B) повышение растворимости и продолжительности действия либо полупериода существования в системе кровообращения посредством добавления гидрофильной составляющей, такой как полиэтиленгликолевая цепь, как описано в настоящем изобретении, например, в положении 16, 17, 20, 21, 24 либо 29,или к С-концевой аминокислоте пептида;(C) повышение посредством модифицирования аспарагиновой кислоты в положении 15, например,путем удаления либо замены глутаминовой кислотой, гомоглутаминовой кислотой, цистеиновой кислотой либо гомоцистеиновой кислотой. Такие модификации могут уменьшить деградацию или расщепление при величине рН от 5,5 до 8, например, с сохранением по меньшей мере 75, 80, 90, 95, 96, 97, 98 или 99% исходного пептида через 24 ч при температуре 25 С;(D) повышение стабильности посредством модификации метионина в положении 27, например, посредством замены лейцином либо норлейцином. Такие модификации могут уменьшить окислительную деградацию. Стабильность может быть также повышена посредством модификации Gln в положении 20 или 24, например, посредством замены на Ala, Ser, Thr либо AIB. Такие модификации могут уменьшить деградацию, обусловленную деамидированием Gln. Стабильность может быть повышена посредством модификации Asp в положении 21, например, посредством замены на Glu. Такие модификации могут уменьшить деградацию, обусловленную дегидратацией Asp, с образованием циклического сукцинимидного промежуточного соединения с последующей изомеризацией до изоаспартата;(E) повышение резистентности к расщеплению дипептидилпептидазой IV (DPPIV) посредством модификации аминокислоты в положении 1 или 2, как описано в настоящем изобретении;(F) консервативные либо неконсервативные замены, добавления или делеции, которые не оказывают влияния на активность, например консервативные замены в одном или нескольких положениях 2, 5,7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 либо 29; делеции в одном или нескольких положениях 27, 28 или 29; либо делеция аминокислоты 29, факультативно объединенной с С-концевой амидной либо сложноэфирной группой вместо С-концевой карбоновокислотной группы;(Н) увеличение полупериода существования в системе кровообращения, и/или продолжительности действия, и/или отсрочку начала действия, например, посредством ацилирования либо алкилирования глюкагонового пептида, как описано в настоящем изобретении;(I) гомодимеризацию либо гетеродимеризацию, как описано в настоящем изобретении. В соответствии с вариантами осуществления настоящего изобретения, приведенными в качестве примера, глюкагоновый пептид может содержать в целом 1 аминокислотную модификацию, до 2 аминокислотных модификаций, до 3 аминокислотных модификаций, до 4 аминокислотных модификаций, до 5 аминокислотных модификаций, до 6 аминокислотных модификаций, до 7 аминокислотных модификаций, до 8 аминокислотных модификаций, до 9 аминокислотных модификаций либо до 10 аминокислотных модификаций по сравнению с последовательностью нативного глюкагона. Другие модификации включают замену His в положении 1 большой ароматической аминокислотой (например, Tyr, Phe, Trp либо амино-Phe);Ser в положении 2 на Ala; замену Tyr в положении 10 на Val либо Phe; замену Lys в положении 12 на Arg; замену Asp в положении 15 на Glu; замену Ser в положении 16 на Thr либо AIB. В одном из вариантов осуществления, описанном в настоящем изобретении, предложен агонист глюкагона, модифицированный по сравнению с пептидом дикого типа (His-Ser-Gln-Gly-Thr-Phe-Thr-SerAsp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr(последовательность SEQ ID NO: 1 для повышения активности пептида на глюкагоновом рецепторе. Неожиданно заявители обнаружили, что серин, занимающий положение 16 нативного глюкагона (последовательностьSEQ ID NO: 1), может быть заменен выбранной кислой аминокислотой для повышения активности глюкагона, с точки зрения его способности стимулировать синтез цАМФ в испытании in vitro модели (смотри пример 14). Конкретнее, эта замена повышает активность аналога на глюкагоновом рецепторе по меньшей мере в 2, 4, 5 и до 10 раз. Эта замена также повышает активность аналога на GLP-1-рецепторе по меньшей мере в 5, 10 или 15 раз по сравнению с нативным глюкагоном, однако селективность сохраняется в отношении глюкагонового рецептора по сравнению с GLP-1-рецептором. В соответствии с одним из вариантов осуществления настоящего изобретения остаток серина в положении 16 нативного глюкагона заменяется аминокислотой, выбранной из группы, которую составляют глутаминовая кислота, глутамин, гомоглутаминовая кислота, гомоцистеиновая кислота, треонин или глицин. В соответствии с другим вариантом осуществления настоящего изобретения остаток серина в положении 16 нативного глюкагона заменяется аминокислотой, выбранной из группы, которую состав- 20019203 ляют глутаминовая кислота, глутамин, гомоглутаминовая кислота и гомоцистеиновая кислота, и в еще одном из вариантов осуществления настоящего изобретения остаток серина заменяется глутаминовой кислотой. В одном из вариантов осуществления настоящего изобретения глюкагоновый пептид, обладающий повышенной специфичностью в отношении глюкагонового рецептора, содержит пептид последовательностей SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10 либо аналог агониста глюкагона, где карбоксиконцевая аминокислота сохраняет свою нативную карбоксильную группу. В соответствии с одним из вариантов осуществления настоящего изобретения предлагается агонист глюкагона, содержащий последовательность NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-TyrLeu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-COOH (последовательность SEQ IDNO: 10), где пептид проявляет приблизительно в пять раз более высокую активность на глюкагоновом рецепторе по сравнению с нативным глюкагоном при определении in vitro анализом цАМФ примера 14. Гидрофильные составляющие. Глюкагоновые пептиды, соответствующие настоящему изобретению, можно подвергать дополнительному модифицированию для улучшения растворимости и стабильности пептида в водных растворах при физиологических значениях рН, при одновременном сохранении высокой биологической активности по сравнению с нативным глюкагоном. Гидрофильные составляющие, например полиэтиленгликолевые группы, могут быть присоединены к глюкагоновым пептидам при любых подходящих условиях, используемых для осуществления реакции белка с активированной полимерной молекулой. Могут использоваться любые способы, известные в данной области, в том числе ацилирование, гидроалкилирование,реакция Михаэля, алкилирование тиолов или другие методы хемоизбирательного сопряжения/лигирования через реакционноспособную группу PEG-составляющей (например, альдегидную группу, аминогруппу, сложноэфирную группу, тиоловую группу, -галогенацетильную группу, малеимидогруппу или гидразиногруппу) с реакционноспособной группой соединения-мишени (например, альдегидной группой, аминогруппой, сложноэфирной группой, тиоловой группой, -галогенацетильной группой, малеимидогруппой или гидразиногруппой). К числу активирующих групп, которые могут применяться для соединения водорастворимого полимера с одним либо несколькими белками, относятся (без ограничения) сульфоновая группа, малеимидная группа, сульфгидрильная группа, тиоловая группа, трифлатная группа, трезилатная группа, азидириновая группа, оксирановая группа, 5-пиридильная группа и альфа-галогенированная ацильная группа (например, альфа-йодоуксусная кислота, альфа-бромуксусная кислота, альфа-хлоруксусная кислота). В случае присоединения к пептиду посредством гидроалкилирования выбранный полимер должен иметь одну реакционноспособную альдегидную группу для контролирования степени полимеризации; см., например, Kinstler et al., Adv. Drag. Delivery Rev. 54:477-485(2002); Roberts et al., Adv. Drag Delivery Rev. 54:459-476 (2002) и Zalipsky et al., Adv. Drag Delivery Rev. 16:157-182 (1995). Согласно конкретному аспекту настоящего изобретения аминокислотный остаток на глюкагоновом пептиде, имеющий тиоловую группу, модифицируют гидрофильной составляющей, например PEG. В некоторых вариантах осуществления настоящего изобретения тиоловую группу модифицируют малеимид-активированным PEG в реакции Михаэля с получением пэгилированного пептида, содержащего тиоэфирную связь, показанную ниже В некоторых вариантах осуществления настоящего изобретения тиоловую группу модифицируют галогенацетил-активированным PEG в реакции нуклеофильного замещения с получением пэгилированного пептида, содержащего тиоэфирную связь, показанную ниже К числу подходящих гидрофильных составляющих относятся полиэтиленгликоль (PEG), полипропиленгликоль, полиоксиэтилированные полиолы (например, POG), полиоксиэтилированный сорбит, полиоксиэтилированная глюкоза, полиоксиэтилированный глицерин (POG), полиоксиалкилены, пропиональдегид полиэтиленгликоля, сополимеры этиленгликоля/пропиленгликоля, монометоксиполиэтиленгликоль, моно-(С 1-С 10)алкокси- либо арилоксиполиэтиленгликоль, карбоксиметилцеллюлоза, полиацетали, поливиниловый спирт (PVA), поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, поли(бета-аминокислоты) (гомополимеры либо статистические сополимеры), поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропропиленгликоля (PPG) и другие полиалкиленоксиды, сополимеры полипропиленоксида/этиленоксида, жирные кислоты толстой кишки и другие полисахаридные полимеры, фиколл либо декстран и их смеси. Декстраны представляют собой полисахаридные полимеры, состоящие из субъединиц глюкозы, соединенных между собой, главным образом, 1-6 связями. Декстраны доступны в различных диапазонах молекулярных масс, например от приблизительно 1 до приблизительно 100 кДа либо от приблизительно 5, 10, 15 или 20 до приблизи- 21019203 тельно 20, 30, 40, 50, 60, 70, 80 или 90 кДа. Предусматриваются линейные либо разветвленные полимеры. Полученные препараты конъюгатов могут быть по сути монодисперсными либо полидисперсными и могут иметь приблизительно, 0,5, 0,7, 1, 1,2, 1,5 либо 2 полимерные составляющие на пептид. В одном из вариантов осуществления настоящего изобретения предполагается, что введение гидрофильных групп в положениях 17, 21 и 24 пептида, имеющего последовательность SEQ ID NO: 9 либо последовательность SEQ ID NO: 10, улучшит растворимость и повысит стабильность высокоэффективного аналога глюкагона в растворах, имеющих физиологическое значение рН. Введение таких групп также увеличивает продолжительность действия, например, определяемую по полупериоду существования в системе кровообращения. К числу подходящих гидрофильных составляющих относятся любые водорастворимые полимеры, известные в данной области, включая PEG, гомо- и сополимеры PEG, монометилзамещенный полимер PEG (mPEG) либо полиоксиэтилированный глицерин (POG). В одном из вариантов осуществления настоящего изобретения гидрофильная группа содержит полиэтиленгликолевую (PEG) цепь. Конкретнее, в одном из вариантов осуществления настоящего изобретения глюкагоновый пептид содержит последовательность SEQ ID NO: 6 либо последовательность SEQ ID NO: 7, где полиэтиленгликолевая цепь ковалентно связана с боковыми цепями аминокислот, присутствующих в положениях 21 и 24 глюкагонового пептида, а карбоксиконцевой аминокислотный остаток пептида имеет карбоновокислотную группу. Конъюгаты. Настоящее описание имеет отношение также к другим конъюгатам, в которых глюкагоновые пептиды, соответствующие настоящему изобретению, присоединены к конъюгатной составляющей факультативно посредством ковалентных связей и факультативно через линкер. Присоединение может осуществляться с помощью ковалентных химических связей, физических сил, например электростатических,водородных, ионных, Ван-дер-ваальсовых, гидрофобных либо гидрофильных взаимодействий. Могут быть использованы различные системы нековалентного взаимодействия, включая биотин-авидин, лиганд/рецептор, фермент/субстрат, нуклеиновая кислота/белок, связывающий нуклеиновые кислоты, липид/белок, связывающий липиды, молекулы-партнеры клеточной адгезии, или любые связывающие партнеры либо их фрагменты, которые обладают взаимным сродством. Пептид может соединяться с конъюгатными составляющими посредством прямого ковалентного присоединения при введении в реакцию целевых аминокислотных остатков пептида с органическим дериватизатором, который может реагировать с избранными боковыми цепями либо N- или С-концевыми остатками этих целевых аминокислот. К числу реакционноспособных групп пептида либо конъюгатной составляющей относятся, например, альдегидная группа, аминогруппа, сложноэфирная группа, тиоловая группа, -галогенацетильная группа, малеимидогруппа или гидразиногруппа. К числу дериватизаторов относятся, например, малеимидобензоилсульфосукцинимидный эфир (сопряжение через цистеиновые остатки), N-гидроксисукцинимид (через лизиновые остатки), глутаральдегид, сукцинангидрид и другие дериватизаторы, известные в данной области. Альтернативно, конъюгатные составляющие могут присоединяться к пептиду опосредованно через промежуточные носители, такие как полисахаридные либо полипептидные носители. Примером полисахаридного носителя является аминодекстран. Примерами подходящих полипептидных носителей являются полилизин, полиглутаминовая кислота, полиаспарагиновая кислота, их сополимеры и смешанные полимеры этих и других аминокислот, например серина, для придания необходимых свойств растворимости получаемому в результате нагруженному носителю. Цистеиниловые остатки чаще всего взаимодействуют с -галогенацетатами (и соответствующими аминами), например хлоруксусной кислотой, хлорацетамидом, с получением карбоксиметиловых либо карбоксиамидометиловых производных. Цистеиниловые остатки дериватизуют также в ходе реакции с бромтрифторацетоном, альфа-бромо(5-имидазоил)пропионовой кислотой, хлорацетилфосфатом, Nалкилмалеимидами,3-нитро-2-пиридилдисульфидом,метил-2-пиридилдисульфидом,nхлормеркурбензоатом, 2-хлормеркур-4-нитрофенолом или хлоро-7-нитробензо-2-окса-1,3-диазолом. Гистидиловые остатки дериватизуют посредством введения в реакцию с диэтилпирокарбонатом при рН 5,5-7,0, поскольку этот агент обладает относительной специфичностью к боковой цепи гистидила. Пригоден также пара-бромфенацетилбромид; реакцию предпочтительно проводят в 0,1 М растворе какодилата натрия при рН 6,0. Лизиниловый и аминоконцевые остатки реагируют с янтарным или другими ангидридами карбоновой кислоты. Дериватизация этими агентами изменяет на противоположный заряд лизиниловых остатков. Другие подходящие реактивы для дериватизации альфа-аминосодержащих остатков включают сложные имидоэфиры, такие как метилпиколинимидат, пиридоксал-фосфат, пиридоксаль, хлорборогидрид, тринитробензолсульфокислота, О-метилизомочевина, 2,4-пентандион и продукт катализированной трансаминазой реакции с глиоксилатом. Аргиниловые остатки модифицируют посредством реакции с одним или несколькими обычными реагентами, к числу которых относятся фенилглиоксаль, 2,3-бутандион, 1,2-циклогександион и нингидрин. Для дериватизации остатков аргинина требуется, чтобы упомянутая реакция осуществлялось в щелочных средах из-за высокой pKa гуанидиновой функциональной группы. Кроме того, такие реагенты могут взаимодействовать с группами лизина, а также аргинин-эпсилон-аминогруппой. Тирозиловые остатки можно подвергать специфической модификации, причем особый интерес в этом случае представляет введение спектральных меток в тирозиловые остатки посредством введения в реакцию с ароматическими соединениями - диазонием либо тетранитрометаном. Чаще всего для получения различных О-ацетилтирозиловых остатков и 3-нитропроизводных применяют N-ацетилимидазол и тетранитрометан соответственно. Карбоксильные боковые группы (аспартил или глутамил) селективно модифицируют путем введения в реакцию с карбодиимидами (R-N=C=N=R'), где R и R' являются разными алкильными группами,такими как 1-циклогексил-3-(2-морфолинил-4-этил)карбодиимид или 1-этил-3-(4-азониа-4,4 диметилфенил)карбодиимид. Кроме того, аспартиловые и глутамиловые остатки превращают в аспарагиниловый и глутаминиловый остатки посредством проведения реакции с ионами аммония. Другие модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп сериловых либо треониловых остатков, метилирование альфа-аминогрупп боковых цепей лизина, аргинина и гистидина (Т.Е. Creighton, Proteins: Structure and Molecular Properties, W.H. FreemanCo., San Francisco, с. 79-86 (1983, деамидирование аспарагинов либо глутамина, ацетилированиеN-концевого амина и/или амидирование либо эстерификацию С-концевой карбоксильной группы. Ковалентной модификацией другого типа является химическое либо ферментативное присоединение гликозидов к пептиду. Сахар(-а) может(-гут) присоединяться к (а) аргинину и гистидину, (b) свободным карбоксильным группам, (с) свободным сульфгидрильным группам, таким как сульфгидрильные группы цистеина, (d) свободным гидроксильным группам, таким как гидроксильные группы серина, треонина либо гидроксипролина, (е) ароматическим остаткам, таким как ароматические остатки тирозина либо триптофана, или (f) амидогруппе глутамина. Эти методы описаны в WO 87/05330, опубликованной 11 сентября 1987 года, и в работе Aplin and Wriston, CRC Crit. Rev. Biochem., с. 259-306 (1981). К примерам конъюгатных составляющих, которые могут присоединяться к любому из глюкагоновых пептидов, описание которых приведено в настоящем изобретении, относятся (но без ограничения ими) гетерологические пептиды либо полипептиды (в том числе, например, белок плазмы крови), направляющий агент, иммуноглобулин либо его часть (например, вариабельная область, гипервариабельная область (CDR) или Fc-фрагмент), диагностическая метка, например радиоизотоп, фторофор либо ферментативная метка, полимер, в том числе водорастворимые полимеры, или другие терапевтические либо диагностические средства. В одном из вариантов осуществления настоящего изобретения предложен конъюгат, содержащий глюкагоновый пептид, соответствующий настоящему изобретению, и белок плазмы крови, где упомянутый белок плазмы крови выбран из группы, включающей альбумин, трансферрин, фибриноген и глобулины. В одном из вариантов осуществления настоящего изобретения плазменнобелковой составляющей конъюгата является альбумин либо трансферрин. В некоторых вариантах осуществления настоящего изобретения линкер содержит цепь атомов длиной от 1 до приблизительно 60 атомов, от 1 до 30 атомов или больше, от 2 до 5 атомов, от 2 до 10 атомов,от 5 до 10 атомов, от 10 до 20 атомов. В некоторых вариантах осуществления настоящего изобретения все атомы цепи являются атомами углерода. В некоторых вариантах осуществления настоящего изобретения атомы цепи в каркасе линкера выбраны из группы, включающей С, О, N и S. Атомы цепи и линкеры могут быть выбраны согласно их ожидаемой растворимости (гидрофильности) для получения более растворимого конъюгата. В некоторых вариантах осуществления настоящего изобретения линкер предоставляет функциональную группу, которую подвергают расщеплению ферментом или другим катализатором либо гидролитическими условиями, складывающимися в ткани-мишени или органе-мишени либо клетке-мишени. В некоторых вариантах осуществления настоящего изобретения длина линкера достаточно велика для снижения потенциала для стерического препятствия. Если линкер представляет собой ковалентную связь или пептидильную связь, а конъюгат является полипептидом, конъюгат в целом может быть гибридным белком. Такие пептидильные линкеры могут иметь любую длину. К примерам линкеров относятся линкеры, которые имеют в длину от приблизительно 1 до приблизительно 50 аминокислот, от 5 до 50 аминокислот, от 3 до 5 аминокислот, от 5 до 10 аминокислот, от 5 до 15 аминокислот или от 10 до 30 аминокислот. Такие гибридные белки можно альтернативно продуцировать методами рекомбинантных ДНК, известными специалисту в данной области. Как отмечалось выше, в некоторых вариантах осуществления настоящего изобретения глюкагоновые пептиды конъюгируют, например сшивают с иммуноглобулином либо его частью (например, вариабельной областью, CDR либо Fc-фрагментом). Иммуноглобулины (Ig) известных типов включают IgG,IgA, IgE, IgD или IgM. Fc-фрагмент представляет собой С-концевой участок тяжелой цепи иммуноглобулина, который отвечает за связывание с Fc-рецепторами, которые осуществляют такие воздействия, например, как рециклизация (следствием которой является увеличенный полупериод существования в плазме крови), антителозависимая клеточноопосредованная цитотоксичность (ADCC) и комплементзависимая цитотоксичность (CDC). Например, согласно некоторым определениям Fc-фрагмент тяжелой цепи человеческого IgG протягивается от Cys226 до С-конца тяжелой цепи. "Шарнирная область", как правило, простирается от Glu216 до Pro230 человеческого IgG1 (шарнирные области других изотипов IgG могут выравниваться с последо- 23019203 вательностью IgG1 посредством выравнивания цистеинов, вовлеченных в связывание цистеинов). Fcфрагмент IgG включает два константных домена, СН 2 и СН 3. Домен СН 2 Fc-фрагмента человеческогоIgG простирается, как правило, от аминокислоты 231 до аминокислоты 341. Домен СН 3 Fc-фрагмента человеческого IgG простирается, как правило, от аминокислоты 342 до аминокислоты 447. Все ссылки на нумерацию аминокислот иммуноглобулинов либо иммуноглобулиновых фрагментов или областей основаны на Kabat et al. 1991, Sequences of Proteins of Immunological Interest, U.S. Department of Public Health,Bethesda, Md. В соответствующих вариантах осуществления настоящего изобретения Fc-фрагмент может содержать одну или несколько нативных либо модифицированных константных областей тяжелой иммуноглобулиновой цепи, кроме СН 1, например области СН 2 и СН 3 IgG и IgA либо области СН 3 и СН 4IgE. Подходящими конъюгатными составляющими являются участки иммуноглобулиновой последовательности, включающие сайт связывания FcRn. FcRn, спасательный рецептор, несет ответственность за рециклизацию иммуноглобулинов и возвращение их в систему кровообращения. Область Fc-фрагментаIgG, которая связывается с FcRn-рецептором, была описана на основании данных рентгеновской кристаллографии (Burmeister et al. 1994, Nature 372:379). Основная зона контакта Fc с FcRn находится поблизости от точки соединения доменов СН 2 и СН 3. Все Fc-FcRn контакты происходят в пределах одной тяжелой цепи иммуноглобулина. Основными контактными участками являются аминокислотные остатки 248, 250-257, 272, 285, 288, 290-291, 308-311 и 314 домена СН 2 и аминокислотные остатки 385-387, 428 и 433-436 домена СН 3. Некоторые конъюгатные составляющие могут включать или могут не включать сайт(-ы) связывания FcR. FcR несет ответственность за ADCC и CDC. Примерами положений в пределах Fc-фрагмента,которые осуществляют непосредственный контакт с FcR, являются аминокислоты 234-239 (нижняя часть шарнирной области), аминокислоты 265-269 (петля В/С), аминокислоты 297-299 (петля С'/Е) и аминокислоты 327-332 (петля F/G) (Sondermann et al., Nature 406:267-273, 2000). Предполагается также причастность нижней части шарнирной области IgE к связыванию RcRI (Henry et al., Biochemistry 36,15568-15578, 1997). Остатки, вовлеченные в связывание рецепторов IgA, описаны у Lewis et al. (J. Immunol. 175:6694-6701, 2005). Аминокислотные остатки, вовлеченные в связывание рецепторов IgE, описаны у Sayers et al. (J. Biol. Chem. 279(34):35320-35325, 2004). Модификации аминокислот могут быть осуществлены на Fc-фрагменте иммуноглобулина. Такие вариантные Fc-фрагменты содержат по меньшей мере одну модификацию аминокислоты в домене СН 3Fc-фрагмента (остатки 342-447) и/или по меньшей мере одну модификацию аминокислоты в домене СН 2Fc-фрагмента (остатки 231-341). Мутации, которые, как полагают, обеспечивают повышенное сродство кFcRn, включают Т 256 А, Т 307 А; Е 380 А и N434A (Shields et al. 2001, J. Biol. Chem. 276:6591). Другие мутации могут снижать связывание Fc-фрагмента с FcRI, FcRIIA, FcRIIB и/или FcRIIIA без значительного снижения сродства к FcRn. Например, замена Asn в положении 297 Fc-фрагмента на Ala или другую аминокислоту удаляет высококонсервативный сайт N-гликозилирования и может привести к снижению иммуногенности с сопутствующим увеличением полупериода существования Fc-фрагмента в плазме крови, а также снижению связывания с FcRs (Routledge et al. 1995, Transplantation 60:847; Friend et al. 1999, Transplantation 68:1632; Shields et al. 1995, J. Biol. Chem. 276:6591). Были осуществлены модификации аминокислот в положениях 233-236 IgG1, что привело к снижению связывания с FcRs (Ward andGhetie 1995, Therapeutic Immunology 2:77 и Armour et al. 1999, Eur. J. Immunol. 29:2613). Некоторые примеры замен аминокислот описаны в патентах США 7355008 и 7381408, содержание которых в полном объеме включено в настоящее описание посредством ссылки. Гибридный белок и концевой удлиняющий сегмент. Настоящее изобретение охватывает также гибридные глюкагоновые пептиды или белки, где второй пептид или полипептид был присоединен к концу, например карбоксильному концу глюкагонового пептида. Конкретнее, гибридный глюкагоновый пептид может содержать агонист глюкагона (последовательность SEQ ID NO: 55, SEQ ID NO: 9 или SEQ ID NO: 10), также содержащий аминокислотную последовательность SEQ ID NO: 26 (GPSSGAPPPS), последовательность SEQ ID NO: 27 (KRNRNNIA) или последовательность SEQ ID NO: 28 (KRNR), связанную с аминокислотой 29 глюкагонового пептида. В одном из вариантов осуществления настоящего изобретения аминокислотная последовательность SEQSEQ ID NO: 28 (KRNR) связана с аминокислотой 29 глюкагонового пептида пептидной связью. Заявители обнаружили, что у гибридных глюкагоновых пептидов, содержащих С-концевой удлиняющий пептид экзендин-4 (например, последовательность SEQ ID NO: 26 или SEQ ID NO: 29), следствием замены нативного треонинового остатка в положении 29 на глицин является значительное усиление активности наGLP-1-рецепторе. Эта аминокислотная замена может применяться в сочетании с другими модификациями, описанными в настоящем изобретении, для повышения сродства аналогов глюкагона к GLP-1 рецептору. Например, замена T29G может комбинироваться с аминокислотными заменами S16E и N20K,факультативно с лактамовым мостиком между аминокислотами 16 и 20 и факультативно с добавлениемPEG-цепи, как описано в настоящем изобретении. В одном из вариантов осуществления настоящего изо- 24019203 бретения предложен коагонист глюкагонового рецептора/GLP-1-рецептора, содержащий последовательность SEQ ID NO: 64. В одном из вариантов осуществления настоящего изобретения составную часть гибридного глюкагонового пептида, представляющую собой глюкагоновый пептид, выбирают из группы, которую составляют последовательности SEQ ID NO: 55, последовательность SEQ ID NO: 2, последовательность SEQ ID NO: 3, последовательность SEQ ID NO: 4 и последовательность SEQ ID NO: 5, гдеPEG-цепь, в случае присутствия в положениях 17, 21, 24 либо на С-концевой аминокислоте или же в обоих положениях 21 и 24, выбирают в диапазоне от 500 до 40000 Да. Конкретнее, в одном из вариантов осуществления настоящего изобретения сегмент, представляющий собой глюкагоновый пептид, выбирают из группы, которую составляют последовательность SEQ ID NO: 7, последовательность SEQ IDNO: 8 и последовательность SEQ ID NO: 63, где PEG-цепь выбирают в диапазоне от 500 до 5000 Да. В одном из вариантов осуществления настоящего изобретения глюкагоновым пептидом является гибридный пептид, содержащий последовательность SEQ ID NO: 55 и последовательность SEQ ID NO: 65, где пептид, содержащий последовательность SEQ ID NO: 65, присоединен к карбоксильному концу последовательности SEQ ID NO: 55. С-конец с нейтральным зарядом. В соответствии с одним из вариантов осуществления настоящего изобретения дополнительная химическая модификация глюкагонового пептида (последовательность SEQ ID NO: 10) придает повышенную активность на GLP-1-рецепторе до такого уровня, на котором относительная активность на глюкагоновом рецепторе и GLP-1-рецепторе оказывается фактически эквивалентной. Соответственно в одном из вариантов осуществления настоящего изобретения предлагается коагонист глюкагонового рецептора/GLP-1-рецептора, где концевая аминокислота глюкагоновых пептидов, соответствующих настоящему изобретению, имеет амидную группу вместо карбоксильной группы, присутствующей у нативной аминокислоты. Относительная активность аналога глюкагона на соответствующем глюкагоновом рецепторе и GLP-1-рецепторе может регулироваться посредством дополнительных модификаций глюкагонового пептида с получением аналогов, демонстрирующих от приблизительно 40 до приблизительно 500% или более активности нативного глюкагона на глюкагоновом рецепторе и от приблизительно 20 до приблизительно 200% или более активности нативного GLP-1 на GLP-1-рецепторе, т.е. 50-кратное, 100 кратное или большее повышение по сравнению с нормальной активностью глюкагона на GLP-1 рецепторе. В некоторых вариантах осуществления настоящего изобретения глюкагоновые пептиды, описание которых приведено в настоящем изобретении, демонстрируют до приблизительно 100, 1000,10000, 100000 либо 1000000% активности нативного глюкагона на глюкагоновом рецепторе. В некоторых вариантах осуществления настоящего изобретения глюкагоновые пептиды, описание которых приведено в настоящем изобретении, демонстрируют до приблизительно 100, 1000, 10000, 100000 либо 1000000% активности нативного GLP-1 на GLP-1-рецепторе. Стабилизация альфа-спирали/внутримолекулярные мостики. В еще одном варианте осуществления настоящего изобретения предложены аналоги глюкагона, демонстрирующие повышенную активность агониста GLP-1-рецептора, где внутримолекулярный мостик образуется между двумя боковыми цепями аминокислот для стабилизации объемной структуры карбоксильного конца пептида. Две боковые цепи аминокислот могут соединяться между собой через нековалентные связи, например водородные связи, ионные взаимодействия, такие как образование солевых мостиков, либо через ковалентные связи. Когда две боковые цепи аминокислот соединяются между собой через одну или несколько ковалентных связей, пептид может рассматриваться в контексте настоящего изобретения как содержащий ковалентный внутримолекулярный мостик. Когда две боковые цепи аминокислот соединяются между собой через нековалентные связи, например водородные связи, ионные взаимодействия, пептид может рассматриваться в контексте настоящего изобретения как содержащий нековалентный внутримолекулярный мостик. В некоторых вариантах осуществления настоящего изобретения внутримолекулярный мостик образуется между двумя аминокислотами, разделенными 3 расположенными между ними аминокислотами,например между аминокислотами в положениях i и i+4, где i представляет собой любое целое число от 12 до 25 (например, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 и 25). Конкретнее, боковые цепи аминокислотных пар 12 и 16, 16 и 20, 20 и 24 либо 24 и 28 (аминокислотные пары, у которых i=12, 16, 20 или 24) связываются между собой и, тем самым, стабилизируют альфа-спираль глюкагона. Альтернативно, i может равняться 17. В некоторых конкретных вариантах осуществления настоящего изобретения, в которых аминокислоты в положениях i и i+4 соединяются внутримолекулярным мостиком, величина линкера составляет приблизительно 8 атомов или приблизительно 7-9 атомов. В других вариантах осуществления настоящего изобретения внутримолекулярный мостик образуется между двумя аминокислотами, отделенными двумя расположенными между ними аминокислотами,например аминокислотами в положении j и j+3, где j представляет собой любое целое число от 12 до 26(например, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 и 26). В некоторых конкретных вариантах осуществления настоящего изобретения j=17. В некоторых конкретных вариантах осуществления настоящего изобретения, в которых аминокис- 25019203 лоты в положениях j и j+3 соединяются внутримолекулярным мостиком, величина линкера составляет приблизительно 6 атомов или от приблизительно 5 до 7 атомов. В других вариантах осуществления настоящего изобретения внутримолекулярный мостик образуется между двумя аминокислотами, отделенными 6 расположенными между ними аминокислотами, например аминокислотами в положениях k и k+7, где k представляет собой любое целое число от 12 до 22(например, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 и 22). В некоторых конкретных вариантах осуществления настоящего изобретения k равняется 12, 13 либо 17. В одном из вариантов осуществления настоящего изобретения k=17. Примерами аминокислотных пар, способных к ковалентному связыванию с образованием шестиатомного линкерного мостика, являются Orn и Asp, Glu и аминокислота формулы I, где n - 2, и гомоглутаминовая кислота и аминокислота формулы I, где n - 1, и где формула I имеет следующий вид: где n=от 1 до 4 Примерами аминокислотных пар, способных к ковалентному связыванию с образованием семиатомного линкерного мостика, являются Orn-Glu (лактамовый цикл); Lys-Asp (лактам); либо гомо-Serгомо-Glu (лактон). Примерами аминокислотных пар, которые могут образовывать восьмиатомный линкер, являются Lys-Glu (лактам); гомо-Lys-Asp (лактам); Orn-гомо-Glu (лактам); 4-амино-Phe-Asp (лактам); либо Tyr-Asp (лактон). Примерами аминокислотных пар, которые могут образовывать девятиатомный линкер, являются гомо-Lys-Glu (лактам); Lys-гомо-Glu (лактам); 4-амино-Phe-Glu (лактам) либо TyrGlu (лактон). Любую из боковых цепей этих аминокислот можно дополнительно замещать дополнительными химическими группами до тех пор, пока не будет разрушена объемная структура альфа-спирали. Специалист в данной области может представить себе альтернативные пары либо альтернативные аналоги аминокислот, включая химически модифицированные производные, которые могли бы образовать стабилизирующую структуру подобного размера и необходимого действия. Например, дисульфидный мостик гомоцистеин-гомоцистеин, который имеет в длину 6 атомов, для обеспечения необходимого действия может быть дополнительно модифицирован. Даже без образования ковалентной связи, вышеописанные аминокислотные пары или подобные пары, которые может представить себе специалист в данной области, также могут обеспечить дополнительную стабильность альфа-спирали благодаря нековалентным связям, например, посредством образования солевых мостиков или взаимодействий водородных связей. Другие варианты осуществления настоящего изобретения включают следующие пары, факультативно с лактамовым мостиком: Glu в положении 12 с Lys в положении 16; нативный Lys в положении 12 с Glu в положении 16; Glu в положении 16 с Lys в положении 20; Lys в положении 16 с Glu в положении 20; Glu в положении 20 с Lys в положении 24; Lys в положении 20 с Glu в положении 24; Glu в положении 24 с Lys в положении 28; Lys в положении 24 с Glu в положении 28. В одном из вариантов осуществления настоящего изобретения предложен аналог глюкагона, который демонстрирует активность коагониста глюкагонового рецептора/GLP-1-рецептора, где упомянутый аналог содержит аминокислотную последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 11, 47, 48 и 49. В одном из вариантов осуществления настоящего изобретения боковые цепи ковалентно связаны между собой, и в одном из вариантов осуществления настоящего изобретения две аминокислоты связаны между собой с образованием лактамового цикла. Величина лактамового цикла может изменяться в зависимости от длины боковых цепей аминокислот, и в одном из вариантов осуществления настоящего изобретения лактам образуется посредством соединения боковых цепей аминокислоты лизина с боковой цепью глутаминовой кислоты. Порядок амидной связи в лактамовом цикле может быть обращен (например, лактамовый цикл может быть образован между боковыми цепями Lis12 и Glu16 либо, альтернативно, между Glu12 и Lys16). В одном из вариантов осуществления настоящего изобретения предложен аналог глюкагона (последовательность SEQ ID NO: 45), где по меньшей мере один лактамовый цикл образован между боковыми цепями пары аминокислот, выбранных из группы, которую составляют аминокислотные пары 12 и 16, 16 и 20, 20 и 24 либо 24 и 28. В одном из вариантов осуществления настоящего изобретения предложен коагонист глюкагонового рецептора/GLP-1-рецептора, который содержит аналог глюкагонового пептида(последовательность SEQ ID NO: 20), причем упомянутый пептид содержит внутримолекулярный лактамовый мостик, образованный между аминокислотными положениями 12 и 16 либо между аминокислотными положениями 16 и 20. В одном из вариантов осуществления настоящего изобретения предложен коагонист глюкагонового рецептора/GLP-1-рецептора, содержащий последовательность SEQ ID NO: 20,где внутримолекулярный лактамовый мостик образован между аминокислотными положениями 12 и 16,между аминокислотными положениями 16 и 20 либо между аминокислотными положениями 20 и 24, и аминокислотой в положении 29 является глицин, где последовательность SEQ ID NO: 29 соединена с Сконцевой аминокислотой (последовательность SEQ ID NO: 20). В другом варианте осуществления настоящего изобретения аминокислотой в положении 28 является аспарагиновая кислота. Для стабилизации альфа-спирали пептидов-аналогов глюкагона могут использоваться другие внутримолекулярные мостики, отличающиеся от лактамового мостика. В одном из вариантов осуществления настоящего изобретения внутримолекулярным мостиком является гидрофобный мостик. В этом случае внутримолекулярный мостик факультативно может располагаться между боковыми цепями двух аминокислот, являющихся частью гидрофобной области альфа-спирали пептида - аналога глюкагона. Например, одной из аминокислот, присоединенных гидрофобным мостиком, может быть аминокислота в положении 10, 14 и 18. Согласно одному из конкретных аспектов настоящего изобретения олефиновый метатезис используется для сшивания одного или двух витков альфа-спирали глюкагонового пептида с применением системы сплошного перекрестного связывания всех углеводородов. Глюкагоновый пептид в этом случае может содержать -метилированные аминокислоты, несущие олефиновые боковые цепи различной длины, конфигурация которых обусловлена R- или S-стереохимией в положениях i, i+4 или i+7. Например,олефиновая боковая цепь может содержать (СН 2)n, где n представляет собой любое целое число в пределах от 1 до 6. В одном из вариантов осуществления настоящего изобретения n равняется 3 для образования поперечной межмолекулярной связи длиной 8 атомов. Подходящие способы образования таких внутримолекулярных мостиков известны в данной области; см., например, Schafmeister et al., J. Am.Chem. Soc. 122:5891-5892 (2000) и Walensky et al., Science 305: 1466-1470 (2004). Альтернативно, глюкагоновый пептид может содержать О-аллил Ser остатки, расположенные на прилегающих витках спирали,которые соединяют между собой мостиком посредством катализируемого рутением метатезиса с замыканием цикла. Подобные методики образования поперечных межмолекулярных связей описаны, например, у Blackwell et al., Angew. Chem. Int. Ed. 37:3281-3284 (1998). Согласно другому конкретному аспекту настоящего изобретения искусственная тиодиаланиновая аминокислота, лантионин, которая нашла широкое применение в качестве пептидомиметика цистина,используется для перекрестного связывания одного витка альфа-спирали. Подходящие способы основанной на лантионине циклизации известны в этой области; см., например, Matteucci et al., Tetrahedron Letters 45: 1399-1401 (2004); Mayer et al., J. Peptide Res. 51:432-436 (1998); Polinsky et al., J. Med. Chem. 35: 4185-4194 (1992); Osapay et al., J. Med. Chem. 40:2241-2251 (1997); Fukase et al., Bull. Chem. Soc. Jpn. 65: 2227-2240 (1992); Harpp et al., J. Org. Chem. 36:73-80 (1971); Goodman and Shao, Pure Appl. Chem. 68: 1303-1308 (1996) и Osapay and Goodman, J. Chem. Soc. Chem. Commun. 1599-1600 (1993). В некоторых вариантах осуществления настоящего изобретения ,-диаминоалкановые связи, например 1,4-диаминопропан и 1,5-диаминопентан, между двумя Glu остатками в положениях i и i+7 применяют для стабилизации альфа-спирали глюкагонового пептида. Такие связи ведут к образованию мостика длиной в 9 или более атомов в зависимости от длины диаминоалкановой связи. Подходящие способы продуцирования пептидов, сшитых такими связями, известны в данной области; см., например, Phelanet al., J. Am. Chem. Soc. 119:455-460 (1997). В еще одном варианте осуществления настоящего изобретения дисульфидный мостик применяют для сшивания одного или двух витков альфа-спирали глюкагонового пептида. Альтернативно, модифицированный дисульфидный мостик, в котором один или оба атома серы заменены метиленовой группой,результатом чего является макроциклизация стереомеров, применяют для стабилизации альфа-спирали глюкагонового пептида. Подходящие способы модифицирования пептидов дисульфидными мостиками либо циклизацией на основе серы описаны, например, Jackson et al., J. Am. Chem. Soc. 113: 9391-9392(1991) и Rudinger and Jost, Experientia 20: 570-571 (1964). В еще одном варианте осуществления настоящего изобретения альфа-спираль глюкагонового пептида стабилизируют посредством связывания атома металла двумя His остатками либо парой His-Cys в положениях i и i+4. Упомянутым атомом металла может быть, например, Ru(III), Cu(II), Zn(II) либоCd(II). Подобные способы стабилизации альфа-спирали на основе связывания металла известны в данной области; см., например, Andrews and Tabor, Tetrahedron 55: 11711-11743 (1999); Ghadiri et al., J. Am.Chem. Soc. 112:1630-1632 (1990) и Ghadiri et al., J. Am. Chem. Soc. 119: 9063-9064 (1997). Альфа-спираль глюкагонового пептида, альтернативно, может быть стабилизирована иными способами циклизации пептидов, обзор которых приведен у Davies, J. Peptide. Sci. 9:471-501 (2003). Альфаспираль может быть стабилизирована посредством образования амидного мостика, тиоэфирного мостика, сложного тиоэфирного мостика, мочевинного мостика, карбаматного мостика, сульфонамидного мостика и т.п. Например, сложный тиоэфирный мостик может быть образован между С-концом и боковой цепью Cys остатка. Альтернативно, сложный тиоэфирный мостик может быть образован через боковые цепи аминокислот, имеющих тиол (Cys) и карбоновую кислоту (например, Asp, Glu). Согласно другому способу агент сшивания, такой как дикарбоновая кислота, например субериновая кислота (октандиоевая кислота), и подобные кислоты, может вводить связь между двумя функциональными группами боковой цепи аминокислоты, такими как свободная аминогруппа, гидроксильная группа, тиоловая группа и их комбинации. В одном из вариантов осуществления настоящего изобретения альфа-спираль глюкагонового пептида стабилизируется посредством включения гидрофобной аминокислоты в положениях i и i+4. Например, i может быть Tyr, а i+4 может быть Val или Leu; i может быть Phe, a i+4 может быть Cys или Met; i может быть Cys, a i+4 может быть Met; либо i может быть Phe, a i+4 может быть Ile. Следует иметь в виду, что в целях настоящего изобретения вышеупомянутые аминокислотные пары могут изменять расположение на противоположное, так что аминокислота, указанная в положении i, может альтернативно быть размещена в положении i+4, в то время как аминокислота, указанная в положении i+4, может быть размещена в положении i. В других вариантах осуществления настоящего изобретения глюкагоновый пептид с повышенной активностью на GLP-1-рецепторе содержит (а) одну либо несколько замен в аминокислотных положениях 12-29 на ,-дизамещенную аминокислоту и факультативно (b) С-концевой амид. В соответствии с некоторыми аспектами настоящего изобретения следует понимать, что у таких глюкагоновых пептидов,в частности, отсутствует внутримолекулярный мостик, например ковалентный внутримолекулярный мостик, который стабилизирует альфа-спираль С-концевого участка глюкагона (вблизи положений 12-29). В некоторых вариантах осуществления настоящего изобретения аминокислоты в одном, двух, трех, четырех или больше положениях 16, 17, 18, 19, 20, 21, 24 или 29 глюкагона заменяют ,-дизамещенной аминокислотой, например аминоизомасляной кислотой (AIB), аминокислотой, замещенной двумя одинаковыми или различными группами, выбранными из числа метиловой, этиловой, пропиловой и нбутиловой групп, либо циклооктаном или циклогептаном (например, 1-аминоциклооктан-1-карбоновой кислотой). Например, замена аминокислоты в положении 16 на AIB повышает активность GLP-1 при отсутствии внутримолекулярного мостика, например нековалентного внутримолекулярного мостика (например, солевого мостика) либо ковалентного внутримолекулярного мостика (например, лактама). В некоторых вариантах осуществления настоящего изобретения аминокислоты в одном, двух, трех или больше положениях 16, 20, 21 или 24 заменяются на AIB. Такой глюкагоновый пептид может также содержать одну или несколько других модификаций, описанных в настоящем изобретении, в том числе (но без ограничения) ацилирование, алкилирование, пэгилирование, делецию 1-2 аминокислот на С-конце,добавление и/или замену заряженными аминокислотами на С-конце, замену С-концевой карбоксилатной группы на аминогруппу, добавление С-концевого удлиняющего сегмента, и консервативные и/или неконсервативные аминокислотные замены, такие как замена Met в положении 27 на Leu или Nle, заменаAsp в положении 15 на Glu (или подобную аминокислоту), замена аминокислоты в положении 1 и/или 2 аминокислотами, которые обеспечивают резистентность против расщепления протеазой DPP-IV, заменаSer в положении 2 на Ala, замена Tyr в положении 10 на Val или Phe, замена Lys в положении 12 на Arg,замена Ser в положении 16 на Thr либо AIB, замена Gln в положении 20 и/или 24 на Asp, Glu или AIB,замена Ser в положении 16 на Glu или Thr, Arg в положении 18 на Ala, Gln в положении 20 на Lys, Asp в положении 21 на Glu и Gln в положении 24 на Asn либо Cys. В некоторых вариантах осуществления настоящего изобретения вышеупомянутый глюкагоновый пептид содержит Gln или Gly в положении 29 либо добавление С-концевого удлиняющего сегмента, например GGPSSGAPPPS (последовательностьSEQ ID NO: 26) в С-концевом направлении относительно аминокислоты в положении 28. В соответствии с конкретным аспектом настоящего изобретения глюкагоновый пептид содержит одну или несколько амидных групп вместо С-концевой карбоксилатной группы, ацильную группу, например С 16 жирную кислоту, и гидрофильную составляющую, например полиэтиленгликоль (PEG). Кроме того, в соответствии с другим конкретным аспектом настоящего изобретения глюкагоновый пептид содержит аминокислотную последовательность, соответствующую любой из последовательностей SEQ ID NO: 1-25, 30-64 и 66-555, содержащую не более десяти модификаций по сравнению с последовательностью SEQ ID NO: 1 и содержащую одну или несколько аминокислотных замен на AIB в положениях 16, 20, 21 и/или 24, где у пептида отсутствует внутримолекулярный мостик, например ковалентный внутримолекулярный мостик, между боковыми цепями двух аминокислот пептида. В соответствии с более конкретным аспектом настоящего изобретения глюкагоновый пептид содержит аминокислотную последовательность, соответствующую любой из последовательностей SEQ ID NO: 556-561. В некоторых вариантах осуществления настоящего изобретения глюкагоновый пептид, не имеющий внутримолекулярного мостика, содержит одну или несколько замен в пределах аминокислотных положений 12-29 на ,-дизамещенную аминокислоту и ацильную либо алкильную группу, ковалентно присоединенную к боковой цепи аминокислоты в положении 10 глюкагонового пептида. В конкретных вариантах осуществления настоящего изобретения упомянутая ацильная либо алкильная группа не является нативной для аминокислоты. В некоторых вариантах осуществления настоящего изобретения ацильная либо алкильная группа не является нативной для аминокислоты в положении 10. В соответствии с вариантами осуществления настоящего изобретения, приведенными в качестве примера, глюкагоновый пептид, не имеющий внутримолекулярного мостика, содержит аминокислотную последовательность, соответствующую любой из последовательностей SEQ ID NO: 556-561, и ацильную либо алкильную группу, ковалентно присоединенную к боковой цепи аминокислоты в положении 10 глюкагонового пептида. Подобные ацилированные либо алкилированные глюкагоновые пептиды, не имеющие внутримолекулярных мостиков, демонстрируют повышенную активность на GLP-1-рецепторе и глюкагоновом рецепторе по сравнению с неацилированными пептидами-аналогами. Дальнейшего усиления активности на GLP-1-рецепторе и глюкагоновом рецепторе можно достичь с помощью ацилированных глюкагоновых пептидов, не имеющих внутримолекулярных мостиков, посредством введения спейсера между ацильной или алкильной группой и боковой цепью аминокислоты в положении 10 пептида. В этом изобретении, кроме того, описывается ацилирование и алкилирование с включением либо без включения спейсеров. Модификация в положении 1. В одном из вариантов осуществления настоящего изобретения глюкагоновый пептид с повышенной активностью на GLP-1-рецепторе содержит (а) замену аминокислоты His в положении 1 большой ароматической аминокислотой и (b) внутримолекулярный мостик, который стабилизирует альфа-спираль на Сконцевом участке молекулы (например, вблизи положений 12-29). В конкретном варианте осуществления настоящего изобретения аминокислотой в положении 1 является Tyr, Phe, Trp, амино-Phe, нитро-Phe,хлоро-Phe, сульфо-Phe, 4-пиридил-Ala, метил-Tyr либо 3-амино-Tyr. В соответствии с конкретным аспектом настоящего изобретения внутримолекулярный мостик находится между боковыми цепями двух аминокислот, разделенных тремя расположенными между ними аминокислотами, т.е. между боковыми цепями аминокислот i и i+4. В некоторых вариантах осуществления настоящего изобретения упомянутым внутримолекулярным мостиком является лактамовый мостик. В более конкретном варианте осуществления настоящего изобретения глюкагоновый пептид содержит большую ароматическую аминокислоту в положении 1 и лактамовый мостик между аминокислотами в положениях 16 и 20 пептида. Такой глюкагоновый пептид может также содержать одну или несколько (например, две, три, четыре, пять или больше) других модификаций, описание которых приведено в настоящем изобретении. Например, глюкагоновый пептид может содержать амид вместо С-концевой карбоксилатной группы. Соответственно в одном из вариантов осуществления настоящего изобретения глюкагоновый пептид содержит аминокислотную последовательность SEQ ID NO: 555. Ацилирование. В одном из вариантов осуществления настоящего изобретения глюкагоновый пептид содержит ацильную группу, например ацильную группу, которая не является нативной для естественной аминокислоты. Ацильная группа придает пептиду одну или несколько из следующих характеристик: (i) увеличенный полупериод существования в системе кровообращения, (ii) отсроченное начало действия, (iii) увеличенную продолжительность действия, (iv) улучшенную резистентность к протеазам, таким какDPP-IV, и (v) повышенную эффективность на GLP-1-рецепторе и глюкагоновом рецепторе. Как показано в настоящем изобретении, ацилированные глюкагоновые пептиды не демонстрируют сниженной активности на глюкагоновом рецепторе и GLP-1-рецепторе по сравнению с соответствующим неацилированным глюкагоновым пептидом. Скорее, в некоторых случаях, ацилированные глюкагоновые пептиды фактически демонстрируют повышенную активность на GLP-1-рецепторе и глюкагоновом рецепторе. Таким образом, эффективность ацилированных аналогов сопоставима с неацилированными вариантами аналогов-коагонистов глюкагона, если не увеличена. В одном из вариантов осуществления настоящего изобретения глюкагоновый пептид модифицируют с включением ацильной группы, которая присоединяется к глюкагоновому пептиду через сложноэфирную, тиоэфирную либо амидную связь с целью увеличения полупериода существования в системе кровообращения, и/или отсрочивания начала действия, и/или увеличения продолжительности действия,и/или улучшения резистентности к протеазам, таким как DPP-IV. Ацилирование можно выполнять в любом положении в пределах глюкагонового пептида, в том числе в любом из положений 1-29, в положении в пределах С-концевого удлиняющего сегмента или Сконцевой аминокислоты, при условии, что активность на глюкагоновом рецепторе и/или GLP-1 рецепторе сохраняется, если не увеличивается. Неограничивающие примеры включают положения 5, 7,10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29. В конкретных вариантах осуществления настоящего изобретения ацилирование происходит в положении 10 глюкагонового пептида, и у глюкагонового пептида отсутствует внутримолекулярный мостик, например ковалентный внутримолекулярный мостик(например, лактамовый мостик). Такие ацилированные пептиды, не имеющие внутримолекулярных мостиков, демонстрируют повышенную активность на GLP-1-рецепторе и глюкагоновом рецепторе по сравнению с соответствующими неацилированными пептидами, не имеющими ковалентных внутримолекулярных мостиков, и по сравнению с соответствующими пептидами, не имеющими внутримолекулярных мостиков, ацилированными в положении, отличающемся от положения 10. Как показано в настоящем изобретении, ацилирование в положении 10 может даже превратить аналог глюкагона, обладающий низкой активностью на глюкагоновом рецепторе, в аналог глюкагона, обладающий активностью как на глюкагоновом рецепторе, так и на GLP-1-рецепторе. Таким образом, положение, в котором происходит ацилирование, может изменять общий профиль активности аналога глюкагона. Глюкагоновые пептиды можно ацилировать в том же самом аминокислотном положении, к которому присоединена гидрофильная составляющая, либо в ином аминокислотном положении. К неограничи- 29
МПК / Метки
МПК: A61K 38/00
Метки: коагонисты, глюкагонового
Код ссылки
<a href="https://eas.patents.su/30-19203-koagonisty-glyukagonovogo-receptora-glp-1-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Коагонисты глюкагонового рецептора/glp-1-рецептора</a>
Предыдущий патент: Способ проведения аллерген-специфической иммунотерапии для профилактики или лечения аллергии
Следующий патент: Производные аденина и их применение в терапии
Случайный патент: Способ получения (мет) акриловых кислот и способ их дистилляции












