Замещенные производные дейтерированных ксантинов и их применение
Формула / Реферат
1. Соединение формулы В
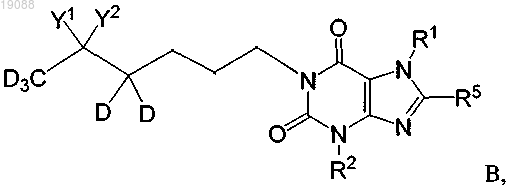
или его фармацевтически приемлемая соль, где
каждый из R1 и R2 независимо выбран из -CH3 и -CD3;
R5 обозначает водород или дейтерий; и
(а) Y1 обозначает ОН и Y2 обозначает водород или дейтерий; или
(б) Y1 и Y2, взятые вместе с атомом углерода, с которым они связаны, образуют С = О.
2. Соединение по п.1, где R5 обозначает дейтерий.
3. Соединение по п.2, где R1 обозначает -CD3.
4. Соединение по п.1, где R1 и R2, каждый, обозначают -CD3.
5. Соединение по любому из пп.1, 2 или 4, где Y1 и Y2 вместе с атомом углерода, к которому они присоединены, образуют С = О.
6. Соединение по любому из пп.1, 2 или 4, где Y1 обозначает ОН и Y2 обозначает водород или дейтерий.
7. Соединение формулы А
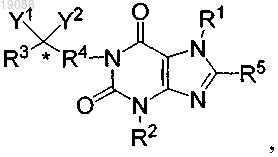
или его фармацевтически приемлемая соль, выбранные из следующих соединений:
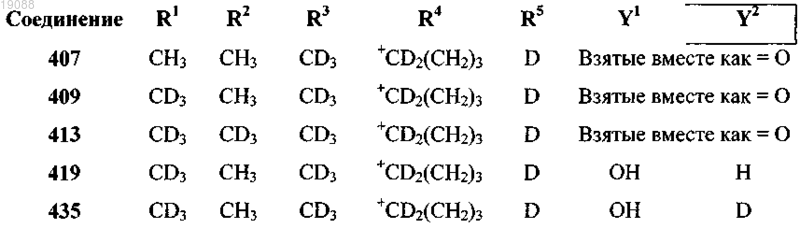
где "+" означает часть группы R4, связанную с C(Y1)(Y2) в соединении.
8. Соединение, выбранное из следующих соединений:
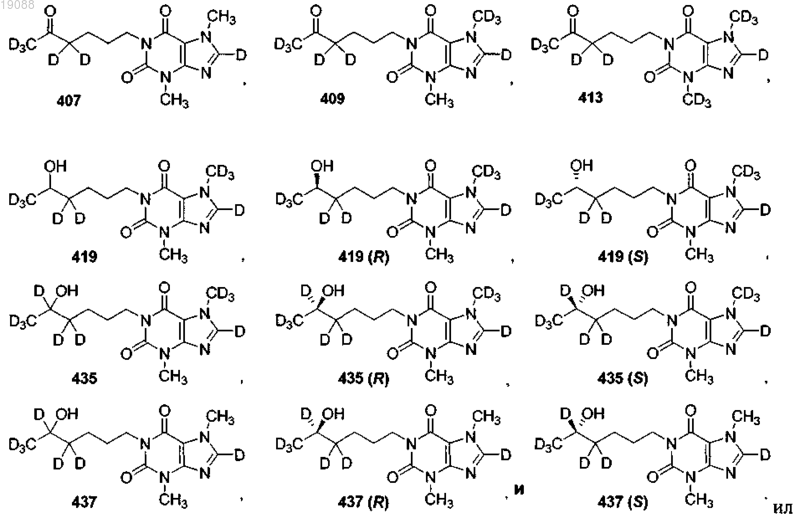
и фармацевтически приемлемая соль любого из указанных выше соединений.
9. Соединение по любому из пп.1-8, где любой атом, не являющийся дейтерием, является атомом с природным содержанием изотопов.
10. Фармацевтическая композиция, содержащая соединение по п.1, и фармацевтически приемлемый носитель.
11. Способ лечения болезни или состояния у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества композиции по п.10, при этом болезнь выбрана из диабетической нефропатии, гипертензивной нефропатии или перемежающейся хромоты вследствие хронической закупорки артерий в легких.
12. Способ лечения хронического заболевания почек у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества композиции по п.10.
13. Способ по п.12, отличающийся тем, что хроническое заболевание почек представляет собой гломерулонефрит, фокальный сегментарный гломерулосклероз, нефротический синдром, мочеточниково-венозную уропатию или поликистоз почек.
14. Способ лечения хронического заболевания печени у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества композиции по п.10.
15. Способ по п.14, отличающийся тем, что хроническое заболевание печени представляет собой неалкогольный стеатогепатит, дегенерацию жирной печени или другие дегенеративные состояния, вызванные питанием с высоким содержанием жира или употреблением алкоголя, цирроз, печеночную недостаточность или алкогольный гепатит.
16. Способ лечения болезни или состояния, связанных с диабетом, у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества композиции по п.10, при этом болезнь или состояние выбраны из резистентности к инсулину, ретинопатии, диабетических язв, некроза, ассоциируемого с облучением, острой почечной недостаточности или нефротоксичности, вызванной употреблением лекарств.
17. Способ лечения перемежающейся хромоты у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества композиции по п.10.
18. Способ лечения болезни или состояния у пациента, нуждающегося в этом, при этом болезнь или состояние выбрано из инсулинзависимого диабета, диабета, не зависящего от инсулина, метаболического синдрома, ожирения, резистентности к инсулину, дислипидемии, нарушения толерантности к глюкозе, гипертонии, гиперлипидемии, гиперурикемии и гиперкоагуляции, включающий введение пациенту эффективного количества композиции по п.10.
Текст
ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ДЕЙТЕРИРОВАННЫХ КСАНТИНОВ И ИХ ПРИМЕНЕНИЕ Данное изобретение относится к новым замещенным производным дейтерированных ксантинов общей формулы В и их фармацевтически приемлемым солям. Настоящее изобретение предусматривает также композиции, содержащие соединение по изобретению и фармацевтически приемлемый носитель, а также применение заявленных соединений и композиций в способах лечения болезней и состояний, для которых благоприятно применение пентоксифиллина и его производных. Предпосылки создания изобретения Пентоксифиллин, 1-(5-оксогексил)-3,7-диметилксантин, продается под маркой Trental в США и Канаде. В настоящее время он одобрен для лечения пациентов с перемежающейся хромотой, вызванной хронической закупоркой артерий конечностей. Он используется также в клиническом лечении гломерулонефрита, нефротического синдрома, неалкогольного стеатогепатита, лейшманиоза, цирроза, печеночной недостаточности, мышечной дистрофии Дюшенна, инфекции ВИЧ, поздних повреждений, вызванных облучением, лимфедемы, вызванной облучением, алкогольного гепатита, радиационного фиброза,некротизирующего энтероколита у недоношенных детей, хронического заболевания почек, легочного саркоидоза, периодического афтозного стоматита, хронической боли в груди у раковых больных, опухолей мозга и центральной нервной системы, а также синдрома нарушения питания - воспаления - общей атрофии. Пентоксифиллин также недавно привлек внимание как лекарство для возможного лечения диабета и нарушений, связанных с диабетом. См. Ferrari, E. et al., Pharmatherapeutica, 1987, 5(1): 26-39; Raptis, S. et al., Acta Diabetol lat, 1987, 24(3): 181-92; и Rahbar R. Et al., Clin Chim Acta, 2000, 301 (1-2): 65-77. Известно, что пентоксифиллин имеет активность ингибитора фосфодиэстеразы (PDE; см. MeskiniN. et al., Biochem. Pharm. 1994, 47(5), 781-788), а также активность в отношении к другим мишеням, но его точный механизм действия, приводящий к появлению клинических эффектов, неизвестен. Было показано, что пентоксифиллин улучшает текучесть крови благодаря реологическим свойствам крови, которые снижают вязкость крови и улучшают эластичность эритроцитов. Пентоксифиллин увеличивает также деформируемость лейкоцитов и ингибирует адгезию и активацию нейтрофилов (см. FDA label for pentoxifylline at http://www.fda.gov/cder/foi/nda/99/74-962Pentoxifyllineprntlbl.pdf). Помимо улучшения реологических свойств крови пентоксифиллин, как полагают, обладает противовоспалительными и антифибротическими свойствами. Клиническая фармакология пентоксифиллина приписывается лекарству-родителю, а также его метаболитам, хотя последовательность событий, приводящая к клиническому улучшению, все еще нуждается в определении. Пиковое содержание пентоксифиллина и его метаболитов в плазме достигается в течение часа. Структура пентоксифиллина и его различных описанных метаболитов показана ниже. Основные получающиеся метаболиты имеют формулы М-1 и М-5. Уровень этих метаболитов в плазме в пять и восемь раз выше, соответственно, чем у родительского соединения (см. FDA label forpentoxifylline at http://www.fda.gov/cder/foi/nda/99/74-962Pentoxifyllineprntlbl.pdf). Метаболит М-1 содержит хиральный центр и образуются и (R)- и (S)-энантиомеры. В процессе метаболизма пентоксифиллина происходит превращение между энантиомерами М-1 и пентоксифиллином. (S)-энантиомер является преобладающим М-1 (отношение S : R равно примерно 90 : 10 или больше) и его превращение происходит более быстро по сравнению с (R)-энантиомером. Менее значительный (R)-M-1-метаболит (известный как лизофиллин) обладает новыми противовоспалительными свойствами. В то время как оказывается, что активный метаболит М-1 играет центральную роль в клинической активности пентоксифиллина, другие метаболиты могут вызывать токсичность лекарства. Риск токсических реакций для пентоксифиллина может быть больше у пациентов, страдающих от почечной недостаточности (http://products.sanofiaventis.us/trental/trental.pdf). Согласно инструкции по медицинскому применению этого продукта пациенты с больными почками должны следить за работой почек. Более того,по меньшей мере одна инструкция предупреждает о том, что пентоксифиллин не следует вводить пациентам с серьезными нарушениями работы почек и печени. См. монографию Trental Product Monograph,Canada, December 16, 2008. У пациентов с больными почками уровни пентоксифиллина и М-1 в плазме стремятся к снижению, а уровни метаболитов М-4 и М-5 значительно повышаются в зависимости от степени серьезности состояния. См. Раар, Ann. Pharmacother., 1996, 30 : 724. Эти наблюдения позволяют предположить, что накопление метаболита М-5 может отвечать за ухудшенную переносимость лекарства у пациентов с почечной дисфункцией. Другие соединения, структурно подобные пентоксифиллину, являются биологически активными. Примеры таких соединений включают албифиллин, торбафиллин, А - 802715 и пропентофиллин, формулы которых приведены ниже. Несмотря на благоприятные свойства пентоксифиллина существует постоянная необходимость в создании новых соединений для лечения указанных выше болезней и состояний у большой популяции пациентов при уменьшении риска токсических реакций и других вредных эффектов. Сущность изобретения Данное изобретение относится к новым соединениям, которые являются дейтерированными замещенными производными ксантина и их фармацевтически приемлемыми солями. Например, настоящее изобретение относится к новым защищенным производным ксантина, которые структурно подобны пентоксифиллину. Изобретение предусматривает также композиции, содержащие одно или несколько соединений по изобретению и носитель, и применение описанных соединений и композиций в способах лечения болезней и состояний, для которых введение пентоксифиллина и родственных соединений является благоприятным. Краткое описание чертежей Фиг. 1 А и 1 В показывают уровни соединения по изобретению в сыворотке, это пентоксифиллин и некоторые его метаболиты, у четырех собак после орального введения комбинации пентоксифиллина и соединения по изобретению. На фиг. 2 показано время образования конкретных метаболитов, измеренное, как показано на фиг. 3, после инкубации различных соединений по изобретению, пентоксифиллина, (S)-M1 и (R)-M1 в цельной крови крысы. На фиг. 3 - относительное количество конкретных метаболитов после инкубации различных соединений по изобретению, пентоксифиллина, (S)-M1 и (R)-М 1 в цельной крови крысы. На фиг. 4 - время образования конкретных метаболитов, измеренное, как показано на фиг. 5, после инкубации различных соединений по изобретению, пентоксифиллина, (S)-M1 и (R)-M1, в микросомах печени человека. На фиг. 5 - относительное количество конкретных метаболитов после инкубации различных соединений по изобретению, пентоксифиллина, (S)-M1 и (R)-М 1, в микросомах печени человека. Подробное описание изобретения Термины "улучшать" и "лечить" являются взаимозаменяемыми и включают как терапевтическое,так и профилактическое лечение. Оба термина означают уменьшение, подавление, ослабление, снижение, остановку или стабилизацию развития или прогрессирования болезни (например, болезни или расстройства, описанных в этой заявке), уменьшение степени серьезности болезни или улучшение симптомов, связанных с болезнью. Термин "болезнь" означает любое состояние или расстройство, которое вредит нормальной функции клетки, ткани или органа или вмешивается в осуществление этой функции. Следует отметить, что некоторое изменение природного изотопного избытка происходит в синтезированном соединении в зависимости от происхождения химических веществ, используемых при синтезе. Так, препарат пентоксифиллина будет содержать небольшие количества дейтерированных изотопологов. Концентрация большого количества стабильного водорода и изотопов углерода, с учетом изменения,является небольшой и не играет никакой роли по сравнению со степенью стабильного изотопного заме-2 019088 щения соединений согласно данному изобретению. См., например, Wada E. et al., Seikagaku, 1994, 66: 15;Gannes LZ et al., Comp Biochem Physiol Mol Integr Physiol, 1998, 119: 725. В соединении по изобретению,когда обозначено конкретное положение как содержащее дейтерий, большое количество дейтерия в этом положении значительно больше, чем природное количество дейтерия, которое составляет 0,015%. Положение, обозначенное как содержащее дейтерий, обычно имеет минимальный фактор изотопного обогащения, равный по меньшей мере 3340 (50,1% дейтерия) у каждого атома, обозначенного в этом соединении как дейтерий. Термин "фактор изотопного обогащения" означает отношение изотопного обогащения и природного обогащения в конкретном изотопе. Согласно другим вариантам соединение по изобретению имеет фактор изотопного обогащения для каждого указанного атома дейтерия, равный по меньшей мере 3500 (52,5% включения дейтерия у каждого указанного атома дейтерия), по меньшей мере 4000 (60% включения дейтерия), по меньшей мере 4500(67,5% включения дейтерия), по меньшей мере 5000 (75% включения дейтерия), по меньшей мере 5500(82,5% включения дейтерия), по меньшей мере 6000 (90% включения дейтерия), по меньшей мере 6333,3(95% включения дейтерия), по меньшей мере 6466,7 (97% включения дейтерия), по меньшей мере 6600(99% включения дейтерия) или по меньшей мере 6633,3 (99,5% включения дейтерия). В соединениях по изобретению любой атом, не указанный как конкретный изотоп, представляет любой стабильный изотоп этого атома. Если иное не указано, когда положение указано конкретно как"Н" или "водород", то считается, что это положение содержит водород в его природном обогащении изотопом. Так же, если иное не указано, когда положение указано как "D" или "дейтерий", считается, что это положение содержит дейтерий в обогащении, которое по меньшей мере в 3340 раз больше, чем природное обогащение дейтерия, которое составляет 0,015% (то есть по меньшей мере 50,1% включения дейтерия). Термин "изотополог" относится к веществу, которое отличается от конкретного соединения по изобретению только изотопным составом. Термин "соединение" в отношении соединения по изобретению относится к собранию молекул,имеющих идентичную химическую структуру, за исключением того, что может быть изменение в изотопах среди атомов, составляющих молекулы. Так, специалистам ясно, что соединение, представленное конкретной химической структурой, содержащей указанные атомы дейтерия, будет также содержать меньшие количества изотопологов, содержащих атомы водорода у одного или более указанных положений дейтерия в этой структуре. Относительное количество таких изотопологов в соединении по изобретению будет зависеть от ряда факторов, включая чистоту изотопов в дейтерированных реагентах, использованных для получения соединения и эффективности включения дейтерия на различных стадиях синтеза получения соединения. Однако, как указано выше, относительное количество таких изотопологов in toto будет меньше чем 49,9% в расчете на соединение. Данное изобретение предусматривает также соли соединений по изобретению. Соль соединения по изобретению образуется кислотой и основной группой соединения, такой как аминогруппа, или основанием и кислотной группой соединения, такой как карбоксильная. Согласно другому варианту соединение представляет собой фармацевтическую соль присоединения. Термин "фармацевтически приемлемый", используемый в данной заявке, относится к компоненту,который с точки зрения здравого медицинского суждения пригоден для применения при контакте с тканями людей и других млекопитающих без проявления токсичности, раздражения, аллергической реакции и т.п. и соответствует разумному отношению польза/риск. "Фармацевтически приемлемая соль" означает любую нетоксичную соль, которая при введении реципиенту способна образовать, непосредственно или косвенно, соединение по изобретению. Термин "фармацевтически приемлемый противоион" означает ионную часть соли, которая не является токсичной при высвобождении из соли после введения реципиенту. Кислоты, обычно применяемые для получения фармацевтически приемлемых солей, включают неорганические кислоты, такие как сероводород, соляная кислота, бромисто-водородная кислота, иодистоводородная кислота, серная кислота и фосфорная кислота, а также органические кислоты, такие как птолуолсульфокислота, салициловая кислота, винная кислота, дивинная кислота, аскорбиновая кислота,малеиновая кислота, бензолсульфокислота, фумаровая кислота, глюконовая кислота, глюкуроновая кислота, муравьиная кислота, глутаминовая кислота, метансульфокислота, этансульфокислота, бензолсульфокислота, молочная кислота, щавелевая кислота, п-бромфенилсульфокислота, угольная кислота,янтарная кислота, лимонная кислота, бензойная кислота и уксусная кислота, а также родственные неорганические и органические кислоты. Такие фармацевтически приемлемые соли включают таким образом сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрогенфосфат, дигидрогенфосфат, метафосфат, пирофосфат, хлорид, бромид, иодид, ацетат, пропионат, деканоат, карилат, акрилат,формиат, изобутират, капрат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себакат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат,гидроксибензоат, метоксибензоат, фталат, терефталат, сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, -гидроксибутират, гликолят, малеоат, тартрат, метан-3 019088 сульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и другие соли. Согласно одному из вариантов фармацевтически приемлемые соли присоединения включают соли, образованные с минеральными кислотами, такими как соляная кислота и бромисто-водородная кислота, и особенно соли, образованные с органическими кислотами, такими как малеиновая кислота. Данное изобретение включает также сольваты и гидраты соединения по изобретению. Используемый термин "гидрат" означает соединение, которое содержит стехиометрическое или нестехиометрическое количество воды, связанной нековалентными внутримолекулярными силами. Применяемый термин"сольват" означает соединение, которое включает стехиометрическое или нестехиометрическое количество растворителя, такого как вода, ацетон, этанол, метанол, дихлорметан, 2-пропанол или т.п., связанного нековалентными внутримолекулярными силами. Атом углерода, который имеет заместители Y1 и Y2 в формулах А, Al, I и В, может быть в некоторых случаях хиральным (когда Y1, Y2 и R3 отличаются друг от друга) и в других случаях он может быть ахиральным (когда по меньшей мере два из Y1 ,Y2 и R3 являются одинаковыми). Этот атом углерода (то есть атом углерода, содержащий заместители Y1 и Y2) указан звездочкой в формулах А, Al, I и В. Как таковые, хиральные соединения по изобретению могут существовать или как индивидуальные энантиомеры, или как рацемические или скалемические смеси энантиомеров. Соответственно, соединение по изобретению будет включать рацемические и скалемические энантиомерные смеси, а также индивидуальные соответствующие стереоизомеры, которые практически не содержат другой возможный стереоизомер. Термин "практически не содержащий другие стереоизомеры" означает, что содержится менее 25% других стереоизомеров, предпочтительно меньше 10% других стереоизомеров, более предпочтительно менее 5% других стереоизомеров и наиболее предпочтительно менее 2% других стереоизомеров или менее "X" % других стереоизомеров (где X обозначает число между 0 и 100, включительно). Способы получения индивидуального энантиомера для данного соединения хорошо известны в уровне техники и могут применяться для конечных соединений или для исходного соединения или промежуточных соединений. Если иное не указано, когда соединение названо или указана его структура без обозначения стереохимии и оно имеет один или более хиральных центров, следует иметь в виду, что представлены все возможные стереоизомеры этого соединения. Термин "стабильные соединения" относится к соединениям, которые обладают стабильностью, достаточной для осуществления их получения и которые сохраняют свою целостность в течение достаточного промежутка времени, достаточного для указанных целей (например, получения терапевтического состава, промежуточных соединений, применяемых для синтеза терапевтических соединений, выделяемых или пригодных к хранению промежуточных соединений, осуществления лечения болезни или состояния, реагирующих на введение терапевтических агентов). Обозначение "D" означает дейтерий. "Стереоизомер" относится к энантиомерам и диастереомерам. Сокращения "трет.", "т" или "т-" относится к термину "третичный". Термин "алкилен" означает линейный или разветвленный двухвалентный углеводородный радикал,предпочтительно содержащий от одного до шести атомов углерода (C1-6 алкилен). Согласно некоторым вариантам алкиленовая группа содержит от 1 до 4 атомов углерода (C1-4 алкилен). Примеры "алкиленов" включают, без ограничения, метилен (-СН 2-), этилен (-СН 2 СН 2-), пропилен (-СН 2 СН 2 СН 3-), а также их разветвленные варианты, такие как (-СН(СН 3)-), -CH2CH(CH3) и т.п."Алкил" означает алифатическую углеводородную группу, которая может быть линейной или разветвленной, содержащей от 1 до 15 атомов углерода в цепи. Предпочтительные алкильные группы содержат от 1 до 12 атомов углерода в цепи и более предпочтительно от 1 до 6 атомов углерода. Термин"разветвленные" группы означает, что одна или несколько низших алкилов, таких как метил, этил или пропил, присоединены к линейному алкилу. Термин "низший алкил" означает, что в цепи содержатся от 1 до примерно 4 атомов углерода, при этом цепь может быть линейной или разветвленной. Примеры алкилов включают метил, фторметил, дифторметил, трифторметил, циклопропилметил, циклопентилметил,этил, н-пропил, изопропил, н-бутил, трет, бутил, н-пентил, 3-пентил, гептил, октил, нонил, децил и додецил; предпочтительны метил, дифторметил и изопропил. Алкильные группы могут быть замещены одной или несколькими группами, выбранными из галоида, циано, гидрокси, карбокси, алкокси, алкоксикарбонила, оксо, амино, алкиламино, диалкиламино, циклогетероалкила, алкилциклогетероалкила, арила,алкиларила, гетероарила и алкилгетероарила. Обычно любая алкильная или алкоксильная группа содержит от 1 до 6 атомов углерода. Термин "арил" означает ароматический карбоциклический радикал, содержащий от 6 до 10 атомов углерода. Примеры "арильных" групп включают фенил или нафтил. Арильные группы могут быть замещены одной или несколькими группами, которые могут быть одинаковыми или разными и могут быть выбраны из алкила, арила, аралкила, алкокси, арилокси, аралкилокси, галоида и нитро. Обычно любой алкил или алкокси, замещающие арильную группу, содержит от 1 до 6 атомов углерода. Термин "гетероарил" означает 5-10-членный ароматический моноциклический или многоцикличе-4 019088 ский углеводородный кольцевой радикал, в котором один или более атомов углерода в кольцевой системе не являются углеродами, а являются другими атомами, такими как азот, кислород или сера. Гетероарильные группы могут быть замещены одной или несколькими группами, которые могут быть одинаковыми или разными и могут быть выбраны из алкила, арила, аралкила, алкокси, арилокси, аралкилокси,галоида и нитро. Примеры гетероарильных групп включают пиразинил, фуранил, тиенил, пиридил, пиримидинил, изоксазолил, изотиазолил, пиридазинил, 1,2,4-триазинил, хинолинил и изохинолинил."Аралкил" означает арил-алкильную группу, в которой арил и алкил имеют значения, указанные выше. Предпочтительные аралкильные радикалы содержат низший алкил. Примеры аралкильных радикалов включают бензил и 2-фенетил."Циклоалкил" означает неароматическую, моно-, многоциклическую или мостиковую кольцевую систему, содержащую от 3 до 10 атомов углерода. Циклоалкильная группа может быть замещена одной или несколькими группами из галоида или алкила. Примеры моноциклических колец включают циклопентил, фторциклопентил, циклогексил и циклогептил. Термин "гетероциклоалкил" означает неароматическую моно-, ди- или трициклическую или мостиковую углеводородную кольцевую систему, в которой один или несколько атомов в кольцевой системе не являются атомами углерода, а представляют собой, например, азот, кислород или серу. Предпочтительные гетероциклоалкильные группы содержат кольца с 3-6 атомами в кольце. Примеры гетероциклоалкильных групп включают пирролидин, пиперидин, тетрагидропиран, тетрагидрофуран, тетрагидротиопиран и тетрагидротиофуран. "Циклоалкилалкил" означает группу, в которой циклоалкил и алкил имеют значения, указанные выше."Циклоалкилалкил" означает группу, в которой циклоалкил и алкил имеют значения, указанные выше. Термин "гетероилциклоалкил" означает группу, в которой циклоалкил и алкил имеют значения,описанные выше. Термин "возможно замещенный дейтерием" означает, что один или несколько атомов водорода в описанной группе или соединении могут быть замещены соответствующим числом атомов дейтерия. По всему данному тексту описания переменный радикал может быть указан как общее понятие (например, "каждый R") или может быть указан конкретно (например, R1, R2, R3 и т.д.). Если иное не указано, если переменный радикал указан общим понятием, он включает все конкретные варианты этого переменного радикала. Терапевтические соединения Данное изобретение предусматривает соединение формулы А:(А) или его фармацевтически приемлемую соль,где или его фармацевтически приемлемая соль, выбранные из следующих соединений: где "+" означает часть группы R4, связанную с C(Y1)(Y2) в соединении. Еще один вариант предусматривает соединение формулы В: или его фармацевтически приемлемую соль, где каждый из R1 и R2 независимо выбран из -СН 3 и -CD3; R5 обозначает водород или дейтерий; и(а) Y1 обозначает ОН и Y2 обозначает водород или дейтерий; или(б) Y1 и Y2, взятые вместе с атомом углерода, с которым они связаны, образуют С=О. По одному из аспектов R1 и R2 каждый обозначает CD3.-5 019088 Согласно другому аспекту Y1 и Y2, взятые вместе с атомом углерода, с которым они связаны, образуют С=О. Согласно еще одному аспекту Y1 обозначает ОН и Y2 обозначает водород или дейтерий. Конкретные примеры соединений формул А включают соединения, приведенные в табл. 1 (ниже),или их фармацевтически приемлемые соли, где "+" обозначает часть группы R4, связанную с C(Y1)(Y2) в соединении. В таблице соединения, обозначенные как "(R)" или "(S)" относится к стереохимии у атома углерода, содержащего заместитель Y1. Соединения без такого обозначения, содержащие хиральный атом углерода, связанный с Y1 и Y2, представляют собой рацемическую смесь энантиомеров. Таблица 1. Примеры конкретных соединений формулы А. Дейтерированные и/или фторированные аналоги пентоксифиллина и его метаболитов, где R5 обозначает D. В табл. 1 выше приведены примеры конкретных соединений формулы А. Эти соединения представляют собой дейтерированные и/или фторированные аналоги пентоксифиллина и его метаболитов, где R5 обозначает дейтерий. По одному аспекту этого варианта соединение не является любым из соединений 100, 116 или 149. Примеры конкретных соединений согласно изобретению включают следующие соединения: или фармацевтически приемлемую соль любого из указанных выше соединений. Согласно другому набору вариантов любой атом, не обозначенный как дейтерий в любом варианте,приведенном выше, содержится в виде атома с природным содержанием изотопов. Синтез соединений по изобретению может быть осуществлен химиками-специалистами. Релевантные способы и промежуточные соединения описаны, например, в Sidzhakova, D et al., Farmatsiya, (Sofia,Bulgaria) 1988, 38(4): 1-5; Davis, PJ et al., Xenobiotica, 1985, 15(12): 1001-10; Akgun, H et al., J Pharm Sci,2001, 26(2): 67-71; патенте Германии DD 274334; патенте Чехии CS 237719, CS 201558; заявке WO 9531450; и в патентах Японии JP 58150594, JP 58134092, JP 58038284, JP 57200391, JP 57098284, JP 57085387, JP 57062278, JP 57080385, JP 57056481, JP 57024385, JP 57011981, JP 57024386, JP 57024382, JP 56077279, JP 56032477, JP 56007785, JP 56010188, JP 56010187, JP 55122779 и JP 55076876. Такие способы можно осуществлять с применением соответствующих дейтерированных реагентов и, возможно, реагентов, содержащих другие изотопы, и/или промежуточных соединений или можно использовать обычные протоколы синтеза, известные из уровня техники, для введения атомов изотопа в химическую структуру. Примеры способов синтеза Способы синтеза возможных промежуточных соединений показаны ниже. Схема IA. Синтез соединений формулы I Как показано на схеме 1 А, дейтерийсодержащее соединение 10 алкилируют дейтерированным промежуточным соединением 11 (где X - ион хлора, брома или иода) в присутствии карбоната калия с получением соединения формулы I. Или же для получения соединений формулы I по способу, описанному в патенте США 4289776, можно применять гидроокись натрия в водном метаноле. Схема 1 В. Получение соединений, где Y1 = ОН из соединений формулы II Как показано на схеме IB, соединения формулы II можно применять для получения соединений, гдеY1 = ОН. Так, соединения формулы II восстанавливают или боргидридом натрия, или бордейтеридом натрия (коммерчески доступным с 99% D) по способу, описанному в ЕР 0330031, с получением соединений, где Y1 = ОН и Y2 = водород или дейтерий. Может быть выделен энантиомерный спирт, например,способом Nicklasson M. et al., Chirality, 2002, 14/8): 643-652. Согласно альтернативному способу ферментативная реакция позволяет получить спирт, обогащенный энантиомером, с применением методов, описанных в Pekala, E et al., Acta Poloniae Pharmaceutica, 2007, 64(2): 109-113, или Pekala, E et al., Biotech J,2007, 2(4): 492-496. Синтез соединения 10 Как показано на схеме 1 А, соединения, которые могут быть применены в качестве соединения 10 для получения соединений формулы I, известны и включают, без ограничения, следующие соединения: теобромин (где R1 и R2 обозначают СН 3), который коммерчески доступен, изотопологи соединения 10,где (a) R1 обозначает CD3 и R2 обозначает СН 3; (б) R1 обозначает СН 3 и R2 обозначает CD3; и (в) R1 и R2 обозначают CD3, являются все известными. См. Benchekroun, Y et al., J Chromatogr В, 1977, 688: 245; Ribon, В et al., Coll INSERM, 1988, 164: 268; и Horning, MG et al., Proc Int Conf Stable Isot 2nd, 1976, 41-54. 3 Метил-7-пропилксантин, где R1 обозначает н-пропил и R2 обозначает CH3, также коммерчески доступен. Соединение 10, где R1 обозначает СН 2 ОСН 3 и R2 обозначает CH3, также известно. См. заявку DE 3942872A1. Схема 2. Синтез соединений 10 Синтез соединения 10 показан на схеме 2 с применением в качестве исходного соединения коммер-7 019088 чески доступной N-нитрозо-N-метилмочевины. Обработка дейтерированным амином 12 в воде привела к получению N-алкилмочевины 13 по методу, описанному в Boivin, JL et al., Canadian journal of Chemistry,1951, 29: 478-81. Мочевина 13 может быть обработана 2-циануксусной кислотой и уксусным ангидридом с получением цианацетамида 14, который обрабатывают вначале водной NaOH и затем водной HCl с получением циклизованного пиримидиндиона 15 согласно методам Dubey, PK et al., Indian Journal ofHeterocyclic Chemistry, 2005, 14(4): 301-306. Или же цианацетамид 14 может быть обработан триметилсилилхлоридом и гексаметилдисилазаном с получением циклизованного продукта 15 по методу Fulle, Fet al., Heterocycles, 2000, 53(2): 347-352. В соответствии со способом, описанным Merlos M. Et al., European Journal of Medicinal Chemistry,1990, 25(8): 653-8, обработка пиримидиндиона 15 нитритом натрия в среде уксусной кислоты и затем гидроокисью аммония и дитионитом натрия приводит к получению соединения 16, которое обрабатывают муравьиной кислотой с получением производного пурина 17. По методу, описанному Rybar A. et al. в заявке Чехии CS 263595 В 1, алкилирование 17 дейтерированным электрофилом 18 (X обозначает хлор, бром или йод) в присутствии карбоната калия и, возможно,в присутствии добавок, таких как NaBr, KBr, NaI, KI или иод, позволяет получение соединения 10. Показанные на схеме 2 дейтерированные аминные реагенты 12 включают, но без ограничения, коммерчески доступные соединения, такие как н-пропил-d7-амин, или известные соединения, такие как 1-пропан-1,1d2-амин (Moritz F. Et al. Organic Mass Spectrometry, 1993, 28(3): 207-15). Дейтерированные мочевины 13 могут включать, но без ограничения, коммерчески доступные соединения, такие как N-метил-d3 мочевина(бромметокси-d2)-метан-d3 (Van der Veken, BJ et al., Journal of Raman Spectroscopy, 1992, 23(4): 205-23). Коммерчески доступные промежуточные дейтерированные соединения 12, 13 и 18, упомянутые выше,также доступны и имеют изотопную чистоту по меньшей мере 98 атом.% D. Схема 3. Синтез промежуточного соединения 11 а-d5-CD2(СН 2)3- и Y1 и Y2 вместе образуют С=О) отражен на схеме 3. Метиллитий добавляют к коммерчески доступному дельта - валеролактону 19 в соответствии со способом, описанным Zhang Q et al., Tetrahedron, 2006, 62(50): 11627-11634, с получением кетона 20. Обработка 20 TFA - d1 (99 атом.% D) в D2O(99 атом.% D) при воздействии микроволн обеспечивает получение дейтерированного кетона 21 согласно способу Fodor - Csorba K. Tet. Lett. 2002, 43: 3789-3792. Спиртовая группа в соединении 21 превращается в хлорид при обработке трифенилфосфином и четыреххлористым углеродом с получением соединения 11 а - d5 в соответствии с методом Clement J-L., Org Biomol. Chem. 2003, 1: 1591-1597. Схема 4 а. Синтез промежуточных соединений 11b-(R) Схемы 4 а и 4b отражают синтез энантиомеров хлоридов 11b-(R) (где Y1 обозначает фтор; Y2 выбран-8 019088 из водорода и дейтерия и соединение имеет (R)-конфигурацию) и 11b-(S) (где Y обозначает фтор; Y2 выбран из водорода и дейтерия и соединение имеет (S)-конфигурацию. На схеме 4 а дейтерированный (или недейтерированный защищенный бензильной группой спирт 27, такой как известный (5R)-5 фторгексил]-окси]метил]бензол (WO 2000/031003) подвергают для снятия защиты гидрирования в присутствии Pd/C с получением спирта 28. Спирт хлорируют тианилхлоридом по способу Lacan G. et al., J.Label Compd. Radiopharm, 2005, 48/9): 635-643 с получением хлорида 11b-(R). Согласно схеме 4b дейтерированный ( или недейтерированный ) спирт 29, такой как известный (S)(+)-5-фторгексанол (Riswoko A. et al., Enantiomer, 2002, 7(1): 33-39), хлорируют с получением хлорида 11b-(S). Схема 5. Синтез промежуточных соединений 11 с и 11e Схема 5 отражает синтез других промежуточных соединений 11 с и 11e. Согласно методам Kutner,Andrzej et al., Journal of Organic Chemistry, 1988, 53(15): 3450-7 или Larsen, SD et al., Journal of MedicinalChemistry, 1994, 37(15): 2343-51, соединения 30 или 31 (где X обозначает галоидид) могут быть обработаны дейтерированным реактивом Гриньяра 32 с получением промежуточного соединения 11c, где R3 и(DAST) в дихлорметане или толуоле приводит к получению промежуточного соединения 11 е, где R3 и Y2 одинаковые, Y1 обозначает F и Х- галоидид, согласно способам Karst, NA et al., Organic Letters, 2003,5(25): 4839-4842 или Kiso, M et al., Carbohydrate Research, 1988, 177: 51-67. Коммерчески доступные галоидные соединения могут применяться для получения соединений 11,как показано на схеме 5. Например, коммерчески доступный 5-хлорвалерилхлорид или коммерчески доступный 5-бромвалерилхлорид, или коммерчески доступный этил-5-бромвалерат могут применяться в качестве реагентов 30 или 31. Как показано на схеме 5, применение коммерчески доступного метил-d3 магнийиодида в качестве реактива Гриньяра 32 позволяет получить электрофил 11, где R3 и Y2 одновременно обозначают CD3. Схема 6. Синтез промежуточного соединения 11e (X=Br) Схема 6 отражает другой способ синтеза промежуточного соединения 11e, где R3 и Y2 одинаковы иX=Br. Так, согласно способу Hester J.B. et al., Journal of Medicinal Chemistry, 2001, 44(7): 1099 - 1115 коммерчески доступный 4-хлор-1-бутанол защищают путем обработки 3,4-дигидро-2 Н-пираном (DHP) и камфосульфокислотой (CSA) с получением хлорида 33. Обработка соответствующего реактива Гриньяра магнием с добавлением ацетона (R3 = Y2 = CH3) или ацетона-d6 (Y2 = R3 = CD3) приводит к получению спирта 34. Фторирование диэтиламиносеры трифторидом (DAST) в дихлорметане приводит к получению фторида 35. Снятие защиты при помощи CSA в МеОН обеспечивает получение спирта 36, а обработка Nбромсукцинимидом и трифенилфосфином обеспечивает получение промежуточного соединения 11e. Схема 7. Альтернативный синтез промежуточного соединения 11 е (X=Br) Схема 7 отражает синтез промежуточного соединения 11 е, где R3 и Y2 одинаковы и X=Br. Коммерчески доступный 4-гидроксибутановой кислоты этиловый эфир 37 обрабатывает DHP и CSA или DHP,TsOH и пиридином с получением эфира 38. Восстановление при помощи LiAlD4 приводит к получению дейтерированного спирта 39, который обрабатывают или трифенилфосфином в CCl4 (Sabitha G. et al.,Tetrahedron Letters, 2006, (том вышел в 2007), 48(2): 313-315), или метансульфонилхлоридом, хлоридом лития и 2,6-лутидином в DMF (Blaszykowski С. et al., Organic Letters, 2004, 6(21): 3771-3774) с получением хлорида 40. Как показано на схеме 6, хлорид 40 можно превратить в соединение 11 е. Схема 10. Синтез промежуточного соединения 11c-d2 Схема 10 отражает получение 11c-d2, где R3 и Y2 одинаковы. Известный дейтерированный эфир 46(Feldman K.S. et al., Journal of Organic Chemistry, 2000, 65(25): 8659-8668) обрабатывают тетрабромидом углерода и трифенилфосфином (Brueckner A.M. et al., European Journal of Organic Chemistry, 2003 (18): 3555-3561) с получением эфира 47, где Х-бромид, или обрабатывают метансульфонилхлоридом и триэтиламином, затем хлоридом лития и DMF (Sagi K. et al., Bioorganic and Medicinal Chemistry, 2005, 13(5): 1487-1496) с получением эфира 47, где X обозначает хлорид. Как на схеме 5, обработка эфира 47 дейтерированным реагентом Гриньяра 48 обеспечивает получение 11 с-d2-. Например, применение коммерчески доступного метил-d3 магнийиодида в качестве реагента Гриньяра 48 обеспечивает получение соединения 11c-d2, где R3 и Y2 обозначают оба CD3. Дополнительные известные хлориды, которые могут быть применены в качестве реагента 11 на схеме 1 А, включают: 1-хлор-5,5-дифторгексан (Rybezynski, PJ et al., J. Med. Chemistry, 2004, 47(1): 196-209); 1-хлор-5 фторгексан (Chambers, RD et al., Tetrahedron, 2006, 62(30): 7162-7167); 6-хлор-2-гексанол (заявка ЕР 0412596); (S)-6-хлор-2-гексанол (Keinan, E. et al., J. Am. Chem. Soc, 1986, 108(12): 3474-3480); коммерчески доступный (R)-6-хлор-2-гексанол; коммерчески доступный 6-хлор-2-гексанон; известный 6-хлор-2 метилгексан-2-ол (Kutner, A. et al., Journal of Organic Chemistry, 1988, 53(15): 3450-7); известный 6-бром 2-метилгексан-2-ол (Kutner, A. et al., Journal of Organic Chemistry, 1988, 53(15): 3450-7); известный 1 бром-5-фтор-5-метилгексан (Hester, J.B. et al., Journal of Medicinal Chemistry, 2001, 44(7): 1099-1115). Схема 11. Синтез соединений формулы А 1 Схема 11 отражает синтез соединения формулы А 1. Так, соединение формулы I обрабатывается карбонатом калия в D2O для осуществления реакции обмена водорода на дейтерий с получением соединения формулы А 1. Специалисту в данной области очевидно, что другие реакции обмена водорода на дейтерий могут также происходить еще где-нибудь в молекуле. Схема 12. Альтернативный синтез соединений формулы А 1 На схеме 12 показан альтернативный синтез соединения формулы А 1. Так, промежуточное соединение 10 (см. схему 1 А) обрабатывается карбонатом калия в D2O для осуществления реакции обмена водорода на дейтерий с получением соединения 50 в качестве N-D или N-Н вещества. Алкилирование промежуточным соединением 11 в присутствии карбоната калия с получением соединений формулы А 1. Для получения соединений формулы А можно использовать ряд новых промежуточных соединений. Соединения а-d, показанные выше, могут быть получены, как описано в Org. Lett., 2005, 7: 14271429, с применением дейтерированных исходных соединений. Соединения е-о могут быть получены из соответствующих бромидов, перечисленных выше со ссылкой на схему 15, приведенную ниже. Некоторые ксантиновые промежуточные соединения, пригодные для получения соединений по изобретению, также являются новыми. Например, дейтерированное производное ксантина общей формулы III где W обозначает водород или дейтерий и каждый из R и R независимо выбран из водорода, дейтерия, С 1-3 алкила, возможно замещенного дейтерием, и С 1-3 алкоксиалкила, возможно замещенного дейтерием. Примеры R1 и R2, С 1-3 алкила включают -CH3, -CD3, -СН 2 СН 2 СН 3 и -CD2CD2CD3. Примеры С 1-3 алкоксилов включают -СН 2 ОСН 2 СН 3, -CD2OCH2CH3, -CD2OCD2CH3 и -CD2OCD2CD3. Примеры приемлемых солей включают, но без ограничения, соль лития, соль натрия, соль калия и соль цезия. Примером особенно пригодной соли является соль калия. Конкретные подходы к синтезу и соединения, описанные выше, не ограничивают изобретение. Химические структуры на схемах отражают переменные радикалы, которые подпадают под определения химических групп (групп, атомов и т.д.) в соответствующем положении в формуле соединения или обозначения (а именно R1, R2, R3 и т.д.) или не подпадают. Пригодность химической группы в структуре соединения для применения при синтезе другого соединения определяется специалистом в данной области. Другие методы синтеза соединений по изобретению и их предшественники, включая те, которые не показаны на приведенных схемах, также находятся в компетенции специалистов. Химические превращения и применение защитных групп (защита и снятие защиты), пригодные для синтеза соединений, известны и включают, например, описанные в Larock R, Comprehensive Organic Transformations, VCH Publishers (1989); Greene TW et al., Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons (1999);Fieser L et al., Fieser and Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994); and Paquette L.,ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и последующие их издания. Комбинации заместителей и переменных, предусмотренные данным изобретением, могут быть только такими, которые приводят к получению стабильных соединений. Композиции Данное изобретение предусматривает также апирогенные композиции, включающие эффективное количество соединения по изобретению или его фармацевтически приемлемой соли и приемлемый носитель. Предпочтительно, чтобы композиция по изобретению составлялась для фармацевтического применения ("фармацевтическая композиция"), когда носитель является фармацевтически приемлемым. Носитель(-и) должен быть "приемлемым" в смысле совместимости с другими ингредиентами состава и, в слу- 11019088 чае фармацевтически приемлемого носителя, не вредным для реципиента в количестве, используемом в лекарстве. Фармацевтически приемлемые носители, адъюванты и наполнители, которые могут быть использованы в фармацевтических композициях по изобретению, включают, но без ограничения, ионообменники,окись алюминия, стеарат алюминия, лецитин, белки сыворотки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, смеси частичных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, динатриевую соль кислого фосфата, калиевую соль кислого фосфата, хлористый натрий, соли цинка, коллоидную двуокись кремния, трисиликат магния, поливинилпирролидон, целлюлозы, полиэтиленгликоль, натриевую соль карбоксиметилцеллюлозы, полиакрилаты, воски, блокполимеры полиэтилена - полиоксипропилена, полиэтиленгликоль и шерстяной жир. Если это требуется, растворимость и биодоступность соединений по изобретению в фармацевтических композициях может быть улучшена методами, известными из уровня техники. Один такой метод включает применение липидных эксципиентов в составе. См. "Oral Lipid-Based Formulations: Enhancingthe Bioavailability of Poorly Water-Soluble Drugs (Drugs and the Pharmaceutical Sciences), "David J. Hauss,ed. Informa Healthcare, 2007 и "Role of Lipid Excipients in Modifying Oral and Parenteral Drug Delivery: Basic Principles and Biological Examples," Kishor M. Wasan, ed. Wiley-Interscience, 2006. Другой известный метод повышения биодоступности состоит в применении аморфной формы соединения по изобретению вместе с полоксамером, таким как LUTROL и PLURONIC (BASF Corporation) или блок-сополимерами окиси этилена и окиси пропилена. См. патент США 7014866 и заявки США на патент 20060094744 и 20060079502. Фармацевтические композиции по изобретению включают композиции, пригодные для орального,ректального, назального, топического (включая буккальное и подъязычное), вагинальное или парентеральное (включая подкожное, внутримышечное, внутривенное и внутрикожное) введение. Согласно некоторым вариантам соединение указанных формул вводится трансдермально (например, с применением трансдермального пластыря или метода ионтофореза). Другие составы могут быть в виде стандартных лекарственных форм, например таблеток, капсул с пролонгированным высвобождением, липосом и могут быть приготовлены любыми методами, хорошо известными из уровня техники. См., например, Remington's Pharmaceutical Sciences, Mack Publishing Company, Philadelphia, PA (17th ed. 1985). Такие препаративные методы включают стадию соединения с веществом, которое должно вводиться, ингредиентов, таких как носитель, который составляет один или несколько вспомогательных компонентов. В общем, композиции готовят путем равномерного и тщательного соединения активных ингредиентов с жидкими носителями, липосомами или мелко измельченными твердыми носителями, или с теми и другими и затем, если это необходимо, формования продукта. По некоторым вариантам соединение вводят орально. Композиции по данному изобретению, подходящие для орального введения, могут быть в виде дискретных форм, таких как капсулы, саше или таблетки, каждая из которых содержит заданное количество активного ингредиента; порошка или гранул; раствора или суспензии в водной жидкости или неводной жидкости; эмульсии масло-в-воде; жидкой эмульсии вода-в-масле; упаковки в липосомах; или в виде болюса и т.д. Мягкие желатиновые капсулы могут подходить для помещения таких суспензий, которые могут повысить скорость абсорбции соединения. В случае таблеток для орального введения носители, которые обычно применяют, включают лактозу и кукурузный крахмал. Обычно добавляются также смазывающие агенты, такие как стеарат магния. Для орального введения в виде капсулы подходящие разбавители включают лактозу и высушенный кукурузный крахмал. Когда орально вводятся водные суспензии, активный ингредиент соединяют с эмульгаторами и суспендирующими агентами. Если это желательно, можно добавлять некоторые подсластители и/или ароматизаторы и/или красители. Композиции, подходящие для орального введения, включают леденцы, содержащие ингредиенты в ароматизированной основе, обычно сахарозе и смоле акации или трагаканте; и постилки, содержащие активные ингредиенты в инертной основе, такой как желатин и глицерин, или сахарозе и смола акации. Композиции, пригодные для парентерального введения, включают водные и не водные стерильные растворы для инъекции, которые могут содержать антиоксиданты, буферные вещества, бактериостатики и солюты, которые придают раствору изотоничность с кровью реципиента; а также водные и не водные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Составы могут быть в контейнерах со стандартной дозой или с многократными дозами, например, в герметичных ампулах и флаконах, и могут храниться в высушенном замораживанием (лиофильном) состоянии, требующем только добавления стерильного жидкого носителя, например воды для инъекций сразу же перед применением. Растворы и суспензии для инъекции, приготовленные по индивидуальному рецепту, могут быть получены из стерильных порошков, гранул и таблеток. Такие растворы для инъекции могут быть, например, в виде стерильной или масляной суспензии для инъекций. Эта суспензия может быть приготовлена согласно методам, известным из уровня техники,с применением подходящих диспергирующих или смачивающих агентов (таких как, например, Tween 80) и суспендирующих агентов. Стерильный препарат для инъекций может также быть стерильным раствором или суспензией в нетоксичных парентерально приемлемых разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых наполнителей и растворителей, которые могут применяться, находятся манит, вода, раствор Рингера и изотонический раствор хлористого натрия. Кроме того, нелетучие масла обычно применяются в качестве растворителя или суспендирующей среды. Для этой цели можно применять любое нелетучее масло, включая моно- и диглицериды. При получении инъецируемых препаратов пригодны жирные кислоты, такие как олеиновая кислота и ее глицеридное производное, как и природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированном виде. Эти масляные растворы или суспензии могут также содержать разбавитель типа длинноцепного спирта или диспергатор. Фармацевтические композиции по изобретению могут вводиться в виде суппозиториев для ректального введения. Эти композиции могут быть получены путем смешения соединения по изобретению с подходящим не раздражающим эксципиентом, который является твердым при комнатной температуре и жидким при ректальной температуре и, следовательно, будет плавиться в заднем проходе с высвобождением активных компонентов. Такие материалы включают, без ограничения, масло какао, пчелиный воск и полиэтиленгликоли. Фармацевтические композиции по изобретению можно вводить при помощи назального аэрозоля или путем ингаляции. Такие композиции готовят хорошо известными методами и могут быть получены в виде растворов в физиологическом растворителе с применением бензилового спирта или других подходящих консервантов, промоторов абсорбции для облегчения биодоступности, фторсодержащих углеводородов и/или других солюбилизирующих или диспергирующих агентов, известных из уровня техники. См., например, Rabinowitz, JD и Zaffaroni, AC, патент США 6803031 assigned to Alexza Molecular DeliveryCorporation. Топическое введение фармацевтических композиций по изобретению особенно полезно, когда лечение направлено на поверхности или органы, которые легко доступны при топическом нанесении. Для топического нанесения на кожу фармацевтическая композиция должна быть получена в виде мази, содержащей активные ингредиенты, суспендированные или растворенные в носителе. Такие носители для топического введения соединений по изобретению включают, без ограничения, минеральное масло,жидкий петролатум, белый петролатум, пропиленгликоль, полиоксиэтилен-полиоксипропиленовое соединение, эмульсионный воск и воду. Или же фармацевтическая композиция может быть получена в виде лосьона или крема, содержащего активное соединение, суспендированное или растворенное в носителе. Подходящие носители включают, без ограничения, минеральное масло, моностеарат сорбитана, полисорбат 60, цетиловые эфиры, воск, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт, а также воду. Фармацевтические композиции по изобретению могут быть топически применены в нижнем кишечном тракте при помощи ректального суппозитория или клизмы. Данное изобретение охватывает топически-трансдермальные пластыри и лекарственный электрофорез (ионтофорез). Нанесение терапевтических веществ может быть локальным, когда они вводятся в нужном месте. Для введения композиций в нужное место могут быть применены различные методы, такие как инъекция, применение катетеров, троакаров, "фонтанчиков", плюроникового геля, стентов, полимеров с пролонгированным высвобождением или другого устройства, позволяющего осуществить внутренний доступ. Так, согласно еще одному варианту соединения по изобретению могут быть введены в композиции для покрытия имплантируемого медицинского устройства, такого как протезы, искусственные клапаны,сосудистые имплантаты, стенты или катетеры. Подходящие покрытия и общий способ изготовления имплантируемых устройств с покрытием известны из уровня техники и описаны в патентах США 6099562,5886026 и 5304121. Покрытия выполняют обычно из биосовместимых полимерных материалов, таких как полимерный гидрогель, полиметилдисилоксан, поликапролактон, полиэтиленгликоль, полимолочная кислота, сополимер этилена с винилацетатом и их смеси. На покрытия могут быть нанесены верхние слои из фторированного силикона, полисахаридов, полиэтиленгликоля, фосфолипидов или их комбинаций для придания композиции свойства контролируемого высвобождения. Покрытия для инвазивных устройств должны включаться в определение фармацевтически приемлемого носителя, адъюванта или наполнителя, используемое в данной заявке. Согласно еще одному варианту данное изобретение предусматривает способ нанесения покрытия на имплантируемое медицинское устройство, включающий стадию контактирования этого устройства с композицией для покрытия, описанной выше. Для специалистов в данной области является очевидным,что покрытие устройства нужно осуществлять до его имплантации млекопитающему. Согласно еще одному варианту данное изобретение предусматривает способ пропитки устройства с имплантируемым лекарством, включающий стадию контактирования указанного устройства с высвобождением лекарства с соединением или композицией по изобретению. Эти имплантируемые устройства включают, без ограничения, биоразлагаемые полимерные капсулы или пулевидные приспособления, не разлагающиеся, способные к диффузии полимерные капсулы и биоразлагаемые полимерные облатки. Согласно другому варианту данное изобретение предусматривает имплантируемое медицинское устройство с покрытием на основе соединения или композиции, содержащей соединение по изобретению, являющееся терапевтически активным. Согласно еще одному варианту изобретение предусматривает имплантируемое устройство, высвобождающее лекарство, пропитанное соединением или композицией, содержащей соединение по изобретению, или содержащее такие соединение или композицию, при этом указанное соединение высвобождается из указанного устройства и является терапевтически активным. Когда орган или ткань доступны, будучи удаленным из организма пациента, такие орган или ткань могут окунаться в среду, содержащую композицию по изобретению, композиция по изобретению может быть нанесена на орган или же эта композиция может быть применена любым другим удобным методом. Согласно еще одному варианту композиция по изобретению содержит также второй терапевтический агент. Этот второй терапевтический агент может быть выбран из любого соединения или терапевтического агента, который имеет или демонстрирует благоприятные свойства при введении с соединением, имеющим тот же механизм действия, что и пентоксифиллин. Такие агенты включают соединения,указанные как полезные для комбинации с пентоксифиллином, включая, без ограничения, агенты, описанные в WO 1997019686, ЕР 0640342, WO 2003013568, WO 2001032156, WO 2006035418 и WO 1996005838. Предпочтительно, чтобы второй терапевтический агент был агентом, пригодным для лечения или профилактики болезни или состояния, выбранных из периферической обструктивной болезни сосудов,гломерулонефрита, нефротического синдрома, неалкогольного стеатогепатита, лешманиаза, цирроза,печеночной недостаточности, мышечной дистрофии Дюшенна, поздних лучевых повреждений, лимфедемы, вызванной облучением, некроза, связанного с облучением, алкогольного гепатита, фиброза, ассоциируемого с облучением, алкогольного гепатита, фиброза, связанного с облучением, некротизирующего энтероколита у недоношенных детей, диабетической нефропатии, почечной недостаточности, вызванной гипертонией, а также другого хронического заболевания почек; фокального сегментного гломерулосклероза, легочного саркоидоза, рецидивирующего афтозного стоматита, хронической боли груди при раке груди, опухолей мозга и центральной нервной системы, синдрома плохое питание - воспаление - кахексия, болезни, опосредованной интерлейкином-1, реакции отторжения имплантата и других аллографтов,жирной печени, вызванной питанием, атероматозных очагов повреждения дегенерации жирной печени и других дегенеративных состояний тканей, вызванных питанием с высоким содержанием жира или употреблением алкоголя, вируса иммунодефицита человека типа 1 (ВИЧ-1) и других ретровирусных инфекций у человека; рассеянного склероза, рака, фибропролиферативных заболеваний, грибковой инфекции,нефротоксичности, вызванной употреблением лекарств, коллагенного колита и других заболеваний и/или состояний, характеризующихся повышенным содержанием тромбоцитарного фактора роста(PDGF) или другими воспалительными цитокинами, эндометриоза, оптической нейропатии и ухудшения состояния ЦНС, ассоциируемого с приобретенным синдромом иммунодефицита (AIDS), иммунных расстройств или множественного склероза, аутоиммунной болезни, вирусной инфекции верхних дыхательных путей, депрессии, недержания мочи, синдрома раздраженного кишечника, септического шока, болезни Альцгеймера, нейропатической боли, дисурии, повреждения ретинального и оптического нерва,пептической язвы, инсулинзависимого диабета, неинсулинзависимого диабета, диабетической нефропатии, метаболического синдрома, ожирения, резистентности к инсулину, дислипидемии, патологической переносимости глюкозы, гипертонии, гиперлипидемии, гиперурикемии, подагры, гиперкоагуляции и воспаления или повреждения, связанных с нейтрофильным хемотаксисом и/или дегрануляцией. Соединения по изобретению могут также применяться для контроля внутриглазного давления или для стабилизации ауторегуляции церебрального тока крови у субъектов, которым требуется такой контроль, что выявлено при медицинском осмотре. По одному из вариантов второй терапевтический агент выбирается из -токоферола и гидроксимочевины. Согласно другому варианту второй терапевтический агент пригоден для лечения диабета или связанного с ним расстройства. Он выбирается из инсулина и аналогов инсулина, агонистов рецептора глюкагонподобного пептида-1 (GLP-1), сульфонилмочевин, бигуанидов, ингибиторов альфа-глюкозидазы,агонистов PPAR, меглитинидов, ингибиторов дипептидил-пептидазы (DPP) IV, ингибиторы других фосфодиэстераз (PDE1, PDE5, PDE9, PDE10 или PDE1), агонистов амилина, ингибиторов коэнзима А и агентов от ожирения. Конкретные примеры инсулинов включают Humulin (человеческий инсулин из рДНК), Novolin(человеческий инсулин на основе рДНК), Velosulin BR (человеческий буферированный инсулин на основе рДНК), Exubera (человеческий инсулин для ингаляции) и другие формы инсулина для ингаляции,например, поставляемая Mannkind's "Technosphere Insulin System". Конкретные примеры аналогов инсулина включают, без ограничения, новарапид, детемир-инсулин,инсулин лиспро, инсулин гларгин, цинковая суспензия инсулина и инсулин Lys-Pro. Конкретные примеры агонистов рецептора глюкагон-подобного пептида-1 включают, без ограни- 14019088 чения BIM-51077 (CAS-No. 275371-94-3), EXENATIDE (CAS-No. 141758-74-9), CJC-1131 (CAS-No. 532951 -64-7), LIRAGLUTIDE (CAS-No. 20656-20-2) и ZP-10 (CAS-No. 320367-13-3). Конкретные примеры сульфонилмочевин включают, без ограничения, TOLBUTAMIDE (CAS-No. 000064-77-7), TOLAZAMIDE (CAS-No. 001156-19-0), GLIPIZIDE (CAS-No. 029094-61-9), CARBUTAMIDE (CAS-No. 000339-43-5), GLISOXEPIDE (CAS-No. 025046-79-1), GLISENTIDE (CAS-No. 03279792-5), GLIBORNURIDE (CAS-No. 026944-48-9), GLIBENCLAMIDE (CAS-NO. 010238-21-8), GLIQUIDONE (CAS-No. 033342-05-1), GLIMEPIRIDE (CAS-No. 093479-97-1) и GLICLAZIDE (CAS-No. 02118798-4). Примером бигуанидного агента является, без ограничения, METFORMIN (CAS-No. 000657-24-9). Конкретные примеры ингибиторов альфа-гликозидазы включают, без ограничения, ACARBOSE(CAS-No. 056180-94-0), MIGLITOL (CAS-No. 072432-03-2) и VOGLIBOSE (CAS-No. 083480-29-9). Конкретные примеры агонистов PPAR включают, без ограничения MURAGLITAZAR (CAS-No. 331741-94-7), ROSIGLITAZONE (CAS-No. 122320-73-4), PIOGLITAZONE (CAS-No. 111025-46-8), RAGAGLITAZAR (CAS-No. 222834-30-2), FARGLITAZAR (CAS-No. 196808-45-4), TESAGLITAZAR (CASNo. 251565-85-2), NAVEGLITAZAR (CAS-No. 476436-68-7), NETOGLITAZAONE (CAS-No. 161600-017), RIVOGLITAZONE (CAS-No. 185428-18-6), K-1 11 (CAS-No. 221564-97-2), GW-677954 (CAS-No. 622402-24-8), FK-614 (CAS-No. 193012-35-0) и (-)-Halofenate (CAS-No. 024136-23-0). Предпочтительные агонисты PPAR представляют собой ROSGLITAZONE и PIOGLITAZONE. Конкретные примеры гелитинидных агентов включают, без ограничения, REPAGLINIDE (CAS-No. 135062-02-1), NATEGLINIDE (CAS-No. 105816-04-4) и MITIGLINIDE (CAS-No. 145375-43-5). Конкретные примеры ингибиторов DPP IV включают, без ограничения, SITAGLIPTIN (CAS-No. 486460-32-6), SAXAGLIPTIN (CAS-No. 361442-04-8), VILDAGLIPTIN (CAS-No. 274901-16-5), DENAGLIPTIN (CAS-No. 483369-58-0), P32/98 (CAS-No. 251572-70-0) и NVP-DPP-728 (CAS-No. 247016-69-9). Конкретные примеры ингибиторов PDE5 включают, без ограничения, SILDENAFIL (CAS-No. 139755-83-2), VARDENAFIL (CAS-No. 224785-90-4) и TADALAFIL (CAS-No. 171596-29-5). ПримерыPDE1, PDE9, PDE10 или PDE11, которые могут применяться согласно данному изобретению, можно найти в US 20020160939, WO 2003037432, US 2004220186, WO 2005/003129, WO 2005012485, WO 2005120514 и WO 03077949. Конкретный пример агониста амилина представляет собой, без ограничения, PRAMLINITIDE(CAS-No. 151126-32-8). Конкретный пример ингибитора коэнзима А представляет собой, без ограничения, ETOMOXIR(CAS-No. 082258-36-4). Конкретные примеры агентов от ожирения включают, без ограничения, HMR-1426 (CAS-No. 262376-75-0), CETILISTAT (CAS-No. 282526-98-1) и SIBUTRAMINE (CAS-No. 106650-56-0). Согласно другому варианту изобретения предусматривает отдельные лекарственные формы соединения по изобретению и одного или нескольких из описанных выше вторых терапевтических агентов, в которых это соединение и второй терапевтический агент связаны друг с другом. Термин "связанные друг с другом" означает, что отдельные лекарственные формы упакованы вместе или присоединены одна к другой таким образом, что является очевидным, что отдельные лекарственные формы предназначены для совместной продажи и применения (в течение менее 24 ч одна после другой, последовательно или одновременно). В фармацевтических композициях по изобретению соединение по изобретению содержится в эффективном количестве. Применяемый в данной заявке термин "эффективное количество" относится к количеству, которое при введении по нужной схеме достаточно для лечения (терапевтически или профилактически) нужного расстройства. Например, эффективное количество является достаточным для уменьшения или смягчения степени серьезности, продолжительности или развития расстройства, подвергающегося лечению, предотвращения прогрессирования этого расстройства, возникновения регрессии такого расстройства и улучшения эффективности профилактических или терапевтических эффектов(-а) другого метода лечения. Взаимосвязь доз для животных и людей (в мг/м 2 поверхности тела) описана в Freireich et al., CancerChemother. Rep. 1966, 50 : 219. Площадь поверхности тела может быть определена примерно, исходя из роста и веса пациента. См., например, Scientific Tables, Geigy Pharmaceuticals, Ardsley, N.Y., 1970, 537). Согласно одному из вариантов эффективное количество соединения по изобретению находится в пределах от 20 до 2000 мг на прием. Согласно конкретным вариантам это количество находится в пределах от 40 до 1000 мг, или в пределах от 100 до 800 мг, или в пределах от 200 до 400 мг на прием. Прием лекарства обычно производится ежедневно от 1 до 3 раз в день. Эффективные дозы будут меняться, как известно специалистам, в зависимости от вида болезни,серьезности заболевания, метода введения, пола, возраста и общего состояния здоровья пациента, используемого эксципиента, возможности применения совместно с другими терапевтическими препаратами, например другими агентами, и от мнения лечащего врача. Например, инструкцию по выбору эффективной дозы можно найти в информации о пентоксифиллине. Для фармацевтических композиций, которые содержат второй терапевтический агент, эффективное количество второго терапевтического агента составляет примерно от 20 до 100% от дозы, применяемой в монотерапии с применением этого агента. Предпочтительно эффективное количество составляет от примерно 70 до 100% от обычной монотерапевтической дозы. Обычные монотерапевтические дозы вторых терапевтических агентов хорошо известны. См., например, Wells et al., eds., Pharmacotherapy Handbook,2nd Edition, Appleton and Lange, Stamford, Conn. (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, Calif. (2000), каждый из этих источников включен в данную заявку в качестве ссылки. Ожидается, что некоторые из вторых терапевтических агентов, описанных выше, будут действовать синергически с соединениями по изобретению. Когда это имеет место, это позволяет уменьшить эффективные дозы второго терапевтического агента и/или соединения по изобретению по сравнению с дозами,которые требуются в монотерапии. Это дает преимущества, состоящие в минимизации токсичных побочных эффектов от второго терапевтического агента или соединения по изобретению, синергическом повышении эффективности, легкости введения или применения и/или уменьшения расходов на препараты, содержащие соединение или композицию. Способы лечения Согласно одному из вариантов данное изобретение предусматривает способ ингибирования активности фосфодиэстеразы (PDE) в клетке, включающий контактирование клетки с одним или несколькими соединениями формул А, А 1, I, II и В. Известно, что в дополнение к активности, ингибирующей PDE, пентоксифиллин подавляет продуцирование ряда других биологических агентов, таких как интерлейкин-1 (IL1), IL-6, IL-12, TNF-альфа, фибриноген и различные факторы роста. Согласно другому варианту изобретение предусматривает способ подавления продуцирования интерлейкина-1 (IL-1), IL-6, IL-12, TNF-альфа,фибриногена и различных факторов роста в клетке, включающий контактирование клетки с одним или более соединениями формул А, А 1, I, II или В. Согласно другому варианту данное изобретение предусматривает способ лечения заболевания у пациента, нуждающегося в этом, которое успешно подвергается лечению пентоксифиллином, включающий стадию введения указанному пациенту эффективного количества соединения формул А, А 1, I, II или В или фармацевтической композиции, содержащей соединение формулы А, А 1, I, II или В и фармацевтически приемлемый носитель. Такие болезни хорошо известны и описаны, но без ограничения, в следующих патентах и опубликованных заявках: WO 1988004928, ЕР 0493682, US 5112827, ЕР 0484785, WO 1997019686, WO 2003013568, WO 2001032156, WO 1992007566, WO 1998055110, WO 2005023193, US 4975432, WO 1993018770, ЕР 0490181 и WO 1996005836. Такие болезни включают, без ограничения, закупорку периферических сосудов, гломерулонефрит, нефротический синдром, неалкогольный стеатогепатит, лейшманиоз, цирроз, печеночную недостаточность, мышечную дистрофию Дюшенна, поздние повреждения,вызванные облучением, лимфедему, вызванную облучением, некроз, ассоциируемый с облучением, алкогольный гепатит, фиброз, ассоциируемый с облучением, некротизирующий энтероколит у недоношенных детей, диабетическую нефропатию, печеночную недостаточность, вызванную гипертонией, и другие хронические заболевания почек, фокальный сегментный гломерулосклероз, легочный саркоидоз, рецидивирующий афтозный стоматит, хроническую боль в груди у раковых больных, опухоли мозга и центральной нервной системы, синдром плохое питание - воспаление - кахексия, болезнь, опосредованную интерлейкином-1, реакция отторжения имплантата и других аллографтов, жирную печень, вызванную питанием, атероматозные очаги повреждения, дегенерацию жирной печени и другие дегенеративные состояния, вызванные пищей с высоким содержанием жира или алкоголем, вирус иммунодефицита человека типа 1 (ВИЧ-1) и другие ретровирусные инфекции у человека; рассеянный склероз, рак, фибропролиферативные заболевания, грибковые инфекции, нефротоксичность, вызванную употреблением лекарств, коллагенный колит и другие заболевания и/или состояния, характеризующиеся повышенным содержанием тромбоцитарного фактора роста (PDGF) или другими воспалительными цитокинами, эндометриоз, оптическую нейропатию и ухудшение состояния ЦНС, ассоциируемую с приобретенным синдромом иммунодефицита (AIDS), иммунные расстройства или множественный склероз, аутоиммунные болезни, вирусные инфекции верхних дыхательных путей, депрессии, недержание мочи, синдром раздраженного кишечника, септический шок, болезнь Альцгеймера, нейропатическую боль, дисурию, повреждения ретинального и оптического нерва, пептическую язву, инсулинзависимый диабет, неинсулинзависимый диабет, диабетическую нефропатию, метаболический синдром, ожирение, резистентность к инсулину, дислипидемию, патологическую переносимость глюкозы, гипертонию, гиперлипидемию, гиперурикемию, подагру, гиперкоагуляцию и воспаление или повреждение, связанные с нейтрофильным хемотаксисом и/или дегрануляцией. Соединения по изобретению могут также применяться для контроля внутриглазного давления или для стабилизации ауторегуляции церебрального тока крови у субъектов,которым требуется такой контроль, что выявлено при медицинском осмотре. Согласно одному конкретному варианту способ по изобретению применяют для лечения болезни или состояния, выбранного из перемежающейся хромоты вследствие хронической закупорки артерий конечностей и других обструктивных заболеваний сосудов, гломерулонефрита, фокального сегментного гломерулосклероза, нефротического синдрома, неалкогольного стеатогепатита, лейшманиоза, цирроза,- 16019088 печеночной недостаточности, мышечной дистрофии Дюшенна, поздних повреждений от облучения,лимфедемы, вызванной облучением, алкогольного гепатита, фиброза, вызванного облучением, некротизирующего энтероколита у недоношенных детей, диабетической нефропатии, почечной недостаточности,вызванной гипертонией и другими хроническими болезнями почек, легочного саркоидоза, рецидивирующего афтозного стоматита, хронической боли в груди у больных раком, опухолей мозга и центральной нервной системы, ожирения, острого алкогольного гепатита, нарушения обоняния, бесплодия, связанного с эндометриозом, синдрома плохое питание - воспаление - кахексия и открытых артериальных протоков. Согласно одному из вариантов способ по изобретению применяют для лечения диабетической нефропатии, гипертонической нефропатии или перемежающейся хромоты вследствие хронической закупорки артерий конечностей. По другому варианту способ по изобретению применяют для лечения болезни или состояния и пациента, нуждающегося в этом, выбранного из перемежающейся хромоты вследствие хронической закупорки артерий конечностей. По одному из вариантов изобретение относится к способу лечения хронической болезни почек. Хроническое заболевание почек может быть выбрано из гломерулонефрита, фокального сегментного гломерулосклероза, нефротического синдрома, рефлюксной уропатии или поликистоза почек. По одному из вариантов способ по изобретению применяют для лечения хронического заболевания печени. Это хроническое заболевание печени может быть выбрано из неалкогольного стеатогепатита,дегенерации жирной печени или других дегенеративных состояний тканей, вызванных питанием с высоким содержанием жира или употреблением алкоголя, цирроза, печеночной недостаточности или алкогольного гепатита. По одному из вариантов способ по изобретению применяют для лечения болезни или состояния,связанных с диабетом. Такая болезнь может быть выбрана из резистентности к инсулину, ретинопатии,диабетических язв, некроза, связанного с облучением, острой почечной недостаточности или нефротоксичности, вызванной лекарствами. По одному из вариантов способ по изобретению применяют для лечения пациента, страдающего от муковисцидоза, включая пациентов, страдающих от хронического бронхита Pseudomonas. Согласно еще одному варианту способ по изобретению применяют для ускорения заживления ран. Примеры таких видов ран включают венозные язвы, диабетические язвы и пролежни. По другому конкретному варианту способ по изобретению применяют для лечения болезни или состояния у пациента, нуждающегося в этом, выбранных из инсулинзависимого диабета, неинсулинзависимого диабета, метаболического синдрома, ожирения, резистентности к инсулину, дислипидемии,патологической переносимости глюкозы, гипертонии, гиперлипидемии, гиперурикемии, подагры, а также гиперкоагуляции. Способы, указанные в данной заявке, включают также такие методы, когда пациент идентифицируется как нуждающийся в конкретном указанном лечении. Такая идентификация пациента может быть осуществлена пациентом или профессиональным медиком и может быть субъективной (например, мнением) или объективной (то есть на основе теста или диагностического метода). Согласно другому варианту любой из указанных выше методов лечения включает дополнительную стадию введения пациенту одного или нескольких вторых терапевтических агентов. Выбор второго терапевтического агента делают из любого второго терапевтического агента, пригодного для совместного введения с пентоксифиллином. Выбор второго терапевтического агента зависит также от конкретных болезни или состояния, которое нужно подвергнуть лечению. Примерами вторых терапевтических агентов, которые могут быть применены в способах по изобретению, являются агенты, которые указаны выше для применения в комбинации в композициях, содержащих соединение по изобретению и второй терапевтический агент. В частности, комбинационная терапия по изобретению включает совместное введение соединения формулы А, А 1, I, II или В и второго терапевтического агента для лечения следующих состояний (с указанием конкретного второго терапевтического агента в скобках после показания): поздних повреждений,вызванных облучением (-токоферол), фиброза, вызванного облучением (-токоферол), лимфедемы,вызванной облучением (-токоферол), хронической боли в груди у раковых больных (-токоферол),диабетической нефропатии типа 2 (каптоприл), синдрома плохое питание - воспаление - кахексия (оральная питательная добавка, такая как Nepro; и оральный противовоспалительный модуль, такой как Охера) и опухоли мозга и центральной нервной системы (радиационная терапия и гидроксимочевина). Комбинационная терапия по изобретению включает также совместное введение соединения формулы А, А 1, I, II и В и второго терапевтического агента для лечения инсулинзависимого диабета, неинсулинзависимого диабета, метаболического синдрома, ожирения, резистентности к инсулину, дислипидемии, патологической переносимости глюкозы, гипертонии, гиперлипидемии, гиперурикемии, подагры, а также гиперкоагуляции. Термин "совместно введенный" означает, что второй терапевтический агент может быть введен вместе с соединением по изобретению как часть однократной лекарственной формы (такой как компози- 17019088 ция по изобретению, содержащая соединение по изобретению и второй терапевтический агент, как описано выше) или в виде отдельных многократных лекарственных форм. Или же дополнительный агент может быть введен до, совместно или после введения соединения по изобретению. В такой комбинационной терапии оба соединения по изобретению и второй терапевтический агент(-ы) вводят обычными методами. Введение композиции по изобретению, содержащей и соединение по изобретению, и второй терапевтический агент, пациенту не исключает отдельное введение того же терапевтического агента и другого второго терапевтического агента или любого соединения по изобретению указанному пациенту в другое время во время курса лечения. Эффективные количества этих вторых терапевтических агентов хорошо известны специалистам и руководство по величине доз можно найти в патентах и опубликованных заявках на патент, указанных в данной заявке, а также в Wells et al., eds., Pharmacotherapy Handbook, 2nd Edition, Appleton and Lange,Stamford, Conn. (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, TarasconPublishing, Loma Linda, Calif. (2000) и в других медицинских изданиях. Однако специалисты в данной области могут сами определить оптимальные величины доз второго терапевтического агента. Согласно одному из вариантов изобретения в случае введения пациенту второго терапевтического агента эффективное количество соединения по изобретению меньше, чем его эффективное количество,применяемое без применения второго терапевтического агента. Согласно другому варианту эффективное количество второго терапевтического агента меньше, чем его эффективное количество, используемое без применения соединения по изобретению. Таким образом могут быть сведены к минимуму нежелательные побочные эффекты, связанные с высокими дозами каждого агента. Другие потенциальные преимущества (включая, без ограничения, улучшенные схемы приема и/или сниженная стоимость лекарств) являются очевидными для специалистов. Согласно другому аспекту изобретение предусматривает применение соединения формулы А, А 1, I,II и В, одного или вместе с одним или несколькими описанными выше вторыми терапевтическими агентами для изготовления лекарственного препарата или в виде одной композиции, или в виде отдельных лекарственных форм для лечения и профилактики у пациента болезни, расстройства или симптомов, указанных выше. Другой аспект изобретения предусматривает соединение формулы А, А 1, I, II или В для применения для лечения и профилактики у пациента болезни, расстройства или симптомов, указанных выше. Диагностические методы и наборы Данное изобретение предусматривает также наборы, применяемые для лечения болезни, выбранной из группы, включающей закупорку периферических сосудов, гломерулонефрит, нефротический синдром, неалкогольный стеатогепатит, лейшманиоз, цирроз, печеночную недостаточность, мышечную дистрофию Дюшенна, поздние повреждения, вызванные облучением, лимфедему, вызванную облучением, некроз, ассоциируемый с облучением, алкогольный гепатит, фиброз, ассоциируемый с облучением, некротизирующий энтероколит у недоношенных детей, диабетическую нефропатию, печеночную недостаточность, вызванную гипертонией, и другие хронические заболевания почек, фокальный сегментный гломерулосклероз, легочный саркоидоз, рецидивирующий афтозный стоматит, хроническую боль в груди у раковых больных, опухоли мозга и центральной нервной системы, синдром плохое питание - воспаление - кахексия, инсулинзависимый диабет, неинсулинзависимый диабет, метаболический синдром, ожирение, резистентность к инсулину, дислипидемию, патологическую переносимость глюкозы, гипертонию, гиперлипидемию, гиперурикемию, подагру и гиперкоагуляцию. Эти наборы включают: (а) фармацевтическую композицию, содержащую соединение формулы А, А 1, I, II или В или его соль; при этом указанная фармацевтическая композиция содержится в контейнере; и (б) инструкции, описывающие способ применения фармацевтической композиции для лечения закупорки периферических сосудов, в частности перемежающейся хромоты вследствие хронической закупорки артерий конечностей; гломерулонефрита, нефротического синдрома, неалкогольного стеатогепатита, лейшманиаза, цирроза, печеночной недостаточности, мышечной дистрофии Дюшенна,поздних повреждений, вызванных радиацией, лимфедемы, вызванной облучением, алкогольного гепатита, фиброза, вызванного облучением, некротизирующего энтероколита у недоношенных детей, хронического заболевания почек, легочного саркоидоза, рецидивирующего афтозного стоматита, хронической боли в груди у раковых больных, опухолей мозга и центральной нервной системы, синдрома плохое питание - воспаление - кахексия, инсулинзависимого диабета, неинсулинзависимого диабета, метаболического синдрома, ожирения, резистентности к инсулину, дислипидемии, патологической переносимости глюкозы, гипертонии, гиперлипидемии, гиперурикемии, подагры и гиперкоагуляции. Контейнер может быть любым сосудом или другим герметичным или запаиваемым приспособлением, которые могут содержать указанную фармацевтическую композицию. Примеры включают флаконы,ампулы, флаконы с делениями или несколькими отделениями, где каждое деление или отделение содержит однократную дозу указанной композиции, пакет из фольги с отделениями, где каждое отделение содержит однократную дозу указанной композиции, или дозирующее устройство, которое дозирует однократные дозы этой композиции. Контейнер может быть любой подходящей формы или формы, известной из уровня техники, он может быть изготовлен из фармацевтически приемлемого материала, например, из бумаги или картона, это может быть стеклянный или пластиковый флакон или бутылочка,- 18019088 пакет, который можно снова запечатывать (например, для содержания "наполнения" таблеток для помещения в другой контейнер) или блистерная упаковка с отдельными дозами для извлечения из упаковки согласно схеме приема. Используемый контейнер может зависеть от вида точной лекарственной формы,например, это может быть картонная коробочка, которая обычно не применяется для хранения жидкой суспензии. Очевидно, что в одной упаковке для однократной лекарственной формы можно применять более одного контейнера. Например, таблетки могут содержаться во флаконе, который, в свою очередь,помещен в коробку. По одному из вариантов контейнер представляет собой блистерную упаковку. Наборы по изобретению могут также включать устройство для введения или для дозирования стандартной дозы фармацевтической композиции, такое устройство может включать ингалятор, если указанная композиция предназначена для ингаляции; шприц и иглу, если указанная композиция предназначена для инъекции; шприц, ложку, насос или сосуд с отметками объема или без них, если указанная композиция является оральным жидким составом, или любое другое мерное приспособление или устройство для доставки, подходящие для лекарственной формы, содержащейся в наборе. По некоторым вариантам наборы по изобретению могут содержать в отдельном сосуде контейнера фармацевтическую композицию, содержащую второй терапевтический агент, такой как один из перечисленных выше, подходящий для совместного введения с соединением по изобретению. Примеры синтеза соединений Примеры синтеза, представленные ниже, описывают детально способы получения некоторых соединений по изобретению. Специалисту очевидно, что другие соединения по изобретению могут быть получены при использовании других реагентов или промежуточных соединений и этих способов и схем,описанных выше. Полученные соединения анализировали методами NMR, масс-спектрометрии и/или элементного анализа. Спектры 1HNMR получали на приборе с частотой 300 МГц, который пригоден для определения введения дейтерия. Если иное не указано, отсутствие сигнала NMR, указанное ниже в примерах, показывает уровень включения дейтерия, который равен по меньшей мере 90%. Пример 1. Синтез 3-метил-7-(метил-d3)-1-(5-оксогексил)-1 Н-пурин-2,6-(3H,7 Н)-диона (соединение 100) Схема 13. Получение соединений 100 и 409 Стадия 1. 3-Метил-7-(метил-d3)-1 Н-пурин-2,6-(3H,7H)-дион (51). Суспензию 3-метилксантина 50 (5,0 г, 30,1 ммоль, 1 экв.) и порошкообразного K2CO3 (5,0 г, 36,0 ммоль, 1,2 экв.) в DMF (95 мл) нагревали до 60 С и при помощи шприца добавляли иодметан-d3 (Cambridge Isotopes, 99,5 атом.% D, 2,2 мл, 36 ммоль, 1,2 экв.). Полученную смесь нагревали при 80 С в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры и выпаривали DMF при пониженном давлении. Сырой остаток растворяли в 5% водной NaOH (50 мл), получали раствор желтого цвета. Водный раствор промывали три раза DCM (всего 500 мл). Водный слой подкисляли до величины рН 5 уксусной кислотой (6 мл), получали осадок оранжевого цвета. Смесь охлаждали на ледяной бане, отфильтровывали твердые вещества и промывали холодной водой. Твердый продукт высушивали в вакуумной печи, получая 2,9 г соединения 51 в виде твердого остатка оранжевого цвета. Фильтрат концентрировали до объема, равного примерно 25 мл, и путем фильтрования собирали вторую порцию соединения 51 (0,70 г). Общий выход соединения 51 составил 3,6 г. Сырой продукт применяли без дальнейшей очистки. Стадия 2. 3-Метил-7-(метил-d3)-1-(5-оксогексил)-1 Н-пурин-2,6-(3H,7 Н)-дион (соединение 100). Сырое соединение 51 (1,50 г, 8,2 ммоль, 1 экв.) и порошкообразный K2CO3 (2,28 г, 16,4 ммоль, 2 экв.) суспендировали в DMF (30 мл) и нагревали до 50 С. К полученной оранжевой суспензии добавляли 6 хлор-2-гексанон (52, 1,2 мл, 9,0 ммоль, 1,1 экв.) и температуру реакции повышали до 130 С. Нагревание при 130 С продолжали в течение 2 ч, в это время суспензия становилась более мелкой и темнела. Реакционную смесь охлаждали до комнатной температуры и выпаривали DMF при пониженном давлении. Полученную оранжевую пасту суспендировали в EtOAc (250 мл) и фильтровали для удаления нерастворимого продукта. Фильтрат концентрировали при пониженном давлении с получением желтого масла. Сырой продукт очищали с применением хроматографической системы Analogix, элюируя 100%EtOAc (10 мин) с градиентом 0-25% МеОН / EtOAc в течение 50 мин. Фракции продукта концентрировали при пониженном давлении, получая бледно-желтое масло, которое отверждалось после стояния в те- 19019088 чение нескольких минут. Твердый продукт растирали с гептанами (100 мл) и фильтровали с получением 2,00 г соединения 100 в виде твердого вещества неправильного белого цвета с т.пл. 101,8-103,0 С. 1C-NMR (75 MHz, CDCl3):20.95, 27.41, 29.69, 29.98, 40.80, 43.18, 107.63, 141.41, 148.75, 151.45,155.26, 208.80. HPLC (20 мм колонка С 18-RP, градиент 2-95% ACN + 0,1% муравьиной кислоты, 3,3 мин,выдержка 1,7 мин с 95% ACN; длина волны 254 нм): время удерживания 2,54 мин, степень чистоты 98,5%. MS (М + Н): 282,0. Элементный анализ (C13H15D3N4O3): рассчитано: С = 55,50, Н = 6,45, N = 19,92. Найдено: С = 55,58, Н = 6,48, N = 19,76. Из-за наличия триплета при 4,01 м.д. в вышеуказанном 1H-NMR спектре определение наличия или отсутствия синглетного пика при 3,99 м.д., соответствующего наличию или отсутствию водородов у Nметильной группы в положении 7 (R1) пуринового кольца, невозможно. Пример 2. Синтез 8-d1-3-метил-7-(метил-d3)-1-(6-d3-4-d2-5-оксогексил)-1 Н-пурин-2,6-(3H,7 Н)-диона(соединение 409) 8-d1-3-метил-7-(метил-d3)-1-(6-d3-4-d2-5-оксогексил)-1 Н-пурин-2,6-(3H,7 Н)-дион (соединение 409). Суспензию соединения 100 (1,80 г, 6,4 ммоль, 1 экв.) и порошкообразного K2CO3 (0,23 г, 1,7 ммоль, 0,25 экв.) в D2O (Cambridge Isotope Labs, 99 атом.% D) (45 мл) перемешивали с обратным холодильником в течение 24 ч, в это время суспензия превращалась в бледно-желтый раствор. Реакционную смесь охлаждали до комнатной температуры, насыщали хлористым натрием и четыре раза экстрагировали дихлорметаном (всего 400 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и выпаривали при пониженном давлении, получая 1,7 г бледно-желтого масла, которое при стоянии отверждалось. Сырой продукт подвергали реакции обмена водорода на дейтерий, описанной выше, при помощи свежегоK2CO3 и D2O. После такой же обработки твердое вещество неправильного белого цвета растирали с гексанами (100 мл) и фильтровали с получением 1,61 г соединения 409 в виде твердого вещества неправильного белого цвета с т.пл. 99,6-99,8 С. 1(метод: колонка Waters Atlantis C18-RP T3 2.150 мм, 3 мкм - градиент 5-95% ACN + 0,1% муравьиной кислоты, 14 мин (1,0 мл/мин), выдержка 4 мин с 95% ACN; длина волны 254 нм): время удерживания: 3,26 мин, 98% чистота. MS (М + Н): 288,3. Элементный анализ (C13H9D9N4O3): рассчитано: С = 54,35, Н = 6,31, N = 19,50. Найдено: С = 54,30, Н = 6,32, N=19,10. В спектре H-NMR было отмечено отсутствие следующих пиков: синглета при примерно 2,15 м.д.,включая отсутствие водородов метилкетона; триплета при примерно 2,51 м.д., свидетельствующего об отсутствии водородов метилкетона и синглета при примерно 7,52 м.д., включая отсутствие водорода в положении 8 пуринового кольца. Благодаря наличию триплета при 4,01 м.д. в вышеуказанном 1 Н-NMR спектре определение наличия или отсутствия синглетного пика при примерно 3,99 м. д., соответствующего наличию или отсутствию водородов у N-метильной группы в положении 7 (R1) пуринового кольца было невозможным. Пример 3. Синтез 3,7-ди-(метил-d3)-1-(5-оксогексил)-1 Н-пурин-2,6-(3H,7 Н)-диона (соединение 101) Схема 14. Получение соединений 101 и 413 Стадия 1. 3,7-ди-(метил-d3)-1 Н-пурин-2,6-(3H,7 Н)-дион (55). Суспензию ксантина 53 (2,00 г, 13,2 ммоль, 1,0 экв) и гексаметилдисилазана (32 мл) в толуоле (60 мл) нагревали с обратным холодильником и перемешивали в течение 4 дн. Реакционную смесь охлаждали до комнатной температуры, разбавляли толуолом (50 мл) и фильтровали через целит для удаления любого непрореагировавшего исходного вещества. Фильтрат выпаривали досуха при пониженном давлении, получая соединение 54 белого цвета (4,1 г). Часть этого продукта (3,00 г) помещали в герметичный трубчатый реакционный сосуд объемом 100 мл, затем добавляли толуол (60 мл) и CD3I (4 мл, Cambridge Isotopes, 99,5 атом.% D). Реакционную смесь нагревали на масляной бане при 120 С и перемешивали в течение 24 ч, в это время реакционная смесь становилась желтой и образовался твердый продукт. Реакционную смесь охлаждали до комнатной температуры, вся реакционная смесь затвердевала с получением желтого твердого продукта. Смесь разбавляли ацетоном (30 мл) и МеОН (5 мл) и отфильтровывали в потоке N2. Твердое вещество промывали ацетоном (100 мл), желтый цвет исчезал и продукт приобретал неправильный белый цвет. Твердое вещество сушили на фильтре в потоке N2 с получением смеси соединения 55 и побочного моноалкилированного продукта, 7-(метил-d3)ксантине в отношении примерно 1:1. Общий выход был равен 2,6 г (выход сырого продукта 42%). Из-за плохой растворимости этой смеси ее применяли без дальнейшей очистки. Стадия 2. 3,7-ди-(метил-d3)-1-(5-оксогексил)-1 Н-пурин-2,6-(3H,7 Н)-дион (соединение 101). Суспензию сырого соединения 55 (2,50 г, 13,4 ммоль, 1,0 экв.) и порошкообразного K2CO3 (2,20 мг,16 ммоль, 1,2 экв.) в DMF (50 мл) нагревали до 60 С. К полученной суспензии оранжевого цвета добавляли 6-хлор-2-гексанон 52 (2,0 мл, 14,8 ммоль, 1,1 экв.) и смесь нагревали до 140 С. Нагревание при 140 С продолжали в течение 4 ч, в это время частицы суспензии становятся мельче и более темного цвета. Реакционную смесь охлаждали до комнатной температуры и выпаривали DMF при пониженном давлении. Полученную оранжевую пасту суспендировали в смеси 1 : 1 дихлорметан/этилацетат (200 мл) и фильтровали до удаления непрореагировавших веществ. Фильтрат концентрировали при пониженном давлении с получением желтовато-коричневого масла (3,0 г). Этот сырой продукт абсорбировали силикагелем и помещали в колонку с силикагелем, нагруженную 100% дихлорметана. Фракции, содержащие полученный продукт, концентрировали при пониженном давлении с получением 0,75 г желтого масла.LCMS показали, что степень чистоты полученного продукта была равна примерно 90%. Желтое масло далее очищали на хроматографической системе Analogix, элюируя вначале 60% EtOAc/гептаны с градиентом 60 - 100% смеси EtOAc/гептаны в течение 20 мин. Полученный продукт элюировали в течение примерно 20 мин. Фракции, содержащие полученный продукт, концентрировали при пониженном давлении с получением 0,55 г (16%) соединения 101 в виде бледно-желтого масла, затвердевавшего при стоянии. 1(М + Na): 307,2. Элементный анализ (C13H12D6N4O3): рассчитано: С = 54,92, Н = 6,38, N = 19,71. Найдено: С = 54,90, Н = 6,40, N = 19,50. В спектрах 1H-NMR отличалось отсутствие синглета при 3,57 м.д., свидетельствующее об отсутствии N-метилводородов в положении 3 пуринового кольца. Из-за наличия триплета при 4,01 м.д. в вышеуказанном спектре определение наличия или отсутствие синглетного пика при 3,99 м.д., соответствующие наличию или отсутствию водородов у N-метильной группы в положении 7 (R1) пуринового кольца было невозможным. Пример 4. Синтез 8-d1-3,7-ди-(метил-d3)-1-(4,4,6,6,6-d5-5-оксогексил)-1 Н-пурин-2,6 (3H, 7 Н)-диона(соединение 413) 8-d1-3,7-ди-(метил-d3)-1-(4,4,6,6,6-d5-5-оксогексил)-1 Н-пурин-2,6-(3H,7 Н)-дион (соединение 413). Суспензию соединения 101 (0,60 г, 2,1 ммоль, 1,0 экв) и порошкообразного K2CO3 (0,10 г, 0,72 ммоль,0,30 экв.) в D2O (15 мл, Cambridge Isotopes, 99 атом.% D) нагревали и перемешивали с обратным холодильником в течение 16 ч, в это время суспензия превращалась в желтоватый раствор. Реакционную смесь охлаждали при комнатной температуре, насыщали хлоридом натрия и экстрагировали 4 раза дихлорметаном (200 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 0,53 г желтоватого масла, которое затвердевало при стоянии. Сырой продукт подвергали вновь реакции со свежей порцией порошкообразного K2CO3 иD2O. После такой же обработки твердый продукт неправильного белого цвета растирали с гексаном (50 мл) и фильтровали с получением 0,45 (74%) соединения 413 в виде продукта белого цвета с т.пл. 99,299,3 С. 1 Н-NMR (300 MHz, CDCl3):1.64-1.71 (m, 4H), 4.01 (t, J = 7.0, 2 Н). 13(метод: колонка Waters Atlantis T3 2.150 мм, 3 мкм, C18-RP-градиент 5-95% ACN + 0,1% муравьиной кислоты, 14 мин (1,0 мл/мин) с выдержкой, равной 4 мин с 95% ACN + 0,1% муравьиной кислоты; длина волны: 254 нм): время удерживания: 3,25 мин, степень чистоты 98,7%. MS (М + Н): 291,3 (М + Na): 313,2. Элементный анализ (C13H6D12N4O3): рассчитано: С = 53,78, Н = 6,25, N = 19,30. Найдено: С = 53,76,Н = 6,39, N = 19,11. В спектрах 1H-NMR, приведенных выше, отмечалось отсутствие следующих пиков: синглета при примерно 2,15 м.д., указывающее на отсутствие водородов метиленкетона; синглета при примерно 3,57 м.д., указывающее на отсутствие водородов у N-метила в положении 3 пуринового кольца; и синглета при примерно 7,51 м.д., что указывает на отсутствие водорода в положении 8 пуринового кольца. Из-за наличия триплета при 4,01 м.д. в указанных спектрах определение наличия или отсутствия синглетного пика около 3,99 м.д., соответствующих наличию или отсутствию водородов N-метильной группы в положении 7 (R1) пуринового кольца было невозможным. Пример 6. Синтез 8-d1-1-(4,4,6,6,6-d5-гидрогексил)-3-метил-7-(метил-d3)-1 Н-пурин-2,6-(3H,7 Н)диона (соединение 419) Схема 16. Получение соединений 419, 419 (R) и 419 (S) 8-d1-1-(4,4,6,6,6-d5-гидроксигексил)-3-метил-7-(метил-d3-1 Н-пурин-2,6-(3H,7 Н)-дион (соединение 419). Соединение 409 (0,50 г, 1,7 ммоль, 1,0 экв, см. пример 2) растворили в EtOD (13 мл, Aldrich,99,5 атом.% D) и добавляли NaBH4 (0,07 г, 1,9 ммоль, 1,1 экв). Наблюдалось повышение температуры от 24 до 28 С. Реакционную смесь перемешивали 2 ч при комнатной температуре, затем обрывали реакцию путем добавления D2O (30 мл, Cambridge Isotope Labs, 99 атом.% D). Образовалась белая суспензия, которую экстрагировали МТВЕ (4X, 200 мл всего). Объединенные органические экстракты сушили надNa2SO4, фильтровали и концентрировали при пониженном давлении с получением прозрачного бесцветного масла (0,45 г). Сырой продукт очищали методом хроматографии на силикагеле, элюируя сначала 1% МеОН/CH2Cl2. Фракции, содержащие полученный продукт, концентрировали при пониженном давлении с получением соединения 419 (0,41 г, 83%) в виде прозрачного бесцветного масла, которое затвердевает при хранении. Пример 7. Хиральное разделение (R)-8-d1-1-(4,4,6,6,6-d5-5-гидроксигексил)-3-метил-7-(метил-d3)1 Н-пурин-2,6-(3H, 7 Н)-диона (соединение 419 (R) и (S)-8-d1-1-(4,4,6,6,6-d5-5-гидроксигексил)-3-метил-7(метил-d3)-1 Н-пурин-2,6-(3H, 7 Н) -диона (соединение 419 (S Разделение энантиомеров соединения 419. Соединение 419, полученное по примеру 6 выше (0,38 г),растворяли в минимальном количестве iPrOH (6 мл, сорт HPLC, требует нагревания) и разбавляли гексаном (4 мл, сорт HPLC). Разделение энантиомеров осуществляли с применением системы Waters HPLC,снабженной колонкой Daicel Chiralpak (20250 мм). В первую минуту мобильную фазу составляли 80% гексана и 20% iPrOH вместе с 0,1% диэтиламина в течение 15 мин с последующей выдержкой при этом отношении растворителей в течение 17 мин при скорости потока 18 мл/мин. Этот способ приводил к выделению 419 (R), элюируемого первым (21,0 мин) с последующим выделением 419 (S) (24,1 мин). Фракции, содержащие каждый энантиомер, концентрировали при пониженном давлении с получением 0,16 г каждого из 419 (R) (т.пл. = 107,8-108,8 С) и 419 (S) (т.пл. = 108,3-108,4 С) в виде твердых продуктов неправильного белого цвета.Na): 312,3. Элементный анализ (C13H11D9N4O3): рассчитано: С = 53,97, Н = 6,97, N = 19,36. Найдено: С = 54,39, Н = 7,11, N = 18,98. Следует заметить, что в спектрах 1H-NMR, описанных выше, отсутствуют следующие пики: пик около 1,19 м.д., что свидетельствует об отсутствии -водородов метила у гидроксильной группы; синглет около 7,51 м.д., что свидетельствует об отсутствии водорода в положении 8 пуринового кольца. Из-за наличия мультиплета у 1,36-1,50 м. д. и триплета у 4,01 м.д. в спектрах 1H-NMR определение наличия или отсутствия пика у 1,51 м.д., соответствующих наличию или отсутствию метиленовых водородовальфа у гидроксильной группы, и синглетного пика у 3,99 м.д., соответствующее наличию или отсутствию водородов у N-метильной группы в положении 7 (R1) пуринового кольца не является возможным. В) (S)-8-d1-1-(4,4,6,6,6-d5-5-гидроксигексил)-3-метил-7-(метил-d3)-1 Н-пурин-2,6-(3H,7 Н)-дион (соединение 419 (S. 1H-NMR (300 MHz, CDCl3):1.41-1.48 (m, 2 Н), 1.64-1.72 (m, 3H), 3.58 (s, 3H), 3.79 (s,- 22019088(метод: колонка Waters Atlantis T3 2.150 мм, 3 мкм, С 18-RP-градиент 5 - 95% ACN + 0,1% муравьиной кислоты, 14 мин (1,0 мл/мин) с выдержкой в течение 4 мин с 95% ACN + 0,1% муравьиной кислоты; длина волны: 254 нм): время удерживания: 3,26 мин, степень чистоты 99,9%. Хиральная HPLC (метод: колонка Chiralpak AD 25 см, изократический метод, 78% гексана/22% изопропанола /0,01% диэтиламина в течение 40 мин, 1,00 мл/мин; длина волны 254 нм): время удерживания 31,19 мин (основной энантиомер); 27,51 мин (для второго энантиомера): ее чистота 99,9%. MS (М + Н): 290,1 (М + Na): 312,3. Элементный анализ (C13H11D9N4O3): рассчитано: С = 53,97, Н = 6,97, N = 19,36. Найдено: С = 54,35, Н = 7,28,N = 18,75. Следует заметить, что в спектрах 1H-NMR, описанных выше, отсутствуют следующие пики: пик около 1,19 м.д., что свидетельствует об отсутствии -водородов метила у гидроксильной группы; синглет около 7,51 м.д., что свидетельствует об отсутствии водорода в положении 8 пуринового кольца. Из-за наличия мультиплета у 1,36-1,50 м.д. и триплета у 4,01 м.д. в спектрах 1H-NMR определение наличия или отсутствия пика у 1,51 м.д., соответствующих наличию или отсутствию метиленовых водородов-альфа у гидроксильной группы, и синглетного пика у 3,99 м.д., соответствующее наличию или отсутствию водородов у N-метильной группы в положении 7 (R1) пуринового кольца, не является возможным. Пример 8. Синтез 8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3-метил-7-(метил-d3)-1 Н-пурин-2,6(3H,7 Н)-диона (соединение 435) Схема 17. Получение соединений 435, 435 (R) и 435 (S) 8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3-метил-7-(метил-d3)-1 Н-пурин-2,6-(3H,7 Н)дион(соединение 435). К раствору соединения 409 (0,50 г, 1,7 ммоль, 1,0 экв) в EtOD (13 мл, Aldrich, 99,5 атом.% D) добавляли NaBD4 (0,08 г, 1,9 ммоль, 1,1 экв. Cambridge Isotope Labs, 99 атом.% D). Повышение температуры от 24 до 27 С было отмечено. Реакционную смесь перемешивали 2 ч при комнатной температуре, затем обрывали реакцию добавлением D2O (30 мл) (Cambridge Isotope, 99 атом.% D). Образовавшуюся белую суспензию экстрагировали MIBE (4X, всего 200 мл). Объединенные органические экстракты высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением прозрачного бесцветного масла (0,45 г). Сырой продукт очищали методом хроматографии на силикагеле, элюируя сначала 1% МеОН/CH2Cl2 и затем с градиентом 1-5% МеОН/CH2Cl2. Фракции, содержащие полученный продукт, концентрировали при пониженном давлении с получением 0,40 г (81%) соединения 435 в виде прозрачного бесцветного масла, которое затвердевало при стоянии. Пример 9. Хиральное разделение (R)-8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3-метил-7-(метил-d3)1 Н-пурин-2,6-(3H,7 Н)-диона (соединение 435 (R) и (S)-8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3-метил 7-(метил-d3)-1 Н-пурин-2,6-(3H,7 Н)-диона (соединение 435 (S Разделение энантиомеров соединения 435. Соединение 435, полученное в примере 8 выше (0,32 г),растворяли в гексане (4 мл, сорт HPLC). Разделение энантиомеров проводили, применяя систему WatersHPLC, снабженную колонкой Daicel Chiralpak AD (20250 мм). В течение первой минуты мобильная фаза состояла из 80% гексана и 20% iPrOH вместе с 0,1% диэтиламина. Через одну минуту применяли градиент до 75% гексана и 25% iPrOH вместе с 0,1% диэтиламина в течение 15 мин с последующей выдержкой при указанном отношении растворителей в течение 17 мин со скоростью потока 18 мл/мин. Этот метод привел к выделению соединения 435 (R), элюируя вначале (21,9 мин) и затем соединения 435(S) (25,2 мин). Фракции, содержащие каждый энантиомер, концентрировали при пониженном давлении с получением 0,12 г каждого из 435 (R) (т.пл. = 108,0-108,1 С) и 435 (S) (т.пл. = 107,6-107,7 С) в виде твердых веществ неправильного белого цвета. А)(ожидалось для энантиомера второго): ее чистота 99,9%. MS (М + Н): 291,3 (М + Na): 313,2. Элементный анализ (C13H10D10N4O3): рассчитано: С = 53,78, Н = 6,94, N = 19,30. Найдено: С = 54,01, Н = 7,07, N = 18,90. Следует отметить, что в спектрах 1H-NMR, приведенных выше, наблюдалось отсутствие следующих пиков: пика у примерно 1,19 м.д., что свидетельствует об отсутствии метальных водородов-альфа у гидроксильной группы, синглетного пика у примерно 7,51 м.д., что указывает на отсутствие водорода в положении 8 пуринового кольца. Из-за наличия мультиплета у 1,36-1,50 м.д. и триплета у 4,01 м.д. в спектрах 1H-NMR определение наличия или отсутствия пика у 1,51 м.д., соответствующих наличию или отсутствию метиленовых водородов-альфа у гидроксильной группы, и синглетного пика у примерно 3,99 м.д., соответствующего наличию или отсутствию водородов у N-метильной группы в положении 7 (R1) пуринового кольца, было невозможным. В)(ожидалось для энантиомера второго): ее чистота 99,9%. MS (М + Н): 291,3 (М + Na): 313,2. Элементный анализ (C13H10D10N4O3): рассчитано: С = 53,78, Н = 6,94, N = 19,30. Найдено: С = 54,01, Н = 7,11, N = 18,78. Следует отметить, что в спектрах 1H-NMR, приведенных выше, наблюдалось отсутствие следующих пиков: пика у примерно 1,19 м.д., что свидетельствует об отсутствии метальных водородов-альфа у гидроксильной группы, синглетного пика у примерно 7,51 м.д., что указывает на отсутствие водорода в положении 8 пуринового кольца. Из-за наличия мультиплета у 1,36-1,50 м.д. и триплета у 4,01 м.д. в спектрах 1H-NMR определение наличия или отсутствия пика у 1,51 м.д., соответствующих наличию или отсутствию метиленовых водородов-альфа у гидроксильной группы, и синглетного пика у примерно 3,99 м. д., соответствующего наличию или отсутствию водородов у N-метильной группы в положении 7 (R1) пуринового кольца, было невозможным. Пример 10. 8-d1-3,7-диметил-1-(4,4,6,6,6-d5-5-оксогексил)-1H-пурин-2,6-(3H,7 Н)-диона (соединение 407) Схема 18. Получение соединений 407, 437, 437 (R) и 437 (S) 8-d1-3,7-диметил-1-(4,4,6,6,6-d5-5-оксогексил)-1H-пурин-2,6-(3H,7 Н)-дион (соединение 407). Смесь коммерчески доступного 59 (7,95 г, 28,6 ммоль) и карбоната калия (990 мг, 7,2 ммоль) в D2O(195 мл, Cambridge Isotopes, 99,9 атом.% D) нагревали с обратным холодильником в течение 24 ч. Суспендированный продукт растворялся, постепенно превращаясь в раствор желтого цвета. Раствор охлаждали до температуры, равной примерно 40 С, и концентрировали при пониженном давлении с образованием твердого продукта оранжевого цвета. Этот продукт растворяли в D2O (195 мл) и раствор нагревали с обратным холодильником еще 24 ч. Раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением твердого продукта оранжевого цвета. Добавляли этилацетат(200 мл) и перемешивали смесь в течение 0,5 ч при температуре около 40 С. Нерастворимые вещества отфильтровывали и фильтрат концентрировали при пониженном давлении с получением твердого вещества бледно-желтого цвета, которое растирали с МТВЕ (40 мл) с получением 7,5 г (93%) соединения 407 в виде вещества неправильного белого цвета. 1HPLC (метод: колонка Waters Atlantis T3 2.150 мм, 3 мкм, С 18-RP-градиент 5-95% ACN + 0,1% муравьиной кислоты в течение 14 мин (1,0 мл/мин) с выдержкой в течение 4 мин, 95% ACN + 0,1% муравьиной кислоты; длина волны: 305 нм): время удерживания: 3,24 мин; степень чистоты 99,9%. MS (M+Н): 285,3 (М+Na): 307,2. Элементный анализ (C13H12D6N4O3): рассчитано: С = 54,92, Н = 6,38, N = 19,71. Найдено: С = 54,89, Н = 6,38, N = 19,70. В спектрах 1H-NMR, описанных выше, отмечалось отсутствие следующих пиков: синглета при примерно 2,15 м.д., показывающего отсутствие метилкетоновых водородов; триплета при примерно 2,51 м.д., что показывает отсутствие метилкетоновых водородов; и синглета при примерно 7,52 м.д., что показывает отсутствие водорода в положении 8 пуринового кольца. Пример 11. Синтез 8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил-1 Н-пурин-2,6-(3H,7 Н)диона (соединение 437) 8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил-1 Н-пурин-2,6-(3H,7 Н)-дион (соединение 437). Бородейтерид натрия (1,06 г, 25,3 ммоль, Cambridge Isotopes, 99 атом.% D) добавляли к суспензии соединения 407 (6,5 г, 22,9 ммоль) в этаноле - d1 (65 мл, Aldrich, 99,5 атом.% D) при температуре 0 С. Смесь нагревали до комнатной температуры и перемешивали до образования прозрачного раствора(примерно 1 ч). Реакцию обрывали насыщенным раствором хлорида-d4 аммония (Cambridge Isotope, 98 атом.% D) в D2O (8 мл, Cambridge Isotope, 99 атом.% D), этанол-d1 выпаривали при пониженном давлении и экстрагировали остаток EtOAc (160 мл). Органическую фазу промывали D2O (20 мл), сушили над сульфатом натрия, фильтровали, концентрировали при пониженном давлении с получением 4,8 г (73%) соединения 437 в виде твердого вещества бледно-желтого цвета. Пример 12. Хиральное разделение (R)-8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил-1 Нпурин-2,6-(3H,7 Н)-диона (соединение 437 (R) и (S)-8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил 1 Н-пурин-2,6 (3H,7 Н)-диона (соединение 437 (S) Разделение энантиомеров соединения 437. Соединение 437, полученное в примере 11 выше, (1,60 г) растворяли в iPrOH (20 мл, сорт HPLC,требует нагревания). Разделение энантиомеров проводили на системе Waters HPLC, снабженной колонкой для препаративной хроматографии Chiralpak AD (20250 мм, Daicel, 10 мкМ) с защитной колонкойChiralpak AD для препаративной хроматографии (2050 мм Daicel, 10 мкМ), помещенной перед основной колонкой. В первую минуту образец элюировали смесью 20% iPrOH / гексаны (затем с 0,1% диэтиламина в качестве со-элюента), меняя скорость потока от 15 мл/мин до 18 мл/мин. В течение следующих 15 мин образец элюировали со скоростью потока 18 мл/мин с градиентом 20-25% смеси iPrOH/гексаны. В течение следующих 19 мин образец элюировали со скоростью потока 18 мл/мин смесью 25%iPrOH/гексаны. В течение следующей 0,5 мин образец элюировали со скоростью потока 18 мл/мин с градиентом от 25 до 20% смеси iPrOH/гексаны. Затем в течение 4,5 мин образец элюировали со скоростью потока 18 мл/мин 20% iPrOH/гексаны. Этот метод элюирования привел к выделению соединения 437 (R),вымываемого первым (время удерживания около 29 мин), и соединения 437 (S), вымываемого вторым(время удерживания около 33 мин). Фракции, содержащие каждый энантиомер, собирали и концентрировали при пониженном давлении с получением 340 мг соединения 437 (R) (т.пл. 112,0-114,5 С) и 375 мг соединения 473 (S) (т.пл. = 111,9-112,3 С) в виде твердых продуктов неправильного белого цвета. (Примечание: только 1,0 г соединения 437 впрыскивали из раствора, полученного выше).(метод: колонка Chiralpak AD 25 см, изократический метод, 78% гексана/22% изопропанола/0,01% диэтиламина в течение 40 мин, 1,00 мл/мин; длина волны 254 нм): время удерживания: 25,20 мин (основной энантиомер); 28,39 мин (второй энантиомер): ее чистота 99,9%. MS (М + Н): 288,3 (М + Na): 310,2. Элементный анализ (C13H13D7N4O3): рассчитано: С = 54,34, Н = 7,02, N = 19,50. Найдено: С = 54,32, Н = 7,23, N = 19,35. В спектрах 1H-NMR, приведенных выше, отмечалось отсутствие следующих пиков: пика у примерно 1,19 м.д., что показывает отсутствие метальных водородов-альфа гидроксильной группы; пика при 3,80 м.д., что показывает отсутствие водорода у метильного гидроксила; и синглетного пика при примерно 7,51 м.д., что показывает отсутствие водорода в положении 8 пуринового кольца. Из-за наличия мультиплета при 1,36-1,50 м.д. в вышеуказанных спектрах определение наличия или отсутствия пика при 1,51 м.д., свидетельствующих наличию или отсутствию метиленовых водородов-альфа гидроксильной группы, не было возможным. В. (S)-8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил-1 Н-пурин-2,6-(3 Н,7H)-диона (соединение 437 (S). 1(метод: колонка Chiralpak AD 25 см, изократический метод, 78% гексана/22% изопропанола/0,01% диэтиламина в течение 40 мин, 1,00 мл/мин; длина волны 254 нм): время удерживания: 28,39 мин (основной энантиомер); 25,20 мин (второй энантиомер): ее чистота 99,9%. MS (М + Н): 288,3 (М + Na): 310,2. Элементный анализ (C13H13D7N4O3): рассчитано: С = 54,34, Н = 7,02, N = 19,50. Найдено: С = 54,33, Н = 7,30, N = 19,36. В спектрах 1H-NMR, приведенных выше, отмечалось отсутствие следующих пиков: пика у примерно 1,19 м.д., что показывает отсутствие метальных водородов-альфа гидроксильной группы; пика при 3,80 м.д., что показывает отсутствие водорода у метильного гидроксила; и синглетного пика при примерно 7,51 м.д., что показывает отсутствие водорода в положении 8 пуринового кольца. Из-за наличия мультиплета при 1,36-1,50 м.д. в вышеуказанных спектрах определение наличия или отсутствия пика при 1,51 м.д., свидетельствующих наличию или отсутствию метиленовых водородов-альфа гидроксильной группы, не было возможным. Определение биологических свойств Пример 15 а. Оценка фармакокинетики у собак после орального введения. Сравнение соединения 409 и пентоксифиллина Метаболизм этих соединений изучали после орального введения самцам биглей (собак). Образцы крови отбирали у собак, получивших лекарство, в различные моменты времени и отделяли из этих образцов плазму. Образцы плазмы применяли для определения содержания лекарства в плазме методомLC-MS/MS (жидкостная хроматография с масс-спектроскопией) для определения фармакокинетических параметров. Соединение 409 и пентоксифиллин растворяли отдельно в физиологическом растворе до получения концентрации, равной 4 мг/мл. Была приготовлена смесь 1 : 1 (об/об) двух растворов для получения раствора, имеющего конечную концентрацию, равную 2 мг/мл соединения 409 и пентоксифиллина. Два самца бигли не получали пищи в течение ночи и затем им орально при помощи желудочного зонда вводили 2,5 мг/кг соединения 409 и пентоксифиллина, используя смесь, описанную выше. Отбирали образцы крови (1,5-2 мл) из бедренной вены перед введением доз (0 мин), через 15, 30, 45 мин, 1, 1,5 , 2, 3, 4, 6, 8 10, 12,16 и 24 ч после введения дозы. Кровь хранили на льду до центрифугирования для получения плазмы. Центрифугирование проводили в течение 1 ч после забора крови для сбора плазмы (максимального объема). Плазму декантировали сразу же и замораживали/хранили при температуре -70 С до анализа. Таблица 2. Уровень в плазме соединения 409 в сравнении с пентоксифиллином у собак (пример 15 а).(недейтерированные соединения) В табл. 2 показаны результаты опыта, описанного в примере 15 а. Средние величины Cmax и AUC для соединения 409, дейтерированного аналога пентоксифиллина, были значительно больше, чем у пентоксифиллина. Дейтерированное соединение экспозиция дейтерированного соединения в плазме у собак была больше, чем для пентоксифиллина. Пример 15b. Повторная оценка фармакокинетики у собак после орального введения. Сравнение соединения 409 и пентоксифиллина с мониторингом метаболитов Повторяли пример 15 а с дополнительным мониторингом метаболитов пентоксифиллина и соединения 409. В этом опыте соединение 409 и пентоксифиллин растворяли отдельно в физиологическом растворе до концентрации 4,4 и 4 мг/л соответственно. Готовили смесь 1 : 1 (об/об) двух растворов для получения раствора с конечной концентрацией, равной 2,2 мг/мл соединения 409 и 2 мг/мл пентоксифиллина. Анализ после введения дозы включал корректировку для объяснения разницы в 10% в дозируемой концентрации между соединением 409 и пентоксифиллином. Четыре бигля (возраст 2-3 года, весом от 5 до 8 кг) не получали пищи в течение ночи и затем при помощи желудочного зонда им вводили 2,75 мг/кг соединения 409 и 2,5 мг/кг пентоксифиллина, используя смесь, описанную выше. Образцы крови (около 1 мл) отбирали из бедренной вены до введения доз (0 мин), через 5, 15, 30, 45 мин, 1, 1,5, 2, 3, 4 и 6 ч после введения доз. Кровь хранили на льду до центрифугирования для получения образцов плазмы. Центрифугирование проводили в течение 15 мин после забора крови для сбора плазмы (максимального объема). Плазму сразу же декантировали и замораживали/ хранили при температуре -20 С до проведения анализа. Образцы плазмы анализировали методом LC-MS/MS на наличие введенного соединения и его соответствующего метаболита M1. Результаты для каждой из четырех собак показаны на фиг. 1 А и 1 В. Результаты для одной из четырех собак (собака Н, фиг. 1b) противоречили результатам, полученным для остальных трех собак. У этой собаки наблюдалась концентрация каждого из введенных соединений и их соответствующих метаболитов через 5 мин после введения дозы в 10 раз большая, чем у других собак. Кроме того, у этой собаки не наблюдалось характерного увеличения концентрации введенных соединений в плазме в промежуток времени между 5 и 15 мин после введения. Был сделан вывод, что этой собаке неправильно вводили желудочный зонд и что соединения, вероятно, были введены скорее через трахею, а не в желудочнокишечный тракт, как это было желательно. Соответственно, данные, полученные для этой собаки, были исключены. Суммарные данные для трех остальных собак показаны в табл. 3. Таблица 3. Уровень в плазме соединения 409 в сравнении с пентоксифиллином у собак (пример 15b) концентрация соединения 409 была на 10% выше, чем концентрация пентоксифиллина и, таким образом, цифры, указанные выше, отражают корректировку этого 10%-ного увеличения. б)% разницы = [(дейтерированные соединения) - (недейтерированные соединения)] (100)/(недейтерированные соединения) Как видно из табл. 3, большие уровни соединения 409, выраженные в виде Cmax и AUC, наблюдались при сравнении с пентоксифиллином, введенным совместно в том же количестве. Фиг. 1 показывает,что соединение 409 более медленно выводилось из плазмы, чем пентоксифиллин у трех собак, которым дозы вводили орально. Фиг. 1 а и 1b показывают, что соединение 409 более медленно выводилось из плазмы, чем пентоксифиллин у трех собак, которым дозы вводили орально. Фиг. 1a и 1b также показывают, что общая системная экспозиция соединения 419 (дейтерированный метаболит M1 соединения 409) после дозирования соединения 409 была дольше, чем эта же величина для метаболита M1 после дозирования пентоксифиллина. Пример 15 с. Оценка фармакокинетики у собак после орального введения. Сравнение соединения 413 и пентоксифиллина Этот опыт был похож на опыты, описанные в примерах 15 а и 15b, за исключением того, что испытывали соединение 413. Четырем самцам биглей вводили орально при помощи желудочного зонда смесь,содержащую 2 мг/мл каждого из пентоксифиллина и соединения 413 в физиологическом растворе. Образцы крови отбирали, как в примере 15b.(недейтерированные соединения) Результаты этого опыта показаны в табл. 4 выше. В ней показан уровень соединения 413 и пентоксифиллина после орального дозирования. Наблюдались более высокие уровни соединения 413 в видеCmax и AUC по сравнению с пентоксифиллином, введенным совместно в том же количестве. Пример 16. Оценка стабильности соединений в цельной крови крыс. Сравнение соединений 409, 435 (S), 435 (R) и пентоксифиллина и их метаболитов М-1 Этот опыт проводили для оценки стабильности указанных соединений в цельной крови крыс. Вследствие того, что кетон (или кетосоединение; или пентоксифиллин, или соединение 409) и его соответствующий спиртовой метаболит М-1 взаимно превращаются, уровень этих соединений измеряли после того, как или кетосоединения, или М-1 добавлялись в кровь. Другими словами, в некоторых опытах кетосоединение было исходным испытуемым соединением, а в других опытах таким исходным испытуемым соединением был метаболит М-1. Свежую цельную кровь крыс получали от ViviSource Laboratories, Waltham, MA. Исходные растворы (7,5 ммоль (мМ испытуемых соединений были приготовлены в диметилсульфоксиде (DMSO). Исходные растворы с концентрацией 7,5 мМ были разбавлены до 500 мкМ в ацетонитриле (ACN). К 990 мкл крови, предварительно нагретой до 37 С, в течение 7 мин добавляли 10 мкм 500 мкМ испытуемого соединения с получением конечной концентрации, равной 5 мкМ. Испытуемыми соединениями были пентоксифиллин, соединение 409, соединение 435 (S) и соединение 435 (R). Последние два испытуемые соединения были дейтерированными (S)-M1 и (R)-M1 метаболитами соединения 409 соответственно. Реакционную смесь инкубировали при температуре 37 С. В моменты времени 0, 5 15, 30 мин, 1 и 2 ч после добавления испытуемого соединения отбирали аликвотные количества (50 мкл) и добавляли в 96 луночные планшеты, содержащие 150 мкл ледяного ацетонитрила с внутренним стандартом для остановки реакции. Планшеты хранили при температуре -20 С в течение 20 мин, после чего в лунки планшета до центрифугирования для гранулирования осажденных белков добавляли 100 мкл смеси 50% ацетонитрила/воды. Аликвоты объемом 200 мкл каждого надосадочной жидкости переносили в другой 96 луночный планшет и анализировали методом LC-MS/MS с применением масс-спектрометра Applied BioSystems API 4000 на количестве введенного соединения и его специфического метаболита, которые приведены в табл. 5 ниже. Таблица 5. Анализ пар соединение-метаболит в цельной крови крыс (опыты 16 и 17) Массу определяли методом LC-MS/MS. Предполагаемая стереохимия 95% (S) на основе опубликованных данных о метаболизме пентоксифиллина. Результаты этого исследования отражены на фиг. 2 и 3. Время образования метаболита показано на фиг. 2. Относительное количество образовавшегося метаболита, показанное на фиг. 3, было рассчитано на основе количества, имеющегося через 2 ч относительно самого раннего момента времени, в который оно было обнаружено в инкубационной смеси, 5 мин для А и В и 15 мин для С. Как видно на фиг. 3, через примерно 2 ч количество (S)-M1, образовавшегося в цельной крови крысы, инкубируемой с пентоксифиллином (фиг. 3, колонка А), было подобно количеству соединения 419(S), образовавшегося в цельной крови крысы, инкубированной с соединением 409 (фиг. 3, колонка В). Таким образом, замещение дейтерием в соединении 409 не оказало заметного влияния на относительный уровень образовавшегося дейтерированного метаболита (S)-M1 (соединение 419 (S, по сравнению с нейдейтерированным (S)-M1, образовавшимся из недейтерированного пентоксифиллина. Для обратимого превращения (S)-M1 в кетосоединение дейтерирование оказывает значительное влияние. Колонка С на фиг. 3 показывает количество пентоксифиллина после добавления (S)-M1. По контрасту через 2 ч после добавления соединения 435 (S) соединение 409 не было обнаружено (фиг. 3,колонка D). В этих условиях замещение дейтерием в соединении 435 (S) препятствует превращению этого соединения в соответствующий кетон. Такой эффект особенно благоприятствует повышению уровня желательного метаболита М-1 в плазме. Этот метод-анализ не выявил метаболизма (R)-M1 с получением пентоксифиллина. Точно так же соединение 409 не было обнаружено после добавления соединения 435 (R) в кровь крысы. Таким образом, нельзя сделать никаких выводов, касающихся влияния дейтерирования на конверсию (R)-M-l в пентоксифиллин. Фиг. 2 отражает время образования конкретного метаболита во время инкубации введенного соединения с цельной кровью крыс. Пример 17. Оценка стабильности соединения в микросомах печени человека. Сравнение соединений 409, 435 (S), 435 (R) и пентоксифиллина Пример 17 похож по процедуре на пример 16 за исключением того, что вместо цельной крови крыс применяют для изучения метаболизма соединение микросомы печени человека. В табл. 5 выше указана каждая пара испытуемого соединения и метаболита, которая анализировалась в этом примере 17. Микросомы печени человека (20 мг/мл) получали от Xenotech, LLC (Lenexa, KS). В Sigma-Aldrich приобретали динуклеотидфосфат -никотинамида в восстановленной форме (NADPH), хлорид магния(MgCl2) и диметилсульфоксид (DMSO). Исходные растворы, содержащие 7,5 мМ испытуемых соединений (пентоксифиллина, (S)-M1 метаболита, (R)-M1 метаболита, соединения 409, соединения 435 (S) и соединения 435 (R), готовили в DMSO. Эти исходные растворы с концентрацией 7,5 мМ разбавляли до 250 мкМ ацетонитрилом (ACN). Микросомы печени человека разбавляли до концентрации 2,5 мг/мл 0,1 М буфером фосфата калия, рН 7,4, содержащим 3 мМ MgCl2. Разбавленные микросомы добавляли в лунки 96-луночного полипропиленового планшета с глубокими лунками по три образца. К микросомам добавляли по 10 мкл испытуемого соединения с концентрацией 250 мкМ и смесь предварительно нагревали до температуры 37 С в течение 10 мин. Реакцию инициировали путем добавления предварительно нагретого раствора NADPH. Конечный объем реакционной смеси составлял 0,5 мл и содержал 2,0 мг/мл микросом печени человека, 5 мМ испытуемого соединения и 2 мМ NADPH в 0,1 М буферном растворе фосфата калия, рН 7,4, и 3 мМ MgCl2. Реакционные смеси инкубировали при температуре 37 С и отбирали аликвоты по 50 мкл через 0, 5, 10,20 и 30 мин и добавляли их в 96-луночные планшеты с неглубокими лунками, которые содержали 50 мкл ледяного ацетонитрила с внутренним стандартом для остановки реакций. Планшеты хранили при температуре 4 С в течение 20 мин и затем в лунки планшета перед центрифугированием для получения гранул осажденных белков добавляли 100 мкл воды. Надосадочные жидкости перемещали в другой 96 луночный планшет и определяли количество введенного соединения и его метаболита (перечисленных в табл. 5 выше) методом LC-MS/MS, используя масс-спектрометр Applied Bio-Systems API 4000. Результаты этого исследования отражены на фиг. 4 и 5. Зависимость образования метаболитов от времени показана на фиг. 4. Относительное количество образовавшегося метаболита было рассчитано по количеству, содержащемуся в момент времени 30 мин, относительно самой ранней временной точки, при которой оно было выявлено в инкубируемой смеси, 0 мин для А, В, С и Е, 5 мин для D и 10 мин для F. Количество (S)-M1, образовавшегося в микросомах печени человека, инкубированных с пентоксифиллином (фиг. 5, колонка А), через 30 мин было похоже на количество соединения 419 (S), образовавшегося в микросомах печени человека, инкубируемых с соединением 409 (фиг. 5, колонка В). Таким образом, дейтерирование пентоксифиллина соединением 409 не оказывает заметного влияния на относительный уровень образовавшегося дейтерированного метаболита (S)-M1 (соединение 419 (S по сравнению с относительным уровнем нейдейтерированного (S)-M1, образовавшегося из недейтерированного пентоксифиллина. Эти результаты в микросомах печени человека согласуются с результатами, наблюдавшимися в цельной крови человека. Для обратной реакции превращения (S)-M1 в кетосоединение дейтерирование имело большое влияние. Колонка С на фиг. 5 показывает, что через 30 мин после добавления (S)-M1 наблюдалось значительное количество пентоксифиллина. В противоположность этому после добавления соединения 435 (S) уровень соединения 409, определенный через 30 мин, был ниже, чем уровень (S)-M1 (фиг. 5, колонка D). Примерно на 30% больше пентоксифиллина образовалось из (S)-M1 по сравнению с соединением 409,образовавшимся из соединения 435 (S). При этих условиях замещение дейтерием в соединении 435 (S) препятствует конверсии этого соединения в соответствующий кетон. В то время как дейтерий оказывает большее влияние в крови крыс, эти результаты согласуются. Сильное влияние дейтерия на метаболизм метаболита (R)-M1 наблюдалось в микросомах печени человека. Дейтерирование (R)-M1 (соединения 435 (R снижало почти в 5 раз количество образовавшегося дейтерированного пентоксифиллина (соединение 409) после 30 мин инкубирования с микросомами печени человека по сравнению с количеством недейтерированного пентоксифиллина, образовавшегося из недейтерированного (R)-M1 (сравните колонки Е и F на фиг. 5). Фиг. 4 показывает зависимость количества метаболита, образовавшегося во время инкубации введенного соединения с микросомами печени человека, от времени.
МПК / Метки
МПК: A61P 1/16, C07D 473/06, A61K 31/522, A61P 13/12
Метки: дейтерированных, ксантинов, замещенные, производные, применение
Код ссылки
<a href="https://eas.patents.su/30-19088-zameshhennye-proizvodnye-dejjterirovannyh-ksantinov-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные дейтерированных ксантинов и их применение</a>
Предыдущий патент: Способ атомно-абсорбционных измерений
Следующий патент: Электротехническая проволока из алюминиевого сплава
Случайный патент: Конструкция строения, складываемого и раскладываемого под действием его собственного веса относительно вертикальных шарнирных осей












