Замещенные производные 1,3-дифенилпропана, получение и их применение
Номер патента: 18437
Опубликовано: 30.08.2013
Авторы: Комон-Бертран Карин, Анф Реми, Дельомель Жан-Франсуа
Формула / Реферат
1. Соединение, имеющее общую формулу (I)
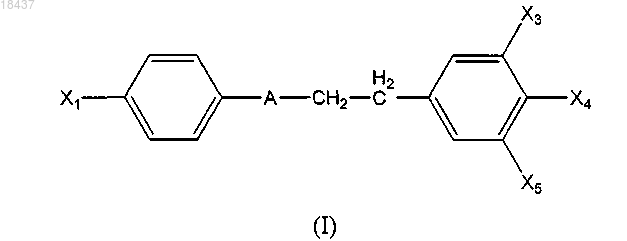
в которой X1 представляет собой атом галогена, группу R1 или G1-R1;
Х4 представляет собой группу G4-R4;
R1 представляет собой галогенированную алкильную группу, содержащую 1-24 атома углерода;
R4 представляет собой C1-C24-алкил, замещенный одной группой COOR9;
X3 и Х5, одинаковые или различные, представляют собой незамещенный С1-С24-алкил;
G1 и G4, одинаковые или различные, представляют собой атом кислорода или серы;
А представляет собой:
(i) CHOR8, где R8 является Н или алкильной группой, содержащей 1-6 углеродных атомов, замещенной или незамещенной одной арильной группой, содержащей 5-14 углеродных атомов, возможно прерываемых одним гетероатомом, выбранным из N, О, S или Р; или
(ii) группу (СО);
R9 представляет собой атом водорода или незамещенный C1-C6-алкил.
2. Соединение по п.1, характеризующееся тем, что А представляет собой карбонильную группу (СО).
3. Соединение по п.1 или 2, характеризующееся тем, что Х4 представляет собой G4R4, где R4 представляет собой C1-C10-алкил.
4. Соединение по пп.1-3, характеризующееся тем, что G4 представляет собой атом кислорода.
5. Соединения по любому из предыдущих пунктов, характеризующиеся тем, что Х4 соответствует формуле
-OC(CH3)2COOR9, где R9 был определен в п.1.
6. Соединения по любому из предыдущих пунктов, характеризующиеся тем, что группы X3 и X5, одинаковые или различные, представляют собой незамещенный С1-С4-алкил.
7. Соединения по любому из предыдущих пунктов, характеризующиеся тем, что X1 представляет собой группу R1 или G1R1, где G1 определен в п.1 и R1 представляет собой галогенированную C1-C3-алкильную группу.
8. Соединения по любому из предыдущих пунктов, характеризующиеся тем, что их выбирают из
2-[2,6-диметил-4-[3-[4-(трифторметокси)фенил]-3-оксопропил]фенокси]-2-метилпропионовой кислоты,
2-[2,6-диметил-4-[3-[4-(трифторметилтио)фенил]-3-оксопропил]фенокси]-2-метилпропионовой кислоты,
2-[2,6-диметил-4-[3-[4-бромфенил]-3-оксопропил]фенокси]-2-метилпропионовой кислоты,
2-[2,6-диметил-4-[3-[4-(трифторметил)фенил]-3-оксопропил]фенокси]-2-метилпропионовой кислоты,
2-[2,6-диметил-4-[3-гидрокси-3-[4-(трифторметилтио)фенил]пропил]фенокси]-2-метилпропионовой кислоты,
2-[2,6-диметил-4-[3-(пиридин-3-илметокси)-3-[4-(трифторметокси)фенил]пропил]фенокси]-2-метилпропионовой кислоты,
2-[4-(3-(4-иодбензилокси)-3-(4-(трифторметокси)фенил)пропил)-2,6-диметилфенокси]-2-метилпропионовой кислоты,
2-[4-(3-метокси-3-(4-(трифторметокси)фенил)пропил)-2,6-диметилфенокси]-2-метилпропионовой кислоты,
2-[2,6-диметил-4-[3-[4-(3,3,3-трифторпропилокси)фенил]-3-оксопропил]фенокси]-2-метилпропионовой кислоты,
2-(2,6-диметил-4-(3-оксо-3-(4-(2,2,2-трифторэтокси)фенил)пропил)фенокси)-2-метилпропионовой кислоты,
2-(2,6-диметил-4-(3-оксо-3-(4-(2,2,2-трифторэтилтио)фенил)пропил)фенокси)-2-метилпропионовой кислоты,
2-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)пропионовой кислоты,
2-[4-(3-гидрокси-3-(4-(трифторметокси)фенил)пропил)-2,6-диметилфенокси]-2-метилпропионовой кислоты,
4-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)-2,2-диметилмасляной кислоты,
2-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)-2-трет-бутилметилпропаноата,
2-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)-2-изопропилметилпропаноата,
2,2-дифтор-2-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)уксусной кислоты.
9. Фармацевтическая композиция, проявляющая свойства агониста PPAR, включающая в фармацевтически приемлемом наполнителе по меньшей мере одно из соединений по пп.1-8.
10. Фармацевтическая композиция по п.9 для лечения осложнений, связанных с метаболическим синдромом, резистентности к инсулину, диабета, дислипидемии, атеросклероза, сердечно-сосудистых заболеваний, ожирения, гипертонии, воспалительных заболеваний, нейродегенеративных патологий или рака.
11. Фармацевтическая композиция по п.9 для лечения дислипидемии.
12. Фармацевтическая композиция по п.9 для лечения факторов риска развития сердечно-сосудистых заболеваний, относящихся к дисрегуляции метаболизма липидов и/или углеводов.
Текст
Изобретение имеет отношение к замещенным производным 1,3-дифенилпропана формулы (I) в которой X1 представляет собой атом галогена, группу R1 или G1R1; X4 представляет собой группу G4-R4; Х 5 представляет собой группу R5; R1 представляет собой галогенированную алкильную группу,содержащую 1-24 атома углерода; R4 представляет собой C1-C24-алкил, замещенный одной группой COOR9;R3 и R5, одинаковые или различные, представляют собой незамещенный C1-C24-алкил; G1 и G4, одинаковые или различные, представляют собой атом кислорода или серы; А представляет собой (i) CHOR8, где R8 является Н или алкильной группой, содержащей 1-6 углеродных атомов, замещенной или незамещенной арильной группой, содержащей 5-14 углеродных атомов, возможно прерываемых одним или несколькими гетероатомами, выбранными из N, О, S или Р или (ii) группу (СО); R9 представляет собой атом водорода или незамещенный C1-C6-алкил, фармацевтическим композициям, включающим их и к терапевтическому применению их, в особенности в области здравоохранения людей и животных. Область техники, к которой относится изобретение Настоящее изобретение имеет отношение к замещенным производным 1,3-дифенилпропана, к фармацевтическим композициям, включающим их, и к их терапевтическому применению, в частности, в областях, относящихся к здоровью людей и животных. Заявители неожиданно обнаружили, что соединения в соответствии с настоящим изобретением обладают присущими им агонистическими свойствами в отношении PPAR. Молекулы, раскрытые в этом изобретении, поэтому представляют особый интерес при лечении осложнений метаболического синдрома, резистентности к инсулину, диабета, дислипидемии, атеросклероза, сердечно-сосудистого заболевания, ожирения, гипертонии, воспалительных заболеваний (астма и т.д.), нейродегенеративных заболеваний (болезнь Альцгеймера и т.д.), рака и т.д., а также для снижения глобального риска. Соединения в соответствии с этим изобретением предпочтительно применяют для лечения дислипидемии. Уровень техники Диабет, ожирение и дислипидемия (высокий уровень ЛПН-холестерина и триглицеридов, низкий уровень ЛВП-холестерина и т.д.) являются некоторыми из точно определяемых сердечно-сосудистых факторов риска, которые могут предрасполагать индивидуума к развитию сердечно-сосудистых заболеваний (Mensah M., 2004). Также следует принимать во внимание факторы риска, связанные с образом жизни, такие как табакокурение, сидячий образ жизни и несбалансированное питание. Эти факторы обладают синергическим эффектом: одновременное присутствие нескольких таких факторов драматическим образом увеличивает риск развития сердечно-сосудистых заболеваний. Таким образом, глобальный риск развития сердечно-сосудистого заболевания заслуживает внимания. В 2004 г. распространенность дислипидемии достигла 43,6% населения в промышленно развитых странах. В настоящее время резкое увеличение количества диабетиков делает диабет еще более важным фактором в эпидемиологии сердечно-сосудистых заболеваний: подсчитано, что к 2010 г. 7,6% населения будут диабетиками (Fox-Tucker J.,2005). Согласно данным Международного общества по изучению атеросклероза (International Atherosclerosis Society, 2003), сердечно-сосудистое заболевание является первичной причиной смерти в промышленно развитых странах и становится еще более распространенным в развитых странах. Основными сердечно-сосудистыми заболеваниями являются сердечная недостаточность, ишемия головного мозга и заболевание периферических артерий. Поэтому эти результаты оправдывают энергичные меры для значительного снижения процента заболеваемости и смертности от сердечно-сосудистых заболеваний и для выявления необходимости поиска эффективных способов лечения, которые связаны с изменением образа жизни. Принимая во внимание факторы риска развития сердечно-сосудистых заболеваний и последствия этих заболеваний, это повсеместно требует неотложных мер. Соединения в соответствии с изобретением благодаря их агонистическим свойствам в отношенииPPAR представляют особенный интерес для лечения патологий, связанных с дисрегуляцией обмена липидов и/или углеводов, таких как диабет, ожирение, дислипидемия или воспаление, а также для снижения глобального риска развития сердечно-сосудистых заболеваний. Известно, что PPARs (,и ) вовлечены в этот тип патологических состояний (Kota B.P. et al.,2005): поэтому для лечения этих патологий предлагают лиганды и рецепторы (Lefebvre P. et al., 2006), а различные модуляторы, агонисты или антагонисты PPAR, селективные или неселективные, в настоящее время находятся на стадии интенсивной разработки. Модулятор PPAR, обладающий полезными эффектами при резистентности к инсулину, ожирении, дислипидемии, гипертонии и/или воспалении, может применяться при лечении метаболического синдрома (или синдрома X) (Liu Y. and Miller A., 2005). Семейство PPARs включает три изоформы, известные как ,и(также известна как изоформа ),каждая из которых кодируется разным геном. Эти рецепторы принадлежат к суперсемейству ядерных рецепторов и транскрипционных факторов, которые активируются в результате контакта с определенными жирными кислотами и/или их липидными метаболитами. Активированные PPARs образуют гетеродимеры с рецепторами 9-цис-ретиноевой кислоты (RXR или ретиноидный рецептор X) и связываются со специфическими чувствительными элементами (PPRE или чувствительные элементы рецептора активаторов пролиферации пероксисом) промотора генов-мишеней, обеспечивая, таким образом, контроль транскрипции.PPAR контролирует метаболизм липидов (в печени и мышцах) и гомеостаз глюкозы, влияет на внутриклеточный метаболизм липидов и углеводов путем прямого регулирования транскрипции генов,кодирующих белки, вовлеченные в гомеостаз липидов, обладает противовоспалительным и антипролиферативным действием и предупреждает проатерогенные эффекты накопления холестерина в макрофагах с помощью стимуляции выведения холестерина (Lefebvre P., Chinetti G., Fruchart J.C., and Staels В.,2006). Фибраты (фенофибрат, безафибрат, ципрофибрат, гемфиброзил), действующие через PPAR,применяют в клинической медицине для лечения определенных типов дислипидемии путем снижения уровня триглицеридов и повышения уровня ЛВП (липопротеин высокой плотности).PPAR играет ключевую роль в регулировании адипогенеза. Кроме того, он вовлечен в обмен липидов зрелых адипоцитов, гомеостаз глюкозы и особенно в развитие резистентности к инсулину, воспаление, аккумуляцию холестерина в макрофагах и пролиферацию клеток (Lehrke M. and Lazar M.A., 2005). Поэтому PPAR играет роль в патогенезе ожирения, резистентности к инсулину и диабета. Тиазолидиндионы (росиглитазон, троглитазон и т.д.) представляют собой лиганды PPAR, применяемые при лечении диабета 2-го типа. В настоящее время имеются лиганды для PPAR (L-165041, GW501516, находящиеся сейчас в клинической разработке), но нет лиганда для PPAR, который можно было бы применять в настоящее время в качестве лекарственного средства. Этот рецептор, однако, представляет собой привлекательную цель для разработки полезных лекарственных средств для лечения дислипидемии, атеросклероза, ожирения и резистентности к инсулину: PPAR действительно вовлечен в регулирование метаболизма липидов и углеводов, энергетический баланс, нейродегенерацию, ожирение, образование ксантомных клеток макрофагов и воспаление (Gross В. et al., 2005). Помимо прямой роли, которую лиганды PPAR играют в регулировании метаболизма липидов и углеводов, эти молекулы обладают целым спектром плейотропного действия благодаря колоссальному разнообразию генов-мишеней для PPAR. Эти многочисленные свойства делают PPARs интересными терапевтическими мишениями, имеющими отношение к лечению таких заболеваний, как атеросклероз,ишемия головного мозга, гипертония, болезни, связанные с неоваскуляризацией (ретинопатия, диабет и т.д.), воспалительные и аутоиммунные заболевания (болезнь Крона, псориаз, множественный склероз,астма и т.д.), неопластические заболевания (канцерогенез и т.д.), нейродегенеративные заболевания, осложнения, связанные с метаболическим синдромом, резистентность к инсулину, диабет, дислипидемия,сердечно-сосудистое заболевание, ожирение и т.д.; а также к снижению глобального риска. Сущность изобретения Соединения в соответствии с изобретением из-за их агонистических свойств в отношении PPAR являются выигрышным терапевтическим средством для совершенствования лечения патологий, относящихся к дисрегуляции обмена липидов и/или углеводов, в особенности дислипидемии, а также для снижения глобального риска развития сердечно-сосудистых заболеваний. В более общем смысле, действуя одновременно на несколько процессов регуляции, соединения в соответствии с изобретением представляют собой выигрышные терапевтические средства для лечения осложнений, связанных с метаболическим синдромом (признаками которого являются ожирение, в частности абдоминальное ожирение, аномальная концентрация липидов крови (высокий уровень триглицеридов и/или высокий уровень ЛВП-холестерина (дислипидемия, гипергликемия и/или резистентность к инсулину и гипертония), атеросклероза, сердечно-сосудистого заболевания, резистентности к инсулину,ожирения, гипертонии, диабета, дислипидемии, воспалительного заболевания (астма и т.д.), нейродегенеративных патологий (болезнь Альцгеймера и т.д.), рака и т.д., а также для снижения глобального риска. Настоящее изобретение направлено на соединения, имеющие общую формулу (I) в которой X1 представляет собой атом галогена, группу R1 или G1-R1; Х 4 представляет собой группу G4-R4;R1 представляет собой галогенированную алкильную группу, содержащую 1-24 атома углерода;R4 представляет собой С 1-С 24-алкил, замещенный одной группой COOR9;X3 и Х 5, одинаковые или различные, представляют собой незамещенный С 1-С 24-алкил;G1 и G4, одинаковые или различные, представляют собой атом кислорода или серы; А представляет собой:(i) CHOR8, где R8 является Н или алкильной группой, содержащей 1-6 углеродных атомов, замещенной или незамещенной одной арильной группой, содержащей 5-14 углеродных атомов, возможно прерываемых одним гетероатомом, выбранным из N, О, S или Р; илиR9 представляет собой атом водорода или незамещенный C1-C6-алкил. В контексте этого изобретения термин "алкил" обозначает углеводородный радикал, который является насыщенным, линейно-цепочечным, разветвленным или циклическим, галогенированный или нет,который имеет, в частности, от 1 до 24 и предпочтительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода,например метил, трифторметил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил,пентил, неопентил, н-гексил или циклогексил. Термин "арил" относится к ароматическим группам, включающим предпочтительно от 5 до 14 атомов углерода, предпочтительно от 6 до 14 атомов углерода, по возможности перемежающихся одним или несколькими гетероатомами, выбираемыми из N, О, S или Р (более точно "гетероарил"). Они в основном являются моно- или бициклическими и включают предпочтительно от 6 до 14 атомов углерода, например фенил, -нафтил, -нафтил, антраценил или флуоренил. Под галогеном понимают атом брома, хлора, фтора или иода. Галогенированный алкильный радикал представляет собой алкильный радикал, который был определен выше и который включает по меньшей мере один атом галогена или полностью галогенирован(пергалогенированный радикал). Предпочтительно соединение по изобретению характеризуется тем, что А представляет собой карбонильную группу (СО), Х 4 представляет собой G4R4, где R4 представляет собой C1-C10-алкил, G4 представляет собой атом кислорода, или Х 4 соответствует формуле -OC(CH3)2COOR9, где R9 был определен в п.1. Предпочтительно соединения по изобретению характеризуются тем, что группы X3 и Х 5, одинаковые или различные, представляют собой незамещенный С 1-С 4-алкил, X1 представляет собой группу R1 или G1R1, где G1 определена в п.1 и R1 представляет собой галогенированную C1-C3-алкильную группу. Предпочтительно соединения по изобретению выбирают из 2-[2,6-диметил-4-[3-[4-(трифторметокси)фенил]-3-оксопропил]фенокси]-2-метилпропионовой кислоты,2-[2,6-диметил-4-[3-[4-(трифторметилтио)фенил]-3-оксопропил]фенокси]-2-метилпропионовой кислоты,2-[2,6-диметил-4-[3-[4-бромфенил]-3-оксопропил]фенокси]-2-метилпропионовой кислоты,2-[2,6-диметил-4-[3-[4-(трифторметил)фенил]-3-оксопропил]фенокси]-2-метилпропионовой кислоты,2-[2,6-диметил-4-[3-гидрокси-3-[4-(трифторметилтио)фенил]пропил]фенокси]-2-метилпропионовой кислоты,2-[2,6-диметил-4-[3-(пиридин-3-илметокси)-3-[4-(трифторметокси)фенил]пропил]фенокси]-2 метилпропионовой кислоты,2-[4-(3-(4-иодбензилокси)-3-(4-(трифторметокси)фенил)пропил)-2,6-диметилфенокси]-2 метилпропионовой кислоты,2-[4-(3-метокси-3-(4-(трифторметокси)фенил)пропил)-2,6-диметилфенокси]-2-метилпропионовой кислоты,2-[2,6-диметил-4-[3-[4-(3,3,3-трифторпропилокси)фенил]-3-оксопропил]фенокси]-2 метилпропионовой кислоты,2-(2,6-диметил-4-(3-оксо-3-(4-(2,2,2-трифторэтокси)фенил)пропил)фенокси)-2-метилпропионовой кислоты,2-(2,6-диметил-4-(3-оксо-3-(4-(2,2,2-трифторэтилтио)фенил)пропил)фенокси)-2-метилпропионовой кислоты,2-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)пропионовой кислоты,2-[4-(3-гидроки-3-(4-(трифторметокси)фенил)пропил)-2,6-диметилфенокси]-2-метилпропионовой кислоты,4-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)-2,2-диметилмасляной кислоты,2-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)-2-трет-бутилметилпропаноата,2-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)-2-изопропилметилпропаноата,2,2-дифтор-2-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)уксусной кислоты. В соответствии с конкретным воплощением изобретения предпочтительные соединения показаны ниже. Соединение 1. 2-[2,6-Диметил-4-[3-[4-(трифторметилокси)фенил]-3-оксопропил]фенокси]-2-метилпропионовая кислота 2-(2-Метокси-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенилтио)-2 Соединения настоящего изобретения включают их стереоизомеры (диастереоизомеры, энантиомеры), в очищенном состоянии или в виде смеси; рацемические формы, их геометрические изомеры, их таутомеры, их соли, их гидраты, их сольваты, их твердые формы и их смеси. Соединения в соответствии с изобретением могут включать один или несколько асимметричных центров. Настоящее изобретение включает стереоизомеры (диастереоизомеры, энантиомеры), в очищенном состоянии или в виде смеси; а также рацемические формы и геометрические изомеры. Если необходимы энантиочистые (или обогащенные) смеси, их можно получить или с помощью очистки конечного продукта, или хиральных интермедиатов, или с помощью асимметрического синтеза в соответствии с методами, известными специалистам в этой области техники (например, с помощью реагентов и хиральных катализаторов). Некоторые соединения в соответствии с изобретением могут иметь таутомерные формы с различной стабильностью, и все эти формы, а также их смеси включены в это изобретение. Это изобретение также имеет отношение к "фармацевтически приемлемым" солям соединений в соответствии с изобретением. Обычно этот термин обозначает слаботоксичные или нетоксичные соли,которые получают из органических или неорганических оснований или кислот. Эти соли могут быть получены во время заключительной стадии очистки соединения в соответствии с изобретением или путем включения соли в очищенное соединение. Некоторые соединения в соответствии с изобретением и их соли могут быть стабильными в нескольких твердых формах. Настоящее изобретение включает все твердые формы соединений в соответствии с изобретением, которое включает аморфные, полиморфные, моно- и поликристаллические формы. Соединения в соответствии с изобретением могут находиться в несольватированной или сольватированной форме, например, вместе с фармацевтически приемлемыми сольвентами, например с водой(гидраты) или этанолом. Соединения в соответствии с изобретением, меченные одним или несколькими изотопами, также включены в изобретение: эти соединения структурно идентичны, но отличаются тем, что по меньшей мере один атом в структуре заменен на изотоп (радиоактивный или нерадиоактивный). Примеры изотопов, которые могут быть включены в структуру соединений в соответствии с изобретением, могут быть выбраны из водорода, углерода, кислорода и серы, например из 2 Н, 3 Н, 13 С, 14 С, 18 О, 17 О, 35S, соответственно. Радиоактивные изотопы являются особенно предпочтительными, так как их легко получать и обнаруживать при исследовании биоусвояемости веществ in vivo. Тяжелые изотопы (такие как 2 Н) являются особенно предпочтительными, так как их применяют в качестве внутренних стандартов при аналитических исследованиях. Настоящее изобретение также имеет отношение к способу синтеза соединений, имеющих формулу(I), как было определено ранее. Способ настоящего изобретения включает стадию смешивания (i) в щелочной или кислой среде по меньшей мере одного соединения, имеющего формулу (А) по меньшей мере с одним соединением, имеющим формулу (В) в которых ранее группам X1, X2, X3, X4 и X5 уже были даны определения,затем стадию восстановления (ii) полученного соединения, и в конечном итоге стадию, обеспечивающую присоединение функциональных групп (iii). Экспериментальные условия для стадии (i) в кислой или щелочной среде и для стадии (ii) не представляют трудности для выполнения для специалистов в этой области техники и могут сильно различаться. Процедуры синтеза могут быть, в частности, теми же, что описаны в разделе "Примеры" в этом изобретении. Смешивание двух соединений выгодно проводить при стехиометрическом соотношении. Его проводят предпочтительно при комнатной температуре (примерно от 18 до 25C) и при нормальном атмосферном давлении. В щелочной среде реакция присходит предпочтительно в присутствии сильного основания, например гидроокиси щелочных металлов, подобной гидроокиси натрия, или алкоголята щелочного металла,подобного этилату натрия. В кислой среде реакция присходит предпочтительно в присутствии сильной кислоты, такой как соляная кислота. Полученные соединения могут быть получены в очищенном состоянии с помощью классических методов специалистом средней квалификации в этой области техники. Они затем могут применяться,например, в качестве лекарственных средств или косметических продуктов. Настоящее изобретение также направлено на соединения, такие как были описаны выше, в качестве лекарственных средств. Другой объект настоящего изобретения имеет отношение к фармацевтической композиции, включающей в фармацевтически приемлемом носителе по меньшей мере одно соединение, которое было описано выше, возможно вместе в одним или несколькими другими терапевтическими и/или косметическими активными компонентами. Предпочтительно это имеет отношение к фармацевтической композиции для лечения осложнений,ассоциированных с метаболическим синдромом, резистентностью к инсулину, диабетом, дислипидемией, атеросклерозом, сердечно-сосудистыми заболеваниями, ожирением, гипертонией, воспалительными заболеваниями (астма и т.д.), нейродегенеративными патологиями (болезнь Альцгеймера и т.д.) или раком и т.д. Эту фармацевтическую композицию в соответствии с изобретением предпочтительно применяют для лечения дислипидемии. Предпочтительно это фармацевтическая композиция для лечения факторов риска развития сердечно-сосудистых заболеваний, связанных с дисрегуляцией метаболизма липидов и/или нарушениями обмена углеводов (гиперлипидемия, диабет 2-го типа, ожирение и т.д.), путем снижения глобального риска. Другой объект изобретения имеет отношение к пищевой композиции, включающей по меньшей мере одно соединение, которое было описано выше. Другой объект изобретения имеет отношение к применению по меньшей мере одного соединения,которое было описано ранее, для получения фармацевтических композиций, предназначенных для лечения множественных патологий, в частности тех, которые связаны с нарушениями метаболизма (например, дислипидемия). В общем смысле, объект изобретения имеет отношение к применению по меньшей мере одного соединения, которое было описано ранее, для получения фармацевтических композиций,предназначенных для лечения факторов риска сердечно-сосудистых заболеваний, связанных с нарушениями метаболизма липидов и/или углеводов, для снижения глобального риска. Например, соединения в соответствии с изобретением (без ограничения) в идеальном случае могут быть успешно введены в комбинации с другими терапевтическими и/или косметическими средствами,доступными в настоящее время в продаже или находящимися на стадии разработки, такими как антидиабетические средства: средства, усиливающие секрецию (сульфонилмочевина (глибенкламид, глимепирид, гликлазид и т.д.) и глиниды (репаглинид, натеглинид и т.д., ингибиторы альфаглюкозидазы, агонисты PPAR (тиазолидиндионы, такие как росиглитазон, пиоглитазон), смешанные агонисты PPAR/ (тезаглитазар, мураглитазар), pan-PPARs (соединения, которые одновременно активируют 3 изоформы PPAR), бигуаниды (метформин), ингибиторы дипептидилпептидазы IV типа (MK-431,вилдаглиптин), агонисты глюкагон-подобного пептида-1 (GLP-1) (эксенатид) и т.д.; инсулин; молекулы, снижающие уровень липидов и/или холестерина: фибраты (фенофибрат, гемфиброзил); ингибиторы HMG-CoA-редуктазы или гидроксилметилглутарил-коэнзим А-редуктазы (статины, такие как аторвастатин, симвастатин, флувастатин); ингибиторы всасывания холестерина (эзетимиб, фитостерины); ингибиторы белка-переносчика СЕТР или сложных эфиров холестерина (торсетрапиб); ингибиторы АСАТ или ацил-коэнзим А:холестерин ацилтрансферазы (авасимиб, эфлуцимиб), ингибиторы МТР(микросомального транспортного белка, переносящего триглицериды); вещества, связывающие желчные кислоты (холестирамин); витамин Е, полиненасыщенные жирные кислоты, омега-3 жирные кислоты,производные никотиновой кислоты (ниацин) и т.д.; противогипертонические средства и гипотензивные средства: ингибиторы АСЕ (ангиотензинпревращающий фермент) (каптоприл, эналаприл, рамиприл или квинаприл); антагонисты рецептора ангиотензина II (лозартан, валсартан, телмисартан, эпросартан, ирбесартан и т.д.); бета-блокаторы (атенолол, метопролол, лабеталол, пропанолол); тиазидные и нетиазидные диуретики (фуросемид, индапамид,гидрохлортиазид, антиальдостерон); сосудорасширяющие средства; ингибиторы кальциевых каналов(нифедипин, фелодипин или амлодипин, дилтиазем или верапамил) и т.д.; противотромбоцитные средства: аспирин, тиклопидин, дипиридамол, клопидогрел, флурбипрофен и т.д.; средства против ожирения: сибутрамин, ингибиторы липазы (орлистат), PPAR, антагонисты каннабиноидных рецепторов CB1 (римонабант) и т.д.; противовоспалительные средства: например кортикоиды (преднизон, бетаметазон, дексаметазон,преднизолон, метилпреднизолон, гидрокортизон и т.д.); NSAIDs или нестероидные противовоспалительные лекарственные средства, производные индола (индометацин, сулиндак); NSAIDs арилкарбоновой группы (тиапрофеновая кислота, диклофенак, этодолак, флурбипрофен, ибупрофен, кетопрофен, напроксен, набуметон, алминопрофен); NSAIDs, производные оксикама (мелоксикам, пироксикам, теноксикам);NSAIDs группы фенаматов, селективные ингибиторы СОХ 2 (целекоксиб, рофекоксиб) и т.д.; антиоксидантные средства: например пробукол и т.д.; вещества, применяемые при лечении сердечной недостаточности: тиазидные и нетиазидные диуретики (фуросемид, индапамид, гидрохлортиазид, антиальдостерон), ингибиторы АСЕ (каптоприл, эналаприл, рамиприл или квинаприл), дигиталисные лекарственные средства (дигоксин, дигитоксин), бетаблокаторы (атенолол, метопролол, лабеталол, пропанолол), ингибиторы фосфодиэстеразы (эноксимон,милринон) и т.д.; средства, применяемые при лечении коронарной недостаточности: бета-блокаторы (атенолол, метопролол, лабеталол, пропанолол), ингибиторы кальциевых каналов (нифедипин, фелодипин или амлодипин, бепридил, дилтиазем или верапамил), доноры NO (окиси азота) (тринитрин, изосорбида динитрат,молсидомин), амиодарон и т.д.; противораковые лекарственные средства: цитотоксические средства (вещества, взаимодействующие с ДНК (дезоксирибонуклеиновой кислотой); алкилирующие средства, цисплатин и производные),цитостатические средства (аналоги GnRH (гонадотропин-высвобождающего гормона), аналоги соматостатина, прогестин, антиэстрогенные лекарственные средства, ингибиторы ароматазы и т.д.), модуляторы иммунного ответа (интерфероны, IL2 и т.д.) и т.д.; противоастматические лекарственные средства, такие как бронхорасширяющие средства (агонисты бета-2-рецепторов), кортикоиды, кромогликат, антагонисты лейкотриеновых рецепторов (монтелукаст) и т.д.; кортикоиды, применяемые при лечении кожных патологий, таких как псориаз и дерматит; сосудорасширяющие средства и/или антиишемические средства (буфломедил, экстракт гинкго билоба, нафтидрофурил, пентоксифиллин, пирибедил) и т.д. Изобретение также имеет отношение к способу лечения патологий, связанных с метаболизмом липидов и/или углеводов, включающему введение субъекту, в частности человеку, эффективного количества соединения или фармацевтической композиции, которая была определена выше. В контексте изобретения термин "эффективное количество" относится к количеству соединения, достаточному для того,чтобы получить желаемый биологический результат. В контексте изобретения термин "субъект" означает млекопитающего и, более конкретно, человека. Термин "лечение" обозначает исцеляющее, симптоматическое или профилактическое лечение. Соединения этого изобретения, таким образом, могут быть применены на субъектах (таких как млекопитающие, в частности люди), у которых есть признанное заболевание. Соединения этого изобретения также могут быть применены для того, чтобы задержать или уменьшить прогрессирование или предотвратить дальнейшее прогрессирование заболевания, улучшая, таким образом, состояние субъектов. Соединения этого изобретения в конечном итоге можно вводить здоровым субъектам, у которых может обычно развиваться заболевание или у которых существует значительный риск развития заболевания. Фармацевтические композиции в соответствии с изобретением преимущественно включают один или несколько эксципиентов или наполнителей, приемлемых в фармацевтическом контексте (например,солевые растворы, физиологические растворы, изотонические растворы и т.д., совместимые с фармацевтическим использованием и хорошо известные специалистам средней квалификации в этой области техники). Композиции могут включать одно или несколько средств или наполнителей, выбираемых из диспергирующих веществ, растворителей, стабилизаторов, консервантов и т.д. Средства или наполнители,полезные в этих композициях (жидких, и/или инъецируемых, и/или твердых) представляют собой, в частности, метилцеллюлозу, гидроксиметилцеллюлозу, карбоксиметилцеллюлозу, полисорбат 80, маннит,желатин, лактозу, растительные масла, гуммиарабик, липосомы и т.д. Композиции могут быть составлены в форме инъецируемых суспензий, гелей, масел, пилюль, суппозиториев, порошков, гелькапсул, капсул, аэрозолей и т.д., в конечном итоге с помощью галеновых форм или приспособлений, обеспечивающих продолжительное и/или медленное высвобождение. Для этой разновидности композиций можно успешно применять такие средства, как целлюлоза, карбонаты или крахмалы. Соединения или композиции в соответствии с изобретением можно вводить различными способами в различных формах. Так, например, их можно вводить систематическим путем, перорально, парентерально, с помощью ингаляции или с помощью инъекции, например, внутривенным, внутримышечным способом, подкожным способом, трансдермальным способом, внутриартериальным способом ит.д. Что касается инъекций, соединения обычно переводят в форму жидких суспензий, которые можно инъецировать, например, с помощью шприцев или перфузии. Ясно, что скорость и/или доза, имеющая отношение к инъекции, может быть адаптирована специалистом средней квалификации в этой области техники в зависимости от пациента, патологии, формы введения и т.д. Обычно соединения вводят в дозах, которые изменяются от 1 мкг до 2 г на прием, предпочтительно от 0,1 мг до 1 г на прием. Введение можно осуществлять ежедневно или даже несколько раз в день, если это необходимо. Кроме того, в композиции в соответствии с изобретением может включать другие средства или активные компоненты. Краткое описание чертежей Сокращения, используемые на этих чертежах:Cpd - соединение,Ctrl - контроль,mpk - мг/кг/день,LDL-cholesterol - ЛНП-холестерин = холестерин липопротеинов низкой плотности,HDL-cholesterol - ЛВП-холестерин = холестерин липопротеинов высокой плотности,VLDL-cholesterol - ЛПОНП-холестерин = холестерин липопротеинов очень низкой плотности,Фиг. 1-1-1-18 - оценка in vitro PPAR-активирующих свойств соединений изобретения в зависимости от дозы. Активацию PPARs оценивали in vitro с помощью линии фибробластов почек обезьяны (COS-7) путем измерения транскрипционной активности химер, составленных из ДНК-связывающего домена дрожжевого транскрипционного фактора Gal4 и домена, связывающего лиганд различных PPARs. Соединения тестировали в дозах от 10-7 до 100 мкМ на химерах Gal4-PPAR,и . Фактор индукции, т.е. соотношение между люминесценцией, индуцированной соединением, и люминесценцией, индуцируемой в контроле, измеряли для всех условий. Чем выше фактор индукции, тем более значительными активирующими свойствами в отношении PPAR обладает соединение. Фиг. 1-1, 1-2, 1-3 - оценка in vitro активирующих свойств соединения 1 в отношении PPAR, , . Фиг. 1-4, 1-5, 1-6 - оценка in vitro активирующих свойств соединения 2 в отношении PPAR, , . Фиг. 1-7, 1-8, 1-9 - оценка in vitro активирующих свойств соединения 3 в отношении PPAR, , . Фиг. 1-10, 1-11, 1-12 - оценка in vitro активирующих свойств соединения 4 в отношении PPAR, ,. Фиг. 1-13, 1-14, 1-15 - оценка in vitro активирующих свойств соединения 5 в отношении PPAR, ,. Фиг. 1-16, 1-17, 1-18 - оценка in vitro активирующих свойств соединения 7 в отношении PPAR, ,. Фиг. 2-1-2-7 - оценка in vivo, проведенная на мышах АроЕ 2/Е 2, параметров массы тела, гиполипидемических свойств и способности соединений в соответствии с изобретением стимулировать синтез ЛВП-холестерина. Эффект соединений в соответствии с изобретением оценивали in vivo на мышах, гуманизированных Е 2-изоформой аполипопротеина Е (Е 2/Е 2). Массу тела мышей Е 2/Е 2 с дислипидемией, уровень общего холестерина, триглицеридов и свободных жирных кислот в плазме крови измеряли через 8 дней после перорального введения соединения в соответствии с изобретением. Эти параметры сравнивали с параметрами, полученными для контрольных животных (животному не вводили соединения в соответствии с изобретением): измеренные различия демонстрируют эффект на массу тела и липидемический эффект соединений в соответствии с изобретением Фиг. 2-1 - увеличение массы тела через 8 дней после воздействия соединением 1, которое вводили в количестве 5, 10 и 50 мг/кг/день. Фиг. 2-2 - уровень холестерина в плазме крови через 8 дней после воздействия соединением 1, которое вводили в количестве 5, 10 и 50 мг/кг/день. Фиг. 2-3 - уровень ЛВП-холестерина в плазме крови через 8 дней после воздействия соединением 1,которое вводили в количестве 5, 10 и 50 мг/кг/день. Фиг. 2-4 - уровень триглицеридов в плазме крови через 8 дней после воздействия соединением 1,которое вводили в количестве 5, 10 и 50 мг/кг/день. Фиг. 2-5 - уровень свободных жирных кислот в плазме крови через 8 дней после воздействия соединением 1, которое вводили в количестве 5, 10 и 50 мг/кг/день. Эффективность соединений в соответствии с изобретением также оценивали с помощью измерения в печеночной ткани экспрессии генов, вовлеченных в метаболизм липидов и углеводов и в рассеяние энергии. Уровень экспрессии каждого гена нормировали относительно уровня экспрессии гена-стандарта 36 В 4. Затем рассчитывали фактор индукции, т.е. соотношение между относительным сигналом (индуцируемым соединением в соответствии с изобретением) и средними относительными значениями, полученными для контрольной группы. Чем выше фактор индукции, тем сильнее соединение вызывает экспрессию печеночных генов. Конечный результат представлен в виде средних значений индукции, полученных для каждой экспериментальной группы. Фиг. 2-6 - экспрессия PDK4 (киназа пируватдегидрогеназы, изоформа 4) в печеночной ткани мышей Е 2/Е 2 через 8 дней после воздействия соединением 1, которое вводили в количестве 5, 10 и 50 мг/кг/день. Фиг. 2-7 - экспрессия ApoCIII (аполипопротеин C3) в печеночной ткани мышей Е 2/Е 2 через 8 дней после воздействия соединением 1, которое вводили в количестве 5, 10 и 50 мг/кг/день. Фиг. 3-1-3-5 - оценка in vivo, проведенная на мышах C57BI6, параметров массы тела, гиполипидемических свойств и способности соединений в соответствии с изобретением стимулировать синтез ЛВПхолестерина. Эффект соединений в соответствии с изобретением оценивали in vivo на мышах C57BI6 с помощью определения изменения массы тела, уровня ЛВП-холестерина и триглицеридов в плазме крови через 14 дней после перорального введения соединений в соответствии с изобретением. Эти параметры сравнивали с параметрами, полученными для контрольных животных (животным не вводили соединения в соответствии с изобретением): измеренные различия демонстрируют эффект соединений в соответствии с изобретением, который они оказывают на массу тела, и показывают их гиполипидемический эффект. Фиг. 3-1 - увеличение массы тела через 14 дней после воздействия соединением 1, которое вводили в количестве 3, 10 и 30 мг/кг/день. Фиг. 3-2 - уровень ЛВП-холестерина в плазме крови через 14 дней после воздействия соединением 1, которое вводили в количестве 3, 10 и 30 мг/кг/день. Фиг. 3-3 - уровень триглицеридов в плазме крови через 14 дней после воздействия соединением 1,которое вводили в количестве 3, 10 и 30 мг/кг/день. Эффективность соединений в соответствии с изобретением также оценивали с помощью измерения в печеночной ткани экспрессии генов, вовлеченных в метаболизм липидов. Уровень экспрессии каждого гена нормировали относительно уровня экспрессии гена-стандарта 36 В 4. Затем рассчитывали фактор индукции. Чем выше фактор индукции, тем сильнее соединение вызывает экспрессию печеночных генов. Конечный результат представлен в виде средних значений индукции, полученных для каждой экспериментальной группы. Фиг. 3-4 - экспрессия PDK4 в печеночной ткани мышей C57BI6 через 14 дней после воздействия соединением 1, которое вводили в количестве 3, 10 и 30 мг/кг/день. Фиг. 3-5 - экспрессия ApoCIII в печеночной ткани мышей C57BI6 через 14 дней после воздействия соединением 1, которое вводили в количестве 3, 10 и 30 мг/кг/день. Фиг. 4-1-4-9 - оценка in vivo, проведенная на мышах db/db, параметров массы тела, антидиабетических свойств, гиполипидемических свойств и способности соединений в соответствии с изобретением стимулировать синтез ЛВП-холестерина. Эффект соединений в соответствии с изобретением оценивали in vivo на мышах db/db с помощью определения изменения массы тела, уровня глюкозы, уровня инсулина, уровня общего холестерина и триглицеридов в плазме крови и с помощью анализа распределения холестерина в различных фракциях липопротеинов в плазме крови через 28 дней после перорального введения соединений в соответствии с изобретением. Эти параметры сравнивали с параметрами, полученными для контрольных животных(животным не вводили соединения в соответствии с изобретением): измеренные различия демонстрируют эффекты соединений в соответствии с изобретением, которые они оказывают на массу тела, резистентность к инсулину и показывают их гиполипидемический эффект. Фиг. 4-1 - увеличение массы тела через 28 дней после воздействия соединением 1, которое вводили в количестве 50 мг/кг/день. Фиг. 4-2 - гликемия через 28 дней после воздействия соединением 1, которое вводили в количестве 50 мг/кг/день. Фиг. 4-3 - инсулинемия через 28 дней после воздействия соединением 1, которое вводили в количестве 50 мг/кг/день. Фиг. 4-4 - уровень холестерина в плазме крови через 28 дней после воздействия соединением 1 и соединением 3, которые вводили в количестве 50 мг/кг/день. Фиг. 4-5 - распределение холестерина в различных фракциях липопротеинов в плазме крови через 28 дней после воздействия соединением 1 и соединением 3, которые вводили в количестве 50 мг/кг/день. Фиг. 4-6 - уровень триглицеридов в плазме крови через 28 дней после воздействия соединением 1 и соединением 3, которые вводили в количестве 50 мг/кг/день. Фиг. 4-7 - уровень свободных жирных кислот в плазме крови через 28 дней после воздействия соединением 1 и соединением 3, которые вводили в количестве 50 мг/кг/день. Эффективность соединений в соответствии с изобретением также оценивали с помощью измерения в печеночной и мышечной (скелетно-мышечной) тканях экспрессии генов, вовлеченных в метаболизм липидов и углеводов и в рассеяние энергии. Уровень экспрессии каждого гена нормировали относительно уровня экспрессии гена-стандарта 36 В 4 в печеночной ткани или относительно уровня экспрессии гена-стандарта 18S в икроножной скелетной мышце. Затем рассчитывали фактор индукции, т.е. соотношение между относительным сигналом (индуцируемым соединением в соответствии с изобретением) и средними относительными значениями, полученными для контрольной группы. Чем выше фактор индукции, тем сильнее соединение вызывает экспрессию генов. Конечный результат представлен в виде средних значений индукции, полученных для каждой экспериментальной группы. Фиг. 4-8 - экспрессия PDK4 в печеночной ткани мышей db/db через 28 дней после воздействия соединением 1 и соединением 3, которые вводили в количестве 50 мг/кг/день. Фиг. 4-9 - экспрессия UCP2 (разобщающий белок-2) в скелетной мышечной ткани мышей db/db через 28 дней после воздействия соединением 1 и соединением 3, которые вводили в количестве 50 мг/кг/день. Фиг. 5 - оценка in vitro противовоспалительных свойств соединений в соответствии с изобретением с помощью измерения секреции МСР 1 моноцитами, обработанными соединениями в соответствии с изобретением и стимулированными с помощью РМА. Противовоспалительные эффекты соединения в соответствии с изобретением оценивали с помощью измерения секреции МСР 1 (моноцитарный хемотаксический протеин-1) моноцитами ТНР 1, обработанными в течение 24 ч соединениями в соответствии с изобретением и одновременно стимулированными РМА (форбол-12-миристат-13-ацетат, который вызывает воспалительный ответ в клетках и их дифференцировку в макрофаги). Чем меньше секретируется МСР-1, тем сильнее соединение в соответствии с изобретением подавляет воспалительную реакцию. Статистический анализ. Статистические исследования состояли из t-теста Стьюдента (//) и/или одномерного дисперсионного анализа ANOVA с последующим тестом Тьюки (//). Результаты сравнивали с контрольной группой, оценивая значение параметра р:/: p0,05; /: p0,01; /: p0,001. Примеры Традиционные реагенты и катализаторы являются коммерчески доступными (Aldrich, Alfa Aesar,Acros, Fluka или Lancaster). Спектры ядерного магнитного резонанса протонов (NMR 1H) измеряли на спектрометре BrukerAC300P. Химические сдвиги выражали в ppm (в частях на миллион) и расщепление сигналов NMR описывали с помощью принятых сокращений. Пример 1. Основной способ синтеза соединений в соответствии с изобретением. Большинство соединений в соответствии с изобретением специфически получали с помощью восстановления, за которым следовал один из способов, указанных ниже, с помощью соединений, заявленных и/или описанных в патенте US 2005176808. Другие соединения было легко получить, следуя простым хорошо известным методам получения,доступным для специалистов в этой области техники. Основной способ А. Восстановление дифенилпропен-2-онов триэтилсиланом. К раствору дифенилпропан-2-она в дихлорметане добавляли триэтилсилан и затем по каплям трифторуксусную кислоту (7,5 экв.). Реакционную смесь перемешивали при комнатной температуре и за реакцией следили с помощью тонкослойной хроматографии. Реакционную смесь промывали водой. Водный слой экстрагировали дихлорметаном. Объединенные органические фазы высушивали над сульфатом магния и концентрировали при пониженном давлении. Остаток хроматографировали на колонке (препаративная HPLC, lichrospher (Merck) RP18 12 мкм 100, колонка: 25250 мм). Основной способ В. Восстановление дифенилпропен-2-онов тетрахлорсиланом. К раствору дифенилпропан-2-она в ацетонитриле добавляли иодид натрия и затем по каплям тетрахлорсилан. Реакционную смесь перемешивали при комнатной температуре и за реакцией следили с помощью тонкослойной хроматографии. Через 30 мин-2 ч смесь разделяли между хлороформом и водой. Водный слой экстрагировали хлороформом. Объединенные органические фазы высушивали над сульфитом натрия, затем сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток хроматографировали на колонке (препаративная HPLC, lichrospher (Merck) RP18 12 мкм 100, колонка: 25250 мм). Основной способ С. Восстановление дифенилпропен-2-онов палладием-на-угле. К раствору дифенилпропен-2-она в этаноле добавляли каталитическое количество палладия-на-угле(10%). Реакционную смесь перемешивали при комнатной температуре в атмосфере водорода при нормальном атмосферном давлении. Катализатор фильтровали, фильтрат концентрировали при пониженном давлении. Остаток хроматографировали на колонке. Основной способ D. Синтез спирта. К раствору дифенилпропан-3-она в этаноле добавляли боргидрид натрия. Реакционную смесь перемешивали в течение 16 ч при 50C (122F). После охлаждения реакционную смесь гидролизовали и концентрировали при пониженном давлении. Остаток разделяли между дихлорметаном и разведенным раствором соляной кислоты. Органическую фазу промывали водой, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток хроматографировали на колонке (препаративная HPLC, lichrospher (Merck)RP18 12 мкм 100, колонка: 25250 мм). Основной способ Е. Синтез простого эфира. Раствор дифенилпропан-3-ола в смеси 1/3:2/3 вода/спирт в присутствии каталитического количества трифторуксусной кислоты перемешивали в течение 16 ч при 60C. Реакционную смесь затем концентрировали при пониженном давлении. Остаток хроматографировали на колонке (препаративная HPLC,lichrospher (Merck) RP18 12 мкм 100, колонка: 25250 мм). Основной способ F. Синтез с помощью оксимов и простых оксимных эфиров. К раствору дифенилпропан-3-она в пиридине добавляли О-алкилгидроксиламина гидрохлорид. После 16 ч нагревания с обратным холодильником реакционную смесь концентрировали при пониженном давлении. Остаток хроматографировали на колонке. Пример 2. Синтез соединений в соответствии с изобретением. Соединение 1. 2-[2,6-Диметил-4-[3-[4-(трифторметокси)фенил]-3-оксопропил]фенокси]-2 метилпропионовая кислота Это соединение получали в соответствии с основным способом В, используя 2-[2,6-диметил-4-[3-[4(трифторметокси)фенил]-3-оксо-проп-2-енил]фенокси]-2-метилпропионовую кислоту, 15 экв. иодида натрия и 15 экв. тетрахлорсилана. Выход: твердое вещество белого цвета; F=64-66. Это соединение получали в соответствии с основным способом А, используя 2-[2,6-диметил-4-[3[4-(трифторметилтио)фенил]-3-оксо-проп-2-енил]фенокси]-2-метилпропионовую кислоту и 1 экв. триэтилсилана. Выход: твердое вещество белого цвета; F=83-85. Это соединение получали в соответствии с основным способом А, используя 2-[2,6-диметил-4-[3[4-бромфенил]-3-оксо-проп-2-енил]фенокси]-2-метилпропионовую кислоту и 1 экв. триэтилсилана. Выход: вязкое масло белого цвета. Это соединение получали в соответствии с основным способом А, используя 2-[2,6-диметил-4-[3[4-(трифторметил)фенил]-3-оксо-проп-2-енил]фенокси]-2-метилпропионовую кислоту и 1 экв. триэтилсилана. Выход: вязкое масло желтого цвета. Это соединение получали в соответствии с основным способом В, используя 2-[4-[3-[4-хлор-2 гидроксифенил]-3-оксо-проп-2-енил]фенилтио]-2-метилпропионовую кислоту и 5 экв. иодида натрия и 5 экв. тетрахлорсилана. Выход: твердое вещество белого цвета; F=136-137. Это соединение получали с помощью восстановления в соответствии с основным способом С, используя сложный трет-бутиловый эфир 2-(4-(3-(4-гидроксифенил)-3-оксо-проп-1-енил)-2 метилфенокси)-2-метилпропионовой кислоты, с последующим О-алкилированием фенола и ацидолизом сложного трет-бутилового эфира в соответствии со способом, описанным в патенте US 2005/176808. Выход: бесцветное вязкое масло. Это соединение получали в соответствии с основным способом Е, используя раствор 2-(4-(3 гидрокси-3-(4-(трифторметокси)фенил)пропил)-2,6-диметилфенокси)-2-метилпропионовой кислоты в смеси 1/3:2/3 вода/метанол. Выход: бесцветное вязкое масло. Это соединение получали с помощью восстановления в соответствии с основным способом С, используя сложный трет-бутиловый эфир 2-(4-(3-(4-гидроксифенил)-3-оксо-проп-1-енил)-2,6 диметилфенокси)-2-метилпропионовой кислоты с последующим О-алкилированием фенола и ацидолизом трет-бутилового эфира в соответствии со способом, описанным в заявке US 2005176808. Выход: твердое вещество белого цвета; F=98-99. Это соединение получали с помощью восстановления в соответствии с основным способом С, используя сложный трет-бутиловый эфир 2-(4-(3-(2-фтор-4-гидроксифенил)-3-оксо-проп-1-енил)-2,6 диметилфенокси)-2-метилпропионовой кислоты с последующим О-алкилированием фенола и ацидолизом трет-бутилового эфира в соответствии со способом, описанным в заявке US 2005176808. Выход: бесцветное вязкое масло. Это соединение получали в соответствии с основным способом D, используя 2-[2,6-диметил-4-[3[4-(трифторметилокси)фенил]-3-оксопропил]фенокси]-2-метилпропионовую кислоту и 4 экв. боргидрида натрия. Выход: бесцветное вязкое масло. Это соединение получали в соответствии с основным способом F, используя 2-[2,6-диметил-4-[3-[4(трифторметокси)фенил]-3-оксопропил]фенокси]-2-метилпропионовую кислоту. Выход: вязкое масло желтого цвета. Это соединение получали с помощью восстановления в соответствии с основным способом С, используя 3-(4-гидрокси-3,5-диметилфенил)-1-(4-(трифторметокси)фенил)пропан-1-он с последующим Оалкилированием фенола и ацидолизом трет-бутилового эфира в соответствии со способом, описанным в заявке US 2005176808. Выход: бесцветное вязкое масло.NMR 1H (300 МГц, CDCl3,ppm): 1,42 (s, 6H), 1,51 (s, 9H), 2,21 (s, 6H), 2,94 (t, 2H, J=7,9 Гц), 3,25 (t,2H, J=7,9 Гц), 6,82 (s, 2H), 7,28 (d, 2H, J=9,1 Гц), 8,01 (d, 2H, J=9,1 Гц). Другие соединения получали в соответствии со способами, сходными со способами А-F и несложными для выполнения специалистами в этой области техники. Пример 3. Оценка in vitro PPAR-активирующих свойств соединений в соответствии с изобретением.PPAR-активирующие свойства соединений в соответствии с изобретением оценивали in vitro. Принцип. Активацию PPARs оценивали in vitro, используя линию фибробластов почек обезьяны (COS-7), с помощью определения транскрипционной активности химер, составленных из ДНК-связывающего домена дрожжевого транскрипционного фактора Gal4 и домена, связывающего лиганд различных PPARs. Соединения тестировали в дозах от 10-7 до 100 мкМ на химерах Gal4-PPAR,и . Протокол. Культура клеток. Клетки COS-7 получали из АТСС (Американская коллекция типовых культур) и выращивали в среде DMEM (среда Игла в модификации Дульбекко), дополненной 10% (об./об.) фетальной сыворотки теленка, 100 Ед/мл пенициллина (Gibco, Paisley, UK) и 2 мМ L-глутамином (Gibco, Paisley, UK). Клетки инкубировали при 37C во влажной атмосфере, содержащей 5% CO2. Описание плазмид, использованных для трансфекции. Плазмиды Gal4(RE)TkpGL3, pGal4-hPPAR, pGal4-hPPAR, pGal4-hPPAR и pGal4- были описа- 17018437PCR и соответствующих DEF-доменам ядерных рецепторов PPAR, PPAR и PPAR человека. Трансфекция. Клетки COS-7 в суспензии трансфицировали с помощью 150 нг ДНК на лунку при соотношенииpGal4-PPAR/Gal4(RE)TkpGL3, равном 1/10, в присутствии 10% фетальной сыворотки теленка. Клетки помещали в 96-луночный планшеты (410 клеток/лунку), затем инкубировали в течение 24 ч при 37C. Активацию с тестируемыми соединениями проводили в течение 24 ч при 37C в среде, не содержавшей сыворотки. В конце эксперимента клетки лизировали и определяли люциферазную активность, используя Steady-Lite HTS (Perkin Elmer) или Steady Glow Luciferase (Promega) в соответствии с рекомендациями фирмы-производителя. Результаты. Соединения в соответствии с изобретением тестировали на 3-х изоформах PPAR. Результаты, полученные с соединениями 1-5 и 7, подробно представлены на фиг. 1-1-1-18. Заявители продемонстрировали значительный и дозо-зависимый прирост люциферазной активности в клетках, трансфицированных плазмидами pGal4-hPPAR и обработанных соединениями в соответствии с изобретением. Неожиданно представленные экспериментальные данные демонстрируют, что соединения в соответствии с изобретением связываются с PPARs in vitro и вызывают активацию транскрипционной активности. Пример 4. Оценка in vivo, проведенная на мышах АроЕ 2/Е 2, параметров массы тела, гиполипидемических свойств и способности соединений в соответствии с изобретением стимулировать синтез ЛВПхолестерина. Принцип. Свойства влиять на массу тела и гиполипидемические свойства соединений в соответствии с изобретением оценивали in vivo с помощью измерения массы тела и липидов в плазме крови и с помощью анализа экспрессии гена-мишени PPARs после обработки дислипидемических мышей Е 2/Е 2 соединениями в соответствии с изобретением. Использованная мышиная модель представляет собой мышь АроЕ 2/Е 2, трансгенную мышь, имеющую изоформу Е 2 аполипопротеина Е человека (Sullivan P.M. et al., 1998). У человека этот аполипопротеин, компонент липопротеинов низкой и очень низкой плотности (ЛНП-ЛПОНП), присутствует в трех изоформах E2, E3 и Е 4. Форма Е 2 несет в себе мутацию, затрагивающую аминокислоту в положении 158,которая значительно ослабляет сродство этого протеина по отношению к ЛНП-рецепторам. Поэтому выведение ЛПОНП практически отсутствует. Затем происходит накопление липопротеинов низкой плотности вместе со смешанной гиперлипидемией, известной также как тип III (высокий уровень холестерина и триглицеридов).PPAR регулирует экспрессию генов, вовлеченных в транспорт липидов (аполипопротеины, такие как Apo AI, Аро AII и ApoCIII; мембранные переносчики, такие как FAT) и катаболизм липидов (АСО,CPT-I или CPT-II, ферменты -окисления жирных кислот). В соответствии с этим, обработка активаторами PPAR у человека, а также у грызунов приводит к снижению уровня циркулирующих триглицеридов. Измерение уровня липидов в плазме крови после обработки соединениями в соответствии с изобретением позволяет оценивать агонистические свойства в отношении PPAR и гиполипидемический эффект соединений в соответствии с изобретением. Обработка активаторами PPAR также иногда приводит к повышению уровня плазматического ЛВП-холестерина у человека и у грызунов. Измерение уровня ЛВП-холестерина в плазме крови поэтому позволяет продемонстрировать стимулирующий эффект соединений в соответствии с изобретением на синтез ЛВП-холестерина. Агонистические свойства PPAR, ранее определенные in vitro, должны были привести к суперэкспрессии генов-мишеней в печени непосредственно под контролем PPAR. Гены, которые мы исследовали в этом эксперименте, представляют собой Apo CIII (аполипопротеин, вовлеченный в метаболизм липидов) и PDK-4 (фермент, вовлеченный в метаболизм углеводов). Измерение транскрипционной активности генов-мишеней для PPAR после обработки соединениями в соответствии с изобретением действительно позволяет оценивать гиполипидемические свойства соединений в соответствии с изобретением. Протокол. Обработка животных. Трансгенных мышей АроЕ 2/Е 2 содержали при 12-часовом цикле свет/темнота (12 ч/12 ч) при постоянной температуре, составляющей 203C. После одной недели акклиматизационного периода мышей взвешивали и делили на группы, состоящие из 6 животных, выбираемых таким образом, чтобы обеспечить равномерное распределение по массе их тела и уровню липидов в плазме крови, которые определяли перед экспериментом. Теститруемые соединения суспендировали в карбоксиметилцеллюлозе(Sigma C4888) и вводили путем кормления через желудочный зонд один раз в день в течение 8 дней при выбранной дозировке. Животные имели свободный доступ к пище и воде (стандартная диета). Прием пищи и прирост массы тела записывали в течение всего эксперимента. В конце эксперимента животных после 4 ч голодания анестезировали, брали образец крови, используя антикоагулянт (EDTA), затем мышей взвешивали и умерщвляли с помощью эвтаназии. Плазму крови получали центрифугированием при 3000 об/мин в течение 20 мин. Образцы хранили при +4C. Извлекали образцы печени, замораживали их в жидком азоте и затем хранили при -80C для дальнейшего анализа. Измерение липидов плазмы крови. Концентрацию липидов плазмы крови (общий холестерин и триглицеридов) измеряли с помощью энзиматического определения (bioMrieux-Lyon-France) в соответствии с рекомендациями фирмыпроизводителя. Уровень холестерина и триглицеридов в плазме крови измеряли через 8 ч после перорального введения соединений в соответствии с изобретением. Эти уровни сравнивали с уровнями, измеренными для контрольных животных (не получавших соединения в соответствии с изобретением). Измеренное различие демонстрировало гиполипидемический эффект соединений в соответствии с изобретением. Измерение ЛВП-холестерина. Липопротеины низкой плотности (ЛПОНП и ЛНП) осаждали с помощью фосфовольфрамата. Осадок удаляли центрифугированием. ЛВП-холестерин, присутствующий в супернатанте, измеряли с помощью энзиматического определения (bioMrieux-Lyon-France) в соответствии с рекомендациями фирмыпроизводителя. Анализ экспрессии генов с помощью количественной RT-PCR. Суммарную РНК экстрагировали из фрагментов печени с помощью набора NucleoSpin 96 RNA kit(Macherey Nagel, Hoerdt, France) в соответствии с рекомендациями фирмы-производителя. Из 1 мкг суммарной РНК (количественно определенной с помощью набора Ribogreen RNA quantification kit (Molecular Probes затем получали комплементарную ДНК методом обратной транскрипции с помощью 1-часовой реакции при 37C в общем объеме 20 мкл, содержавшем 1X буфер (Sigma), 1,5 мМMMLV-RT (Sigma). Эксперименты по количественной PCR проводили с помощью системы MyiQ Single-Color RealTime PCR Detection System (Biorad, Marnes-la-Coquette, France) и выполняли, используя набор iQ SYBRGreen Supermix kit в соответствии с рекомендациями фирмы-производителя, в 96-луночном планшете в 5 мкл разведенного раствора для обратной транскрипции при температуре гибридизации 55C. Использовали специфические пары праймеров изучаемых генов:ApoCIII: смысловой праймер 5'-CTCTTGGCTCTCCTGGCATC-3' (SEQ ID NO: 3) и антисмысловой праймер 5'-GCATCCTGGACCGTCTTGGA-3' (SEQ ID NO: 4). Значение испускаемой флуоресценции прямо пропорционально количеству кДНК, присутствующей в начале реакции и амплифицированной во время PCR. Для каждой исследованной мишени делали серию растворов с помощью подходящих разведений смеси из нескольких микролитров различных растворов для обратной транскрипции. Уровень относительной экспрессии для каждой мишени определяли, таким образом, с помощью кривых эффективности, полученных с помощью точек, относящихся к серии растворов для PCR. Уровень экспрессии генов, представляющих интерес, затем нормировали относительно уровня экспрессии гена-стандарта 36 В 4 (для которого специфические праймеры представляют собой смысловой праймер 5'-CATGCTCAACATCTCCCCCTTCTCC-3' (SEQ ID NO: 7) и антисмысловой праймер 5'GGGAAGGTGTAATCCGTCTCCACAG-3' (SEQ ID NO: 8. Затем для каждого образца рассчитывали фактор индукции, т.е. соотношение между относительным сигналом (индуцируемым соединением в соответствии с изобретением) и средними относительными значениями, полученными для контрольной группы. Чем выше фактор индукции, тем сильнее соединение вызывает экспрессию генов. Конечный результат представляют в виде средних значений индукции, полученных для каждой экспериментальной группы. Результаты. Масса тела. Фиг. 2-1 сравнивает прирост массы тела животных через 8 дней после приема соединения 1, которое вводили в количестве 5, 10 и 50 мг/кг/день, с приростом массы тела контрольных животных. Неожиданно у животных, получавших соединение 1, была определена потеря массы тела. Измерение липидов плазмы крови. Фиг. 2-2 и 2-3 сравнивают уровни общего холестерина и ЛВП-холестерина в плазме крови через 8 дней после приема соединения 1, которое вводили в количестве 5, 10 и 50 мг/кг/день, с уровнями, полученными для контрольных животных. Неожиданно уровень циркулирующего общего холестерина был значительно снижен, а уровень ЛВП-холестерина был значительно повышен с помощью такой обработки. Фиг. 2-4 и 2-5 сравнивают уровни триглицеридов и свободных жирных кислот в плазме крови через 8 дней после приема соединения 1, которое вводили в количестве 5, 10 и 50 мг/кг/день, с уровнями, полученными для контрольных животных. Неожиданно уровень циркулирующих триглицеридов и свободных жирных кислот значительно снизился после такой обработки. Анализ экспрессии генов с помощью количественной RT-PCR. Заявители также показали, что in vivo соединения в соответствии с изобретением являются регуляторами экспрессии генов-мишеней для PPARs. Результаты, представленные на фиг. 2-6 и 2-7, показывают, что соединение 1, которое вводили в количестве 5, 10 и 50 мг/кг/день в течение 8 дней мышам Е 2/Е 2,индуцирует в печени значительное увеличение экспрессии гена, кодирующего PDK4 (фиг. 2-6) и снижение в печени экспрессии гена, кодирующего ApoCIII (фиг. 2-7). То, что все гены кодируют ферменты,специфически вовлеченные в метаболизм липидов и углеводов, и тот факт, что их экспрессия модулируется соединениями в соответствии с изобретением, подкрепляет идею, что эти соединения представляют собой огромный потенциал для лечения метаболических патологий. Вывод. Неожиданно представленные экспериментальные данные показывают, что соединения в соответствии с изобретением in vivo индуцируют потерю массы тела и стимулируют синтез ЛВП-холестерина, а также демонстрируют гиполипидемический эффект (снижение уровня триглицеридов и свободных жирных кислот в плазме крови). Кроме того, представленные экспериментальные данные показывают, что соединения в соответствии с изобретением модулируют экспрессию генов, регулируемых путем активации PPARs, которые кодируют ферменты, специфически вовлеченные в метаболизм липидов и углеводов. Пример 5. Оценка in vivo, проведенная на мышах C57BI6, параметров массы тела, гиполипидемических свойств и способности соединений в соответствии с изобретением стимулировать синтез ЛВПхолестерина. Принцип. Эффекты соединений в соответствии с изобретением на массу тела и их гиполипидемические свойства оценивали in vivo путем измерения массы тела и липидов в плазме крови и с помощью анализа экспрессии генов-мишеней для PPARs после обработки дислипидемических мышей C57BI6 соединениями в соответствии с изобретением. Протокол. Обработка животных. Самок мышей C57BI6 содержали при 12-часовом цикле (12 ч свет/12 ч темнота) при постоянной температуре 203C. После одной недели акклиматизационного периода мышей взвешивали и делили на группы, состоящие из 6 животных, выбираемых таким образом, чтобы обеспечить равномерное распределение по массе их тела и уровню липидов в плазме крови, которые определяли перед экспериментом. Теститруемые соединения суспендировали в карбоксиметилцеллюлозе (Sigma C4888) и вводили через желудочный зонд один раз в день в течение 14 дней при выбранной дозировке. Животные имели свободный доступ к пище и воде (стандартная диета). Прием пищи и прирост массы тела записывали в течение всего эксперимента. В конце эксперимента животных после 4 ч голодания анестезировали, брали образец крови, используя антикоагулянт (EDTA). Затем мышей взвешивали и умерщвляли с помощью эвтаназии. Плазму крови получали центрифугированием при 3000 об/мин в течение 20 мин. Образцы хранили при+4C. Извлекали образцы печени, замораживали их в жидком азоте и затем хранили при -80C для дальнейшего анализа. Измерение ЛВП-холестерина. Липопротеины низкой плотности (ЛПОНП и ЛНП) осаждали с помощью фосфовольфрамата. Осадок удаляли центрифугированием. ЛВП-холестерин, присутствующий в супернатанте, измеряли с помощью энзиматического определения (bioMrieux-Lyon-France) в соответствии с рекомендациями фирмыпроизводителя. Измерение триглицеридов плазмы крови. Концентрацию триглицеридов плазмы крови измеряли с помощью энзиматического определения(bioMrieux-Lyon-France) в соответствии с рекомендациями фирмы-производителя. Анализ экспрессии генов с помощью количественной RT-PCR. Суммарную РНК экстрагировали из фрагментов печени с помощью набора NucleoSpin 96 RNA kit(Macherey Nagel, Hoerdt, France) в соответствии с рекомендациями фирмы-производителя. Из 1 мкг суммарной РНК (количественно определенной с помощью спектрофотомета) затем получали кДНК методом обратной транскрипции с помощью 1-часовой реакции при 37C в общем объеме 20 мкл, содержавшем 1X буфер (Sigma), 1,5 мМ DTT, 0,18 мМ dNTPs (Promega), 200 нг pdN6 (Amersham),30 Ед. ингибитора RNase (Sigma) и 1 мкл MMLV-RT (Sigma). Эксперименты по количественной PCR проводили с помощью системы MyiQ Single-Color RealTime PCR Detection System (Biorad, Marnes-la-Coquette, France) и выполняли, используя набор iQ SYBRGreen Supermix kit в соответствии с рекомендациями фирмы-производителя, в 96-луночном планшете в 5 мкл разведенного раствора для обратной транскрипции при температуре гибридизации 55C. Использовали специфические пары праймеров изучаемых генов:ApoCIII: смысловой праймер 5'-CTCTTGGCTCTCCTGGCATC-3' (SEQ ID NO: 3) и антисмысловой праймер 5'-GCATCCTGGACCGTCTTGGA-3' (SEQ ID NO: 4). Значение испускаемой флуоресценции прямо пропорционально количеству кДНК, присутствующей в начале реакции и амплифицированной во время PCR. Для каждой исследованной мишени делали серию растворов с помощью подходящих разведений смеси из нескольких микролитров различных растворов для обратной транскрипции. Уровень относительной экспрессии для каждой мишени определяли, таким образом, с помощью кривых эффективности, полученных с помощью точек, относящихся к серии разведений. Уровень экспрессии генов, представляющих интерес, затем нормировали относительно уровня экспрессии гена-стандарта 36 В 4 (для которого специфические праймеры представляют собой смысловой праймер 5'CATGCTCAACATCTCCCCCTTCTCC-3' (SEQ ID NO: 7) и антисмысловой праймер 5'GGGAAGGTGTAATCCGTCTCCACAG-3' (SEQ ID NO: 8. Затем для каждого образца рассчитывали фактор индукции. Чем выше фактор индукции, тем сильнее соединение вызывает экспрессию генов. Конечный результат представляют в виде средних значений индукции, полученных для каждой экспериментальной группы. Результаты. Масса тела. Фиг. 3-1 сравнивает прирост массы тела животных через 14 дней после приема соединения 1, которое вводили в количестве 3, 10 и 30 мг/кг/день, с приростом массы тела контрольных животных. Неожиданно у животных, получавших соединение 1, была определена потеря массы тела. Измерение липидов плазмы крови. Фиг. 3-2 сравнивает уровни ЛВП-холестерина в плазме крови через 14 дней после приема соединения 1, которое вводили в количестве 3, 10 и 30 мг/кг/день, с уровнями, полученными для контрольных животных. Неожиданно уровень циркулирующего ЛВП-холестерина был значительно повышен благодаря такой обработке. Фиг. 3-3 сравнивает уровни триглицеридов в плазме крови через 14 дней после приема соединения 1, которое вводили в количестве 3, 10 и 30 мг/кг/день, с уровнями, полученными для контрольных животных. Неожиданно уровень циркулирующих триглицеридов значительно снизился благодаря такой обработке. Анализ экспрессии генов с помощью количественной RT-PCR. Заявители также показали, что in vivo соединения в соответствии с изобретением являются регуляторами экспрессии генов-мишеней для PPARs. Результаты, представленные на фиг. 3-4 и 3-5, показывают, что соединение 1, которое вводили в количестве 3, 10 и 30 мг/кг/день в течение 14 дней мышамC57BI6, индуцирует в печени значительное увеличение экспрессии генов, кодирующих PDK4 (фиг. 3-4),и снижение в печени экспрессии гена, кодирующего ApoCIII (фиг. 3-5). То, что все гены кодируют ферменты, специфически вовлеченные в метаболизм липидов и углеводов, и тот факт, что их экспрессия модулируется соединениями в соответствии с изобретением, подкрепляет идею, что эти соединения представляют собой огромный потенциал для лечения метаболических патологий. Вывод. Неожиданно представленные экспериментальные данные показывают, что соединения в соответствии с изобретением in vivo индуцируют потерю массы тела, стимулируют синтез ЛВП-холестерина, а также демонстрируют гиполипидемический эффект (снижение уровня триглицеридов в плазме крови). Кроме того, представленные экспериментальные данные показывают, что соединения в соответствии с изобретением модулируют экспрессию генов, регулируемых путем активации PPARs, которые кодируют ферменты, специфически вовлеченные в метаболизм липидов и углеводов. Пример 6. Оценка in vivo, проведенная на мышах db/db, параметров массы тела, антидиабетических свойств, гиполипидемических свойств и способности соединений в соответствии с изобретением стимулировать синтез ЛВП-холестерина. Принцип. Эффекты соединений в соответствии с изобретением на массу тела, резистентность к инсулину и гиполипидемические свойства этих соединений оценивали in vivo путем измерения массы тела и уровня глюкозы и инсулина в плазме крови, липидов в плазме крови и с помощью анализа распределения холестерина в различных фракциях липопротеинов в плазме крови, а также экспрессии генов-мишеней дляPPARs после перорального введения мышам db/db соединений в соответствии с изобретением. Протокол. Обработка животных. Самок мышей db/db содержали при 12-часовом цикле (12 ч свет/12 ч темнота) при постоянной температуре 203C. После одной недели акклиматизационного периода мышей взвешивали и делили на группы, состоящие из 8 животных, выбираемых таким образом, чтобы обеспечить равномерное распределение по их массе тела и уровню липидов в плазме крови, которые определяли перед экспериментом. Теститруемые соединения суспендировали в карбоксиметилцеллюлозе (Sigma C4888) и вводили через желудочный зонд один раз в день в течение 28 дней при выбранной дозировке. Животные имели свободный доступ к пище и воде (стандартная диета). Прием пищи и прирост массы тела записывали в течение всего эксперимента. В конце эксперимента животных анестезировали после 4 ч голодания, брали образец крови, используя антикоагулянт (EDTA), затем мышей взвешивали и умерщвляли с помощью эвтаназии. Плазму крови получали центрифугированием при 3000 об/мин в течение 20 мин. Образцы хранили при+4C. Извлекали образцы тканей печени и скелетных мышц, сразу же замораживали их в жидком азоте и затем хранили при -80C для дальнейшего анализа. Измерение гликемии и инсулинемии в плазме крови. Глюкозу в плазме крови мышей измеряют по энзиматическому колориметрическому методу с помощью набора Glucose RTU kit (Biomrieux). Глюкозу превращают в глюконовую кислоту под действием глюкозооксидазы; реакция приводит к выделению перекиси водорода. Перекись водорода измеряют в реакции Триндера, катализируемой пероксидазой, в которой в присутствии фенола и амино-4 антипирина образуется вода и окрашенный продукт хинонимин. Интенсивность окрашивания в результате образования хинонимина пропорциональна количеству глюкозы, присутствующей в образце. Инсулин у мышей измеряют с помощью метода ELISA (используя набор INSKR020 kit от фирмыCrystal chem.). Микропланшет покрывают мышиными антителами к инсулину. Затем в планшет помещают сыворотку, которую анализируют на присутствие инсулина. Чтобы обнаружить комплекс, образованный мышиным инсулином и моноклональными антителами к инсулину, применяют антитела морской свинки к инсулину. В конце добавляют антитела к иммуноглобулинам морской свинки, меченные пероксидазой, и связывают их с антителами морской свинки к инсулину. Проводят колориметрическую реакцию, добавляя субстрат фермента OPD (орто-фенилдиамин). Интенсивность окрашивания пропорциональна количеству инсулина, присутствующего в образце. Измерение липидов плазмы крови. Концентрацию липидов плазмы крови (общий холестерин и триглицериды) измеряли с помощью энзиматического анализа (bioMrieux-Lyon-France) в соответствии с рекомендациями фирмыпроизводителя. Анализ распределения холестерина во фракциях липопротеинов плазмы крови. Различные фракции липидов (ЛПОНП, ЛНП, ЛВП) в плазме крови разделяли с помощью гельфильтрации. Затем в каждой фракции измеряли концентрацию холестерина с помощью энзиматического анализа (bioMrieux-Lyon-France) в соответствии с рекомендациями фирмы-производителя. Анализ экспрессии генов с помощью количественной RT-PCR. Печеночная ткань. Суммарную РНК экстрагировали из фрагментов печени с помощью набора NucleoSpin 96 RNA kit(Macherey Nagel, Hoerdt, France) в соответствии с рекомендациями фирмы-производителя. Ткань скелетных мышц. Суммарную РНК экстрагировали из фрагментов икроножной скелетной мышцы с помощью набораRNeasy Fibrous Tissue kit (Qiagen) в соответствии с рекомендациями фирмы-производителя. Из 1 мкг суммарной РНК (количественно определенной с помощью спектрофотометрии) затем получали комплементарную ДНК методом обратной транскрипции с помощью 1-часовой реакции при 37C в общем объеме 20 мкл, содержавшем 1X буфер (Sigma), 1,5 мМ DTT, 0,18 мМ dNTPs (Promega), 200 нгpdN6 (Amersham), 30 Ед. ингибитора RNase (Sigma) и 1 мкл MMLV-RT (Sigma). Эксперименты по количественной PCR проводили с помощью системы MyiQ Single-Color RealTime PCR Detection System (Biorad, Marnes-la-Coquette, France) и выполняли, используя набор iQ SYBRGreen Supermix kit в соответствии с рекомендациями фирмы-производителя, в 96-луночном планшете в 5 мкл разведенного раствора для обратной транскрипции при температуре гибридизации 55C. Использовали специфические пары праймеров изучаемых генов:UCP2: смысловой праймер 5'-GTCGGAGATACCAGAGCACTGTCG-3' (SEQ ID NO: 5) и антисмысловой праймер 5'- CACATCAACAGGGGAGGCGA-3' (SEQ ID NO: 6). Значение испускаемой флуоресценции прямо пропорционально количеству комплементарной ДНК,присутствующей в начале реакции и амплифицированной во время PCR. Для каждой исследованной мишени делали серию растворов с помощью подходящих разведений смеси из нескольких микролитров различных растворов для обратной транскрипции. Уровень относительной экспрессии для каждой мишени определяли, таким образом, с помощью кривых эффективности, полученных с помощью точек,относящихся к серии растворов PCR. Уровень экспрессии генов, представляющих интерес, затем нормировали в печеночной ткани отно- 22018437 сительно уровня экспрессии гена-стандарта 36 В 4 (для которого специфические праймеры представляют собой смысловой праймер 5'-CATGCTCAACATCTCCCCCTTCTCC-3' (SEQ ID NO: 7) и антисмысловой праймер 5'-GGGAAGGTGTAATCCGTCTCCACAG-3' (SEQ ID NO: 8; и в скелетно-мышечной ткани относительно уровня экспрессии гена-стандарта 18S (для которого специфические праймеры представляют собой смысловой праймер 5'-CGGACACGGACAGGATTGACAG-3' (SEQ ID NO: 9) и антисмысловой праймер 5'-AATCTCGGGTGGCTGAACGC-3' (SEQ ID NO: 10. Затем для каждого образца рассчитывали фактор индукции. Чем выше фактор индукции, тем больше соединение вызывает экспрессию генов. Конечный результат представляют в виде средних значений индукции, полученных для каждой экспериментальной группы. Результаты. Масса тела. Фиг. 4-1 сравнивает прирост массы тела животных через 28 дней после приема соединения 1, которое вводили в количестве 50 мг/кг/день, с приростом массы тела контрольных животных. Неожиданно у животных, получавших соединение 1, была определена потеря массы тела. Измерение гликемии и инсулинемии. Фиг. 4-2 и 4-3 сравнивают уровни глюкозы и инсулина в плазме крови через 28 дней после обработки соединением 1, которое вводили в количестве 50 мг/кг/день. Неожиданно гликемия и инсулинемия были значительно снижены в результате такой обработки. Измерение липидов плазмы крови. Фиг. 4-4 сравнивает уровень общего холестерина в плазме крови через 28 дней после приема соединения 1 и 3, которые вводили в количестве 50 мг/кг/день, с уровнем, полученным для контрольных животных. Неожиданно уровень циркулирующего общего холестерина был значительно повышен. Фиг. 4-5 показывает, что это повышение уровня общего холестерина в плазме крови происходит из-за значительного повышения фракции ЛВП-холестерина, вызванного обработкой животных соединениями 1 и 3 в количестве 50 мг/кг/день. Фиг. 4-6 и 4-7 сравнивают уровни триглицеридов и свободных жирных кислот в плазме крови через 28 дней после приема соединений 1 и 3, которые вводили в количестве 50 мг/кг/день, с уровнями, полученными для контрольных животных. Неожиданно уровень циркулирующих триглицеридов и свободных жирных кислот значительно снизился в результате такой обработки. Анализ экспрессии генов с помощью количественной RT-PCR. Заявители также показали, что in vivo соединения в соответствии с изобретением являются регуляторами экспрессии генов-мишеней для PPARs. Результаты, представленные на фиг. 4-8 и 4-9, показывают, что соединения 1 и 3, которые вводили в количестве 50 мг/кг/день в течение 28 дней мышам db/db,вызывали значительное увеличение в печени экспрессии генов, кодирующих PDK4 (фиг. 4-8), и снижение экспрессии гена, кодирующего UCP2 (фиг. 4-9) в скелетной мышце. Все кодирующие гены ферментов специфически вовлечены в метаболизм липидов и углеводов и в рассеяние энергии, и тот факт, что их экспрессия модулируется соединениями в соответствии с изобретением, подкрепляет идею, что эти соединения представляют собой огромный потенциал для лечения метаболических патологий. Вывод. Неожиданно представленные экспериментальные данные показывают, что соединения в соответствии с изобретением in vivo индуцируют потерю массы тела и улучшение чувствительности к инсулину,стимулируют синтез ЛВП-холестерина, а также демонстрируют гиполипидемический эффект (снижение уровня триглицеридов в плазме крови). Кроме того, представленные экспериментальные данные показывают, что соединения в соответствии с изобретением модулируют экспрессию генов, регулируемых путем активации PPARs, которые кодируют ферменты, специфически вовлеченные в метаболизм липидов и углеводов и рассеяние энергии. Пример 7. Оценка in vitro противовоспалительных свойств соединений в соответствии с изобретением. Принцип. Противовоспалительные эффекты соединений в соответствии с изобретением оценивали с помощью измерения секреции МСР 1 (моноцитарный хемотаксический протеин-1) моноцитами, обработанными в течение 24 ч соединениями в соответствии с изобретением и одновременно стимулированными РМА (форбол-12-миристат-13-ацетат, который вызывает воспалительный ответ в клетках и их дифференцировку в макрофаги). Чем меньше секретируется МСР-1, тем сильнее соединение в соответствии с изобретением подавляет воспалительную реакцию. Протокол. Культура клеток ТНР-1 и их обработка. Линию клеток моноцитов человека ТНР-1 (получена из АТСС) выращивали в среде RPMI1640 с 25 мМ Hepes (Gibco; 42401-018), 1% глутамином (Gibco; 25030-24), 1% пенициллином/стрептомицином и затем инкубируют при 37C и 5% СО 2 в течение 24 ч в культуральной среде, содержащей 0,2% фетальной сыворотки теленка в присутствии 5 нг/мл форбол-12-миристат-13-ацетата (РМА) и 1 мкМ соединения 3 в соответствии с изобретением. Соединение в соответствии с изобретением растворяют в диметилсульфоксиде (DMSO, Fluka; 41640). Эффект соединений в соответствии с изобретением сравнивают с эффектом DMSO самого по себе. Измерение секреции МСР 1. Извлекают среду для обработки и измеряют концентрацию МСР 1 с помощью набора ELISA "Human MCP-1 ELISA Set" (BD OptEIA; 555179) в соответствии с рекомендациями фирмы-производителя. МСР 1 помещают в планшет и обнаруживают с помощью специфического антитела к МСР 1. Это специфическое антитело само распознается вторичным антителом, связанным с ферментом пероксидазой. Окрашивание, появляющееся в результате ферментативной активности, пропорционально связано с МСР 1 и может быть измерено спектрофотометрическим методом. Делают измерения для точки с известной концентрацией, с помощью которой рассчитывают концентрацию МСР 1 для каждого образца. Затем рассчитывали фактор индукции, т.е. соотношение между сигналом, вызываемым соединением в соответствии с изобретением, и сигналом, определяемым в контрольной группе. Чем меньше этот фактор, тем сильнее соединение подавляет секрецию МСР 1. Конечный результат представляют в виде средних значений индукции, полученных для каждой экспериментальной группы. Результаты. Заявители показали, что in vitro соединения в соответствии с изобретением оказывали противовоспалительные эффекты на моноциты. Результаты, представленные на фиг. 5, показывают, что соединение 3 в соответствии с изобретением в концентрации 1 мкМ вызывает значительное снижение секреции МСР 1 моноцитами. Вывод. Неожиданно раскрытые экспериментальные данные показывают, что соединения в соответствии с изобретением обладают противовоспалительным эффектом на моноциты, стимулированные РМА. Общие выводы Заявители показали, что соединения в соответствии с изобретением вызывают потерю массы тела,обладают гиполипидемическими свойствами, снижают уровень холестерина и триглицеридов в плазме крови, стимулируют синтез ЛВП-холестерина и обладают антидиабетическими свойствами. Кроме того,заявители показали, что соединения в соответствии с изобретением обеспечивают регулирование экспрессии генов, кодирующих ферменты, специфически вовлеченные в метаболизм липидов и углеводов и рассеяние энергии. Заявители также показали, что соединения в соответствии с изобретением обладают противовоспалительными свойствами. Эти результаты, полученные in vivo и in vitro, демонстрируют терапевтический потенциал соединений в соответствии с изобретением при лечении важнейших патологий, таких как дислипидемия, диабет 2-го типа и ожирение. Список литературы. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее общую формулу (I) в которой X1 представляет собой атом галогена, группу R1 или G1-R1; Х 4 представляет собой группу G4-R4;R1 представляет собой галогенированную алкильную группу, содержащую 1-24 атома углерода;R4 представляет собой C1-C24-алкил, замещенный одной группой COOR9;X3 и Х 5, одинаковые или различные, представляют собой незамещенный С 1-С 24-алкил;G1 и G4, одинаковые или различные, представляют собой атом кислорода или серы; А представляет собой:(i) CHOR8, где R8 является Н или алкильной группой, содержащей 1-6 углеродных атомов, замещенной или незамещенной одной арильной группой, содержащей 5-14 углеродных атомов, возможно прерываемых одним гетероатомом, выбранным из N, О, S или Р; илиR9 представляет собой атом водорода или незамещенный C1-C6-алкил. 2. Соединение по п.1, характеризующееся тем, что А представляет собой карбонильную группу(СО). 3. Соединение по п.1 или 2, характеризующееся тем, что Х 4 представляет собой G4R4, где R4 представляет собой C1-C10-алкил. 4. Соединение по пп.1-3, характеризующееся тем, что G4 представляет собой атом кислорода. 5. Соединения по любому из предыдущих пунктов, характеризующиеся тем, что Х 4 соответствует формуле -OC(CH3)2COOR9, где R9 был определен в п.1. 6. Соединения по любому из предыдущих пунктов, характеризующиеся тем, что группы X3 и X5,одинаковые или различные, представляют собой незамещенный С 1-С 4-алкил. 7. Соединения по любому из предыдущих пунктов, характеризующиеся тем, что X1 представляет собой группу R1 или G1R1, где G1 определен в п.1 и R1 представляет собой галогенированную C1-C3 алкильную группу. 8. Соединения по любому из предыдущих пунктов, характеризующиеся тем, что их выбирают из 2-[2,6-диметил-4-[3-[4-(трифторметокси)фенил]-3-оксопропил]фенокси]-2-метилпропионовой кислоты,2-[2,6-диметил-4-[3-[4-(трифторметилтио)фенил]-3-оксопропил]фенокси]-2-метилпропионовой кислоты,2-[2,6-диметил-4-[3-[4-бромфенил]-3-оксопропил]фенокси]-2-метилпропионовой кислоты,2-[2,6-диметил-4-[3-[4-(трифторметил)фенил]-3-оксопропил]фенокси]-2-метилпропионовой кислоты,2-[2,6-диметил-4-[3-гидрокси-3-[4-(трифторметилтио)фенил]пропил]фенокси]-2-метилпропионовой кислоты,2-[2,6-диметил-4-[3-(пиридин-3-илметокси)-3-[4-(трифторметокси)фенил]пропил]фенокси]-2 метилпропионовой кислоты,2-[4-(3-(4-иодбензилокси)-3-(4-(трифторметокси)фенил)пропил)-2,6-диметилфенокси]-2-метилпропионовой кислоты,2-[4-(3-метокси-3-(4-(трифторметокси)фенил)пропил)-2,6-диметилфенокси]-2-метилпропионовой кислоты,2-[2,6-диметил-4-[3-[4-(3,3,3-трифторпропилокси)фенил]-3-оксопропил]фенокси]-2-метилпропионовой кислоты,2-(2,6-диметил-4-(3-оксо-3-(4-(2,2,2-трифторэтокси)фенил)пропил)фенокси)-2-метилпропионовой кислоты,2-(2,6-диметил-4-(3-оксо-3-(4-(2,2,2-трифторэтилтио)фенил)пропил)фенокси)-2-метилпропионовой кислоты,2-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)пропионовой кислоты,2-[4-(3-гидрокси-3-(4-(трифторметокси)фенил)пропил)-2,6-диметилфенокси]-2-метилпропионовой кислоты,4-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)-2,2-диметилмасляной кислоты,2-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)-2-трет-бутилметилпропа- 25018437 ноата,2-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)-2-изопропилметилпропаноата,2,2-дифтор-2-(2,6-диметил-4-(3-оксо-3-(4-(трифторметокси)фенил)пропил)фенокси)уксусной кислоты. 9. Фармацевтическая композиция, проявляющая свойства агониста PPAR, включающая в фармацевтически приемлемом наполнителе по меньшей мере одно из соединений по пп.1-8. 10. Фармацевтическая композиция по п.9 для лечения осложнений, связанных с метаболическим синдромом, резистентности к инсулину, диабета, дислипидемии, атеросклероза, сердечно-сосудистых заболеваний, ожирения, гипертонии, воспалительных заболеваний, нейродегенеративных патологий или рака. 11. Фармацевтическая композиция по п.9 для лечения дислипидемии. 12. Фармацевтическая композиция по п.9 для лечения факторов риска развития сердечнососудистых заболеваний, относящихся к дисрегуляции метаболизма липидов и/или углеводов.
МПК / Метки
МПК: C07D 213/30, C07C 69/736, C07C 323/22, A61K 31/192, C07C 251/48, C07C 59/84, C07C 323/62, C07C 59/90, A61P 3/10, C07C 59/88, C07C 59/68, A61P 3/06, A61P 3/04
Метки: получение, 1,3-дифенилпропана, замещенные, производные, применение
Код ссылки
<a href="https://eas.patents.su/30-18437-zameshhennye-proizvodnye-13-difenilpropana-poluchenie-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные 1,3-дифенилпропана, получение и их применение</a>
Предыдущий патент: Беспроводное передающее устройство
Следующий патент: Добавка к культуральной среде для производства вируса
Случайный патент: Способ получения 2-[4-(4-фтор-2-метил-1h-индол-5-илокси)-5-метилпирроло[2,1-f][1,2,4]триазин-6-илокси]-1-метилэтилового эфира [(1r),2s]-2-аминопропионовой кислоты












