Гетероциклические производные
Номер патента: 18521
Опубликовано: 30.08.2013
Авторы: Им Дзунг Хван, Ахн Сунг Ох, Ко Кванг Сеок, Хан Сун Янг, Ли Соон Ок, Ли Вон Ил, Чо Сеонг Воок, Парк Чан Хее, Ли Киоунг Дзун
Формула / Реферат
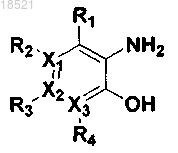
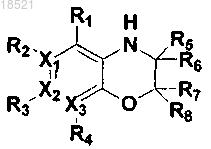
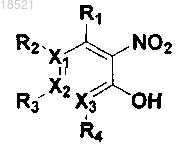
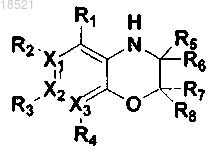
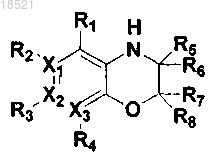
1. Соединение, представляющее собой гетероциклическое производное формулы I
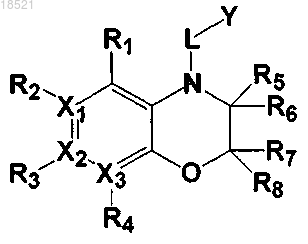
(I)
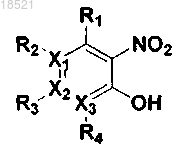
где каждый из X1, X2 и Х3 независимо представляет собой углерод или азот при условии, что по меньшей мере один из X1, X2 и Х3 представляет собой азот,
R1, R2, R3 и R4 могут быть одинаковыми или отличными друг от друга и независимо выбраны из группы, включающей водород; гидрокси; C1-C6 алкил; C1-C6 галогеналкил; C1-C6 алкокси; C1-C6 галогеналкокси; галоген; фенил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из C1-C6 галогеналкокси, C1-C6 галогеналкила, ди(С1-С6)алкиламино, нитро, галогена, циано и C1-C6 алканоила; циано; нитро; амино; C1-C6 алкиламид; C3-C12 моно- или бициклоалкил; С6-C12 арил; насыщенный или ненасыщенный C3-C12 моно- или поликарбоциклил; и насыщенный или ненасыщенный 3-12-членный моно- или полигетероциклил, содержащий от 1 до 3 гетероатомов, выбранных из N, О и S, необязательно замещенный оксо или C1-C6 алкокси,
при условии, что когда X1 представляет собой азот, R2 отсутствует; когда Х2 представляет собой азот, R3 отсутствует; и когда Х3 представляет собой азот, R4 отсутствует, или каждая из пар R1-R2, R2-R3 и R3-R4 может быть независимо конденсирована с образованием насыщенного или ненасыщенного 5-11-членного карбоцикла или гетероцикла,
R5, R6, R7 и R8 могут быть одинаковыми или отличными друг от друга и независимо выбраны из группы, включающей водород; гидрокси; C1-C6 алкил; С1-С6 алкокси; галоген; фенил; циано; нитро; и амино; или R5 и R6 вместе с атомом углерода, с которым они связаны, могут образовывать карбонильную группу (С=O), или R7 и R8 вместе с атомом углерода, с которым они связаны, могут образовывать карбонильную группу (С=O),
L может образовывать карбонильную группу (-С(=O)-), сульфонильную группу (-S(=O)2-), C1-C6 алкилкарбонил, карбонил C1-C6 алкил или тиоксогруппу (-С(=S)-), и
Y выбран из группы, включающей насыщенный или ненасыщенный С3-С12 моно- или поликарбоциклил, замещенный R9 R10 и R11; и насыщенный или ненасыщенный 3-12-членный моно- или полигетероциклил, содержащий от 1 до 3 гетероатомов, выбранных из N, О и S, и замещенный R9, R10 и R11,
где каждый из R9, R10 и R11 независимо выбран из группы, включающей водород; гидрокси; C1-C6 алкил; C1-C6 галогеналкил; C1-С6 алкокси; C1-C6 галогеналкокси; галоген; фенил; циано; нитро; амино; группу карбоновой кислоты и С3-С8 сложный эфир-окси,
при условии, что когда Y представляет собой фенил, i) по меньшей мере один из R9, R10 и R11 представляет собой гидрокси, или ii) все из R9, R10 и R11 являются отличными от водорода, если ни один из R9, R10 и R11 не является гидрокси, и когда Y представляет собой пиридинил, по меньшей мере один из R9, R10 и R11 является отличным от водорода,
или его рацемат, изомер или фармацевтически приемлемая соль.
2. Соединение по п.1, где
каждый из X1, X2 и Х3 независимо представляет собой углерод или азот, при условии, что по меньшей мере один из Х1, Х2 и Х3 представляет собой азот,
R1 и R4 независимо представляют собой водород или галоген;
R2 и R3 могут быть одинаковыми или отличными друг от друга и независимо выбраны из группы, включающей водород; C1-C6 алкил; C1-C6 галогеналкил; галоген; фенил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из C1-C6 галогеналкокси, C1-C6 галогеналкила, ди(С1-С6)алкиламино, нитро, галогена, циано и C1-С6 алканоила; циано; С3-С12 циклоалкил; насыщенный или ненасыщенный 5- или 6-членный моногетероциклил, содержащий 1 гетероатом, выбранный из N и О, необязательно замещенный оксо или C1-C6 алкокси; изохинолил и индолил;
при условии, что когда X1 представляет собой азот, R2 отсутствует; когда Х2 представляет собой азот, R3 отсутствует; и когда Х3 представляет собой азот, R4 отсутствует, или пара R3-R4 может быть независимо конденсирована с образованием ненасыщенного 6-членного карбоцикла,
R5, R6, R7 и R8 могут быть одинаковыми или отличными друг от друга и независимо выбраны из группы, включающей водород и C1-С6 алкил; или R5 и R6 вместе с атомом углерода, с которым они связаны, могут образовывать карбонильную группу (С=О),
L может образовывать карбонильную группу (-С(=O)-), сульфонильную группу (-S(=O)2-), C1-C6 алкилкарбонил, карбонил C1-C6 алкил или тиоксогруппу(-С(=S)-), и
Y выбран из группы, включающей фенил, замещенный R9, R10 и R11; и ненасыщенный 5- или 6-членный моногетероциклил, содержащий от 1 до 2 гетероатомов, выбранных из N и О, и замещенный R9, R10 и R11,
где каждый из R9, R10 и R11 независимо выбран из группы, включающей водород; гидрокси; C1-C6 галогеналкил; C1-C6 алкокси; галоген; нитро; группу карбоновой кислоты и С3-С8 сложный эфир-окси,
при условии, что когда Y представляет собой фенил, i) по меньшей мере один из R9, R10 и R11 представляет собой гидрокси, или ii) все из R9, R10 и R11 являются отличными от водорода, если ни один из R9, R10 и R11 не является гидрокси, и когда Y представляет собой пиридинил, по меньшей мере один из R9, R10 и R11 является отличным от водорода,
или его рацемат, изомер или фармацевтически приемлемая соль.
3. Соединение по п.1, где L представляет собой карбонильную группу (-С(=O)-), сульфонильную группу
(-S(=O)2-) или тиоксогруппу (-C(=S)-), или его рацемат, изомер или фармацевтически приемлемая соль.
4. Соединение по п.1, где пара R3-R4 конденсирована с образованием ненасыщенного 6-членного карбоцикла, или его рацемат, изомер или фармацевтически приемлемая соль.
5. Соединение по п.2, где насыщенный или ненасыщенный 5-6-членный моногетероциклил представляет собой пиридинил, фуранил, пирролил или изоксазолил, или его рацемат, изомер или фармацевтически приемлемая соль.
6. Соединение по п.1, где Х2 представляет собой углерод и каждый из X1 и Х3 независимо представляет собой углерод или азот при условии, что по меньшей мере один из Х1 и Х3 представляет собой азот, или его рацемат, изомер или фармацевтически приемлемая соль.
7. Соединение по п.1, которое выбрано из группы, включающей
(3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)метанон (соединение 1);
(3,5-дибром-4-метоксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон (соединение 2);
(3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон, соль бромисто-водородной кислоты (соединение 3);
(3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон (соединение 4);
(3,5-дибром-4-метоксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон (соединение 5);
(3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон (соединение 6);
(3,5-дибром-4-гидроксифенил)-(6-метил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)метанон (соединение 7);
(3,5-дибром-4-гидроксифенил)-(2,2-диметил-2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон (соединение 8);
(3,5-дибром-4-гидроксифенил)-(7-циклопропил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)метанон (соединение 9);
(3-хлор-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон, соль бромисто-водородной кислоты (соединение 10);
(3-бром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон, соль бромисто-водородной кислоты (соединение 11);
(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)-(4-гидрокси-3-трифторметилфенил)метанон (соединение 12);
(3,5-дихлор-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон, соль бромисто-водородной кислоты (соединение 13);
(3-хлор-4-гидрокси-5-нитрофенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон (соединение 14);
(3,5-дихлор-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон, соль бромисто-водородной кислоты (соединение 15);
(3-бром-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон, соль бромисто-водородной кислоты (соединение 16);
(3-хлор-4-гидрокси-5-нитрофенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон, соль бромисто-водородной кислоты (соединение 17);
(3-хлор-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон, соль бромисто-водородной кислоты (соединение 18);
(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)-(4-гидрокси-3-трифторметилфенил)метанон (соединение 19);
(3,5-дибром-4-гидроксифенил)-(7-фенил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)метанон (соединение 20);
2,6-дихлор-4-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-сульфонил)фенол (соединение 21);
(3,5-дибром-4-метоксифенил)-(7-трифторметил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)метанон (соединение 22-1);
(3,5-дибром-4-гидроксифенил)-(7-трифторметил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)метанон (соединение 22-2);
2,5-дибром-4-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-карбонил)бензойная кислота (соединение 23);
метиловый эфир [2,6-дибром-4-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-карбонил)фенокси]уксусной кислоты (соединение 24);
(7-бром-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)-(3,5-дибром-4-гидроксифенил)метанон (соединение 25);
(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)-(3-фтор-4-гидроксифенил)метанон (соединение 26);
(3,5-дибром-4-метоксифенил)-(7-метил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)метанон (соединение 27-1);
(3,5-дибром-4-гидроксифенил)-(7-метил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)метанон (соединение 27-2);
(3,5-дифтор-4-метоксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон (соединение 28);
(3,5-дифтор-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон (соединение 29);
(5-хлор-2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)-(3,5-дибром-4-гидроксифенил)метанон (соединение 30);
(2,6-дихлоропиридин-4-ил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон (соединение 31);
(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)-(6-гидроксипиридин-3-ил)метанон (соединение 32);
(3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон, соль хлористо-водородной кислоты (соединение 33);
(3-хлор-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон (соединение 34);
4-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-сульфонил)фенол (соединение 35-1);
2,6-дибром-4-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-сульфонил)фенол (соединение 35-2);
(3-хлор-4-гидрокси-5-нитрофенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон (соединение 36);
(3-хлор-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон (соединение 37);
(3-бром-4-гидроксифенил)- (2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон (соединение 38);
(3,5-дихлор-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон (соединение 39);
(3-бром-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон (соединение 40);
(3,5-дихлор-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон (соединение 41);
2-(3,5-дибром-4-гидроксифенил)-1-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)этанон (соединение 42);
(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)-(3-метоксиизоксазол-5-ил)метанон (соединение 43);
(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)-(3-гидроксиизоксазол-5-ил)метанон (соединение 44);
(3,5-дибром-4-гидроксифенил)-[7-(4-трифторметилфенил)-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил]метанон (соединение 45);
(3,5-дибром-4-гидроксифенил)-[7-(2-трифторметилфенил)-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил]метанон (соединение 46);
1-(3,5-дибром-4-метоксибензоил)-2,3-дигидро-1Н-пиридо[2,3-b][1,4]оксазин-7-карбонитрил (соединение 47-1);
1-(3,5-дибром-4-гидроксибензоил)-2,3-дигидро-1Н-пиридо[2,3-b][1,4]оксазин-7-карбонитрил (соединение 47-2);
1-(3,5-дибром-4-метоксифенил)-[7-(3-нитро-фенил)-2,3-дигидропиридо[2,3-b][1,4]оксазин-ил]метанон (соединение 48);
(3,5-дибром-4-метоксифенил)-[7-(3-нитро-фенил)-2,3-дигидропиридо[2,3-b][1,4]оксазин-ил]метанон (соединение 49);
(3,5-дибром-4-гидроксифенил)-[7-(3-диметиламинофенил)-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил]метанон (соединение 50);
(3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метантион (соединение 51);
(3,5-дибром-4-гидроксифенил)-[7-пиридин-3-ил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил]метанон (соединение 52);
(3,5-дибром-4-гидроксифенил)-[7-фуран-3-ил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил]метанон (соединение 53);
1-(3,5-дибром-4-гидроксифенил)-2-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)этанон (соединение 54);
(3,5-дибром-4-гидроксифенил)-(2,3-дигидро-4-окса-1,9-диазафенантрен-1-ил)метанон (соединение 55);
4-[2-(3,5-дибром-4-гидроксифенил)-2-оксоэтил]-4Н-пиридо[4,3-b][1,4]оксазин-3-он (соединение 56);
4-(3,5-дибром-4-метоксибензоил)-4Н-пиридо[4,3-b][1,4]оксазин-3-он (соединение 57);
(3,5-дибром-4-метоксифенил)-(6-метил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)метанон (соединение 58);
(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)-(2,4-дигидроксипиримидин-5-ил)метанон (соединение 59);
(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)-(2,6-дигидроксипиримидин-4-ил)метанон (соединение 60);
(3,5-дибром-4-гидроксифенил)-(7-изохинолин-4-ил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)метанон (соединение 61);
(3,5-дибром-4-гидроксифенил)-(6,7-дигидропиримидо[4,5-b][1,4]оксазин-5-ил)метанон (соединение 62);
(3,5-дибром-4-гидроксифенил)-[7-(3-трифторметилфенил)-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил]метанон (соединение 63);
(3,5-дибром-4-гидроксифенил)-[7-(3-фторметилфенил)-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил]метанон (соединение 64);
4-[1-(3,5-дибром-4-гидроксибензоил)-2,3-дигидро-1Н-пиридо[2,3-b][1,4]оксазин-7-ил]бензонитрил (соединение 65);
(3,5-дибром-4-гидроксифенил)-[7-(4-трифторметоксифенил)-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил]метанон (соединение 66);
1-{4-[1-(3,5-дибром-4-гидроксибензоил)-2,3-дигидро-1Н-пиридо[2,3-b][1,4]оксазин-7-ил]фенил}этанон (соединение 67);
(3,5-дибром-4-гидроксифенил)-[7-(5-метоксипиридин-3-ил)-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил]метанон (соединение 68);
(4-гидрокси-3-трифторметилфенил)-(7-метил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)метанон (соединение 69);
(3,5-дибром-4-гидроксифенил)-[7-(1Н-индол-4-ил)-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил]метанон (соединение 70);
(3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон, соль серной кислоты (соединение 71);
2,6-дибром-4-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-карбонил)фенолят, натриевая соль (соединение 72);
2,6-дибром-4-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-карбонил)фенолят, калиевая соль (соединение 73);
(3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метантион, соль трифторуксусной кислоты (соединение 74) и
1-[1-(3,5-дибром-4-гидроксибензоил)-2,3-дигидро-1Н-пиридо[2,3-b][1,4]оксазин-7-ил]пирролидин-2-он (соединение 75),
или его рацемат, изомер или фармацевтически приемлемая соль.
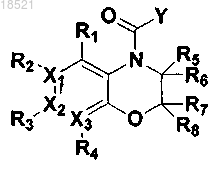
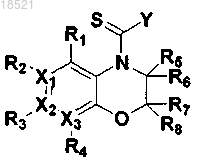
8. Способ получения соединения формулы II или его рацемата, изомера или фармацевтически приемлемой соли, включающий следующие стадии:
а) восстановление соединения формулы VII с получением соединения формулы VI,
b) циклизация полученного соединения формулы VI с соединением формулы V с получением соединения формулы IV и
с) образование пептидной связи полученного соединения формулы IV с соединением формулы III с получением соединения формулы II
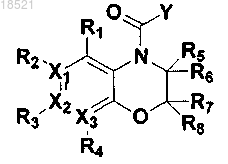
(II)

(III)
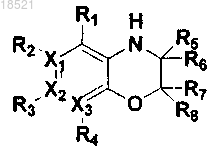
(IV)
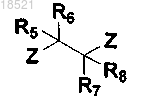
(V)
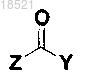
(VI)
(VII)
где в формулах II-VII
X1, Х2, Х3, R1, R2, R3, R4, R5, R6, R7, R8 и Y имеют значения, определенные в п.1 и
Z представляет собой реакционноспособную удаляемую группу.
9. Способ получения соединения формулы II или его рацемата, изомера или фармацевтически приемлемой соли, включающий следующие стадии:
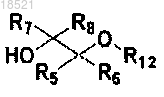
a) галогенирование соединения формулы VII с получением соединения формулы X и затем взаимодействие полученного соединения формулы X с соединением формулы IX с получением соединения формулы VIII, или осуществление реакции Мицунобу соединения формулы VII и соединения формулы IX с получением соединения формулы VIII,
b) циклизация полученного соединения формулы VIII с получением соединения формулы IV и
c) образование пептидной связи полученного соединения формулы IV с соединением формулы III с получением соединения формулы II
(II)
(III)
(IV)
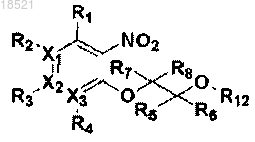
(VIII)
(IX)
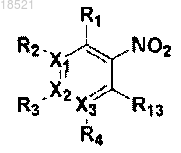
(X)
(VII)
где в формулах II-X
X1, Х2, Х3, R1, R2, R3, R4, R5, R6, R7, R8 и Y имеют значение, определенное в п.1;
R12 представляет собой неводородный заместитель и
R13 представляет собой удаляемую группу.
10. Способ получения соединения формулы XI или его рацемата, изомера или фармацевтически приемлемой соли, включающий стадию взаимодействия соединения формулы II с реагентом Лоуссона
(XI)
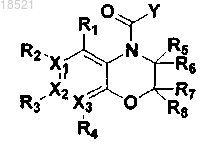
(II)
где в формулах II и XI
X1, Х2, Х3, R1, R2, R3, R4, R5, R6, R7, R8 и Y имеют значение, определенное в п.1.
11. Способ получения соединения формулы XII или его рацемата, изомера или фармацевтически приемлемой соли, включающий стадию образования амидной связи соединения формулы IV с соединением формулы XIII в присутствии основания
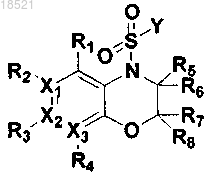
(XII)
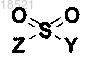
(XIII)
(IV)
где в формулах IV, XII и XIII
X1, Х2, Х3, R1, R2, R3, R4, R5, R6, R7, R8 и Y имеют значение, определенное в п.1; и
Z представляет собой удаляемую группу.
12. Способ получения соединения XIV формулы или его рацемата, изомера или фармацевтически приемлемой соли, включающий стадию алкилирования соединения формулы IV при помощи соединения формулы XV в присутствии основания
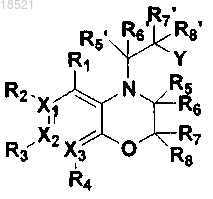
(XIV)
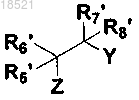
(XV)
(IV)
где в формулах IV-XV,
X1, Х2, Х3, R1, R2, R3, R4, R5, R6, R7, R8 и Y имеют значение, определенное в п.1;
Z представляет собой удаляемую группу и
каждый из R5', R6', R7' и R8' могут быть одинаковыми или отличными друг от друга и независимо выбраны из группы, включающей водород; гидрокси; C1-C6 алкил; C1-C6 галогеналкил; C1-C6 алкокси; C1-C6 галогеналкокси; С2-С7 алканоил; галоген; фенил; циано; нитро; амино; и группу карбоновой кислоты; или R5' и R6' вместе с атомом углерода, с которым они связаны, могут образовывать карбонильную группу (С=O) или тиоксогруппу (C=S), или R7' и R8' вместе с атомом углерода, с которым они связаны, могут образовывать карбонильную группу (С=O) или тиоксогруппу (C=S).
13. Фармацевтическая композиция, обладающая ингибирующей активностью по отношению к человеческому транспортеру уратного аниона 1 (hURAT1), включающая эффективное количество соединения по любому из пп.1-7 или его рацемата, изомера или фармацевтически приемлемой соли в качестве активного ингредиента и фармацевтически приемлемый носитель.
14. Фармацевтическая композиция по п.13, которая предназначена для лечения или профилактики гиперурикемии, подагрического заболевания, нефрита, хронической почечной недостаточности, почечно-каменной болезни, уремии, мочекаменной болезни или заболевания, связанного с мочевой кислотой.
15. Фармацевтическая композиция по п.14, где подагрическое заболевание представляет собой острый подагрический артрит, хронический подагрический артрит, подагрический узел или подагрический нефроз.
16. Фармацевтическая композиция по п.14, где заболевание, связанное с мочевой кислотой, представляет собой гиперлипидемию, ишемическую болезнь сердца, инфаркт миокарда, церебральный инфаркт, сердечно-сосудистое заболевание, диабет или гипертензию.
17. Фармацевтическая композиция по п.13, которая составлена для перорального введения.
Текст
Изобретение относится к гетероциклическим производным и более конкретно к новым гетероциклическим производным, полезным для получения лекарственных средств для лечения заболевания, связанного с мочевой кислотой. Ахн Сунг Ох, Парк Чан Хее, Им Дзунг Хван, Ли Соон Ок, Ли Киоунг Дзун,Чо Сеонг Воок, Ко Кванг Сеок, Хан Сун Янг, Ли Вон Ил (KR) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: СИ ЭНД СИ РИСЕРЧ ЛЭБОРЕТЕРИЗ (KR) Изобретение относится к новым гетероциклическим производным, полезным для получения лекарственных средств для лечения заболеваний, связанных с мочевой кислотой. Более конкретно, эти новые гетероциклические производные являются полезными для получения лекарственных средств для лечения заболеваний, которые входят в область заболеваний, которые лечат с использованием средства, способствующего выведению из организма мочевой кислоты, где мишенью является человеческий транспортер уратных анионов 1 (hURAT1). Эти лекарственные средства являются полезными для лечения таких заболеваний, как сердечно-сосудистые заболевания и метаболический синдром, связанных с мочевой кислотой, в частности, таких как гиперурикемия, острый подагрический артрит, хронический подагрический артрит, подагрический узел, подагрический нефроз, нефрит, хроническая почечная недостаточность, почечно-каменная болезнь, уремия, мочекаменная болезнь, гиперлипидемия, ишемическая болезнь сердца,инфаркт миокарда, церебральный инфаркт, сердечно-сосудистое заболевание, диабет или гипертензия. Предпосылки изобретения Мочевая кислота является конечным продуктом окисления метаболизма пурина и, в основном, экскретируется с мочой. Сообщалось о том, что она обладает противоокислительной активностью, а также функцией защиты нервных клеток [Ames, В. N. et al. Proc. Natl. Acad. Sci. USA, 78, 6858-6862 (1981);(1998)]. Источники пурина, образуемые из нуклеотидов, существующих в клетках живого организма, и чрезмерная не содержащая пуринов диета сходятся в одной точке на общем промежуточном продукте ксантине в результате процедуры биосинтеза in vivo, и мочевая кислота в конечном счете образуется в результате ферментативной реакции с ксантиноксидазой, ключевым ферментом при захвате пуринов из пути к мочевой кислоте, в печени [F. Borges et al. Current Medi. Chem., 9, p. 195-217 (2002)]. Суточный уровень мочевой кислоты, образуемой в организме, составляет приблизительно 700 мг. Из этого общего количества, 60-70% (500 мг/день) экскретируется через почки, а остальное количество (200 мг/день) экскретируется через тонкий кишечник [Japan Clinic History, Japan Clinic Hyperuricemia Hypouricemia, p. 161, 166 (2003)]. Гиперурикемия представляет собой аномально высокий уровень мочевой кислоты в крови. Для человека это определено как состояние, когда концентрация мочевой кислоты в сыворотке выше нормы(7-8 мг/дл для мужчин, 6 мг/дл для женщин). Это связано с недостаточной экскрецией мочевой кислоты в почках или чрезмерной продукцией мочевой кислоты в печени. Подагрический пациент имеет заметно повышенный уровень мочевой кислоты в крови по сравнению с нормой (7-8 мг/дл для мужчин, 6 мг/дл для женщин). Подагру часто связывают с гиперурикемией. Подагра представляет собой тип воспалительного артрита, который инициируется кристаллизацией мочевой кислоты в суставах - большей частью периферических, таких как суставы пальцев ног и рук. Острая подагра типично является перемежающейся и является одним из самых болезненных состояний, испытываемых человеком. Хроническая подагра обычно развивается через несколько лет острой перемежающейся подагры. Игольчатые мононатрийуратные (MSU) кристаллы могут отлагаться на соединительных мягких тканях, таких как суставный хрящ в суставах, сухожилиях и связках. Эти кристаллы колют мышцы или хондроциты вокруг сустава и затем приводят к воспалительному артриту, который вызывает набухание, покраснение, жжение, боль и затрудненную подвижность в суставах. Уратные кристаллы способны непосредственно инициировать,усиливать и поддерживать сильный воспалительный приступ из-за их способности стимулировать высвобождение воспалительных медиаторов. Уратные кристаллы отлагаются в основном в метатарсофалангеальном суставе большого пальца стопы, и редко в поясничном отделе позвоночника [Vervaeck M.,et al., Clinical Neurology and Neurosurgery, 93, p233-236 (1991)]. Подагра является очень опасным фактором, поскольку она может вызывать осложнение различных метаболических заболеваний, таких как диабет, гипертензия, сердечное заболевание, ожирение, почечнокаменная болезнь, мочекаменная болезнь или подобные. Пик случаев подагры наблюдают преимущественно у мужчин в возрасте от 40 до 50 лет, а у женщин это чаще встречается в постклимактерическом периоде. Также часты случаи этого заболевания у людей, страдающих ожирением и испытывающих чрезмерные физические нагрузки. Приступы подагры тесно связывают с пациентами, которые в течение многих лет страдали гиперурикемией. Сообщалось о том, что развитие приступов подагры составляет 4,9%, когда уровень мочевой кислоты в организме составляет 9 мг/дл или выше, 0,5%, когда уровень мочевой кислоты в организме составляет 7,0-8,9 мг/дл, и 0,1%, когда уровень мочевой кислоты в организме составляет 7,0 мг/дл или ниже, и общий показатель развития приступов подагры за 5 лет составляет около 22% у пациентов,имеющих уровень мочевой кислоты в организме 9 мг/дл или выше [Campion E. W. et al., Am. J. Med., 82,p. 421-426 (1987)]. Как указано выше, количество урата в организме зависит от баланса между пищевым потреблением, синтезом и скоростью экскреции. Для пациентов, имеющих высокий уровень мочевой кислоты в крови, патогенез гиперурикемии и подагры является результатом недостаточной экскреции урата (90%),чрезмерной продукции урата (10%) или часто сочетания этих двух факторов [Choi et al., Ann. Intern. Med.p. 499-516 (2005)]. Учитывая такие причины гиперурикемии и подагры, разработка средства, способст-1 018521 вующего выведению из организма мочевой кислоты, является более эффективной для лечения гиперурикемии/подагры по сравнению с теми, которые подавляют продукцию мочевой кислоты. Уровень урата в плазме человека выше, чем у большинства других млекопитающих. Человек является единственным млекопитающим, у которого известно, что подагра развивается спонтанно. Это является результатом эволюционного процесса, у человека и обезьяны потерян ген уриказы в печени, который известен как фермент для расщепления мочевой кислоты (фермент Уриказа; катализирующий преобразование мочевой кислоты в более растворимое соединение аллантоин) [Fields, M. et al., Free Radical Biol. Med., 20, p. 595 (1996); Haliwell, B. Uric acid: an example of antioxidant evaluation, E. Cadenas and L. Packer Editors,Handbook of Antioxidants, Marcel Dekker New York (1996)], и они приобрели систему повторного поглощения мочевой кислоты в почках, при помощи которой большая часть отфильтрованного урата из клубочков обратно абсорбируется через почечные канальцы. Недавно в литературе был описан ген (SLC22A12), кодирующий человеческий транспортер уратного аниона 1 (hURAT1), анионообменный мембранный транспортер, специфически ответственный за функцию реабсорбции отфильтрованного урата в почке. Этот транспортер (hURAT1) относится к семейству транспортеров органических анионов (OATs), и были сообщения о том, что транспортеры уратных анионов существуют в проксимальном почечном канальце, как было определено при помощи иммунохимических экспериментов, и играют важную роль в повторном поглощении урата, как было определено при помощи экспериментов по абсорбции с использованием пленчатого пузырька со щеточной каемкой(BBMV) почки человека. Поэтому человеческий транспортер уратного аниона 1 (hURAT1), как было подтверждено, является полезной мишеневой молекулой для разработки средств для лечения заболеваний, связанных с мочевой кислотой, таких как гиперурикемия и подагра [Enomoto A. et al., Nature, 417, р. 447-452 (2002)]. Что касается физико-химических свойств, мочевая кислота имеет кислотность (pKa) 5,75 и существует в кислотной форме (мочевая кислота) или в форме аниона (урат), в зависимости от рН. Таким образом, ожидается, что белковая структура человеческого транспортера уратного аниона 1 (hURAT1),имеющего функциональную схожесть, будет иметь схожие структурные характеристики с белками, принадлежащими к семейству транспортеров органических анионов (OATs). Действительно, были сообщения о том, что аминокислотная последовательность ОАТ 4 (SLC22A12) из семейства транспортеров органических анионов (OATs), транспортирующих анион, присутствующий в апикальной мембране проксимального канальца, имеет 42% гомологию с последовательностью белка человеческого транспортера уратного аниона 1 (hURAT1) [Enomoto A. et al., Nature, 417, p. 447-452 (2002)]. К настоящему времени идентифицировано шесть (6) транспортеров в живом организме (ОАТ 1-4 иURAT1, и ОАТ 5 у грызунов), которые вовлечены в абсорбцию и экскрецию анионных веществ в почке,образованных из различных эндогенных веществ, ксенобиотиков и лекарственных средств. Их основные субстраты-мишени являются самыми разнообразными и отличными друг от друга. Однако в качестве основного субстрата для человеческого транспортера уратного аниона 1 (hURAT1) известна только мочевая кислота [Nahohiko Anzai, et al., J phamacol. Sci., 100, p. 411-426 (2006)]. В качестве средств для лечения или профилактики гиперурикемии и подагры в настоящее время используют бензбромарон, который представляет собой средство, способствующее выведению из организма мочевой кислоты, которое обладает активностью ингибирования hURATl-опосредованного повторной абсорбции урата, а также пробенецид и сульфинпиразон. Однако эти лекарственные средства не обладают достаточной активностью в отношении URAT1. В частности, бензбромарон имеет некоторые недостатки, касающиеся его побочных эффектов. Бензбромарон демонстрирует сильную способность ингибирования 2 С 9 белка среди белков цитохрома Р 450 (CYP450) и, таким образом, имеет возможность межлекарственного взаимодействия. Также сообщалось об образовании реакционноспособного метаболита, полученного в экспериментах по образованию глутатионового (GSH) конъюгата [Dermot F. McGinnity et al., Drug Metabolism and Disposition, 33, p. 700-1707 (2005)]. Кроме того, поскольку бензбромарон имеет бензофурановый скелет, подобный структурам лекарственных средств бенздиодарона, бензарона и амиодарона, которые согласно сообщениям являются лекарственными средствами, демонстрирующими гипертоксичность, с ним связаны такие проблемы, как смерть в результате индукции гепатотоксичности,а также такие побочные эффекты, как поражение печени. Поэтому следует проверять функцию печени у пациентов, которым предполагают принимать это лекарственное средство, перед его введением, и даже в процессе введения, в терапии рекомендуется осуществлять контроль в течение определенного периода(шесть месяцев), происходит ли индукция гепатотоксичности или нет. В силу этой причины, все еще остается неудовлетворенная потребность в лекарственном средстве для лечения заболеваний, связанных с мочевой кислотой, таких как гиперурикемия и подагра [Hautekeete M. L., et al., Liver, 15, р. 25-29 (1995);magazine, 30, 187-194 (2003); Priska Kaufmann, et al., HEPATOLOGY, 41, p925-935 (2005)]. Фармакокинетические данные бензбромарона следующие: что касается концентрации в крови, когда 2 таблетки (50 мг/таблетка) вводят одновременно здоровому и голодающему взрослому, время максимальной концентрации лекарственного средства в крови (Tmax) для немодифицированного бензбромарона составляет 2,71,0 ч, период полужизни лекарственного средства составляет 5,41,9 ч, площадь под кривой (AUC) составляет 15,93,3 мкгч/мл, и максимальная концентрация лекарственного средства(Cmax) составляет 2,30,8 мкг/мл. В случае 6-гидроксибензбромарона, который является метаболитом бензбромарона, время максимальной концентрации лекарственного средства в крови (Tmax) составляет 4,8 1,3 ч, период полужизни лекарственного средства составляет 18,0 2,9 ч, площадь под кривой (AUC) составляет 39,9 4,4 мкгч/мл, и максимальная концентрация лекарственного средства (Cmax) составляет 1,7 0,4 мкг/мл. Что касается части и количества экскреции лекарственного средства, скорость экскреции 6-гидроксибензбромарона в моче составляла 1,2% от введенного количества вплоть до 72 часов после введения. Однако бензбромарон вообще не был обнаружен в моче [Urinome international interview (2005);Oikawa Tosihiro et al., New drug and Clinic, 53, p. 682 (2004)]. Недавно в Японии был опубликован и зарегистрирован один патент на соединения, которые ингибируют человеческий транспортер уратного аниона 1 (hURAT1), в качестве средства, способствующего выведению из организма мочевой кислоты, и которые обладают слабым эффектом ингибирования цитохрома Р 450 2 С 9 (CYP2C9) [Japan Tobacco, WO 2006/057460 и JP3988832 В 2]. Раскрытие изобретения Техническая задача Изобретение направлено на решение проблем предшествующего уровня техники, изложенных выше. Таким образом, задачей настоящего изобретения является обеспечение новых соединений, являющихся гетероциклическими производными, которые обладают терапевтической активностью при гиперурикемии, которые демонстрируют сильную активность ингибирования человеческого транспортера уратного аниона 1 (hURAT1), не демонстрируют никакого межлекарственного взаимодействия в отношении цитохрома Р 450 (CYP450), в частности CYP2C9, и обладают селективным действием в отношении транспортеров органических анионов, и их можно вводить при более низких дозах и при длительном лечении, поскольку они обладают более высокой растворимостью и метаболической стабильностью, демонстрируя выгодные фармакокинетические свойства, по сравнению с традиционным ингибиторомhURAT1 активности; и фармацевтической композиции, включающей такие соединения. Поскольку новые соединения, представляющие собой гетероциклические производные в соответствии с настоящим изобретением, и фармацевтические композиции, включающие такие соединения, демонстрируют сильную активность ингибирования человеческого транспортера уратного аниона 1 (hURAT1), они контролируют повторное поглощение мочевой кислоты и, таким образом, являются полезными для лечения или профилактики гиперурикемии, острого подагрического артрита, хронического подагрического артрита,подагрического узла, подагрического нефроза, нефрита, хронической почечной недостаточности, почечнокаменной болезни, уремии, мочекаменной болезни и осложнений, которые, как было указано, сопровождают повышение уровня мочевой кислоты в крови, таких как гиперлипидемия, ишемическая болезнь сердца, инфаркт миокарда, артериосклероз, церебральный инфаркт, сердечно-сосудистое заболевание,диабет и гипертензия. Техническое решение В соответствии с настоящим изобретением обеспечивается соединение, представляющее собой гетероциклическое производное, имеющее структуру следующей формулы I, или его рацемат, изомер или фармацевтически приемлемую соль:(I) где в формуле I каждый из X1, X2 и Х 3 независимо представляет собой углерод или азот, при условии, что по меньшей мере один из X1, X2 и Х 3 представляет собой азот,каждый из R1, R2, R3 и R4 могут быть одинаковыми или отличными друг от друга и независимо выбран из группы, включающей водород; гидрокси; незамещенный или замещенный C1-С 6 алкил; незамещенный или замещенный С 2-С 7 алкенил; незамещенный или замещенный С 2-С 7 алкинил; C1-С 6 гидроксиалкил; незамещенный или замещенный C1-С 6 галогеналкил; незамещенный или замещенный C1-С 6 алкокси; незамещенный или замещенный C1-С 6 галогеналкокси; галоген; незамещенный или замещенный фенил; циано; нитро; амино; группу карбоновой кислоты; группу фосфорной кислоты; N-оксид; амид; C1-C6 алкиламид; альдегид; гидроксамовую кислоту; незамещенный или замещенный C1-С 6 алкилсульфид; незамещенный или замещенный C1-С 6 алкилтиоксо; незамещенный или замещенный C1-С 6 алкилсульфонил; незамещенный или замещенный С 1-С 6 оксималкил; незамещенный или замещенный C1 С 6 аминоалкил; незамещенный или замещенный С 3-C8 алкилкарбонилалкил; незамещенный или замещенный С 2-С 7 алканоил; незамещенный или замещенный С 2-С 7 алкоксикарбонил; незамещенный или замещенный С 2-С 7 алканоилокси; незамещенный или замещенный С 3-С 12 моно- или бициклоалкил; незамещенный или замещенный С 4-С 12 циклоалкилалкил; незамещенный или замещенный С 6-С 12 арил; незамещенный или замещенный, насыщенный или ненасыщенный С 3-С 12 моно- или поликарбоциклил; и не-3 018521 замещенный или замещенный, насыщенный или ненасыщенный 3-12-членный моно- или полигетероциклил, содержащий от 1 до 3 гетероатомов (предпочтительно, гетероатом выбран из N, О и S), при условии, что когда X1 представляет собой азот, R2 отсутствует; когда Х 2 представляет собой азот, R3 отсутствует; и когда Х 3 представляет собой азот, R4 отсутствует, или каждая из R1-R2, R2-R3 и R3-R4 пар может быть независимо конденсирована с образованием насыщенного или ненасыщенного 5-11-членного карбоцикла или гетероцикла (предпочтительно, гетероцикл содержит от 1 до 3 гетероатомов, выбранных изN, О и S),каждый из R5, R6, R7 и R8 могут быть одинаковыми или отличными друг от друга и независимо выбраны из группы, включающей водород; гидрокси; незамещенный или замещенный C1-С 6 алкил; незамещенный или замещенный С 2-С 7 алкенил; незамещенный или замещенный С 2-С 7 алкинил; C1-С 6 гидроксиалкил; незамещенный или замещенный C1-С 6 галогеналкил; незамещенный или замещенный C1-С 6 алкокси; незамещенный или замещенный С 1-С 6 галогеналкокси; незамещенный или замещенный С 2-С 7 алканоил; группу фосфорной кислоты; N-оксид; амид; альдегид; гидроксамовую кислоту; незамещенный или замещенный C1-С 6 алкилсульфид; незамещенный или замещенный C1-C6 алкилтиоксо; незамещенный или замещенный C1-С 6 алкилсульфонил; незамещенный или замещенный C1-С 6 оксималкил; незамещенный или замещенный C1-С 6 аминоалкил; незамещенный или замещенный C3-C8 алкилкарбонилалкил; галоген; незамещенный или замещенный фенил; циано; нитро; амино; и группу карбоновой кислоты, или R5 и R6 вместе с атомом углерода, с которым они связаны, могут образовывать карбонильную группу (С=O) или тиоксогруппу (C=S), или R7 и R8 вместе с атомом углерода, с которым они связаны,могут образовывать карбонильную группу (С=O) или тиоксогруппу (C=S),L может образовывать карбонильную группу (-С(=O)-), сульфонильную группу (-S(=O)2-), C1-C6 алкилкарбонил (например, -СН 2 С(=О)-), карбонил C1-С 6 алкил (например, -С(=О)СН 2-) или тиоксогруппуY выбран из группы, включающей насыщенный или ненасыщенный С 3-С 12 моно- или поликарбоциклил, замещенный R9 R10 и R11; и насыщенный или ненасыщенный 3-12-членный моно- или полигетероциклил, содержащий от 1 до 3 гетероатомов (предпочтительно, гетероцикл содержит от 1 до 3 гетероатомов, выбранных из N, О и S) и замещенный R9, R10 и R11,где каждый из R9, R10 и R11 независимо выбран из группы, включающей водород; гидрокси; незамещенный или замещенный C1-C6 алкил; незамещенный или замещенный С 2-С 7 алкенил; незамещенный или замещенный С 2-С 7 алкинил; C1-С 6 гидроксиалкил; незамещенный или замещенный C1-C6 галогеналкил; незамещенный или замещенный C1-С 6 алкокси; незамещенный или замещенный C1-C6 галогеналкокси; галоген; незамещенный или замещенный C1-C6 алкилсульфид; незамещенный или замещенныйC1-С 6 алкилтиоксо; гидроксамовую кислоту; незамещенный или замещенный фенил; циано; нитро; амино; группу карбоновой кислоты; амид; C1-С 6 алкиламид; незамещенный или замещенный С 2-С 7 алканоил; альдегид; незамещенный или замещенный С 3-С 8 сложный эфир; незамещенный или замещенный С 3 С 8 сложный эфир-окси; незамещенный или замещенный C1-С 6 алкилсульфонил; незамещенный или замещенный C1-C6 оксималкил; незамещенный или замещенный C1-C6 аминоалкил; незамещенный или замещенный C3-C8 алкилкарбонилалкил; группу фосфорной кислоты и N-оксид,при условии, что когда Y представляет собой фенил, i) по меньшей мере один из R9, R10 и R11 представляет собой гидрокси, или ii) все из R9, R10 и R11 являются отличными от водорода, если ни один изR9, R10 и R11 не является гидрокси, и когда Y представляет собой пиридинил, по меньшей мере один изR9, R10 и R11 является отличным от водорода. Предпочтительно в представленной выше формуле I L может образовывать карбонильную группу (С(=O)-), сульфонильную группу (-S(=O)2-) или тиоксогруппу (-C(=S)-). Предпочтительно в представленной выше формуле I, каждый из R5, R6, R7 И R8 могут быть одинаковыми или отличными друг от друга и независимо выбраны из группы, включающей водород; гидрокси; незамещенный или замещенный C1-C4 алкил; незамещенный или замещенный C1-C4 галогеналкил; незамещенный или замещенный С 1-С 4 алкокси; незамещенный или замещенный С 1-С 4 галогеналкокси; незамещенный или замещенный С 2-С 5 алканоил; галоген; незамещенный или замещенный фенил; циано; нитро; амино; и группу карбоновой кислоты; или R5 и R6 вместе с атомом углерода, с которым они связаны, могут образовывать карбонильную группу (С=O) или тиоксогруппу (C=S), или R7 и R8 вместе с атомом углерода, с которым они связаны, могут образовывать карбонильную группу (С=O) или тиоксогруппу (C=S). Предпочтительно в представленной выше формуле I Y выбран из группы, включающей насыщенный или ненасыщенный С 5-С 6 карбоциклил, замещенный R9, R10 и R11; и насыщенный или ненасыщенный 5-6-членный гетероциклил, содержащий от 1 до 3 гетероатомов (предпочтительно, гетероцикл содержит от 1 до 3 гетероатомов, выбранных из N, О и S) и замещенный R9, R10 и R11, где R9, R10 и R11 имеют значение, определенное в представленной выше формуле I. Предпочтительно в представленной выше формуле I R9, R10 и R11 независимо выбраны из группы,включающей водород; гидрокси; незамещенный или замещенный C1-C4 алкил; незамещенный или замещенный C1-C4 галогеналкил; незамещенный или замещенный C1-C4 алкокси; незамещенный или замещенный C1-C4 галогеналкокси; галоген; незамещенный или замещенный фенил; циано; нитро; амино; группу карбоновой кислоты; амид; С 1-С 6 алкиламид; незамещенный или замещенный С 2-С 5 алканоил; альдегид; незамещенный или замещенный С 3-С 7 сложный эфир; незамещенный или замещенный С 3-С 7 сложный эфирокси; незамещенный или замещенный C1-C4 алкилсульфонил; незамещенный или замещенный C1-C4 оксималкил; незамещенный или замещенный C1-C4 аминоалкил; незамещенный или замещенный С 3-С 7 алкилкарбонилалкил; группу фосфорной кислоты; и N-оксид, при условии, что когда Y представляет собой фенил, i) по меньшей мере один из R9, R10 и R11 представляет собой гидрокси, или ii) все из R9, R10 и R11 являются отличными от водорода, если ни один из R9, R10 и R11 не является гидрокси,и когда Y представляет собой пиридинил, по меньшей мере один из R9, R10 и R11 является отличным от водорода. Предпочтительно в представленной выше формуле I каждая из R1-R2, R2-R3 и R3-R4 пар может быть независимо конденсирована с образованием насыщенного или ненасыщенного 5-6-членного карбоцикла или гетероцикла, где гетероцикл предпочтительно содержит от 1 до 3 гетероатомов, выбранных из N, О иS. Предпочтительно в представленной выше формуле I каждый из R1, R2, R3 и R4 могут быть одинаковыми или отличными друг от друга и независимо выбраны из группы, включающей водород; гидрокси; незамещенный или замещенный С 1-С 4 алкил; незамещенный или замещенный C1-C4 галогеналкил; незамещенный или замещенный C1-C4 алкокси; незамещенный или замещенный С 1-С 4 галогеналкокси; галоген; незамещенный или замещенный фенил; циано; нитро; амино; группу карбоновой кислоты; незамещенный или замещенный С 2-С 5 алканоил; незамещенный или замещенный С 2-С 5 алкоксикарбонил; незамещенный или замещенный С 2-С 5 алканоилокси; незамещенный или замещенный С 3-С 10 моно- или бициклоалкил; незамещенный или замещенный С 4-С 11 циклоалкилалкил; незамещенный или замещенный С 6-С 10 арил; незамещенный или замещенный, насыщенный или ненасыщенный С 3-С 10 моно- или поликарбоциклил; и незамещенный или замещенный, насыщенный или ненасыщенный 3-10-членный моноили полигетероциклил, содержащий от 1 до 3 гетероатомов (предпочтительно, гетероатом выбран из N,О и S) , при условии, что когда X1 представляет собой азот, R2 отсутствует; когда Х 2 представляет собой азот, R3 отсутствует; и когда Х 3 представляет собой азот, R4 отсутствует. В представленной выше формуле I предпочтительным примером "С 3-С 12 моно- или бициклоалкила" может быть моноциклоалкил, такой как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и циклононил, или бициклоалкил, полученный в результате конденсации одинаковых или отличных друг от друга двух из указанных моноциклоалкилов, но не ограничивается этим. В представленной выше формуле I предпочтительным примером "С 3-С 12 моно- или поликарбоциклила" может быть моноциклоалкил, такой как циклопропил, циклобутил, циклопентил, циклогексил,циклогептил, циклооктил и циклононил, или полициклоалкил, полученный в результате конденсации одинаковых или отличных друг от друга двух или более из указанных моноциклоалкилов, или карбоарил(например, фенил или нафтил), но не ограничивается этим. В представленной выше формуле I предпочтительный пример "насыщенный или ненасыщенный 312-членный моно- или полигетероциклил, содержащий от 1 до 3 гетероатомов" может представлять собой тиенил, тиазолил, имидазолил, бензимидазолил, триазолил, тетрагидропиранил, пиридинил, фуранил, пиранил, пирролил, пиразолил, пиразинил, пиримидинил, изотиазолил, изоксазолил, пиридазинил,изобензопиранил, хроменил, индолил, индазолил, хинолинил, пуринил, пирролинил, хроманил, пиразолидинил, пиперидинил, пиперазинил или подобные, но не ограничивается этим. В представленной выше формуле I предпочтительный пример "С 4-С 12 циклоалкилалкила" может представлять собой циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, циклопентилэтил, циклогексилэтил, циклогептилметил, циклогептилэтил, циклооктилметил или подобные,но не ограничивается этим. Предпочтительно в представленной выше формуле I Х 2 представляет собой углерод, и каждый из X1 и Х 3 независимо представляет собой углерод или азот, при условии, что по меньшей мере один из X1 и Х 3 представляет собой азот. Предпочтительно в представленной выше формуле I R1, R2, R3 и R4 могут быть одинаковыми или отличными друг от друга и независимо выбраны из группы, включающей водород; незамещенный или замещенный C1-C4 алкил; незамещенный или замещенный С 1-С 4 галогеналкил; галоген; незамещенный или замещенный фенил; циано; и незамещенный или замещенный, насыщенный или ненасыщенный 310-членный моно- или полигетероциклил, содержащий от 1 до 3 гетероатомов (предпочтительно, гетероатом выбран из N, О и S); или каждая из R1-R2, R2-R3 и R3-R4 пар может быть независимо конденсирована с образованием насыщенного или ненасыщенного 5-6-членного карбоцикла; при условии, что когдаX1 представляет собой азот, R2 отсутствует; когда Х 2 представляет собой азот, R3 отсутствует; и когда Х 3 представляет собой азот, R4 отсутствует. Предпочтительно в представленной выше формуле I Y представляет собой ароматический 5-6 членный карбоцикл или гетероцикл (предпочтительно, гетероцикл содержит от 1 до 3 гетероатомов, выбранных из N, О и S) , замещенный R9, R10 и R11, где R9, R10 и R11 имеют значение, определенное в представленной выше формуле I. Предпочтительно в представленной выше формуле I каждый из R9, R10 и R11 независимо выбран из группы, включающей водород; гидрокси; незамещенный или замещенный C1-C4 алкил; незамещенный или замещенный C1-C4 галогеналкил; незамещенный или замещенный C1-C4 алкокси; незамещенный или замещенный C1-C4 галогеналкокси; галоген; нитро; группу карбоновой кислоты; и незамещенный или замещенный С 3-С 7 сложный эфир-окси, при условии, что когда Y представляет собой фенил, i) по меньшей мере один из R9, R10 и R11 представляет собой гидрокси, или ii) все из R9, R10 и R11 являются отличными от водорода, если ни один из R9, R10 и R11 не является гидрокси, и когда Y представляет собой пиридинил, по меньшей мере один из R9, R10 и R11 является отличным от водорода. В соответствии с предпочтительным вариантом воплощения настоящего изобретения в представленной выше формуле I каждый из X1, X2 и Х 3 независимо представляет собой углерод или азот, при условии, что по меньшей мере один из X1, X2 и Х 3 представляет собой азот, R1, R2, R3 и R4 могут быть одинаковыми или отличными друг от друга и независимо выбраны из группы, включающей водород; гидрокси; незамещенный или замещенный С 1-С 4 алкил; незамещенный или замещенный C1-C4 галогеналкил; незамещенный или замещенный C1-C4 алкокси; незамещенный или замещенный С 1-С 4 галогеналкокси; галоген; циано; нитро; амино; группу карбоновой кислоты; незамещенный или замещенный С 2-С 5 алканоил; незамещенный или замещенный C2-C5 алкоксикарбонил; незамещенный или замещенный С 2-С 5 алканоилокси; С 6-С 12 арил; и незамещенный или замещенный, насыщенный или ненасыщенный С 3-С 12 моно- или поликарбоциклил или гетероциклил, при условии, что когда X1 представляет собой азот, R2 отсутствует; когда Х 2 представляет собой азот, R3 отсутствует; и когда Х 3 представляет собой азот, R4 отсутствует, или каждая из R1-R2, R2-R3 и R3-R4 пар может быть независимо конденсирована с образованием насыщенного или ненасыщенного 5-6-членного карбоцикла или гетероцикла, R5, R6, R7 и R8 могут быть одинаковыми или отличными друг от друга и независимо выбраны из группы, включающей водород; гидрокси; незамещенный или замещенный C1-C4 алкил; незамещенный или замещенный C1-C4 галогеналкил; незамещенный или замещенный C1-C4 алкокси; незамещенный или замещенный C1-C4 галогеналкокси; незамещенный или замещенный С 2-С 5 алканоил; галоген; циано; нитро; амино; и группу карбоновой кислоты, или R5 и R6 вместе с атомом углерода, с которым они связаны, могут образовывать карбонильную группу (С=O), или R7 и R6 вместе с атомом углерода, с которым они связаны, могут образовывать карбонильную группу (С=O),L может образовывать карбонильную группу (-С(=O)-), сульфонильную группу (-S(=O)2-) или тиоксогруппу(-С(=S)-), иY выбран из группы, включающей насыщенный или ненасыщенный С 3-С 12 моно- или поликарбоциклил, замещенный R9, R10 и R11; и насыщенный или ненасыщенный 3-12-членный моно- или полигетероциклил, содержащий от 1 до 3 гетероатомов и замещенный R9, R10 и R11, где гетероцикл предпочтительно содержит от 1 до 3 гетероатомов, выбранных из N, О и S,где R9, R10 и R11 независимо выбраны из группы, включающей водород; гидрокси; незамещенный или замещенный C1-C4 алкил; незамещенный или замещенный C1-C4 галогеналкил; незамещенный или замещенный C1-C4 алкокси; незамещенный или замещенный C1-C4 галогеналкокси; галоген; циано; нитро; амино; группу карбоновой кислоты; и незамещенный или замещенный С 3-С 7 сложный эфирокси,при условии, что когда Y представляет собой фенил, i) по меньшей мере один из R9, R10 и R11 представляет собой гидрокси, или ii) все из R9, R10 и R11 являются отличными от водорода, если ни один изR9, R10 и R11 представляет собой гидрокси, и когда Y представляет собой пиридинил, по меньшей мере один из R9, R10 и R11 является отличным от водорода. В соответствии с другим предпочтительным вариантом воплощения настоящего изобретения в представленной выше формуле I каждый из X1, X2 и Х 3 независимо представляет собой углерод или азот,при условии, что по меньшей мере один из X1, X2 и Х 3 представляет собой азот,R1, R2, R3 и R4 могут быть одинаковыми или отличными друг от друга и независимо выбраны из группы, включающей водород; незамещенный или замещенный C1-C4 алкил; незамещенный или замещенный С 1-С 4 галогеналкил; незамещенный или замещенный C1-C4 алкокси; галоген; циано; нитро; амино; и незамещенный или замещенный, насыщенный или ненасыщенный C5-С 6 карбоциклил или гетероциклил, при условии, что когда X1 представляет собой азот, R2 отсутствует; когда Х 2 представляет собой азот, R3 отсутствует; и когда Х 3 представляет собой азот, R4 отсутствует, или каждая из R1-R2, R2-R3 и R3R4 пар может быть независимо конденсирована с образованием фенила или 6-членного гетероцикла, содержащего от 1 до 2 атомов азота или кислорода,R5, R6, R7 и R8 могут быть одинаковыми или отличными друг от друга и независимо выбраны из группы, включающей водород; незамещенный или замещенный C1-C4 алкил; незамещенный или замещенный C1-C4 алкокси; галоген; циано; нитро; и амино,L представляет собой карбонильную группу (-С(=O)-) или тиоксогруппу(-С(=S)-), иY представляет собой фенил, который содержит гидроксигруппу в пара-положении относительно положения присоединения L и дополнительно замещен 1-3 заместителями, независимо выбранными из галогена и нитро. В качестве репрезентативных примеров соединения формулы I в соответствии с настоящим изобретением, можно указать следующие соединения:(3-хлор-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон, соль бромистоводородной кислоты (соединение 10);(3-бром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон, соль бромистоводородной кислоты (соединение 11);(3,5-дихлор-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон, соль бромистоводородной кислоты (соединение 13);(3,5-дихлор-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон, соль бромистоводородной кислоты (соединение 15);(3-бром-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][I,4]оксазин-1-ил)метанон, соль бромистоводородной кислоты (соединение 16);(3-хлор-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон, соль бромистоводородной кислоты (соединение 18);(3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон, соль хлористоводородной кислоты (соединение 33);(3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон, соль серной кислоты (соединение 71);(3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метантион, соль трифторуксусной кислоты (соединение 74); и 1-[1-(3,5-дибром-4-гидроксибензоил)-2,3-дигидро-1 Н-пиридо[2,3-b][1,4]оксазин-7-ил]пирролидин 2-он (соединение 75). Названия соединений, описанных выше, соответствуют номенклатуре (AutoNom version 2.1) с использованием структур, представленных программой CS ChemDraw Ultra software of CambridgeSoft. Как это используется в настоящей заявке, термин "незамещенный или замещенный" относится к незамещенному состоянию, или состоянию замещения одним или несколькими подходящими заместителями, например, такими как гидрокси; оксо (=O); C1-С 6 алкил или галогеналкил; C1-С 6 алкокси или галогеналкокси; С 1-С 6 алканоил или галогеналканоил; галоген; циано; нитро; амино; моно- или ди-(C1-C6) алкиламино; группа карбоновой кислоты; С 2-С 7 алкенил; С 2-С 7 алкинил; C1-C6 гидроксиалкил; фенил; группа фосфорной кислоты; N-оксид; амид; C1-С 6 алкиламид; альдегид; гидроксамовая кислота; C1-C6 алкилсульфид; C1-С 6 алкилтиоксо; C1-С 6 алкилсульфонил; C1-С 6 оксималкил; C1-C6 аминоалкил; С 3-С 8 алкилкарбонилалкил; С 2-С 7 алкоксикарбонил; С 2-С 7 алканоилокси или подобные. Если не указано иное, алкильный заместитель, как он указан в настоящей заявке, и алкильный остаток в другом заместителе (например, алкокси), как он указан в настоящей заявке, может быть линейным или разветвленным. Также, галоген включает фтор (F), хлор (Cl), бром (Br) и иод (I). Соединение формулы I в соответствии с настоящим изобретением может представлять собой рацемат. Рацемат можно разделить на отдельные изомеры с использованием традиционных методов разделения, например метода с использованием общей колоночной хроматографии с наполнителем из силикагеля с нормальной фазой (Merk, 0,040-0,063 мм и 0,063-0,200 мм), общей колоночной хроматографии с наполнителем из аминового силикагеля (chromatorex, 100-200 меш) или колоночной хроматографии для фракционирования под давлением с обращенной фазой (Young-rin, SDV 30 plus), с использованием соответствующего растворителя, предпочтительно смешанного растворителя из гексана, этилацетата, дихлорметана и метанола для нормальной фазы, и смеси воды и ацетонитрила для обращенной фазы. Соединение формулы I в соответствии с настоящим изобретением также может образовывать фармацевтически приемлемые соли. Фармацевтически приемлемые соли включают кислотно-аддитивные соли, полученные из кислот, образующих нетоксичные кислотно-аддитивные соли, содержащие фармацевтически приемлемый анион, например, неорганических кислот, таких как хлористо-водородная кислота, серная кислота, азотная кислота, фосфорная кислота, бромисто-водородная кислота, иодистоводородная кислота, и т.д.; органических карбоновых кислот, таких как винная кислота, муравьиная кислот,лимонная кислота, уксусная кислота, трихлоруксусная кислота или трифторуксусная кислота, глюконовая кислота, бензойная кислота, молочная кислота, фумаровая кислота, малеиновая кислота, и т.д.; и сульфоновых кислот, таких как метансульфоновая кислота, бензолсульфоновая кислота, птолуолсульфоновая кислота или нафталинсульфоновая кислота. Соли с щелочными металлами, такими как натрий, калий или подобные, также включены. Кроме того, могут быть включены соли с другими кислотами или основаниями, которые традиционно используют в области, относящейся к ароматическим амидиновым производным или лактамовым производны. Их получают в соответствии с широко известными способами. Соединение по настоящему изобретению является полезным в качестве ингибитора, в частности,селективного ингибитора повторного поглощения мочевой кислоты через человеческий транспортер уратного аниона 1 (hURAT1). Соединения по настоящему изобретению, имеющие структуру представленной выше формулы I,можно получить в соответствии со способами, описанными ниже. Поэтому еще одной целью настоящего изобретения является обеспечение способов получения соединения формулы I. Более конкретно, соединение формулы I можно получить при помощи каждого из способов получения 1-5, описанных ниже, но не ограничиваясь этим. Способ получения 1 Следующее соединение формулы II, которое представляет собой соединение формулы I, где L представляет собой -С(=O)-, можно получить способом, включающим следующие стадии: восстановление соединения формулы VII с получением соединения формулы VI; циклизация полученного соединения формулы VI с соединением формулы V с получением соединения формулы IV; и образование пептидной связи полученного соединения формулы IV с использованием соединения формулы III.(VII) В формулах II-VII выше, Xl, Х 2, X3, R1, R2, R3, R4, R5, R6, R7, R8 и Y имеют значения, указанные в формуле I выше, и Z представляет собой реакционноспособную удаляемую группу, предпочтительно гидрокси или галоген. Способ получения 1 подробно объясняется ниже. Соединения формул VI и VII, используемые в качестве исходных веществ, можно получить в соответствии со способом, описанным в JOC. 60, 1995, 5721-5725, или являются коммерчески доступными от компаний, поставляющих химические реагенты, таких как Sigma Aldrich, Merck и т.д. Восстановление соединения формулы VII с получением соединения формулы VI осуществляют в соответствии с известными способами синтеза в присутствии подходящего растворителя, катализатора восстановления и газообразного водорода. Растворитель конкретно не ограничен, но его предпочтительные примеры включают эфирные растворители, такие как диэтиловый эфир, тетрагидрофуран, диоксан,1,2-диметоксиэтан, диглим и т.д.; углеводородные растворители, такие как бензол, толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители, такие как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д.; спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и т.д.; сложноэфирные растворители, такие как этилацетат, метил ацетат, бутилацетат и т.д.; и полярные растворители, такие как ацетон, N,N-диметилформамид, N,Nдиметилацетамид, диметилсульфоксид, ацетонитрил и т.д. Также можно использовать смешанный растворитель, состоящий из двух или более растворителей, описанных выше. Метанол, этилацетат и тетрагидрофуран являются особенно предпочтительными в качестве растворителя для этой реакции. Восстановители, используемые в этой реакции, включают общие катализаторы восстановления, такие как палладий на активированном угле (5% мас./мас.), палладий на активированном угле (10% мас./мас.), гидроксид палладия на активированном угле (10% мас./мас.) и никель Ренея и т.д. Палладий на активированном угле (10% мас./мас.) является предпочтительным для этой реакции. Реакцию можно осуществить в пределах времени от 1 ч до 24 ч, предпочтительно в течение около 18 ч, при температуре в пределах от 0 С до комнатной температуры, предпочтительно при комнатной температуре, при давлении водорода от атмосферного давления до 3 атмосфер, предпочтительно при атмосферном давлении водорода, но не ограничиваясь этим. На следующей стадии реакцию циклизации соединения формулы VI, полученного в соответствии с описанным выше способом, осуществляют с использованием известных способов синтеза в присутствии подходящего растворителя, соединения формулы V и основания. Растворитель конкретно не ограничен,но его предпочтительные примеры включают эфирные растворители, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, диглим и т.д.; углеводородные растворители, такие как бензол,толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители, такие как дихлорметан,хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д.; спиртовые растворители, такие как метанол,этанол, изопропиловый спирт, трет-бутиловый спирт и т.д.; сложноэфирные растворители, такие как этилацетат, метилацетат, бутилацетат и т.д.; и полярные растворители, такие как ацетон, N,Nдиметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил и т.д. Также можно использовать смешанный растворитель, состоящий из двух или более растворителей, описанных выше. Ацетонитрил и N,N-диметилформамид являются особенно предпочтительными в качестве растворителя для этой реакции. Примеры основания, используемого в этой реакции, включают органические основания,такие как триэтиламин, пиридин, 4-метиламинопиридин, 4-метилморфолин, пиперазин, N-метилпиперазин и т.д.; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид кальция и т.д.; гидриды щелочных металлов, такие как гидрид натрия, гидрид калия и т.д.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия и т.д.; и гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия и т.д. Карбонат калия является предпочтительным для этой реакции. Реакцию циклизации осуществляют в пределах времени от 1 до 24 ч, предпочтительно в течение около 18 ч, при комнатной температуре или температуре кипения с обратным холодильником, в зависимости от используемого растворителя, предпочтительно в условиях от комнатной температуры до 150 С. Более предпочтительными условиями являются 100 С в N,N-диметилформамидном растворителе. Также соединения формулы IV можно получить из другого промежуточного соединения, в зависимости от структуры соединения формулы V. Например, в случае структуры кетона, где R7 и R8 образуют карбонил(-С(=O)-), соединения формулы IV можно получить при помощи реакции восстановления с использованием подходящего растворителя и восстановителя. Растворитель конкретно не ограничен, но его предпочтительные примеры включают эфирные растворители, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, диглим и т.д.; углеводородные растворители, такие как бензол, толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители, такие как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д.; спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и т.д.; сложноэфирные растворители, такие как этилацетат, метилацетат, бутилацетат и т.д.; и полярные растворители, такие как ацетон, N,Nдиметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил и т.д. Также можно использовать смешанный растворитель, состоящий из двух или более растворителей, описанных выше. Тетрагидрофуран, дихлорметан, диметиловый эфир и толуол являются особенно предпочтительными в качестве растворителя для этой реакции. Примеры восстановителя включают литийалюминийгидрид, борогидрид натрия, диборан, диизобутилалюминийгидрид, комплекс боран-тетрагидрофуран, бис(2 метоксиэтокси)алюмогидрид натрия (Red-Al), борогидрид тетра-н-бутиламмония и т.д. Предпочтительно, используют литийалюминийгидрид или борогидрид тетра-н-бутиламмония. Реакция начинается при 0 С и, и далее ее осуществляют при температуре в пределах от 0 до 150 С, предпочтительно в условиях от комнатной температуры до 50 С, в пределах времени от 10 мин до 10 ч, предпочтительно в течение около 2 ч, с получением соединения формулы IV, где R7 и R8 восстановлены. Также соединения формулы IV, которые замещены R1, R2, R3 и R4, можно получить при помощи реакци сочетания арилбороновой кислоты или винилбороновой кислоты, коммерчески доступной от компаний, поставляющих химические реагенты, таких как Sigma Aldrich, Merck и т.д., в присутствии металлического катализатора. Растворитель конкретно не ограничен, но его предпочтительные примеры включают эфирные растворители, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан,диглим и т.д.; углеводородные растворители, такие как бензол, толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители, такие как дихлорметан, хлороформ, тетрахлорид углерода, 1,2 дихлорэтан и т.д.; спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, третбутиловый спирт и т.д.; сложноэфирные растворители, такие как этилацетат, метилацетат, бутилацетат и т.д.; и полярные растворители, такие как ацетон, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил и т.д. Также можно использовать смешанный растворитель, состоящий из двух или более растворителей, описанных выше. Смесь ацетонитрила и воды является особенно предпочтительной в качестве растворителя для этой реакции. Примеры металлического катализатора, используемого в этой реакции, включают ацетат палладия, тетракис(трифенилфосфин) палладий,трис(дибензилиденацетон)дипалладий, дихлорид палладия, дихлорид (1,1-бис(дифенилфосфино)ферроцен)палладия, хлорид бис(трифенилфосфин)палладия и т.д. Ацетат палладия является особенно предпочтительным для этой реакции. Примеры основания для использования в этой реакции, включают органические основания, такие как триэтиламин, пиридин, 4-метиламинопиридин, 4-метилморфолин, пиперазин, N-метилпиперазин и т.д.; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид кальция и т.д.; гидриды щелочных металлов, такие как гидрид натрия, гидрид калия и т.д.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия,карбонат цезия и т.д.; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия и т.д.; и фосфат калия. Карбонат калия и фосфат калия являются предпочтительными для этой реакции. Реакцию можно далее осуществлять при температуре в пределах от комнатной температуры до 180 С, предпочтительно в условиях от комнатной температуры до 100 С, в пределах времени от 1 до 24 ч, предпочтительно в течение около 18 ч, с получением другого соединения, охватываемого формулой IV, где заместитель, указанный выше, вводят в R1, R2, R3, R4. На следующей стадии соединение формулы II получают при помощи реакции конденсации соединения формулы IV с промежуточным соединением, образованным из соединения формулы III с использованием общеизвестного агента галогенирования, предпочтительно оксалилхлорида или тионилхлорида, или путем образования пептидной связи соединения формулы IV с соединением формулы III с использованием пептидных конденсирующих реагентов, таких как HATU, HBTU, ВОР, РуВОР, EDC, соль хлористо-водородной кислоты, TBTU, HOBt, DEPBT, CDI и т.д., в растворителе, таком как N,Nдиметилацетамид, дихлорметан, тетрагидрофуран. В реакции с реакционным продуктом, образованным из соединения формулы III путем добавления к нему общеизвестного агента галогенирования, органическое основание можно выбрать в соответствии с соединением формулы III, и, в этом случае, реакцию осуществляют в щелочных условиях, предпочтительно с использованием триэтиламина. Растворитель конкретно не ограничен, но его предпочтительные примеры включают эфирные растворители, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, диглим и т.д.; углеводородные растворители, такие как бензол, толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители,такие как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д.; спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и т.д.; сложноэфирные растворители, такие как этилацетат, метилацетат, бутилацетат и т.д.; и полярные растворители, такие как ацетон, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил и т.д. Также можно использовать смешанный растворитель, состоящий из двух или более растворителей, описанных выше. Дихлорметан и N,N-диметилацетамид являются особенно предпочтительными в качестве растворителя для этой реакции. Примеры основания, используемого в этой реакции, включают органические основания, такие как триэтиламин, пиридин, 4-метиламинопиридин, 4-метилморфолин, пиперазин, Nметилпиперазин и т.д.; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия,гидроксид калия, гидроксид кальция и т.д.; гидриды щелочных металлов, такие как гидрид натрия, гидрид калия и т.д.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия и т.д.; и гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия и т.д. Триэтиламин является предпочтительным для этой реакции. Реакцию в щелочных условиях осуществляют в пределах времени от 10 минут и 10 часов, предпочтительно в течение около 2 ч, при температуре в пределах от 0 до 60 С, предпочтительно при комнатной температуре. Реакцию без использования щелочных условий осуществляют в пределах времени от 1 ч до 24 ч, предпочтительно в течение около 18 ч. Реакция начинается при 0 С и, и далее ее осуществляют при температуре в пределах от комнатной температуры до 60 С, предпочтительно при комнатной температуре. Способ получения соединения формулы II, указанного выше, подробно объясняется в примерах. Способ получения 2 Соединение формулы II также можно получить способом, включающим следующие стадии: галогенирование соединения формулы VII с получением соединения формулы X и затем взаимодействие полученного соединения формулы X с соединением формулы IX с получением соединения формулы VIII, или осуществление реакции Мицунобу соединения формулы VII и соединения формулы IX с получением соединения формулы VIII; циклизация полученного соединения формулы VIII с получением соединения формулы IV; и осуществление реакции образования пептидной связи полученного соединения формулы(VII) В формулах II-X выше, X1, X2, Х 3, R1, R2, R3, R4, R5, R6, R7, R8 и Y имеют значение, определенное для формулы I выше; R12 представляет собой неводородный заместитель, предпочтительно С 1-С 4 алкил,более предпочтительно метил или этил; и R13 представляет собой удаляемую группу, предпочтительно галоген. Способ получения 2 подробно объясняется ниже. Соединения формул VII и IX, используемые в качестве исходных веществ, являются коммерчески доступными от компаний, поставляющих химические реагенты, таких как Sigma Aldrich, Merck и т.д. Реакцию галогенирования соединения формулы VII с получением соединения формулы X осуществляют в соответствии с известными способами синтеза в присутствии подходящего растворителя и агента галогенирования. Растворитель конкретно не ограничен, но его предпочтительные примеры включают эфирные растворители, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, диглим и т.д.; углеводородные растворители, такие как бензол, толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители, такие как дихлорметан, хлороформ, тетрахлорид углерода, 1,2 дихлорэтан и т.д.; спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, третбутиловый спирт и т.д.; сложноэфирные растворители, такие как этилацетат, метилацетат, бутилацетат и т.д.; и полярные растворители, такие как ацетон, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил и т.д. Также можно использовать смешанный растворитель, состоящий из двух или более растворителей, описанных выше. Ацетонитрил является особенно предпочтительным в качестве растворителя для этой реакции. Примеры агента галогенирования, используемого в этой реакции, включают общеизвестные агенты галогенирования, такие как оксихлорид фосфора, оксибромид фосфора, пентахлорид фосфора или пентабромид фосфора и т.д. Оксихлорид фосфора является предпочтительным для этой реакции. Реакцию можно осуществить в пределах времени от около 2 ч до около 6 ч,в условиях нагревания при температуре в пределах от 80 до 100 С, но не ограничиваясь этим. На следующей стадии соединение формулы X подвергают реакции замещения с соединением формулы IX в соответствии с известными способами синтеза, в присутствии подходящего растворителя и основания. Растворитель конкретно не ограничен, но его предпочтительные примеры включают эфирные растворители, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, диглим и т.д.; углеводородные растворители, такие как бензол, толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители, такие как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д.; спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и т.д.; сложноэфирные растворители, такие как этилацетат, метилацетат, бутилацетат и т.д.; и полярные растворители, такие как ацетон, ацетонитрил, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и т.д. Также можно использовать смешанный растворитель, состоящий из двух или более растворителей, описанных выше. Тетрагидрофуран и диэтиловый эфир являются особенно предпочтительными в качестве растворителя для этой реакции. Примеры основания, используемого в этой реакции, включают органические основания, такие как триэтиламин, пиридин, 4-метиламинопиридин, 4-метилморфолин,пиперазин, N-метилпиперазин и т.д.; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид кальция и т.д.; гидриды щелочных металлов, такие как гидрид натрия, гидрид калия и т.д.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия,карбонат цезия и т.д.; и гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия и т.д. Гидрид натрия является предпочтительным для этой реакции. Реакцию замещения осуществляют в пределах времени от около 1 ч до около 6 ч при комнатной температуре, предпочтительно в течение около 1 часа при комнатной температуре, с получением соединения формулы VIII, замещенного соединением формулы IX. Иным образом, соединение формулы VIII можно получить путем осуществления общеизвестной реакции конденсации Мицунобу между соединением формулы VII и соединением формулы IX, не проходя через соединение формулы X. В качестве агента конденсации обычно можно использовать трифенилфосфин и диэтилазодикарбоксилат (DEAD), но не ограничиваясь этим. Реагенты, представляющие собой их модификацию, также можно использовать. Растворитель конкретно не ограничен, но его пример предпочтительно включает эфирные растворители, такие как диэтиловый эфир, тетрагидрофуран,диоксан, 1,2-диметоксиэтан, диглим и т.д.; углеводородные растворители, такие как бензол, толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители, такие как дихлорметан, хлороформ,тетрахлорид углерода, 1,2-дихлорэтан и т.д.; спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и т.д.; сложноэфирные растворители, такие как этилацетат,метилацетат, бутилацетат и т.д.; и полярные растворители, такие как ацетон, ацетонитрил, N,Nдиметилформамид, N,N-диметилацетамид, диметилсульфоксид и т.д. Также можно использовать смешанный растворитель, состоящий из двух или более растворителей, описанных выше. Тетрагидрофуран и диэтиловый эфир являются особенно предпочтительными в качестве растворителя для этой реакции. Реакцию конденсации осуществляют в пределах времени от около 6 ч до около 18 ч, при температуре 0 С или комнатной температуре, предпочтительно в течение около 6 ч при комнатной температуре. На следующей стадии для соединения формулы VIII, полученного в соответствии с описанным выше способом, осуществляют реакцию циклизации в соответствии с известными способами синтеза, в присутствии подходящего растворителя, восстановителя нитрогруппы и кислоты. Растворитель конкретно не ограничен, но его пример предпочтительно включает эфирные растворители, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, диглим и т.д.; углеводородные растворители, такие как бензол, толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители, такие как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д.; спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и т.д.; сложноэфирные растворители,такие как этилацетат, метилацетат, бутилацетат и т.д.; и полярные растворители, такие как ацетон, ацетонитрил, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и т.д. Также можно использовать смешанный растворитель, состоящий из двух или более растворителей, описанных выше. Кислотный раствор концентрированной хлористо-водородной кислоты, уксусной кислоты или других кислот, водный раствор аммиака, метанол и толуол являются особенно предпочтительными в качестве растворителя для этой реакции. Примеры восстановителя включают общеизвестные катализаторы восстановления, такие как тетрахлорид олова, железо, цинк, палладий на активированном угле (5% мас./мас.), палладий на активированном угле (10% мас./мас.), гидроксид палладия на активированном угле (10% мас./мас.), никель Ренея и т.д. Тетрахлорид олова является особенно предпочтительным для этой реакции. Реакцию циклизации осуществляют в пределах времени от около 1 ч до около 6 ч, в условиях нагревания при температуре в пределах от 80 до 100 С, предпочтительно в течение около 1 ч в условиях нагревания при 80 С, с получением циклизованного соединения формулы IV. Из полученного соединения формулы IV можно получить другое соединение, охватываемое формулой IV, путем осуществления соответствующей реакции, например реакции восстановления с использованием подходящего растворителя и восстановителя в случае кетоновой структуры, где R7 и R8, вместе с атомом углерода, с которым они связаны, образуют карбонил(-С(=O)-). Растворитель конкретно не ограничен, но его пример предпочтительно включает эфирные растворители, такие как диэтиловый эфир,тетрагидрофуран, диоксан, 1,2-диметоксиэтан, диглим и т.д.; углеводородные растворители, такие как бензол, толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители, такие как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д.; спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и т.д.; сложноэфирные растворители, такие как этилацетат, метилацетат, бутилацетат и т.д.; и полярные растворители, такие как ацетон, ацетонитрил, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и т.д. Также можно использовать смешанный растворитель, состоящий из двух или более растворителей, описанных выше. Тетрагидрофуран, дихлорметан, диметиловый эфир и толуол являются особенно предпочтительными в качестве растворителя для этой реакции. Примеры восстановителя включают литийалюминийгидрид, борогидрид натрия, диборан, диизобутилалюминийгидрид, комплекс борантетрагидрофуран, бис(2-метоксиэтокси)алюмогидрид натрия (Red-А 1), борогидрид тетра-н-бутиламмония и т.д. Предпочтительно исполь- 14018521 зуют литийалюминийгидрид или борогидрид тетра-н-бутиламмония. Реакция начинается при 0 С, и далее ее осуществляют при температуре в пределах от 0 до 150 С, предпочтительно в условиях от комнатной температуры до 50 С, в пределах времени от 10 мин и 10 ч, предпочтительно в течение около 2 ч, с получением соединения формулы IV, где R7 и R8 являются восстановленными. Если необходимо, соединения формулы IV, которые замещены R1, R2, R3 и R4, можно получить путем реакции сочетания арилбороновой кислоты или винилбороновой кислоты, коммерчески доступной от компаний, поставляющих химические реагенты, таких как Sigma Aldrich, Merck и т.д., в присутствии металлического катализатора. Растворитель конкретно не ограничен, но его пример предпочтительно включает эфирные растворители, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2 диметоксиэтан, диглим и т.д.; углеводородные растворители, такие как бензол, толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители, такие как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д.; спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и т.д.; сложноэфирные растворители, такие как этилацетат, метилацетат,бутилацетат и т.д.; и полярные растворители, такие как ацетон, ацетонитрил, N,N-диметилформамид,N,N-диметилацетамид, диметилсульфоксид и т.д. Также можно использовать смешанный растворитель,состоящий из двух или более растворителей, описанных выше. Смесь ацетонитрила и воды является особенно предпочтительной в качестве растворителя для этой реакции. Примеры металлического катализатора, используемого в этой реакции, включают ацетат палладия, тетракис(трифенилфосфин) палладий,трис(дибензилиденацетон) дипалладий, дихлорид палладия, (1,1-бис(дифенилфосфино)ферроцен)палладийдихлорид, бис(трифенилфосфин)палладийхлорид и т.д. Ацетат палладия является особенно предпочтительным для этой реакции. Примеры основания, используемого в этой реакции, включают органические основания, такие как триэтиламин, пиридин, 4-метиламинопиридин, 4-метилморфолин, пиперазин,N-метилпиперазин и т.д.; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия,гидроксид калия, гидроксид кальция и т.д.; гидриды щелочных металлов, такие как гидрид натрия, гидрид калия и т.д.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия и т.д.; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия и т.д.; и фосфат калия. Карбонат калия и фосфат калия являются предпочтительными для этой реакции. Реакцию можно далее осуществлять при температуре в пределах от комнатной температуры до 180 С,предпочтительно в условиях от комнатной температуры до 100 С, в пределах времени от 1 до 24 ч, предпочтительно в течение около 18 ч, с получением другого соединения, охватываемого формулой IV, где заместитель, указанный выше, вводят в R1, R2, R3, R4. На следующей стадии соединение формулы II получают путем реакции конденсации соединения формулы IV с промежуточным соединением, образованным из соединения формулы III, с использованием для этого общеизвестного агента галогенирования, предпочтительно оксалилхлорида или тионилхлорида, или путем образования пептидной связи соединения формулы IV с соединением формулы III с использованием пептидных связывающих агентов, таких как HATU, HBTU, ВОР, РуВОР, EDC, соль хлористо-водородной кислоты, TBTU, HOBt, DEPBT, CDI и т.д., в растворителе, таком как N,Nдиметилацетамид, дихлорметан, тетрагидрофуран. В этой реакции с реакционным продуктом, образованным из соединения формулы III путем добавления к нему общеизвестного агента галогенирования,органическое основание можно выбрать в соответствии с соединением формулы III, и, в этом случае,реакцию осуществляют в щелочных условиях, предпочтительно с использованием триэтиламина. Растворитель конкретно не ограничен, но его пример предпочтительно включает эфирные растворители,такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, диглим и т.д.; углеводородные растворители, такие как бензол, толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители, такие как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д.; спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и т.д.; сложноэфирные растворители, такие как этилацетат, метилацетат, бутилацетат и т.д.; и полярные растворители, такие как ацетон, ацетонитрил, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и т.д. Также можно использовать смешанный растворитель, состоящий из двух или более растворителей,описанных выше. Дихлорметан и N,N-диметилацетамид являются особенно предпочтительными в качестве растворителя для этой реакции. Примеры основания, используемого в этой реакции, включают органические основания, такие как триэтиламин, пиридин, 4-метиламинопиридин, 4-метилморфолин, пиперазин, N-метилпиперазин и т.д.; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид кальция и т.д.; гидриды щелочных металлов, такие как гидрид натрия, гидрид калия и т.д.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия,карбонат цезия и т.д.; и гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия и т.д. Триэтиламин является предпочтительным для этой реакции. Реакцию в щелочных условиях осуществляют в пределах времени от 10 мин до 10 ч, предпочтительно в течение около 2 ч, при температуре в пределах от 0 до 60 С, предпочтительно при комнатной температуре. Реакцию без использования щелочных условий осуществляют в пределах времени от 1 ч до 24 ч, предпочтительно в течение около 18 ч. Реакция начинается при 0 С, и далее ее осуществляют при температуре в пределах от ком- 15018521 натной температуры до 60 С, предпочтительно при комнатной температуре. Способ получения соединения формулы II, указанного выше, подробно объясняется в примерах ниже. Способ получения 3 Следующее соединение формулы XI, которое представляет собой соединение формулы I, где L представляет собой -C(=S)-, можно получить из соединения формулы II путем взаимодействия с реагентом Лоуссона.(II) В формулах II и XI выше, X1, X2, X3, R1, R2, R3, R4, R5, R6, R7, R8 и Y имеют значение, определенное для формулы I выше. Способ получения 3 подробно объясняется ниже. Соединение формулы II, используемое в качестве исходного вещества, можно получить таким же способом, как описано выше, и полученное соединение формулы II можно подвергнуть взаимодействию в растворителе с реагентом Лоуссона, коммерчески доступным от компаний Sigma Aldrich, Merck и т.д.,для получения соединения формулы XI. Растворитель конкретно не ограничен, но его пример предпочтительно включает эфирные растворители, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, диглим и т.д.; углеводородные растворители, такие как бензол, толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители, такие как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д.; спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и т.д.; сложноэфирные растворители, такие как этилацетат, метилацетат, бутилацетат и т.д.; и полярные растворители, такие как ацетон, ацетонитрил, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и т.д. Также можно использовать смешанный растворитель, состоящий из двух или более растворителей, описанных выше. Тетрагидрофуран и толуол являются особенно предпочтительными в качестве растворителя для этой реакции. Реакцию осуществляют, например, в пределах времени от 1 до 24 ч, при температуре в пределах от 0 до 150 С, предпочтительно в течение около 18 ч при температуре около 120 С, с получением соединения формулы XI. Способ получения соединения формулы XI, указанного выше, подробно объясняется в примерах. Способ получения 4 Следующее соединение формулы XII, которое представляет собой соединение формулы I, где L представляет собой -S(=O)2-, можно получить путем реакции образования сульфонамида при взаимодействии соединения формулы IV с соединением формулы XIII в присутствии основания. ные для формулы I выше; и Z представляет собой удаляемую группу, предпочтительно галоген. Способ получения 4 подробно объясняется ниже. Соединение формулы IV, используемое в качестве исходного вещества, можно получить таким же способом, как описано выше, и полученное соединение формулы IV можно использовать в реакции образования сульфонамида с соединением формулы XIII, коммерчески доступным от компаний Sigma Aldrich, Merck и т.д., в растворителе, в присутствии основания, с получением соединения формулы XII. Растворитель конкретно не ограничен, но его пример предпочтительно включает эфирные растворители, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, диглим и т.д.; углеводородные растворители, такие как бензол, толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители, такие как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д.; спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и т.д.; сложноэфирные растворители, такие как этилацетат, метилацетат, бутилацетат и т.д.; и полярные растворители, такие как ацетон, ацетонитрил, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и т.д. Также можно использовать смешанный растворитель, состоящий из двух или более растворителей, описанных выше. Дихлорметан и тетрагидрофуран являются особенно предпочтительными в качестве растворителя для этой реакции. Примеры основания, используемого в этой реакции, включают органические основания, такие как триэтиламин, пиридин, 4-метиламинопиридин, 4-метилморфолин,пиперазин, N-метилпиперазин и т.д.; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид кальция и т.д.; гидриды щелочных металлов, такие как гидрид натрия, гидрид калия и т.д.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия,карбонат цезия и т.д.; и гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия и т.д. Триэтиламин является предпочтительным для этой реакции. Реакцию образования сульфонамида осуществляют в пределах времени от около 10 мин до около 8 ч, при температуре в пределах от 0 до 60 С, предпочтительно в течение около 2 ч при комнатной температуре, с получением соединения формулы XII. Способ получения соединения формулы XII, указанного выше, подробно объясняется в примерах. Способ получения 5 Следующее соединение формулы XIV, которое представляет собой соединение формулы I, где L представляет собой алкилкарбонил или карбонилалкил, можно получить из соединения формулы IV путем алкилирования соединения формулы соединением формулы XV в присутствии основания.(IV) В формулах IV-XV выше, X, Х 2, Х 3, R1, R2, R3, R4, R5, R6, R'7, R'8 и Y имеют значения, указанные для формулы I выше; Z представляет собой удаляемую группу, предпочтительно галоген; и каждый из R'5,R'6, R'7 и R'8 могут быть одинаковыми или отличными друг от друга и независимо выбраны из группы,включающей водород; гидрокси; незамещенный или замещенный C1-C6 алкил; незамещенный или замещенный C1-C6 галогеналкил; незамещенный или замещенный C1-C6 алкокси; незамещенный или замещенный C1-С 6 галогеналкокси; незамещенный или замещенный С 2-С 7 алканоил; галоген; незамещенный или замещенный фенил; циано; нитро; амино; и группу карбоновой кислоты; или R'5 и R'6 вместе с атомом углерода, с которым они связаны, могут образовывать карбонильную группу (С=O) или тионильную группу (C=S), или R'7 и R'8 вместе с атомом углерода, с которым они связаны, могут образовывать карбонильную группу (С=O) или тионильную группу (C=S). Способ получения 5 подробно объясняется ниже. Соединение формулы IV, используемое в качестве исходного вещества, можно получить таким же способом, как описано выше, и полученное соединение формулы IV можно подвергнуть реакции алкилирования, в растворителе в присутствии основания, с соединением формулы XV, которое получают с использованием известных способов синтеза или закупают у Sigma Aldrich, Merck и т.д., с получением соединения формулы XIV. Растворитель конкретно не ограничен, но его пример предпочтительно включает эфирные растворители, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, диглим и т.д.; углеводородные растворители, такие как бензол, толуол, гексан, ксилол и т.д.; галогенированные углеводородные растворители, такие как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д.; спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и т.д.; сложноэфирные растворители, такие как этилацетат, метилацетат, бутилацетат и т.д.; и полярные растворители, такие как ацетон, ацетонитрил, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и т.д. Также можно использовать смешанный растворитель, состоящий из двух или более растворителей, описанных выше. Дихлорметан и тетрагидрофуран являются особенно предпочтительными в качестве растворителя для этой реакции. Примеры основания, используемого в этой реакции, включают органические основания, такие как триэтиламин, пиридин, 4-метиламинопиридин, 4-метилморфолин,пиперазин, N-метилпиперазин и т.д.; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид кальция и т.д.; гидриды щелочных металлов, такие как гидрид натрия, гидрид калия и т.д.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия,карбонат цезия и т.д.; и гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия и т.д. Триэтиламин является предпочтительным для этой реакции. Реакцию алкилирования осуществляют в пределах времени от около 10 мин до около 8 ч, при температуре в пределах от 0 до 60 С, предпочтительно в течение около 2 ч при комнатной температуре с получением соединения формулы XIV. Способ получения соединения формулы XIV, указанного выше, подробно объясняется в примерах. Соединение формулы I по настоящему изобретению, как объяснялось выше, обладает сильной ингибиторной активностью в отношении человеческого транспортера уратного аниона 1 (hURAT1). Фармацевтическую композицию, содержащую соединение формулы I или его рацемат, стереохимический изомер или фармацевтически приемлемую соль в качестве активного ингредиента, можно получить с использованием суспензии в сочетании с фармацевтически приемлемым носителем, эксципиентом, рецептором, связующим, стабилизатором и другими добавками, традиционно использууемыми в формулировании композиций. Также, когда фармацевтическую композицию по настоящему изобретению получают в форме для инъекций, фармацевтически приемлемый буфер, добавку, способствующую растворению, и/или агент изотоничности можно смешать с соединением формулы I по настоящему изобретению или его рацематом, стереохимическим изомером или фармацевтически приемлемой солью. Фармацевтическая композиция по настоящему изобретению обладает сильной активностью ингибирования человеческого транспортера уратного аниона 1 (hURAT1) и, таким образом, является полезной для лечения или профилактики гиперурикемии; подагрического заболевания, такого как острый подагрический артрит, хронический подагрический артрит, подагрический узел или подагрический нефроз; нефрита; хронической почечной недостаточности; почечнокаменной болезни; уремии; мочекаменной болезни; заболевания, связанного с мочевой кислотой, такого как гиперлипидемия, ишемическая болезнь сердца, инфаркт миокарда, церебральный инфаркт, сердечно-сосудистое заболевание, диабет или гипертензия; и подобных заболеваний. Фармацевтическую композицию по настоящему изобретению можно получить в формах фармацевтической композиции, подходящих для перорального или парентерального введения. Фармацевтическую композицию можно вводить перорально в форме порошка, гранулы, таблетки, пилюли, капсулы, сиропа или суспензии, или путем парентерального введения при помощи инъекции, такой как внутривенная или внутримышечная инъекция, с использованием раствора, эмульсии или суспензии этой композиции. Время введения и дозу подходящим образом можно определить в зависимости от конкретного случая, с учетом симптома, возраста, пола, массы тела и лекарственной формы. Для взрослых фармацевтическую композицию по настоящему изобретению можно вводить в количестве 0,1-2000 мг, предпочтительно 1-200 мг в день, в виде одной дозы или нескольких доз, но не ограничиваясь этим. Благоприятный эффект Новые соединения, представляющие собой гетероциклические производные по настоящему изобретению, обладают сильной активностью ингибирования человеческого транспортера уратного аниона 1(hURAT1), не демонстрируют никакого межлекарственного взаимодействия в отношении цитохрома Р 450 (CYP450), и обладают селективным действием в отношении транспортеров органических анионов,и их можно вводить с использованием более низких доз и меньшего времени введения, поскольку они обладают более высокой растворимостью и метаболической стабильностью, демонстрируя выгодные фармакокинетические свойства, по сравнению с традиционным ингибитором hURAT1 активности. В результате фармакокинетического анализа и сравнения с традиционным лекарственным средством бензбромароном и соединением, раскрытым в WO 2006/057460, с использованием животной модели, такой как мышь, крыса или обезьяна, соединения, представляющие собой гетероциклические производные по настоящему изобретению показали превосходный эффект. Кроме того, в экспериментах по выделению лекарственных средств с мочой, соединения, представляющие собой гетероциклические производные по настоящему изобретению, показали превосходные результаты, подтверждающие то, что доставка лекарственного средства в почку легко осуществима. Поэтому новое гетероциклическое производное по настоящему изобретению и фармацевтическая композиция, содержащая соединение формулы I, могут показать эффекты, превосходящие эффекты традиционных лекарственных средств при лечении или профилактики гиперурикемии, острого подагрического артрита, хронического подагрического артрита, подагрического узла, подагрического нефроза,нефрита, хронической почечной недостаточности, почечнокаменной болезни, уремии, мочекаменной болезни и осложнений, которые, как было указано, сопровождают повышение уровня мочевой кислоты в крови, таких как гиперлипидемия, ишемическая болезнь сердца, инфаркт миокарда, артериосклероз, церебральный инфаркт, сердечно-сосудистое заболевание, диабет, гипертензия или подобные. Варианты воплощения для осуществления изобретения Далее способы получения соединения формулы I по настоящему изобретению объясняются более подробно со ссылкой на описываемые далее примеры и эксперименты. Однако изобретение не ограничивается изобретением соединений, описанных в следующих далее примерах. Также способы получения промежуточных соединений показаны как примеры синтеза промежуточных соединений. Названия соединений, описанных в следующих далее примерах, соответствуют номенклатуреa) Синтез 3-аминопиридин-2-ола. В 500-мл колбе 3-нитропиридин-2-ол (1 г, 71,4 ммоль) растворяли в метаноле (200 мл) и затем добавляли 10% палладий на активированном угле (100 мг, 10% мас./мас.). Реакционную смесь перемешивали в течение 3 ч в атмосфере водорода при комнатной температуре. Полученный реакционный раствор фильтровали через целит и затем упаривали при пониженном давлении с получением белого твердого вещества (800 мг, количественный выход). 1b) Синтез 1 Н-пиридо[2,3-b][1,4]оксазин-2-она. В 20-мл колбе, снабженной обратным холодильником, 3-аминопиридин-2-ол (300 мг, 2,72 ммоль) растворяли в ацетонитриле (27 мл). К реакционному раствору добавляли хлорацетилхлорид (0,24 мл, 3,0 ммоль) по каплям при комнатной температуре, с последующим добавлением карбоната калия (940 мг,6,80 ммоль). Смесь нагревали при 100 С в течение 15 ч. После завершения реакции ацетонитрил выпаривали при пониженном давлении. К остатку добавляли воду и затем смесь экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении с получением белого твердого вещества (113 мг, 28%). 1c) Синтез 2,3-дигидро-1 Н-пиридо[2,3-b][1,4]оксазина. 1 Н-пиридо[2,3-b][1,4]оксазин-2-он (113 мг, 0,75 ммоль) растворяли в тетрагидрофуране (3,5 мл) и затем охлаждали до 0 С. 1,0 М Литийалюминийгидрида, растворенного в тетрагидрофуране (1,5 мл, 1,5 ммоль), добавляли к смеси по каплям. После перемешивания в течение 2 ч при комнатной температуре добавляли 0,1 мл воды, 0,2 мл 10% водного раствора гидроксида натрия и 0,3 мл воды, в указанном порядке, при перемешивании. Осажденные вещества фильтровали и фильтрат экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении с получением бесцветной жидкости (90 мг, 88%). 1(1,5 мл) и затем охлаждали до -5 С. К смеси добавляли тионилхлорид (0,024 мл, 0,33 ммоль) и перемешивали при -5 С в течение 30 мин. К смеси добавляли 2,3-дигидро-1 Н-пиридо[2,3-b][1,4]оксазин, растворенный в N,N-диметилацетамиде (0,7 мл), и затем перемешивали при -5 С в течение 20 мин, а затем перемешивали при комнатной температуре в течение 15 ч. Добавляли воду и смесь экстрагировали дихлорметаном и затем (экстрагированный) объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем н-гексан:этилацетат=1:1. Фракции, содержащие продукт, собирали и упаривали с получением бледно-желтого твердого вещества (28 мг, 31%). 1 Н-ЯМР (CDCl3, 300 МГц);= 10,58 (с, 1 Н), 7,93 (дд, J=4,6 Гц, 1,5 Гц, 1 Н), 7,81-7,55 (м, 3 Н), 6,92a) Синтез 3-аминопиридин-4-ола. В 1000-мл колбе 3-нитропиридин-4-ол (11,6 г, 82,8 ммоль) растворяли в метаноле (800 мл) и затем добавляли 10% палладий на активированном угле (1,2 г, 10% мас./мас.). Реакционную смесь перемешивали в течение 3 ч в атмосфере водорода при комнатной температуре. Полученный реакционный раствор фильтровали через целит и затем упаривали при пониженном давлении с получением белого твердого вещества (9,4 г, количественный выход). 1b) Синтез 4 Н-пиридо[4,3-b][1,4]оксазин-3-она. В 500-мл колбе, снабженной обратным холодильником, 3-аминопиридин-4-ол (7,8 г, 71 ммоль) растворяли в N,N-диметилформамиде (350 мл). К реакционному раствору добавляли хлорацетилхлорид (6,2 мл, 78 ммоль) по каплям при комнатной температуре и затем перемешивали при комнатной температуре в течение 30 мин. К смеси добавляли карбонат калия (24 г, 177 ммоль) и смесь нагревали при 100 С в течение 40 ч. После завершения реакции к смеси добавляли воду. Смесь экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали путем перекристаллизации из растворителей этилацетата и н-гексана с получением белого твердого вещества (5,6 г, 53%). 1 Н-ЯМР (DMCO-d6, 300 МГц);= 10,90 (с, 1 Н), 8,06-8,04 (м, 2 Н), 6,96 (д, J=5,3 Гц, 1 Н), 4,71 (с, 2 Н). МС (ESI); 150,8 (М 1).c) Синтез 3,4-дигидро-2 Н-пиридо[4,3-b][1,4]оксазина. 4 Н-пиридо[4,3-b][1,4]оксазин-3-он (4,3 г, 28 ммоль) растворяли в тетрагидрофуране (140 мл) и затем охлаждали до 0 С. К смеси добавляли 1,0 М литийалюминийгидрида, растворенного в тетрагидрофуране (57 мл, 57 ммоль) по каплям. После перемешивания в течение 2 ч при комнатной температуре добавляли 1,4 мл воды, 2,8 мл 10% водного раствора гидроксида натрия и 4,2 мл воды, в указанном порядке, при перемешивании. Осажденные вещества фильтровали и фильтрат экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на аминовом силикагеле, используя дихлорметан в качестве элюирующего растворителя. Фракции, содержащие продукт,собирали и упаривали с получением бесцветной жидкости (3,5 г, 91%). 1(0,51 мл, 3,7 ммоль) и затем перемешивали при комнатной температуре в течение 5 ч. После нейтрализации 1 н. раствором хлористо-водородной кислоты смесь экстрагировали дихлорметаном и объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем дихлорметан:метанол=20:1. Фракции, содержащие продукт, собирали и упаривали с получением целевого соединения 2 в виде белого твердого вещества (190 мг, 61%). 1H-ЯМР (CDCl3, 300 МГц);= 8,30 (с, 1 Н), 8,16 (д, J=5,7 Гц, 1 Н), 7,66 (с, 2 Н), 6,87 (д, J=5,3 Гц, 1 Н),4,44 (м, 2 Н), 4,01 (м, 2 Н), 3,93 (с, 3 Н). МС (ESI); 426,8 (М 1). Пример 3. Синтез (3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанона, соли бромноватой кислоты (соединение 3). В 20-мл колбе (3,5-дибром-4-метоксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон(310 мг, 0,72 ммоль), полученный в примере 2, растворяли в дихлорметане и затем охлаждали до 0 С. К смеси добавляли 1,0 М трибромида бора, растворенного в дихлорметане (4,3 мл, 4,3 ммоль), и затем перемешивали при 0 С в течение 10 ч. Полученное твердое вещество при добавлении н-гексана фильтровали, собирали и очищали путем перекристаллизации из метанола с получением целевого соединения 3 в виде белого твердого вещества (130 мг, 43%). 1 Н-ЯМР (DMCO-d6, 300 МГц);= 9,02 (с, 1 Н), 8,45 (д, 1 Н, J=6,5 Гц), 7,82 (с, 2 Н), 7,53 (д, 1 Н, J=6,5 Гц), 4,57 (м, 2 Н), 3,99 (м, 2 Н). МС (ESI);412,8 (М 1). Элементный анализ: C14H10Br2N2O3HBr С, 34,47; Н, 2,26; N, 5,63. Пример 4. Синтез (3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанона (соединение 4).(3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон, соль бромисто-водородой кислоты (45 мг, 0,091 ммоль), полученный в примере 3, добавляли в воду (5 мл) и нейтрализовали (рН 7) с использованием насыщенного раствора гидрокарбоната натрия и затем экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия Na2SO4,фильтровали и упаривали при пониженном давлении. Полученное твердое вещество перекристаллизовы- 20018521 вали из дихлорметана и н-гексана с получением целевого соединения 4 в виде белого твердого вещества(3,1 мл, 25,6 ммоль) и триэтиламин (8,9 мг, 63,9 ммоль), в указанном порядке, при комнатной температуре по каплям. Реакционный раствор перемешивали при комнатной температуре в течение 15 ч и реакцию гасили путем добавления воды. Органический слой экстрагировали этилацетатом и затем объединенный органический слой промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем дихлорметан:метанол=20:1. Фракции,содержащие продукт, собирали и упаривали с получением целевого соединения в виде белого твердого вещества (3,6 г, 95%). 1b) Синтез N-(3-гидрокси-4-пиридинил)-2,2-диметил пропионамида. 2,2-диметил-N-пиридин-4-ил-пропионамид (1,6 г, 8,977 моль) растворяли в безводном тетрагидрофуране (20 мл) в атмосфере азота и затем охлаждали до -78 С, затем к смеси добавляли по каплям 2,5 М раствор н-бутиллития (n-BuLi) в н-гексане (9 мл, 22,443 ммоль) и затем перемешивали при 0 С в течение 2,5 часов вплоть до образования желтых кристаллов. После охлаждения реакционной смеси до -78 С к смеси добавляли триметилбор (2,5 мл, 22,443 ммоль) по каплям в течение 10 мин и температуру повышали медленно до 0 С. После перемешивания в течение 2 ч к реакционному раствору добавляли по каплям уксусную кислоту (1,9 мл) и 30% мас./мас. водный раствор перекиси водорода при 0 С, а затем после перемешивания в течение 30 мин к смеси по каплям добавляли воду (1 мл) и затем перемешивали при комнатной температуре в течение 18 ч. Добавляли воду и смесь упаривали при пониженном давлении и остаток экстрагировали с использованием воды и 10% изопропанола/хлороформ. Объединенный органический слой обрабатывали активированным углем и фильтрат промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем дихлорметан:метанол=20:1. Фракции, содержащие продукт, собирали и упаривали с получением белого твердого вещества (1,16 г, 67%). 1c) Синтез 4-амино-3-пиридинола. При комнатной температуре N-(3-гидрокси-4-пиридинил)-2,2-диметилпропионамид (1,15 г, 5,921 ммоль) суспендировали путем добавления по каплям к 3 н раствору хлористо-водородной кислоты. Гетерогенный раствор нагревали при 90 С в течение 18 ч. Реакционную смесь охлаждали до 0 С и нейтрализовали путем добавления бн раствора гидроксида натрия по каплям и упаривали при пониженном давлении. Остаток растворяли в метаноле и затем фильтровали для удаления побочного продукта. Фильтрат упаривали при пониженном давлении с получением твердого вещества. Снова, полученное твердое вещество растворяли в этанольном растворе, фильтровали и упаривали при пониженном давлении с получением белого твердого вещества (660 мг, количественный выход). 1 Н-ЯМР (CD3OD, 300 МГц);= 7,42 (д, J=6,l Гц, 1 Н), 7,24 (с, 1 Н), 6,67 (д, J=6,l Гц, 1 Н).d) Синтез 1 Н-пиридо[3,4-b][1,4]-оксазин-2-она 4-амино-3-пиридинол (650 мг, 5,904 ммоль) растворяли в безводном N,N-диметилформамиде (15 мл) в атмосфере азота и к смеси добавляли раствор хлорацетилхлорида (0,52 мл, 6,494 ммоль) по каплям при комнатной температуре и затем перемешивали в течение 30 мин. Затем к смеси добавляли карбонат калия (2,0 г, 14,760 ммоль) по каплям при комнатной температуре и реакционную смесь нагревали при 100 С в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли воду для гашения реакции. Органический слой экстрагировали этилацетатом и объединенный органический слой промывали водой и насыщенным солевым раствором,сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении с получением белого твердого вещества. Полученное белое твердое вещество перекристаллизовывали из этилацетата и н-гексана с получением белого твердого вещества (520 мг, 59%). 1 не (20 мл) в атмосфере азота и затем охлаждали до 0 С. К смеси добавляли по каплям 1,0 М литийалюминийгидрида, растворенного в тетрагидрофуране (6,8 мл, 6,794 ммоль). Смесь перемешивали в течение 30 мин и температуру повышали до комнатной температуры и затем смесь перемешивали в течение 1 ч. После завершения реакции смесь снова охлаждали до 0 С и затем добавляли по каплям воду (0,25 мл),10% водный раствор гидроксида натрия (0,5 мл) и воду (0,8 мл), в указанном порядке, и полученный раствор интенсивно перемешивали при комнатной температуре в течение 1 ч. Образовавшееся твердое вещество фильтровали и промывали избыточным количеством этилацетат и затем фильтрат промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении с получением белого твердого вещества (300 мг, 65%). 1f) Синтез (3,5-дибром-4-метоксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанона. С использованием такого же способа, как на стадии d) примера 2, 2,3-дигидро-1 Н-пиридо[3,4-b][1,4]-оксазин (180 мг, 0,587 ммоль) и 3,5-дибром-4-метокси-бензоилхлорид (193 мг, 0,587 ммоль) подвергали взаимодействию с получением целевого соединения 5, (3,5-дибром-4-метоксифенил)-(2,3 дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанона, в виде белого твердого вещества (85 мг, 34%). 1 Н-ЯМР (DMCO-d6, 300 МГц);= 8,23 (с, 1 Н), 7,99 (д, J=5,7 Гц, 1 Н), 7,92 (с, 2 Н), 7,56 (м, 1 Н), 4,33(3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1 ил)метанона (соединение 6). С использованием такого же способа, как в примере 3, (3,5-дибром-4-метоксифенил)-(2,3 дигидропиридо[3,4-b][1,4]оксазин-1-ил) метанон (60 мг, 0,140 ммоль) и 1 М раствор трибромида бора(0,84 мл, 0,840 ммоль) подвергали взаимодействию и затем реакционную смесь нейтрализовали (рН=7) с использованием насыщенного раствора гидрокарбоната натрия и экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении с получением твердого вещества. Полученное твердое вещество перекристаллизовывали из дихлорметана и н-гексана с получением целевого соединения 6, (3,5-дибром-4 гидроксифенил)-(2,3-дигидро-пиридо[3,4-b][1,4]оксазин-1-ил)метанона, в виде белого твердого веществаa) Синтез 3-амино-6-метилпиридин-2-ола 6-гидрокси-5-нитро-2-пиколин (500 мг, 3,247 ммоль) растворяли в метаноле: дихлорметане (5:1, 60 мл) и к смеси медленно добавляли 10% палладий на активированном угле и затем перемешивали в течение 2 ч при добавлении газообразного водорода при комнатной температуре. Реакционную смесь фильтровали с использованием целита и упаривали при пониженном давлении с получением количественного выхода белого твердого вещества (400 мг). 1 Н-ЯМР (CDCl3, 300 МГц);= 11,67 (ушир.с, 1 Н), 6,57 (д, J=7,2 Гц, 1 Н), 5,88 (д, J=7,2 Гц, 1 Н), 3,20b) Синтез 6-метил-1 Н-пиридо[2,3-b][1,4]оксазин-2-она. С использованием такого же способа, как на стадии d) примера 5, 3-амино-6-метилпиридин-2-олc) Синтез 6-метил-2, 3-дигидро-1 Н-пиридо[2,3-b][1,4]оксазина. С использованием такого же способа, как на стадии е) примера 5,6-метил-1 Н-пиридо[2,3-b][1,4]оксазин-2-он (230 мг, 1,401 ммоль) подвергали взаимодействию с 1,0 М литийалюминийгидрида,растворенного в тетрагидрофуране (3,0 мл, 3,082 ммоль), с получением целевого соединения, 6-метил 2,3-дигидро-1 Н-пиридо[2,3-b][1,4]оксазина, в виде белого твердого вещества (160 мг, 76%). 1d) Синтез (3,5-дибром-4-гидроксифенил)-(6-метил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)метанона. С использованием такого же способа, как на стадии d) примера 1,6-метил-2,3-дигидро-1 Нпиридо[2,3-b][1,4]оксазин (50 мг, 0,333 ммоль), тионилхлорид (53 мкл, 0,733 ммоль) и 3,5-дибром-4 гидроксибензоилхлорид (197 мг, 0,666 ммоль) подвергали взаимодействию с получением целевого соединения 8, (3,5-дибром-4-гидроксифенил)-(6-метил-2,3-дигидро-1 Н-пиридо[2,3-b][1,4]оксазин-1-ил) метанона, в виде белого твердого вещества (40 мг, 28%). 1a) Синтез 3-аминопиридин-4-ола. С использованием такого же способа, как на стадии а) примера 2,3-нитропиридин-4-ол (3,0 г, 21 ммоль) восстанавливали при помощи палладия на активированном угле с получением 3-аминопиридин 4-ола (2,4 г, количественный выход). 1b) Синтез 2,2-диметил-4 Н-пиридо[4,3-b][1,4]оксазин-3-она. С использованием такого же способа, как на стадии b) примера 2, 3-аминопиридин-4-ол (300 мг, 2,7 ммоль) подвергали взаимодействию с 2-бром-2-метилпропионилбромидом (0,37 мл, 3,0 ммоль) с получением 2,2-диметил-4 Н-пиридо[4,3-b][1,4]оксазин-3-она (122 мг, 25%). 1c) Синтез 2,2-диметил-3,4-дигидро-2 Н-пиридо[4,3-b][1,4]оксазина. С использованием такого же способа, как на стадии с) примера 2, 2,2-диметил-4 Н-пиридо[4,3-b]d) Синтез (3,5-дибром-4-метоксифенил)(2,2-диметил-2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил) метанона. С использованием такого же способа, как на стадии d) примера 2,2,2-диметил-3,4-дигидро-2 Нпиридо[4,3-b][1,4]оксазин (60 мг, 0,36 ммоль) подвергали взаимодействию с 3,5-дибром-4-метоксибензоилхлоридом (120 мг, 0,36 ммоль) с получением целевого соединения, (3,5-дибром-4-метоксифенил)(2,2-диметил-2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанона (73 мг, 44%). 1 Н-ЯМР (CDCl3, 300 МГц);= 8,36 (ушир.с, 1 Н), 8,17 (д, J=5,4 Гц, 1 Н), 7,66 (с, 2 Н), 6,83 (д, J=5,4 Гц, 1 Н), 3,9 (с, 3 Н), 3,7 (ушир.с, 2 Н), 1,4 (с, 6 Н). МС (ESI); 454,9 (М 1).e) Синтез (3,5-дибром-4-гидроксифенил)-(2,2-диметил-2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил) метанона. С использованием такого же способа, как в примере 6, (3,5-дибром-4-метоксифенил)-(2,2-диметил 2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон (70 мг, 0,15 ммоль) подвергали взаимодействию с 1 М раствором трибромида бора (0,9 мл, избыточное количество) с получением целевого соединения 8,(3,5-дибром-4-гидроксифенил)-(2,2-диметил-2,3-дигидропиридо [4,3-b][1,4]оксазин-4-ил) метанона (33 мг, 49%). 1(с, 2 Н), 6,92 (д, J=5,7 Гц, 1 Н), 3,73 (ушир.с, 2 Н) 1,26 (с, 6 Н). МС (ESI); 440,9 (М 1). Пример 9. Синтез (7-циклопропил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)-(3,5-дибром-4 гидроксифенил)метанона (соединение 9). а) Синтез 7-циклопропил-1 Н-пиридо[2,3-b][1,4]оксазин-2-она. В 10-мл колбе 7-бром-1 Н-пиридо[2,3-b][1,4]оксазин-2-он (400 мг, 1,746 ммоль), циклопропилбороновую кислоту (165 мг, 1,921 ммоль), ацетат палладия (39,1 мг, 0,174 ммоль), трифенилфосфин (91,5 мг,0,349 ммоль) и карбонат калия (482,6 мг, 3,492 ммоль) растворяли в растворителе ацетонитрил/вода (6/1,4,2 мл/0,9 мл). Реакционную смесь перемешивали в течение 60 мин при 100 С с использованием микроволнового (100 Вт) устройства. После охлаждения до комнатной температуры реакционную смесь экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. Объединенный органический слой сушили над безводным сульфатом магния (MgSO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, используя в качестве элюирующего растворителя дихлорметан и этилацетат. Фракции, содержащие продукт,собирали и упаривали с получением смеси (40 мг, 0,8%), содержащей трифенил фосфоксид. 1 Н-ЯМР (CDCl3, 300 МГц);= 8,95 (с, 1 Н), 7,72 (д, J=l,8 Гц, 1 Н), 6,82 (д, J=2,l Гц, 1 Н), 4,77 (с, 2 Н),1,80-1,87 (м, 1 Н), 0,64-0,99 (м, 2 Н), 0,57-0,63 (м, 2 Н).b) Синтез 7-циклопропил-2,3-дигидро-1 Н-пиридо[2,3-b][1,4]оксазина. 7-Циклопропил-1 Н-пиридо[2,3-b][1,4]оксазин-2-он (40 мг, 0,052 ммоль) растворяли в 1 мл безводного тетрагидрофурана в атмосфере азота и затем охлаждали до 0 С. К смеси добавляли 1,0 М литийалюминийгидрида, растворенного в тетрагидрофуране (0,1 мл, 0,104 ммоль), по каплям и затем перемешивали при комнатной температуре в течение 5 ч. К смеси добавляли воду (0,3 мл) по каплям. Полученный раствор упаривали при пониженном давлении с получением смеси, содержащей 7-циклопропил-2,3 дигидро-1 Н-пиридо[2,3-b][1,4]оксазин и трифенилфофсфоксид, в виде белого твердого вещества (10 мг).c) Синтез (7-циклопропил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)(3,5-дибром-4-метокси-фенил)метанона. В 10-мл колбе 7-циклопропил-2,3-дигидро-1 Н-пиридо[2,3-b][1,4]оксазин (10 мг, 0,057 ммоль) и 3,5 дибром-4-метоксибензоилхлорид (28 мг, 0,085 ммоль) растворяли в дихлорметане (1,2 мл). После охлаждения до 0 С к смеси добавляли триэтиламин (0,04 мл, 0,285 ммоль) и затем перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь нейтрализовали 1 н. раствором хлористо-водородной кислоты и экстрагировали дихлорметаном и затем объединенный органический слой сушили над безводным сульфатом магния (MgSO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, используя в качестве элюирующего растворителя этилацетат и н-гексан (1:1). Фракции, содержащие продукт, собирали и упаривали с получением целевого соединения в виде белого твердого вещества (9,0 мг, 33%). 1 Н-ЯМР (CDCl3, 300 МГц);= 7,86 (д, J=2,4 Гц, 1 Н), 7,45 (с, 2 Н), 7,21 (с, 1 Н), 4,43-4,47 (м, 2 Н),3,95-3,97 (м, 2 Н), 3,94 (с, 3 Н), 1,73-1,82 (м, 1 Н), 0,85-0,91 (м, 2 Н), 0,39-0,45 (м, 2 Н).d) Синтез (7-циклопропил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)-(3,5-дибром-4-гидроксифенил)метанона. В 10-мл колбе (7-циклопропил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)-(3,5-дибром-4-метоксифенил)метанон (9,0 мг, 0,019 ммоль) растворяли в дихлорметане и затем охлаждали до 0 С. К смеси добавляли 1,0 М трибромида бора, растворенного в дихлорметане (0,2 мл 2, 0,203 ммоль), и затем перемешивали при комнатной температуре в течение 16 ч. рН доводили до 6 при помощи 1 н. раствора гидроксида натрия, реакционную смесь экстрагировали дихлорметаном и объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении с получением твердого вещества. Полученное твердое вещество перекристаллизовывали из дихлорметана с получением белого твердого вещества (6,7 мг, 84%). 1 Н-ЯMR (DMCO-d6, 300 МГц);= 10,59 (с, 1 Н), 7,78 (д, J=2,1 Гц, 1 Н), 7,72 (с, 2 Н), 7,25 (с, 1 Н), 4,354,38 (м, 2 Н), 3,82-3,84 (м, 2 Н), 1,79-1,81 (м, 1 Н), 0,80-0,86 (м, 2 Н), 0,28-0,39 (м, 2 Н). МС (ESI); 452,8 (М 1). Пример 10. Синтез(3-хлор-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4 ил)метанона, соли бромисто-водородной кислоты (соединение 10). а) Синтез (3-хлор-4-метоксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанона. В 10-мл колбе 3,4-дигидро-2 Н-пиридо[4,3-b][1,4]оксазин (150 мг, 1,102 ммоль) и 3-хлор-4-метоксибензоил хлорид (249 мг, 1,212 ммоль) растворяли в дихлорметане. К смеси добавляли триэтиламин (0,77 мл, 5,510 ммоль) и затем перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь нейтрализовали 1 н. раствором хлористо-водородной кислоты, экстрагировали дихлорметаном и объединенный органический слой сушили над безводным сульфатом магния (MgSO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, используя в качестве элюирующего растворителя этилацетат. Фракции, содержащие продукт, собирали и упаривали с получением твердого вещества цвета слоновой кости (238 мг, 71%). 1b) Синтез (3-хлор-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанона, соли бромисто-водородной кислоты. В 10-мл колбе (3-хлор-4-метоксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон (100 мг, 0,328 ммоль) растворяли в дихлорметане и затем охлаждали до 0 С. К смеси добавляли 1,0 М трибромида бора, растворенного в дихлорметане (2,0 мл, 1,969 ммоль), и затем перемешивали при комнатной температуре в течение 16 ч. Твердое вещество, образованное при добавлении этилацетатного растворителя, фильтровали и собирали, и очищали путем перекристаллизации из дихлорметана с получением белого твердого вещества (45 мг, 47%). 1(м, 2 Н). МС (ESI); 291,2 (М 1). Пример 11. Синтез (3-бром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанона, соли бромисто-водородной кислоты (соединение 11). а) Синтез (3-бром-4-метоксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанона. К смеси 3,4-дигидро-2 Н-пиридо[4,3-b][1,4]оксазина (50 мг, 0,37 ммоль) и 3-бром-4-метоксибензойной кислоты (102 мг, 0,44 ммоль) добавляли оксихлорид фосфора (2 мл) и перемешивали при 100 С в течение 12 ч. Реакционную смесь охлаждали до 0 С, нейтрализовали насыщенным раствором гидрокарбоната натрия до рН 8-9 и экстрагировали этилацетатом. Затем объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем н-гексан:дихлорметан=1:1. Фракции, содержащие продукт, собирали и упаривали с получением белого твердого вещества (38 мг, 51%). 1b) Синтез (3-бром-4-гидроксифенил)-2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанона, соли бромисто-водородной кислоты. С использованием такого же способа, как в примере 3, (3-бром-4-метоксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон (30 мг, 0,086 ммоль) и 1 М раствор трибромида бора (0,86 мл,0,86 ммоль) подвергали взаимодействию с получением целевого соединения, (3-бром-4-гидроксифенил)(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанона, соли бромисто-водородной кислоты (26 мг, 72%). 1 Н-ЯМР (DMCO-d6, 300 МГц);= 11,1 (ушир.с, 1 Н), 8,97 (с, 1 Н), 8,42 (д, J=6,5 Гц, 1 Н), 7,78 (д, J=l,9 Гц, 1 Н), 7,54-7,44 (м, 2 Н), 7,05 (д, J=8,4 Гц, 1 Н), 4,56 (м, 2 Н), 4,01 (м, 2 Н). МС (ESI); 335,1 (М 1). Пример 12. Синтез (2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)-(4-гидрокси-3-трифторметилфенил)метанона (соединение 12). а) Синтез (2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)-(4-метокси-3-трифторметилфенил)метанона. В 50-мл колбе 3,4-дигидро-2 Н-пиридо[4,3-b][1,4]оксазин (1,0 г, 7,34 ммоль) и 3-трифторметил-4 метоксибензоилхлорид (2,1 г, 8,80 ммоль) растворяли в дихлорметане. К смеси добавляли триэтиламин(2,0 мл, 14,68 ммоль) и затем перемешивали при комнатной температуре в течение 4 ч. К реакционной смеси добавляли воду для гашения реакции и смесь экстрагировали дихлорметаном и объединенный органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем этилацетат:н-гексан=2:1. Фракции,содержащие продукт, собирали и упаривали с получением желтого твердого вещества (1,19 г, 80%). 1 Н-ЯМР (CDCl3, 300 МГц);= 8,41 (с, 1 Н), 8,08 (д, J=5, 7 Гц, 1 Н), 7,88 (дд, J=8,7 Гц, 2,1 Гц, 1 Н),7,82 (с, 1 Н), 7,36 (д, J=8,7 Гц, 1 Н), 6,96 (д, J=5,7 Гц, 1 Н), 4,42 (м, 2 Н), 3,96 (с, 3 Н), 3,93 (м, 2 Н). MC (ESI); 339,0 (Ml).b) Синтез (2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)-(4-гидрокси-3-трифторметилфенил)метанона. В 100-мл колбе 2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)-(4-метокси-3-трифторметилфенил)метанон (1,19 г, 3,52 ммоль) растворяли в дихлорметане. После охлаждения до 0 С к смеси добавляли 1,0 М трибромида бора, растворенного в дихлорметане (35,2 мл, 35,2 ммоль), и затем перемешивали при комнатной температуре в течение 10 ч. Твердое вещество, образованное путем добавления растворителя нгексана и воды, фильтровали. Неочищенное вещество очищали путем перекристаллизации из дихлорметана с получением белого твердого вещества. Полученное твердое вещество дополнительно очищали при помощи препаративной хроматографии высокого давления с использованием оборудования WatersLC/MS, используя в качестве элюирующего растворителя ацетонитрил и дистиллированную воду, содержащую 0,1% трифторуксусной кислоты (TFA), с получением соединения в форме соли трифторуксусной кислоты (TFA). Полученное соединение промывали 10% водным раствором гидрокарбоната натрия (NaHCO3) и экстрагировали дихлорметаном. Объединенный органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении с получением целевого соединения 12 в виде белого твердого вещества (13,52 мг, 1,2%). 1(М 1). Пример 13. Синтез (3,5-дихлор-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4 ил)метанона, соли бромисто-водородной кислоты (соединение 13). а) Синтез (3,5-дихлор-4-метоксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанона. К смеси 3,4-дигидро-2 Н-пиридо[4,3-b][1,4]оксазина (80 мг, 0,58 ммоль) и 3,5-дихлор-4-метоксибензойной кислоты (141 мг, 0,64 ммоль) добавляли оксихлорид фосфора (4 мл) и затем перемешивали при 100 С в течение 12 ч. Реакционную смесь охлаждали до 0 С и доводили до рН 8-9 с использованием насыщенного раствора гидрокарбоната натрия и экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия(Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем н-гексан:этилацетат=4:1. Фракции, содержащие продукт, собирали и упаривали с получением белого твердого вещества (107 мг, 54%). 1b) Синтез (3,5-дихлор-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанона, соли бромисто-водородной кислоты. С использованием такого же способа, как в примере 3, (3,5-дихлор-4-метоксифенил)-(2,3-дигидро- 25018521 пиридо[4,3-b][1,4]оксазин-4-ил)метанон (116 мг, 0,342 ммоль) подвергали взаимодействию с 1 М раствором трибромида бора (3,42 мл, 3,42 ммоль) с получением целевого соединения, (3,5-дихлор-4 гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанона, соли бромисто-водородной кислоты (65 мг, 67%). 1 Н-ЯМР (DMCO-d6, 300 МГц);= 11,0 (ушир.с, 1 Н), 9,04 (с, 1 Н), 8,46 (д, J=6,5 Гц, 1 Н), 7,66 (с, 2 Н),7,55 (д, J=6,5 Гц, 1 Н), 4,58 (м, 2 Н), 4,00 (м, 2 Н). MC (ESI); 325,0 (Ml). Пример 14. Синтез (3-хлор-4-гидрокси-5-нитрофенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4 ил)метанона (соединение 14).a) Синтез (3-хлор-4-метокси-5-нитрофенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанона. К оксихлориду фосфора (3,00 мл) добавляли 3,4-дигидро-2 Н-пиридо[4,3-b][1,4]оксазин (177 мг, 1,30 ммоль) и 3-хлор-4-метокси-5-нитробензойную кислоту (200 мг, 0,87 ммоль) и затем перемешивали при 95 С в течение 16 ч. После завершения реакции реакционную смесь выливали в ледяную воду и нейтрализовали насыщенным раствором гидроксида натрия и экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем дихлорметан:метанол=20:1. Фракции, содержащие продукт, собирали и упаривали с получением желтого твердого вещества (132 мг, 29%). 1 Н-ЯМР (DMCO-d6, 300 МГц);= 8,70 (ушир.с, 1 Н), 8,16 (д, J=l,9 Гц, 1 Н), 8,14-8,09 (м, 2 Н), 6,98 (д,J=53 Гц, 1 Н), 4,40 (м, 2 Н), 4,00 (с, 3 Н), 3,90 (м, 2 Н). MC (ESI); 350,1 (М 1).b) Синтез (3-хлор-4-гидрокси-5-нитрофенил)(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанона,соли бромноватой кислоты. В 20-мл колбе (3-хлор-4-метокси-5-нитрофенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон (132 мг, 0,38 ммоль) растворяли в дихлорметане и затем охлаждали до 0 С. К смеси добавляли 1,0 М трибромида бора, растворенного в дихлорметане (3 мл, 3,00 ммоль), и затем перемешивали при 0 С в течение 10 ч. После завершения реакции, концентрированную жидкость очищали при помощи ВЭЖХ. Полученное твердое вещество дополнительно очищали путем перекристаллизации из этанола с получением целевого соединения 14, (3-хлор-4-гидрокси-5-нитрофенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин 1-ил)метанона, в виде белого твердого вещества (80 мг, 63%). 1(д, J=2,7 Гц, 1 Н), 6,98 (д, 1 Н), 4,38 (м, 2 Н), 3,96 (м, 2 Н). МС (ESI); 336,1 (М 1). Пример 15. Синтез (3,5-дихлор-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанона, соли бромисто-водородной кислоты (соединение 15). С использованием такого же способа, как в примере 3, (3,5-дихлор-4-метоксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон (114 мг, 0,33 ммоль) подвергали взаимодействию с 1 М раствором трибромида бора (3,3 мл, 3,3 ммоль). Целевое соединение, (3,5-дихлор-4-гидроксифенил)-(2,3 дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон, соль бромисто-водородной кислоты, очищали путем перекристаллизации из этанола с получением коричневого твердого вещества (19,7 мг, 14%). 1H-ЯМР (DMCO-d6, 300 МГц);= 8,63 (с, 1 Н), 8,25 (д, J=6,5 Гц, 1 Н), 7,89 (д, J=6,5 Гц, 1 Н), 7,74 (с,2 Н), 4,44 (м, 2 Н), 3,98 (м, 2 Н). МС (ESI); 325,1 (М 1). Пример 16. Синтез (3-бром-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанона, соли бромисто-водородной кислоты (соединение 16). С использованием такого же способа, как в примере 3, (3-бром-4-метоксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон (68 мг, 0,19 ммоль) подвергали взаимодействию с 1 М раствором трибромида бора (1,9 мл, 1,9 ммоль). Целевое соединение, (3-бром-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон, соль бромисто-водородной кислоты, очищали путем перекристаллизации из этанола с получением коричневого твердого вещества (48,6 мг, 60%). 1(0,29 мл, 2,1 ммоль) и затем перемешивали при комнатной температуре в течение 2 ч. После нейтрализации 1 н. раствором хлористо-водородной кислоты, реакционную смесь экстрагировали дихлорметаном. Объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4) и фильтровали, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния с использованием в качестве растворителя этилацетат:н-гексан=1:2. Фракции, содержащие продукт, собирали и упаривали с получением желтого твердого вещества (118 мг, 81%). 1b) Синтез (3-хлор-4-гидрокси-5-нитрофенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанона,соли бромисто-водородной кислоты. В 20-мл колбе (3-хлор-4-метокси-5-нитрофенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон (109 мг, 0,31 ммоль) растворяли в дихлорметане и затем охлаждали до 0 С. К смеси добавляли 1,0 М трибромида бора, растворенного в дихлорметане (3,1 мл, 3,1 ммоль), и затем перемешивали при 0 С в течение 18 ч. Реакцию гасили, используя небольшое количество воды, и затем упаривали при пониженном давлении. Полученный остаток очищали путем перекристаллизации из метанола с получением желтого твердого вещества (67 мг, 52%). 1H-HMP (DMCO-d6, 300 МГц);= 8,67 (с, 1 Н), 8,27 (д, J=6,9 Гц, 1H), 8,24 (д, J=2,l Гц, 1H), 8,08 (д,J=l,8 Гц, 1 Н), 7,98 (д, J=6,6 Гц, 1H), 4,45 (м, 2H), 3,99 (м, 2 Н). МС (ESI); 336,0 (М 1). Пример 18. Синтез (3-хлор-4-гидроксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанона, соли бромисто-водородной кислоты (соединение 18). С использованием такого же способа, как в примере 3, (3-хлор-4-метоксифенил)-(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанон (100 мг, 0,328 ммоль) подвергали взаимодействию с 1 М раствором трибромида бора (3,28 мл, 3,28 ммоль) с получением целевого соединения, (3-хлор-4-гидроксифенил)(2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)метанона, соли бромисто-водородной кислоты, в виде белого твердого вещества (45 мг, 37%). 1H-ЯМР (DMCO-d6, 300 МГц);= 11,17 (с, 1 Н), 8,65 (с, 1 Н), 8,25 (д, J=6,4 Гц, 1 Н), 7,85 (д, J=6,4 Гц,1 Н), 7,75 (д, 7=2,1 Гц, 1 Н), 7,55 (дд, J=8,4, 2,1 Гц, 1 Н), 7,06 (д, J=8,4 Гц, 1 Н), 4,44 (м, 2 Н), 3,99 (м, 2 Н). МС (ESI); 291,1 (М 1). Пример 19. Синтез (2,3-дигидропиридо[3,4-b][1,4]оксазин-1-ил)-(4-гидрокси-3-трифторметилфенил)метанона (соединение 19). С использованием такого же способа, как на стадии b) примера 12, (2,3-дигидропиридо[3,4-b][1,4] оксазин-1-ил)-(4-метокси-3-трифторметилфенил)метанон (110 мг, 0,325 ммоль) подвергали взаимодействию с 1 М раствором трибромида бора (3,25 мл, 3,25 ммоль) с получением целевого соединения, (2,3 дигидропиридо[3,4-b][1,4]оксазин-1-ил)-(4-гидрокси-3-трифторметилфенил)метанона, в виде белого твердого вещества (11 мг, 10%). 1 Н-ЯМР (CD3OD, 300 МГц);= 8,16 (с, 1 Н), 7,85 (д, J=5,7 Гц, 1 Н), 7,81 (д, J=l,8 Гц, 1 Н), 7,66 (дд,J=8,4, 1,8 Гц, 1 Н), 7,32 (д, J=5,7 Гц, 1 Н), 7,00 (д, J=8,4 Гц, 1 Н), 4,37 (м, 2 Н), 3,98 (м, 2 Н). МС (ESI); 325,1(48 мг, 0,21 ммоль), фенилбороновую кислоту (PhB(OH)2, 28 мг, 0,23 ммоль), трифенилфосфин (PPh3, 11 мг, 0,04 ммоль), ацетат палладия (Pd(OAc)2, 5 мг, 0,02 ммоль), карбонат калия (44 мг, 0,31 ммоль) растворяли в ацетонитриле (1,6 мл) и воде (0,4 мл). Смесь нагревали до 90 С и затем подвергали кипячению с обратным холодильником в течение 15 ч. Смесь упаривали и добавляли воду и затем смесь экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия(Na2SO4), фильтровали и упаривали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем дихлорметан:метанол=30:1. Фракции,содержащие продукт, собирали и упаривали с получением бледно-коричневого твердого вещества (21 мг,44%). МС (ESI); 227,1 (М 1).b) Синтез 7-фенил-2,3-дигидро-1 Н-пиридо[2,3-b][1,4]оксазина. 7-Фенил-1 Н-пиридо[2,3-b][1,4]оксазин-2-он (21 мг, 0,09 ммоль) растворяли в тетрагидрофуране (0,5 мл) и затем охлаждали до 0 С. К смеси добавляли 1,0 М литийалюминийгидрида, растворенного в тетрагидрофуране (0,19 мл, 0,19 ммоль), по каплям. После перемешивания в течение 5 ч при комнатной температуре добавляли 0,1 мл воды, 0,2 мл 10% водного раствора гидроксида натрия и 0,3 мл воды, в указанном порядке, при перемешивании. Осажденные вещества фильтровали и фильтрат экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4),фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем дихлорметан:метанол=40:1. Фракции, содержащие продукт,собирали и упаривали с получением бледно-серого твердого вещества (10 мг, 50%). МС (ESI); 213,0c) Синтез (3,5-дибром-4-метоксифенил)(7-фенил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)метанона В 5-мл колбе 7-фенил-2,3-дигидро-1 Н-пиридо[2,3-b][1,4]-оксазин (10 мг, 0,05 ммоль) и 3,5-дибром 4-метокси-бензоилхлорид (17 мг, 0,05 ммоль) растворяли в дихлорметане. К смеси добавляли триэтиламин (0,02 мл, 0,14 ммоль) и затем перемешивали при комнатной температуре в течение 1 ч. После нейтрализации 1 н раствором хлористо-водородной кислоты, смесь экстрагировали дихлорметаном и объе- 27018521 диненный органический слой сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния,элюируя растворителем дихлорметан:метанол=40:1. Фракции, содержащие продукт, собирали и упаривали с получением белого твердого вещества (14 мг, 59%). МС (ESI); 503,0 (М 1).d) Синтез (3,5-дибром-4-гидроксифенил)-(7-фенил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил)метанона. В 5-мл колбе (3,5-дибром-4-метоксифенил)-(7-фенил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1-ил) метанон (14 мг, 0,03 ммоль) растворяли в дихлорметане и затем охлаждали до 0 С. К смеси добавляли 1,0 М трибромида бора, растворенного в дихлорметане (0,17 мл, 0,17 ммоль), и затем перемешивали при 0 С в течение 15 ч. После завершения реакции к смеси добавляли воду, смесь экстрагировали этилацетатом и объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем дихлорметан:метанол=40:1. Фракции, содержащие продукт, собирали и упаривали с получением целевого соединения 20 в виде белого твердого вещества (8,7 мг, 64%). 1H-HMP (DMCO-d6, 300 МГц);= 10,53 (ушир.с, 1 Н), 8,23 (д, 1 Н, J=2,28 Гц), 8,02 (с, 1 Н), 7,79 (с,2 Н), 7,43-7,32 (м, 5 Н), 4,45 (м, 2 Н), 3,92 (м, 2 Н). МС (ESI); 488,9 (М 1). Пример 21. Синтез 2,6-дихлор-4-(2,3-дигидропиридо[4,3-b][1,4]-оксазин-4-сульфонил)фенола (соединение 21). В 5-мл колбе, 3,4-дигидро-2 Н-пиридо[4,3-b][1,4]оксазин (30 мг, 0,220 ммоль) растворяли в тетрагидрофуране (3 мл). Добавляли диизопропилэтиламин (0,153 мл, 0,878 ммоль) и затем перемешивали при 0 С в течение 10 мин, затем к смеси добавляли 3,5-дихлор-4-гидроксибензолсульфонилхлорид (69 мг,0,264 ммоль) и затем перемешивали при 0 С в течение 1 ч. Реакционную смесь упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем дихлорметан:этилацетат=1:2. Фракции, содержащие продукт, собирали и упаривали с получением целевого соединения 21 в виде бледно-желтого твердого вещества (2,7 мг, 3,4%). 1 Н-ЯМР (CD3OD, 300 МГц);= 8,80 (с, 1 Н), 8,12 (д, J=5,3 Гц, 1 Н), 7,38 (с, 2 Н), 6,90 (д, J=5,3 Гц,1 Н), 3,86-3,84 (ушир.с, 4 Н). МС (ESI); 361,0 (М 1). Пример 22. Синтез (3,5-дибром-4-гидроксифенил)-(7-трифторметил-2,3-дигидропиридо[2,3-b][1,4] оксазин-1-ил)метанона (соединение 22-2). а) Синтез 2-хлор-3-нитро-5-трифторметилпиридина В 25-мл колбе, 3-нитро-5-трифторметилпиридин-2-ол (300 мг, 1,44 ммоль) растворяли в ацетонитриле (4,5 мл) и затем к смеси добавляли оксихлорид фосфора (0,4 мл, 4,33 ммоль) и бензилтриметиламмонийхлорид (164 мг, 0,721 ммоль). Смесь перемешивали в течение 3 ч при 80 С. После завершения реакции к смеси добавляли воду и смесь экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4),фильтровали и упаривали при пониженном давлении с получением белого твердого вещества (300 мг,92%). 1 Н-ЯМР (DMCO-d6, 300 МГц);= 9,21 (с, 1 Н), 9,08 (с, 1 Н).b) Синтез метилового эфира (3-нитро-5-трифторметилпиридин-2-илокси)уксусной кислоты. В 10-мл колбе метиловый эфир оксиуксусной кислоты (0,4 мл, 0,53 ммоль) растворяли в тетрагидрофуране (1,5 мл) и затем к смеси добавляли гидрид натрия (23 мг, 0,57 ммоль). Через 40 мин добавляли 2-хлор-3-нитро-5-трифторметилпиридин (100 мг, 0,44 ммоль) и затем перемешивали в течение 2 ч при комнатной температуре. После завершения реакции к смеси добавляли воду и смесь экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4),фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем н-гексан:этилацетат=9:1. Фракции, содержащие продукт, собирали и упаривали с получением белого твердого вещества (84 мг, 68%). 1 Н-ЯМР (DMCO-d6, 300 МГц);= 8,95 (с, 1 Н), 8,92 (с, 1 Н), 5,23 (с, 2 Н), 3,69 (с, 3 Н).c) Синтез 7-трифторметил-1 Н-пиридо[2,3-b][1,4]оксазин-2-она. В 10-мл колбе метиловый эфир (3-нитро-5-трифторметилпиридин-2-илокси)уксусной кислоты (84 мг, 0,30 ммоль) растворяли в концентрированной хлористо-водородной кислоте (1,5 мл) и затем к смеси добавляли тетрахлорид олова (227 мг, 1,2 ммоль). Смесь перемешивали в течение 30 мин при 80 С. После завершения реакции к смеси добавляли воду при комнатной температуре и смесь экстрагировали с использованием в качестве растворителя метанол:дихлорметан=1:9. Объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем метанол:дихлорметан=1:50. Фракции, содержащие продукт, собирали и упаривали с получением белого твердого вещества (40 мг, 62%). 1 Н-ЯМР (DMCO-d6, 300 МГц);= 11,1 (с, 1 Н), 8,19 (с, 1 Н), 7,40 (с, 1 Н), 4,91 (с, 2 Н). МС (ESI); 219 В 5-мл колбе 7-трифторметил-1 Н-пиридо[2,3-b][1,4]оксазин-2-он (60 мг, 0,28 ммоль) растворяли в тетрагидрофуране (1,0 мл) и затем к смеси добавляли 1,0 М литийалюминийгидрида, растворенного в тетрагидрофуране (0,33 мл, 0,33 ммоль), по каплям и перемешивали в течение 1 ч при 0 С. Добавляли воду и насыщенный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем метанол:дихлорметан=1:50. Фракции, содержащие продукт, собирали и упаривали с получением белого твердого вещества (29 мг, 52%). 1 Н-ЯМР (DMCO-d6, 300 МГц);= 7,69 (ушир.с, J=2,29 Гц, 1 Н), 7,10 (ушир.с, J=2,29 Гц, 1 Н), 6,486,54 (м, 1 Н), 4,31-4,37 (м, 2 Н), 3,33-3,39 (м, 2 Н). МС (ESI); 205 (М 1). е) Синтез (3,5-дибром-4-метоксифенил)-(7-трифторметил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1 ил)метанона (соединение 22-1). В 5-мл колбе 7-трифторметил-2,3-дигидро-1 Н-пиридо[2, 3-b][1,4]оксазин (27 мг, 0,23 ммоль) и 3,5 дибром-4-метокси-бензоилхлорид (65 мг, 0,20 ммоль) растворяли в дихлорметане (0,6 мл) и затем к смеси добавляли триэтиламин (0,55 мл, 0,33 ммоль) по каплям при 0 С. После перемешивания в течение 4 ч при комнатной температуре добавляли воду и смесь экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем метанол:дихлорметан=1:100. Фракции, содержащие продукт, собирали и упаривали с получением белого твердого вещества (64 мг, 98%). 1f) Синтез (3,5-дибром-4-гидроксифенил)-(7-трифторметил-2,3-дигидропиридо[2,3-b][1,4]оксазин-1 ил)метанона (соединение 22-2). В 5-мл колбе (3,5-дибром-4-метоксифенил)-(7-трифторметил-2,3-дигидропиридо[2,3-b][1,4]оксазин 1-ил)метанон (30 мг, 0,061 ммоль) растворяли в N,N-диметилформамиде (0,3 мл) и затем добавляли бромид лития (10 мг, 0,12 ммоль) и пиперазин (7,8 мг, 0,091 ммоль). После перемешивания в течение 1 ч растворитель удаляли выпариванием при пониженном давлении. Остаток нейтрализовали водой и 1 н. раствором хлористо-водородной кислоты. Полученное твердое вещество фильтровали с получением целевого соединения 22-2 в виде белого твердого вещества (25 мг, 86%). 1(м,2 Н), 3,86-3,93 (м, 2 Н). МС (ESI); 480,8 (М 1). Пример 23. Синтез 2,5-дибром-4-(2,3-дигидропиридо[4,3-b][1,4]-оксазин-4-карбонил)бензойной кислоты (соединение 23). В 20-мл колбе 2,5-дибромтерефталевую кислоту (100 мг, 0,31 ммоль) и N,N-диметилформамид (3 капли) растворяли в тионилхлориде (2 мл). После перемешивания в течение 2 ч при 80 С реакционную смесь охлаждали до комнатной температуры и концентрировали. Неочищенный дихлорид 2,5-дибромтерефталевой кислоты (112 мг, 0,31 ммоль) растворяли в дихлорметане (6 мл) и добавляли к 3,4-дигидро 2 Н-пиридо[4,3-b][1,4]оксазину (20,9 мг, 0,15 ммоль), растворенному в дихлорметане (1 мл). К смеси медленно добавляли триэтиламин (3 капли) и перемешивали при комнатной температуре в течение 16 ч. После завершения реакции остаток очищали препаративной ЖХ/Mass с получением целевого соединения 23, т.е., 2,5-дибром-4-(2,3-дигидро-пиридо [4,3-b][1,4]оксазин-4-карбонил)бензойной кислоты, в виде белого твердого вещества (23 мг, 5%). 1H-ЯМР (CD3OD, 300 МГц);= 9,70 (с, 1 Н), 8,47 (д, J=1,2 Гц, 1 Н), 7,83 (д, J=12,6 Гц, 2 Н), 7,58 (д,J=6,9 Гц, 1 Н), 4,72 (м, 2 Н), 4,12-3,88 (м, 2 Н). МС (ESI); 440,9 (М 1). Пример 24. Синтез метилового эфира (2,6-дибром-4-(2,3-дигидропиридо[4,3-b][1,4]-оксазин-4 карбонил)фенокси]уксусной кислоты (соединение 24). В 25-мл колбе (3,5-дибром-4-гидроксифенил)-(2,3-дигидропиридо[4,3-b][1,4]оксазин-4-ил)метанон(100 мг, 0,24 ммоль) растворяли в N,N-диметилформамиде (2,4 мл) и к смеси добавляли карбонат калия(37 мг, 0,266 ммоль) по каплям при комнатной температуре. После перемешивания при комнатной температуре в течение 10 мин добавляли по каплям бром-метилацетат и затем перемешивали в течение 40 мин при комнатной температуре. Реакционную смесь фильтровали через целит и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния, элюируя растворителем дихлорметан:метанол=20:1, с получением целевого соединения 24 в виде белого пенистого вещества (48 мг, 41,0%). 1
МПК / Метки
МПК: C07D 498/04
Метки: производные, гетероциклические
Код ссылки
<a href="https://eas.patents.su/30-18521-geterociklicheskie-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероциклические производные</a>
Предыдущий патент: Защитное укупорочное устройство для емкости, в частности для бутылки для жидкостей
Следующий патент: Способ мониторинга технического состояния компрессорного агрегата
Случайный патент: Полиморфная, кристаллическая и мезофазная формы 2-(5-бром-4-(4-циклопропилнафталинил-1-ил)-4н-1,2,4-триазол-3-илтио)ацетата натрия и их применение












