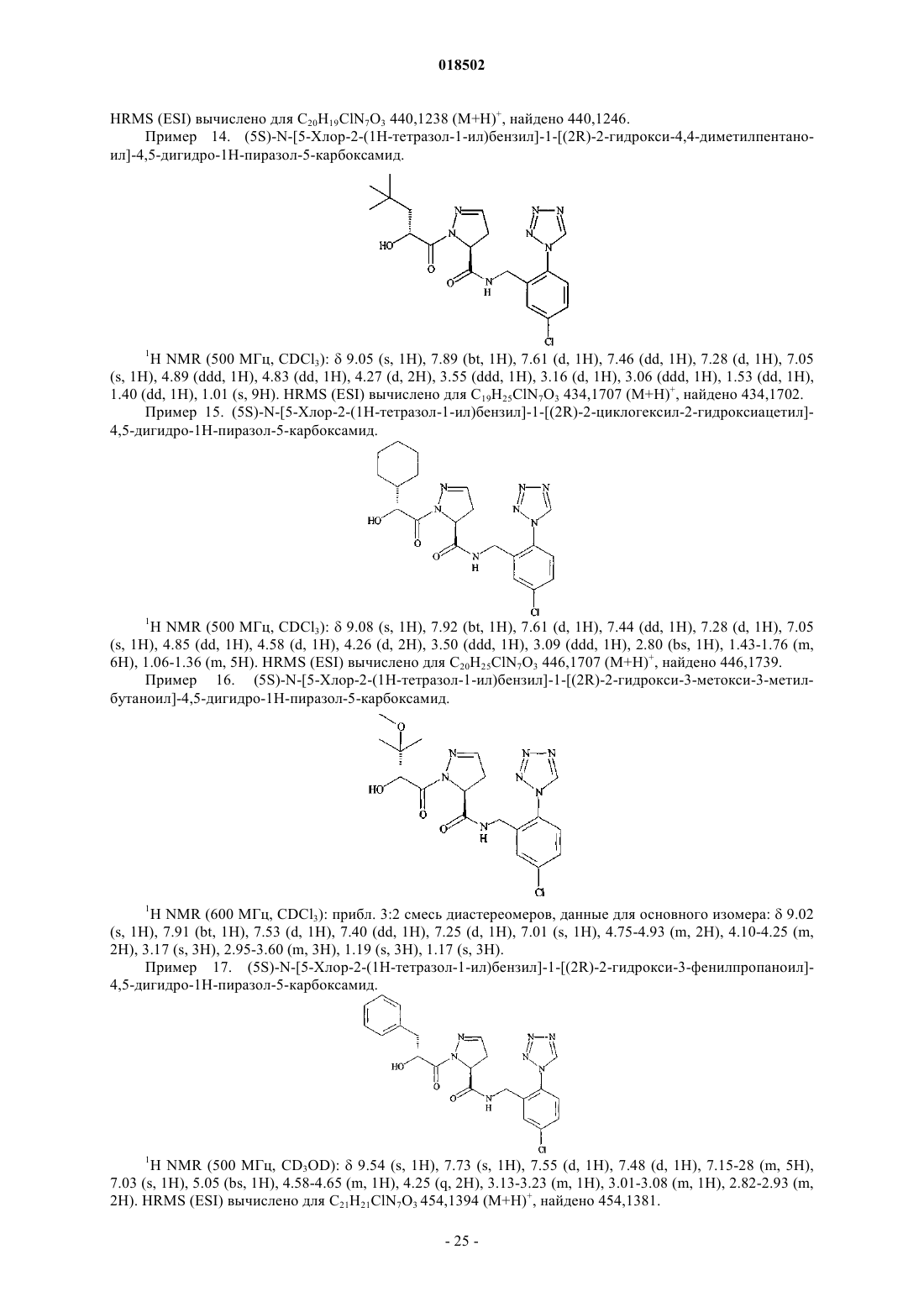
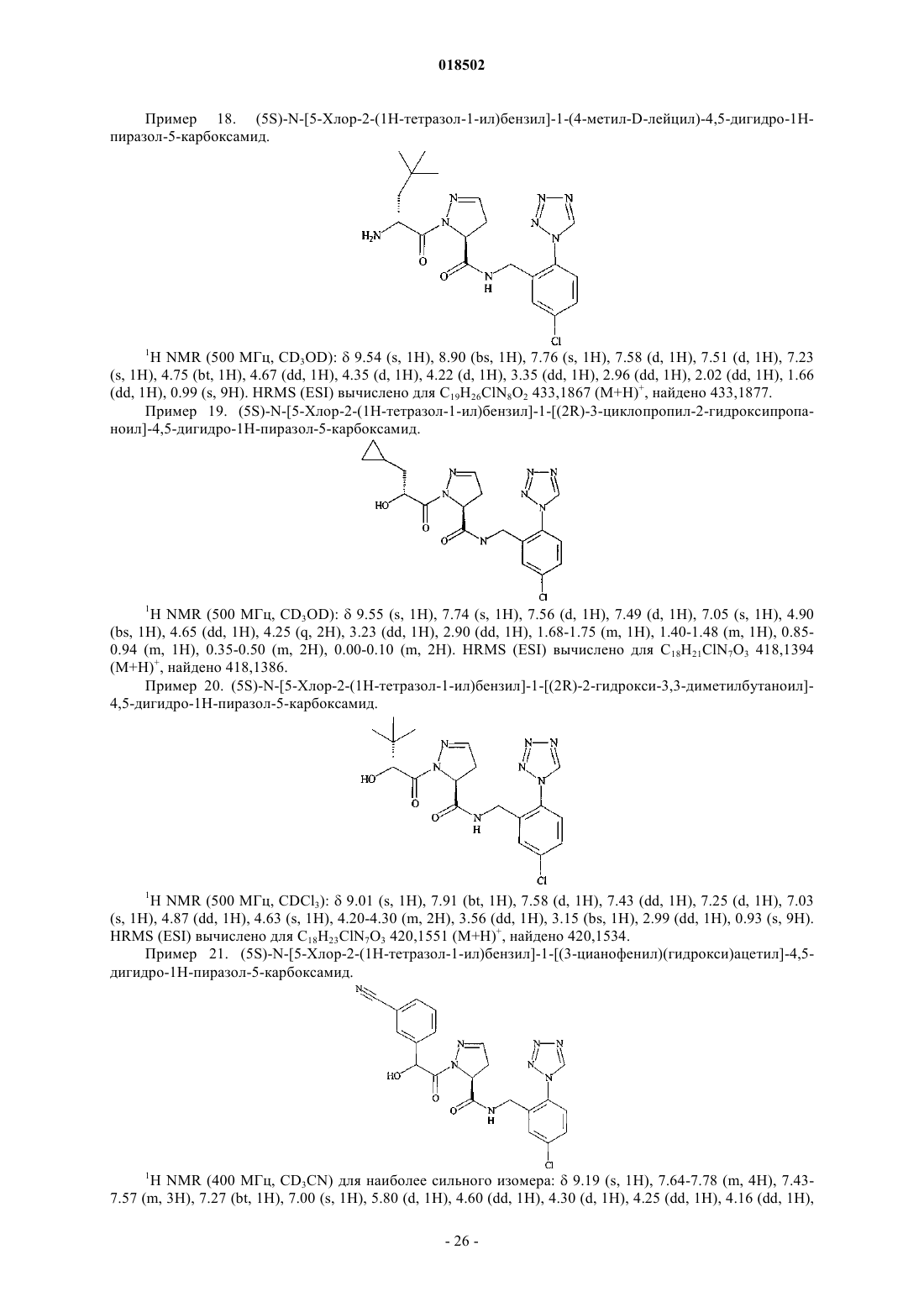
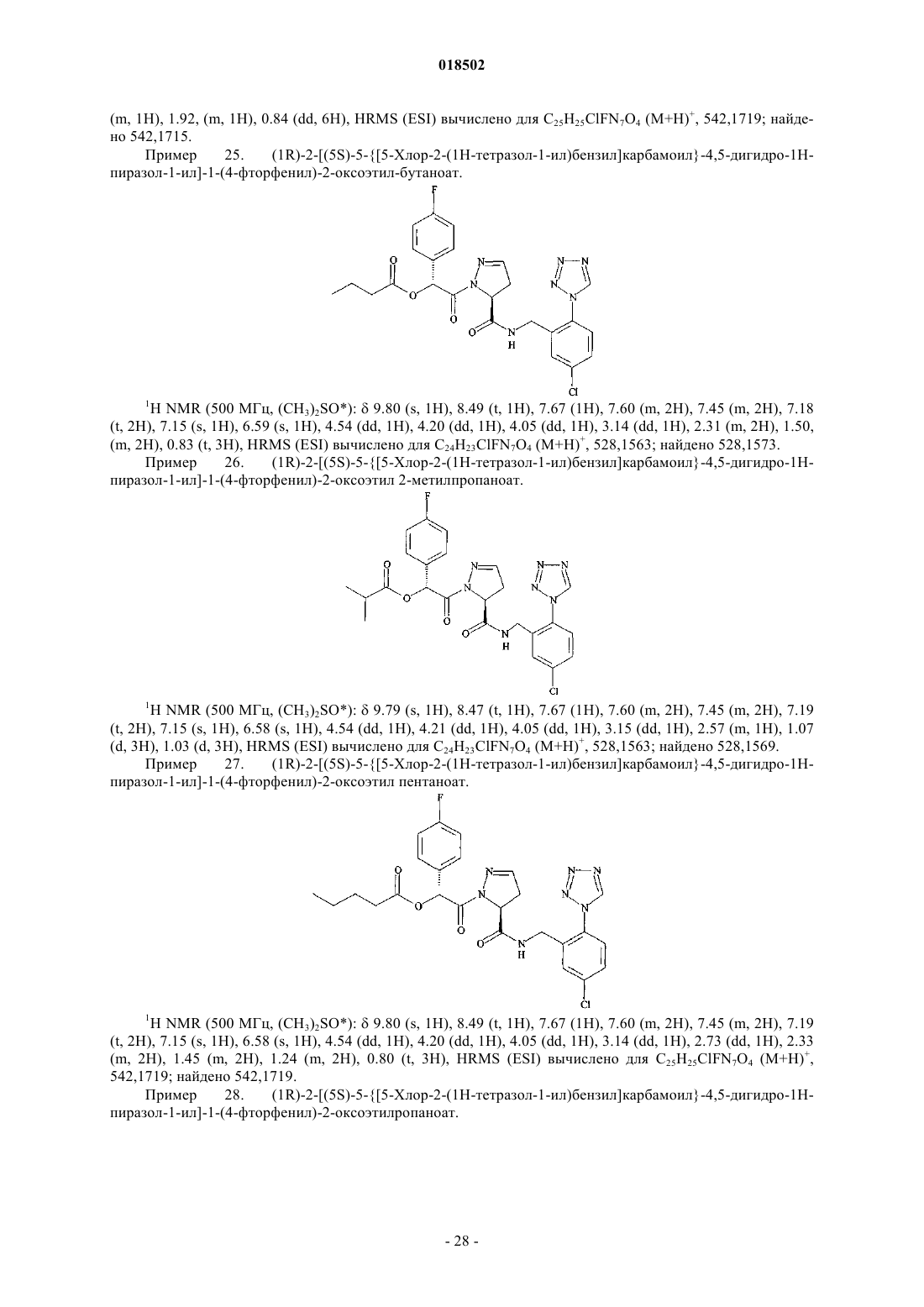
Новые гетероциклические карбоксамиды и фармацевтические композиции, содержащие их
Номер патента: 18502
Опубликовано: 30.08.2013
Авторы: Брональт Йонас, Полла Магнус, Нильссон Ингемар, Густафссон Давид
Формула / Реферат
1. Соединение, представляющее собой (5S)-N-[5-хлор-2-(1Н-тетразол-1-ил)бензил]-1-[(2R)-2-(4-фторфенил)-2-гидроксиацетил]-4,5-дигидро-1Н-пиразол-5-карбоксамид
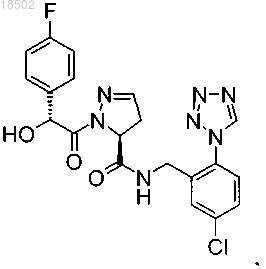
или фармацевтически приемлемая соль указанного соединения.
2. Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль по п.1 в смеси по меньшей мере с одним фармацевтически приемлемым носителем, эксципиентом или разбавителем.
3. Соединение, представляющее собой (1R)-2-[(5S)-5-{[5-хлор-2-(1Н-тетразол-1-ил)бензил]карбамоил}-4,5-дигидро-1Н-пиразол-1-ил]-1-(4-фторфенил)-2-оксоэтилпропаноат
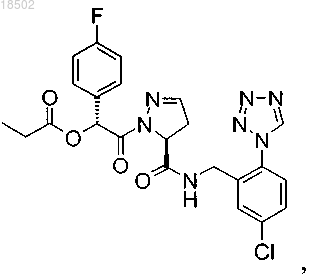
или фармацевтически приемлемая соль указанного соединения.
4. Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль по п.3 в смеси по меньшей мере с одним фармацевтически приемлемым носителем, эксципиентом или разбавителем.
Текст
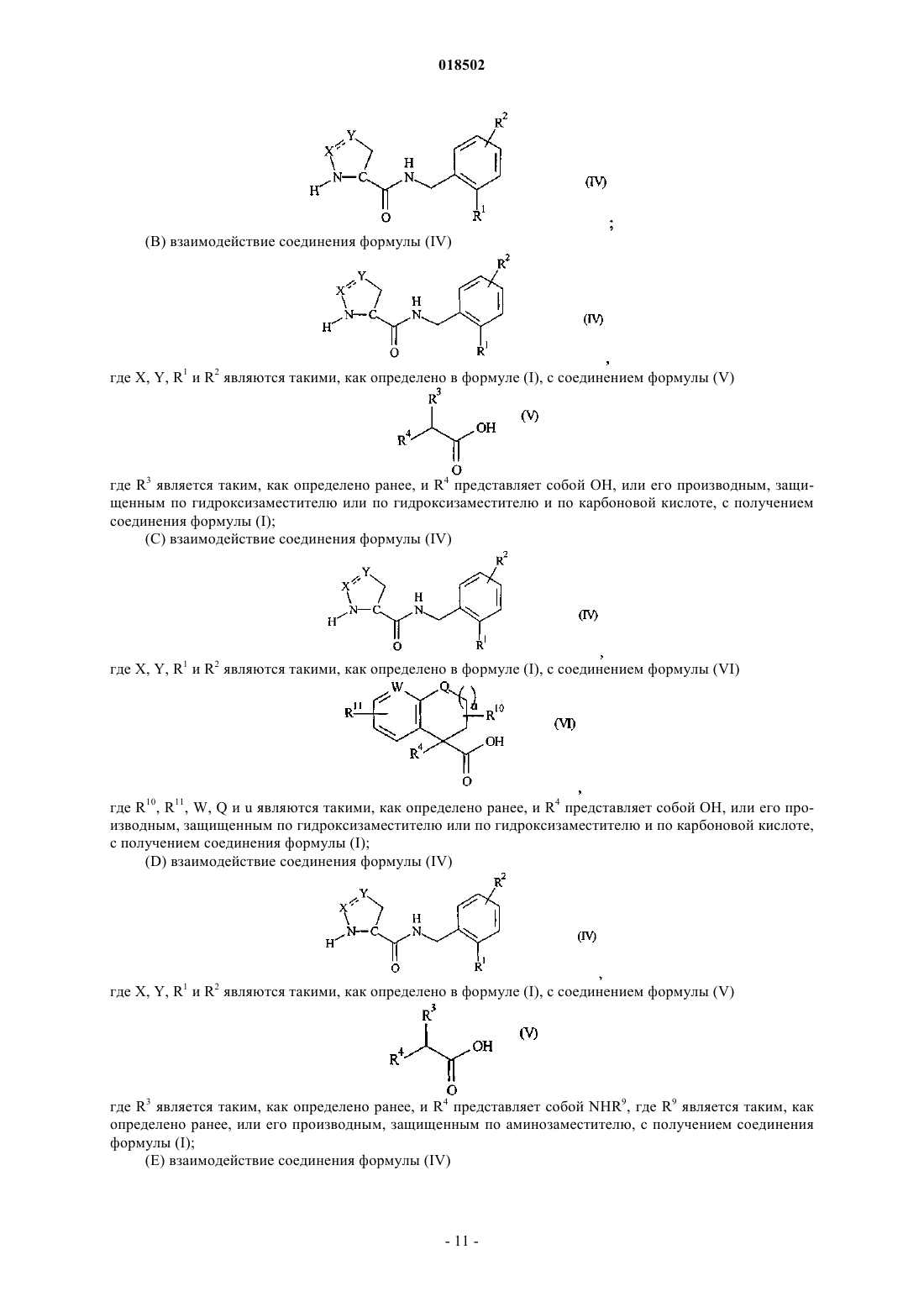
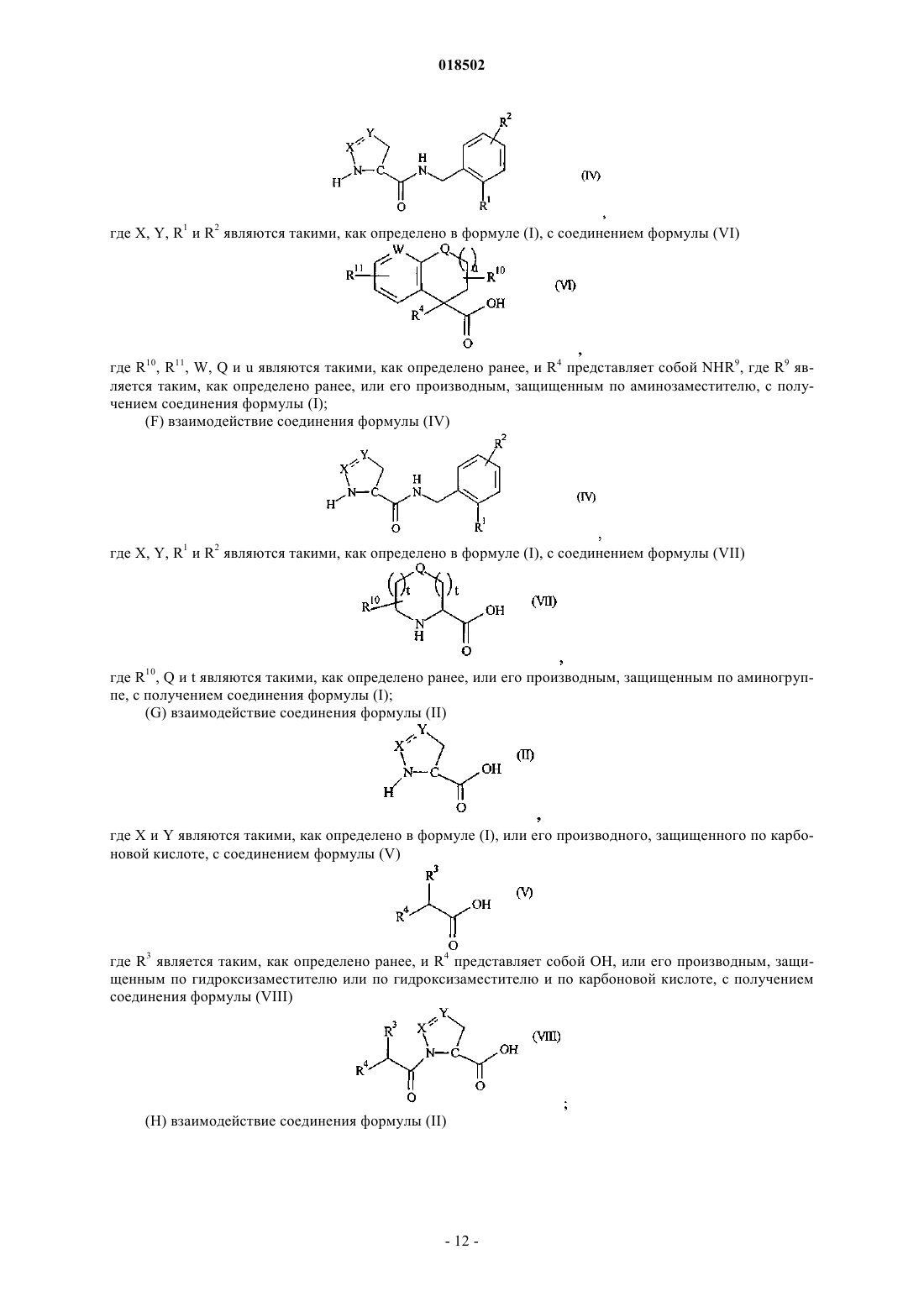
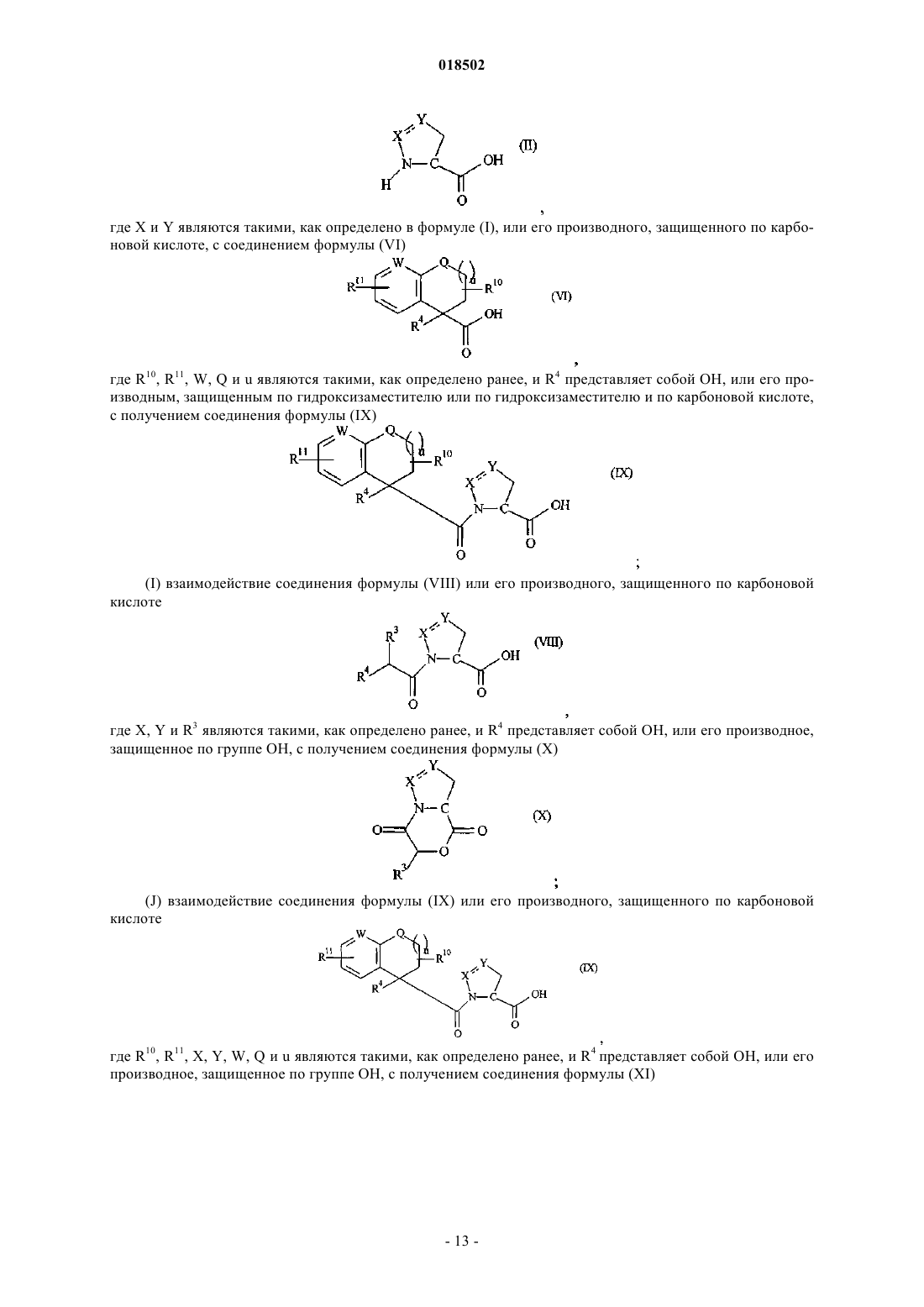
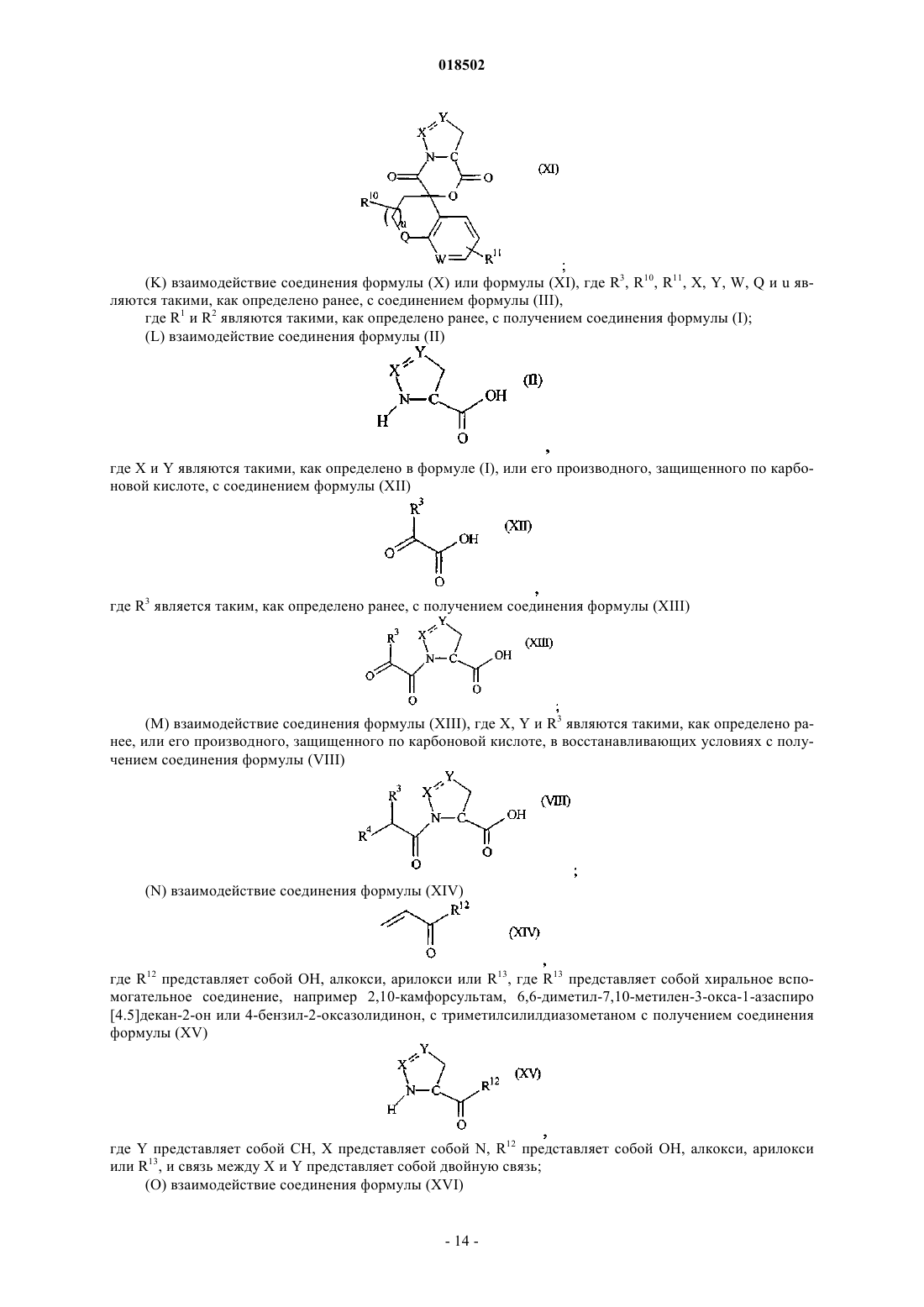
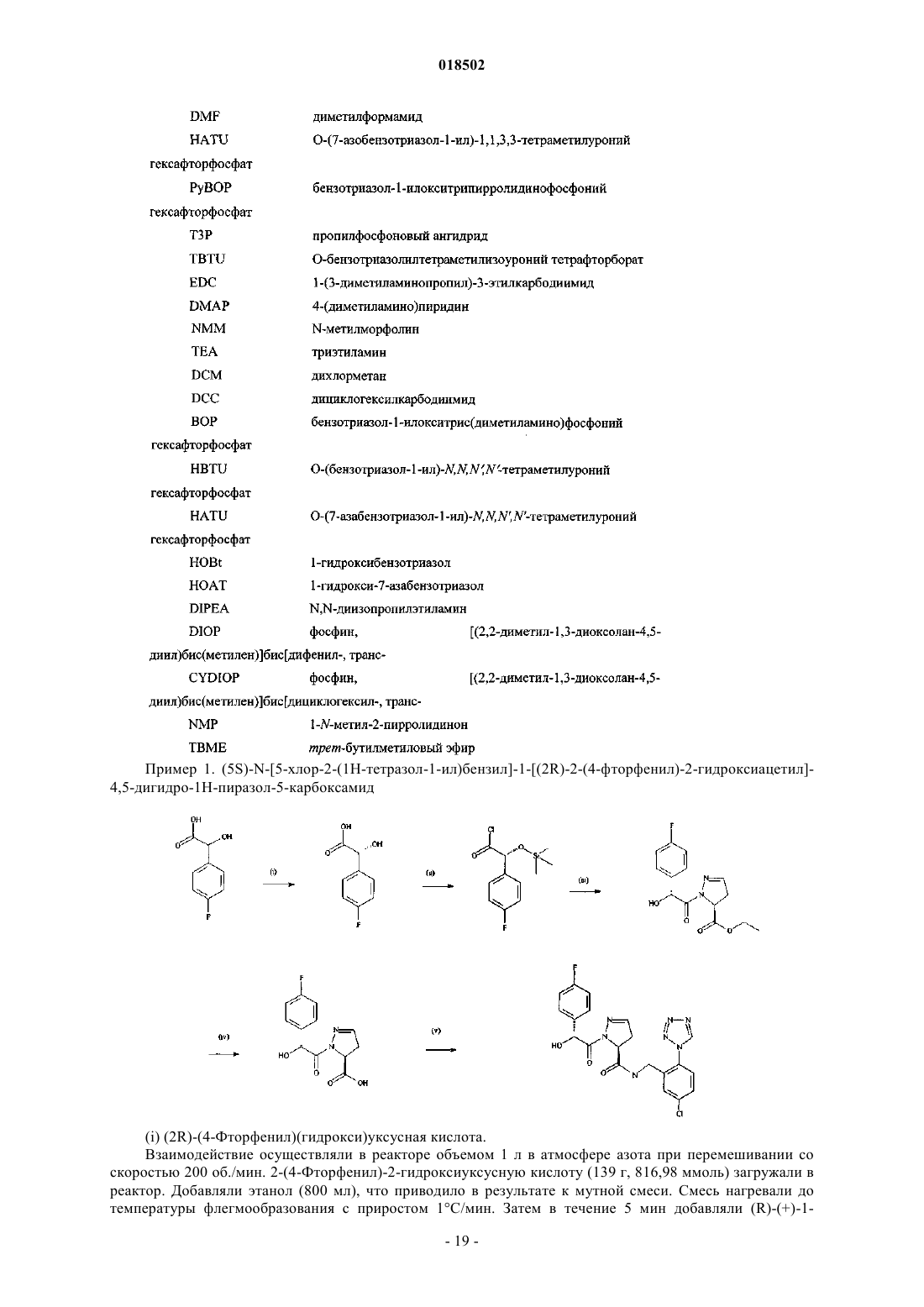
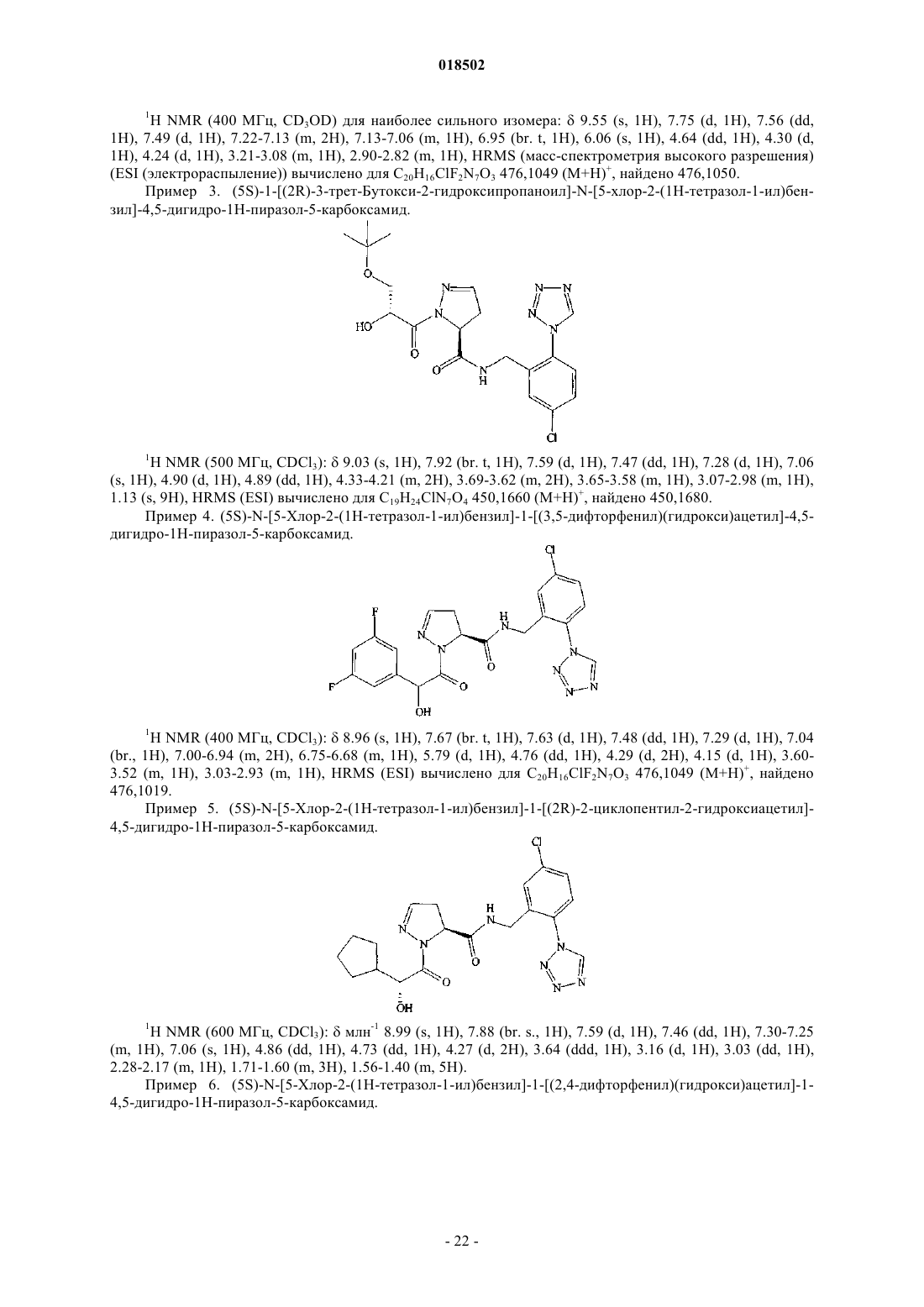
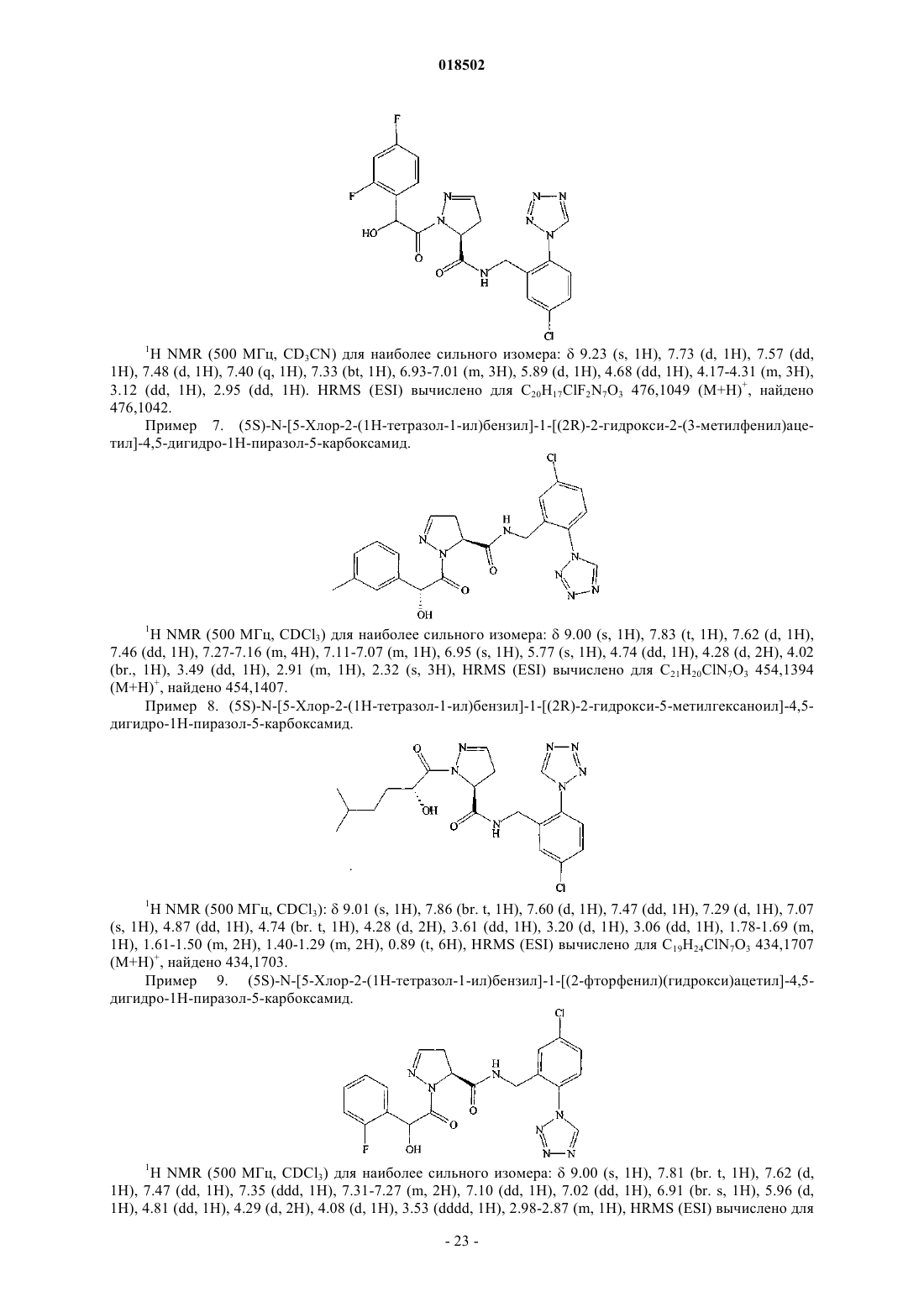
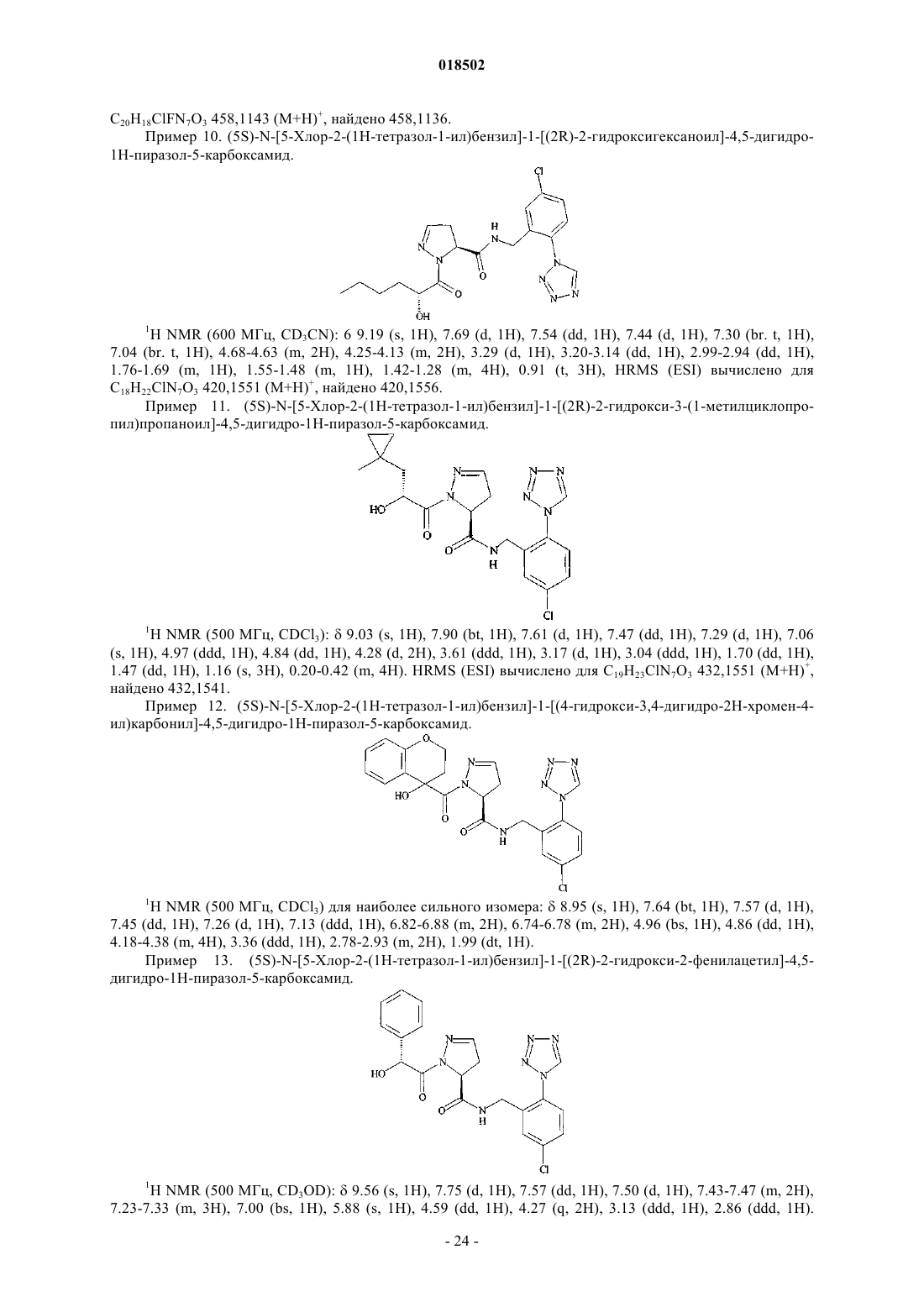
НОВЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ КАРБОКСАМИДЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ Изобретение относится к новым фармацевтически полезным соединениям формулы (I), в частности соединениям, которые представляют собой конкурентные ингибиторы трипсиноподобных сериновых протеаз, в частности тромбина, их применению в качестве лекарственных средств,содержащим их фармацевтическим композициям и путям синтеза для их получения. Область изобретения Изобретение относится к новым фармацевтически полезным соединениям, в частности соединениям, которые представляют собой конкурентные ингибиторы трипсиноподобных сериновых протеаз, в частности тромбина, их применению в качестве лекарственных средств, содержащим их фармацевтическим композициям и путям синтеза для их получения. Предшествующий уровень техники Свертывание крови представляет собой ключевой процесс, вовлеченный в гемостаз (т.е. предупреждение потери крови из поврежденного сосуда) и тромбоз (т.е. образование сгустка крови в кровеносном сосуде, иногда приводя к закупорке сосуда). Свертывание представляет собой результат сложных серий ферментативных реакций. Одна из итоговых стадий в этих сериях реакций представляет собой превращение профермента протромбина в активный фермент тромбин. Известно, что тромбин играет центральную роль в свертывании крови. Он активирует тромбоциты,приводя к агрегации тромбоцитов, превращает фибриноген в фибриновые мономеры, которые спонтанно полимеризуются в фибриновые полимеры, и активирует фактор XIII, который, в свою очередь, перекрестно связывает полимеры с образованием нерастворимого фибрина. Кроме того, тромбин активирует фактор V, фактор VIII и фактор XI, приводя к образованию тромбина из протромбина по типу "положительной обратной связи". Путем ингибирования агрегации тромбоцитов и образования и перекрестного связывания фибрина эффективные ингибиторы тромбина, как можно ожидать, демонстрируют антитромботическую активность. Дополнительно можно ожидать, что антитромботическая активность усиливается путем эффективного ингибирования механизма положительной обратной связи. Действительно, убедительные антитромботические действия тромбинового ингибитора у людей описаны S. Schulman et al. в N. Engl. J. Med. 349, 1713-1721 (2003), L. Wallentin et al. в Lancet 362, 789-97 (2003) и Н.-С. Diener et al. в Cerebrovasc. Dis. 21, 279-293 (2006). Ранние разработки низкомолекулярных ингибиторов тромбина описаны Claesson в Blood Coagul.Blombck et al. (в J. Clin. Lab. Invest. 24, suppl. 107, 59 (1969 сообщал об ингибиторах тромбина,основанных на аминокислотной последовательности, располагающейся вокруг сайта расщепления А цепи фибриногена. В обсуждаемых аминокислотных последовательностях эти авторы предположили,что трипептидная последовательность Phe-Val-Arg (P9-P2-P1, далее последовательность Р 3-Р 2-Р 1) может представлять собой наиболее эффективный ингибитор. Ингибиторы тромбина, основанные (в Р 1-позиции молекулы) на 2-гетероароматической замещенной 1-ил-бензиламидной структурной единице, раскрыты в US 7144899 и WO 2004032834. Ингибиторы тромбина, основанные (в Р 2-позиции молекулы) на структурных единицах амида 1 ацетилпирролидин-2-карбоновой кислоты, амида 1-ацетилпиперидин-2-карбоновой кислоты или амида 1-ацетилазепан-2-карбоновой кислоты, раскрыты в US 7144899. Ингибиторы тромбина, основанные (в Р 2-позиции молекулы) на структурных единицах амида 1 ацетилпирролидин-2-карбоновой кислоты или амида 1-ацетилдигидропиррол-2-карбоновой кислоты,раскрыты в US 6515011 и WO 2004032834. Ингибиторы тромбина, основанные (в Р 2-позиции молекулы) на структурной единице амида 1 ацетилазепан-2-карбоновой кислоты, раскрыты в US 6528503. Ингибиторы тромбина, основанные (в Р 2-позиции молекулы) на структурной единице амида азабицикло[3.1.0]гексан-1-карбоновой кислоты, раскрыты в US 6288077. Ингибиторы тромбина, основанные (в Р 2-позиции молекулы) на структурных единицах амида 1,3 тиазолидин-2-карбоновой кислоты, амида 1,3-тиазолидин-4-карбоновой кислоты, амида пиразолидин-3 карбоновой кислоты и амида 4,5-дигидро-1H-пиразол-5-карбоновой кислоты, раскрыты в US 6740647 и также описаны Lange et al. в BioorganicMedicinal Chemistry Letters 16, 2648-2653 (2006). Количественные исследования взаимосвязи структуры и активности основанных на арилгетероциклах ингибиторов тромбина описаны Roy et al. в European Journal of Medicinal Chemistry 41, 1339-1346al. в BioorganicMedicinal Chemistry 14, 6900-6916 (2006). Ингибиторы тромбина, основанные (в Р 2-позиции молекулы) на пиразинонах, несущих различные арилгетероциклы в Р 1-позиции молекулы, описаны Young et al. в Journal of Medicinal Chemistry 47, 29953008 (2004). Остается потребность в эффективных ингибиторах трипсиноподобных сериновых протеаз, таких как тромбин. Также существует потребность в соединениях, которые обладают благоприятным фармакокинетическим профилем. Можно ожидать, что такие соединения полезны в качестве антикоагулянтов и,таким образом, в терапевтическом лечении тромбоза и родственных расстройств. Описание изобретения В одном из аспектов настоящего изобретения предложено соединение формулы (I)Y представляет собой СН 2, когда X представляет собой О или NH, где X и Y связаны простой связью,или, альтернативно,Y представляет собой СН, когда X представляет собой N, где X и Y связаны двойной связью;R1 представляет собой 5-членное гетероарильное кольцо, содержащее 2, 3 или 4 гетероатома, выбранных из N, О и S, где по меньшей мере 2 гетероатома представляют собой N, и 0 или 1 гетероатом представляет собой О или S, где указанное 5-членное гетероарильное кольцо замещено по любому кольцевому атому углерода 0, 1 или 2 заместителями, независимо выбранными из C1-6 алкила, и 6-членное гетероарильное кольцо, содержащее 1 или 2 атома азота, где указанное 6-членное гетероарильное кольцо замещено по любому кольцевому атому углерода 0, 1, 2 или 3 заместителями, независимо выбранными из С 1-6 алкила; где R3 представляет собой Н, R5, C1-6 алкил, C2-6 алкенил, C2-6 алкинил или С 3-6 циклоалкил, где каждый из указанных C1-6 алкила, C2-6 алкенила, C2-6 алкинила и С 3-6 циклоалкила независимо замещен 0, 1, 2, 3, 4 или 5 заместителями, выбранными из галогена, и 0, 1 или 2 заместителями, выбранными из ОН, оксо, циано,NH2, групп NH(C1-4 алкил), N(С 1-4 алкил)2, С 1-4 алкила, С 3-6 циклоалкила, С 4-7 циклоалкенила, циклогетероалкила, R5 и R6;R5 представляет собой фенил, 5- или 6-членное гетероароматическое кольцо, содержащее 1, 2 или 3 гетероатома, независимо выбранных из О, S и N, 4-, 5- или 6-членное циклогетероалкильное кольцо, содержащее 1 или 2 гетероатома, независимо выбранных из О, S и N, или конденсированное с фенилом 5 или 6-членное циклогетероалкильное кольцо, содержащее 1 или 2 гетероатома, независимо выбранных из О, S и N, где указанный фенил, указанное гетероароматическое кольцо, указанное циклогетероалкильное кольцо и указанное конденсированное с фенилом циклогетероалкильное кольцо замещены по любому кольцевому атому углерода 0, 1, 2, 3, 4 или 5 заместителями, независимо выбранными из СООН,ОН, галогена, CF3, CHF2, CH2F, циано, C1-6 алкила, R6 и SO2R7;R8 представляет собой фенил, где указанный фенил замещен 0, 1, 2, 3, 4 или 5 заместителями, независимо выбранными из C1-4 алкила, C1-4 алкокси, циано, F, CF3, CHF2 и CH2F, или C1-4 алкил, где указанный C1-4 алкил замещен 0, 1, 2 или 3 заместителями, независимо выбранными из метила и этила, и 0 или 1 заместителем, выбранным из фенила, где указанный фенил замещен 0, 1, 2, 3, 4 или 5 заместителями,независимо выбранными из C1-4 алкила, C1-4 алкокси, циано, F, CF3, CHF2, CH2F и OC(O)R7;R11 представляет собой 0, 1, 2, 3, 4 или 5 заместителей, выбранных из галогена, ОН, циано, C1-4 алкила, С 3-6 циклоалкила, R5 и R6, где указанный С 1-4 алкил замещен 0 или 1 заместителем, выбранным из R5,NH2, групп NH(C1-4 алкил) или N(С 1-4 алкил)2; или его фармацевтически приемлемая соль, или энантиомер, или фармацевтически приемлемая соль указанного энантиомера. Соединения формулы (I) имеют хиральные центры, а некоторые имеют геометрические изомерные центры (Е- и Z-изомеры), и понятно, что изобретение охватывает все такие оптические, диастереоизомерные и геометрические изомеры. В одном из аспектов изобретения предложено применение соединения формулы (I) в терапии. В еще одном аспекте изобретения предложено применение соединения формулы (I) в антикоагуляционной терапии. В еще одном аспекте изобретения предложено применение соединения формулы (I) в лечении состояния, при котором благоприятно ингибирование тромбина. В еще одном аспекте изобретения предложено применение соединения формулы (I) в лечении и предупреждении тромбоэмболических расстройств. В еще одном аспекте изобретения предложен способ лечения состояния, при котором благоприятно ингибирование тромбина, включающий введение терапевтически эффективного количества соединения формулы (I) лицу, страдающему таким состоянием или предрасположенному к такому состоянию. В еще одном аспекте изобретения предложен способ лечения и предупреждения тромбоэмболических расстройств, включающий введение терапевтически эффективного количества соединения формулы(I) лицу, страдающему состоянием тромбофилии или предрасположенному к состоянию тромбофилии. В еще одном аспекте изобретения предложены фармацевтические композиции, содержащие терапевтически эффективное количество соединения формулы (I) в смеси по меньшей мере с одним фармацевтически приемлемым разбавителем, эксципиентом и/или инертным носителем. В еще одном аспекте изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I) для применения в лечении состояний, при которых благоприятно ингибирование тромбина, таких как тромбоэмболия, и/или состояний, при которых показана антикоагуляционная терапия. В еще одном аспекте изобретения предложен способ получения соединения формулы (I) и промежуточных соединений, используемых в его получении. Эти и другие аспекты настоящего изобретения более подробно описаны ниже. Подробное описание изобретения Задача настоящего изобретения заключается в том, чтобы предложить соединения, которые представляют собой конкурентные ингибиторы трипсиноподобных сериновых протеаз, в частности тромбина, их применение в качестве лекарственных средств, содержащие их фармацевтические композиции и пути синтеза для их получения. Ниже приведены определения различных терминов, используемых в описании изобретения и формуле изобретения для раскрытия настоящего изобретения. Для того чтобы избежать неопределенности, следует понимать, что когда в этом описании группа обозначена как "определенная ранее", "определенная до" или "определенная выше", тогда указанная группа охватывает первое появление и самое широкое определение, а также каждое и все другие определения этой группы. Для того чтобы избежать неопределенности, следует понимать, что в этом описании "C1-6" обозначает углеродную группу, имеющую 1, 2, 3, 4, 5 или 6 атомов углерода, и "C1-4" обозначает углеродную группу, имеющую 1, 2, 3 или 4 атома углерода. В этом описании, если не указано иное, термин "алкил" включает прямоцепочечные и имеющие разветвленную цепь алкильные группы и может представлять собой метил, этил, н-пропил, изопропил, нбутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, трет-пентил, неопентил, н-гексил, изогексил или трет-гексил, но не ограничивается ими. В этом описании, если не указано иное, термин "циклоалкил" относится к насыщенной циклической углеводородной кольцевой системе. Термин "С 3-6 циклоалкил" может представлять собой циклопропил,циклобутил, циклопентил или циклогексил. В этом описании, если не указано иное, термин "алкенил" включает прямоцепочечные и имеющие разветвленную цепь алкенильные группы. Термин "С 2-6 алкенил" включает алкенильные группы, имеющие от 2 до 6 атомов углерода, и одну или две двойные связи и может представлять собой винил, аллил,-3 018502 пропенил, бутенил, кротил, пентенил или гексенил, но не ограничивается ими, а бутенильная группа может представлять собой, например, бутен-2-ил, бутен-3-ил или бутен-4-ил. В этом описании, если не указано иное, термин "алкинил" включает прямоцепочечные и имеющие разветвленную цепь алкинильные группы. Термин "С 2-6 алкинил" включает алкинильные группы, имеющие от 2 до 6 атомов углерода, и одну или две тройные связи и может представлять собой этинильную,пропаргильную, пентинильную или гексинильную группу, но не ограничивается ими, а бутинильная группа может представлять собой, например, бутин-3-ил или бутин-4-ил. В этом описании, если не указано иное, термин "циклоалкенил" относится к неароматической циклической углеводородной кольцевой системе, содержащей одну или две двойные связи. Термин "С 4-7 циклоалкенил" может представлять собой циклобутенильную, циклопентенильную, циклогексенильную или циклогептенильную группу, но не ограничивается ими, и циклопентенильная группа может представлять собой, например, циклопентен-3-ил или циклопентен-4-ил. В этом описании, если не указано иное, термин "алкокси" включает прямоцепочечные или разветвленные группы алкокси. C1-6 алкокси может представлять собой метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентокси, изопентокси, трет-пентокси, неопентокси, н-гексилокси, изогексилокси или трет-гексилокси, но не ограничивается ими. В этом описании, если не указано иное, термин "5-членное гетероарильное кольцо, содержащее 2, 3 или 4 гетероатома, выбранных из N, О и S, где по меньшей мере 2 гетероатома представляют собой N, и 0 или 1 гетероатом представляет собой О или S" включает ароматические гетероциклические кольца. Примеры таких колец представляют собой имидазол, тетразол, триазол, тиадиазол или оксадиазол. В этом описании, если не указано иное, термин "6-членное гетероарильное кольцо, содержащее 1 или 2 атома азота," включает пиридин, пиридазин, пиримидин или пиразин. В этом описании, если не указано иное, термин "4-, 5- или 6-членное циклогетероалкильное кольцо,имеющее 1 или 2 гетероатома, выбранных из О, S и N" включает оксетан, азетидин, оксазетидин, пирролидин, имидазолин, тетрагидрофуран, оксазолидин, пиперидин, пиперазин, гексагидропиридазин, гексагидропиримидин, морфолин, оксазинан, тиетан, тиетан-1-оксид, тиетан-1,1-диоксид, тетрагидротиофен,тетрагидротиофен-1-оксид, тетрагидротиофен-1,1-диоксид, тетрагидротиопиран, тетрагидротиопиран-1 оксид или тетрагидротиопиран-1,1-диоксид. В этом описании, если не указано иное, термин "5- или 6-членное гетероароматическое кольцо, содержащее 1, 2 или 3 гетероатома, независимо выбранных из О, S и N" включает фуран, тиофен, пиррол,оксазол, изоксазол, тиазол, изотиазол, имидазол, триазол, тиадиазол, оксадиазол, пиридин, пиридазин,пиримидин, пиразин или триазин. В этом описании, если не указано иное, термин "конденсированное с фенилом 5- или 6-членное циклогетероалкильное кольцо, содержащее 1 или 2 гетероатома, независимо выбранных из О, S и N" включает индолин, дигидроизоиндол, дигидробензофуран, дигидроизобензофуран, дигидробензотиофен,дигидробензоимидазол, дигидроиндазол, дигидробензооксазол, дигидробензотиазол, тетрагидрохинолин,тетрагидроизохинолин, тетрагидрохиноксалин, тетрагидрохиназолин, тетрагидрофталазин, хроман, изохроман, тиохроман, изотиохроман, дигидробензооксазин или дигидробензотиазин. В этом описании, если не указано иное, термин "галоген" может представлять собой фтор, хлор,бром или йод. В этом описании представляет собой мотивы следующих структур: В одном из воплощений изобретения R1 представляет собой 5-членное гетероарильное кольцо, содержащее 2, 3 или 4 гетероатома, выбранных из N, О и S, где по меньшей мере 2 гетероатома представляют собой N, и 0 или 1 гетероатом представляет собой О или S, где указанное 5-членное гетероарильное кольцо замещено по любому кольцевому атому углерода 0, 1 или 2 заместителями, независимо выбранными из C1-6 алкила, и 6-членное гетероарильное кольцо, содержащее 1 или 2 атома азота, где указанное 6-членное гетероарильное кольцо замещено по любому кольцевому атому углерода 0, 1, 2 или 3 заместителями, независимо выбранными из С 1-6 алкила. В еще одном воплощении изобретения R1 представляет собой 5-членное гетероарильное кольцо,содержащее 2, 3 или 4 гетероатома, выбранных из N, О и S, где по меньшей мере 2 гетероатома представляют собой N, и 0 или 1 гетероатом представляет собой О или S. В еще одном воплощении изобретения R1 представляет собой тетразол. В одном из воплощений изобретения R2 представляет собой Н, галоген, циано, C1-6 алкил или C1-6 алкокси, где указанный C1-6 алкил или C1-6 алкокси замещен 0, 1, 2, 3, 4 или 5 галогенами. В еще одном воплощении изобретения R2 представляет собой Н или галоген. В еще одном воплощении изобретения R2 представляет собой Н, Cl или F. В одном из воплощений изобретения стереохимическая конфигурация вокруг углерода в пиразолидине, дигидропиразоле или изоксазолидине, т.е. кольце, содержащем X и Y, которые ковалентно связаны с карбонилом, представляет собой (S). В одном из воплощений изобретения G представляет собой В еще одном воплощении изобретения G представляет собойR3 представляет собой Н, R5, C1-6 алкил, C2-6 алкенил, C2-6 алкинил или С 3-6 циклоалкил, где каждый из указанных C1-6 алкила, C2-6 алкенила, C2-6 алкинила и С 3-6 циклоалкила независимо замещен 0, 1, 2, 3, 4 или 5 заместителями, выбранными из галогена, и 0, 1 или 2 заместителями, выбранными из ОН, оксо, циано,NH2, групп NH(C1-4 алкил), N(C1-4 алкил)2, C1-4 алкила, С 3-6 циклоалкила, С 4-7 циклоалкенила, циклогетероалкила, R5 и R6,где R5 представляет собой фенил, 5- или 6-членное гетероароматическое кольцо, содержащее 1, 2 или 3 гетероатома, независимо выбранных из О, S и N, 4-, 5- или 6-членное циклогетероалкильное кольцо, содержащее 1 или 2 гетероатома, независимо выбранных из О, S и N, или конденсированное с фенилом 5- или 6-членное циклогетероалкильное кольцо, содержащее 1 или 2 гетероатома, независимо выбранных из О, S и N, где указанное фенильное, указанное гетероароматическое кольцо, указанное циклогетероалкильное кольцо и указанное конденсированное с фенилом циклогетероалкильное кольцо замещено по любому кольцевому атому углерода 0, 1, 2, 3, 4 или 5 заместителями, независимо выбранными из СООН, ОН, галогена, CF3, CHF2, CH2F, циано, C1-6 алкила, R6 и SO2R7;R8 представляет собой фенил, где указанный фенил замещен 0, 1, 2, 3, 4 или 5 заместителями, независимо выбранными из C1-4 алкила, C1-4 алкокси, циано, F, CF3, CHF2 и CH2F, или C1-4 алкил, где указанный C1-4 алкил замещен 0, 1, 2 или 3 заместителями, независимо выбранными из метила и этила, и 0 или 1 заместителем, выбранным из фенила, где указанный фенил замещен 0, 1, 2, 3, 4 или 5 заместителями,независимо выбранными из C1-4 алкила, C1-4 алкокси, циано, F, CF3, CHF2, CH2F и OCOR7;R9 представляет собой Н, COOR7 или SO2R7, где указанный R7 замещен 0, 1, 2 или 3 заместителями,независимо выбранными из ОН, галогена, циано, R6 и С 3-7 циклоалкила; где R6 представляет собой C1-6 алкокси, где указанный C1-6 алкокси замещен 0, 1, 2, 3, 4 или 5 галогенами; и R7 представляет собой C1-6 алкил. В еще одном воплощении изобретения G представляет собойR3 представляет собой C1-6 алкил, С 3-6 циклоалкил, 5- или 6-членное гетероароматическое кольцо, содержащее 1, 2 или 3 гетероатома, независимо выбранных из О, S и N, 4-, 5- или 6-членное циклогетероалкильное кольцо, содержащее 1 или 2 гетероатома, независимо выбранных из О, S и N, или R12, где указанный C1-6 алкил, указанный С 3-6 циклоалкил, указанное гетероароматическое кольцо и указанное циклогетероалкильное кольцо замещено 0 или 1 заместителем, выбранным из NH2, NH(C1-4 алкил), N(C1-4 алкил)2, С 3 циклоалкила, R6 или R12, где R6 представляет собой C1-6 алкокси, где указанный C1-6 алкокси замещен 0, 1, 2, 3, 4 или 5 галогенами;R12 представляет собой фенил, где указанный фенил замещен 0, 1 или 2 заместителями, выбранными из галогена и R6; иR8 представляет собой фенил, где указанный фенил замещен 0, 1, 2, 3, 4 или 5 заместителями, независимо выбранными из C1-4 алкила, C1-4 алкокси, циано, F, CF3, CHF2 и CH2F, или C1-4 алкил, где указан-5 018502 ный С 1-4 алкил замещен 0, 1, 2 или 3 заместителями, независимо выбранными из метила и этила, и 0 или 1 заместителем, выбранным из фенила, где указанный фенил замещен 0, 1, 2, 3, 4 или 5 заместителями,независимо выбранными из C1-4 алкила, C1-4 алкокси, циано, F, CF3, CHF2, CH2F и OCOR7. В еще одном воплощении изобретения G представляет собойR3 представляет собой С 3-6 циклоалкил, R12 или C1-6 алкил, где указанный С 1-6 алкил замещен 0 или 1 заместителем, выбранным из С 3 циклоалкила, N(C1-4 алкил)2, R6 или R12, где R6 представляет собой C1-6 алкокси, где указанный C1-6 алкокси замещен 0, 1, 2, 3, 4 или 5 галогенами; и R12 представляет собой фенил, где указанный фенил замещен 0, 1 или 2 заместителями, выбранными из галогена; иR4 представляет собой ОН или OC(O)R7. В одном из воплощений изобретения стереохимическая конфигурация вокруг углерода, замещенного R3 и R4, в G представляет собой (R). В еще одном воплощении G представляет собойR5 представляет собой фенил, который замещен, 0, 1, 2, 3, 4 или 5 заместителями, независимо выбранными из СООН, ОН, галогена, CF3, циано, С 1-6 алкила, R6 и SO2R7, где R6 представляет собой C1-6 алкокси, где указанный C1-6 алкокси замещен 0, 1, 2, 3, 4 или 5 галогенами; иn независимо равен 0, 1 или 2 и каждый t независимо равен 0, 1 или 2. В еще одном воплощении изобретения G представляет собойR5 представляет собой фенил, который замещен 0, 1, 2, 3, 4 или 5 заместителями, независимо выбранными из СООН, ОН, галогена, CF3, циано, C1-6 алкила, R6 и SO2R7; где R6 представляет собой C1-6 алкокси, где указанный C1-6 алкокси замещен 0, 1, 2, 3, 4 или 5 галогенами; и R7 представляет собой C1-6 алкил. В еще одном воплощении изобретения G представляет собойR10 представляет собой 0, 1 или 2 заместителя, выбранные из оксо и C1-4 алкила. В еще одном воплощении изобретения G представляет собойR8 представляет собой фенил, где указанный фенил замещен 0, 1, 2, 3, 4 или 5 заместителями, независимо выбранными из C1-4 алкила, C1-4 алкокси, циано, F, CF3, CHF2 и CH2F, или C1-4 алкил, где указанный C1-4 алкил замещен 0, 1, 2 или 3 заместителями, независимо выбранными из метила и этила, и 0 или 1 заместителем, выбранным из фенила, где указанный фенил замещен 0, 1, 2, 3, 4 или 5 заместителями,независимо выбранными из C1-4 алкила, C1-4 алкокси, циано, F, CF3, CHF2, CH2F и CO2R7; иR5 представляет собой фенил, который замещен 0, 1, 2, 3, 4 или 5 заместителями, независимо выбранными из СООН, ОН, галогена, CF3, циано, C1-6 алкила, R6 и SO2R7,где R6 представляет собой C1-6 алкокси, где указанный C1-6 алкокси замещен 0, 1, 2, 3, 4 или 5 галогенами; иR7 представляет собой C1-6 алкил. В еще одном воплощении изобретения G представляет собойR4 представляет собой ОН, OC(O)R7, OC(O)R8 или NH2, где R7 представляет собой C1-6 алкил; R8 представляет собой фенил, где указанный фенил замещен 0, 1, 2, 3, 4 или 5 заместителями, независимо выбранными из C1-4 алкила, C1-4 алкокси, циано, F, CF3, CHF2 и CH2F, или C1-4 алкил, где указанный C1-4 алкил замещен 0, 1, 2 или 3 заместителями, независимо выбранными из метила и этила, и 0 или 1 заместителем, выбранным из фенила, где указанный фенил замещен 0, 1, 2, 3, 4 или 5 заместителями, независимо выбранными из C1-4 алкила, C1-4 алкокси, циано, F, CF3, CHF2, CH2F и CO2R7;R11 представляет собой 0, 1 или 2 заместителя, выбранные из C1-4 алкила, галогена и R6, где R6 представляет собой C1-6 алкокси, где указанный C1-6 алкокси замещен 0, 1, 2, 3, 4 или 5 галогенами. В еще одном воплощении изобретения G представляет собойR4 представляет собой ОН или OC(O)R7; В одном из воплощений изобретения соединение формулы (I) выбрано из(3S)-N-[5-хлор-2-(1 Н-тетразол-1-ил)бензил]-2-[(2R)-2-гидрокси-3,3-диметилбутаноил]пиразолидин 3-карбоксамида,или фармацевтически приемлемой соли, или энантиомера, или фармацевтически приемлемой соли указанного энантиомера. В еще одном аспекте настоящего изобретения предложено соединение формулы (X)Y представляет собой СН 2, когда X представляет собой О или NH, где X и Y связаны посредством простой связи, илиY представляет собой СН, когда X представляет собой N, где X и Y связаны посредством двойной связи;R3 представляет собой С 1-6 алкил, С 3-6 циклоалкил, 5- или 6-членное гетероароматическое кольцо, содержащее 1, 2 или 3 гетероатома, независимо выбранных из О, S и N, 4-, 5- или 6-членное циклогетероалкильное кольцо, содержащее 1 или 2 гетероатома, независимо выбранных из О, S и N, или R12, где указанный С 1-6 алкил, указанный С 3-6 циклоалкил, указанное гетероароматическое кольцо и указанное циклогетероалкильное кольцо замещены 0 или 1 заместителем, выбранным из NH2, NH(С 1-6 алкил), N(С 1-4 алкил)2, С 3 циклоалкила, R6 или R12;R12 представляет собой фенил, где указанный фенил замещен 0, 1 или 2 заместителями, выбранными из галогена и R6. В еще одном аспекте настоящего изобретения предложено соединение формулы (XI)Y представляет собой СН 2, когда X представляет собой О или NH, где X и Y связаны посредством простой связи, илиY представляет собой СН, когда X представляет собой N, где X и Y связаны посредством двойной связи;R6 представляет собой С 1-6 алкокси, где указанный С 1-6 алкокси замещен 0, 1, 2, 3, 4 или 5 галогенами. В настоящем изобретении также предложен способ получения определенного выше соединения формулы (I), включающий:(А) взаимодействие соединения формулы (II) где R1 и R2 являются такими, как определено в формуле (I), с получением соединения формулы (IV), или его производного, которое защищено по аминогруппе(В) взаимодействие соединения формулы (IV) где R3 является таким, как определено ранее, и R4 представляет собой ОН, или его производным, защищенным по гидроксизаместителю или по гидроксизаместителю и по карбоновой кислоте, с получением соединения формулы (I);(С) взаимодействие соединения формулы (IV) где R10, R11, W, Q и u являются такими, как определено ранее, и R4 представляет собой ОН, или его производным, защищенным по гидроксизаместителю или по гидроксизаместителю и по карбоновой кислоте,с получением соединения формулы (I);(D) взаимодействие соединения формулы (IV) где R3 является таким, как определено ранее, и R4 представляет собой NHR9, где R9 является таким, как определено ранее, или его производным, защищенным по аминозаместителю, с получением соединения формулы (I);(Е) взаимодействие соединения формулы (IV) где R10, R11, W, Q и u являются такими, как определено ранее, и R4 представляет собой NHR9, где R9 является таким, как определено ранее, или его производным, защищенным по аминозаместителю, с получением соединения формулы (I);(F) взаимодействие соединения формулы (IV) где R10, Q и t являются такими, как определено ранее, или его производным, защищенным по аминогруппе, с получением соединения формулы (I);(G) взаимодействие соединения формулы (II) где X и Y являются такими, как определено в формуле (I), или его производного, защищенного по карбоновой кислоте, с соединением формулы (V) где R3 является таким, как определено ранее, и R4 представляет собой ОН, или его производным, защищенным по гидроксизаместителю или по гидроксизаместителю и по карбоновой кислоте, с получением соединения формулы (VIII)(Н) взаимодействие соединения формулы (II) где X и Y являются такими, как определено в формуле (I), или его производного, защищенного по карбоновой кислоте, с соединением формулы (VI) где R10, R11, W, Q и u являются такими, как определено ранее, и R4 представляет собой ОН, или его производным, защищенным по гидроксизаместителю или по гидроксизаместителю и по карбоновой кислоте,с получением соединения формулы (IX)(I) взаимодействие соединения формулы (VIII) или его производного, защищенного по карбоновой кислоте где X, Y и R3 являются такими, как определено ранее, и R4 представляет собой ОН, или его производное,защищенное по группе ОН, с получением соединения формулы (X)(J) взаимодействие соединения формулы (IX) или его производного, защищенного по карбоновой кислоте где R10, R11, X, Y, W, Q и u являются такими, как определено ранее, и R4 представляет собой ОН, или его производное, защищенное по группе ОН, с получением соединения формулы (XI)(K) взаимодействие соединения формулы (X) или формулы (XI), где R3, R10, R11, X, Y, W, Q и u являются такими, как определено ранее, с соединением формулы (III),где R1 и R2 являются такими, как определено ранее, с получением соединения формулы (I);(L) взаимодействие соединения формулы (II) где X и Y являются такими, как определено в формуле (I), или его производного, защищенного по карбоновой кислоте, с соединением формулы (XII) где R3 является таким, как определено ранее, с получением соединения формулы (XIII)(М) взаимодействие соединения формулы (XIII), где X, Y и R3 являются такими, как определено ранее, или его производного, защищенного по карбоновой кислоте, в восстанавливающих условиях с получением соединения формулы (VIII)(N) взаимодействие соединения формулы (XIV) где R12 представляет собой ОН, алкокси, арилокси или R13, где R13 представляет собой хиральное вспомогательное соединение, например 2,10-камфорсультам, 6,6-диметил-7,10-метилен-3-окса-1-азаспиро[4.5]декан-2-он или 4-бензил-2-оксазолидинон, с триметилсилилдиазометаном с получением соединения формулы (XV) где Y представляет собой СН, X представляет собой N, R12 представляет собой ОН, алкокси, арилокси или R13, и связь между X и Y представляет собой двойную связь;(О) взаимодействие соединения формулы (XVI) где R12 представляет собой ОН или алкокси, L представляет собой Cl, Br, I или OSO2CF3, и X представляет собой О, N, или его защищенного производного, в присутствии основания с получением соединения формулы (XV) где Y представляет собой СН 2, X представляет собой N или О, R12 представляет собой ОН или алкокси и связь между X и Y представляет собой простую связь. Способы (А)-(Н) и (L) могут быть осуществлены с использованием известных способов получения амидов из карбоновых кислот или, аналогично, например, как описано ниже в примерах. Это может быть осуществлено в растворителе, например DCM, MeCN, H2O, EtOAc или DMF, в присутствии подходящего основания, например пиридина, DMAP, NMM, TEA, NaHCO3, 2,4,6-коллидина или DIPEA, и подходящего реагента, например оксалилхлорида, цианурфторида, смеси EDC/HOBt, DCC/HOBt, HBTU, HATU,PyBOP, Т 3 Р или TBTU. Температура реакции может составлять от 0 до 100 С или представлять собой температуру флегмообразования растворителя, если она меньше 100 С, но обычно комнатную температуру. Способы (I) и (J) могут быть осуществлены с использованием известных способов получения лактонов или, аналогично, например, как описано ниже в примерах. Это может быть осуществлено в органическом растворителе, например CHCl3, бензоле, толуоле, EtOH или THF (тетрагидрофуран), в присутствии подходящего реагента, например TsOH, MsOH, NaOH, смеси пивалоилхлорид/ТЕА илиDMAP/BOP (бензотриазол-1-илокситрис(диметиламино)фосфоний гексафторфосфат). Температура реакции может составлять от 0 до 100 С или представлять собой температуру флегмообразования растворителя, если она меньше 100 С, но обычно комнатную температуру. Способ (K) может быть осуществлен с использованием известных способов получения амидов из лактонов или, аналогично, например, как описано ниже в примерах. Это может быть осуществлено в органическом растворителе, например DCM, THF или МеОН, в присутствии подходящего реагента, например TEA. Температура реакции может составлять от 0 до 100 С или представлять собой температуру флегмообразования растворителя, если она меньше 100 С, но обычно комнатную температуру. Способ (М) может быть осуществлен с использованием известных способов получения спиртов из кетонов или, аналогично, например, как описано ниже в примерах. Это может быть осуществлено в органическом растворителе, например THF, в присутствии подходящего реагента, например NaBH4,Zn(BH4)2, Ph2SiH2, в присутствии подходящего катализатора, например Rh(PPh3)3Cl или Rh(I)-2-(2 пиридил)-4-карбометокси-1,3-тиазолидина, или, альтернативно, в присутствии Н 2 и подходящего катализатора, например Ru/C, Rh-DIOP или Rh-CYDIOP. Температура реакции может составлять от 0 до 100 С или представлять собой температуру флегмообразования растворителя, если она меньше 100 С, но обычно комнатную температуру. Способ (N) может быть осуществлен с использованием известных способов получения пиразолинов из олефинов или, аналогично, например, как описано ниже в примерах. Это может быть осуществлено в органическом растворителе, например метиленхлориде, гексане или THF. Температура реакции может составлять от -100 до 100 С или представлять собой температуру флегмообразования растворителя, если она меньше 100 С, но обычно комнатную температуру. Способ (P) может быть осуществлен с использованием известных способов получения пиразолидинов или изоксазолидинов или, аналогично, например, как описано ниже в примерах. Это может быть осуществлено в органическом растворителе, например THF, в присутствии подходящего реагента, например NaHMDS, LiHMDS или тетрабутиламмонийфторида. Температура реакции может составлять от 0 до 100 С или представлять собой температуру флегмообразования растворителя, если она меньше 100 С, но обычно комнатную температуру. Способы, используемые для гидролиза эфиров карбоновых кислот до карбоновых кислот, могут быть осуществлены с использованием известных процедур или, аналогично, например как описано ниже в примерах. Это может быть осуществлено в растворителе, например MeCN или Н 2 О, в присутствии подходящего основания, например TEA или DIPEA, или подходящей кислоты, например HCl, и возможно подходящего реагента, например LiBr. Температура реакции может составлять от 0 до 100 С или представлять собой температуру флегмообразования растворителя, если она меньше 100 С, но обычно комнатную температуру. Соединения формулы (II) и формулы (XV) имеются в продаже или могут быть получены при помощи известных способов (например, Tempahedron Letters 1997, 38, 4935-4938 (N-NHCH2); J. Am. Chem. Soc. 1997, 119, 8379-8380 (N-N=CH); Helv. Chim. Acta 1983, 66, 1241 (N-O-C. Соединения формулы (III) имеются в продаже или могут быть получены при помощи известных способов (например, J. Med. Chem. 2004, 47, 2995). Соединения формулы (V), (VI), (VII), (XII) и (XIV) имеются в продаже или могут быть получены при помощи известных способов. Введение и удаление защиты функциональных групп описано в "Protective Groups in Organic Synthesis", 2nd Ed, T.W. Greene and P.G.M. Wuts, Wiley-Interscience (1991) и 'Protecting Groups', P.J. Kocienski,Georg Thieme Verlag (1994). Еще одно воплощение изобретения охватывает фармацевтически приемлемые соли соединений формулы (I). Когда соединение является достаточно кислым, то фармацевтически приемлемые соли включают соль щелочного металла, например натрия или калия, соль щелочно-земельного металла, например кальция или магния, соль органического амина, например триэтиламина, морфолина, нметилпиперидина, н-этилпиперидина, прокаина, дибензиламина, N,N-дибензилэтиламина, или аминокислот, например лизина, но не ограничиваются ими. Когда соединение является достаточно основным,то фармацевтически приемлемые соли включают соли присоединения кислоты, такие как соль гидрохлорид, гидробромид, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, оксалат, метансульфонат или паратолуолсульфонат, но не ограничиваются ими. Может существовать больше чем один катион или анион в зависимости от количества заряженных функциональных групп и валентности катионов или анионов. Обзор подходящих солей см. в Berge et al., J. Pharm. Sci, 66, 1-19 (1977). Соединения формулы (I) могут быть введены в форме пролекарства, которое распадается в организме человека или животного с получением соединения формулы (I). Некоторые соединения формулы(I) сами могут действовать как пролекарства других соединений формулы (I). Пролекарства формулы (I) могут демонстрировать улучшенные физико-химические, биофармацевтические или фармакокинетические свойства. Примеры пролекарств включают гидролизуемые in vivo сложные эфиры соединения формулы (I). Гидролизуемый (или расщепляемый) in vivo сложный эфир соединения формулы (I), которое содержит карбоксильную или гидроксильную группу, представляет собой, например, фармацевтически приемлемый сложный эфир, который гидролизуется в организе человека или животного с образованием родительской кислоты или спирта. Примеры производных в виде сложно-эфирного пролекарства см.Curr. Drug. Metab. 2003, 4, 461. Различные другие формы пролекарств известны в области техники. Примеры пролекарственных производных см. Rautio, J. et al. Nature Reviews Drug Discovery 2008, 7, 255 и цитированные там ссылки. Медицинское и фармацевтическое применение Таким образом, ожидают, что соединения по изобретению будут полезны для тех состояний, при которых благоприятно ингибирование тромбина (что определяют путем ссылки на клинически релевантную конечную точку, например, таких состояний, как тромбоэмболии, при которых требуется или желательно ингибирование тромбина, и/или состояний, при которых показана антикоагуляционная терапия),включая следующее. Лечение и/или профилактика тромбоза и гиперкоагуляции в крови и/или тканях животных, включая человека. Известно, что гиперкоагуляция может привести к тромбоэмболическим заболеваниям. Состояния, ассоциированные с гиперкоагуляцией и тромбоэмболическими заболеваниями, обычно обозначают как состояния тромбофилии. Эти состояния включают наследственную или приобретенную резистентность к активированному белку С, такую как мутация фактора V (фактор V Лейдена), наследственные или приобретенные дефициты антитромбина III, белка С, белка S, белка Z, гепаринового кофактора II, и состояния с увеличенными уровнями в плазме крови факторов свертывания, таких как вызванные мутацией протромбина G20210A, но не ограничиваются ими. Другие состояния, которые, как известно, ассоциированы с гиперкоагуляцией и тромбоэмболическим заболеванием, включают циркулирующие в системе кровообращения антифосфолипидные антитела (волчаночный антикоагулянт), гомоцистеинемии,вызванную гепарином тромбоцитопению и дефекты фибринолиза, а также коагуляционные синдромы(например, диссеминированное внутрисосудистое свртывание (DIC и сосудистое поражение в общем(например, вследствие травмы или хирургического вмешательства). Кроме того, низкая физическая активность, низкий минутный объем сердца или большой возраст, которые, как известно, увеличивают риск тромбоза и гиперкоагуляции, могут всего лишь представлять собой один из нескольких факторов,лежащих в основе увеличенного риска. Эти состояния включают продолжительный постельный режим,продолжительное воздушное путешествие, госпитализацию вследствие острого медицинского расстройства, такого как сердечная недостаточность или респираторная недостаточность, но не ограничиваются ими. Дополнительные состояния, сопровождающиеся увеличенным риском тромбоза и гиперкоагуляции в качестве одного из компонентов, представляют собой беременность и лечение гормонами (например,эстрогеном). Лечение состояний, при которых существует нежелательный избыток тромбина без симптомов ги- 16018502 перкоагуляции, например нейродегенератиных заболеваний, таких как болезнь Альцгеймера, при прогрессе и/или предупреждении атеросклероза и при росте и распространении рака. Конкретные болезненные состояния, которые могут быть упомянуты, включают терапевтическое и/или профилактическое лечение венозного тромбоза (например, тромбоза глубоких вен, DVT) и легочной эмболии, артериального тромбоза (например, при инфаркте миокарда, стенокардии и остром коронарном синдроме, вызванном тромбозом инсульте и тромбозе периферических артерий), и системной эмболии (которая может привести к инсульту), обычно из предсердия в течение мерцательной аритмии(например, неклапанной или клапанной мерцательной аритмии) или из левого желудочка после трансмурального инфаркта миокарда, или вызванного застойной сердечной недостаточностью; профилактику повторной окклюзии (т.е. тромбоза) после тромболиза, чрескожных транслюмбальных вмешательств(PTI) и операций коронарного шунтирования; предупреждение тромбоза после микрохирургии и сосудистой хирургии в общем, трансплантации органов и пластической хирургии. Дополнительные показания включают терапевтическое и/или профилактическое лечение диссеминированного внутрисосудистого свертывания, вызванного бактериями, множественными травмами, интоксикацией или любым другим механизмом; антикоагуляционное лечение, когда кровь находится в контакте с чужеродными поверхностями в организме, такими как сосудистые трансплантаты, сосудистые стенты, сосудистые катетеры, механические и биологические искусственные клапаны или любое другое медицинское устройство; и антикоагуляционное лечение, когда кровь находится в контакте с медицинскими устройствами за пределами организма, такое как в течение сердечно-сосудистой хирургии с использованием аппарата искусственного кровообращения или при гемодиализе; терапевтическое и/или профилактическое лечение идиопатического и респираторного дистресс-синдрома у взрослых, легочного фиброза после лечения радиацией или химиотерапии, хронического обструктивного заболевания легких,септического шока, сепсиса, воспалительных реакций, которые включают отек, но не ограничиваются ими, острого или хронического атеросклероза, такого как коронарное артериальное заболевание и образование атеросклеротических бляшек, сердечной недостаточности, заболевания артерий головного мозга,инфаркта головного мозга, тромбоза сосудов головного мозга, эмболии сосудов головного мозга, заболевания периферических артерий, ишемии, стенокардии (включающей нестабильную стенокардию), реперфузионного повреждения, рестеноза после чрескожных транслюмбальных вмешательств (PTI) и коронарного шунтирования. Соединения по изобретению, которые ингибируют трипсин и/или тромбин, также могут быть полезны в лечении панкреатита. Таким образом, соединения по изобретению показаны для терапевтического и/или профилактического лечения этих состояний. Таким образом, в соответствии с одним из аспектов изобретения предложено применение соединения формулы (I) в терапии. Таким образом, в соответствии с еще одним аспектом изобретения предложено применение соединения формулы (I) в антикоагулянтной терапии. Таким образом, в соответствии с еще одним аспектом изобретения предложено применение соединения формулы (I) в лечении состояния, при котором благоприятно ингибирование тромбина. Таким образом, в соответствии с еще одним аспектом изобретения предложено применение соединения формулы (I) в лечении и предупреждении тромбоэмболических расстройств. Таким образом, в соответствии с еще одним аспектом изобретения предложено применение соединения формулы (I) для изготовления лекарственного средства для лечения состояния, при котором благоприятно ингибирование тромбина. Таким образом, в соответствии с еще одним аспектом изобретения предложено применение соединения формулы (I) для изготовления лекарственного средства для лечения и предупреждении тромбоэмболических расстройств. Таким образом, в соответствии с еще одним аспектом изобретения предложен способ лечения состояния, при котором благоприятно ингибирование тромбина, который включает введение терапевтически эффективного количества соединения формулы (I) лицу, страдающему таким состоянием или предрасположенному к такому состоянию. Таким образом, в соответствии с еще одним аспектом изобретения предложен способ лечения и предупреждения тромбоэмболических расстройств, который включает введение терапевтически эффективного количества соединения формулы (I) лицу, страдающему таким состоянием или предрасположенному к такому состоянию. Соединения по изобретению обладают преимуществом, заключающемся в том, что они могут быть более эффективны, менее токсичны, более селективны (например, в отношении ингибирования тромбина по сравнению с другими сериновыми протеазами, в частности трипсином и вовлеченными в гемостаз),обладают большей силой, приводят к меньшим побочным действиям, легче абсорбируются и/или обладают более хорошим фармакокинетическим профилем (например, более высокой доступностью при пероральном введении и/или меньшим клиренсом) по сравнению с соединениями, известными из предшествующего уровня техники. Фармацевтическая композиция В соответствии с еще одним аспектом настоящего изобретения предложен способ лечения состояния, при котором требуется ингибирование тромбина, который включает введение терапевтически эффективного количества соединения по изобретению лицу, страдающему таким состоянием или подверженному такому состоянию. Соединения по изобретению в норме вводят перорально, внутривенно, подкожно, трансбуккально,ректально, трансдермально, назально, трахеально, бронхиально, при помощи любого другого парантерального пути или путем ингаляции, в форме фармацевтических препаратов, содержащих соединение по изобретению в виде свободного основания или фармацевтически приемлемой нетоксичной органической или неорганической соли присоединения кислоты, в фармацевтически приемлемой лекарственной форме. Предпочтительный путь введения соединений по изобретению является пероральным. В зависимости от расстройства и пациента, которого лечат, и пути введения композиции могут быть введены в различных дозах. Соединения по изобретению также могут быть объединены и/или введены вместе с каким(и)-либо антитромботическим(и) агентом(ами), обладающими другим механизмом действия, таким как один или более чем один из следующих: антикоагулянты нефракционированного гепарина, низкомолекулярный гепарин, другие производные гепарина, синтетические производные гепарина (например, фондапаринукс), антагонисты витамина K, синтетические или биотехнологические ингибиторы других факторов свертывания крови, отличающихся от тромбина (например, синтетические ингибиторы FXa, FVIIa, FIXa и ингибиторы FXIa, и rNAPc2), антитромбоцитарные агенты ацетилсалициловая кислота и дипиридамол,ингибиторы тромбоксанового рецептора и/или синтетазы, антагонисты рецептора фибриногена, простациклиновые миметики, ингибиторы фосфодиэстеразы, антагонисты ADP-рецептора (P2X1, P2Y1, P2Y12[например, тиклопидин, клопидогрел, кангрелор, сатигрел и AZD6140]), ингибиторы фосфоинозитид-3 киназыили , ингибиторы карбоксипептидазы U (CPU или TAFIa) и ингибиторы ингибитора-1 активатора плазминогена (PAI-1, например, SCH530348 и Е-5555). Соединения по изобретению дополнительно могут быть объединены и/или введены вместе с тромболитическими средствами, такими как один или более чем один тканевый активатор плазминогена(природный, рекомбинантный или модифицированный), стрептокиназа, урокиназа, проурокиназа, анизоилированньй плазминоген-стрептокиназный активаторный комплекс (APSAC), активаторы плазминогена слюнных желез животных и т.п., в лечении тромботических заболеваний, в частности инфаркта миокарда. Таким образом, в соответствии с еще одним аспектом изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I) в смеси по меньшей мере с одним фармацевтически приемлемым адъювантом, разбавителем или носителем. Подходящие суточные дозы соединений по изобретению для терапевтического лечения людей составяют приблизительно 0,001-100 мг/кг массы тела при пероральном введении и 0,001-50 мг/кг массы тела при парентеральном введении. Для того чтобы избежать неопределенности, используемый здесь термин "лечение" включает терапевтическое и/или профилактическое лечение. Примеры Изобретение далее будет дополнительно раскрыто путем ссылки на следующие примеры. В примерах масс-спектры высокого разрешения регистрировали на масс-спектрометре MicromassLCT, оборудованном электрораспылительным интерфейсом (LC-HRMS). Измерения 1 Н NMR (ядерного магнитного резонанса) осуществляли на спектрометрах Varian UNITY plus 400, 500 и 600, функционирующих при 1 Н частотах 400, 500 и 600 МГц соответственно. Химические сдвиги приведены в м.д. с растворителем в качестве внутреннего стандарта. (CH3)2SO в некоторых приведенных NMR спектрах относятся к растворам, которые взяты из концентрированного образца, растворенного в (CH3)2SO и разбавленного (CD3)2SO. Поскольку значительное количество (CH3)2SO присутствует в образце, то первый прескан проводят и анализируют для автоматического подавления пиков (CH3)2SO (2,54 м.д.) и Н 2 О (3,3 м.д.). Таким образом, интенсивность пиков, которые находятся в этих областях вокруг 3,3 и 2,54 м.д.,изменена. Из-за этого некоторые сигналы от соединения вокруг этих частот могли оказаться пропущенными, и пропущенная область указана в специфических примерах. Разделения путем флэшхроматографии осуществляли с использованием силикагеля Merck Silica gel 60 (0,063-0,200 мм). Соединения, приведенные ниже, названы с использованием ACD/Name 9.04 from ACD/Labs. Использованы следующие сокращения:(i) (2R)-(4-Фторфенил)(гидрокси)уксусная кислота. Взаимодействие осуществляли в реакторе объемом 1 л в атмосфере азота при перемешивании со скоростью 200 об./мин. 2-(4-Фторфенил)-2-гидроксиуксусную кислоту (139 г, 816,98 ммоль) загружали в реактор. Добавляли этанол (800 мл), что приводило в результате к мутной смеси. Смесь нагревали до температуры флегмообразования с приростом 1 С/мин. Затем в течение 5 мин добавляли (R)-(+)-1- 19018502 фенилэтиламин (68,5 мл, 531,04 ммоль). Прозрачный гомогенный раствор затем оставляли медленно охлаждаться до 60 С с изменением 1 С/мин. Когда достигалась эта температура, добавляли затравки 95:5 диастереоизомерной чистоты (приблизительно 100 мг). Медленно инициировали кристаллизацию. Температуру уменьшали до 20 С с изменением 0,5 С/мин. Когда достигалась эта температура, смесь оставляли перемешиваться в течение еще 2 ч. Смесь затем фильтровали. Это позволяло получить кристаллы аммониевой соли (95 г). Эту соль затем перекристаллизовывали из EtOH (99,5%, 800 мл) с использованием следующего способа. В реактор объемом 1 л и в атмосфере азота загружали полученную выше соль. Добавляли EtOH (800 мл) (получали суспензию) и температуру затем увеличивали до температуры флегмообразования с изменением 1 С/мин. Когда вся соль растворялась, температуру уменьшали с изменением 1 С/мин до 65 С. Когда достигалась эта температура (прозрачный гомогенный раствор), добавляли затравочные кристаллы (добавляли приблизительно 0,5 г). Кристаллизация инициировалась немедленно, но очень медленно. Температуру затем уменьшали до 20 С с изменением 0,5 С/мин. Смесь затем перемешивали (200 об./мин) в течение ночи. После фильтрования и сушки в вакууме получали 67,9 г соли. Анализ путем хиральной HPLC свободной кислоты соли продемонстрировал энантиомерный избыток 95,2% (энантиомерное отношение 97,6:2,4). Соль перекристаллизовывали еще один раз из EtOH(99,5%, 500 мл) с использованием того же самого способа, как описанный выше, но смесь оставляли перемешиваться в течение только 2 ч при комнатной температуре вместо перемешивания в течение ночи. После фильтрования и сушки получали 56,3 г кристаллов аммониевой соли. Анализ путем хиральнойHPLC свободной кислоты продемонстрировал энантиомерный избыток 99,1%. Вышеописанную аммониевую соль затем распределяли между метил-трет-бутиловым эфиром (400 мл) и 1 М HCl (водн., 300 мл). Водную фазу экстрагировали ТВМЕ (2100 мл). Объединенную органическую фазу промывали водой (100 мл) и затем сушили (MgSO4) и концентрировали. Это позволяло получить указанное в заголовке соединение в виде твердого вещества (32,5 г).(0,718 г, 5,88 ммоль) и пиридина (19,93 мл, 246,86 ммоль) в дихлорметане (250 мл) медленно (10 мин) добавляли хлортриметилсилан (30,6 мл, 240,98 ммоль). Смесь перемешивали при охлаждении на льду в течение 15 мин и затем при комнатной температуре в течение ночи. Смесь затем охлаждали в ледяной бане и добавляли DMF (0,211 мл, 2,74 ммоль), а затем медленно (15 мин) добавляли оксалилхлорид(10,25 мл, 121,08 ммоль). Суспензию перемешивали при 0 С в течение 1 ч и в течение 30 мин при комнатной температуре. Смесь затем использовали как таковую на следующей стадии. Выход (2R)-(4 фторфенил)-[(триметилсилил)окси]ацетоилхлорида предположили равным 100%.(iii) (Альтернатива 1). Этил-(5S)-1-[(2R)-2-(4-фторфенил)-2-гидроксиацетил]-4,5-дигидро-1 Нпиразол-5-карбоксилат. В атмосфере азота и при охлаждении на льду этилакрилат (13,00 мл, 120 ммоль) растворяли в гептане (60 мл) и толуоле (60 мл). Добавляли триметилсилилдиазометан (2M в гексанах, 60,0 мл, 120,00 ммоль). Раствор затем оставляли достигать комнатной температуры и перемешивали в течение 1,5 ч. Смесь затем концентрировали при пониженном давлении при 30 С. Это позволяло получить неочищенный промежуточный циклоаддукт, который использовали без дополнительной очистки. В атмосфере азота при охлаждении на льду к раствору (2R)-(4-фторфенил)[(триметилсилил)окси]ацетоилхлорида(30,7 г, 117,7 ммоль, см. (ii, в дихлорметане (250 мл) медленно (5 мин) добавляли неочищенный циклоаддукт с вышеприведенной стадии. Смесь затем оставляли достигать комнатной температуры и перемешивали в течение 2 ч. LC/MS анализ неочищенной смеси продемонстрировал правильный продукт и один побочный продукт, где триметилсилильная группа все еще остается интактной. Добавляли воду(300 мл). Водную фазу экстрагировали CH2Cl2 (100 мл). Объединенные органические слои концентрировали с получением вязкого масла (45 г). К нему затем добавляли Me-THF (100 мл) и TFA (44,6 мл, 600,00 ммоль). Смесь нагревали до 78 С и перемешивали в течение ночи. Добавляли воду (200 мл) и смесь затем оставляли интенсивно перемешиваться в течение 15 мин. Добавляли EtOAc (300 мл), фазы разделяли и органическую фазу концентрировали. Неочищенную диастереоизомерную смесь затем очищали путем хроматографии на силикагеле с использованием 20-60% EtOAc в гептане в качестве элюента. Чистые фракции, содержащие желаемый диастереоизомер, собирали и концентрировали. Перекристаллизация из горячей смеси EtOAc/гептан (30/70, 200 мл) позволила получить желаемое соединение в виде твердого вещества (8,9 г, выход 25%). 1 Н NMR (600 МГц, CDCl3)1.29 (t, 3 Н), 2.91 (ddd, 1H), 3.16 (ddd, 1H), 4.12(iii) (Альтернатива 2). Этил-(5S)-1-[(2R)-2-(4-фторфенил)-2-гидроксиацетил]-4,5-дигидро-1 Нпиразол-5-карбоксилат. В атмосфере азота этилакрилат (288 г, 2877 ммоль) растворяли в дихлорметане (4000 мл) при 20 С при скорости перемешивания 150 об./мин. Триметилсилилдиазометан (2M в гексанах, 1150 мл, 2301 ммоль) добавляли в течение периода 30 мин, после чего смесь перемешивали при 20 С в течение 19,5 ч. После охлаждения до -30 С трифторуксусную кислоту (443 мл, 5752 ммоль) медленно добавляли в течение периода 35 мин. Неочищенную смесь (R)-2-(4-фторфенил)-2-(триметилсилилокси)ацетилхлорида(600 г, 2301 ммоль) в дихлорметане (4000 мл) медленно добавляли в течение 110 мин, в течение этого времени температуре давали возможность увеличиваться до 20 С. Смесь перемешивали при 20 С в течение 45 мин, после чего EtOH (500 мл) и воду (500 мл) добавляли одной порцией. Смесь перемешивали при 200 об./мин в течение 50 мин, добавляли воду (2500 мл), перемешивали 5 мин при 200 об./мин, затем слои оставляли разделяться в течение 10 мин. Водный слой (4 л) отделяли от органического (10,5 л) и к органическому слою добавляли раствор NaHCO3 (водн., 8%, 2,5 л). Смесь перемешивали в течение 10 мин при 200 об./мин, после чего органический слой (V = 9,75 л) отделяли от водного (3000 мл). Неочищенный продукт в растворе CH2Cl2 концентрировали в вакууме при 40 С в течение 15 ч. EtOAc (2000 мл) и гептан (1000 мл) добавляли к твердому веществу и получающуюся в результате смесь нагревали до температуры флегмообразования. Добавляли еще 1000 мл гептана, после чего добавляли затравочные кристаллы (200 мг) (5S)-N-[5-хлор-2-(1 Н-тетразол-1-ил)бензил]-1-[(2R)-2-(4-фторфенил)-2-гидроксиацетил]-4,5-дигидро-1 Н-пиразол-5-карбоксамида, что приводило в результате к немедленной кристаллизации. Скорость перемешивания устанавливали равной 100 об./мин и температуру уменьшали до 20 С со скоростью 1 С/мин и смесь затем перемешивали в течение ночи. Смесь фильтровали через фильтр Р 3 и осадок на фильтре промывали смесью EtOAc/гептан (50/50, 3300 мл). Твердое вещество затем сушили в вакууме с получением указанного в заголовке соединения (345 г, выход 51%).(iv) (5S)-1-[(2R)-2-(4-Фторфенил)-2-гидроксиацетил]-4,5-дигидро-1 Н-пиразол-5-карбоновая кислота. К раствору ацетонитрила (70 мл), воды (1,5 мл) и LiBr (12,69 г, 146,12 ммоль) добавляли этил-(5S)1-[(2R)-2-(4-фторфенил)-2-гидроксиацетил]-4,5-дигидро-1 Н-пиразол-5-карбоксилат (8,6 г, 29,22 ммоль),а затем триэтиламин (10,13 мл, 73,06 ммоль). Гомогенный прозрачный раствор затем перемешивали при комнатной температуре в течение ночи. Добавляли EtOAc (200 мл) и 1 М HCl (водн., 150 мл). Водную фазу экстрагировали EtOAc (100 мл). Объединенные органические слои затем концентрировали. Это позволяло получить 7,2 г желаемой кислоты в виде твердого вещества. Объединенные водные слои экстрагировали EtOAc (250 мл), а затем объединенные органические слои промывали водой (50 мл), выделяли еще 0,42 г продукта. Общий выход 98%. 1 Н NMR [400 МГц, (CD3)2SO]2.86 (ddd, 1H), 3.23 (ddd, 1H), 4.53 (dd, 1H), 5.71-5.77 (m, 2H), 7.077.15 (m, 3H), 7.36-7.42 (m, 2H), 12.97 (s, br, 1H).(5S)-N-[5-Хлор-2-(1 Н-тетразол-1-ил)бензил]-1-[(2R)-2-(4-фторфенил)-2-гидроксиацетил]-4,5 дигидро-1 Н-пиразол-5-карбоксамид. В открытом сосуде трет-бутил-5-хлор-2-(1 Н-тетразол-1-ил)бензилкарбамат (14 г, 45,20 ммоль, полученный, как описано в J. Med. Chem. 2004, 47, 2995) суспендировали в ацетонитриле (80 мл). Добавляли HCl (6 М водный раствор, 37,7 мл, 225,99 ммоль) и смесь затем перемешивали при комнатной температуре в течение 4 ч. Добавляли воду (200 мл) и ТВМЕ (100 мл). К водной фазе и при охлаждении на льду добавляли EtOAc (200 мл), а затем медленно добавляли 2 М NaOH (водн., 130 мл). Органическую фазу затем промывали водой (100 мл). К раствору EtOAc (220 мл), содержащему неочищенный (5-хлор 2-(1 Н-тетразол-1-ил)фенил)метанамин, затем добавляли (5S)-1-[(2R)-2-(4-фторфенил)-2-гидроксиацетил]-4,5-дигидро-1 Н-пиразол-5-карбоновую кислоту (7,53 г, 28,28 ммоль), а затем добавляли нметилморфолин (4,66 мл, 42,43 ммоль). К этому прозрачному гомогенному раствору затем одной порцией добавляли TBTU (10,90 г, 33,94 ммоль). Смесь затем перемешивали при комнатной температуре в течение ночи. Образующийся осадок отфильтровывали и затем промывали ТВМЕ (100 мл). После сушки в вакууме желаемое соединение получали в виде твердого вещества (7,65 г, 59%). Жидкость, оставшуюся после кристаллизации, разбавляли EtOAc и промывали Na2CO3 (водн., насыщ.), водой и 1 М HCl (водн.). Кристаллизация из смеси CH3CN/вода позволила получить 4,59 г указанного в заголовке соединения. Общий выход 88%. 1(m, 1 Н), 7.71 (d, 1 Н), 9.20 (s, 1H). Примеры 2-22 получали по аналогии с примером 1, описанным выше, с использованием подходящих исходных веществ. Пример 2. (5S)-N-[5-Хлор-2-(1 Н-тетразол-1-ил)бензил]-1-[(2,3-дифторфенил)-(гидрокси)ацетил]4,5-дигидро-1 Н-пиразол-5-карбоксамид. Н NMR (400 МГц, CD3OD) для наиболее сильного изомера:9.55 (s, 1H), 7.75 (d, 1H), 7.56 (dd,1 Н), 7.49 (d, 1 Н), 7.22-7.13 (m, 2 Н), 7.13-7.06 (m, 1 Н), 6.95 (br. t, 1H), 6.06 (s, 1H), 4.64 (dd, 1 Н), 4.30 (d,1H), 4.24 (d, 1H), 3.21-3.08 (m, 1H), 2.90-2.82 (m, 1 Н), HRMS (масс-спектрометрия высокого разрешения) Н NMR (500 МГц, CD3CN) для наиболее сильного изомера:9.23 (s, 1H), 7.73 (d, 1H), 7.57 (dd,1H), 7.48 (d, 1H), 7.40 (q, 1H), 7.33 (bt, 1H), 6.93-7.01 (m, 3H), 5.89 (d, 1H), 4.68 (dd, 1 Н), 4.17-4.31 (m, 3 Н),3.12 (dd, 1H), 2.95 (dd, 1H). HRMS (ESI) вычислено для C20H17ClF2N7O3 476,1049 (М+Н)+, найдено 476,1042. Пример 7. (5S)-N-[5-Хлор-2-(1 Н-тетразол-1-ил)бензил]-1-[(2R)-2-гидрокси-2-(3-метилфенил)ацетил]-4,5-дигидро-1 Н-пиразол-5-карбоксамид. Н NMR (500 МГц, CDCl3) для наиболее сильного изомера:9.00 (s, 1H), 7.83 (t, 1 Н), 7.62 (d, 1 Н),7.46 (dd, 1H), 7.27-7.16 (m, 4 Н), 7.11-7.07 (m, 1 Н), 6.95 (s, 1H), 5.77 (s, 1 Н), 4.74 (dd, 1 Н), 4.28 (d, 2 Н), 4.02H NMR (500 МГц, CDCl3) для наиболее сильного изомера:9.00 (s, 1H), 7.81 (br. t, 1 Н), 7.62 (d,1H), 7.47 (dd, 1H), 7.35 (ddd, 1H), 7.31-7.27 (m, 2H), 7.10 (dd, 1H), 7.02 (dd, 1H), 6.91 (br. s, 1H), 5.96 (d,1H), 4.81 (dd, 1H), 4.29 (d, 2H), 4.08 (d, 1H), 3.53 (dddd, 1H), 2.98-2.87 (m, 1H), HRMS (ESI) вычислено для Н NMR (500 МГц, CDCl3) для наиболее сильного изомера:8.95 (s, 1H), 7.64 (bt, 1H), 7.57 (d, 1H),7.45 (dd, 1H), 7.26 (d, 1H), 7.13 (ddd, 1H), 6.82-6.88 (m, 2H), 6.74-6.78 (m, 2 Н), 4.96 (bs, 1 Н), 4.86 (dd, 1 Н),4.18-4.38 (m, 4 Н), 3.36 (ddd, 1H), 2.78-2.93 (m, 2 Н), 1.99 (dt, 1H). Пример 13. (5S)-N-[5-Хлор-2-(1 Н-тетразол-1-ил)бензил]-1-[(2R)-2-гидрокси-2-фенилацетил]-4,5 дигидро-1 Н-пиразол-5-карбоксамид. Н NMR (600 МГц, CDCl3): прибл. 3:2 смесь диастереомеров, данные для основного изомера:9.02H NMR (400 МГц, CD3CN) для наиболее сильного изомера:9.19 (s, 1H), 7.64-7.78 (m, 4H), 7.437.57 (m, 3 Н), 7.27 (bt, 1H), 7.00 (s, 1H), 5.80 (d, 1H), 4.60 (dd, 1H), 4.30 (d, 1H), 4.25 (dd, 1H), 4.16 (dd, 1 Н),- 26018502 3.10 (ddd, 1H), 2.92 (ddd, 1H). HRMS (ESI) вычислено для C21H18ClN8O3 465,1190 (М+Н)+, найдено 465,1185. Пример 22.(5S)-N-[5-хлор-2-(1 Н-тетразол-1-ил)бензил]-1-[(2R)-2-(4-фторфенил)-2-гидроксиацетил]-4,5 дигидро-1 Н-пиразол-5-карбоксамиду (пример 1) (483 мг, 1,05 ммоль) в дихлорметане (10 мл) добавляли пиридин (2 мл) и уксусный ангидрид (100 мкл, 1,06 ммоль). Смесь перемешивали в течение 4 ч. Добавляли еще одну порцию уксусного ангидрида (600 мкл, 6,34 ммоль) и DMAP (23 мг, 0,19 ммоль) и смесь перемешивали в течение еще 15 ч. Растворители удаляли путем упаривания и остаток очищали при помощи HPLC (MeCN градиент от 0 до 100% в водном 0,1 М буфере NH4OAc, содержащем 5% MeCN, колонка С 8: 50300 мм). Соответствующие фракции собирали, объединяли и подвергали сублимационной сушке с получением указанного в заголовке соединения (476 мг, 90%) в виде твердого вещества. 1 Н NMR (500 МГц, CDCl3):9.07 (s, 1H), 7.60 (d, 1 Н), 7.53 (m, 2H), 7.46 (dd, 1H), 7.43 (bt, 1H), 7.28(d, 1H), 7.06 (m, 2H), 7.02 (bt, 1H), 6.53 (s, 1H), 4.81 (dd, 1H), 4.27 (dd, 1H), 4.18 (dd, 1H), 3.30 (ddd, 1H),3.11 (ddd, 1H), 2.13 (s, 3H), HRMS (ESI) вычислено для C22H19ClFN7O4 500,1249 (M+H)+, найдено 500,1267. Примеры 24-27 получали по аналогии с примером 23, описанным выше, с использованием подходящих исходных веществ. Пример 24.(93 мл, 723 ммоль). Через 2 ч суспензия становилась слегка более густой, а через 3 ч суспензия становилась очень густой. Добавляли еще одну порцию 2-метил-THF (2 л) и дополнительную лопасть прикрепляли к мешалке. Суспензию перемешивали при 30 С (температура рубашки) в течение ночи. Температуру затем уменьшали до 15 С и через 30 мин реакционную смесь фильтровали через воронку Бюхнера Р 3 и осадок на фильтре промывали этилацетатом (2250 мл). Белый продукт сушили при 40 С в вакууме с получением указанного в заголовке соединения (238 г, 77%) в виде твердого вещества. К маточному раствору (7,6 л) добавляли воду (2 л) и фазы разделяли. Органическую фазу осторожно упаривали до появления густого осадка. Суспензию отфильтровывали с получением после сушки второй партии указанного в заголовке соединения (37 г, 12%). 1(0,023 г, 0,188 ммоль) в CH2Cl2 (8 мл) при -10 С добавляли бензоилхлорид (135 мкл, 1,15 ммоль). Реакционную смесь оставляли достигать к.т. и перемешивали в течение 5 ч. Еще одну порцию бензоилхлорида (400 мкл, 3,4 ммоль). Смесь перемешивали в течение 60 ч. Анализ путем LCMS указал лишь на следовое количество продукта. Растворители удаляли путем упаривания и добавляли пиридин (5 мл, 62 ммоль), а затем еще одну порцию бензоилхлорида (400 мкл, 3,4 ммоль). Реакционную смесь нагревали до 70 С в течение ночи. LCMS анализ указывал на приблизительно 20% превращение исходного вещества. Растворитель упаривали и остаток очищали при помощи HPLC (MeCN градиент от 0 до 100% в 0,1 М буфере NH4OAc, содержащем 5% MeCN). Соответствующие фракции объединяли и лиофилизировали с получением указанного в заголовке соединения (77 мг, 13%) вместе с 289 мг не вступившего во взаимодействие исходного вещества. 1
МПК / Метки
МПК: A61P 7/02, C07D 405/14, C07D 403/12, A61K 31/422, A61K 31/4155, C07D 413/12
Метки: фармацевтические, композиции, гетероциклические, карбоксамиды, новые, содержащие
Код ссылки
<a href="https://eas.patents.su/30-18502-novye-geterociklicheskie-karboksamidy-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Новые гетероциклические карбоксамиды и фармацевтические композиции, содержащие их</a>
Предыдущий патент: Устройство для хранения компакт-дисков
Следующий патент: Замещенные производные индазола, активные как ингибиторы киназы
Случайный патент: Композиции активных веществ в форме наночастиц, способ получения водных дисперсий, способ борьбы с паразитирующими грибками