Аналоги аденозина, обладающие гипотензивным, кардиопротективным, антиишемическим и антилиполитическим свойствами
Номер патента: 1801
Опубликовано: 27.08.2001
Авторы: Полс Генри В., Эвинг Уильям Р., Чой-Следески Йонг-Ми, Магир Мартин П., Спада Альфред П., Майерс Майкл Р.
Формула / Реферат
1. Соединение
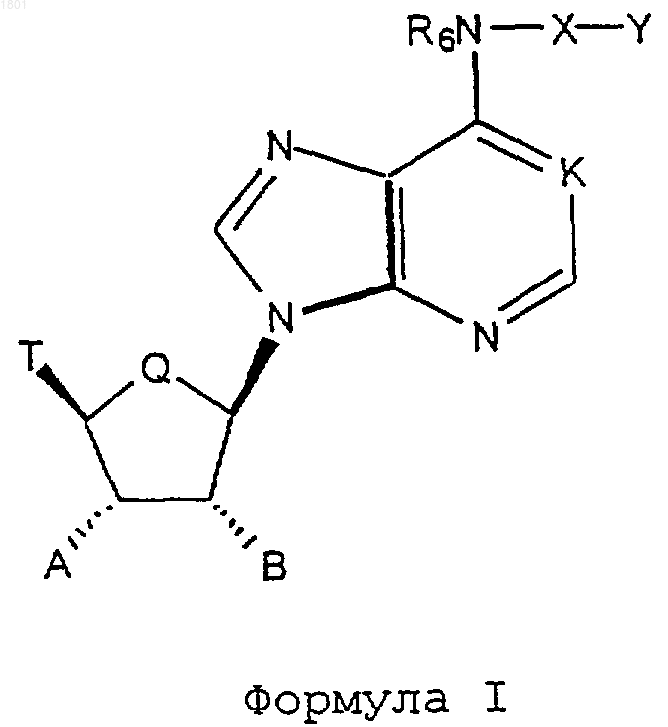
где K - N, N R О или СН;
Q - СН2 или О;
R6 - водород, С1-10алкил, аллил, 2-метилаллил, 2-бутенил или C3-10циклоалкил;
Х представляет собой
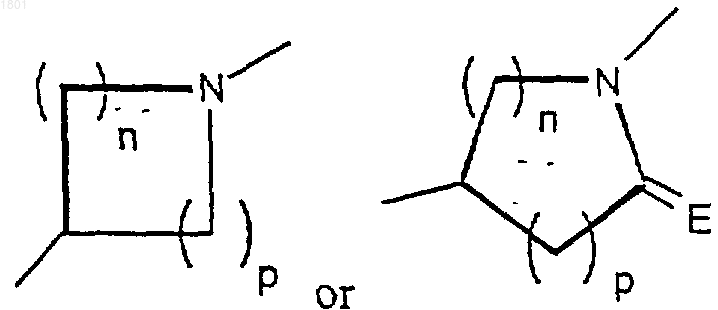
где азот в кольце Х замещен Y;
Е - О или S;
Y - водород, С1-20алкил, С1-20алкил, замещенный фенилом, С1-20алкил, замещенный нафтилом, С1-20алкил, замещенный замещенным фенилом, С1-20aлкил, замещенный замещенным нафтилом, 4-10 членное гетероциклическое кольцо, содержащее, по крайней мере, один атом N, O или S, замещенное 4-10 членное гетероциклическое кольцо, содержащее, по крайней мере, один атом N, О, S, С1-20алкил, замещенный 4-10 членным гетероциклическим кольцом, содержащим, по крайней мере, один атом N, О, S, или С1-20алкил, замещенный замещенным 4-10 членным гетероциклическим кольцом, содержащим, по крайней мере, один атом N, О, S;
n и p- независимо друг от друга 0, 1, 2 или 3, при условии, что n + р равно, по крайней мере, 1;
Т - водород, С1-20aлкил, С1-20aцил, С1-20тио-ацил, галоген, карбоксил,
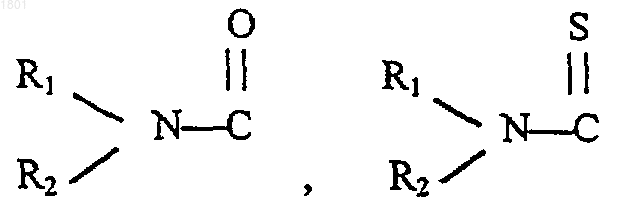 или R3О-СН2;
или R3О-СН2;
R1, R2 и R3 - независимо Н, С1-20aлкил, С3-10 циклоалкил,
А - Н, С1-20алкил, С1-20гидроксиалкил, С1-20 алкил, замещенный С1-20алкокси, OR';
В - Н, С1-20алкил, С1-20гидроксиалкил, С1-20 алкил, замещенный С1-20алкокси, OR";
R' и R" независимо Н, С1-20алкил, С1-20 алкил, замещенный фенилом, С1-20алкил, замещенный нафтилом, карбамоил, С1-20 алкилкарбамоил, ди-(С1-20алкил)-карбамоил, ацил, С1-20 алкоксикарбонил, фенил С1-20алкоксикарбонил, нафтилС1-20aлкоксикабонил, фенилоксикарбонил, нафтилоксикарбонил, или, когда А и В являются OR' или OR", соответственно R' и R" могут вместе образовать
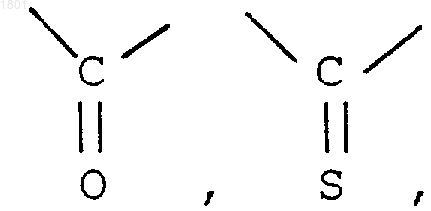
Н ORc, где Rc - водород, С1-20алкил,
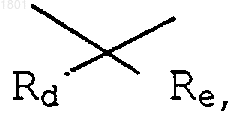
где Rd и Re - независимо водород, С1-20алкил; вместе с атомом углерода, с которым они соединены, могут образовывать С3-10 1,1-циклоалкильную группу;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором K представляет собой N, Т предсталяет собой гидроксиметил или метоксиметил; А и В - гидрокси; Х есть
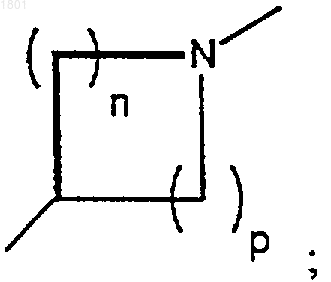
и n + р = 3 или 4;
или его фармацевтически приемлемая соль.
3. Соединение по п.2, которое включает:
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-[1-(5-хлорпиридин-2-ил)-пирролидин-3(S)-иламино]-пурин-9-ил]-тетрагидрофуран-3,4-диол,
(2R,3S,4R,5R)-2-гидроксиметил-5-[6-[1-(5-трифторметилпиридин-2-ил)-пирролидин-3(R)-иламино]-пурин-9-ил]тетрагидрофуран-3,4-диол,
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-[1-(5-трифторметилпиридин-2-ил)-пирролидин-3(S)-иламино]-пурин-9-ил]тетрагидрофуран-3,4-диол,
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-[1-(4-трифторметилпиридин-2-ил)-пирролидин-3(S)-иламино]-пурин-9-ил]тетрагидрофуран-3,4-диол,
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-[1-(5-бромпиридин-2-ил)-пирролидин-3(S)-иламино]-пурин-9-ил]тетрагидрофуран-3,4-диол,
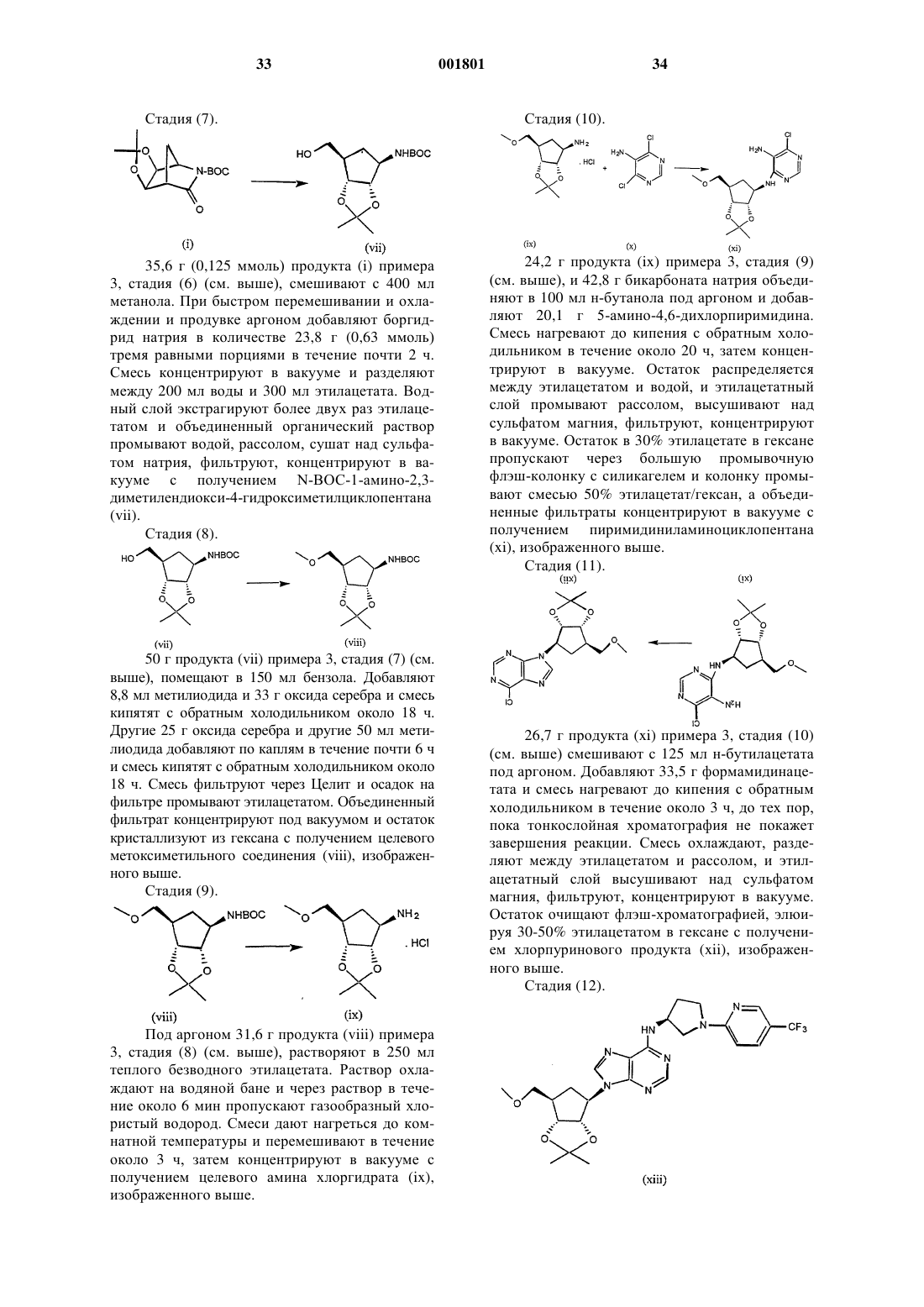
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-[1-(4-нитрофенил)-пирролидин-3(S)-иламино]-пурин-9-ил]тетрагидрофуран-3,4-диол,
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-(5'-трифторметил-3,4,5,6-тетрагидро-2Н-[1,2']-бипиридинил-3-ил)-пурин-9-ил]тетрагидрофуран-3,4-диол,
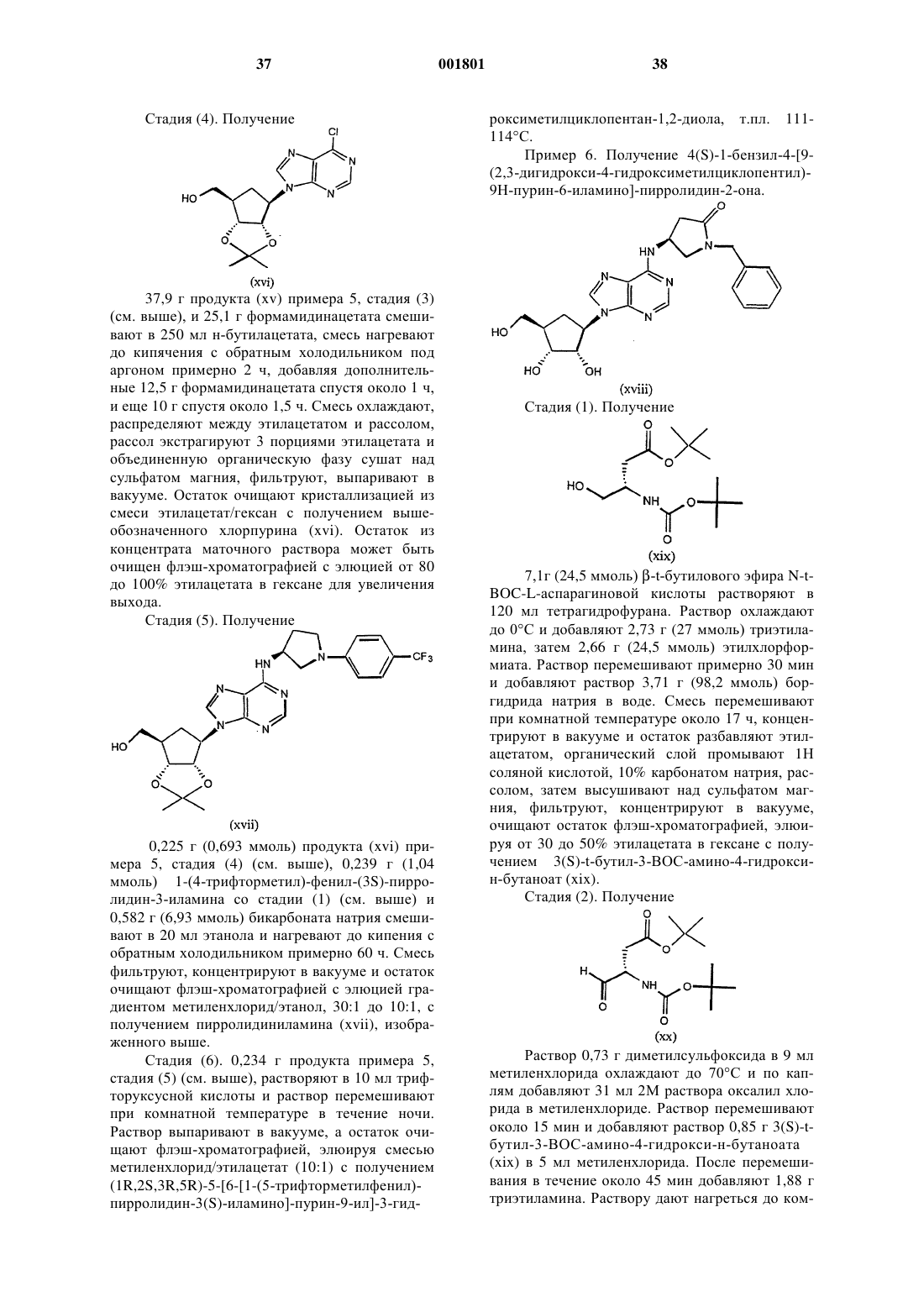
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-(фeнилпирpoлидин-3(S)-илaминo)-пyрин-9-ил] тетрагидрофуран-3,4-диол,
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-[1-пиридин-2-илпирролидин-3(S)-иламино]-пурин-9-ил]тетрагидрофуран-3,4-диол,
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-[1-(4-хлорфенил)-пирролидин-3(S)-иламино]-пурин-9-ил]тетрагидрофуран-3,4-диол,
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-[1-(5-метилпиридин-2-ил)-пирролидин-3(S)-иламино]-пурин-9-ил]тетрагидрофуран-3,4-диол,
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-[1-(5-тиофен-2-илпиридин-2-ил)-пирролидин-3(S)-иламино]-пурин-9-ил]тетрагидрофуран-3,4-диол,
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-[1-(5-метилмеркаптопиридин-2-ил)-пирролидин-3(S)-иламино]-пурин-9-ил]тетрагидрофуран-3,4-диол,
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-[1-(6-метоксипиримидин-4-ил)пирролидин-3(S)-иламино]-пурин-9-ил]тетрагидрофуран-3,4-диол,
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-[1-(6-хлорпиримидин-4-ил)пирролидин-3(S)-иламино]-пурин-9-ил]тетрагидрофуран-3,4-диол,
(2R,3R,4S,5R)-2-гидроксиметил-5-[6-[1-(6-хлорпиридазин-3-ил)пирролидин-3-иламино]-пурин-9-ил]тетрагидрофуран-3,4-диол,
(2R,3R,4S,5R)-2-метоксиметил-5-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]тетрагидрофуран-3,4-диол,
(1S,2R,3R,5R)-3-гидроксиметил-5-[6-[1-(4-нитрофенил)пиперидин-4-ил]-пурин-9-ил]циклопентан-1,2-диол,
хлордигидрат(1S,2R,3R,5R)-3-гидроксиметил-5-[6-((3S)-пирролидин-3-иламино)-пурин-9-ил]циклопентан-1,2-диола,
(1S,2R,3R,5R)-3-гидроксиметил-5-[6-[1-(4-нитрофенил)пирролидин-3-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1S,2R,3R,5R)-3-гидроксиметил-5-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(R)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1S,2R,3R,5R)-3-гидроксиметил-5-[6-((3R)пирролидин-3-иламино)-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(5-бромпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(5-хлорпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(4-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(пиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(хинолин-3-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-3-(4-нитрофенил)-пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(4,5-бис-трифторпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-3-метоксиметил-5-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(фенил)-пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
4-[3(S)-[9-(2,3-дигидрокси-4-гидроксиметилциклопентил)-9Н-пурин-6-иламино] пирролидин-1-ил]бензонитрил,
(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(изохинолин-1-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(6-бромхинолин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(4-хлорфенил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-3-[6-[1-(3-хлор-5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-метоксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(6-хлорпиримидин-4-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(6-хлорпиримидин-4-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(6-хлорпиримидин-4-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-метоксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(6-хлорпиридазин-3-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-3-метоксиметил-5-[6-[1-(6-метоксипиримидин-4-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(6-хлорпиридазин-3-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-метоксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(4-трифторметил-фенил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(5-бромпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-метоксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(5-хлорпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-метоксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-3-метоксиметил-5-[6-[1-(4-трифторметилфенил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(4-хлорфенил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-метоксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(3-хлорфенил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-метоксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(3-хлорфенил)-пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-3-метоксиметил-5-[6-[1-фенилпирролидин-3(S)-иламино]-пурин-9-ил] циклопентан-1,2-диол,
(1R,2S,3R,5R)-3-[6-(1-бензилпирролидин-3(S)-иламино)пурин-9-ил]-5-гидроксиметилциклопентан-1,2-диол или
(1R,2S,3R,5R)-3-[6-(1-бензилпирролидин-3(S)-иламино)пурин-9-ил]-5-метоксиметилциклопентан-1,2-диол,
или их фармацевтически приемлемые соли.
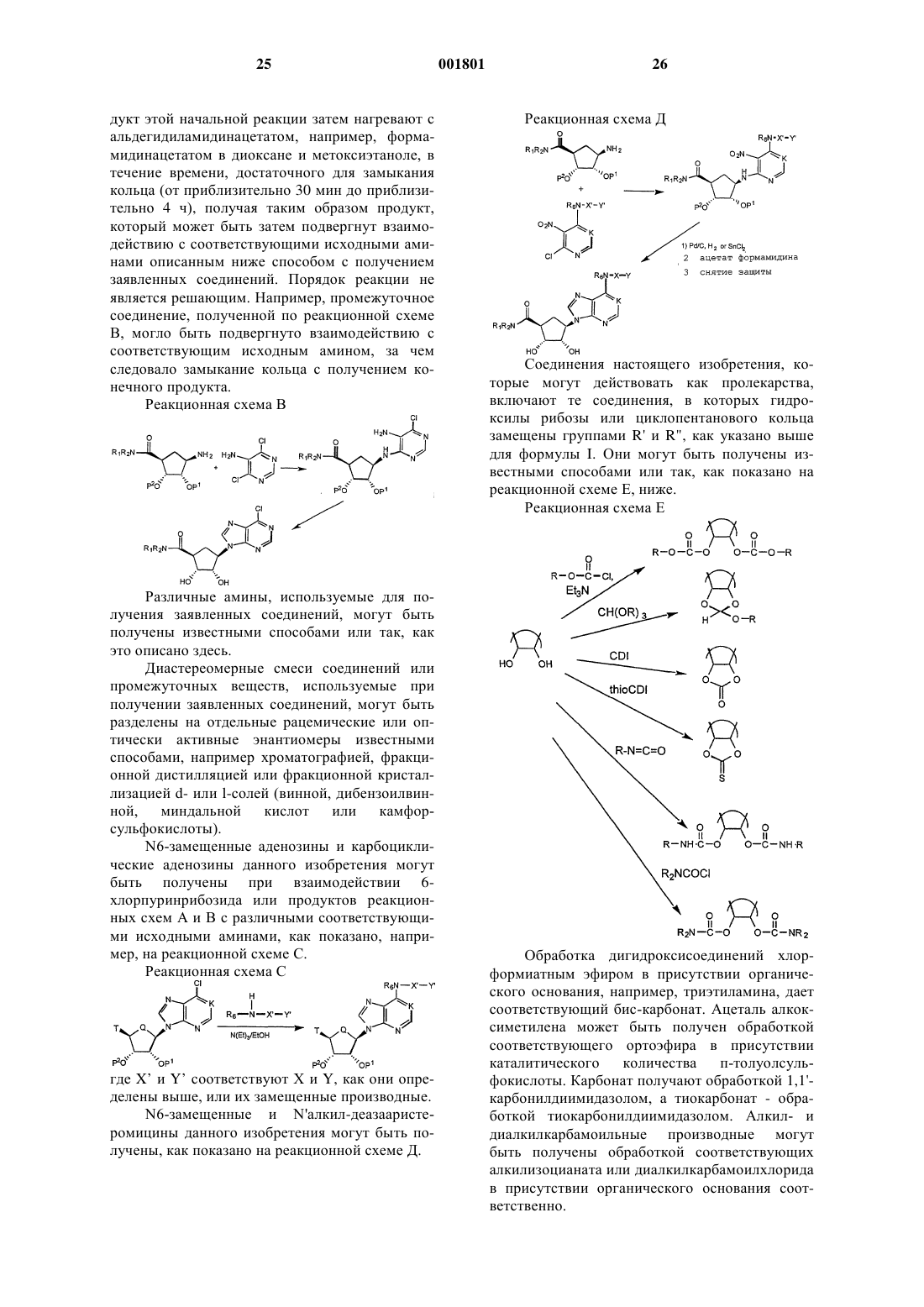
4. Соединение по п.1, в котором Q есть СН2, K представляет собой N, Т представляет собой
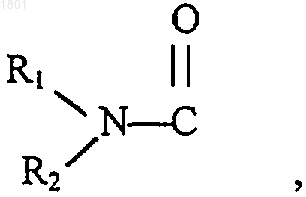
где R1 является Н, a R2 является C1-6алкилом, А и В оба гидрокси, Х представляет собой
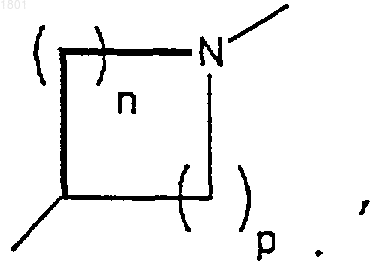
a n + р = 3 или 4,
или его фармацевтически пригодная соль.
5. Соединение по п.4, которое включает этиламид (1S,2R,3S,4R)-2,3-дигидрокси-4-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3-иламино]-пурин-9-ил]циклопентанкарбоновой кислоты, (S)-втор-бутиламид(1S,2R,3S,4R)-2,3-дигидрокси-4-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3-иламино]-пурин-9-ил] циклопентанкарбоновой кислоты и (R)-вторбутиламид (1S,2R,3S,4R)-2,3-дигидрокси-4-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3-иламино]-пурин-9-ил]циклопентанкарбоновой кислоты и его фармацевтически приемлемая соль.
6. Соединение по п.1, в котором Q представляет собой СН2, K представляет собой N, Т является гидроксиметилом или метоксиме-тилом, А и В - гидрокси, Х представляет собой
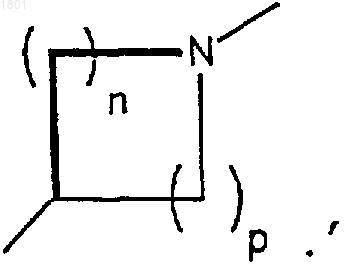
а n + р = 3 или 4, или их фармацевтически приемлемая соль.
7. Соединение по п.6 представляющее собой
(1S,2R,3R,5R)-3-гидроксиметил-5-[6-[1-(4-нитрофенил)пиперидин-4-ил]-пурин-9-ил]циклопентан-1,2-диол,
дигидрохлoрид(1S,2R,3R,5R)-3-гидроксиметил-5-[6-((3S)-пирролидин-3-иламино)-пурин-9-ил]циклопентан-1,2-диол,
(1S,2R,3R,5R)-3-гидроксиметил-5-[6-[1-(4-нитрофенил)пирролидин-3-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1S,2R,3R,5R)-3-гидроксиметил-5-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(R)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1S,2R,3R,5R)-3-гидроксиметил-5-[6-((3R)-пирролидин-3-иламино)-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(5-трифторметилпиридин-2-ил)-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(5-бромпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(5-хлорпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(4-трифторметилпиридин-2-ил)-пирролидин-3(S)-иламино]-пурин-9-ил]цикпопентан-1,2-диол,
(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(пиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(хинолин-3-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-3-(4-нитрофенил)-пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(4,5-бис-трифторпиридин-2-ил)-пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-3-метоксиметил-5-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(фенил)-пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
4-[3(S)-[9-(2,3-дигидрокси-4-гидроксиметилциклопентил)-9Н-пурин-6-иламино]пирролидин-1-ил]бензонитрил,
(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(изохинолин-1-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(6-бромхинолин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(4-хлорфенил)пирролидин-3(3)-иламино]-пурин-9-ил]-3-гидроксиметилцикпопентан-1,2-диол,
(1R,2S,3R,5R)-3-[6-[1-(3-хлор-5-трифтор-метилпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-метоксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(6-хлорпиримидин-4-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(6-хлорпиримидин-4-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(6-хлорпиримидин-4-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-метоксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(6-хлорпиридазин-3-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-3-метоксиметил-5-[6-[1-(6-метоксипиримидин-4-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(6-хлорпиридазин-3-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-метоксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(4-трифторметилфенил)-пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(5-бромпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-метоксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(5-хлорпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-метоксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-3-метоксиметил-5-[6-[1-(4-трифторметилфенил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(4-хлорфенил)-пирролидин-3(S)-иламино]-пурин-9-ил]-3-метоксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(3-хлорфенил)-пирролидин-3(S)-иламино]-пурин-9-ил]-3-метоксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-[6-[1-(3-хлорфенил)-пирролидин-3(S)-иламино]-пурин-9-ил]-3-гидроксиметилциклопентан-1,2-диол,
(1R,2S,3R,5R)-3-метоксиметил-5-[6-[1-фенилпирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол,
(1R,2S,3R,5R)-3-[6-(1-бензилпирролидин-3(S)-иламино)-пурин-9-ил]-5-гидроксиметилциклопентан-1,2-диол или
(1R,2S,3R,5R)-3-[6-(1-бензилпирролидин-3(S)-иламино)-пурин-9-ил]-5-метоксиметилциклопентан-1,2-диол, или его фармацевтически приемлемая соль.
8. Соединение по п.6, представляющее собой (1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол или (1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(4-трифторметилпиридин-2-ил)пирролидин-3(S)-ил-амино]-пурин-9-ил]циклопентан-1,2-диол, или его фармацевтически приемлемая соль.
9. Соединение по п.6, которое представляет собой (1R,2S,3R,5R)-3-метоксиметил-5-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол или (1R,2S,3R,5R)-3-метоксиметил-5-[6-[1-(4-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]-3-циклопентан-1,2-диол или их фармацевтически приемлемые соли.
10. Соединение формулы
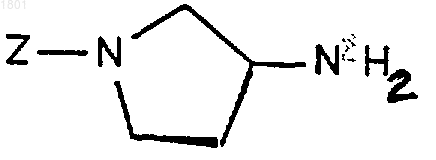
где Z представляет собой 4-трифторметилпиридин-2-ил шыш 5-трифторметилпиридин-2-ил.
11. Соединение по п.10, которое представляет собой 2-[(3S)-3-аминопирролидин-1-ил]-5-трифторметилпиридин или 2-[(3S)-3-аминопирролидин-1-ил]-4-трифторметилпиридин.
12. Композиция для лечения сердечно-сосудистого заболевания, характеризующегося гипертонией или миокардиальной ишемией, содержащая гипотензивное эффективное количество или антиишемически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
13. Композиция для уменьшения области ишемического поражения или уменьшения обширности инфаркта миокарда, являющегося следствием миокардиальной ишемии, содержащая кардиопротективное количество соединения по п.1 и фармацевтически приемлемый носитель .
14. Композиция для понижения уровней липидов, уровней триглицеридов или уровней холестерина у млекопитающих, содержащая антилиполитическое количество соединения по п.1 и фармацевтически приемлемый носитель.
15. Способ лечения больных гипертонией, включающий введение такому больному эффективно снижающего кровяное давление соединения по п.1.
16. Способ лечения больного, страдающего миокардиальной ишемией, включающий введение такому больному эффективного антиишемического количества соединения по п.1.
17. Способ лечения больного, страдающего гиперлипидемией или гиперхолестеринемией, включающий введение такому больному эффективного антилиполитического количества соединения по п.1.
Текст
1 Данное изобретение относится к соединениям, производным аденозина и его аналогам,фармацевтическим композициям, содержащим такие соединения, их использованию при лечении гипертонии и ишемической болезни сердца,а также в качестве кардиопротективных средств,которые уменьшают интенсивность ишемического поражения или обширность инфаркта миокарда, являющего следствием ишемии, и их использованию в качестве антилиполитических средств, которые понижают уровень липидов в плазме, уровни сывороточных триглицеридов и уровень холестерина в плазме, а также к способам и промежуточным соединениям, используемым для получения этих соединений. Гипертония Гипертония, состояние повышенного кровяного давления, оказывает влияние на значительное число людей. Последствия устойчивой гипертонии включают поражение сосудов зрительной, почечной, сердечной и церебральной систем, а риск этих осложнений возрастает по мере того, как повышается кровяное давление. Основными факторами, регулирующими кровяное давление, являются минутный сердечный выброс и сопротивление периферических сосудов с преобладающим общим механизмом последнего, на который оказывают влияние различные условия. Симпатическая нервная система регулирует сопротивление периферических сосудов непосредственным влиянием на - и адренергические рецепторы, а также косвенно посредством выделения ренина. Лекарственная терапия направлена на специфические компоненты этих систем регуляции кровяного давления с различными механизмами действия, определяющими несколько классов лекарств, включающих бета-адренергические рецепторные антагонисты (бета-блокаторы), ингибиторы ангиотензинпревращающего фермента (АСЕ) и антагонисты кальциевых каналов. Диуретики тиазидного типа используются при гипертонии для уменьшения сопротивления периферических сосудов с учетом их влияния на выведение натрия и воды. Этот класс лекарств включает гидрохлортиазид, хлортиазид, метиклотиазид и циклотиазид, а также родственные средства - индапамид, метолазон и хлорталидон. Несмотря на то, что некогда полагали, что механизм действия бета-блокаторов - это блокада бета 1-гадренергических рецепторов в сердце с целью понижения частоты сердечных сокращений и минутного сердечного выброса, более новые бета-блокаторы со свойственной им симпатомиметической активностью (ISA), включающие пиндолол, ацетобутолол, пенбутолол и картеолол, также являются эффективными, как и не обладающие ISA бета-блокаторы, вызывающие меньшее снижение частоты сердечных сокращений и минутного сердечного выброса. Другие теоретически принятые механизмы действия, присущие этому типу лекарств, включа 001801 2 ют ингибирование выделения ренина, главный эффект, и воздействие на предсинаптические бета-адренергические рецепторы, приводящие к ингибированию выделения норэпинефрина. Кардиоселективный бета-блокатор метопролол (Lopressor-Geigy), ацетобутолол (SectralWyeth) и атенолол (Tenormin-ICI) в малых дозах оказывают большее воздействие на бетаадренергические рецепторы, чем на бета 2 адренергические рецепторы, локализованные в бронхах и кровеносных сосудах. Неселективные бета-блокаторы воздействуют на оба подтипа бета-адренергических рецепторов и включают пропранолол (Inderal-Ayerst), тимолол (Blokadren-Merck), надолол (Corgard-Squibb), пиндолол (Visken-Sandoz), пенбутолол (LevatolHoechst-Roussel) и картеолол (Cartrol-Abbott). Побочные эффекты бета-блокаторов включают асимптоматическую брадикардию, обострение застойной сердечной недостаточности, желудочно-кишечные расстройства, затруднения дыхания, скрытые симптомы гипоклемии и снижение объема циркулирующей крови. Они могут вызывать повышение уровня сывороточных триглицеридов и могут понижать липопротеиновый холестерин высокой плотности. АСЕ ингибиторы предотвращают образование ангиотензина II и ингибируют распад брадикинина. Ангиотензин II является эффективным вазоконстриктором, а также стимулирует секрецию альдостерона. Вызывая блокаду ренин-ангиотензин-альдостероновой системы,эти агенты уменьшают периферическое сосудистое сопротивление, а также удерживание натрия и воды. Кроме того, АСЕ ингибиторы повышают уровни брадикинина и простагландинов, эндогенных вазодилятаторов. Ведущими АСЕ ингибиторами являются Каптоприл(Capoten-Squibb) и Эналаприл (Vasotec-Merck). Побочными эффектами АСЕ ингибиторов являются сыпь, расстройство вкуса, протеинурия и нейтропения. Антагонисты кальциевых каналов уменьшают поступление кальция в клетки гладкой мышцы сосуда и вызывают общее расширение кровеносных сосудов, что и обеспечивает в результате их гипотензивный эффект. К другим эффектам антагонистов кальциевых каналов относится их свойство препятствовать действию ангиотензинаII и блокаде альфа 2 адренергических рецепторов, которое может дополнять их гипотензивные свойства. Антагонисты кальциевых каналов не имеют вредных метаболических и фармакологических эффектов тиазидов и бета-блокаторов и могут, таким образом, быть полезны больным диабетом, периферическими сосудистыми заболеваниями или заболеванием хронической закупорки легких. Два антагониста кальциевых каналов, Верапамил и дилтиазем, оказывают серьезные нежелательные эффекты в отношении сосудов сердца на антивентрикулярную проводимость сердца у 3 больных с предрасположенностью к нарушениям проводимости, и их может беспокоить брадикардия, закупорка сердца и застойная сердечная недостаточность. Другие отрицательные побочные эффекты антагонистов кальциевых каналов включают периферические отеки, головокружение, бестолковость, головную боль,тошноту, приливы жара, особенно нифедипин и никардипин. Многие другие средства пригодны для лечения гипертонии. К этим средствам относятся празозин и теразоцин, антагонисты альфа 1-адренергических рецепторов, гипотензивное действие которых является результатом артериальной вазодилятации; клонидин, альфа 2 адренергический агонист, который оказывает как всеобщее, так и периферическое воздействие на ингибирующие альфa2-адренергические рецепторы, уменьшая симпатическую реакцию. К другим действующим на ЦНС агентам относятся метилдопа, кванабенз и кванфасин; резерпин, который действует, истощая запасы катехоламинов; кванадрел, периферический адренергический антагонист, аналогичный кванатидину с более короткой продолжительностью действия; и непосредственно воздействующие дилататоры, такие как гидралазин и миноксидил. Эти средства, несмотря на эффективность, вызывают заметные симптоматические побочные эффекты, включая симпатическую стимуляцию рефлексов и удерживание жидкости, ортостатическую гипертонию и импотенцию. Многие гипотензивные средства активируют компенсаторные прессорные механизмы,например, увеличенное выделение ренина, повышенную секрецию альдостерона и повышенный симпатический вазоконстрикторный тонус,которые предназначены для возвращения артериального давления к уровням, который был до лечения и который может привести к удерживанию соли и воды, отекам и, в конечном итоге, к устойчивости к гипотензивным свойствам средства. К тому же вследствие целого ряда познанных на практике побочных эффектов имеющегося в настоящее время ассортимента гипотензивных лекарств и проблем, с которыми сталкиваются на практике определенные категории больных, включающие пожилых, темнокожих; пациентов с хроническим заболеванием закупорки легких, диабетом или периферическими васкулярными заболеваниями, существует потребность в дополнительных видах лекарств для лечения гипертонии. Ишемия Ишемия сердца - есть результат дисбаланса снабжения сердца кислородом и потребности в нем и включает напряженную и вазоспастическую дисфункцию миокарда. Ишемию напряжения, в основном, связывают с присутствующим угрожающим стенозирующим атеросклерозом, захватывающим крупные коронарные артерии, приводящим к уменьшению ме 001801 4 жэндокардиального кровотока. Вазоспастическая ишемия связана со спазмом локальной разновидности, начало которого не связывают с напряжением или стрессом. Этот спазм лучше определять как резкое повышение тонуса сосудов. Механизмы вазоспастической ишемии включают: (i) повышенный тонус сосудов в точке стеноза вследствие увеличенной секреции катехоламинов; (ii) быструю закупорку внутри просвета сосуда; (iii) высвобождение вазоактивных веществ, образуемых тромбоцитами в местах поражения эндотелия. Коронарное кровообращение уникально с той точки зрения, что оно снабжает орган, который создает перфузионное давление во всей системе кровообращения. Таким образом, вмешательства, которые изменяют состояние периферического кровоснабжения и сократимость,будет оказывать глубокое влияние на коронарное кровообращение. Регуляторным компонентом коронарной сосудистой системы являются небольшие коронарные артериолы, которые могут значительно изменять свой внутренний диаметр. Изменение внутреннего радиуса является результатом или внутреннего сокращения мышцы сосуда (ауторегуляция), или экстраваскулярного сжатия вследствие сокращения желудочка. Общий эффект терапии ишемической болезни предусматривает сложное взаимодействие противопоставленных факторов, которое решает проблему снабжения кислородом и потребности в нем. Кардиопротектирование и профилактика ишемической болезни Разработка новых лекарственных средств,способных ограничивать распространение поражений сердца, т.е. расширения области инфаркта миокарда после резкой миокардиальной ишемии, является главной задачей современной кардиологии. Возникновение тромболитической(растворяющей тромбы) терапии в течение последнего десятилетия показывает, что раннее вмешательство во время сердечной атаки может приводить к значительному снижению опасности для ткани миокарда. С тех пор обширными клиническими испытаниями документально подтверждено, что тромболитическая терапия уменьшает риск развития нарушений сердечного ритма, а также сохраняет способность сердца функционировать как насос. Показано, что такое предохранение нормальной функции сердца уменьшает отдаленную смертность вследствие инфаркта. Представляет также интерес развитие терапии, способной обеспечивать дополнительную защиту сердца, которую можно проводить совместно с тромболитической терапией, или без нее, т.к. ретроспективные эпидемиологические исследования показали, что смертность в течение первых нескольких лет после инфаркта,по-видимому, связана с первоначальной обширностью области инфаркта. 5 В предклинических исследованиях инфаркта, проводимых на различных животныхмоделях, было показано, что множество типов фармакологических средств, таких как блокаторы кальциевых каналов, аналоги простациклина и средства, способные ингибировать определенные пути метаболизма, способны уменьшать ишемические поражения у некоторых опытных животных. Недавние исследования показали, что обнажение миокарда в краткие периоды ишемии(прерывание кровотока в сердце) с последующей реперфузией (восстановление кровотока) может предохранить сердце от существенного ишемического поражения, что в противном случае привело бы от последующей выдержки к более длительному периоду ишемии. Это явление названо сохранением состояния сердца, и считают, что оно частично имеет отношение к высвобождению аденозина во время периода сохранения состояния сердца. Другими исследованиями показано, что аденозин и аналоги аденозина уменьшают степень поражения ткани, что наблюдается вслед за прерыванием кровотока в сердце при различных видах ишемических поражений на некоторых образцах (см., например, Toombs, С. et al.,"Myocardial protective effects of adenosine. Infarct(5), 170-176 (1992. Соединения настоящего изобретения имитируют сохранение состояния сердца, уменьшая, таким образом, ишемические поражения или вызывая уменьшение области инфаркта миокарда вследствие ишемии, и являются таким образом полезными в качестве кардиопротективных средств. Антилиполиз Известно, что гиперлипидемия и гиперхолестеринемия - два основных фактора риска атеросклероза и сердечно-сосудистых заболеваний,главных причин смерти и нетрудоспособности в странах Запада. Хотя этиология атеросклероза связано со множеством факторов, развитие атеросклероза и состояний, связанных с заболеванием коронарных артерий, периферическим васкулярным заболеванием и заболеванием сосудов головного мозга, являющихся следствием нарушения кровообращения, связывают с отклонениями уровней холестерина и липидов в сыворотке. Этиология гиперхолестеринемии и гиперлипидемии носит, в основном, генетический характер, хотя такие факторы, как диетическое потребление насыщенных жиров и холестерина,тоже могут оказывать свое влияние. 6 Антилиполитическая активность аденозина и аналогов аденозина повышается вследствие активации A1 рецепторов (Lohse, M.J., et al., Recent Advances in Receptor Chemistry, Melchiorre,C. and Gianella, Eds, Elsevier Science PublishersB.V., Amsterdam, 1988, 107-121). Стимуляция рецепторов этого типа понижает концентрацию внутриклеточного циклического АМФ в адипоцитах. Циклический АМФ - необходимый кофактор для энзима липопротеинлипазы, которая гидролитически расщепляет триглицериды в адипоцитах на свободные жирные кислоты и глицерин (Egan, J.J., et аl., Рrос. Natl. Acad. 1992(89), 8357-8541). Соответственно, уменьшение концентрации внутриклеточного циклического АМФ в адипоцитах уменьшает активность липопротеинлипазы и, как следствие, гидролиз триглицеридов. Повышенное кровяное давление и липиды в плазме, включающие триглицериды - два хорошо известных фактора риска, связанных со смертностью в результате сердечно-сосудистых заболеваний. Для больных диабетом, у которых вероятность смертности от сердечно-сосудистых заболеваний существенно выше, риск, связанный с этими факторами, еще более возрастает (Bierman, E.L., Arteriosclerosis and Trombois 1992(12), 647-656). Кроме того, есть данные, которые наводят на мысль, что избыточный липолиз характерен для инсулин-независимого диабета и,возможно, приводит к невосприимчивости инсулина и гипергликемии (Swislocki, A.L., Ноrm.Metab. Res. 1993 (25), 90-95). Соединения настоящего изобретения как гипотензивные и антилиполитические средства являются полезными при лечении и снижении роли как сосудистых, так и метаболических факторов риска и представляют собой особую ценность при использовании. Настоящее изобретение относится к классу аналогов аденозина и их использованию при лечении гипертонии, ишемии сердца, в качестве кардиопротективных средств, которые уменьшают ишемические поражения или инфаркт миокарда как результат ишемии, и в качестве антилиполитических средств, которые снижают уровень липидов в плазме, уровни сывороточных триглицеридов и уровни холестерина в плазме, а также и к промежуточным соединениям, используемым способам получения таких соединений. Аденозин обладает множеством физиологических и фармакологических функций и свойств, включая заметную перестройку функции сердечно-сосудистой системы и почек. У животных и человека внутривенное введение аденозинового нуклеотида вызывает гипотензию. В физиологических и фармакологических действиях аденозина задействованы специфические рецепторы, локализованные на поверхности клетки. Обнаружены четыре типа рецепто 7 ров аденозина, обозначенные как A1, А 2A, А 2B и А 3. A1 рецептор ингибирует образование цАМФ подавлением активности аденилатциклазы, тогда как стимуляция A2 рецептора увеличивает активность аденилатциклазы и цАМФ. Каждый рецептор, по-видимому, участвует в специфических действиях аденозина в различных тканях: например, васкулярное действие аденозина проявляется, по-видимому, благодаря стимуляции А 2 рецептора, которая поддерживается позитивной корреляцией между образованием цАМФ и вазорелаксацией выделенной гладкой сосудистой мышцы, обработанной аденозином; хотя стимуляция A1 рецепторов сердца уменьшает образование цАМФ в сердце, что способствует негативным дромотропным, инотропным и хронотропным кардиальным эффектам. Следовательно, в отличие от большинства дилататоров,введение аденозина не вызывает рефлекса тахикардии. Аденозин также оказывает существенное влияние на функцию почек. Интраренальная инфузия аденозина вызывает кратковременное снижение кровоснабжения почек и повышение сопротивления сосудов в почках. При продолжительной инфузии аденозина почечное кровоснабжение возвращается к контрольному уровню и сопротивление сосудов в почках падает. Первоначальные ренальные вазоконстрикторные реакции на аденозин не являются следствием воздействий нуклеотида на вазоконстрикторы, но включают взаимодействия между аденозином и системой ренин-ангиотензин. Аденозин считается общепризнанным первичным физиологическим медиатором реактивной гиперемии и ауторегуляции ложа коронарного сосуда в ответ на ишемию миокарда. Известно, что коронарный эндотелий обладает А 2 рецепторами аденозина, связанными с аденилатциклазой, которые активируются параллельно с увеличением коронарного тока, и что рецепторы кардиомиоцитов преимущественно аденозинового A1 типа и связаны с брадикардией. Соответственно, аденозин предлагает уникальный механизм терапии ишемии. Кардиоваскулярные реакции на аденозин являются кратковременными благодаря быстрому поглощению и вследствие метаболизма эндогенного нуклеотида. Наоборот, аналоги аденозина более устойчивы к метаболическому распаду, и сообщается о том, что добились длительных изменений артериального давления и частоты сокращений сердца. Были синтезированы несколько мощных метаболически устойчивых аналогов аденозина,демонстрирующих различающиеся степени селективности к двум типам рецепторов. Агонисты аденозина, в основном, показали большую селективность к A1 рецепторам, чем к А 2 рецепторам. Циклопентиладенозин (ЦПА) и Rфенилизопропиладенозин (R-PIA) - стандартные агонисты аденозина, которые показывают зна 001801(NECA) является сильным агонистом А 2 рецептора (Ki - 12 нМ), но имеет главное сродство кA1 рецептору (Ki - 6,3 нМ; A2 = 0,19), даже несмотря на то, что соединение в 10 раз слабее,чем NECA в его аффинности к А 2 рецептору. Недавними исследованиями были открыты более новые соединения, которые оказались очень сильными и селективными A2 агонистами (Ki 3-8 нМ для A1; A2/A1 = 0,027-0,042) (С.Е. MullerN6-apил и N6-гетероарилалкил замещенные аденозины и замещенные (2-амино и 2 гидрокси)аденозины проявляют различную фармакологическую активность, включая и активность в отношении сердца и кровеносных сосудов. См., например, описание патента Великобритании 1123245, вылож. заявку Германии 2136624, вылож. заявку Германии 2059922, вылож. заявку Германии 2514284, Патент ЮАР; 67/7630, US патент 4501735, публикацию ЕР 0139358 (раскрыты N6-[геминал диарил замещ. алкил]аденозины), патентную заявку ЕР сер.88106818.3 (описано, что N6 гетероциклозамещенные производные аденозина проявляют кардиососудорасширяющую активность), вылож. заявку Германии 2131938(раскрывающую N6-арил и гетероциклозамещенные аденозины), вылож. заявку Германии 2205002 (раскрыты аденозины с N6 зaмecтитeлями, включающие мостиковые кольцевые структуры, поперечно связывающие N6 азот с заместителями, включающими тиенил) и патент ЮАР 68/5477 (раскрывающий замещенные 2-гидроокси по N6-индолилу аденозины). Патент 4954504 и ЕР публикация 0267878 описывают в целом, что карбоциклические на основе рибозы аналоги аденозина и их фармацевтически пригодные эфиры, замещенные в положениях 2- и/или N6-арил-низший-алкилгруппами, включающими тиенил, тетрагидропиранил, тетрагидротиапиранил и бициклобензоконденсированные 5- или 6-членные насыщенные гетероциклические производные низших алкилов, проявляют свойства агонистов аденозина. Аналоги аденозина, имеющие заместители типа тиенила, описаны в ЕР публикации заявки 0277917 (раскрывающей N6-замещенные-2 гетероарилалкиламино замещенные аденозины,включающие 2-[(2-[тиен-2-ил]этил)амино] замещенный аденозин). Выложенная заявка Германии 2139107WO 85/04882 (раскрывающая, что N6-гетероциклилалкилзамещенные производные аденозина,включая N6-[2-(2-тиенил)этил] амино-9-(Дрибофуранозил)-9 Н-пурин, показывают сердеч 9 но-сосудорасширяющую активность и что N6 хиральные заместители показывают повышенную активность), опубликованное описание ЕР заявки 0232813 (раскрывающее, что N6-(1 замещенный тиенил)циклопропилметил замещенные аденозины, показывают кардиоваскулярную активность), US патент 4683223 (раскрывающий,чтоN6-бензотиопиранилзамещенные аденозины проявляют гипотензивные свойства), РСТ WO 88/03147 и WO 88/03148N6 бензотиенилэтил-замещенные аденозины проявляют гипотензивные свойства). В патенте US3914415 описано, что амиды аденозин-5'-карбоновой кислоты могут быть пригодны как антигипертензивные и антиангинальные средства, тогда как US патент 4738954 описывает, что 5'-этилкарбоксамидыN6-замещенного арил и арилалкиладенозинов показывают различные гипотензивные в отношении сердца свойства.N6-aлкил-2'-O-aлкил-aдeнoзины описаны в публикации ЕР заявки 0378518 и UK патентной заявке 2226027 как имеющие гипотензивную активность, известно, что N6-алкил-2',3'ди-O-алкиладенозины также могут использоваться в качестве гипотензивных средств, US патент 4843066. Известно, что аденозин-5'-(N-замещенные)карбоксамиды и карбоксилатные эфиры и их N1-оксиды являются сосудистыми вазодилататорами. Stein, et al., J. Med. Chem. 1980, 23,313-319 and J. Med. Chem. 19, (10), 1180 (1976). Аденозин-5'-карбоксамиды и их N1-оксиды также охарактеризованы как слабые животные яды в US патенте 4167565. Антилополитическая активность аденозина описано Dole, V.P., J. Biol. Chem. 236 (12),3125-3130 (1961). Ингибирование липолиза (R)N6-фенилизопропиладенозином описаноN6-замещенные аденозины и аналоги, полезные для лечения расстройств сократительной способности желудочно-кишечного тракта, описаны в опубликованных ЕР заявках 0423776 и 0423777.N6-гетероциклические соединения, полученные на основе аденозина и его аналогов, и их применение при лечении гипертонии и ишемической болезни сердца, их применение в качест 001801 10 ве кардиопротективных средств, которые облегчают ишемические поражения и уменьшают обширность инфаркта миокарда после ишемического поражения, их применение в качестве антилиполитических средств, которые уменьшают уровень липидов в плазме, уровень сывороточных триглицеридов и уровень холестерина в плазме, описаны в US патентной заявке 08/316761, поданной 3 октября 1994 г., переуступленной заявителю настоящего изобретения и Notice of Allowance которого было подано на почту 26 марта 1996 г. N6-гетероциклические соединения, полученные на основе аденозина и его аналогов, и их применение при лечении ишемии сердца и гипертонии, раскрыты также вUS патенте 5364862, заявка на который подана заявителем настоящего изобретения 2 октября 1992 г. Полагают, что упомянутые токсичность,CNS свойства, повышение частоты сердечных сокращений, связываемые с аналогами аденозина, усугубили трудности, мешающие разработке коммерческого средства, являющегося аналогом аденозина и обладающего гипотензивным противоишемическим свойством. Настоящее изобретение относится к классу метаболически стабильных аналогов аденозина и их производным, обладающим неожиданно привлекательными фармакологическими свойствами, т.е. являются гипотензивными,кардиопротективными, противоишемическими и антилиполитическими средствами с уникальным терапевтическим назначением. Соединения настоящего изобретения описываются формулой In и p - независимо друг от друга 0, 1, 2 или 3, при условии, что n + р равно, по крайней мере, 1; Т - водород, С 1-20 алкил, С 1-20 ацил, С 1-20 тиоацил, галоген, карбоксил, или R3 О-СН 2; Н, ORc, где Rc - водород, С 1-20 алкил,где Rd и Re - независимо водород, С 1-20 алкил; вместе с атомом углерода, с которым они соединены,могут образовывать С 3-101,1 циклоалкильную группу; или его фармацевтически приемлемая соль. Данное изобретение относится также к способам лечения кардиоваскулярного заболевания, характеризующегося гипертензией или миокардиальной ишемией, с помощью фармацевтических композиций, включающих понижающих давление количество или оказывающее противоишемический эффект количество соединения вышеприведенной формулы I, способу лечения ишемического повреждения или размеров инфаркта миокарда с помощью фармацевтических композиций, включающих кардиопротективное количество соединения вышеприведенной формулы I, способу лечения гиперлипидемии или гиперхолестеролемии с помощью фармацевтических композиций, включающих противолиполитическое количество соединения формулы I, и способам и промежуточным соединениям, используемым при получении таких соединений. Используемые по тексту описания значения терминов, если иное не оговорено, имеют следующие значения:"Ацил" означает прямой или разветвленный алкил-С=O группу."Тиоацил" означает прямую или разветвленную алкил-С=S группу. Предпочтительными ацильной и тиоацильной группами являются низший алканоил и низший тиоалканоил,имеющие от 1 до 6 атомов углерода в алкильной группе."Алкил" означает насыщенную прямую или разветвленную алифатическую углеводородную группу, которая может иметь в цепи от 1 до 20 атомов углерода. Предпочтительные алкильные группы могут быть прямыми или разветвленными и иметь цепочку от 1 до 10 атомов углерода. Разветвленное строение означает, что низшая алкильная группа, например метил, этил или пропил, присоединены к линейной алкильной цепи."Низший алкил" означает, что алкильная группа имеет от 1 до 6 атомов углерода."Циклоалкил" означает алифатическое циклическое соединение, имеющее в цикле от 3 до 10 атомов углерода. Предпочтительные циклоалкильные группы имеют от 4 до 7 атомов углерода в кольце. Алкилкарбамоил и диалкилкарбамоил означают, что азот карбамоила замещен одной или двумя алкильными группами соответственно."Алкокси" означает алкил-O группу, в которой "алкил" соответствует ранее данному определению. Низшие алкоксигруппы предпочтительны. Примерами групп являются метокси,этокси, н-пропокси, i-пропокси и н-бутокси."Алкоксиалкил" означает алкильную группу, в соответствии с данным ранее определением, замещенную алкоксигруппой, в соответствии с ее ранее данным определением."арил" означает фенил или нафтил, "замещенный аралкил" и "замещенный арил" означает,что арильная группа, или арильная группа аралкильной группы замещена одним или несколькими заместителями, которые включают алкил,алкокси, амино, нитро, карбокси, карбоалокси,циано, алкиламино, галоид, гидрокси, гидроксиалкил, меркаптил, алкилмеркаптил, тригалоалкил, карбокиалкил или карбамоил."Галоген" (или "гало") означает хлор,фтор, бром или иод. "Гетероциклический оста 13 ток (гетероцикл)" означает 4-10-членную кольцевую структуру, в которой один или несколько атомов является элементом, отличным от углерода, например, N, О или S. Гетероцикл может быть ароматическим или не ароматическим, т.е. может быть насыщенным, частично или полностью ненасыщенным. Предпочтительные гетероциклические группы включают пиридил, пиридазинил, пиримидинил, изохинолинил, хинолинил, хиназололинил, имидазолил, пирролил, фуранил, тиенил, тиазолил, бензотиазолил, пиперидинил,пирролидинил, тетрагидрофуранил, тетрагидропиранил и морфолинил."Замещенный гетероциклил" означает, что гетероциклическая группа замещена одним или несколькими заместителями, причем заместители включают алкокси, алкиламино, арил, карбалкокси, карбамоил, циано, галоид, гетероцикл, тригалоидметил, гидрокси, меркаптил,алкилмеркаптил или нитро."Гидроксиалкил" означает алкильную группу, замещенную гидроксигруппой. Гидрокси - низшие алкильные группы являются предпочтительными. Примерные предпочтительные группы включают гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил и 3-гидроксипропил."Пролекарство" означает соединение, которое может быть или может не быть само по себе биологически активным, но которое может быть превращено в биологически активную химическую форму метаболическим, сольволитическим или иным физиологическим путем."Кардиопротекция" означает действие,благодаря которому миокард становится менее уязвимым для ишемического поражения, а инфаркт миокарда менее вероятным результатом ишемии миокарда."Уменьшение поражения ишемической болезнью" означает предотвращение и уменьшение ишемического поражения миокарда, являющегося результатом миокардиальной ишемии."Уменьшение области (размера) инфаркта миокарда" означает уменьшение размеров области инфаркта миокарда или предотвращение инфаркта миокарда как следствия ишемической болезни. Соединения формулы I содержат хиральные (асимметричные) центры. Изобретение включает как индивидуальные стереоизомеры,так и их смеси. Индивидуальные изомеры получают или выделяют хорошо известными в данной области методами или способами, которые здесь описываются. Соединения данного изобретения могут использоваться в форме свободного основания,в форме солей присоединения кислот или как гидраты. Все эти формы включены в объем данного изобретения. Соли присоединения кислот просто являются более общепринятой формой их использования. На практике использование 14 солевой формы по существу сводится к использованию основной формы. Кислоты, которые могут быть использованы для получения солей,предпочтительно являются такими, которые при взаимодействии со свободным основанием, образуют фармацевтически приемлемые соли, т.е. соли, анионы которых являются нетоксичными для реципиента при фармацевтических дозах этих солей, так что полезные гипотензивные,кардио-протективные, противоишемические и антилиполитические свойства, присущие свободному основанию, не пропадают из-за побочных эффектов, приписываемых анионам. Хотя фармацевтически приемлемые соли соединений настоящего изобретения являются предпочтительными, все соли присоединения кислот являются полезными как источники веществ в форме свободного основания, даже если отдельная соль сама по себе требуется только как промежуточный продукт, как, например, когда соль получают только с целью выделения и идентификации или когда она используется как промежуточное соединение при получении фармацевтически приемлемой соли с помощью процедур ионообмена. Фармацевтически приемлемыми солями, входящими в объем данного изобретения, являются соли следующих кислот: минеральные кислоты, например соляная, серная, фосфорная или сульфаминовая кислоты, и органические кислоты, например, уксусная кислота, лимонная кислота, молочная кислота,виннокаменная кислота, малоновая кислота,метансульфокислота, фумаровая кислота, этансульфокислота,бензолсульфокислота,птолуолсульфокислота, циклогексилсульфаминовая кислота, хинная кислота и т.п. Соответствующие соли присоединения кислот включают следующие: хлоргидраты, сульфаты, фосфаты,сульфаминаты, ацетаты, цитраты, лактаты, тартраты, соли метансульфокислоты, фумараты,соли этансульфокислоты, соль бензолсульфокислоты, соли п-толуолсульфокислоты, циклогексилсульфонаты и хинаты соответственно. Соли присоединения кислот для соединений настоящего изобретения обычно готовятся либо растворением свободного основания в водном или водноспиртовом растворе или другого подходящего растворителя, содержащем соответствующую кислоту, с последующим выделением соли выпариванием из раствора, либо при взаимодействии свободного основания с кислотой в органическом растворителе, в этом случае соль выделяется непосредственно или может быть получена концентрированием раствора. Подпадающие под объем формулы I классы соединений могут быть в общем охарактеризованы как N6-замещенные аденозины; N6 замещенные карбоциклические аденозины (или же дигидрокси[N6-замещенные-9-аденил]циклопентаны) и их N6-оксиды; и N6-замещенныеN'-I-деазааристеромицины (или же дигид 15 рокси[N7-замещенные[4,5-b]имидазопиридил] циклопентаны). Также под объем формулы I подпадают 5'-алкилкарбоксамидные производные аденозинов, карбоциклические аденозины иI-деазааристеромицины, производные соединений вышеуказанных классов, в которых одна или обе из 2- или 3-гидроксильных групп циклопентанового кольца или, в случаях классов соединений с рибозным остатком, 2'- или 3'гидроксильные группы рибозного кольца, замещены. Такие производные могут сами содержать биологически активный химический агент,полезный при лечении повышенного давления и ишемической болезни в качестве кардиопротектора и антилиполитического средства, или могут действовать как пролекарства для таких биологически активных соединений, которые образуются из них под влиянием физиологических условий. Представители соединений изобретения включают:(R)-втор-бутиламид(1S,2R,3S,4R)-2,3 дигидрокси-4-[6-[1-(5-трифторметилпиридин-2 ил)пирролидин-3-иламино]-пурин-9-ил]циклопентанкарбоновой кислоты. Предпочтительный класс соединений данного изобретения описывается формулой I, в которой K - это N, Т - гидроксиметил или метоксиметил, А и В - гидрокси, Х представляет собойa n + р = 3 или 4,или их фармацевтически приемлемые соли. Представители соединений этого предпочтительного класса включают:(1R,2S,3R,5R)-3-[6-(1-бензилпирролидин 3(S)-иламино)-пурин-9-ил]-5-метоксиметилциклопентан-1,2-диол. Другой предпочтительный класс соединений изобретения описывается формулой I, где Q есть СН 2, K это N, Т есть где R1 - Н, a R2 низший алкил, А и В оба гидрокси, Х представляет собойa n + р = 3 или 4,и их фармацевтически пригодные соли. Представители соединений другого предпочтительного класса соединений включают: этиламид (1S,2R,3S,4R)-2,3-дигидрокси-4[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3-иламино]-пурин-9-ил]циклопентанкарбоновой кислоты,(S)-втор-бутиламид(1S,2R,3S,4R)-2,3 дигидрокси-4-[6-[1-(5-трифторметилпиридин-2 ил)пирролидин-3-иламино]-пурин-9-ил]циклопентанкарбоновой кислоты и(R)-втор-бутиламид(1S,2R,3S,4R)-2,3 дигидрокси-4-[6-[1-(5-трифторметилпиридин-2 ил)пирролидин-3-иламино]-пурин-9-ил]циклопентанкарбоновой кислоты. Более предпочтительный класс соединений данного изобретения описывается формулой I, в которой Q это СН 2, K - это N, Т - гидроксиметилa n + р = 3 или 4,а также их фармацевтически приемлемые соли. Представители соединений этого более предпочтительного класса включают:(1R,2S,3R,5R)-3-[6-(1-бензилпирролидин 3(S)-иламино)-пурин-9-ил]-5-метоксиметилциклопентан-1,2-диол. Самые предпочтительные соединения настоящего изобретения включают(1R,2S,3R,5R)-3-метоксиметил-5-[6-[1-(4 трифторметилпиридин-2-ил)пирролидин-3(S)иламино]-пурин-9-ил]-3-циклопентан-1,2-диол. Соединения данного изобретения могут быть получены известными способами или в соответствии с приведенными ниже реакционными схемами. Исходные вещества, используемые для получения соединений настоящего изобретения, хорошо известны или коммерчески доступны, или же могут быть получены известными способами или по специальным реакционным схемам, описываемым здесь. Соединения формулы I, где K является N,Q = O, а Т есть R3 О-СН 2, могут быть получены взаимодействием коммерчески доступного 6 хлорпуринрибозида с различными незамещенными, алкил, аралкил, арил, замещенный арил,гетероцикл, или замещенный гетероциклил азациклоалкиламинами или их замещенными производными (далее "соответствующие исходные амины"), как продемонстрировано ниже в примерах. Соединения формулы I, где K=N, Q=O, aT=R1R2N-C = O получают аналогично исходя из продукта реакционной схемы А. В этой реакции 6-хлорпуринрибозид с защищенными 2'- и 3'гидроксильными группами рибозного кольца обрабатывают окислителем, например реагентом Джонса, а полученную кислоту обрабатывают либо дициклогексилкарбодиимидом(ДЦК), либо ВОР-Сl в присутствии выбранного амина с получением производного 5'алкилкарбоксамида. Реакционная схема А(Р = защитная группа) Подходящие исходные вещества для соединений формулы I, в которых K = N, Q = СН 2,а Т представляет собой R1R2N-C = O, могут быть получены как описано Chem et al., Tetrahedron Letters 30: 5543-46 (1989). Или же для получения этих исходных веществ может быть использована реакционная схема В. При воспроизведении реакционной схемы В 4-этилкарбоксамидное производное 2,3-дигидроксициклопентиламина, полученное как описано Chem et аl., подвергают взаимодействию с 3-амино-2,4-дихлорпиримидином. Про 25 дукт этой начальной реакции затем нагревают с альдегидиламидинацетатом, например, формамидинацетатом в диоксане и метоксиэтаноле, в течение времени, достаточного для замыкания кольца (от приблизительно 30 мин до приблизительно 4 ч), получая таким образом продукт,который может быть затем подвергнут взаимодействию с соответствующими исходными аминами описанным ниже способом с получением заявленных соединений. Порядок реакции не является решающим. Например, промежуточное соединение, полученной по реакционной схеме В, могло быть подвергнуто взаимодействию с соответствующим исходным амином, за чем следовало замыкание кольца с получением конечного продукта. Реакционная схема В Различные амины, используемые для получения заявленных соединений, могут быть получены известными способами или так, как это описано здесь. Диастереомерные смеси соединений или промежуточных веществ, используемые при получении заявленных соединений, могут быть разделены на отдельные рацемические или оптически активные энантиомеры известными способами, например хроматографией, фракционной дистилляцией или фракционной кристаллизацией d- или l-солей (винной, дибензоилвинной, миндальной кислот или камфорсульфокислоты).N6-замещенные аденозины и карбоциклические аденозины данного изобретения могут быть получены при взаимодействии 6 хлорпуринрибозида или продуктов реакционных схем А и В с различными соответствующими исходными аминами, как показано, например, на реакционной схеме С. Реакционная схема С где X и Y соответствуют Х и Y, как они определены выше, или их замещенные производные.N6-замещенные и N'алкил-деазааристеромицины данного изобретения могут быть получены, как показано на реакционной схеме Д. Соединения настоящего изобретения, которые могут действовать как пролекарства,включают те соединения, в которых гидроксилы рибозы или циклопентанового кольца замещены группами R' и R", как указано выше для формулы I. Они могут быть получены известными способами или так, как показано на реакционной схеме Е, ниже. Реакционная схема Е Обработка дигидроксисоединений хлорформиатным эфиром в присутствии органического основания, например, триэтиламина, дает соответствующий бис-карбонат. Ацеталь алкоксиметилена может быть получен обработкой соответствующего ортоэфира в присутствии каталитического количества п-толуолсульфокислоты. Карбонат получают обработкой 1,1'карбонилдиимидазолом, а тиокарбонат - обработкой тиокарбонилдиимидазолом. Алкил- и диалкилкарбамоильные производные могут быть получены обработкой соответствующих алкилизоцианата или диалкилкарбамоилхлорида в присутствии органического основания соответственно. 27 Соединения настоящего изобретения, в которых K представляет собой NO, т.е. Nоксиды, могут быть получены окислением соответствующего аденозина или карбоциклического аденозина известными способами, например обработкой пероксидом водорода в уксусной кислоте. 2'-O-алкильные производные могут быть получены известными путями, например реакцией соответствующего исходного амина с 6 хлор-9-(2'-O-метил-b-D-рибофуранозил)-9 Нпурином. Функциональные группы исходных и промежуточных соединений, которые используются для получения заявленных соединений, могут быть защищены с помощью обычных хорошо известных в данной области защитных групп. Обычно применяемые защищающие группировки для амино- и гидроксильных функциональных групп описаны, например, T.W. Greene,"Protective Groups in Organic Synthesis", Wiley,New York (1984). Гидроксильные группы могут быть защищены как сложные эфиры, например, как ацильные производные, или в форме простых эфиров. Гидроксильные группы на соседних атомах углерода могут быть успешно защищены в форме кеталей или ацеталей. На практике соседние 2' и 3' гидроксильные группы исходных соединений на реакционных схемах А и В обычно защищаются путем получения 2', 3' изопропилиденовых производных. Свободные гидроксилы могут быть восстановлены кислотным гидролизом, например, или реакциями сольволиза или гидрогенолиза, обычно используемыми в органической химии. После синтеза заявленные соединения обычно очищают жидкостной хроматографией при умеренном давлении (УДЖХ) на хроматотроне, тонкослойной хроматографией с радиальным ускорениeм, флэш-хроматографией или колоночной хроматографией через силикагельную или Флорисильную матрицу с последующей кристаллизацией. Для соединений формулыR3 О-СН 2, типичными системами растворителей являются хлороформ:метанол,этилацетат:гексан и метиленхлорид:метанол. Элюаты могут быть подвергнуты кристаллизации из метанола, этанола, этилацетата, гексана или хлороформа и т.д. Для соединений формулы I, где K - N, Q O, а Т есть R1R2N-C=O, типичной системой растворителей являются хлороформ: метанол. Например, элюаты могут быть кристаллизованы из 50-100% этанола (водного). Для соединений формулы I, где Q есть СН 2, K - N, или СН, а Т является R1R2N-C=O,типичная система растворителей включает метилехлорид:метанол. Например, элюаты могут быть кристаллизованы из этилацетата с или без метанола, этанола или гексана. 28 Соединения, требующие нейтрализации,могут быть нейтрализованы основанием, таким как натрий бикарбонат, с последующей промывкой метиленхлоридом и рассолом. Продукты, которые очищаются как масла, иногда растирают в порошок со смесью гексан/этанол перед конечной кристаллизацией. Способ данного изобретения далее иллюстрируется и объясняется с помощью следующих примеров. Пример 1. Получение 5'-N-этил-2',3'-изопропилиденN6-хлораденозин-5'-уронамида. Стадия 1: N6-Xлop-2',3'-изопропилиденаденозин. 6-Хлорпуринрибозид (31,5 г), триэтилортоформиат (73 мл) и TsOH (19,8 г) перемешивают в 600 мл ацетона в течение 2 ч при комнатной температуре. Реакционную смесь концентрируют в вакууме, соединяют с этилацетотом и промывают насыщенным растворомNаНСО 3 и рассолом. Сушат (Na2SO4) и концентрируют, получая N6-хлор-2',3'-изопропилиденаденозин в виде твердого продукта белого цвета. Стадия 2: N6-Xлop-2',3'-изопропилиденаденозин-5'-карбоновая кислота.N6-Xлop-2',3'-изопропилиденаденозин (4,5 г, 13,8 ммоль) и 4-гидрокси-2,2,6,6-тетраметилпиперидинилоксибензоат (4-гидрокси-ТЕМПО бензоат) (0,0381 г, 0,14 ммоль) объединяют в ацетонитриле, к реакционной смеси добавляют 5% NaHCO3 (87%) и порциями при 0-5 С добавляют натрийбромит гидрат (10,41 г, 55,1 ммоль). Реакционную смесь оставляют нагреваться до комнатной температуры и раствор энергично перемешивают в течение около 3 ч. Добавляют 10% винной кислоты и водный слой отделяют и экстрагируют этилацетатом (3 х). Объединенные органические слои промывают 5% раствором бикарбоната натрия (3 х). Щелочные соли собирают и подкисляют до рН 3 с помощью концентрированной соляной кислоты. Водные слои экстрагируют этилацетатом (3 х). Объединенные органические слои затем промывают рассолом и высушивают над сульфатом магния. Фильтрат концентрируют до аморфного твердого осадка белого цвета, испаряют вместе с 3 порциями толуола и сушат в вакууме с получением N6xлop-2',3'-изопропилиденаденозин-5'-карбоновой кислоты. Стадия 3: 5'-N-Этил-2',3'-изопропилиденN6-хлораденозин-5'-уронамид.N6-Хлор-2',3'-изопропилиденаденозин-5'карбоновую кислоту (4,4 г, 12,9 ммоль), триэтиламин (1,64 мл, 11,7 ммоль), изопропенилхлорформиат (1,28 мл, 11,7 ммоль) и метиленхлорид (50 мл) объединяют под аргоном при-10 С перемешивают в течение около 2 мин. К реакционной добавляют этиламид (0,77 мл, 11,7 ммоль) и перемешивание продолжают еще 1 мин. Реакционная смесь разделяется между ме 29 тиленхлоридом и насыщенным бикарбонатом натрия. Водные слои промывают метиленхлоридом (3 х). Объединенные органические слои промывают рассолом и высушивают над сульфатом натрия, фильтруют, выпаривают в вакууме и очищают остаток флэш-хроматографией на силикагеле, элюируя 3% МеОН/СНСl3 с получением 5'-N-этил-2',3'-изопролилиден-N6-хлораденозин-5'-уронамида. 1 Н ЯМР (300 МГц, (CDCl3) d 8,75 (с, 1 Н),8,23 (с, 1 Н), 6,20 (д, 1 Н), 5,50 (дд, 2 Н), 4,73 (д,1 Н), 3,01 (м, 2 Н), 1,63 (с, 1 Н), 1,41 (с, 3 Н), 0,77 54 ммоль продукта (ii) из вышеприведенного примера 2, стадия (1), растворяют в 110 мл н-бутанола и 9,7 г 5-амино-4,6-дихлорпиримидина, затем добавляют 23 мл триэтиламина и смесь нагревают с обратным холодильником в течение около 18 ч. Смесь охлаждают, разбавляют хлороформом и насыщенным раствором хлорида аммония. Водный слой трижды экстрагируют хлороформом и дважды смесью 10% изопропанол/хлороформ. Органические слои объединяют, высушивают над сульфатом натрия, фильтруют, концентрируют до получения масла (iii), которое используют без дополнительной обработки на следующей стадии. Стадия (3). ПолучениеN-ВОС-5,6 Диметилендиокси-2-азабицикло[2.2.1]гептан-3 она (i) (приготовленного как показано на стадии(6) примера 3, ниже), растворяют в 16 мл изопропиламина и смесь перемешивают при комнатной температуре в течение около 2 ч. Смесь выпаривают в вакууме и остаток подвергают азеотропной перегонке с хлороформом до получения твердого белого продукта. Этот твердый продукт растворяют в 250 мл этилацетата, раствор охлаждают до 0 С и в раствор пропускают газообразный хлористый водород с охлаждением в течение около 15 мин. Затем раствор перемешивают около 4 ч при комнатной температуре. Раствор выпаривают под вакуумом и подвергают азеотропной перегонке с метанолом,затем с хлороформом, получая целевой амин в виде хлоргидратной соли. Хлоргидратная соль распределяется между хлороформом и раствором натрий-бикарбоната, и органический слой промывают рассолом, сушат, фильтруют и добавляют один эквивалент бензойной кислоты. Растворитель удаляют под вакуумом и остаток растирают с эфиром с получением целевого амина (ii), изображенный выше как соль бензойной кислоты, т.пл. 183-184 С. Стадия (2). Получение Продукт (iii) из вышеприведенного примера 2, стадия (2), вносят в 150 мл н-бутилацетата и добавляют 11,2 г формамидинацетата. Смесь нагревают с обратным холодильником под аргоном в течение приблизительно 9 ч, добавляя три порции формамидинацетата по 5,56 г спустя два, четыре и шесть часов. Смесь охлаждают,разбавляют этилацетатом, промывают рассолом,водой, рассолом, сушат над сульфатом натрия,фильтруют, концентрируют в вакууме, а остаток очищают флэш-хроматографией с элюцией 4080% этилацетатом в гексане и получением целевого хлорпуринового продукта (iv), изображенного выше. Стадия (4). Получение(1,57 ммоль) триэтиламина и 270 мг (1,16 ммоль) 2-[(3S)-3-аминопирролидин-1-ил]-4-трифторметилпиридина (приготовленного, как показано ниже в примере 3, стадия 1-5) растворяют вместе в 3 мл этанола и раствор нагревают в атмосфере аргона с обратным холодильником в течение 20 ч. Смесь выпаривают пoд вакуумом и остаток распределяют между хлороформом и насыщенным раствором бикарбоната натрия. 31 Водный слой экстрагируют 4 порциями хлороформа и объединенные органические слои сушат над сульфатом натрия, фильтруют, выпаривают под вакуумом. Остаток очищают флэшхроматографией,используя метиленхлорид/этилацет (1:1) и элюируя раствором 0-3% метанола в этилацетате с получением продукта,изображенного выше (v). Стадия (5). Продукт из примера 2, стадия(4) (см. выше), растворяют в 2 мл метанол/тетрагидрофуран (1:1) и добавляют 3,3 мл 1,5 Н водного раствора соляной кислоты, раствор перемешивают при комнатной температуре в течение около 20 ч. Смесь выпаривают под вакуумом. Получившийся остаток переносят в 10 мл смеси 15% изопропанол/хлороформ, 1 мл 1 Н раствора гидроксида натрия и 9 мл насыщенного раствора бикарбоната натрия. Слои разделяют и водный слой экстрагируют смесью 15% изопропанол/хлороформ 4 раза порциями по 15 мл. Объединенный органический слой сушат над сульфатом натрия, фильтруют, выпаривают в вакууме с получением изопропиламида (1S,2R, 3S,4R)-2,3-дигидрокси-4-[6-[1-(4 трифторметилпиридин-2-ил)пирролидин-3(S)иламино]-пурин-9-ил]циклопентанкарбоновой кислоты, т.пл. 227-228 С. Пример 3. Получение (1R,2S,3R,5R)-3 метоксиметил-5-[6-[1-(5-трифторметилпиридин 2-ил)пирролидин-3(S)-иламино]-пурин-9-ил] циклопентан-1,2-диола. Стадия (1). 20 г (232 ммоль) (3S)-(-)-3 Аминопирролидина и 26 мл (255 ммоль, 1,1 экв.) бензальдегида смешивают в 250 мл толуола и кипятят с обратным холодильником, удаляя воду сифоном Дина-Старка в течение около 4,5 ч. Смесь охлаждают до 0 С и добавляют 55,7 г(255,2 ммоль, 1,1 экв.) ди-третбутилдикарбоната и перемешивают при комнатной температуре. Смесь концентрируют в вакууме, перемешивают с раствором KHSO4, три раза экстрагируют эфиром. Водный слой подщелачивают и экстрагируют CH2Cl2. Органический слой промывают рассолом и сушат над MgSO4, фильтруют и выпаривают в вакууме с получением N1-BOC-(3S)(-)-3-аминопирролидина. Стадия (2). 34,25 г (183,9 ммоль) продукта примера 3, стадия (1) (см. выше), растворяют в 200 мл СН 2 Сl2 и добавляют 25 мл (183,9 ммоль,1 экв) триэтиламина. В атмосфере азота добавляют по каплям 34,7 мл (367,8 ммоль, 2 экв.) уксусного ангидрида, смесь перемешивают при комнатной температуре, она разделяется NaHCO3 раствор/СН 2 Сl2. Органический слой промывают рассолом, сушат над МgSO4, фильтруют, выпаривают в вакууме и продукт очищают флэш-хроматографией с элюцией 2-8% раствора в метилене и получают N1-BOC-(3S)-(-)-3 ацетиламинопирролидин. Стадия (3). 39,2 г (171,7 ммоль) продукта примера 3, стадия (2) (см. выше), растворяют в 400 мл CH2Cl2 и прикапывают по каплям 26,46 32 мл (343,4 ммоль, 2 экв) трифторуксусной кислоты (здесь и далее "ТФУК") при 0 С в атмосфере азота. Смесь нагревают с обратным холодильником до кипения, добавляют еще 26 мл, затем еще 10 мл ТФУК, кипятят с обратным холодильником в течение еще около 3 ч, затем выпаривают при глубоком вакууме для отгонки ТФУК. Остаток перемешивают с основной смолой Амберлит IRA-400 (здесь и далее "основная смола"), фильтруют, фильтрат растворяют в метаноле, медленно фильтруют через основную смолу, выпаривают фильтрат до получения (3S)(-)-3-ацетиламинопирролидина. Стадия (4). 4 г (31,2 ммоль) продукта примера 3, стадия (3) (см. выше), и 5,19 (40,6 ммоль) 2-хлор-5-трифторметилпиридина смешивают в 50 мл этанола и добавляют 13 мл (93,6 ммоль, 3 экв) триэтиламина. Смесь кипятят с обратным холодильником около 18 ч, концентрируют в вакууме и остаток разделяется между метиленхлоридом и раствором бикарбоната натрия. Органический слой промывают рассолом,сушат над сульфатом магния, фильтруют, выпаривают в вакууме и остаток очищают флэшхроматографией, элюируя 2-5% метанолом в метиленхлориде, с получением 2-[(3S)-3 ацетиламинопирролидин-1-ил]-5-трифторметилпиридина в твердом виде. Стадия (5). 7,52 г (27,5 ммоль) продукта примера 3, стадия (4) (см. выше), смешивают с 75 мл 6 Н водной соляной кислотой и смесь кипятят с обратным холодильником около 18 ч. Смесь охлаждают до комнатной температуры,нейтрализуя твердым бикарбонатом натрия,разделяют между разбавленным раствором гидроксида натрия и метиленхлоридом. Органический слой промывают рассолом, высушивают над сульфатом магния, фильтруют, выпаривают в вакууме до получения 2-[(3S)-3-аминопирролидин-1-ил]-5-трифторметилпиридина. Стадия (6).(vi), 1,5 г 4-диметиламинопиридина (здесь и далее "ДМАП"), 12,4 г триэтиламина и 37,5 г ди-трет-бутилдикарбоната соединяют в метиленхлориде и перемешивают при комнатной температуре около 18 ч. Смесь промывают 1 Н соляной кислотой, 5% раствором бикарбоната натрия, рассолом, сушат над сульфатом натрия,фильтруют, концентрируют в вакууме и остаток перекристаллизовывают из изопропанола с получением N-BOC-5,6-диметилендиокси-2-азабицикло [2.2.1]гептан-3-она (i). 35,6 г (0,125 ммоль) продукта (i) примера 3, стадия (6) (см. выше), смешивают с 400 мл метанола. При быстром перемешивании и охлаждении и продувке аргоном добавляют боргидрид натрия в количестве 23,8 г (0,63 ммоль) тремя равными порциями в течение почти 2 ч. Смесь концентрируют в вакууме и разделяют между 200 мл воды и 300 мл этилацетата. Водный слой экстрагируют более двух раз этилацетатом и объединенный органический раствор промывают водой, рассолом, сушат над сульфатом натрия, фильтруют, концентрируют в вакууме с получением N-ВОС-1-амино-2,3 диметилендиокси-4-гидроксиметилциклопентана 50 г продукта (vii) примера 3, стадия (7) (см. выше), помещают в 150 мл бензола. Добавляют 8,8 мл метилиодида и 33 г оксида серебра и смесь кипятят с обратным холодильником около 18 ч. Другие 25 г оксида серебра и другие 50 мл метилиодида добавляют по каплям в течение почти 6 ч и смесь кипятят с обратным холодильником около 18 ч. Смесь фильтруют через Целит и осадок на фильтре промывают этилацетатом. Объединенный фильтрат концентрируют под вакуумом и остаток кристаллизуют из гексана с получением целевого метоксиметильного соединения (viii), изображенного выше. Стадия (9). Под аргоном 31,6 г продукта (viii) примера 3, стадия (8) (см. выше), растворяют в 250 мл теплого безводного этилацетата. Раствор охлаждают на водяной бане и через раствор в течение около 6 мин пропускают газообразный хлористый водород. Смеси дают нагреться до комнатной температуры и перемешивают в течение около 3 ч, затем концентрируют в вакууме с получением целевого амина хлоргидрата (ix),изображенного выше.(см. выше), и 42,8 г бикарбоната натрия объединяют в 100 мл н-бутанола под аргоном и добавляют 20,1 г 5-амино-4,6-дихлорпиримидина. Смесь нагревают до кипения с обратным холодильником в течение около 20 ч, затем концентрируют в вакууме. Остаток распределяется между этилацетатом и водой, и этилацетатный слой промывают рассолом, высушивают над сульфатом магния, фильтруют, концентрируют в вакууме. Остаток в 30% этилацетате в гексане пропускают через большую промывочную флэш-колонку с силикагелем и колонку промывают смесью 50% этилацетат/гексан, а объединенные фильтраты концентрируют в вакууме с получением пиримидиниламиноциклопентана(см. выше) смешивают с 125 мл н-бутилацетата под аргоном. Добавляют 33,5 г формамидинацетата и смесь нагревают до кипения с обратным холодильником в течение около 3 ч, до тех пор,пока тонкослойная хроматография не покажет завершения реакции. Смесь охлаждают, разделяют между этилацетатом и рассолом, и этилацетатный слой высушивают над сульфатом магния, фильтруют, концентрируют в вакууме. Остаток очищают флэш-хроматографией, элюируя 30-50% этилацетатом в гексане с получением хлорпуринового продукта (xii), изображенного выше. Стадия (12). 35 7,75 г (22,9 ммоль) продукта (xii) примера 3, стадия (11) (см. выше), и 6,35 г (27,4 ммоль) 2-[(3S)-3-аминопирролидин-1-ил]-5-трифторметилпиридина соединяют в 20 мл этанола и добавляют 6,33 мл триэтиламина. Смесь нагревают в запечатанном сосуде при 105 С около 4 ч. Смесь охлаждают, выпаривают в вакууме, разделяют между метиленхлоридом и раствором натрия бикарбоната. Органический слой высушивают над сульфатом магния, фильтруют,концентрируют в вакууме и остаток очищают флэш-хроматографией, элюируя 4% метанолом в метиленхлориде с получением вышепоказанного продукта (xiii). Стадия (13). 10,81 г (20,3 ммоль) продукта(xiii) примера 3, стадия (12) (см. выше), смешивают с 90 мл трифторацетата и 10 мл воды,смесь перемешивают при комнатной температуре около 30 мин. TFA выпаривают при глубоком вакууме, а остаток разделяют между метиленхлоридом и раствором бикарбоната натрия. Раствор метиленхлорида промывают раствором бикарбоната натрия, рассолом, добавляют изопропиловый спирт и раствор высушивают над сульфатом магния, фильтруют, концентрируют в вакууме, остаток подвергают флэшхроматографии с элюцией 5-10% метанолом в метиленхлориде. Соответствующие фракции собирают, концентрируют, остаток кристаллизуют из ацетонитрила с получением(1R,2S,3R,5R)-3-метоксиметил-5-[6-[1-(5-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диола, т.пл. 166-168 С. Пример 4. Получение (2R,3S,4R,5R)-2-гидроксиметил-5-[6-[1-(5-трифторметилпиридин-2 ил)пирролидин-3(R)-иламино]-пурин-9-ил] тетрагидрофуран-3,4-диола. 267 мг 2-[(3R)-3-аминопирролидин-1-ил]5-трифторметилпири-дина,331 мг 6 хлорпуринрибозида, 233 мг триэтиламина и 0,5 мл этанола смешивают и нагревают в закупоренном сосуде при 100 С около 5 ч. Смесь охлаждают, разделяют между метиленхлоридом (с добавлением некоторого количества изопропилового спирта) и бикарбонатом натрия. Органический слой промывают рассолом, сушат над сульфатом магния, выпаривают и остаток очищают флэш-хроматографией с элюцией 5% метанолом в метиленхлориде с получением(P[о-толил]3)2 (полученного по US патенту 4196135, упоминаемого здесь как ссылка) смешивают в 30 мл толуола и смесь нагревают в закупоренном сосуде при 100 С около 40 ч. Смесь охлаждают, фильтруют, выпаривают в вакууме и очищают флэш-хроматографией,элюируя смесью метиленхлорид/этанол (от 10:1 до 7:1) с получением 1-(4-трифторметил)фенил(3S)пирролидин-3-ил-амина. Стадия (2). Раствор, состоящий из 24,7 мл (0,61 моль) метанола и 50 мл этилацетата, охлаждают до 0 С под аргоном. 43,3 мл (0,61 моль) ацетилхлорида добавляют по каплям и раствору и дают достигнуть комнатной температуры в течение около 45 мин. Этот раствор снова охлаждают на льду и добавляют 50,0 г N-ВОС-1-амино 2,3-диметилендиокси-4-гидроксиметилциклопентана (vii) в 100 мл этилацетата в течение примерно 45 мин. Раствору дают нагреться до комнатной температуры, затем выпаривают в вакууме с получением целевого амингидрохлорида (xiv), изображенного выше. Стадия (3).(см. выше), и 73 г бикарбоната натрия соединяют в 150 мл н-бутанола под аргоном и смесь перемешивают при комнатной температуре в течение около 30 мин. Добавляют 34,2 г 5 амино-4,6-дихлорпиримидина и смесь перемешивают при кипячении с обратным холодильником примерно 19 ч. Смесь концентрируют в вакууме, остаток переносят в этилацетат и воду. Водный слой экстрагируют этилацетатом и объединенную органическую фазу промывают рассолом, фильтруют, концентрируют в вакууме. Остаток очищают флэш-хроматографией, элюируя градиентом от 30 до 100% этилацетата в гексане с получением целевого замещенного хлорпиримидина (xv), изображенного выше.(см. выше), и 25,1 г формамидинацетата смешивают в 250 мл н-бутилацетата, смесь нагревают до кипячения с обратным холодильником под аргоном примерно 2 ч, добавляя дополнительные 12,5 г формамидинацетата спустя около 1 ч,и еще 10 г спустя около 1,5 ч. Смесь охлаждают,распределяют между этилацетатом и рассолом,рассол экстрагируют 3 порциями этилацетата и объединенную органическую фазу сушат над сульфатом магния, фильтруют, выпаривают в вакууме. Остаток очищают кристаллизацией из смеси этилацетат/гексан с получением вышеобозначенного хлорпурина (xvi). Остаток из концентрата маточного раствора может быть очищен флэш-хроматографией с элюцией от 80 до 100% этилацетата в гексане для увеличения выхода. Стадия (5). Получение 0,225 г (0,693 ммоль) продукта (xvi) примера 5, стадия (4) (см. выше), 0,239 г (1,04 ммоль) 1-(4-трифторметил)-фенил-(3S)-пирролидин-3-иламина со стадии (1) (см. выше) и 0,582 г (6,93 ммоль) бикарбоната натрия смешивают в 20 мл этанола и нагревают до кипения с обратным холодильником примерно 60 ч. Смесь фильтруют, концентрируют в вакууме и остаток очищают флэш-хроматографией с элюцией градиентом метиленхлорид/этанол, 30:1 до 10:1, с получением пирролидиниламина (xvii), изображенного выше. Стадия (6). 0,234 г продукта примера 5,стадия (5) (см. выше), растворяют в 10 мл трифторуксусной кислоты и раствор перемешивают при комнатной температуре в течение ночи. Раствор выпаривают в вакууме, а остаток очищают флэш-хроматографией, элюируя смесью метиленхлорид/этилацетат (10:1) с получением 7,1 г (24,5 ммоль) -t-бутилового эфира N-tBOC-L-аспарагиновой кислоты растворяют в 120 мл тетрагидрофурана. Раствор охлаждают до 0 С и добавляют 2,73 г (27 ммоль) триэтиламина, затем 2,66 г (24,5 ммоль) этилхлорформиата. Раствор перемешивают примерно 30 мин и добавляют раствор 3,71 г (98,2 ммоль) боргидрида натрия в воде. Смесь перемешивают при комнатной температуре около 17 ч, концентрируют в вакууме и остаток разбавляют этилацетатом, органический слой промывают 1 Н соляной кислотой, 10% карбонатом натрия, рассолом, затем высушивают над сульфатом магния, фильтруют, концентрируют в вакууме,очищают остаток флэш-хроматографией, элюируя от 30 до 50% этилацетата в гексане с получением 3(S)-t-бутил-3-ВОС-амино-4-гидроксин-бутаноат (xix). Стадия (2). Получение Раствор 0,73 г диметилсульфоксида в 9 мл метиленхлорида охлаждают до 70 С и по каплям добавляют 31 мл 2 М раствора оксалил хлорида в метиленхлориде. Раствор перемешивают около 15 мин и добавляют раствор 0,85 г 3(S)-tбутил-3-ВОС-амино-4-гидрокси-н-бутаноата(xix) в 5 мл метиленхлорида. После перемешивания в течение около 45 мин добавляют 1,88 г триэтиламина. Раствору дают нагреться до ком 39 натной температуры, перемешивают примерно 30 минут, затем разбавляют этилацетатом. Раствор промывают 1 Н соляной кислотой, 10% карбонатом натрия, рассолом, высушивают над сульфатом магния, фильтруют, концентрируют в вакууме с получением 3(S)-t-бутил-3-ВОСамино-4-оксо-н-бутаноата (хх). Стадия (3). Продукт (хх) примера 6, стадия (2) (см. выше), растворяют в 9 мл метанола и (добавляют) 1,34 г хлоргидрата бензиламина, затем 0,94 г триэтиламина, затем 200 мг 3 А молекулярных сит. Раствор перемешивают около 45 мин и добавляют раствор 0,23 г хлорида цинка и 0,22 г цианоборгидрида натрия в 5 мл метанола. Раствор перемешивают около 4 ч, добавляют 2 мл 1 Н гидроксида натрия, затем 10 мл воды, смесь концентрируют до половины объема и экстрагируют этилацетатом. Раствор этилацетата промывают 10% раствором карбоната натрия, рассолом, высушивают над сульфатом магния,фильтруют, концентрируют в вакууме, остаток очищают флэш-хроматографией, элюируя от 30 до 40% этилацетата в гексане, с получением бензиламина (xxi), изображенного выше. Стадия (4). 0,90 г продукта примера 6, стадия (3) (см. выше), растворяют в 12 мл смеси толуол/уксусная кислота (10:1) и раствор кипятят с обратным холодильником около 1,5 ч. Смесь концентрируют в вакууме, а остаток очищают флэш-хроматографией, элюируя 2535% этилацетатом в метиленхлориде с получением 1-бензил-4(S)-ВОС-амино-2-пирролидина. Стадия (5). 0,64 г продукта примера 6, стадия (4) (см. выше), растворяют в 20 мл этилацетата и раствор охлаждают до 0 С. В течение 5 мин через раствор пропускают газообразный хлористый водород и смесь перемешивают при комнатной температуре около 18 ч. К смеси добавляют эфир, выпавший осадок собирают фильтрацией и получают хлоргидрат 1-бензил 4(S)-амино-2-пирролидинона. Стадия (6). 0,33 г защищенного хлорпурина примера 5, стадия (4) (см. выше), 0,26 г хлоргидрата 1-бензил-4(S)-амино-2-пирролидинона и 0,29 г триэтиламина соединяют в 10 мл этанола и смесь нагревают до кипения с обратным холодильником около 50 ч. Смесь концентрируют в вакууме, остаток растворяют в 20 мл 1 Н соляной кислоты и перемешивают при комнатной температуре около 1 ч. Смесь концентрируют в вакууме и остаток очищают препаративной ВЭЖХ, элюируя градиентом ацетонитрила 40 от 10 до 60% в воде, содержащим 0,1% трифторуксусной кислоты. Соответствующие фракции объединяют, концентрируют, а остаток растворяют в 20 мл 1 Н соляной кислоты, растворитель выпаривают в вакууме и это повторяют еще 2 раза. Этот остаток растворяют в метаноле, растворитель выпаривают под вакуумом, остаток растирают в порошок с эфиром, получая 4(S)-1 бензил-4-[9-(2,3-дигидрокси-4-гидроксиметилциклопентил)-9 Н-пурин-6-иламино]пирролидин-2-он в форме хлоргидратного тригидрата,т.пл. 100 С (dec). Пример 7. Получение (1S,2R,3R,5R)-3 гидроксиметил-5-[6-[1-(4-нитрофенил)пирролидин-3-иламино]-пурин-9-ил]циклопентан-1,2 диола. Стадия (1). 4-Нитрофенол (1,0 г, 7,19 ммоль) и триэтиламин (3 мл, 21,6 ммоль) растворяли вместе в безводном метиленхлориде (10 мл) и раствор охлаждали до -15 С. Добавляют ангидрид трифторметансульфокислоты (1,81 мл,10,8 ммоль) и смесь перемешивают при -15 С примерно 30 мин. Смесь разбавляют метиленхлоридом, промывают раствором бикарбоната натрия и рассолом, органический слой высушивают над сульфатом магния, фильтруют и концентрируют в вакууме. Остаток очищают флэшхроматографией, элюируя метиленхлоридом с получением 4-нитрофенилтрифторметансульфоната в виде твердого продукта светло-желтого цвета. Стадия (2). 3(S)-Амино-1-бензилпирролидин (3,0 г, 17,0 ммоль) и триэтиламин (2,50 мл, 17,9 ммоль) растворяют вместе в безводном метаноле (17 мл) под азотом и по каплям добавляют этилтрифторацетат (2,53 мл, 21,3 ммоль). Раствор перемешивают около 18 ч, выпаривают в вакууме и остаток переносят в метиленхлорид. Раствор промывают раствором бикарбоната натрия, рассолом, высушивают над сульфатом магния, фильтруют, концентрируют в вакууме с получением 1-бензил-3(S)-трифторацетиламинопирролидина. Стадия (3). 1-Бензил-3(S)-трифторацетиламинопирролидин (4,59 г, 16,7 ммоль) растворяют под азотом в безводном метаноле (50 мл) и добавляют ди-трет-бутилдикарбонат (3,68 г,16,7 ммоль) и 10% палладия на угле (0,90 г). Смесь затем перемешивают под водородом при атмосферном давлении около 5 ч. Смесь фильтруют через Целит, промывая метанолом,фильтрат выпаривают в вакууме. Остаток очищают флэш-хроматографией, элюируя 5% метанолом в метиленхлориде с получением 1-ВОС 3(S)-трифторацетиламинопирролидина. Стадия (4). 1-ВОС-3(S)-трифторацетиламинопирролидин (4 г) растворяют в метиленхлориде (130 мл) и добавляюттрифторуксусную кислоту (19 мл). Раствор перемешивают при комнатной температуре около часа, затем концентрируют в вакууме. Остаток разделяется между метиленхлоридом и насыщенным рас 41 твором бикарбоната натрия. Слои разделяются и водный раствор экстрагируют этилацетатом. Объединенный органический слой сушат над сульфатом магния, фильтруют, выпаривают в вакууме с получением 3(S)-трифторацетиламинопирролидина. Стадия (5). 4-Нитрофенилтрифторметансульфонат (0,423 г, 1,56 ммоль) вместе с триэтиламином (0,217 мл, 1,56 ммоль) растворяют в безводном ацетонитриле (15 мл) и добавляют 3(S)-трифторацетиламинопирролидин (0,852 г,4,68 ммоль), смесь нагревают до кипения с обратным холодильником около 18 ч. Смесь охлаждают, концентрируют в вакууме и очищают остаток флэш-хроматографией, элюируя градиентом от 25% до 50% этилацетата в гексане с получением 1-(4-нитро)фенил-3(S)-трифторацетиламинопирролидина. Стадия (6). 1-(4-Нитрофенил-3(S)-трифторацетиламинопирролидин (0,334 г, 1,10 ммоль) смешивают с насыщенным раствором карбоната калия в смеси метанол/вода (2:3) (20 мл) и смесь нагревают при 55 С около 2 ч, затем при комнатной температуре около 18 ч. Смесь концентрируют в вакууме и остаток переносят в воду(10 мл). Водный раствор экстрагируют этилацетатом и органический слой высушивают над сульфатом магния, фильтруют, выпаривают в вакууме с получением 3(S)-амино-1-(4-нитро) фенилпирролидина. Стадия (7). Используя, в основном, процедуры примера 3, стадии 12 и 13 и примера 5,стадии 5 и 6, из 3(S)-амино-1-(4-нитро)фенилпирролидина получают(1S,2R,3R,5R)-3 гидроксиметил-5-[6-[1-(4-нитрофенил)пирролидин-3-иламино]-пурин-9-ил]циклопентан-1,2 диол, т.пл. 119-120 С. Используя, в основном, методы, показанные на реакционных схемах и в примерах, которые описаны выше, и соответствующих исходных веществ получают следующие соединения:(разл.) Соединения настоящего изобретения пригодны как гипотензивные средства при лечении гипертонии; они также увеличивают просвет кровеносных сосудов и, соответственно, полезны при лечении ишемической болезни сердца; они также действуют как кардиопротекторы,пригодные для предотвращения или уменьшения поражения миокарда, приводящего к ишемии сердца; и они также действуют как антилиполитические агенты, пригодные для лечения гиперлипидемии и гиперхолестеринемии. Соединения, включенные в объем данного изобретения, проявляют активность в стандартных анализах A1/A2 рецепторного связывания при определении активности аденозинрецепторного агониста у млекопитающих. Отдельные методики опытов, которые используют при определении сродства связывания рецептором заявленных соединений, описываются ниже. А. Определение in vitro сродства связывания аденозинового рецептора. Сродство связывания A1 рецептора определялось конкурентным исследованием, основанным на лигандном вытеснении 3H-СНАInc., Natick, Mass] из рецептора с использованием мембранного препарата из мозга крысы, в соответствии со способом R.F. Bruns et al., Mol.Pharmacol., 29:331 (1986). Неспецифическое связывание определяли в присутствии 1 мМ теофиллина. Сродство связывания A2 рецептора определялось аналогичным способом, основанным на лигандном вытеснении из рецептора 3H-CGS 21680, известного агониста на основе аденозина,специфичного к А 2 рецептору, с использованием мембран из полосатого тела мозга крысы. Неспецифическое связывание определяли в присутствии 20 М 2-хлораденозина. Исследования выполняли в стеклянных пробирках для опытов в двух повторностях при 25 С. Как только добавлялись мембраны, пробирки встряхивали и инкубировали их при 25 С в течение 60 мин (исследование A1) или 20 мин(исследование А 2) на роторной качалке. Пробирки с образцами встряхивали в середине инкубационного периода времени и ближе к концу инкубации. Опыты заканчивались быстрой фильтрацией через 2,4 см GF/B фильтры с использованием коллектора клеток Brandel'a. Пробирки с образцами трижды промывали холодным 50 мМ трис-НСl (рН 7,7 или 7,4) с последующей фильтрацией, завершаемой в течение 15 с. Влажные фильтры помещали в стеклянные ампулы для подсчета радиоактивности, заполненные 10 мл Аквазола II (New EnglandNuclear). Ампулы встряхивали всю ночь в ро 001801 46 торном шейкере и помещали в жидкостной сцинтилляционный анализатор для двухминутных замеров. Значения IC50 связывания с рецептором, т.е. концентрация, при которой соединение данного изобретения вытесняло радиоактивномеченный стандартный образец, были получены с использованием дающей графические изображения компьютерной программы. (RS/1,Bolt, Beranek and Newman, Boston, MA). Сродство связывания A1 рецептора определяли также с использованием препарата мембран эпидидимальной жировой ткани крысы. Приготовление образца мембран: эпидидимальную жировую ткань крысы гомогенизируют в буфере, содержащем 0,25 М сахарозы, 10 мМ Триса, 2 мМ ЭДТА, 0,1 М фенилметилсульфонилфторида и 1 г/мл Лейпептина (200 мг сырой ткани по весу на 1 мл буфера). Этот гомогенат помещают в 50 мл центрифужные пробирки и центрифугируют при 1000 g (3000RPM) в течение 1 мин, промежуточный супернатант удаляют и центрифугируют при 38 000 g 15 мин. Осадок ресуспендируют в основном буфере анализа (50 мМ Трис и 1 мМ ЭДТА)(300 мг ткани по первоначальному весу/мл основного буфера анализа) и к суспензии добавляют 2 л/мл раствора аденозиндезаминазы (10 мг/мл), суспензию инкубируют 30 мин при 37 С. Суспензию центрифугируют при 38 000 g 10 мин, осадок один раз промывают 20 мл основного буфера анализа, ресуспендируют в этом же буфере (1,2 г веса исходной сырой ткани/мл буфера). Анализ и учет радиоактивности: пробирки готовят следующим образом: общие (для учета общего связывания) пробирки, 100 л суспензии мембран (приготовленной, как описано выше),50 л раствора 3H-циклогексиладенозина (приготовленного разбавлением раствора с приблизительно 1 мКюри/мл со специфической активностью приблизительно 29,9 Кюри/ммоль буфером анализа до 100 нМ (здесь и далее "ЦГА раствор"), 350 л буфера анализа; пробирки для неспецифического связывания, 100 л мембранной суспензии, 50 л ЦГА раствора, 50 л 100M 2-хлораденозина в буфере анализа, 300 л буфера анализа; пробирки для исследуемых образцов, 100 л мембранной суспензии, 50 л ЦГА раствора, 50 л раствора испытуемого соединения, который может быть приготовлен серийным разбавлением раствора (ДМСО в буфере анализа), 300 л буфера анализа, пробирки Бланка, 50 л ЦГА раствора, 450 л буфера анализа. Каждую пробирку встряхивают 10 с, инкубируют при 23 С 2 ч и фильтруют, используя фильтрационную ячейку Brandel'a, используя Ватмановскую GF/B фильтровальную бумагу,промывая дважды по 5 мл 50 мМ Трисом. Фильтровальные диски помещают в 7 мл ампулы для подсчета радиоактивности, которые затем заполняют приблизительно 5 мл готовой 47 безопасной сцинтилляционной смесью и подсчитывают уровень радиоактивности. В. Определение in vitro вазорелаксации в выделенных венечных артериях сердца свиньи. Венечные артерии сердца свиньи были получены с местной бойни, аккуратно рассечены и очищены от жира, крови и приросшей ткани. Были нарезаны кольца приблизительно 2-3 мм шириной и перенесены в ванночки, имеющие водяные рубашки (10 мл), заполненные теплым(37 С) оксигенированным (O2/СO2:95%/5%) буфером Кребса-Хенселита и снабженные Lобразными крюками между стержнями из нержавеющей стали и силовым преобразователем. Состав буфера Кребса следующий (мМ): NaCl,118; KСl, 4,7; CaCl2, 2,5; MgSO4, 1,2; KН 2 РO4,1,2; NаНСО 3, 25,0; и глюкоза, 10,0. Кольца удерживали в равновесии в течение 90 мин с частыми сменами буфера при напряжении покоя 5 г. Для того, чтобы гарантировать оптимальное повышение давления, артериальные кольца предварительно заливали дважды 36 мМ KСl и один раз 10 М PGF2a перед выдержкой с 3 MPGF2a. Когда изометрическое давление достигало устойчивого уровня, в ванночки добавляли аккумулятивные количества аналогов аденозина, относящихся к данному изобретению (обычно от 1 мМ до 100 M, на половину ванны). За 100% принимали величину давления, которое достигалось при 3 М PGF2a; все другие величины выражались в процентах от этого максимального значения. Значения IС 50 релаксации,т.е. концентрация, при которой заявленное соединение вызывало 50% уменьшение давления,определяли с помощью вышеуказанной компьютерной программы линейной графики. С. Определение in vivo среднего артериального кровяного давления (САД) и частоты сердечных сокращений (ЧСС) у анестезированной крысы с нормальным давлением и крысы со спонтанной гипертонией. 1. Анастезированная крыса. Крыс с нормальным давлением анастезировали фенобарбиталом натрия (50 мг/кг) внутрибрюшинно и помещали на нагретый хирургический стол. В бедренную артерию с просвечивающим венозным рисунком были введены артериальные катетеры для обеспечения измерения артериального давления и облегчения введения исследуемых соединений. Животным предоставили 10 мин, чтобы прийти в себя после хирургического вмешательства. Непрерывно измерялось и регистрировалось артериальное давление, частоту сердечных сокращений определяли, используя пульсовые колебания кровяного давления для приведения в действие кардиотахометра. После того, как были установлены и зарегистрированы исходные параметры,внутривенно стали вводить увеличивающиеся дозы (1, 3, 10, 30, 100, 300 и 1000 г/кг) соединений данного изобретения, которые подверга 001801 48 лись исследованию. Максимальные изменения в параметрах сосудов сердца наблюдали после каждой дозы аналога аденозина. Каждой крысе вводили только одно соединение. Способность соединений снижать частоту сердечных сокращений и среднее кровяное давление оценивали в результате определения дозы средства, необходимой для понижения частоты сердечных сокращений или артериального давления на 25% (ЕД 25). 2. Крыса со спонтанной гипертонией(СГК). Активность соединений данного изобретения, введенных перорально, исследовалась на крысах со спонтанной гипертонией, находящихся в сознании. Крыс анестезировли пентабарбатолом натрия (50 мг/кг внутрибрюшинно). Дистанционный преобразователь был вживлен крысам срединной лапаротомией брюшной полости. Канюля преобразователя была вставлена в аорту брюшной полости для обеспечения непосредственного измерения артериального давления у крыс (СГК), находящихся в сознании. Преобразователь был прикреплен к брюшной стенке. После восстановления после операции (минимум семи дней) СГК были помещены на пластину ресивера и преобразователь/передатчик был активирован. Систолическое, диастолическое и среднее артериальное давление и частоту сокращений сердца регистрировали в течение 1,5 ч у незафиксированных крыс, находящихся в сознании, для того, чтобы определить устойчивые значения. Каждая крыса потом получала единственную дозу одного из заявленных соединений, которые исследовались, или наполнителя, и изменения артериального давления и сердечного ритма снимались и регистрировались в течение 20 ч. Когда поступление крови в сердце нарушалось на небольшие промежутки времени (от 2 до 5 мин) с последующим восстановлением тока крови (реперфузией), это предохраняло сердце от развития ишемии при прерывании тока крови на более длительные периоды времени (например 30 мин). Д. Определение частоты сердечных сокращений in vitro. Предсердие, удаленное у крысы. Самцов крыс породы Sprague-Dawley анастезируют с помощью Кеtamine/Rompun и быстро иссекают сердца, помещают их в теплый,насыщенный кислородом (95% О 2/5% СO2) буфер Кребса-Хенселита следующего составаKH2PO4 1,2; NaHCO3 25,0 и глюкоза, 10,0 (рН 7,4). Правые спонтанно пульсирующие предсердия рассекают и суспендируют в ваннах с водяными рубашками, с помощью сеток из нержавеющей стали. Ткань предсердий уравновешивают в течение 60 мин при напряжении покоя в 2 г со сменой буфера каждый 5 мин в течение первых 15 мин, затем с 15-минутным ин 49 тервалом. Соединения настоящего изобретения,которые нужно исследовать, добавляют кумулятивно в ванночки и частоту сердечных сокращений определяют с помощью Grass Model 7D полиграфа. Заявленные соединения показывают активность в опытах, используемых для определения способности соединений имитировать кардиопротективную активность в отношении улучшения состояния сердечной мышцы. Методики некоторых опытов, которые полезны при определении кардиопротективной активности соединений настоящего изобретения, описываются ниже. Е. Определение кардиопротективной активности на крысах. 1. Общие методы хирургической подготовки. Взрослых крыс породы Sprague-Dawley анастезируют Инактином (100 мг/кг внутрибрюшинно). Трахею интубируют и принудительную вентиляцию обеспечивают через небольшой респиратор для животных. В бедренную вену и артерию помещают катетеры для введения исследуемых соединений настоящего изобретения и соответственно измерения кровяного давления. Делают разрез на левой стороне грудной клетки через грудные мышцы и мышцы оттягивают, чтобы высвободить четверть межреберного пространства. Грудную полость вскрывают и обнажают сердце. Proline нить длиной 4-0 прокладывают через вентрикулярную стенку поблизости от левой главной коронарной артерии и используют для прерывания кровотока через коронарную артерию,затягивая скользящий узел. На поверхности сердца помещают колеблемый кровотоком зонд Допплера (средство для оценки кровообращения), чтобы удостовериться, что коронарная артерия определена правильно. Катетер также помещают в левый желудочек для того, чтобы контролировать работу левого желудочка во время эксперимента. 2. Предварительные меры для сохранения состояния сердца и методики теста. Для сохранения сердца коронарную артерию перекрывают (кровоток прекращается) на время двух минут. Затем ослабляют скользящий узел, чтобы восстановить кровоток (реперфузия) на период трех минут. Эту процедуру окклюзии/реперфузии повторяют дважды. Спустя пять минут после завершения заключительной процедуры по сохранению сердца артерию снова перекрыли на 30 мин с последующим реперфузированием в течение 3 ч. При испытании соединения данного изобретения, помимо выполнения операций окклюзия/реперфузия, вводилось указанное соединение за 30 мин до 30 минутного периода окклюзии. К концу трехчасового периода реперфузии артерию реокклюдируют и в катетер левого желудочка вводят 1 мл свободного Голубого красителя, останавли 001801 50 вают сердце внутривенным введением хлорида калия. Эта процедура позволяет красителю перфузировать в области сердца, которые находятся в здоровом состоянии, тогда как часть сердца,подвергнувшаяся ишемии, не впитывает краситель (она представляет собой так называемую"область повышенного риска"). Сердце быстро извлекают для исследования обширности инфаркта. Зона инфаркта определяется в результате тонкослойного рассечения сердца от верхушки до основания на 4 или 5 срезов толщиной 1-2 мм. Срезы инкубируют в 1% растворе трифенилтетразолия в течение 15 мин. Этот краситель реагирует с жизнеспособной тканью и окрашивает ее в кирпично-красный цвет. Подвергнувшаяся инфаркту ткань не окрашивается красителем и остается тускло-белой. Срезы ткани помещают в видеоустройство для анализа изображений и инфаркт определяют при изучении проекций на плоскость. Оценивают влияние соединения, относящегося к изобретению, на размеры инфаркта миокарда и на его основе количественно определяют величину кардиопротективной активности. Результаты представляют в процентах от области риска, которая подверглась инфаркту. Соединения настоящего изобретения показывают активность в опытах, проводимых для определения способности соединений ингибировать расщепление жиров (липолиз). Методики некоторых опытов, которые пригодны для определения антилиполитической активности заявленных соединений, описываются ниже.F. Определение антилиполитической активности на жировых клетках (адипоцитах) крысы. 1. Выделение адипоцитов из эпидидимальных скоплений жировой ткани. Из анестезированных крыс извлекают жировую ткань и дважды прополаскивают в инкубационной среде (2,09 г бикарбоната натрия и 0,04 г ЭДТА, динатриевой соли, в 1 л буфера Кребса). От каждой крысы (300-500 г) получают приблизительно 4 мл жировой ткани. Жировую ткань (35 мл) режут ножницами на маленькие кусочки и промывают в инкубационной среде(50 мл). Смесь вливают в шприц 50 мл объема, к которому вместо иглы присоединен короткий кусочек трубки с зажимом. Водная фаза может дренировать. Второе промывание инкубационной средой выполняют через шприц. Ткань добавляют к 50 мл раствора коллагеназы (коллагеназа (90 мг), бычий сывороточный альбумин(БСА) (500 мг) и 0,1 М раствору хлорида кальция (1 мл) в инкубационной среде (50 мл) в 1 литровой колбе. Смесь встряхивают при температуре окружающей среды 37 С в течение примерно 60 мин в атмосфере 95% кислорода на 5% углекислого газа, чтобы вызвать усвоение ткани. Дисперсные клетки собирают фильтрованием через 2 слоя марли в 100 мл пластмассовый стакан. Нераспавшиеся клеточные агрегации, 51 оставшиеся на марле, промывают еще раз инкубационной средой (20 мл). Клетки в стакане центрифугируют в двух пластиковых пробирках в течение 30 мин при комнатной температуре при 300 об/мин. Водный слой отсасывают снизу рыхлого слоя плавающих на поверхности жировых клеток и отбрасывают. Адипоциты осторожно собирают в 250 мл пластмассовый стакан, содержащий 100 мл промывающего раствора (1 г БСА на 100 мл инкубационной среды). После осторожного перемешивания повторяют стадию центрифугирования. Затем еще раз промывают раствором для промывок. Клетки собирают и измеряют их объем с помощью мерного цилиндра. Адипоциты разбавляют в два раза по объему буфером анализа (инкубационная среда(13 мг. 2. In vitro исследование липолиза. Анализ выполняют в 20 мл пластмассовых сцинтилляционных флаконах и суммарный анализируемый объем составляет 4,2 мл. Буфер анализа (2,5 мл), разбавленные адипоциты (1,5 мл) и раствор испытуемого соединения (12,3 л) агониста аденозина (12,3 л, изменяющаяся концентрация) инкубируют в шейкере в условиях окружающей среды в течение 15 мин, затем начинают реакцию с раствором норэпинефрина(20 л) и аденозиндезаминазой (1 г/мл, 41,2 л). После 60 мин в шейкере реакцию заканчивали, помещая флаконы на лед. Содержание каждого флакона переносили в стеклянную пробирку 12 х 75 мм и центрифугировали при 810 С при 3600 об/мин в течение 20 мин. Плотный липидный слой удаляли отсасыванием, а водный слой исследовали на наличие глицерина(400 л пробы). Позитивный контроль выполняют в отсутствие какого либо агониста аденозина, заменяя водный раствор, который исследуется. Антилиполитическия активность аденозина опосредована через подкласс A1 рецепторов. Селективные агонисты подкласса А 2 рецепторов, такие как CGS 21680, не показывают антилиполитической активности. Соответственно,несмотря на то, что некоторые селективные A1 агонисты могут не иметь желаемой гипотензивной активности, а А 2 агонисты могут не быть эффективными антилиполитическими средствами, соединения настоящего изобретения, которые объединяют с агонистами, чрезвычайно подходят для того, чтобы эффективно лечить оба фактора риска, которые обсуждались выше,т.е. гипертонию и гиперлипидемию. Соединения настоящего изобретения обычно могут вводиться орально или парентерально при лечении больных, страдающих гипертонией, ишемической болезнью сердца, или больных, нуждающихся в кардиопротективной 52 терапии или антилиполитической терапии. Термин "больные" в данном здесь смысле означает человека и других млекопитающих. Соединения данного изобретения, предпочтительно в виде соли, могут быть приготовлены для введения любым общепринятым способом, и в объем изобретения включены композиции, содержащие, по крайней мере, одно соединение из заявленных согласно изобретению, использующееся в медицине или в ветеринарии. Такие композиции можно составить обычно используемым способом, используя один или более фармацевтически приемлемых носителей или наполнителей. Пригодные носители включают разбавители или наполнители, стерильную водную среду и различные нетоксичные органические растворители. Композиции можно готовить в виде таблеток, капсул, лепешек, пастилок, леденцов,порошков, водных суспензий или растворов,растворов для инъекций, эликсиров, сиропов и т.п., и они могут содержать одно или несколько средств, выбранных из группы, включающей подсластители, отдушки, подкрашивающие вещества и консерванты, для того, чтобы обеспечить фармацевтическую пригодность препарата. Конкретный носитель и соотношение аналогов аденозина и носителя определяются растворимостью и химическими свойствами соединений, специальным образом введения и обычной фармацевтической практикой. Например,наполнители, такие как лактоза, цитрат натрия,карбонат кальция и дикальцийфосфат и различные разрыхлители, такие как крахмал, альгиновая кислота и некоторые сложные силикаты,вместе с либрикантами, такими как стеарат магния, натрийлаурилсульфат и тальк, могут использоваться при изготовлении таблеток. Для капсульных форм лактоза и высокомолекулярные полиэтиленгликоли входят в число предпочтительных фармацевтически пригодных носителей. При приготовлении водных суспензий для орального использования носителем должен быть эмульгирующий или суспендирующий агент. Разбавители, например этанол, пропиленгликоль, глицерин и хлороформ, а также их сочетания могут использоваться наряду с другими веществами. Для парентерального введения могут использоваться растворы и суспензии заявленных соединений в кунжутном или арахисовом масле или водных растворах пропиленгликоля, так же как и стерильные водные растворы растворимых фармацевтически приемлемых солей, описанные здесь. Растворы солей этих соединений особенно подходят для инъекционного введения внутримышечно и подкожно. Водные растворы, содержащие эти соли, растворенные в чистой дистиллированной воде,пригодны для внутривенных инъекций при условии, что их рН соответственно отрегулирован и что они содержат подходящий буфер, доведены до изотонического состояния достаточной 53 засоленностью или глюкозой и простерилизованы термообработкой или микрофильтрацией. Схема приема лекарственного средства,используемая при осуществлении методов настоящего изобретения, обеспечивает максимальный терапевтический эффект до тех пор,пока не будет достигнуто улучшение, а с этого времени минимальный эффективный уровень,который обеспечивает успокоение. Таким образом, в целом дозировки такие, которые оказывают лечебное действие снижением давления при гипертонии, увеличением коронарного кровотока при лечении ишемической болезни сердца, проявляют кардиопротективный эффект, т.е. обеспечивают уменьшение ишемического поражения или размеров области инфаркта миокарда, последовавшего за ишемией миокарда,или проявляют антилиполитическое действие. В общем, оральная доза может составлять от около 0,1 до 100 (предпочтительно в пределах от 1 до 10) мг/кг, а внутривенная доза от примерно 0,01 до примерно 10 мг/кг (предпочтительно в пределах от 0,1 до 5 мг/кг), необходимо принимать во внимание, конечно, что при выборе подходящей дозировки в каждом отдельном случае следует учитывать вес, общее состояние здоровья больного, его возраст и другие факторы, которые могут повлиять на реакцию на лекарство. Соединения настоящего изобретения можно вводить так часто, как это необходимо для достижения и поддержания желаемого терапевтического эффекта. Некоторые пациенты могут быстро реагировать на относительно большие или малые дозы и им требуется невысокий поддерживающий уровень или вообще таковой не требуется. С другой стороны, другим пациентам может быть необходимо поддерживающее введение от приблизительно 1 до приблизительно 4 раз в день в зависимости от физиологических потребностей конкретного пациента. Обычно лекарство можно вводить орально от 1 до приблизительно 4 раз в день. Предполагается, что многим больным потребуется не более чем примерно от одной до двух доз ежедневно. Предполагается также, что настоящее изобретение окажется полезным в качестве инъецируемой дозировочной формы, которая может вводиться в случае крайней необходимости больному при внезапной гипертонии или ишемии миокарда или больному, нуждающемуся в кардиопротектировании или антилиполитической терапии. Такое лечение может последовать после внутривенного введения активного соединения и количество соединения, вводимого такому пациенту, должно быть эффективным для достижения и поддержания желаемого лечебного результата.n и p- независимо друг от друга 0, 1, 2 или 3, при условии, что n + р равно, по крайней мере, 1; Т - водород, С 1-20aлкил, С 1-20aцил, С 1-20 тиоацил, галоген, карбоксил,или R3 О-СН 2; где Rd и Re - независимо водород, С 1-20 алкил; вместе с атомом углерода, с которым они соединены, могут образовывать С 3-10 1,1 циклоалкильную группу; или его фармацевтически приемлемая соль. 2. Соединение по п.1, в котором K представляет собой N, Т предсталяет собой гидроксиметил или метоксиметил; А и Вгидрокси; Х есть и n + р = 3 или 4; или его фармацевтически приемлемая соль. 3. Соединение по п.2, которое включает:(1R,2S,3R,5R)-3-[6-(1-бензилпирролидин 3(S)-иламино)пурин-9-ил]-5-метоксиметилциклопентан-1,2-диол,или их фармацевтически приемлемые соли. 4. Соединение по п.1, в котором Q есть СН 2, K представляет собой N, Т представляет собойa n + р = 3 или 4,или его фармацевтически пригодная соль. 5. Соединение по п.4, которое включает этиламид (1S,2R,3S,4R)-2,3-дигидрокси-4-[6-[1(5-трифторметилпиридин-2-ил)пирролидин-3 иламино]-пурин-9-ил]циклопентанкарбоновой кислоты, (S)-втор-бутиламид(1S,2R,3S, 4R)-2,3 дигидрокси-4-[6-[1-(5-трифторметилпиридин-2 ил) пирролидин-3-иламино]-пурин-9-ил]циклопентанкарбоновой кислоты и (R)-втор-бутиламид (1S,2R,3S,4R)-2,3-дигидрокси-4-[6-[1-(5 трифторметилпиридин-2-ил)пирролидин-3 иламино]-пурин-9-ил]циклопентанкарбоновой кислоты и его фармацевтически приемлемая соль. 6. Соединение по п.1, в котором Q представляет собой СН 2, K представляет собой N, Т является гидроксиметилом или метоксиметилом, А и В - гидрокси, Х представляет собой а n + р = 3 или 4, или их фармацевтически приемлемая соль. 7. Соединение по п.6 представляющее собой(1R,2S,3R,5R)-3-[6-(1-бензилпирролидин 3(S)-иламино)-пурин-9-ил]-5-метоксиметилциклопентан-1,2-диол, или его фармацевтически приемлемая соль. 8. Соединение по п.6, представляющее собой (1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(5 трифторметилпиридин-2-ил)пирролидин-3(S)иламино]-пурин-9-ил]циклопентан-1,2-диол или(1R,2S,3R,5R)-3-гидроксиметил-5-[6-[1-(4-трифторметилпиридин-2-ил)пирролидин-3(S)-иламино]-пурин-9-ил]циклопентан-1,2-диол, или его фармацевтически приемлемая соль. 9. Соединение по п.6, которое представляет собой (1R,2S,3R,5R)-3-метоксиметил-5-[6-[1(5-трифторметилпиридин-2-ил)пирролидин 3(S)-иламино]-пурин-9-ил]циклопентан-1,2 диол или (1R,2S,3R,5R)-3-метоксиметил-5-[6-[1(4-трифторметилпиридин-2-ил)пирролидин 3(S)-иламино]-пурин-9-ил]-3-циклопентан-1,2 диол или их фармацевтически приемлемые соли. 10. Соединение формулы где Z представляет собой 4-трифторметилпиридин-2-ил или 5-трифторметилпиридин-2-ил. 11. Соединение по п.10, которое представляет собой 2-[(3S)-3-аминопирролидин-1-ил]-5 трифторметилпиридин или 2-[(3S)-3-аминопирролидин-1-ил]-4-трифторметилпиридин. 12. Композиция для лечения сердечнососудистого заболевания, характеризующегося гипертонией или миокардиальной ишемией,содержащая гипотензивное эффективное коли
МПК / Метки
МПК: A61P 9/00, C07D 227/10, A61K 31/52
Метки: свойствами, антилиполитическим, аденозина, кардиопротективным, аналоги, гипотензивным, обладающие, антиишемическим
Код ссылки
<a href="https://eas.patents.su/30-1801-analogi-adenozina-obladayushhie-gipotenzivnym-kardioprotektivnym-antiishemicheskim-i-antilipoliticheskim-svojjstvami.html" rel="bookmark" title="База патентов Евразийского Союза">Аналоги аденозина, обладающие гипотензивным, кардиопротективным, антиишемическим и антилиполитическим свойствами</a>
Предыдущий патент: Способы лечения и предупреждения неблагоприятного воздействия активных форм кислорода.
Следующий патент: Дисперсионные покрытия на основе (со)полимеров винилиденфторида, модифицированных акриловыми полимерами
Случайный патент: Способ лечения заболеваний периодонта