Пентафторбензолсульфонамиды и их аналоги.
Номер патента: 1367
Опубликовано: 26.02.2001
Авторы: Флайджэйр Джон, Шан Бей, Медина Джулио К., Кларк Дэвид, Роузен Терри
Формула / Реферат
1. Фармацевтическая композиция, содержащая в качестве фармацевтически активного компонента соединение формулы I
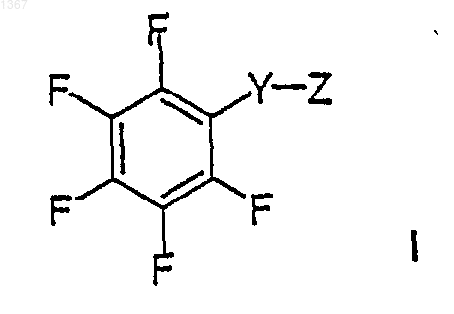
или его фармацевтически приемлемую соль, где
Y является -S(O)- или -S(O)2- и
Z является -NR1R2, где R1 выбирают из водорода, замещенного или незамещенного (C1-С10)алкила, замещенного или незамещенного (C3-С6)алкенила, замещенного или незамещенного (C3-С8)циклоалкила и замещенного или незамещенного (C2-С6)гетероалкила, и R2 выбирают из замещенного или незамещенного арила и замещенного или незамещенного гетероарила; при этом R1 и R2 могут быть соединены связующей группой Е с получением заместителя формулы
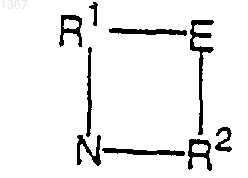
где Е обозначает связь, (C1-С4)алкилен или (C1-С4)гeтероалкилен, и кольцо, образуемое R1, Е, R2 и атомом азота, имеет не более 8 атoмов;
и фармацевтически приемлемый наполнитель.
2. Композиция по п.1, где R1 обозначает водород или (C1-С6)алкил, R2 обозначает необязательно замещенный фенил и между R1 и R2 отсутствует связующая группа Е.
3. Композиция по п.1, где R1 обозначает водород или метил, и R2 обозначает замещенный фенил, имеющий от одного до четырех заместителей, которые независимо друг от друга выбирают из (C1-С6)алкила, гидрокси, (C1-С6)алкокси, амино, необязательно замещенного одним или двумя (C1-С6)алкилами, необязательно замещенного ариламино, необязательно замещенного гетероариламино, необязательно замещенного фенокси и галогена.
4. Композиция по п.1, где R1 обозначает водород и R2 обозначает замещенный фенил, причем заместители в R2, находящиеся в одном или нескольких 3- и 4-положениях фенильного кольца относительно сульфонамидогруппы, независимо друг от друга выбирают из амино, (C1-С6)алкиламино и ди((C1-С6)алкил)амино.
5. Композиция по п.4, где соединение выбирают из группы, включающей
4-(N,N-диметиламино)-1-пентафторфенилсульфонамидобензол,
4-(N,N-диэтиламино)-1-пентафторфенилсульфонамидобензол,
3-(N,N-диметиламино)-1-пентафторфенилсульфонамидобензол,
4-амино-1-пентафторфенилсульфонамидобензол и
4-(N,N-диметиламино)-1-пентафторфенилсульфонамидобензолгидрохлорид.
6. Композиция по п.1, где R1 обозначает водород и R2 обозначает фенил, замещенный в 3- и 4-положениях относительно сульфонамидогруппы двухвалентной частью, образующей 5- или 6-членное кольцо с 3- и 4-атомами углерода фенильного кольца.
7. Композиция по п.6, где двухвалентная часть является -OCH2CH2O-, -OCH2O-, -C=CNH- или -C=NNH-.
8. Композиция по п.7, где соединение представляет
1,2-этилендиокси-4-пентафторфенилсульфонамидобензол,
1,2-метилендиокси-4-пентафторфенилсульфонамидобензол,
5-пентафторфенилсульфонамидоиндазол или
5-пентафторфенилсульфонамидоиндол.
9. Композиция по п.1, где R1 обозначает водород, R2 обозначает замещенный фенил, и заместители фенила независимо друг от друга выбирают из галогена, гидрокси, (C1-С6)алкила, (C1-С6)алкокси, амино, (C1-С6)алкиламино и ди((C1-С6)алкил)амино.
10. Композиция по п.9, где заместители фенила независимо друг от друга выбирают из брома, хлора, фтора, гидрокси, метокси, этокси, амино и диметиламино.
11. Композиция по п.10, где соединение выбирают из группы, включающей
4-метокси-1-пентафторфенилсульфонамидобензол,
3-гидрокси-1-пентафторфенилсульфонамидобензол,
4-гидрокси-1-пентафторфенилсульфонамидобензол,
4-этокси-1-пентафторфенилсульфонамидобензол,
3-этокси-1-пентафторфенилсульфонамидобензол,
3-фентокси-1-пентафторфенилсульфонамидобензол,
3-метокси-1-пентафторфенилсульфонамидобензол и
4-трет-бутокси-1-пентафторфенилсульфонамидобензол.
12. Композиция по п.1, где соединение выбирают из группы, включающей
1,2-диметокси-4-пентафторфенилсульфонамидобензол,
2-гидрокси-1-метокси-4-пентафторфенилсульфонамидобензол,
1,2-дигидрокси-4-пентафторфенилсульфонамидобензол,
мононатриевую соль 2-гидрокси-1-метокси-4-пентафторфенилсульфонамидобензола и
монокалиевую соль 2-гидрокси-1-метокси-4-пентафторфенилсульфонамидобензола.
13. Композиция по п.1, где соединение выбирают из группы, включающей
2-фтор-1-метокси-4-пентафторфенилсульфонамидобензол,
2-бром-1-метокси-4-пентафторфенилсульфонамидобензол,
2-хлор-1-метокси-4-пентафторфенилсульфонамидобензол,
натриевую соль 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензола и
калиевую соль 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензола.
14. Композиция по п.1, где в соединении формулы I Y является SO2, R1 обозначает водород или (C1-С6)алкил и R2 обозначает незамещенную или необязательно замещенную нафтильную группу.
15. Композиция по п.1, где R2 обозначает фенильное кольцо, замещенное гетероциклической группой в 4-положении относительно сульфонамидогруппы.
16. Композиция по п.1, где R1 и R2 ковалентно связаны в части, образующей 5- или 6-членное гетероциклическое кольцо с атомом азота группы NR1R2.
17. Композиция по п.16, где R1 обозначает группу -СН=СН- или группу -(СН2)3-, присоединенную в 2-положении фенильной группы R2 относительно сульфонамидогруппы.
18. Композиция по п.1, где R1 обозначает необязательно замещенный (C2-С10)алкил или необязательно замещенный (С3-С6)алкенил.
19. Композиция по п.18, где соединение выбирают из группы, включающей
2-гидрокси-1-метокси-4-[N-(5-гидроксипент-1-ил)пентафторфенилсульфонамидо]бензол,
4-метокси-1-[N-(2-пропенил)пентафторфенилсульфонамидо]бензол,
4-метокси-1-[N-(4-пентенил)пентафторфенилсульфонамидо]бензол,
1-[N-(2,3-дигидроксипропил)пентафторфенилсульфонамидо]-4-метоксибензол,
1-[N-(3,4-дигидроксибутил)пентафторфенилсульфонамидо]-4-метоксибензол,
1-[N-(4,5-дигидроксипентил)пентафторфенилсульфонамидо]-4-метоксибензол,
1-[N-(4-гидроксибутил)пентафторфенилсульфонамидо]-4-метоксибензол и
4-метокси-1-[N-(5-гидроксипентил)пентафторфенилсульфонамидо]-бензол.
20. Способ лечения или профилактики болезней, характеризующихся повышенным содержанием частиц липопротеина низкой плотности или холестерина в крови, который заключается в том, что субъекту-млекопитающему вводят терапевтически эффективное количество композиции по п.1.
21. Способ по п.20, где болезнь является атеросклерозом.
22. Способ по п.20, где болезнь является панкреатитом.
23. Способ по пункту 20, где болезнь является гиперхолестеринемией.
24. Способ по п.20, где болезнь является гиперлипопротеинемией.
25. Способ по п.20, где композицию вводят перорально.
26. Способ по п.20, где субъект является человеком.
27. Способ по п.20, где композицию вводят в сочетании с терапевтически эффективным количеством агента, понижающего содержание липидов в крови, или агента, понижающего содержание холестерина в крови.
28. Соединение формулы I
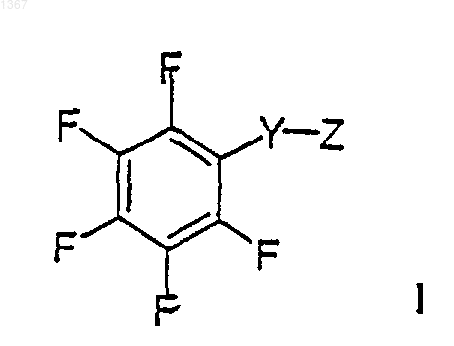
или его фармацевтически приемлемая соль, где
Y является -S(O)- или -S(O)2-; и
Z является -NR1R2, где R2 обозначает необязательно замещенэую фенильную группу и R1 выбирают из группы, включающей водород, замещенный или незамещенный (C1-С10)алкил, замещенный или незамещенный (C3-С6)алкенил, замещенный или незамещенный (C2-С6)гетероалкил, замещенный или незамещенный (C3-С6)гетероалкенил, замещенный или незамещенный (C3-С8)циклоалкил, замещенный или нeзамещенный (C5-С7)циклоалкенил;
заместители фенила, если они имеются, выбирают из группы, включающей (C1-С6)алкил, гидрокси, (C1-С6)алкокси, амино, необязательно замещенный одним или двумя (C1-С6)алкилами, необязательно замещенный ариламино, необязательно замещенный гетероариламино, необязательно замещенный фенокси и галоген; R1 и R2 могут быть соединены связующей группой Е с получением заместителя формулы
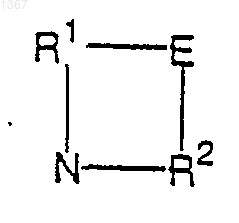
где Е обозначает связь, (C1-С4)алкилен или (C1-С4)гетероалкилен, и кольцо, образованное R1, Е, R2 и атомом азота, имеет не более 8 атомов, при условии, что
когда Y является -S(O)2- и R1 обозначает водород или метил, тогда R2 обозначает замещенный фенил;
когда Y является -S(O)2-, R2 обозначает фенил и R1 обозначает пропиленовое звено, присоединяющее атом азота группы -NR1R2 в 2-положении фенильного кольца относительно сульфонамидогруппы с образованием 1,2,3,4-тетрагидрохинолиновой системы, одна или несколько оставшихся валентностей в полученной таким образом бициклической системе замещены, по крайней мере, одним заместителем, который не является водородом;
когдаY является -S(O)2- и R2 обозначает фенил, замещенный 3-(1-гидроксиэтилом), 3-диметиламино, 4-диметиламино, 4-фенилом, 3-гидрокси, 3-гидрокси-4-диэтиламиноэтилом, 3,4-метилендиокси, 3,4-этилендиокси, 2-(1-пирролилом) или 2-метокси-4-(1-морфолино), тогда или R1 не является водородом или, когда R1 обозначает водород, одна или несколько оставшихся валентностей в фенильном кольце R2 замещены заместителем, который не является водородом; где указанное соединение обладает фармакологической активностью.
29. Соединение по п.28, где R2 обозначает водород или метил и R2 обозначает замещенный фенил, имеющий от одного до четырех заместителей, которые независимо друг от друга выбирают из (C1-С6)алкила, гидрокси, (C1-С6)алкокси, амино, необязательно замещенного одним или двумя (C1-С6) алкилами, необязательно замещенного ариламино, необязательно замещенного гетероариламино, необязательно замещенного фенокси и галогена.
30. Соединение по п.29, где R1 обозначает водород и R2 обозначает замещенный фенил, и заместители фенила, находящиеся в одном или нескольких 3- и 4-положениях фенильного кольца относительно сульфонамидогруппы, независимо друг от друга выбирают из амино, (C1-С6)алкиламино и ди((C1-С6)алкил)амино.
31. Соединение по п.30, которое выбирают из группы, включающей
4-(N,N-диэтиламино)-1-пентафторфенилсульфонамидобензол,
4-амино-1-пентафторфенилсульфонамидобензол и
4-(N,N-диметиламино)-1-пентафторфенилсульфонамидобензол.
32. Соединение по п.28, где R1 обозначает водород и R2 обозначает фенил, замещенный в 3- и 4-положениях относительно сульфонамидогруппы двухвалентной частью, образующей 5- или 6-членное кольцо с 3- и 4-атомами углерода фенильного кольца.
33. Соединение по п.29, где R1 обозначает водород и заместители фенила независимо друг от друга выбирают из галогена, гидрокси, низшего алкила, низшего алкокси, амино, (низший)алкиламино и ди(низший)алкиламино.
34. Соединение по п.29, где заместители фенила независимо друг от друга выбирают из брома, хлора, фтора, гидрокси, метокси, этокси, амино и диметиламино.
35. Соединение по п.28, где заместители фенила, находящиеся в одном или нескольких 3- и 4-положениях фенильного кольца относительно сульфонамидогруппы, независимо друг от друга выбирают из брома, хлора, фтора, гидрокси, метокси и этокси.
36. Соединение по п.35, которое выбирают из группы, включающей
4-метокси-1-пентафторфенилсульфонамидобензол,
3-гидрокси-1-пентафторфенилсульфонамидобензол,
4-гидрокси-1-пентафторфенилсульфонамидобензол,
4-этокси-1-пентафторфенилсульфонамидобензол,
3-этокси-1-пентафторфенилсульфонамидобензол и
3-метокси-1-пентафторфенилсульфонамидобензол.
37. Соединение по п.28, которое выбирают из группы, включающей
1,2-диметокси-4-пентафторфенилсульфонамидобензол,
2-гидрокси-1-метокси-4-пентафторфенилсульфонамидобензол,
1,2-дигидрокси-4-пентафторфенилсульфонамидобензол,
мононатриевую соль 2-гидрокси-1-метокси-4-пентафторфенилсульфонамидобензола и
монокалиевую соль 2-гидрокси-1-метокси-4-пентафторфенилсульфонамидобензола.
38. Соединение по п.28, которое выбирают из группы, включающей
2-фтор-1-метокси-4-пентафторфенилсульфонамидобензол,
2-бром-1-метокси-4-пентафторфенилсульфонамидобензол,
2-хлор-1-метокси-4-пентафторфенилсульфонамидобензол,
натриевую соль 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензола и
калиевую соль 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензола.
39. Соединение по п.28, которое выбирают из группы, включающей
2-гидрокси-1-метокси-4-[N-(5-гидроксипент-1-ил)пентафторфенилсульфонамидо]бензол,
4-метокси-1-[N-(2-пропенил)пентафторфенилсульфонамидо]бензол,
4-метокси-1-[N-(4-пентенил)пентафторфенилсульфонамидо]бензол,
1-[N-(2,3-дигидроксипропил)пентафторфенилсульфонамидо]-4-метоксибензол,
1-[N-(3,4-дигидроксибутил)пентафторфенилсульфонамидо]-4-метоксибензол,
1-[N-(4,5-дигидроксипентил)пентафторфенилсульфонамидо]-4-метоксибензол,
1-[N-(4-гидроксибутил)пентафторфенилсульфонамидо]-4-метоксибензол и
4-метокси-1-[N-(5-гидроксипентил)пентафторфенилсульфонамидо]бензол.
Текст
1 Область техники Данное изобретение относится к производным пентафторбензолсульфонамида и их аналогам, а также к их использованию в качестве фармацевтически активных средств. Предпосылки изобретения Атеросклероз является одной из наиболее распространенных причин смертности в США. Эта болезнь возникает вследствие избытка холестерина в стенках артерий, что ведет к образованию бляшек, которые препятствуют кровотоку и способствуют образованию тромбов, вызывающих, в конечном счете, сердечные приступы, инсульты и нарушение кровообращения. Главным источником отложений холестерина является присутствие в крови частиц липопротеина низкой плотности (LDL). Существует прямая взаимосвязь между концентрацией липопротеина низкой плотности и образованием бляшек в артериях. Содержание липопротеина низкой плотности регулируется в значительной степени активными рецепторами LDL на поверхности клеток, которые связывают частицы липопротеина низкой плотности и переносят их из крови внутрь клеток. Поэтому важное значение в лечебном процессе имеет регуляция экспрессии рецепторов LDL. Нарушения, связанные с уровнем липопротеина, именуются гиперлипопротеинемией и определяются как повышенное содержание липопротеина. Гиперлипопротеинемия ведет к повышению уровней холестерина, триглицеридов или того и другого вместе и имеет клинически важное значение, так как она способствует возникновению атеросклероза и панкреатита. Липопротеины - это сферические макромолекулярные комплексы, состоящие из липида и белка. Липидные компоненты липопротеинов представляют собой этерифицированный и неэтерифицированный (свободный) холестерин,триглицериды и фосфолипиды. Липопротеины переносят холестерин и триглицериды из сайтов поглощения и синтеза в сайты потребления. Холестериновый эфир и триглицериды являются неполярными веществами и в разных пропорциях входят в состав гидрофобного ядра липопротеинов. Поверхностная оболочка липопротеинов содержит полярные компоненты: свободный холестерин, фосфолипиды и апопротеины, которые позволяют этим частицам смешиваться в плазме. Холестерин используется для синтеза желчных кислот в печени, для создания и репарации клеточных мембран и для синтеза стероидных гормонов. Существуют как экзогенные,так и эндогенные источники холестерина. Средний американец потребляет около 450 мг холестерина в день и еще 500-1000 мг холестерина образуется у него в печени и других тканях. Кроме того, в кишечник ежедневно выделяется 500-1000 мг желчного холестерина и около 50% холестерина вновь поглощается (печеночное 2 кровообращение). Эндогенный синтез холестерина регулируется таким ферментом, как редуктаза 3-гидрокси-3-метилглутарил-кофермента A(HMG-CoA). Триглицериды, которые являются неполярными липидами, состоящими из глицеринового остова и трех жирных кислот разной длины и степени насыщенности, накапливаются в жировой ткани и расходуются на выработку энергии. Липопротеины классифицированы по группам на основании размера, плотности, электрофоретической подвижности и по составу липида и белка. Липопротеины очень низкой плотности (VLDL) являются большими липопротеинами с высоким содержанием триглицеридов, которые синтезируются и выделяются гапатоцитами. Липопротеины очень низкой плотности взаимодействуют с липазой липопротеинов в капиллярном эндотелии, при этом триглицериды ядра гидролизуются с образованием жирных кислот, которые поступают в жировую и мышечную ткань. Примерно половина частиц диссимилированных липопротеинов очень низкой плотности поглощается печеночными рецепторами липопротеинов низкой плотности, а другая половина остается в плазме и превращается в липопротеины средней плотности (IDL). Липопротеины средней плотности характеризуются более высоким содержанием холестеринового эфира по сравнению с триглицеридом и под действием печеночной липазы триглицерида постепенно превращаются в более плотные липопротеины низкой плотности меньшего размера с более высоким содержанием холестерина. По мере превращения липопротеина средней плотности в липопротеин низкой плотности происходит отщепление аполипопротеина Е, в результате чего остается только один аполипопротеин, аро В-100. Липопротеин низкой плотности обычно переносит около 75% циркулирующего холестерина. Поглощение клетками липопротеина низкой плотности опосредовано молекулами рецепторов гликопротеина, которые связываются с аро В-100. Примерно 70% липопротеина низкой плотности выводится в результате поглощения рецепторами, а остальная часть удаляется клетками-утилизаторами посредством безрецепторных механизмов. Рецепторы липопротеина низкой плотности увеличивают толщину плазматической мембраны клетки и скапливаются в специальных областях, где клеточная мембрана имеет насечки, образующие углубления, именуемые окаймленными ямками. Эти ямки инвагинируют с образованием окаймленных пузырьков, где липопротеин низкой плотности отделяется от рецептора и направляется в лизосому с тем, чтобы пищеварительные ферменты могли выделить холестериновый эфир и расщепить эфирную связь с образованием свободного холестерина. Затем рецептор возвращается к поверхности клетки. 3 По мере того как свободный холестерин,высвобождающийся из липопротеина низкой плотности, накапливается в клетках, происходят три важных процесса обмена веществ. Вопервых, снижается синтез редуктазы HMG-CoA,а именно фермента, который регулирует уровень синтеза клеткой холестерина de novo. Вовторых, активируется такой фермент, как ацилхолестеринацилтрансфераза (АСАТ), который этерифицирует свободный холестерин с образованием холестеринового эфира, в виде которого холестерин хранится в клетках. В-третьих, накопление холестерина подавляет синтез клеткой новых рецепторов липопротеина низкой плотности. Этот механизм обратной связи сокращает поглощение клеткой липопротеина низкой плотности из кровотока. Липопротеины играют важную роль в атерогенезе. Подобная связь с наиболее распространенной причиной смертности в развитых странах определяет клиническую значимость гиперлипопротеинемии. Субъекты с повышенным уровнем холестерина подвергаются гораздо большему риску заболеть атеросклерозом. Многочисленные наблюдения, в том числе эпидемиологические исследования, аутопсия, исследования на животных и клинические исследования, показывают, что липопротеин низкой плотности имеет атерогенный характер и что чем выше уровень липопротеина низкой плотности, тем больше риск заболевания атеросклерозом и тем чаще эта болезнь диагностируется в клинических условиях. Повышенный уровень липопротеина, по-видимому, является обязательным условием развития атеросклероза, хотя на этот процесс влияет множество других факторов (например, кровяное давление, курение,уровень глюкозы в крови, содержание антиоксиданта и факторы свертывающей системы крови). Острый панкреатит является еще одним важным клиническим симптомом дислипопротеинемии. Он связан с хиломикронемией и повышенными уровнями липопротеина очень низкой плотности. У большинства субъектов, страдающих острым панкреатитом, уровни триглицерида превышают 2000 мг/дл, но в 1983 г. на конференции Национального института здравоохранения было рекомендовано начинать профилактическое лечение гипертриглицеридемии,когда содержание триглицеридов превышает 500 мг/дл. До сих пор неизвестен механизм, в соответствии с которым хиломикронемия и повышенный уровень липопротеина очень низкой плотности вызывают панкреатит. Липаза поджелудочной железы может воздействовать на триглицерид в ее капиллярах, в результате чего образуются токсичные жирные кислоты, вызывающие воспалительный процесс. Многочисленные данные показывают, что лечение гиперлипопротеинемии уменьшает вероятность или предотвращает возникновение атеросклеротических осложнений. Помимо дие 001367 4 ты, которая позволяет поддерживать нормальную массу тела и сократить до минимума содержание липидов в плазме, важное клиническое значение имеют лекарственные средства,снижающие уровни липопротеинов в плазме благодаря меньшему образованию липопротеинов или более эффективному их удалению из плазмы. Наиболее перспективные лекарственные средства, применяемые в настоящее время для лечения гиперлипопротеинемии или гиперхолестеринемии, ингибируют редуктазу HMGCoA, которая представляет собой фермент, регулирующий эндогенный синтез холестерина. Лекарственные средства этого класса эффективно ингибируют активность этого фермента. В конечном счете, это ведет к сокращению эндогенного синтеза холестерина и к нормализации гомеостатических механизмов. Холестерин плазмы поглощается рецепторами липопротеина низкой плотности с целью восстановления внутриклеточного баланса холестерина. Благодаря высвобождению предшественников липопротеина низкой плотности и опосредованному рецепторами поглощения LDL из сыворотки клетки печени играют важную роль в сохранении гомеостаза холестерина в сыворотке. Как у людей, так и у животных, повидимому, существует обратная зависимость между печеночными рецепторами LDL и уровнями холестерина в сыворотке, определяемыми липопротеинами низкой плотности. Как правило, большее количество гепатоцитных рецепторов ведет к более низким уровням холестерина в сыворотке, определяемым липопротеинами низкой плотности. Холестерин, перенесенный в гепатоциты, может храниться там в виде холестериновых эфиров, может быть превращен в желчные кислоты и выведен в желчные протоки или введен в оксихолестериновый пул. Считается, что именно этот оксихолестериновый пул имеет отношение к репрессии генов рецепторов липопротеина низкой плотности и ферментов,определяющих синтез холестерина. Известно, что транскрипция гена рецептора липопротеина низкой плотности подавляется,когда клетки имеют избыток холестерина, скорее всего в форме оксихолестерина. Последовательность ДНК в промоторной области рецептора липопротеина низкой плотности, известная как чувствительный к стеролу элемент (SRE),по-видимому, стимулирует репрессию стерола. Этот элемент всесторонне исследован (Brown,Goldstein and Russell, патенты США 4745060 и 4935363). SRE можно вставить в гены, которые обычно не чувствительны к холестерину,благодаря чему они приобретают способность подавлять стерол химерного гена. Точный механизм репрессии неизвестен. Браун и Голдстейн описали методы использования SRE для определения лекарственных средств, способных стимулировать в клетках синтез рецепторов ли 5 попротеина низкой плотности (патент США 4935363). Весьма желательно позитивно регулировать синтез рецепторов липопротеина низкой плотности на уровне экспрессии гена. Позитивная регуляция синтеза рецепторов липопротеина низкой плотности на этом уровне предоставляет многообещающую возможность снизить содержание холестерина в сыворотке до более приемлемого уровня. Однако в настоящее время нет лекарственных средств, снижающих содержание холестерина, которые бы действовали на уровне экспрессии гена. В настоящем изобретении описываются методы и соединения, которые прямо или косвенно ингибируют репрессию гена рецептора липопротеина низкой плотности,что вызывает индукцию рецепторов липопротеина низкой плотности на поверхности печеночных клеток, облегчает поглощение липопротеина низкой плотности, синтез желчных кислот и секрецию с целью удаления метаболитов холестерина и, следовательно, вызывает снижение уровней холестерина в сыворотке, определяемых липопротеинами низкой плотности. Таким образом, одним объектом настоящего изобретения являются соединения, которые прямо или косвенно позитивно регулируют синтез рецепторов липопротеина низкой плотности на уровне экспрессии гена и позволяют эффективно лечить гиперхолестеринемию или гиперлипопротеинемию. Другим объектом настоящего изобретения являются лекарственные композиции, предназначенные для лечения указанных заболеваний. Другим объектом данного изобретения являются лекарственные композиции, предназначенные для лечения панкреатита. Еще одним объектом данного изобретения являются методы позитивной регуляции синтеза рецепторов липопротеина низкой плотности с целью снижения уровней холестерина LDL в сыворотке и предотвращения атеросклероза. Все другие объекты, отличительные особенности и преимущества данного изобретения станут очевидными для специалистов в этой области из приводимого ниже описания изобретения и формулы изобретения. Краткое изложение существа изобретения Настоящее изобретение относится к композициям, содержащим новые производные пентафторбензолсульфонамида и их аналоги, а также к способам их получения и применения в качестве фармацевтически активных средств. Эти композиции являются эффективными фармацевтическими средствами для лечения таких заболеваний, как гиперхолестеринемия и атеросклероз, или основными ингредиентами для получения таких средств. В соответствии с одним вариантом осуществления данное изобретение предусматривает фармацевтическое использование соединений общей формулы I и фармацевтически приемле 001367 6 мые композиции, содержащие соединения формулы I или их физиологически приемлемые соли,где Y является -S(O)- или -S(O)2-;Z является -NR1R2,где R1 выбирают из группы, включающей водород, замещенный или незамещенный (C1 С 10)алкил, замещенный или незамещенный (C3 С 6)алкенил, замещенный или незамещенный(C2-С 6)гетероалкил, и замещенный или незамещенный (C3-С 8)циклоалкил, иR2 выбирают из группы, включающей замещенный или незамещенный арил и замещенный или незамещенный гетероарил,при этом R1 и R2 могут быть соединены связующей группой Е с получением заместителя формулы где Е обозначает связь, (C1-С 4)алкилен или (C1 С 4)гетероалкилен и кольцо, образованное R1, Е,R2 и атомом азота, имеет не более 8 атомов. Заместители для алкильных, алкенильных,гетероалкильных, циклоалкильных радикалов выбирают независимо друг от друга из группы,включающей -Н, -ОН, -O-(C1-С 10)алкил, =O,-NH2, NH-(C1-С 10)алкил, -N[(C1-С 10)алкил]2,-SH,-S-(C1-С 10)алкил,галоген,-Si[(C1 С 10)алкил]3, в количестве от нуля до (2N+1), гдеN означает общее число атомов углерода в таком радикале. Заместители для арильных и гетероарильных групп выбирают независимо друг от друга из группы, включающей галоген, -ОН, -O-R', -OC(O)-R', -NH2, -NHR', -NR'R", -SH, -SR', -R',-CN, -NO2, -CO2H, -CO2-R', -CONH2, -CONH-R',-CONR'R", -O-C(O)-NH-R', -O-C(O)-NR'R", -NHC(O)-R', -NR"-C(O)-R', -NH-C(O)-OR', -NR"C(O)-R, -NH-C(NH2)=NH, -NR'-C(NH2)=NH,-NH-C(NH2)=NR', -S(O)-R', -S(O)2-R', -S(O)2-NHR', -S(O)2-NR'R", -N3, -CH(Ph)2, замещенный или незамещенный арилокси, замещенный или незамещенный ариламино, замещенный или незамещенный гетероариламино, замещенный или незамещeнный гетероарилокси, замещенный или незамещенный арил(C1-С 4)алкокси, замещенный или незамещенный гетероарил(C1 С 4)алкокси, перфтор(C1-С 4)алкокси и перфтор(C1-С 4)алкил, в количестве от нуля до общего числа открытых валентностей в ароматической кольцевой системе; и где R и R" независимо друг от друга выбирают из группы, включающей замещенный или незамещенный (C1-С 10)алкил, замещенный или незамещенный (C1-С 10)гетероалкил, заме 7 щенный или незамещенный (C2-С 6)алкенил,замещенный или незамещенный(C2-С 6)алкинил, замещенный или незамещенный (C3-С 8)циклоалкил, замещенный или незамещенный (C3-С 8)гетероциклоалкил, замещенный или незамещенный (C5-С 6)циклоалкенил,замещенный или незамещенный(C5 С 6)циклоалкадиенил, замещенный или незамещенный арил,замещенный или незамещенный арил(C1 С 4)алкил, замещенный или незамещенный арил(C1-С 4)гетероалкил, замещенный или незамещенный арил(C2-С 6)алкенил, замещенный или незамещенный арилокси(C1-С 4)алкил, замещенный или незамещенный арилокси(C1 С 4)гетероалкил, замещенный или незамещенный гетероарил, замещенный или незамещенный гетероарил(C1-С 4)алкил, замещенный или незамещенный гетероарил(C1-С 4)гетероалкил,замещенный или незамещенный гетероарил(C2 С 6)алкенил, замещенный или незамещенный гетероарилокси(C1-С 4)алкил и замещенный или незамещенный гетероарилокси(C1-С 4)гетероалкил. Два заместителя у смежных атомов арильного или гетероарильного кольца могут быть заменены заместителем формулы -Т-С(О)(CH2)n-U-, где Т и U независимо друг от друга выбирают из N, О и С и n=0-2. Альтернативно два заместителя у смежных атомов арильного или гетероарильного кольца могут быть заменены заместителем формулы -А-(СН 2)р-В-, где А и В независимо друг от друга выбирают из С, О,N, S, SO, SO2 и SO2NR' и р=1-3. Одну простую связь нового кольца, полученного таким образом, можно заменить двойной связью. Альтернативно два заместителя у смежных атомов арильного или гетероарильного кольца можно заменить заместителем формулы -(CH2)q-X(СН 2)r-, где q и r независимо друг от друга равны 1-3 и Х выбирают из О, N, S, SO, SO2 иSO2NR'. Заместитель R' в SO2NR' выбирают из водорода или (C1-С 6)алкила. В соответствии с другим вариантом осуществления данное изобретение предусматривает новые методы использования фармацевтических композиций, содержащих соединения общей формулы I, для лечения таких патологий,как гиперхолестеринемия, атеросклероз, панкреатит и гиперлипопротеинемия, которые заключаются в том, что нуждающемуся субъекту вводят эффективное количество одной или нескольких указанных композиций. В соответствии с другим вариантом осуществления данное изобретение предусматривает химически устойчивые, фармацевтически активные соединения общей формулы I или их фармацевтически приемлемые соли,где Y является -S(O)- или -S(O2)-; иZ является -NR1R2,где R2 обозначает необязательно замещенную фенильную группу, и R1 выбирают из группы,включающей водород, замещенный или незамещенный (C1-С 10)алкил, замещенный или незамещенный (C3-С 6)алкенил, замещенный или незамещенный (C2-С 6)гетероалкил, замещенный или незамещенный (C3-С 6)гетероалкенил, замещенный или незамещенный (C3-С 8)циклоалкил,замещенный или незамещенный(C5 С 7)циклоалкенил; заместители фенила, если они имеются,выбирают из группы, включающей алкил, гидрокси, алкокси, амино, необязательно замещенный одним или двумя алкилами, необязательно замещенный ариламино, необязательно замещенный гетероариламино, необязательно замещенный фенокси и галоген; при этом R1 и R2 могут быть соединены связующей группой Е с получением заместителя формулы где Е обозначает связь, (C1-С 4)алкилен или (C1 С 4)гетероалкилен и кольцо, образованное R1, Е,R2 и атомом азота, имеет не более 8 атомов,при условии, что когда Y является -S(О 2)- и R1 обозначает водород или метил, тогда R2 является замещенной фенильной или гетероарильной группой; когда Y является -S(О 2)-, R2 обозначает фенил и R1 обозначает пропиленовое звено,присоединяющее атом азота группы -NR1R2 в 2 положении фенильного кольца относительно сульфонамидогруппы с образованием 1,2,3,4 тетрагидрохинолиновой системы, одна или несколько оставшихся валентностей в полученной таким образом бициклической системе замещены, по крайней мере, одним заместителем, который не является водородом; когда Y является -S(O2)- и R2 обозначает фенил, замещенный 3-(1-гидроксиэтилом), 3 диметиламино, 4-диметиламино, 4-фенилом, 3 гидрокси, 3-гидрокси-4-диэтиламинометилом,3,4-метилендиокси, 3,4-этилендиокси, 2-(1 пирролилом), или 2-метокси-4-(1-морфолино),тогда R1 не является водородом или, когда R1 является водородом, одна или несколько оставшихся валентностей в фенильном кольце R2 замещены заместителем, который не является водородом. Подробное описание изобретения 9 Термин "алкил", используемый отдельно или как часть другого заместителя, означает, за исключением особо оговоренных случаев, углеводородный радикал с прямой или разветвленной цепью, в том числе двухвалентный и многовалентный радикал, имеющий указанное число атомов углерода (то есть C1-С 10 означает от одного до десяти атомов углерода), и включает группы с прямой или разветвленной цепью, такие как метил, этил, н-пропил, изопропил, нбутил, трет-бутил, изобутил, втор-бутил, гомологи и изомеры н-пентила, н-гексила, 2 метилпентила, 1,5-диметилгексила, 1-метил-4 изопропилгексила и тому подобные. Термин"алкилен", используемый отдельно или как часть другого заместителя, означает двухвалентный радикал, полученный из алкана, например, -CH2CH2CH2CH2-. "Низший алкил" является алкилом с более короткой цепью, который обычно имеет шесть или меньше атомов углерода. Термин "гетероалкил", используемый отдельно или в сочетании с другим термином,означает, за исключением особо оговоренных случаев, устойчивый радикал с прямой или разветвленной цепью, который имеет указанное число атомов углерода и один или два гетероатома, выбираемых из группы, включающей О, N и S, и в котором атомы азота и серы могут быть окислены и гетероатом азота может быть кватернизован. Гетероатом(ы) может находиться в любом положении гетероалкильной группы, в том числе между концом гетероалкильной группы и фрагментом, к которому он присоединен. Кроме того, он может быть присоединен к наиболее удаленному атому углерода в гетероалкильной группе. Примерами таких радикалов являются -O-СН 2-СН 2-СН 3,-СН 2-СН 2-O-СН 3, -СН 2-СН 2-СН 2-ОН, -СН 2-СН 2NH-СН 3, -СН 2-СН 2-N(CH3)-CH3, -СН 2-S-СН 2 СН 3, -СН 2-СН 2-S(О)-СН 3, -O-СН 2-СН 2-СН 2-NHCH3 и -СН 2-СН 2-S(О)2-СН 3. Последовательно можно расположить до двух гетероатомов, например, -CH2-NH-OCH3. Термин "гетероалкилен", используемый отдельно или как часть другого заместителя, означает двухвалентный радикал, полученный из гетероалкила, например,-СН 2-СН 2-S-СН 2-СН 2- и -CH2-S-СН 2-СН 2-NH-. Термины "циклоалкил" и "гетероциклоалкил", используемые отдельно или в сочетании с другими терминами, означают соответственно,за исключением особо оговоренных случаев,циклические варианты "алкила" и "гетероалкила". Примерами циклоалкила являются циклопентил, циклогексил, циклогептил и тому подобные. Примерами гетероциклоалкила являются 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил, 1-пиперазинил, 2-пиперазинил и тому подобные. 10 Термин "алкенил", используемый отдельно или в сочетании с другими терминами, означает, за исключением особо оговоренных случаев,устойчивую мононенасыщенную или диненасыщенную углеводородную группу, с прямой или разветвленной цепью, имеющую указанное число атомов углерода. Примерами таких групп являются винил, пропенил(аллил), кротил, изопентенил, бутадиенил, 1,3-пентадиенил, 1,4 пентадиенил и высшие гомологи и изомеры. Примером двухвалентного радикала, полученного из алкена, является -СН=СН-СН 2-. Термин "гетероалкенил", используемый отдельно или в сочетании с другим термином,означает, за исключением особо оговоренных случаев, устойчивый мононенасыщенный или диненасыщенный углеводородный радикал с прямой или разветвленной цепью, который имеет указанное число атомов углерода и один или два гетероатома, выбираемых из группы, включающей О, N и S, и в котором атомы азота и серы могут быть окислены и гетероатом азота может быть кватернизован. Последовательно можно расположить до двух гетероатомов. Примерами таких радикалов являются -СН=СНО-СН 2-, -СН=СН-СН 2-О-, -СН 2-СН=N-ОСН 3-,-CH=CH-N(СН 3)-СН 2 и -CH2-CH=CH-CH2-SH. Термин "алкинил", используемый отдельно или в сочетании с другими терминами, означает, за исключением особо оговоренных случаев, устойчивую углеводородную группу с прямой или разветвленной цепью, которая имеет указанное число атомов углерода и одну или две тройные углерод-углеродные связи, в частности, этинил, 1- и 3-пропинил, 4-бут-1-инил и высшие гомологи и изомеры. Термин "алкокси", используемый отдельно или в сочетании с другими терминами, означает, за исключением особо оговоренных случаев,указанную выше алкильную группу, присоединенную к остальной части молекулы с помощью атома кислорода, например, метокси, этокси, 1 пропокси, 2-пропокси, изопропокси и высшие гомологи и изомеры. Термин "галоген", используемый отдельно или как часть другого заместителя, означает, за исключением особо оговоренных случаев, атом фтора, хлора, брома или иода. Термин "арил", используемый отдельно или в сочетании с другими терминами, означает, за исключением особо оговоренных случаев,фенильную, 1-нафтильную или 2-нафтильную группу. Максимальное число заместителей, допускаемых в одной из этих кольцевых систем,соответственно составляет пять, семь и семь. Заместители выбирают из группы перечисленных выше приемлемых заместителей. Термин "гетероарил", используемый отдельно или как часть другого заместителя, означает, за исключением особо оговоренных случаев, незамещенную или замещенную, устойчивую моно- или бициклическую гетероцикличе 11 скую ароматическую кольцевую систему, которая состоит из атомов углерода и одногочетырех гетероатомов, выбираемых из группы,включающей N, О и S, и в которой гетероатомы азота и серы могут быть окислены и атом азота может быть кватернизован. Гетероциклическая система может быть присоединена,за исключением особо оговоренных случаев, к любому гетероатому или атому углерода, который обеспечивает устойчивую структуру. Гетероциклическая система может быть замещена или не замещена одним-четырьмя заместителями, которые независимо друг от друга выбирают из приведенного выше перечня приемлемых ароматических заместителей. Примерами таких гетероциклов являются 2-пирролил, 3-пирролил,3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 5-оксазолил,3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2 тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3 фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3 пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил,5-бензотиазолил,пуринил,2 бензимидазолил, 5-индолил, 1-изохинолинил, 5 изохинолил, 2-зиноксалинил, 5-хиноксалинил,3-хинолинил и 6-хинолинил. Фармацевтически приемлемыми солями соединений формулы I являются соли этих соединений с относительно нетоксичными кислотами или основаниями в зависимости от заместителей, входящих в состав конкретных соединений формулы I. Когда соединения формулы I имеют относительно кислотные функциональные группы, можно получить соли присоединения основания в результате взаимодействия нейтральной формы соединения I с достаточным количеством требуемого основания без растворителя или в приемлемом инертном растворителе. Примерами фармацевтически приемлемых солей присоединения основания являются соли натрия, калия, кальция, аммония, органического аминосоединения, магния или подобные соли. Когда соединения формулы I имеют относительно основные функциональные группы, можно получить соли присоединения кислоты в результате взаимодействия нейтральной формы соединения I с достаточным количеством требуемой кислоты без растворителя или в приемлемом инертном растворителе. Примерами фармацевтически приемлемых солей присоединения кислоты являются соли, получаемые из неорганических кислот, таких как хлористоводородная, бромисто-водородная, азотная, угольная, моноугольноводородная, фосфорная, монофосфорноводородная, дифосфорноводородная, серная, моносероводородная,иодоводородная или фосфористая кислоты и тому подобные, а также соли, полученные из относительно нетоксичных органических кислот, таких как уксусная, пропионовая, изомасляная, щавелевая, малеиновая, малоновая, бензойная, янтарная, субериновая, фумаровая, мин 001367 12 дальная, фталевая, бензолсульфоновая, паратолуолсульфоновая, лимонная, винная, метансульфоновая кислоты и тому подобные. В объем настоящего изобретения входят также соли аминокислот, такие как аргинат и тому подобные, и соли органических кислот, таких как глюконовая или галактуроновая кислоты и тому подобные (см., например, Berge, S.M., et. Al.,"Pharmaceutical Salts", Journal of PharmaceuticalScience, т. 66, стр. 1-19 (1977. Некоторые соединения формулы I содержат как основные,так и кислотные функциональные группы, которые позволяют превращать эти соединения в соли присоединения основания или кислоты. Форму свободного основания можно восстановить в результате взаимодействия соли с основанием или кислотой и выделения исходного соединения обычным способом. Исходная форма данного соединения отличается от разных солей определенными физическими свойствами, такими как растворимость в полярных растворителях, но во всех других отношениях эти соли аналогичны исходному соединению с точки зрения целей настоящего изобретения. Некоторые соединения по настоящему изобретению могут существовать в несольватированных и сольватированных формах, в том числе в гидратированных формах. Как правило,сольватированные формы аналогичны несольватированным формам и входят в объем настоящего изобретения. Некоторые соединения по настоящему изобретению имеют асимметричные атомы углерода (оптические центры); поэтому рацематы,диастереомеры и отдельные изомеры входят в объем настоящего изобретения. Соединения по настоящему изобретению могут также содержать в одном или нескольких атомах не встречающееся в природе количество изотопов. Например, эти соединения можно метить радиоактивными изотопами, например,тритием (3H) или углеродом-14 (14 С). В объем настоящего изобретения входят все изотопные варианты соединений по настоящему изобретению независимо от того, являются они радиоактивными или нет. В предпочтительных соединениях формулы I, входящих в фармацевтические композиции, Y является S(О 2) и Z является NR1R2, гдеR1 обозначает водород или метил и R2 обозначает замещенный фенил, предпочтительно моно-,ди- или трехзамещенный. В одной группе предпочтительных соединений Y является S(O2) и Z является NR1R2, где R1 обозначает водород или метил и R2 обозначает фенильную группу,предпочтительно замещенную в параположении одной из следующих групп, в частности, гидрокси, амино, (С 1-С 10)алкокси, (C1-С 10)алкил, (С 1 С 10)алкиламино и [ди(С 1-С 10)алкил]амино, дополнительными заместителями в количестве до четырех, которые независимо друг от друга выбирают из водорода, галогена, (C1-С 10)алкокси, 13(С 1-С 10)алкила и [ди(С 1-С 10)алкил]амино. Кроме того, предпочтение отдается соединениям формулы I, в которой отсутствует связующая группа Е между R1 и R2. Фармацевтические композиции и соединения по настоящему изобретению можно проиллюстрировать приводимыми ниже примерами: 3-фтор-4-метокси-1-пентафторфенилсульфинамидобензол; 4-диметиламино-1-пентафторфенилсульфинамидобензол; 4-метил-6-метокси-2-пентафторфенилсульфонамидопиримидин; 4,6-диметокси-2-пентафторфенилсульфонамидопиримидин; 2-пентафторфенилсульфонамидотиофен; 3-пентафторфенилсульфонамидотиофен; 3-пентафторфенилсульфонамидопиридин; 4-пентафторфенилсульфонамидопиридин; 4-(N,N-диметиламино)-1-(N-этилпентафторфенилсульфонамидо)бензол; 4-трет-бутокси-1-пентафторфенилсульфонамидобензол; 3-трет-бутокси-1-пентафторфенилсульфонамидобензол; 2-трет-бутокси-1 пентафторфенилсульфонамидобензол; 4-изопропокси-1-пентафторфенилсульфонамидобензол; 3-изопропокси-1-пентафторфенилсульфонамидобензол; 2-изопропокси-1-пентафторфенилсульфонамидобензол; 2-метокси-1,3-дифтор-5-пентафторфенилсульфонамидобензол; 4-циклопропокси-1-пентафторфенилсульфонамидобензол; 3-фтор-4-циклопропокси-1-пентафторфенилсульфонамидобензол; 3-гидрокси-4-циклопропокси-1-пентафторфенилсульфонамидобензол; 1-гидрокси-2,3-метилендиокси-5-пентафторфенилсульфонамидобензол; 1-гидрокси-2,3-этилендиокси-5-пентафторфенилсульфонамидобензол; 1-гидрокси-2,3-карбодиокси-5-пентафторфенилсульфонамидобензол; 1,3-дигидрокси-2-этокси-5-пентафторфенилсульфонамидобензол; 1-пентафторфенилсульфонилиндол; 1-пентафторфенилсульфонил(2,3-дигидро) индол; 1-пентафторфенилсульфонил(1,2-дигидро) хинолин; 1-пентафторфенилсульфонил(1,2,3,4 тетрагидро)хинолин; 3,4-дифтор-1-пентафторфенилсульфонамидобензол; 4-трифторметокси-1-пентафторфенилсульфонамидобензол; 15 4-(1-метил)этокси-1-пентафторфенилсульфонамидобензол; 1,2-метилендиокси-4-пентафторфенилсульфонамидобензол; 1,2-диметокси-4-пентафторфенилсульфонамидобензол; 4-(N,N-диэтиламино)-1-пентафторфенилсульфонамидобензол; 4-амино-1-пентафторфенилсульфонамидобензол; пентафторфенилсульфонамидобензол; 5-пентафторфенилсульфонамидоиндазол; 4-(N,N-диметиламино)-1-(N-метилпентафторфенилсульфонамидо)бензол; 1,2-дигидрокси-4-пентафторфенилсульфонамидобензол; 3,5-диметокси-1-пентафторфенилсульфонамидобензол; 3-этокси-1-пентафторфенилсульфонамидобензол; 7-гидрокси-2-пентафторфенилсульфонамидонафталин; 3-фенокси-1-пентафторфенилсульфонамидобензол; 4-(1-морфолино)-1-пентафторфенилсульфонамидобензол; 5-пентафторфенилсульфонамидо-1,2,3 триметоксибензол; 2-гидрокси-1,3-метокси-5-пентафторфенилсульфонамидобензол; 1,2-дигидрокси-3-метокси-5-пентафторфенилсульфонамидобензол; 5-пентафторфенилсульфонамидо-1,2,3 тригидроксибензол; 3-гидрокси-5-метокси-1-пентафторфенилсульфонамидобензол; 3,5-дигидрокси-1-пентафторфенилсульфонамидобензол; 2-фтор-1-метокси-4-(N-метилпентафторфенилсульфонамидо)бензол; 4-(N,N-диметиламино)-1-пентафторфенилсульфонамидобензолгидрохлорид; 2-метокси-5-пентафторфенилсульфонамидопиридин; 2-анилино-3-пентафторфенилсульфонамидопиридин. Примерами наиболее предпочтительных фармацевтических композиций и соединений по настоящему изобретению являются: 4-(N,N-диметиламино)-1-пентафторфенилсульфонамидобензол; 3-(N,N-диметиламино)-1-пентафторфенилсульфонамидобензол; 1,2-этилендиокси-4-пентафторфенилсульфонамидобензол; 2-гидрокси-1-метокси-4-пентафторфенилсульфонамидобензол; 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензол; натриевая соль 2-гидрокси-1-метокси-4 пентафторфенилсульфонамидобензола; 16 калиевая соль 2-гидрокси-1-метокси-4 пентафторфенилсульфонамидобензола; натриевая соль 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензола; калиевая соль 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензола; 4-метокси-1-пентафторфенилсульфонамидобензол; 3-гидрокси-1-пентафторфенилсульфонамидобензол; 4-гидрокси-1-пентафторфенилсульфонамидобензол; 1,2-диметил-4-пентафторфенилсульфонамидобензол; 5-пентафторфенилсульфонамидоиндол; 4-этокси-1-пентафторфенилсульфонамидобензол; 3-метокси-1-пентафторфенилсульфонамидобензол; 2-бром-1-метокси-4-пентафторфенилсульфонамидобензол; 2-хлор-1-метокси-4-пентафторфенилсульфонамидобензол; 2-бром-3-гидрокси-4-метокси-1-пентафторфенилсульфонамидобензол; 2-бром-4-метокси-5-гидрокси-1-пентафторфенилсульфонамидобензол; 1-бром-4-фтор-5-метокси-2-пентафторфенилсульфонамидобензол; 4-хлор-1-пентафторфенилсульфонамидобензол; 3-амино-4-метокси-1-пентафторфенилсульфонамидобензол. Данное изобретение предусматривает новые соединения общей формулы I, которые обладают одним или несколькими полезными биологическими действиями, в частности, фармакологическим, токсикологическим, метаболическим и другими. Типичными соединениями по этому варианту осуществления изобретения являются: 2-фтор-1-метокси-4-пентафторфенилсульфинамидобензол; 4-диметиламино-1-пентафторфенилсульфинамидобензол; 4-метил-6-метокси-2-пентафторфенилсульфонамидопиримидин; 4,6-диметокси-2-пентафторфенилсульфонамидопиримидин; 2-пентафторфенилсульфонамидотиофен; 3-пентафторфенилсульфонамидотиофен; 3-пентафторфенилсульфонамидопиридин; 4-пентафторфенилсульфонамидопиридин; 4-(N,N-диметиламино)-1-(N-этилпентафторфенилсульфонамидо)бензол; 4-трет-бутокси-1 пентафторфенилсульфонамидобензол; 3-трет-бутокси-1 пентафторфенилсульфонамидобензол; 19 2,3-дигидро-5-пентафторфенилсульфонамидоиндол; 5-пентафторфенилсульфонамидобензо[а] тиофен; 5-пентафторфенилсульфонамидобензо[а] фуран; 3-гидрокси-4-(1-пропенил)-1-пентафторфенилсульфонамидобензол; 3-гидрокси-5-метокси-1-пентафторфенилсульфонамидобензол; 3,5-дигидрокси-1-пентафторфенилсульфонамидобензол; 2-фтор-1-метокси-4-(N-метилпентафторфенилсульфонамидо)бензол; 4-(N,N-диметиламино)-1-пентафторфенилсульфонамидобензолгидрохлорид и 2-анилино-3-пентафторфенилсульфонамидопиридин. Предпочтительные соединения по этому варианту осуществления изобретения обладают специфическими фармакологическими свойствами. Примерами наиболее предпочтительных соединений по этому варианту осуществления изобретения являются: 4-(N,N-диметиламино)-1-пентафторфенилсульфонамидобензол; 3-(N,N-диметиламино)-1-пентафторфенилсульфонамидобензол; 1,2-этилендиокси-4-пентафторфенилсульфонамидобензол; 2-гидрокси-1-метокси-4-пентафторфенилсульфонамидобензол; 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензол; натриевая соль 2-гидрокси-1-метокси-4 пентафторфенилсульфонамидобензола; калиевая соль 2-гидрокси-1-метокси-4 пентафторфенилсульфонамидобензола; натриевая соль 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензола; калиевая соль 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензола; 4-метокси-1-пентафторфенилсульфонамидобензол; 3-гидрокси-1-пентафторфенилсульфонамидобензол; 4-гидрокси-1-пентафторфенилсульфонамидобензол; 1,2-диметил-4-пентафторфенилсульфонамидобензол; 5-пентафторфенилсульфонамидоиндол; 4-этокси-1-пентафторфенилсульфонамидобензол; 3-метокси-1-пентафторфенилсульфонамидобензол; 2-бром-1-метокси-4-пентафторфенилсульфонамидобензол; 2-хлор-1-метокси-4-пентафторфенилсульфонамидобензол; 2-бром-3-гидрокси-4-метокси-1-пентафторфенилсульфонамидобензол; х = 1-3 Это изобретение относится к способам получения соединений и композиций по данному изобретению. В соответствии с одним общим вариантом осуществления изобретения пентафторфенилсульфонилхлорид смешивают с амином общей формулы R1R2NH в условиях, при которых пентафторфенилсульфонилхлорид и амин взаимодействуют друг с другом с образованием целевого соединения, которое затем выделяют из реакционной смеси. Соединения общей формулы 1 или 3 (схема I) можно получить в результате взаимодей 21 ствия соответствующего исходного амина в растворителе, таком как тетрагидрофуран (ТГФ),диметилформамид (ДМФ), простой эфир,толуол или бензол, в присутствии основания,такого как пиридин, парадиметиламинопиридин, триэтиламин, карбонат натрия или карбонат калия, соответственно с пентафторфенилсульфонил-хлоридом или пентафторфенилсульфинилхлоридом. В качестве растворителя можно также использовать пиридин. Предпочтительными растворителями являются пиридин и ДМФ, и предпочтительными основаниями являются пиридин, триэтиламин и карбонат калия. Эту реакцию можно осуществлять при температуре от 0 до 100 С, в частности, при комнатной температуре. Соединения общей формулы 1 можно также получить путем обработки исходного сульфонамида (схема II) основанием, таким какLDA, NaH, соль димсила, алкиллитий, карбонат калия, в инертной атмосфере, такой как аргон или азот, в растворителе, таком как бензол, толуол, ДМФ или ТГФ, алкилирующим агентом,имеющим отщепляемую группу, такую как Cl,Br, I, MsO-, TsO-, TFAO-, обозначенную Е на схеме II. Предпочтительным растворителем для осуществления этой реакции является ТГФ и предпочтительным основанием является бис(триметилсилил)амид лития. Эту реакцию можно осуществлять при температуре от 0 до 100 С, в частности, при комнатной температуре. Сульфоновые эфиры (2) и сульфиновые эфиры (4) можно получить в результате взаимодействия приемлемого исходного фенола в растворителе, таком как ТГФ, ДМФ, толуол или бензол, в присутствии основания, такого как пиридин, триэтиламин, карбонат натрия, карбонат калия или 4-диметиламинопиридин, соответственно с пентафторфенилсульфонилхлоридом или пентафторфенилсульфинилхлоридом. В качестве растворителя можно также использовать пиридин. Предпочтительными растворителями являются пиридин и ДМФ, и предпочтительными основаниями являются карбонат натрия и карбонат калия. Эту реакцию можно осуществлять при температуре от 0 до 100 С, в частности, при комнатной температуре. Соединения общей формулы 5, в которой Аr является ароматической группой и х обозначает целое число от одного до трех, можно получить из соответствующих метиловых эфиров(схема III) в результате взаимодействия с трехбромистым бором в растворителе с низкой полярностью, таком как гексаны или CH2Cl2, в инертной атмосфере при температуре от -45 до 30 С. В соответствии с предпочтительным вариантом эту реакцию осуществляют в CH2Cl2 при температуре около 30 С. Субстраты, используемые для превращений, показанных на схемах I-III, иногда могут содержать функциональные группы (например,амино, гидрокси или карбокси), которые не со 001367 22 вместимы с условиями данной реакции. В таких случаях эти группы можно защитить приемлемыми защитными группами, которые удаляют после выполнения превращения и получают первоначальные функциональные группы. Для этой цели можно использовать известные методы, описанные, например в работе T.W. GreeneSynthesis, Second Edition, John WileySons,Inc., 1991. Соединения, используемые в качестве исходных веществ в этом изобретении, можно приобрести коммерческим путем или легко синтезировать стандартными методами, которые хорошо известны специалистам в этой области. Некоторые соединения формулы I могут существовать в виде стереоизомеров, и в объем данного изобретения входят все активные стереоизомерные формы этих соединений. Оптически активные изомеры можно получить из соответствующих оптически активных предшественников, используя описанные выше методы,или путем разделения рацемических смесей с помощью разных методов, таких как хроматография, перекристаллизация полученных асимметричных солей или получение производных веществ, которые хорошо известны специалистам в этой области. Соединения формулы I, которые являются кислотными или основными по своей природе,могут образовывать разные соли при взаимодействии с разными неорганическими и органическими основаниями или кислотами. Эти соли должны быть фармацевтически приемлемы для введения млекопитающим. Соли кислотных соединений по данному изобретению легко получить путем обработки кислотного соединения необходимым молярным количеством неорганического или органического основания в водном или приемлемом органическом растворителе с последующим выпариванием растворителя. Соли присоединения кислоты основных соединений по данному изобретению можно получить аналогичным образом путем обработки соответствующей неорганической или органической кислотой, последующего выпаривания растворителя и выделения целевого соединения. Соединения по данному изобретению можно метить разными способами. Например,эти соединения можно получить в виде радиоактивных изотопов, например, трития и 14 Сизотопов. Эти соединения можно аналогичным образом присоединять, ковалентно или нековалентно, к целому ряду связанных соединений,которые являются пролекарствами или служат в качестве наполнителей, меток, адъювантов, коактиваторов, стабилизаторов и тому подобных веществ. Таким образом, к соединениям по настоящему изобретению относятся соединения,присоединенные с помощью прямой или непрямой связи (например, посредством связующей молекулы) к таким связанным соединениям. 23 Анализ Композиции по данному изобретению демонстрируют фармакологическую активность при выполнении анализов как in vitro, так и invivo. Например, они способны изменять физиологию клетки, устраняя присущую ей патологию, или оказывать на клетки профилактическое действие. Предпочтительные соединения способны специфически регулировать экспрессию генов рецепторов липопротеина низкой плотности. Соединения можно оценить in vitro в отношении их способности увеличивать экспрессию рецепторов липопротеина низкой плотности при помощи вестерн-блоттинга, например, так, как это описано в статье Tam et al., (1991) J. Biol.Chem. 266, 16764. Известны животные модели,позволяющие определять воздействие соединений на снижение уровней холестерина. Например, соединения, рассмотренные в этом описании изобретения, снижают уровни холестерина у хомяков, получающих корм с высоким содержанием холестерина, при исследовании в соответствии с протоколом, описанным в статьяхMed. Chem. 38, 277. Получение лекарственных средств и их введение нуждающимся субъектам Данное изобретение относится к использованию соединений и композиций по этому изобретению для лечения или профилактики болезней, для позитивной регуляции экспрессии генов рецепторов липопротеина низкой плотности в клетке, для снижения уровня холестерина в крови нуждающегося субъекта и т.д. Эти методы обычно заключаются в том, что соединения по данному изобретению вводят в соприкосновение с клетками или эффективное количество указанных соединений или фармацевтически приемлемых композиций вводят внутрь нуждающемуся субъекту. Композиции и соединения по данному изобретению и их фармацевтически приемлемые соли можно эффективно вводить перорально и парентерально или применять местно. Эти соединения обычно вводят в дозах от около 2 до около 2000 мг в день, хотя указанная дозировка может изменяться в зависимости от заболевания, состояния нуждающегося субъекта и способа введения. Эти лекарственные средства предпочтительно вводят перорально в количестве от около 0,05 до около 20 мг/кг, более предпочтительно от около 0,05 до около 2 мг/кг,наиболее предпочтительно от около 0,05 до около 0,2 мг/кг массы тела в день. В соответствии с одним вариантом соединения по этому изобретению смешивают с фармацевтически приемлемыми наполнителями,такими как стерильный солевой раствор или другая среда, вода, желатин, масло и тому подобные. Указанные композиции и/или соединения можно вводить отдельно или в сочетании с 24 любым наполнителем, разбавителем и т.д. в виде одной или нескольких доз. Полезными наполнителями являются твердые, полутвердые или жидкие среды, в том числе вода и нетоксичные органические растворители. В соответствии с другим вариантом данное изобретение предусматривает соединения в виде пролекарств, которые в результате обмена веществ могут превращаться в соединения по данному изобретению в организме нуждающегося субъекта. Известен целый ряд пролекарственных составов. Указанные композиции можно получить в любой удобной форме, включая таблетки, капсулы, лепешки, пастилки, леденцы, порошки,аэрозоли, кремы, суппозитории и другие. Эти композиции в виде фармацевтически приемлемых дозированных форм или в общей массе могут быть помещены в разные упаковки. Дозированные формы, например, могут быть заключены в капсулы, пилюли и т.д. Эти композиции можно объединять и эффективно использовать вместе с другими лечебными или профилактическими средствами,снижающими уровни холестерина и/или липидов. Во многих случаях введение других лекарственных средств вместе с композициями по данному изобретению усиливает эффективность таких средств. Типичными лекарственными средствами, понижающими уровни холестерина и/или липидов, являются вещества, усиливающие экскрецию желчной кислоты, такие как четвертичные амины (например, холестирамин и колестипол); никотиновая кислота и ее производные; ингибиторы редуктазы HMG-CoA, такие как мевастатин, правастатин и симвастатин; гемфиброзил и другие фибриновые кислоты, такие как гемфиброзил, клофибрат,фенофибрат, бензафибрат и ципофибрат; пробукол; ралоксифен и его производные; а также их смеси. Кроме того, указанные соединения и композиции весьма полезны при выполнении анализов in vitro и in vivo, в том числе диагностических анализов. Например, при помощи анализов на чувствительность, выполняемых с использованием соединений и композиций по данному изобретению или их панелей, можно выявлять разные аллотипические процессы экспрессии генов рецепторов липопротеина низкой плотности. При выполнении некоторых анализов, например, анализов вытеснения радиолиганда, и в процессе исследования распределения in vivo желательно использовать меченые формы соединений и композиций по данному изобретению. Таким образом, объектом данного изобретения являются соединения и композиции, содержащие детектируемую метку, которая может быть спектроскопической (например, флуоресцентной), радиоактивной и тому подобной. Представленные ниже примеры приведены исключительно в иллюстративных целях и ни 25 коим образом не ограничивают данное изобретение. Примеры Спектры 1H ЯМР (1H NMR) получены в спектрометре ядерного магнитного резонанса 400 МГц "Varian Gemini". Значимые линии спектра представлены в порядке множественности (s, синглет; d, дублет; t, триплет; q, квартет;m, мультиплет), константы взаимодействия выражены в Герцах в соответствии с числом протонов. Масс-спектры с электронной ионизацией(EI) получены в масс-спектрометре 5989 А фирмы "Hewlett Packard". Масс-спектрометрию с бомбардировкой ускоренными атомами (FAB) выполняли в аналитическом масс-спектрометре с широким полем зрения VG ZAB 2-SE. Результаты масс-спектроскопии приведены в виде отношения массы к заряду, и в скобках указана относительная распространенность иона. Условные обозначения ТГФ - тетрагидрофуран; ДМСО - диметилсульфоксид; ppm - части на миллион; mр - температура плавления; IR (neat) - инфракрасный спектр (чистый). Пример 1. 4-(N,N-Диметиламино)-1-пентафторфенилсульфонамидобензол.N,N-диметил-1,4 фенилдиамина (3 г, 14,6 ммоль), суспендированному в пиридине (50 мл), при 0 С в атмосфере аргона по каплям добавляют пентафторбензолсульфонилхлорид (2,38 мл, 16 ммоль). Реакционную смесь перемешивают в течение 30 мин при 0 С, оставляют нагреваться до комнатной температуры и перемешивают при комнатной температуре еще 3 ч. Затем объем смеси уменьшают до 10 мл при пониженном давлении. Реакционную смесь разбавляют этилацетатом и гасят водой. Слои разделяют и водный слой дважды экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором соли и сушат MgSO4. Растворитель выпаривают и остаток очищают хроматографией на силикагеле, производя элюирование СН 2 Сl2. Указанный в заголовке продукт получают в виде белого твердого вещества с выходом 63% (3,4 г). 1FAB m/z: 366 (100%, M+). Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 3-(N,N-диметиламино)анилин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. Пример 3. 1,2-Этилендиокси-4-пентафторфенилсульфонамидобензол.FAB m/z: 381(100%, М+Н+). Элем. анализ: Вычислено для C14H8F5NО 4S: С 44.09, Н 2.12, N 3.68, S 8.39. Найдено С 43.83, Н 2.19, N 3.62, S 8.20. Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 3,4-этилендиоксианилин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. Пример 4. 1,2-Метилендиокси-4-пентафторфенилсульфонамидобензол.(s, 2H). Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 3,4-метилендиоксианилин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. Пример 5. 1,2-Диметокси-4-пентафторфенилсульфонамидобензол.EI, m/z: 383(50, M+), 152 (100). Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 3,4-диметоксианилин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. Пример 6. 2-Гидрокси-1-метокси-4-пентафторфенилсульфонамидобензол.EI, m/z: 333 (20, М+), 138(100), mр 118120 С. Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 3-гидрокси-4-метоксианилин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. Пример 7. 3-Фтор-4-метокси-1-пентафторсульфонамидобензол.EI, m/z: 371 (20, M+), 140 (100). Элем. анализ: Вычислено для С 13 Н 7 НF6N1O3S1: С 42.06,Н 1.90, N 3.77, S 8.64 Найдено С 42.19, Н 1.83, N 3.70, S 8.60. Мр 118-119 С. Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 3-фторпараанизидин вместо дигидрохлорида N,N-диметил-14-фенилдиамина. Пример 8. 4-Метокси-1-пентафторфенилсульфонамидобензол.EI, m/z: 353 (60, M+), 122 (100). М.р. 102-103 С. Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 4-метоксианилин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина.EI, m/z: 339 (80, M+), 256 (50), 81 (100). Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 3-гидроксианилин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. Пример 10. 4-Гидрокси-1-пентафторсульфонамидобензол.EI, m/z: 339 (30, М+). Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 4-гидроксианилин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. Пример 11. 1,2-Диметил-4-пентафторфенилсульфонамидобензол. Н NMR (CDCl3): 7.03 (d, J=7.9Hz, 1H),6.92 (s, 1H), 6.85-6.82 (m, 2H), 2.18 (s, 3H),2.16ppm (s, 3H). Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 3,4-диметиланилин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. Пример 12. 4-(N,N-Диэтиламино)-1-пентафторфенилсульфонамидобензол.H NMR (CDCl3): 6.93 (d, J=8.8Hz, 2H),6.78 (s, 1), 6.45 (d, J=8.7Hz, 2H), 3.25 (dd,J=7.0Hz, 7.3Hz, 4H), 1.10ppm (t, J=7.2Hz, 6H). Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 4-(N,N-диэтиламино)анилин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. Пример 13. 4-Амино-1-пентафторфенилсульфонамидобензол.EI, m/z: 338 (7, M+), 107 (100), 80 (40). Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 1,4-диаминобензол вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. Пример 14. Пентафторфенилсульфонамидобензол.EI, m/z: 323 (90, M+), 92 (100). Это соединение получают так же, как в примере 1, используя в качестве исходного вещества анилин вместо дигидрохлорида N,Nдиметил-1,4-фенилдиамина. Пример 15. 5-Пентафторфенилсульфонамидоиндазол.EI m/z: 364 (50, M+H+), 133 (100). Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 5-аминоиндазол вместо дигидрохлоридаEI m/z: 362 (M+), 131 (100). Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 5-аминоиндол вместо дигидрохлоридаN2 при комнатной температуре к реакционной системе добавляют 1 М раствор бис(триметилсилил)амида лития (0,274 мл). Реакционную смесь перемешивают в течение 10 мин, добавляют МеI (65 мг, 0,028 мл) и продолжают перемешивать в течение ночи. Растворитель выпаривают при пониженном давлении и сырой продукт очищают жидкостной хроматографией высокого давления, используя силикагель в качестве стационарной фазы и производя элюирование смесью 20% EtOAc и гексана (в объемном отношении), что дает продукт в виде белого твердого вещества с выходом 60% (62 мг). 1-Гидрокси-2-метокси-4-пентафторфенилсульфонамидобензол (250 мг, 0,678 ммоль) суспендируют в сухом CH2Cl2 (5 мл) при 0 С в атмосфере азота. К смеси добавляют ВВr3 в виде 1 М раствора в СН 2 Сl2 (0,746 ммоль, 1,1 экв.). Полученную смесь нагревают до комнатной температуры, перемешивают в течение ночи,выливают на лед (75 мл) и трижды экстрагируют 30 мл порциями СН 2 Сl2. Органический слой сушат MgSO4 и выпаривают растворитель. Сырой продукт очищают хроматографией на силикагеле, производя элюирование смесью 30% (в объемном отношении) EtOAc и гексана, что дает продукт в виде белого твердого вещества с выходом 41% (98 мг). 1 Н NMR (DMSO): 10.63 (s, 1H), 9.15 (s,1H), 8.91 (s, 1H), 6.61 (d, J=9Hz, 1H), 6.58 (d,J=3Hz, 1H), 6.39ppm (dd, J= 9Hz, 3Hz, 1H). Пример 19. 4-Этокси-1-пентафторбензолсульфонамидобензол. 31 К перемешанному раствору парафенетидина (0,100 г, 0,729 ммоль) в диметилформамиде (3,65 мл) при температуре 25 С добавляют пентафторбензолсульфонилхлорид (0,135 мл,0,911 ммоль) и карбонат натрия (0,116 г, 1,09 ммоль), после чего смесь перемешивают в течение 18 ч. Реакционную смесь разбавляют этилацетатом (50 мл) и промывают 20% хлоридом аммония (220 мл) и насыщенным раствором хлорида натрия (220 мл). Органический слой сушат (сульфит натрия) и удаляют этилацетат при пониженном давлении с получением красновато-коричневого масла. Хроматография на колонках (элюент: смесь этилацетата и гексана,3:1) дает указанное в заголовке соединениеEI m/z: 367 (M+), 154, 136. Соединения, представленные в примерах с 20 по 26, получают так же, как в примере 19,используя в качестве исходного вещества соответствующий амин вместо парафенетидина. Пример 20. 3,5-Диметокси-1-пентафторбензолсульфонамидобензол. Это соединение получают так же, как в примере 19, используя в качестве исходного вещества 3,5-диметоксианилин вместо парафенетидина. 1 Это соединение получают так же, как в примере 19, используя в качестве исходного вещества 3-этоксианилин вместо парафенетидина. 1 Это соединение получают так же, как в примере 19, используя в качестве исходного вещества 2-амино-7-гидроксинафталин вместо парафенетидина. 1 Н NMR (CDCl3) 8.15 (t, J=8Hz, 1H), 7.55 Это соединение получают так же, как в примере 19, используя в качестве исходного вещества 3-феноксианилин вместо парафенетидина. 1 Это соединение получают так же, как в примере 19, используя в качестве исходного вещества 3-метоксианилин вместо парафенетидина. 1 Это соединение получают так же, как в примере 19, используя в качестве исходного вещества 4-(1-морфолино)анилин вместо парафенетидина. 1 Это соединение получают так же, как в примере 19, используя в качестве исходного вещества 3,4,5-триметоксианилин вместо парафенетидина. 1H NMR (CDCl3) 8.14 (s, 1H), 6.46 (s, 2H),3.69 (s, 6H), 3.59 (s, 3H). Пример 27. 1,3-Диметокси-2-гидрокси-5 пентафторбензолсульфонамидобензол 1,2-Дигидрокси-3-метокси-5-пентафторбензолсульфонамидобензол 5-Пентафторбензолсульфонамидо-1,2,3 тригидроксибензол 1,2,3-Метокси-5-пентафторбензолсульфонамидобензол (269 мг, 0,65 ммоль) суспендируют в сухом CH2Cl2 (5 мл) при 0 С в атмосфере азота. К полученной смеси добавляют ВВr3 в виде 1 М раствора в CH2Cl2 (3,26 ммоль, 5 экв.). Реакционную смесь нагревают до комнатной температуры, перемешивают в течение ночи, выливают на лед (75 мл) и трижды экстрагируют 30 мл порциями СН 2 Сl2. Органический слой сушат МgSO4, упаривают и остаток обрабатывают хроматографией на силикагеле, производя элюирование смесью 30% (в объемном отношении) EtOAc и гексана, что дает три продукта. Соединения, представленные в примерах 28 и 29, получают в соответствии с приведенным выше описанием, используя в качестве исходного вещества продукт по примеру 20, который обрабатывают ВВr3. 1,3-Диметокси-2-гидрокси-5-пентафторбензолсульфонамидобензол. Это соединение получают так же, как в примере 18, используя в качестве исходного вещества соответствующий незамещенный сульфонамид (продукт по примеру 7) вместо 4(N,N-диметиламино)-1-пентафторфенилсульфонамидобензола. 1EI m/z: 433 (35, M+), 202 (100). Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 3-бром-4-метоксианилин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. Пример 32. 2-Хлор-1-метокси-4-пентафторфенилсульфонамидобензол. Это соединение получают также, как в примере 1, используя в качестве исходного вещества 3-хлор-4-метоксианилин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. 1 4-(N,N-Диметиламино)-1-пентафторфенилсульфонамидобензол (2 г, 5,5 ммоль) растворяют в 15 мл диэтилового эфира при комнатной температуре в атмосфере азота. В течение 5 мин в реакционную смесь барботируют газообразный НСl. Реакционную смесь фильтруют и полученное твердое вещество дважды промывают 15 мл порциями охлажденного льдом диэтилового эфира, что дает продукт в виде белого твердого вещества (1,89 г, выход 86%). 1 Н NMR (СD3 ОD): 7.62 (dd, J=9.0Hz, 1.6Hz,2H), 7.44 (dd, J=9.0Hz, 1.6Hz, 2H), 3.28ppm (s,6H). 36 Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 3,4-дифторанилин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. 1 Н NMR (CDCl3) 7.13 (m, 3 Н), 6.91ppm (m,1H). Это соединение получают так же, как в примере 1, используя в качестве исходного вещества 4-(трифторметокси)анилин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. 1 Это соединение получают также, как в примере 1, используя в качестве исходного вещества 5-амино-2-хлорпиридин вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. Белые кристаллы с т.п. = 144-145 С. 1N-(5-Гидроксифенил)-2-гидрокси-1 метокси-4-аминобензол, полученный посредством гидроаминирования 5-амино-2-метоксифенола глутаровым альдегидом с NaBH4 в метаноле. 2-Гидрокси-1-метокси-4-(N-петан-5-олпентафторфенилсульфонамидо)бензол получают так же, как в примере 1, используя в качестве исходного вещества N-(5-гидроксипентил)-2 гидрокси-1-метокси-4-аминобензол вместо дигидрохлорида N,N-диметил-1,4-фенилдиамина. Белые кристаллы с т.п. = 118 С. 1 Это соединение получают так же, как в примере 46, используя в качестве исходного вещества 4-трет-бутоксианилин вместо 3 хлоранилина. 4-Трет-бутоксианилин получают по методу Дея (Day, J. Med. Chem. 1975, 18,1065). 1 Это соединение получают путем бромирования соединения по примеру 6 N-бромсукцинамидом в дихлорметане. 1 Это соединение получают путем бромирования соединения по примеру 6 N-бромсукцинамидом в дихлорметане. 1 Это соединение получают путем бромирования соединения по примеру 7 бромной водой. Белые кристаллы с т.п. = 109 С. 1 Это соединение получают путем обработки соединения по примеру 6 эквимолярным количеством 1 н водного раствора NaOH. Эту смесь затем лиофилизуют и остаток перекристаллизовывают из смеси этилацетата и эфира. 1 Это соединение получают так же, как в примере 42, используя в качестве исходного вещества 1 н раствор КОН вместо 1 н раствора Это соединение получают так же, как в примере 43, используя в качестве исходного вещества соединение по примеру 7 вместо соединения по примеру 6. 1 Это соединение получают так же, как в примере 44, используя в качестве исходного вещества 1 н раствор NaOH вместо 1 н раствора КОН. 1 К раствору пентафторбензолсульфонилхлорида (0,15 мл, 1,00 ммоль) в метаноле (4 мл) добавляют 3-хлоранилин (260 мг, 2,04 ммоль). Реакционную смесь перемешивают в течение 1 ч при комнатной температуре и концентрируют при пониженном давлении. Остаток поглощаютEtOAc и фильтруют через слой силикагеля. Фильтрат концентрируют, что дает желтое масло, которое хроматографируют с получением 265 мг (74%) продукта. 1 Н NMR (CDCl3): d 7.28-7.24 (m, 1 Н), 7.217.17 (m, 2 Н), 7.10-7.08 (m, 1 Н), 7.07 (s, 1 Н). Это соединение получают так же, как в примере 46, используя в качестве исходного вещества 4-хлоранилин вместо 3-хлоранилина. 1 Это соединение получают так же, как в примере 46, используя в качестве исходного вещества 3-нитроанилин вместо 3-хлоранилина. 1 Это соединение получают так же, как в примере 46, используя в качестве исходного вещества 4-метокси-3-трифторметиланилин вместо 3-хлоранилина. 4-Метокси-3-трифторметиланилин получают путем гидрогенизации соответствующего нитросоединения. Белое твердое вещество, т.п. 121-123 С. 1 Н NMR (CDCl3): d 7.43-7.37 (m, 2H), 6.96 К раствору 4-метокси-1-пентафторфенилсульфонамидобензола (448 мг, 1,27 ммоль) в ТГФ (3 мл) добавляют трифенилфосфин (333 мг, 1,27 ммоль) и аллиловый спирт (0,09 мл,1,27 ммоль). Затем добавляют диэтилазодикарбоксилат (0,20 мл, 1,27 ммоль) и перемешивают смесь при комнатной температуре. Через 1 ч реакционную смесь выливают в насыщенный раствор NaCl (10 мл) и экстрагируют CH2Cl2 (310 мл). Объединенные органические экстракты промывают насыщенным раствором NаНСО 3(10 мл) и сушат (МgSО 4). Концентрирование и последующая флэш-хроматография (элюент: смесь гексанов, CH2Cl2 и EtOAc, 25:25:1) дают 451 мг (90%) продукта в виде белого твердого вещества, т.п. 59-60 С. 1 Это соединение получают так же, как в примере 50, используя в качестве исходного вещества 3-бутен-1-ол вместо аллилового спирта. Белое твердое вещество, т.п. 64-66 С. 1 Н NMR (CDCl3): d 7.08 (m, 2H), 6.86 (m,2H), 5.74 (m, 1H), 5.10-5.04 (m, 2H), 3.83 (m,2H), 3.81 (s, 3H), 2.25 (q, J=6.9, 2H). Это соединение получают также, как в примере 50, используя в качестве исходного вещества 4-пентен-1-ол вместо аллилового спирта. Полутвердое вещество с низкой температурой плавления. 1 К раствору 4-метокси-1-(N-(2-пропенил) пентафторфенилсульфонамидо)бензола (101 мг,0,26 ммоль) в смеси ацетона и воды (8:1,1 мл) при комнатной температуре добавляют N-оксид(0,10 мл 0,16M раствора H2O, 1,6010-2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч, обрабатывают насыщенным раствором NаНSО 3 (5 мл) и продолжают перемешивать при комнатной температуре. Через 1 ч реакционную смесь выливают в насыщенный раствор NаНSО 3 (5 мл) и экстра 43 гируют СН 2 Сl2 (310 мл). Объединенные органические экстракты сушат (МgSO4) и концентрируют. Флэш-хроматография (элюент: смесь гексанов и EtOAc, 1:1, 1:2) дает 90 мг (83%) продукта в виде белого твердого вещества, т.п. 130-131 С. 1 Это соединение получают так же, как в примере 53, используя в качестве исходного вещества 1-(N-(3-бутенил)пентафторфенилсульфонамидо)-4-метоксибензол вместо 4-метокси 1-(N-(2-пропенил)пентафторфенилсульфонамидо)бензола. Белое твердое вещество, т.п. 126128 С. 1 Н NMR (CDCl3): d 7.10 (m, 2H), 6.88 (m,2H), 4.13 (m, 1H), 3.96 (m, 1H), 3.81 (s, 3 Н), 3.783.73 (m, 1H), 3.64 (dd, 1, J=2.9, 10.7, 1 Н), 3.47 Это соединение получают так же, как в примере 53, используя в качестве исходного вещества 4-метокси-1-(N-(4-пентенил)пентафторфенилсульфонамидо)бензол вместо 4 метокси-1-(N-(2-пропенил)пентафторфенилсульфонамидо)бензола. Белое твердое вещество,т.п. 116-118 С. 1-78 С добавляют раствор ВН 3 в ТГФ (1,00 мл 1 М раствора в ТГФ, 1,00 ммоль). Реакционную смесь перемешивают 1 ч при температуре -78 С и еще 1 ч при температуре 0 С, после чего обрабатывают Н 2 О (20 мл) и перборатом натрия(513 мг, 5,14 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 2 ч, выливают в H2O (20 мл) и экстрагируют СН 2 Сl2 (315 мл). Объединенные органические экстракты промывают насыщенным растворомNaCl (20 мл) и сушат (МgSО 4). Концентрирование и последующая хроматография (элюент: смесь гексанов и EtOAc, 2:1) дают 270 мг (64%) продукта в виде белого твердого вещества, т.п. 88-90 С. 1 Это соединение получают так же, как в примере 56, используя в качестве исходного вещества 4-метокси-1-(N-(4-пентенил)пентафторфенилсульфонамидо)бензол вместо 1-(N(3-бутенил)пентафторфенилсульфонамидо)-4 метоксибензола. Белое твердое вещество, т.п. 96-97 С. 1 Н NMR (СDСl3): d 7.08 (m, 2H), 6.86 (m,2H), 3.81 (s, 3 Н), 3.76 (t, J=6.8, 2H), 3.62 (t, J=6.4; 2H), 1.58-1.43 (m, 6 Н). Элем. анализ: Вычислено для С 18H18F5NO4S: С, 49.20; Н,4.13; N, 3.19; S, 7.30. Найдено С, 49.11; Н, 4.09; N, 3.14; S, 7.19. Пример 58. 4-Метокси-3-нитро-1-пентафторфенилсульфонамидобензол. Это соединение получают так же, как в примере 46, используя в качестве исходного вещества 4-метокси-3-нитроанилин вместо 3 хлоранилина. 4-Метокси-3-нитроанилин получают по методу Норриса (Norris, Aust. J. Chem. 1971, 24, 1449). Оранжево-желтое твердое вещество, т.п. 95-97 С. 1(51 мг). Полученную смесь перемешивают в атмосфере газообразного водорода под давлением 1 атм. Через 14 ч смесь пропускают через слой целита и фильтрат концентрируют с получением твердого остатка. Хроматография на силикагеле (элюент: смесь гексанов и EtOAc,2:1, 1:1) дает 542 мг (93%) продукта в виде белого твердого вещества, т.п. 142-143 С. 1 Н NMR (DMSO-d6): 10.64 (s, 1), 6.68 (d,J=8.4; 1 Н), 6.44 (d, J=2.1; 1H), 6.30 (d, J=2.1, 8.4; 1H), 4.88 (bs, 2H), 3.69 (s, 3 Н). Элем. анализ: Вычислено для С 13H9F5N2O3S: С, 42.40; Н,2.46; N, 7.61; S, 8.71. Найденo С, 42.29; Н, 2.36; N, 7.52; S, 8.60. Пример 60. 4-Бутокси-1-пентафторфенилсульфонамидобензол. К раствору пентафторбензолсульфонилхлорида (203 мг, 0,763 ммоль) в метаноле (4 мл) добавляют 4-бутоксианилин (0,26 мл, 1,53 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, выливают в 1 М раствор НСl (15 мл) и экстрагируют СН 2 Сl2 (310 мл). Объединенные органические экстракты промывают насыщенным раствором Это соединение получают так же, как в примере 60, используя в качестве исходного вещества 4-феноксианилин вместо 4 бутоксианилина. 1 Это соединение получают так же, как в примере 60, используя в качестве исходного вещества 4-бензилоксианилин вместо 4 бутоксианилина. 4-Бензилоксианилин получают из приобретаемой коммерческим путем хлористо-водородной соли путем обработки водным раствором NaOH. 1 Это соединение получают так же, как в примере 60, используя в качестве исходного вещества 4-(метилмеркапто)анилин вместо 4 бутоксианилина. 1 Это соединение получают так же, как в примере 60, используя в качестве исходного вещества ортоанизидин вместо 4-бутоксианилина. 1 Это соединение получают так же, как в примере 60, используя в качестве исходного вещества 4-аллилоксианилин вместо 4 бутоксианилина. 4-Аллилоксианилин получают по методу Бутера (Butera, J. Med. Chem. 1991,34, 3212). 1 Это соединение получают так же, как в примере 60, используя в качестве исходного вещества 4-пропоксианилин вместо 4-бутоксианилина. 4-Пропоксианилин получают путем каталической гидрогенизации 4-аллилоксинитробензола. 4-Аллилоксинитробензол получают по методу Бутера (Butera, J. Med. Chem. 1991,34, 3212). 1 Это соединение получают так же, как в примере 60, используя в качестве исходного вещества 4-изопропоксианилин вместо 4 бутоксианилина. 4-Изопропоксианилин получают из 4-фторнитробензола аналогично методу Дея (Day, J. Med. Chem. 1975, 18, 1065). 1 К перемешанному раствору фенола (0,068 г, 0,729 ммоль) в диметилформамиде (3,65 мл) при температуре 25 С добавляют пентафторбензолсульфонилхлорид (0,135 мл, 0,911 ммоль) и карбонат натрия (0,116 г, 1,09 ммоль),после чего смесь перемешивают в течение 18 ч. Реакционную смесь разбавляют этилацетатом(50 мл), промывают 20% хлоридом аммония (220 мл) и насыщенным раствором хлорида натрия (220 мл). Органический слой сушат(сульфит натрия) и удаляют этилацетат в вакуу 49 ме. Хроматография на колонках (элюент: смесь этилацетата и гексана, 3:1) дает указанное в заголовке соединение. Пример 69. 1-Пентафторбензолсульфонилиндол. К перемешанному раствору индола (0,085 г, 0,729 ммоль) в диметилформамиде (3,65 мл) при температуре 25 С добавляют пентафторбензолсульфонилхлорид (0,135 мл, 0,911 ммоль) и карбонат натрия (0,116 г, 1,09 ммоль),после чего смесь перемешивают в течение 18 ч. Реакционную смесь разбавляют этилацетатом(50 мл), промывают 20% хлоридом аммония (220 мл) и насыщенным раствором хлорида натрия (220 мл). Органический слой сушат(сульфит натрия) и удаляют этилацетат в вакууме. Хроматография на колонках (элюент: смесь этилацетата и гексана, 3:1) дает указанное в заголовке соединение. Пример 70. 2-Фтор-1-метокси-4-пентафторфенилсульфинамидобензол.(1,84 г, 23,3 ммоль) при 0 С в атмосфере аргона добавляют по каплям пентафторбензолсульфинилхлорид (5,3 г, 21,2 ммоль). Реакционную смесь перемешивают в течение 30 мин при 0 С и оставляют нагреваться до комнатной температуры, затем ее перемешивают при комнатной температуре и обрабатывают посредством тонкослойной хроматографии. После окончания реакции смесь разбавляют этилацетатом и гасят водой. Слои разделяют и водный слой дважды экстрагируют этилацетатом. Органические слои объединяют и сушат насыщенным раствором соли и Na2SO4. Растворитель выпаривают и остаток очищают хроматографией на силикагеле с получением указанного в заголовке соединения. Пример 71. 2-Анилино-3-пентафторфенилсульфонамидопиридин. К раствору пентафторфенилсульфонилхлорида (863 мг, 3,24 ммоль) в пиридине (9 мл) при комнатной температуре добавляют 3 амино-2-анилинопиридин (600 мг, 3,24 ммоль). Реакционную смесь перемешивают в течение ночи при комнатной температуре и концентрируют при пониженном давлении. Остаток распределяют между 1 М раствором НСl (50 мл) и СН 2 Сl2 (50 мл). Органический экстракт сушат и концентрируют с получением масла, которое 50 очищают жидкостной хроматографией среднего давления, что дает 377 мг (28%) продукта в виде оранжевого твердого вещества. 1MS (FAB): m/z 438 (M+Na), 416 (M+H). Пример 72. Соединения оценивали в отношении их способности увеличивать экспрессию рецепторов липопротеина низкой плотности в клетках Нер G2 путем анализа на основе вестернблоттинга, описанного в статье Тама и др. (Tamet al., J. Biol. Chem., 266, 16764 (1991). Приведенные данные (Есmах) показывают минимальную концентрацию, при которой наблюдалась максимальная индукция рецепторов липопротеина низкой плотности для каждого соединения. Во всех случаях уровень индукции был выше значения, полученного в условиях отсутствия липидов (активированная система). Соединение Пример 1 Пример 2 Пример 3 Пример 4 Пример 6 Пример 7 Пример 8 Пример 9 Пример 12 Пример 15 Пример 17 Пример 24 Пример 25 Пример 30 Пример 31 Пример 32 Все публикации и заявки на патент, приведенные в этом описании изобретения включены в него в качестве ссылки, как если бы это было специально указано для каждой отдельной публикации или заявки на патент. Подробное описание данного изобретения на основании иллюстраций и примеров дано только для того, чтобы сделать понимание изобретения более доступным, поэтому совершенно ясно, что в данное изобретение могут быть внесены некоторые изменения и модификации, которые также входят в объем прилагаемой формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, содержащая в качестве фармацевтически активного компонента соединение формулы I или его фармацевтически приемлемую соль,где Y является -S(O)- или -S(O)2- иZ является -NR1R2, где R1 выбирают из водорода, замещенного или незамещенного (C1 С 10)алкила, замещенного или незамещенного(C3-С 6)алкенила, замещенного или незамещенного (C3-С 8)циклоалкила и замещенного или незамещенного (C2-С 6)гетероалкила, и R2 выбирают из замещенного или незамещенного арила и замещенного или незамещенного гетероарила; при этом R1 и R2 могут быть соединены связующей группой Е с получением заместителя формулы где Е обозначает связь, (C1-С 4)алкилен или (C1 С 4)гeтероалкилен, и кольцо, образуемое R1, Е,R2 и атомом азота, имеет не более 8 атoмов; и фармацевтически приемлемый наполнитель. 2. Композиция по п.1, где R1 обозначает водород или (C1-С 6)алкил, R2 обозначает необязательно замещенный фенил и между R1 и R2 отсутствует связующая группа Е. 3. Композиция по п.1, где R1 обозначает водород или метил, и R2 обозначает замещенный фенил, имеющий от одного до четырех заместителей, которые независимо друг от друга выбирают из (C1-С 6)алкила, гидрокси, (C1 С 6)алкокси, амино, необязательно замещенного одним или двумя (C1-С 6)алкилами, необязательно замещенного ариламино, необязательно замещенного гетероариламино, необязательно замещенного фенокси и галогена. 4. Композиция по п.1, где R1 обозначает водород и R2 обозначает замещенный фенил,причем заместители в R2, находящиеся в одном или нескольких 3- и 4-положениях фенильного кольца относительно сульфонамидогруппы,независимо друг от друга выбирают из амино,(C1-С 6)алкиламино и диC1-С 6)алкил)амино. 5. Композиция по п.4, где соединение выбирают из группы, включающей 4-(N,N-диметиламино)-1-пентафторфенилсульфонамидобензол,4-(N,N-диэтиламино)-1-пентафторфенилсульфонамидобензол,3-(N,N-диметиламино)-1-пентафторфенилсульфонамидобензол,4-амино-1-пентафторфенилсульфонамидобензол и 4-(N,N-диметиламино)-1-пентафторфенилсульфонамидобензолгидрохлорид. 6. Композиция по п.1, где R1 обозначает водород и R2 обозначает фенил, замещенный в 52 3- и 4-положениях относительно сульфонамидогруппы двухвалентной частью, образующей 5 или 6-членное кольцо с 3- и 4-атомами углерода фенильного кольца. 7. Композиция по п.6, где двухвалентная часть является -OCH2CH2O-, -OCH2O-, -C=CNHили -C=NNH-. 8. Композиция по п.7, где соединение представляет 1,2-этилендиокси-4-пентафторфенилсульфонамидобензол,1,2-метилендиокси-4-пентафторфенилсульфонамидобензол,5-пентафторфенилсульфонамидоиндазол или 5-пентафторфенилсульфонамидоиндол. 9. Композиция по п.1, где R1 обозначает водород, R2 обозначает замещенный фенил, и заместители фенила независимо друг от друга выбирают из галогена, гидрокси, (C1-С 6)алкила,(C1-С 6)алкокси, амино, (C1-С 6)алкиламино и диC1-С 6)алкил)амино. 10. Композиция по п.9, где заместители фенила независимо друг от друга выбирают из брома, хлора, фтора, гидрокси, метокси, этокси,амино и диметиламино. 11. Композиция по п.10, где соединение выбирают из группы, включающей 4-метокси-1-пентафторфенилсульфонамидобензол,3-гидрокси-1-пентафторфенилсульфонамидобензол,4-гидрокси-1-пентафторфенилсульфонамидобензол,4-этокси-1-пентафторфенилсульфонамидобензол,3-этокси-1-пентафторфенилсульфонамидобензол,3-фентокси-1-пентафторфенилсульфонамидобензол,3-метокси-1-пентафторфенилсульфонамидобензол и 4-трет-бутокси-1 пентафторфенилсульфонамидобензол. 12. Композиция по п.1, где соединение выбирают из группы, включающей 1,2-диметокси-4-пентафторфенилсульфонамидобензол,2-гидрокси-1-метокси-4-пентафторфенилсульфонамидобензол,1,2-дигидрокси-4-пентафторфенилсульфонамидобензол,мононатриевую соль 2-гидрокси-1-метокси-4-пентафторфенилсульфонамидобензола и монокалиевую соль 2-гидрокси-1-метокси 4-пентафторфенилсульфонамидобензола. 13. Композиция по п.1, где соединение выбирают из группы, включающей 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензол, 53 2-бром-1-метокси-4-пентафторфенилсульфонамидобензол,2-хлор-1-метокси-4-пентафторфенилсульфонамидобензол,натриевую соль 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензола и калиевую соль 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензола. 14. Композиция по п.1, где в соединении формулы IY является SO2, R1 обозначает водород или (C1-С 6)алкил и R2 обозначает незамещенную или необязательно замещенную нафтильную группу. 15. Композиция по п.1, где R2 обозначает фенильное кольцо, замещенное гетероциклической группой в 4-положении относительно сульфонамидогруппы. 16. Композиция по п.1, где R1 и R2 ковалентно связаны в части, образующей 5- или 6 членное гетероциклическое кольцо с атомом азота группы NR1R2. 17. Композиция по п.16, где R1 обозначает группу -СН=СН- или группу -(СН 2)3-, присоединенную в 2-положении фенильной группы R2 относительно сульфонамидогруппы. 18. Композиция по п.1, где R1 обозначает необязательно замещенный (C2-С 10)алкил или необязательно замещенный (С 3-С 6)алкенил. 19. Композиция по п.18, где соединение выбирают из группы, включающей 2-гидрокси-1-метокси-4-[N-(5-гидроксипент-1-ил)пентафторфенилсульфонамидо] бензол,4-метокси-1-[N-(2-пропенил)пентафторфенилсульфонамидо]бензол,4-метокси-1-[N-(4-пентенил)пентафторфенилсульфонамидо]бензол,1-[N-(2,3-дигидроксипропил)пентафторфенилсульфонамидо]-4-метоксибензол,1-[N-(3,4-дигидроксибутил)пентафторфенилсульфонамидо]-4-метоксибензол,1-[N-(4,5-дигидроксипентил)пентафторфенилсульфонамидо]-4-метоксибензол,1-[N-(4-гидроксибутил)пентафторфенилсульфонамидо]-4-метоксибензол и 4-метокси-1-[N-(5-гидроксипентил)пентафторфенилсульфонамидо]бензол. 20. Способ лечения или профилактики болезней, характеризующихся повышенным содержанием частиц липопротеина низкой плотности или холестерина в крови, который заключается в том, что субъекту-млекопитающему вводят терапевтически эффективное количество композиции по п.1. 21. Способ по п.20, где болезнь является атеросклерозом. 22. Способ по п.20, где болезнь является панкреатитом. 23. Способ по п.20, где болезнь является гиперхолестеринемией. 24. Способ по п.20, где болезнь является гиперлипопротеинемией. 54 25. Способ по п.20, где композицию вводят перорально. 26. Способ по п.20, где субъект является человеком. 27. Способ по п.20, где композицию вводят в сочетании с терапевтически эффективным количеством агента, понижающего содержание липидов в крови, или агента, понижающего содержание холестерина в крови. 28. Соединение формулы I или его фармацевтически приемлемая соль,где Y является -S(O)- или -S(O)2-; иZ является -NR1R2, где R2 обозначает необязательно замещенную фенильную группу иR1 выбирают из группы, включающей водород,замещенный или незамещенный (C1-С 10)алкил,замещенный или незамещенный (C3-С 6)алкенил,замещенный или незамещенный (C2-С 6)гетероалкил, замещенный или незамещенный (C3 С 6)гетероалкенил, замещенный или незамещенный (C3-С 8)циклоалкил, замещенный или нeзамещенный (C5-С 7)циклоалкенил; заместители фенила, если они имеются,выбирают из группы, включающей (C1 С 6)алкил, гидрокси, (C1-С 6)алкокси, амино, необязательно замещенный одним или двумя (C1 С 6)алкилами, необязательно замещенный ариламино, необязательно замещенный гетероариламино, необязательно замещенный фенокси и галоген; R1 и R2 могут быть соединены связующей группой Е с получением заместителя формулы где Е обозначает связь, (C1-С 4)алкилен или (C1 С 4)гетероалкилен, и кольцо, образованное R1, Е,R2 и атомом азота, имеет не более 8 атомов, при условии, что когда Y является -S(O)2- и R1 обозначает водород или метил, тогда R2 обозначает замещенный фенил; когда Y является -S(O)2-, R2 обозначает фенил и R1 обозначает пропиленовое звено,присоединяющее атом азота группы -NR1R2 в 2 положении фенильного кольца относительно сульфонамидогруппы с образованием 1,2,3,4 тетрагидрохинолиновой системы, одна или несколько оставшихся валентностей в полученной таким образом бициклической системе замещены, по крайней мере, одним заместителем, который не является водородом; когда Y является -S(O)2- и R2 обозначает фенил, замещенный 3-(1-гидроксиэтилом), 3 55 диметиламино, 4-диметиламино, 4-фенилом, 3 гидрокси,3-гидрокси-4-диэтиламиноэтилом,3,4-метилендиокси, 3,4-этилендиокси, 2-(1 пирролилом) или 2-метокси-4-(1-морфолино),тогда или R1 не является водородом или, когдаR1 обозначает водород, одна или несколько оставшихся валентностей в фенильном кольце R2 замещены заместителем, который не является водородом; где указанное соединение обладает фармакологической активностью. 29. Соединение по п.28, где R2 обозначает водород или метил и R2 обозначает замещенный фенил, имеющий от одного до четырех заместителей, которые независимо друг от друга выбирают из (C1-С 6)алкила, гидрокси, (C1 С 6)алкокси, амино, необязательно замещенного одним или двумя (C1-С 6)алкилами, необязательно замещенного ариламино, необязательно замещенного гетероариламино, необязательно замещенного фенокси и галогена. 30. Соединение по п.29, где R1 обозначает водород и R2 обозначает замещенный фенил, и заместители фенила, находящиеся в одном или нескольких 3- и 4-положениях фенильного кольца относительно сульфонамидогруппы,независимо друг от друга выбирают из амино,(C1-С 6)алкиламино и диC1-С 6)алкил)амино. 31. Соединение по п.30, которое выбирают из группы, включающей 4-(N,N-диэтиламино)-1-пентафторфенилсульфонамидобензол,4-амино-1-пентафторфенилсульфонамидобензол и 4-(N,N-диметиламино)-1-пентафторфенилсульфонамидобензол. 32. Соединение по п.28, где R1 обозначает водород и R2 обозначает фенил, замещенный в 3- и 4-положениях относительно сульфонамидогруппы двухвалентной частью, образующей 5 или 6-членное кольцо с 3- и 4-атомами углерода фенильного кольца. 33. Соединение по п.29, где R1 обозначает водород и заместители фенила независимо друг от друга выбирают из галогена, гидрокси, низшего алкила, низшего алкокси, амино, (низший)алкиламино и ди(низший)алкиламино. 34. Соединение по п.29, где заместители фенила независимо друг от друга выбирают из брома, хлора, фтора, гидрокси, метокси, этокси,амино и диметиламино. 35. Соединение по п.28, где заместители фенила, находящиеся в одном или нескольких 3- и 4-положениях фенильного кольца относительно сульфонамидогруппы, независимо друг от друга выбирают из брома, хлора, фтора, гидрокси, метокси и этокси. 36. Соединение по п.35, которое выбирают из группы, включающей 56 4-метокси-1-пентафторфенилсульфонамидобензол,3-гидрокси-1-пентафторфенилсульфонамидобензол,4-гидрокси-1-пентафторфенилсульфонамидобензол,4-этокси-1-пентафторфенилсульфонамидобензол,3-этокси-1-пентафторфенилсульфонамидобензол и 3-метокси-1-пентафторфенилсульфонамидобензол. 37. Соединение по п.28, которое выбирают из группы, включающей 1,2-диметокси-4-пентафторфенилсульфонамидобензол,2-гидрокси-1-метокси-4-пентафторфенилсульфонамидобензол,1,2-дигидрокси-4-пентафторфенилсульфонамидобензол,мононатриевую соль 2-гидрокси-1-метокси-4-пентафторфенилсульфонамидобензола и монокалиевую соль 2-гидрокси-1-метокси 4-пентафторфенилсульфонамидобензола. 38. Соединение по п.28, которое выбирают из группы, включающей 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензол,2-бром-1-метокси-4-пентафторфенилсульфонамидобензол,2-хлор-1-метокси-4-пентафторфенилсульфонамидобензол,натриевую соль 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензола и калиевую соль 2-фтор-1-метокси-4-пентафторфенилсульфонамидобензола. 39. Соединение по п.28, которое выбирают из группы, включающей 2-гидрокси-1-метокси-4-[N-(5-гидроксипент-1-ил)пентафторфенилсульфонамидо] бензол,4-метокси-1-[N-(2-пропенил)пентафторфенилсульфонамидо]бензол,4-метокси-1-[N-(4-пентенил)пентафторфенилсульфонамидо]бензол,1-[N-(2,3-дигидроксипропил)пентафторфенилсульфонамидо]-4-метоксибензол,1-[N-(3,4-дигидроксибутил)пентафторфенилсульфонамидо]-4-метоксибензол,1-[N-(4,5-дигидроксипентил)пентафторфенилсульфонамидо]-4-метоксибензол,1-[N-(4-гидроксибутил)пентафторфенилсульфонамидо]-4-метоксибензол и 4-метокси-1-[N-(5-гидроксипентил)пентафторфенилсульфонамидо]бензол.
МПК / Метки
МПК: A61P 9/10, A61K 31/18, C07C 303/00
Метки: пентафторбензолсульфонамиды, аналоги
Код ссылки
<a href="https://eas.patents.su/29-1367-pentaftorbenzolsulfonamidy-i-ih-analogi.html" rel="bookmark" title="База патентов Евразийского Союза">Пентафторбензолсульфонамиды и их аналоги.</a>
Предыдущий патент: Способ для сталкивания предмета с транспортера при помощи толкателя и устройство для его осуществления
Следующий патент: Нефтеводяной фильтрующий сепаратор









