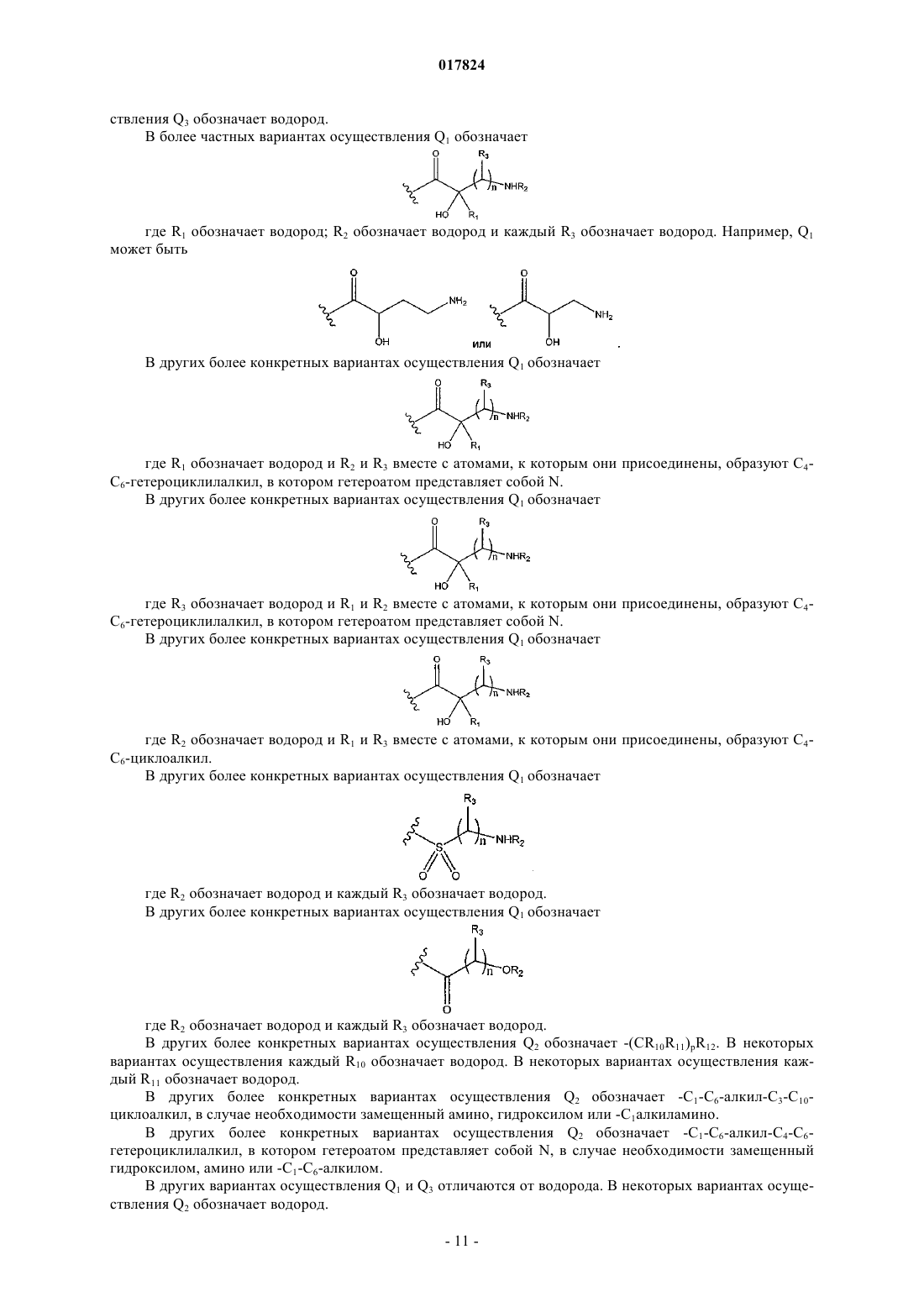
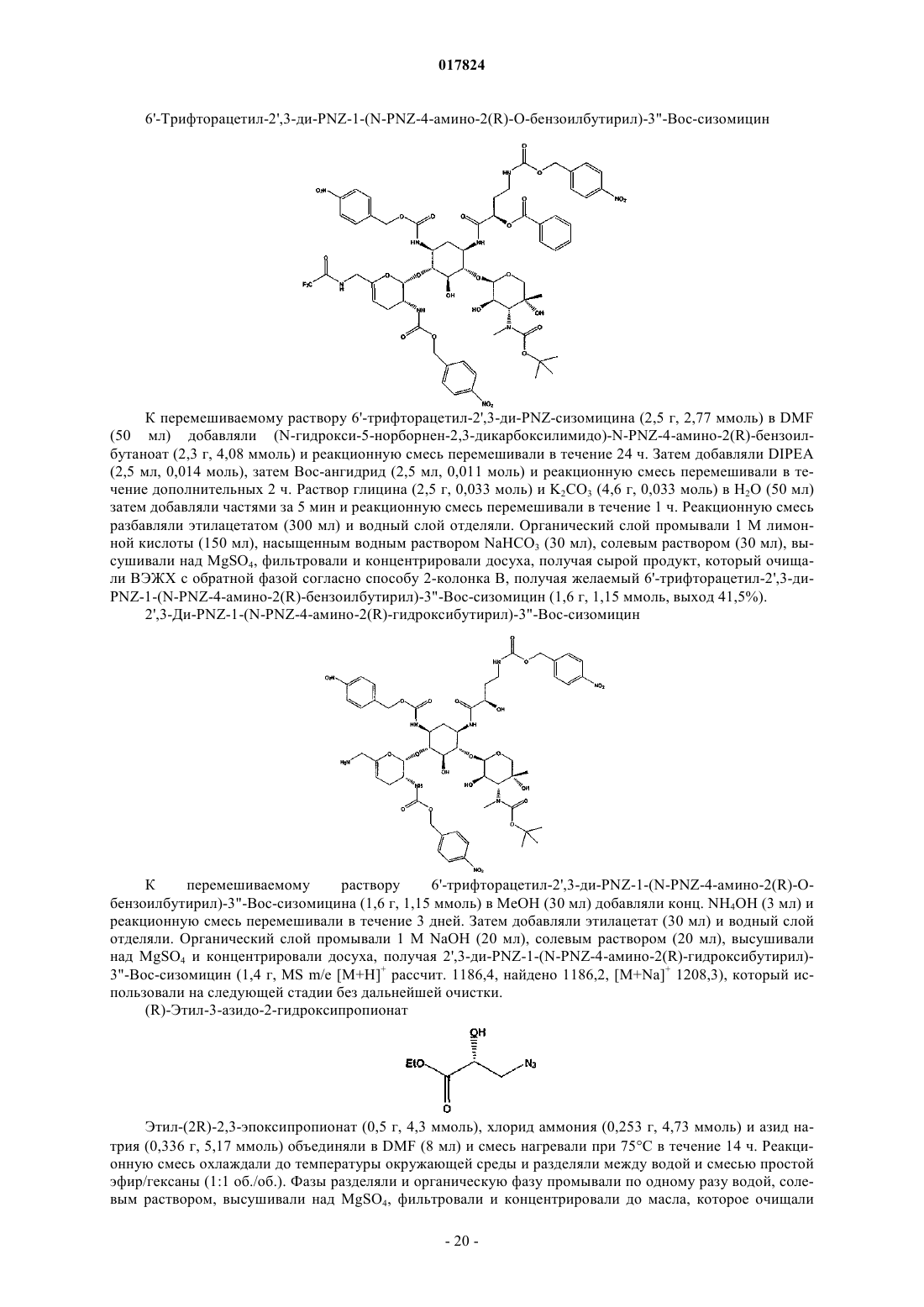
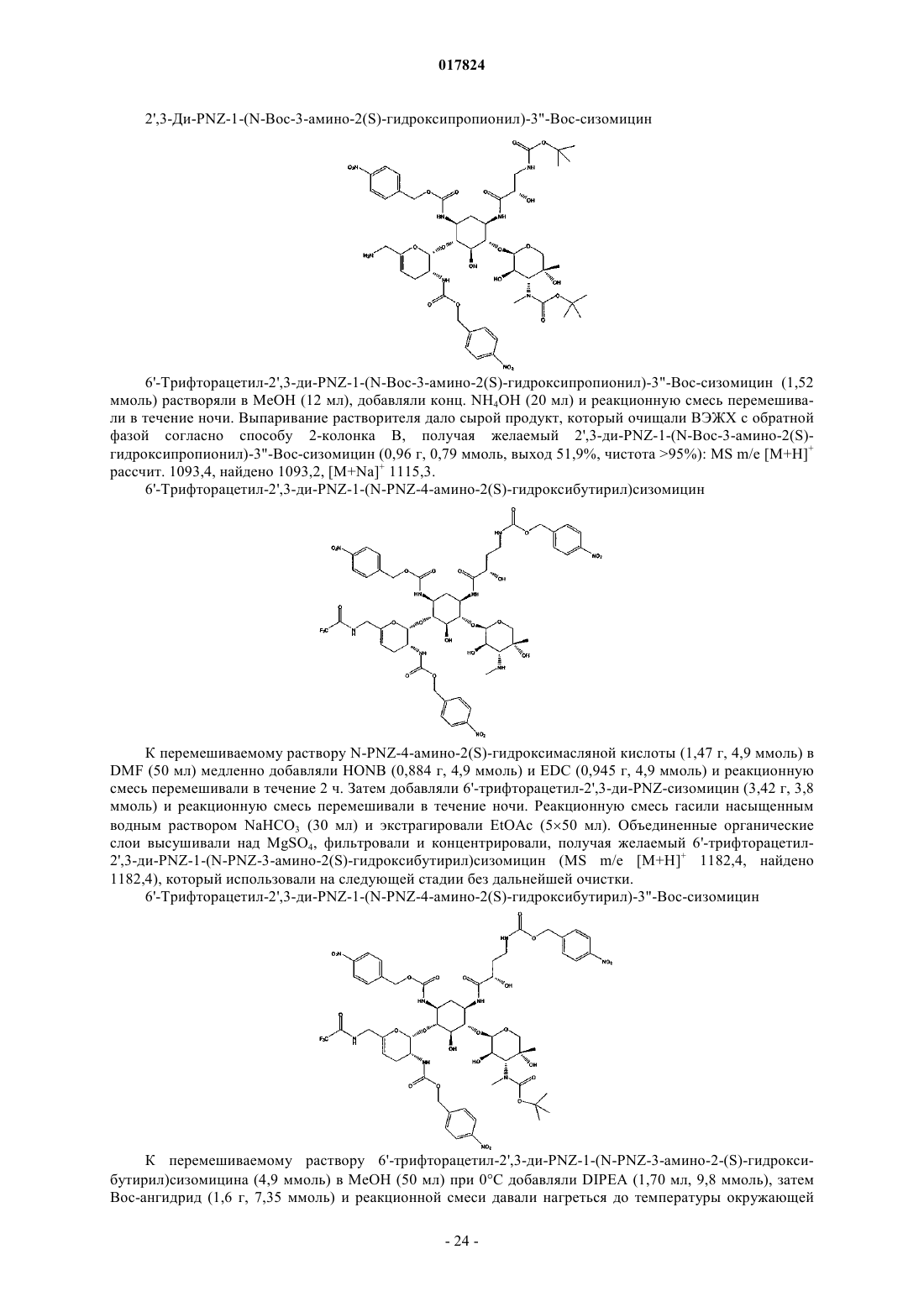
Антибактериальные аналоги аминогликозида
Номер патента: 17824
Опубликовано: 29.03.2013
Авторы: Голдблум Адам Аарон, Эгжен Джеймс, Линселл Мартин, Доззо Паола, Моузер Хейнц Эрнст, Хилдебрандт Дарин, Глидт Миках
Формула / Реферат
1. Соединение, имеющее следующую структуру (I):
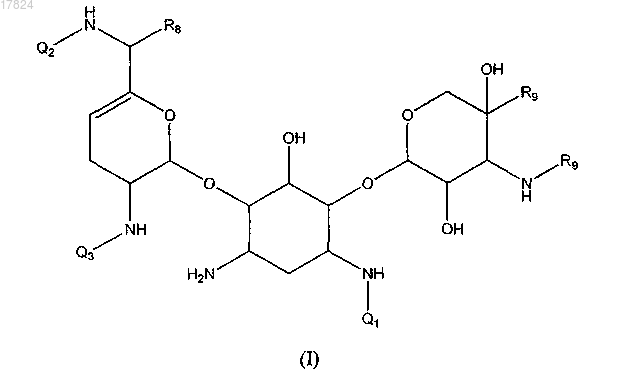
или его стереоизомер или фармацевтически приемлемая соль,
в которой Q1 обозначает водород,
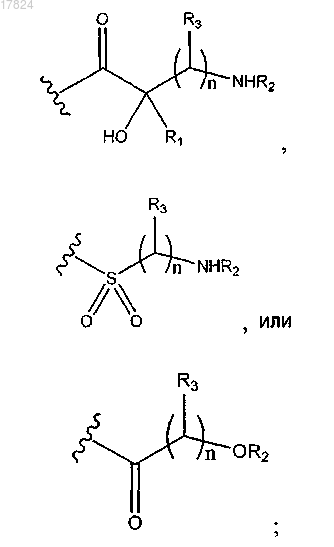
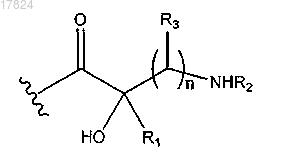
Q2 обозначает водород, -(CR10R11)pR12; -С1-С6-алкил-С3-С10-циклоалкил, в случае необходимости замещенный амино, гидроксилом или -С1-алкиламино; -C1-C6-алкил-С4-С6-гетероциклилалкил, в котором гетероатом представляет собой N, в случае необходимости замещенный гидроксилом, амино или -C1-С6-алкилом; -C(=NH)NR4R5; или
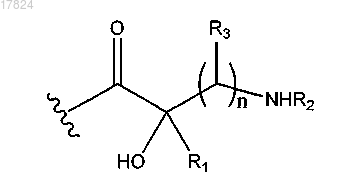
Q3 обозначает водород,-(CR10R11)pR12; -С1-С6-алкил-С3-C10-циклоалкил, в случае необходимости замещенный амино или гидроксилом; -С1-С6-алкил-С4-С6-гетероциклилалкил, в котором гетероатом представляет собой N, в случае необходимости замещенный гидроксилом или амино; С4-С6-гетероциклилалкил, в котором гетероатом представляет собой N; -C(=NH)NR4R5,
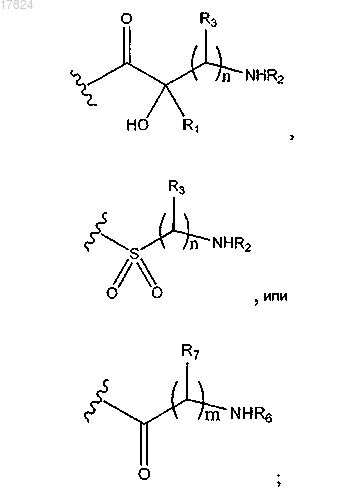
каждый R1, R2, R3, R4, R5, R8 и R10, независимо, обозначают водород или C1-C6-алкил, или R1 и R2 вместе с атомами, к которым они присоединены, могут образовывать С4-С6-гетероциклоалкил, в котором гетероатом представляет собой N, или R2 и R3 вместе с атомами, к которым они присоединены, могут образовывать С4-С6-гетероциклилалкил, в котором гетероатом представляет собой N, или R1 и R3 вместе с атомами, к которым они присоединены, могут образовывать С4-С6-циклоалкил;
каждый R6 и R7, независимо, обозначает водород или C1-C6-алкил или R6 и R7 вместе с атомами, к которым они присоединены, могут образовывать гетероциклическое кольцо, имеющее от 4 до 6 кольцевых атомов;
каждый R9, независимо, обозначает водород или метил;
каждый R11, независимо, обозначает водород, гидроксил, амино или C1-С6-алкил;
каждый R12, независимо, обозначает гидроксил или амино;
каждый n, независимо, означает целое число от 0 до 4;
каждый m, независимо, означает целое число от 0 до 4;
каждый p, независимо, означает целое число от 1 до 5,
в которой (i) по меньшей мере два из Q1, Q2 и Q3 отличаются от водорода и (ii) если Q1 обозначает водород, то по меньшей мере один из Q2 и Q3 обозначает -C(=NH)NR4R5.
2. Соединение по п.1, в котором R8 обозначает водород.
3. Соединение по п.1 или 2, в котором каждый R9 обозначает метил.
4. Соединение по любому из пп.1-3, в котором Q1 и Q2 отличаются от водорода.
5. Соединение по п.4, в котором Q3 обозначает водород.
6. Соединение по п.4 или 5, в котором Q1 обозначает
где R1 обозначает водород;
R2 обозначает водород;
каждый R3 обозначает водород.
7. Соединение по п.6, в котором Q1 обозначает

8. Соединение по п.4 или 5, в котором Q1 обозначает
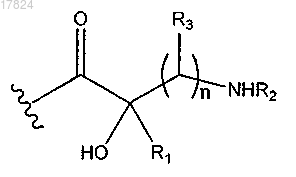
где R1 обозначает водород;
R2 и R3 вместе с атомами, к которым они присоединены, образуют С4-С6-гетероциклилалкил, в котором гетероатом представляет собой N.
9. Соединение по п.4 или 5, в котором Q1 обозначает
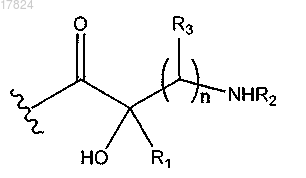
где R3 обозначает водород;
R1 и R2 вместе с атомами, к которым они присоединены, образуют С4-С6-гетероциклилалкил, в котором гетероатом представляет собой N.
10. Соединение по п.4 или 5, в котором Q1 обозначает
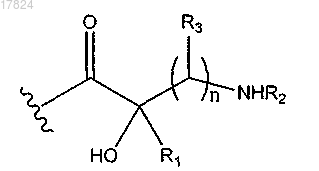
где R2 обозначает водород;
R1 и R3 вместе с атомами, к которым они присоединены, образуют С4-С6-циклоалкил.
11. Соединение по п.4 или 5, в котором Q1 обозначает
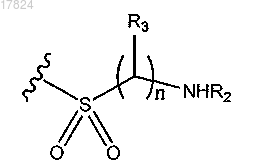
где R2 обозначает водород;
каждый R3 обозначает водород.
12. Соединение по п.4 или 5, в котором Q1 обозначает
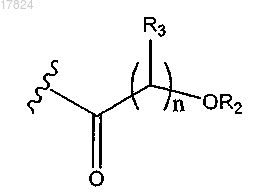
где R2 обозначает водород;
каждый R3 обозначает водород.
13. Соединение по любому из пп.4-12, в котором Q2 обозначает -(CR10R11)pR12.
14. Соединение по п.13, в котором каждый R10 обозначает водород.
15. Соединение по п.14, в котором каждый R11 обозначает водород.
16. Соединение по любому из пп.4-12, в котором Q2 обозначает -C1-C6-алкил-C3-C10-циклоалкил, в случае необходимости замещенный амино, гидроксилом или -С1-алкиламино.
17. Соединение по любому из пп.4-12, в котором Q2 обозначает -С1-С6-алкил-С4-С6-гетероциклилалкил, в котором гетероатом представляет собой N, в случае необходимости замещенный гидроксилом, амино или
-С1-С6-алкилом.
18. Соединение по п.4, в котором соединение представляет собой
6'-(2-гидроксиэтил)-1-(4-амино-2(S)-гидроксибутирил)сизомицин;
6'-(2-гидроксиэтил)-1-(4-амино-2(R)-гидроксибутирил)сизомицин;
6'-(2-гидроксипропанол)-1-(4-амино-2(R)-гидроксибутирил)сизомицин;
6'-(метилпиперидин-4-ил)-1-(4-амино-2(R)-гидроксибутирил)сизомицин;
6'-(метилциклопропил)-1-(4-амино-2(R)-гидроксибутирил)сизомицин;
6'-(3-аминопропил)-1-(4-амино-2(R)-гидроксибутирил)сизомицин;
6'-метилциклопропил-1-(3-амино-2(R)-гидроксипропионил)сизомицин;
6'-метилпиперидинил-1-(3-амино-2(R)-гидроксипропионил)сизомицин;
6'-(2-гидроксиэтил)-1-(3-амино-2(R)-гидроксипропионил)сизомицин;
6'-(2-гидроксипропанол)-1-(3-амино-2(R)-гидроксипропионил)сизомицин;
6'-(3-аминопропил)-1-(3-амино-2(R)-гидроксипропионил)сизомицин;
6'-(метилпиперидин-4-ил)-1-(4-амино-2(S)-гидроксибутирил)сизомицин;
6'-(метилциклопропил)-1-(3-амино-2(S)-гидроксипропионил)сизомицин;
6'-(2-гидроксипропанол)-1-(3-амино-2(S)-гидроксипропионил)сизомицин;
6'-(метилпиперидин-4-ил)-1-(3-амино-2(S)-гидроксипропионил)сизомицин;
6'-(2-гидроксиэтил)-1-(3-амино-2(S)-гидроксипропионил)сизомицин;
6'-(3-аминопропил)-1-(3-амино-2(S)-гидроксипропионил)сизомицин;
6'-(метилциклопропил)-1-(4-амино-2(S)-гидроксибутирил)сизомицин;
6'-(2-гидроксипропанол)-1-(4-амино-2(S)-гидроксибутирил)сизомицин;
6'-(3-амино-2-гидроксипропил)-1-(3-амино-2(S)-гидроксипропионил)сизомицин;
6'-(2-гидроксиэтил)-1-(2-гидроксиацетил)сизомицин;
6'-(3-аминопропил)-1-(2-аминоэтилсульфонамид)сизомицин;
6'-(2-гидроксипропанол)-1-(2-аминоэтилсульфонамид)сизомицин;
6'-(2(S)-гидроксипропанол)-1-(4-амино-2(S)-гидроксибутирил)сизомицин;
6'-(2-гидроксиэтил)-1-(2-аминоэтилсульфонамид)сизомицин;
6'-(метил-транс-3-аминоциклобутил)-1-(4-амино-2(S)-гидроксибутирил)сизомицин;
6'-(2-гидроксиэтил)-1-(3-гидроксипирролидин-3-илацетил)сизомицин;
6'-(2-гидрокси-4-аминобутил)-1-(3-гидроксипирролидин-3-илацетил)сизомицин;
6'-(метилциклопропил)-1-(3-гидроксиазетидин-3-илацетил)сизомицин;
6'-(2-гидроксиэтил)-1-(3-гидроксиазетидин-3-илацетил)сизомицин;
6'-(метил-(1-гидрокси-3-метиламиноциклобутил)-1-(4-амино-2(S)-гидроксибутирил)сизомицин;
6'-(3-аминопропил)-1-(3-гидроксипирролидин-3-илацетил)сизомицин;
6'-(метилциклопропил)-1-(3-гидроксипирролидин-3-илацетил)сизомицин;
6'-(2-гидрокси-3-аминопропил)-1-(3-гидроксипирролидин-3-илацетил)сизомицин;
6'-(3-аминопропил)-1-(4-амино-2(S)-гидроксибутирил)сизомицин;
6'-(метилпирролидин-2-ил)-1-(4-амино-2(S)-гидроксибутирил)сизомицин;
6'-(3-аминопропил)-1-(3-гидроксиазетидин-3-илацетил)сизомицин;
6'-(3-аминопропил)-1-(1-гидрокси-3-аминоциклобутилацетил)сизомицин;
6'-(метил-транс-3-аминоциклобутил)-1-(3-амино-2(S)-гидроксипропионил)сизомицин;
6'-(метил-транс-3-аминоциклобутил)-1-(1-гидрокси-3-аминоциклобутилацетил)сизомицин;
6'-(2-гидроксиэтил)-1-(1-гидрокси-3-аминоциклобутилацетил)сизомицин;
6'-метилциклопропил-1-(2-(азетидин-3-ил)-2-гидроксиацетил)сизомицин;
6'-(метил-транс-3-аминоциклобутил)-1-(2-(азетидин-3-ил)-2-гидроксиацетил)сизомицин;
6'-(2-гидроксиэтил)-1-(2-(азетидин-3-ил)-2-гидроксиацетил)сизомицин;
6'-(3-аминопропил)-1-(2-(азетидин-3-ил)-2-гидроксиацетил)сизомицин;
6'-(метил-транс-3-аминоциклобутил)-1-(3-гидроксипирролидин-3-илацетил)сизомицин;
6'-(2-гидрокси-3-аминопропил)-1-(2-(азетидин-3-ил)-2-гидроксиацетил)сизомицин или
6'-(метил-3-амино-1-гидроксициклобутил)-1-(2-(азетидин-3-ил)-2-гидроксиацетил)сизомицин.
19. Соединение по любому из пп.1-3, в котором Q1 и Q3 отличаются от водорода.
20. Соединение по п.19, в котором Q2 обозначает водород.
21. Соединение по любому из пп.1-3, в котором Q2 и Q3 отличаются от водорода.
22. Соединение по п.21, в котором Q1 обозначает водород.
23. Соединение по п.4, представляющее собой 6'-(2-гидроксиэтил)-1-(4-амино-2(S)-гидроксибутирил)сизомицин.
24. Способ лечения бактериальной инфекции у млекопитающего, включающий введение млекопитающему эффективного количества соединения по любому из пп.1-23.
Текст
В изобретении раскрыты соединения структуры (I) имеющие антибактериальную активность, включая их стереоизомеры, фармацевтически приемлемые соли и пролекарства, в которых Q1, Q2, Q3, R8 и R9 имеют определенные здесь значения. Также раскрыты способы, связанные с получением и применением таких соединений, а также фармацевтические композиции, содержащие такие соединения. Перекрестная ссылка на родственные заявки По этой заявке на основании 35 U.S.С.119(е) испрашивается приоритет временной заявки на патент США 60/989645, поданной 21 ноября 2007, которая полностью включена в настоящее описание путем ссылки. Уровень техники Область. Настоящее изобретение относится к новым соединениям аминогликозида, более конкретно, новым производным сизомицина и к способам их получения и применения в качестве терапевтических или профилактических средств. Описание связанного уровня техники. Особый интерес в области открытия лекарственных средств представляет в наше время разработка новых низкомолекулярных перорально-биодоступных лекарственных средств, которые действуют, связываясь с РНК. Считалось, что РНК, которая служит посредником между ДНК и белками, является полностью гибкой молекулой без значительной структурной сложности. Недавние исследования раскрыли удивительную сложность структуры РНК. РНК имеет структурную сложность, сравнимую с белками, а не простые звенья, как ДНК. Секвенирование генома раскрывает последовательности как белков, так и мРНК, которые их кодируют. Так как белки синтезируются с использованием матрицы РНК, такие белки могут ингибироваться путем предотвращения их продукции в первую очередь на уровне трансляции мРНК. Поскольку как белки, так и РНК представляют собой потенциальные сайты нацеливания лекарственного средства, число мишеней, определяемых в результате секвенирования генома, фактически удваивается. Эти наблюдения открывают новый мир возможностей для фармацевтической промышленности, позволяя нацеливать на РНК малые молекулы. В традиционной области открытия лекарственных средств усилия фокусировались на белках как мишенях для вмешательства. Белки может быть чрезвычайно трудно выделить и очистить в подходящей форме для использования в тестах по скринингу лекарственных средств. Многие белки требуют посттрансляционных модификаций, которые происходят только в определенных типах клеток в определенных условиях. Белки складываются в шаровидные домены с гидрофобными ядрами и гидрофильными и заряженными группами на поверхности. Множественные субъединицы часто формируют комплексы, что может требоваться для эффективного скрининга лекарственных средств. Мембранные белки обычно должны быть встроены в мембрану, чтобы сохранить присущую им форму. Наименьшая практическая единица белка, которая может использоваться в скрининге лекарственных средств, представляет собой шаровидный домен. Понятие удаления единственной альфа-спирали или поворота бета-листа и ее использования в скрининге лекарственных средств не используется на практике, так как только интактный белок может иметь адекватную 3-мерную форму для связывания лекарственного средства. Получение биологически активных белков для скрининга является главным ограничением в классическом высокопроизводительном скрининге. Весьма часто ограничивающим реагентом в высокопроизводительном скрининге является биологически активная форма белка, которая может также быть весьма дорогой. Для скрининга в целях обнаружить соединения, которые связываются с РНК-мишенями, классические подходы, используемые для белков, можно заменить новыми подходами. Все РНК, по существу,эквивалентны в отношении их растворимости, легкости синтеза или использования в тестах. Физические свойства РНК независимы от белка, который они кодируют. Они могут быть легко получены в большом количестве как химическим, так и ферментативным синтезом и экстенсивно не модифицируются in vivo. В случае РНК, наименьшая практическая единица для связывания лекарственного средства представляет собой функциональный субдомен. Функциональный субдомен в РНК представляет собой фрагмент, который, при его удалении из большей РНК и изолированном изучении, сохраняет ее биологически релевантную форму и свойства в отношении связывания с белком или РНК. Размер и состав функциональных субдоменов РНК делают их доступными путем ферментативного или химического синтеза. Специалисты в области структурной биологии накопили значительный опыт в идентификации функциональных субдоменов РНК, что облегчает структурные исследования такими методиками, как ЯМР-спектроскопия. Например, малые аналоги декодирующей области 16S рРНК (А-участок) были идентифицированы как содержащие только существенную область, и было показано, что они связываются с антибиотиками тем же самым способом, как интактная рибосома. Связывающие участки на РНК являются гидрофильными и относительно открытыми по сравнению с белками. Потенциал для распознавания малой молекулы, основанного на форме, усиливается за счет способности РНК подвергаться деформации. Связывание молекул со специфической РНК-мишенью может быть определено общей конформацией и распределением заряженных, ароматических групп и групп, образующих водородные связи, относительно твердого скелета. Считается, что правильно расположенные положительные заряды являются важными, так как долгосрочные электростатические взаимодействия могут использоваться для направления молекул в связывающий карман с правильной ориентацией. В структурах с открытыми нуклеобазами накладывающиеся взаимодействия с ароматическими функциональными группами могут способствовать связывающему взаимодействию. Большая борозда РНК содержит множество участков для специфического связывания через водородные связи с лигандом. Они включают ароматические атомы азота N7 аденозина и гуанозина, атомы кислорода О 4 и О 6 уридина и гуанозина и амины аденозина и цитидина. Богатое структурное разнообразие и разнообразие последовательности РНК позволяет сделать предположение, что лиганды могут быть получены с высоким сродством и специфичностью к их мишени. Хотя наше понимание структуры и фолдинга РНК, а также процессов распознавания РНК другими лигандами далеко от всестороннего, в прошлое десятилетие был достигнут значительный прогресс (см.,например, Chow, С.S.; Bogdan, F.M., Chem. Rev., 1997, 97, 1489 and Wallis, M.G.; Schroeder, R., Prog. Biophys. Molec. Biol. 1997, 67, 141). Несмотря на центральную роль РНК в репликации у бактерий, не хватает лекарственных средств, мишенями которых являются эти стержневые участки РНК этих патогенов. Увеличивающаяся проблема резистентности бактерий к антибиотикам делает поиск новых агентов, связывающих РНК, критически важным. Некоторые малые молекулы могут связываться с РНК и блокировать их существенные функции. Примеры таких молекул включают аминогликозидные антибиотики и такие лекарственные средства, как эритромицин, который связывается с бактериальной рРНК и высвобождает пептидил-тРНК и мРНК. Аминогликозидные антибиотики, как давно известно, связываются с РНК. Они проявляют свои антибактериальные эффекты, связываясь с определенными целевыми участками в бактериальной рибосоме. Для структурно связанных антибиотиков неамина, рибостамицина, неомицина В и паромомицина, связывающий участок локализован в А-участке декодирующей области РНК прокариотических рибосом (см.Moazed, D.; Noller, H.F., Nature, 1987, 327, 389). Связывание аминогликозидов с этой РНК-мишенью нарушает точность трансляции мРНК и приводит к неправильному кодированию и усечению, и в конечном счете к гибели бактериальной клетки (см. Alper, Р.В.; Hendrix, М.; Sears, P.; Wong, С., J Am. Chem. Soc.,1998, 120, 1965). Существует потребность в новых химических соединениях, которые обладали бы антибактериальной активностью широкого спектра. Возможно самой важной задачей в обнаружении связывающихся с РНК антибактериальных лекарственных средств является идентификация витальных структур, общие для бактерий, которые могут быть повреждены в результате связывания с лекарственным средством,представляющим собой малую молекулу. Задачей в нацеливании малых молекул на РНК является разработка химической стратегии распознавания определенных форм РНК. Существуют три набора данных,которые подсказывают, как это сделать: естественные взаимодействия белка с РНК, натуральные антибиотики, которые связываются с РНК, и искусственные РНК (аптамеры), которые связываются с белками и другими молекулами. Каждый из этих наборов данных, однако, дает свое понимание проблемы. Было показано, что несколько классов лекарственных средств, полученных из естественных источников, действуют, связываясь с РНК или комплексом РНК/белок. Они включают три различных структурных класса антибиотиков: тиострептон, аминогликозидное семейство и макролидное семейство антибиотиков. Эти примеры предоставляют ключи к пониманию того, как малые молекулы и мишени могли бы быть выбраны. Природа выбрала РНК-мишени в рибосоме, одной из самых древних и консервативных мишеней у бактерий. Так как желательно, чтобы антибактериальные лекарственные средства были мощными и имели широкий спектр активности, эти древние процессы, фундаментальные для всей жизни бактерий, представляют собой привлекательные мишени. Чем ближе мы подбираемся к древним консервативным функциям, тем более вероятно мы можем найти высококонсервативные формы РНК. Важно также рассмотреть форму эквивалентной структуры у человека, так как бактерии вряд ли учитывали терапевтический индекс их РНК при эволюции. Существует большое число натуральных антибиотиков, они включают аминогликозиды, такие как кирромицин, неомицин, паромомицин, тиострептон и многие другие. Они представляют собой очень мощные бактерицидные соединения, которые связываются с РНК малой субъединицы рибосомы. Бактерицидное действие опосредуется связыванием с бактериальной РНК таким образом, что это приводит к неправильному считыванию генетического кода. Считается, что неправильное считывание кода в ходе трансляции мембранных белков приводит к синтезу патологических белков, которые ставят под угрозу барьерные свойства бактериальной мембраны. Антибиотики представляют собой химические вещества, продуцируемые различными видами микроорганизмов (бактерии, грибы, актиномицеты), которые подавляют рост других микроорганизмов и могут в конечном счете разрушать их. Однако в обиходе термин "антибиотики" также включает синтетические антибактериальные агенты, такие как сульфонамиды и хинолины, которые не являются продуктами микроорганизмов. Число антибиотиков, которые были идентифицированы к настоящему времени,составляет сотни, и многие из них были разработаны до такой степени, на которой они могут использоваться в терапии инфекционных заболеваний. Антибиотики заметно различаются по физическим, химическим и фармакологическим свойствам, антибактериальным спектрам и механизмам действия. В последние годы результаты изучения молекулярных механизмов репликации бактерий, грибов и вирусов значительно облегчило рациональную разработку соединений, которые могут нарушать жизненные циклы этих микроорганизмов. По меньшей мере 30% всех госпитализированных пациентов теперь получают один или более кур-2 017824 сов терапии с антибиотиками, и миллионы потенциально фатальных инфекций были вылечены. В то же самое время эти фармацевтические средства оказались среди наиболее неправильно используемых из доступных для практикующего врача. Одним из результатов широко распространенного использования антибактериальных агентов было появление резистентных к антибиотикам патогенов, которое, в свою очередь, спровоцировало постоянно увеличивающуюся потребность в новых лекарственных средствах. Многие из этих средств также значительно способствовали увеличению стоимости медицинского обслуживания. При первом тестировании противомикробной активности нового средства обычно определяется структура чувствительности и резистентности. К сожалению, этот спектр активности может впоследствии в значительной степени измениться, поскольку микроорганизмы эволюционируют множеством изобретательных путей, обсуждаемых выше, что позволяет им выживать в присутствии антибиотиков. Механизм лекарственной резистентности варьирует от микроорганизма к микроорганизму и от лекарственного средства к лекарственному средству. Развитие резистентности к антибиотикам обычно включает стабильное генетическое изменение, наследуемое от поколения к поколению. Может функционировать любой из механизмов, которые приводят к изменению состава генома бактерий. Хотя причиной часто является мутация, резистентность к антибактериальным агентам может быть приобретена через передачу генетического материала от одной бактерии к другой путем трансдукции, трансформации или конъюгации. По вышеописанным причинам, несмотря на достигнутые в этой области успехи, существует потребность в новых химических соединениях, которые обладали бы антибактериальной активностью. Кроме того, чтобы ускорить процесс открытия лекарственных средств, необходимы новые способы синтеза аминогликозидных антибиотиков для получения множества соединений, которые были бы потенциальными новыми лекарственными средствами для лечения бактериальных инфекций. Настоящее изобретение отвечает этим потребностям и обеспечивает связанные с этим преимущества. Краткое описание изобретения Коротко говоря, настоящее изобретение относится к новым соединениям аминогликозида, более конкретно, к новым производным сизомицина, имеющим антибактериальную активность, включая их стереоизомеры, фармацевтически приемлемые соли и пролекарства, и к применению таких соединений в лечении бактериальных инфекций. В одном варианте осуществления изобретение относится к соединениям, имеющим следующую структуру (I): или к их стереоизомеру или фармацевтически приемлемой соли, в которой мещенный амино, гидроксилом или -С 1 алкиламино; -С 1-С 6-алкил-C4-C6-гетероциклилалкил, в котором гетероатом представляет собой N, в случае необходимости замещенный гидроксилом, амино или -C1-C6 алкилом; -C(=NH)NR4R5; илиQ3 обозначает водород, -(CR10R11)pR12; -С 1-С 6-алкил-C3-С 10-циклоалкил, в случае необходимости замещенный амино или гидроксилом; -С 1-С 6-алкил-С 4-С 6-гетероциклилалкил, в котором гетероатом представляет собой N, в случае необходимости замещенный гидроксилом или амино; C4-C6 гетероциклилалкил, в котором гетероатом представляет собой N; -C(=NH)NR4R5, каждый R1, R2, R3, R4, R5, R8 и R10, независимо, обозначают водород или C1-C6-алкил, или R1 и R2 вместе с атомами, к которым они присоединены, могут образовывать C4-C6-гетероциклоалкил, в котором гетероатом представляет собой N, или R2 и R3 вместе с атомами, к которым они присоединены, могут образовывать С 4-С 6-гетероциклилалкил, в котором гетероатом представляет собой N, или R1 и R3 вместе с атомами, к которым они присоединены, могут образовывать C4-C6-циклоалкил; каждый R6 и R7, независимо, обозначает водород или C1-C6-алкил или R6 и R7 вместе с атомами, к которым они присоединены, могут образовывать гетероциклическое кольцо, имеющее от 4 до 6 кольцевых атомов; каждый R9, независимо, обозначает водород или метил; каждый R11, независимо, обозначает водород, гидроксил, амино или C1-C6-алкил; каждый R12, независимо, обозначает гидроксил или амино; каждый n, независимо, означает целое число от 0 до 4; каждый m, независимо, означает целое число от 0 до 4; каждый p, независимо, означает целое число от 1 до 5, и в которой (i) по меньшей мере два из Q1, Q2 и Q3 отличаются от водорода и (ii), если Q1 обозначает водород, то по меньшей мере один из Q2 и Q3 обозначает -C(=NH)NR4R5. В другом варианте осуществления изобретение относится к способу применения соединения,имеющего структуру (I) в терапии. В частности, настоящее изобретение относится к способу лечения бактериальной инфекции у млекопитающего, включающему введение млекопитающему эффективного количества соединения, имеющего структуру (I), или его стереоизомера, фармацевтически приемлемой соли или пролекарства. Эти и другие аспекты изобретения будут очевидны из следующего подробного описания. Подробное описание В следующем описании сформулированы некоторые специфические детали, чтобы обеспечить полное понимание различных вариантов осуществления изобретения. Однако специалист поймет, что изобретение может быть осуществлено без этих деталей. Если контекст не требует иного, по всему тексту настоящего описания и формулы изобретения слово "содержит" и его варианты, такие как "содержащий", должны быть рассмотрены в открытом, включительном смысле, т.е. как "включая, но не ограничиваясь". В рамках описания указание на "один вариант осуществления" или "вариант осуществления" означает, что особый признак, структура или характеристика, описанные применительно к этому варианту осуществления, включены по меньшей мере в один вариант осуществления настоящего изобретения. Таким образом, появления фраз "в одном варианте осуществления" или "в варианте осуществления" в различных местах настоящего описания не обязательно все относятся к одному и тому же варианту осуществления. Кроме того, особые признаки, структуры или характеристики могут быть скомбинированы любым подходящим образом в одном или более вариантах осуществления. В рамках описания и приложенной формулы изобретения, если не указано иное, следующие термины имеют указанное значение."Алкил" относится к углеводородному радикалу с прямой или разветвленной цепью, состоящей исключительно из атомов углерода и водорода, который является насыщенным или ненасыщенным (то есть содержит одну или более двойных и/или тройных связей), имеющему от одного до двенадцати атомов углерода (C1-C12-алкил), предпочтительно от одного до восьми атомов углерода (C1-C8-алкил) или от одного до шести атомов углерода (C1-C6-алкил), и который присоединен к остальной части молекулы простой связью, например метил, этил, н-пропил, 1-метилэтил (изопропил), н-бутил, н-пентил, 1,1 диметилэтил (трет-бутил), 3-метилгексил, 2-метилгексил, этенил, проп-1-енил, бут-1-енил, пент-1-енил,пента-1,4-диенил, этинил, пропинил, бутинил, пентинил, гексинил и т.п. Если в описании специально не указано иное, алкильная группа может быть замещена."Алкилен" или "алкиленовая цепь" относится к прямой или разветвленной двухвалентной углеводородной цепи, связывающей остальную часть молекулы с радикальной группой, состоящей исключительно из углерода и водорода, которая является насыщенной или ненасыщенной (то есть содержит одну или более двойных и/или тройных связей), и имеющей от одного до двенадцати атомов углерода, например метилен, этилен, пропилен, трет-бутилен, этенилен, пропенилен, н-бутенилен, пропинилен, нбутинилен и т.п. Алкиленовая цепь присоединена к остальной части молекулы простой или двойной связью и к радикальной группе - простой или двойной связью. Точками присоединения алкиленовой цепи к остальной части молекулы и к радикальной группе могут быть один углерод или любые два углерода в пределах цепи. Если в описании специально не указано иное, алкиленовая цепь может быть замещена."Алкокси" относится к радикалу формулы -ORa, где Ra обозначает алкильный радикал, как определено выше, содержащий от одного до двенадцати атомов углерода. Если в описании специально не указано иное, алкоксигруппа может быть замещена."Алкиламино" относится к радикалу формулы -NHRa или -NRaRa, где каждый Ra, независимо, обозначает алкильный радикал, как определено выше, содержащий от одного до двенадцати атомов углерода. Если в описании специально не указано иное, алкиламиногруппа может быть замещена."Тиоалкил" относится к радикалу формулы -SRa, где Ra обозначает алкильный радикал, как определено выше, содержащий от одного до двенадцати атомов углерода. Если в описании специально не указано иное, тиоалкильная группа может быть замещена."Арил" относится к кольцевому углеводородному радикалу, содержащему водород, от 6 до 18 атомов углерода и по меньшей мере одно ароматическое кольцо. В целях этого изобретения арильный радикал может быть моноциклической, бициклической, трициклической или тетрациклической кольцевой системой, которая может включать конденсированные или соединенные мостиковой связью кольцевые системы. Арильные радикалы включают, но не ограничены ими, арильные радикалы, полученные из ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, кризола, флуорантена, флуорена, as-индацена, s-индацена, индана, индена, нафталина, феналена, фенантрена, плеядена, пирена и трифенилена. Если в описании специально не указано иное, термин "арил" или приставка "Ar-" (такая как в"аралкиле") включает арильные радикалы, которые могут быть замещены."Аралкил" относится к радикалу формулы -Rb-Rc, где Rb обозначает алкиленовую цепь, как определено выше, и Rc обозначает один или более арильных радикалов, как определено выше, например бензил,дифенилметил и т.п. Если в описании специально не указано иное, аралкильная группа может быть замещена."Циклоалкил" или "карбоциклическое кольцо" относится к стабильному неароматическому моноциклическому или полициклическому углеводородному радикалу, состоящему исключительно из атомов углерода и водорода, которые могут включать конденсированные или соединенные мостиковой связью кольцевые системы, имеющие от 3 до 15 атомов углерода, предпочтительно имеющие от 3 до 10 атомов углерода, и которые являются насыщенными или ненасыщенными и присоединены к остальной части молекулы простой связью. Моноциклические радикалы включают, например, циклопропил, циклобутил,циклопентил, циклогексил, циклогептил и циклооктил. Полициклические радикалы включают, например, адамантил, норборнил, декалинил, 7,7-диметил-бицикло[2.2.1]гептанил и т.п. Если в описании специально не указано иное, циклоалкильная группа может быть замещена."Циклоалкилалкил" относится к радикалу формулы -RbRd, где Rb обозначает алкиленовую цепь, как определено выше, и Rd обозначает циклоалкильный радикал, как определено выше. Если в описании специально не указано иное, циклоалкилалкильная группа может быть замещена. нена к существующей кольцевой структуре в соединениях по изобретению. Когда конденсированное кольцо является гетероциклильным кольцом или гетероарильным кольцом, любой атом углерода на существующей кольцевой структуре, которая становится частью конденсированного гетероциклильного кольца, или конденсированного гетероарильного кольца, может быть заменено атомом азота."Галогеналкил" относится к алкильному радикалу, как определено выше, который замещен одним или более атомами галогена, как определено выше, например трифторметил, дифторметил, трихлорметил, 2,2,2-трифторэтил, 1,2-дифторэтил, 3-бром-2-фторпропил, 1,2-дибромэтил и т.п. Если в описании специально не указано иное, галогеналкильная группа может быть замещена."Гетероциклил" или "гетероциклическое кольцо" относится к стабильному 3-18-членному неароматическому кольцевому радикалу, который состоит из двух-двенадцати атомов углерода и от одного до шести гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы. Если в описании специально не указано иное, гетероциклильный радикал может быть моноциклической, бициклической,трициклической или тетрациклической кольцевой системой, которая может включать конденсированные или соединенные мостиковой связью кольцевые системы; и атомы азота, углерода или серы в гетероциклильном радикале могут быть окислены; атом азота может быть в случае необходимости кватернизован и гетероциклильный радикал может быть частично или полностью насыщен. Примеры таких гетероциклильных радикалов включают, но не ограничены ими, диоксоланил, тиенил[1,3]дитианил, декагидроизохинолил, имидазолинил, имидазолидинил, изотиазолидинил, изоксазолидинил, морфолинил, октагидроиндолил, октагидроизоиндолил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, оксазолидинил, пиперидинил, пиперазинил, 4-пиперидонил, пирролидинил, пиразолидинил, хинуклидинил,тиазолидинил, тетрагидрофурил, тритианил, тетрагидропиранил, тиоморфолинил, тиаморфолинил, 1 оксотиоморфолинил, и 1,1-диоксотиоморфолинил. Если в описании специально не указано иное, гетероциклильная группа может быть замещена."N-гетероциклил" относится к гетероциклильному радикалу, как определено выше, содержащему по меньшей мере один атом азота, и где точкой присоединения гетероциклильного радикала к остальной части молекулы является атом азота в гетероциклильном радикале. Если в описании специально не указано иное, N-гетероциклильная группа может быть замещена."Гетероциклилалкил" относится к радикалу формулы -RbRe, где Rb обозначает алкиленовую цепь,как определено выше, и Re обозначает гетероциклильный радикал, как определено выше, и если гетероциклил представляет собой азотсодержащий гетероциклил, гетероциклил может быть присоединен к алкильному радикалу на атоме азота. Если в описании специально не указано иное, гетероциклилалкильная группа может быть замещена."Гетероарил" относится к 5-14-членному кольцевому радикалу, включающему атомы водорода, от одного до тринадцати атомов углерода, от одного до шести гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, и по меньшей мере одно ароматическое кольцо. В целях этого изобретения гетероарильный радикал может быть моноциклической, бициклической, трициклической или тетрациклической кольцевой системой, которая может включать конденсированные или соединенные мостиковой связью кольцевые системы; и атомы азота, углерода или серы в гетероарильном могут быть окислены; атом азота может быть кватернизован. Примеры включают, но не ограничены ими, азепинил,акридинил, бензимидазолил, бензотиазолил, бензиндолил, бензодиоксолил, бензофуранил, бензооксазолил, бензотиазолил, бензотиадиазолил, бензо[6][1,4]диоксепинил, 1,4-бензодиоксанил, бензонафтофуранил, бензоксазолил, бензодиоксолил, бензодиоксинил, бензопиранил, бензопиранонил, бензофуранил,бензофуранонил, бензотиенил (бензотиофенил), бензотриазолил, бензо[4,6]имидазо[1,2-a]пиридинил,карбазолил, циннолинил, дибензофуранил, дибензотиофенил, фуранил, фуранонил, изотиазолил, имидазолил, индазолил, индолил, индазолил, изоиндолил, индолинил, изоиндолинил, изохинолил, индолизинил, изоксазолил, нафтиридинил, оксадиазолил, 2-оксоазепинил, оксазолил, оксиранил, 1 оксидопиридинил, 1-оксидопиримидинил, 1-оксидопиразинил, 1-оксидопиридазинил, 1-фенил-1Hпирролил, феназинил, фенотиазинил, феноксазинил, фталазинил, птеридинил, пуринил, пирролил, пиразолил, пиридинил, пиразинил, пиримидинил, пиридазинил, хиназолинил, хиноксалинил, хинолинил, хинуклидинил, изохинолинил, тетрагидрохинолинил, тиазолил, тиадиазолил, триазолил, тетразолил, триазинил и тиофенил (то есть тиенил). Если в описании специально не указано иное, гетероарильная группа может быть замещена."N-гетероарил" относится к гетероарильному радикалу, как определено выше, содержащему по меньшей мере один атом азота, и где точкой присоединения гетероарильного радикала к остальной части молекулы является атом азота в гетероарильном радикале. Если в описании специально не указано иное,N-гетероарильная группа может быть замещена."Гетероарилалкил" относится к радикалу формулы -RbRf, где Rb обозначает алкиленовую цепь, как определено выше, и Rf обозначает гетероарильный радикал, как определено выше. Если в описании специально не указано иное, гетероарилалкильная группа может быть замещена. Термин "замещенный", используемый здесь, означает любую из вышеуказанных групп (то есть алкил, алкилен, алкокси, алкиламино, тиоалкил, арил, аралкил, циклоалкил, циклоалкилалкил, галогенал-6 017824 кил, гетероциклил, N-гетероциклил, гетероциклилалкил, гетероарил, N-гетероарил и/или гетероарилалкил), в которой по меньшей мере один атом водорода заменен связью с атомами, отличными от водорода, такими как, но не ограничиваясь ими: атом галогена, такой как F, Cl, Br и I; атом кислорода в таких группах, как гидроксильные группы, алкоксигруппы и сложноэфирные группы; атом серы в таких группах, как тиоловые группы, тиоалкильные группы, сульфоновые группы, сульфонильные группы и сульфоксидные группы; атом азота в таких группах, как амины, амиды, алкиламины, диалкиламины, ароматические амины, алкилариламины, диариламины, N-оксиды, имиды и енамины; атом кремния в таких группах, как триалкилсилильные группы, диалкиларилсилильные группы, алкилдиарилсилильные группы и триарилсилильные группы; и другие гетероатомы в различных других группах. "Замещенный" также означает любую из вышеуказанных групп, в которых один или более атомов водорода заменены связью более высокого порядка (например, двойной или тройной связью) с гетероатомом, таким как кислород в оксогруппе, карбонильной, карбоксильной группе и сложноэфирных группах; и азот в таких группах, как имины, оксимы, гидразины и нитрилы. Например, "замещенный" включает любую из вышеуказанных групп, в которых один или более атомов водорода заменены группами -NRgRh, -NRgC(=O)Rh,-NRgC(=O)NRgRh, -NRgC(=O)ORh, -NRgSO2Rh, -OC(=O)NRgRh, -ORg, -SRg, -SORg, -SO2Rg, -OSO2Rg,-SO2ORg, =NSO2Rg и -SO2NRgRh. "Замещенный" также означает любую из вышеуказанных групп, в которых один или более атомов водорода заменены группами -C(=O)Rg, -C(=O)ORg, -C(=O)NRgRh,-CH2SO2Rg, -CH2SO2NRgRh. В вышеуказанных группах Rg и Rh являются одинаковыми или разными и независимо обозначают водород, алкил, алкокси, алкиламино, тиоалкил, арил, аралкил, циклоалкил, циклоалкилалкил, галогеналкил, гетероциклил, N-гетероциклил, гетероциклилалкил, гетероарил, Nгетероарил и/или гетероарилалкил. "Замещенный" также означает любую из вышеуказанных групп, в которых один или более атомов водорода заменены связью с амино, циано, гидроксильной, имино, нитро, оксо, тиоксо, галогеном, алкильной, алкокси, алкиламино, тиоалкильной, арильной, аралкильной,циклоалкильной, циклоалкилалкильной, галогеналкильной, гетероциклильной, N-гетероциклильной, гетероциклилалкильной, гетероарильной, N-гетероарильной и/или гетероарилалкильной группой. Кроме того, каждый из описанных выше заместителей может также быть в случае необходимости замещен одним или более вышеуказанных заместителей. Изобретение, раскрытое здесь, также охватывает все фармацевтически приемлемые соединения структуры (I), изотопно меченные путем замены одного или более атомов атомом, имеющим другую атомную массу или массовое число. Примеры изотопов, которые могут быть включены в раскрытые в настоящем изобретении соединения, включают изотопы водорода, углерода, азота, кислорода, фосфораI, соответственно. Эти меченные изотопом соединения могут быть использованы для определения или измерения эффективности соединений, характеризуя, например, участок или способ действия или связывающее сродство к фармакологически важному участку действия. Некоторые изотопно меченные соединения структуры (I), например, такие, которые включают радиоактивный изотоп, могут быть использованы в исследованиях распределения лекарственного средства и/или субстрата в ткани. Радиоактивные изотопы тритий, то есть 3H, и углерод 14, то есть 14C, являются особенно пригодными для использования с этой целью ввиду легкости их включения и имеющихся средств детекции. Замещение более тяжелыми изотопами, такими как дейтерий, то есть 2H, может предоставить определенные терапевтические преимущества, являющиеся следствием большей метаболической стабильности, например увеличенного периода полураспада in vivo или сниженной требуемой дозы, и следовательно, может быть предпочтительным при некоторых обстоятельствах. Замещение изотопов, испускающих позитроны, таких как 11C, 18F, 15O и 13N, может быть полезным в исследованиях методом позитронно-эмиссионной томографии (ПЭТФ) для того, чтобы исследовать заполнение рецептора субстратом. Изотопно меченные соединения структуры (I) могут в целом быть получены обычными методиками, известными специалисту, или способами, аналогичными описанным в"Примерах получения" и "Примерах", как изложено ниже, с использованием подходящего изотопномеченного реагента вместо немеченного реагента. Изобретение, раскрытое здесь, также охватывает продукты метаболизма раскрытых соединений in vivo. Такие продукты могут образовываться, например,вследствие окисления, восстановления, гидролиза, амидирования, этерификации и т.п. вводимого соединения, прежде всего вследствие ферментативных процессов. Соответственно изобретение включает соединения, полученные способом, включающим введение соединения по изобретению млекопитающему сроком на время, достаточное, получая продукту его метаболизма. Такие продукты обычно идентифицируют, вводя меченное радиоактивным изотопом соединение по изобретению в обнаруживаемой дозе животному, такому как крыса, мышь, морская свинка, обезьяна или человек, оставляя на достаточное для метаболизма время и выделяя его продукты превращения из мочи, крови или других биологических образцов."Стабильное соединение" и "стабильная структура" означают соединение, которое является достаточно устойчивым для выделения с полезной степенью чистоты из реакционной смеси и составление в эффективное терапевтическое средство."Млекопитающее" включает человека и как домашних животных, таких как лабораторные живот-7 017824 ные и домашние животные (например, кошки, собаки, свиньи, рогатый скот, овцы, козы, лошади, кролики), так и недомашних животных, таких как дикие животные, и т.п."Возможно" или "в случае необходимости" означает, что описанный случай может иметь место или может не иметь места, и что описание включает ситуации, где указанный случай или обстоятельство имеет место, и ситуации, в которых это не происходит. Например, "в случае необходимости замещенный арил" означает, что арильный радикал может быть замещен или не замещен и что описание включает как замещенные арильные радикалы, так и арильные радикалы, не имеющие никакого замещения."Фармацевтически приемлемый носитель, разбавитель или эксципиент" включает без ограничения любой адъювант, носитель, эксципиент, глидант, подсластитель, разбавитель, консервант, краску/пигмент, усилитель аромата, поверхностно-активное вещество, смачивающее вещество, диспергирующий агент, суспендирующий агент, стабилизатор, изотоническое средство, растворитель или эмульгатор, которые были одобрены Фармкомитетом Соединенных Штатов как являющиеся приемлемыми для использования у человека или домашних животных."Фармацевтически приемлемая соль" включает соли присоединения как с кислотой, так и с основанием. " Фармацевтически приемлемая соль присоединения с кислотой" относится к солям, которые сохраняют биологическую эффективность и свойства свободных оснований, которые не являются биологически или в другом отношении нежелательными и которые образованы с неорганическими кислотами,такими как, но не ограничиваясь ими, соляная кислота, бромисто-водородная кислота, серная кислота,азотная кислота, фосфорная кислота и т.п., и органическими кислотами, такими как, но не ограничиваясь ими, уксусная кислота, 2,2-дихлоруксусная кислота, адипиновая кислота, альгиновая кислота, аскорбиновая кислота, аспарагиновая кислота, бензолсульфоновая кислота, бензойная кислота, 4 ацетамидобензойная кислота, камфорная кислота, камфор-10-сульфоновая кислота, каприновая кислота,капроновая кислота, каприловая кислота, угольная кислота, коричная кислота, лимонная кислота, цикламовая кислота, додецилсерная кислота, этан-1,2-дисульфоновая кислота, этансульфоновая кислота, 2 гидроксиэтансульфоновая кислота, муравьиная кислота, фумаровая кислота, галактаровая кислота, гентизиновая кислота, глюкогептоновая кислота, глюконовая кислота, глюкуроновая кислота, глутаминовая кислота, глутаровая кислота, 2-оксо-глутаровая кислота, глицерофосфорная кислота, гликолевая кислота,гиппуровая кислота, изомасляная кислота, молочная кислота, лактобионовая кислота, лауриновая кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота, метансульфоновая кислота, слизевая кислота, нафталин-1,5-дисульфоновая кислота, нафталин-2-сульфоновая кислота, 1 гидрокси-2-нафтойная кислота, никотиновая кислота, олеиновая кислота, оротовая кислота, щавелевая кислота, пальмитиновая кислота, памовая кислота, пропионовая кислота, пироглутаминовая кислота,пировиноградная кислота, салициловая кислота, 4-аминосалициловая кислота, себациновая кислота,стеариновая кислота, янтарная кислота, винная кислота, тиоциановая кислота, п-толуолсульфоновая кислота, трифторуксусная кислота, ундециленовая кислота и т.п."Фармацевтически приемлемая соль присоединения с основанием" относится к солям, которые сохраняют биологическую эффективность и свойства свободных кислот, которые не являются биологически или в другом отношении нежелательными. Эти соли получают присоединением неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганических оснований, включают, но не ограничены ими, соли натрия, калия, лития, аммония, кальция, магния, железа,цинка, меди, марганца, алюминия и т.п. Предпочтительными неорганическими солями являются соли аммония, натрия, калия, кальция и магния. Соли, полученные из органических оснований, включают, но не ограничены ими, соли первичных, вторичных и третичных аминов, замещенные амины, включая натуральные замещенные амины, циклические амины и катионобменные смолы, такие как гидроксид аммония, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, диэтаноламин, этаноламин, деанол, 2-диметиламиноэтанол, 2-диэтиламиноэтанол, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, бенетамин, бензатин, этилендиамин, глюкозамин,метилглюкамин, теобромин, триэтаноламин, трометамин, пурины, пиперазин, пиперидин, Nэтилпиперидин, полиаминовые смолы и т.п. Особенно предпочтительными органическими основаниями являются изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин и кофеин. Часто кристаллизация приводит к образованию сольвата соединения по изобретению. В рамках изобретения термин "сольват" относится к агрегату, который включает одну или более молекул соединения по изобретению с одной или более молекулами растворителя. Растворитель может быть водой, тогда сольват может быть гидратом. Альтернативно, растворитель может быть органическим растворителем. Таким образом, соединения согласно настоящему изобретению могут существовать в форме гидрата,включая моногидрат, дигидрат, полугидрат, сесквигидрат, тригидрат, тетрагидрат и т.п., а также в соответствующих сольватированных формах. Соединение по изобретению может быть истинным сольватом,в то время как в других случаях соединение по изобретению может просто сохранять адвентициальную воду или представлять собой смесь воды с некоторым количеством адвентициального растворителя."Фармацевтическая композиция" относится к составу соединения по изобретению и среды, обычно используемой в данной области для доставки биологически активного соединения млекопитающим, например человеку. Такая среда включает все фармацевтически приемлемые носители, разбавители или"Эффективное количество" или "терапевтически эффективное количество" относится к количеству соединения по изобретению, которое, при введении млекопитающему, предпочтительно человеку, является достаточным для лечения, как определено ниже, бактериальной инфекции у млекопитающего, предпочтительно человека. Количество соединения по изобретению, которое составляет "терапевтически эффективное количество", варьирует в зависимости от соединения, состояния и его серьезности, образа введения и возраста получающего лечение млекопитающего, но может быть определено обычным образом специалистом на основании его собственных знаний и настоящего раскрытия."Лечение" в рамках изобретения включает лечение заболевания или состояния у млекопитающего,предпочтительно человека, имеющего это заболевание или состояние, и включает:(i) предупреждение возникновения заболевания или состояния у млекопитающего, в частности, когда такое млекопитающее предрасположено к состоянию, но у которого оно еще не было диагностировано;(ii) ингибирование заболевания или состояния, то есть остановку его развития;(iii) излечение заболевания или состояния, то есть регрессию заболевания или состояния; или(iv) излечение симптомов, являющихся следствием заболевания или состояния, то есть уменьшение боли безотносительно основного заболевания или состояния. В рамках изобретения термины "заболевание" и "состояние" могут использоваться взаимозаменяемо или могут различаться в том, что конкретное заболевание или состояние, возможно, не имеют известного возбудителя (так, что этиология еще не была установлена), и поэтому оно еще не считается заболеванием, а только нежелательным состоянием или синдромом, при котором клиническими врачами был идентифицирован более или менее определенный набор симптомов. Соединения по изобретению или их фармацевтически приемлемые соли могут содержать один или более центров асимметрии и могут, таким образом, давать начало энантиомерам, диастереомерам и другим стереоизомерным формам, которые могут быть определены, в терминах абсолютной стереохимии,как (R)- или (S)-, или как (D)- или (L)- для аминокислот. Настоящее изобретение включает все такие возможные изомеры, а также их рацемические и оптически чистые формы. Оптически активные (+) и (-),(R)- и (S)- или (D)- и (L)-изомеры могут быть получены с использованием хиральных синтонов или хиральных реагентов, или разделением с использованием обычных методик, например хроматографии и фракционной кристаллизации. Обычные методики для получения/выделения индивидуальных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного) с использованием, например, хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ). Когда соединения, описанные здесь, содержат олефиновые двойные связи или другие центры геометрической асимметрии, и если не указано иное, соединения включают геометрические изомеры E и Z. Аналогично, все таутомерные формы также входят в рамки изобретения."Стереоизомер" относится к соединению, составленному из тех же самых атомов, соединенных теми же самыми связями, но имеющему другие пространственные структуры, которые не являются взаимозаменяемыми. Настоящее изобретение рассматривает различные стереоизомеры и их смеси и включает "энантиомеры", которые относятся к двум стереоизомерам, молекулы которых являются ненакладываемыми зеркальными отображениями друг друга."Таутомер" относится к протонному сдвигу от одного атома молекулы к другому атому той же самой молекулы. Настоящее изобретение включает таутомеры любых указанных соединений. Как отмечено выше, в одном варианте осуществления настоящее изобретение относится к соединениям, имеющим антибактериальную активность, имеющим следующую структуру (I): или к их стереоизомеру или фармацевтически приемлемой соли,в которой Q1 обозначает водород,Q2 обозначает водород, -(CR10R11)pR12; -С 1-С 6-алкил-C3-C10-циклоалкил, в случае необходимости замещенный амино, гидроксилом или -C1-алкиламино; -C1-C6-алкил-C4-C6-гетероциклилалкил, в котором гетероатом представляет собой N, в случае необходимости замещенный гидроксилом, амино или -С 1-С 6 алкилом; -C(=NH)NR4R5; илиQ3 обозначает водород, -(CR10R11)pR12; -С 1-С 6-алкил-C3-C10-циклоалкил, в случае необходимости замещенный амино или гидроксилом; -С 1-С 6-алкил-C4-C6-гетероциклилалкил, в котором гетероатом представляет собой N, в случае необходимости замещенный гидроксилом или амино; C4-C6 гетероциклилалкил, в котором гетероатом представляет собой N; -C(=NH)NR4R5, каждый R1, R2, R3, R4, R5, R8 и R10, независимо, обозначают водород или C1-C6-алкил, или R1 и R2 вместе с атомами, к которым они присоединены, могут образовывать C4-C6-гетероциклоалкил, в котором гетероатом представляет собой N, или R2 и R3 вместе с атомами, к которым они присоединены, могут образовывать С 4-С 6-гетероциклилалкил, в котором гетероатом представляет собой N, или R1 и R3 вместе с атомами, к которым они присоединены, могут образовывать C4-C6-циклоалкил; каждый R6 и R7, независимо, обозначает водород или C1-C6-алкил или R6 и R7 вместе с атомами, к которым они присоединены, могут образовывать гетероциклическое кольцо, имеющее от 4 до 6 кольцевых атомов; каждый R9, независимо, обозначает водород или метил; каждый R11, независимо, обозначает водород, гидроксил, амино или C1-C6-алкил; каждый R12, независимо, обозначает гидроксил или амино; каждый n, независимо, означает целое число от 0 до 4; каждый m, независимо, означает целое число от 0 до 4; каждый p, независимо, означает целое число от 1 до 5, и в которой (i) по меньшей мере два из Q1, Q2 и Q3 отличаются от водорода и (ii), если Q1 обозначает водород, то по меньшей мере один из Q2 и Q3 обозначает -C(=NH)NR4R5. В других вариантах осуществления R8 обозначает водород. В других вариантах осуществления каждый R9 обозначает метил. В других вариантах осуществления Q1 и Q2 отличаются от водорода. В некоторых вариантах осуще- 10017824 ствления Q3 обозначает водород. В более частных вариантах осуществления Q1 обозначает В других более конкретных вариантах осуществления Q1 обозначает где R1 обозначает водород и R2 и R3 вместе с атомами, к которым они присоединены, образуют С 4 С 6-гетероциклилалкил, в котором гетероатом представляет собой N. В других более конкретных вариантах осуществления Q1 обозначает где R3 обозначает водород и R1 и R2 вместе с атомами, к которым они присоединены, образуют C4C6-гетероциклилалкил, в котором гетероатом представляет собой N. В других более конкретных вариантах осуществления Q1 обозначает где R2 обозначает водород и R1 и R3 вместе с атомами, к которым они присоединены, образуют C4C6-циклоалкил. В других более конкретных вариантах осуществления Q1 обозначает где R2 обозначает водород и каждый R3 обозначает водород. В других более конкретных вариантах осуществления Q1 обозначает где R2 обозначает водород и каждый R3 обозначает водород. В других более конкретных вариантах осуществления Q2 обозначает -(CR10R11)pR12. В некоторых вариантах осуществления каждый R10 обозначает водород. В некоторых вариантах осуществления каждый R11 обозначает водород. В других более конкретных вариантах осуществления Q2 обозначает -С 1-С 6-алкил-С 3-С 10 циклоалкил, в случае необходимости замещенный амино, гидроксилом или -С 1 алкиламино. В других более конкретных вариантах осуществления Q2 обозначает -С 1-С 6-алкил-C4-C6 гетероциклилалкил, в котором гетероатом представляет собой N, в случае необходимости замещенный гидроксилом, амино или -С 1-С 6-алкилом. В других вариантах осуществления Q1 и Q3 отличаются от водорода. В некоторых вариантах осуществления Q2 обозначает водород. Следует понимать, что любой вариант соединений структуры (I), как определено выше, и любой конкретный заместитель, определенный здесь для Q1, Q2, Q3, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11 илиR12 в соединениях структуры (I), как определено выше, могут быть независимо скомбинированы с другими вариантами осуществления и/или заместителями соединений структуры (I), образуя варианты осуществления изобретения, специфически не определенные в настоящем описании. Кроме того, когда приведен список заместителей для любой конкретной группы заместителей в конкретном варианте осуществления и/или в пункте формулы изобретения, следует понимать, что каждый индивидуальный заместитель может быть удален из частного варианта осуществления и/или пункта формулы изобретения и что оставшийся список заместителей остается в рамках изобретения. Соединения согласно настоящему изобретению обладают антибактериальной активностью против широкого спектра грамположительных и грамотрицательных бактерий, а также энтеробактерий и анаэробов. Репрезентативные чувствительные организмы в целом включают такие грамположительные и грамотрицательные, аэробные и анаэробные организмы, рост которых может ингибироваться соединениями по изобретению, такие как Staphylococcus, Lactobacillus, Streptococcus, Sarcina, Escherichia, Enterobacter, Klebsiella, Pseudomonas, Acinetobacter, Mycobacterium, Proteus, Campylobacter, Citrobacter, Nisseria,Baccillus, Bacteroides, Peptococcus, Clostridium, Salmonella, Shigella, Serratia, Haemophilus, Brucella и другие организмы. Введение соединений по изобретению или их фармацевтически приемлемых солей может быть осуществлено любым из принятых способов введения средств для подобных целей. Соединения по изобретению или их фармацевтически приемлемые соли вводят в терапевтически эффективном количестве, которое варьирует в зависимости от различных факторов, включая активность конкретного используемого соединения; метаболическую стабильность и продолжительность действия соединения; возраст, массу тела, общее состояние здоровья, пол и режим питания пациента; способ и время введения; скорость экскреции; комбинации лекарственных средств; серьезность конкретного нарушения или состояния и особенности проходящего терапию пациента. Соединения по изобретению или его фармацевтически приемлемые производные могут также вводиться одновременно с, до или после введения одного или более других терапевтических средств. Такая комбинированная терапия включает введение единственного фармацевтического состава, который содержит соединение по изобретению и одно или более дополнительных активных средств, а также введение соединения по изобретению и каждого активного средства в его собственном отдельном фармацевтическом составе. Например, соединение по изобретению и другое активное средство может вводиться пациенту вместе в единственной пероральной лекарственной композиции, такой как таблетка или капсула, или каждое средство вводят в отдельных пероральных лекарственных составах. Если используют отдельные лекарственные составы, соединения по изобретению и одно или более дополнительных активных средств могут вводиться в, по существу, одно и то же время, то есть одновременно, или отдельно в разное время, то есть последовательно; комбинированная терапия, как ее понимают, включает все эти режимы. Следует понимать, что в настоящем описании комбинации заместителей и/или переменных в показанных формулах допустимы, только если такие комбинации приводят к стабильным соединениям. Специалисту также будет понятно, что в способах синтеза, описанных здесь, функциональные группы промежуточных соединений, возможно должны быть защищены подходящими защитными группами. Такие функциональные группы включают гидроксил, амино, меркапто и карбоновую кислоту. Подходящие защитные группы для гидроксила включают триалкилсилил или диарилалкилсилил (например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил), тетрагидропиранил, бензил и т.п. Подходящие защитные группы для амино, амидино и гуанидино включают трет-бутоксикарбонил,бензилоксикарбонил и т.п. Подходящие защитные группы для меркапто включают -C(O)-R (где R обозначает алкил, арил или арилалкил), п-метоксибензил, тритил и т.п. Подходящие защитные группы для карбоновой кислоты включают сложные алкиловые, ариловые или арилалкиловые эфиры. Защитные группы могут быть добавлены или удалены в соответствии со стандартными методиками, которые известны специалисту и как описано здесь. Использование защитных групп описано подробно в Green,T.W. и P.G.M. Wutz, Protective Groups in Organic Synthesis (1999), 3rd Ed., Wiley. Как понятно специалисту, защитная группа может также быть полимерной смолой, такой как смола Ванга, смола Ринка или 2 хлортритил-хлоридная смола. Специалисту также будет понятно, что, хотя защищенное производное соединений по изобретению,возможно, не обладает фармакологической активностью как таковое, они могут вводиться млекопитающему и после этого метаболизироваться в организме, образуя соединения по изобретению, которые являются фармакологически активными. Такие производные могут поэтому быть описаны как "пролекарства". Все пролекарства соединений по изобретению находятся в рамках изобретения. Кроме того, все соединения по изобретению, которые существуют в форме свободного основания или кислоты, могут быть превращены в их фармацевтически приемлемые соли обработкой подходящим неорганическим или органическим основанием или кислотой способами, известными специалисту. Соли соединений по изобретению могут быть превращены в форму их свободного основания или кислоты стандартными методиками. Следующие примеры иллюстрируют различные способы получения соединений по изобретению, то есть соединений структуры (I) в которой Q1, Q2, Q3 R8 и R9 имеют определенные здесь значения. Следует понимать, что специалист может получить эти соединения подобными способами или комбинацией других способов, известных специалисту. Также следует понимать, что специалист может получить, подобным образом, как описано ниже, другие соединения структуры (I), не проиллюстрированные специально ниже, при использовании подходящих исходных компонентов и модификаций параметров синтеза, как это необходимо. В общем, исходные компоненты могут быть получены из таких источников, как Sigma Aldrich, Lancaster Synthesis, Inc., Maybridge, Matrix Scientific, TCI, and Fluorochem USA и т.д., или могут синтезироваться согласно источникам, известным специалисту (см., например, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th edition (Wiley, December 2000, или могут быть получены, как описано здесь. Следующие примеры приведены в целях иллюстрации, но не ограничения. Примеры Общие процедуры синтеза. Процедура 1. Восстановительное аминирование. Способ А. К перемешиваемому раствору производного сизомицина (0,06 ммоль) в MeOH (2 мл) добавляли альдегид (0.068 ммоль), цианоборгидрид на кремнеземе (0,1 г, 1,0 ммоль/г) и реакционную смесь нагревали микроволновым облучением до 100C (мощность 100 Вт) в течение 15 мин. Реакцию проверяли MS на предмет завершенности и по ее завершении весь растворитель удаляли в роторном испарителе. Полученный остаток растворяли в EtOAc (20 мл) и промывали 5%-ным NaHCO3 (25 мл), затем солевым раствором (5 мл). Органическую фазу затем высушивали над Na2SO4, фильтровали и растворитель удаляли в роторном испарителе. Способ В. К раствору производного сизомицина (0,078 ммоль) в DMF (1 мл) добавляли молекулярные сита 3 (15-20), затем альдегид (0,15 ммоль) и реакционную смесь взбалтывали в течение 2,5 ч. Реакцию проверяли MS на предмет завершенности и при необходимости добавляли дополнительное количество альдегида (0,5 экв.). Реакционную смесь затем добавляли по каплям при 0C к перемешиваемому раствору NaBH4 (0,78 ммоль) в MeOH (2 мл) и реакционную смесь перемешивали в течение 1 ч. Реакционную смесь разбавляли H2O (2 мл) и EtOAc (2 мл). Органический слой отделяли и водный слой экстрагировали EtOAc (33 мл). Объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали досуха. Процедура 2. Удаление защитной группы PNZ. К перемешиваемому раствору PNZ-защищенного производного сизомицина (0,054 ммоль) в EtOH(1,5 мл) и H2O (1 мл) добавляли 1 н. NaOH (0,3 мл), затем Na2S2O4 (0,315 ммоль) и реакционную смесь нагревали при 70C в течение 12 ч. Развитие реакции проверяли MS. По завершении реакции реакционную смесь разбавляли H2O (5 мл) и затем экстрагировали EtOAc (210 мл). Объединенные органические слои промывали H2O (25 мл), солевым раствором (5 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха. Процедура 3. Удаление защитной группы Boc (трет-бутилдиметилсилильную защитную группу удаляют в этих условиях). Важно: перед удалением защитной группы Boc образец должен быть хорошо высушен в высоком вакууме в течение 3 ч. Способ А. К перемешиваемому раствору Вос-защищенного сизомицина (0,054 ммоль) в DCM (1 мл) добавляли молекулярные сита 3 (4-6) и трифторуксусную кислоту (0,6 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч и проверяли на предмет завершенности MS. После завершения реакционную смесь разбавляли простым эфиром (15 мл), чтобы вызвать осаждение. Ампулу центрифугировали и супернатант декантировали. Осадок промывали простым эфиром (215 мл),декантировали и высушивали над вакуумом. Способ В. К перемешиваемому раствору Вос-защищенного производного сизомицина (0,078 ммоль) в DCM (1,5 мл) при 0C добавляли трифторуксусную кислоту (1/5 мл). Реакционную смесь перемешивали в течение 45 мин и проверяли на предмет завершенности MS. После завершения реакции ре- 13017824 акционную смесь разбавляли дихлорэтаном (10 мл) и концентрировали досуха. Последнюю стадию разбавления/концентрации повторяли дважды. Процедура 4. Сочетание ВОР и РуВОР. Способ А. К перемешиваемому раствору производного сизомицина (0,078 ммоль) в DMF (1 мл) добавляли кислоту (0,16 ммоль), затем РуВОР (0,16 ммоль) и DIPEA (0,31 ммоль) и реакционную смесь перемешивали в течение ночи. Реакционную смесь разбавляли EtOAc (3 мл) и H2O (3 мл) и водный слой отделяли и экстрагировали EtOAc (33 мл). Объединенные органические слои высушивали над Na2SO4,фильтровали и концентрировали досуха. Способ В. К перемешиваемому раствору производного сизомицина (0,073 ммоль) в DMF (1 мл) добавляли кислоту (0,102 ммоль), DIPEA (0,43 ммоль) и раствор ВОР (0,102 ммоль) в DMF (1 мл) и реакционную смесь перемешивали в течение 4 ч, причем протекание реакции проверяли MS. Реакционную смесь разбавляли водой (8 мл) и экстрагировали EtOAc (210 мл). Объединенные органические слои промывали 5%-ным водным раствором NaHCO3 (23 мл) и солевым раствором (3 мл), высушивали надNa2SO4, фильтровали и концентрировали досуха. Процедура 5. Раскрытие эпоксида. К перемешиваемому раствору производного сизомицина (0,06 ммоль) в MeOH (2 мл) добавляли эпоксид (0,07 ммоль), LiClO4 (0,15 ммоль) и реакционную смесь нагревали микроволновым облучением до 100C в течение 90 мин. Развитие реакции проверяли MS. После завершения растворитель удаляли в роторном испарителе. Полученный остаток растворяли в EtOAc (20 мл), промывали H2O (25 мл) и солевым раствором (5 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха. Процедура 6. Удаление фталимидной защитной группы. К перемешиваемому раствору защищенного фталимидной группой сизомицина (0,064 ммоль) вEtOH (3 мл) добавляли гидразин (0,32 ммоль) и реакционную смесь нагревали с обратным холодильником в течение 2 ч. Развитие реакции проверяли MS. После охлаждения до температуры окружающей среды циклический побочный продукт осаждали и удаляли фильтрацией. Фильтрат концентрировали досуха, получая остаток, который растворяли в EtOAc (20 мл), промывали 5%-ным NaHCO3 (25 мл) и солевым раствором (5 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха. Процедура 7. Добавление группы гуанидиния. К перемешиваемому раствору производного сизомицина (0,063 ммоль) в DMF (1 мл) добавляли 1Hпиразол-1-карбоксамидин гидрохлорид (0,09 ммоль), затем DIPEA (0,862 мл), реакционную смесь нагревали до 80C и перемешивали в течение ночи. Развитие реакции проверяли MS. После завершения реакции реакционную смесь охлаждали до температуры окружающей среды и разбавляли водой (3 мл). Водную фазу отделяли и экстрагировали EtOAc (25 мл) и объединенные органические фракции промывали солевым раствором (5 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха. Процедура 8. Нозилирование. К перемешиваемому раствору производного сизомицина (0,23 ммоль) в DCM (20 мл) добавляли 2 нитробензолсульфонил хлорид (0,25 ммоль) и DIPEA (0,3 ммоль) и реакционную смесь перемешивали в течение 3 ч. Развитие реакции проверяли MS. После завершения DCM удаляли в роторном испарителе,полученный остаток растворяли в этилацетате (50 мл) и промывали 5%-ным NaHCO3 (210 мл) и солевым раствором (10 мл). Объединенные органические слои затем высушивали над Na2SO4, фильтровали и концентрировали досуха. Процедура 9. Удаление нозильной защитной группы. К перемешиваемому раствору защищенного нозильной группой производного сизомицина (0,056 ммоль) в DMF (1,5 мл) добавляли тиофенол (0,224 ммоль), K2CO3 (1,12 ммоль) и реакционную смесь перемешивали в течение 2 ч, причем развитие реакции проверяли MS. После завершения реакции реакционную смесь разбавляли водой (5 мл) и экстрагировали этилацетатом (210 мл). Объединенные органические слои промывали водой (25 мл) и солевым раствором (5 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха. Процедура 10. Удаление PNZ гидрогенолизом. К перемешиваемому раствору производного сизомицина (0,41 ммоль) в EtOH (60 мл) добавляли АсОН (0,14 мл), затем Pd/C (30 вес.%). Реактор эвакуировали и пополняли H2 (1 атм.) и реакционную смесь перемешивали в течение 6 ч. Реактор затем эвакуировали и пополняли азотом. Твердые частицы удаляли фильтрацией через слой целита и промывали MeOH (10 мл). Выпаривание растворителя дало желаемый продукт. Процедура 11. Моноалкилирование. К перемешиваемому раствору защищенного нозильной группой производного сизомицина (0,072 ммоль) в DMF (1,5 мл) добавляли галогензамещенный алкан (0,144 ммоль), K2CO3 (0,216 ммоль) и реакционную смесь нагревали до 80C, проверяя развитие реакции MS. После завершения реакции реакционную смесь разбавляли водой (2 мл) и экстрагировали этилацетатом (25 мл). Объединенные органические слои промывали солевым раствором (1,5 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха. Процедура 12. Сульфонилирование. К перемешиваемому раствору сизомицинового скелета (0,067 ммоль) в DCM (3 мл) добавлялиDIPEA (0,128 моль) и сульфонилхлорид (0,07 ммоль). Реакционную смесь перемешивали при температуре окружающей среды и развитие реакции проверяли MS. После завершения реакции растворитель удаляли в роторном испарителе и остаток растворяли в этилацетате (20 мл), промывали 5%-ным NaHCO3(25 мл) и солевым раствором (5 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха. Процедура 13. Защита N-Boc. К перемешиваемому раствору амина (4,64 ммоль) в THF (10 мл) добавляли 1 н. NaOH (10 мл), затем Вос-ангидрид (5,57 ммоль) и развитие реакции проверяли MS. После завершения реакции THF удаляли в роторном испарителе и добавляли воду (40 мл). Водную фазу отделяли и экстрагировали Et2O (230 мл). Водную фазу подкисляли до pH 3 добавлением разбавленного H3PO4 и затем экстрагировали EtOAc(260 мл). Объединенные органические слои промывали H2O (230 мл) и солевым раствором (30 мл),высушивали над Na2SO4, фильтровали и концентрировали досуха. Процедура 14. Синтез эпоксидов. К перемешиваемому раствору алкена (5,16 ммоль) в хлороформе (20 мл) при 0C добавляли мхлорпербензойную кислоту (8,0 ммоль), реакционную смесь перемешивали в течение 30 мин при 0C и затем давали нагреться до температуры окружающей среды. Развитие реакции проверяли MS и TLC и при необходимости добавляли дополнительные части м-СРВА. После завершения реакции реакционную смесь разбавляли хлороформом (50 мл) и промывали 10%-ным водным раствором Na2SO3 (230 мл),10%-ным водным раствором NaHCO3 (250 мл) и солевым раствором (50 мл). Органический слой высушивали над Na2SO4, фильтровали и концентрировали, получая сырой продукт, который очищали флэшхроматографией (силикагель/гексаны: этилацетат 0-25%). Процедура 15. Общая процедура для синтеза -гидроксикарбоновых кислот. Стадия 1. O-(триметилсилил)цианогидрины. В колбу на 50 мл, оборудованную магнитной мешалкой и сушильной трубкой, загружали кетон или альдегид (0,010 ммоль), затем THF (50 мл), триметилсилил цианид (1,39 г, 14 ммоль) и йодид цинка (0,090 г, 0,28 ммоль) и реакционную смесь перемешивали при температуре окружающей среды в течение 24 ч. Выпаривание растворителя дало остаток, который растворяли в EtOAc (60 мл), промывали 5%-ным водным раствором NaHCO3 (230 мл), H2O (30 мл) и солевым раствором (30 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха, получая сырой продукт, который использовали на следующей стадии без дальнейшей очистки. Стадия 2. Кислотный гидролиз до -гидроксикарбоновой кислоты. АсОН (25 мл) и конц. HCl (25 мл) добавляли к неочищенному материалу со стадии 1 и реакционную смесь нагревали с обратным холодильником в течение 2-3 ч. Реакционную смесь затем концентрировали досуха, получая твердое вещество белого цвета, которое использовали на следующей стадии без дальнейшей очистки. Стадия 3. Защита Boc. К перемешиваемому раствору твердого вещества со стадии 2 в 2 М NaOH(20 мл) и i-PrOH (20 мл) при 0C небольшими порциями добавляли Boc2O (6,6 г, 3 ммоль) и реакционной смеси давали нагреться до температуры окружающей среды за 4 ч. Затем i-PrOH выпаривали, добавлялиH2O (50 мл) и водную фазу отделяли и экстрагировали Et2O (230 мл). Водный слой подкисляли до 3 добавлением разбавленного Н 3 РО 4 и экстрагировали EtOAc (260 мл). Объединенные органические слои промывали H2O (230 мл) и солевым раствором (30 мл), высушивали над Na2SO4, фильтровали и концентрировали, получая желаемые N-Bocгидроксикарбоновые кислоты с выходом 56-72%. Используемые альдегиды и кетоны: N-Boc-3-пирролидонон, N-Вос-3-азетидинон, N-Boc-4 пиперидон и N-Boc-3-азетидинкарбоксальдегид. Процедура 16. Защита амина группой Fmoc. К перемешиваемому раствору амина (0,049 моль) в DCM (100 мл) добавляли DIPEA (16 мл, 0,099 моль) и реакционную смесь охлаждали до 0C. Затем добавляли Fmoc-Cl (12,8 г, 0,049 моль) частями за несколько минут и реакционной смеси давали нагреться до температуры окружающей среды в течение 2 ч. Органический слой промывали водой (250 мл) и солевым раствором (50 мл), высушивали над Na2SO4,фильтровали и концентрировали досуха, получая Fmoc-защищенный амин (выход 90-95%). Процедура 17. Алкилирование Mitsunobu. К перемешиваемому раствору нозилированного производного сизомицина (0,087 ммоль) в толуоле(2,5 мл) добавляли спирт (0,174 ммоль), трифенилфосфин (0,174 ммоль) и реакционную смесь охлаждали до 4C в рефрижераторе в течение 10 мин. Затем добавляли охлажденный раствор DEAD (0,174 ммоль в 2 мл безводного толуола) и реакционную смесь взбалтывали в течение ночи. Развитие реакции проверялиMS и при необходимости добавляли дополнительное количество спирта и трифенилфосфина. После завершения реакции добавляли этилацетат (30 мл) и органическую фазу промывали 5%-ным водным раствором NaHCO3 (25 мл) и солевым раствором (5 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха. Процедура 18. Синтез альдегидов через окисление TEMPO/Bleach. К энергично перемешиваемому раствору спирта (1,54 ммоль) в DCM (4 мл) добавляли TEMPO(0,007 г, 0,045 ммоль, % на 0,03 моль) и 2 М водный раствор KBr (75 мл, 0,15 ммоль, 10 мол.%) и реакционную смесь охлаждали до -10C. В отдельной колбе NaHCO3 (0,5 г, 9,5 ммоль) растворяли в Bleach (25 мл, Chlorox 6,0% NaOCl), получая 0,78 М буферизованного раствора NaOCl. Этот свежеприготовленный 0,78 М раствор NaOCl (2,3 мл, 1,8 ммоль, 117 мол.%) добавляли к реакционной смеси за 5 мин и реакционную смесь перемешивали в течение дополнительных 30 мин при 0C. Органическую фазу отделяли и водный слой экстрагировали дихлорметаном (24 мл). Объединенные органические слои промывали 10%-ным водным раствором Na2S2O3 (4 мл), насыщенным водным раствором NaHCO3 (24 мл), солевым раствором (5 мл), высушивали над Na2SO4 и концентрировали досуха. Процедура 19. Синтез спиртов восстановлением гидрида бора. К перемешиваемому раствору кислоты (1,5 ммоль) в THF (5 мл) при -10C медленно добавляли 1,0 М BH3-THF (2,98 мл, 2,98 ммоль). Реакционную смесь энергично перемешивали в течение дополнительных 3 мин при -10C и затем давали нагреться до температуры окружающей среды в течение ночи. Реакционную смесь гасили добавлением по каплям раствора НОАс/H2O (1:1 об./об., 2,0 мл). THF удаляли в роторном испарителе и добавляли насыщенный водный раствор NaHCO3 (15 мл). Водный слой экстрагировали DCM (35 мл) и объединенные органические слои промывали насыщенным водным растворомNaHCO3 (25 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха. Процедура 20. Сочетание EDC. К перемешиваемому раствору производного сизомицина (0,048 ммоль) в DMF (0,3 мл) и THF (0,6 мл) добавляли EDC (0,058 ммоль), затем HONb (0,062 ммоль) и кислоту (0,058 ммоль) и реакционную смесь перемешивали в течение ночи. Реакционную смесь гасили H2O (2 мл) и добавляли EtOAc (4 мл). Органический слой промывали насыщенным водным раствором NaHCO3, насыщенным водным раствором NH4Cl, высушивали над Na2SO4, фильтровали и концентрировали досуха. Общие процедуры очистки. Способ 1. Очистка в основных условиях. Мобильные фазы: А - вода с 10 мМ NH4OH; В - ацетонитрил с 10 мМ NH4OH. Колонки: А: колонка Waters-XTerra Prep MS C18 OBD 19100 мм, 5 мкм; градиент: 20 мин при 0%, затем 0-20% за 200 мин при потоке 20 мл/мин; В: колонка Waters-XTerra Prep MS C18 OBD 50100 мм, 5 мкм; градиент: 20 мин при 0%, затем 0-20% за 200 мин при потоке 20 мл/мин. Используя Waters-XTerra, отбор фракций инициировали сигналом MS. Собранные фракции высушивали лиофилизацией и анализировали LC/MS/ELSD. Чистые фракции объединяли и анализировалиLC/MS/ELSD для финальной проверки чистоты. Количественную оценку проводили с помощью системыA: Microsorb BDS Dynamax 21,4250 мм, 10 мкм, 100; градиент: 0-100%, поток 25 мл/мин; В: Microsorb BDS Dynamax 41,4250 мм, 10 мкм, 100; градиент: 0-100%, поток 45 мл/мин; Способ 3. Очистка хроматографией гидрофильного взаимодействия (HILIC). Буферы: буфер А - 3400 мл ацетонитрила; 600 мл воды; 15 мл уксусной кислоты; 15 мл TEA; буфер В - 4000 мл воды; 100 мл TEA; 100 мл уксусной кислоты; колонка: ПолиС-полигидроксиэтил А 15021 мм, 5 мкм; градиент: 20-70% 10 мл/35 мин. Сигнал ELSD использовали, чтобы инициировать отбор фракций. Фракции высушивали лиофилизацией и анализировали LC/MS/ELSD. Чистые фракции затем объединяли, разбавляли водой и лиофилизировали. Высушенные фракции снова растворяли в воде и лиофилизировали в третий раз, чтобы гарантировать полное удаление TEA. Любые образцы, демонстрирующие следы TEA, проходили дополнительное высушивание. Для доставки очищенные соединения растворяли в концентрации 10 мг/мл. Финальную проверку чистоты осуществляли с помощью LC/MS/ELSD и количественную оценку - с помощью LC/MS/CLND.IRA Amberlite 400 (ОН форма) (200 г) промывали MeOH (3200 мл). К перемешиваемой суспензии промытой смолы в MeOH (150 мл) добавляли сизомицин сульфат (20,0 г, 0,029 моль) и смесь перемешивали в течение ночи. Смолу затем отфильтровывали, промывали MeOH (100 мл) и объединенные органические слои концентрировали досуха, получая желаемый сизомицин (11,57 г, 0,026 моль, выход 89,6%): MS m/e [M+H]+ рассчит. 448,3, найдено 448,1. К перемешиваемому раствору 4-нитробензил хлорформиата (5,0 г, 0,023 моль) в THF (90 мл) при 0C добавляли N-гидрокси-5-норборнен-2,3-дикарбоксимид (4,16 г, 0,023 моль) с последующим добавлением по каплям раствора Et3N (3,2 мл, 0,02 моль) в THF (50 мл) и реакционную смесь перемешивали в течение 4 ч с постепенным нагреванием до температуры окружающей среды. Реактор затем помещали в морозильник (-5C) на 1 ч, чтобы вызвать осаждение гидрохлорида триэтиламина, который удаляли фильтрацией. Фильтрат концентрировали досуха, получая остаток, который энергично перемешивали вMeOH (80 мл) в течение 1 ч и затем фильтровали, получая (N-гидрокси-5-норборнен-2,3 дикарбоксилимидо)-4-нитробензоат в форме твердого вещества белого цвета (7,98 г, 0,022 моль, 96%ный выход): TLC (гексаны: EtOAc об./об. 1:1) Rf=0,35. 2,5-Диоксопирролидин-1-ил-4-нитробензил карбонат (PNZ-сукцинимид) К перемешиваемому раствору N-гидроксисукцинимида (5,35 г, 46,5 ммоль) в безводном THF (100 мл) добавляли п-нитробензилхлорформиат (10,0 г, 46,5 ммоль) и раствор охлаждали в ванне со льдом. Триэтиламин (6,5 мл, 4,89 г, 46,5 ммоль) добавляли за 10 мин и через 30 мин реакционной смеси давали нагреться до температуры окружающей среды и перемешивали в течение ночи. Суспензию охлаждали в ванне со льдом и фильтровали, затем промывали этилацетатом. Фильтрат концентрировали в вакууме, и остаток растирали с метанолом. Твердые частицы отделяли фильтрацией, получая 2,5 диоксопирролидин-1-ил-4-нитробензил карбонат. 6'-Трифторацетил-2',3-ди-PNZ-сизомицин К перемешиваемому раствору сизомицина (30,1 г, 0,067 моль) в MeOH (700 мл) добавляли ацетат цинка (37,07 г, 0,202 моль) с последующим медленным добавлением раствора S-этилтрифтортиоацетата(9,37 мл, 0,074 моль) в MeOH (100 мл) и реакционную смесь перемешивали под N2 в течение ночи. Затем по каплям добавляли раствор триэтиламина (37,5 мл, 0,27 моль) и PNZ-сукцинимид (64,2 г, 0,179 моль) вTHF (1 л) и реакционную смесь перемешивали в течение 3 ч. Выпаривание растворителя дало сырой продукт, который растворяли в DCM (2 л) и промывали конц. NH4OH:H2O (3:1 об./об., 2800 мл) и солевым раствором (800 мл), высушивали над MgSO4, фильтровали и концентрировали досуха. Остаток растворяли в этилацетате (1 л) и экстрагировали АсОН: H2O (1/9 об./об., 1 л). Водный слой промывали этилацетатом (21 л), подщелачивали до pH 12 с помощью 10 н. NaOH и экстрагировали этилацетатом (21 л). Органический слой промывали солевым раствором (500 мл), высушивали над MgSO4, фильтровали и концентрировали, получая остаток. Сырой продукт растворяли в этилацетате (500 мл) и раствор отстаивали в течение ночи. Осажденные твердые частицы удаляли фильтрацией и оставшийся фильтрат концентрировали, получая сырой продукт, который очищали ВЭЖХ с обратной фазой согласно способу 2 колонка В, получая желаемый 6'-трифторацетил-2',3-ди-PNZ-сизомицин (MS m/e [M+H]+ рассчит. 902,3,найдено 902,2. 6'-Трифторацетил-2',3-ди-PNZ-1-ацетил-3"-Boc-сизомицинMeOH (7 мл) при 0C медленно добавляли уксусный ангидрид (0,095 мл, 1,01 ммоль) и реакционной смеси давали нагреться до температуры окружающей среды в течение ночи. Реакция сопровождаласьMS, которая подтверждала полное формирование промежуточного 6'-трифторацетил-2',3-ди-PNZ-1 ацетилсизомицина (MS m/e [M+H]+ рассчит. 944,3, найдено 944,2, [M+Na]+ 966,3). Реакционную смесь затем охлаждали до 0C и добавляли DIPEA (0,54 мл, 3,11 ммоль), затем Вос-ангидрид (0,53 мл, 2,33 ммоль) и реакционную смесь перемешивали в течение 6 ч, отслеживая протекание реакции с помощьюMS. Реакционную смесь гасили глицином (0,29 г, 3,88 ммоль) и K2CO3 (0,54 г, 3,88 ммоль) и реакционную смесь перемешивали в течение ночи. После выпаривания растворителя остаток разделяли междуH2O (10 мл) и EtOAc (10 мл). Водный слой отделяли и далее экстрагировали EtOAc (310 мл) и объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали досуха, получая желаемый 6'-трифторацетил-2',3-ди-PNZ-1-ацетил-3"-Boc-сизомицин (MS m/e [M+H]+ рассчит. 1044,4,найдено 1044,0, [M+Na]+ 1066,3), который использовали на следующей стадии без дальнейшей очистки. 2',3-Ди-PNZ-1-ацетил-3"-Boc-сизомицин. К перемешиваемому раствору 6'-трифторацетил-2',3-ди-PNZ-1-ацетил-3"-Boc-сизомицина (0,77 ммоль) в MeOH (5 мл) добавляли конц. NH4OH (8,2 мл) и реакционную смесь перемешивали в течение ночи. Выпаривание растворителя дало сырой продукт, который очищали ВЭЖХ с обратной фазой согласно способу 2-колонка В, получая желаемый 2',3-ди-PNZ-1-ацетил-3"-Boc-сизомицин (0,35 г, 0,36 ммоль, выход 46,7%, чистота 95%): MS m/e [M+H]+ рассчит. 948,4, найдено 948,2. К перемешиваемому раствору 4-амино-2(S)-гидроксимасляной кислоты (5,0 г, 0,041 моль) в смеси диоксан:H2O (200 мл, 1:1 об./об.) добавляли K2CO3 (11,6 г, 0,084 моль), затем п-нитробензил хлорформиат (9,23 г, 0,043 моль) и реакционную смесь перемешивали в течение ночи. Полученный осадок удаляли фильтрацией и органический растворитель удаляли в роторном испарителе. Полученный водный раствор подкисляли до pH 1 добавлением 1 М HCl (100 мл). После добавления к водному слою этилацетата (100 мл) продукт осаждали и собирали фильтрацией. Фильтрат добавляли к делительной воронке и органический слой отделяли. После добавления к водному слою этилацетата (100 мл) имело место второе осаждение, продукт собирали фильтрацией и этот процесс повторяли еще раз. Объединенные органические слои затем помещали на ночь при -5C, в результате чего происходило осаждение продукта, который собирали фильтрацией. Желаемую N-PNZ-4-амино-2(S)-гидроксимасляную кислоту (9,3 г, 0,031 моль, 75%-ный выход, 90%-ная чистота) использовали на следующей стадии без дальнейшей очистки. MS m/e [M+H]+ рассчит. 299,1, найдено 298,9. К перемешиваемому раствору N-PNZ-4-амино-2(S)-гидроксимасляной кислоты (8,95 г, 30,0 ммоль) в THF (200 мл) при 0C медленно добавляли DCC (6,8 г, 33,0 ммоль) и реакционную смесь перемешивали в течение 30 мин. Затем по каплям за 1 ч добавляли раствор имида N-гидрокси-5-норборнен-2,3 дикарбоновой кислоты (6,45 г, 36,0 ммоль) в THF (100 мл). Осажденный карбамид удаляли фильтрацией и оставшийся фильтрат концентрировали досуха. Остаток растворяли в этилацетате (200 мл) и промывали H2O (150 мл), высушивали над MgSO4, фильтровали и концентрировали досуха. Продукт перекристаллизовывали из смеси этилацетат/простой диэтиловый эфир, получая желаемый N-гидрокси-5 норборнен-2,3-дикарбоксилимидо)-N-PNZ-4-амино-2(S)-гидроксибутаноат (10,0 г, 21,78 ммоль, выход 72,6%). MS m/e [M+H]+ рассчит. 482,1, найдено 482,2. К перемешиваемому раствору (N-гидрокси-5-норборнен-2,3-дикарбоксилимидо)-N-PNZ-4-амино 2(S)-гидроксибутаноата (6,4 г, 0,014 моль) в THF (65 мл) добавляли трифенилфосфин (4,0 г, 0,015 ммоль), затем бензойную кислоту (1,9 г, 0,015 ммоль) и реакционную смесь охлаждали до 0C. Затем добавляли по каплям DIAD (3,0 мл, 0,015 моль) и реакционную смесь перемешивали в течение дополнительных 50 мин. Выпаривание растворителя дало сырой продукт, который очищали флэшхроматографией (силикагель/гексаны:этилацетат 20-100%), получая желаемый (N-гидрокси-5 норборнен-2,3-дикарбоксилимидо)-N-PNZ-4-амино-2(R)-бензоилбутаноат (2,3 г, 4,08 ммоль, выход 29,1%), с незначительной примесью трифенилфосфиноксида: 1H ЯМР (400 МГц, CDCl3)8,17 (д, 2H),7,98 (д, 2H), 7,44-7,70 (м, 5H), 5,96-6,18 (м, 2H), 5,41-5,55 (м, 1H), 5,10 (с, 2H), 3,40-3,58 (m, 2H), 3,21-3,39(50 мл) добавляли (N-гидрокси-5-норборнен-2,3-дикарбоксилимидо)-N-PNZ-4-амино-2(R)-бензоилбутаноат (2,3 г, 4,08 ммоль) и реакционную смесь перемешивали в течение 24 ч. Затем добавляли DIPEA(2,5 мл, 0,014 моль), затем Вос-ангидрид (2,5 мл, 0,011 моль) и реакционную смесь перемешивали в течение дополнительных 2 ч. Раствор глицина (2,5 г, 0,033 моль) и K2CO3 (4,6 г, 0,033 моль) в H2O (50 мл) затем добавляли частями за 5 мин и реакционную смесь перемешивали в течение 1 ч. Реакционную смесь разбавляли этилацетатом (300 мл) и водный слой отделяли. Органический слой промывали 1 М лимонной кислоты (150 мл), насыщенным водным раствором NaHCO3 (30 мл), солевым раствором (30 мл), высушивали над MgSO4, фильтровали и концентрировали досуха, получая сырой продукт, который очищали ВЭЖХ с обратной фазой согласно способу 2-колонка В, получая желаемый 6'-трифторацетил-2',3-диPNZ-1-(N-PNZ-4-амино-2(R)-бензоилбутирил)-3"-Boc-сизомицин (1,6 г, 1,15 ммоль, выход 41,5%). 2',3-Ди-PNZ-1-(N-PNZ-4-амино-2(R)-гидроксибутирил)-3"-Вос-сизомицин К перемешиваемому раствору 6'-трифторацетил-2',3-ди-PNZ-1-(N-PNZ-4-амино-2(R)-Oбензоилбутирил)-3"-Boc-сизомицина (1,6 г, 1,15 ммоль) в MeOH (30 мл) добавляли конц. NH4OH (3 мл) и реакционную смесь перемешивали в течение 3 дней. Затем добавляли этилацетат (30 мл) и водный слой отделяли. Органический слой промывали 1 М NaOH (20 мл), солевым раствором (20 мл), высушивали над MgSO4 и концентрировали досуха, получая 2',3-ди-PNZ-1-(N-PNZ-4-амино-2(R)-гидроксибутирил)3"-Boc-сизомицин (1,4 г, MS m/e [M+H]+ рассчит. 1186,4, найдено 1186,2, [M+Na]+ 1208,3), который использовали на следующей стадии без дальнейшей очистки. Этил-(2R)-2,3-эпоксипропионат (0,5 г, 4,3 ммоль), хлорид аммония (0,253 г, 4,73 ммоль) и азид натрия (0,336 г, 5,17 ммоль) объединяли в DMF (8 мл) и смесь нагревали при 75C в течение 14 ч. Реакционную смесь охлаждали до температуры окружающей среды и разделяли между водой и смесью простой эфир/гексаны (1:1 об./об.). Фазы разделяли и органическую фазу промывали по одному разу водой, солевым раствором, высушивали над MgSO4, фильтровали и концентрировали до масла, которое очищали флэш-хроматографией (силикагель/гексаны:10%-ный этилацетат), получая (R)-этил-3-азидо-2 гидроксипропионат в форме прозрачного масла (0,47 г, 2,97 ммоль, 69%-ный выход). Rf 0,27 (гексаны: 10%-ный EtOAc, об./об., п-анизальдегид); MS m/e [M+Na]+ рассчит. 182,1, найдено 182,0. Стадия 1). К перемешиваемому раствору (R)-этил-3-азидо-2-гидроксипропионата (159 мг, 1,0 ммоль) в этаноле (4 мл) добавляли уксусную кислоту (0,10 мл), затем после промывки колбы азотом - 5%Pd/C (25 мг). Колбу оснащали баллоном с водородом и перемешивали в течение 1 ч. Затем колбу промывали азотом, смесь фильтровали через целит и фильтрующий слой промывали этанолом (4 мл). Стадия 2). К фильтрату добавляли 1 М NaOH (3 мл), затем Boc2O (0,28 мл, 0,27 г, 1,2 ммоль) и раствор перемешивали при температуре окружающей среды в течение 2 дней. Раствор затем разделяли между простым эфиром и водой и фазы разделяли. Водную фазу промывали дважды простым эфиром, подкисляли с помощью 1 М NaHSO4 и экстрагировали этилацетатом. Этилацетатную фазу промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали до масла, которое отверждали,получая (R)-3-(трет-бутоксикарбониламино)-2-гидроксипропионовую кислоту (117 мг, 57%-ный выход):(1,35 г, 7,5 ммоль) растворяли в THF (40 мл), раствор охлаждали до 0C и добавляли EDC (1,33 г, 6,9 ммоль). Через 20 мин реакционной смеси давали нагреться до температуры окружающей среды. Через 6 ч добавляли раствор 6'-трифторацетил-2',3-ди-PNZ-сизомицина (5,23 г, 5,8 ммоль) в DMF (25 мл) и раствор перемешивали в течение ночи. Реакционную смесь концентрировали, чтобы удалить THF, и разделяли между водой и этилацетатом. Фазы разделяли и этилацетатную фазу промывали по одному разу водой, насыщенным NaHCO3, водой и солевым раствором. Этилацетатную фазу затем высушивали надNa2SO4, фильтровали и концентрировали, получая остаток. Остаток хроматографировали ВЭЖХ с обратной фазой согласно способу 2-колонка В, получая 6'-трифторацетил-2',3-ди-PNZ-1-[(R)-3-(третбутоксикарбониламино)-2-гидроксипропионил]сизомицин в форме грязно-белой пены (1,64 г, 1,51 ммоль, 24%-ный выход): MS m/e [M+H]+ рассчит. 1089,4, найдено 1089,2.Boc2O (0,65 мл, 0,62 г, 2,8 ммоль). Через 3 ч добавляли глицин (312 мг, 4,17 ммоль) и 0,5 М K2CO3 (24 мл) и реакционную смесь энергично перемешивали в течение 1 ч. Смесь затем разделяли между этилацетатом и водой и фазы разделяли. Этилацетатную фазу промывали по одному разу водой и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали досуха, получая 6'-трифторацетил-2',3 ди-PNZ-1-[(R)-3-(трет-бутоксикарбониламино)-2-гидроксипропионил]-3"-Вос-сизомицин в форме твердого вещества, которое использовали на следующей стадии без дальнейшей очистки. MS m/e [M-Boc]+ рассчит. 1089,4, найдено 1089,2. 2',3-Ди-PNZ-1-[(R)-3-(трет-бутоксикарбониламино)-2-гидроксипропионил]-3"-Boc-сизомицин К раствору 6'-трифторацетил-2',3-ди-PNZ-1-[(R)-3-(трет-бутоксикарбониламино)-2-гидроксипропионил]-3"-Boc-сизомицина (1,39 ммоль) в метаноле (45 мл) добавляли концентрированный гидроксид аммония (45 мл, 12 М). Раствор выдерживали при температуре окружающей среды в течение 18 ч и затем концентрировали в вакууме. Остаток разделяли между этилацетатом и водой и фазы разделяли. Водную фазу повторно экстрагировали один раз этилацетатом. Объединенные этилацетатные фазы концентрировали, получая остаток, который растворяли в смеси 1:1:1 об./об. метанол/уксусная кислота/вода и очищали ВЭЖХ с обратной фазой согласно способу 2-колонка В. Чистые фракции объединяли, подщелачивали с помощью 1 М Na2CO3 и концентрировали в вакууме, чтобы удалить ацетонитрил. Смесь затем экстрагировали дважды этилацетатом. Конечные этилацетатные фазы объединяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали, получая 2',3-ди-PNZ-1-[(R)-3(трет-бутоксикарбониламино)-2-гидроксипропионил]-3"-Boc-сизомицин (316 мг, 30%-ный выход) в форме твердого вещества белого цвета. MS m/e [M+H]+ рассчит. 1093,4, найдено 1093,3. К перемешиваемому раствору S-изосерина (4,0 г, 0,038 моль) в смеси диоксан:H2O (100 мл, 1:1 об./об.) при 0C добавляли N-метилморфолин (4,77 мл, 0,043 моль), затем Boc2O (11,28 мл, 0,049 моль) и реакционную смесь перемешивали в течение ночи с постепенным нагреванием до температуры окружающей среды. Затем добавляли глицин (1,0 г, 0,013 моль) и реакционную смесь перемешивали в течение 20 мин. Реакционную смесь охлаждали до 0C и добавляли насыщенный водный раствор NaHCO3(75 мл). Водный слой промывали этилацетатом (260 мл) и затем подкисляли до pH 1 с помощью NaHSO4. Этот раствор затем экстрагировали этилацетатом (370 мл) и эти объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали досуха, получая желаемую N-Boc-3 амино-2(S)-гидроксипропионовую кислоту (6,30 г, 0,031 ммоль, выход 81,5%): 1 Н ЯМР (400 МГц, CDCl3)7,45 (ушир.с, 1H), 5,28 (ушир.с, 1H), 4,26 (м, 1H), 3,40-3,62 (м, 2H), 2,09 (с, 1H), 1,42 (с, 9 Н); 13 С ЯМР К перемешиваемому раствору N-Boc-3-амино-2(S)-гидроксипропионовой кислоты (1,30 г, 6,34 ммоль) в DMF (14 мл) медленно добавляли HONB (1,14 г, 6,34 ммоль) и EDC (1,21 г, 6,34 ммоль) и реакционную смесь перемешивали в течение 2 ч, после чего MS показала полное формирование активированного сложного эфира (MS m/e [M+Na]+ рассчит. 389,1, найдено 389,1). Затем добавляли 6'трифторацетил-2',3-ди-PNZ-сизомицин (4,76 г, 5,28 ммоль) и реакционную смесь перемешивали в течение ночи. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (10 мл) и экстрагировалиEtOAc (515 мл). Объединенные органические слои высушивали над Na2SO4, фильтровали и упаривали досуха, получая сырой продукт, который очищали ВЭЖХ с обратной фазой согласно способу 2-колонка В,получая желаемый 6'-трифторацетил-2',3-ди-PNZ-1-(N-Вос-3-амино-2(S)-гидроксипропионил)сизомицин (1,66 г, 1,52 ммоль, 29%-ный выход, чистота 95%): MS m/e [M+H]+ рассчит. 1089,4,найдено 1089,2, [M+Na]+ 1111,3. 6'-Трифторацетил-2',3-ди-PNZ-1-(N-Boc-3-амино-2(S)-гидроксипропионил)-3"-Boc-сизомицин К перемешиваемой суспензии 6'-трифторацетил-2',3-ди-PNZ-1-(N-Boc-3-амино-2(S)-гидроксипропионил)сизомицина (1,66 г, 1,52 ммоль) в MeOH (20 мл) при 0C добавляли DIPEA (0,53 мл, 3,05 ммоль),затем Вос-ангидрид (0,52 мл, 2,29 ммоль) и реакционной смеси давали нагреться до температуры окружающей среды. Через 2 ч все ингредиенты растворялись. Реакционную смесь охлаждали до 0 и гасили глицином (0,5 г, 6,66 ммоль) и насыщенным водным раствором NaHCO3. Реакционную смесь экстрагировали EtOAc (320 мл) и объединенные органические слои высушивали над Na2SO4, фильтровали и упаривали досуха, получая 6'-трифторацетил-2',3-ди-PNZ-1-(N-Boc-3-амино-2(S)-гидроксипропионил)3"-Boc-сизомицин (MS m/e [M+H]+ рассчит. 1189,4, найдено 1188,8, [M+Na]+ 1211,3), который использовали на следующей стадии без дальнейшей очистки. 6'-Трифторацетил-2',3-ди-PNZ-1-(N-Boc-3-амино-2(S)-гидроксипропионил)-3"-Boc-сизомицин (1,52 ммоль) растворяли в MeOH (12 мл), добавляли конц. NH4OH (20 мл) и реакционную смесь перемешивали в течение ночи. Выпаривание растворителя дало сырой продукт, который очищали ВЭЖХ с обратной фазой согласно способу 2-колонка В, получая желаемый 2',3-ди-PNZ-1-(N-Вос-3-амино-2(S)гидроксипропионил)-3"-Boc-сизомицин (0,96 г, 0,79 ммоль, выход 51,9%, чистота 95%): MS m/e [M+H]+ рассчит. 1093,4, найдено 1093,2, [M+Na]+ 1115,3. 6'-Трифторацетил-2',3-ди-PNZ-1-(N-PNZ-4-амино-2(S)-гидроксибутирил)сизомицинDMF (50 мл) медленно добавляли HONB (0,884 г, 4,9 ммоль) и EDC (0,945 г, 4,9 ммоль) и реакционную смесь перемешивали в течение 2 ч. Затем добавляли 6'-трифторацетил-2',3-ди-PNZ-сизомицин (3,42 г, 3,8 ммоль) и реакционную смесь перемешивали в течение ночи. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (30 мл) и экстрагировали EtOAc (550 мл). Объединенные органические слои высушивали над MgSO4, фильтровали и концентрировали, получая желаемый 6'-трифторацетил 2',3-ди-PNZ-1-(N-PNZ-3-амино-2(S)-гидроксибутирил)сизомицин (MS m/e [M+H]+ 1182,4, найдено 1182,4), который использовали на следующей стадии без дальнейшей очистки. 6'-Трифторацетил-2',3-ди-PNZ-1-(N-PNZ-4-амино-2(S)-гидроксибутирил)-3"-Boc-сизомицин К перемешиваемому раствору 6'-трифторацетил-2',3-ди-PNZ-1-(N-PNZ-3-амино-2-(S)-гидроксибутирил)сизомицина (4,9 ммоль) в MeOH (50 мл) при 0C добавляли DIPEA (1,70 мл, 9,8 ммоль), затем Вос-ангидрид (1,6 г, 7,35 ммоль) и реакционной смеси давали нагреться до температуры окружающей среды. Реакционную смесь затем охлаждали до 0C и гасили глицином (1,10 г, 14,7 ммоль) и насыщенным водным раствором NaHCO3. Реакционную смесь экстрагировали EtOAc (350 мл) и объединенные органические слои высушивали над MgSO4, фильтровали и упаривали досуха, получая 6'-трифторацетил 2',3-ди-PNZ-1-(N-PNZ-4-амино-2(S)-гидроксибутирил)-3"-Boc-сизомицин, который использовали на следующей стадии без дальнейшей очистки. 2',3-Ди-PNZ-1-(N-PNZ-4-амино-2(S)-гидроксибутирил)-3"-Вос-сизомицин(4,9 ммоль) растворяли в MeOH (30 мл), добавляли конц. NH4OH (50 мл) и реакционную смесь перемешивали в течение ночи. Выпаривание растворителя дало сырой продукт, который очищали ВЭЖХ с обратной фазой согласно способу 2-колонка В, получая желаемый продукт 2',3-ди-PNZ-1-(N-PNZ-4-амино-2(S)гидроксибутирил)-3"-Boc-сизомицин. MS m/e [M+H]+ рассчит. 1186,4, найдено 1186,3. 6'-PNZ-Сизомицин К перемешиваемому раствору сизомицина (19,1 г, 42,65 ммоль) в MeOH (300 мл) добавлялиZn(OAc)2 (23,5 г, 0,128 моль) и реакционную смесь перемешивали в течение 1 ч до растворения всего цинка. Затем по каплям за 3 ч добавляли раствор (N-гидрокси-5-норборнен-2,3-дикарбоксилимидо)-4 нитробензоата (15,28 г, 42,65 ммоль) в DCM (150 мл) и реакционную смесь перемешивали в течение ночи. Затем реакционную смесь концентрировали досуха, получая сырой продукт, который медленно добавляли к энергично перемешиваемому раствору 10%-ного водного раствора NH4OH (480 мл) и DCM(180 мл). Водный слой отделяли, промывали DCM (3160 мл) и разбавляли солевым раствором (250 мл). Водный слой экстрагировали DCM:IPA (7:3 об./об., 4160 мл). Объединенные органические слои промывали 10%-ным водным раствором NH4OH:солевым раствором (7:3 об./об., 200 мл), высушивали надTHF (200 мл) при 0C добавляли триэтиламин (0,65 мл, 4,8 ммоль) с последующим добавлением по каплям раствора Boc2O (29,23 г, 0,134 моль) в THF (30 мл) и реакционную смесь перемешивали в течение ночи с постепенным нагреванием до температуры окружающей среды. Образовывали осадок, который фильтровали и промывали холодным THF (200 мл). Сырое твердое вещество энергично перемешивали вMeOH (100 мл) в течение 1 ч, затем отфильтровывали, промывали MeOH (50 мл) и высушивали под высоким вакуумом,получая желаемый(N-гидрокси-5-норборнен-2,3-дикарбоксилимидо)-третбутилкарбонат в форме твердого вещества белого цвета (28,0 г, 0,1 моль, выход 89,3%): TLC (гексаны:этилацетат, 1:1 об. /об.) Rf=0,44; ЯМР (400 МГц, ДМСО-d6)6,10 (ушир.с, 2H), 3,48 (ушир.с, 2H),3,29-3,32 (м, 2H), 1,58-1,62 (м, 1H), 1,50-1,55 (м, 1H), 1,47 (с, 9H).Zn(OAc)2 (5,15 г, 28,05 ммоль) и реакционную смесь перемешивали в течение 1 ч, пока все твердые частицы не растворились. Раствор (N-гидрокси-5-норборнен-2,3-дикарбоксилимидо)-трет-бутилкарбонат(4,96 г, 17,77 ммоль) в THF (48 мл) добавляли по каплям за 4 ч и реакционную смесь перемешивали в течение ночи. Затем добавляли триэтиламин (2,61 мл, 18,7 ммоль), затем раствор (N-гидрокси-5 норборнен-2,3-дикарбоксилимидо)-трет-бутилкарбоната (1,31 г, 4,68 ммоль) в THF (12 мл) и реакционную смесь перемешивали в течение дополнительных 24 ч. Реакционную смесь гасили добавлением глицина (2,81 г, 37,4 ммоль). Растворитель удаляли в роторном испарителе, получая остаток, который растворяли в DCM (2 00 мл) и промывали смесью H2O:конц. NH4OH (7:3 об./об., 350 мл). Органический слой высушивали над MgSO4, фильтровали и концентрировали досуха. Твердые частицы растворяли в водном растворе 0,1 М АсОН (2,0 л) и промывали смесью этилацетат:простой диэтиловый эфир (9:1 об./об., 41,0 л). Водный слой затем подщелачивали до pH 10 с помощью конц. NH4OH, превращали в соль и экстрагировали этилацетатом (330 мл). Объединенные органические слои высушивали надTHF (200 мл) при 0C добавляли N-метилморфолин (4,53 ноля, 0,041 моль) с последующим добавлением по каплям раствора 9-флуоренилметил хлорформиата (10,15 г, 0,039 моль) в THF (50 мл) и реакционную смесь перемешивали в течение ночи с постепенным нагреванием до температуры окружающей среды. Колбу затем охлаждали до 0C и осажденные соли удаляли фильтрацией. Фильтрат концентрировали под вакуумом, получая воскообразный остаток, который осаждали из метанола, получая (N-гидрокси-5 норборнен-2,3-дикарбоксилимидо)-9-флуорен-ацетат (9,9 г, 0,025 моль, выход 61,0%), который использовали на следующей стадии без дальнейшей очистки: TLC (гексаны:этилацетат 3:1 об./об.) Rf=0,28. 6'-PNZ-2',3,3"-Три-Boc-1-Fmoc-сизомицин К перемешиваемому раствору 6'-PNZ-2',3-ди-Вос-сизомицина (7,38 г, 8,93 ммоль) в THF (200 мл) добавляли (N-гидрокси-5-норборнен-2,3-дикарбоксилимидо)-9-флуорен-ацетат (2,51 г, 6,25 ммоль) и реакционную смесь перемешивали в течение 1 ч, контролируя протекание реакции с помощью ВЭЖХ иMS (MS m/e [M+H]+ рассчит. 1049,5, найдено 1049,4). Добавляли дополнительное количество (Nгидрокси-5-норборнен-2,3-дикарбоксилимидо)-9-флуорен-ацетата (0,05 экв) и реакционную смесь перемешивали в течение 1,5 ч. Затем добавляли N-метилморфолин (0,98 мл, 8,93 ммоль) с последующим добавлением Вос-ангидрида (3,94 г, 17,85 ммоль) и реакционную смесь перемешивали в течение 3 ч. Реакционную смесь гасили добавлением глицина (7,51 г, 40,18 ммоль) и перемешивали в течение ночи. Осажденные соли фильтровали и полученный раствор концентрировали досуха, получая остаток, который растворяли в DCM (150 мл) и промывали насыщенным водным раствором NaHCO3 (380 мл), 1 М ли- 26017824 монной кислоты (380 мл), H2O:NaHCO3 (1:1 об./об., 80 мл), солевым раствором (40 мл) и высушивали над MgSO4. Фильтрация и выпаривание растворителя дали желаемый 6'-PNZ-2',3,3"-три-Boc-1-Fmocсизомицин (MS m/e [M+Na]+ рассчит. 1171,5, найдено 1171,3), который использовали на следующей стадии без дальнейшей очистки. 6'-PNZ-2',3,3"-Три-Boc-сизомицин К перемешиваемому раствору 6'-PNZ-2',3,3"-три-Boc-1-Fmoc-сизомицина (8,93 ммоль) в DCM (150 мл) медленно добавляли трис-(2-аминоэтил)амин (13,37 мл, 89,27 ммоль) и реакционную смесь перемешивали в течение 45 мин. Реакционную смесь затем промывали солевым раствором (3100 мл), подкисляли до pH 5,5 с помощью фосфатного буферного раствора (2500 мл, 1100 мл), H2O (100 мл), промывали насыщенным водным раствором NaHCO3 (100 мл) и солевым раствором (100 мл). Органическую фазу концентрировали, получая сырой продукт, который очищали ВЭЖХ с обратной фазой согласно способу 2-колонка В, получая желаемый 6'-PNZ-2',3,3"-три-Boc-сизомицин (2,77 г, 2,99 ммоль, выход 33,5%, 93%-ная чистота): MS m/e [M+H]+ рассчит. 927,4, найдено 927,2. 6'-PNZ-2',3,3"-Три-Boc-1-(N-Boc-3-амино-2(S)-гидроксипропионил)сизомицин К перемешиваемому раствору N-Boc-3-амино-2(S)-гидроксипропионовой кислоты (0,93 г, 4,53 ммоль) в DMF (8 мл) медленно добавляли HONB (0,82 г, 4,53 ммоль) и EDC (0,87 г, 4,53 ммоль) и реакционную смесь перемешивали в течение 2 ч. Затем добавляли 6'-PNZ-2',3,3"-три-Boc-сизомицин (3,0 г,3,23 ммоль) и реакционную смесь перемешивали в течение ночи. Реакционную смесь гасили H2O (10 мл) и экстрагировали EtOAc (515 мл). Объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали досуха, получая желаемый 6'-PNZ-2',3,3"-три-Boc-1-(N-Boc-3-амино-2(S)гидроксипропионил)сизомицин (MS m/e [M+H]+ рассчит. 1114,5, найдено 1113,9, [M+Na]+ 1136,3), который использовали на следующей стадии без дальнейшей очистки. 2',3,3"-Три-Boc-1-(N-Boc-3-амино-2(S)-гидроксипропионил)сизомицин К перемешиваемому раствору S-4-амино-2-гидроксимасляной кислоты (51,98 г, 0,44 моль) в смеси диоксан:H2O (2 L, 1:1 об./об.) добавляли K2CO3 (106 г, 0,91 моль), затем раствор Вос-ангидрида (100 г,0,46 моль) в диоксане (100 мл) и реакционную смесь перемешивали в течение ночи. Реакционную смесь промывали DCM (2300 мл) и водный слой подкисляли до pH 2 с помощью Н 3 РО 4. Водный слой экстрагировали DCM (2300 мл) и объединенные органические слои высушивали над MgSO4, фильтровали и концентрировали досуха, получая желаемую N-Boc-4-амино-2(S)-гидроксимасляную кислоту (48,2 г,50%-ный выход). 6'-PNZ-2',3,3"-Три-Boc-1-(N-Boc-4-амино-2(S)-гидроксибутирил)сизомицинDMF (12 мл) медленно добавляли HONB (1,11 г, 6,17 ммоль) и EDC (1,18 г, 6,17 ммоль). Затем медленно добавляли раствор 6'-PNZ-2',3,3"-три-Вос-сизомицина (4,4 г, 4,75 ммоль) в DMF (13 мл) и реакционную смесь перемешивали в течение ночи. Реакционную смесь охлаждали до 0C и гасили насыщенным водным раствором NaHCO3 (20 мл) и экстрагировали EtOAc (50 мл). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 (220 мл), солевым раствором (25 мл), высушивали надMgSO4, фильтровали и концентрировали досуха, получая желаемый 6'-PNZ-2',3,3"-три-Boc-1-(N-Boc-4 амино-2(S)-гидроксибутирил)сизомицин (MS m/e [M+H]+ рассчит. 1128,5, найдено 1129,4), который использовали на следующей стадии без дальнейшей очистки. 2',3,3"-Три-Boc-1-(N-Boc-4-амино-2(S)-гидроксибутирил)сизомицин Сизомицин (12,9 г, 28,9 ммоль) и ацетат никеля(II) (29 г, 115,6 ммоль) растворяли в метаноле (900 мл) и зеленый раствор охлаждали в ванне, содержащей воду со льдом. К этому раствору добавляли 2,4- 28017824 диоксо-3-азабицикло[3.2.1]окт-6-ен-3-ил-4-нитробензил карбонат (16,6 г, 46,2 ммоль) в форме твердого вещества. Смеси давали медленно нагреться до температуры окружающей среды и перемешивали в течение ночи. Раствор концентрировали в вакууме, получая зеленое масло, и это масло разделяли между концентрированным гидроксидом аммония (12 М) и этилацетатом. Фазы разделяли и фиолетовую водную фазу повторно экстрагировали один раз этилацетатом. Объединенные этилацетатные фазы промывали один раз солевым раствором, разбавляли 10 об.% изопропанола и экстрагировали три раза 5%-ным водным раствором уксусной кислоты. Объединенные фазы уксусной кислоты подщелачивали с помощью 6 М NaOH до pH11 и затем дважды экстрагировали этилацетатом. Две конечные этилацетатные фазы объединяли и промывали один раз солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали до 1/2 объема в вакууме. Продукт, осажденный в ходе концентрации, отделяли фильтрацией, получая 6',2'-ди-PNZ-сизомицин (12,1 г, 65%-ный выход) в форме твердого вещества белого цвета. MS m/e [M+H]+ рассчит. 806,3, найдено 806,2. 6',2'-Ди-PNZ-1,3,3"-три-Boc-сизомицин(70 мл) в колбе, помещенной в водяную баню, добавляли ди-трет-бутилдикарбонат (5,8 мл, 5,51 г, 25,5 ммоль). Через 2 ч добавляли глицин (1,9 г, 25,5 ммоль), воду (70 мл) и 1 М карбоната натрия (15 мл) и смесь энергично перемешивали в течение 12 ч. Смесь концентрировали, чтобы удалить THF и метанол, и добавляли воду (100 мл), чтобы суспендировать твердые частицы. Твердые частицы отделяли фильтрацией, промывали водой и высушивали, получая 6',2'-ди-PNZ-1,3,3"-три-Boc-сизомицин (5,41 г, 96%-ный выход) в форме твердого вещества белого цвета. Rf 0,15 (CHCl3:5% IPA об./об., УФ) MS m/e [M-Boc]+ рассчит. 1006,5, найдено 1006,4. 1,3,3"-Три-Boc-сизомицин 6',2'-Ди-PNZ-1,3,3"-три-Boc-сизомицин (4,84 г, 4,38 ммоль) и гидросульфит натрия (7,6 г, 44 ммоль) объединяли с этанолом (70 мл) и водой (70 мл) в колбе. Колбу оснащали конденсатором и смесь нагревали при 60C в течение 12 ч. Смесь затем нагревали при 65C в течение дополнительных 3 ч, после чего охлаждали до температуры окружающей среды. Смесь разделяли между 0,2 М NaOH и этилацетатом и фазы разделяли. Водную фазу снова экстрагировали один раз этилацетатом. Объединенные органические фазы промывали один раз солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали, получая масло. Масло растирали с простым эфиром и твердые частицы отделяли фильтрацией, получая 6',2'-ди-PNZ-1,3,3"-три-Boc-сизомицин (2,71 г, 83%-ный выход) в форме твердого вещества белого цвета. Rf 0,23 (IPA: CHCl3 4:1, с 2% NH3, УФ, нингидрин); MS m/e [M+H]+ рассчит. 748,4, найдено 748,3.
МПК / Метки
МПК: A61K 31/7036, A61P 31/04, C07H 15/222
Метки: аминогликозида, антибактериальные, аналоги
Код ссылки
<a href="https://eas.patents.su/30-17824-antibakterialnye-analogi-aminoglikozida.html" rel="bookmark" title="База патентов Евразийского Союза">Антибактериальные аналоги аминогликозида</a>
Предыдущий патент: Способ изготовления пневматической шины для тяжелых автомобилей
Следующий патент: Контейнер с соединенными пачками
Случайный патент: Способ добычи углеводородов из подземных пластов (варианты)