Способ лечения обычной простуды или аллергического ринита
Формула / Реферат
1. Способ лечения или уменьшения интенсивности симптомов обычной простуды или аллергического ринита у млекопитающих, который включает введение нуждающемуся в этом млекопитающему эффективного количества агониста 5-HT1F серотонина.
2. Способ по п.1, отличающийся тем, что агонист 5-HT1F серотонина проявляет селективность по отношению к 5-HT1F рецептору в сравнении с другими рецепторами.
3. Способ по п.1, отличающийся тем, что агонист 5-HT1F серотонина представляет собой соединение формулы

в которой А-В обозначает -СН-СН2- или -С=СН-;
Х обозначает Н, галоген, C1-C4алкокси, C1-C4алкилтио, C1-C4алкил, бензилокси, гидрокси или карбоксамидо;
n обозначает 1-4;
Аr обозначает пиридинил, пирролил или структуру формулы
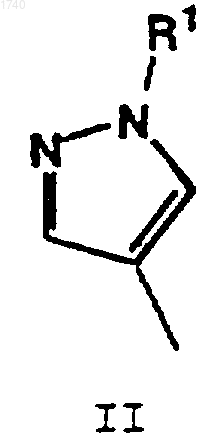
где R1 обозначает Н, C1-C6алкил, C3-C7циклоалкил, C3-C7циклоалкилметил, бензил, фенил или замещенный фенил.
4. Способ по п.1, отличающийся тем, что агонист 5-HT1F серотонина представляет собой соединение формулы

в которой А-В обозначает -СН-СН2- или -С=СН-;
Х обозначает Н, галоген, C1-C4алкокси, C1-C4алкилтио, C1-C4алкил, бензилокси, гидрокси или карбоксамидо;
Y обозначает О, S или связь;
n обозначает 1-4;
Аr обозначает 1-нафтил, 2-нафтил, фенил или монозамещенный фенил с заместителем, выбранным из группы, состоящей из галогена, C1-C4алкокси, C1-C4алкилтио, C1-C4алкила, бензилокси, гидрокси или трифторметила.
5. Способ по п.1, отличающийся тем, что агонист 5-HT1F серотонина представляет собой соединение формулы
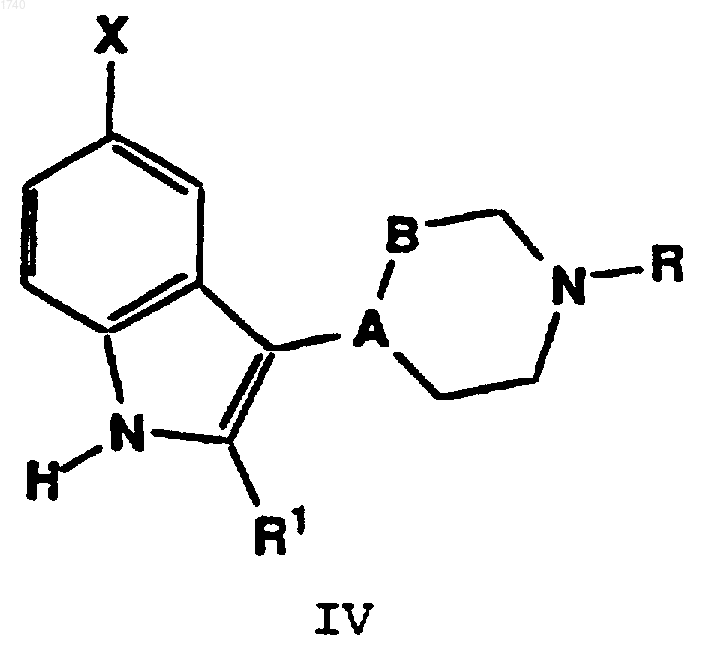
в которой А-В обозначает -СН-СН2- или -С=СН-;
R обозначает Н или C1-C6алкил;
R1 обозначает Н или C1-C4алкил;
Х обозначает -S-R2, -C(O)R3, -C(O)NR4R15, -NR5R6, -NR7SO2R8, -NHC(Q)NR10R11, -NHC(O)OR12 или -NR13C(О)R14;
где Q обозначает О или S;
R2 обозначает фенил, замещенный фенил, фенил(C1-C4алкилен), фенил(C1-C4алкилен), замещенный в фенильном кольце, или пиридинил;
R3 обозначает C1-C6алкил, фенил(C1-C4алкилен), фенил(C1-C4алкилен), замещенный в фенильном кольце, нафтил, N-метил-N-метоксиамино, гетероарил, замещенный гетероарил, гетероарил(C1-C4алкил) или замещенный гетероарил(C1-C4алкил);
R4 обозначает гетероарил, замещенный гетероарил, гетероарил(C1-C4алкил) или замещенный гетероарил(C1-C4алкил);
R4 и R15, взятые вместе с атомом азота, образуют пирролидиновое, пиперидиновое, замещенное пиперидиновое, пиперазиновое, 4-замещенное пиперазиновое, морфолиновое или тиоморфолиновое кольцо;
R5 и R6 оба обозначают трифторметансульфонил;
R7 обозначает Н или C1-C4алкил;
R8 обозначает C1-C4алкил, фенил, замещенный фенил или ди(C1-C4алкил)амино;
R10 и R11 выбирают независимо друг от друга из группы, состоящей из C1-C6алкила, C3-C6алкенила, C3-C8циклоалкила, фенила, замещенного фенила, фенил(C1-C4алкилена), фенил(C1-C4алкилена), замещенного в фенильном кольце, ((C1-C4алкил или C1-C4алкоксикарбонилзамещенные)C1-C4алкил)фенила, C1-C4алкила, замещенного в a-положении C1-C4алкоксикарбонилом; или
R10 и R11, взятые вместе с атомом азота, образуют пирролидиновое, пиперидиновое, пиперазиновое, 4-замещенное пиперазиновое, морфолиновое или тиоморфолиновое кольцо;
R12 обозначает C1-C6алкил, C3-C6алкенил, фенил, замещенный фенил, C3-C8циклоалкил, C1-C4алкил, замещенный в w-положении C1-C4алкокси;
R13 обозначает Н или C1-C4алкил;
R14 обозначает C1-C10алкил, замещенный заместителями в количестве до трех, выбранными из группы, состоящей из гидрокси, C1-C4алкокси, галогена, арилокси, C1-C4алкоксикарбонила и гетероарилокси, C2-C10алкенила, C2-C10алкинила, C3-C8циклоалкила, фенила, замещенного фенила, нафтила, фенила(C1-C4алкилен), фенила(C1-C4алкилен), замещенного в фенильном кольце, 2-фенилэтилен-1-ил, дифенилметила, конъюгированного с бензольным кольцом C4-C8циклоалкила, C1-C4алкилена, замещенного в w-положении C3-C6циклоалкилом, или гетероцикла; и
R15 обозначает водород или C1-C6алкил.
6. Способ по п.5, отличающийся тем, что агонист 5-HT1F серотонина представляет собой N-(4-фторбензоил)-5-амино-3-(1-метилпиперидин-4-ил)-1H-индол.
7. Способ по п.1, отличающийся тем, что агонист 5-HT1F серотонина представляет собой соединение формулы
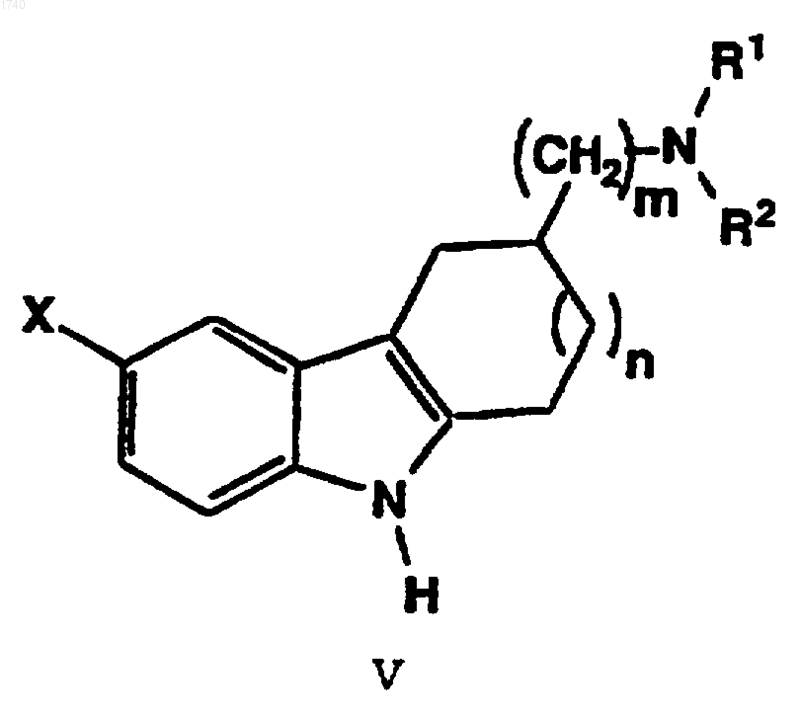
в которой R1 и R2 обозначают независимо друг от друга водород, C1-C4алкил или -СН2СН2-арил, где арил обозначает фенил, фенил, замещенный в одном положении галогеном, или 1-(C1-C6алкил)пиразол -4-ил;
Х обозначает -ОН, -NHC(O)R3, -NHC(Y)NHR4, -NHC(O)OR5, -C(O)R6 или -NHSO2R7;
R3 обозначает C1-C6алкил, C2-C6алкенил, C3-C8циклоалкил, фенил, замещенный фенил, нафтил, (C1-C4алкилен)фенил, тиенилметил или гетероцикл;
R4 обозначает C1-C6алкил, фенил или фенил, замещенный в двух положениях галогеном;
R5 обозначает C1-C6алкил, C2-C6алкенил, бензил или фенил, замещенный в одном положении галогеном;
R6 обозначает C1-C6алкил, фенил или фенил, замещенный в одном положении галогеном или C1-C4алкокси;
R7 обозначает диметиламино, фенил или фенил, замещенный в одном положении галогеном или C1-C4алкилом;
m обозначает 0 или 1;
n обозначает 1 или 2; и
Y обозначает S или О.
8. Способ по п.1, отличающийся тем, что агонист 5-HT1F ceротонина представляет собой соединение формулы
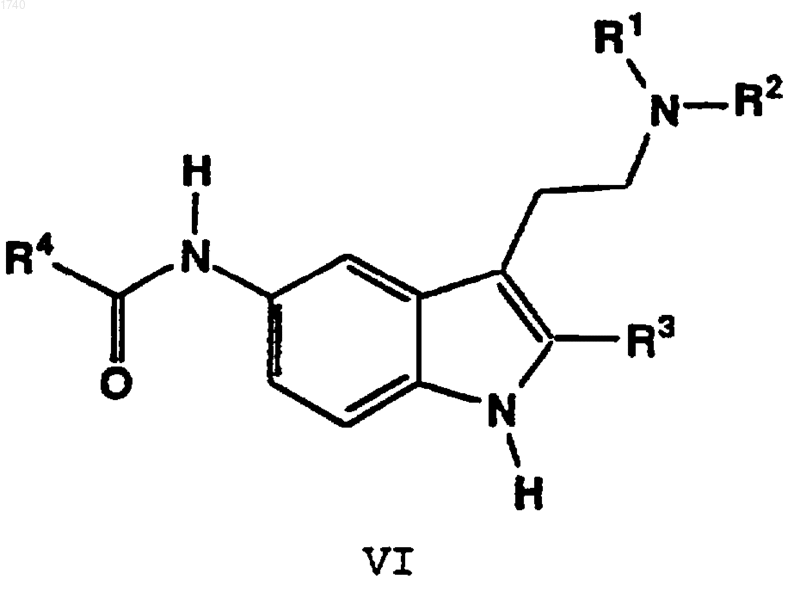
в которой R1 обозначает C1-C4алкил;
R2 обозначает C1-C4алкшы, циклоалкил-(C1-C3алкилен), арил-(C1-C3алкилен) или гетероарил-(C1-C3алкилен);
R3 обозначает C1-C4алкил или фенил;
R4 обозначает C1-C4алкил, C3-C7циклоалкил, фенил, замещенный фенил, бифенилил, нафтил или гетероцикл;
и его фармацевтически приемлемые соли присоединения кислоты.
9. Способ по любому из пп.1-8, в котором млекопитающим является человек.
Текст
1 Результаты многочисленных исследований, проведенных после открытия около сорока лет назад серотонина (5-гидрокситриптамина, 5 НТ), указывают на то, что серотонин играет важную роль в организме млекопитающих, принимая участие в функционировании как центральной нервной системы, так и периферической системы. Морфологические исследования центральной нервной системы показали, что серотонергические нейроны, происходящие из ствола мозга, образуют очень диффузную систему, которая связана со значительными участками головного и спинного мозга (R.A. O'Brien,Serotonin in Mental Abnormalities, 1:41 (1978);(1966. Указанные исследования сопровождались биохимическими данными, которые показали наличие больших концентраций 5-НТ в головном и спинном мозге (H.W.M. Steinbusch,supra). С точки зрения столь диффузного характера системы, не удивительно, что входящий в нее 5-НТ функционирует через участие в механизмах экспрессии множества поведенческих, физиологических реакций и заболеваний, связанных с центральной нервной системой. Они включают такие различные проявления как сон,принятие пищи, ощущение боли, регуляция температуры тела, регуляция давления крови,депрессия, шизофрения и другие состояния организма (R.W. Fuller, Biology of Serotonergicin Mental Abnormalities 1:316 (1978); J. Barchas,et al., Serotonin and Behavior, (1973. Серотонин играет также важную роль в периферической системе. Так, например, примерно 90% серотонина организма синтезируется в желудочно-кишечном тракте, который, как было показано, опосредует множество сократительных, секреторных и электрофизиологических функций этой системы. Серотонин может захватываться тромбоцитами и высвобождаться при агрегации тромбоцитов, в связи с чем сердечно-сосудистая система может представлять собой еще один пример периферической сети,которая обладает большой чувствительностью к серотонину. Широкое распространение серотонина в организме делает понятным тот громадный интерес к лекарственным средствам, которые воздействуют на серотонергические системы. В частности, представляют большой интерес рецептор-чувствительные агонисты и антагонисты, пригодные для лечения широкого перечня заболеваний, включая беспокойство, депрессию, гипертензию, мигрень, компульсивные расстройства, шизофрению, аутизм, нейродегенеративные расстройства, такие как болезнь Альцгеймера, паркинсонизм и хорея Хантингтона, а также рвоту, вызванную химиотерапией рака (M.D. Gershon, et al., The Peripheral ActionsSupplement 7 (1990. Серотонин оказывает воздействие на физиологию клетки при связывании со специфическими рецепторами на клеточной поверхности. В настоящее время известно, что существует множество типов рецепторов для различных нейромедиаторов и гормонов, включая серотонин. Наличие различных структурно различающихся рецепторов серотонина дает возможность создавать фармакологические средства, селективные по отношению к тому или иному подтипу. Результатом разработки таких соединений могут стать новые лекарственные средства с повышенной селективностью и меньшим количеством побочных эффектов, поскольку активация индивидуальных рецепторных подтипов должна будет проявляться через специфическое воздействие на различные части центральной и/или периферической серотонергических систем. Пример такой специфичности может быть продемонстрирован на модели сосудистой системы. В некоторых кровеносных сосудах стимуляция 5-НТ 1-подобных рецепторов на эндотелиальных клетках приводит к вазодилатации,тогда как стимулирование 5-HT2 рецепторов в клетках гладких мышц приводит к вазоконстрикции. В настоящее время известно, что основные классы рецепторов серотонина (5-HT1, 5-НТ 2, 5 НТ 3, 5-НТ 4, 5-HT5, 5-HT6 и 5-НТ 7) содержат от четырнадцати до восемнадцати отдельных рецепторов, которые формально классифицированы на основе их фармакологических или структурных различий. [Прекрасный обзор фармакологического действия и клинических проявлений различных типов 5-НТ рецепторов приведен в работе (Glennon, et al., Neuroscience andBehavioral Reviews, 14:35 (1990)]. Давно известно, что пыльца вызывает аллергический ринит, называемый обычно "сенной лихорадкой". Пыльца содержит протеазы,которые индуцируют высвобождение медиаторов из тучных клеток, стимулируя, таким образом, биосинтез IgE. Грануляция тучных клеток под действием IgE приводит к высвобождению гистаминов, что, в свою очередь, ведет к развитию воспалительной реакции, которая вызывает гиперемию, зуд и набухание полостей. В слизи больных с аллергией присутствует много эозинофилов, а в слизи инфицированных больных имеются нейтрофилы. Антигистамины относятся к широко используемым лекарственным средствам, которые при пероральном употреблении способны вызывать седативный эффект. Альтернативно была показана эффективность назальных спреев, содержащих натрий-кромолин, поскольку кромолин действует посредством блокирования реакции аллергена с тучными клетками тканей. 3 Кромолин недостаточно эффективен, так как, по всей видимости, не связывается с рядом медиаторов воспаления или активаторов биосинтезаIgE, которые стимулируют дегрануляцию тучных клеток и выход гистаминов из тучных клеток. Воспаление представляет собой неспецифическую реакцию тканей на различные стимулы или поражения и приводит к высвобождению материала в месте воспаления, что вызывает боль. В настоящее время известно, что тучные клетки, нейтрофилы и Т-клетки участвуют в патофизиологии воспаления кожи, а также других физиологических расстройств. Тучные клетки представляют собой самый обширный источник гистаминов при остром воспалении,так же как и химаз после дегрануляции под действием IgE."Обычная простуда" представляет собой сокращенный термин, используемый врачами,который относится к индивидуумам, соответствующим по симптоматике небольшому острому респираторному заболеванию. С момента идентификации риновируса в 1956 г. было накоплено много данных по этиологии и эпидемиологии обычной простуды. Известно, что обычная простуда - это не одно заболевание, а представляет собой скорее группу заболеваний, вызванных представителями нескольких семейств вирусов,включая вирусы парагриппа, риновирусы, респираторные синцитиальные вирусы, энтеровирусы и коронавирусы. Была проведена большая работа по характеристике вирусов, которые вызывают обычную простуду. Кроме того, уже в значительной степени понятна молекулярная биология риновирусов, наиболее важных вирусов, вызывающих обычную простуду. Однако несмотря на указанные успехи, был достигнут весьма умеренный прогресс в области лечения обычной простуды. Несмотря на то, что в настоящее время имеется множество соединений,обладающих антивирусной активностью против вируса простуды в клеточной культуре, при использовании у пациентов эти антивирусные соединения демонстрируют ограниченную эффективность. Таким образом, в настоящее время сложилась весьма неудовлетворительная ситуация,связанная с лечением обычной простуды и аллергического ринита у нуждающихся в этом людей, что определяет настоятельную потребность в разработке более эффективного и безопасного способа лечения. Настоящее изобретение относится к способам лечения или уменьшения интенсивности симптомов обычной простуды или аллергического ринита у млекопитающих, которое включает введение млекопитающему, при необходимости, эффективного количества композиции,обладающей активностью агониста серотонина 5-HT1F. 4 Применяемый в контексте настоящего описания термин "аллергический ринит" включает медикаментозный ринит, сухой ринит и атрофический ринит. Было идентифицировано множество рецепторов, связывающих серотонин. Эти рецепторы в основном сгруппированы по семи классам на основании их структуры и фармакологических свойств рецептора, которые определяются по эффективности связывания и с учетом характеристик различных серотонинсвязывающих соединений как потенциальных лекарственных средств. В некоторых из групп были идентифицированы несколько подтипов. [Относительно недавний обзор рецепторов 5 гидрокситриптамина см. Е. Zifa and G. Fillion,Pharmacological Reviews, 44:401-458 (1992); D.al.) приведены для каждого класса или подтипа одно или более соединений, которые обладают эффективностью в качестве антагонистов или агонистов рецептора]. 5-HT1 семейство включает подтипы, которые могут быть сгруппированы на основании отсутствия интронов в клонированных генах,наличия общей системы трансдукции, сопряженной с G-белком (ингибирование аденилатциклазы) и близких характеристик функционирования. Семейство ингибиторов 5-HT1 рецепторов включает подтипы А, В, D, Е и F. 5-HT1 рецепторы, связанные с G-белком, обычно ингибируют продукцию циклического аденозинмонофосфата (цАМФ), тогда как 5-НТ 2 рецепторы, связанные с G-белком, стимулируют гидролиз фосфоинозита. 5-HT1A рецептор был первым клонированным рецептором серотонина у человека. Активированные 5-HT1A рецепторы, экспрессируемые в клетках HeLa, ингибируют активность аденилатциклазы, стимулируемую форсколином. 5-НТ 1D рецептор был первоначально идентифицирован в мембранах мозга быка Хойрингом и Пероутка (R.E. Heuring and S.J. Peroutka,Journal of Neuroscience, 7:894-903 (1987. 5 НТ 1D рецепторы являются самым распространенным подтипом 5-НТ рецептора в мозге человека, и они могут быть идентичны 5-НТ 1 подобному рецептору в черепной сосудистой сети. (S.D. Silberstein, Headache, 34:408-417(1994. Алкалоиды суматриптан и эргот имеют высокое сродство к человеческим 5-НТ 1D и 5HT1B рецепторам Id. 5-HT1F подтип рецептора обладает низким сродством к 5-карбоксамидотриптамину (5-КТ) в отличие от других 5-НТ рецепторов, за исключением 5-HT1E подтипа. В отличие от 5HT1E рецепторов, рецепторы 5-HT1F, однако,демонстрируют сродство к суматриптану. Соединение рассматривается как биологически эффективное в качестве агониста 5-HT1F серотонина, если в скрининг-тесте демонстри 5 рует быстрое и точно измеряемое связывание тестируемого соединения с рецептором 5-HT1F серотонина. Как только устанавливается наличие связывания исследуемого соединения с рецептором серотонина 5-HT1F, определяют активность рассматриваемого соединения in vivo. Активность связывания с рецептором серотонина Связывание с 5-HT1F рецептором Способность соединения связываться с рецептором серотонина определяют с использованием стандартных процедур. Так, например,способность соединения связываться с 5-HT1F подтипом рецептора измеряют методом, описанным N. Adham, et al., Proceedings of the National Academy of Sciences (USA), 90:408-412LM(tk-) клетках. Мембранные препараты получают при выращивании таких трансфицированных клеточных линий до слияния. Клетки дважды промывают фосфатно-буферным раствором,соскребают в 5 мл охлажденного на льду фосфатно-буферного раствора и центрифугируют при 200g примерно 5 мин при 4 С. Осадок ресуспендируют в 2,5 мл холодного Трис буфера (20 мМ Трис-HCl, рН 7,4 при 23 С, 5 мМ ЭДТА) и гомогенизируют. Лизат центрифугируют при 200g примерно 5 мин при 4 С до получения крупных фрагментов осадка. Затем супернатант центрифугируют при 40000g примерно 20 мин при 4 С. Мембраны промывают один раз гомогенизирующим буфером и ресуспендируют в 25 мМ глицилглицинового буфера, рН 7,6 при 23 С. Исследования связывания радиоактивно меченого лиганда проводят с использованием[3H]5-HT (20-30 Кюри/ммоль. Эксперименты по конкурентному ингибированию проводят с использованием различных концентраций препарата и 4,5-5,5 нМ [3H]5-HT. Неспецифическое связывание определяют при наличии 10 мкМ 5 НТ. Данные по связыванию анализируют методом нелинейной регрессии. Значения IC50 (ИК 50) превращают в величины Ki с использованием уравнения Ченга-Прусова. Активность в качестве агониста серотонина Аденилатциклазная активность Активность аденилатциклазы определяют в исходных экспериментах на LM(tk-) клетках с использованием стандартных методик. (См.,например, N. Adham, et al., supra,; R.L. Weinshank, et al., Proceedings of the National Academyof Sciences (USA), 89:3630-3634 (1992), и др. цитированные в описании ссылки). Внутриклеточный уровень цАМФ измеряют с использованием приведенной выше клонированной клеточной линии. Клетки прeинкубируют в течение примерно 20 мин при 37 С при содержании 5% двуокиси углерода в 6 среде Дульбекко, модифицированной по методу Игла, содержащей 10 мМ HEPES, 5 мМ теофиллина, и 10 мкМ паргилина. К этой среде добавляют различные концентрации исследуемых соединений с тем, чтобы определить наличие ингибирования форсколинстимулируемой аденилатциклазы. Модели животных для измерения назальной транссудации с использованием морских свинок и крыс Электростимуляция ганглия тройничного нерва Морскую свинку или крысу анестезируют и помещают в условия стереотаксиса. После срединных сагиттальных разрезов скальпа помещают две пары стимулирующих электродов в ганглий тройничного нерва. Обнажают бедренную артерию и внутривенно инъецируют краситель эванс синий в дозе 50 мг/кг. Краситель эванс синий образует комплексы с белками крови и выполняет функцию маркера белковой транссудации. Через 2 мин после инъекции эванса синего левый ганглий тройничного нерва стимулируют в течение 3 мин при плотности тока 1,0 мА (5 Гц, длительностью 4 мс). Через 15 мин после стимуляции животных умерщвляют обескровливанием, проводя перфузию через сердце 40 мл солевого раствора. Сразу же вырезают нос позади разрезов для сбора назальной слизистой ткани и носовой раковины ростральной части носа. Затем удаляют заднюю часть носа для обнажения носовой полости. Слизистую оболочку и носовую и верхнечелюстную части носовой раковины удаляют и взвешивают. Затем эти ткани инкубируют в 4 мл диметилформамида в течение 18-24 ч для экстрагирования вышедшего красителя эванса синего. Количество диметилформамидного экстракта определяют измерением оптической плотности при 620 нм на спектрофотометре. Концентрацию красителя эванса синего, вышедшего в ткани,определяют интерполяцией на основании по стандартной кривой концентрации эванса синего в диметилформамиде. Способность 5-HT1F агонистов блокировать выход эванса синего в назальные ткани оценивают при введении исследуемым животным внутривенно дозы 5-HT1F агониста за 8 мин до инъекции красителя эванса синего. Внутривенная инъекция и назальное закапывание метахлорфенилпиперазина(мХФП) или нитроглицерина Белковая транссудация под влиянием ганглия тройничного нерва может быть также стимулирована внутривенной инъекцией или назальным закапыванием мХФП или нитроглицерина. Морскую свинку или крысу анестезируют и обнажают бедренную артерию. Затем животному либо инъецируют внутривенно дозу мХФП или нитроглицерина, либо закапывают непосредственно в носовую полость мХФП или нитроглицерин. Через 2 мин после введения мХФП или нитроглицерина вводят внутривенно 7 краситель эванс синий в дозе 50 мг/кг. Через 15 мин после инъекции эванса синего животных умерщвляют обескровливанием перфузией через сердце 40 мл физиологического раствора. Сразу же вырезают нос позади разрезов для сбора назальной слизистой ткани и носовой раковины ростральной части носа. Затем удаляют заднюю часть носа для обнажения носовой полости. Слизистую оболочку и носовую, и верхнечелюстную части носовой раковины удаляют и взвешивают. Затем эти ткани инкубируют в 4 мл диметилформамида в течение 18-24 ч для экстрагирования вышедшего красителя эванса синего. Количество диметилформамидного экстракта определяют измерением оптической плотности при 620 нм на спектрофотометре. Концентрацию красителя эванса синего, вышедшего в ткани, определяют интерполяцией на основании по стандартной кривой концентрации эванса синего в диметилформамиде. Способность 5-HT1F агонистов блокировать выход эванса синего в назальные ткани оценивают при введении исследуемым животным внутривенно дозы 5-HT1F агониста за 8 мин до инъекции красителя эванса синего. Термин "5-HT1F агонист" в контексте настоящего описания обозначает полный или частичный агонист. Соединение, являющееся частичным агонистом 5-HT1F рецептора, должно проявлять достаточную активность в качестве агониста, обеспечивающую проявление нужного биологического эффекта в приемлемой дозе. По методу настоящего изобретения может быть использован частичный агонист относительно любой присущей организму активности, однако,предпочтительны частичные агонисты, демонстрирующие, по меньшей мере, 50% эффекта агониста (Емакс), и более предпочтительны частичные агонисты, более предпочтительны, по меньшей мере, 80% эффекта агониста (Емакс). Наиболее предпочтительными являются полные агонисты 5-HT1F рецептора. В технике известно множество 5-HT1F агонистов серотонина, которые применимы по методу настоящего изобретения. Один такой класс соединений представляет собой необязательно замещенные 3-[1,2,3,6-тетрагидро-(1-алкиленгетероарил)-4-пиридинил]-1 Н-индолы и 3-(1 алкиленгетероарил)-4-пиперидинил-1 Н-индолы формулыn обозначает 1-4; Аr обозначает пиридинил, пирролил или структуру формулы где R1 обозначает Н, C1-C6 алкил, C3-C7 циклоалкил, C3-C7 циклоалкилметил, бензил, фенил или замещенный фенил. Эти соединения, их синтез и использование в качестве агонистов 5HT1F серотонина описаны в патенте США 5521196, выданном 28 мая 1996 г. Указанный патент полностью включен в описание в качестве ссылки. Еще один класс 5-HT1F агонистов включает необязательно замещенные 3-[1,2,3,6 тетрагидро-(1-алкиленарил)-4-пиридинил]-1 Ниндолы и 3-(1-алкиленарил)-4-пиперидинил-1 Ниндолы формулыn обозначает 1-4; Аr обозначает 1-нафтил, 2-нафтил, фенил или монозамещенный фенил с заместителем,выбранным из группы, состоящей из галогена,C1-C4 алкокси, C1-C4 алкилтио, C1-C4 алкила, бензилокси, гидрокси или трифторметила. Эти соединения, их синтез и использование в качестве 5-HT1F агонистов серотонина описаны в патенте США 5521197, выданном 28 мая 1996 г. Указанный патент полностью включен в описание в качестве ссылки. Соединения формул I и III могут быть получены с использованием методов, известных специалистам в данной области. В общих чертах, он сводится к реакции соответствующим образом замещенного индола с подходящим 1 замещенным-4-пиперидоном в присутствии основания с получением соответствующего 3(1,2,3,6-тетрагидропиридин-4-ил)-1H-индола. Эти соединения могут использоваться непосредственно по методу настоящего изобретения или могут быть восстановлены с получением соответствующих 3-(пиперидин-4-ил)-1H-индолов, применимых по методу настоящего изобретения. Получаемые таким способом соединения могут также служить в качестве субстратов для 9 изготовления других соединений, используемых по методу настоящего изобретения. Еще один класс соединений, применимых для использования по методу настоящего изобретения, включает 5-замещенные-3-(1,2,3,6 тетрагидропиридин-4-ил)-1H-индолы и 5-замещенные-3-(пиперидин-4-ил)-1H-индолы формулыR3 обозначает C1-C6 алкил, фенил (C1C4 алкилен), фенил (C1-C4 алкилен), замещенный в фенильном кольце, нафтил, N-метил-Nметоксиамино, гетероарил, замещенный гетероарил, гетероарил (C1-C4 алкил) или замещенный гетероарил (C1-C4 алкил);R4 обозначает гетероарил, замещенный гетероарил, гетероарил(C1-C4 алкил) или замещенный гетероарил (C1-C4 алкил);R4 и R15, взятые вместе с атомом азота, образуют пирролидиновое, пиперидиновое, замещенное пиперидиновое, пиперазиновое, 4 замещенное пиперазиновое, морфолиновое или тиоморфолиновое кольцо;R8 обозначает C1-C4 алкил, фенил, замещенный фенил или ди(C1-C4 алкил)амино;R10 и R11 выбираются независимо друг от друга из группы, состоящей из C1-C6 алкила, C3C6 алкенила, C3-C8 циклоалкила, фенила, замещенного фенила, фенила(C1-C4 алкилен), фенилаR15 обозначает водород или C1-C6 алкил. Основные химические термины, использованные в вышеприведенных формулах, имеют свои обычные значения. Например, термин "алкил, алкокси и алкилтио" включает такие группы, как метил, этил, н-пропил, изопропил, нбутил, изобутил, втор-бутил, трет-бутил, пентил, 2-пентил-, 3-пентил-, неопентил, гексил,гептил, октил и др. Термин "алкенил" включает винил, аллил, 1-бутен-4-ил, 2-бутен-4-ил, 1 пентен-5-ил, 2-пентен-5-ил, 3-пентен-5-ил, 1 гексен-6-ил, 2-гексен-6-ил, 3-гексен-6-ил, 4 гексен-6-ил и др. Термин "алкинил" включает ацетиленил, пропинил, 2-бутин-4-ил, 1-бутин-4 ил, 1-пентин-5-ил, 2-пентин-5-ил и др. Термин"ацил" включает, например, формил, ацетил,пропаноил, бутаноил и 2-метилпропаноил. Термин "циклоалкил" включает такие группы, как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Термин "фенил (C1-C4 алкилен)" включает такие группы, как бензил, фенетил, фенпропил и фенбутил. Термин "(C1-C4 алкил)сульфонил" включает метансульфонил, этансульфонил, пропансульфонил,изопропансульфонил, бутансульфонил и др. Термин галоген включает фтор, хлор, бром и йод. Термин "замещенный фенил" или "фенил(C1-C4 алкилен), замещенный в фенильном кольце" в контексте настоящего описания означает,что фенильная часть может быть замещена одним заместителем, выбранным из группы, состоящей из галогена, C1-C4 алкила, C1-C8 алкокси,C1-C4 алкилтио, нитро, циано, ди(C1-C4 алкил) амино, трифторметила, трифторметокси, фенила, C1-C4 ацила, бензоила или (C1-C4 алкил) сульфонила или двумя-тремя заместителями,выбранными независимо друг от друга из группы, состоящей из галогена, нитро, C1-C4 алкила или C1-C4 алкокси. Термин "гетероцикл" обозначает стабильные ароматические и неароматические 5- и 6 членные кольца, содержащие от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, при этом указанные 11 кольца могут быть необязательно конъюгированы с бензольным кольцом. Все эти кольца могут быть замещены заместителями в количестве до трех, выбранными независимо друг от друга из группы, состоящей из галогена, C1-C4 алкокси,C1-C4 алкила, циано, нитро, гидрокси, -S(O)n-(C1C4 алкила) и -S(О)n-фенила, где n обозначает 0, 1 или 2. Неароматические кольца включают, например, пирролидинил, пиперидинил, пиперазинил, тетрагидрофурил, оксазолидинил,диоксанил, пиранил и др. Конъюгированные с бензолом неароматические кольца включают индолинил,1,2,3,4-тетрагидрохинолинил,1,2,3,4-тетрагидроизохинолинил и др. Ароматические кольца включают фурил, тиенил, пиридинил, пирролил, N-метилпирролил, оксазолил,изоксазолил, пиразолил, имидазолил, триазолил,оксадиазолил, тиадиазолил, тиазолил, пиримидинил, пиразинил, пиридазинил и др. Конъюгированные с бензолом ароматические кольца включают изохинолинил, бензоксазолил, бензтиазолил, хинолинил, бензофуранил, тионафтил, индолил и др. Термин "гетероарил" обозначает в настоящем контексте ароматический или конъюгированный с бензольным кольцом ароматический гетероцикл, как было определено в предыдущем абзаце. Термин "замещенный гетероарил" обозначает в настоящем контексте ароматический или конъюгированный с бензольным кольцом ароматический гетероцикл, как было определено в предыдущем абзаце, замещенный заместителями в количестве до трех, выбранными независимо друг от друга из группы, состоящей из галогена, C1-C4 алкокси, C1-C4 алкила, циано,нитро, гидрокси, -S(О)n-(C1-C4 алкила) и -S(О)nфенила, где n обозначает 0, 1 или 2. Термин "гетероарил(C1-C4 алкил)" обозначает разветвленную или прямую алкильную цепь, содержащую от 1 до 4 атомов углерода, замещенную в некоторой позиции ароматической или слитой с бензольным кольцом ароматической гетероциклической группой. Термин "замещенный гетероарил(C1-C4 алкил)" обозначает в настоящем контексте разветвленную или прямую алкильную цепь, содержащую от 1 до 4 атомов углерода, замещенную в некоторой позиции ароматической или слитой с бензольным кольцом ароматической гетероциклической группой, которая замещена заместителями в количестве до трех, выбранными независимо друг от друга из группы, состоящей из галогена, C1-C4 алкокси,C1-C4 алкила, циано, нитро, гидрокси, S(O)n-(C1C4 алкила) и S(О)n-фенила, где n обозначает 0, 1 или 2. Термин "гетероарилокси" обозначает гетероарильную или замещенную гетероарильную группу, как было определено в предыдущем абзаце, соединенную с атомом кислорода. Термин "арилокси" обозначает фенильную или замещенную фенильную группу, соединенную с атомом кислорода. 12 Термин "4-замещенный пиперазин" обозначает пиперазиновое кольцо, замещенное в 4 положении заместителем, выбранным из группы, состоящей из C1-C6 алкила, C1-C4 алкокси,замещенного C1-C6 алкилом, фенила, замещенного фенила, фенила(C1-C4 алкилен), фенила(C1C4 алкилен), замещенного в фенильном кольце,гетероарила и гетероарила (C1-C4 алкилен). Термин "замещенный пиперидин" обозначает пиперидиновое кольцо, необязательно замещенное заместителем, выбранным из группы,состоящей из гидрокси, гидроксиметила, и N,Nди(C1-C4 алкил)карбоксамидо. Термин "конъюгированный с бензольным кольцом C4-C8 циклоалкил" обозначает C4C8 циклоалкильную группу, конъюгированную с фенильным кольцом. Примеры таких групп включают бензоциклобутил, инданил, 1,2,3,4 тетрагидронафтил и др. Соединения формулы IV получают с помощью методов, известных специалистам в данной области, таких, в общем, как описанные в патенте США 4443451, который включен в настоящее описание в качестве ссылки. Простые индолы, необходимые для получения соединений по настоящему изобретению, в основном,коммерчески доступны, а их получение описаноChemistry, 59, 6372 (1994); and Russell, et al.,Organic Preparations and Procedures International,17,391 (1985). Соединения по настоящему изобретению,в которых Х обозначает -NR7SO2R8, могут быть получены при модификации вначале соответствующего 5-аминоиндола. Если R7 обозначает водород, 5-аминоиндол взаимодействует с соответствующим галогенидом или ангидридом сульфокислоты с получением соответствующего сульфонамида. Если R7 представляет собой низший алкил, 5-аминоиндол вначале ацилируют и затем восстанавливают соответствующим гидридным восстановителем. Альтернативно, 5 аминоиндол может быть подвергнут восстановительному алкилированию соответствующим альдегидом или кетоном в присутствии подходящего гидридного восстановителя с получением соответствующего замещенного индола. Такие замещенные индолы затем вступают в реакцию с галогенидом или ангидридом сульфокислоты с получением соответствующего сульфонамида. Указанная химическая схема проиллюстрирована на схеме синтеза I, где М обозначает метокси, этокси, метил, этил, пропил или изопропил, LG обозначает хлор или бром, и R1, R7 и R8 определены выше. Если R7 обозначает водород, раствор 5 аминоиндола в подходящем растворителе, таком как тетрагидрофуран, диоксан, диэтиловый эфир или диметилформамид, при температуре от температуры окружающей среды до примерно 0 С вступает в реакцию с коммерчески доступным R8-сульфонилгалогенидом или R8 сульфоновым ангидридом в присутствии подходящего основания, такого как пиридин или триэтиламин. Полученный сульфонамид может быть выделен разбавлением реакционной смеси водой, коррекцией рН и экстракцией в несмешивающийся с водой растворитель, такой как дихлорметан. Продукт может быть использован для дальнейшей реакции как уже готовый или может быть подвергнут очистке методом хроматографии или повторной кристаллизации из подходящего растворителя. Если R7 обозначает низший алкил, проводят реакцию раствора 5-аминоиндола в подходящем растворителе, таком как тетрагидрофуран, диоксан или диэтиловый эфир, при температуре от температуры окружающей среды до примерно 0 С с соединением структуры МС(О)-галоген в присутствии подходящего основания, такого как пиридин или триэтиламин. Полученное соединение выделяют при разбавлении реакционной смеси водой и экстракцией в несмешивающийся с водой растворитель, такой как дихлорметан. Ацилированный таким образом продукт может быть подвергнут либо хроматографической очистке, либо может использоваться непосредственно на последующей стадии. Ацилированный продукт затем растворяют в подходящем растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре от температуры окружающей среды до 14 примерно 0 С, и затем обрабатывают подходящим гидридным восстановителем, таким как диборан или алюмогидрид лития. Реакционную смесь перемешивают от 1 до 24 ч и затем обрабатывают водным раствором сульфата натрия. Полученную суспензию фильтруют, и фильтрат концентрируют под пониженным давлением. Продукт может использоваться для дальнейшей реакции в полученном виде, после хроматографической очистки или после повторной кристаллизации из подходящего растворителя. Альтернативно, раствор 5-аминоиндола в растворителе, пригодном для азеотропного удаления воды, таком как толуол, бензол или циклогексан, взаимодействует при температуре кипения с обратным холодильником с подходящим альдегидом или кетоном, таким как формальдегид, ацетальдегид, пропанал, бутанал или ацетон, в присутствии 0,1-10% источника протонов, такого как р-толуолсульфоновая кислота. После завершения реакции летучие продукты удаляют под пониженным давлением и остаток перерастворяют в алканоле, таком как метанол или этанол. Этот раствор затем помещают в условия гидрогенизации или обрабатывают соответствующим гидридным восстановителем, таким как боргидрид натрия или предпочтительно цианборгидрид натрия, в присутствии безводной кислоты, такой как хлористый водород. Реакционную смесь затем разбавляют водой, обрабатывают основанием и экстрагируют в несмешивающийся с водой растворитель, такой как дихлорметан. Продукт может использоваться в полученном виде для дальнейшей реакции,после очистки хроматографией или после кристаллизации из подходящего растворителя. Указанный продукт обрабатывают коммерчески доступным R8-сульфонилгалогенидом или R8 сульфоновым ангидридом, как было описано выше, с получением нужных сульфонамидов. Соединения по настоящему изобретению,в которых Х обозначает -S-R2, -C(O)R3 или-C(O)NR4R15, получают при превращении вначале 5-броминдола в 5-бром-3-(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индол или 5-бром-3-(1 пиперидин-4-ил)-1H-индол. Соединения по настоящему изобретению, в которых Х обозначает-NR13C(O)R14, получают при превращении вначале 5-нитро- или 5-аминоиндола в 5-нитро- или 5-амино-3-(1,2,3,6-тетрагидропиридин-4-ил)-1Hиндол или в соответствующий 5-нитро- или 5 амино-(1-пиперидин-4-ил)-1H-индол. Соединения по настоящему изобретению, в которых Х обозначает -NR7SO2R8 или -NR13C(О)R14, могут быть получены при превращении подходящим образом замещенного индола в соответствующий 3-(1,2,3,6-тетрагидропиридин-4-ил)-1Hиндол или 3-(1-пиперидин-4-ил)-1H-индол. Указанное химическое превращение проиллюстрировано на схеме синтеза II, где Y обозначает нитро, амино, бром, -NR13C(O)R14 или 5-замещенный индол конденсируют с 4 пиперидоном в присутствии подходящего основания с получением соответствующего 5-замещенного-3-(1,2,3,6-тетрагидропиридин-4-ил)1H-индола. Указанную реакцию проводят вначале при растворении избытка основания, в типичном случае гидроксида натрия или калия, в низшем алканоле, в типичном случае метаноле или этаноле. Затем добавляют индол и два эквивалента 4-пиперидона, и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 8-72 ч. Полученные 5 замещенные-3-(1,2,3,6-тетрагидропиридин-4 ил)-1H-индолы могут быть выделены из реакционной смеси при добавлении воды. Соединения, которые выпали в осадок, могут быть выделены непосредственно фильтрованием, тогда как другие могут быть проэкстрагированы при соответствующем подведении рН раствора и экстракции в несмешивающийся с водой растворитель, такой как этилацетат или дихлорметан. Полученные соединения могут быть использованы в том виде, как они есть, на последующих стадиях, или могут быть вначале очищены хроматографией на силикагеле или подвергнуты повторной кристаллизации из подходящего растворителя. 5-замещенные-3-(1-замещенные-1,2,3,6 тетрагидропиридин-4-ил)-1-индолы могут быть использованы для приготовления других соединений по настоящему изобретению или, если желательно, могут быть гидрогенизированы с использованием благородного металла в качестве катализатора, такого как палладий на угле, с получением соответствующих 5-замещенных-3(пиперидин-4-ил)-1 Н-индолов. Если Y обозначает бром, для гидрогенизации используют такой катализатор, как сульфидированная платина на угле, оксид платины или смешанная каталитическая система на основе сульфидированной платины на угле в сочетании с оксидом плати 001740 16 ны, используемая для предотвращения гидрогенолиза 5-бромзаместителя при восстановлении тетрагидропиридинильной двойной связи. Растворитель, используемый в реакции гидрогенизации, может включать низший алканол, такой как метанол или этанол, тетрагидрофуран или смешанную систему растворителей, состоящую из тетрагидрофурана и этилацетата. Гидрогенизация может проводиться при начальном давлении водорода 20-80 фунт/дюйм 2 (113378,4453513,6 Па), предпочтительно 50-60 фунт/ дюйм 2 (283446-340135,2 Па) при 0-60 С, предпочтительно при температуре от температуры окружающей среды до 40 С, в течение времени от 1 ч до 3 дней. Может потребоваться дополнительное введение водорода для проведения реакции до конца, в зависимости от специфики субстрата. Приготовленные таким образом 5 замещенные-3-(пиперидин-4-ил)-1 Н-индолы выделяют удалением катализатора при фильтровании с последующим концентрированием под пониженным давлением растворителя, используемого в реакционной смеси. Полученный продукт может использоваться непосредственно на последующей стадии или может быть подвергнут дальнейшей очистке хроматографией или посредством повторной кристаллизации из подходящего растворителя. В качестве альтернативы гидрогенизации может быть использована процедура, в соответствии с которой 5-замещенные-3-(1,2,3,6 тетрагидро-4-пиридинил)-1H-индолы могут быть превращены в соответствующие 5 замещенные-3-(пиперидин-4-ил)-1H-индолы при обработке, если нужно, трифторуксусной кислотой/триэтилсиланом. 5-замещенный-3-(1 замещенный-1,2,5,6-тетрагидро-4-пиридинил)1H-индол растворяют в трифторуксусной кислоте, в которую добавляют избыток от 1,1 до 10,0 эквивалентов триэтилсилана. Реакционную смесь перемешивают при температуре, примерно соответствующей температуре окружающей среды, в течение времени от примерно 1 до примерно 48 ч, после чего реакционную смесь концентрируют под пониженным давлением. Затем остаток обрабатывают 2N гидроксидом натрия или калия, и смесь экстрагируют в несмешивающемся с водой растворителем, таким как дихлорметан или диэтиловый эфир. Полученный 5-замещенный-3-(пиперидин-4-ил)-1 Ниндол очищают с помощью колоночной хроматографии, если нужно. Для любого специалиста в данной области очевидно, что 5-нитропроизводное может быть восстановлено либо перед, либо после конденсации с соответствующим 4-пиперидоном. При этом нитрогруппа и 1,2,3,6-тетрагидропиридинильная двойная связь могут быть гидрогенизированы одновременно, если желательно. Соединения, в которых Х обозначает -S-R2,получают из соответствующих 5-бром-3(1,2,3,6-тетрагидропиридин-4-ил)-1H-индолов 17 или 5-бром-3-(пиперидин-4-ил)-1H-индолов, как показано на схеме синтеза III, где А, В, R1 и R2 определены выше, и R = C1-C4 алкил. Схема синтеза III Охлаждают примерно до 0 С 5-бром-3(1,2,3,6-тетрагидропиридин-4-ил)-1H-индолы или 5-бром-3-(пиперидин-4-ил)-1H-индолы в подходящем апротонном растворителе, таком как диэтиловый эфир или тетрагидрофуран, и обрабатывают гидридом калия с целью депротонирования индольного ядра в 1 положении. Другие гидриды также могут использоваться для проведения такого депротонирования, однако, получаемая в данном случае соль калия лучше растворима в типично применяемых в реакции растворителях. Затем реакционную смесь охлаждают до температуры примерно -78 С и обмен галоген-металл ускоряют добавлением двух эквивалентов т-бутиллития. К указанному дианионному раствору добавляют затем соответствующий дисульфид и реакционной смеси позволяют нагреться до температуры окружающей среды. Соединение по настоящему изобретению выделяют при обработке реакционной смеси водным основанием, таким как гидроксид натрия или калия с последующей экстракцией несмешивающимся с водой растворителем, таким как диэтиловый эфир или дихлорметан. Продукт реакции может быть затем очищен хроматографией на колонке. Соединения, в которых Х обозначает-C(O)R3 или -C(O)NR4R15, получают из соответствующих 5-бром-3-(1,2,3,6-тетрагидропиридин-4-ил)-1H-индолов или 5-бром-3-(пиперидин-4-ил)-1H-индолов, как показано на схеме синтеза IV, где А, В, R1, R3, R4 и R15 определены выше, и R = C1-C4 алкил. Схема синтеза IV Дианион 5-бром-3-(1,2,3,6-тетрагидропиридин-4-ил)-1H-индолов или 5-бром-3-(1-замещенный-пиперидин-4-ил)-1H-индола, полученный как описано выше, затем обрабатывают 18 1 Н-индол выделяют при обработке реакционной смеси водным основанием, таким как гидроксид натрия или калия, и затем при экстракции несмешивающимся с водой растворителем, таким как диэтиловый эфир или дихлорметан. Реакционный продукт затем может быть очищен хроматографией на колонке. Соединения, в которых Х обозначает-C(O)R3, получают при взаимодействии раствораN-метил-N-метокси-5-карбоксамидо-3-(пиперидин-4-ил)-1H-индола в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран, при температуре примерно 0 С, при наличии соответствующего реагента, такого как арил- или алкиллитий или алкилового или арилового реагента Гриньяра. Указанные реагенты либо являются коммерчески доступными, либо могут быть получены с помощью хорошо известных специалистам в данной области методов. Арил- или алкиллитиевый реагенты достаточно просто получают при обработке соответствующего арил- или алкилгалогенида нбутиллитием. Ариловый или алкиловый реагенты Гриньяра могут быть получены при обработке соответствующего арилового или алкилового галогенида магнием. Интересующие соединения могут быть выделены водной обработкой при экстракции в несмешивающийся с водой растворитель, такой как диэтиловый эфир или дихлорметан, и затем очищены хроматографией или повторной кристаллизацией из подходящего растворителя. Любому специалисту в данной области понятно, что соединения, в которых Х обозначает -C(O)R3, также могут быть получены посредством реакции дианиона либо 5-бром-3(1,2,3,6-тетрагидропиридин-4-ил)-1H-индола,либо 5-бром-3-(пиперидин-4-ил)-1H-индола с соответствующим арил или алкил N-метил-Nметоксикарбоксамидом. Указанные карбоксамиды получают из соответствующих карбоновых кислот и N-метил-N-метоксиамина в стандартных условиях связывания пептидов с использованием N,N'-дициклогексилкарбодиимида. Соединения, в которых Х обозначает-С(O)NR4R15, получают при взаимодействии раствора N-метил-N-метокси-5-карбоксамидо-3(1,2,3,6-тетрагидропиридин-4-ил)-1H-индола или N-метил-N-метокси-5-карбоксамидо-3-(пиперидин-4-ил)-1H-индола в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран, при температуре примерно 0 С, с анионом соответствующего амина. Указанные анионы получают при обработке соответствующего амина н-бутиллитием. Интересующие соединения могут быть выделены водной обработкой при экстракции в несмешивающийся с водой растворитель, такой как диэтиловый эфир или дихлорметан, и затем очищены хромато 19 графией или повторной кристаллизацией из подходящего растворителя. Альтернативно, соединения, в которых Х обозначает -C(O)NR4R15, получают при помещении соответствующей индол 5-карбоновой кислоты и соответствующего амина в стандартные условия образования пептида. Индол 5 карбоновая кислота в соответствующем растворителе может быть обработана оксалилхлоридом, тионилхлоридом или трибромидом фосфора в подходящем растворителе, например, в толуоле, для получения соответствующего галогенангидрида. Галогенангидрид в соответствующем растворителе, например, в тетрагидрофуране или диметилформамиде, может быть обработан амином формулы HNR4R14 в присутствии подходящего основания, такого как триэтиламин, пиридин или диметиламинопиридин, с получением целевого соединения. Продукт может быть выделен водной обработкой при экстракции в несмешивающийся с водой растворитель,такой как диэтиловый эфир, этилацетат или дихлорметан, и затем очищен хроматографией или повторной кристаллизацией из подходящего растворителя. Предпочтительно, соединения, в которых Х обозначает -C(O)NR4R15, получают при взаимодействии соответствующей индол 5 карбоновой кислоты с соответствующим амином в присутствии типичных реагентов для связывания пептида,таких как-NR13C(O)R14, получают посредством реакции соответствующего 5-амино-3-(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола или 5-амино-3(пиперидин-4-ил)-1H-индола с подходящим электрофилом. Указанные реакции приведены на схеме синтеза V, где А, В, R1, R5, R6, R10, R11,R12, R13 и R14 описаны выше, и R = C1-C4 алкил. Схема синтеза V-NR5R6, получают при обработке раствора 5 амино-3-(1,2,3,6-тетрагидропиридин-4-ил)-1 Ниндола или 5-амино-3-(пиперидин-4-ил)-1Hиндола в подходящем растворителе, таком как дихлорметан, тетрагидрофуран, ацетонитрил или диметилформамид, соответствующим электрофилом, таким как ангидрид трифторметансульфоновой кислоты или N-карбэтоксифталимид, в присутствии подходящего основания, такого как пиридин или триэтиламин. Продукт реакции выделяют при выпаривании растворителя реакции под пониженным давлением. Продукт может быть очищен хроматографией или повторной кристаллизацией из соответствующего растворителя. Соединения, в которых Х обозначает-NHC(Q)NR10R11, получают при обработке раствора 5-амино-3-(1,2,3,6-тетрагидропиридин-4 ил)-1H-индола или 5-амино-3-(пиперидин-4-ил)1H-индола в подходящем растворителе, таком как хлороформ или дихлорметан, соответствующим изоцианатом, изотиоцианатом, карбамоилхлоридом или карбамоилбромидом. Подходящие карбамоилхлориды могут быть получены при обработке амина формулы HNR10R11 фосгеном. Если используется карбамоилхлорид или карбамоилбромид, реакции проводят в присутствии подходящего основания. Подходящие основания включают амины, которые типично используются как раскислители кислоты, такие как пиридин или триэтиламин, или коммерчески доступные основания на полимерной основе,такой как поливинилпиридин. Если необходимо, используют избыток изоцианата, изотиоцианата, карбамоилхлорида или карбамоилбромида для гарантии полного потребления в реакции исходного амина. Реакции осуществляют при температуре от примерно температуры окружающей среды до примерно 80 С, в течение времени от примерно 3 ч до примерно 3 дней. В типичном случае продукт может быть выделен при промывании реакционной смеси водой и последующем концентрировании остающихся органических соединений под пониженным давлением. Если применяют избыток изоцианата, изотиоцианата, карбамоилхлорида или карбамоилбромида, для связывания избытка реагента можно добавить первичный или вторичный амин на полимерной основе, такой как аминометилированный полистирол. Процедура выделения продуктов из реакционных смесей, в которых используется реагент на полимерной основе, достаточно проста и требует только фильтрования реакционной смеси с последующим концентрированием фильтрата под пониженным давлением. Продукт, полученный из таких реакционных смесей, может быть очищен хроматографией или повторной кристаллизацией из подходящего растворителя, если желательно. Для любого специалиста в данной области очевидно, что соединения, представляю 21 щие собой мочевины, могут быть превращены в соответствующую тиомочевину при обработке-NHC(O)OR12, получают при взаимодействии 5 амино-3-(1,2,3,6-тетрагидропиридин-4-ил)-1Hиндола или 5-амино-3-(пиперидин-4-ил)-1Hиндола с соответствующим образом замещенным хлорформиатом в присутствии подходящего амина в условиях, описанных в предыдущем абзаце. Подобно этому, соединения, в которых Х обозначает -NR13C(О)R14, получают при взаимодействии 5-амино-3-(1,2,3,6-тетрагидропиридин-4-ил)-1H-индола или 5-амино-3-(пиперидин-4-ил)-1H-индола с соответствующим хлорангидридом, бромангидридом или ангидридом карбоновой кислоты, необязательно в присутствии катализатора ацилирования, такого как диметиламинопиридин, в присутствии подходящего основания, такого как описано выше. Альтернативно, соединения, в которых Х обозначает -NR13C(O)R14, получают при взаимодействии 5-амино-3-(1,2,3,6-тетрагидропиридин-4-ил)-1H-индола или 5-амино-3-(пиперидин-4-ил)-1H-индола с соответствующим галогенангидридом карбоновой кислоты, ангидридом карбоновой кислоты или карбоновой кислотой в присутствии типичных реагентов связывания пептида, таких как N,N'-карбонилдиимидазол (КДИ), N,N'-дициклогексилкарбодиимид (ДЦК) и 1-(3-диметиламинопропил)-3 этилкарбодиимида гидрохлорид (ЭДК). Полимерная форма ЭДК, которая описана в литературе (Tetrahedron Letters, 34(48), 7685 (1993,пригодна для получения соединений по настоящему изобретению. Продукт, полученный в указанных реакциях, выделяют и очищают, как описано выше. Для любого специалиста в данной области очевидно, что порядок, в котором осуществляются стадии получения данных соединений, во многих случаях не важен. Так, например, соединения, в которых Х обозначает -NR7SO2R8,доступны при помещении 5-амино-3-(1,2,3,6 тетрагидропиридин-4-ил)-1H-индолов или 5 амино-3-(пиперидин-4-ил)-1H-индолов в условия, приведенные на схеме синтеза I. Аналогично, 5-аминоиндол может быть помещен в условия последовательности реакций, приведенные на схеме синтеза V, перед реакцией с 4 пиперидоном, как приведено на схеме синтезаII. Любой специалист в данной области также видит, что соединения, в которых R обозначает Н, могут быть получены при конденсировании 4-пиперидона с соответствующим образом замещенным индолом с получением соответствующих 3-(1,2,3,6-тетрагидропиридин-4-ил)-1 Ниндолов, которые затем могут быть гидрогенизированы, если желательно. Альтернативно, 1 бензил-4-пиперидон может быть замещен в лю 001740 22 бой точке в процессе синтеза с получением соответствующим образом замещенного 4 пиперидона. Бензильная группа может быть затем удалена в стандартных условиях гидрогенизирования после завершения реакции, условия которой неприемлемы для вторичного амина. 3-(1,2,3,6-Тетрагидропиридин-4-ил)-1Hиндолы могут быть также восстановлены до соответствующих 3-(пиперидин-4-ил)-1Hиндолов в удобной точке последовательности реакций синтеза. Указанные вариации проиллюстрированы в приведенных ниже способах получения и примерах. Способ получения I 5-Бром-3-(1-метилпиперидин-4-ил)-1H-индол Получение 5-бром-3-(1-метил-1,2,3,6 тетрагидропиридин-4-ил)-1 Н-индола К раствору 56,11 г (306 ммоль) гидроксида калия в 300 мл метанола добавляют 38 мл (306 ммоль) 1-метил-4-пиперидона и затем 30,0 г(153 ммоль) 5-бром-1 Н-индола. Реакционную смесь перемешивают при температуре кипения с обратным холодильником в течения 18 ч. Затем реакционную смесь охлаждают до температуры окружающей среды и разбавляют 1,5 л воды. Полученное белое твердое вещество отфильтровывают, промывают последовательно водой и диэтиловым эфиром и затем высушивают под вакуумом с получением 44,6 г (100%) 5-бром-3-(1-метил-1,2,3,6-тетрагидро-4-пиридинил)-1H-индола. Каталитическая гидрогенизация К раствору 44,6 г (153 ммоль) 5-бром-3-(1 метил-1,2,3,6-тетрагидро-4-пиридинил)-1 Н-индола в 1,95 л тетрагидрофурана добавляют 9,0 г оксида платины. Реакционную смесь гидрогенизируют при начальном давлении водорода 60 фунт/дюйм 2 (340135,2 Па) при температуре окружающей среды в течение 24 ч. Реакционную смесь фильтруют и фильтрат концентрируют под пониженным давлением. Остаток подвергают повторной кристаллизации из ацетонитрила с получением 32,6 г (73,7%) целевого соединения в виде белого твердого вещества.N-метил-N-метокси-5-карбоксамидо-3-(1 метилпиперидин-4-ил)-1 Н-индол К суспензии 0,72 г (3,58 ммоль) гидрида калия в 16,0 мл тетрагидрофурана при 0 С добавляют раствор 1,0 г (3,41 ммоль) 5-бром-3-(1 метилпиперидин-4-ил)-1H-индола в 16,0 мл тетрагидрофурана и раствор перемешивают в течение примерно 30 мин. Полученную смесь охлаждают примерно до -78 С и к ней добавляют через канюлю 4,4 мл(7,5 ммоль) т-бутиллития, который был предварительно охлажден до -78 С. Примерно через 15 мин добавляют 0,66 г (3,41 ммоль) N,N' 23 диметил-N,N'-диметоксимочевины и реакционной смеси дают постепенно нагреться до температуры окружающей среды. Затем реакционную смесь обрабатывают 5N гидроксидом натрия и экстрагируют диэтиловым эфиром. Эфирные экстракты объединяют, промывают насыщенным водным раствором хлорида натрия, высушивают над сульфатом натрия и концентрируют под пониженным давлением. Очистка флэшхроматографией с проведением элюции смесью этилацетат:метанол:толуол (4,5:0,5:0,2) дают 0,61 г (60%) целевого соединения.MS (m/e): 301 (M+). ИК: 1632 см-1 Элементный анализ С 17 Н 23N3 О 20,25 H2O: Расчет (в %): С - 66,75; Н - 7,74; N - 13,73. Найдено (в %) : С - 66,47; Н - 7,72; N 13,69. Способ получения III 2-Метил-5-амино-1 Н-индол К раствору 2,0 г (11,4 ммоль) 2-метил-5 нитро-1 Н-индола в 100 мл смеси этанол:тетрагидрофуран (1:1) добавляют 0,25 г 5% палладия на угле. Суспензию гидрогенизируют при температуре окружающей среды и начальном давлении водорода 60 фунт/дюйм 2(340135,2 Па). Через 5 ч реакционную смесь фильтруют и фильтрат концентрируют под пониженным давлением с получением 1,5 г темнокоричневого твердого вещества. Твердое вещество очищают флэш-хроматографией, проводя элюцию градиентом дихлорметана, содержащего 0-3% метанола, с получением 1,19 г (71,7%) целевого соединения в виде светло-коричневых пластинок. Т.пл.=154-156 СMS (m/e): 147(М+1). Элементный анализ С 9 Н 10N2: Расчет (в %): С - 73,94; Н - 6,89; N - 19,16. Найдено (в %): С - 74,15; Н - 6,93; N 19,27. Многие 5-(C1-C4 алкил)амино-1 Н-индолы,необходимые для синтеза соединений по настоящему изобретению, можно получить с помощью процедур, описанных в способе получения IV. Способ получения IV 5-Метиламино-1 Н-индол А. Получение N-этоксикарбонил-5-амино 1 Н-индола. К раствору 4,27 г (32,3 ммоль) 5-амино-1 Ниндола в 50 мл тетрагидрофурана добавляют 5,4 мл (38,8 ммоль) триэталамина и затем реакционную смесь охлаждают до 0 С. К этому раствору добавляют затем по каплям 3,4 мл (35,5 ммоль) этилхлорформиата. Через 4 ч реакционную смесь разбавляют 1N НСl и затем экстрагируют этилацетатом. Органическую фазу промывают последовательно 1N НСl, водой и насыщенным водным раствором хлорида натрия. Оставшиеся органические компоненты высушивают над сульфатом натрия и концентрируют 24 под пониженным давлением с получением 7,4 г темного масла. Указанное масло очищают флэш-хроматографией, проводя элюцию градиентом дихлорметана, содержащего 0-2,5% метанола, с получением 4,95 г (75%) целевого соединения в виде рыжевато-коричневого твердого вещества. Т.пл.=113-114 С%): С - 64,69; Н - 5,92; N - 13,72. Найдено (в %): С - 64,76; Н - 5,92; N 13,76. Б. Восстановление N-этоксикарбонил-5 амино-1 Н-индола. К суспензии 6,3 г (164,5 ммоль) алюмогидрида лития в 50 мл тетрагидрофурана добавляют по каплям раствор 4,8 г (23,5 ммоль) Nэтоксикарбонил-5-амино-1 Н-индола в 40 мл тетрагидрофурана. Реакционную смесь нагревают до температуры кипения с обратным холодильником до потребления исходного материала, на основании результатов тонкослойной хроматографии. Затем реакционную смесь охлаждают до температуры окружающей среды и обрабатывают насыщенным водным сульфатом натрия для разрушения избытка алюмогидрида лития. Полученную суспензию фильтруют и фильтрат концентрируют под пониженным давлением с получением 3,6 г темного твердого вещества. Твердое вещество подвергают флэшхроматографии, проводя элюцию градиентом дихлорметана, содержащего 0-2% метанола, с получением 3,3 г (97,1%) целевого соединения в виде рыжевато-коричневого твердого вещества.MS (m/e): 146 (М+). Элементный анализ С 9 Н 10N2: Расчет (в %): С - 73,94; Н - 6,90; N - 19,16. Найдено (в %): С - 73,78; Н - 6,94; N 19,04. Все 5-сульфонамидо-1 Н-индолы, необходимые для получения соединений по настоящему изобретению, могут быть получены при обработке 5-амино-1 Н-индола соответствующим сульфонилхлоридом, как описано в способе получения V. Способ получения V 5-Метансульфонамидо-1 Н-индол К раствору 2,0 г (15,1 ммоль) 5-амино-1 Ниндола в 25 мл тетрагидрофурана добавляют 2,4 мл (17,2 ммоль) триэтиламина. Реакционную смесь охлаждают в ледяной бане и добавляют по каплям 1,23 мл (15,9 ммоль) метансульфонилхлорида. Через 3,5 ч реакционную смесь распределяют между 1N гидроксидом натрия и этилацетатом. Органическую фазу экстрагируют дважды 1N гидроксидом натрия. Все фазы, полученные при экстракции гидроксидом натрия,объединяют, подводят рН до значения 5 кислотой и хорошо экстрагируют этилацетатом. Указанные органические фазы объединяют, промывают последовательно водой и насыщенным 25 водным раствором хлорида натрия, высушивают над сульфатом натрия и концентрируют под пониженным давлением с получением 3,0 г фиолетового твердого вещества. Указанное твердое вещество кристаллизуют из циклогексана/этилацетата с получением 2,5 г (78,6%) целевого соединения в виде светло-фиолетовых кристаллов. Т.пл.=133-135 С%): С - 51,41; Н - 4,79; N - 13,32. Найдено (в %): С - 51,16; Н - 4,93; N 13,27. Способ получения VI 5-Амино-3-(1-метилпиперидин-4-ил)-1H-индол А. Из 5-нитро-1 Н-индола. К раствору 10,38 г (185 ммоль) гидроксида калия в 200 мл метанола добавляют 10,0 г (61,7 ммоль) 5-нитро-1 Н-индола и затем 13,96 г (123 ммоль) 1-метил-4-пиперидoна. Смесь нагревают при температуре кипения с обратным холодильником в течение 4 дней в атмосфере азота. Затем реакционной смеси позволяют охладиться до температуры окружающей среды и образованный твердый материал отфильтровывают и промывают метанолом. Указанный твердый материал высушивают под вакуумом при температуре 50 С. Объединенные фильтраты затем концентрируют под пониженным давлением и остаток подвергают флэш-хроматографии, проводя элюцию смесью дихлорметан:метанол(92,5:7,5). Фракции, которые, как показано, содержат продукт, объединяют и концентрируют под пониженным давлением. Указанное твердое вещество объединяют с тем, что было выделено непосредственно из реакционной смеси, с получением 13,79 г (87%) 5-нитро-3-(1-метил-1,2,3,6 тетрагидропиридин-4-ил)-1H-индола. К раствору 38,2 г (145 ммоль) 5-нитро-3(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1Hиндола в 1,9 л этанола и 30 мл 5N НСl добавляют 10,0 г 5% палладия на угле. Реакционную смесь гидрогенизируют при температуре окружающей среды в течение 18 ч при начальном давлении водорода 60 фунт/дюйм 2 (340135,2 Па). Реакционную смесь фильтруют и затем концентрируют под пониженным давлением. Остаток растворяют в метаноле и раствор фильтруют. Фильтрат концентрируют под пониженным давлением, и остаток перераспределяют в этаноле. Раствор концентрируют до объема примерно 500 мл, и при этом продукт начинает кристаллизоваться. Кристаллы отфильтровывают с получением 48,9 г (95%) целевого соединения в виде его дигидрохлоридной соли,этанольного сольвата. Т.пл.=310-320 С (разлож.) 26 Найдено (в %): С - 55,23; Н - 7,61; N -12,30. Б. Через 5-амино-1 Н-индол. К раствору 1,29 г (20 ммоль) гидроксида калия в 10 мл метанола добавляют 1,32 г (10 ммоль) 5-амино-1 Н-индола и затем 2,46 мл (20 ммоль) 1-метил-4-пиперидона. Затем реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 18 ч. Реакционную смесь охлаждают до температуры окружающей среды, разбавляют 20 мл воды и осадок собирают фильтрованием. Твердое вещество повторно кристаллизуют из этилацетата: метанола с получением 1,11 г (48,9%) 5-амино-3-(1-метил-1,2,3,6-тетрагидропиридин 4-ил)-1H-индола в виде рыжевато-коричневого твердого вещества (Т.пл.=200-203 С). Рыжевато-коричневое твердое вещество подвергают флэш-хроматографии, проводя элюцию смесью дихлорметан:метанол:гидроксид аммония(100:20:0,5) с получением 0,99 г 5-амино-3-(1 метил-1,2,3,6-тетрагидропиридин-4-ил)-1H-индола в виде кремообразного окрашенного твердого вещества (Т.пл.=212-215 С (этилацетат:метанол.MS (m/e): 227 (М+). Элементный анализ С 14 Н 17N3: Расчет (в %): С - 73,98; Н - 7,54; N - 18,49. Найдено (в %): С - 73,76; Н - 7,48; N 18,22. К раствору 11,3 г (50 ммоль) 5-амино-3-(1 метил-1,2,3,6-тетрагидропиридин-4-ил)-1Hиндола в 250 мл метанола добавляют 3,0 г 5% палладия на угле. Реакционную смесь гидрогенизируют при комнатной температуре при начальном давлении водорода 60 фунт/дюйм 2(340135,2 Па) в течение 18 ч. Реакционную смесь фильтруют и фильтрат концентрируют под пониженным давлением с получением темной камеди, которая образует кашицеобразное вещество в гексане, что дает в итоге целевое соединение в виде коричневого твердого вещества.MS (m/e): 229 (М+). Способ получения VII 4-Хлор-N-метил-N-метоксибензамид К раствору 11,38 г (116,7 ммоль) гидрохлорида N-метокси-N-метиламина в 700 мл 1N гидроксида натрия добавляют раствор 18,56 г(106,04 ммоль) 4-хлорбензоилхлорида в 200 мл дихлорметана и смесь перемешивают при температуре окружающей среды. Через 18 ч фазы разделяют и оставшуюся водную фазу хорошо экстрагируют дихлорметаном. Все органические фазы объединяют, высушивают над сульфатом натрия и концентрируют под пониженным давлением с получением 27,9 г (95%) целевого соединения в виде прозрачного масла. 27 К раствору 5,8 г (90 ммоль) гидроксида калия в 50 мл метанола добавляют 4,83 г (30 ммоль) индол 5-карбоновой кислоты и затем 7,4 мл (60 ммоль) 1-метил-4-пиперидона и полученный раствор нагревают до температуры кипения с обратным холодильником в течения 18 ч. Затем реакционную смесь концентрируют под пониженным давлением и полученное масло растворяют в 200 мл воды. Раствор медленно нейтрализуют добавлением 18 мл 5N соляной кислоты. Отделяют фильтрованием образовавшийся осадок и промывают его водой с получением после высушивания 6,09 г. Указанное твердое вещество растворяют в 100 мл 0,5N гидроксида натрия, фильтруют и фильтрат обрабатывают 50 мл 1N соляной кислоты. Образованное твердое вещество отфильтровывают и высушивают под пониженным давлением с получением 5,46 г (71%) целевого соединения. Т.пл.=249 С%): С - 70,29; Н - 6,29; N - 10,93. Найдено (в %): С - 70,02; Н - 6,39; N -11,02. Способ получения IX 5-Карбокси-3-(1-метилпиперидин-4-ил)-1Hиндол 5-этоксикарбонил-3-(1-метил-1,2,5,6 тетрагидропиридин-4-ил)-1 Н-индол Раствор 0,513 г (2 ммоль) 5-карбокси-3-(1 метил-1,2,5,6-тетрагидропиридин-4-ил)-1Hиндола в 5,1 мл этанола охлаждают в ледяной бане, добавляя по каплям 0,51 мл серной кислоты. Полученную смесь нагревают до температуры кипения с обратным холодильником в течение 5 ч. Теперь уже гомогенный раствор вливают в 50 мл охлажденной воды, которую подщелачивают насыщенным раствором гидроксида аммония. Светло-желтый осадок собирают фильтрованием и затем повторно кристаллизуют из этанола с получением 0,24 г (42%) целевого соединения в виде светло-желтых кристаллов. Т.пл.=249 С%): С - 71,81; Н - 7,09; N - 9,85. Найдено (в %): С - 71,97; Н - 7,25; N - 9,71. 5-Этоксикарбонил-3-(1-метилпиперидин-4-ил)1H-индол К раствору 3,24 г (11,3 ммоль) 5 этоксикарбонил-3-(1-метил-1,2,5,6-тетрагидропиридин-4-ил)-1H-индола в 100 мл этанола добавляют 0,8 г 5% палладия на угле и реакционную смесь гидрогенизируют при комнатной температуре в течение 18 ч при начальном давлении водорода 60 фунт/дюйм 2 (340135,2 Па). Реакционную смесь фильтруют и фильтрат концентрируют под пониженным давлением. Остаточное вещество в виде масла, которое кристаллизуется при стоянии при комнатной температуре, повторно кристаллизуют из 30 мл ацето 001740%): С - 71,30; Н - 7,74; N - 9,78. Найдено (в %): С - 71,07; Н - 7,88; N - 9,73. Омыление/протонирование Смесь 0,859 г (3 ммоль) 5-этоксикарбонил 3-(1-метилпиперидин-4-ил)-1H-индола, 6,0 мл этанола и 6 мл 2N гидроксида натрия нагревают до температуры кипения с обратным холодильником в течения 2 ч. Этанол отгоняют от полученного раствора и оставшийся водный раствор нейтрализуют с помощью 2,4 мл 5N соляной кислоты. Полученное масло, суспендированное в воде, обрабатывают небольшим количеством дихлорметана и охлаждают. Полученное твердое вещество отфильтровывают, промывают водой и ацетоном и затем повторно кристаллизуют из 15 мл воды с получением 0,308 г (40%) целевого соединения в виде бесцветных кристаллов. Т.пл.280 С%): С - 69,74; Н - 7,02; N - 10,84. Найдено (в %): С - 69,66; Н - 7,03; N 10,92. Способ получения Х Получение изоцианатной смолы, связанной с полистиролом К перемешанной суспензии 50 г (61 ммоль) аминометилированной полистироловой смолы (1,22 ммоль/г) в 800 мл толуола добавляют 193 мл (366 ммоль) 1,9 М фосгена в толуоле. После перемешивания реакционной смеси в течение 10 мин добавляют 67 мл (482 ммоль) триэтиламина и реакционную смесь перемешивают в течение 18 ч при комнатной температуре. Смесь фильтруют и полученное твердое вещество промывают 10 раз дихлорметаном. Получают светло-розовую смолу, смешанную с белым твердым веществом. Указанную твердую смесь ресуспендируют в 700 мл дихлорметана,перемешивают в течение 10 мин и затем отфильтровывают и хорошо промывают дихлорметаном. Полученное твердое вещество снова суспендируют, перемешивают и промывают дихлорметаном с получением целевой смолы. ИК (КВr): 2252 см-1 (характерный пик для-N=C=O). Пример 1. 5-Фенилтио-3-(1-метилпиперидин-4-ил)-1H-индол. К суспензии 0,21 г (1,05 ммоль) гидрида калия в 5,0 мл тетрагидрофурана при 0 С добавляют раствор 0,3 г (1,0 ммоль) 5-бром-3-(1 метилпиперидин-4-ил)-1H-индола в 5,0 мл тетрагидрофурана и раствор перемешивают в течение примерно 30 мин. Полученную смесь охлаждают до температуры примерно -78 С и к ней добавляют через канюлю 1,47 мл (2,3 ммоль) т 29 бутиллития, который был предварительно охлажден до температуры -78 С. Примерно через 15 мин добавляют 0,43 г (2 ммоль) дифенилдисульфида и реакционной смеси дают постепенно нагреться до температуры окружающей среды. Затем реакционную смесь обрабатывают 5N гидроксидом натрия и экстрагируют диэтиловым эфиром. Эфирные экстракты объединяют,промывают насыщенным водным раствором хлорида натрия, высушивают над сульфатом натрия и концентрируют под пониженным давлением. Очистка флэш-хроматографией с проведением элюции смесью этилацетат: метанол:толуол (4,5:0,5:0,2) с последующей повторной кристаллизацией из смеси гексан: диэтиловый эфир дает 0,28 г (85,1%) целевого соединения в виде белого твердого вещества. Т.пл.=147-150 С%): С - 74,49; Н - 6,89; N - 8,69. Найдено (в %): С - 74,27; Н - 6,96; N - 8,77. Соединения примеров 2-5 получают с использованием метода, детально описанного в примере 1. Пример 2. 5-(4-Метоксифенил)тио-3-(1 метилпиперидин-4-ил)-1H-индол. С использованием 0,3 г (1,0 ммоль) 5 бром-3-(1-метилпиперидин-4-ил)-1H-индола и 0,55 г (1,99 ммоль) ди(4-метоксифенил) дисульфида получают 0,28 г (64,0%) целевого соединения в виде бесцветного твердого вещества. Т.пл.=160-162 С%): С - 71,55; Н - 6,86; N - 7,95. Найдено (в %): С - 71,67; Н - 6,89; N - 8,24. Пример 3. 5-Бензилтио-3-(1-метилпиперидин-4-ил)-1H-индол. С использованием 0,325 г (1,11 ммоль) 5 бром-3-(1-метилпиперидин-4-ил)-1H-индола и 0,55 г (2,22 ммоль) дибензилдисульфида получают 0,065 г (17,0%) целевого соединения в виде бесцветного твердого вещества. Т.пл.=138-141 С 30 Найдено (в %): С - 70,25; Н - 6,60; N 12,80. Пример 5. 5-(4-Хлорфенил)тио-3-(1 метилпиперидин-4-ил)-1H-индол. С использованием 0,4 г (1,36 ммоль) 5 бром-3-(1-метилпиперидин-4-ил)-1H-индола и 0,78 г (2,73 ммоль) ди(4-хлорфенил)дисульфида получают 0,39 г (79,6%) целевого соединения в виде бесцветного твердого вещества. Т.пл.=148-150 С%): С - 67,30; Н - 5,93; N - 7,85. Найдено (в %): С - 67,47; Н - 6,10; N - 7,84. Пример 6. 5-Бензоил-3-(1-метилпиперидин-4-ил)-1H-индол. К раствору 0,41 мл (0,73 ммоль) фениллития в 4,0 мл тетрагидрофурана при 0 С добавляют 0,10 г (0,33 ммоль) N-метил-N-метокси-5 карбоксамидо-3-(1-метилпиперидин-4-ил)-1Hиндола (способ получения II) в 2,0 мл тетрагидрофурана. Через 1 ч реакционную смесь гасят добавлением 2N гидроксида натрия и смесь хорошо экстрагируют диэтиловым эфиром. Затем эфирные экстракты промывают насыщенным водным раствором хлорида натрия, высушивают над сульфатом натрия и концентрируют под пониженным давлением. Остаток очищают радиальной хроматографией (кремнезем толщиной 2 мм) с проведением элюции смесью дихлорметан:метанол (10:1) с получением 0,096 г(91%) целевого соединения в виде светложелтого твердого вещества. Т.пл. = 101 СMS (m/e): 319 (М+). ИК: 1644 см-1 Элементный анализ C21H22N2OH2O: Расчет (в %): С - 74,48; Н - 7,19; N - 8,33. Найдено (в %): С - 74,85; Н - 7,00; N - 8, 67. Соединения примеров 7-9 получают с использованием метода, детально описанного в примере 6. Пример 7. Моногидрат гидрохлорида 5 ацетил-3-(1-метилпиперидин-4-ил)-1H-индола. С использованием 0,30 г (1,0 ммоль) Nметил-N-метокси-5-карбоксамидо-3-(1-метилпиперидин-4-ил)-1H-индола (способ получения II) и 3,56 мл (4,98 ммоль) метиллития получают 5 ацетил-3-(1-метилпиперидин-4-ил)-1H-индол,который превращают в его хлористоводородную соль. Получают при этом 0,153 гII) и 1,66 мл (2,67 ммоль) н-бутиллития получают 5-пентаноил-3-(1-метилпиперидин-4-ил)-1Hиндол, который превращают в его хлористоводородную соль. 0,124 г (63%) целевого соединения получают в виде рыжевато-коричневого твердого вещества, которое кристаллизуют из этанола/диэтилового эфира. Т.пл.=242-245 СII) и 2,5 мл (5,0 ммоль) хлорида магнийбензила получают 0,22 г (66%) целевого соединения в виде желтовато-белого твердого вещества. Т.пл. = 69 С%): С - 79,48; Н - 7,28; N - 8,43. Найдено (в %): С - 79,68; Н - 7,47; N - 8,61. Пример 10. 5-(4-Метоксибензоил)-3-(1 метилпиперидин-4-ил)-1H-индол. К раствору 0,35 мл (2,82 ммоль) 4-метокси 1-бромбензола в 3,0 мл тетрагидрофурана при температуре -78 С добавляют 1,83 мл (2,93 ммоль) н-бутиллития и реакционную смесь перемешивают в течение 30 мин при -78 С. Затем к этому раствору добавляют 0,17 г (0,56 ммоль)II) в 2,0 мл тетрагидрофурана. Реакционной смеси дают постепенно нагреться до температуры окружающей среды и затем гасят реакцию добавлением 2N гидроксида натрия. Полученную смесь хорошо экстрагируют диэтиловым эфиром. Затем эфирные экстракты промывают насыщенным водным раствором хлорида натрия, высушивают над сульфатом натрия и концентрируют под пониженным давлением. Остаток очищают радиальной хроматографией(кремнезем толщиной 2 мм), проводя элюцию смесью дихлорметан:метанол (10:1), с получением 0,135 г (72%) целевого соединения в виде светло-желтого твердого вещества.II) и 0,41 мл (3,32 ммоль) 4-метил-1 бромбензола получают 0,180 г (79%) целевого соединения в виде желтого твердого вещества. Т.пл. = 92 СII) и 0,35 мл (2,49 ммоль) 4-трифторметил-1 бромбензола получают 0,122 г (64%) целевого соединения в виде желтого твердого вещества. Т.пл.=160-162 СII) и 0,30 мл (3,32 ммоль) анилина получают 0,118 г (53%) целевого соединения в виде слабо окрашенного рыжевато-коричневого твердого вещества. Т.пл. = 97 СII) и 2,2 мл (20,0 ммоль) бензиламина получают 0,788 г (57%) целевого соединения в виде белого твердого вещества. Т.пл.=87 С%): С - 76,05; Н - 7,25; N - 12,09. Найдено (в %): С - 76,06; Н - 7,51; N 12,35. Пример 20. 5-(4-Хлорбензоил)-3-(1 метилпиперидин-4-ил)-1H-индол. К суспензии 0,21 г (1,05 ммоль) гидрида калия в 5,0 мл тетрагидрофурана при 0 С добавляют раствор 0,3 г (1,0 ммоль) 5-бром-3-(1 метилпиперидин-4-ил)-1H-индола в 5,0 мл тетрагидрофурана и раствор перемешивают в течение примерно 30 мин. Полученную смесь охлаждают до температуры примерно -78 С и к ней через канюлю добавляют 1,47 мл (2,3 ммоль) тбутиллития, который был предварительно охлажден до -78 С. Примерно через 15 мин добавляют раствор 1,0 г (5,0 ммоль) N-метил-N 001740VII) в 3,0 мл тетрагидрофурана. Реакционной смеси позволяют медленно нагреться до температуры окружающей среды и затем гасят реакцию добавлением 2N гидроксида натрия. Смесь хорошо экстрагируют диэтиловым эфиром и эфирные экстракты затем промывают насыщенным водным раствором хлорида натрия, высушивают над сульфатом натрия и концентрируют под пониженным давлением. Остаток очищают радиальной хроматографией (кремнезем толщиной 2 мм), проводя элюцию смесью этилацетат: метанол (95:5), с получением целевого соединения в виде светло-желтого твердого вещества. Т.пл.=133 СMS (m/e): 352(М+). Элементный анализ C21H21N2OCl0,5 Н 2 О: Расчет (в %): С - 69,70; Н - 6,13; N - 7,74. Найдено (в %): С - 70,02; Н - 6,20; N - 7,93. Пример 21. 5-Метансульфониламино-3-(1 метил-1,2,3,6-тетрагидропиридин-4-ил)-1Hиндол. К раствору 1,2 г (21,4 ммоль) гидроксида калия в 12 мл метанола добавляют 1,0 г (4,76 ммоль) 5-метансульфониламино-1 Н-индола и затем 0,76 мл (6,2 ммоль) 1-метил-4 пиперидона. Гомогенный раствор нагревают при температуре кипения с обратным холодильником в течения 18 ч в атмосфере азота. Затем реакционную смесь охлаждают и концентрируют под пониженным давлением. Остаток растворяют в воде и подводят рН раствора от значения 14 до 8-9 добавлением кислоты. Образованный остаток отфильтровывают, промывают водой и высушивают под вакуумом с получением 1,3 г (89,6%) целевого соединения виде рыжевато-коричневого твердого вещества. Т.пл.=210-214 С(80%) целевого соединения в виде рыжеватокоричневого кристаллического порошка. Т.пл.=198-202 С(33,3%) целевого соединения в виде желтого твердого вещества. Т.пл.=176-184 С(58,8%) целевого соединения в виде светложелтого кристаллического порошка. Т.пл.=218-219 С (разлож.)%): С - 62,22; Н - 7,25; N - 12,09. Найдено (в %): С - 62,10; Н - 7,11; N 12,28. Пример 30. Оксалат 5-метансульфониламино-3-(1-метилпиперидин-4-ил)-1H-индола. К раствору 0,815 г (2,67 ммоль) 5 метансульфониламино-3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1H-индола в 125 мл метанола добавляют 0,815 г 5% палладия на угле. Смесь гидрогенизируют при температуре окружающей среды в течение 18 ч при начальном давлении водорода 60 фунт/дюйм 2 (340135,2 Па). Реакционную смесь фильтруют и фильтрат концентрируют под пониженным давлением. Остаточное масло очищают флэшхроматографией, проводя элюцию смесью дихлорметан: метанол (90:10). Фракции, которые,как показано, содержат продукт, объединяют и концентрируют под пониженным давлением. Остаток растворяют в метаноле и к нему добавляют щавелевую кислоту. Суспензию фильтруют с получением 0,261 г (25%) целевого соединения. Т.пл.=119,1 С%): С - 59,79; Н - 7,21; N - 13,07. Найдено (в %): С - 59,62; Н - 7,33; N 12,82. Пример 32. 2-Метил-5-метансульфониламино-3-(1-метилпиперидин-4-ил)-1 Н-индол. К раствору 0,45 г (1,41 ммоль) 2-метил-5 метансульфониламино-3-(1,2,3,6-тетрагидропиридин-4-ил)-1H-индола (пример 23) в 125 мл метанола добавляют 0,11 г 5% палладия на угле и реакционную смесь гидрогенизируют при температуре окружающей среды при начальном давлении водорода 60 фунт/дюйм 2 (340135,2 Па). Через 18 ч реакционную смесь фильтруют и фильтрат концентрируют под пониженным давлением с получением желтого масла. Масло очищают радиальной хроматографией (силикагель толщиной 2 мм), проводя элюцию смесью дихлорметан:метанол:гидроксид аммония(100:5:0,5), с получением 0,21 г желтой пены,которая затем осаждается из этилацетата/гексанов с выходом 0,18 г (39,7%) целевого соединения в виде белого порошка. Т.пл. = 124-128 С%): С - 61,86; Н - 7,79; N -12,02. Найдено (в %): С - 61,66; Н - 7,74; N 11,87. Пример 39. 5-Бензолсульфониламино-3-(1 метилпиперидин-4-ил)-1H-индол. К раствору 2,00 г (5,74 ммоль) 5-амино-3(1-метилпиперидин-4-ил)-1H-индола в 50,0 мл дихлорметана добавляют 1,63 г (20,7 ммоль) пиридина и раствор охлаждают до 0 С. К указанному охлажденному раствору добавляют 39 затем по каплям раствор 2,23 г (12,6 ммоль) бензолсульфонилхлорида в 50 мл дихлорметана. Реакционной смеси позволяют медленно нагреться до температуры окружающей среды. Через 24 ч реакционную смесь промывают 100 мл воды и оставшиеся органические вещества концентрируют под пониженным давлением. Остаток суспендируют в воде и доводят значение рН до 14 с помощью гидроксида натрия. После этого хорошо экстрагируют водную фазу дихлорметаном. Органическую фазу промывают последовательно водой и насыщенным водным раствором хлорида натрия, высушивают над сульфатом натрия и концентрируют под пониженным давлением. Водные фазы объединяют и рН доводят до значения 10 добавлением кислоты и снова экстрагируют смесью хлороформ:изопропанол (3:1). Указанные органические экстракты объединяют и концентрируют под пониженным давлением. Полученный остаток подвергают флэш-хроматографии, проводя элюцию градиентной системой, включающей смесь дихлорметан:метанол:гидроксид аммония в пропорциях от 100:10:0,5 до 100:11:0,5, что дает 0,83 г (39,1%) целевого соединения виде белого порошка. Т.пл.=246-249 С (разлож.)(3,45 ммоль) 5-амино-3-(1-метилпиперидин-4 ил)-1H-индола и 1,1 г (3,62 ммоль) 4 йодбензолсульфонилхлорида с получением 0,809 г (47,3%) целевого соединения виде рыжевато-коричневого порошка. Т.пл.250 С(в %): С - 48,49; Н - 4,48; N - 8,48. Найдено (в %): С - 48,68; Н - 4,47; N - 8,26. Пример 41. Гидрохлорид 5-(ди(трифторметансульфониламино-3-(1-метилпиперидин 4-ил)-1H-индола. К суспензии 1,00 г (2,87 ммоль) дигидрохлорида 5-амино-3-(1-метилпиперидин-4-ил)1H-индола в 100 мл дихлорметана добавляют 2,5 мл (14,3 ммоль) диизопропилэтиламина и затем 1,06 мл (6,3 ммоль) трифторметансульфонового ангидрида. Через 20 мин реакционную смесь промывают водой, высушивают над сульфатом натрия и концентрируют под пониженным давлением. Остаток очищают флэшхроматографией, проводя элюцию дихлорметаном, содержащим 15% метанола, что дает 5(ди(трифторметансульфониламино-3-(1-метилпиперидин-4-ил)-1H-индол. Указанный материал превращают в его хлористо-водородную 40 соль и кристаллизуют из ацетонитрила с получением 0,34 г (22,3%) целевого соединения. Т.пл.=175-185 С (разлож.)(0,131 ммоль) поливинилпиридина в 3,0 мл дихлорметана добавляют 4,3 мг (0,0458 ммоль) метилхлорформиата. Реакционную смесь перемешивают в течение 18 ч при температуре окружающей среды. К указанной смеси добавляют затем 170 мг (0,137 ммоль) аминометилированного полистирола и реакционную смесь перемешивают еще в течение 18 ч. Затем реакционную смесь фильтруют и выпаривают летучие продукты с получением 10,2 мг (81%) целевого соединения.MS (m/e): 380 (М+). Пример 50. 5-(4-Хлорфенил)оксикарбонил) амино-3-(1-метилпиперидин-4-ил)-1 Н-индол. Из исходных 13 мг (0,0567 ммоль) 5 амино-3-(1-метилпиперидин-4-ил)-1H-индола и 11,1 мг (0,062 ммоль) 4-хлорфенилхлорформиата получают 18,1 мг (93%) целевого соединения. Пример 51. N-метил-N'-(3-(1-метилпиперидин-4-ил)-1 Н-индол-5-ил)мочевина. К раствору 2,0 г (5,74 ммоль) моноэтанолата дигидрохлорида 5-амино-3-(1-метилпиперидин-4-ил)-1H-индола и 5,0 мл (36 ммоль) триэтиламина в 100 мл дихлорметана добавляют 0,74 мл (12,6 ммоль) метилизоцианата. Реакционную смесь перемешивают в течение 15 мин и затем промывают 100 мл воды. Оставшиеся органические вещества высушивают над сульфатом натрия и концентрируют под пониженным давлением. Полученный остаток кристаллизуют из ацетонитрила с получением 1,05 г (64%) целевого соединения.%): С - 69,11; Н - 7,74; N - 19,56. Найдено (в %): С - 69,37; Н - 7,82; N -19,67. Пример 52. Гидрохлорид N-фенил-N'-(3-(1 метилпиперидин-4-ил)-1H-индол-5-ил)мочевины. К раствору 2,0 г (5,74 ммоль) моноэтанолата дигидрохлорида 5-амино-3-(1-метилпиперидин-4-ил)-1H-индола и 5,0 мл (36 ммоль) триэтиламина в 100 мл дихлорметана добавляют 1,37 мл (12,6 ммоль) фенилизоцианата. Реакционную смесь перемешивают в течение 15 мин и затем промывают 100 мл воды. Оставшиеся органические вещества высушивают над сульфатом натрия и концентрируют под пониженным давлением. Полученный остаток кристаллизуют из ацетонитрила с получением 1,40 г (70%) Nфенил-N'-(3-(1-метилпиперидин-4-ил)-1 Ниндол-5-ил)мочевины. Указанный материал растворяют в метаноле и к нему добавляют эквивалент метанольного раствора хлористого водорода. Раствор затем концентрируют под пониженным давлением и оставшееся масло 42 кристаллизуют из этанола с получением целевого соединения. Т.пл.=215-220 СMS (m/e): 348 (М+). Элементный анализ C21H24N4OНСl: Расчет (в %): С - 65,53; Н - 6,55; N - 14,56. Найдено (в %): С - 65,27; Н - 6,43; N 14,35. Пример 53. N-этил-N'-(3-(1-метилпиперидин-4-ил)-1 Н-индол-5-ил)мочевина. К раствору 15,0 мг (0,0655 ммоль) 5 амино-3-(1-метилпиперидин-4-ил)-1H-индола в 3,0 мл хлороформа добавляют 9,3 мг (0,131 ммоль) этилизоцианата. Реакционную смесь перемешивают в течение 48 ч и к ней добавляют 0,23 г (0,131 ммоль) аминометилированного полистирола и полученную реакционную смесь перемешивают еще 18 ч. Затем реакционную смесь фильтруют и летучие продукты выпаривают с получением 16,1 мг (82%) целевого соединения. Соединения примеров 54-75 получают с использованием процедуры, детально описанной в примере 53. Пример 54. N-пропил-N'-(3-(1-метилпиперидин-4-ил)-1H-индол-5-ил)мочевина. Из исходных 15,0 мг (0,0655 ммоль) 5 амино-3-(1-метилпиперидин-4-ил)-1H-индола и 11,1 мг (0,131 ммоль) пропилизоцианата получают 5,8 мг целевого соединения.MS (m/e): 449 (М+). Соединения примеров 76-79 получают при температуре примерно 50 С с использованием процедуры, детально описанной в примере 42. Пример 76. N,N-диметил-N'-(3-(1-метилпиперидин-4-ил)-1H-индол-5-ил)мочевина. Из исходных 13,0 мг (0,056 ммоль) 5 амино-3-(1-метилпиперидин-4-ил)-1H-индола и 6,4 мг (0,059 ммоль) диметилкарбамоилхлорида получают 13,2 мг (79%) целевого соединения.MS (m/e): 379 (М+). Пример 87. Оксалат 5-фталимидо-3-(1 метилпиперидин-4-ил)-1H-индола. К раствору 0,458 г (2,0 ммоль) 5-амино-3(1-метилпиперидин-4-ил)-1H-индола в 8,0 мл дихлорметана добавляют 0,438 г (2,0 ммоль) Nкарбэтоксифталимида. Реакционную смесь перемешивают 18 ч при температуре окружающей среды, после чего растворитель удаляют под 47 пониженным давлением. Остаток подвергают флэш-хроматографии, проводя элюцию смесью дихлорметан:метанол:гидроксид аммония(100:20:0,5), что дает 0,467 г (65%) 5 фталимидо-3-(1-метилпиперидин-4-ил)-1Hиндола в виде желтой пены. Желтую пену растворяют в смеси метанол:этилацетат и к ней добавляют эквивалент щавелевой кислоты. Образованный бесцветный осадок повторно кристаллизуют из метанола с получением 0,267 г целевого соединения в виде бесцветных кристаллов. Т.пл.=224 СMS (m/e): 359 (М+). Элементный анализ C22H21N3O2C2H2O4: Расчет (в %): С - 64,13; Н - 5,16; N - 9,35. Найдено (в %): С - 63,88; Н - 5,27; N - 9,51. Пример 88. 5-(Ацетил)амино-3-(1-метил 1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индол. К раствору 1,0 г (4,4 ммоль) 5-амино-3-(1 метил-1,2,3,6-тетрагидропиридин-4-ил)-1Hиндола в 60 мл тетрагидрофурана добавляют 0,67 мл (4,8 ммоль) триэтиламина и раствор охлаждают до 0 С. Затем к этому раствору добавляют 0,32 мл (4,6 ммоль) ацетилхлорида и реакционную смесь перемешивают при температуре окружающей среды в течение 18 ч. Реакционную смесь фильтруют и концентрируют под пониженным давлением с получением темного масла. Полученное масло обрабатывают водой,что дает черную камедь. Указанный остаток очищают радиальной хроматографией (кремнезем толщиной 2 мм) с проведением элюции смесью дихлорметан:метанол:гидроксид аммония(100:10:1), что дает 0,20 г (16,9%) целевого соединения в виде желтого твердого вещества. Т.пл.=186-189 С 48 Из исходных 1,13 г (5,0 ммоль) 5-амино-3(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1Hиндола и 0,58 мл (5,0 ммоль) бензоилхлорида получают 0,477 г (28,9%) целевого соединения в виде слегка зеленого твердого вещества. Т.пл.250 С%): С - 68,94; Н - 5,51; N - 11,48. Найдено (в %): С - 68,75; Н - 5,65; N 11,63. Пример 92. 5-(4-Метоксибензоил)амино-3(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1Hиндол. Из исходных 1,13 г (5,0 ммоль) 5-амино-3(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1Hиндола и 0,853 г (5,0 ммоль) 4-метоксибензоилхлорида получают 0,367 г (20,4%) целевого соединения в виде слегка желтого твердого вещества. Т.пл.=232 С (разлож.)%): С - 73,11; Н - 6,41; N - 11,63. Найдено (в %): С - 72,86; Н - 6,39; N 11,33. Пример 93. 5-(2-Хлор-4-фторбензоил) амино-3-(1-метил-1,2,3,6-тетрагидропиридин-4 ил)-1H-индол. Из исходных 2,0 г (8,8 ммоль) 5-амино-3(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1Hиндола и 1,9 г (9,7 ммоль) 2-хлор-4 фторбензоилхлорида получают 0,67 г (19,8%) целевого соединения в виде слегка желтого твердого вещества. Т.пл.=212-222 С 49 целевого соединения в виде жженого оранжевого порошка. Т.пл.=127-135 С (разлож.)(33,0%) целевого соединения в виде яркожелтого твердого вещества. Т.пл.=229-233 С (разлож.)(5,0 ммоль) 3-хлорбензоилхлорида получают 0,942 г (38,9%) целевого соединения в виде бесцветного твердого вещества. Т.пл.=185 С (разлож.)(5,0 ммоль) 4-хлорбензоилхлорида получают 0,339 г (14,0%) целевого соединения в виде бесцветного твердого вещества. Т.пл.=163 С (разлож.)(19,1%) целевого соединения в виде желтоватобелого твердого вещества. Т.пл.=114 С (разлож.)MS (m/e): 347 (М+). Элементный анализ C22H25N3OС 2H2O4: Расчет (в %): С - 65,89; Н - 6,22; N - 9,60. Найдено (в %): С - 65,68; Н - 6,29; N - 9,83. Пример 111. 5-(Фур-2-оил)амино-3-(1 метил-1,2,3,6-тетрагидропиридин-4-ил)-1Hиндол. А. Получение 5-(2-фуроил)амино-1 Ниндола. К раствору 2,09 г (15,8 ммоль) 5-амино-1 Ниндола в 20 мл тетрагидрофурана добавляют 2,6 мл (18,97 ммоль) триэтиламина и раствор охлаждают в ледяной бане. Затем к реакционной смеси добавляют по каплям 1,71 мл (17,4 ммоль) 2-фуроилхлорида. После завершения добавления удаляют охлаждающую баню и реакционную смесь перемешивают в течение 1,5 ч при температуре окружающей среды. После окончания этого срока реакционную смесь разбавляют водой и хорошо экстрагируют этилацетатом. Органические растворы объединяют и промывают последовательно водой, 2N гидроксидом натрия, водой и насыщенным водным раствором хлорида натрия. Оставшиеся органические вещества затем высушивают над сульфатом натрия и концентрируют под пониженным давлением с получением темно-фиолетового твердого вещества. Затем твердое вещество подвергают флэш-хроматографии, проводя элюцию градиентом дихлорметана, содержащего 0-2% метанола. Регенерированное твердое вещество кристаллизуют из этилацетата с получением 1,8 г (50,3%) 5-(2-фуроил)амино-1 Ниндола в виде бледно-фиолетовых кристаллов. Т.пл.=181-182 С 53 Б. Конденсация замещенного индола с 1 этил-4-пиперидоном. К раствору 0,868 г (15,5 ммоль) гидроксида калия в 8 мл метанола добавляют 1,0 г (4,42 ммоль) 5-(2-фуроил)амино-1 Н-индола и 0,774 мл 1-этил-4-пиперидона и раствор перемешивают при температуре кипения с обратным холодильником в течение 18 ч. Реакционную смесь охлаждают до температуры окружающей среды и затем разбавляют смесью лед/вода. Полученный осадок собирают и высушивают под вакуумом. Указанное твердое вещество очищают радиальной хроматографией (кремнезем толщиной 2 мм), проводя элюцию градиентом дихлорметана, содержащего 5-7,5% метанола и 0,5-1,0% гидроксида аммония. Затем продукт кристаллизуют из этилацетата с получением 0,715 г (48,3%) целевого соединения в виде ярко-желтого порошка. Т.пл.=120-122 С%): С - 71,62; Н - 6,31; N - 12,53. Найдено (в %): С - 71,51; Н - 6,33; N 12,73. Пример 112. 5-(2-Фуроил)амино-3-(1 этилпиперидин-4-ил)-1H-индол. К раствору 0,780 г (3,2 ммоль) 5-амино-3(1-этилпиперидин-4-ил)-1H-индола в 10 мл тетрагидрофурана и 10 мл диметилформамида добавляют 0,536 мл (3,85 ммоль) триэтиламина и затем по каплям добавляют 0,348 мл (3,5 ммоль) 2-фуроилхлорида. Через 18 ч реакционную смесь охлаждают в ледяной бане. После этого реакционную смесь распределяют между 100 мл этилацетата и 100 мл 2N гидроксида натрия. Фазы разделяют и водную фазу вновь экстрагируют этилацетатом. Органические экстракты объединяют и промывают последовательно 2N гидроксидом натрия, водой и насыщенным водным раствором хлорида натрия. Оставшиеся органические вещества высушивают над сульфатом натрия и концентрируют под пониженным давлением. Остаток подвергают радиальной хроматографии (кремнезем толщиной 2 мм), проводя элюцию смесью дихлорметан:метанол:гидроксид аммония (100:10:1). Фракции, содержащие продукт, объединяют и концентрируют под пониженным давлением. Остаток кристаллизуют из смеси этилацетат/гексан с получением 0,789 г (73,1%) целевого соединения в виде желтовато-белого твердого вещества. Т.пл.=178-179 СMS (m/e): 366 (М+1). Элементный анализ C22H24N3OFC4H4O4: Расчет (в %): С - 64,85; Н - 5,86; N - 8,73. Найдено (в %): С - 65,15; Н - 5,95; N - 8,95. Пример 114. 5-(2-Хлор-4-фторбензоил) амино-3-(1-метилпиперидин-4-ил)-1 Н-индол. К раствору 0,40 г (1,04 ммоль) 5-(2-хлор-4 фторбензоил)амино-3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1H-индола в 5,2 мл трифторуксусной кислоты добавляют 0,208 мл (1,3 ммоль) триэтилсилана и реакционную смесь перемешивают при температуре окружающей среды. Через 2 ч реакционную смесь концентрируют под пониженным давлением. К остатку добавляют 2N гидроксид натрия и водный слой экстрагируют дихлорметаном. Объединенные органические экстракты промывают 2N гидроксидом натрия, высушивают над сульфатом натрия и затем концентрируют под пониженным давлением с получением оранжевой пены. Указанную пену подвергают радиальной хроматографии (кремнезем толщиной 2 мм), проводя элюцию смесью дихлорметан:метанол:гидроксид аммония (100:10:1). Остаток кристаллизуют из смеси этилацетат/гексаны с получением 0,27 г (67,3%) целевого соединения в виде жженого оранжевого порошка.MS (m/e): 325 (М+). Пример 125. Альтернативный синтез оксалата 5-(2-тиеноил)амино-3-(1-метилпиперидин-4-ил)-1H-индола. К раствору 0,615 г (4,8 ммоль) 2-тиеноевой кислоты в 10 мл дихлорметана добавляют 0,778 г (4,8 ммоль) N,N-карбонилдиимидазола в 2 мл дихлорметана. Через 1,5 ч добавляют раствор 1,0 г (4,4 ммоль) 5-амино-3-(1-метилпиперидин 4-ил)-1H-индола в 15 мл дихлорметана и реакционную смесь перемешивают в течение 18 ч при температуре окружающей среды. Реакцион 001740 56 ную смесь последовательно промывают 1N гидроксидом натрия, водой и насыщенным водным раствором хлорида натрия. Оставшиеся органические вещества высушивают над сульфатом натрия и летучие продукты удаляют под пониженным давлением. Оставшуюся коричневую пену подвергают радиальной хроматографии(кремнезем толщиной 2 мм), проводя элюцию градиентом дихлорметана, содержащего 5-7,5% метанола и 0,5% гидроксида аммония. Фракции,которые, как показано, содержат продукт, объединяют и концентрируют под пониженным давлением. Далее этот материал растворяют в смеси этилацетат/этанол и обрабатывают щавелевой кислотой с получением 0,20 г (10,7%) целевого соединения в виде рыжевато-коричневого твердого вещества. Т.пл.=160 СMS (m/e): 339 (М+). Элементный анализ C19H21N3OSС 2H2 О 4: Расчет (в %): С - 58,73; Н - 5,40; N - 9,78. Найдено (в %): С - 58,61; Н - 5,54; N - 9,64. Общая процедура связывания карбоновых кислот с 5-амино-3-(1-метилпиперидин-4-ил)-1Hиндолом К суспензии 4-5 эквивалентов 1-этил-3-(3 диметиламинопропил)карбодиимида на полимерной основе (Desai, et al., Tetrahedron Letters,34(48), 7685 (1993 в хлороформе добавляют 1 эквивалент 5-амино-3-(1-метилпиперидин-4-ил)1H-индола и 2-3 эквивалента карбоновой кислоты. Реакционную смесь перемешивают до завершения реакции, при этом может быть проведено при необходимости нагревание. Смолу удаляют фильтрованием и продукт выделяют при выпаривании растворителя. Указанная процедура проиллюстрирована примерами 126-178. Пример 126. 5-(1-Пропаноил)амино-3-(1 метилпиперидин-4-ил)-1H-индол. Из исходных 12,0 мг (0,05 ммоль) 5-амино 3-(1-метилпиперидин-4-ил)-1H-индола и 8 мкл(0,10 ммоль) изомасляной кислоты получают 11,8 мг (79%) целевого соединения.(0,10 ммоль) изовалериановой кислоты получают 17,0 мг (100+%) целевого соединения.(0,10 ммоль) пентаноевой кислоты получают 12,8 мг (82%) целевого соединения.MS (m/e): 314 (М+1). Пример 130. 5-(Этоксиацетил)амино-3-(1 метилпиперидин-4-ил)-1H-индол. Из исходных 12,0 мг (0,05 ммоль) 5-амино 3-(1-метилпиперидин-4-ил)-1 Н-индола и 11,0 мкл (0,10 ммоль) этоксиуксусной кислоты получают 15,2 мг (97%) целевого соединения.(0,10 ммоль) феноксиуксусной кислоты получают 9,4 мг (52%) целевого соединения.(0,10 ммоль) дифенилуксусной кислоты получают 14,0 мг (66%) целевого соединения.(0,10 ммоль) коричной кислоты получают 7,2 мг(0,10 ммоль) циклопрпанкарбоновой кислоты получают 11,4 мг (77%) целевого соединения.(0,10 ммоль) циклобутанкарбоновой кислоты получают 15,0 мг (96%) целевого соединения.(0,10 ммоль) циклопентанкарбоновой кислоты получают 16,4 мг (100+%) целевого соединения.(0,10 ммоль) циклогесанкарбоновой кислоты получают 20,6 мг (100+%) целевого соединения. 58 В ходе реакции исходных 12,0 мг (0,05 ммоль) 5-амино-3-(1-метилпиперидин-4-ил)-1Hиндола с 16,2 мг (0,10 ммоль) 1,2,3,4 тетрагидро-1-нафтоевой кислоты при 70 С получают 16,2 мг (84%) целевого соединения.MS (m/e): 459 (М+). Пример 143. 5-(4-Метилбензоил)амино-3(1-метилпиперидин-4-ил)-1H-индол. В ходе реакции исходных 12,0 мг (0,05 ммоль) 5-амино-3-(1-метилпиперидин-4-ил)-1Hиндола с 14,0 мг (0,10 ммоль) 4-метилбензойной кислоты при 70 С получают 12,0 мгMS (m/e): 380 (М+1). Пример 150. 5-(3-(Диметиламино)бензоил) амино-3-(1-метилпиперидин-4-ил)-1 Н-индол. В ходе реакции исходных 12,0 мг (0,05 ммоль) 5-амино-3-(1-метилпиперидин-4-ил)-1Hиндола с 17,0 мг (0,10 ммоль) 3-(диметиламино)бензойной кислоты при 70 С получают 12,4 мг (66%) целевого соединения.MS (m/e): 377 (М+1). Пример 151. 5-(4-Фенилбензоил)амино-3(1-метилпиперидин-4-ил)-1H-индол. В ходе реакции исходных 12,0 мг (0,05 ммоль) 5-амино-3-(1-метилпиперидин-4-ил)-1Hиндола с 20,0 мг (0,10 ммоль) 4-фенилбензойной кислоты при 70 С получают 10,0 мг
МПК / Метки
МПК: A61K 31/404, A61P 11/02
Метки: способ, простуды, аллергического, обычной, лечения, ринита
Код ссылки
<a href="https://eas.patents.su/30-1740-sposob-lecheniya-obychnojj-prostudy-ili-allergicheskogo-rinita.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения обычной простуды или аллергического ринита</a>
Предыдущий патент: Замещенные n-[(аминоиминометил)фенилалкил]азагетероцикламиды сульфоновых кислот.
Следующий патент: Дерматологические и косметические композиции местного применения, содержащие сфингомиелиназу для повышения уровня церамидов в коже и слизистых оболочках
Случайный патент: Резервуар и способ для обработки сусла в пивоварении












