Замещенные n-[(аминоиминометил)фенилалкил]азагетероцикламиды сульфоновых кислот.
Номер патента: 1739
Опубликовано: 27.08.2001
Авторы: Чои-Следески Йонг Ми, Ивинг Вильям Р., Бекер Майкл Р., Макгэрри Дэниел Г., Паулс Хейнц В., Спада Альфред П., Дэйвис Родерик С.
Формула / Реферат
1. Соединение формулы
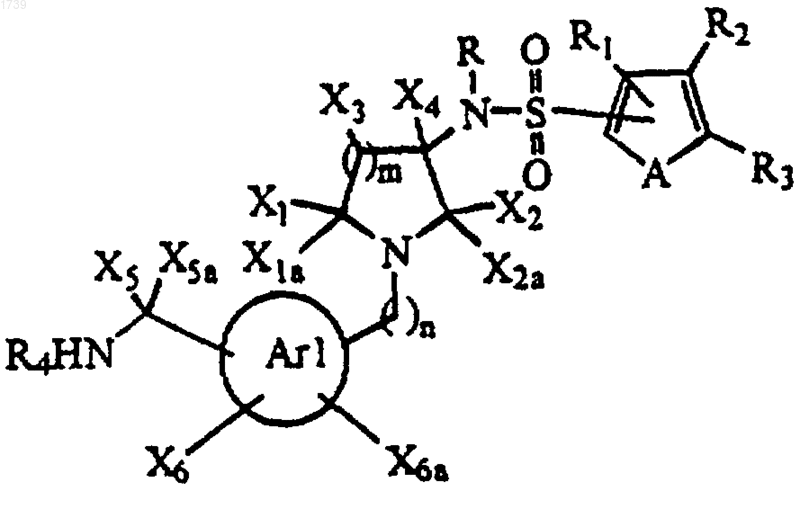
где  представляет собой фенил или моноциклический гетероарил;
представляет собой фенил или моноциклический гетероарил;
R представляет собой водород, необязательно замещенный алкил, необязательно замещенный аралкил, необязательно замещенный гетероаралкил, R6O(СН2)х-, R6O2(СН2)х-, Y1Y2NC(O)(CH2)x- или Y1Y2N(CH2)x-;
R1 представляет собой водород, алкил, гидрокси, алкокси, Y1Y2N-, галоген, -CO2R6, -C(O)NY1Y2, -(СН2)хОR6, -(CH2)xNY1Y2 или -CN;
R2 и R3 независимо выбраны из водорода, гидрокси, алкокси, Y1Y2N-, галогена, -CO2R6, -C(O)NY1Y2, -(СН2)хОR6, -(СН2)xNY1Y2, -CN, необязательно замещенного алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероциклила, необязательно замещенного арила, необязательно замещенного гетероарила, необязательно замещенного аралкила, необязательно замещенного гетероаралкила, необязательно замещенного аралкенила или необязательно замещенного гетероаралкенила или R2 и R3, взятые вместе с атомами углерода, посредством которых они связаны, образуют необязательно замещенный 5-7-членный конденсированный циклоалкил, необязательно замещенное 5-7-членное конденсированное гетероциклильное кольцо или необязательно замещенный 6-членный конденсированный арил, или необязательно замещенное 5-7-членное конденсированное гетероарильное кольцо;
R4 представляет собой водород или необязательно замещенный низший алкил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил;
X1 и X1a независимо выбраны из водорода, необязательно замещенного алкила, необязательно замещенного арила, необязательно замещенного аралкила, необязательно замещенного гетероарила или необязательно замещенного гетероаралкила или X1 и X1a, взятые вместе, образуют оксо;
Х2 и Х2а обозначают водород или, взятые вместе, образуют оксо;
Х3 представляет собой водород, гидрокси, необязательно замещенный алкил, необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил или Х3 и один из X1 и X1a, взятые вместе с атомами углерода, посредством которых связаны Х3 и один из X1 и X1a, образуют 4-7-членное циклоалкильное или гетероциклильное кольцо;
Х4 представляет собой водород, необязательно замещенный алкил или необязательно замещенный аралкил;
X5 и Х5а представляют собой водород или, взятые вместе, образуют =NR5;
R5 представляет собой водород, R6O2C-, R6O-, циано, R6CO-, необязательно замещенный низший алкил, нитро или Y1Y2N-;
Y1 и Y2 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный арил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил или Y1 и Y2, взятые вместе с атомом N, посредством которого Y1 и Y2 связаны, образуют 4-7-членный гетероциклил;
X6 и Х6а независимо представляют собой водород, R7R8N-, R9O-, R7R8NCO-, R7R8NSO2-, R7R8NSO2N-, R7R8NSO2O-, R9CO-, -CO2R6, -C(O)NY1Y2, -(CH2)xCO2R6, -(CH2)xC(O)NY1Y2, -(CH2)xOR6, -(CH2)xNY1Y2, галоген, циано или нитро;
R6 представляет собой водород, необязательно замещенный алкил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил;
R7 и R8 независимо представляют собой водород или необязательно замещенный низший алкил или один из R7 и R8 представляет собой водород, а другой из R7 и R8 представляет собой R10(O)CCH2- или низший ацил;
R9 представляет собой водород, необязательно замещенный низший алкил, необязательно замещенный низший ацил или R10(O)CCH2-;
R10 представляет собой водород, необязательно замещенный низший алкил, необязательно замещенный алкокси или гидрокси;
А представляет собой S или -СН=СН-;
m равно 0, 1, 2 или 3;
n равно 0, 1, 2 или 3; и
х равно 1, 2, 3, 4 или 5;
и при этом, если не указано особо, алкил может быть прямым или разветвленным и содержит от 1 до 20 атомов углерода, и низший алкил содержит от 1 до 4 атомов углерода,
циклоалкил означает насыщенную или частично ненасыщенную моно- или полициклическую систему, содержащую от 3 до 10 атомов углерода,
гетероциклил означает неароматическую, насыщенную или частично ненасыщенную моно- или полициклическую систему, содержащую от 3 до 10 кольцевых атомов, по крайней мере, один из которых является атомом кислорода, серы или азота,
алкокси означает алкоксильную группу, где алкил такой, как указано выше, и низший алкокси содержит от 1 до 4 атомов углерода,
ацил означает ацильную группу, где алкил такой, как указано выше, и низший ацил содержит от 1 до 4 атомов углерода,
арил означает ароматическую моно- или полициклическую систему, содержащую от 6 до 10 атомов углерода,
аралкил означает аралкильную группу, в которой арил и алкил являются такими, как указано выше,
гетероарил означает гетероароматическую моно- или полициклическую систему, содержащую от 5 до 10 кольцевых атомов, по крайней мере, один из которых является атомом кислорода, серы или азота,
гетероаралкил означает гетероаралкильную группу, в которой гетероарил и алкил являются такими, как указано выше,
аралкенил означает аралкенильную группу, в которой арил является таким, как указано выше, и алкенил представляет собой алкил, указанный выше, который содержит, по меньшей мере, одну двойную связь в алифатической цепи,
гетероаралкил означает гетероаралкильную группу, в которой гетероарил и алкил являются такими, как указано выше,
гетероалкенил означает гетероалкенильную группу, в которой гетероарил и алкенил являются такими, как указано выше,
его фармацевтически приемлемая соль, N-оксид, гидрат или сольват.
2. Соединение по п.1, где n=1 и m=1.
3. Соединение по п.1, где Х2 и Х2а, взятые вместе, представляют собой оксо.
4. Соединение по п.1, где X1 и X1a и Х4 представляют собой водород и Х3 представляет собой водород или алкил.
5. Соединение по п.1, где Х5 и X5a, взятые вместе, представляют =NR5, где R5 является R6O2C-.
6. Соединение по п.1, где X5 и X5a, взятые вместе, представляют собой =NR5, где R5 является -ОН.
7. Соединение по п.1, где Х5 и X5a, взятые вместе, представляют собой =NR5, где R5 является Н.
8. Соединение по п.1, где  представляет собой фенил и углерод, замещенный X5, X5a и R4HN-, присоединеэ т метаположении относительно присоединения группы -(CH)nN- в фениле.
представляет собой фенил и углерод, замещенный X5, X5a и R4HN-, присоединеэ т метаположении относительно присоединения группы -(CH)nN- в фениле.
9. Соединение по п.1, где  представляет собой тиенил и углерод, замещенный Х5, Х5а и R4HN-, присоединен в положении 2 относительно серы, тиенила, а группа -(CH)nN- присоединена в положении 4 тиенила.
представляет собой тиенил и углерод, замещенный Х5, Х5а и R4HN-, присоединен в положении 2 относительно серы, тиенила, а группа -(CH)nN- присоединена в положении 4 тиенила.
10. Соединение по п.1, где R представляет собой водород, метил, аралкил, гетероаралкил, НO2ССН2-, H2NCO(O)CH2- или R6НNС(O)СН2-.
11. Соединение по п.1, где R1 представляет собой водород, алкил или галоген.
12. Соединение по п.1, где R2 и R3 независимо представляют собой водород, галоген, алкокси, амино, арил или гетероарил.
13. Соединение по п.1, где R2 и R3 образуют необязательно замещенный конденсированный арил или необязательно замещенный конденсированный гетероарил, где заместителем является галоген, алкил, амино, гидрокси или алкокси.
14. Соединение по п.1, где R2 и R3 образуют необязательно замещенный конденсированный циклоалкил или необязательно замещенный конденсированный гетероциклил, в котором гетероатомом является азот, где заместителем является водород, Y1Y2N или алкил.
15. Соединение по п.1, где  представляет собой фенил и один из X6 и Х6а представляет собой амино или гидрокси в параположении относительно группы
представляет собой фенил и один из X6 и Х6а представляет собой амино или гидрокси в параположении относительно группы  .
.
16. Соединение по п.1, где X6 и X6a представляют собой водород.
17. Соединение по п.1, где А представляет собой -СН=СН-; R2 и R3, взятые вместе с атомами углерода, посредством которых R2 и R3 связаны, образуют необязательно замещенное 5- или 6-членное гетероарильное кольцо или необязательно замещенное 6-членное арильное кольцо.
18. Соединение по п.1, где А представляет собой -СН=СН-; R2 представляет собой водород и R3 представляет собой необязательно замещенное гетероарильное кольцо или необязательно замещенное 6-членное арильное кольцо.
19. Соединение по п.1, где А представляет собой S.
20. Соединение по п.1, где А представляет собой S; и R2 и R3, взятые вместе с атомами углерода, посредством которых R2 и R3 связаны, образуют необязательно замещенное 5- или 6-членное гетероарильное кольцо или необязательно замещенное 6-членное арильное кольцо.
21. Соединение по п.1, где А представляет собой S, R2 представляет собой водород и R3 представляет собой необязательно замещенное гетероарильное кольцо или необязательно замещенное 6-членное арильное кольцо.
22. Соединение по п.1, представляющее собой
трифторацетат 3-[3-(S)-(бензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-[(бензо[b]тиофен-2-сульфонил)метиламино]-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-[3-(S)-(бензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]тиофен-2-карбоксамидина;
трифторацетат 4-[3-(S)-[(бензо[b]тиофен-2-сульфонил)метиламино]-2-оксопирролидин-1-илметил]тиофен-2-карбоксамидина;
трифторацетат 3-[3-(S)-(4-хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(6-хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-[(4-хлорбензо[b]тиофен-2-сульфонил)метиламино]-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-[(6-хлорбензо[b]тиофен-2-сульфонил)метиламино]-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(5-хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-[(5-хлорбензо[b]тиофен-2-сульфонил)метиламино]-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(4-метилбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(6-метилбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(5-метилбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(4,6-дихлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
2,2,2-трихлорэтиловый эфир [(3-[3-(S)-(4,6-дихлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]фенил)иминометил]карбаминовой кислоты;
трифторацетат 4-амино-3-[3-(S)-(4,6-дихлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-гидрокси-3-[3-(S)-(4,6-дихлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(6-фторбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-амино-3-[3-(S)-(6-фторбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-гидрокси-3-[3-(S)-(6-фторбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-амино-3-[3-(S)-(4-хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-гидрокси-3-[3-(S)-(4-хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(4-хлортиено[3,2-с]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-гидрокси-3-[3-(S)-(4-хлортиено[3,2-с]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(5-хлортиено[3,2-b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
бистрифторацетат 3-[3-(S)-(тиено[3,2-b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(5-хлортиено[3,2-b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]гидроксибензамидина;
трифторацетат 3-{3-(S)-[(5-хлортиено[3,2-b]пиридин-2-сульфонил)метиламино]-2-оксопирролидин-1-илметил}бензамидина;
трифторацетат 3-[3-(S)-(6-хлортиено[2,3-b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
бистрифторацетат 3-[3-(S)-(тиено[2,3-b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-{3-(S)-[(6-хлортиено[2,3-b]пиридин-2-сульфонил)метиламино]-2-оксопирролидин-1-илметил}бензамидина;
трифторацетат 4-гидрокси-3-[2-оксо-3-(S)-(5-хлортиено[3,2-b]пиридин-2-сульфониламино)пирролидин-1-илметил]бензамидина;
бистрифторацетат 4-гидрокси-3-[2-оксо-3-(S)-(тиено[3,2-b]пиридин-2-сульфониламино)пирролидин-1-илметил]бензамидина;
трифторацетат 4-гидрокси-3-[2-оксо-3-(S)-(5-хлортиено-[3,2-b]пиридин-2-сульфониламино)пирролидин-1-илметил]гидроксибензамидина;
трифторацетат 4-амино-3-[2-оксо-3-(S)-(5-хлортиено[3,2-b] пиридин-2-сульфониламино)пирролидин-1-илметил]бензамидина;
бистрифторацетат 4-амино-3-[2-оксо-3-(S)-(тиено[3,2-b]пиридин-2-сульфониламино)пирролидин-1-илметил]бензамидина;
трифторацетат 4-[3-(S)-(5-хлортиено[3,2-b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]тиофен-2-карбоксамидина;
трифторацетат 4-[3-(S)-(5-хлортиено[3,2-b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]тиофен-2-гидроксикарбоксамидина;
трифторацетат 4-{3-(S)-[(5-хлортиено[3,2-b]пиридин-2-сульфонил)метиламино]-2-оксопирролидин-1-илметил}тиофен-2-карбоксамидина;
трифторацетат 3-{3-(S)-[5-(2-метилсульфанилпиримидин-4-ил)тиофен-2-сульфониламино]-2-оксопирролидин-1-илметил}бензамидина;
трифторацетат 3-{3-(S)-[5-(2-метоксипиримидин-4-ил)тиофен-2-сульфониламино]-2-оксопирролидин-1-илметил}бензамидина;
бистрифторацетат 3-{3-(S)-[5-(2-аминопиримидин-4-ил)тиофен-2-сульфониламино]-2-оксопирролидин-1-илметил}бензамидина;
бистрифторацетат 3-{3-(S)-[5-(2-аминопиримидин-4-ил)тиофен-2-сульфонилметиламино]-2-оксопирролидин-1-илметил}бензамидина;
трифторацетат 3-[3-(S)-(5'-хлор[2,2']битиофенил-5-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-амино-3-[(3-(S)-бензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-амино-3-[(6-хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-амино-3-[(6-хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]гидроксибензамидина;
трифторацетат 3-[2-оксо-3-(S)-(5-пиридин-3-илтиофен-2-сульфониламино)пирролидин-1-илметил]бензамидина;
трифторацетат 4-амино-3-[2-оксо-3-(S)-(5-пиридин-3-илтиофен-2-сульфониламино)пирролидин-1-илметил]бензамидина;
трифторацетат 4-гидрокси-3-[2-оксо-3-(S)-(5-пиридин-3-илтиофен-2-сульфониламино)пирролидин-1-илметил]бензамидина;
трифторацетат 4-гидрокси-3-[2-оксо-3-(S)-(5-пиридин-N-оксид-3-илтиофен-2-сульфониламино)пирролидин-1-илметил]бензамидина;
трифторацетат 3-[2-оксо-3-(S)-(5-пиридин-4-илтиофен-2-сульфониламино)пирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(4-хлортиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-{3-(S)-[5-(5-хлорпиридин-3-ил)тиофен-2-сульфониламино]-2-оксопирролидин-1-илметил}бензамидина;
трифторацетат 3-[3-(S)-(4-хлор-5-пиридин-3-илтиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-гидрокси-3-[3-(S)-(6-хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамида;
трифторацетат 3-[3-(S)-(1-аминоизохинолин-6-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-фтор-3-[3-(S)-(5-пиридин-3-илтиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамида;
трифторацетат {1-[3-(аминоиминометил)бензил]-2-оксопирролидин-3-(S)-ил}амида 2-хлорохинолин-6-сульфоновой кислоты;
бистрифторацетат {1-[3-(аминоиминометил)бензил]-2-оксопирролидин-3-(S)-ил}амида 2-аминохинолин-6-сульфоновой кислоты;
трифторацетат 4-гидрокси-3-[3-(S)-(7-хлортиено[2,3-с]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
бистрифторацетат 4-гидрокси-3-[3-(S)-(тиено[2,3-с]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-гидрокси-3-[3-(S)-(тиено[3,2-с]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
гидрохлорид 4-[3-(6-фторбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]тиофен-2-карбоксамидина;
бистрифторацетат 4-{3-(S)-[(3-аминопропил)-(6-фторбензо[b]тиофен-2-сульфониламино)]-2-оксопирролидин-1-илметил}тиофен-2-карбоксамидина;
трифторацетат [[1-(5-карбамимидоилтиофен-3-илметил-2-оксопирролидин-3-ил]-(6-фторбензо[b]тиофен-2-сульфонил)амино]уксусной кислоты;
этиловый эфир [имино-(4-{3-[(7-метоксинафталин-2-сульфонил)пиридин-2-илметиламино]-2-оксопирролидин-1-илметил}тиофен-2-ил)метил]карбаминовой кислоты;
трифторацетат 4-амино-3-{3-(S)-[(7-метоксинафталин-2-сульфонил)пиридин-2-илметиламино]-2-оксопирролидин-1-илметил}бензамидина;
трифторацетат 2-[[1-(2-амино-5-карбамимидоилбензил)-2-оксопирролидин-3-(S)-ил]-(7-метоксинафталин-2-сульфонил)амино]ацетамида;
этиловый эфир [имино-3-{3-[(7-метоксинафталин-2-сульфонил)метиламино]-2-оксо-3-(S)пирролидин-1-илметил}-(4-аминофенил)метил]карбаминовой кислоты;
трифторацетат 4-гидрокси-3-{3-(S)-[5-(1-гидроксипиридин-4-ил)тиофен-2-сульфониламино]-2-оксопирролидин-1-илметил}бензамидина;
трифторацетат 4-амино-3-[3-(S)-(5-хлортиено[3,2-b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]гидроксибензамидина;
бистрифторацетат 4-амино-3-[3-(S)-(5-метокситиено[3,2-b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(5-изоксазол-3-илтиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-амино-3-[3-(S)-(5-изоксазол-3-илтиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина ;
трифторацетат 4-гидрокси-3-[3-(S)-(5-изоксазол-3-илтиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-(S)-[3-([2,2']битиофенил-5-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-амино-3-[3-(S)-(3-[2,2']битиофенил-5-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-амино-3-[3-(S)-(5'-хлор[2,2']битиофенил-5-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
гидрохлорид 4-гидрокси-3-[3-(S)-(5'-хлор[2,2']битиофенил-5-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
4-гидрокси-3-[3-(S)-(5'-хлор[2,2']битиофенил-5-сульфониламино)-2-оксопирролидин-1-илметил]гидроксибензамидин, или
гидрохлорид 4-[3-(S)-(6-фторбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]пиридин-2-карбоксамидина,
или его фармацевтически приемлемые соли.
23. Соединение по п.22, представляющее
трифторацетат 3-[3-(S)-[(бензо[b]тиофен-2-сульфонил)метиламино]-2-оксопирролидин-1-илметил]бензамидина, или
трифторацетат 4-[3-(бензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]тиофен-2-карбоксамидина,
или его фармацевтически приемлемые соли.
24. Соединение по п.22, представляющее
трифторацетат 3-[3-(S)-(6-хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(6-хлорбензо[b]тиофен-2-сульфонилметиламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(4,6-дихлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
2,2,2-трихлорэтиловый эфир [3-[3-(S)-(4,6-дихлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]фенил]иминометил карбаминовой кислоты;
трифторацетат 3-[3-(S)-(6-фторбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-амино-3-[3-(S)-(6-фторбензо[b]тиофен-2-сульфамиламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-гидрокси-3-[3-(S)-(6-фторбензо[b]тиофен-2-сульфамиламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-амино-3-[(6-хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-амино-3-[(6-хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]гидроксибензамидина; или
трифторацетат 4-гидрокси-3-[3-(S)-(6-хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-ил]бензамидина,
или их фармацевтически приемлемая соль.
25. Соединение по п.22, представляющее
трифторацетат 3-[3-(S)-(4-хлортиено[3,2-с]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-гидрокси-3-[3-(S)-(4-хлортиено[3,2-с]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(5-хлортиено[3,2-b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 3-[3-(S)-(5-хлортиено[3,2-b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]гидроксибензамидина;
трифторацетат 3-{3-(S)-[(5-хлортиено[3,2-b]пиридин-2-сульфонил)метиламино]-2-оксопирролидин-1-илметил}бензамидина;
трифторацетат 3-[3-(S)-(6-хлортиено[2,3-b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина;
трифторацетат 4-гидрокси-3-[3-(S)-(7-хлортиено[2,3-с]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина, или
бистрифторацетат 4-амино-3-[3-(S)-(5-метокситиено[3,2-b]пиридин-2-сульфониламино)-2-oкcoпиppoлидин-1-илмeтил]бензамидина,
или его фармацевтически приемлемая соль.
26. Соединение по п.22, представляющее трифторацетат 3-[2-оксо-3-(S)-(5-пиридин-3-илтиофен-2-сульфониламино)пирролидин-1-илметил]бензамидина, или его фармацевтически приемлемая соль.
27. Соединение по п.22, представляющее трифторацетат 4-амино-3-[2-оксо-3-(S)-(5-пиридин-3-илтиофен-2-сульфониламино)пирролидин-1-илметил]бензамидина, или его фармацевтически приемлемая соль.
28. Соединение по п.22, представляющее трифторацетат 4-гидрокси-3-[2-оксо-3-(S)-(5-пиридин-3-илтиофен-2-сульфониламино)пирролидин-1-илметил]бензамидина, или его фармацевтически приемлемая соль.
29. Соединение по п.22, представляющее трифторацетрт 4-гидрокси-3-[2-оксо-3-(S)-(5-пиридин-N-оксид-3-илтиофен-2-сульфониламино)пирролидин-1-илметил]бензамидина, или его фармацевтически приемлемая соль.
30. Соединение по п.22, представляющее трифторацетат 3-[2-оксо-3-(S)-(5-пиридин-4-илтиофен-2-сульфониламино)пирролидин-1-илметил]бензамидина, или его фармацевтически приемлемая соль.
31. Соединение по п.22, представляющее трифторацетат 3-{3-(S)-[5-(2-метилсульфанилпиримидин-4-ил)тиофен-2-сульфониламино]-2-оксопирролидин-1-илметил}бензамидина, или его фармацевтически приемлемая соль.
32. Соединение по п.22, представляющее трифторацетат 4-амино-[3-(S)-([2,2']битиофенил-5-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина, трифторацетат 4-амино-3-[3-(S)-(5'-хлор[2,2']битиофенил-5-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина или гидрохлорид 4-гидрокси-3-[3-(S)-(5'-хлор[2,2']битиофенил-5-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина, или его фармацевтически приемлемая соль.
33. Соединение по п.22, представляющее бистрифторацетат 3-[3-(S)-(тиено[3,2-b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина, или его фармацевтически приемлемая соль.
34. Соединение по п.22, представляющее бистрифторацетат 3-[3-(S)-(тиено[2,3-b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина, или его фармацевтически приемлемая соль.
35. Соединение по п.22, представляющее бистрифторацетат 4-гидрокси-3-[2-оксо-3-(S)-(тиено[3,2-b]пиридин-2-сульфониламино)пирролидин-1-илметил]бензамидина, или его фармацевтически приемлемая соль.
36. Соединение по п.22, представляющее бистрифторацетат 4-амино-3-[2-оксо-3-(S)-(тиено[3,2-b]-пиридин-2-сульфониламино)пирролидин-1-илметил]бензамида, или его фармацевтически приемлемая соль.
37. Соединение по п.22, представляющее бистрифторацетат 4-гидрокси-3-[3-(S)-(тиено[2,3-с]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина, или его фармацевтически приемлемая соль.
38. Соединение по п.22, представляющее трифторацетат 4-гидрокси-3-[3-(S)-(тиено[3,2-с]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина, или его фармацевтически приемлемая соль.
39. Соединение по п.22, представляющее трифторацетат 4-амино-3-[3-(S)-(5-изоксазол-3-илтиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина или трифторацетат 4-гидрокси-3-[3-(S)-(5-изоксазол-3-илтиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина, или его фармацевтически приемлемая соль.
40. Соединение по п.22, представляющее трифторацетат 4-гидрокси-3-{3-(S)-[5-(1-гидроксипиридин-4-ил)тиофен-2-сульфониламино]-2-оксопирролидин-1-илметил}бензамидина, или его фармацевтически приемлемая соль.
41. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
42. Способ лечения пациента, страдающего от физиологического нарушения, которое можно модулировать посредством ингибирования активности фактора Ха, включающий введение пациенту терапевтически эффективного количества соединения по п.1.
43. Способ по п.42, отличающийся тем, что физиологическим нарушением является нарушение в венозной сосудистой системе, артериальной сосудистой системе, аномальное тромбообразование, инфаркт миокарда, нестабильная стенокардия, тромбоэмболия, резкая закупорка сосуда, связанная с тромболитической терапией и чрезкожной внутрипросветной коронарной ангиопластикой, преходящие нарушения мозгового кровообращения, удар, перемежающаяся хромота или обходное шунтирование коронарной или периферических артерий, сужение просвета сосудов, рестеноз после коронарной или венозной ангиопластики, поддержание проходимости сосудов у пациентов хронического гемодиализа, паталогическое тромбообразование, имеющее место в венах нижних конечностей после операций в брюшной полости, коленного и тазобедренного суставов, опасность легочной тромбоэмболии или рассеянная системная интраваскулярная коагулопатия, имеющая место в сосудистых системах при септическом шоке, некоторых вирусных инфекциях или раке.
44. Способ по п.42, отличающийся тем, что физиологическим нарушением является аномальное тромбообразование, инфаркт миокарда, нестабильная стенокардия, тромбоэмболия, резкая закупорка сосудов, связанная с тромболитической терапией, преходящие нарушения мозгового кровообращения, перемежающаяся хромота или обходное шунтирование коронарной или периферических артерий, рестеноз после коронарной или венозной ангиопластики, паталогическое тромбообразование, имеющее место в венах нижних конечностей после операций в брюшной полости, коленного и тазобедренного суставов, или опасность легочной тромбоэмболии.
45. Способ по п.42, отличающийся тем, что физиологическим нарушением является удар, сужение просвета сосудов, поддержание проходимости сосудов у пациентов хронического гемодиализа или рассеянная системная интраваскулярная коагулопатия, имеющая место в сосудистых системах при септическом шоке, некоторых вирусных инфекциях или раке.
Текст
1 Данная заявка является частичным продолжением находящейся в процессе одновременного рассмотрения заявки на патент США,регистрационный 08/761414, поданной 6 декабря 1996 г., которая, в свою очередь, является частичным продолжением РСТ/US 96/09816,поданной 7 июня 1996 г., принадлежащей США,которая, в свою очередь, является частичным продолжением заявки на патент США, регистрационный 08/481024, поданной 7 июня 1995 г. - теперь патента США 5612353, выданного 18 марта 1997 г. Эта заявка также является частичным продолжением находящейся в процессе одновременного рассмотрения заявки на патент США, не переуступленной, поданной 21 ноября 1997 г., которая, в свою очередь, является продолжением заявки РСТ/US 96/09816,поданной 7 июня 1996 г. Область техники, к которой относится изобретение Соединения формулы I обладают полезной фармакологической активностью и поэтому вводятся в состав фармацевтических композиций и могут использоваться при лечении пациентов, страдающих от некоторых заболеваний. Конкретнее, они являются ингибиторами фактора Ха. Настоящее изобретение относится к соединениям формулы I, композициям, содержащим соединения формулы I, и их применению, которое заключается в лечении пациента,страдающего от или подвергаемого состоянию,которое можно улучшить посредством введения ингибитора фактора Ха. Фактор Ха является предпоследним ферментом в коагулирующей системе. Как свободный фактор Ха, так и фактор Ха в составе протромбиназного комплекса (фактор Ха, факторVa, кальций и фосфолипид) ингибируются соединениями формулы I. Ингибирование фактора Ха достигается благодаря прямому образованию комплекса между ингибитором и ферментом и,следовательно, не зависит от плазменного кофактора антитромбина III. Эффективное ингибирование фактора Ха достигается путем введения соединений либо пероральным способом посредством непрерывной внутривенной инфузии, болюсным внутривенным введением, либо любым парентеральным путем, чтобы при этом достигался нужный эффект предупреждения индуцированного фактором Ха образования тромбина из протромбина. Антикоагулянтная терапия показана для лечения и профилактики многих тромботических состояний как венозной, так и артериальной сосудистой системы. В артериальной системе аномальное тромбообразование ассоциируется, в первую очередь, с артериями коронарной, церебральной и периферической сосудистой сети. Заболеваниями, связанными с тромботической окклюзией этих сосудов, являются,главным образом, инфаркт миокарда (AMI),нестабильная стенокардия, тромбоэмболия, рез 001739 2 кая закупорка сосуда, связанная с тромболитической терапией и чрезкожной внутрипросветной коронарной ангиопластикой (РТСА), преходящие нарушения мозгового кровообращения, удар, перемежающаяся хромота и обходное шунтирование коронарной (CABG) или периферических артерий. Длительная антикоагулянтная терапия также может быть использована для предупреждения сужения просвета сосуда (рестеноз), что часто происходит после РТСА иCABG, и для поддержания раскрытого состояния сосуда у пациентов хронического гемодиализа. Что касается венозной сосудистой системы, патологическое тромбообразование часто происходит в венах нижних конечностей после операций на брюшной полости, коленного и тазобедренного суставов (тромбоз глубоких вен,DVT). DVT также вызывает у пациента повышенную опасность заболевания легочной тромбоэмболией. Системная коагулопатия потребления (DIC) обычно имеет место в обеих сосудистых системах при септическом шоке, некоторых вирусных инфекциях и раке. Это состояние характеризуется быстрым потреблением факторов коагуляции и их плазменных ингибиторов,что приводит, в результате, к образованию опасных для жизни сгустков по всей длине микроциркуляторной части сосудистого русла некоторых органов. Показания, описанные выше,включают некоторые, но не все, возможные клинические ситуации, когда антикоагулянтная терапия оправдана. Исследователям, работающим в этой области, хорошо известны обстоятельства, при которых требуется либо срочная,либо постоянная профилактическая антикоагулянтная терапия. Краткое изложение сущности изобретения Данное изобретение относится к фармацевтическому применению соединения приведенной ниже формулы I при лечении пациента,страдающего от физиологического нарушения,которое можно модулировать путем ингибирования активности фактора Ха, и указанная формула I имеет вид представляет фенил или моноциклический гетероарил;R2 и R3 выбраны независимо из водорода,гидрокси, алкокси, Y1Y2N-, галогена, -CO2R6,-C(O)NY1Y2, -(CH2)xOR6, -(СН 2)хNY1Y2, -CN,необязательно замещенного алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероциклила, необязательно замещенного арила, необязательно замещенного гетероарила, необязательно замещенного аралкила, необязательно замещенного гетероаралкила, необязательно замещенного аралкенила или необязательно замещенного гетероаралкенила,или R2 и R3, взятые вместе с атомами углерода,посредством которых они связаны, образуют необязательно замещенный 5-7-членный конденсированный циклоалкил, необязательно замещенное 5-7-членное конденсированное гетероциклическое кольцо или необязательно замещенный 6-членный конденсированный арил,или необязательно замещенное 5-7-членное конденсированное гетероарильное кольцо;R4 представляет водород или необязательно замещенный низший алкил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил;X1 и X1a выбраны независимо из водорода,необязательно замещенного алкила, необязательно замещенного арила, необязательно замещенного аралкила, необязательно замещенного гетероарила или необязательно замещенного гетероаралкила, или X1 и X1a, взятые вместе,образуют оксо; Х 2 и Х 2 а являются атомами водорода или,взятые вместе, образуют оксо; Х 3 представляет водород, гидрокси, необязательно замещенный алкил, необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил,или Х 3 и один из X1 и X1a, взятые вместе с атомами углерода, посредством которых связаны Х 3 и один из X1 и X1a, образуют 4-7-членное циклоалкильное или гетероциклическое кольцо; Х 4 представляет водород, необязательно замещенный алкил или необязательно замещенный аралкил; Х 5 и Х 5a представляют водород или, взятые вместе, представляют = NR5;R5 представляет водород, R6O2C-, R6 О-,циано, R6CO-, необязательно замещенный низший алкил, нитро или Y1Y2N-;Y1 и Y2 представляют независимо водород,необязательно замещенный алкил, необязательно замещенный арил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил, или Y1 и Y2, взятые вместе с атомом N, посредством которого Y1 и Y2 связаны, образуют 4-7-членный гетероцикл; Х 6 и X6a представляют независимо водород, R7R8N-, R9O-, R7R8NCO-, R7R8NSO2-, 001739R6 представляет водород, необязательно замещенный алкил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил;R7 и R8 представляют независимо водород или необязательно замещенный низший алкил,или один из R7 и R8 представляет водород, а другой из R7 и R8 представляет R10(O)CCH2- или низший ацил;R9 представляет водород, необязательно замещенный низший алкил, необязательно замещенный низший ацил или R10(O)ССН 2-;R10 представляет водород, необязательно замещенный низший алкил, необязательно замещенный алкокси или гидрокси; А представляет S или -СН=СН-;n равен 0, 1, 2 или 3; и х равен 1, 2, 3, 4 или 5; или к его фармацевтически приемлемой соли, Nоксида, гидрата или сольвата. Подробное описание изобретения Использованные выше и в дальнейшем описании изобретения термины должны пониматься, если нет других указаний, как имеющие указанные ниже значения. Определения"Алкил" означает алифатическую углеводородную группу, которая может быть линейной или разветвленной, с 1-20 атомами углерода в цепи. Предпочтительные алкильные группы содержат от 1 до примерно 12 атомов углерода в цепи. "Разветвленные" означает, что к линейной алкильной цепи присоединены одна или несколько низших алкильных групп, таких как метил, этил или пропил. "Низший алкил" содержит примерно 1-4 атома углерода в цепи,которая может быть линейной или разветвленной. Алкил может замещаться одним или несколькими "заместителями для алкильной группы", которые могут быть одинаковыми или различными и включают галоген, циклоалкил, гидрокси, алкокси, амино, ациламино, ароиламино,карбокси, алкоксикарбонил, аралкилоксикарбонил, гетероаралкилоксикарбонил или Y1Y2NCO-,где Y1 и Y2 представляют независимо водород,необязательно замещенный алкил, необязательно замещенный арил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил, или Y1 и Y2, взятые вместе с N,через который Y1 и Y2 связываются, образуют 47-членный гетероциклил. Примерами алкильных групп являются метил, трифторметил, циклопропилметил, циклопентилметил, этил, нпропил, изопропил, н-бутил, трет-бутил, нпентил, 3-пентил, метоксиэтил, карбоксиметил, 5 метоксикарбонилэтил, бензилоксикарбонилметил, пиридилметилоксикарбонилметил."Циклоалкил" означает не ароматическую моно- или полициклическую ядерную систему примерно из 3-10 атомов углерода. Примерами моноциклических циклоалкильных систем являются циклопентил, циклогексил и циклогептил. Циклоалкильная группа является, необязательно, частично ненасыщенной или, необязательно, замещенной одним или несколькими заместителями для циклоалкильной группы,которые могут быть одинаковыми или различными, где "заместителем для циклоалкильной группы" является водород, алкил, арил, гетероарил, аралкил, гетероаралкил, гидрокси, гидроксиалкил, алкокси, арилокси, аралкокси, ацил,ароил, галоген, нитро, циано, карбокси, алкоксикарбонил, арилоксикарбонил, аралкоксикарбонил, ациламино, ароиламино, алкилсульфонил, арилсульфонил, гетероарилсульфо-нил,алкилсульфинил, арилсульфинил, гетероарилсульфинил, алкилтио, арилтио, гетероарилтио,аралкилтио, гетероаралкилтио, конденсированный циклоалкил, конденсированный гетероциклил, арилазо, гетероарилазо, Y1Y2N-, Y1Y2NCOили Y1Y2NSO2-, где Y1 и Y2 представляют независимо водород, необязательно замещенный алкил, необязательно замещенный арил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил, или Y1 и Y2, взятые вместе с N, через который Y1 и Y2 связываются, образуют 4-7-членный гетероциклил. Заместителями для арильной группы являются описанные здесь заместители. Примерами полициклических циклоалкильных систем являются 1-декалин, норборнил, адамант (1- или 2-)ил."Гетероциклил" означает не ароматическую моноциклическую или полициклическую ядерную систему примерно с 3-10 кольцевыми атомами. Предпочтительные ядра включают примерно 5-6 кольцевых атомов, при этом один из кольцевых атомов является атомом кислорода, азота или серы. Гетероциклил является, необязательно, частично ненасыщенным или, необязательно, замещенным одним или несколькими заместителями для гетероциклильной группы, которые могут быть одинаковыми или различными, где "заместитель для гетероциклильной группы" представляет водород, алкил,арил, гетероарил, аралкил, гетероаралкил, гидрокси, гидроксиалкил, алкокси, арилокси, аралкокси, ацил, ароил, галоген, нитро, циано, карбокси, алкоксикарбонил, арилоксикарбонил,аралкоксикарбонил, ациламино, ароиламино,алкилсульфонил, арилсульфонил, гетероарилсульфонил, алкилсульфинил, арилсульфинил,гетероарилсульфинил, алкилтио, арилтио, гетероарилтио, аралкилтио, гетероаралкилтио, конденсированный циклоалкил, конденсированный гетероциклил, арилазо, гетероарилазо, Y1Y2N-,Y1Y2NCO- или Y1Y2NSO2-, где Y1 и Y2 представляют независимо водород, необязательно 6 замещенный алкил, необязательно замещенный арил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил, илиY2 связываются, образуют 4-7-членный гетероциклил. Заместителями для гетероциклильной группы являются установленные здесь заместители. Примерами моноциклических систем являются пирролидил, пиперидил, тетрагидрофуранил, тетрагидротиенил и тетрагидротиопиранил. Тио- или азотная составляющая гетероциклила также может быть, необязательно,окислена до соответствующего N-оксида или Sоксида или S,S-диоксида."Арил" означает 6-10-членную ароматическую моноциклическую или полициклическую углеводородную ядерную систему. Примерами арила являются фенил или нафтил, или замещенный фенил или замещенный нафтил, замещенные одним или несколькими заместителями для арильной группы, которые могут быть одинаковыми или различными, где "заместитель для арильной группы" представляет водород,алкил, арил, гетероарил, аралкил, гетероаралкил, гидрокси, гидроксиалкил, алкокси, арилокси, аралкокси, ацил, ароил, галоген, нитро,циано, карбокси, алкоксикарбонил, арилоксикарбонил,аралкоксикарбонил,ациламино,ароиламино, алкилсульфонил, арилсульфонил,гетероарилсульфонил, алкилсульфинил, арилсульфинил, гетероарилсульфинил, алкилтио,арилтио, гетероарилтио, аралкилтио, гетероаралкилтио, конденсированный циклоалкил, конденсированный гетероциклил, арилазо,гетероарилазо,Y1Y2N-,Y1Y2NCOили 1 2 1 2Y Y NSO2-, где Y и Y представляют независимо водород, необязательно замещенный алкил,необязательно замещенный арил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил, или Y1 и Y2, взятые вместе с N, через который Y1 и Y2 связываются,образуют 4-7-членный гетероциклил. Заместителями для арильной группы являются установленные здесь заместители. Предпочтительными арильными группами являются необязательно замещенный фенил или необязательно замещенный нафтил. Предпочтительными заместителями для арильной группы являются водород,алкил, гидрокси, ацил, арил, ароил, арилокси,галоген, нитро, алкокси, циано, алкоксикарбонил, ациламино, алкилтио, Y1Y2N-, Y1Y2NCOили Y1Y2NSO2-, где Y1 и Y2 представляют независимо необязательно замещенный алкил, арил,аралкил или гетероаралкил; предпочтительными заместителями для фенильной группы являются гидрокси, галоген, алкил, амино."Гетероарил" означает 5-10-членную ароматическую моноциклическую или полициклическую углеводородную ядерную систему, в которой один или несколько атомов в ядерной системе является (являются) элементом (элементами) иным (иными), чем углерод, например 7 азотом, кислородом или серой. "Гетероарил" также может быть замещен одним или несколькими из указанных выше "заместителей для арильной группы". Примерами гетероарильных групп являются замещенный пиразинил, фуранил, тиенил, пиридил, пиримидинил, изоксазолил, изотиазолил, оксазолил, тиазолил, пиразолил, фуразанил, пирролил, имидазо[2,1-b]тиазолил, бензофуразанил, индолил, азаиндолил,бензимидазолил, бензотиенил, хинолинил, имидазолил и изохинолинил. Когда представляет моноциклический гетероарил, тогда предпочтительными гетероарилами являются тиенил или пиридил."Аралкил" означает арилалкильную группу, в которой арил и алкил являются такими,какие описаны ранее. Предпочтительные аралкилы содержат низкую алкильную группу. Примерами аралкильных групп являются бензил, 2-фенетил и нафталинметил."Гетероаралкил" означает гетероарилалкильную группу, в которой гетероарил и алкил являются такими, какие описаны ранее. Предпочтительные гетероаралкилы содержат низшую алкильную группу. Примерами гетероаралкильных групп являются тиенилметил, пиридилметил, имидазолилметил и пиразинилметил."Аралкенил" означает арилалкенильную группу, в которой арил и алкенил являются такими, какие описаны ранее. Предпочтительные аралкенилы содержат низшую алкенильную группу. Примером аралкенильной группы является 2-фенетенил."Гетероаралкенил" означает гетероарилалкенильную группу, в которой гетероарил и алкенил такие, какие описаны ранее. Предпочтительные гетероаралкенилы содержат низшую алкенильную группу. Примерами гетероаралкенильных групп являются тиенилэтенил, пиридилэтенил, имидазолилэтенил и пиразинилэтенил."Гидроксиалкил" означает НО-алкильную группу, в которой алкил является таким, какой описан ранее. Предпочтительные гидроксиалкилы содержат низший алкил. Примерами гидроксиалкильных групп являются гидроксиметил и 2-гидроксиэтил."Ацил" означает Н-СО- или алкил-СОгруппу, в которой алкильная группа такая, какая описана ранее. Предпочтительные ацилы содержат низший алкил. Примерами ацильных групп являются формил, ацетил, пропаноил, 2 метилпропаноил, бутаноил и пальмитоил."Ароил" означает арил-СО-группу, в которой арильная группа является такой, какая описана ранее. Примерами таких групп являются бензоил и 1- или 2-нафтоил."Гетероароил" означает гетероарил-СОгруппу, в которой гетероарильная группа является такой, какая описана ранее. Примерами таких групп являются тиофеноил и пиридиноил."Алкокси" означает алкил-O-группу, в которой алкильная группа такая, какая описана ранее. Примерами алкоксигрупп являются метокси, этокси, н-пропокси, изопропокси, нбутокси и гептокси."Арилокси" означает арил-O-группу, в которой арильная группа такая, какая описана ранее. Примерами арилоксигрупп являются фенокси и нафтокси."Аралкилокси" означает аралкил-Oгруппу, в которой аралкильная группа такая,какая описана ранее. Примерами аралкилоксигрупп являются бензилокси и 1- или 2-нафталинметокси."Алкилтио" означает алкил-S-группу, в которой алкильная группа такая, какая описана ранее. Примерами алкилтиогрупп являются метилтио, этилтио, изопропилтио и гептилтио."Арилтио" означает арил-S-группу, в которой арильная группа такая, какая описана ранее. Примерами арилтиогрупп являются фенилтио и нафтилтио."Аралкилтио" означает аралкил-S-группу,в которой аралкильная группа такая, какая описана ранее. Примером аралкил-тиогруппы является бензилтио."Y1Y2N-" означает замещенную или незамещенную аминогруппу, в которой Y1 и Y2 являются такими, какие описаны ранее. Примерами таких групп являются амино (H2N-), метиламино, ди-метиламино, диэтиламино, пирролидин, пиперидин, бензиламино или фенетиламино."Алкоксикарбонил" означает алкил-O-СОгруппу. Примерами алкоксикарбонильных групп являются метоксикарбонил, этоксикарбонил или трет-бутоксикарбонил."Арилоксикарбонил" означает арил-O-СОгруппу. Примерами арилоксикарбонильных групп являются феноксикарбонил и нафтоксикарбонил."Аралкоксикарбонил" означает аралкил-OСО-группу. Примером аралкоксикарбонильной группы является бензилоксикарбонил."Y1Y2NCO-" означает замещенную или незамещенную карбамоильную группу, в которойY1 и Y2 являются такими, какие описаны ранее. Примерами таких групп являются карбамоил"Y1Y2NSO2-" означает замещенную или незамещенную сульфамоильную группу, в которой Y1 и Y2 являются такими, какие описаны ранее. Примерами таких групп являются аминосульфамоил (H2NSO2-) и диметиламиносульфамоил (Me2NSO2-)."Ациламино" представляет ацил-NHrpyппy, в которой ацил имеет установленные здесь значения."Ароиламино" представляет ароил-NHrpyппy, в которой ароил имеет установленные здесь значения."Алкилсульфонил" означает алкил-SO2 группу. Предпочтительными группами являются группы, в которых алкильная группа представляет низший алкил."Алкилсульфинил" означает алкил-SOгруппу. Предпочтительными группами являются группы, в которых алкильная группа представляет низший алкил."Галоген" означает фтор(о), хлор(о),бром(о) или иодо (о). Предпочтительными являются фтор(о), хлор(о) или бром(о), и более предпочтительны фтор(о) или хлор(о). Предпочтительные варианты воплощения изобретения Предпочтительным вариантом воплощения данного изобретения является способ лечения пациента, страдающего от физиологического нарушения, которое можно модулировать посредством ингибирования активности фактора Ха путем введения терапевтически эффективного количества соединения формулы I. Другим предпочтительным аспектом соединения изобретения является соединение формулы I, в котором n равен 1 и m равен 1. Еще одним предпочтительным вариантом соединения изобретения является соединение формулы I, в котором Х 2 и X2a, взятые вместе,представляет оксо. Еще одним предпочтительным вариантом соединения изобретения является соединение формулы I, в котором X1, X1a, X4 представляют водород, а Х 3 представляет водород или алкил. Еще одним предпочтительным вариантом соединения изобретения является соединение формулы I, в котором X5 и Х 5 а, взятые вместе,представляют =NR5, где R5 представляет R6O2C. Еще одним предпочтительным вариантом соединения изобретения является соединение формулы I, в котором Х 5 и X5a, взятые вместе,представляет =NR5, где R5 представляет -ОН. Еще одним предпочтительным вариантом соединения изобретения является соединение формулы I, в котором Х 5 и Х 5 а, взятые вместе,представляют =NR5, где R5 представляет Н. Еще одним предпочтительным вариантом соединения изобретения является соединение формулы I, в котором представляет фенил, а углерод, замещенный X5,X5a и R4HN-, присоединяется в метаположении относительно присоединения группы -(CH)nN- к фенилу. 10 Еще одним предпочтительным вариантом соединения изобретения является соединение формулы I, в котором представляет тиенил, а углерод, замещенный X5,X5a и R4HN-, присоединяется в положении 2 относительно атома серы тиенила, и присоединение группы -(CH)nN- происходит в положении 4 тиенила. Еще одним предпочтительным вариантом соединения изобретения является соединение формулы I, в котором R представляет водород,метил, аралкил, гетероаралкил, НО 2 ССН 2-,H2NC(O)СН 2- или R6HNC(O)CH2-. Еще одним предпочтительным вариантом соединения изобретения является соединение формулы I, в котором R1 представляет водород,алкил или галоген. Еще одним предпочтительным вариантом соединения изобретения является соединение формулы I, в котором R2 и R3 независимо представляют водород, галоген, алкилокси, амино,арил или гетероарил. Еще одним предпочтительным вариантом соединения изобретения является соединение формулы I, в котором R2 и R3 образуют необязательно замещенное конденсированное арильное или необязательно замещенное конденсированное гетероарильное ядро, при этом заместитель представляет галоген, алкил, амино, гидрокси или алкокси. Еще одним предпочтительным вариантом соединения изобретения является соединение формулы I, в котором R2 и R3 образуют необязательно замещенный конденсированный циклоалкил или необязательно замещенный конденсированный гетероциклил, в котором гетероатомом является атом азота, при этом заместитель представляет водород, Y1Y2N или алкил. Еще одним предпочтительным вариантом соединения изобретения является соединение по п.1, в котором представляет фенил, а один из X6 и Х 6 а является амино или гидрокси в параположении относительно группы Еще одним предпочтительным вариантом соединения изобретения является соединение по п.1, в котором X6 и X6a представляют водород. Еще одним предпочтительным вариантом соединения изобретения является соединение по п.1, в котором А представляет -СН=СН-; и R2 иR3, взятые вместе с атомами углерода, через которые R2 и R3 соединяются, образуют необязательно замещенное 5- или 6-членное гетероарильное кольцо, предпочтительно содержащее,по меньшей мере, один гетероатом, являющийсяN, или необязательно замещенное 6-членное арильное кольцо, и при этом указанные заместители являются, предпочтительно, хлоро, гидрокси или амино. Еще одним предпочтительным вариантом соединения изобретения является соединение по п.1, в котором А представляет -СН=СН-; R2 представляет водород; и R3 представляет необязательно замещенное гетероарильное кольцо,предпочтительно 5- или 6-членное гетероарильное кольцо, предпочтительно содержащее, по меньшей мере, один гетероатом, являющийся N или S, или необязательно замещенное 6-членное арильное кольцо, и при этом указанные заместители являются, предпочтительно, хлоро, гидрокси или амино. Еще одним предпочтительным вариантом соединения изобретения является соединение по п.1, в котором А представляет S (атом серы). Еще одним предпочтительным вариантом соединения изобретения является соединение по п.1, в котором А представляет S (серу); a R2 иR3, взятые вместе с атомами углерода, через которые R2 и R3 соединяются, образуют необязательно замещенное 5- или 6-членное гетероарильное кольцо, предпочтительно содержащее,по меньшей мере, один гетероатом, являющийсяN, или необязательно замещенное 6-членное арильное кольцо, и при этом указанные заместители являются предпочтительно хлоро, гидрокси или амино. Еще одним предпочтительным вариантом соединения изобретения является соединение по п.1, в котором А представляет S (серу); R2 представляет водород; и R3 представляет необязательно замещенное гетероарильное кольцо,предпочтительно 5- или 6-членное гетероарильное кольцо, предпочтительно содержащее, по меньшей мере, один гетероатом, являющийся N или S, или необязательно замещенное 6-членное арильное кольцо, и при этом указанные заместители являются предпочтительно хлоро, гидрокси или амино. Тип соединения по изобретению выбирают из группы, в которую входят трифторацетат 3-[3-(S)-(бензо[b]тиофен-2 сульфониламино)-2-оксопирролидин-1 илметил]бензамидина; трифторацетат 3-[3-(S)-(бензо[b]тиофен-2 сульфонил)метиламино]-2-оксопирролидин-1 илметил]бензамидина; трифторацетат 4-[3-(S)-(бензо[b]тиофен-2 сульфониламино)-2-оксопирролидин-1 илметил]тиофен-2-карбоксамидина; трифторацетат 4-[3-(S)-[(бензо[b]тиофен-2 сульфонил)метиламино]-2-оксопирролидин-1 илметил]тиофен-2-карбоксамидина; трифторацетат 3-[3-(S)-(4-хлорбензо[b] тиофен-2-сульфониламино)-2-оксопирролидин 1-илметил]бензамидина; 16 гидрохлорид 4-[3-(S)-(6-фторбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1 илметил]пиридин-2-карбоксамидина; Более предпочтительные соединения по изобретению выбирают из группы, в которую входят трифторацетат 3-[3-(S)-[(бензо[b]тиофен-2 сульфонил)метиламино]-2-оксопирролидин-1 илметил]бензамидина; трифторацетат 4-[3-(S)-(бензо[b]тиофен-2 сульфонилами-но)-2-оксопирролидин-1-илметил]тиофен-2-карбоксамидина; трифторацетат 3-[3-(S)-(6-хлорбензо[b] тиофен-2-сульфониламино)-2-оксопирролидин 1-илметил]бензамидина; трифторацетат 3-3-(S)-[(6-хлорбензо[b] тиофен-2-сульфонил)метиламино]-2-оксопирролидин-1-илметилбензамидина; трифторацетат 3-[3-(S)-(4,6-дихлорбензо[b] тиофен-2-сульфониламино)-2-оксопирролидин 1-илметил]бензамидина; 2,2,2-трихлорэтиловый эфир ([3-[3-(S)(4,6-дихлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]фенил]иминометил)карбаминовой кислоты; трифторацетат 3-[3-(S)-(6-фторбензо[b] тиофен-2-сульфониламино)-2-оксопирролидин 1-илметил]бензамидина; трифторацетат 4-амино-3-[3-(S)-(6-фторбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина; трифторацетат 4-гидрокси-3-[3-(3)-(6 фторбензо[b]тиофен-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина; трифторацетат 4-гидрокси-3-[3-(S)-(4 хлортиено-[3,2-с]пиридин-2-сульфониламино)2-оксопирролидин-1-илметил]бензамедина; бистрифторацетат 3-[3-(S)-(тиено[3,2-b] пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина; бистрифторацетат 3-[3-(S)-(тиено[2,3-b] пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина; бистрифторацетат 4-амино-3-[2-оксо-3-(S)(тиено[3,2-b]пиридин-2-сульфониламино)пирролидин-1-илметил]бензамидина; трифторацетат 3-3-(S)-[5-(2-метилсульфанилпиримидин-4-ил)тиофен-2-сульфониламино]-2-оксопирролидин-1-илметилбензамидина; трифторацетат 4-амино-3-[6-хлорбензо[b][2,2']битиофенил-5-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина; Данное изобретение также охватывает все комбинации предпочтительных аспектов изобретения, отмеченных здесь. Соединения формулы I можно получить посредством применения или адаптации известных способов, под которыми подразумеваются способы, использованные ранее или описанные в литературе. Соединения формулы I можно получить путем обработки соединения формулы II 18 лы I, в котором R4=H, a X5 и X5a, взятые вместе,представляют =NR5, где R5 является Н (амидин). В случае таких соединений, в которых R5=OH,имидат обрабатывают гидроксиламином в спиртовом растворителе. В случае соединений, в которых R5=С(O)ОR6, амидин растворяют в ДМФА/СН 2 Сl2, а затем обрабатывают основанием - третичным амином, таким как триэтиламин, диизопропилэтиламин или N-метилпиперидин, и алкилкарбонатом или алкилхлорформиатом при температуре примерно от -20 С до примерно 100 С. Соединения формулы II, в которых R не равен Н, можно получить путем обработки соединений формулы III в инертном органическом растворителе, таком как ТГФ, ДМФА или Et2O, сильным основанием, таким как гидрид натрия или карбонат калия, с последующим добавлением необязательно замещенного алкилгалогенида, необязательно замещенного аралкилгалогенида или необязательно замещенного гетероаралкилгалогенида при температурах примерно от -78 С до примерно 100 С. Соединения формулы III можно получить из аминов формулы IV либо путем растворения гидрохлорида амина в органическом растворителе, таком как СН 2 Сl2,ТГФ или ДМФА, содержащем подходящее основание, такое как триэтиламин или карбонат калия, либо путем растворения гидрохлорида амина в органическом основании, таком как пиридин, с последующим добавлением сульфонилхлорида, представленного формулой V Сульфонилхлорид, представленный формулой V, можно получить путем обработки соединений, изображенных формулой VI в спиртовом растворителе, таком как этанол,вместе с сорастворителем или без него, например CH2Cl2, газообразным галогенводородом,например НСl при температуре примерно от-40 С до примерно 100 С. Полученный в результате имидат затем обрабатывают в спиртовом растворителе (таком как МеОН) газообразным аммиаком, и получают соединение форму сильным основанием, таким как н-BuLi, при-78 С с последующим добавлением газообразного SО 2 и обработкой гетероарилсульфоната лития хлорирующим агентом, таким как NCS или SO2Cl2. Соединения формулы IV, в которых можно получить путем обработки соединений формулы VII в которых Р является обычной защитной группой, такой как бензил, трет-бутил, аллил, силилэтил или трихлорэтил, метилгалогенидом,представленным соединениями формулы VIII в инертном органическом растворителе, таком как ТГФ, Et2O или ДМФА, в присутствии сильного основания, такого как NaH, гексаметилдисилилазид лития или диизопропиламины лития. Затем карбонатную защитную группу удаляют одним из таких подходящих методов отщепления защитной группы, как кислотный или щелочной гидролиз, отщепление защитной группы с помощью палладия, отщепление защитной группы, промотированное цинком, или отщепление защитной группы с помощью фтор-аниона. Соединения формулы VIII можно получить путем обработки соединений формулы IX хлорирующим или бромирующим агентом, таким как NCS или NBS. Когда X6=NH2, a X6a является Н, соответствующее нитросоединение восстанавливают с использованием SnСl2 и защищают до двузамещенного алкила или арила или аралкилимина. Получающееся в результате содержащее защитные группы соединение бромируют с помощью NBS, и получают соединение, изображенное формулой VIII. КогдаX6=OH, a X6a является Н, гидроксильную группу защищают силильной, MOM- или МЕМгруппой. Получающееся в результате соединение затем бромируют с использоанием NBS. Соединения формулы IV, в которых можно получить путем взаимодействия бромили иодсодержащего тиофенкарбоксальдегида с восстановителем, таким как боргидрид натрия или боргидрид лития. Получающийся в резуль 001739 20 тате бром- или иодсодержащий тиофенметанол затем превращают в нитрил путем реакции сочетания с помощью палладия с источником цианид-иона, таким как Zn(CN)2. Полученный в результате цианотиофенметанол затем преобразуют в соответствующий метилхлорид или метилбромид с использованием РРh3 с ССl4 или СВr4. Соединения формулы IV, в которых Х 3=Н,можно получить из коммерческих источников,или по литературным данным, или путем обработки защищенной необязательно замещенной диаминоалкилкарбоновой кислоты, в которой защищенной группой является аминогруппа,присоединенная к углероду, несущему карбоксильную группу, сшивающими пептиды реагентами, такими как EDC (гидрохлорид (1,3 диметиламинопропил)-3-этилкарбодиимида),DCC (1,3-дициклогексилкарбодиимид) или ВОP(диметиламино)фосфония в инертном растворителе, таком как CH2Cl2, ТГФ или ДМФA. Соединения, в которых Х 3=алкил, можно получить с использованием способов, подобных способам, описанным в работе J.E. Baldwin et al., Tetrahedron 46 (13), р.4733, 1990. Соединение формулы I с гетероарильной группой, содержащей один или несколько атомов азота в кольце, предпочтительно имин (=N-),можно преобразовать в соответствующее производное, в котором один или несколько кольцевых атомов азота гетероарильной группы окислены до N-оксида предпочтительно путем взаимодействия с перкислотой, например перуксусной кислотой, в уксусной кислоте, или мхлорпероксибензойной кислотой в инертном растворителе, таком как дихлорметан, при температуре примерно от комнатной до температуры образования флегмы, предпочтительно - при повышенной температуре. Соединения по настоящему изобретению могут использоваться в виде свободных основания или кислоты или в виде их фармацевтически приемлемых солей. Все эти виды входят в объем данного изобретения. Когда соединение по настоящему изобретению замещено группой основного характера,получают соли присоединения кислот, которые являются просто более удобными для применения; и на практике применение соли, по существу, равнозначно применению свободного основания. Кислоты, которые можно использовать для получения солей присоединения кислот,включают предпочтительно кислоты, которые при соединении со свободным основанием образуют фармацевтически приемлемые соли, т.е. соли, анионы которых нетоксичны для пациента в фармацевтических дозах солей, так что благоприятное ингибирующее действие на активность фактора Ха, присущее свободному основанию, не ослабляется побочным действием,которое можно приписать анионам. Хотя фар 21 мацевтически приемлемые соли указанных соединений основного характера предпочтительны, все соли присоединения кислот могут использоваться в качестве источника свободного основания, даже если конкретная соль сама по себе нужна только в качестве промежуточного продукта, как например, в случае, когда соль получают только в целях очистки и идентификации, или когда ее используют в качестве промежуточного соединения при получении фармацевтически приемлемой соли посредством технических приемов ионного обмена. Фармацевтически приемлемые соли в пределах объема данного изобретения являются солями, образованными из следующих кислот: неорганических кислот, таких как хлороводородная кислота,серная кислота, фосфорная кислота и сульфаминовая кислота; и органических кислот, таких как уксусная кислота, трифторуксусная кислота,лимонная кислота, молочная кислота, винная кислота, малоновая кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота,циклогексилсульфаминовая кислота, хинная кислота, и подобных кислот. Соответствующие соли присоединения кислот включают следующие соли: гидрогалогениды, например гидрохлорид и гидробромид, трифторацетат, сульфат,фосфат, нитрат, сульфамат, ацетат, цитрат, лактат, тартрат, малонат, оксалат, салицилат, пропионат, сукцинат, фумарат, малеат, метиленбис-В-гидроксинафтоаты, гентизинаты, мезилаты, изэтионаты и ди-п-толуолтартратметансульфонат, этансульфонат, бензолсульфонат, птолуолсульфонат, циклогексилсульфамат и хинат соответственно. В соответствии с другим признаком изобретения, соли присоединения кислот соединений по данному изобретению получают путем взаимодействия свободного основания с соответствующей кислотой при применении или адаптации известных способов. Например, соли присоединения кислот соединений по данному изобретению получают либо путем растворения свободного основания в водном или водноспиртовом растворе или в других подходящих растворителях, содержащих соответствующую кислоту, и выделения соли посредством выпаривания раствора, либо путем взаимодействия свободного основания и кислоты в органическом растворителе, в котором соль непосредственно отделяется или может быть получена путем концентрирования раствора. Соединения по данному изобретению можно регенерировать из солей присоединения кислот, применяя или приспосабливая известные способы. Например, исходные соединения по изобретению можно снова получить из их солей присоединения кислот путем обработки щелочью, например водным раствором бикарбоната натрия или водным раствором аммиака. 22 Когда соединение по изобретению замещено кислотной группой, могут быть образованы соли присоединения оснований, которые просто более удобны для применения; и на практике применение соли, по существу, равнозначно применению свободной кислоты. Основания, которые можно использовать для получения солей присоединения оснований, включают, предпочтительно, основания, которые при соединении со свободной кислотой образуют фармацевтически приемлемые соли, т.е. соли,катионы которых нетоксичны для организма животного при фармацевтических дозах солей,так что благоприятное ингибирующее действие на активность фактора Ха, присущее свободной кислоте, не ослабляется побочным действием,которое можно приписать катионам. Фармацевтически приемлемые соли, включающие, например, соли щелочных и щелочноземельных металлов, в пределах данного изобретения являются солями, образованными из следующих оснований: гидрида натрия, гидроксида натрия,гидроксида калия, гидроксида кальция, гидроксида алюминия, гидроксида лития, гидроксида магния, гидроксида цинка, аммиака, этилендиамина, N-метилглюкамина, лизина, аргинина,орнитина, холина, N,N'-дибензилэтилендиамина, хлорпрокаина, диэтаноламина, прокаина,диэтиламина, N-бензилфенетиламина, пиперазина, трис(гидроксиметил)аминометана, гидроксида тетраметиламмония и подобных оснований. Соли металлов соединений по настоящему изобретению можно получить путем приведения в контакт гидрида, гидроксида, карбоната или подобного реакционноспособного соединения выбранного металла в водном или органическом растворителе с соединением в форме свободной кислоты. Используемый водный растворитель может представлять воду или может представлять смесь воды с органическим растворителем, предпочтительно спиртом, таким как метанол или этанол, кетоном, таким как ацетон, простым алифатическим эфиром, таким как тетрагидрофуран, или со сложным эфиром,таким как этилацетат. Такие взаимодействия обычно проводят при температуре окружающей среды, но при желании их можно осуществлять при нагревании. Аминосоли соединений по настоящему изобретению можно получить путем приведения в контакт амина в водном или органическом растворителе с соединением в виде свободной кислоты. Подходящими водными растворителями являются вода и смеси воды со спиртами,такими как метанол или этанол, простыми эфирами, такими как тетрагидрофуран, нитрилами,такими как ацетонитрил, или кетонами, такими как ацетон. Подобным образом можно получить соли аминокислот. Соли присоединения оснований соединений по данному изобретению можно регенери 23 ровать из солей при применении или приспособлении известных способов. Например, исходные соединения по изобретению можно снова получить из их солей присоединения оснований посредством обработки кислотой, например хлороводородной кислотой. Соли по изобретению также включают соединения с кватернизованным азотом. Кватернизованные соли получают такими способами,как алкилирование sp3- или sр 2-гибридизованного азота в соединениях. Как совершенно ясно для специалистов в этой области техники, некоторые из соединений данного изобретения не образуют устойчивых солей. Однако наиболее вероятно, что соли присоединения кислот образуются соединениями по изобретению с азотсодержащей гетероарильной группой, и/или при этом соединения содержат аминогруппу в качестве заместителя. Предпочтительными солями присоединения кислот соединений по данному изобретению являются соли, в которых нет кислотной лабильной группы. Будучи полезными сами по себе в качестве активных соединений, соли соединений по изобретению также могут использоваться для целей очистки соединений, например, посредством использования различий в растворимости между солями и исходными соединениями, побочными продуктами и/или исходными веществами, с помощью технических приемов, хорошо известных специалистам в этой области техники. Соединения по настоящему изобретению могут содержать асимметричные центры. Такие асимметричные центры могут быть независимо или в R-, или в S-конфигурации. Для специалистов в этой области техники также очевидно,что некоторые соединения формулы I могут демонстрировать геометрическую изомерию. Геометрические изомеры включают цис- и транс-формы соединений по изобретению с алкенильными или диазенильными (азо) группами. Настоящее изобретение включает отдельные геометрические изомеры и стереоизомеры и их смеси. Соединения по настоящему изобретению также могут иметь таутомерные структуры, например Настоящее изобретение включает различные таутомерные структуры и их смеси. Такие изомеры можно выделить из смесей приприменении или приспособлении известных способов, например, хроматографическими методами и техническими приемами перекристаллизации, или их можно получить раздельно из соответствующих изомеров промежуточных соединений, например, применяя или приспосабливая методы, описанные здесь. 24 Исходные вещества и промежуточные соединения получают при применении или адаптации известных способов, например, описанных в ссылочных примерах, или их очевидных химических эквивалентов. Далее приводятся примеры, но настоящее изобретение не ограничивается приведенными ниже примерами, которые поясняют получение соединений по изобретению. В спектрах ядерного магнитного резонанса(ЯМР) химические сдвиги выражены в м.д. относительно тетраметилсилана. Сокращения имеют следующие значения: с=синглет; д=дублет; т=триплет; м=мультиплет; дд=дублет дублетов; ддд=дублет дублета дублетов; дт=двойной триплет; уш.=уширенный; уш.с=уширенный синглет; кв=квартет; АВ=система полос АВ. Пример 1. Трифторацетат 3-[3-(S)-(бензо(S)-Бок-диаминомасляную кислоту (25 г,115 ммоль), триэтиламин (35 г, 344 ммоль) и гидрат 1-гидроксибензотриазола (19,3 г, 143 ммоль) растворяют в 300 мл ТГФ. К раствору добавляют гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (27,4 г, 143 ммоль). Раствор греют при 60 С в течение 15 мин. Образуется белый осадок, и раствор выдерживают при 60 С в течение 4 ч. После этого раствор фильтруют, и собранную жидкость концентрируют. Сырой продукт очищают колоночной хроматографией с элюированием с градиентом от 1% MeOH/CH2Cl2 до 3% MeOH/CH2Cl2, и получают указанное в заголовке соединение(19,6 г, 98 ммоль) в виде белого твердого вещества. 1(9,0 г, 45 ммоль) и -бром-м-толуилнитрила (9,3 г, 47 ммоль) в 225 мл смеси ТГФ и ДМФА (10:1) при 0 С добавляют 60% дисперсию гидрида натрия в минеральном масле (1,8 г, 46 ммоль). Реакционную смесь перемешивают при 0 С в течение 0,5 ч и затем нагревают до температуры окружающей среды. Через 3 ч реакционную смесь гасят путем добавления насыщенного раствора NH4Cl. Полученный в результате раствор разбавляют EtOAc. Слои разделяют и органический слой промывают 1 н. НСl, H2O и насыщенным раствором NaCl. Органический слой сушат над МgSO4 фильтруют и концентрируют. Сырой продукт очищают колоночной хромато 25 графией с элюированием с градиентом от 20%EtOAc в гексане до 40% EtOAc в гексане и получают указанное в заголовке соединение (12,7 г, 40 ммоль) в виде белого твердого вещества. 1EtOAc при 0 С барботируют газообразный НСl в течение 10 мин. После этого раствор перемешивают в течение 4 ч. Затем раствор концентрируют и получают указанное в заголовке соединение (7,3 г, 29 ммоль) в виде белого твердого вещества. 1D. Бензо[b]тиофен-2-сульфонилхлорид. К раствору тианафталина (11,8 г, 88,1 ммоль) в 400 мл ТГФ при -78 С добавляют нBuLi (55 мл, 1,6 М раствора в гексане, 88,1 ммоль). Через 15 мин этот раствор через канюлю добавляют к предварительно охлажденному(-78 С) раствору SO2 (200 г) в 100 мл ТГФ. По окончании добавления раствор нагревают до температуры окружающей среды. Через 0,5 ч раствор концентрируют. Остаток суспендируют в гексане (400 мл) и охлаждают до 0 С. К этому раствору добавляют SO2Cl2 (12,5 г, 92,5 ммоль). После перемешивания в течение 15 мин раствор концентрируют и остаток растворяют в EtOAc. Органический раствор промывают насыщенным раствором (водн.) NH4Cl, H2O и насыщенным раствором (водн.) NaCl. Органический слой сушат над MgSO4, фильтруют и концентрируют. Сырой продукт растворяют в CH2Cl2 и раствор фильтруют через слой силикагеля. Затем органический раствор концентрируют. Полученное в результате твердое вещество растирают в порошок в гексане и получают указанное в заголовке соединение (12,1 г, 38 ммоль) в виде белого твердого вещества. 1H ЯМР (СDСl3, 300 МГц)8,16 (с, 1 Н),7,97 (м, 2 Н), 7,57 (м, 2 Н). Е. [1-(3-цианобензил)-2-оксопирролидин 3-(S)-ил]амид бензо[b]тиофен-2-сульфоновой кислоты. К раствору гидрохлорида 3-(3-(S)-амино-2 оксопирролидин-1-илметил)бензонитрила (0,36 г, 1,43 ммоль) в 15 мл CH2Cl2 добавляют бензо[b]тиофен-2-сульфонилхлорид (0,32 г, 1,38 ммоль). К получающемуся в результате раствору добавляют триэтиламин (0,29 г, 2,88 ммоль). Через 16 ч раствор разбавляют EtOAc. Раствор промывают 1 н. раствором NaCl, насыщенным раствором NаНСО 3 и насыщенным растворомNaCl. Органический слой сушат над MgSO4,фильтруют и концентрируют. Получают указанное в заголовке соединение (0,45 г, 1,09 ммоль) в виде белого твердого вещества. 1[1-(3-цианобензил)-2-оксопирролидин-3-ил]амид бензо[b]тиофен-2-сульфоновой кислоты (0,20 г, 0,49 ммоль) в 20 мл смеси EtOH с CH2Cl2 (1:1) при 0 С барботируют газообразный НСl в течение 5 мин, и затем раствор нагревают до температуры окружающей среды. Через 16 ч раствор концентрируют. Остаток растворяют в 20 мл МеОН, и через раствор в течение 5 мин барботируют газообразныйNН 3. После этого раствор нагревают при 60 С и через 2 ч раствор концентрируют. Остаток очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О(0,1% ТФУ) до 80% СН 3 СN/Н 2 О (0,1% ТФУ). Соответствующие фракции лиофилизуют и получают указанное в заголовке соединение в виде твердого вещества. 1(м, 1 Н). М.-с. (бомбардировка быстрыми атомами,FAB): [М+Н]+=479. Элементный анализ при расчете с 1,5 моль ТФУ: вычислено: С=46,07%, Н=3,62%, N=9,35%; найдено: С=46,35%, Н=3,83%, N=9,46%. Пример 2. Трифторацетат 3-[3-(S)-[(бензо[b]тиофен-2-сульфонил)метиламино]-2 оксопирролидин-1-илметил]бензамидина. А. [1-(3-Цианобензил)-2-оксопирролидин 3-(S)-ил]метиламид бензо[b]тиофен-2-сульфоновой кислоты. К раствору [1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил]амида бензо[b]тиофен-2 сульфоновой кислоты (0,25 г, 0,61 ммоль) в 3 мл ДМФА добавляют метилиодид (0,13 г, 0,91 ммоль), а затем К 2 СО 3 (0,13 г, 0,91 ммоль). Раствор перемешивают при температуре окружающей среды в течение 6 ч. Затем раствор разбавляют H2O и EtOAc и слои разделяют. Органический слой промывают Н 2 О и насыщенным раствором NaCl. Органический слой сушат надMgSO4, фильтруют и концентрируют. Остаток обрабатывают Et2O и получают указанное в заголовке соединение (0,25 г, 0,59 ммоль) в виде белого твердого вещества. 1H ЯМР (СDСl3, 300 МГц)7,99 (с, 1 Н),7,82 (м, 2 Н), 7,54 (м, 1 Н), 7,38 (м, 5 Н), 4,89 (м, 27 1 Н), 4,40 (АВ, 2 Н), 3,18 (м, 2 Н), 2,89 (с, 3 Н),2,32 (м, 1 Н), 1,98 (м, 1 Н). В. Трифторацетат 3-[3-[(S)-[(бензо[b]тиофен-2-сульфонил)метиламино]-2-оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть Е, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил] метиламида бензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 80% СН 3 СN/ Н 2 О (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают названное в заголовке соединение в виде белого твердого вещества. 1(м, 1 Н). М.-с. (FAB): [M+H]+=443. Элементный анализ при расчете с 1,5 моль[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]тиофен-2-карбоксамидина. А. 5-иодотиофен-3-карбоксальдегид. К раствору тиофен-3-карбоксальдегида (36 г, 321 ммоль) в 80 мл ССl4 и 60 мл H2O добавляют 2,5 мл конц. H2SO4 в 160 мл уксусной кислоты. К получающемуся в результате раствору добавляют НIO3 (14 г, 80 ммоль) и I2 (38 г, 150 ммоль). Раствор кипятят с обратным холодильником в течение 6 ч. После этого реакционную смесь охлаждают до температуры окружающей среды, и добавляют 200 мл СНСl3. Слои разделяют и водный слой экстрагируют СНСl3. Органические слои объединяют и промывают 0,5 М раствором Nа 2S2 О 3, насыщенным растворомNaHCO3 и насыщенным раствором NaCl. Органический слой сушат над МgSO4, фильтруют и концентрируют. Сырой продукт очищают колоночной хроматографией с элюированием с градиентом от 2% EtOAc в гексане до 5% EtOAc в гексане и получают указанное в заголовке соединение (20 г, 84 ммоль) в виде белого твердого вещества. 1NaBH4 (7,0 г, 185 ммоль). Через 1 ч реакцию гасят путем добавления 100 мл насыщ. раствораNH4Cl. Полученный в результате раствор разбавляют 1 л EtOAc и разделяют слои. Органический слой промывают H2O и насыщенным рас 001739 28 твором NaCl. Органический слой сушат над МgSO4, фильтруют и концентрируют. Получают указанное в заголовке соединение (42 г, 175 ммоль) в виде масла. 1(42 г, 176 ммоль) в 150 мл ТГФ добавляют цианид цинка (12,4 г, 106 ммоль) и тетракис(трифенилфосфин)палладий (0) (8,13 г, 7,04 ммоль). Раствор нагревают до 80 С. Через 6 ч раствор разбавляют 3 л EtOAc и получающийся в результате раствор промывают 1 н. растворомNH4OH, Н 2 О и насыщ. раствором NaCl. Органический слой сушат над MgSO4, фильтруют и концентрируют. Сырой продукт очищают колоночной хроматографией с элюированием с градиентом от 20% EtOAc в гексане до 30% EtOAc в гексане и получают указанное в заголовке соединение (10 г, 72 ммоль) в виде прозрачного масла. 1D. 4-Бромметилтиофен-2-карбонитрил. К раствору 4-гидроксиметилтиофен-2 карбонитрила (10 г, 72 ммоль) в 360 мл ТГФ добавляют трифенилфосфин (18,3 г, 76 ммоль) и четырехбромистый углерод (25 г, 76 ммоль). Через 3 ч раствор фильтруют и концентрируют. Сырой продукт очищают колоночной хроматографией с элюированием с градиентом от 5%EtOAc в гексане до 10% EtOAc в гексане и получают указанное в заголовке соединение (14 г,69 ммоль) в виде белого твердого вещества. 1H ЯМР (СDСl3, 300 МГц)7,62 (с, 1 Н),7,49 (с, 1 Н), 4,42 (с, 2 Н). Е. трет-Бутиловый эфир [1-(5-цианотиофен-3-илметил)-2-оксопирролидин-3-(S)-ил] карбаминовой кислоты. К раствору трет-бутилового эфира (2 оксопирролидин-3-(S)-ил)карбаминовой кислоты (3,2 г, 16 ммоль), полученного так, как описано в примере 1, часть А, в 80 мл смеси ТГФ с ДМФА (10:1) при 0 С добавляют 4 бромметилтиофен-2-карбонитрил (3,23 г, 16 ммоль) и борогидрид натрия (60% дисперсия в масле, 0,67 г, 16,8 ммоль). По окончании добавления раствор нагревают до температуры окружающей среды. Через 2 ч реакцию в растворе гасят путем добавления насыщ.раствора NH4Cl. Раствор разбавляют Н 2 О и EtOAc и разделяют слои. Органический слой промывают H2O и насыщ. раствором NaCl. Органический слой сушат над MgSO4, фильтруют и концентрируют. Сырой продукт очищают колоночной хроматографией с элюированием с градиентом от 20%EtOAc в CH2Cl2 до 30% EtOAc в CH2Cl2 и получают указанное в заголовке соединение (4,0 г,13,8 ммоль) в виде белого твердого вещества.(4,0 г, 13,8 ммоль). Через 3 ч раствор концентрируют. Получают указанное в заголовке соединение (3,3 г, 13,5 ммоль) в виде белого твердого вещества. 1G. [1-(5-Цианотиофен-3-илметил)-2-оксопирролидин-3-(S)-ил]амид бензо[b]тиофен-2 сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 1, часть Е, заменяя гидрохлорид 3-(3-(S)-амино-2-оксопирролидин-1-илметил)бензонитрила на гидрохлорид 4-(3-(S)-амино-2-оксопирролидин-1 илметил)тиофен-2-карбонитрила. Сырой продукт реакции обрабатывают Et2O и получают продукт в виде белого твердого вещества. 1(АВ, 2 Н), 3,89 (м, 1 Н), 3,27 (м, 2 Н), 2,66 (м, 1 Н),2,13 (м, 1 Н). Н. Трифторацетат 4-[3-(S)-(бензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1 илметил]тиофен-2-карбоксамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(5-цианотиофен-3-илметил)-2-оксопирролидин-3-(S)-ил]амида бензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% CH3CN/H2O (0,1% ТФУ) до 80% СН 3 СN/Н 2 О (0,1% ТФУ). Соответствующие фракции лиофилизуют и получают указанное в заголовке соединение в виде белого твердого вещества. 1 30 Указанное в заголовке соединение получают так, как описано в примере 2, часть А, заменяя[1-(3-цианобензил-3-илметил)-2-оксопирролидин-3-(S)-ил]амид бензо[b]тиофен-2 сульфоновой кислоты на [1-(5-цианотиофен-3 илметил)-2-оксопирролидин-3-(S)-ил]амид бензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт реакции обрабатывают Et2O, и получают продукт в виде белого твердого вещества. 1(м, 1 Н), 2,03 (м, 1 Н). В. Трифторацетат 4-[3-(S)-[(бензо[b]тиофен-2-сульфонил)метиламино]-2-оксопирролидин-1-илметил]тиофен-2-карбоксамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(5-цианотиофен-3-илметил)-2-оксопирролидин-3-(S)-ил]метиламида бензо[b]тиофен-2 сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% CH3CN/H2O (0,1% ТФУ) до 70% СН 3 СN/Н 2 О (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1M.-c. (FAB): [M+H]+=449. Элементный анализ при расчете с 1,5 моль Н 2 О: вычислено: С=42,78%, Н=4,10%, N=9,50%; найдено: С=42,83%, Н=3,71%, N=9,27%. Пример 5. Трифторацетат 3-[3-(S)-(4-хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина. А. 1-Хлор-3-(2,2-диметоксиэтилсульфанил)бензол. К раствору 3-хлортиофенола (2,4 г, 16,6 ммоль) в ТГФ (200 мл) при 0 С добавляют бромацетальдегиддиметилацеталь (2,8 г, 16,6 ммоль). Добавляют к раствору борогидрид натрия (60% дисперсия в минеральном масле, 0,70 г, 17,4 ммоль), и реакционную смесь перемешивают в течение 16 ч, и затем гасят посредством добавления насыщенного раствора (водн.)NH4Cl. Раствор разбавляют EtOAc, и органический слой промывают насыщенным раствором(водн.) NaCl. Органический слой сушат надMgSO4, фильтруют и концентрируют. Сырой продукт очищают колоночной хроматографией с элюированием гексаном. Получают указанное в заголовке соединение (3,7 г, 15,9 ммоль) в виде масла.[b]тиофен. Раствор, содержащий полифосфорную кислоту (8 г) и хлорбензол (50 мл) кипятят с обратным холодильником. К кипящему раствору полифосфорной кислоты добавляют по каплям раствор, содержащий 1-хлор-3-(2,2-диметоксиэтилсульфанил)бензол (2,7 г, 11,6 ммоль) в хлорбензоле (5 мл). Через 6 ч раствор охлаждают до температуры окружающей среды. Раствор разбавляют CH2Cl2 и промывают водой и насыщенным раствором (водн.) NaCl. Органический слой сушат над MgSO4, фильтруют и концентрируют. Сырой продукт очищают колоночной хроматографией с элюированием гексаном, и получают названные в заголовке соединения(2,4 г, 9,0 ммоль) в виде смеси изомеров (1:1). 1[М]+=168, 170, Cl. С. 4-Хлорбензо[b]тиофен-2-сульфонилхлорид и 6-хлорбензо[b]тиофен-2-сульфонилхлорид. Указанное в заголовке соединение получают так, как описано в примере 1, часть D, заменяя тианафталин на смесь 4-хлорбензо[b]тиофена и 6-хлорбензо[b]тиофена. Сырой продукт реакции очищают колоночной хроматографией с элюированием гексаном, и получают названные в заголовке соединения в виде белых твердых веществ. 4-Хлорбензо[b]тиофен-2-сульфонилхлорид. 1D. [1-(3-Цианобензил)-2-оксопирролидин 3-(S)-ил]амид 4-хлорбензо[b]тиофен-2-сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 1, часть Е, заменяя бензо[b]тиофен-2-сульфонилхлорид на 4 хлорбензо[b]тиофен-2-сульфонилхлорид. Сырой продукт реакции обрабатывают Et2O, и получают продукт в виде белого твердого вещества. 1(уш.с, 1 Н), 4,48 (АВ, 2 Н), 3,96 (м, 1 Н), 3,24 (м,2 Н), 2,66 (м, 1 Н), 2,18 (м, 1 Н). Е. Трифторацетат 3-[3-(S)-(4-хлорбензо[b] тиофен-2-сульфониламино)-2-оксопирролидин 1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества 32 амида 4-хлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 70%CH3CN/H2O (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают названное в заголовке соединение в виде белого твердого вещества. 1(м, 1 Н). М.-с. (FAB): [М+Н]+=463, 465, система линий Сl. Элементный анализ при расчете с 1,5 мольH2O: вычислено: С=43,75%, Н=3,84%, N=9,28%; найдено: С=43,85%, Н=3,50%, N=9,03%. Пример 6. Трифторацетат 3-[3-(S)-(6 хлорбензо[b]тиофен-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина. А. [1-(3-Цианобензил)-2-оксопирролидин 3-(S)-ил]амид 6-хлорбензо[b]тиофен-2-сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 1, часть Е, заменяя бензо[b]тиофен-2-сульфонилхлорид на 6 хлорбензо[b]тиофен-2-сульфонилхлорид, полученный так, как описано в примере 5, часть С. Сырой продукт реакции обрабатывают Et2O, и получают продукт в виде белого твердого вещества. 1(уш.с, 1 Н), 4,46 (АВ, 2 Н), 3,93 (м, 1 Н), 3,22 (м,1H), 2,64 (м, 1 Н), 2,12 (м, 1 Н). В. Трифторацетат 3-[3-(6-хлорбензо[b] тиофен-2-сульфониламино)-2-оксопирролидин 1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил] амида 6-хлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% CH3CN/H2O (0,1% ТФУ) до 70%CН 3CN/H2O (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1H ЯМР (ДМСО-d6, 300 МГц)9,28 (уш.с,2 Н), 9,16 (уш.c, 2 Н), 8,68 (д, 1 Н), 8,27 (с, 1 Н),8,01 (с, 1 Н), 7,98 (д, 1 Н), 7,68 (м, 1 Н), 7,55 (м,5 Н), 4,42 (АВ, 2 Н), 4,21 (м, 1 Н), 3,10 (м, 2 Н),2,14 (м, 1 Н), 1,68 (м, 1 Н). М.-с. (FAB): [М+H]+=463, 465, система линий Сl. Элементный анализ при расчете с 1,5 моль Н 2 О: 33 вычислено: С=43,75%, Н=3,84%, N=9,28%; найдено: С=43,85%, Н=3,50%, N=9,03%. Пример 7. Трифторацетат 3-[3-(S)-[(4 хлорбензо[b]тиофен-2-сульфонил) метиламино]2-оксопирролидин-1-илметил]бензамидина А. [1-(3-Цианобензил)-2-оксопирролидин 3-(S)-ил]метиламид 4-хлорбензо[b]тиофен-2 сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 2, часть А, заменяя [1-(3-цианобензил)-2-оксопирролидин-3(S)-ил]амид бензо[b]тиофен-2-сульфонилхлорид на [1-(3-цианобензил)-2-оксопирролидин-3-(S)ил]амид 4-хлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт реакции обрабатываютEt2O, и получают продукт в виде белого твердого вещества. 1[b]тиофен-2-сульфонил)метиламино]-2-оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил] метиламида 4-хлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% CH3CN/H2O (0,1% ТФУ) до 70% СН 3 СN/Н 2 О (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества . 1(м, 1 Н). М.-с. (FAB) : [M+H]+=477, 479, система линий Сl. Элементный анализ при расчете с 1,5 моль Н 2 О: вычислено: С=44,70%, Н=4,08%, N=9,06%; найдено: С=44,67%, Н=3,66%, N=8,91%. Пример 8. Трифторацетат 3-[3-(S)-[(6 хлорбензо[b]тиофен-2-сульфонил)метиламино]2-оксопирролидин-1-илметил]бензамидина. А. [1-(3-Цианобензил)-2-оксопирролидин 3-(S)-ил]метиламид 6-хлорбензо[b]тиофен-2 сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 2, часть А, заменяя [1-(3-цианобензил)-2-оксопирролидин-3(S)-ил]амид бензо[b]тиофен-2-сульфоновой кислоты на [1-(3-цианобензил)-2-оксопирролидин 3-(S)-ил]амид 6-хлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт реакции об 001739 34 рабатывают Et2O, и получают продукт в виде белого твердого вещества. 1[b]тиофен-2-сульфонил)метиламино]-2 оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил] метиламида 6-хлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 70% СH3 СN/H2 О (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1H ЯМР (ДМСО-d6, 300 МГц)9,28 (уш.с,2 Н), 8,98 (уш.с, 2 Н), 8,29 (д, 1 Н), 8,12 (с, 1 Н),7,99 (д, 1 Н), 7,65 (м, 1 Н), 7,52 (м, 4 Н), 4,89 (т,1 Н), 4,40 (АВ, 2 Н), 3,13 (м, 2 Н), 2,74 (с, 3 Н),2,08 (м, 1 Н), 1,90 (м, 1 Н). М.-с. (FAB): [M+H]+=477, 479, система линий Сl. Элементный анализ при расчете с 2,0 моль Н 2 О: вычислено: С=44,05%, Н=4,18%, N=8,93%; найдено: С=44,13%, Н=3,55%, N=8,61%. Пример 9. Трифторацетат 3-[3-(S)-(5 хлорбензо[b]тиофен-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина. А. 1-Хлор-4-(2,2-диметоксиэтилсульфанил)бензол. Указанное в заголовке соединение получают так, как описано в примере 5, часть А, заменяя 3-хлортиофенол на 4-хлортиофенол. Сырой продукт реакции очищают колоночной хроматографией с элюированием с градиентом от 4% Et2O в гексане до 10% Et2O в гексане, и получают указанное в заголовке соединение в виде масла. 1H ЯМР (СDСl3, 300 МГц)7,28 (м, 2 Н),7,20 (м, 2 Н), 4,50 (т, 1 Н), 3,06 (с, 3 Н), 3,03 (с,3 Н). М.-с. (EI): [М]+=232, 234, система линий Сl. В. 5-Хлорбензо[b]тиофен. Указанное в заголовке соединение получают так, как описано в примере 5, часть В, заменяя 1-хлор-3-(2,2-диметоксиэтилсульфанил) бензол на 1-хлор-4-(2,2-диметоксиэтилсульфанил)бензол. Сырой продукт реакции очищают колоночной хроматографией с элюированием гексаном, и получают указанное в заголовке соединение в виде белого твердого вещества. 1 35 М.-с. (EI): [М]+=168, 170, система линий Сl. С. 5-Хлорбензо[b]тиофен-2-сульфонилхлорид. Указанное в заголовке соединение получают так, как описано в примере 1, часть D, заменяя тианафталин на 5-хлорбензо[b]тиофен. Сырой продукт реакции очищают колоночной хроматографией с элюированием гексаном, и получают указанное в заголовке соединение в виде белого твердого вещества. 1D. [1-(3-Цианобензил)-2-оксопирролидин 3-ил]амид 5-хлорбензо[b]тиофен-2-сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 1, часть Е, заменяя бензо[b]тиофен-2-сульфонилхлорид на 5 хлорбензо[b]тиофен-2-сульфонилхлорид. Сырой продукт реакции очищают колоночной хроматографией с элюированием с градиентом от 10%EtOAc в CH2Cl2 до 20% EtOAc в CH2Cl2, и получают продукт в виде белого твердого вещества. 1(м, 5 Н), 7,51 (м, 5 Н), 4,36 (АВ, 2 Н), 4,24 (м, 1 Н),3,08 (м, 2 Н), 2,12 (м, 1 Н), 1,61 (м, 1 Н). М.-с. (FAB): [М+Н]+=446, 448, система линий Сl. Е. Трифторацетат 3-[3-(S)-(5-хлорбензо[b] тиофен-2-сульфониламино)-2-оксопирролидин 1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил] метиламида 5-хлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 80% СН 3 СN/Н 2 О (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1(м, 1 Н). М.-с. (FAB): [М+Н]+=463, 465, система линий Сl Элементный анализ при расчете с 2,0 моль 36 А. [1-(3-Цианобензил)-2-оксопирролидин 3-(S)-ил]метиламид-5-хлорбензо[b]тиофен-2 сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 2, часть А, заменяя [1-(3-цианобензил)-2-оксопирролидин-3(S)-ил]амид бензо[b]тиофен-2-сульфонилхлорид на [1-(3-цианобензил)-2-оксопирролидин-3(S)-ил]амид 5-хлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт реакции обрабатывают Et2O, и получают продукт в виде белого твердого вещества. 1[b]тиофен-2-сульфонил)метиламино]-2-оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил] метиламида 5-хлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 70%CH3CN/H2O (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1M.-c. (FAB): [М+Н]+=477, 479, система линий Сl. Элементный анализ при расчете с 1,25 моль H2O: вычислено: С=45,10%, Н=4,03%, N=9,15%; найдено: С=44,97%, Н=3,94%, N=8,91%. Пример 11. Трифторацетат 3-[3-(S)-(4 метилбензо[b]тиофен-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина. А. 3-Метил-1-(2,2-диметоксиэтилсульфанил)бензол. Указанное в заголовке соединение получают так, как описано в примере 5, часть А, заменяя 3-хлортиофенол на 3-метилтиофенол. Сырой продукт реакции очищают колоночной хроматографией с элюированием с градиентом от гексана до 10% Et2O в гексане, и получают указанное в заголовке соединение в виде масла. 1 37 Названные в заголовке соединения получают так, как описано в примере 5, часть В, заменяя 1-хлор-3-(2,2-диметоксиэтилсульфанил) бензол на 3-метил-1-(2,2-диметоксиэтилсульфанил)бензол. Сырые продукты реакции очищают колоночной хроматографией с элюированием гексаном, и получают названные в заголовке соединения как неразделяемую смесь(2:1), в виде масла. М.-с. (El): [M]+=148. С. 4-Метилбензо[b]тиофен-2-сульфонилхлорид и 6-метилбензо[b]тиофен-2-сульфонилхлорид. Названные в заголовке соединения получают так, как описано в примере 1, часть D, заменяя тианафталин на смесь 4-метилбензо[b] тиофена и 6-метилбензо[b]тиофена. Сырой продукт реакции очищают колоночной хроматографией с элюированием гексаном, и получают 4-метилбензо[b]тиофен-2-сульфонилхлорид, а также 6-метилбензо[b]тиофен-2-сульфонилхлорид в виде белых твердых веществ. 4-Метилбензо[b]тиофен-2-сульфонилхлорид. 1D. [1-(3-Цианобензил)-2-оксопирролидин 3-(S)-ил]амид 4-метилбензо[b]тиофен-2-сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 1, часть Е, заменяя бензо[b]тиофен-2-сульфонилхлорид на 4 метилбензо[b]тиофен-2-сульфонилхлорид. Сырой продукт реакции обрабатывают Et2O, и получают продукт в виде белого твердого вещества. 1[b]тиофен-2-cyльфониламино)-2-оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил] амида 4-метилбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% CH3CN/H2O (0,1% ТФУ) до 80% 38 заголовке соединение в виде белого твердого вещества. 1H ЯМР (ДМСО-d6, 300 МГц)9,26 (уш.с,2 Н), 9,00 (уш.с, 2 Н), 8,58 (м, 1 Н), 7,97 (м, 2 Н),7,79 (с, 1 Н), 7,60 (м, 1 Н), 7,49 (м, 3 Н), 7,31 (м,1 Н), 4,40 (АВ, 2 Н), 4,22 (м, 1 Н), 3,12 (м, 2 Н),2,40 (с, 3 Н), 2,10 (м, 1 Н), 1,66 (м, 1 Н). М.-с. (FAB): [M+H]+=443. Элементный анализ при расчете с 2,0 мольH2O: вычислено: С=46,61%, Н=4,59%, N=9,45%; найдено: С=46,75%, Н=4,14%, N=9,38%. Пример 12. Трифторацетат 3-[3-(S)-(6 метилбензо[b]тиофен-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина. А. [1-(3-Цианобензил)-2-оксопирролидин 3-(S)-ил]амид 6-метилбензо[b]тиофен-2-сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 1, часть Е, заменяя бензо[b]тиофен-2-сульфонилхлорид на 6 метилбензо[b]тиофен-2-сульфонилхлорид, полученного так, как описано в примере 11 часть С. Сырой продукт реакции очищают колоночной хроматографией с элюированием с градиентом от 10% EtOAc в СН 2 Сl2 до 20% EtOAc вCH2Cl2, и получают указанное в заголовке соединение в виде белого твердого вещества. 1[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)ил]амида 5-метилбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 80% СН 3 СN/Н 2 О (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают названное в заголовке соединение в виде белого твердого вещества. 1H ЯМР (ДМСО-d6, 300 МГц)9,23 (уш.с,2 Н), 9,00 (уш.с, 2 Н), 8,56 (д, 1 Н), 7,96 (с, 1 Н),7,84 (м, 2 Н), 7,67 (м, 1 Н), 7,53 (м, 3 Н), 7,28 (д,1 Н), 4,42 (АВ, 2 Н), 4,19 (м, 1 Н), 3,12 (м, 2 Н),2,40 (с, 3 Н), 2,12 (м, 1 Н), 1,64 (м, 1 Н). М.-с. (FAB): [М+Н]+=443. Элементный анализ при расчете с 0,50 моль H2O: вычислено: С=48,84%, Н=4,28%, N=9,91%; найдено: С=48,89%, Н=4,05%, N=9,73%. Пример 13. Трифторацетат 3-[3-(S)-(5 метилбензо[b]тиофен-2-сульфониламино]-2 оксопирролидин-1-илметил]бензамидина. 39 А. 4-Метил-1-(2,2-диметоксиэтилсульфанил)бензол. Указанное в заголовке соединение получают так, как описано в примере 5, часть А, заменяя 3-хлортиофенол на 4-метилтиофенол. Сырой продукт реакции очищают колоночной хроматографией с элюированием гексаном, и получают указанное в заголовке соединение в виде масла. 1H ЯМР (СDСl3, 300 МГц)7,28 (м, 1 Н),7,10 (м, 1 Н), 4,49 (т, 1 Н), 3,06 (с, 1 Н), 3,06 (с,3 Н), 3,03 (с, 3 Н), 2,28 (с, 3 Н). В. 5-Метилбензо[b]тиофен. Указанное в заголовке соединение получают так, как описано в примере 5, часть В, заменяя 1-хлор-3-(2,2-диметоксиэтилсульфанил) бензол на 4-метил-1-(2,2-диметоксиэтилсульфанил)бензол. Сырой продукт реакции очищают колоночной хроматографией с элюированием гексаном, и получают указанное в заголовке соединение в виде белого твердого вещества. 1H ЯМР (СDСl3, 300 МГц)7,78 (д, 1 Н),7,62 (с, 1 Н), 7,39 (д, 1 Н), 7,23 (д, 1 Н), 7,17 (д,1 Н), 2,50 (с, 3 Н). С. 5-Метилбензо[b]тиофен-2-сульфонилхлорид. Указанное в заголовке соединение получают так, как описано в примере 1, часть D, заменяя тианафталин на 5-хлорбензо[b]тиофен. Сырой продукт реакции очищают колоночной хроматографией с элюированием гексаном, и получают указанное в заголовке соединение в виде белого твердого вещества. 1D. [1-(3-Цианобензил)-2-оксопирролидин 3-(S)-ил]амид 5-метилбензо[b]тиофен-2-сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 1, часть Е, заменяя бензо[b]тиофен-2-сульфонилхлорид на 5 метилбензо[b]тиофен-2-сульфонилхлорид. Сырой продукт реакции обрабатывают Et2O, и получают продукт в виде белого твердого вещества. 1[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил] амида 5-метилбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 80% 40 СН 3 СN/Н 2 О (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают названное в заголовке соединение в виде белого твердого вещества. 1(FAB): [М+Н]+=443. Элементный анализ при расчете с 0,75 моль Н 2 О: вычислено: С=48,46%, Н=4,33%, N=9,83%; найдено: С=48,41%, Н=3,98, N=9,43%. Пример 14. Трифторацетат 3-[3-(S)-(4,6 дихлорбензо[b]тиофен-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина. А. 1,3-Дихлор-5-(2,2-диметоксиэтилсульфанил)бензол. Указанное в заголовке соединение получают так, как описано в примере 5, часть А, заменяя 3-хлортиофенол на 3,5-дихлортиофенол. Сырой продукт реакции очищают колоночной хроматографией с элюированием гексаном, и получают указанное в заголовке соединение в виде масла. 1H ЯМР (СDСl3, 300 МГц)7,19 (с, 2 Н),7,12 (с, 1 Н), 4,51 (м, 1 Н), 3,13 (с, 3 Н), 3,09 (с,3 Н). В. 4,6-Дихлорбензо[b]тиофен. Указанное в заголовке соединение получают так, как описано в примере 5, часть В, заменяя 1-хлор-3-(2,2-диметоксиэтилсульфанил) бензол на 1,3-дихлор-5-(2,2-диметоксиэтилсульфанил)бензол. Сырой продукт реакции очищают колоночной хроматографией с элюированием гексаном, и получают указанное в заголовке соединение в виде белого твердого вещества. М.-с. (El): [M]+=202. С. 4,6-Дихлорбензо[b]тиофен-2-сульфонилхлорид. Указанное в заголовке соединение получают так, как описано в примере 1, часть D, заменяя тианафталин на 4,6-дихлорбензо[b]тиофен. Сырой продукт реакции очищают колоночной хроматографией с элюированием гексаном, и получают указанное в заголовке соединение в виде белого твердого вещества. 1D. [1-(3-Цианобензил)-2-оксопирролидин 3-(S)-ил]амид 4,6-дихлорбензо[b]тиофен-2-сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 1, часть Е, заменяя бензо[b]тиофен-2-сульфонилхлорид на 4,6-дихлорбензо[b]тиофен-2-сульфонилхлорид. Сырой продукт реакции обрабатывают Et2O и получают продукт в виде белого твердого вещества.(уш.с, 1 Н), 4,41 (АВ, 2 Н), 3,95 (м, 1 Н), 3,22 (м,2 Н), 2,62 (м, 1 Н), 2,12 (м, 1 Н). Е. Трифторацетат 3-[3-(S)-(4,6-дихлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил] амида 4,6-дихлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% CH3CN/H2O (0,1% ТФУ) до 80%CH3CN/H2O (0,1% ТФУ). Соответствующие ракции лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1H ЯМР (ДМСО-d6, 300 МГц)9,27 (уш.с,2 Н), 9,18 (уш.с, 2 Н), 8,82 (м, 1 Н), 8,24 (д, 1 Н),7,98 (д, 1 Н), 7,72 (м, 1 Н), 7,63 (м, 1 Н), 7,52 (м,3 Н), 4,39 (АВ, 2 Н), 4,28 (м, 1 Н), 3,12 (м, 2 Н),2,13 (м, 1 Н), 1,68 (м, 1 Н). М.-с. (FAB): [M+H]+=497, 499, система линий Сl. Элементный анализ при расчете с 1,33 моль Н 2 О: вычислено: С=43,22%, Н=3,44%, N=8,82%; найдено: С=43,10%, Н=3,18% N=8,47%. Пример 15. 2,2,2-Трихлорэтиловый эфир(0,12 г, 1,2 ммоль), а затем трихлорэтилхлорформиат (0,93 г, 0,44 ммоль), и раствор перемешивают в течение 16 ч. После этого раствор разбавляют EtOAc. Органический слой промывают 1 н. НСl, Н 2 О и насыщенным растворомNaCl. Органический слой сушат над MgSO4,фильтруют и концентрируют. Остаток очищают колоночной хроматографией с элюированием с градиентом от 1% МеОН в CH2Cl2 до 3% МеОН в CH2Cl2, и получают указанное в заголовке соединение (0,20 г, 0,30 ммоль) в виде белого твердого вещества. 1SnCl2 (13,9 г, 61,7 ммоль). Получающийся в результате раствор кипятят с обратным холодильником. Через 2 ч раствор охлаждают до температуры окружающей среды, и выливают раствор в 150 мл воды со льдом. Доводят рН раствора до 7 с помощью насыщенного раствора NaHCO3. Раствор разбавляют EtOAc, и получающуюся в результате смесь фильтруют через целит. Фильтрованный раствор разделяют. Органический слой сушат над MgSO4, фильтруют и концентрируют, и получают указанное в заголовке соединение (1,57 г, 8,7 ммоль) в виде не совсем белого твердого вещества. 1(EI): [М]+=132. В. 4-(Бензгидрилиденамино)-3-метилбензонитрил. К раствору 4-амино-3-бензонитрила (1,20 г, 9,08 ммоль) в 75 мл толуола добавляют бензофенон (1,74 г, 9,53 ммоль) и п-толуолсульфоновую кислоту (0,43 г, 2,1 ммоль). Реакционный сосуд снабжают ловушкой Дина-Старка и раствор кипятят с обратным холодильником. Через 24 ч раствор охлаждают до температуры окружающей среды и раствор концентрируют. Сырое вещество очищают колоночной хроматографией с элюированием с градиентом от 3%M.-c. (El): [М]+=296. С. 4-(бензгидрилиденамино)-3-бромметилбензонитрил. К раствору 4-(бензгидрилиденамино)-3 метилбензонитрила (1,36 г, 4,27 ммоль) в 40 мл ССl4 добавляют N-бромсукцинимид (0,84 г, 4,7 ммоль) и пероксид бензоила (0,22 г, 0,64 ммоль). Раствор кипятят с обратным холодильником в течение 16 ч. Раствор охлаждают до температуры окружающей среды, и разбавляютCH2Cl2. Раствор промывают 1 н. NaOH и насыщенным раствором NaCl. Органический слой сушат над MgSO4, фильтруют и концентрируют. Сырое вещество очищают колоночной хроматографией с элюированием с градиентом от 5%D. трет-Бутиловый эфир 1-[2-(бензгидрилиденамино)-5-цианобензил]-2-оксопирролидин-3-(S)-илкарбаминовой кислоты. Указанное в заголовке соединение получают так, как описано в примере 1, часть В, заменяя -бром-м-толуилнитрил на 4-(бензгидрилиденамино)-3-бромметилбензонитрил. Сырой продукт реакции очищают колоночной хроматографией с элюированием с градиентом от 30%EtOAc в гексане до 40% EtOAc в гексане, и получают продукт в виде желтого твердого вещества. 1(АВ, 2 Н), 4,15 (м, 1 Н), 3,30 (м, 2 Н), 2,61 (м, 1 Н),1,90 (м, 1 Н), 1,45 (с, 9 Н). Е. Дигидрохлорид 4-амино-[3-(3-(S)-амино-2-оксопирролидин-1-илметил)]бензонитрила. Указанное в заголовке соединение получают так, как описано в примере 1, часть С. Указанное в заголовке соединение получают в виде белого твердого вещества. 1F. [1-(2-Амино-5-цианобензил)-2-оксопирролидин-3-(S)-ил]амид 4,6-дихлорбензо[b]тиофен-2-сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 1, часть Е, заменяя бензо[b]тиофен-2-сульфонилхлорид на 4,6-дихлорбензо[b]тиофен-2-сульфонилхлорид,и заменяя гидрохлорид 3-(3-(S)-амино-2 оксопирролидин-1-илметил)бензонитрила на дигидрохлорид 4-амино-[3-(3-(S)-амино-2-оксопирролидин-1-илметил)]бензонитрила. Сырой продукт реакции обрабатывают Et2O, и получают продукт в виде белого твердого вещества. 1 ЯМР (СDСl3+CD3OD, 300 МГц)7,97 (с,1 Н), 7,68 (с, 1 Н), 7,40 (с, 1 Н), 7,27 (д, 1 Н), 7,21G. Трифторацетат 4-амино-3-[3-(S)-(4,6 дихлорбензо[b]-тиофен-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в пример 1, часть F, с использованием в качестве исходного вещества [1(3-цианобензил)-2-оксопирролидин-3-ил]амида 4,6-дихлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% CH3CN/H2O (0,1% ТФУ) до 80% 44 заголовке соединение в виде белого твердого вещества. 1H ЯМР (ДМСО-d6, 300 МГц)9,27 (уш.с,2 Н), 9,18 (уш.с, 2 Н), 8,82 (м, 1 Н), 8,24 (д, 1 Н),7,98 (д, 1 Н), 7,72 (м, 1 Н), 7,63 (м, 1 Н), 7,52 (м,3 Н), 4,39 (АВ, 2 Н), 4,28 (м, 1 Н), 3,12 (м, 2 Н),2,13 (м, 1 Н), 1,68 (м, 1 Н). М.-с. (FAB): [М+Н]+=497, 499, система линий Сl. Элементный анализ при расчете с 1,33 моль Н 2 О: вычислено: С=43,22%, Н=3,44%, N=8,82%; найдено: С=43,10%, Н=3,18%, N=8,47%. Пример 17. Трифторацетат 4-гидрокси-3[3-(S)-(4,6-дихлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина. А. 2-Гидрокси-5-иодбензальдегид. К раствору салицилальдегида (10 г, 82 ммоль) в 50 мл CH2Cl2 добавляют 22 мл 1 М раствора ICl в CH2Cl2. Раствор перемешивают в течение 14 ч. После этого добавляют насыщенный раствор сульфита натрия до тех пор, пока не исчезнет окраска. Раствор разбавляют CH2Cl2 и разделяют слои. Органический слой промывают водой, сушат над MgSO4, фильтруют и концентрируют. Получающееся в результате сырое вещество перекристаллизовывают из циклогексана, и получают указанное в заголовке соединение (7,2 г, 32 ммоль) в виде белого твердого вещества. 1H ЯМР (СDСl3, 300 МГц)10,91 (с, 1 Н),9,82 (с, 1 Н), 7,84 (д, 1 Н), 7,75 (дд, 1 Н), 6,75 (д,1 Н). М.-с. (El): [M]+=248. В. 5-Иод-2-(2-метоксиэтоксиметокси)бензиловый спирт. К раствору гидрида натрия (1,2 г 60% дисперсии в минеральном масле, 52 ммоль) в 25 мл ТГФ при 0 С добавляют 2-гидрокси-5 иодбензальдегид (7,0 г, 28 ммоль). К получающемуся в результате раствору добавляют 2 метоксиэтоксиметоксихлорид (3,4 мл, 30 ммоль) и 4 мл 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н) пиримидинона. Раствор оставляют нагреваться до температуры окружающей среды, а через 45 мин раствор охлаждают до -15 С, и добавляют 6 мл 2 М раствора борогидрида натрия в ТГФ. Раствор перемешивают в течение 10 мин, и после этого добавляют 24 мл 2 М раствора НСl в воде. Получающийся в результате раствор разбавляют эфиром, и промывают водой и насыщенным раствором NaCl. Органический слой сушат над MgSO4, фильтруют и концентрируют. Получающееся в результате сырое вещество очищают колоночной хроматографией с элюированием 40% EtOAc в гексане, и получают указанное в заголовке соединение (7,6 г, 22,5 ммоль) в виде белого твердого вещества. 1(т, 1 Н). М.-с. (El): [M]+=338. С. 5-Иод-2-(2-метоксиэтоксиметокси) бензилбромид. К раствору 5-иод-2-(2-метоксиэтоксиметокси)бензилового спирта (7,5 г, 22 ммоль) в 60 мл ТГФ при 15 С добавляют трифенилфосфин(4,3 г, 24 ммоль). Раствор перемешивают в течение 5 мин, а затем оставляют нагреваться до температуры окружающей среды. Через 20 мин раствор концентрируют. Сырой продукт реакции очищают колоночной хроматографией с элюированием смесью EtOAc с CH2Cl2 и гексаном (3:1:6). 1D. 3-(S)-(трет-Бутоксикарбониламино)-1(5-иод-2-(2-метоксиэтоксиметокси)бензил)пирролидин-2-он. Указанное в заголовке соединение получают так, как описано в примере 1, часть В, заменяя -бром-м-толуилнитрил на 5-иод-2-(2 метоксиэтоксиметокси)бензилбромид. Сырое вещество очищают колоночной хроматографией с элюированием смесью EtOAc с CH2Cl2 и гексаном (3:1:1). 1(м, 2 Н), 3,53 (м, 2 Н), 3,37 (с, 3 Н), 3,22 (м, 2 Н),2,62 (м, 1 Н), 1,84 (м, 1 Н), 1,46 (с, 9 Н). М.-с. (ионное распыление, IS): [М]+=521. Е. 3-(S)-(тет-Бутоксикарбониламино)-1-(5 циано-2-(2-метоксиэтоксиметокси)бензил) пирролидин-2-он. Указанное в заголовке соединение получают так, как описано в примере 3, часть С, заменяя (5-иодотиофен-3-ил)метанол на 3-(S)(трет-бутоксикарбониламино)-1-(5-иод-2-(2-метоксиэтоксиметокси)бензил)пирролидин-2-он. Сырое вещество очищают колоночной хроматографией с элюированием смесью EtOAc сF. Гидрохлорид 3-(S)-[(3-амино-2-оксопирролидин-1-ил)метил]-4-гидроксибензонитрила. Указанное в заголовке соединение получают так, как описано в примере 1, часть С, заменяя трет-бутиловый эфир [1-(3-цианобензил)2-оксопирролидин)-3-(S)-ил]карбаминовой кислоты на 3-(S)-(трет-бутоксикарбониламино)-1(5-циано-2-(2-метоксиэтоксиметокси)бензил) 46 пирролидин-2-он. Указанное в заголовке соединение получают в виде белого твердого вещества. 1G. [1-(2-Гидрокси-5-цианобензил)-2-оксопирролидин-3-ил]амид-4,6-дихлорбензо[b]тиофен-2-сульфоновой кислоты. К раствору гидрохлорида 3-[(3-амино-2 оксопирролидин-1-ил)метил]-4-гидроксибензонитрила (0,20 г, 0,75 моль) в 3 мл пиридина при 0 С добавляют 4,6-дихлорбензо[b]тиофен-2 сульфонилхлорид. Раствор оставляют нагреваться до температуры окружающей среды и перемешивают в течение 6 ч. После этого раствор концентрируют, и остаток растворяют вCH2Cl2. Органический раствор промывают 1 н. НСl и насыщенным раствором NaCl. Сырое вещество обрабатывают Et2O, и получают названное в заголовке соединение (0,22 г, 0,44 ммоль) в виде белого твердого вещества. 1H ЯМР (СDСl3+ДМСО-d6, 300 МГц)7,97 (с, 1 Н), 7,73 (м, 1 Н), 7,67 (с, 1 Н), 7,57 (с,1 Н), 7,45 (м, 2 Н), 6,86 (уш.с, 1 Н), 4,31 (АВ, 2 Н),4,04 (м, 1 Н), 3,24 (м, 2 Н), 2,40 (м, 1 Н), 1,94 (м,1 Н). Н. Трифторацетат 4-гидрокси-3-[3-(S)-(4,6 дихлорбензо[b]тиофен-2-сульфониламино)-2 оксопирролицин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(2-гидрокси-5-цианобензил)-2-оксопирролидин-3-(S)-ил]амида 4,6-дихлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт реакции очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% CH3CN/H2O(0,1% ТФУ) до 80% СН 3 СN/Н 2 О (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1(уш.с, 2 Н), 8,29 (с, 1 Н), 7,57 (м, 2 Н), 7,48 (м,2 Н), 6,97 (д, 1 Н), 4,30 (АВ, 2 Н), 4,26 (м, 1 Н),3,22 (м, 2 Н), 2,23 (м, 1 Н), 1,74 (м, 1 Н). М.-с. (FAB): [М+Н]+=513, 515, система линий Cl2. Пример 18. Трифторацетат 3-[3-(S)-(6 фторбензо[b]тиофен-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина. А. 1-Фтор-3-(2,2-диметоксиэтилсульфанил)бензол. Указанное в заголовке соединение получают так, как описано в примере 5, часть А, заменяя 3-хлортиофенол на 3-фтортиофенол. Сырой продукт реакции очищают колоночной хроматографией с элюированием с градиентом отH ЯМР (СDСl3, 300 МГц)7,21 (м, 1 Н),7,09 (м, 2 Н), 6,82 (м, 2 Н), 4,51 (м, 1 Н), 3,09 (с,31 Н), 3,07 (с, 3 Н). В. 6-Фторбензо[b]тиофен. Указанное в заголовке соединение получают так, как описано в примере 5, часть В, заменяя 1-хлор-3-(2,2-диметоксиэтилсульфанил) бензол на 1-фтор-3-(2,2-диметоксиэтилсульфанил) бензол. Сырой продукт реакции очищают колоночной хроматографией с элюированием гексаном, и получают указанное в заголовке соединение в виде белого твердого вещества. М.-с. (EI): [M]+=152. С. 6-Фторбензо[b]тиофен-2-сульфонилхлорид. Указанное в заголовке соединение получают так, как описано в примере 1, часть D, заменяя тианафталин на 6-фторбензо[b]тиофен. Сырой продукт реакции очищают колоночной хроматографией с элюированием гексаном, и получают указанное в заголовке соединение в виде белого твердого вещества. 1D. [1-(3-Цианобензил)-2-оксопирролидин 3-(S)-ил]амид 6-фторбензо[b]тиофен-2-сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 17, часть G,заменяя 3-[(3-(S)-амино-2-оксопирролидин-1 ил)метил]-4-гидроксибензонитрил на 3-[(3-(S)амино-2-оксопирролидин-1-ил)метил]бензонитрил, и заменяя 4,6-дихлорбензо[b]тиофен-2 сульфонилхлорид на 6-фторбензо[b]тиофен-2 сульфонилхлорид. Сырой продукт реакции обрабатывают Et2O, и получают продукт в виде белого твердого вещества.[b]тиофен-2-cyльфониламино)-2-оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)ил]амида 6-фторбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт реакции очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 80% СН 3 СN/Н 2 О (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1(м, 1 Н). М.-с. (FAB): [М+Н]+=447. Элементный анализ при расчете с 1,0 моль Н 2 О: вычислено: С=45,67%, Н=3,71%, N=9,68%; найдено: С=45,52%, Н=3,95%, N=9,31%. Пример 19. Трифторацетат 4-амино-3-[3(S)-(6-фторбензо[b]тиофен-2-сульфониламино)2-оксопирролидин-1-илметил]бензамидина. А. [1-(2-Амино-5-цианобензил)-2-оксопирролидин-3-(S)-ил]амид 6-фторбензо[b]тиофен-2 сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 17, часть G,заменяя 3-[(3-(S)-(амино-2-оксопирролидин-1 ил)метил]-4-гидроксибензонитрил на 3-[(3-(S)(амино-2-оксопирролидин-1-ил)метил]-4-аминобензонитрил и заменяя 4,6-дихлорбензо[b]тиофен-2-сульфонилхлорид на 6-фторбензо[b] тиофен-2-сульфонилхлорид. Сырой продукт реакции обрабатывают Et2O, и получают указанное в заголовке соединение в виде белого твердого вещества. М.-с. (FAB): [М+Н]+=445. В. Трифторацетат 4-амино-3-[3-(S)-(6 фторбензо[b]тиофен-2-сульфониламино]-2 оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(2-амино-5-цианобензил)-2-оксопирролидин 3-(S)-ил]амида 6-фторбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% CH3CN/H2O (0,1% ТФУ) до 70%CH3CN/H2O (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1H ЯМР (ДМСО-d6, 300 МГц)8,74 (уш.с,2 Н), 8,68 (д, 1 Н), 8,40 (уш.с, 2 Н), 8,01 (м, 3 Н),7,53 (д, 1 Н), 7,36 (м, 2 Н), 6,72 (д, 1 Н), 6,20 (уш.с,2 Н), 4,28 (м, 1 Н), 4,26 (АВ, 2 Н), 3,12 (м, 2 Н),2,09 (м, 1 Н), 1,60 (м, 1 Н). М.-с. (FAB): [M+H]+=462. Пример 20. Трифторацетат 4-гидрокси-3[3-(S)-(6-фторбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина. А. [1-(2-Гидрокси-5-цианобензил)-2-оксопирролидин-3-(S)-ил]амид 6-фторбензо[b]тиофен-2-сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 17, часть G,заменяя 4,6-дихлорбензо[b]тиофен-2-сульфонилхлорид на 6-фторбензо[b]тиофен-2-сульфонилхлорид. Сырой продукт реакции обрабатывают Et2O, и получают продукт в виде белого твердого вещества.(м, 2 Н), 2,60 (м, 1 Н), 2,09 (м, 1 Н). В. Трифторацетат 4-гидрокси-3-[3-(S)-(6 фторбензо[b]тиофен-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил] амида 6-фторбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% CH3CN/H2O (0,1% ТФУ) до 70% СН 3 СN/Н 2 О (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают названное в заголовке соединение в виде белого твердого вещества. 1(д, 1 Н), 8,01 (с, 1 Н), 8,00 (м, 2 Н), 7,54 (д, 1 Н),7,38 (м, 2 Н), 6,92 (м, 1 Н), 4,30 (АВ, 2 Н), 4,21 (м,1 Н), 3,15 (м, 2 Н), 2,18 (м, 1 Н), 1,67 (м, 1 Н). М.-с. (FAB): [М+H]+=463. Пример 21. Трифторацетат 4-амино-3-[3(S)-(4-хлорбензо[b]тиофен-2-сульфониламино)2-оксопирролидин-1-илметил]бензамидина. А. [1-(2-Амино-5-цианобензил)-2-оксопирролидин-3-(S)-ил]амид 4-хлорбензо[b]тиофен-2 сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 17, часть G, 3[(3-(S)-амино-2-оксопирролидин-1-ил)метил]-4 гидроксибензонитрил на 3-[(3-(S)-амино-2 оксопирролидин-1-ил)метил]-4-аминобензонитрил и заменяя 4,6-дихлорбензо[b]тиофен-2 сульфонилхлорид на 4-хлорбензо[b]тиофен-2 сульфонилхлорид. Сырой продукт реакции обрабатывают Et2O, и получают продукт в виде белого твердого вещества. М.-с. (FAB): [М+H]+=461, 463, система линий Сl. В. Трифторацетат 4-амино-3-[3-(S)-(4 хлорбензо[b]тиофен-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(2-амино-5-цианобензил)-2-оксопирролидин 3-(S)-ил]амида 4-хлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 70% СН 3 СN/Н 2 О (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1(м, 2 Н), 6,70 (д, 1 Н), 6,15 (уш. с, 3 Н), 4,27 (м,1 Н), 4,13 (АВ, 1 Н), 3,14 (м, 2 Н), 2,13 (м, 1 Н),1,60 (м, 1 Н). М.-с. (FAB): [M+H]+=478, 480, система линий Сl. Пример 22. Трифторацетат 4-гидрокси-3[3-(S)-(4-хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина. А. [1-(2-Гидрокси-5-цианобензил)-2-оксопирролидин-3-(S)-ил]амид 4-хлорбензо[b]тиофен-2-сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 17, часть G,заменяя 4,6-дихлорбензо[b]тиофен-2-сульфонилхлорид на 4-хлорбензо[b]тиофен-2-сульфонилхлорид. Сырой продукт реакции обрабатывают Et2O, и получают продукт в виде белого твердого вещества.M.-c. (FAB): [M+H]+=462, 464, система линий Сl. В. Трифторацетат 4-гидрокси-3-[3-(S)-(4 хлорбензо[b]тиофен-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)ил]амида 4-хлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированим с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 70%CH3CN/H2O (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1M.-c. (FAB): [M+H]+=479, 481, система линий Сl. Пример 23. Трифторацетат 3-[3-(S)-(4 хлортиено[3,2-с]пиридин-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина. А. 3-Тиофен-2-илакриловая кислота. К раствору 2-тиофенкарбоксальдегида (10 г, 89 ммоль) в 300 мл CH2Cl2 добавляют метил(трифенилфосфорилиден)ацетат. Раствор перемешивают в течение 48 ч. После этого раствор концентрируют, и растворяют остаток в 1000 мл смеси Н 2 О с МеОН и ТГФ (1:1:1). К получающемуся в результате раствору добавляют гидроксид лития (22,9 г, 547 ммоль). Раствор перемешивают в течение 3 ч. После этого раствор концентрируют до 1/3 его объема, и промывают оставшийся раствор EtOAc. Водный раствор подкисляют 1 н. НСl до рН 5. Образуется белый осадок. Твердое вещество собирают фильтрацией, и затем сушат в вакууме над Р 2O5.H ЯМР (СDСl3, 300 МГц)7,90 (д, 1 Н),7,42 (д, 1 Н), 7,27 (д, 1 Н), 7,08 (д, 1 Н), 6,22 (д,1 Н). В. 5 Н-Тиено[3,2-с]пиридин-4-он. К раствору 3-тиофен-2-илакриловой кислоты (7,39 г, 47,9 ммоль) в 200 мл ацетона добавляют триэтиламин (4,9 г, 47,9 ммоль). Получающийся в результате раствор охлаждают до 0 С, и добавляют по каплям этилхлорформиат(5,7 г, 52,8 ммоль). Затем через 2 ч добавляют азид натрия (4,67 г, 71,9 ммоль) в 25 мл Н 2 О. Раствор перемешивают в течение 1,5 ч при 0 С. После этого раствор выливают в 300 мл Н 2 О. Образуется белый осадок, который собирают посредством фильтрации. Получающееся твердое вещество сушат в вакууме над P2O5. Твердое вещество суспендируют в 20 мл дифенилового эфира. Этот раствор добавляют по каплям к раствору трибутиламина (6,9 г, 37,4 ммоль) в 200 мл дифенилового эфира при 190 С. Через 2 ч раствор охлаждают до температуры окружающей среды. Раствор разбавляют 1000 мл гексана и охлаждают до 0 С. Получающееся в результате твердое вещество собирают посредством фильтрации, и промывают это твердое вещество гексаном. Получают указанное в заголовке соединение (3,6 г, 23,8 ммоль) в виде белого твердого вещества. 1(1,0 г, 6,62 ммоль) в 30 мл оксихлорида фосфора. Раствор нагревают до 100 С и через 4 ч раствор концентрируют. Остаток растворяют вCH2Cl2 и получающийся в результате раствор промывают водой и насыщенным растворомNaCl. Органический слой сушат над МgSO4,фильтруют и концентрируют. Сырой продукт реакции очищают колоночной хроматографией с элюированием с градиентом от 40% CH2Cl2 в гексане до 60% CH2Cl2 в гексане. Получают указанное в заголовке соединение в виде белого твердого вещества. 1D. 4-Хлортиено[3,2-с]пиридин-2-сульфонилхлорид. Указанное в заголовке соединение получают так, как описано в примере 1, часть D, заменяя тианафталин на 4-хлортиено[3,2 с]пиридин. Сырой продукт очищают колоночной хроматографией с элюированием с градиентом от 40% CH2Cl2 в гексане до 60% CH2Cl2 в гексане. Получают указанное в заголовке соединение в виде белого твердого вещества. 1[3,2-с]пиридин-2 сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 17, часть G,заменяя 3-[(3-(S)-амино-2-оксопирролидин-1 ил)метил]-4-гидроксибензонитрил на 3-(3-(S)амино-2-оксопирролидин-1-ил)метилбензонитрил и заменяя 4,6-дихлорбензо[b]тиофен-2 сульфонилхлорид на 4-хлортиено[3,2-с] пиридин-2-сульфонилхлорид. Сырой продукт очищают колоночной хроматографией с элюированием с градиентом от 10% CH2Cl2 в EtOAc до 20% CH2Cl2 EtOAc. Получают указанное в заголовке соединение в виде белого твердого вещества. 1[3,2-с]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил] амида 4-хлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 70% СН 3 СN/Н 2 О (0,1% ТФУ). Соответствующие фракции лиофилиэуют, и получают названное в заголовке соединение в виде белого твердого вещества. 1H ЯМР (ДМСО-d6, 300 МГц)9,28 (уш.с,2 Н), 9,18 (уш.с, 2 Н), 9,06 (д, 1 Н), 8,38 (д, 1 Н),8,22 (д, 1 Н), 8,08 (с, 1 Н), 7,68 (м, 1 Н), 7,52 (м,3 Н), 4,41 (АВ, 2 Н), 4,33 (м, 1 Н), 3,14 (м, 2 Н),2,21 (м, 1 Н), 1,72 (м, 1 Н). М.-с. (FAB): [М+Н]+=464, 466, система линий Сl. Пример 24. Трифторацетат 4-гидрокси-3[3-(S)-(4-хлортиено[3,2-с]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина. А. [1-(2-Гидрокси-5-цианобензил)-2-оксопирролидин-3-(S)-ил]амид 4-хлортиено[3,2-с] пиридин-2-сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 17, часть G,заменяя 4,6-дихлорбензо[b]тиофен-2-сульфонилхлорид на 4-хлортиено[3,2-с]пиридин-2 сульфонилхлорид. Сырой продукт реакции очищают колоночной хроматографией с элюированием с градиентом от 1% МеОН в CH2Cl2 до 4% в CH2Cl2. Указанное в заголовке соединение получают в виде белого твердого вещества. 1(АВ, 2 Н), 4,10 (м, 1 Н), 3,48 (м, 2 Н), 2,74 (м, 1 Н),2,18 (м, 1 Н). В. Трифторацетат 4-гидрокси-3-[3-(S)-(4 хлортиено[3,2-с]пиридин-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина. Указанное в заголовке соединение получают так, как описано в примере 1, часть F, с использованием в качестве исходного вещества[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил] амида 4-хлорбензо[b]тиофен-2-сульфоновой кислоты. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 70% СН 3 СN/Н 2 О (0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают названное в заголовке соединение в виде белого твердого вещества. 1(м, 1 Н). М.-с. (FAB): [М+Н]+=480, 482, система линий Сl. Пример 25. Трифторацетат 3-[3-(S)-(5 хлортиено[3,2-b]пиридин-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина. А. 5-Хлортиено[3,2-b]пиридин. Указанное в заголовке соединение получают так, как описано в J. Chem. Soc., PerkinTrans. I, 1981, 1531. Сырой продукт очищают колоночной хроматографией с элюированием с градиентом от 10% EtOAc в гексане до 20%EtOAc в гексане, и получают белое твердое вещество. 1H ЯМР (СDСl3, 300 МГц)8,12 (д, 1 Н),7,80 (д, 1 Н), 7,51 (д, 1 Н), 7,28 (д, 1 Н). М.-с. (EI): [M]+=169, 171, система линий Сl. В. 5-Хлортиено[3,2-b]пиридин-2-сульфонилхлорид. Указанное в заголовке соединение получают так, как описано в примере 1, часть D, с использованием 5-хлортиено[3,2-b]пиридина вместо тианафталина. Получают сырой продукт в виде белого твердого вещества, и он является достаточно чистым для использования на последующей стадии. 1M.-c. (El): [M]+=267, 269, система линий Сl. С. [1-(3-Цианобензил)-2-оксопирролидин 3-(S)-ил]амид 5-хлортиено[3,2-b]пиридин-2 сульфоновой кислоты. Указанное в заголовке соединение получают из гидрохлорида 3-(3-(S)-амино-2 оксопирролидин-1-илметил)бензонитрила так,как описано в примере 1, часть Е, с использованием 5-хлортиено[3,2-b]пиридин-2-сульфонил 001739 54 хлорида вместо бензо[b]тиофен-2-сульфонилхлорида. Получают продукт в виде белого твердого вещества. 1[1-(3-Цианобензил)-2-оксопирролидин-3(S)-ил]амид 5-хлортиено[3,2-b]пиридин-2-сульфоновой кислоты превращают в названное в заголовке соединение так, как описано в примере 1, часть F. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% CH3CN/H2O (0,1% ТФУ) до 70% СН 3 СN/Н 2 О (0,1% ТФУ), и фракции с соответствующим продуктом лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1M.-c. (FAB) : [М+Н]+=464, 466, система линий Сl. Элементный анализ при расчете с 1,0 мольH2O: вычислено: С=42,35%, Н=3,55%, N=11,76%; найдено: С=42,34%, Н=3,30%, N=11,39%. Пример 26. Бистрифторацетат 3-[3-(S)(тиено[3,2-b]пиридин-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина. К раствору трифторацетата 3-[3-(S)-(5 хлортиено[3,2-b]пиридин-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина (0,21 г, 0,36 ммоль) в 10 мл смеси бензола с МеОН(1:1) добавляют избыток твердого КОН (0,25 г) и каталитическое количество 10% палладия на активированном угле. Гетерогенную смесь гидрируют при комнатной температуре в аппарате Парра при давлении H2483 кПа (70 ф/д 2) в течение 5 суток. Реакционную смесь фильтруют через целит, промывают МеОН, и фильтрат концентрируют в вакууме. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 60% CH3CN/H2O (0,1% ТФУ), и фракции с соответствующим продуктом лиофилизуют, и получают указанное в заголовке соединение (0,14 г, 0,21 ммоль) в виде белого твердого вещества. 1[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил]амид 5-хлортиено[3,2-b] пиридин-2-сульфоновой кислоты (0,20 г, 0,45 ммоль) в 10 мл МеОН. Раствор охлаждают до 0 С, и через раствор в течение 5 мин барботируют газообразный НСl. Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 16 ч. После этого раствор концентрируют в вакууме и сушат при высоком вакууме. К растворенному в 20 мл МеОН остатку добавляют гидрохлорид гидроксиламина (0,78 г, 11,2 ммоль), а затем триэтиламин (2,23 г, 22,0 ммоль). Получающийся в результате раствор кипятят с обратным холодильником в течение 2 ч. Раствор концентрируют, и остаток очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 70% СН 3 СN/Н 2 О(0,1% ТФУ). Соответствующие фракции лиофилизуют, и получают указанное в заголовке соединение (0,17 г, 0,29 ммоль) в виде белого твердого вещества. 1(м, 1 Н). М.-с. (FAB): [M+H]+=480, 482, система линий Сl. Элементный анализ при расчете с 1,6 моль Н 2 О: вычислено: С=40,50%, Н=3,59%, N=11,24%; найдено: С=40,75%, Н=3,20%, N=10,86%. Пример 28. Трифторацетат 3-3-(S)-[(5 хлортиено[3,2-b]пиридин-2-сульфонил)метиламино]-2-оксопирролидин-1-илметилбензамидина. А. [1-(3-Цианобензил)-2-оксопирролидин 3-(S)-ил]метиламид 5-хлортиено[3,2-b]пиридин 2-сульфоновой кислоты. Растворяют[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил]амид 5-хлортиено[3,2-b] пиридин-2-сульфоновой кислоты (0,25 г, 0,56 ммоль) в 6 мл ДМФА, и раствор охлаждают до 0 С. Добавляют к раствору метилиодид (0,40 г,2,82 ммоль) и гидрид натрия (25 мг 60% дисперсии в минеральном масле, 0,62 ммоль). Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 2 ч. После этого раствор разбавляют H2O и EtOAc, и разделяют слои. Органический слой промывают 1 н. НСl, Н 2 О, насыщенным раствором NaНСО 3 и насыщенным раствором NaCl. Затем органическую фазу сушат над MgSO4, фильтруют и концентрируют, и получают указанное в заго 001739[1-(3-Цианобензил)-2-оксопирролидин-3(S)-ил]метиламид 5-хлортиено[3,2-b]пиридин-2 сульфоновой кислоты превращают в указанное в заголовке соединение так, как описано в примере 1, часть F. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 60% СН 3 СN/Н 2 О (0,1% ТФУ), и фракции с соответствующим продуктом лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1H ЯМР (ДМСО-d6, 500 МГц)9,32 (уш.с,2 Н), 9,14 (уш.с, 2 Н), 8,69 (д, 1H), 8,24 (с, 1H),7,70 (м, 1H), 7,66 (д, 1H), 7,58 (м, 2 Н), 7,56 (с,1H), 5,00 (м, 1H), 4,44 (АВ, 2 Н), 3,24 (м, 1H),3,19 (м, 1H), 2,83 (с, 3 Н), 2,17 (м, 1H), 1,96 (м,1H). М.-с. (FAB): [М+Н]+=478, 480, система линий Сl. Элементный анализ при расчете с 1,3 моль Н 2 О: вычислено: С=42,91%, Н=3,87%, N=11,37%; найдено: С=42,90%, Н=3,52%, N=11,07%. Пример 29. Трифторацетат 3-[3-(S)-(6 хлортиено[2,3-b]пиридин-2-сульфониламино)-2 оксопирролидин-1-илметил]бензамидина. А. 2-Бром-6-хлортиено[2,3-b]пиридин. Указанное в заголовке соединение получают из 2-бром-5-ацетилтиофена по методике,описанной в J. Chem. Soc., Perkin Trans. I, 1981,1531. Сырой продукт очищают колоночной хроматографией с элюированием 2% EtOAc в гексане, и получают белое твердое вещество. 1H ЯМР (СDСl3, 300 МГц)7,89 (д, 1H),7,28 (д, 1H), 7,27 (д, 1 Н). В. 6-Хлортиено[2,3-b]пиридин-2-сульфонилхлорид. Указанное в заголовке соединение получают так, как описано в примере 1, часть D, с использованием 2-бром-6-хлортиено [2,3-b] пиридина вместо тианафталина. Получают сырой продукт в виде белого твердого вещества, и он является достаточно чистым для использования на последующей стадии. 1 57 Указанное в заголовке соединение получают из гидрохлорида 3-(3-(S)-амино-2 оксопирролидин-1-илметил)бензонитрила так,как описано в примере 1, часть Е, с использованием 6-хлортиено[2,3-b]пиридин-2-сульфонилхлорида вместо бензо[b]тиофен-2-сульфонилхлорида. Сырой продукт очищают колоночной хроматографией с элюированием с градиентом от 10% EtOAc в CH2Cl2 до 25% EtOAc в CH2Cl2,и получают белое твердое вещество. 1[1-(3-Цианобензил)-2-оксопирролидин-3(S)-ил]амид 6-хлортиено[2,3-b]пиридин-2-сульфоновой кислоты превращают в названное в заголовке соединение так, как описано в примерe 1, часть F. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 60%CH3CN/H2O (0,1% ТФУ), и фракции с соответствующим продуктом лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1(м, 1 Н). М.-с. (FAB): [M+H]+=464, 466, система линий Сl. Элементный анализ при расчете с 1,5 моль Н 2 О: вычислено: С=41,69%, Н=3,66%, N=11,58%; найдено: С=41,78%, Н=3,28%, N=11,16%. Пример 30. Бистрифторацетат 3-[3-(S)(тиено[2,3-b]пиридин-2-сульфониламино)-2 оксолирролидин-1-илметил]бензамидина. Трифторацетат 3-[3-(S)-(6-хлортиено[2,3b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]бензамидина превращают в указанное в заголовке соединение так, как описано в примере 26. Реакционную смесь гидрируют при комнатной температуре в течение 3 суток. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 80% СН 3 СN/Н 2 О (0,1% ТФУ), и фракции с соответствующим продуктом лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1 58 М.-с. (IS): [М+Н]+=430. Пример 31. Трифторацетат 3-3-(S)-[(6 хлортиено[2,3-b]пиридин-2-сульфонил)метиламино]-2-оксопирролидин-1-илметилбензамидина. А. [1-(3-Цианобензил)-2-оксопирролидин 3-(S)-ил]метиламид 6-хлортиено[2,3-b]пиридин 2-сульфоновой кислоты. Указанное в заголовке соединение получают так, как описано в примере 28, часть А, с использованием[1-(3-цианобензил)-2-оксопирролидин-3-(S)-ил]амида 6-хлортиено[2,3-b] пиридин-2-сульфоновой кислоты вместо [1-(3 цианобензил)-2-оксопирролидин-3-(S)-ил]амида 5-хлортиено[3,2-b]пиридин-2-сульфоновой кислоты. Сырой продукт очищают колоночной хроматографией с элюированием с градиентом от 5% EtOAc в CH2Cl2 до 10% EtOAc в CH2Cl2, и получают белое твердое вещество. 1[1-(3-Цианобензил)-2-оксопирролидин-3(S)-ил]метиламид 6-хлортиено[2,3-b]пиридин-2 сульфоновой кислоты превращают в указанное в заголовке соединение так, как описано в примере 1, часть F. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 80% СН 3 СN/Н 2 О (0,1% ТФУ), и фракции с соответствующим продуктом лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1H ЯМР (ДМСО-d6, 500 МГц)9,30 (уш.с,2 Н), 9,03 (уш.с, 2 Н), 8,49 (д, 1 Н), 8,17 (с, 1 Н),7,70 (д, 1 Н), 7,68 (м, 1 Н), 7,55 (м, 3 Н), 4,96 (м,1 Н), 4,43 (АВ, 2 Н), 3,19 (м, 2 Н), 2,81 (с, 3 Н),2,15 (м, 1 Н), 1,97 (м, 1 Н). М.-с. (FAB): [M+H]+=478, 480, система линий Сl. Пример 32. Трифторацетат 4-гидрокси-3[2-оксо-3-(S)-(5-хлортиено[3,2-b]пиридин-2 сульфониламино)пирролидин-1-илметил]бензамидина. А. [1-(5-Циано-2-гидроксибензил)-2-оксопирролидин-3-(S)-ил]амид 5-хлортиено[3,2-b] пиридин-2-сульфоновой кислоты. Указанное в заголовке соединение получают из гидрохлорида 4-гидрокси-3-(3-(S)амино-2-оксопирролидин-1-илметил)бензонитрила так, как описано в примере 17, часть F, с использованием 5-хлортиено[3,2-b]пиридин-2 сульфонилхлорида вместо 4,6-дихлорбензо[b]тиофен-2-сульфонилхлорида. Получают продукт в виде белого твердого вещества. 1[1-(5-Циано-2-гидроксибензил)-2-оксопирролидин-3-(S)-ил]амид 5-хлортиено[3,2-b] пиридин-2-сульфоновой кислоты превращают в указанное в заголовке соединение так, как описано в примере 1, часть F. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 80% СН 3 СN/Н 2 О (0,1% ТФУ), и фракции с соответствующим продуктом лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1H ЯМР (ДМСО-d6, 300 МГц)9,03 (уш.с,2 Н), 8,93 (д, 1 Н), 8,75 (уш.с, 2 Н), 8,67 (д, 1 Н),8,11 (с, 1 Н), 7,65 (д, 1 Н), 7,59 (дд, 1 Н), 7,41 (с,1 Н), 6,97 (д, 1 Н), 4,33 (АВ, 2 Н), 4,29 (м, 1 Н),3,21 (м, 2 Н), 2,22 (м, 1 Н), 1,74 (м, 1 Н). М.-с. (IS): [M+H]+=480, 482, система линий Сl. Элементный анализ при расчете с 1,5 моль Н 2 О: вычислено: С=40,62%, Н=3,57%, N=11,27%; найдено: С=41,02%, Н=3,24%, N=10,86%. Пример 33. Бистрифторацетат 4-гидрокси 3-[2-оксо-3-(S)-(тиено[3,2-b]пиридин-2-сульфониламино)пирролидин-1-илметил]бензамидина. Трифторацетат 5-[3-(S)-(5-хлортиено[3,2b]пиридин-2-сульфониламино)-2-оксопирролидин-1-илметил]-2-гидроксибензамидина превращают в указанное в заголовке соединение так, как описано в примере 26. Реакционную смесь гидрируют при комнатной температуре в течение 7 суток. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% СН 3 СN/Н 2 О (0,1% ТФУ) до 60% СН 3 СN/Н 2 О (0,1% ТФУ), и фракции с соответствующим продуктом лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1[1-(5-Циано-2-гидроксибензил)-2-оксопирролидин-3-(S)-ил]амид 5-хлортиено[3,2-b]пиридин-2-сульфоновой кислоты превращают в указанное в заголовке соединение так, как описано в примере 27. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% CH3CN/H2O (0,1% ТФУ) до 60 80% СН 3 СN/Н 2 О (0,1% ТФУ), и фракции с соответствующим продуктом лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1[1-(2-Амино-5-цианобензил)-2-оксопирролидин-3-(S)-ил]амид 5-хлортиено[3,2-b] пиридин-2-сульфоновой кислоты. Указанное в заголовке соединение получают из дигидрохлорида 4-амино-3-(3-(S)амино-2-оксопирролидин-1-илметил)бензонитрила так, как описано в примере 17, часть F, с использованием 5-хлортиено[3,2-b]пиридин-2 сульфонилхлорида вместо 4,6-дихлорбензо[b] тиофен-2-сульфонилхлорида. Сырой продукт очищают колоночной хроматографией с элюированием с градиентом от 10% EtOAc в CH2Cl2 до 25% EtOAc в CH2Cl2, и получают белое твердое вещество. 1[1-(2-Амино-5-цианобензил)-2-оксопирролидин-3-(S)-ил]амид 5-хлортиено[3,2-b]пиридин-2-сульфоновой кислоты превращают в указанное в заголовке соединение так, как описано в примере 1, часть F. Сырой продукт очищают ВЭЖХ с обращенной фазой с элюированием с градиентом от 10% CH3CN/H2O (0,1% ТФУ) до 70% CH3CN/H2O (0,1% ТФУ), и фракции с соответствующим продуктом лиофилизуют, и получают указанное в заголовке соединение в виде белого твердого вещества. 1(с, 1H), 6,72 (д, 1 Н), 6,19 (уш.с, 2 Н), 4,33 (м, 1H),4,20 (АВ, 2 Н), 3,20 (м, 2 Н), 2,22 (м, 1H), 1,70 (м,1H). М.-с. (FAB): [M+H]+=479, 481, система линий Сl. Элементный анализ при расчете с 2,0 моль Н 2 О, 1,7 моль СF3 СО 2 Н: вычислено: С=39,49%, Н=3,10%, N=12,49%; вычислено: С=40,03%, Н=3,19%, N=12,67%.
МПК / Метки
МПК: A61P 7/00, A61K 31/381, C07D 403/02
Метки: кислот, сульфоновых, n-[(аминоиминометил)фенилалкил]азагетероцикламиды, замещенные
Код ссылки
<a href="https://eas.patents.su/30-1739-zameshhennye-n-aminoiminometilfenilalkilazageterociklamidy-sulfonovyh-kislot.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные n-[(аминоиминометил)фенилалкил]азагетероцикламиды сульфоновых кислот.</a>
Предыдущий патент: Способ и система оценивания набора данных (варианты)
Следующий патент: Способ лечения обычной простуды или аллергического ринита
Случайный патент: Пена на основе фосфата клиндамицина












