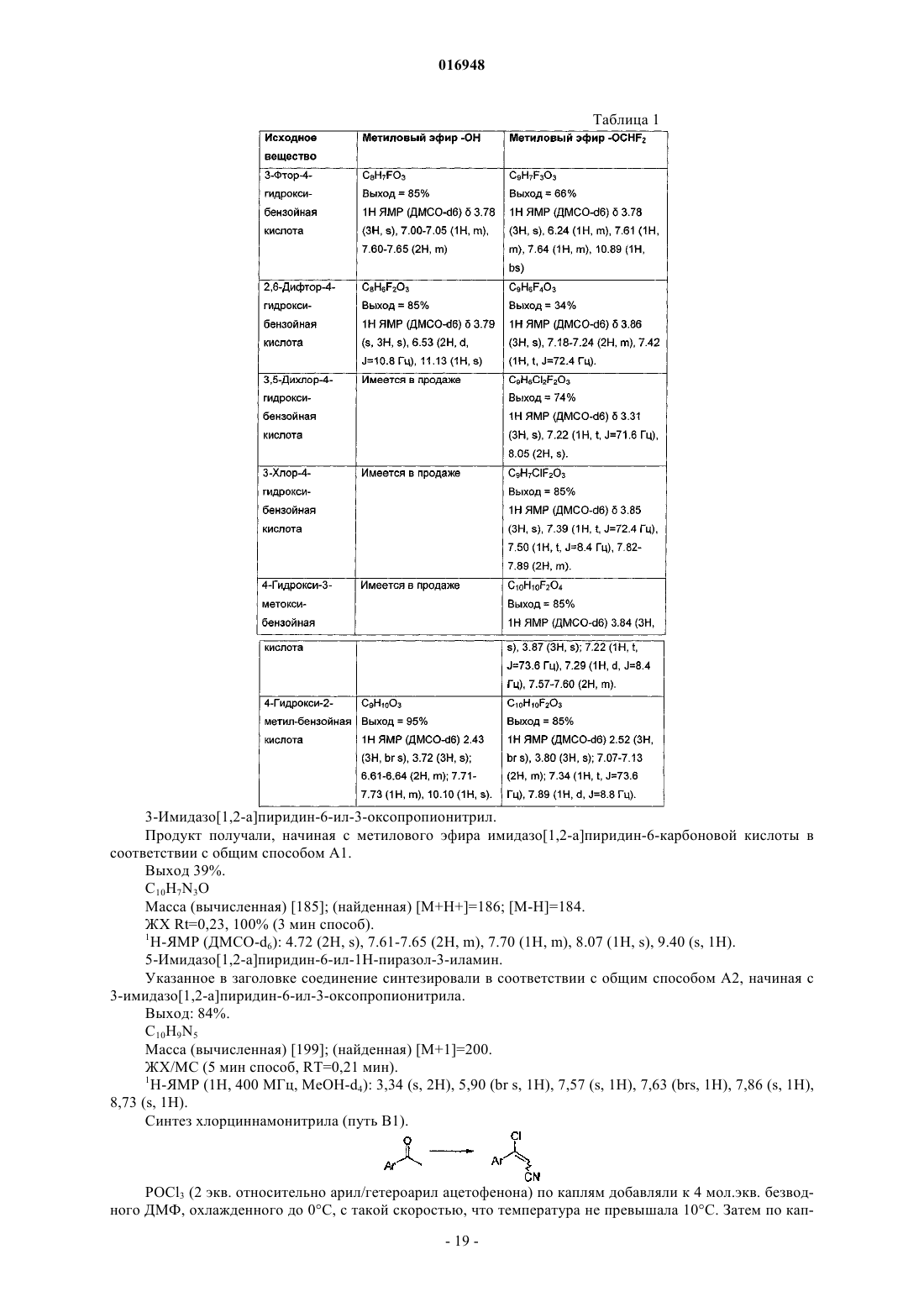
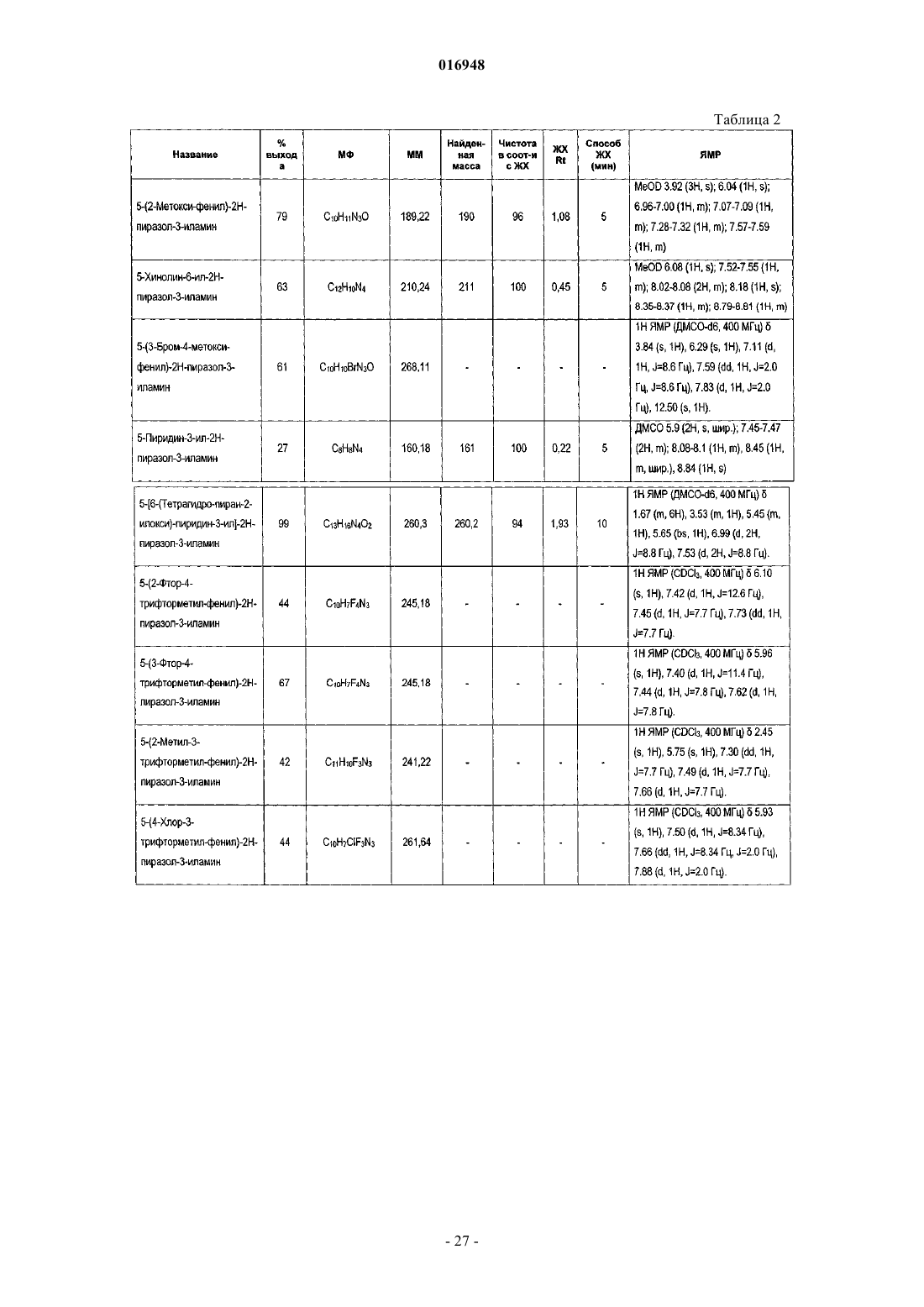
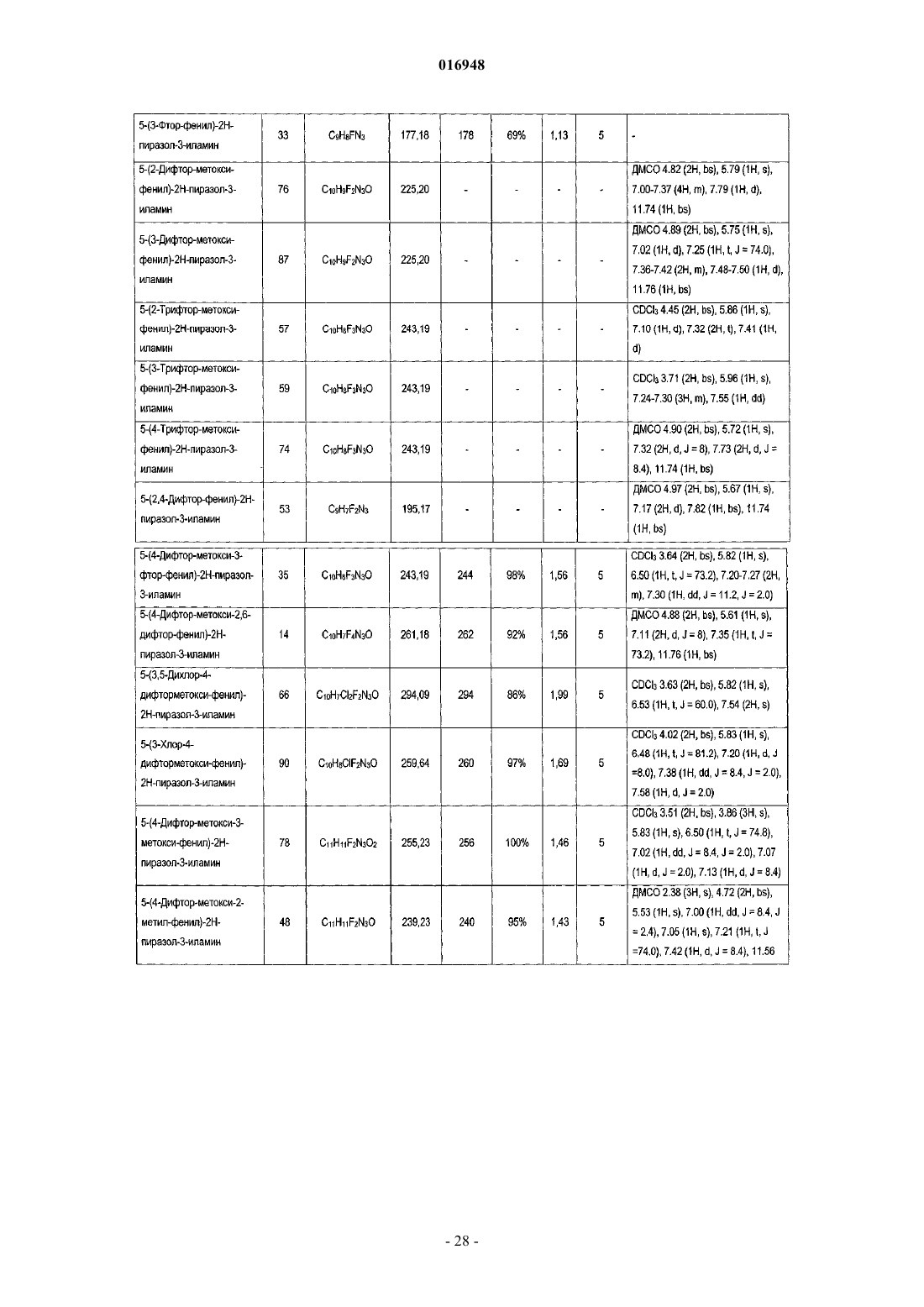
Модуляторы никотиновых ацетилхолиновых рецепторов
Номер патента: 16948
Опубликовано: 30.08.2012
Авторы: Микко Иоланда, Гаррисон Бойд, Варроне Маурицио, Хайдар Симон, Ненчини Арианна, Ботманн Хендрик, Заналетти Риккардо, Прателли Кармела, Маккари Лаура, Гирон Кьяра
Формула / Реферат
1. Соединение формулы (I)
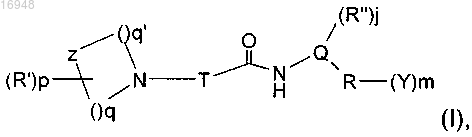
где Т представляет собой (C3-С5)алкан-α,w-диил, возможно содержащий группу оксо и возможно замещенный одним или более чем одним галогеном; гидроксигруппами; группами (С1-С5)алкил, (С1-С5)алкокси, фтор(С1-С5)алкил, гидрокси(С1-С5)алкил, (С1-С5)алкилиден, фтор(С1-С5)алкилиден; группами (С3-С6)циклоалкан-1,1-диил, окса(С3-С6)циклоалкан-1,1-диил; группами (С3-С6)циклоалкан-1,2-диил, окса(С3-С6)циклоалкан-1,2-диил, где связи 1,2-диильного радикала образуют кольцо, конденсированное с Т цепью; при условии, что когда Т содержит группу оксо, тогда она не представляет собой часть амидной связи;
z представляет собой СН2, N или О;
q и q' независимо друг от друга представляют собой целые числа от 1 до 4 при условии, что сумма q+q' не больше 6;
р равен 0, 1 или 2;
R' независимо друг от друга для р, равного 2, выбран из группы, состоящей из групп линейный (С1-С6)алкил, разветвленный или циклический (С3-С6)алкил, (С1-С6)алкокси, (С2-С6)ацил;
Q представляет собой группу формулы

R" представляет собой (С1-С3)алкил;
j равен 0 или 1;
R представляет собой 5-10-членное ароматическое или гетероароматическое кольцо, содержащее 1-2 гетероатома, выбранных из N, О, S;
m равен 0, 1, 2 или 3;
Y независимо друг от друга представляет собой, когда m больше 1, галоген; гидрокси; меркапто; циано; нитро; амино; линейный (С1-С6)алкил, разветвленный или циклический (С3-С6)алкил, тригалоген(С1-С6)алкил, ди- или тригалоген(С1-С6)алкокси, (С1-С6)алкокси или (С1-С6)алкилкарбонил; (С3-С6)циклоалкил(С1-С6)алкокси; (С3-С6)циклоалкил(С1-С6)алкил; линейный, разветвленный или циклический (С1-С6)алкокси(С1-С6)алкил; или, когда m равно 2, два заместителя Y вместе с атомами группы R, к которой они присоединены, могут образовывать -О-СН2-СН2-О-;
его соли, оптические изомеры, диастереоизомеры и рацемические смеси.
2. Соединение формулы (I) по п.1, где
Т представляет собой бутан-1,4-диил, возможно замещенный одним или более чем одним (С1-С3)алкилом, галогеном;
z представляет собой N или О;
R' независимо друг от друга для р, равного 2, выбран из группы, состоящей из групп линейный (С1-С6)алкил, разветвленный или циклический (С3-С6)алкил, (С1-С6)алкокси, (С2-С6)ацил;
Q представляет собой
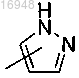
р, q, q', R", j, R, Y и m являются такими, как определено для формулы (I).
3. Соединение по п.2, где
Т представляет собой бутан-1,4-диил;
z представляет собой N или О;
R' выбран из группы, состоящей из линейного (С1-С6)алкила, разветвленного или циклического (С3-С6)алкила, (С1-С6)алкокси, (С2-С6)ацила;
р равен 0 или 1;
Q представляет собой
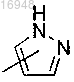
j равен 0;
R представляет собой 5-10-членное ароматическое или гетероароматическое кольцо, содержащее 1-2 гетероатома, выбранных из N, О, S;
q, q', R, Y и m являются такими, как определено для формулы (I).
4. Соединение по п.3, где
Т представляет собой бутан-1,4-диил;
z представляет собой N;
р равен 1;
R' представляет собой (С1-С6)ацил;
Q представляет собой
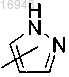
j равен 0;
R представляет собой фенил; пиридил; тиенил; индолил;
m равен 0, 1 или 2;
Y независимо друг от друга, когда m больше 1, представляет собой галоген; гидрокси; линейный (С1-С6)алкил; разветвленный или циклический (С3-С6)алкил; тригалогено(С1-С6)алкил; ди- или тригалогено(С1-С6)алкокси; (С1-С6)алкокси; (С3-С6)циклоалкил(С1-С6)алкил;
q, q' являются такими, как определено для формулы (I).
5. Соединения по п.4, где Q-R представляет собой
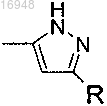
6. Соединение формулы (I) по п.1, где
Т представляет собой пропан-1,3-диил, возможно замещенный (С1-С3)алкилом, галогеном;
z представляет собой СН2, N, О;
Q представляет собой группу формулы

R', р, q, q', R", j, R, Y и m являются такими, как определено для формулы (I).
7. Соединение по п.6, где
Т представляет собой пропан-1,3-диил, возможно замещенный (С1-С3)алкилом, галогеном;
z представляет собой СН2;
Q представляет собой
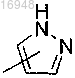
q и q' независимо друг от друга равны 1 или 2;
р равен 0 или 1;
R' выбран из группы, состоящей из линейного (С1-С6)алкила, разветвленного или циклического (С3-С6)алкила, (С1-С6)алкокси, (С2-С6)ацила;
j равен 0;
R, Y и m являются такими, как определено для формулы (I).
8. Соединение по п.7, где
Т представляет собой пропан-1,3-диил;
z представляет собой СН2;
q и q' независимо друг от друга равны 1 или 2;
р равен 0 или 1;
R' выбран из группы, состоящей из линейного (С1-С6)алкила, разветвленного или циклического (С3-С6)алкила;
Q представляет собой
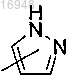
j равен 0;
R представляет собой фенил, пиридил, нафтил;
m равен 1 или 2;
Y независимо друг от друга, когда m больше 1, представляет собой галоген; гидрокси; линейный (С1-С6)алкил; разветвленный или циклический (С3-С6)алкил; тригалогено(С1-С6)алкил; ди- или тригалогено(С1-С6)алкокси; (С1-С6)алкокси; (С3-С6)циклоалкил(С1-С6)алкоксил.
9. Соединения по п.8, где Q-R представляет собой
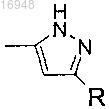
10. Соединение по п.6, где
Т представляет собой пропан-1,3-диил, возможно замещенный (С1-С3)алкилом, галогеном;
z представляет собой СН2;
Q представляет собой
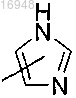
q и q' независимо друг от друга равны 1 или 2;
р равен 0 или 1;
R' выбран из группы, состоящей из линейного (С1-С6)алкила, разветвленного или циклического (С3-С6)алкила, (С1-С6)алкокси, (С2-С6)ацила;
j равен 0;
R, Y и m являются такими, как определено для формулы (I).
11. Соединение по п.10, где
Т представляет собой пропан-1,3-диил;
z представляет собой СН2;
q и q' независимо друг от друга равны 1 или 2;
р равен 0 или 1;
R' выбран из группы, состоящей из линейного (С1-С6)алкила, разветвленного или циклического (С3-С6)алкила;
Q представляет собой

j равен 0;
R представляет собой фенил, пиридил, нафтил;
m равен 1 или 2;
Y независимо друг от друга, когда m больше 1, представляет собой галоген; гидрокси; линейный (С1-С6)алкил; разветвленный или циклический (С3-С6)алкил; тригалогено(С1-С6)алкил; ди- или тригалогено(С1-С6)алкокси; (С1-С6)алкокси; (С3-С6)циклоалкил(С1-С6)алкоксил.
12. Соединение по п.11, где Q-R представляет собой
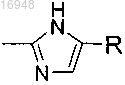
13. Фармацевтическая композиция, содержащая соединение по любому из пп.1-12 и фармацевтически приемлемый носитель или эксципиент.
14. Применение соединений по любому из пп.1-12 для изготовления лекарственного средства для лечения неврологических, нейродегенеративных, психиатрических, когнитивных, иммунологических, воспалительных, метаболических, аддиктивных, ноцицептивных и половых расстройств.
15. Применение по п.14 для лечения старческой деменции, расстройств дефицита внимания, болезни Альцгеймера и шизофрении.
16. Способ профилактики или лечения заболеваний, состояний или дисфункций, в которые вовлечен α7 nAChR (никотиновый ацетилхолиновый рецептор), включающий введение субъекту, нуждающемуся в этом, эффективного количества соединения по любому из пп.1-12.
17. Способ по п.16 для профилактики или лечения старческой деменции, расстройств дефицита внимания, болезни Альцгеймера и шизофрении.
Текст
МОДУЛЯТОРЫ НИКОТИНОВЫХ АЦЕТИЛХОЛИНОВЫХ РЕЦЕПТОРОВ В настоящем изобретении предложены соединения формулы (I) и композиции, способы их получения и способы их применения для модуляции альфа 7 никотиновых ацетилхолиновых рецепторов и/или для лечения любого из множества расстройств, заболеваний и состояний. Предложенные соединения среди прочего могут оказывать влияние на неврологические,психические и/или воспалительные состояния. 016948 Родственные заявки на изобретения В заявке на данный патент заявлен приоритет поданной ранее заявки на патент США 60/880629,поданной 16 января 2007 г., полное содержание которой включено здесь путем ссылки. Область изобретения Настоящее изобретение относится к соединениям, обладающим агонистической активностью в отношении альфа 7 никотинового ацетилхолинового рецептора (7 nAChR), способам их получения, содержащим их фармацевтическим композициям и их применению для лечения неврологических, психиатрических, воспалительных заболеваний. Предшествующий уровень техники Показано, что агенты, которые связываются с никотиновыми ацетилхолиновыми рецепторами, полезны при лечении и/или профилактике различных заболеваний и состояний, в частности психических заболеваний, нейродегенеративных заболеваний, в которые вовлечена дисфункция холинергической системы, и состояний нарушения памяти и/или когнитивных нарушений, включая, например, шизофрению,тревогу, манию, депрессию, маниакальную депрессию, синдром Туретта, болезнь Паркинсона, болезнь Гентингтона, когнитивные расстройства (такие как болезнь Альцгеймера, деменция с тельцами Леви,боковой амиотрофический склероз, нарушение памяти, утрата памяти, когнитивный дефицит, дефицит внимания, расстройство дефицита внимания с гиперактивностью), и в других применениях, таких как лечение никотиновой зависимости, включая отказ от курения, лечение боли (например, применение для обезболивания), обеспечение нейропротекции и лечение нарушения суточного ритма. См., например,WO 97/30998; WO 99/03850; WO 00/42044; WO 01/36417; Holladay et al., J. Med. Chem., 40:26, 4169-94(1997); Schmitt et al., Annual Reports Med. Chem., Chapter 5, 41-51 (2000); Stevens et al., Psychopharmatology (1998), 136:320-27; Shytle et al., Molecular Psychiatry (2002), 7, p. 525-535. Описаны различные гетероциклические соединения, несущие основной атом азота и демонстрирующие аффинность в отношении никотинового и мускаринового ацетилхолинового рецептора или заявленные для применения при болезни Альцгеймера, например 1 Н-пиразол и пиррол-азабициклические соединения (WO 2004013137); никотиновые ацетилхолиновые агонисты (WO 2004039366); уреидопиразольные производные (WO 0112188); оксадиазольные производные, обладающие активностью, ингибирующей ацетилхолинэстеразу, и мускариновой агонистической активностью (WO 9313083); амидные производные пиразол-3-карбоновой кислоты в качестве фармацевтических соединений(WO 2006077428); арилпиперидины (WO 2004006924); уреидоалкилпиперидины (US 6605623); соединения, обладающие активностью в отношении мускариновых рецепторов (WO 9950247). Дополнительно,модуляторы 7 никотинового ацетилхолинового рецептора раскрыты в WO 06008133 под именем того же самого заявителя. Краткое изложение сущности изобретения Среди прочего в изобретении предложены новые соединения, действующие как полные или частичные агонисты 7 nAChR, фармацевтические композиции, содержащие те же самые соединения, и их применение для лечения заболеваний, при которых полезна активация 7 никотинового ацетилхолинового рецептора, таких как неврологические, нейродегенеративные, психиатрические, когнитивные, иммунологические, воспалительные, метаболические, аддиктивные, ноцицептивные и половые расстройства, в частности болезни Альцгеймера, шизофрении и/или других. Краткое описание графических материалов Фиг. 1: рентгеновские картины для различных кристаллических форм соли гидрохлорида. Фиг. 2: изображение различных кристаллических форм соли гидрохлорида, полученное при помощи ДСК (дифференциальной сканирующей калориметрии). Фиг. 3: ТГА (термогравиметрический анализ) различных кристаллических форм соли гидрохлорида. Фиг. 4: ДСП (динамическая сорбция паров) соли моно-HCl (нет изменения формы после теста ДСП). Фиг. 5: ДСП соли гидрохлорида (кристалл II) (нет изменения формы после теста ДСП). Фиг. 6: ДСП соли гидрохлорида (кристалл III) (данные по заранее выбранной минуте); Фиг. 7: ДСП соли гидрохлорида (кристалл V). Фиг. 8: действие рН и эквивалента HCl на формирование соли HCl. Фиг. 9: действие рН и эквивалента HCl на формирование соли HCl. Фиг. 10: превращение более высоких солей в моно-HCl кристалл I. 259 мг соль ди-HCl суспендировали в 4 объемах ацетона + 0,5 объема этанола ASDQ при комнатной температуре. Получающаяся в результате суспензия позволила получить рН приблизительно 2. Для увеличения рН добавляли 0,02 мл 30%NaOH, что увеличивало рН до 5-5,5. Суспензию перемешивали в течение ночи и превращали в моно-HCl. Получали 173 мг моно-HCl. Фиг. 11: превращение моно-HCl в форму II путем уменьшения рН (суспендирование в течение ночи). Фиг. 12: ДСК изображение формы I соли гидрохлорида 5-(4-ацетил-1,4-диазепан-1-ил)-N-(5-(4-1 016948 метоксифенил)-1 Н-пиразол-3-ил)пентанамида. Фиг. 13: ТГА термограмма формы I соли гидрохлорида 5-(4-ацетил-1,4-диазепан-1-ил)-N-(5-(4 метоксифенил)-1 Н-пиразол-3-ил)пентанамида. Фиг. 14: картина дифракции рентгеновских лучей для формы I соли гидрохлорида 5-(4-ацетил-1,4 диазепан-1-ил)-N-(5-(4-метоксифенил)-1 Н-пиразол-3-ил)пентанамида. Фиг. 15: ДСП изотермальный анализ формы I соли гидрохлорида 5-(4-ацетил-1,4-диазепан-1-ил)-N(5-(4-метоксифенил)-1 Н-пиразол-3-ил)пентанамида. Фиг. 16: изображение формы II соли гидрохлорида 5-(4-ацетил-1,4-диазепан-1-ил)-N-(5-(4 метоксифенил)-1 Н-пиразол-3-ил)пентанамида, полученное с помощью ДСК. Фиг. 17: ТГА термограмма формы II соли гидрохлорида 5-(4-ацетил-1,4-диазепан-1-ил)-N-(5-(4 метоксифенил)-1 Н-пиразол-3-ил)пентанамида. Фиг. 18: картина дифракции рентгеновских лучей для формы II соли гидрохлорида 5-(4-ацетил-1,4 диазепан-1-ил)-N-(5-(4-метоксифенил)-1 Н-пиразол-3-ил)пентанамида. Фиг. 19: ДСП изотермальный анализ формы II соли гидрохлорида 5-(4-ацетил-1,4-диазепан-1-ил)N-(5-(4-метоксифенил)-1 Н-пиразол-3-ил)пентанамида. Описание некоторых конкретных воплощений Соединения В первом аспекте изобретения предложено соединение формулы (I) где Т представляет собой (C3-С 5)алкан-,-диил, возможно несущий группу оксо и возможно замещенный одним или более чем одним галогеном; гидроксигруппами; группами (C1-C5)алкил, (C1C5)алкокси, фтор(C1-C5)алкил, гидрокси(С 1-С 5)алкил, (С 1-С 5)алкилиден, фтор(C1-C5)алкилиден; группами(С 3-С 6)циклоалкан-1,1-диил, окса(С 3-С 6)циклоалкан-1,1-диил; группами (С 3-С 6)циклоалкан-1,2-диил, окса(С 3-С 6)циклоалкан-1,2-диил, где связи 1,2-диильного радикала образуют кольцо, конденсированное с Т цепью; при условии, что когда Т несет группу оксо, тогда она не представляет собой часть амидной связи;z представляет собой СН 2, N или О;q и q' независимо друг от друга представляют собой целые числа от 1 до 4 при условии, что суммаR' независимо друг от друга для р, равного 2, выбран из группы, состоящей из групп линейный, разветвленный или циклический (C1-С 6)алкил, (C1-С 6)алкокси, (С 2-С 6)ацил;Q представляет собой группу формулыR представляет собой 5-10-членное ароматическое или гетероароматическое кольцо, содержащее 12 гетероатома, выбранных из N, О, S;Y независимо друг от друга представляет собой, когда m больше 1, галоген; гидрокси; меркапто; циано; нитро; амино; линейный, разветвленный или циклический (C1-C6)алкил; тригалоген(C1-C6)алкил; ди- или тригалоген(C1-С 6)алкокси; (C1-С 6)алкокси или (C1-С 6)алкилкарбонил; (С 3-С 6)циклоалкил(С 1 С 6)алкокси; (C3-C6)циклоалкил(С 1-С 6)алкил; линейный, разветвленный или циклический (С 1-С 6)алкокси(C1-С 6)алкил; или, когда m равно 2, два заместителя Y вместе с атомами группы R, к которой они присоединены, могут образовывать -О-СН 2-СН 2-О-; его соли, оптические изомеры, диастереоизомеры и рацемические смеси. В первом предпочтительном воплощении в изобретении предложены соединения формулы (I), где Т представляет собой бутан-1,4-диил, возможно замещенный одним или более чем одним (C1C3)алкилом, галогеном;R' независимо друг от друга для р, равного 2, выбран из группы, состоящей из групп линейный, разветвленный или циклический (C1-C6)алкил, (C1-С 6)алкокси, (С 2-С 6)ацил;Q представляет собой р, q, q', R", j, R, Y и m являются такими, как определено для формулы (I). В этом воплощении особенно предпочтительные соединения формулы (I) представляют собой со-2 016948 единения, где Т представляет собой бутан-1,4-диил;R' выбран из группы, состоящей из линейного, разветвленного или циклического (С 1-С 6)алкила,(С 1-С 6)алкокси, (C2-C6)ацила; р равен 0 или 1;R представляет собой 5-10-членное ароматическое или гетероароматическое кольцо, содержащее 12 гетероатома, выбранных из N, О, S;q, q', R, Y и m являются такими, как определено для формулы (I). Еще одна группа особенно предпочтительных соединений представляет собой группу, где Т представляет собой бутан-1,4-диил;Y независимо друг от друга, когда m больше 1, представляет собой галоген; гидрокси; линейный,разветвленный или циклический (C1-C6)алкил; тригалогено(C1-C6)алкил; ди- или тригалогено(C1C6)алкокси; (C1-C6)алкокси; (C3-C6)циклоалкил(C1-C6)алкил;q, q' являются такими, как определено для формулы (I). В еще одном предпочтительном воплощении в изобретении предложены соединения, далее названные G1 формулы (I), где Т представляет собой пропан-1,3-диил, возможно замещенный (C1-C3)алкилом, галогеном;Q представляет собой группу формулыR', р, q, q', R", j, R, Y и m являются такими, как определено для формулы (I). В G1 особенно предпочтительные соединения формулы (I) представляют собой соединения, где Т представляет собой пропан-1,3-диил, возможно замещенный (C1-С 3)алкилом, галогеном;q и q' независимо друг от друга равны 1 или 2; р равен 0 или 1;R' выбран из группы, состоящей из линейного, разветвленного или циклического (C1-C6)алкила,(C1-C6)алкокси, (C2-C6)ацила;R, Y и m являются такими, как определено для формулы (I). В G1 еще одна группа особенно предпочтительных соединений представляет собой группу, где Т представляет собой пропан-1,3-диил;z представляет собой СН 2;q и q' независимо друг от друга равны 1 или 2; р равен 0 или 1;R' выбран из группы, состоящей из линейного, разветвленного или циклического (C1-C6)алкила;Y независимо друг от друга, когда m больше 1, представляет собой галоген; гидрокси; линейный,разветвленный или циклический (C1-C6)алкил; тригалогено(C1-C6)алкил; ди- или тригалогено(C1-3 016948C6)алкокси; (C1-C6)алкокси; (С 3-С 6)циклоалкил(C1-C6)алкоксил. В этой группе некоторые заявленные соединения представляют собой соединения, где Q-R пред. ставляет собой В G1 оказывается еще одна группа предпочтительных соединений формулы (I), где Т представляет собой пропан-1,3-диил, возможно замещенный (C1-С 3)алкилом, галогеном;z представляет собой СН 2;q и q' независимо друг от друга равны 1 или 2; р равен 0 или 1;R' выбран из группы, состоящей из линейного, разветвленного или циклического (С 1-С 6)алкила,(С 1-С 6)алкокси, (С 2-С 6)ацила;R, Y и m являются такими, как определено для формулы (I). Четвертая группа предпочтительных соединений G1 представляют собой соединения, где Т представляет собой пропан-1,3-диил;z представляет собой СН 2;q и q' независимо друг от друга равны 1 или 2; р равен 0 или 1;R' выбран из группы, состоящей из линейного, разветвленного или циклического (С 1-С 6)алкила;Y независимо друг от друга, когда m больше 1, представляет собой галоген; гидрокси; линейный,разветвленный или циклический (С 1-С 6)алкил; тригалогено(С 1-С 6)алкил; ди- или тригалогено(С 1 С 6)алкокси; (С 1-С 6)алкокси; (С 3-С 6)циклоалкил(С 1-С 6)алкоксил. В этой группе наиболее предпочтительные соединения представляют собой соединения, где Q-R представляет собой. Как будет хорошо понятно специалистам в данной области техники, известно, что пиразолы и имидазолы с незамещенным кольцевым атомом азота, как в соединениях по настоящему изобретению, быстро уравновешиваются в растворе в виде смесей обоих таутомеров: таким образом, в следующем описании, когда только один таутомер указан для соединений формулы (I), предполагается, что другой таутомер также находится в объеме настоящего изобретения. Соединения по изобретению могут находиться в форме свободных оснований или солей присоединения кислот, предпочтительно солей с фармацевтически приемлемыми кислотами. В изобретении также предложены выделенные изомеры и диастереоизомеры соединений формулы (I) или их смеси (например,рацемические и диастереоизомерные смеси), а также изотопные варианты. Фармакологическая активность типичной группы соединений формулы (I) продемонстрирована в анализе in vitro с использованием клеток, стабильно трансфицируемых 7 никотиновым ацетилхолиновым рецептором, и клеток, экспрессирующих 1 и 3 никотиновые ацетилхолиновые рецепторы и 5-НТ 3 рецептор в качестве контролей избирательности. Соединения формулы (I) могут быть предложены в соответствии с настоящим изобретением в любой из множества полезных форм, например в виде фармацевтически приемлемых солей, в виде конкретных кристаллических форм и т.д. В некоторых воплощениях предложены пролекарства одного или более чем одного соединения формулы (I). Различные формы пролекарств известны в области техники,например, как обсуждается в Bundgaard (ed.), Design of Prodrugs, Elsevier (1985); Widder et al. (ed.), Methods in Enzymology, vol. 4, Academic Press (1985); Kgrogsgaard-Larsen et al. (ed.); "Design and Application of-4 016948 Применения Агенты, связывающиеся с никотиновыми ацетилхолиновыми рецепторами, показаны в качестве полезных агентов при лечении и/или профилактике различных заболеваний и состояний, в частности психических заболеваний, нейродегенеративных заболеваний, в которые вовлечена дисфункция холинергической системы, и состояний нарушения памяти и/или когнитивных нарушений, включая, например, шизофрению, тревогу, манию, депрессию, маниакальную депрессию, синдром Туретта, болезнь Паркинсона, болезнь Гентингтона, когнитивные расстройства (такие как болезнь Альцгеймера, деменция с тельцами Леви, боковой амиотрофический склероз, нарушение памяти, утрата памяти, когнитивный дефицит,дефицит внимания, расстройство дефицита внимания с гиперактивностью), и в других применениях, таких как лечение никотиновой зависимости, включая отказ от курения, лечение боли (т.е. применение для обезболивания), обеспечение нейропротекции и лечение нарушения суточного ритма. См., например,WO 97/30998; WO 99/03850; WO 00/42044; WO 01/36417; Holladay et al., J. Med. Chem., 40:26, 4169-94(1997); Schmitt et al., Annual Reports Med. Chem., Chapter 5, 41-51 (2000); Stevens et al., Psychopharmacology (1998), 136:320-27; Shytle et al., Molecular Psychiatry (2002), 7, p. 525-535. Таким образом, в соответствии с изобретением предложен способ лечения пациента, в особенности человека, страдающего любым психическим заболеванием, нейродегенеративным заболеванием, в которое вовлечена дисфункция холинергической системы, и/или состоянием нарушения памяти и/или когнитивных нарушений, включая, например, шизофрению, тревогу, манию, депрессию, маниакальную депрессию, синдром Туретта, болезнь Паркинсона, болезнь Гентингтона и/или когнитивные расстройства(такие как болезнь Альцгеймера, деменция с тельцами Леви, боковой амиотрофический склероз, нарушение памяти, утрата памяти, когнитивный дефицит, дефицит внимания, расстройство дефицита внимания с гиперактивностью), включающий введение пациенту эффективного количества соединения формулы (I). Нейродегенеративные расстройства, лечение которых включено в способы по настоящему изобретению, включают лечение и/или профилактику болезни Альцгеймера, болезни Пика (Friedland, Dementia(1993), 192-203; Procter, Dement Geriatr Cogn Disord. (1999), 80-4; Sparks, Arch Neural. (1991), 796-9; Mizukami, Acta Neuropathol. (1989), 52-6; Hansen, Am J. Pathol. (1988), 507-18), болезни диффузных телец Леви, прогрессирующего супрануклеарного паралича (Steel-Richardson syndrome, см. Whitehouse, J. Neural Transm Suppl. (1987), 24:175-82; Whitehouse, Arch Neural. (1988), 45(7):722-4; Whitehouse, AlzheimerDis Assoc Disord. 1995; 9 Suppl 2:3-5; Warren, Brain. 2005 Feb; 128 (Pt 2):239-49), мультисистемной дегенерации (синдрома Шая-Дрейджера), заболеваний моторных нейронов, включая боковой амиотрофический склероз (Nakamizo, Biochem Biophys Res Commun. (2005), 330(4), 1285-9; Messi, FEBS Lett. (1997),411(1):32-8; Mohammadi, Muscle Nerve. (2002), Oct; 26(4):539-45; Hanagasi, Brain Res Cogn Brain Res.(2002), 14(2):234-44; Crochemore, Neurochem Int. (2005), 46(5):357-68), дегенеративных атаксий, кортикальной базальной дегенерации, комплекса острова Гуам БАС (боковой амиотрофический склероз)болезнь Паркинсона-деменция, подострого склерозирующего панэнцефалита, болезни Гентингтона (Kanazawa, J. Neural Sci. (1985), 151-65; Manyam, J. Neural. (1990), 281-4; Lange, J. Neural. (1992), 103-4; Vetter, J. Neurochem. (2003), 1054-63; De Tommaso, Mov Disord. (2004), 1516-8; Smith, Hum Mol Genet. (2006),3119-31; Cubo, Neurology. (2006), 1268-71), болезни Паркинсона, синуклеинопатий, первичной прогрессирующей афазии, стриатонигральной дегенерации, болезни Мачадо-Джозефа/спинальноцеребеллярной атаксии 3 типа, оливопонтоцеребеллярных дегенерации, синдрома Жилль де ла Туретта, бульбулярного,псевдобульбарного паралича, атрофии мышц спины, спинобульбарной мышечной атрофии (болезни Кеннеди), первичного бокового склероза, семейной спастической параплегии, болезни ВерднигаГоффманна, болезни Кугельберга-Веландер, болезни Тея-Сакса, болезни Сандгоффа, семейной спастической болезни, болезни Вольфарта-Кугельберга-Веландера, спастического парапареза, прогрессирующей мультифокальной лейкоэнцефалопатии, прионовых заболеваний (такие как болезнь КрейтцфельдаЯкоба, болезни Герстмана-Страуслера-Шейнкера, Куру и фатальной семейной бессонницы), и нейродегенеративных расстройств, возникающих в результате ишемии или инфаркта головного мозга, включая эмболическую окклюзию и тромботическую окклюзию, а также внутричерепного кровотечения любого типа (включая эпидуральное, субдуральное, субарахноидальное и внутримозговое, но не ограничивающегося ими), и внутричерепных и внутрипозвоночных поражений (включая контузию, прободение, смещение, сдавливание и разрыв, но не ограничивающихся ими), но не ограничиваются ими. Дополнительно агонисты рецептора 7 nACh, такие как соединения по настоящему изобретению,могут быть использованы для лечения возрастной деменции и других деменций и состояний с утратой памяти, включая возрастную утрату памяти, старение, сосудистую деменцию, диффузное заболевание белого вещества (болезни Бинсвангера), деменции эндокринной или метаболической природы, деменции в результате травмы головы и диффузного повреждения головного мозга, деменции боксеров, деменции,связанной с алкоголизмом (синдрома Корсакова) и деменции лобной доли. См., например, WO 99/62505,Tomimoto Dement Geriatr Cogn Disord. (2005), 282-8; Tohgi - J. Neural Transm. (1996), 1211-20; Casamenti,Neuroscience (1993), 465-71, Kopelman, Br J. Psychiatry (1995), 154-73; Cochrane, Alcohol Alcohol. (2005),151-4).-5 016948 Известно, что амилоидный белок-предшественник (АРР) и его производные А пептиды, например А 1-42 и другие фрагменты, вовлечены в патологию болезни Альцгеймера. Пептиды А 1-42 не только вовлечены в нейротоксичность, но также, как известно, ингибируют холинергическую медиаторную функцию. Кроме того, определили, что А пептиды связываются с рецепторами 7 nACh. Воспалительный рефлекс представляет собой ответ вегетативной нервной системы на воспалительный сигнал. После восприятия воспалительного стимула вегетативная нервная система отвечает через блуждающий нерв путем высвобождения ацетилхолина и активирования никотиновых 7 рецепторов на макрофагах. Эти макрофаги, в свою очередь, высвобождают цитокины. Дисфункции в этом пути связаны с воспалительными заболеваниями у людей, включая ревматоидный артрит, сахарный диабет и сепсис. Макрофаги экспрессируют никотиновый 7 рецептор, и вероятно именно этот рецептор опосредует холинергический противовоспалительный ответ. См., например, Czura, С.J. et al., J. Intern. Med. (2005), 257(2), 156-66;Wang, H. et al. Nature (2003), 421:384-388; de Jonge British Journal of Pharmacology (2007), 151, 915-929. Акросомная реакция сперматозоида млекопитающих представляет собой экзоцитоз, важный при оплодотворении яйцеклетки сперматозоидом. Как было показано, активация 7 nACh на клетках сперматозоидов является важной для акросомной реакции (Son, J.-H. And Meizel, S. Biol. Reproduct. 68:1348-1353,2003). Кроме того, никотиновые рецепторы играют роль в ответе тела на всасывание алкоголя. Поэтому агонисты 7 nACh рецепторов, такие как соединения, предложенные здесь, полезны при лечении таких нарушений, заболеваний и состояний. Например, агонисты подтипов рецептора 7 nACh также могут быть использованы при лечении никотиновой зависимости, включая отказ от курения, лечение боли и лечение нарушений суточного ритма, ожирения, сахарного диабета, половых и репродуктивных расстройств (например, преждевременной эякуляции или вагинальной сухости, см. US 6448276), наркотической зависимости (Solinas, Journal ofNeuroscience (2007), 27(21), 5615-5620) и воспаления (Wang H., et al. (2003), Nature 421:384-388). Множество недавних наблюдений указывает на потенциальный нейропротективный эффект никотина при множестве моделей нейродегенерации у животных и в культивируемых клетках, включающих эксцитотоксические инсульты (Prendergast, M.A., et al. Med. Sci. Monit. (2001), 7, 1153-1160; Garrido, R.,et al. (2001), J. Neurochem. 76, 1395-1403; Semba, J., et al. (1996), Brain Res. 735, 335-338; Shimohama, S., etKihara, Т., et al. (1997), Ann. Neurol. 42, 159-163; Kihara, Т., et al. (2001), J. Biol. Chem. 276, 13541-13546) и опосредованную агрегацией белков нейрональную дегенерацию (Kelton, M.С. et al. (2000), Brain Cogn 43,274-282). Во многих случаях, когда никотин демонстрирует нейропротективное действие, имеет место прямое вовлечение рецепторов, включающих подтип 7 (Shimohama, S. et al. (1998), Brain Res. 779, 359363; Kihara, Т., et al. (2001), J. Biol. Chem. 276, 13541-13546; Kelton, M.C., et al. (2000), Brain Cogn 43, 274282; Kem, W.R. (2000), Behav. Brain Res. 113, 169-181; Dajas-Bailador, F.A., et al. (2000), Neuropharmacology 39, 2799-2807; Strahlendorf, J.C., et al. (2001), Brain Res. 901, 71-78), что предполагает, что активация никотиновых ацетилхолиновых рецепторов, содержащих подтип 7, может представлять собой инструмент, опосредующий нейропротективные эффекты никотина. Доступные данные предполагают, что 7 никотиновый ацетилхолиновый рецептор представляет собой подходящую молекулярную мишень для разработки агонистических/положительных модуляторов, активных в качестве нейропротективных молекул. Действительно, агонисты 7 никотинового рецептора идентифицированы и оцениваются в качестве образцов для разработки нейропротективных лекарств (Jonnala, R.R., et al. (2002), Life Sci. 70, 15431554; Bencherif, M., et al. (2000), Eur. J. Pharmacol. 409, 45-55; Donnelly-Roberts, D.L., et al. (1996), Brain(2003), J. Neuroscience 23, 10093-10099). Описанные здесь соединения могут быть использованы для лечения таких заболеваний. В соответствии с изобретением предложен способ лечения пациента, в особенности человека, страдающего от возрастной деменции и других деменций и состояний, сопровождающихся утратой памяти,включающий введение пациенту эффективного количества соединения формулы (I). Настоящее изобретение включает способы лечения пациентов, страдающих от нарушения памяти вследствие, например, умеренного когнитивного нарушения ввиду старения, болезни Альцгеймера, шизофрении, болезни Паркинсона, болезни Гентингтона, болезни Пика, болезни Крейтцфельдта-Якоба, депрессии, старения, травмы головы, инсульта, гипоксии ЦНС (центральной нервной системы), старения головного мозга, мультиинфарктной деменции и других неврологических состояний, а также HIV (вирус иммунодефицита человека) и сердечно-сосудистых заболеваний, включающие введение эффективного количества соединения формулы (I). В соответствии с воплощением изобретения предложен способ лечения и/или профилактики деменции у пациента, страдающего болезнью Альцгеймера, включающий введение субъекту терапевтически эффективного количества соединения формулы (I) для ингибирования связывания амилоидного бета-6 016948 пептида (предпочтительно, А 1-42) с рецепторами nACh, предпочтительно рецепторами 7 nACh, наиболее предпочтительно человеческими рецепторами 7 nACh (a также способ лечения и/или профилактики других клинических проявлений болезни Альцгеймера, которые включают когнитивный и речевой дефициты, апраксии, депрессию, бредовые идеи и другие нейропсихические симптомы и показатели, и аномалии движений и походки, но не ограничиваются ими). В настоящем изобретении также предложены способы лечения других амилоидозов, например врожденной ангиопатии головного мозга, ненейропатического врожденного амилоидоза, синдрома Дауна,макроглобулинемии, вторичной семейной средиземноморской лихорадки, синдром Макла-Уэлса, множественной миеломы, панкреатического и сердечного амилоидоза, хронической гемодиализной антропатии и амилоидоза финского типа и типа Айова. Дополнительно никотиновые рецептор играют роль в ответе организма на прием алкоголя. Таким образом, агонисты рецепторов 7 nACh могут быть использованы при лечении алкогольной абстиненции и при противоинтоксикационной терапии. Таким образом, в соответствии с воплощением по изобретению предложен способ лечения пациента с алкогольной абстиненцией, или оказания пациенту противоинтоксикационной терапии, включающий введение пациенту эффективного количества соединения формулы (I). Агонисты подтипов рецептора 7 nACh также могут быть использованы для нейропротекции против нарушения, ассоциированного с инсультом и ишемией, и вызванной глутаматом эксайтотоксичностью. Таким образом, в соответствии с воплощением по изобретению предложен способ лечения пациента, обеспечивающий нейропротекцию против повреждения, ассоциированного с инсультами и ишемией,и вызванной глутаматом эксайтотоксичностью, включающий введение пациенту эффективного количества соединения формулы (I). Агонисты подтипов рецептора 7 nACh также могут быть использованы при лечении никотиновой зависимости, включая отказ от курения, лечении боли и лечении смены суточного ритма, ожирения, сахарного диабета, половых и репродуктивных расстройств (например, преждевременной эякуляции или вагинальной сухости, см. US 6448276), злоупотребления лекарственными средствами (Solinas, Journal ofNeuroscience (2007), 27(21), 5615-5620) и воспаления. Таким образом, в соответствии с воплощением изобретения предложен способ лечения пациента, страдающего от никотиновой зависимости, боли, нарушений смены суточного ритма, ожирения и/или сахарного диабета, или способ стимулирования отказа от курения у пациента, включающий введение пациенту эффективного количества соединения формулы(I). Воспалительный рефлекс представляет собой ответ вегетативной нервной системы на воспалительный сигнал. После восприятия воспалительного стимула вегетативная нервная система реагирует через блуждающий нерв путем высвобождения ацетилхолина и активации никотиновых 7 рецепторов на макрофагах. Эти макрофаги, в свою очередь, высвобождают цитокины. Дисфункции этого пути связаны с воспалительными заболеваниями у людей, включая ревматоидный артрит, сахарный диабет и сепсис. Макрофаги экспрессируют никотиновый 7 рецептор и вероятно именно этот рецептор опосредует холинергический противовоспалительный ответ. Таким образом, соединения, обладающие аффинностью в отношении рецептора 7 nACh на макрофагах, могут быть полезны при воспалительных заболеваниях у людей, включая ревматоидный артрит, сахарный диабет и сепсис. См., например Czura, С.J. et al., J. Intern. Med. (2005), 257(2), 156-66, Wang, H. et al. Nature (2003), 421:384-388; de Jonge British Journal ofPharmacology (2007), 151, 915-929. Таким образом, в соответствии с воплощением изобретения предложен способ лечения пациента(например, млекопитающего, такого как человек), страдающего воспалительным заболеванием, таким как ревматоидный артрит, сахарный диабет или сепсис, но не ограничиваясь ими, включающий введение пациенту эффективного количества соединения формулы (I). Акросомальная реакция сперматозоидов млекопитающих представляет собой процесс экзоцитоза,важный для оплодотворения яйцеклетки сперматозоидами. Показано, что активация 7 nAChR на сперматозоиде является важной для акросомальной реакции (Son, J.-H. and Meizel, S. Biol. Reproduct. 68:13481353, 2003). Следовательно, селективные агенты 7 полезны при лечении репродуктивных расстройств. Дополнительно, ввиду своей аффинности в отношении рецепторов 7 nACh, меченые производные соединений формулы (I) (например, производные, меченые C11 или F18) могут быть использованы при нейровизуализации рецепторов, например, в головном мозге. Таким образом, путем применения таких меченых агентов может быть осуществлена in vivo визуализация рецепторов с использованием, например, визуализации путем PET (позитронно-эмиссионной томографии). Состояние нарушения памяти проявляется путем нарушения способности к восприятию новой информации и/или неспособностью воспроизводить ранее воспринятую информацию. Нарушение памяти представляет первичный симптом деменции и также может представлять собой симптом, ассоциированный с такими заболеваниями, как болезнь Альцгеймера, шизофрения, болезнь Паркинсона, болезнь Гентингтона, болезни Пика, болезнь Крейтцфельда-Якоба, HIV, сердечно-сосудистое заболевание и травма головы, а также возрастное когнитивное расстройство.-7 016948 Таким образом, в соответствии с воплощением изобретения предложен способ лечения пациента,страдающего, например, от умеренного когнитивного нарушения (MCI), сосудистой деменции (VaD),возрастного когнитивного ухудшения (AACD), амнезии, ассоциированной с открытой операцией на сердце, остановкой сердца и/или общей анестезией, дефицитов памяти ввиду раннего воздействия анестезирующих агентов, депривации сна, вызванной когнитивным нарушением, синдрома хронической усталости, нарколепсии, деменции, связанной со СПИД (синдром приобретенного иммунодефицита),связанного с эпилепсией когнитивного нарушения, синдрома Дауна, деменции, связанной с алкоголизмом (синдром Корсакова), вызванных лекарственными средствами/веществами нарушений памяти, деменции боксеров (синдрома боксеров) и деменции у животных (например, у собак, кошек, лошадей и т.д.), включающий введение пациенту эффективного количества соединения формулы (I). Доза соединений для применения в терапии может варьировать в зависимости, например, от пути введения, природы и тяжести заболевания. Как правило, приемлемое фармакологическое действие у людей может быть получено с суточными дозами, находящимися в диапазоне от 0,01 до 200 мг/кг. В некоторых воплощениях по настоящему изобретению одно или более чем одно соединение формулы (I) вводят в комбинации с одним или более чем одним другим фармацевтически активным агентом. Используемая здесь фраза "в комбинации" относится к агентам, которые одновременно вводят субъекту. Понятно, что два или более чем два агента рассматривают как водимые "в комбинации", когда субъект одновременно подвергается воздействию обоих (или более чем двух) агентов. Каждый из двух или более чем двух агентов может быть введен в соответствии с различными схемами приема; не требуется, чтобы индивидуальные дозы различных агентов вводили одновременно или в одной и той же композиции. Скорее, до тех пор, пока оба (или более чем два) агента остаются в организме субъекта, их рассматривают как вводимые "в комбинации". Например, соединения формулы (I) в описанных здесь формах могут быть введены в комбинации с одним или более чем одним другим модулятором 7 никотиновых ацетилхолиновых рецепторов. Альтернативно или дополнительно, соединения формулы (I) в описанных здесь формах могут быть введены в комбинации с одним или более чем одним другим антипсихотическим агентом, болеутоляющим средством, противовоспалительным или другим фармацевтически активным агентом. Эффективные количества широкого диапазона других фармацевтически активных агентов хорошо известны специалистам в данной области техники. Тем не менее, в компетенции специалиста в данной области техники определить оптимальный эффективный диапазон значений других фармацевтически активных агентов. Соединение формулы (I) и другие фармацевтически активные агенты могут действовать аддитивно или, в некоторых воплощениях, синергетически. В некоторых воплощениях по изобретению, когда животному вводят еще один фармацевтически активный агент, эффективное количество соединения формулы (I) является меньшим, чем было бы его эффективное количество, если бы другой фармацевтически активный агент не вводили. В этом случае, не желая быть связанными теорией, полагают, что соединение формулы (I) и другой фармацевтически активный агент действуют синергетически. В некоторых случаях, пациента, нуждающегося в лечении, лечат одним или более чем одним другим фармацевтически активным агентом. В некоторых случаях, пациента, нуждающегося в лечении, лечат по меньшей мере двумя другими фармацевтически активными агентами. В некоторых воплощениях другой фармацевтически активный агент выбран из группы, состоящей из одного или более чем одного антидепрессанта, противотревожного средства, антипсихотического агента или усилителя когнитивных функций. Примеры классов антидепрессантов, которые могут быть использованы в комбинации с активными соединениями по изобретению, включают ингибиторы обратного захвата норэпинефрина, селективные ингибиторы обратного захвата серотонина (SSRI), антагонисты рецептора NK-1, ингибиторы моноаминоксидазы (МАО), обратимые ингибиторы моноаминоксидазы(RIMA), ингибиторы обратного захвата серотонина и норадреналина (SNRI), антагонисты кортиколиберина (CRF), антагонисты -адренорецептора и атипичные антидепрессанты. Подходящие ингибиторы обратного захвата норэпинефрина включают трициклические соединения на основе третичного амина и трициклические соединения на основе вторичного амина. Подходящие трициклические соединения на основе третичного амина и трициклические соединения на основе вторичного амина включают амитриптилин, кломипрамин, доксепин, имипрамин, тримипрамин, дотиепин, бутриптилин, иприндол, лофепрамин, нортриптилин, протриптилин, амоксапин, дезипрамин и мапротилин. Подходящие селективные ингибиторы обратного захвата серотонина включают флуоксетин, цитолопрам, эсциталопрам, флувоксамин, пароксетин и сертралин. Примеры ингибиторов моноаминоксидазы включают изокарбоксазид, фенелзин и транилципромин. Подходящие обратимые ингибиторы моноаминоксидазы включают моклобемид. Подходящие ингибиторы обратного захвата серотонина и норадреналина для применения по настоящему изобретению включают венлафаксин, нефазодон, милнаципран и дулоксетин. Подходящие антагонисты CRF включают соединения, описанные в Международных заявках на патенты WO 94/13643,WO 94/13644, WO 94/13661, WO 94/13676 и WO 94/13677. Подходящие атипичные антидепрессанты включают бупропион, литий, нефазодон, тразодон и вилоксазин. Подходящие антагонисты рецептораNK-1 включают упомянутые в Международной заявке на патент WO 01/77100.-8 016948 Противотревожные агенты, которые могут быть использованы в комбинации с соединениями формулы (I), включают без ограничения объема изобретения бензодиазепины и агонисты или антагонисты серотонина 1 А (5-HT1A), в особенности частичные агонисты 5-HT1A, и антагонисты кортиколиберина(CRF). Примеры подходящих бензодиазепинов включают алпразолам, хлордиазепоксид, клоназепам,хлоразепат, диазепам, галазепам, лоразепам, оксазепам и празепам. Примеры подходящих агонистов или антагонистов рецептора 5-HT1A включают буспирон, флезиноксан, гепирон и ипсапирон. Антипсихотические агенты, которые применяют в комбинации с соединениями формулы (I), включают без ограничения объема изобретения алифатический фетиазин, пиперазин фенотиазин, бутирофенон, замещенный бензамид и тиоксантин. Дополнительные примеры таких лекарств включают без ограничения объема изобретения галоперидол, оланзапин, клозапин, рисперидон, пимозид, арипипразол и зипразидон. В некоторых случаях лекарство представляет собой антиконвульсант, например фенобарбитал, фенитоин, примидон или карбамазепин. Усилители когнитивных функций, которые используют в комбинации с соединениями формулы (I),включают без ограничения объема изобретения лекарства, которые модулируют уровни нейромедиаторов (например, ингибиторы ацетилхолинэстеразы или холинэстеразы, агонисты холинергического рецептора или антагонисты серотонинового рецептора), лекарства, которые модулируют уровень растворимого А, образование амилоидной фибрилы или массу амилоидных бляшек (например, ингибиторы секретазы, ингибиторы -секретазы, препараты для терапия антителами и разрушающие ферменты), и лекарства, которые защищают нейрональную интеграцию (например, антиоксиданты, киназные ингибиторы, каспазные ингибиторы и гормоны). Другие типичные лекарства-кандидаты, которые вводят одновременно с соединениями по изобретению, включают ингибиторы холинэстеразы (например, такринThompson et al., 1995, Proc. Natl. Acad. Sci. USA, 92:7667-7671), 3-бицикло[2,2,1]гепт-5-ен-2-ил-6-хлор 3,4-дигидро-2 Н-1,2,4-бензотиадиазин-7-сульфонамид-1,1-диоксид (Yamada, et al., 1993, J. Neurosc. 13:3904-3915); 7-фтор-3-метил-5-этил-1,2,4-бензотиадиазин-S,S-диоксид; и соединения, описанные в патенте США 6620808 и Международных заявках на патент WO 94/02475, WO 96/38414, WO 97/36907,WO 99/51240 и WO 99/42456), модуляторы комплекса бензодиазепин (BZD)/GABA рецептор (например,прогабид, генгабин, залеплон и соединения, описанные в патентах США 5538956, 5260331 и 5422355); серотониновые антагонисты (например, модуляторы 5-НТ рецептора, антагонисты или агонисты 5HT1A(включая, без ограничения объема изобретения, лекозотан и соединения, описанные в патентах США 6465482, 6127357, 6469007 и 6586436, и в публикации РСТWO 97/03982) и антагонисты 5-НТ 6(включая, без ограничения объема изобретения, соединения, описанные в патентах США 6727236,6825212, 6995176 и 7041695; никотиновые соединения (например, ниацин); мускариновые соединения(Novartis; G белки; модуляторы каналов; иммунотерапевтические соединения (например, соединения,описанные в публикациях заявок на патенты СШАUS 2005/0197356 и US 2005/0197379); антиамилоидные агенты или агенты, снижающие уровень амилоида (например, бапинеузумаб и соединения, описанные в патенте США 6878742 или публикациях заявок на патент СШАUS 2005/0282825 или US 2005/0282826); статины и модуляторы рецептора, активируемого пероксисомальными пролифераторами(PPAR) (например, гемфиброзил (LOPID), фенофибрат (TRICOR), розиглитазона малеат (AVANDIA), пиоглитазон (Actos), розиглитазон (Avandia), клофибрат и безафибрат); ингибиторы цистеинилпротеазы; ингибитор рецептора конечного продукта усиленного гликозилирования (RAGE) (например, аминогуанидин, пиридоксамин карнозин, феназиндиамин, ОРВ-9195 и тенилсетам); прямые или непрямые нейротрофические агенты (например, Cerebrolysin, пирацетам, оксирацетам, AIT-082 (Emilieu, 2000, Arch. Neurol. 57:454; ингибиторы бета-секретазы (ВАСЕ), -секретаза, иммунофилины, ингибиторы каспазы-3, ингибиторы Src киназы, активаторы тканевого активатора плазминогена (ТРА),АМРА (альфа-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты) модуляторы, агонисты М 4,ингибиторы JNK3, агонисты LXR, антагонисты Н 3 и антагонисты ангиотензина IV. Другие усилители-9 016948 когнитивных функций включают, без ограничения объема изобретения, ацетил-1-карнитин, цитихолин,гуперзин, DMAE (диметиламиноэтанол), экстракт Васора monneiri, экстракт шалфея, L-альфа глицерил фосфорил холин, Ginko biloba и экстракт Ginko biloba, винпоцетин, DHA, ноотропы, включая фенилтропин, пикатропин (от Creative Compounds, LLC, Scott City, МО), безипирдин, линопирдин, сибопирдин,эстроген и эстрогеновые соединения, идебенон, Т-588 (Toyama Chemical, Japan), и FK960 (Fujisawa Pharmaceutical Co. Ltd.). Соединения, описанные в патентах США 5219857, 4904658, 4624954 и 4665183,также полезны в качестве усилителей когнитивных функций, как здесь описано. Усилители когнитивных функций, которые действуют через один или более чем один из вышеприведенных механизмов, также находятся в объеме изобретения. В некоторых воплощениях соединение формулы (I) и усилитель когнитивных функций действуют аддитивно, а в некоторых воплощениях - синергетически. В некоторых воплощениях, когда усилитель когнитивных функций и соединение формулы (I) по изобретению вводят животному одновременно, эффективное количество соединения или фармацевтически приемлемой соли соединения по изобретению меньше, чем было бы его эффективное количество, если бы усилитель когнитивных функций не вводили. В некоторых воплощениях, когда усилитель когнитивных функций и соединение формулы (I) вводят животному одновременно, эффективное количество усилителя когнитивных функций меньше, чем было бы его эффективное количество, если бы соединение или фармацевтически приемлемую соль по изобретению не вводили. В некоторых воплощениях усилитель когнитивных функций и соединение формулы(I) по изобретению вводят одновременно животному в дозах меньших, чем были бы их эффективные количества, если бы они не вводились одновременно. В этих случаях, не желая быть связанными теорией, полагают, что соединение формулы (I) и усилитель когнитивных функций действуют синергетически. В некоторых воплощениях другой фармацевтически активный агент представляет собой агент, полезный для лечения болезни Альцгеймера или состояния, ассоциированного с болезнью Альцгеймера,такого как деменция. Примеры агентов, полезных для лечения болезни Альцгеймера, включают без ограничения объема изобретения донепезил, ривастигмин, галантамин, мемантин и такрин. В некоторых воплощениях соединение формулы (I) вводят вместе с еще одним фармацевтически активным агентом по одному или в композиции. В некоторых воплощениях может быть введена композиция, включающая эффективное количество соединения формулы (I) и эффективное количество другого фармацевтически активного агента в той же самой композиции. В еще одном воплощении одновременно может быть введена композиция, содержащая эффективное количество соединения формулы (I), и отдельная композиция, содержащая эффективное количество другого фармацевтически активного агента. В еще одном воплощении эффективное количество соединения формулы (I) вводят до или после введения эффективного количества другого фармацевтически активного агента. В этом воплощении соединение формулы (I) вводят, пока другой фармацевтически активный агент проявляет свое терапевтическое действие, или другой фармацевтически активный агент вводят, пока соединение формулы (I) проявляет свое профилактическое или терапевтическое действие. Таким образом, в некоторых воплощениях в изобретении предложена композиция, содержащая эффективное количество соединения формулы (I) по настоящему изобретению и фармацевтически приемлемый носитель. В некоторых воплощениях композиция дополнительно содержит второй фармацевтически активный агент. В еще одном воплощении композиция дополнительно содержит фармацевтически активный агент,выбранный из группы, состоящей из одного или более чем одного другого антидепрессанта, противотревожного агента, антипсихотического агента или усилителя когнитивных функций. Антидепрессанты,противотревожные агенты, антипсихотические агенты и усилители когнитивных функций, подходящие для применения в композиции, включают приведенные выше антидепрессанты, противотревожные агенты, антипсихотические агенты и усилители когнитивных функций. В еще одном воплощении фармацевтически приемлемый носитель подходит для перорального введения, и композиция содержит лекарственную форму для перорального введения. В некоторых воплощениях одно или более чем одно соединение формулы (I) вводят в комбинации с антидепрессантом, антипсихотическим средством и/или антиконвульсантом. В некоторых воплощениях соединение формулы (I) вводят в комбинации с одним или более чем одним селективным ингибитором обратного захвата серотонина (SSRI) (например, флуоксетином, циталопрамом, эсциталопрама оксалатом, флувоксамина малеатом, пароксетином или сертралином), трициклическими антидепрессантами (например, дезипрамином, амитриптилином, амоксипином, кломипрамином, доксепином, имипрамином, нертриптилином, протриптилином, тримипрамином, дотиепином, бутриптилином, иприндолом или лофепрамином), соединениями аминокетонового класса (например, бупропионом); в некоторых воплощениях соединение формулы (I) вводят в комбинации с ингибитором моноаминоксидазы (MAOI) (например, фенелзином, изокарбоксазидом или транилципромином), ингибитором обратного захвата серотонина и норэпинефрина (SNRI) (например, венлафаксином, нефазодоном, милнаципраном, дулоксетином), ингибитором обратного захвата норэпинефрина (NRI) (например,ребоксетином), частичным агонистом 5-HT1A (например, буспироном), антагонистом рецептора 5-НТ 2 А(например, нефазодоном), типичным антипсихотическим средством или атипичным антипсихическим средством. Примеры таких антипсихотических средств включают алифатический фетиазин, пиперазина фенотиазин, бутирофенон, замещенный бензамид и тиоксантин. Дополнительные примеры таких лекарств включают галоперидол, оланзапин, клозапин, рисперидон, пимозид, арипипразол и зипразидон. В некоторых случаях лекарство представляет собой антиконвульсант, например фенобарбитал, фенитоин,примидон или карбамазепин. В некоторых случаях соединение формулы (I) вводят в комбинации по меньшей мере с двумя лекарствами, представляющими собой антидепрессанты, антипсихотические средства, антиконвульсанты или их комбинацию. Фармацевтические композиции В еще одном аспекте изобретение относится к фармацевтической композиции, содержащей одно или более чем одно соединение формулы (I) в комбинации с фармацевтически приемлемыми носителями и эксципиентами. Фармацевтические композиции могут находиться в форме твердых, полутвердых или жидких препаратов, предпочтительно в форме растворов, суспензий, порошков, гранул, таблеток, капсул,сиропов, суппозиториев, аэрозолей или систем контролируемой доставки. Композиции могут быть введены множеством путей, включая пероральный, трансдермальный, подкожный, внутривенный, внутримышечный, ректальный и интраназальный путь, и предпочтительно приготовлены в виде стандартной лекарственной формы, каждая доза которой содержит от приблизительно 1 до приблизительно 1000 мг,от предпочтительно 1 до 600 мг активного ингредиента. Соединения по изобретению могут находиться в форме свободных оснований или в виде солей присоединения кислоты, предпочтительно соли с фармацевтически приемлемыми кислотами. Изобретение также включает выделенные изомеры и диастереоизомеры соединений I или их смеси (например, рацемические смеси). Принципы и способы приготовления фармацевтических композиций описаны, например, в Remington's Pharmaceutical Science, Mack Publishing Company, Easton (PA). При введении животному одного или более чем одного соединения формулы (I) в любой желаемой форме (например, форме соли, кристаллической форме и т.д.) соединение может быть введено самостоятельно или в виде компонента фармацевтической композиции, содержащей физиологически приемлемый носитель или разбавитель. Такая фармацевтическая композиция по изобретению может быть приготовлена с использованием стандартных способов, например, смешивания соединения(ий) и физиологически приемлемого носителя, эксципиента или разбавителя. Смешивание может быть осуществлено с использованием способов, хорошо известных для смешивания соединения формулы (I) и физиологически приемлемого носителя, эксципиента или разбавителя. Предложенные фармацевтические композиции (т.е. включающие одно или более чем одно соединение формулы (I в подходящей форме могут быть введены перорально. Альтернативно или дополнительно предложенные фармацевтические композиции могут быть введены при помощи любого другого удобного пути, например парентерально (например, подкожно, внутривенно и т.д., путем инфузии или болюсной инъекции и т.д.), путем абсорбции через эпителиальные или кожно-слизистые поверхности(например, ротовой полости, прямой кишки, влагалища и слизистой оболочки кишечника и т.д.) и т.д. Введение может быть системным или локальным. Могут быть использованы различные известные системы доставки, включая, например, инкапсуляцию в липосомах, микрочастицах, микрокапсулах и капсулах. Способы введения включают внутрикожный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, эпидуральный, пероральный, подъязычный, интрацеребральный, интравагинальный, трансдермальный, ректальный путь, путем ингаляции или местно, в частности в уши,нос, глаза, или на кожу, но не ограничиваются ими. В некоторых случаях введение приводит в результате к высвобождению соединения (и/или одного или более чем одного его метаболита) в кровоток. Способ введения может быть оставлен на усмотрение лечащего врача. В некоторых воплощениях предложенные фармацевтические композиции вводят перорально; в некоторых воплощениях предложенные фармацевтические композиции вводят внутривенно. В некоторых воплощениях может быть желательно вводить предложенные фармацевтические композиции локально. Последнее может быть осуществлено, например, путем локальной инфузии при хирургическом вмешательстве, местного применения, например в сочетании с повязкой на рану после хирургического вмешательства, путем инъекции, при помощи катетера, при помощи суппозитория или клизмы, или при помощи имплантата, где указанный имплантат представляет собой пористый, непористый или желатинообразный материал, включая мембраны, такие как сиаластовые мембраны, или волокна. В некоторых воплощениях может быть желательно вводить соединение формулы (I) в центральную нервную систему, систему кровообращения или желудочно-кишечный тракт при помощи любого подходящего пути, включая внутрижелудочковую, внутриоболочечную инъекцию, параспинальную инъекцию,эпидуральную инъекцию, клизму и путем инъекции рядом с периферическим нервом. Внутрижелудочковая инъекция может быть осуществлена при помощи внутрижелудочкового катетера, например, присоединенного к резервуару, такому как резервуар Оммайя. Также может быть использовано легочное введение, например, путем применения ингалятора или- 11016948 небулайзера и препарат с распыляемым агентом или путем перфузии в фторуглеродном или синтетическом легочном сурфактанте. В некоторых воплощениях соединение формулы (I) может быть приготовлено в виде суппозитория с традиционными связующими веществами и эксципиентами, такими как триглицериды. В некоторых воплощениях одно или более чем одно соединение формулы (I) может быть доставлено в везикуле, в частности липосоме (см. Langer, Science 249:1527-1533, 1990 и Treat et al., Liposomes inthe Therapy of Infectious Disease and Cancer 317-327 и 353-365, 1989). В некоторых воплощениях одно или более чем одно соединение формулы (I) может быть доставлено в системе с контролируемым высвобождением или системе с длительным высвобождением (см., например, Goodson, в Medical Applications of Controlled Release, vol. 2, p. 115-138, 1984). Могут быть использованы другие системы с контролируемым или длительным высвобождением, обсуждаемые в обзореLanger, Science 249:1527-1533, 1990. В некоторых воплощениях может быть использован насос (Langer,Science 249:1527-1533, 1990; Sefton, CRC Crit. Ref. Biomed. Eng. 14:201, 1987; Buchwald et al., Surgery 88:507, 1980; и Saudek et al., N. Engl. J. Med. 321:574, 1989). В еще одном воплощении могут быть использованы полимерные вещества (см. Medical Applications of Controlled Release (Langer and Wise eds.,1974); Controlled Drug Bioavailability, Drug Product Design and Performance (Smolen and Ball eds., 1984);During et al., Ann. Neural. 25:351, 1989; и Howard et al., J. Neurosurg. 71:105, 1989). Как указано выше, предложенные фармацевтические композиции возможно могут включать подходящее количество физиологически приемлемого эксципиента. Примеры физиологически приемлемых эксципиентов могут представлять собой жидкости, такие как вода и масла, включая вазелин, животное,растительное или синтетическое масло, такое как арахисовое масло, соевое масло, минеральное масло,кунжутное масло и т.п. Например, полезные физиологически приемлемые эксципиенты могут представлять собой физиологический раствор, аравийскую камедь, желатин, крахмальную пасту, тальк, кератин,коллоидный диоксид кремния, мочевину и т.п. Альтернативно или дополнительно могут быть использованы вспомогательные агенты, стабилизаторы, загустители, смазывающие вещества и красители. В некоторых воплощениях используют физиологически приемлемый эксципиент, который является стерильным при введении животному. Такие физиологически приемлемые эксципиенты желательно являются стабильными в условиях приготовления и хранения и типично должны быть защищены от контаминирующего действия микроорганизмов. Вода представляет собой особенно полезный эксципиент при внутривенном введении соединения формулы (I). Также могут быть использованы физиологические растворы и водные декстрозные и глицериновые растворы в качестве жидких эксципиентов, в частности,для инъецируемых растворов. Подходящие физиологически приемлемые эксципиенты также включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, глицеролмоностеарат, тальк, хлорид натрия, высушенное обезжиренное молоко, глицерин, пропилен, гликоль,воду, этанол и т.п. Предложенные фармацевтические композиции, если желательно, также могут содержать незначительные количества увлажнителей, или эмульгаторов, или рН забуферивающих агентов. Жидкие носители могут быть использованы при изготовлении растворов, суспензий, эмульсий, сиропов и эликсиров. Соединение формулы (I) может быть растворено или суспендировано в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель, их смесь или фармацевтически приемлемые масла или жир. Такой жидкий носитель может содержать другие подходящие фармацевтические добавки, включая солюбилизаторы, эмульгаторы, буферы, консерванты, подсластители, корригенты, суспендирующие агенты, загустители, красители, регуляторы вязкости, стабилизаторы или осмотические регуляторы. Подходящие примеры жидких носителей для перорального и парентерального введения включают воду (в частности, содержащую вышеприведенные добавки, например производные целлюлозы, включая раствор натрий карбоксиметилцеллюлозы), спирты (включая одноатомные и многоатомные спирты, например гликоли) и их производные, и масла (например, фракционированное кокосовое масло и арахисовое масло). Для парентерального введения носитель также может представлять собой масляный сложный эфир, такой как этилолеат и изопропилмиристат. Стерильные жидкие носители используют в форме стерильной жидкой композиции для парентерального введения. Жидкий носитель для композиций под давлением может представлять собой галогенированный углеводород или другой фармацевтически приемлемый пропеллент. Предложенные фармацевтические композиции могут принимать форму растворов, суспензий,эмульсий, таблеток, пилюль, лепешек, капсул, капсул, содержащих жидкости, порошков, препаратов с длительным высвобождением, суппозиториев, эмульсий, аэрозолей, спреев, суспензий или любой другой формы, подходящей для применения. В некоторых воплощениях предложены фармацевтические композиции в форме капсулы. Другие примеры подходящих физиологически приемлемых эксципиентов описаны в Remington's Pharmaceutical Sciences 1447-1676 (Alfonso R. Gennaro, ed., 19th ed. 1995). В некоторых воплощениях соединение формулы (I) (в подходящей форме) приготовлено в соответствии со стандартными способами в виде композиции, адаптированной для перорального введения людям. Композиции для пероральной доставки могут находиться в форме, например, таблеток, лепешек,трансбуккальных форм, пастилок, водных или масляных суспензий или растворов, гранул, порошков,- 12016948 эмульсий, капсул, сиропов или эликсиров. Перорально вводимые композиции могут содержать один или более чем один агент, например подсластитель, такой как фруктоза, аспартам или сахарин; корригенты,такие как мята перечная, масло грушанки или вишни; красители; консерванты, с получением фармацевтически приятного препарата. В порошках носитель может представлять собой тонкоизмельченное твердое вещество, представляющее собой смесь с тонкоизмельченным соединением или фармацевтически приемлемой солью соединения. В таблетках соединение или фармацевтически приемлемую соль соединения смешивали с носителем, обладающим необходимыми свойствами для прессования в подходящих пропорциях, и прессовали до желаемой формы и размера. Порошки и таблетки могут содержать до приблизительно 99% соединения или фармацевтически приемлемой соли соединения. Капсулы могут содержать смеси одного или более чем одного соединения формулы (I) с инертными наполнителями и/или разбавителями, такими как фармацевтически приемлемые крахмалы (например,кукурузный, картофельный или тапиоковый крахмал), сахара, искусственные подсластители, порошкообразные целлюлозы (такие как кристаллические и микрокристаллические целлюлозы), мука, желатины,смолы и т.д. Таблетируемые препараты могут быть приготовлены при помощи способов обычного прессования,влажного гранулирования или безводного гранулирования и с использованием фармацевтически приемлемых разбавителей, связующих агентов, смазывающих веществ, разрыхлителей, поверхностных модификаторов (включая поверхностно-активные вещества), суспендирующих агентов или стабилизаторов(включая стеарат магния, стеариновую кислоту, лаурилсульфат натрия, тальк, сахара, лактозу, декстрин,крахмал, желатин, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, натриевую карбоксиметилцеллюлозу, кальциевую карбоксиметилцеллюлозу, поливинилпирролидин, альгиновую кислоту,аравийскую камедь, ксантановую камедь, цитрат натрия, сложные силикаты, карбонат кальция, глицин,сахарозу, сорбит, вторичный кислый фосфат кальция, сульфат кальция, лактозу, каолин, маннит, хлорид натрия, легкоплавкие воски и ионообменные смолы, но не ограничивающихся ими). Поверхностные модификаторы включают неионные и анионные поверхностные модификаторы. Типичные примеры поверхностных модификаторов включают полоксамер 188, бензалкония хлорид, стеарат кальция, цетостеариловый спирт, цетомакрогол эмульгирующие воски, сорбитановые эфиры, коллоидный диоксид кремния, ортофосфаты, додецилсульфат натрия, алюмосиликат магния и триэтаноламин, но не ограничиваются ими. Кроме того, когда фармацевтические композиции предложены в форме таблетки или пилюли, они могут быть покрыты оболочкой для замедления разрыхления и абсорбции в желудочно-кишечный тракт,таким образом, обеспечивая длительное действие в течение более продолжительного периода. Избирательно проницаемые мембраны, окружающие осмотически активное выталкивающее соединение, также подходят для перорально вводимых композиций. В этих последних платформах жидкость из среды, окружающей капсулу, может поглощаться выталкивающим соединением, которое набухает для выталкивания агента или композиции агента через оболочку. Эти платформы доставки могут обеспечивать, по существу, профиль доставки нулевого порядка в противоположность профилям с пиками для препаратов с немедленным высвобождением. Также может быть использовано вещество с задержкой по времени, такое как глицерина моностеарат или глицерина стеарат. Композиции для перорального введения могут включать стандартные эксципиенты, такие как маннит, лактозу, крахмал, стеарат магния, сахарин натрия, целлюлозу и карбонат магния. В некоторых воплощениях эксципиенты имеют фармацевтическое качество. В некоторых воплощениях одно или более чем одно соединение формулы (I) (в подходящей форме) может быть приготовлено для внутривенного введения. Типично, композиции для внутривенного введения содержат стерильный изотонический водный буфер. При необходимости композиции также могут включать солюбилизатор. Композиции для внутривенного введения возможно могут включать местный анестетик, такой как лигнокаин, для уменьшения боли в сайте инъекции. Как правило, ингредиенты проставляются отдельно или смешанные вместе в стандартной лекарственной форме, например в виде безводного лиофилизированного порошка или безводного концентрата в герметично запаянном контейнере,таком как ампула или саше с указанием количества активного агента. Когда соединение формулы (I) должно быть введено путем инфузии, оно может дозироваться, например, при помощи инфузионного флакона, содержащего стерильную воду фармацевтического качества или физиологический раствор. Когда соединение формулы (I) вводят путем инъекции, может быть предложена ампула со стерильной водой для инъекции или физиологическим раствором, таким образом, что ингредиенты могут быть смешаны перед введением. В некоторых воплощениях одно или более чем одно соединения формулы (I) (в подходящей форме) может быть введено трансдермально путем использования трансдермального пластыря. Трансдермальные введения включают введения через поверхность организма и внутренние поверхности протоков,включая эпителиальные и слизистые ткани. Такие введения могут быть осуществлены в лосьонах, кремах, пенах, пластырях, суспензиях, растворах и суппозиториях (например, ректальных или вагинальных). Трансдермальное введение может быть осуществлено путем применения трансдермального пластыря, содержащего одно или более чем одно соединение формулы (I) (в подходящей форме) и носитель,- 13016948 который является инертным в отношении соединения или фармацевтически приемлемой соли соединения, является не токсичным для кожи, и дает возможность для доставки агента для системной абсорбции в кровоток через кожу. Носитель может принимать любое количество форм, таких как кремы или масла,пасты, гели или окклюзионные устройства. Кремы или масла могут представлять собой вязкие жидкие или полутвердые эмульсии типа масло-в-воде или вода-в-масле. Также могут быть подходящими пасты,состоящие из абсорбируемых порошков, диспергированных в нефтяных углеводах или гидрофильных нефтяных углеводах, содержащих активный ингредиент. Множество окклюзионных устройств может быть использовано для высвобождения соединения или фармацевтически приемлемой соли соединения в кровоток, таких как полупроницаемая мембрана, покрывающая резервуар, содержащий соединение формулы (I) с носителем или без него, или матрикс, содержащий активный ингредиент. Одно или более чем одно соединение формулы (I) (в подходящей форме) может быть введено ректально или вагинально в форме обычного суппозитория. Препараты суппозиториев могут быть приготовлены из традиционных материалов, включая масло какао, с добавлением восков для изменения температуры плавления суппозитория или без них, и глицерин. Также могут быть использованы водорастворимые основания суппозиториев, такие как полиэтиленгликоли, с различной молекулярной массой. Одно или более чем одно соединение формулы (I) (в подходящей форме) может быть введено при помощи средств с контролируемым высвобождением или длительным высвобождением или при помощи устройств доставки, которые известны специалистам в данной области техники. Такие лекарственные формы могут быть использованы с получением контролируемого или длительного высвобождения одного или более чем одного активного ингредиента с использованием, например, гидроксипропилметилцеллюлозы, других полимерных матриц, гелей, проницаемых мембран, осмотических систем, многослойных оболочек, микрочастиц, липосом, микросфер или их комбинации с получением желаемого профиля высвобождения в различных пропорциях. Подходящие препараты с контролируемым или длительным высвобождением, известные специалистам в данной области техники, включающие описанные здесь, легко могут быть выбраны для применения с активными ингредиентами по изобретению. Таким образом, изобретение охватывает единичные стандартные лекарственные формы, подходящие для перорального введения, такие как таблетки, капсулы, гелевые капсулы и таблетки в форме капсулы, адаптированные для контролируемого или длительного высвобождения, но не ограничивающиеся ими. В некоторых воплощениях композиция с контролируемым или длительным высвобождением содержит минимальное количество соединения формулы (I) для лечения или профилактики одного или более чем одного расстройства, заболевания или состояния, ассоциирующегося с активностью 7 никотиновых ацетилхолиновых рецепторов. Преимущества композиций с контролируемым или длительным высвобождением включают увеличенную активность лекарства, уменьшенную частоту введения доз, и улучшенное соблюдение схемы лечения пациента-животного, которого лечат. Дополнительно композиции с контролируемым или длительным высвобождением благоприятно могут влиять на момент начало действия или другие характеристики, такие как уровни соединения или фармацевтически приемлемой соли соединения в крови, и, таким образом, могут уменьшать частоту неблагоприятных побочных действий. Композиции с контролируемым или длительным высвобождением исходно могут высвобождать количество одного или более чем одного соединения формулы (I), которое быстро обеспечивает желаемое терапевтическое или профилактическое действие, и постепенно и непрерывно высвобождает другие количества соединения для поддержания этого уровня терапевтического или профилактического действия в течение длительного периода времени. Для поддержания постоянного уровня соединения в организме соединение может быть высвобождено из лекарственной формы со скоростью, которая позволит компенсировать количество соединения, которое метаболизирует и выводится из организма. Контролируемое или длительное высвобождение активного ингредиента может быть стимулировано различными условиями, включающими изменения рН, изменения температуры, концентрации или доступности ферментов, концентрации или доступности воды, или другими физиологическими состояниями или соединениями, но не ограничивающимися ими. В некоторых воплощениях предложены фармацевтические композиции, доставляющие количество соединения формулы (I), эффективное для лечения одного или более чем одного расстройства, заболевания или состояния, ассоциированного с активностью (или неактивностью) 7 никотиновых ацетилхолиновых рецепторов. В соответствии с настоящим изобретением анализы in vitro или in vivo могут быть осуществлены для того, чтобы способствовать идентификации оптимальных диапазонов доз. Точная используемаядоза также может зависеть от пути введения, состояния, серьезности состояния, которое лечат, а также различных физических факторов, относящихся к индивиду, которого лечат, и может быть определена в соответствии с решением лечащего врача. Эквивалентные дозы могут быть введены в течение различных периодов времени, включая приблизительно каждые 2 ч, приблизительно каждые 6 ч,приблизительно каждые 8 ч, приблизительно каждые 12 ч, приблизительно каждые 24 ч, приблизительно каждые 36 ч, приблизительно каждые 48 ч, приблизительно каждые 72 ч, приблизительно каждую неделю, приблизительно каждые две недели, приблизительно каждые три недели, приблизительно каждый- 14016948 месяц и приблизительно каждые два месяца, но не ограничивающихся ими. Количество и частота доз,соответствующих завершенному курсу терапии, определяется в соответствии с решением лечащего врача. Описанные здесь эффективные дозы типично относятся к общим вводимым количествам; то есть если вводят более чем одно соединение формулы (I), эффективные дозы соответствуют общему вводимому количеству. Эффективное количество соединения формулы (I) для описанного здесь применения типично находится в диапазоне от приблизительно 0,001 до приблизительно 600 мг/кг массы организма в сутки, в некоторых воплощениях, от приблизительно 1 до приблизительно 600 мг/кг массы организма в сутки, в еще одном воплощении от приблизительно 10 до приблизительно 400 мг/кг массы организма в сутки, в еще одном воплощении от приблизительно 10 до приблизительно 200 мг/кг массы организма в сутки, в еще одном воплощении от приблизительно 10 до приблизительно 100 мг/кг массы организма в сутки, в еще одном воплощении от приблизительно 1 до приблизительно 10 мг/кг массы организма в сутки, в еще одном воплощении от приблизительно 0,001 до приблизительно 100 мг/кг массы организма в сутки, в еще одном воплощении от приблизительно 0,001 до приблизительно 10 мг/кг массы организма в сутки и в еще одном воплощении от приблизительно 0,001 до приблизительно 1 мг/кг массы организма в сутки. В некоторых воплощениях фармацевтические композиции предложены в стандартной лекарственной форме, например в виде таблетки, капсулы, порошка, раствора, суспензии, эмульсии, гранулы или суппозитория. В такой форме композиция разделена на стандартные дозы, содержащие подходящие количества активного ингредиента; стандартная лекарственная форма может представлять собой упакованные композиции, например упакованные порошки, виалы, ампулы, предварительно заполненные шприцы или саше, содержащие жидкости. Стандартная лекарственная форма сама может представлять собой,например, капсулу или таблетку или может представлять собой подходящее количество любых таких композиций в упакованной форме. Такая стандартная лекарственная форма может содержать, например,от приблизительно 0,01 мг/кг до приблизительно 250 мг/кг, и может быть введена в виде однократной дозы или двух или боле чем двух дробных доз. Вариации дозы возникают в зависимости от видов, массы и состояния пациента, которого лечат, и индивидуального ответа пациента на лекарственное средство. В некоторых воплощениях стандартная лекарственная форма составляет от приблизительно 0,01 до приблизительно 1000 мг. В еще одном воплощении стандартная лекарственная форма составляет от приблизительно 0,01 до приблизительно 500 мг; в еще одном воплощении стандартная лекарственная форма составляет от приблизительно 0,01 до приблизительно 250 мг; в еще одном воплощении стандартная лекарственная форма составляет от приблизительно 0,01 до приблизительно 100 мг; в еще одном воплощении стандартная лекарственная форма составляет от приблизительно 0,01 до приблизительно 50 мг; в еще одном воплощении стандартная лекарственная форма составляет от приблизительно 0,01 до приблизительно 25 мг; в еще одном воплощении стандартная лекарственная форма составляет от приблизительно 0,01 до приблизительно 10 мг; в еще одном воплощении стандартная лекарственная форма составляет от приблизительно 0,01 до приблизительно 5 мг; и в еще одном воплощении стандартная лекарственная форма составляет от приблизительно 0,01 до приблизительно 10 мг. Соединение формулы (I) может быть проанализировано in vitro или in vivo в отношении желаемой терапевтической или профилактической активности перед использованием у людей. Системы моделей животных могут быть использованы для демонстрации безопасности и эффективности. Синтез и получение Соединения формулы (I) или их предшественники могут быть получены при помощи множества путей синтеза, среди которых пути, проиллюстрированные на схемах 1-5 ниже. Схема 1 В соответствии со схемой 1 -галогеноалканоилхлорид 1 (далее в качестве примера которого приведен -бромалканоилхлорид) вступает во взаимодействие с подходящим гетероциклическим амином 2 в растворителе, таком как, например, дихлорметан, диметилформамид, диметилацетамид, тетрагидрофуран, этилацетат и т.п., или их смеси, но не ограничивающемся ими, в присутствии основания, такого как,например, триэтиламин, основание Хюнига (диизопропилэтиламин) или неорганического основания,такого как, например, карбонат калия, но не ограничивающегося ими, с получением сочетающего амидного продукта 3, который может быть выделен или не выделен, и очищен. Амид 3 затем приводят во взаимодействие в подходящем растворителе, таком как дихлорметан, диметилформамид или диметилацетамид, но не ограничивающемся ими, с амином X, который может быть использован в избытке или не в избытке, в присутствии дополнительного основания, такого как триэтиламин или основание Хюнига,или его отсутствии, с получением объекта изобретения соединения формулы (I). В соответствии со схемой 2 -галогеноалкановая кислота подходящим образом активирована с использованием агента, такого как, например, 1,1'-карбонилдиимидазол, но не ограничивающегося им, в растворителе, таком как, например, дихлорметан, диметилформамид или их смеси, и приведена во взаимодействие с подходящим гетероциклическим амином с получением промежуточного соединения амида-галогеноалкановой кислоты 3, которое может быть выделено и очищено или не выделено и не очищено. Амид 3 затем приводят во взаимодействие в подходящем растворителе, таком как дихлорметан, диметилформамид или диметилацетамид, но не ограничивающемся ими, с амином X, который может быть использован в избытке или не в избытке, в присутствии дополнительного основания, такого как триэтиламин или основание Хюнига, или его отсуствии, с получением объекта изобретения соединения формулы (I). Схема 3 В соответствии со схемой 3 -аминоалкановая кислота подходящим образом активирована с использованием агента, такого как, например, 1,1'-карбонилдиимидазол, но не ограничивающегося им, в растворителе, таком как, например, дихлорметан, диметилформамид или их смеси, и приведена во взаимодействие с подходящим гетероциклическим амином с получением объекта изобретения соединения формулы (I). Схема 4 В соответствии со схемой 4 -аминоалкановая кислота 5 подходящим образом активирована с использованием агента, такого как, например, 1,1'-карбонилдиимидазол, но не ограничивающегося им, в растворителе, таком как, например, дихлорметан, диметилформамид или их смеси, и приведена во взаимодействие с подходящим бромгетероциклическим амином с получением бромгетероариламидов формулы 7, которые затем дополнительно приводят во взаимодействие в условиях перекрестного связывания, например условиях Сузуки, с получением объекта изобретения соединения формулы (I). Схема 5 демонстрирует один возможный путь синтеза кислот 5 с замещенной цепью, представляющих собой предшественники соединений формулы (I). Схема 5 В соответствии со схемой 5 диэфир алкилзамещенной малоновой кислоты обрабатывают основанием, таким как, например, гидрид натрия, но не ограничивающемся им, в растворителе, таком как тетрагидрофуран или диметилформамид, и приводят во взаимодействие с ,-дигалогеноалканом. Получающийся таким образом диэфир двузамещенной малоновой кислоты гидролизуют и подвергают монодекарбоксилированию путем обработки сильной кислотой, такой как, например, бромисто-водородная кислота. Затем осуществляют этерификацию, например, путем обработки метанолом и каталитическим количеством кислоты. Замещение -галогена может быть осуществлено путем нагревания подходящего амина в растворителе, таком как толуол, но не ограничивающемся им. Наконец, гидролиз эфирной функциональной группы водным основанием позволяет получить промежуточные соединения формулы 5,которые могут быть активированы, как описано, с получением соединения формулы (I). Соединения формулы (I), их оптические изомеры или диастереоизомеры могут быть очищены или- 16016948 выделены в соответствии с хорошо известными способами, включая хроматографию с хиральной матрицей и фракционную кристаллизацию, но не ограничивающимися ими. Примеры Экспериментальные способы - Синтез соединений. Общая информация. Если не указано иное, все спектры ядерного магнитного резонанса регистрировали с использованием спектрометра Varian Mercury Plus 400 МГц, оборудованного зондом PFG ATB Broadband. Анализы ВЭЖХ-МС осуществляли при помощи разделительного модуля Waters 2795, оборудованного Waters Micromass ZQ (ионизация РЭ) и Waters PDA 2996, с использованием колонки Waters XTerraMC C18 3,5 мкм 2,150 мм. Препаративную ВЭЖХ осуществляли с использованием системы Waters 2767 с бинарным насосомGradient Module Waters 2525 и сопряженной с Waters Micromass ZQ (ES) или Waters 2487 DAD, с использованием колонки Supelco Discovery HS C18 5,0 мкм 1021,2 мм. Градиенты получали с использованием 0,1% муравьиной кислоты/воды и 0,1% муравьиной кислоты/ацетонитрила с градиентом от 5/95 до 95/5 и временем разделения, указанным в примерах. Всю колоночную хроматографию осуществляли в соответствии со следующим способом Still, С.; J.Org. Chem. 43, 2923 (1978). Все анализы ТСХ осуществляли на силикагеле (Merck 60 F254), и пятна визуализировали при помощи УФ (ультрафиолета) при 254 нм и KMnO4 или нингидринового окрашивания. Когда указан матричный синтез, нагревание осуществляли в системе Buchi Syncore. Все микроволновые реакции осуществляли в печи СЕМ Discover. Сокращения, используемые в экспериментальных способах:TEA - триэтиламин; ТФУ - трифторуксусная кислота; ТГФ - тетрагидрофуран; ТСХ - тонкослойная хроматография; ЖХ-МС - жидкостная хроматография-масс-спектрометрия; ВЭЖХ - высокоэффективная жидкостная хроматография. Общий синтез 3-амино-5-арил/гетероарил пиразола. 3-Амино-5-арил/гетероарил пиразолы, используемые в примерах, имеются в продаже или их синтезируют с использованием путей, представленных на нижеприведенной схеме Общий способ синтеза арил/гетероарил -кетонитрила (А 1) Арил или гетероарил метилкарбоксилат имеются в продаже или были синтезированы в соответствии со следующим стандартным способом: арил или гетероарил карбоновую кислоту (32 ммоль) растворяли в МеОН (40 мл) и добавляли серную кислоту (1 мл). Смесь кипятили с обратным холодильником в течение ночи, после чего растворитель выпаривали при пониженном давлении; неочищенное вещество растворяли в ДХМ и промывали насыщенным водным раствором NaHCO3. Органическую фазу сушили и выпаривали при пониженном давлении, неочищенное вещество использовали без дополнительной очистки. К раствору арил или гетероарил метилкарбоксилата (6,5 ммоль) в безводном толуоле (6 мл) в атмосфере N2 осторожно добавляли NaH (50-60% дисперсия в минеральном масле, 624 мг, 13 ммоль). Смесь нагревали при 80 С и затем по каплям добавляли безводный CH3CN (1,6 мл, 30,8 ммоль). Реакционную- 17016948 смесь нагревали в течение 18 ч и, как правило, продукт осаждался из реакционной смеси в виде Na соли. Реакционной смеси затем давали возможность охладиться до комнатной температуры и образующееся твердое вещество фильтровали и затем растворяли в воде. Раствор затем подкисляли 2 н. раствором HCl и при рН 2-6 (в зависимости от кольцевых заместителей в арил/гетероарильной системе) продукт осаждался и его отфильтровывали. Если осаждение не происходило, продукт экстрагировали ДХМ. После обработки продукты, как правило, использовали на следующей стадии без дополнительной очистки. Общий выход составлял от 40 до 80%. Общий способ синтеза арил/гетероарил -кетонитрила (путь А 1 бис): Метиловые эфиры арил- или гетероарилкарбоновой кислоты имеются в продаже или их синтезируют в соответствии со стандартным способом, как описано в общем способе А 1. К раствору безводного алканнитрила в толуоле (1 ммоль/мл, 5 экв.), охлажденному до -78 С в атмосфере азота, по каплям добавляли раствор н-бутиллития в н-гексане (1,6 н., 3,5 экв.). Смесь оставляли перемешиваться при -78 С в течение 20 мин и затем добавляли раствор арил или гетероарил метилкарбоксилата в толуоле (0,75 ммоль/мл, 1 экв.) и реакционной смеси давали возможность достичь комнатной температуры. После завершения взаимодействия после приблизительно 20 мин смесь охлаждали до 0 С и добавляли 2 н. HCl до рН 2. Органическую фазу отделяли, сушили над Na2SO4 и концентрировали при пониженном давлении с получением указанного в заголовке продукта, который, как правило, использовали без дополнительной очистки. Общий способ синтеза арил аминопиразола (путь А 2):(0,44 мл, 9,0 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 18 ч. Реакционной смеси давали возможность охладиться до комнатной температуры и растворитель выпаривали при пониженном давлении. Остаток растворяли в ДХМ и промывали водой. Органическую фазу концентрировали при пониженном давлении с получением неочищенного продукта, который очищали при помощи колонки SiO2 или путем осаждения из Et2O. Выходы, как правило, составляют от 65 до 90%. Превращение гидроксиарил- или гидроксигетероарилкарбоновой кислоты в метиловый эфир. Общий способ. 4-Гидроксибензойную кислоту (как правило, 24,0 ммоль) растворяли в МеОН (50 мл) и добавляли серную кислоту (1 мл/г субстрата). Смесь кипятили с обратным холодильником в течение ночи, после чего растворитель выпаривали при пониженном давлении; неочищенное вещество растворяли в ДХМ и промывали насыщенным NaHCO3 до основного рН. Органическую фазу сушили и упаривали при пониженном давлении и продукт использовали без дополнительной очистки. Выходы составляли от 80 до 90%. Превращение метилового эфира гидроксиарил- или гидроксигетероарилкарбоновой кислоты в метиловый эфир F2CHO-арил- или гетероарилкарбоновой кислоты. Общий способ. В атмосфере N2 метиловый или этиловый эфир 4-гидроксибензойной кислоты (1,0 экв.) и натрия хлордифторацетат (1,2 экв.) растворяли в ДМФ (20-25 мл) в двухгорлой круглодонной колбе; добавляли карбонат калия (1,2 экв.) и смесь нагревали при 125 С до полного превращения исходного вещества, обнаруживаемого при помощи ЖХ-МС. Смесь затем разбавляли водой и экстрагировали ДХМ; органическую фазу сушили и удаляли при пониженном давлении, неочищенное вещество очищали через колонкуSi с получением продукта (выходы от 20 до 70%). В следующей табл. 1 приведены выходы и аналитические данные, полученные при получении серий метиловых эфиров F2CHO-арил- или F2CHO-гетероарилкарбоновой кислоты, полученных в соответствии с описанными выше общими способами.C10H7N3O Масса (вычисленная) [185]; (найденная) [М+Н+]=186; [М-Н]=184. ЖХ Rt=0,23, 100% (3 мин способ). 1 Н-ЯМР (ДМСО-d6): 4.72 (2H, s), 7.61-7.65 (2 Н, m), 7.70 (1 Н, m), 8.07 (1 Н, s), 9.40 (s, 1H). 5-Имидазо[1,2-а]пиридин-6-ил-1 Н-пиразол-3-иламин. Указанное в заголовке соединение синтезировали в соответствии с общим способом А 2, начиная с 3-имидазо[1,2-а]пиридин-6-ил-3-оксопропионитрила. Выход: 84%.POCl3 (2 экв. относительно арил/гетероарил ацетофенона) по каплям добавляли к 4 мол.экв. безводного ДМФ, охлажденного до 0 С, с такой скоростью, что температура не превышала 10 С. Затем по кап- 19016948 лям добавляли ацетофенон (1 экв.) и реакционной смеси давали возможность достичь комнатной температуры. Реакционную смесь затем перемешивали в течение еще 30' и затем добавляли 0,4 ммоль гидроксиламина гидрохлорида. Реакционную смесь затем нагревали до 50 С, после чего нагревание прекращали и порциями добавляли дополнительно 4 экв. гидроксиламина гидрохлорида (с такой скоростью, что температура никогда не превышала 120 С). Реакционную смесь затем перемешивали до тех пор, пока температура смеси спонтанно не уменьшалась до 25 С. Затем добавляли воду (100 мл) и смесь экстрагировали диэтиловым эфиром. Органическую фазу сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенный продукт использовали на следующей стадии без дополнительной очистки. Синтез ариламинопиразола (путь В 2). К раствору хлорциннамонитрила (0,5 ммоль/мл, 1 экв.) в абсолютном EtOH добавляли 2 экв. гидразина моногидрата, и реакционную смесь кипятили с обратным холодильником в течение 4 ч. Реакционной смеси давали возможность охладиться до комнатной температуры и растворитель упаривали при пониженном давлении. Остаток растирали с Et2O, давая возможность для выделения указанного в заголовке соединения, которое, как правило, использовали без дополнительной очистки. 5-(2-Трифторметилфенил)-2 Н-пиразол-3-иламин. а) 3-Оксо-3-(2-трифторметилфенил)пропионитрил. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 1) из метилового эфира 2-трифторметилбензойной кислоты (3,1 г, 14,0 ммоль, 1,0 экв.). Неочищенное вещество осаждали из HCl с получением указанного в заголовке продукта в виде желтого твердого вещества (2,8 г,выход: 94%).C10H6F3NO 1 Н-ЯМР (CD3OD): 4.90 (2 Н, br s); 7.52-7.86 (4 Н, m). б) 5-(2-Трифторметилфенил)-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенное вещество очищали при помощи колонки Si (элюент: ДХМ) и сушили с получением указанного в заголовке продукта (0,6 г, выход 20%).C10H8F3N3 5-(2,6-Диметилфенил)-2 Н-пиразол-3-иламин. а) 3-(2,6-Диметилфенил)-3-оксопропионитрил. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 1) с кипячением смеси с обратным холодильником в течение ночи и затем в течение 2 ч при 110 С. Неочищенный продукт экстрагировали ДХМ и использовали на следующей стадии без дополнительной очистки (2,2 г,выход: 76%).C11H11NO б) 5-(2,6-Диметилфенил)-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенное вещество очищали при помощи колонки Si (элюент: ДХМ) и промывали водой, экстрагировали и сушили с получением указанного в заголовке продукта (0,25 г, выход 10%).C11H13N3 1 Н-ЯМР (CD3OD): 2.09-2.23 (6 Н, m); 7.04-7.12 (2 Н, m); 7.18-7.26 (2 Н, m). 5-(2-Хлор-4-фторфенил)-2 Н-пиразол-3-иламин. а) 3-(2-Хлор-4-фторфенил)-3-оксопропионитрил. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 1) из метилового эфира 2-хлор-4-фторбензойной кислоты (0,7 г, 3,7 ммоль, 1,0 экв.). Неочищенный продукт экстрагировали ДХМ и использовали на следующей стадии без дополнительной очистки (0,4 г, выход: 60%).C9H5ClFNO б) 5-(2-Хлор-4-фторфенил)-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенное вещество растворяли в ДХМ, промывали насыщ. NaHCO3, экстрагировали и сушили с получением указанного в заголовке продукта (0,12 г, выход 26%).C9H7ClFN3 1 Н-ЯМР (ДМСО-d6): 7.03-7.53 (4 Н, m). 5-(5-трет-Бутилтиофен-2-ил)-2 Н-пиразол-3-иламин. а) 3-(5-трет-Бутилтиофен-2-ил)-3-оксопропионитрил. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 1) из метилового эфира 5-трет-бутилтиофен-2-карбоновой кислоты (3,0 г, 15,0 ммоль, 1,0 экв.). Неочищенный продукт экстрагировали ДХМ и использовали на следующей стадии без дополнительной очистки (2,7 г, выход: 86%).C11H13NOS б) 5-(5-трет-Бутилтиофен-2-ил)-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенное вещество промывали водой и осаждали с получением указанного в заголовке продукта (2,7 г, выход 91%).(1 Н, m). 5-(3-Хлор-2-метилфенил)-2 Н-пиразол-3-иламин. а) Метиловый эфир 2-этилбензойной кислоты. 2-Этилбензойную кислоту (3,0 г, 17,6 ммоль) растворяли в МеОН (20 мл) и добавляли серную кислоту (1 мл). Смесь кипятили с обратным холодильником в течение ночи, после чего растворитель выпаривали при пониженном давлении; неочищенное вещество растворяли в ДХМ и промывали насыщеннымNa2CO3 до основного рН. Органическую фазу сушили и упаривали при пониженном давлении и продукт(3,1 г, выход 96%) использовали без дополнительной очистки.C9H9ClO2 1 Н-ЯМР (ДМСО-d6): 2.48 (3H, brs); 3.82 (3H, s); 7.31 (1 Н, t, J=7.6 Гц); 7.63-7.67 (2 Н, m). б) 3-(3-Хлор-2-метилфенил)-3-оксопропионитрил. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 1) из метилового эфира 3-хлор-2-метилбензойной кислоты (3,1 г, 16,8 ммоль, 1,0 экв.). Неочищенный продукт осаждали из воды и использовали на следующей стадии без дополнительной очистки (2,4 г, выход: 74%).C10H8ClNO 1 Н-ЯМР (ДМСО-d6): 2.31 (3H, br s); 4.64 (2 Н, br s); 7.27-7.36 (2 Н, m); 7.54-7.77 (1 Н, m). в) 5-(3-Хлор-2-метилфенил)-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенный продукт очищали через колонку SiO2 (20 г) с элюцией градиентом от 100% EtOAc до EtOAc-МеОН 80:20. Получали указанный в заголовке продукт (1,3 г, выход 50%).C10H10ClN3 Масса (вычисленная) [207]; (найденная) [М+Н+]=208. ЖХ Rt=1,96 мин, 85% (10 мин способ). 1 Н-ЯМР (CDCl3): 2.41 (3H, s); 5.74 (1 Н, s); 7.16 (1 Н, t, J=8.0 Гц); 7.20-7.26 (1H, m); 7.38-7.40 (1H, m). 5-(2-Этилфенил)-2 Н-пиразол-3-иламин. а) Метиловый эфир 2-этилбензойной кислоты. 2-Этилбензойную кислоту (3,0 г, 20,0 ммоль) растворяли в МеОН (20 мл) и добавляли каталитическое количество серной кислоты (1 мл). Смесь кипятили с обратным холодильником в течение ночи, после чего растворитель выпаривали при пониженном давлении; неочищенное вещество растворяли в ДХМ и промывали насыщенным Na2CO3 до основного рН. Органическую фазу сушили и выпаривали при пониженном давлении и продукт (2,9 г, выход 88%) использовали без дополнительной очистки. С 10 Н 12 О 2 1 Н-ЯМР (ДМСО-d6): 1.12 (3H, t, J=7.2 Гц); 2.86 (2 Н, q, J=7.2 Гц); 3.81 (3H, s); 7.27-7.34 (2 Н, m); 7.467.51 (1 Н, m); 7.73-7.75 (1 Н, m). б) 3-(2-Этилфенил)-3-оксопропионитрил. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 1) из метилового эфира 2-этилбензойной кислоты (2,9 г, 17,6 ммоль, 1,0 экв.). Неочищенный продукт экстрагировали ДХМ в виде желтого масла и использовали на следующей стадии без дополнительной очистки (2,8 г,выход: 92%).C11H11NO 1 Н-ЯМР (ДМСО-d6): 1.10-1.18 (3H, m); 2.78 (2H, q, J=7.2 Гц); 4.67 (1H, s); 7.23-7.53 (3H, m); 7.737.78 (1H, m). в) 5-(2-Этилфенил)-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенный продукт очищали при помощи колонки SiO2 (20 г) с элюцией градиентом от 100% EtOAc до EtOAcМеОН 80:20. Получали указанный в заголовке продукт (1,2 г, выход 40%).- 21016948 5-(4-Метоксифенил)-4-метил-2 Н-пиразол-3-иламин. а) 3-(4-Метоксифенил)-2-метил-3-оксопропионитрил. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 1) из метилового эфира 4-метоксибензойной кислоты (3,0 мл, 18,0 ммоль, 1,0 экв.), NaH (1,4 г, 36,0 ммоль, 2,0 экв.) и пропионитрила (6,1 мл, 84,9 ммоль, 4,7 экв.). Неочищенное вещество очищали при помощи колонки SiC11H11NO2 б) 5-(4-Метоксифенил)-4-метил-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенный продукт промывали подщелаченной водой, сушили и указанный в заголовке продукт (1,8 г, выход 80%) использовали без дополнительной очистки.C11H13N3O Масса (вычисленная) [203]; (найденная) [М+Н+]=204. ЖХ Rt=1,34 мин, 91% (10 мин способ). 1 Н-ЯМР (CDCl3): 2.03 (3H, s); 3.84 (3H, s); 6.96-6.98 (2 Н, m); 7.37-7.39 (2 Н, m). 4-Метил-5-(4-трифторметилфенил)-2 Н-пиразол-3-иламин. а) 2-Метил-3-оксо-3-(4-трифторметилфенил)пропионитрил. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 1) из метилового эфира 4-трифторметилбензойной кислоты (3,0 г, 14,7 ммоль, 1,0 экв.), NaH (1,2 г, 29,4 ммоль,2,0 экв.) и пропионитрила (4,9 мл, 69,4 ммоль, 4,7 экв.). Неочищенный продукт экстрагировали ДХМ и использовали на следующей стадии без дополнительной очистки (3,2 г, выход: 96%).C11H8F3NO б) 4-Метил-5-(4-трифторметилфенил)-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенный продукт промывали подщелаченной водой и сушили и указанный в заголовке продукт (2,8 г, выход 84%) использовали без дополнительной очистки.C11H10F3N3 Масса (вычисленная) [241]; (найденная) [М+Н+]=242. ЖХ Rt=2,34 мин, 92% (10 мин способ). 1 Н-ЯМР (CDCl3): 2.05 (3H, s); 7.56 (2 Н, d, J=8.4 Гц); 7.64 (2 Н, d, J=8.4 Гц). 5-(4-Циклопропилметокси-2-метилфенил)-2 Н-пиразол-3-иламин. а) Метиловый эфир 4-гидрокси-2-метилбензойной кислоты. 4-Гидрокси-2-метилбензойную кислоту (4,8 г, 32,0 ммоль) растворяли в МеОН (40 мл) и добавляли каталитическое количество серной кислоты (1 мл). Смесь кипятили с обратным холодильником в течение ночи, после чего растворитель выпаривали при пониженном давлении; неочищенное вещество растворяли в ДХМ и промывали насыщенным NaHCO3 до основного рН. Органическую фазу сушили и упаривали при пониженном давлении и продукт (5,0 г, выход 95%) использовали без дополнительной очистки. С 9 Н 10 О 3 1 Н-ЯМР (ДМСО-d6): 2.43 (3H, s); 3.72 (3H, s); 6.62-6.64 (2 Н, m); 7.71-7.73 (1 Н, m); 10.10 (1H, s). б) Метиловый эфир 4-циклопропилметокси-2-метилбензойной кислоты. Метиловый эфир 4-гидрокси-2-метилбензойной кислоты (1,0 г, 6,0 ммоль, 1,0 экв.) растворяли в ацетоне (14 мл), добавляли NaI (0,45 г, 3,0 ммоль, 0,5 экв.) и K2CO3 (1,66 г, 12,0 ммоль, 2,0 экв.) и смесь перемешивали при комнатной температуре в течение 20 мин. Добавляли (бромметил)циклопропан(0,53 мл, 5,4 ммоль, 0,9 экв.) и смесь кипятили с обратным холодильником в течение 2 суток. Растворитель концентрировали при пониженном давлении, добавляли NaOH 10% и неочищенное вещество экстрагировали ДХМ и сушили. Выделяли 0,42 г указанного в заголовке продукта (выход 32%) и использовали без дополнительной очистки. С 13 Н 16 О 3 1 Н-ЯМР (CDCl3): 0.23-0.34 (2 Н, m); 0.52-0.64 (2 Н, m); 1.15-1.24 (1 Н, m); 2.52 (3H, s); 3.75 (2 Н, d,J=7.2 Гц); 3.77 (3H, s); 6.64-6.66 (1 Н, m); 7.83-7.85 (2 Н, m). в) 3-(4-Циклопропилметокси-2-метилфенил)-3-оксопропионитрил. Продукт получали в соответствии с общим способом синтеза аминопиразола из метилового эфира 4-циклопропилметокси-2-метилбензойной кислоты (путь А 1 бис). 0,54 г указанного в заголовке продукта экстрагировали из воды и сушили (выход 69%) и использовали непосредственно на следующей стадии.C14H15NO2 г) 5-(4-Циклопропилметокси-2-метилфенил)-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенный продукт очищали при помощи колонки SiO2 с элюцией градиентом от 100% EtOAc до EtOAc-МеОН 90:10. Получали указанный в заголовке продукт (206 мг, выход 36%).J=7.2 Гц); 5.67 (1H, s); 6.74-6.80 (2 Н, m); 7.25 (1 Н, d, J=8.8 Гц). 5-(3-Хлор-4-циклопропилметоксифенил)-2 Н-пиразол-3-иламин. а) Метиловый эфир 3-хлор-4-циклопропилметоксибензойной кислоты. Метиловый эфир 3-хлор-4-гидроксибензойной кислоты (1,1 г, 6,0 ммоль, 1,0 экв.) растворяли в ацетоне (14 мл), добавляли NaI (0,45 г, 3,0 ммоль, 0,5 экв.) и K2CO3 (1,66 г, 12,0 ммоль, 2,0 экв.) и смесь перемешивали при комнатной температуре в течение 20 мин. Добавляли (бромметил)циклопропан (0,53 мл,5,4 ммоль, 0,9 экв.) и смесь кипятили с обратным холодильником в течение 2 суток. Растворитель концентрировали при пониженном давлении, добавляли 10%NaOH и неочищенное вещество экстрагировали ДХМ и сушили. Указанный в заголовке продукт (0,88 г, выход 32%) выделяли и использовали без дополнительной очистки.C12H13ClO3 1 Н-ЯМР (ДМСО-d6): 0.33-0.37 (2 Н, m); 0.55-0.60 (2 Н, m); 1.25-1.27 (1 Н, m); 3.80 (3H, s); 3.99 (2 Н, d,J=7.2 Гц); 7.21 (1 Н, s, J=8.8 Гц); 7.85-7.91 (2 Н, m). б) 3-(3-Хлор-4-циклопропилметоксифенил)-3-оксопропионитрил. Продукт получали в соответствии с общим способом из метилового эфира 3-хлор-4 циклопропилметоксибензойной кислоты (путь А 1 бис). 0,74 г указанного в заголовке продукта экстрагировали из воды и сушили (выход 81%) и использовали непосредственно на следующей стадии.C13H12ClNO2 в) 5-(3-Хлор-4-циклопропилметоксифенил)-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенный продукт очищали при помощи колонки SiO2 (элюция градиентом от 100% EtOAc до EtOAc-МеОН 90:10). Получали 521 мг указанного в заголовке продукта (выход 67%).(1 Н, s); 6.95-6.99 (1 Н, m); 7.24-7.30 (2 Н, m). 5-(4-Циклопропилметокси-2-трифторметилфенил)-2 Н-пиразол-3-иламин. а) Метиловый эфир 4-гидрокси-2-трифторметилбензойной кислоты. 4-Гидрокси-2-трифторметилбензойную кислоту (5,0 г, 24,0 ммоль) растворяли в МеОН (50 мл) и добавляли каталитическое количество серной кислоты. Смесь кипятили с обратным холодильником в течение ночи, после чего растворитель выпаривали при пониженном давлении; неочищенное вещество растворяли в ДХМ и промывали насыщенным NaHCO3. Органическую фазу сушили и упаривали при пониженном давлении и продукт использовали без дополнительной очистки.C9H7F3O3 б) Метиловый эфир 4-циклопропилметокси-2-трифторметилбензойной кислоты. Метиловый эфир 4-гидрокси-2-трифторметилбензойной кислоты (1,1 г, 4,8 ммоль, 1,0 экв.) растворяли в ацетоне (14 мл), добавляли NaI (0,5 экв.) и K2CO3 (1,04 г, 2,0 экв.) и смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли (бромметил)циклопропан (0,42 мл, 4,3 ммоль, 0,9 экв.) и смесь кипятили с обратным холодильником в течение 2 суток. Растворитель концентрировали при пониженном давлении, добавляли 10% NaOH и его экстрагировали ДХМ и сушили. Указанный в заголовке продукт (1,21 г, выход 92%) выделяли и использовали без дополнительной очистки.C13H13F3O3 в) 3-(4-Циклопропилметокси-2-трифторметилфенил)-3-оксопропионитрил. Продукт получали в соответствии с общим способом (путь А 1 бис). Смесь подкисляли 1 М HCl и органическую фазу отделяли и сушили с получением 1,2 г указанного в заголовке продукта (выход 94%),который использовали непосредственно на следующей стадии.C14H12F3NO2 Масса (вычисленная) [283]; (найденная) [М+Н+]=284. ЖХ Rt=3,86 мин, 98% (10 мин способ). г) 5-(4-Циклопропилметокси-2-трифторметилфенил)-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенный продукт очищали при помощи колонки SiO2 (элюция градиентом от этилацетат-циклогексан 1:1 до этилацетат-МеОН 90:10). Получали 650 мг указанного в заголовке продукта (выход 52%).C14H14F3N3O Масса (вычисленная) [297]; (найденная) [М+Н+]=298. ЖХ Rt=2,78 мин, 59% (10 мин способ). 1 Н-ЯМР (CDCl3): 0.32-0.44 (2 Н, m); 0.64-0.62 (2 Н, m); 1.22-1.37 (1 Н, m); 3.80-3.92 (2 Н, m); 5.78 (1 Н,s); 7.04-7.07 (1 Н, m); 7.24-7.26 (1 Н, m); 7.38-7.40 (1 Н, m). 5-(4-Циклопропилметокси-2,3-дифторфенил)-2 Н-пиразол-3-иламин. а) Метиловый эфир 4-гидрокси-2,3-дифторбензойной кислоты. 4-Гидрокси-2,3-дифторбензойную кислоту (2,0 г, 11,5 ммоль) растворяли в МеОН (20 мл) и добав- 23016948 ляли каталитическое количество серной кислоты. Смесь кипятили с обратным холодильником в течение ночи, после чего растворитель выпаривали при пониженном давлении; неочищенное вещество растворяли в ДХМ и промывали насыщенным NaHCO3. Органическую фазу сушили и упаривали при пониженном давлении и продукт использовали без дополнительной очистки.C8H6F2O3 б) Метиловый эфир 4-циклопропилметокси-2,3-дифторбензойной кислоты. Метиловый эфир 4-гидрокси-2,3-дифторбензойной кислоты (0,9 г, 4,8 ммоль, 1,0 экв.) растворяли в ацетоне (14 мл), добавляли NaI (0,5 экв.) и K2CO3 (1,03 г, 2,0 экв.) и смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли (бромметил)циклопропан (0,42 мл, 0,9 экв.) и смесь кипятили с обратным холодильником в течение 2 суток. Растворитель концентрировали при пониженном давлении,добавляли 10% NaOH и экстрагировали ДХМ и сушили. Указанный в заголовке продукт (0,97 г, выход 84%) отделяли и использовали без дополнительной очистки.C12H12F2O3 в) 3-(4-Циклопропилметокси-2,3-дифторфенил)-3-оксопропионитрил. Продукт получали в соответствии с общим способом (путь А 1 бис). Смесь подкисляли 1 М HCl и органическую фазу отделяли и сушили с получением 0,79 г указанного в заголовке продукта (выход 79%), который использовали непосредственно на следующей стадии.C13H11F2NO2 Масса (вычисленная) [251]; (найденная) [М+Н+]=252. ЖХ Rt=3,53 мин, 82% (10 мин способ). г) 5-(4-Циклопропилметокси-2,3-дифторфенил)-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенный продукт очищали при помощи колонки SiO2 (элюция градиентом от EtOAc-циклогексан 1:1 доC13H13F2N3O Масса (вычисленная) [265]; (найденная) [М+Н+]=266. ЖХ Rt=2,59 мин, 75% (10 мин способ). 1 Н-ЯМР (CDCl3): 032-0.47 (2 Н, m); 0.64-0.75 (2 Н, m); 1.19-1.38 (1 Н, m); 3.67-4.15 (4 Н, m); 5.95 (1 Н,s); 6.74-6.88 (1 Н, m); 7.17-7.26 (1 Н, m). 5-(3,5-Дихлор-4-циклопропилметоксифенил)-2 Н-пиразол-3-иламин. а) Метиловый эфир 3,5-дихлор-4-циклопропилметоксибензойной кислоты. Этиловый эфир 3,5-дихлор-4-гидроксибензойной кислоты (1,0 г, 4,5 ммоль, 1,0 экв.) растворяли в ацетоне (14 мл), добавляли NaI (0,5 экв.) и K2CO3 (0,98 г, 9,0 ммоль, 2,0 экв.) и смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли (бромметил)циклопропан (0,39 мл, 4,1 ммоль,0,9 экв.) и смесь кипятили с обратным холодильником в течение 2 суток. Растворитель концентрировали при пониженном давлении, добавляли 10% NaOH и экстрагировали ДХМ и сушили. Указанного в заголовке продукта (0,98 г, выход 79%) отделяли и использовали без дополнительной очистки.C12H12Cl2O3 б) 3-(3,5-Дихлор-4-циклопропилметоксифенил)-3-оксопропионитрил. Продукт получали в соответствии с общим способом (путь А 1 бис). Смесь подкисляли 1 М HCl и органическую фазу отделяли и сушили с получением 0,91 г указанного в заголовке продукта (выход 90%), который использовали непосредственно на следующей стадии.C13H13Cl2N3O Масса (вычисленная) [283]; (найденная) [М+Н+]=284. ЖХ Rt=4,06 мин, 99% (10 мин способ). в) 5-(3,5-Дихлор-4-циклопропилметоксифенил)-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенный продукт очищали при помощи колонки SiO2 (элюция градиентом от EtOAc-циклогексан 1:1 до этилацетат:МеОН 90:10). Получали 750 мг указанного в заголовке продукта (выход 79%).C13H13Cl2N3O Масса (вычисленная) [297]; (найденная) [М+Н+]=298. ЖХ Rt=3,23 мин, 93% (10 мин способ). 1 Н-ЯМР (CDCl3): 0.23-0.46 (2 Н, m); 0.64-0.74 (2 Н, m); 1.30-1.48 (1 Н, m); 3.60-4.04 (4 Н, m); 5.86 (1 Н,s); 7.48 (2 Н, s). 5-(4-Циклопропилметокси-3-метоксифенил)-2 Н-пиразол-3-иламин. а) Метиловый эфир 4-циклопропилметокси-3-метоксибензойной кислоты. Метиловый эфир 4-гидрокси-3-метоксибензойной кислоты (1,0 г, 5,5 ммоль, 1,0 экв.) растворяли в ацетоне (14 мл), добавляли NaI (0,5 экв.) и K2CO3 (1,0 г, 2,0 экв.) и смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли (бромметил)циклопропан (0,53 мл, 0,9 экв.) и смесь кипятили с обратным холодильником в течение 2 суток. Растворитель концентрировали при пониженном давлении,добавляли 10% NaOH и экстрагировали ДХМ и сушили. Указанного в заголовке продукта (1,21 г, выход 93%) выделяли и использовали без дополнительной очистки.- 24016948 С 13 Н 16 О 4 б) 3-(4-Циклопропилметокси-3-метоксифенил)-3-оксопропионитрил. Продукт получали в соответствии с общим способом (путь А 1 бис). Смесь подкисляли 1 М HCl и органическую фазу отделяли и сушили с получением 1,24 г указанного в заголовке продукта (выход 99%), который использовали непосредственно на следующей стадии.C14H15NO3 Масса (вычисленная) [245]; (найденная) [М+Н+]=246. ЖХ Rt=3,03 мин, 100% (10 мин способ). в) 5-(4-Циклопропилметокси-3-метоксифенил)-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенный продукт очищали при помощи колонки SiO2 (элюция градиентом от EtOAc-циклогексан 1:1 до этилацетат:МеОН 90:10). Получали 220 мг указанного в заголовке продукта (выход 50%).C14H17N3O2 Масса (вычисленная) [259]; (найденная) [М+Н+]=260. ЖХ Rt=1,86 мин, 93% (10 мин способ). 1 Н-ЯМР (CDCl3): 0.27-0.43 (2 Н, m); 0.56-0.72 (2 Н, m); 1.23-1.40 (1 Н, m); 348 (2 Н, m); 3.87 (3H, s); 3.98 (2 Н, br s); 5.82 (1H, s); 6.85-6.89 (1H, m); 7.05-7.10 (2H, m). трет-Бутиловый эфир 3-амино-5-(3-фторфенил)пиразол-1-карбоновой кислоты. 3-Амино-5-(3-фторфенил)пиразол (5,0 г, 28,0 ммоль, 1,0 экв.) и 4,5 М KOH (50 мл, 226 ммоль,8 экв.) растворяли в ДХМ (200 мл) и добавляли ди-трет-бутилдикарбонат (6,5 г, 30,0 ммоль, 1,1 экв.); смесь перемешивали при комнатной температуре до полного превращения, обнаруживаемого при помощи анализа путем ЖХ-МС. Органическую фазу промывали насыщенным рассолом и выпаривали; неочищенное вещество кристаллизовалось с МеОН с получением 7,4 г указанного в заголовке продуктаC14H16FN3O2 1 Н-ЯМР (ДМСО-d6): 1.57 (9 Н, s), 5.80 (1 Н, s), 6.43 (2 Н, br s), 7.16-7.21 (1 Н, m), 7.41-7.47 (1 Н, m); 7.50-7.54 (1 Н, m); 7.58-7.60 (1 Н, m). трет-Бутиловый эфир 3-амино-5-орто-толилпиразол-1-карбоновой кислоты. 3-Амино-5-орто-толилпиразол (0,5 г, 2,89 ммоль, 1,0 экв.) и KOH 4,5 М (5,1 мл, 23,1 ммоль,8,0 экв.) растворяли в ДХМ (20 мл) и добавляли ди-трет-бутилдикарбонат (0,66 г, 3,0 ммоль, 1,1 экв.); смесь перемешивали при комнатной температуре до полного превращения, обнаруживаемого при помощи анализа путем ЖХ-МС. Органическую фазу промывали насыщенным рассолом и выпаривали с получением 0,6 г указанного в заголовке продукта (выход 76%).C15H19N3O2 Масса (вычисленная) [273]; (найденная) [М+Н+]=274. ЖХ Rt=2,34 мин, 96% (5 мин способ). трет-Бутиловый эфир 3-амино-5-(4-трифторметилфенил)пиразол-1-карбоновой кислоты. 3-Амино-5-(4-трифторметилфенил)пиразол (2,0 г, 8,8 ммоль, 1,0 экв.) и 4,5 М KOH (15,7 мл,70,5 ммоль, 8,0 экв.) растворяли в ДХМ (70 мл) и добавляли ди-трет-бутилдикарбонат (2,02 г, 9,2 ммоль,1,1 экв.); смесь перемешивали при комнатной температуре до полного превращения, обнаруживаемого при помощи анализа путем ЖХ-МС. Органическую фазу промывали насыщенным рассолом и выпаривали; неочищенное вещество кристаллизовалось с CH3CN с получением 1,9 г указанного в заголовке продукта (выход 69%).C15H16F3N3O2 Масса (вычисленная) [327]; (найденная) [М+Н+]=328. ЖХ Rt=2,59 мин, 100% (5 мин способ). 1 Н-ЯМР (ДМСО-d6): 1.57 (9 Н, s), 5.83 (1 Н, s), 6.46 (2 Н, s), 7.74 (2 Н, d, J=8.4 Гц), 7.95 (2 Н, d, J=8.8 Гц). 5-Пиридин-2-ил-2 Н-пиразол-3-иламин. а) Оксопиридин-2-илацетонитрил. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 1) из метилового эфира пиридин-2-карбоновой кислоты (3,0 г, 21,9 ммоль, 1,0 экв.). Неочищенное вещество осаждали из HCl с получением указанного в заголовке продукта в виде твердого вещества (2,2 г, выход: 69%), которое использовали непосредственно на следующей стадии.C8H6N2O б) 5-Пиридин-2-ил-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенный продукт растворяли в EtOAc, промывали NaHCO3, сушили и упаривали. ЯМР анализ продемонстрировал, что основная порция смеси неочищенного вещества все еще остается в открытой форме: смесь затем растворяли в СН 3 СООН и нагревали при 80 С в течение ночи для того, чтобы дать возможность для закрывания кольца открытой формы. Продукт затем выделяли в виде ацилированной формы, которую деацилировали при перемешивании с 6 н. HCl при 60 С в течение ночи с получением указанного вC8H8N4 1 Н-ЯМР (ДМСО-d6): 4.81 (2 Н, bs), 5.92 (1 Н, s), 7.21-7.24 (1 Н, m), 7.76 (2 Н, d), 8.51 (1H, d), 11.96 (1H,bs). 5-(3-Дифторметоксифенил)-2 Н-пиразол-3-иламин. а) Метиловый эфир 3-дифторметоксибензойной кислоты. Дифторметоксибензойную кислоту (2,0 г, 10,6 ммоль, 1,0 экв.) растворяли в МеОН (15 мл) и добавляли каталитическое количество серной кислоты. Смесь кипятили с обратным холодильником в течение ночи, после чего растворитель выпаривали при пониженном давлении; неочищенное вещество растворяли в ДХМ и промывали насыщенным NaHCO3 до основного рН. Органическую фазу сушили и упаривали при пониженном давлении и указанный в заголовке продукт использовали без дополнительной очистки(1 Н, s); 7.82 (1 Н, d, J=7.6 Гц). б) 3-(3-Дифторметоксифенил)-3-оксопропионитрил. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 1 бис) из метилового эфира 3-дифторметоксибензойной кислоты (1,5 г, 7,4 ммоль, 1,0 экв.). Неочищенное вещество осаждали путем добавления водного HCl с получением продукта, который использовали непосредственно на следующей стадии.C10H7F2NO2 в) 5-(3-Дифторметоксифенил)-2 Н-пиразол-3-иламин. Продукт получали в соответствии с общим способом синтеза аминопиразола (путь А 2). Неочищенный продукт очищали при помощи колонки Si с элюцией градиентом от 100% EtOAc до EtOAc-МеОН 90:10. Получали 1,45 г указанного в заголовке продукта (выход 87%).C10H9F2N3O 1 Н-ЯМР (ДМСО-d6): 4.89 (2 Н, br s), 5.75 (1 Н, s), 7.02 (1 Н, d), 7.25 (1 Н, t, J=74.0 Гц), 7.36-7.42 (2 Н,m), 7.48-7.50 (1 Н, d), 11.76 (1 Н, br s). 5-Пиразоло[1,5-а]пиридин-3-ил-2 Н-пиразол-3-иламин. а) 3-Оксо-3-пиразоло[1,5-а]пиридин-3-илпропионитрил. К раствору безводного ацетонитрила в толуоле (0,66 мл, 13 ммоль, 5 экв.), охлажденном до -78 С, в атмосфере азота по каплям добавляли раствор н-бутиллития в н-гексане (5,2 мл, 13 ммоль, 5 экв.). Смесь оставляли перемешиваться при -78 С в течение 20 мин и затем добавляли раствор метилового эфира пиразоло[1,5-а]пиридин-3-карбоновой кислоты (0,46 г, 2,6 ммоль, 1 экв.), полученный в соответствии с приведенным способом (Anderson et al. Journal of Heterocyclic Chemistry 1981, 18, 1149-1152) в толуоле и реакционной смеси давали возможность достичь комнатной температуры. После завершения взаимодействия после приблизительно 20 мин смесь охлаждали до 0 С и добавляли 2 н. HCl до рН 2. Органическую фазу отделяли, сушили над Na2SO4 и концентрировали при пониженном давлении с получением указанного в заголовке продукта, который использовали без дополнительной очистки на следующей стадии.EtOH (25 мл) добавляли гидразина моногидрат (0,44 мл, 9,0 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 18 ч. Реакционной смеси давали возможность охладиться до комнатной температуры и растворитель выпаривали при пониженном давлении. Остаток растворяли в ДХМ и промывали водой. Органическую фазу концентрировали при пониженном давлении с получением неочищенного продукта, который очищали при помощи колонки SiO2 (градиент от ДХМ до ДХМ:МеОН 95:5-85:15) с получением указанного в заголовке соединения с выходом 41% (0,29 г, 1,48 ммоль).(s, 2H). Масса (вычисленная) [199]; (найденная) [М+Н+]=200. ЖХ Rt=0,86 мин, 92% (5 мин способ). В следующей табл. 2 продемонстрированы аналитические данные, полученные для серий аминопиразолов, синтезированных в соответствии со способами А 1/А 2, изложенными в общем разделе.
МПК / Метки
МПК: C07D 231/40, C07D 473/04, C07D 403/12, C07D 401/04, C07D 407/04, A61P 25/00, C07D 487/04, C07D 407/14, C07D 413/12, C07D 403/14, C07D 409/04, A61K 31/4155, C07D 403/04
Метки: рецепторов, никотиновых, модуляторы, ацетилхолиновых
Код ссылки
<a href="https://eas.patents.su/30-16948-modulyatory-nikotinovyh-acetilholinovyh-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Модуляторы никотиновых ацетилхолиновых рецепторов</a>
Предыдущий патент: Беспроводное приемное устройство
Следующий патент: Трубопровод для транспортировки газа
Случайный патент: Способ определения траектории движения (ориентации) человека (спортсмена) или отдельных его частей и устройство для его реализации