1, 2-аннелированные производные хинолина
Номер патента: 4542
Опубликовано: 24.06.2004
Авторы: Бурдре Ксавье Марк, Вене Марк Гастон, Анжибо Патрик Рене
Формула / Реферат
1. Соединение формулы (I)
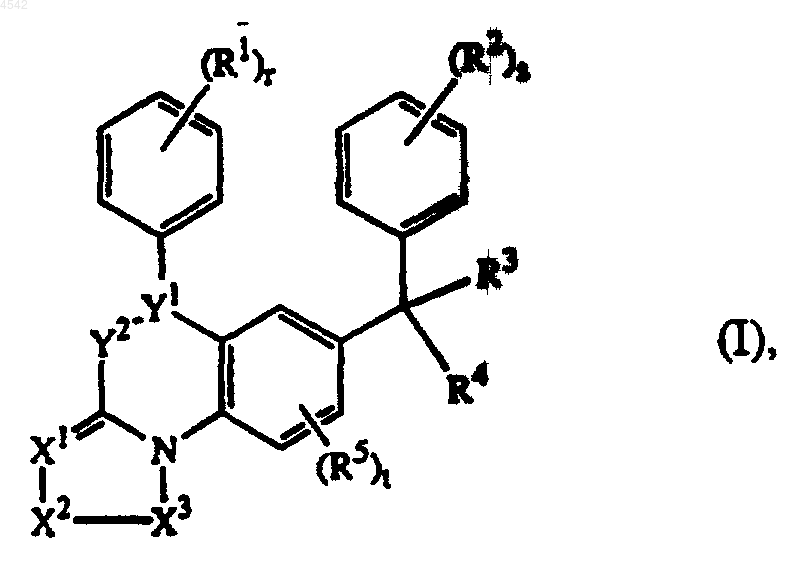
или его фармацевтически приемлемая соль присоединения кислоты, или его стереохимически изомерная форма,
где =XX-X2-X3- представляет собой тривалентный радикал формулы

где каждый из R6, R7 и R8 независимо представляет собой водород, C1-4алкил, гидрокси, C1-4алкилокси, арилокси, C1-4алкилоксикарбонил, гидроксиC1-4алкил, C1-4алкилоксиC1-4алкил, моно- или ди(C1-4алкил)аминоC1-4алкил, циано, амино, тио, C1-4алкилтио, арилтио или арил;
>Y1-Y2- представляет собой тривалентный радикал формулы
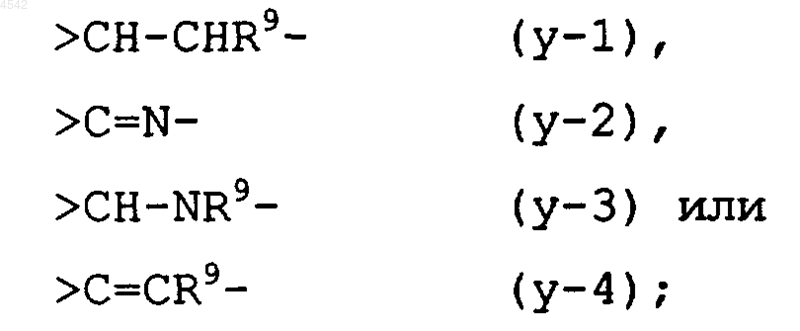
где каждый R9 независимо представляет собой водород, галоген, галогенкарбонил, аминокарбонил, гидроксиC1-4алкил, циано, карбоксил, C1-4алкил, C1-4алкилокси, C1-4алкилоксиC1-4алкил, C1-4алкилоксикарбонил, моно- или ди(C1-4алкил)амино, моно- или ди(C1-4алкил) аминоC1-4 алкил, арил;
r и s равны, каждый независимо, 0, 1, 2, 3, 4 или 5;
t равно 0, 1, 2 или 3;
каждый из R1 и R2 независимо представляет собой гидрокси, галоген, циано, C1-6алкил, тригалогенметил, тригалогенметокси, C2-6алкенил, C1-6алкилокси, гидроксиC1-6алкилокси, C1-6алкилтио, C1-6алкилоксиC1-6алкилокси, C1-6алкилоксикарбонил, аминоC1-6алкилокси, моно- или ди(C1-6алкил)амино, моно- или ди(C1-6алкил)аминоC1-6алкилокси, арил, арилC1-6алкил, арилокси или арилC1-6алкилокси, гидроксикарбонил, C1-6алкилоксикарбонил, аминокарбонил, аминоC1-6алкил, моно- или ди(C1-6алкил)аминокарбонил, моно- или ди(C1-6алкил) аминоC1-6алкил; или
два соседних заместителя R1 или R2 на фенильном кольце могут вместе независимо образовывать бивалентный радикал формулы
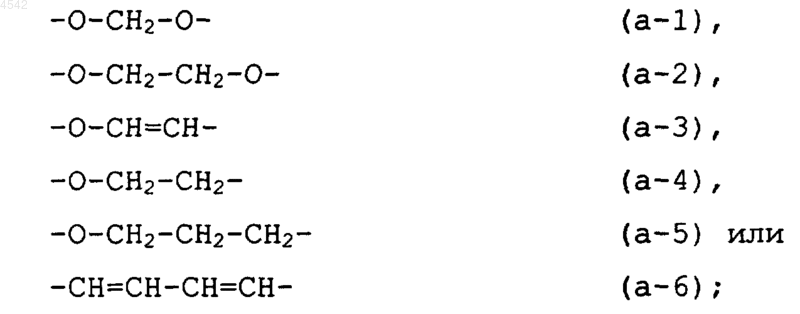
R3 представляет собой водород, галоген, C1-6алкил, циано, галогенC1-6алкил, гидроксиC1-6алкил, цианоC1-6алкил, аминоC1-6алкил, C1-6алкилоксиC1-6алкил, C1-6алкилтиоC1-6алкил, аминокарбонилC1-6алкил, гидроксикарбонил, гидроксикарбонилC1-6алкил, C1-6алкилоксикарбонилC1-6алкил, C1-6алкилкарбонилC1-6алкил, C1-6алкилоксикарбонил, арил, арилC1-6алкилоксиC1-6алкил, моно- или ди(C1-6алкил) аминоC1-6алкил;
или радикал формулы

где R10 представляет собой водород, C1-6алкил, C1-6алкилкарбонил, арил, арилC1-6алкил, C1-6алкилоксикарбонилC1-6 алкил,
или радикал формулы -Alk-OR13 или -Alk-NR14R15;
R11 представляет собой водород, C1-6алкил, арил или арилC1-6алкил;
R12 представляет собой водород, C1-6алкил, арил, гидрокси, амино, C1-6алкилокси, C1-6алкилкарбонилC1-6алкил, арилC1-6алкил, C1-6алкилкарбониламино, моно- или ди(C1-6алкил)амино, C1-6 алкилкарбонил, аминокарбонил, арилкарбонил, галогенC1-6 алкилкарбонил, арилC1-6алкилкарбонил, C1-6алкилоксикарбонил, C1-6алкилоксиC1-6алкилкарбонил, моно- или ди(C1-6алкил)аминокарбонил, где алкильная часть необязательно может быть замещена одним или несколькими заместителями, независимо выбранными из арила, C1-3алкилоксикарбонила, аминокарбонилкарбонила или моно- или ди(C1-6алкил)аминоC1-6алкилкарбонила,
или радикал формулы -Alk-OR13 или -Alk-NR14R15;
где Alk представляет собой C1-6алкандиил;
R13 представляет собой водород, C1-6алкил, C1-6 алкилкарбонил, гидроксиC1-6алкил, арил или арилC1-6алкил;
R14 представляет собой водород, C1-6алкил, арил или арилC1-6алкил;
R15 представляет собой водород, C1-6алкил, C1-6 алкилкарбонил, арил или арилC1-6алкил;
R4 представляет собой радикал формулы
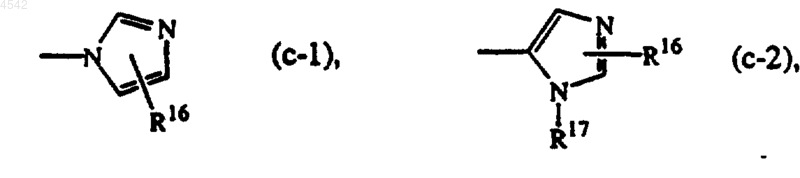
где R16 представляет собой водород, галоген, арил, C1-6алкил, гидроксиC1-6алкил, C1-6алкилоксиC1-6алкил, C1-6алкилокси, C1-6алкилтио, амино, моно- или ди(C1-4алкил)амино, гидроксикарбонил, C1-6алкилоксикарбонил, C1-6алкилтиоC1-6алкил, C1-6алкилS(O)C1-6алкил или C1-6алкилS(O)2C1-6алкил;
R16 может также быть связан с одним атомом азота имидазольного кольца формулы (c-1) или (c-2), в таком случае значение R16, связанного с азотом, ограничено водородом, арилом, C1-6алкилом, гидроксиC1-6алкилом, C1-6алкилоксиC1-6алкилом, C1-6алкилоксикарбонилом, C1-6алкилS(O)-C1-6алкилом или C1-6алкилS(O)2C1-6алкилом;
R17 представляет собой водород, C1-6алкил, C1-6алкилоксиC1-6алкил, арилC1-6алкил, трифторметил или ди(C1-4алкил)аминосульфонил;
R5 представляет собой C1-6алкил, C1-6алкилокси или галоген;
арил представляет собой фенил, нафталинил или фенил, замещенные 1 или несколькими заместителями, каждый из которых независимо выбран из галогена, C1-6алкила, C1-6алкилокси или трифторметила.
2. Соединение по п.1, где каждый из R1 и R2 представляет собой, независимо, гидрокси, галоген, циано, C1-6алкил, тригалогенметил, тригалогенметокси, C2-6алкенил, C1-6алкилокси, гидроксиC1-6алкилокси, C1-6алкилтио, C1-6алкилоксиC1-6алкилокси, C1-6алкилоксикарбонил, аминоC1-6алкилокси, моно- или ди(C1-6алкил)амино, моно- или ди(C1-6алкил) аминоC1-6алкилокси, арил, арилC1-6алкил, арилокси или арилC1-6алкилокси, гидроксикарбонил, C1-6алкилоксикарбонил; или два соседних заместителя R1 или R2 относительно друг друга на фенильном кольце могут вместе независимо образовывать бивалентный радикал формулы
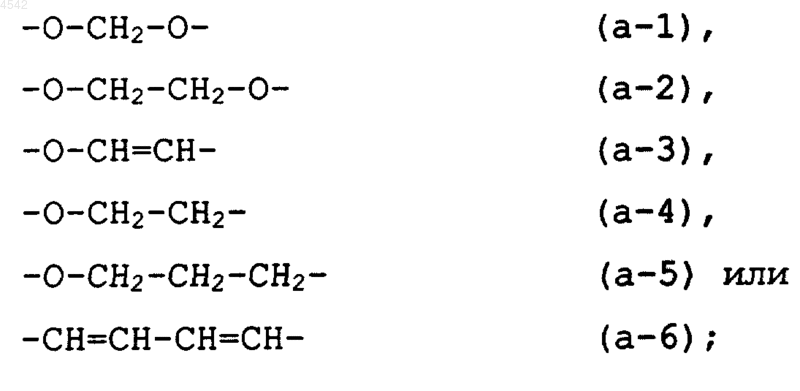
R16 представляет собой водород, галоген, арил, C1-6алкил, гидроксиC1-6алкил, C1-6алкилоксиC1-6алкил, C1-6алкилокси, C1-6алкилтио, амино, моно- или ди(C1-4алкил)амино, гидроксикарбонил, C1-6алкилоксикарбонил, C1-6алкилтиоC1-6алкил, C1-6алкилS(O)C1-6алкил или C1-6алкилS(O)2C1-6алкил;
R16 может быть также связан с одним из атомов азота имидазольного кольца формулы (c-1), в таком случае значение R16, связанного с азотом, ограничено водородом, арилом, C1-6алкилом, гидроксиC1-6алкилюь, C1-6алкилоксиC1-6алкилом, C1-6алкилоксикарбонилом, C1-6алкилS(O)C1-6алкилом или C1-6алкилS(O)2C1-6алкилом;
R17 представляет собой водород, C1-6алкил, трифторметил или ди(C1-4алкил)аминосульфонил.
3. Соединение по любому из пп.1 и 2,
где =X1-X2-X3- представляет собой тривалентный радикал формулы (x-1), (x-2), (x-3), (x-4) или (x-9),
где каждый R6 независимо представляет собой водород, C1-4алкил, C1-4алкилоксикарбонил, амино или арил и R7 представляет собой водород;
>Y1-Y2- представляет собой тривалентный радикал формулы (y-1), (y-2), (y-3) или (y-4),
где каждый R9 независимо представляет собой водород, галоген, карбоксил, C1-4алкил или C1-4алкилоксикарбонил;
r равно 0, 1 или 2; s равно 0 или 1; t равно 0;
R1 представляет собой галоген, C1-6алкил или два заместителя R1 в орто-положении относительно друг друга на фенильном кольце могут вместе независимо образовывать бивалентный радикал формулы (a-1);
R2 представляет собой галоген;
R3 представляет собой галоген или радикал формулы (b-1) или (b-3),
где R10 представляет собой водород или радикал формулы -Alk-OR13, R11 представляет собой водород;
R12 представляет собой водород, C1-6алкил, C1-6алкилкарбонил, гидрокси, C1-6алкилокси или моно- или ди(C1-6 алкил)аминоC1-6алкилкарбонил;
Alk представляет собой C1-6алкандиил и
R13 представляет собой водород;
R4 представляет собой радикал формулы (c-1) или (c-2),
где R16 представляет собой водород, галоген или моно- или ди (C1-4алкил) амино;
R17 представляет собой водород или C1-6алкил;
арил представляет собой фенил.
4. Соединение по любому из пп.1-3,
где =X1-X2-X3- представляет собой тривалентный радикал формулы (x-1),
>Y1-Y2- представляет собой тривалентный радикал формулы (y-4),
r равно 0 или 1, s равно 1, t равно O,
R1 представляет собой 3-хлор,
R2 представляет собой 4-хлор или 4-фтор,
R3 представляет собой водород или радикал формулы (b-1) или (b-3),
R4 представляет собой радикал формулы (c-1) или (c-2),
R6 представляет собой водород,
R7 представляет собой водород,
R9 представляет собой водород,
R10 представляет собой водород,
R11 представляет собой водород и
R12 представляет собой водород.
5. Соединение по любому из пп.1-4,
где =X1-X2-X3-представляет собой тривалентный радикал формулы (c-2) или (c-3), >Y1-Y2- представляет собой тривалентный радикал формулы (y-2), (y-3) или (y-4), r и s равны 1, t равно 0, R1 представляет собой 3-хлор или 3-метил, R2 представляет собой 4-хлор, R3 представляет собой радикал формулы (b-1) или (b-3), R4 представляет собой радикал формулы (c-2), R6 представляет собой C1-4алкил, R9 представляет собой водород, R10 и R11 представляют собой водород и R12 представляет собой водород или гидрокси.
6. Соединение по п.1 или 2, выбранное из группы, включающей
7-[(4-фторфенил)(1H-имидазол-1-ил)метил]-5-фенилимидазо[1,2-a]хинолин;
a-(4-хлорфенил)-a-(1-метил-1H-имидазол-5-ил)-5-фенилимидазо[1,2-a]хинолин-7-метанол;
5-(3-хлорфенил)-a-(4-хлорфенил)-a-(1-метил-1H-имидазол-5-ил)имидазо[1,2-a]хинолин-7-метанол;
5-(3-хлорфенил)-a-(4-хлорфенил)-a-(1-метил-1H-имидазол-5-ил)имидазо[1,2-a]хинолин-7-метанамин;
5-(3-хлорфенил)-a-(4-хлорфенил)-a-(1-метил-1H-имидазол-5-ил)тетразоло[1,5-a]хинолин-7-метанамин;
5-(3-хлорфенил)-a-(4-хлорфенил)-1-метил-a-(1-метил-1H-имидазол-5-ил)-1,2,4-триазоло[4,3-a]хинолин-7-метанол;
5-(3-хлорфенил)-a-(4-хлорфенил)-a-(1-метил-1H-имидазол-5-ил)тетразоло[1,5-a]-хинолин-7-метанамин;
5-(3-хлорфенил)-a-(4-хлорфенил)-a-(1-метил-1H-имидазол-5-ил)тетразоло[1,5-a]-хинолин-7-метанол;
5-(3-хлорфенил)-a-(4-хлорфенил)-4,5-дигидро-a-(1-метил-1H-имидазол-5-ил)тетразоло[1,5-a]хиназолин-7-метанол;
5-(3-хлорфенил)-a-(4-хлорфенил)-N-гидрокси-a-(1-метил-1H-имидазол-5-ил)тетрагидро[1,5-a]хинолин-7-метанамин;
a-(4-хлорфенил)-a-(1-метил-1H-имидазол-5-ил)-5-(3-метилфенил)тетразоло[1,5-a]хинолин-7-метанамин или
его фармацевтически приемлемая соль присоединения кислоты или стереохимически изомерная форма.
7. 5-(3-Хлорфенил)-a-(4-хлорфенил)-a-(1-метил-1H-имидазол-5-ил)тетразоло [1,5-a] хиназолин-7-метанамин или его фармацевтически приемлемая соль присоединения кислоты или стереохимически изомерная форма.
8. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения, указанного в любом из пп.1-7.
9. Способ получения фармацевтической композиции, указанной в п.8, заключающийся в том, что терапевтически эффективное количество соединения, указанного в любом из пп.1-7, тщательно смешивают с фармацевтически приемлемым носителем.
10. Применение соединения по любому из пп.1-7 в качестве лекарственного средства.
11. Применение по п.10, где лекарственным средством является лекарственное средство для ингибирования аномального роста клеток.
12. Применение соединения по п.10, где лекарственным средством является лекарственное средство для ингибирования роста опухоли.
13. Применение соединения по п.10, где лекарственным средством является лекарственное средство для ингибирования пролиферативных заболеваний.
14. Способ получения соединения, указанного в п.1, представленного соединением формулы (I-4), где =X1-X2-X3-представляет собой тривалентный радикал формулы (x-4), путем взаимодействия промежуточного соединения формулы (II) с NaN3
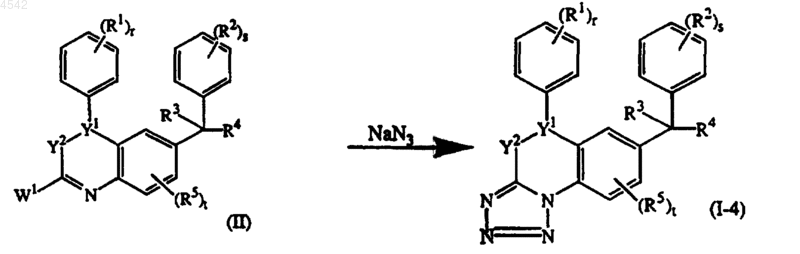
где >Y1-Y2-, R1, R2, R3, R4, R5, r, s и t такие, как указано в п.1, и W1 представляет собой удаляемую группу.
15. Способ получения соединения по п.1, представленного формулой (I-7), где >Y1-Y2- представляет собой тривалентный радикал формулы (y-3) или (y-1) и R9 представляет собой водород, путем взаимодействия соединения формулы (I-6), где >Y1-Y2- представляет собой тривалентный радикал формулы (y-2) или (y-4), с NaBH4 или LiAlH4
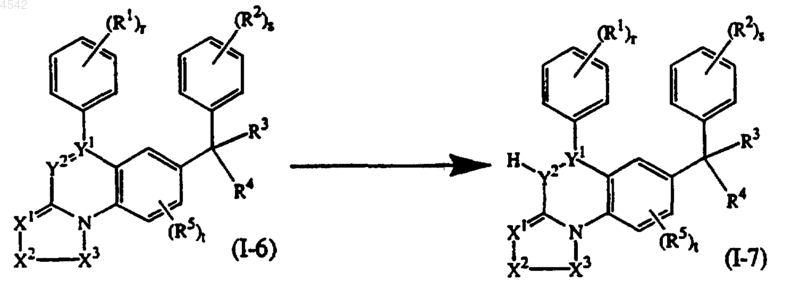
где =X1-X2-X3-, R1, R2, R3, R4, R5, r, s и t такие, как указано в п.1.
16. Способ получения соединения по п.1, представленного формулой (I-6), где >Y1-Y2- представляет собой тривалентный радикал формулы (y-2) или (y-4), путем окисления с помощью MnO2 соединения формулы (I-7), где >Y1-Y2- представляет собой тривалентный радикал формулы (y-3) или (y-1) и R9 представляет собой водород
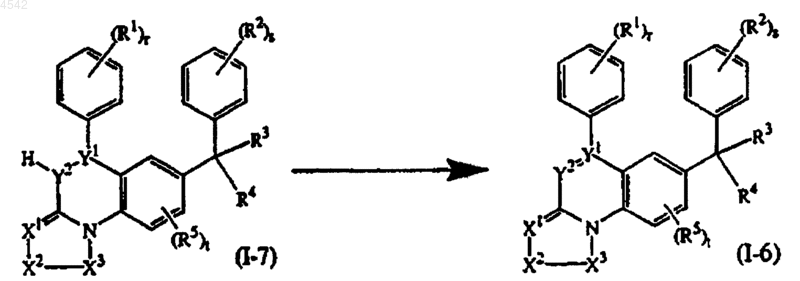
где =X1-X2-X3-, R1, R2, R3, R4, R5, r, s и t такие, как указанов п.1.
17. Способ получения соединения по п.1, представленного формулой (I-8-c), путем взаимодействия соединения формулы (I-8) с галогенирующим агентом и образованием соединения формулы (I-8-b), где R4 представляет собой галоген, с последующим взаимодействием соединения формулы (I-8-b) с реагентом формулы H-NR11R12
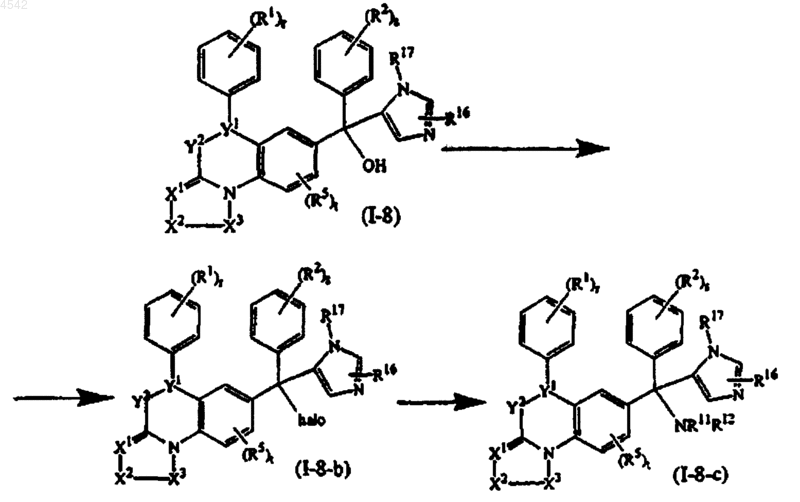
где =X1-X2-X3-, >Y1-Y2-, R1, R2, R3, R4 (в соединении I-8-b R4 представляет собой галоген), R5, R11, R12, R16, R17, r, s и t такие, как указано в п.1.
Текст
1 Настоящее изобретение относится к новым 1,2-аннелированным производным хинолина, их получению, фармацевтическим композициям,содержащим указанные новые соединения, и к использованию этих соединений в качестве лекарств, а также к способам лечения путем введения указанных соединений. Онкогены часто кодируют белковые компоненты путей передачи сигнала, которые приводят к стимуляции клеточного роста и митогенеза. Экспрессия онкогена в культивированных клетках приводит к клеточной трансформации,характеризующейся способностью клеток к росту в мягком агаре и росту клеток в виде плотных очагов, не проявляющих контактное ингибирование, характерное для нетрансформированных клеток. Мутация и/или избыточная экспрессия определенных онкогенов часто связана со злокачественными опухолями у человека. Определенная группа онкогенов, известная какras состоит из трех основных членов (изоформ): онкогены H-ras, K-ras и N-ras. Данные онкогены ras, кодирующие близкородственные белки, обычно известны как p21ras. Прикрепившись к плазматическим мембранам, мутированные или онкогенные формы p21ras обеспечивают сигнал к трансформации и неконтролируемому росту злокачественных опухолевых клеток. Приобретая такую возможность к трансформации, предшественник p21rdS белка может подвергаться ферментативно катализируемому фарнезилированию цистеинового радикала, находящегося на карбоксиконцевом тетрапептиде. Таким образом, ингибиторы ферментов, которые катализируют данный переход,например, фарнезилтрансферазы, будут предотвращать присоединение p21ras и блокировать аномальный рост ras-трансформированных опухолей. Следовательно, широко используемые в данной области ингибиторы фарнезилтрансферазы могут быть весьма полезными в качестве противораковых агентов в случае опухолей, в которых ras способствует трансформации. В-изоформа K-ras была обнаружена как преобладающая изоформа, являющаяся мутантной в злокачественных опухолях человека, в частности в злокачественных опухолях толстой кишки (50% случаев) и поджелудочной железы (90% случаев). Однако, также было обнаружено, что активация белка ras в злокачественных опухолях, трансформированных В-изоформой K-ras, устойчива к ингибированию фарнезилтрансферазы. Изоформа устойчива к ингибиторам фарнезилтрансферазы,однако, делает изоформу также субстратом для геранилгеранилтрансферазы I. Следовательно,ингибиторы геранилгеранилтрансферазы способны ингибировать аберрантное образование трансформированных K-ras опухолей, которые являют 004542 2 ся устойчивыми к ингибиторам фарнезилтрансферазы. Так как мутированные онкогенные формыras часто обнаруживаются во многих человеческих злокачественных опухолях, особенно часто, более чем в 50% случаев карциномы толстой кишки и поджелудочной железы (Kohl et al.,Science, vol. 260, 1834-1837, 1993), было замечено, что ингибиторы фарнезилтрансферазы могут быть весьма полезны для лечения этих видов злокачественных опухолей. В ЕР-0371564 описаны производные (1Hазол-1-илметил)замещенного хинолина и хинолинона, которые супрессируют элиминацию ретиноевой кислоты из плазмы. Некоторые из этих соединений также обладают способностью ингибирования образования андрогенов из прогестинов и/или ингибирования активности ароматазного ферментного комплекса. В WO 97/16443, WO 97/21701, WO 98/40383 и WO 98/49157 описаны производные 2-хинолона, которые проявляют ингибирующую фарнезилтрансферазу активность. Неожиданно было обнаружено, что данные новые 1,2-аннелированные хинолиновые соединения, содержащие азот- или углеродсвязанный имидазол, демонстрируют ингибирующую фарнезилпротеинтрансферазу активность и ингибирующую геранилгеранилтрансферазу активность. Настоящее изобретение относится к соединениям формулы или их фармацевтически приемлемой соли присоединения кислоты и стереохимическим изомерным формам,где =Х 1-Х 2-Х 3- представляет собой тривалентный радикал формулы =N-CR6=CR7- (х-1),=CR6-CR7=CR8- (х-6), =N-N-CR6- (x-2), =CR6-NCR7- (х-7), =N-NH-C(=O)- (х-3), =CR6-NHC(=O)- (х-8) или =N-N=N- (х-4), =CR6-N=N-(х 9); =N-CR6=N- (х-5),где каждый из R6, R7 и R8 независимо представляет собой водород, С 1-4 алкил, гидрокси, С 1-4 алкилокси, арилокси, С 1-4 алкилоксикарбонил, гидроксиС 1-4 алкил, С 1-4 алкилоксиС 1-4 алкил, моно- или ди(С 1-4 алкил) аминоС 1-4 алкил,циано, амино, тио, С 1-4 алкилтио, арилтио или арил;Y1-Y2- представляет собой тривалентный радикал формулы CH-CHR9- (y-1), C=N- (y2), CH-NR9- (y-3) или C=CR9- (y-4); 3 где каждый R9 независимо представляет собой водород, галоген, галогенкарбонил, аминокарбонил, гидроксиС 1-4 алкил, циано, карбоксил, С 1-4 алкил, С 1-4 алкилокси, С 1-4 алкилоксиС 1-4 алкил, С 1-4 алкилоксикарбонил, моно- или ди(С 1-4 алкил)амино, моно- или ди(С 1-4 алкил)аминоС 1-4 алкил, арил;t равно 0, 1, 2 или 3; каждый из R1 и R2 независимо представляет собой гидрокси, галоген, циано, C1-6 алкил,тригалогенметил, тригалогенметокси, С 2-6 алкенил, C1-6 алкилокси, гидроксиС 1-6 алкилокси,C1-6 алкилтио, С 1-6 алкилоксиС 1-6 алкилокси, С 1-6 алкилоксикарбонил, аминоC1-6 алкилокси, моноили ди(С 1-6 алкил) амино, моно- или ди(C1-6 алкил) аминоС 1-6 алкилокси, арил, арилС 1-6 алкил,арилокси или арилС 1-6 алкилокси, гидроксикарбонил, С 1-6 алкилоксикарбонил, аминокарбонил,аминоС 1-6 алкил, моно- или ди(С 1-6 алкил)аминокарбонил, моно- или ди(C1-6 алкил)аминоС 1-6 алкил; или два соседних заместителя R1 или R2 на фенильном кольце могут вместе независимо образовывать бивалентный радикал формулы(а-1),-О-СН 2-СН 2-О(а-2),-О-СН 2-О-О=СН=СН- (а-3), -О-СН 2-СН 2- (а-4), -О-СН 2 СН 2-СН 2- (а-5) или -СН=СН-СН=СН- (а-6); R3 представляет собой водород, галоген, С 1-6 алкил,циано, галогенС 1-6 алкил, гидроксиС 1-6 алкил, цианоС 1-6 алкил, аминоС 1-6 алкил, С 1-6 алкилоксиС 1-6 алкил, С 1-6 алкилтиоС 1-6 алкил, аминокарбонил С 1-6 алкил, гидроксикарбонил, гидроксикарбонил С 1-6 алкил, С 1-6 алкилоксикарбонилС 1-6 алкил, C1-6 алкилкарбонилС 1-6 алкил, С 1-6 алкилоксикарбонил, арил, арилС 1-6 алкилоксиС 1-6 алкил, моноили ди(С 1-6 алкил)аминоС 1-6 алкил; или радикал формулы -O-R10 (b-1), -S-R10 (b-2), -NR11R12(b-3), где R10 представляет собой водород, С 1-6 алкил, С 1-6 алкилкарбонил, арил, арилС 1-6 алкил,С 1-6 алкилоксикарбонилС 1-6 алкил, или радикал формулы -Alk-OR13 или -Alk-NR14R15; R11 представляет собой водород, С 1-6 алкил, арил или арилС 1-6 алкил;(C1-6 алкил)аминокарбонил, где алкильная часть необязательно может быть замещена одним или несколькими заместителями, независимо выбранными из арила или C1-3 алкилоксикарбонила, аминокарбонилкарбонила, моно- или или ди(C1-6 алкил)аминоС 1-6 алкилкарбонила,радикал формулы -Alk-OR13 или -Alk-NR14R15; где Alk представляет собой C1-6 алкандиил;R13 представляет собой водород, С 1-6 алкил,С 1-6 алкилкарбонил, гидроксиС 1-6 алкил, арил или арилС 1-6 алкил;R15 представляет собой водород, С 1-6 алкил,С 1-6 алкилкарбонил, арил или арилС 1-6 алкил;R4 представляет собой радикал формулыR16 может также быть связан с одним атомом азота имидазольного кольца формулы (с-1) или (с-2), в таком случае значение R16, когда он связан с азотом, ограничено водородом, арилом,C1-6 алкилом, гидроксиС 1-6 алкилом, С 1-6 алкилоксиС 1-6 алкилом, C1-6 алкилоксикарбонилом, С 1-6 алкилS(О)С 1-6 алки-лом или С 1-6 алкилом S (О)2 С 1-6 алкилом;R5 представляет собой С 1-6 алкил, C1-6 алкилокси или галоген; арил представляет собой фенил, нафталенил или фенил, замещенные 1 или несколькими заместителями, каждый из которых независимо выбран из галогена, C1-6 алкила, C1-6 алкилокси или трифторметила. Дополнительная группа соединений содержит такие соединения формулы (I),где каждый из R1 и R2 представляет собой,независимо, гидрокси, галоген, циано, C1-6 алкил,тригалогенметил, тригалогенметокси, С 2-6 алкенил, C1-6 алкилокси, гидроксиС 1-6 алкилокси,C1-6 алкилтио, С 1-6 алкилоксиС 1-6 алкилокси, С 1-6 алкилоксикарбонил, аминоС 1-6 алкилокси, моноили ди(С 1-6 алкил)амино, моно- или ди(C1-6 алкил)аминоС 1-6 алкилокси, арил, арилС 1-6 алкил,арилокси или арилС 1-6 алкилокси, гидроксикарбонил, С 1-6 алкилоксикарбонил; или два соседних заместителя R1 или R2 на фенильном кольце могут вместе независимо образовывать бивалентный радикал формулыR16 может быть также связан с одним из атомов азота имидазольного кольца формулы (с 1), в таком случае значение R16, связанного с азотом, ограничивается водородом, арилом, С 1-6 алкилом, гидроксиС 1-6 алкилом, С 1-6 алкилоксиС 1-6 алкилом, С 1-6 алкилоксикарбонилом, С 1-6 алкилR17 представляет собой водород, С 1-6 алкил,трифторметил или ди(С 1-4 алкил)аминосульфонил. Как использовалось в вышеуказанном определении и далее, галоген является родовым определением для фтора, хлора, брома и йода; С 1-4 алкил обозначает насыщенные углеводородные радикалы с прямой и разветвленной цепью,содержащие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил, 1 метилэтил, 2-метилпропил и тому подобное; C1-6 алкил включает C1-4 алкил и более высокие гомологи, содержащие от 5 до 6 атомов углерода,такие как, например, пентил, 2-метилбутил, гексил, 2-метилпентил и тому подобное; C1-6 алкандиил обозначает бивалентные насыщенные углеводородные радикалы с прямой и разветвленной цепью, содержащие от 1 до 6 атомов углерода, такие как, например, метилен, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,5-пентандиил, 1,6-гександиил и их разветвленные изомеры; С 2-6 алкенил обозначает углеводородные радикалы с прямой и разветвленной цепью,имеющие одну двойную связь и содержащие от 2 до 6 атомов углерода, такие как, например,этенил, 2-пропенил, 3-бутенил, 2-пентенил, 3 пентенил, 3-метил-2-бутенил и тому подобное. Термин "S(O)" относится к сульфоксиду, a"S(O)2" к сульфону. Фармацевтически приемлемые соли присоединения кислоты, как показано выше, включают терапевтически активную нетоксичную соль добавления кислоты, которую способно образовывать соединение формулы (I). Соединения формулы (I),которые обладают основными свойствами, могут быть преобразованы в их фармацевтически приемлемые соли прибавления кислот путем обработки указанных форм оснований соответствующей кислотой. Подходящие кислоты включают, например,неорганические кислоты, такие как галогенводородные кислоты, например, хлористо-водородную или бромисто-водородную кислоту; серную; азотную; фосфорную и тому подобные кислоты; или органические кислоты, такие как, например, уксусную, пропановую, гидроксиуксусную, молочную,пировиноградную, щавелевую, малоновую, янтарную (то есть бутандиовую кислоту), малеиновую,фумаровую, молочную, винную, лимонную, метансульфоновую, этансульфоновую, бензолсульфоновую, п-толуолсуль-фоновую, цикламиновую, салициловую, п-ами-носалициловую, памовую и тому подобные кислоты. 6 Термин соли присоединения кислоты также включает гидраты и сольваты, которые способны образовывать соединения формулы (I). Примерами таких форм являются, например,гидраты, алкоголяты и тому подобное. Термин стереохимически изомерные формы соединения формулы (I), как указано выше,характеризует все возможные соединения, состоящие из указанных атомов, путем указанной последовательности связей, однако имеющих различные, не взаимозаменяемые трехмерные структуры, которые могут иметь соединения формулы (I). Если не оговорено или не указано противное, химическое обозначение соединения охватывает смесь всех возможных стереохимически изомерных форм, которыми могут обладать указанные соединения. Указанная смесь может содержать все диастереомеры и/или энантиомеры основных молекулярных структур указанного соединения. Все стереохимически изомерные формы соединения формулы (I) в чистой форме или в виде смеси друг с другом включены в объем настоящего изобретения. Некоторые соединения формулы (I) могут также существовать в виде таутомерных форм. Такие формы, хотя и не указаны специально в вышеуказанной формуле, включены в объем настоящего изобретения. Всегда, когда здесь используется термин соединения формулы (I), это означает, что включены также фармацевтически приемлемые соли прибавления кислоты и все стереоизомерные формы. Группа представляющих интерес соединений включает такие соединения формулы (I),где применяются один или несколько следующих ограничений:=Х 1-Х 2-Х 3 представляет собой тривалентный радикал формулы (х-1), (х-2), (х-3), (х-4) или (х-9), где каждый R6 независимо представляет собой водород, С 1-4 алкил, С 1-4 алкилоксикарбонил, амино или арил и R7 представляет собой водород;Y1-Y2- представляет собой тривалентный радикал формулы (у-1), (у-2), (у-3) или (у-4), где каждый R9 независимо представляет собой водород, галоген, карбоксил, С 1-4 алкил или С 1-4 алкилоксикарбонил; r равно 0, 1 или 2; s равно 0 или 1; t равно 0;R1 представляет собой галоген, C1-6 алкил или два заместителя R1 в положении орто относительно друг друга на фенильном кольце могут вместе независимо образовывать бивалентный радикал формулы (а-1);R3 представляет собой галоген или радикал формулы (b-1) или (b-3), гдеR10 представляет собой водород или радикал формулы -Alk-OR13;R4 представляет собой радикал формулыR17 представляет собой водород или C1-6 алкил; арил представляет собой фенил. Конкретная группа соединения включает такие соединения формулы (I),где =Х 1-Х 2-Х 3 представляет собой тривалентный радикал формулы (х-1), (х-2), (х-3) или(х-9),Y1-Y2 представляет собой тривалентный радикал формулы (у-2), (у-3) или (у-4),r равно 0 или 1, s равен 1, t равно 0,R1 представляет собой галоген, С(1-4)алкил или бивалентный радикал формулы (а-1),R2 представляет собой галоген или С 1-4 алкил,R3 представляет собой водород или радикал формулы (b-1) или (b-3),R4 представляет собой радикал формулы(с-1) или (с-2),R6 представляет собой водород, С 1-4 алкил или фенил,R7 представляет собой водород,R9 представляет собой водород или С 1-4 алкил,R10 представляет собой водород или -Alk13R12 представляет собой водород или C1-6 алкилкарбонил, иR13 представляет собой водород. Предпочтительными соединениями являются такие соединения формулы (I),где =Х 1-Х 2-Х 3 представляет собой тривалентный радикал формулы (х-1),Y1-Y2 представляет собой тривалентный радикал формулы (у-4),r равно 0 или 1, s равно 1, t равно 0,R1 представляет собой галоген, предпочтительно хлор и более предпочтительно 3-хлор,R2 представляет собой галоген, предпочтительно 4-хлор или 4-фтор,R3 представляет собой водород или радикал формулы (b-1) или (b-3),R4 представляет собой радикал формулы(с-1) или (с-2),R6 представляет собой водород,R7 представляет собой водород,R9 представляет собой водород,R10 представляет собой водород,R11 представляет собой водород иR12 представляет собой водород. Другие предпочтительные соединения представляют собой такие соединения формулы 8 где =Х 1-Х 2-Х 3 представляет собой тривалентный радикал формулы (х-2) или (х-3),Y1-Y2 представляет собой тривалентный радикал формулы (у-2), (у-3) или (у-4),r и s равны 1, t равно 0,R1 представляет собой галоген, предпочтительно хлор и более предпочтительно 3-хлор,или R1 представляет собой С 1-4 алкил, предпочтительно 3-метил,R2 представляет собой галоген, предпочтительно хлор и более предпочтительно 4-хлор,R3 представляет собой радикал формулы(b-1) или (b-3),R4 представляет собой радикал формулы(с-2),R6 представляет собой С 1-4 алкил,R9 представляет собой водород,R10 и R11 представляют собой водород иR12 представляет собой водород или гидрокси. Более предпочтительными соединениями формулы (I) являются 7-[(4-фторфенил)(1H-имидазол-1-ил)метил]5-фенилимидазо-[1,2-а]хинолин;-(4-хлорфенил)(1-метил-1H-имидазол-5-ил)-5-(3-метилфенил)тетразоло[1,5-а]-хинолин-7-метанамин; фармацевтически приемлемые соли прибавления кислот и стереохимически изомерные формы. Соединения формулы (I), где =Х 1-Х 2-Х 3 представляет собой тривалентный радикал фор 9 мулы (х-1) и R6 и R7 представляют собой водород, представленные соединениями формулы (I1), обычно могут быть получены путем взаимодействия промежуточного соединения формулы(II) с реагентом формулы (III) или его функциональным производным, где W1 представляет собой подходящую удаляемую группу, такую как хлор, с последующей внутримолекулярной циклизацией, которая может быть проведена в инертном растворителе, таком как ксилол, и в присутствии подходящей кислоты, например уксусной кислоты. Реакцию можно удобно проводить при повышенной температуре в пределах от 80 С до температуры кипения с обратным холодильником. Альтернативно, соединения формулы (I),где =Х 1-Х 2-Х 3 представляет собой тривалентный радикал формулы (х-1), Y1-Y2 представляет собой тривалентный радикал формулы (у-4), R9 представляет собой водород и R6 и/или R7 не является водородом, представленные формулой(I-1-a), могут быть получены путем взаимодействия соединения формулы (IV) с реагентом формулы (V), с последующей внутримолекулярной циклизацией, которую можно проводить в инертном растворителе, таком как этанол. Реакцию удобно проводить при температуре в пределах от комнатной до 80 С. Соединения формулы (I), где =Х 1-Х 2-Х 3 представляет собой тривалентный радикал формулы (х-2), представленные соединениями формулы (I-2), обычно могут быть получены путем взаимодействия соединения формулы (II) с промежуточным соединением формулы (VI). Указанная реакция может проводиться в подходящем растворителе, таком как 1-бутанол, при повышенной температуре в пределах от 80 С до температуры кипения с обратным холодильником. Альтернативно, соединения формулы (I-2) могут быть получены путем взаимодействия соединения формулы (VIII) с промежуточным соединением формулы (VII). Указанная реакция может проводиться в подходящем растворителе,таком как н-бутанол, при температуре в пределах от комнатной до температуры кипения с обратным холодильником. Промежуточные соединения формулы (VII) могут быть получены путем взаимодействия промежуточного соединения формулы (II) с N2H4. Указанная реакция 10 может проводиться в инертном растворителе,например диоксане. Реакцию обычно можно проводить при температуре в пределах от комнатной температуры до 100 С. Соединения формулы (I-2), где R6 представляет собой амин, представленные соединениями формулы (I-2-a), могут быть получены путем взаимодействия промежуточного соединения формулы (VII) с BrCN в инертном растворителе, таком как метанол. Реакцию обычно можно проводить при температуре в пределах от 0 до 100 С. Соединения формулы (I), где =Х 1-Х 2-Х 3 представляет coбой тривалентный радикал формулы (х-3), представленные соединениями формулы (1-3) обычно могут быть получены путем взаимодействия промежуточного соединения формулы (VII) с соединением формулы (IX) в инертном растворителе, таком как тетрагидрофуран. Реакцию обычно можно проводить при температуре в пределах от 0 до 50 С. Альтернативно, соединения формулы (I-3) могут быть получены путем взаимодействия соединения формулы (X) с промежуточным соединением формулы (II). Указанную реакцию можно проводить в подходящем растворителе,таком как 1-бутанол, при температуре в пределах от 80 С до температуры кипения с обратным холодильником. Соединения формулы (I), где =Х 1-Х 2-Х 3 представляет собой тривалентный радикал фор 11 мулы (х-4), представленные соединениями формулы (I-4), обычно могут быть получены путем взаимодействия промежуточного соединения формулы (II) с NaN3 в инертном растворителе,таком как N,N-диметилформамид. Реакцию обычно можно проводить при повышенной температуре в пределах от 60 до 150 С. Соединения формулы (I-4) могут также быть получены путем взаимодействия промежуточного соединения формулы (XVIII) с NaNO2 в кислой водной среде, такой как, например, НСl в воде. Соединения формулы (I), где =Х 1-X2-X3 представляет собой тривалентный радикал формулы (х-9), YX-Y2 представляет собой тривалентный радикал формулы (у-4) и R9 представляет собой водород, представленные соединениями формулы (I-5), обычно могут быть получены путем взаимодействия промежуточного соединения формулы (XI) с соединением формулы (XII) в инертном растворителе, таком как метанол. Удобная реакционная температура находится в пределах от комнатной температуры до 80 С. Промежуточные соединения формулы (XI) могут быть получены путем взаимодействия промежуточного соединения формулы(XIII) с SeО 2 в инертном растворителе, таком как диоксан. Реакцию обычно можно проводить при повышенной температуре в пределах от комнатной температуры до температуры кипения с обратным холодильником. Промежуточные соединения формулы (XIII) обычно могут быть получены путем взаимодействия промежуточного соединения формулы (XIV) с 2 пропаноном в кислом растворе, таком как смесь уксусной кислоты и H2SO4. Реакцию обычно можно проводить при повышенной температуре в пределах от комнатной температуры до температуры кипения с обратным холодильником. Соединения формулы (I-6), определенные как соединения формулы (I), где Y1-Y2 представляет собой тривалентный радикал формулы(у-2) или (у-4), могут быть преобразованы в соответствующие соединения формулы (I-7), гдеY1-Y2 представляет собой тривалентный радикал формулы (у-3) или (у-1) и R9 представляет собой водород, используя известные в данной области способы восстановления, такие как обработка NaBH4 или LiAlH4 в подходящем растворителе, таком как метанол или тетрагидрофуран. И наоборот, соединения формулы (I-7) могут быть преобразованы в соответствующие соединения формулы (I-6) известными в данной области способами окисления, такими как окисление с помощью МnО 2 в инертном растворителе, таком как дихлорметан. Кроме того, соединения формулы (I-7) могут быть преобразованы в соединения формулы(I-7-a), где Y1-Y2 представляет собой тривалентный радикал формулы (у-3) или (у-1), и R9 не является водородом, путем взаимодействия этих соединений формулы (I-7) с реагентом формулы R9-W2, где W2 представляет собой соответствующую удаляемую группу, такую как иод, в инертном растворителе, например диметилформамиде, и в присутствии NaH. Реакцию обычно можно проводить при температуре в пределах от 0 до комнатной температуры. Соединения формулы (I), где R3 представляет собой радикал формулы (с-2) и R4 представляет собой гидрокси, представленные со 13 единениями формулы (I-8), могут быть преобразованы в соединения формулы (I-8-a), где R4 представляет собой водород, подвергая соединения формулы (I-8) соответствующим условиям восстановления, например перемешиванию в уксусной кислоте в присутствии формамида. Далее, соединения формулы (I-8) могут быть преобразованы в соединения формулы (I8-b), где R4 представляет собой галоген, путем взаимодействия соединений формулы (I-8) с соответствующим галогенирующим агентом,например, тионилхлоридом или трибромидом фосфора. Соединения формулы (I-8-b) могут быть успешно обработаны реагентом формулы Промежуточные соединения формулы (II) могут быть получены путем взаимодействия промежуточного соединения формулы (XV) с соответствующим галогенирующим реагентом,таким как РОСl3.(XV), где Y1-Y2 представлен формулой (у-1) или (у-4) и R4 представлен формулой (с-1), могут быть получены как описано в WO 97/16443,со строки 16, стр. 6 до строки 3, стр. 16. Промежуточные соединения формулы(XV), где Y1-Y2 представлен формулой (у-1) или (у-4) и R4 представлен формулой (с-2), могут быть получены как описано в WO 97/21701,со строки 28, стр. 7 до строки 3, стр. 16. Промежуточные соединения формулы(с-2), могут быть получены как описано в WO 98/49157, со строки 27, стр. 6 до строки 14, стр. 13. Альтернативно, промежуточные соединения формулы (II), где W1 представляет собой хлор и R3 представляет собой гидрокси, представленные промежуточными соединениями формулы (II-а), могут быть получены путем взаимодействия промежуточного соединения 14 формулы (XVI), где W3 представляет собой подходящую удаляемую группу, такую как Вr, с промежуточным кетоном формулы (XVII). Эту реакцию осуществляют путем преобразования промежуточного соединения формулы (XVI) в металлоорганическое соединение путем перемешивания его с сильным основанием, таким как бутиллитий, и затем добавлением промежуточного кетона формулы (XVII). Гидроксипроизводное может быть затем преобразовано в промежуточное соединение, где R4 имеет другое значение, путем осуществления известных в данной области преобразований. Промежуточные соединения формулы (IV) могут быть получены путем взаимодействия промежуточного соединения формулы (XIV) сCH3CN в присутствии NaH и подходящим основанием, таким как пиридин. Реакцию обычно можно проводить при повышенной температуре в пределах от 50 до 100 С. Промежуточные соединения формулы(XIV) могут быть получены по методам, описанным в WO 97/16443 и WO 97/21701. Соединения формулы (I) и некоторые промежуточные соединения имеют в структуре по меньшей мере один стереохимический центр. Этот стереохимический центр может иметь R или S конфигурацию. Соединения формулы (I), полученные способами, описанными выше, обычно представляют собой рацемические смеси энантиомеров,которые могут быть разделены с помощью следующих известных в данной области методов. Рацемические соединения формулы (I) могут быть преобразованы в соответствующую диастереомерную соль путем взаимодействия с соответствующей хиральной кислотой. Указанную диастереомерную соль затем разделяют, например, путем селективной или фракционной кристаллизации, и энантиомеры выделяют с помощью щелочи. Альтернативный способ выделения энантиомера соединения формулы (I) включает жидкую хроматографию с использованием стационарной хиральной фазы. Указанные чистые стереохимически изомерные формы могут быть также получены из соответствующих стереохимически чистых изомерные форм соответствующих исходных продуктов, при условии,что реакция протекает стереоселективно. Предпочтительно, если желателен конкретный стереоизомер, указанное соединение синтезируют стереоспецифическими методами получения. В этих методах успешно используются энантиомерно чистые исходные продукты. Соединения формулы (I), их фармацевтически приемлемые соли присоединения кислоты 15 и стереоизомерные формы обладают различными фармакологическими свойствами, где они неожиданно имеют фарнезилпротеинтрансферазный (ФПТаза) и геранилгеранилтрансферазный (ГГТаза) ингибирующий эффект. Кроме того, соединения формулы (I), в частности такие соединения формулы (I), где =Х 1 Х 2-Х 3 представляет собой тривалентный радикал формулы (х-4), проявляют сильное ингибирование ГГТазы. Обнаружено, что другие соединения формулы (I) являются особенно полезными для ингибирования активности ФПТазы. Данное изобретение относится к способу ингибирования аномального роста клеток,включая трансформированные клетки, путем введения эффективного количества соединения по изобретению. Аномальный рост клеток относится к росту клеток независимо от нормальных механизмов регуляции (например, утрата контактного ингибирования). Он включает аномальный рост: (1) опухолевых клеток (опухолей) экспрессирующих активированный онкогенras; (2) опухолевых клеток, в которых белок ras активирован в результате онкогенной мутации другого гена; (3) доброкачественных и злокачественных клеток других пролиферативных заболеваний, при которых происходит аномальная активация ras. Кроме того, в литературе было высказано предположение о том, что онкогеныras не только способствуют росту опухолей invivo путем прямого воздействия на развитие опухолевой клетки, но также косвенно, то есть путем способствования индуцированному опухолью ангиогенезу (Rak. J. et al., Cancer Research, 55, 4575-4580, 1995). Следовательно,фармакологическое нацеливание мутантных онкогенов ras могло бы подавлять рост солидной опухоли in vivo частично путем ингибирования индуцированного опухолью ангиогенеза. Данное изобретение относится также к способу ингибирования роста опухоли путем введения эффективного количества соединения по настоящему изобретению субъекту, например млекопитающему (и, более конкретно, человеку), нуждающемуся в таком лечении. В частности, данное изобретение относится к способу ингибирования роста опухолей, экспрессирующих активированный онкоген ras, путем введения эффективного количества соединения по настоящему изобретению. Примерами опухолей, которые могут быть ингибированы, являются, не ограничиваясь, злокачественная опухоль легкого (например, аденокарцинома), злокачественная опухоль поджелудочной железы(например, карцинома поджелудочной железы,такая как, например, экзокринная панкреатическая карцинома), злокачественные опухоли толстой кишки (например, колоректальная карцинома, такая как, например, аденокарцинома толстой кишки и аденома толстой кишки), опухоли из системы крови лимфоидного ряда (например, 004542 16 острый лимфолейкоз, В-клеточная лимфома,лимфома Беркитта), миелолейкозы (например,острый миелолейкоз (ОМЛ, фолликулярная злокачественная опухоль щитовидной железы,миелодиспластический синдром (МДС), опухоли мезенхимального происхождения (например,фибросаркомы и рабдомиосаркомы), меланомы,тератокарциномы, нейробластомы, глиомы,доброкачественные опухоли кожи (например,кератоакантомы), карцинома молочной железы,карцинома почек, карцинома яичника, карцинома мочевого пузыря и эпидермальная карцинома. Данное изобретение может также относиться к способу ингибирования пролиферативных заболеваний, как доброкачественных, так и злокачественных, где белки ras аномально активированы в результате онкогенной мутации в генах. Указанное ингибирование достигается путем введения эффективного количества описанного здесь соединения субъекту при необходимости такого лечения. Например, нейрофиброматозные доброкачественные пролиферативные расстройства или опухоли, в которых ras активируется путем мутации или избыточной экспрессии тирозинкиназных онкогенов, могут быть ингибированы с помощью соединений по данному изобретению. Соединения по настоящему изобретению являются особенно применимыми для лечения пролиферативных заболеваний, как доброкачественных, так и злокачественных, где K-ras В изоформа является активированной в результате онкогенной мутации. Итак, в настоящем изобретении описаны соединения формулы (I) для использования в качестве лекарственного препарата, а также для использования самого соединения формулы (I) для получения лекарственного препарата для лечения одного или нескольких вышеуказанных состояний. Ввиду этих полезных фармакологических свойств предложенные соединения могут быть включены в состав препаратов в виде различных фармацевтических форм для целей введения. Для получения фармацевтических композиций по данному изобретению эффективное количество конкретного соединения в виде основания или соли прибавления кислот в качестве активного ингредиента объединяли в однородную смесь с фармацевтически приемлемым носителем, которая может принимать разнообразные формы, в зависимости от вида препарата, необходимого для введения. Фармацевтические композиции, желательно в единичной дозированной форме, пригодны предпочтительно для введения перорально, ректально, подкожно или путем парентеральных инъекций. Например, при получении композиций в пероральной дозированной форме может использоваться любая обычная фармацевтическая среда, такая как,например, вода, гликоли, масла, спирты и тому 17 подобное, в случае пероральных жидких составов, такая как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазки, связующие вещества, разрыхляющие агенты и тому подобное в случае порошков, пилюль, капсул и таблеток. Ввиду простоты введения таблетки и капсулы представляют собой наиболее удобную пероральную дозированную единичную форму,в этом случае, очевидно, используются твердые фармацевтические носители. Для парентеральных композиций носитель обычно включает стерильную воду, по крайней мере, в большей степени, чем другие ингредиенты, хотя другие ингредиенты, например, для улучшения растворимости могут быть включены. Могут быть получены, например, растворы для инъекций, в которых носители содержат физиологический раствор, раствор глюкозы или смесь физиологического или глюкозного раствора. Также могут быть получены суспензии для инъекций, и в таком случае используются соответствующие жидкие носители, суспендирующие агенты и тому подобное. В композициях, пригодных для подкожного введения, носитель необязательно содержит агент для усиления проникновения и/или подходящий смачивающий агент, необязательно объединенные с соответствующими добавками любой природы в незначительной пропорции, которые не вызывают значительного вредного эффекта для кожи. Указанные добавки могут способствовать проникновению в кожу и/или могут быть полезны для получения желаемых композиций. Эти композиции могут вводиться различными способами, например в виде трансдермального пластыря, в виде разбрызгивания, в виде мази. Это особенно полезно дляприготовления вышеуказанных фармацевтических композиций в виде дозированных единичных форм для легкого введения и однородности дозировки. Дозированная единичная форма, как здесь использовано в описании и формуле, относится к физически дискретным единицам, соответствующим единичным дозам,каждая единица содержит заданное количество активного ингредиента, рассчитанного для получения желаемого терапевтического эффекта в сочетании с необходимым фармацевтическим носителем. Примерами таких стандартных единичных форм являются таблетки (включая таблетки с ядром или покрытые таблетки), капсулы, пилюли, пакетики с порошком, пластинки,растворы или суспензии для инъекций, расфасовки, соответствующие чайным ложкам, столовым ложкам и тому подобное, и их разделенные единицы. Специалисты в данной области смогут легко определить эффективное количество по результатам экспериментов, представленных ниже. Обычно предполагается, что эффективное количество может быть от 0,01 мг/кг до 100 мг/кг массы вещества, и в частности, от 0,05 18 мг/кг до 10 мг/кг массы вещества. Оно может быть приемлемым для введения требуемой дозы в виде двух, трех, четырех или более субдоз при соответствующих интервалах в течение дня. Указанные субдозы могут быть получены в виде стандартной лекарственной формы, например содержащей от 0,5 до 500 мг, и в частности от 1 до 200 мг активного ингредиента на единичную дозированную форму. Следующие примеры даны в целях иллюстрации. Экспериментальная часть Здесь и далее ТГФ означает тетрагидрофуран, ДИПЭ означает диизопропиловый эфир, ДМЭ означает 1,2-диметоксиэтан иEtOAc означает этилацетат. А. Получение промежуточных соединений Пример А 1.(0,0253 моль) в фосфорилхлориде (30 мл) кипятили с обратным холодильником в течение 1 ч. Смесь упаривали досуха и продукт использовали без дополнительной очистки с получением 10,4 г (99%) (+)-2-хлор-6-[(4-фторфенил)(1Hимидазол-1-ил)метил]-4-фенилхинолина (пром. соед. 1).b) Смесь промежуточного соединения (1)(0,0251 моль) в 2,2-диметоксиэтиламине (20 мл) перемешивали при 120 С в течение 12 ч. Смесь выливали в ледяную воду и экстрагировали СН 2 С 12. Органический слой сушили (MgSO4) и упаривали досуха. Маслянистый остаток (21 г) очищали с помощью колоночной хроматографии. Чистые фракции собирали и упаривали с получением 10 г (83%) -N-(2,2-диметоксиэтил)-6-[(4-фторфенил)(1H-имидазол-1-ил)метил]-4-фенил-2-хинолинамина (пром. соед. 2). Пример А 2. а) Получение промежуточного соединения К смеси -[2-амино-5-[(4-хлорфенил) гидрокси(1-метил-1H-имидазол-5-ил)метил]фенил](3-хлорфенил)метанона (0,00961 моль) и ацетонитрила (0,058 моль) в пиридине (30 мл) добавляли порциями гидрид натрия (0,0384 моль). Смесь перемешивали при 90 С в течение 6 ч и затем охлаждали. Добавляли Н 2 О. Растворитель упаривали. Остаток обрабатывалиCH2Cl2. Органический раствор промывали Н 2O,сушили (MgSO4), фильтровали и растворитель упаривали. Остаток (6,1 г) очищали с помощью колоночной хроматографии на силикагеле. Чистые фракции собирали и растворитель упаривали с получением 2,9 г (63%) промежуточного соединения 3. К смеси промежуточного соединения (3)(0,0019 моль) в ДМЭ (5 мл) добавляли этилбромпируват (0,0023 моль). Смесь перемешивали при комнатной температуре в течение 19 ч. Смолу отфильтровывали, промывали диэтиловым эфиром и использовали без дополнительной очистки с получением промежуточного соединения (4). Пример A3. Смесь -6-[(4-хлорфенил)-1H-имидазол 1-илметил]-4-фенил-2(1H)-хинолинона(MgSO4), отфильтровывали и упаривали. Продукт использовали без дополнительной очистки с получением 8 г (85%) -2-хлор-6-[(4 хлорфенил)-1H-имидазол-1-илметил]-4-фенилхинолина (пром. соед. 5). Пример А 4. Смесь промежуточного соединения (6)(0,0242 моль) в гидразингидрате (120 мл) и диоксане (240 мл) перемешивали при 70 С в течение ночи и затем доводили до комнатной температуры. Добавляли Н 2 О и смесь экстрагировалиCH2Cl2. Органический слой отделяли, промывали насыщенным раствором NaCl, сушили Раствор бутиллития в гексане (1,6 М) (74,4 мл) добавляли по каплям при -70 С в токе N2 к смеси 1-метилимидазола (0,119 моль) в ТГФ(200 мл). Смесь перемешивали при -70 С в течение 30 мин. Добавляли хлортриэтилсилан(0,119 моль). Смесь медленно доводили до 10 С и охлаждали вновь до -70 С. Добавляли по каплям раствор бутиллития в гексане (1,6 М) (74,4 мл). Смесь перемешивали при -70 С в течение 1 ч, доводили до -15 С и охлаждали вновь до-70 С. По каплям добавляли смесь промежуточного соединения (8) (0,052 моль) в ТГФ (200 мл). Смесь перемешивали при -70 С в течение 30 мин, гидролизовали, экстрагировали EtOAc и декантировали. Органический слой сушили(MgSO4), фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии. Чистые фракции собирали и растворитель упаривали с получением 12 г(46,5%) промежуточного соединения (9). Пример А 6. а) Получение промежуточного соединения (10)(3-хлорфенил)метанона (0,0415 моль) и 2-пропанона (0,124 моль) в серной кислоте (0,6 мл) и уксусной кислоте (55 мл) перемешивали и кипятили с обратным холодильником в течение ночи, доводили до комнатной температуры, выливали на лед, подщелачивали NH4OH и экстрагировали СН 2 Сl2. Органический слой отделяли,сушили (MgSO4), фильтровали и растворитель упаривали. Остаток (30 г) очищали с помощью колоночной хроматографии на силикагеле. Чистые фракции собирали и растворитель упаривали с получением 12 г (60%) продукта. Часть этой фракции (2 г) кристаллизовали из CH3CN. Остаток отфильтровывали и сушили с получением 1,25 г (37,5%) промежуточного продукта Смесь промежуточного соединения (10) К смеси промежуточного соединения (12)(0,0071 моль) в тетрагидрофуране (25 мл) добавляли по каплям при -70 С бутиллитий в гексане(MgSO4), фильтровали и растворитель упаривали досуха. Остаток (3,9 г) очищали с помощью колоночной хроматографии на силикагеле. Две чистые фракции собирали и растворители упаривали с получением 1,3 г (65%; исходный продукт (промежуточное соединение 13 и 0,71 г(0,024 моль) в ДМФ (50 мл) перемешивали при 100 С в течение 8 ч, доводили до комнатной температуры и выливали на лед. Остаток отфильтровывали, промывали Н 2 О и обрабатывали СН 2 Сl2. Органический слой отделяли, сушили, фильтровали и растворитель упаривали. Остаток обрабатывали CH3CN. Остаток отфильтровывали и сушили с получением 5,1 г промежуточного соединения (15) (76%). Пример А 9. Получение промежуточного соединения(MgSO4), фильтровали и растворитель упаривали. Остаток (11,8 г) очищали с помощью колоночной хроматографии на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH 97/3/0,1; 20-45 мкм). Чистые фракции собирали и растворитель упаривали. Выход: 5 г промежуточного соединения 16 (34%). Смесь 6-бром-2-хлор-4-(3-хлорфенил) хинолина (0,0276 моль) в ТГФ (30 мл) охлаждали до -70 С в токе N2. Добавляли по каплям 1,6 нBuLi в гексане (0,033 моль) при -70 С. Смесь перемешивали при -70 С в течение 1 ч. Добавляли по каплям раствор 2,4-дифторбензальдегида (0,0276 моль) в ТГФ (100 мл) при-70 С. Смесь перемешивали при -70 С в течение 1 ч, гидролизовали холодной и экстрагировалиEtOAc. Органический слой отделяли, промывали Н 2 О, сушили (MgSO4), фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии (элюент: СН 2 Сl2/СН 3 ОН 99,5/0,5; 20-45 мкм). Чистые фракции собирали и растворитель упаривали. Выход: 5,2 г промежуточного соединения (17) К смеси промежуточного соединения (17)(0,0125 моль) в диоксане (50 мл) добавляли МnО 2 (0,0374 моль). Смесь перемешивали при 80 С в течение ночи, доводили до комнатной температуры, фильтровали над целитом и промывали CH2Cl2. Фильтрат упаривали. Выход: 5 г промежуточного соединения (18) (96%). Пример A11. 23 19 и затем 3-хлорбензацетонитрил (0,147 моль). Смесь перемешивали и кипятили с обратным холодильником. Добавляли лед и затем этанол. Смесь оставляли кристаллизоваться. Остаток фильтровали, промывали этанолом и сушили с получением промежуточного соединения 20.c) К смеси промежуточного соединения 20(15% в Н 2 О; 308 мл) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 48 ч. Добавляли воду и смесь экстрагировали СН 2 Сl2. Органический слой отделяли, промывали 10% K2 СО 3, сушили, фильтровали и растворитель упаривали с получением промежуточного соединения 21.d) Смесь промежуточного соединения 21(1 мл) и уксусной кислоте (100 мл) перемешивали и кипятили с обратным холодильником в течение 24 ч. Смесь выливали на лед и NH4OH и дважды экстрагировали CH2Cl2. Объединенные органические слои отделяли, сушили, фильтровали и растворитель упаривали. Остаток обрабатывали CH3CN, отфильтровывали и сушили с получением 24 г (63%) промежуточного соединения 22.e) Смесь промежуточного соединения 22(0,0255 моль), 1,2-этандиола (0,102 моль) и птолуолсульфоновой кислоты (0,0305 моль) в толуоле (200 мл) перемешивали и кипятили с обратным холодильником в течение 16 ч. Смесь выливали на лед. Добавляли 10% K2 СО 3 и смесь дважды экстрагировали СН 2 Сl2. Объединенный органический слой сушили, фильтровали и растворитель упаривали. Остаток кристаллизовали из ДИПЭ и пентана. Остаток отфильтровывали и сушили с получением 9 г (80%) промежуточного соединения 23.f) Смесь промежуточного соединения 23(100 мл) и Н 2 О (10 мл) перемешивали и кипятили с обратным холодильником в течение 3 ч. Теплую смесь фильтровали через целит, промывали Н 2O и CH2Cl2 и декантировали. Органический слой сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: циклогексан/EtOAc 80/20). Чистые фракции собирали и растворитель упаривали с получением 4,68 г (50%) промежуточного соединения 24. д) Смесь промежуточного соединения 24(0,0104 моль) и 4-метилбензолсульфоновой кислоты, гидразина (0,0114 моль) в метаноле (60 мл) перемешивали при 50 С в течение ночи. Смесь оставляли охлаждаться до комнатной температуры. Остаток отфильтровывали, промывали этанолом и сушили с получением 4,09 гh) Смесь промежуточного соединения 25(0,00865 моль) в 6 н НСl (40 мл) и ТГФ (140 мл) перемешивали при комнатной температуре в течение 48 ч. Смесь выливали на лед, подщела 004542 24 чивали 10% K2 СО 3 и экстрагировали EtOAc. Органический слой отделяли, сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/EtOAc 95/5). Чистые фракции собирали и растворитель упаривали с получением 1,2 г (33%) промежуточного соединения 26.i) К раствору промежуточного соединения 26 (0,00286 моль) в ТГФ (10 мл) и метаноле (10 мл) добавляли при комнатной температуреNaBH4 (0,00344 моль). Смесь перемешивали при комнатной температуре в течение 15 мин. Добавляли Н 2 О и смесь экстрагировали СН 2 Сl2. Органический слой отделяли, сушили, фильтровали и растворитель упаривали с получением 1,2 г промежуточного соединения 27.j) Смесь промежуточного соединения 27(0,00286 моль) в СН 2 Сl2 (20 мл) перемешивали при 0 С в N2. Добавляли SOCl2 (5 мл). Смесь перемешивали при 10 С в течение 1 ч, растворитель упаривали с получением промежуточного соединения 28. Пример А 12.a) Смесь промежуточного соединения 29,получаемая аналогично примеру А 1 (0,0727 моль), в уксусной кислоте (90 мл) и ксилолеCH2Cl2, добавляли 10% K2 СО 3 и фильтровали через целит. Органический слой декантировали,сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH 99/1). Чистые фракции собирали и растворитель упаривали. Остаток перекристаллизовывали из CH3CN. Остаток отфильтровывали и сушили с получением 6,7 г (56%) промежуточного соединения 30.b) К раствору промежуточного соединения 30 (0,00719 моль) в метаноле (30 мл) и ТГФ (20 мл) порциями добавляли NaBH4 (0,0086 моль) при 10 С. Смесь перемешивали при С в течение 15 мин. Добавляли воду и смесь концентрировали. Концентрат обрабатывали CH2Cl2. Органический слой отделяли, промывали водой, сушили, фильтровали и растворитель упаривали. Остаток кристаллизовали из 2-пропанона. Остаток отфильтровывали и сушили с получением 1,45 г (48%) промежуточного соединения 31.c) Смесь промежуточного соединения 30d) Смесь промежуточного соединения 32(60 мл) перемешивали при 80 С в течение 2,5 ч. Смесь выливали на лед, подщелачивали NH4OH и экстрагировали CH2Cl2. Органический слой отделяли, сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент:CH2Cl2/ CH3OH/NH4OH 98/2/0,1). Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из CH3CN и ДИПЭ. Остаток отфильтровывали и сушили с получением 1,15 г (29%) промежуточного соединения 33. Пример А 13. Смесь промежуточного соединения 29CH2Cl2, промывали 10% K2 СО 3, сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 99/1/0,1). Чистые фракции собирали и растворитель упаривали с получением 15,6 г (75%) промежуточного соединения 34. В. Получение целевого соединения. Пример В 1. Смесь промежуточного соединения (2)(0,0207 моль) в уксусной кислоте (10 мл) и смешанных ксилолов (100 мл) перемешивали и кипятили с обратным холодильником в течение 12 ч и охлаждали. Смесь упаривали и остаток обрабатывали водой, подщелачивали NaOH (2 н) и экстрагировали CH2Cl2. Остаток очищали с помощью колоночной хроматографии на силикагеле. Чистые фракции собирали и упаривали. Остаток преобразовывали в соль этандиовой кислоты (2:3) в С 2 Н 5OН/СН 3 ОН/2-пропаноне с получением 3,5 г (30%) -7-[(4-фторфенил)(1Hимидазол-1-ил)метил]-5-фенилимидазо[1,2-а]хинолин этандиоата (2:3). Гемигидрат; т.пл. 204,3 С (соед. 3). Пример В 2. Получение промежуточного соединения 26 Смесь промежуточного соединения (4)(0,0019 моль) в этаноле (5 мл) перемешивали при 80 С в течение 5 ч, затем охлаждали и обрабатывали CH2Cl2. Органический раствор промывали 10% K2 СО 3, сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле. Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из 2 пропанона и ДИПЭ. Остаток отфильтровывали и сушили с получением 0,14 г (12%) соединения(95); т.пл. 143 С. Пример В 3. Смесь промежуточного соединения (5)(0,029 моль) и формилгидразина (0,043 моль) в 1-бутаноле (150 мл) перемешивали и кипятили с обратным холодильником в течение 48 ч. Смесь упаривали, остаток обрабатывали CH2Cl2 и промывали водой. Органический слой сушили,фильтровали и упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле. Чистые фракции собирали и упаривали. Остаток растворяли в 2-пропаноне и преобразовывали в соль этандиовой кислоты (2:3) с получением 4,4 г (26,1%) -7-[(4-хлорфенил)-1Hимидазол-1-илметил]-5-фенил[1,2,4]-триазоло[4,3-а]хинолина этандиоата (2:3), гемигидрат(соед. 5). Пример В 4. Смесь промежуточного соединения (7)(0,0071 моль) и триэтилортоацетата (0,0086 моль) в н-бутаноле (35 мл) перемешивали при 100 С в течение ночи. Растворитель упаривали. Остаток обрабатывали CH2Cl2, промывали Н 2 О и насыщенным раствором NaCl, сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле. Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из 2-пропанона. Остаток отфильтровывали и сушили с получением 1,95 г (53%) -5-(3 хлорфенил)(4-хлорфенил)-1-метил(1-метил-1H-имидазол-5-ил)-1,2,4-триазоло[4,3-а]хинолин-7-метанола (соед. 19). Пример В 5. Получение промежуточного соединения(7) (0,00815 моль) в метаноле (80 мл) добавляли порциями цианидбромид (0,00815 моль) при 5 С. Смесь перемешивали при 60 С в течение 10 мин и затем доводили до комнатной температуры. Растворитель упаривали. Остаток обрабатывали 10% K2 СО 3, отфильтровывали, промывали K2 СО 3 (10%) и Н 2 О и сушили. Остаток 27 очищали с помощью колоночной хроматографии на силикагеле. Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из ТГФ/ДИПЭ. Остаток отфильтровывали и сушили с получением 1,45 г (34%) соединения(7) (0,00367 моль) в ТГФ (30 мл) добавляли при комнатной температуре 1,1'-карбонилбис-1Hимидазол (0,0055 моль) и смесь перемешивали при комнатной температуре в течение 30 мин. Затем добавляли лед и воду и смесь экстрагировали EtOAc. Объединенный органический слой отделяли, сушили, фильтровали и растворитель упаривали. Остаток обрабатывали CH2Cl2. Остаток отфильтровывали и сушили. Остаток кристаллизовали из ТГФ/диэтилового эфира. Остаток отфильтровывали и сушили с получением 0,85 г (45%) соединения (22). Пример В 7. Смесь промежуточного соединения (5)(0,02 9 моль) и этилкарбазат (0,0436 моль) в 1 бутаноле (150 мл) перемешивали и кипятили с обратным холодильником в течение одной ночи. Смесь упаривали в вакууме, остаток обрабатывали CH2Cl2 и промывали водой. Органический слой сушили, отфильтровывали и упаривали. Остаток очищали с помощью колоночной хроматографии. Чистые фракции собирали и упаривали. Остаток растворяли в 2-пропаноне и преобразовывали в соль этандиовой кислоты(1:1), гемигидрат; т.пл. 198,3 С (соед. 7). Пример В 8. Смесь промежуточного соединения (9)(20 мл) перемешивали при 140 С в течение 4 ч. Смесь охлаждали до комнатной температуры и выливали в ледяную воду. Остаток отфильтровывали, промывали Н 2 О и обрабатывали СН 2 Сl2. Органический раствор сушили, фильтровали и растворитель упаривали. Остаток кристаллизовали из CH3CN и 2-пропанона. Остаток отфильтровывали и сушили с получением 1,2 г(38,2%) -5-(3-хлорфенил)(4-хлорфенил)-(1-метил-1H-имидазол-5-ил)тетразоло[1,5-а]хиназолин-7-метанола; т.пл. 139 С (соед. 29). Пример В 9. Смесь промежуточного соединения (11) 28 комнатной температуры. Добавляли Н 2 О. Смесь экстрагировали СН 2 Сl2. Органический слой отделяли, сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии. Две чистые фракции собирали и растворители упаривали. Желаемые фракции кристаллизовали из 2-пропанона и[1,2,3]-триазоло[1,5-а]хинолин-7-метанола; т.пл. 222 С (соед. 26). Пример В 10. Смесь соединения (29) (0,008 моль) в метаноле (60 мл) охлаждали до 5 С. Порциями добавляли тетрагидроборат натрия (0,008 моль). Смесь перемешивали при 5 С в течение 1 ч, гидролизовали, экстрагировали CH2Cl2 и декантировали. Органический слой сушили, фильтровали и растворитель упаривали. Остаток кристаллизовали из 2-пропанона. Остаток отфильтровывали и сушили с получением 1,8 г (44,6%)-5-(3-хлорфенил)(4-хлорфенил)-4,5-дигидро(1-метил-1H-имидазол-5-ил)тетразоло[1,5 а]-хиназолин-7-метанола; т.пл. 212 С (соед. 30). Пример В 11. К смеси промежуточного соединения (10)(0,007 моль) в ДМФ (33 мл) при 5 С в токе N2 добавляли дисперсию гидрида натрия (80%) в минеральном масле (0,0083 моль). Смесь перемешивали при 5 С в течение 30 мин. Добавляли йодметан (0,008 моль). Смесь перемешивали при 5 С в течение 30 мин и затем гидролизовали. Остаток отфильтровывали, промывали Н 2 О и обрабатывали СН 2 Сl2. Органический раствор сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле. Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из СН 3 СN и ДИПЭ. Остаток отфильтровывали и сушили с получением 0,8 г (22%) -5-(3-хлорфенил)(4 хлорфенил)-4,5-дигидро-4-метил(1-метил 1H-имидазол-5-ил)тетразоло[1,5-а]хиназолин-7 метанола; т.пл. 235 С (соед. 33). Пример В 12. Получение промежуточного соединения[1,5-а]хинолин-7-метанола (0,005 моль) в формамиде (10 мл) и уксусной кислоте (20 мл) перемешивали при 160 С в течение 5 ч, выливали на лед, подщелачивали NH4OH и экстрагировали СН 2 Сl2. Органический слой отделяли, сушили, фильтровали и растворитель упаривали. Ос 29 таток очищали с помощью колоночной хроматографии на силикагеле. Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из CH3CN и диэтилового эфира. Остаток отфильтровывали и сушили с получением 0,8 4 г (35%) соединения (94); т.пл. 166 С. Пример В 13. Получение промежуточного соединения Соединение (29) (0,006 моль) добавляли при пониженной температуре к тионилхлориду(30 мл). Смесь перемешивали при 40 С в течение 2 ч. Растворитель упаривали с получением соединения (31) . Пример В 14. Смесь 2-пропанола и NH3 (35 мл) быстро добавляли по каплям при 0 С к смеси соединения (31) (0,006 моль) в ТГФ (35 мл). Смесь перемешивали при 5 С в течение 30 мин и затем доводили до комнатной температуры. Растворитель упаривали. Остаток обрабатывали СН 2 Сl2 и Н 2 О и смесь декантировали. Органический слой сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле. Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из CH2Cl2 и ДИПЭ. Остаток отфильтровывали и сушили с получением 0,6 г(20%) -5-(3-хлорфенил)(4-хлорфенил)-(1-метил-1H-имидазол-5-ил)тетразоло[1,5-а]хиназолин-7-метанамина; т.пл. 159 С (соед. 32). Пример В 15. К раствору 1-метилимидазола (0,0129 моль) в ТГФ (25 мл) при -70 С в токе N2 медленно добавляли н-бутиллитий (0,0129 моль). Смесь перемешивали в течение 30 мин. Добавляли хлортри-этилсилан (0,0129 моль). Смеси давали нагреться до комнатной температуры и затем охлаждали до -70 С. Добавляли нбутиллитий (0,0129 моль). Смесь перемешивали при -70 С в течение 1 ч, затем давали нагреться до(4-хлорфенил)-5-фенилимидазо[1,2-а]хинолин-7-метанона (0,0107 моль) в ТГФ (12 мл). Смесь перемешивали при -70 С в течение 1 ч. Добавляли воду. Смесь экстрагировали EtOAc. Органический слой отделяли, сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле. Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из 2-пропанона. Остаток отфильтровывали и сушили с получением 0,9 г (18%) (4-хлорфенил)(1-метил-1Hимидазол-5-ил)-5-фенилимидазо[1,2-а]-хинолин-7 метанола (соединение 11). Смесь промежуточного соединения 28CH3CN (20 мл) перемешивали и кипятили с обратным холодильником в течение 48 ч и затем доводили до комнатной температуры. Добавляли Н 2 О. Смесь экстрагировали СН 2 Сl2. Органический слой отделяли, сушили, фильтровали и растворитель упаривали. Остаток очищали на колонке с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,1). Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из CH3CN и ДИПЭ. Остаток отфильтровывали и сушили с получением 0,55 г соединения 25 (40%). Пример В 17. Получение промежуточного соединения К CH3CN (5 мл) добавляли по каплям конц. H2SO4 (0,1 мл). Затем добавляли порциями соединение (142) (0,00042 моль). Смесь перемешивали при 80 С в течение 2 ч, доводили до комнатной температуры и выливали в ледяную воду. Добавляли EtOAc. Смесь подщелачивали 10% K2 СО 3 и экстрагировали EtOAc. Органический слой отделяли, промывали Н 2 О, сушили,фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 96/4/0,1; 15-40 мкм). Чистые фракции собирали и растворитель упаривали. Эту фракцию кристаллизовали из CH3CN и ДИПЭ. Остаток отфильтровывали и сушили с получением 0,11 г соединения (144) (44%). Пример В 18. Смесь соединения 53 (0,00464 моль) вSOCl2 (30 мл) перемешивали при 60 С в течение 6 ч. Растворитель упаривали с получением соединения 76. Пример В 19. Смесь соединения 16 (0,0022 моль) в 1,2 этандиоле (15 мл) и H2SO4 (конц.) (5 капель) перемешивали и кипятили с обратным холодильником при 125 С в течение 6 ч. Добавляли 10% K2 СО 3 и смесь экстрагировали CH2Cl2. Органический слой отделяли, сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: толуол/2-пропанол/NН 4OН 88/12/0,8). Чистые фракции собирали и растворитель упаривали. Остаток преобразовывали в соль этандиовой кислоты (1:1) в 2-пропаноне и 31 кристаллизовали из CH3CN/2-пропанона. Остаток отфильтровывали, промывали диэтиловым эфиром и сушили с получением 0,5 г соединения 41 (35%); т.пл. 150 С. Пример В 20. 4-(3-Хлорфенил)(4-хлорфенил)-2-гидразино-6-(1-метил-1H-имидазол-5-ил)-3,6-хинолиндиметанол (0,00371 моль) добавляли к 1 н НСl (25 мл) и перемешивали при комнатной температуре. Добавляли по каплям растворNaNO2 (0,00408 моль) в Н 2 О (5 мл) и полученную реакционную смесь перемешивали и кипятили с обратным холодильником в течение 1 ч. Смеси давали остыть до комнатной температуры, затем выливали в ледяную воду и остаток отфильтровывали, промывали водой, промывали диэтиловым эфиром и сушили с получением 1,95 г соединения 82 (92%; т.пл.: 280 С). Пример В 21. К раствору соединения 51 (0,0123 моль) вH2O (80 мл) добавляли по каплям 3 н НСl (20 мл)(0,0086 моль) в ТГФ (45 мл) при комнатной температуре добавляли по каплям NH2CH3 (2,5 мл). Смесь перемешивали при 40 С в течение 30 мин, гидролизовали и экстрагировали СН 2 Сl2. Органический слой отделяли, сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: толуол/2-пропанол/NH4 ОН 85/15/1). Собирали три фракции и растворители упаривали. Фракцию 1 кристаллизовали изCH2Cl2. Органический слой отделяли, сушили,фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: циклогексан/2 пропанол/NН 4 ОН 70/30/1). Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из CH3CN и ДИПЭ. Остаток отфильтровывали и сушили с получением 0,55 г соединения 135 (40%). Пример В 24. Соединение 18 (0,008 моль) очищали и разделяли на его энантиомеры с помощью хиральной колоночной хроматографии на ChiralcelOD (элюент: этанол 100%). Две чистые фракции собирали и растворители упаривали. Фракцию 1 преобразовывали в соль этандиовой кислоты(1:1). Остаток отфильтровывали и сушили с получением 1,59 г соединения 28 (34%); т.пл. 180 С. Фракцию 2 преобразовывали в соль этандиовой кислоты (1:1) и кристаллизовали из этанола. Остаток отфильтровывали и сушили с получением 1,85 г соединения 27 (39%); т.пл. 172 С. Пример В 25. К смеси гидроксиламин гидрохлоридаK2 СО 3 (0,096 моль). Смесь перемешивали в течение 15 мин. Добавляли по каплям раствор соединения 69 (0,003 моль) в ТГФ (15 мл). Смесь перемешивали при 5 С в течение 30 мин. Добавляли ледяную воду и смесь экстрагировали CH2Cl2. Органический слой отделяли, сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 95/5/0,3). Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из EtOAc. Остаток отфильтровывали и сушили с получением 0,17 г соединения 98 (11%); т.пл. 191 С. Пример В 26. К смеси соединения 76 (0,00464 моль) в ТГФ (20 мл) при 5 С добавляли по каплям конц.NH4OH (10 мл). Смесь перемешивали при комнатной температуре в течение 2 ч, выливали на лед и экстрагировали CH2Cl2. Органический слой отделяли, сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 95/5/0,1). Собирали две чистые фракции и растворители упаривали. Фракцию 1 кристаллизовали из CH3CN и ДИПЭ. Эстаток отфильтровывали и сушили с получением 0,55 г соединения 77 (21%); т.пл. 250 С. Фракцию 2 очищали с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/ СН 3 ОН/NН 4 ОН 95/5/0,5; 20-45 мкм). Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из CH3CN. Остаток отфильтровывали и сушили с получением 0,17 г соединения 80 (6%); т.пл. 250 С. Пример В 27. К смеси соединения 119 (0,004 моль) в ТГФ (20 мл) добавляли метанамин (30 мл; 40% в Н 2 О). Смесь перемешивали в течение 1 ч. Добавляли K2 СО 3 (10%) и смесь экстрагировали СН 2 Сl2. Органический слой отделяли, сушили,фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 90/10/0,1 и 80/20/0,1). Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из ТГФ и диэтилового эфира. Остаток отфильтровывали и сушили сN2 LiAlH4 (0,00663 моль). Затем порциями добавляли соединение 52 (0,00331 моль). Смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли EtOAc. Смесь гидролизовали холодной, фильтровали через целит и промывали EtOAc. Фильтрат экстрагировалиEtOAc. Органический слой отделяли, промывали Н 2 О, сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: циклогексан/2-пропанол/NH4 ОН 80/20/1). Чистые фракции собирали и растворитель упаривали. Эту фракцию кристаллизовали из 2-пропанона и диэтилового эфира. Остаток отфильтровывали и сушили с получением 0,98 г соединения 75 (51%). Следующие соединения получали аналогично одному из примеров, указанных выше(номер примера, аналогично которому они получены, указан в скобках после номера соединения). С. Фармакологический пример. Пример С.1. Исследование in vitro ингибирования фарнезилпротеинтрансферазы. Исследование in vitro ингибирования фарнезилтрансферазы проводилось, по существу,как описано в WO 98/40383, стр. 33-34. Пример С.2. Исследование реверсии фенотипа ras-трансформированной клетки. Исследование реверсии фенотипа rasтрансформированной клетки проводилось, по существу, как описано в WO 98/40383, стр.3436. Пример С.3. Ингибитор фарнезилпротеинтрансферазы модели вторичной опухоли. Ингибирование фарнезилпротеинтрансферазы модели вторичной опухоли проводилось,как описано в WO 98/40383, стр. 37. Пример С.4. Исследование геранилгеранилтрансферазы типа I. Предпосылки: Фермент ГГТаза I катализирует ковалентное присоединение С-20 геранилгеранильной группы, производной геранилгеранилпирофосфата, к K-ras онкогенному продукту p21K-ras. Геранилгеранилирование происходит путем образования тиоэфирной связи с 38 отдельным, конкретным цистеиновым радикалом, содержащимся в мотиве cysA-A-X, где А представляет собой нейтральные аминокислоты и X представляет собой С-концевой лейцин или метионин. Фарнецилирование Н, N и K-ras изоформы с помощью фарнезилпротеинтрансферазы необходимо для активации и прикрепления p21ras к плазматическим мембранам. Однако, K-ras изоформа, которая представляет собой главную изоформу ras в человеческих злокачественных опухолях, также изопренилируется путем ГГТазы I. Поэтому ингибиторы ГГТазы I могут ингибировать аномальный рост трансформированных K-ras человеческих опухолей, которые устойчивы к фарнезилтрансферазным ингибиторам. Способы. Соединения скринировали in vitro, используя фермент ГГТазу I, полученную из клеток человеческой остеосаркомы (KHOS), трансформированных вирусом Kirsten. При исследовании измеряли радиоактивностьYRASNRSCAIL субстрату. Система измерения. Процентная активность контрольной ГГТазы I. Изменяющиеся переменные. Активность контрольного фермента = [число имп/мин 3 Нгеранилгеранилпептидного продукта в присутствии транспортного растворителя]. Концентрация тестируемого соединения = 10 мкМ. Контрольная активность тестируемого соединения в % = (число имп/мин 3 Н-геранилгеранилпептидного продукта в присутствии тестируемого соединения/активность контрольного фермента) X 100%. Стандартные условия. Соединения растворяли в ДМСО при концентрации 20 мМ. Дополнительные растворы готовили в ДМСО. Конечная концентрация ДМСО в исследуемой среде равнялась 10%. Концентрация тестируемого соединения для скринига равнялась 10 мкМ. Р. Пример композиции. Покрытые пленкой таблетки. Приготовление ядра таблетки. Смесь 100 г соединения формулы (I), 570 г лактозы и 200 г крахмала тщательно перемешивали и затем смачивали раствором 5 г додецилсульфата натрия и 10 г поливинилпирролидона в около 200 мл воды. Влажную порошкообразную смесь просеивали, сушили и вновь просеивали. Затем добавляли 100 г микрокристаллической целлюлозы и 15 г гидрированного растительного масла. Полученную смесь тщательно перемешивали и прессовали в таблетки, получая 10000 таблеток, по 10 мг соединения формулы(I) в каждой. Покрытие К раствору 10 г метилцеллюлозы в 75 мл денатурированного этанола добавляли 5 г этилцеллюлозы в 150 мл дихлорметана. Затем до 39 бавляли 75 мл дихлорметана и 2,5 мл 1,2,3 пропантриола. 10 г полиэтиленгликоля расплавляли и растворяли в 75 мл дихлорметана. Последний раствор добавляли к первому и затем туда добавляли 2,5 г октадеканоата магния, 5 г поливинилпирролидона и 30 мл концентрированной окрашенной суспензии и вс гомогенизировали. Таблеточную основу покрывали полученной таким образом смесью в аппарате для нанесения покрытия. 40 аминоС 1-6 алкил, моно- или ди(С 1-6 алкил)аминокарбонил, моно- или ди(С 1-6 алкил)аминоС 1-6 алкил; или два соседних заместителя R1 или R2 на фенильном кольце могут вместе независимо образовывать бивалентный радикал формулы или его фармацевтически приемлемая соль присоединения кислоты, или его стереохимически изомерная форма,где =ХХ-Х 2-Х 3- представляет собой тривалентный радикал формулы где каждый из R6, R7 и R8 независимо представляет собой водород, С 1-4 алкил, гидрокси, С 1-4 алкилокси, арилокси, C1-4 алкилоксикарбонил, гидроксиС 1-4 алкил, С 1-4 алкилоксиС 1-4 алкил, моно- или ди(С 1-4 алкил)аминоС 1-4 алкил, циано, амино, тио,C1-4 алкилтио, арилтио или арил;Y1-Y2- представляет собой тривалентный радикал формулы где каждый R9 независимо представляет собой водород, галоген, галогенкарбонил, аминокарбонил, гидроксиС 1-4 алкил, циано, карбоксил, С 1-4 алкил, С 1-4 алкилокси, С 1-4 алкилоксиС 1-4 алкил, С 1-4 алкилоксикарбонил, моно- или ди(С 1-4 алкил) амино, моно- или ди(С 1-4 алкил) аминоС 1-4 алкил, арил;r и s равны, каждый независимо, 0, 1, 2, 3, 4 или 5; t равно 0, 1, 2 или 3; каждый из R1 и R2 независимо представляет собой гидрокси, галоген, циано, C1-6 алкил,тригалогенметил, тригалогенметокси, С 2-6 алкенил, C1-6 алкилокси, гидроксиС 1-6 алкилокси,C1-6 алкилтио, С 1-6 алкилоксиС 1-6 алкилокси, С 1-6 алкилоксикарбонил, аминоС 1-6 алкилокси, моноили ди(С 1-6 алкил)амино, моно- или ди(С 1-6 алкил)аминоС 1-6 алкилокси, арил, арилС 1-6 алкил,арилокси или арилС 1-6 алкилокси, гидроксикарбонил, C1-6 алкилоксикарбонил, аминокарбонил,R12 представляет собой водород, C1-6 алкил,арил, гидрокси, амино, C1-6 алкилокси, С 1-6 алкилкарбонилС 1-6 алкил, арилС 1-6 алкил, C1-6 алкилкарбониламино, моно- или ди(С 1-6 алкил)амино,С 1-6 алкилкарбонил, аминокарбонил, арилкарбонил, галогенС 1-6 алкилкарбонил, арилС 1-6 алкилкарбонил, С 1-6 алкилоксикарбонил, С 1-6 алкилоксиС 1-6 алкилкарбонил, моно- или ди(С 1-6 алкил) аминокарбонил, где алкильная часть необязательно может быть замещена одним или несколькими заместителями, независимо выбранными из арила, C1-3 алкилоксикарбонила, аминокарбонилкарбонила или моно- или ди(С 1-6 алкил)аминоС 1-6 алкилкарбонила,или радикал формулы -Alk-OR13 или -Alk14 15R13 представляет собой водород, С 1-6 алкил,С 1-6 алкилкарбонил, гидроксиС 1-6 алкил, арил или арилС 1-6 алкил;R15 представляет собой водород, С 1-6 алкил,С 1-6 алкилкарбонил, арил или арилС 1-6 алкил;R4 представляет собой радикал формулыR16 может также быть связан с одним атомом азота имидазольного кольца формулы (с-1) или (с-2), в таком случае значение R16, связанного с азотом, ограничено водородом, арилом,C1-6 алкилом, гидроксиС 1-6 алкилом, C1-6 алкилоксиС 1-6 алкилом, C1-6 алкилоксикарбонилом, C1-6 алкилS(О)C1-6 алкилом или С 1-6 алкилS(О)2 С 1-6 алкилом;R5 представляет собой С 1-6 алкил, C1-6 алкилокси или галоген; арил представляет собой фенил, нафталинил или фенил, замещенные 1 или несколькими заместителями, каждый из которых независимо выбран из галогена, C1-6 алкила, C1-6 алкилокси или трифторметила. 2. Соединение по п.1, где каждый из R1 и 2R представляет собой, независимо, гидрокси,галоген, циано, C1-6 алкил, тригалогенметил,тригалогенметокси, С 2-6 алкенил, C1-6 алкилокси,гидроксиС 1-6 алкилокси, C1-6 алкилтио, С 1-6 алкилоксиС 1-6 алкилокси, C1-6 алкилоксикарбонил, аминоС 1-6 алкилокси, моно- или ди(С 1-6 алкил)амино,моно- или ди(C1-6 алкил) аминоС 1-6 алкилокси,арил, арилС 1-6 алкил, арилокси или арилС 1-6 алкилокси,гидроксикарбонил,C1-6 алкилоксикарбонил; или два соседних заместителя R1 или R2 относительно друг друга на фенильном кольце могут вместе независимо образовывать бивалентный радикал формулыR16 может быть также связан с одним из атомов азота имидазольного кольца формулы (с 1), в таком случае значение R16, связанного с азотом, ограничено водородом, арилом, С 1-6 алкилом, гидроксиС 1-6 алкилом, С 1-6 алкилоксиС 1-6 алкилом, C1-6 алкилоксикарбонилом, C1-6 алкилR17 представляет собой водород, С 1-6 алкил,трифторметил или ди(С 1-4 алкил)аминосульфонил. 3. Соединение по любому из пп.1 и 2,где =Х 1-Х 2-Х 3- представляет собой тривалентный радикал формулы (х-1), (х-2), (х-3),(х-4) или (х-9),где каждый R6 независимо представляет собой водород, С 1-4 алкил, С 1-4 алкилоксикарбонил, амино или арил и R7 представляет собой водород;Y1-Y2- представляет собой тривалентный радикал формулы (у-1), (у-2), (у-3) или (у-4),где каждый R9 независимо представляет собой водород, галоген, карбоксил, С 1-4 алкил или С 1-4 алкилоксикарбонил;R1 представляет собой галоген, C1-6 алкил или два заместителя R1 в орто-положении относительно друг друга на фенильном кольце могут вместе независимо образовывать бивалентный радикал формулы (а-1);R3 представляет собой галоген или радикал формулы (b-1) или (b-3),где R10 представляет собой водород или радикал формулы -Alk-OR13, R11 представляет собой водород;R4 представляет собой радикал формулыR17 представляет собой водород или C1-6 алкил; арил представляет собой фенил. 4. Соединение по любому из пп.1-3,где =Х 1-Х 2-Х 3- представляет собой тривалентный радикал формулы (х-1),Y1-Y2- представляет собой тривалентный радикал формулы (y-4),r равно 0 или 1, s равно 1, t равно О,R1 представляет собой 3-хлор,R2 представляет собой 4-хлор или 4-фтор,R3 представляет собой водород или радикал формулы (b-1) или (b-3),R4 представляет собой радикал формулы(с-1) или (с-2),R6 представляет собой водород,R7 представляет собой водород,R9 представляет собой водород,R10 представляет собой водород,R11 представляет собой водород иR12 представляет собой водород. 5. Соединение по любому из пп.1-4, 43 где =Х 1-Х 2-Х 3-представляет собой тривалентный радикал формулы (х-2) или (х-3), Y1Y2- представляет собой тривалентный радикал формулы (у-2), (у-3) или (у-4), r и s равны 1, t равно 0, R1 представляет собой 3-хлор или 3 метил, R2 представляет собой 4-хлор, R3 представляет собой радикал формулы (b-1) или (b-3),R4 представляет собой радикал формулы (с-2),R6 представляет собой С 1-4 алкил, R9 представляет собой водород, R10 и R11 представляют собой водород и R12 представляет собой водород или гидрокси. 6. Соединение по п.1 или 2, выбранное из группы, включающей 7-[(4-фторфенил)(1H-имидазол-1-ил)метил]-5-фенилимидазо[1,2-а]хинолин;-(4-хлорфенил)(1-метил-1H-имидазол 5-ил)-5-(3-метилфенил)тетразоло[1,5-а]хинолин-7-метанамин или его фармацевтически приемлемая соль присоединения кислоты или стереохимически изомерная форма. 7. 5-(3-Хлорфенил)(4-хлорфенил)(1 метил-1 Н-имидазол-5-ил)тетразоло [1,5-а] хиназолин-7-метанамин или его фармацевтически приемлемая соль присоединения кислоты или стереохимически изомерная форма. 8. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения, указанного в любом из пп.1-7. 9. Способ получения фармацевтической композиции, указанной в п.8, заключающийся в том, что терапевтически эффективное количест 004542 44 во соединения, указанного в любом из пп.1-7,тщательно смешивают с фармацевтически приемлемым носителем. 10. Применение соединения по любому из пп.1-7 в качестве лекарственного средства. 11. Применение по п.10, где лекарственным средством является лекарственное средство для ингибирования аномального роста клеток. 12. Применение соединения по п.10, где лекарственным средством является лекарственное средство для ингибирования роста опухоли. 13. Применение соединения по п.10, где лекарственным средством является лекарственное средство для ингибирования пролиферативных заболеваний. 14. Способ получения соединения, указанного в п.1, представленного соединением формулы (I-4), где =Х 1-Х 2-Х 3-представляет собой тривалентный радикал формулы (х-4), путем взаимодействия промежуточного соединения формулы (II) с NaN3 где Y1-Y2-, R1, R2, R3, R4, R5, r, s и t такие, как указано в п.1, и W1 представляет собой удаляемую группу. 15. Способ получения соединения по п.1,представленного формулой (I-7), где Y1-Y2 представляет собой тривалентный радикал формулы (у-3) или (у-1) и R9 представляет собой водород, путем взаимодействия соединения формулы (I-6), где Y1-Y2- представляет собой тривалентный радикал формулы (у-2) или (у-4),с NaBH4 или LiАlН 4 где =Х 1-Х 2-Х 3-, R1, R2, R3, R4, R5, r, s и t такие,как указано в п.1. 16. Способ получения соединения по п.1,представленного формулой (I-6), где Y1-Y2 представляет собой тривалентный радикал формулы (у-2) или (у-4), путем окисления с помощью МnО 2 соединения формулы (I-7), где Y1Y2- представляет собой тривалентный радикал формулы (у-3) или (у-1) и R9 представляет собой водород 17. Способ получения соединения по п.1,представленного формулой (I-8-c), путем взаимодействия соединения формулы (I-8) с галогенирующим агентом и образованием соединения формулы (I-8-b), где R4 представляет собой галоген, с последующим взаимодействием соединения формулы (I-8-b) с реагентом формулы HNR11R12
МПК / Метки
МПК: A61P 35/00, A61K 31/4365, C07D 471/04, C07D 487/04
Метки: хинолина, производные, 2-аннелированные
Код ссылки
<a href="https://eas.patents.su/24-4542-1-2-annelirovannye-proizvodnye-hinolina.html" rel="bookmark" title="База патентов Евразийского Союза">1, 2-аннелированные производные хинолина</a>
Предыдущий патент: Полиморф 5-[4-[2-(n-метил-n-(2-пиридил)амино) этокси]бензил] тиазолидин-2, 4-диона, соли малеиновой кислоты
Следующий патент: Применение треосульфана для подготовки пациентов перед трансплантацией костного мозга или трансплантацией стволовых клеток крови
Случайный патент: Система и способ измерения электрического тока в трубопроводе












