Способы получения фенилпиразолов и кристаллическая форма производного фенилпиразола
Номер патента: 16675
Опубликовано: 30.06.2012
Авторы: Гхарбауи Тавфик, Лалли Эдвард А., Шах Найнеш, Сенгупта Дипанджан, Харт Райан М., Масиас Марк, Кришнан Ашвин М.
Формула / Реферат
1. Способ получения соединения формулы (I)
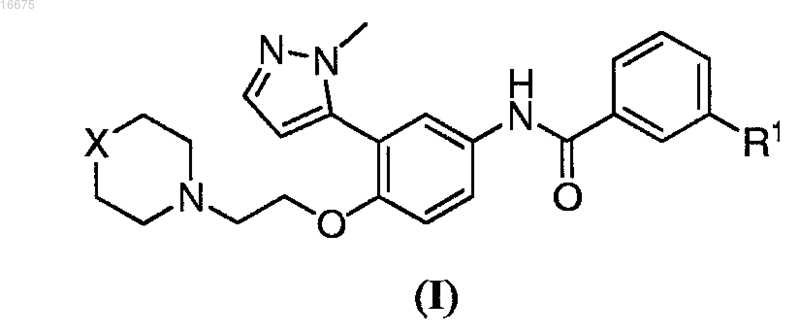
или его солевой формы, где
R1 представляет собой С1-С8алкил, галоген или С1-С8алкокси;
X представляет собой О или NR2 и
R2 представляет собой С1-С8ацил; включающий взаимодействие соединения формулы (II)
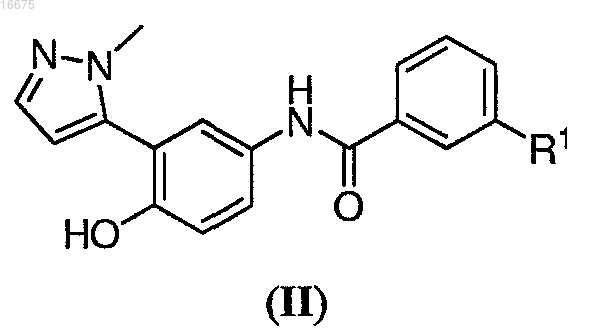
с соединением формулы (III)
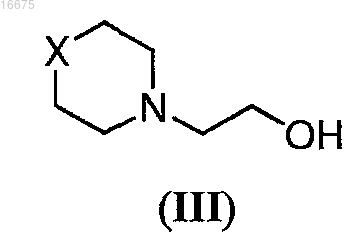
в присутствии тризамещенного фосфина и соединения, имеющего формулу (А)

где Ra и Rb, независимо друг от друга, представляют собой C1-С10алкил или С1-С7циклоалкил; с получением указанного соединения формулы (I).
2. Способ по п.1, где R1 представляет собой метокси и X представляет собой О.
3. Способ по п.1 или 2, где Ra и Rb, каждый независимо, представляют собой С1-С4алкил.
4. Способ по любому из пп.1-3, где указанное соединение формулы (II) получают способом, включающим взаимодействие соединения формулы (IV)
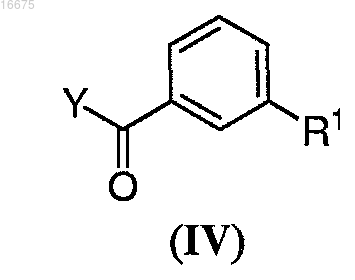
где R1 представляет собой C1-С8алкил, галоген или С1-С8алкокси;
Y представляет собой галоген, ОН или OC(O)R3 и
R3 представляет собой С1-С8алкил, C1-С8алкенил, C1-С8алкинил, С3-С7циклоалкил, С1-С8галогеналкил, арилалкил, арил, гетероарил или гетероарилалкил, каждый необязательно замещенный C1-С8алкилом, галогеном, C1-С8галогеналкилом или С1-С8алкокси; с соединением формулы (V)
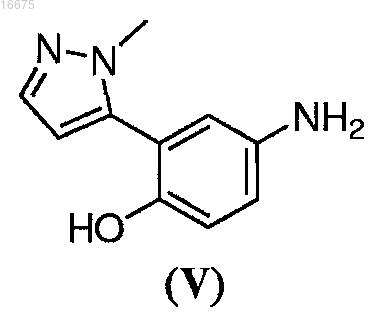
или его солью, с получением указанного соединения формулы (II);
при этом ²арил² означает моноциклический или полициклический ароматический углеводород, содержащий от 6 до 20 атомов углерода;
²арилалкил² означает алкильный фрагмент, замещенный арильной группой, и содержит от 7 до 20 атомов углерода;
²гетероарил² означает моноциклический или полициклический ароматический углеводород, который содержит по меньшей мере один гетероатом в кольце, выбранный из серы, кислорода и азота, а также содержит от 1 до 20 атомов углерода; и
²гетероарилалкил² означает алкил, замещенный гетероарилом.
5. Способ по п.4, где указанное соединение формулы (V) или его соль получают способом, включающим взаимодействие соединения формулы (VI)
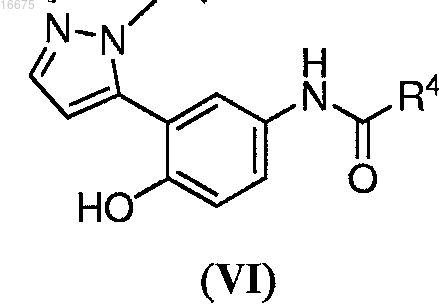
где R4 представляет собой С1-С8алкил; с расщепляющим реагентом, с получением соединения формулы (V) или его соли.
6. Способ по п.5, где указанное соединение формулы (VI) получают способом, включающим взаимодействие соединения формулы (VII)
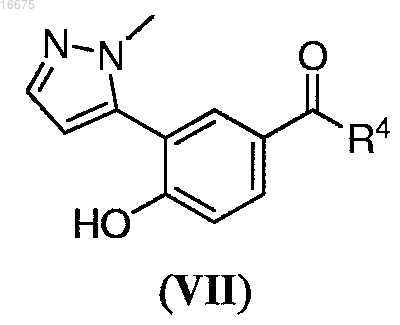
где R4 представляет собой С1-С8алкил; с амином в присутствии кислоты, с получением указанного соединения формулы (VI).
7. Способ по п.5, где указанное соединение формулы (VI) получают способом, включающим взаимодействие соединения формулы (VIII)
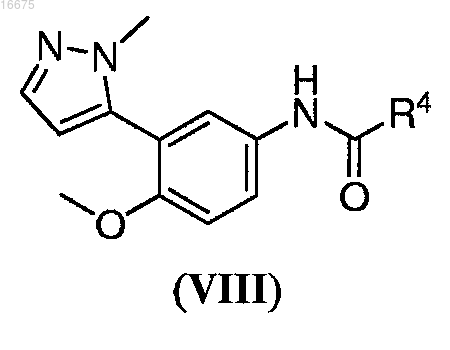
где R4 представляет собой C1-С8алкил; с деметилирующим агентом, с получением указанного соединения формулы (VI).
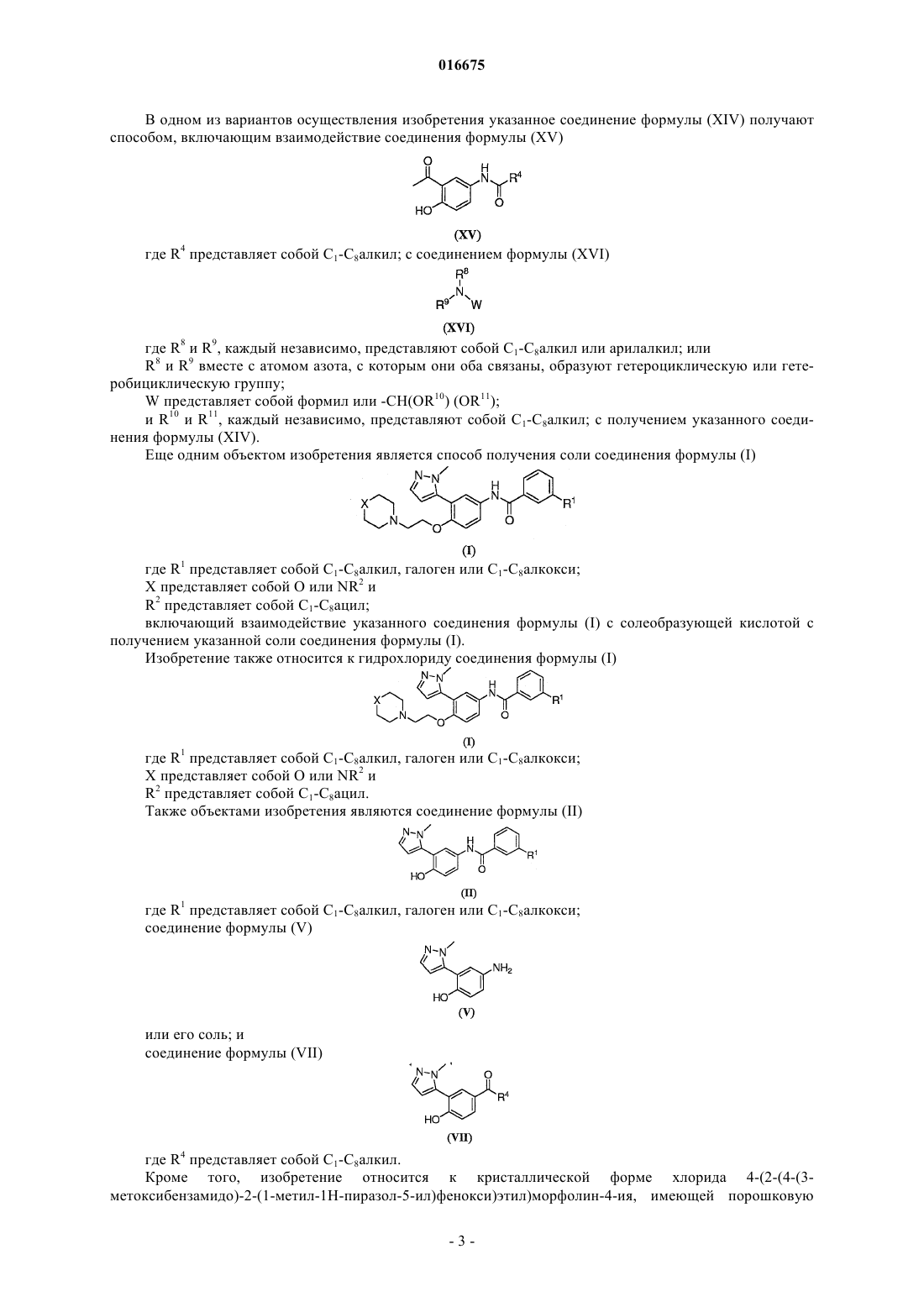
8. Способ по п.5, где указанное соединение формулы (VI) получают способом, включающим взаимодействие соединения формулы (XIV)
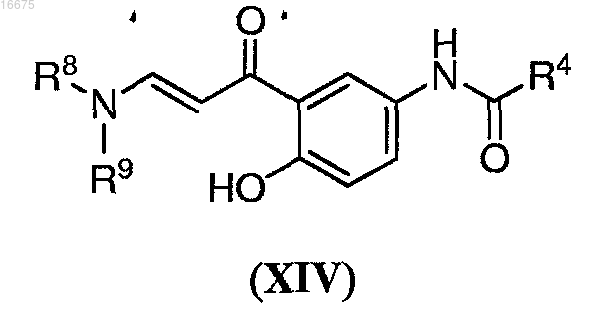
где R8 и R9, каждый независимо, представляют собой С1-С8алкил или арилалкил или
R8 и R9 вместе с атомом азота, с которым они оба связаны, образуют гетероциклическую или гетеробициклическую группу; с метилгидразином в присутствии катализатора, с получением указанного соединения формулы (VI);
при этом ²гетероциклил² означает насыщенную или ненасыщенную карбоциклическую группу, в которой один или несколько образующих кольцо атомов углерода карбоциклической группы заменены гетероатомом, выбранным из О, S и N; при этом гетерокарбоциклильные группы содержат в дополнение по меньшей мере к одному гетероатому от 1 до 20 атомов углерода и могут быть присоединены через атом углерода или гетероатом; и
"гетеробициклил" означает бициклическое кольцо, в котором 1, 2 или 3 атома углерода кольца заменены гетероатомом или группой, выбранной из О, S, S (=O), S(=O)2 и NH; где азот, необязательно, может быть замещен и 1 или 2 кольцевых атома углерода, необязательно, могут быть замещены оксо- или тиоксогруппой, таким образом, вместе образуя карбонильную или тиокарбонильную группу соответственно; при этом одно из колец, необязательно, является ароматическим.
9. Способ по п.8, где указанное соединение формулы (XIV) получают способом, включающим взаимодействие соединения формулы (XV)
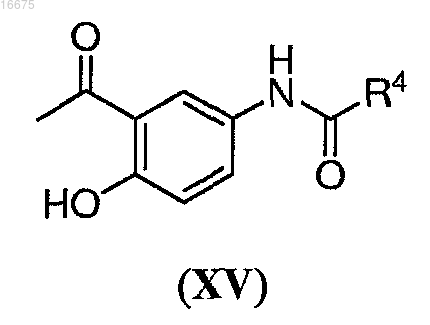
где R4 представляет собой С1-С8алкил; с соединением формулы (XVI)
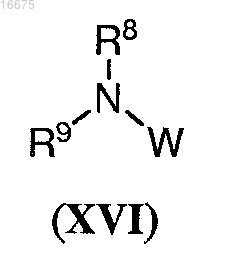
где R8 и R9, каждый независимо, представляют собой С1-С8алкил или арилалкил или
R8 и R9 вместе с атомом азота, с которым они оба связаны, образуют гетероциклическую или гетеробициклическую группу;
W представляет собой формил или -CH(OR10)(OR11); и
R10 и R11, каждый независимо, представляют собой C1-С8алкил; с получением указанного соединения формулы (XIV).
10. Способ получения соли соединения формулы (I)

где R1 представляет собой C1-С8алкил, галоген или С1-С8алкокси;
X представляет собой О или NR2 и
R2 представляет собой С1-С8ацил; включающий взаимодействие указанного соединения формулы (I) с солеобразующей кислотой с получением указанной соли соединения формулы (I).
11. Способ по п.10, где R1 представляет собой метокси и X представляет собой О.
12. Способ по п.10 или 11, где указанная солеобразующая кислота представляет собой хлороводородную кислоту.
13. Способ по любому из пп.10-12, где указанная соль представляет собой гидрохлорид.
14. Гидрохлорид соединения формулы (I)
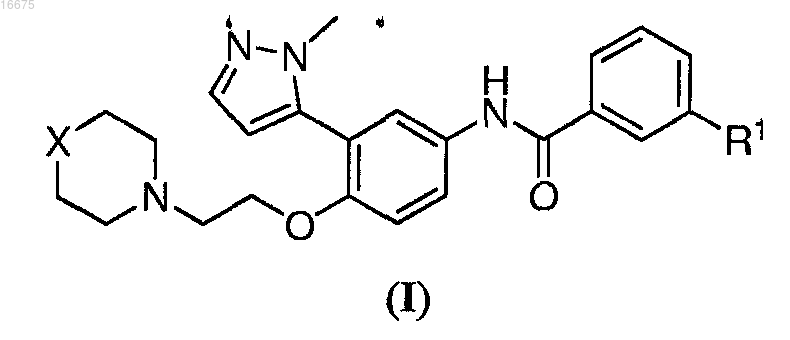
где R1 представляет собой С1-С8алкил, галоген или С1-С8алкокси;
X представляет собой О или NR2 и
R2 представляет собой С1-С8ацил.
15. Гидрохлорид по п.14, где R1 представляет собой метокси и X представляет собой О.
16. Соединение формулы (II)

где R1 представляет собой C1-С8алкил, галоген или C1-С8алкокси.
17. Соединение по п.16, где R1 представляет собой метокси.
18. Соединение формулы (V)
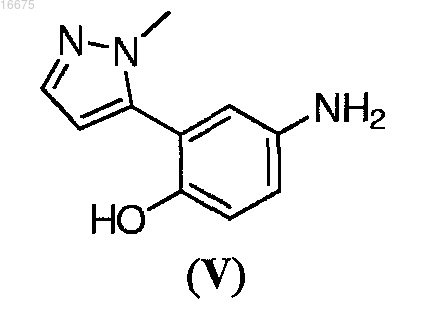
или его соль.
19. Соединение формулы (VII)
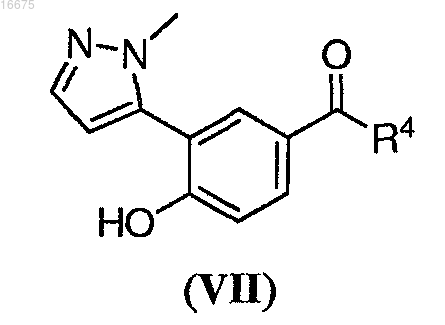
где R4 представляет собой C1-С8алкил.
20. Соединение по п.19, где R4 представляет собой метил.
21. Кристаллическая форма хлорида 4-(2-(4-(3-метоксибензамидо)-2-(1-метил-1Н-пиразол-5-ил)фенокси)этил)морфолин-4-ия, имеющая порошковую рентгенограмму, включающую пики, выраженные в градусах 2θ, при примерно 14,4°, при примерно 5,2° и при примерно 25,6°.
22. Фармацевтическая композиция, включающая соль по п.14 или 15 или кристаллическую форму по п.21 и фармацевтически приемлемый носитель.
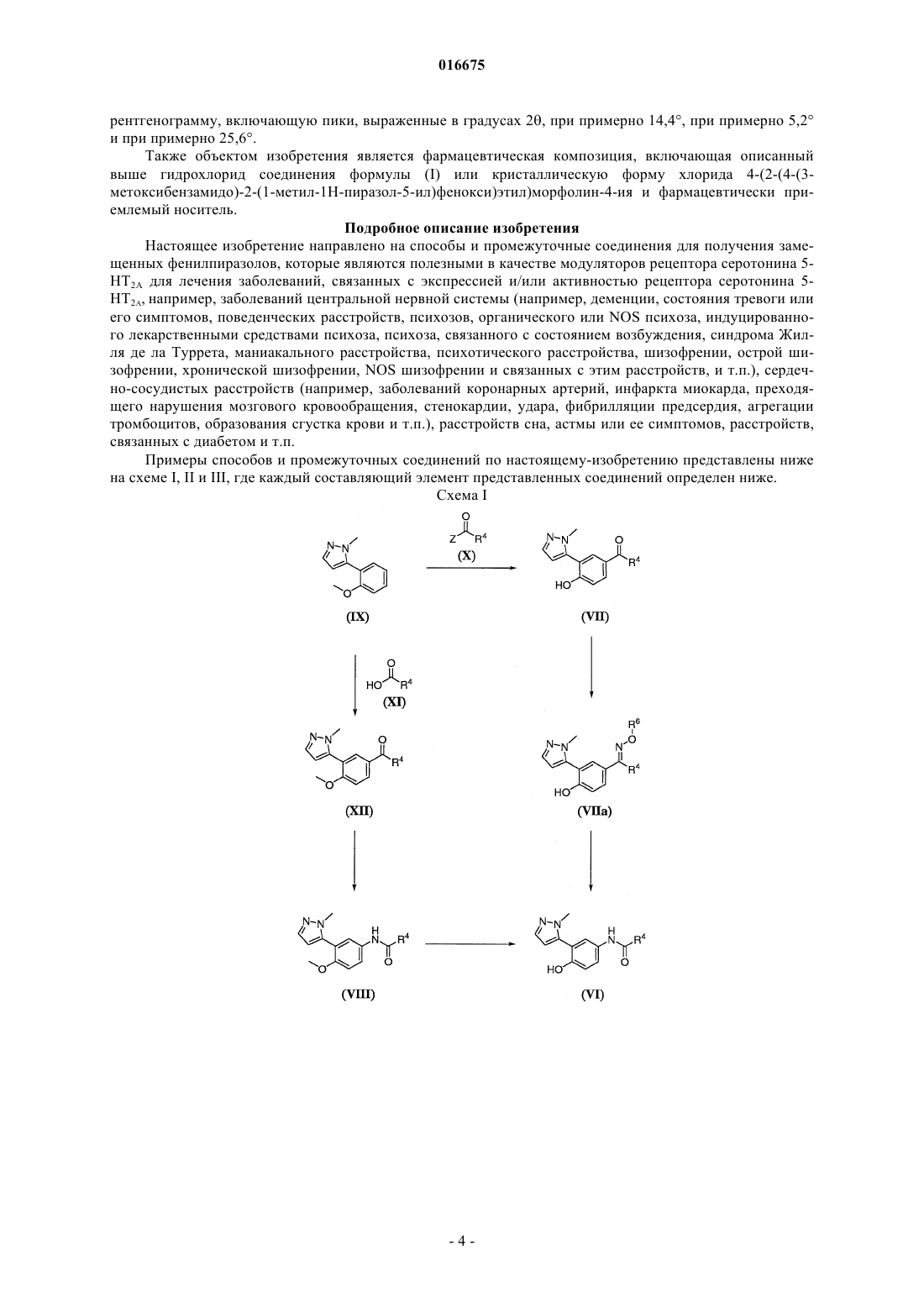
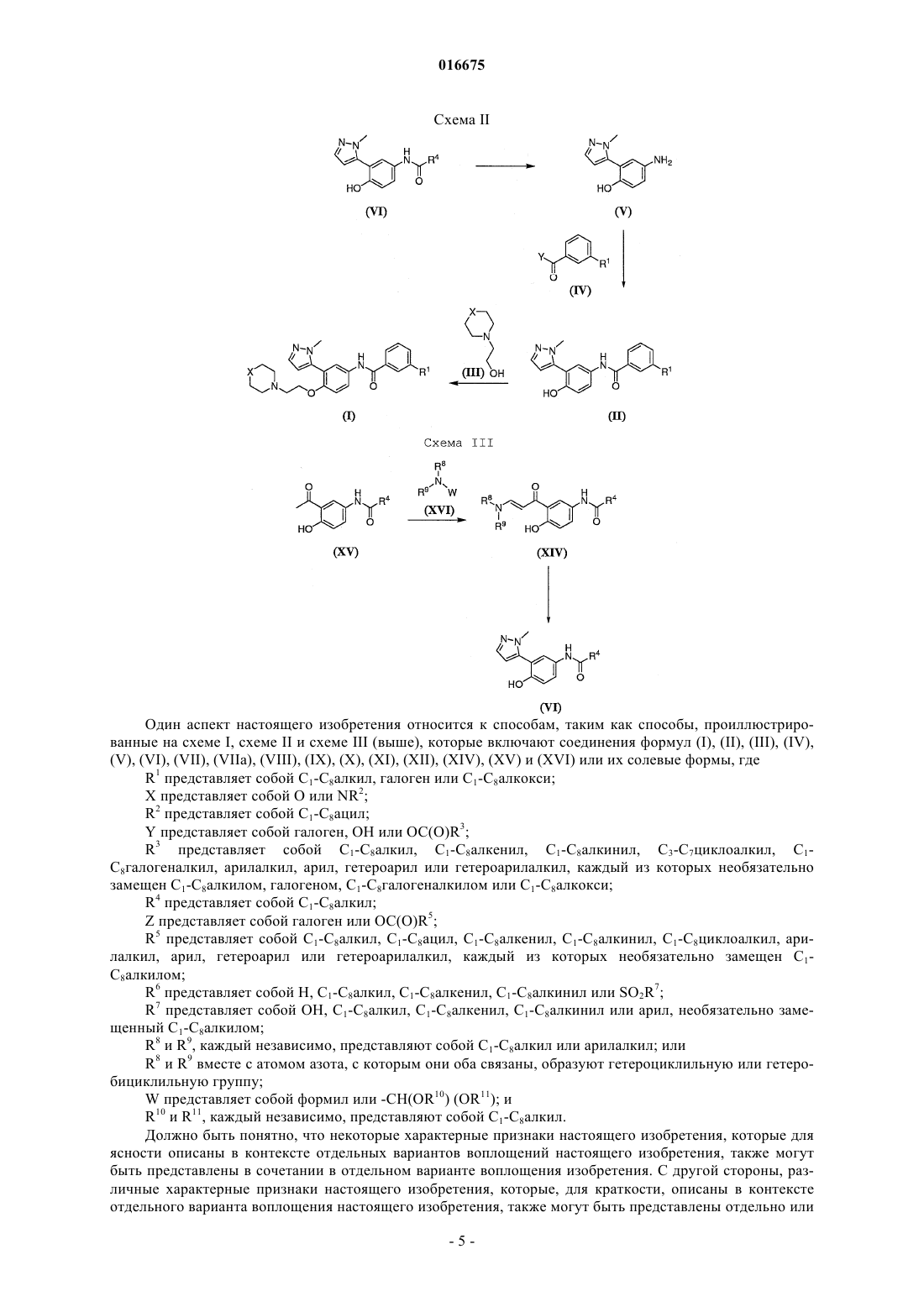
Текст
СПОСОБЫ ПОЛУЧЕНИЯ ФЕНИЛПИРАЗОЛОВ И КРИСТАЛЛИЧЕСКАЯ ФОРМА ПРОИЗВОДНОГО ФЕНИЛПИРАЗОЛА Настоящее изобретение относится к способам получения фенилпиразолов формулы (I) и их солей,используемых в качестве модуляторов активности рецептора серотонина 5-НТ 2A, и содержащих их фармацевтических композиций. Настоящее изобретение также относится к промежуточным соединениям, применяемым в способах, и их получению. Кроме этого настоящее изобретение относится к кристаллической форме хлорида 4-(2-(4-(3-метоксибензамидо)-2-(1-метил-1 Н-пиразол-5 ил)фенокси)этил)морфолин-4-ия. 016675 Область техники, к которой относится изобретение Настоящее изобретение относится к способам получения фенилпиразолов формулы (I), их солей и их фармацевтических композиций, используемых в качестве модуляторов активности рецептора серотонина 5-НТ 2 А. Настоящее изобретение также относится к промежуточным соединениям, используемым в таких способах, и их получению. Настоящее изобретение также относится к кристаллической форме модулятора рецептора серотонина 5-НТ 2 А. Уровень техники Рецепторы серотонина (5-гидрокситриптамина, 5-НТ) представляют собой важный класс связанных с G-белком рецепторов. Рецепторы серотонина подразделяются на семь подсемейств, обозначаемых как 5-HT1-5-HT7, включительно. Эти подсемейства также разделены на подтипы. Например, 5-НТ 2 подсемейство разделено на три подтипа рецепторов: 5-HT2A, 5-HT2B и 5-HT2C. Некоторые фенилпиразолы являются модуляторами активности рецептора серотонина 5-HT2A и являются полезными для лечения агрегации тромбоцитов, заболеваний коронарных артерий, инфаркта миокарда, преходящего нарушения мозгового кровообращения, стенокардии, удара, фибрилляции предсердия, образования сгустка крови, астмы или ее симптомов, состояния тревоги или его симптомов, поведенческих расстройств, индуцированного лекарственными средствами психоза, психоза, связанного с состоянием возбуждения, синдрома Жилля де ла Туретта, маниакального расстройства, органического или NOS психоза, психотического расстройства,психоза, острой шизофрении, хронической шизофрении, NOS шизофрении и связанных с этим расстройств, расстройств сна, расстройств, связанных с диабетом, прогрессивной многоочаговой лейкоэнцефалопатии и т.п. Поскольку постоянно ведется поиск соединений для использования в качестве лекарственных средств, обладающих, например, улучшенной стабильностью, растворимостью, стойкостью при хранении и фармакологическими свойствами in vivo, существует все возрастающая необходимость получения новых или более чистых солей, гидратов, сольватов и полиморфных кристаллических форм существующих молекул лекарственных средств. Кристаллическая форма хлорида 4-(2-(4-(3-метоксибензамидо)-2(1-метил-1 Н-пиразол-5-ил)фенокси)этил)морфолин-4-ил, обозначенная как форма I, описанная в настоящей заявке, отвечает этой и другим потребностям. Краткое описание чертежей На фиг. 1 представлена термограмма, полученная путем термогравиметрического анализа (TGA) для кристаллической формы I соединения 7 по настоящему изобретению (ТА Instruments TGA Q500 в открытой ячейке; 25-300 С; 10 С/мин). На фиг. 2 представлена термограмма, полученная анализом дифференциальной сканирующей калориметрии (DSC) для кристаллической формы I соединения 7 по настоящему изобретению (ТА Instruments DSC Q1000; 25-250 С; 10 С/мин). На фиг. 3 представлена порошковая рентгенограмма (XRPD) для образца, содержащего кристаллическую форму I соединения 7 (порошковый рентгеновский дифрактометр PANalytical X'Pert Plus; 5,040,02). На фиг. 4 представлен график динамической сорбции паров (DVS) для кристаллической формы I соединения 7 по настоящему изобретению (анализатор динамической сорбции паров VTI). Сущность изобретения Настоящее изобретение обеспечивает способ получения соединения формулы (I) или его солевой формы,где R1 представляет собой C1-С 8 алкил, галоген или С 1-С 8 алкокси;R2 представляет собой С 1-С 8 ацил; включающий взаимодействие соединения формулы (II) в присутствии тризамещенного фосфина и соединения, имеющего формулу (А) где Ra и Rb, независимо друг от друга, представляют собой C1-С 10 алкил или С 1-С 7 циклоалкил; с получением указанного соединения формулы (I). В одном из вариантов осуществления изобретения указанное соединение формулы (II) получают способом, включающим взаимодействие соединения формулы (IV)R3 представляет собой С 1-С 8 алкил, С 1-С 8 алкенил, C1-С 8 алкинил, С 3-С 7 циклоалкил, С 1 С 8 галогеналкил, арилалкил, арил, гетероарил или гетероарилалкил, каждый необязательно замещенный С 1-С 8 алкилом, галогеном, С 1-С 8 галогеналкилом или С 1-С 8 алкокси; с соединением формулы (V) или его солью, с получением указанного соединения формулы (II). В одном из вариантов осуществления изобретения указанное соединение формулы (V) или его соль получают способом, включающим взаимодействие соединения формулы (VI) где R4 представляет собой C1-С 3 алкил; с расщепляющим реагентом, с получением соединения формулы (V) или его соли. В одном из вариантов осуществления изобретения указанное соединение формулы (VI) получают способом, включающим взаимодействие соединения формулы (VII) где R4 представляет собой С 1-С 8 алкил; с амином в присутствии кислоты, с получением указанного соединения формулы (VI). В другом варианте осуществления изобретения указанное соединение формулы (VI) получают способом, включающим взаимодействие соединения формулы (VIII) где R4 представляет собой С 1-С 8 алкил; с деметилирующим агентом, с получением указанного соединения формулы (VI). В еще одном из вариантов осуществления изобретения указанное соединение формулы (VI) получают способом, включающим взаимодействие соединения формулы (XIV)R8 и R9 вместе с атомом азота, с которым они оба связаны, образуют гетероциклическую или гетеробициклическую группу; с метилгидразином в присутствии катализатора, с получением указанного соединения формулы (VI).-2 016675 В одном из вариантов осуществления изобретения указанное соединение формулы (XIV) получают способом, включающим взаимодействие соединения формулы (XV)R8 и R9 вместе с атомом азота, с которым они оба связаны, образуют гетероциклическую или гетеробициклическую группу;W представляет собой формил или -CH(OR10) (OR11); и R10 и R11, каждый независимо, представляют собой С 1-С 8 алкил; с получением указанного соединения формулы (XIV). Еще одним объектом изобретения является способ получения соли соединения формулы (I)R2 представляет собой C1-С 8 ацил; включающий взаимодействие указанного соединения формулы (I) с солеобразующей кислотой с получением указанной соли соединения формулы (I). Изобретение также относится к гидрохлориду соединения формулы (I)R2 представляет собой C1-С 8 ацил. Также объектами изобретения являются соединение формулы (II) где R4 представляет собой С 1-С 8 алкил. Кроме того, изобретение относится к кристаллической форме хлорида 4-(2-(4-(3 метоксибензамидо)-2-(1-метил-1 Н-пиразол-5-ил)фенокси)этил)морфолин-4-ия, имеющей порошковую-3 016675 рентгенограмму, включающую пики, выраженные в градусах 2, при примерно 14,4, при примерно 5,2 и при примерно 25,6. Также объектом изобретения является фармацевтическая композиция, включающая описанный выше гидрохлорид соединения формулы (I) или кристаллическую форму хлорида 4-(2-(4-(3 метоксибензамидо)-2-(1-метил-1 Н-пиразол-5-ил)фенокси)этил)морфолин-4-ия и фармацевтически приемлемый носитель. Подробное описание изобретения Настоящее изобретение направлено на способы и промежуточные соединения для получения замещенных фенилпиразолов, которые являются полезными в качестве модуляторов рецептора серотонина 5HT2A для лечения заболеваний, связанных с экспрессией и/или активностью рецептора серотонина 5 НТ 2 А, например, заболеваний центральной нервной системы (например, деменции, состояния тревоги или его симптомов, поведенческих расстройств, психозов, органического или NOS психоза, индуцированного лекарственными средствами психоза, психоза, связанного с состоянием возбуждения, синдрома Жилля де ла Туррета, маниакального расстройства, психотического расстройства, шизофрении, острой шизофрении, хронической шизофрении, NOS шизофрении и связанных с этим расстройств, и т.п.), сердечно-сосудистых расстройств (например, заболеваний коронарных артерий, инфаркта миокарда, преходящего нарушения мозгового кровообращения, стенокардии, удара, фибрилляции предсердия, агрегации тромбоцитов, образования сгустка крови и т.п.), расстройств сна, астмы или ее симптомов, расстройств,связанных с диабетом и т.п. Примеры способов и промежуточных соединений по настоящему-изобретению представлены ниже на схеме I, II и III, где каждый составляющий элемент представленных соединений определен ниже. Схема I Один аспект настоящего изобретения относится к способам, таким как способы, проиллюстрированные на схеме I, схеме II и схеме III (выше), которые включают соединения формул (I), (II), (III), (IV),(V), (VI), (VII), (VIIa), (VIII), (IX), (X), (XI), (XII), (XIV), (XV) и (XVI) или их солевые формы, гдеR3 представляет собой C1-С 8 алкил, C1-С 8 алкенил, C1-С 8 алкинил, С 3-С 7 циклоалкил, C1 С 8 галогеналкил, арилалкил, арил, гетероарил или гетероарилалкил, каждый из которых необязательно замещен C1-С 8 алкилом, галогеном, C1-С 8 галогеналкилом или C1-С 8 алкокси;Z представляет собой галоген или OC(O)R5;R5 представляет собой C1-С 8 алкил, C1-С 8 ацил, C1-С 8 алкенил, C1-С 8 алкинил, С 1-С 8 циклоалкил, арилалкил, арил, гетероарил или гетероарилалкил, каждый из которых необязательно замещен C1 С 8 алкилом;R8 и R9 вместе с атомом азота, с которым они оба связаны, образуют гетероциклильную или гетеробициклильную группу;W представляет собой формил или -CH(OR10) (OR11); иR10 и R11, каждый независимо, представляют собой C1-С 8 алкил. Должно быть понятно, что некоторые характерные признаки настоящего изобретения, которые для ясности описаны в контексте отдельных вариантов воплощений настоящего изобретения, также могут быть представлены в сочетании в отдельном варианте воплощения изобретения. С другой стороны, различные характерные признаки настоящего изобретения, которые, для краткости, описаны в контексте отдельного варианта воплощения настоящего изобретения, также могут быть представлены отдельно или-5 016675 в любой подходящей суб-комбинации. Все комбинации вариантов воплощений, относящиеся к химическим группам, представленным переменными (R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, Ra, Rb, W, X, Y иZ), содержащимися в родовых химических формулах, описанных в настоящей заявке [(I), (II), (III), (IV),(V), (VI), (VII), (VIIa), (VIII), (IX), (X), (XI), (XII), (XIV), (XV) и (XVI)], специально охватываются настоящим изобретением, как если бы они были подробно раскрыты, в той степени, в которой такие комбинации охватывают соединения, дающие в результате стабильные соединения (т.е. соединения, которые могут быть выделены, охарактеризованы и испытаны на биологическую активность). Как используется в данном описании, "замещенный" означает, что по меньшей мере один атом водорода химической группы заменен неводородным заместителем или группой, при этом такой неводородный заместитель или группа могут быть одно- или двухвалентными. В случае когда заместитель или группа являются двухвалентными, подразумевается, что эта группа является дополнительно замещенной другим заместителем или группой. Когда химическая группа, описанная в настоящей заявке, является"замещенной", она может быть замещена вплоть до замещения всех валентностей, которые могут быть замещены; например, метильная группа может быть замещенной 1, 2 или 3 заместителями, метиленовая группа может быть замещена 1 или 2 заместителями, фенильная группа может быть замещена 1, 2, 3, 4 или 5 заместителями, нафтильная группа может быть замещена 1, 2, 3, 4, 5, 6 или 7 заместителями и т.д. В некоторых вариантах воплощения R1 представляет собой метокси и X представляет собой О. В некоторых вариантах воплощения R4 представляет собой метил. Стадия образования эфира Настоящее изобретение обеспечивает, среди прочего, способ получения соединения формулы (I) или его солевой формы, включающий взаимодействие соединения формулы (II) в присутствии тризамещенного фосфина и соединения, имеющего формулу (А) где Ra и Rb, каждый независимо, представляют собой C1-С 10 алкил или С 3-С 7 циклоалкил, с получением соединения формулы (I). Тризамещенный фосфин может представлять собой любой подходящий третичный фосфин, такой как фосфин, имеющий формулу P(R)3, в которой каждый R независимо представляет собой C1-С 8 алкил,арил, циклоалкил, гетероарил, гетероциклил, арилалкил, циклоалкилалкил, гетероарилалкил или гетероциклический алкил, каждый из которых может быть замещен одной или несколькими группами, такими как галоген, С 1-С 4 алкил, С 1-С 4 галогеналкил, С 1-С 4 алкокси или С 1-С 4 галогеналкокси. В некоторых вариантах воплощения тризамещенный фосфин представляет собой триарилфосфин. В некоторых вариантах воплощения тризамещенный фосфин представляет собой трифенилфосфин. Подходящее соединение формулы (А) может быть легко выбрано специалистом в данной области. В некоторых вариантах воплощения Ra и Rb, независимо друг от друга, представляют собой C1-С 10 алкил. В других вариантах воплощения Ra и Rb, независимо друг от друга, представляют собой С 1-С 4 алкил. В других вариантах воплощения Ra и Rb оба представляют собой проп-2-ил. В некоторых вариантах воплощения соединение формулы (III) добавляют к смеси, содержащей соединение формулы (II), соединение формулы (А) и тризамещенный фосфин. В некоторых вариантах воплощения соединение формулы (А) добавляют к смеси, содержащей соединение формулы (II), соединение формулы (III) и тризамещенный фосфин. В некоторых вариантах воплощения дополнительные порции фосфина, и/или дополнительные порции соединения формулы (А), и/или дополнительные порции соединения формулы (III) можно добавлять после начала взаимодействия. В некоторых вариантах воплощения общее количество фосфина добавляют двумя или более пор-6 016675 циями. В некоторых вариантах воплощения общее количество соединения формулы (А) добавляют двумя или более порциями. В некоторых вариантах воплощения общее количество соединения формулы (III) добавляют двумя или более порциями. Взаимодействие соединения формулы (II) с соединением формулы (III) может быть осуществлено при любой подходящей температуре. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно -50 до примерно 75 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно -25 до примерно 50 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 0 до примерно 25 С. Взаимодействие соединения формулы (II) с соединением формулы (III) также необязательно можно осуществлять в растворителе. Подходящие растворители могут быть легко выбраны специалистом в данной области. Примеры растворителей включают от полярных до умеренно полярных растворителей или растворители с высокой температурой кипения, такие как N,N-диметилформамид (DMF), N,Nдиметилацетамид, толуол, ацетонитрил, пропионитрил, тетрагидрофуран, N-метилпирролидон, или третичные амины, включая циклические амины. В некоторых вариантах воплощения растворитель представляет собой N-метилморфолин. В некоторых вариантах воплощения растворитель представляет собой простой эфир. В некоторых вариантах воплощения простой эфир представляет собой циклический эфир. В некоторых вариантах воплощения простой эфир представляет собой тетрагидрофуран. Взаимодействие соединения формулы (II) с соединением формулы (III) можно осуществлять при молярном отношении соединения формулы (А) к соединению формулы (II), составляющем от примерно 4:1 до примерно 1:1, от примерно 1,8:1 до примерно 1,2:1 или от примерно 1,6:1 до примерно 1,4:1. В некоторых вариантах воплощения молярное соотношение соединения формулы (А) к соединению формулы (II) составляет от примерно 4:1 до примерно 1:1; от примерно 1,8:1 до примерно 1,1:1; от примерно 1,6:1 до примерно 1,2:1. В некоторых вариантах воплощения молярное соотношение тризамещенного фосфина к соединению формулы (II) составляет от примерно 4:1 до примерно 1:1, от 1,8:1 до примерно 1,2:1 или от примерно 1,6:1 до примерно 1,4:1. В некоторых вариантах воплощения молярное соотношение тризамещенного фосфина к соединению формулы (II) составляет от примерно 4:1 до примерно 1:1; от 1,8:1 до примерно 1,1:1 или от примерно 1,6:1 до примерно 1,4:1. В следующих вариантах воплощения молярное соотношение соединения формулы (А) к тризамещенному фосфину составляет примерно 1:1. В других вариантах воплощения молярное соотношение соединения формулы (II) к соединению формулы (III) составляет от примерно 2,5:1 до примерно 0,5:1 или от примерно 2:1 до примерно 1:1. В других вариантах воплощения молярное соотношение соединения формулы (III) к соединению формулы (II) составляет от примерно 2,5:1 до примерно 0,5:1 или от примерно 2:1 до примерно 1:1. Стадия образования амида Настоящее изобретение также обеспечивает способы получения соединения формулы (II), включающие взаимодействие соединения формулы (IV) или его солью с получением соединения формулы (II). В некоторых вариантах воплощения Y представляет собой галоген или OC(O)R3 и R3 представляет собой С 1-С 8 алкил, C1-С 8 алкенил, С 1-С 8 алкинил, С 3-С 7 циклоалкил, С 1-С 8 галогеналкил, арилалкил, арил,гетероарил или гетероарилалкил, каждый из которых необязательно замещен С 1-С 8 алкилом, галогеном,C1-С 8 галогеналкилом или C1-С 8 алкокси. В некоторых вариантах воплощения взаимодействие соединения формулы (IV) с соединением формулы (V) можно осуществлять, необязательно, в присутствии любого подходящего основания, которое может легко выбрать специалист в данной области.-7 016675 В некоторых вариантах воплощения основание представляет собой неорганическое основание. Примеры неорганических оснований включают аммиак и карбонаты, гидроксиды и гидрокарбонаты металлов, таких как натрий, калий, магний, кальций, цезий и т.п. В некоторых вариантах воплощения основание представляет собой органическое основание. Примеры органических оснований включают алифатические и ароматические амины, такие как триэтиламин,N-этилдиизопропиламин, дибензиламин или пиридин. В некоторых вариантах воплощения основание представляет собой смесь пиридина и N,Nдиметиламинопиридина. В некоторых вариантах воплощения основание представляет собой N-метилморфолин. В некоторых вариантах воплощения основание представляет собой бикарбонат натрия. В некоторых вариантах воплощения основание представляет собой пиридин. В некоторых вариантах воплощения Y представляет собой ОН, и взаимодействие соединения формулы (IV) с соединением формулы (V) можно осуществлять, необязательно, в присутствии любого подходящего конденсирующего агента, который может легко выбрать специалист в данной области. Примеры конденсирующих агентов включают, но не ограничиваются этим, HATU, HOAt, HODhbt, HAPyU,TAPipU, HBTU, TBTU, TPTU, TSTU, TNTU, TOTU, BOP, PyBOP, BroP, PyBroP, BOI, MSNT, TDO, DCC,EDCI, CDI, HOBt, HOSu, NEPIS, BBC, BDMP, BOMI, AOP, BDP, PyAOP, TDBTU, BOP-Cl, CIP, DEPBT,Dpp-Cl, EEDQ, FDPP, HOTT, TOTT, PyCloP и т.п. Взаимодействие соединения формулы (IV) с соединением формулы (V) можно осуществлять, необязательно, в присутствии любого подходящего растворителя, который может легко выбрать специалист в данной области. Примеры растворителей включают от полярных до умеренно полярных растворителей или растворители с высокой температурой кипения, такие как N,N-диметилформамид, N,Nдиметилацетамид, толуол, ацетонитрил, пропионитрил, тетрагидрофуран, N-метилпирролидинон или третичные амины, включая циклические амины. В некоторых вариантах воплощения растворитель представляет собой полярный апротонный растворитель. Примеры растворителей включают N,N-диметилформамид, N,N-диметилацетамид, Nметилпирролидинон и т.п. В некоторых вариантах воплощения растворитель представляет собой амид. В некоторых вариантах воплощения растворитель представляет собой N,N-диметилацетамид. В некоторых вариантах воплощения растворитель представляет собой спирт, такой как этанол, нпропанол, изопропанол, н-бутанол и т.п. В некоторых вариантах воплощения растворитель представляет собой изопропанол. В некоторых вариантах воплощения взаимодействие соединения формулы (IV) с соединением формулы (V) можно осуществлять при любой подходящей температуре. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно -60 до примерно 75 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно -35 до примерно 50 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно -10 до примерно 25 С. Стадия отщепления амида Настоящее изобретение также обеспечивает способы получения соединения формулы (V), включающие взаимодействие соединения формулы (VI) с расщепляющим реагентом с получением соединения формулы (V) или его соли. В некоторых вариантах воплощения соединение формулы (V) можно получить взаимодействием соединения формулы (VI) с любым из многочисленных агентов отщепления амида, известных из уровня техники. Примеры расщепляющих агентов включают, но не ограничиваются ими, HCl, гидразин,Н 2/палладий, пероксид водорода, гидроксид натрия, тетрафторборат триэтилоксония, ацилазы, натрий,метоксид натрия, боргидрид натрия, карбонат калия, аммиак, иод, ацетат меди, HF и DIBAL. Химию процессов удаления защиты у амида можно найти, например, в Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Ed., WileySons, 1999, включенном в данное описание посредством ссылки во всей полноте. В некоторых вариантах воплощения агентом расщепления является кислота. Примеры кислот включают хлороводородную кислоту, бромоводородную кислоту, метансульфоновую кислоту, трифторметансульфоновую кислоту, серную кислоту и т.п. В некоторых вариантах воплощения агент расщепления представляет собой серную кислоту. Взаимодействие соединения формулы (VI) с агентом расщепления можно осуществлять, необяза-8 016675 тельно, в присутствии любого подходящего растворителя, который может легко выбрать специалист в данной области. В некоторых вариантах воплощения растворитель представляет собой спирт, такой как метанол,этанол, н-пропанол, изопропанол, н-бутанол и т.п. В некоторых вариантах воплощения растворитель представляет собой метанол. Взаимодействие соединения формулы (VI) с агентом расщепления можно осуществлять при любой подходящей температуре, которую легко может подобрать специалист в данной области. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 25 до примерно 90 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 40 до примерно 80 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 60 до примерно 75 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 25 до примерно 65 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 30 до примерно 60 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 40 до примерно 55 С. Стадия перегруппировки Настоящее изобретение также обеспечивает способы получения соединений формулы (VI), включающие взаимодействие соединения формулы (VII) с амином в присутствии кислоты с получением соединения формулы (VI). В некоторых вариантах воплощения кислоту добавляют двумя или более порциями, при этом вторую порцию добавляют после образования соединения формулы (VIIa) которое образуется в результате взаимодействия соединения формулы (VII) с амином в присутствии кислоты. В некоторых вариантах воплощения R4 представляет собой C1-С 8 алкил. В некоторых вариантах воплощения R4 представляет собой метил. В некоторых вариантах воплощения R6 представляет собой Н, С 1-С 8 алкил, С 1-С 8 алкенил, С 1 С 8 алкинил, или SO2R7 и R7 представляет собой ОН, С 1-С 8 алкил, С 1-С 8 алкенил, С 1-С 8 алкинил или арил,необязательно замещенный С 1-С 8 алкилом. В некоторых вариантах воплощения R6 представляет собой Н. В качестве примера, молекулярный ион (m/z 232,3) соединения формулы (VIIa), где R4 представляет собой метил и R6 представляет собой Н, наблюдали способом масс-спектрометрии при взаимодействии соединения формулы (VII) с гидроксиламином в присутствии серной кислоты. В некоторых вариантах воплощения амин представляет собой гидроксиламин. В некоторых вариантах воплощения амин представляет собой соль гидроксиламина. Примеры солей гидроксиламина включают, но не ограничиваются этим, HCl, фосфат, оксалат, нитрат, EDTA и сульфат. В некоторых вариантах воплощения амин представляет собой гидрохлорид гидроксиламина. Кислота может быть любой подходящей кислотой, которую может легко выбрать специалист в данной области. В некоторых вариантах воплощения кислота представляет собой серную кислоту. Взаимодействие соединения формулы (VII) с амином можно осуществлять, необязательно, в присутствии любого подходящего растворителя, который может легко выбрать специалист в данной области. В некоторых вариантах воплощения растворитель представляет собой карбоновую кислоту, такую как муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, изомасляная кислота-9 016675 и т.п. В некоторых вариантах воплощения растворитель представляет собой уксусную кислоту. Взаимодействие соединения формулы (VI) с агентом расщепления можно осуществлять при любой подходящей температуре, которую легко может подобрать специалист в данной области. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 25 до примерно 105 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 50 до примерно 95 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 75 до примерно 85 С. Стадия ацилирования Способ получения соединений формулы (VII) включает взаимодействие соединения формулы (IX) в присутствии кислоты Льюиса, с получением соединения формулы (VII). Кислота Льюиса может быть любой подходящей кислотой Льюиса, которую может легко выбрать специалист в данной области. Примеры кислот Льюиса включают AlCl3, FeCl3, ZnCl2, AlBr3, ZnBr2, TiCl4,SnCl4 и т.п. В некоторых вариантах воплощения кислота Льюиса представляет собой AlCl3. Взаимодействие соединения формулы (IX) с соединением формулы (X) можно осуществлять, необязательно, в присутствии любого подходящего растворителя, который может легко выбрать специалист в данной области. Примеры подходящих растворителей включают дисульфид углерода; простые эфиры, такие как диэтиловый эфир, МТВЕ и ТГФ; галогеналканы, такие как дихлорметан, 1,2 дихлорэтан и хлороформ; нитроалканы, такие как нитрометан и нитроэтан; нитрилы, такие как ацетонитрил и пропионитрил; и ароматические растворители, такие как бензол, толуол, пиридин, хлорбензол,нитробензол и т.п. В некоторых вариантах воплощения растворитель представляет собой высококипящий ароматический растворитель. В некоторых вариантах воплощения растворитель представляет собой 1,2-дихлорбензол. Взаимодействие соединения формулы (IX) с соединением формулы (X) можно осуществлять при любой подходящей температуре, которую легко может подобрать специалист в данной области. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 25 до примерно 175 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 50 до примерно 130 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 75 до примерно 85 С. Стадия деметилирования Настоящее изобретение также обеспечивает способы получения соединений формулы (VI), включающие взаимодействие соединения формулы (VIII) с деметилирующим агентом, с получением соединения формулы (VI). Деметилирующий агент может быть любым подходящим реагентом, который может легко выбрать специалист в данной области. Примеры деметилирующих агентов включают триметилсилилиодид; кислоты Льюиса, такие как BCl3, BBr3, Bl3, AlCl3, AlBr3, TiCl4 и SnCl4; HBr в уксусной кислоте; тиолаты,такие как сульфид натрия, С 1-С 18 алкилтиолаты, тиокрезолат натрия, тиофеноксид калия и триметилсилантиолат натрия; бензилселенид натрия; щелочные металлы, такие как натрий/NH3 и калий/18-краун-6; галогенид лития; сильные основания, такие как NaHMDS и LDA; цианид натрия в ДМСО или 9-Br-BBN и т.п.- 10016675 В некоторых вариантах воплощения деметилирующий агент представляет собой С 1-С 18 алкилтиолат. В некоторых вариантах воплощения деметилирующий агент представляет собой додецилтиолат натрия. Взаимодействие соединения формулы (VIII) с деметилирующим агентом можно осуществлять, необязательно, в присутствии любого подходящего растворителя, который может легко выбрать специалист в данной области. Примеры подходящих растворителей включают кислоты, такие как уксусная кислота или пропионовая кислота; простые эфиры, такие как диэтиловый эфир, МТВЕ и ТГФ; галогеналканы, такие как дихлорметан, 1,2-дихлорэтан и хлорформ, или амиды, такие как N,N-диметилформамид иN,N-диметилацетамид, и N-метилпирролидинон и т.п. В некоторых вариантах воплощения растворитель представляет собой амид. В некоторых вариантах воплощения растворитель представляет собой N,N-диметилацетамид. Взаимодействие соединения формулы (VIII) с деметилирующим агентом можно осуществлять при любой подходящей температуре, которую легко может подобрать специалист в данной области. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 25 до примерно 165 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 75 до примерно 155 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 130 до примерно 145 С. Стадия ацилирования-перегруппировки Способ получения соединений формулы (VIII) включает взаимодействие соединения формулы (IX) и амином, с получением соединения формулы (VIII). В некоторых вариантах воплощения амин присутствует в начале взаимодействия, в результате чего стадии ацилирования и перегруппировки складываются в единый процесс. В некоторых вариантах воплощения амин добавляют in situ после образования промежуточного соединения формулы (XII) образованного путем ацилирования соединения формулы (IX) соединением формулы (XI). В некоторых вариантах воплощения амин представляет собой гидроксиламин. В некоторых вариантах воплощения амин представляет собой соль гидроксиламина. Примеры солей гидроксиламина включают, но не ограничиваются этим, HCl, фосфат, оксалат, нитрат, EDTA и сульфат. В некоторых вариантах воплощения амин представляет собой гидрохлорид гидроксиламина. Взаимодействие соединения формулы (IX) с соединением формулы (XI) и амином можно осуществлять, необязательно, в присутствии любого подходящего растворителя, который может легко выбрать специалист в данной области. В некоторых вариантах воплощения растворитель представляет собой фосфорную кислоту. В некоторых вариантах воплощения растворитель представляет собой пентоксид фосфора в метансульфоновой кислоте (реагент Итона). Взаимодействие соединения формулы (IX) с соединением формулы (XI) и амином можно осуществлять при любой подходящей температуре, которую легко может подобрать специалист в данной области. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 20 до примерно 140 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 40 до примерно 120 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 60 до примерно 100 С.- 11016675 Стадия образования пиразола Настоящее изобретение также обеспечивает способы получения соединений формулы (VI), включающие взаимодействие соединения формулы (XIV) с метилгидразином в присутствии катализатора, с получением указанного соединения формулы(VI). Катализатор может быть любым подходящим катализатором, который может легко выбрать специалист в данной области. Примеры подходящих катализаторов включают кислоты Льюиса, кислоты Бренстеда, органические кислоты, неорганические кислоты, органические основания, неорганические основания и монтмориллониты. В некоторых вариантах воплощения катализатор представляет собой кислоту Льюиса. Примеры кислот Льюиса включают BF3, BCl3, BBr3, BI3, AlCl3, FeCl3, ZnCl2, AlBr3, ZnBr2, TiCl4, SnCl4 и т.п. В некоторых вариантах воплощения кислота Льюиса представляет собой трифториддизтилэфират бора. В некоторых вариантах воплощения R8 и R9, каждый независимо, представляют собой С 1-С 8 алкил или арилалкил. В некоторых вариантах воплощения R8 и R9 вместе с атомом азота, с которым они оба связаны, образуют гетероциклическую или гетеробициклическую группу. В некоторых вариантах воплощения R8 и R9, каждый независимо, представляют собой С 1-С 8 алкил. В некоторых вариантах воплощения R8 и R9 оба представляют собой метил. Взаимодействие соединения формулы (XIV) с метилгидразином при желании можно осуществлять в присутствии любого подходящего растворителя, который может легко выбрать специалист в данной области. В некоторых вариантах воплощения растворитель представляет собой спирт, такой как метанол,этанол, н-пропанол, изопропанол, н-бутанол и т.п. В некоторых вариантах воплощения растворитель представляет собой метанол. Взаимодействие соединения формулы (XIV) с метилгидразином можно осуществлять при любой подходящей температуре. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно -20 до примерно 30 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно -10 до примерно 20 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 0 до примерно 10 С. Стадия образования енаминона Настоящее изобретение также обеспечивает способы получения соединений формулы (XIV), включающие взаимодействие соединения формулы (XV) с получением указанного соединения формулы (XIV). В некоторых вариантах воплощения W представляет собой формил. В некоторых вариантах воплощения W представляет собой -CH(OR10)(OR11) и R10 и R11, каждый независимо, представляют собой С 1-С 8 алкил; В некоторых вариантах воплощения W представляет собой -CH(OR10)(OR11) и R10 и R11 оба представляют собой метил. Взаимодействие соединения формулы (XV) с соединением формулы (XVI) можно осуществлять,необязательно, в присутствии любого подходящего растворителя, который может легко выбрать специалист в данной области.- 12016675 В некоторых вариантах воплощения растворитель представляет собой спирт, такой как метанол,этанол, н-пропанол, изопропанол, н-бутанол и т.п. В некоторых вариантах воплощения растворитель представляет собой изопропанол. Взаимодействие соединения формулы (XV) с соединением формулы (XVI) можно осуществлять при любой подходящей температуре. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 20 до примерно 90 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 30 до примерно 70 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 40 до примерно 50 С. Образование соли Настоящее изобретение также обеспечивает способы получения солей соединений формулы (I) включающие взаимодействие соединения формулы (I) с солеобразующей кислотой, с получением соли соединения формулы (I), при условии, что солеобразующая кислота не является трифторуксусной кислотой. В некоторых вариантах воплощения R1 представляет собой C1-С 8 алкил, галоген или C1-С 8 алкокси,Х представляет собой О или NR2; иR2 представляет собой С 1-С 8 ацил. В некоторых вариантах воплощения R1 представляет собой метокси и X представляет собой О. В некоторых вариантах воплощения солеобразующая кислота представляет собой хлороводородную кислоту. Взаимодействие соединения формулы (I) с солеобразующей кислотой, с получением соли соединения формулы (I), можно осуществлять, необязательно, в присутствии любого подходящего растворителя,который может легко выбрать специалист в данной области. В некоторых вариантах воплощения растворитель представляет собой спирт, такой как метанол,этанол, н-пропанол, изопропанол, н-бутанол и т.п. В некоторых вариантах воплощения растворитель представляет собой метанол. В некоторых вариантах воплощения растворитель представляет собой изопропанол. В некоторых вариантах воплощения растворитель представляет собой этанол. Взаимодействие соединения формулы (I) с солеобразующей кислотой, с получением соли соединения формулы (I), можно осуществлять при любой подходящей температуре, которую легко может подобрать специалист в данной области. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от выше точки замерзания растворителя до примерно температуры рефлюкса. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно -10 С до примерно температуры рефлюкса. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 10 до примерно 80 С. В некоторых вариантах воплощения взаимодействие осуществляют при температуре от примерно 20 до примерно 80 С. Фармацевтически приемлемые соли Некоторые варианты воплощения настоящего изобретения относятся к фармацевтически приемлемым солям соединений формулы (I) при условии, что фармацевтически приемлемая соль не является солью трифторуксусной кислоты. В некоторых вариантах воплощения R1 представляет собой C1-С 8 алкил, галоген или C1-С 8 алкокси; Х представляет собой О или NR2; и R2 представляет собой С 1-С 8 ацил. В некоторых вариантах воплощения R1 представляет собой метокси и X представляет собой О. В некоторых вариантах воплощения фармацевтически приемлемая соль имеет чистоту 80% или более. В некоторых вариантах воплощения фармацевтически приемлемая соль имеет чистоту 90% или бо- 13016675 лее. В некоторых вариантах воплощения фармацевтически приемлемая соль имеет чистоту 95% или более. В некоторых вариантах воплощения фармацевтически приемлемая соль имеет чистоту 99% или более. В некоторых вариантах воплощения фармацевтически приемлемая соль имеет чистоту 99,5% или более. В некоторых вариантах воплощения фармацевтически приемлемая соль включает фармацевтически приемлемую соль соединения формулы (I) и соединение формулы (I) в соотношении примерно 4:1 или более. В некоторых вариантах воплощения фармацевтически приемлемая соль включает фармацевтически приемлемую соль соединения формулы (I) и соединение формулы (I) в соотношении примерно 9:1 или более. В некоторых вариантах воплощения фармацевтически приемлемая соль включает фармацевтически приемлемую соль соединения формулы (I) и соединение формулы (I) в соотношении примерно 19:1 или более. В некоторых вариантах воплощения фармацевтически приемлемая соль включает фармацевтически приемлемую соль соединения формулы (I) и соединение формулы (I) в соотношении примерно 99:1 или более. В некоторых вариантах воплощения фармацевтически приемлемая соль представляет собой гидрохлорид. В некоторых вариантах воплощения фармацевтически приемлемая соль представляет собой оксалат. Промежуточные соединения Настоящее изобретение также обеспечивает промежуточные соединения, которые используют для получения соединений формулы (I) и их солей. Некоторые варианты воплощения относятся к соединениям формулы (II) Некоторые варианты воплощения относятся к соединениям формулы (II) и их солям. В некоторых вариантах воплощения R1 представляет собой С 1-С 8 алкил, галоген или С 1-С 8 алкокси. В некоторых вариантах воплощения R1 представляет собой метокси. Некоторые варианты воплощения относятся к соединениям формулы (V) Некоторые варианты воплощения относятся к соединениям формулы (VII) Некоторые варианты воплощения относятся к соединениям формулы (VII) и их солям. В некоторых вариантах воплощения R4 представляет собой С 1-С 8 алкил. В некоторых вариантах воплощения R4 представляет собой метил. Кристаллическая форма Кристаллическая форма хлорида 4-(2-(4-(3-метоксибензамидо)-2-(1-метил-1 Н-пиразол-5 ил)фенокси)этил)морфолин-4-ия (соединение 7), обозначенная как форма I может быть идентифицирована по ее уникальным кривым твердого состояния, полученным, например, методами дифференциальной сканирующей калориметрии (DSC), рентгено-структурного анализа (XRPD) и другими методами исследования твердых веществ. Другие характеристики, касающиеся содержания воды или растворителя в кристаллических формах, можно измерить при помощи любого из следующих методов, например, методом термогравиметрического анализа (TGA), DSC и т.п. Известно, что для DSC наблюдаемые температуры будут зависеть как от скорости изменения температуры, так и от способа получения образца и конкретного используемого оборудования. Таким образом, значения, приведенные в данном описании на основании DSC термограмм, могут иметь расхождение плюс/минус примерно 4 С. Что касается XRPD,относительные интенсивности пиков могут варьировать в зависимости от способа получения образца,процедуры монтировки образца и конкретного используемого оборудования. Более того, изменения в- 14016675 оборудовании и другие факторы часто влияют на значения 2-тета. Поэтому значения пиков на диффрактограммах могут иметь расхождение плюс/минус примерно 0,2. Физические свойства кристаллической формы соединения 7 по настоящему изобретению представлены в табл. 1 ниже. Таблица 1I представляет собой безводную несольватированную кристаллическую форму. Отдельные DSC следы также обнаруживают эндотерму плавления/разложения при примерно 218 С для соединения 7 формы I.DVS данные для соединения 7 формы I показывают, что оно является негигроскопичным, с абсорбцией менее чем 0,4% при 95% относительной влажности. Пики порошковой рентгенограммы для соединения 7 формы I представлены в табл. 2. Таблица 2 Соединение 7 форма I Один аспект настоящего изобретения направлен на кристаллическую форму хлорида 4-(2-(4-(3 метоксибензамидо)-2-(1-метил-1 Н-пиразол-5-ил)фенокси)этил)морфолин-4-ия (форма I), имеющую порошковую рентгенограмму, включающую пик, выраженный в градусах 2, при примерно 14,4. В некоторых вариантах воплощения эта кристаллическая форма имеет порошковую рентгенограмму, включающую пик, выраженный в градусах 2, при примерно 14,4. В некоторых вариантах воплощения эта кристаллическая форма имеет порошковую рентгенограмму, включающую пик, выраженный в градусах 2, при примерно 5,2. В некоторых вариантах воплощения эта кристаллическая форма имеет порошковую рентгенограмму, включающую пик, выраженный в градусах 2, при примерно 14,4 и примерно 25,6. В некоторых вариантах воплощения эта кристаллическая форма имеет порошковую рентгенограмму, включающую пик, выраженный в градусах 2, при примерно 5,2 и примерно 25,6. В некоторых вариантах воплощения эта кристаллическая форма имеет порошковую рентгенограмму, включающую пик, выраженный в градусах 2, при примерно 14,4, примерно 5,2, и примерно 25,6. В некоторых вариантах воплощения эта кристаллическая форма имеет порошковую рентгенограмму, включающую пик,выраженный в градусах 2, при примерно 14,4, примерно 5,2, примерно 25,6, примерно 17,3, примерно 27,1, примерно 15,8 и примерно 20,1. В других вариантах воплощения эта кристаллическая форма имеет порошковую рентгенограмму, включающую пик, выраженный в градусах 2, при примерно 14,4,примерно 5,2, примерно 25,6, примерно 17,3, примерно 27,1, примерно 15,8, примерно 20,1, примерно 19,8, примерно 23,1 и примерно 15,3. В следующих воплощениях эта кристаллическая форма- 15016675 имеет порошковую рентгенограмму, по существу, такую, как показана на фиг. 3, где под "по существу" подразумевается, что указанные пики могут иметь расхождение плюс/минус примерно 0,2. В некоторых вариантах воплощения кристаллическая форма хлорида 4-(2-(4-(3-метоксибензамидо)2-(1-метил-1 Н-пиразол-5-ил)фенокси)этил)морфолин-4-ия (форма I) имеет картину дифференциальной сканирующей калориметрии, включающую эндотерму при примерно 218 С. В других вариантах воплощения эта кристаллическая форма имеет картину дифференциальной сканирующей калориметрии, по существу, как показано на фиг. 2, где "по существу" означает, что представленные показатели DSC могут иметь расхождение плюс/минус примерно 4. В некоторых вариантах воплощения кристаллическая форма хлорида 4-(2-(4-(3-метоксибензамидо)2-(1-метил-1 Н-пиразол-5-ил)фенокси)этил)морфолин-4-ия (форма I) имеет форму кристаллов, которые являются пластинчатыми. В некоторых вариантах воплощения кристаллическая форма хлорида 4-(2-(4-(3-метоксибензамидо)2-(1-метил-1 Н-пиразол-5-ил)фенокси)этил)морфолин-4-ия (форма I) имеет профиль динамической сорбции паров, по существу, как показано на фиг. 4, где "по существу" означает, что представленные показатели DVS могут иметь расхождение плюс/минус примерно 5% RH(относительная влажность). В некоторых вариантах воплощения кристаллическая форма хлорида 4-(2-(4-(3-метоксибензамидо)2-(1-метил-1 Н-пиразол-5-ил)фенокси)этил)морфолин-4-ия (форма I) имеет профиль термогравиметрического анализа, по существу, как показано на фиг. 1, где "по существу" означает, что представленные показатели TGA могут иметь расхождение плюс/минус примерно 5 С. Соединение 7 формы I можно получить при помощи любой подходящей процедуры, известной из уровня техники для получения кристаллических полиморфов. В некоторых вариантах воплощения форму I можно получить, как описано в примере 6. В некоторых вариантах воплощения соединение 7 формыI может быть получено, как описано в примере 12. В некоторых вариантах воплощения соединение 7 формы I может быть получено путем нагревания кристаллического хлорида 4-(2-(4-(3 метоксибензамидо)-2-(1-метил-1 Н-пиразол-5-ил)фенокси)этил)морфолин-4-ия, где кристаллический хлорид 4-(2-(4-(3-метоксибензамидо)-2-(1-метил-1 Н-пиразол-5-ил)фенокси)этил)морфолин-4-ий содержит одну или несколько кристаллических форм, отличных от формы I. В некоторых вариантах воплощения соединение 7 формы I может быть получено путем перекристаллизации кристаллического хлорида 4-(2(4-(3-метоксибензамидо)-2-(1-метил-1 Н-пиразол-5-ил)фенокси)этил)морфолин-4-ия, где кристаллический хлорид 4-(2-(4-(3-метоксибензамидо)-2-(1-метил-1 Н-пиразол-5-ил)фенокси)этил)морфолин-4-ий содержит одну или несколько кристаллических форм, отличных от формы I. Фармацевтические композиции Еще аспект настоящего изобретения относится к фармацевтическим композициям, включающим одно или несколько соединений по настоящему изобретению и один или несколько фармацевтически приемлемых носителей. Некоторые варианты воплощения относятся к фармацевтическим композициям,включающим соединение по настоящему изобретению и фармацевтически приемлемый носитель. Некоторые варианты воплощения относятся к фармацевтическим композициям, включающим соль по настоящему изобретению и фармацевтически приемлемый носитель. Некоторые варианты воплощения относятся к фармацевтическим композициям, включающим кристаллическую форму по настоящему изобретению и фармацевтически приемлемый носитель. Некоторые варианты воплощения настоящего изобретения включают способ получения фармацевтической композиции, включающий смешивание по меньшей мере одного соединения в соответствии с любым из вариантов воплощения соединения, раскрываемых в настоящей заявке, с фармацевтически приемлемым носителем. Некоторые варианты воплощения настоящего изобретения включают способ получения фармацевтической композиции, включающий смешивание соли, раскрываемой в настоящей заявке, с фармацевтически приемлемым носителем. Некоторые варианты воплощения настоящего изобретения включают способ получения фармацевтической композиции, включающий смешивание кристаллической формы, раскрываемой в настоящей заявке, с фармацевтически приемлемым носителем. Композиции можно получить любым подходящим способом, типично путем однородного смешивания активного соединения(соединений) с жидкостями или тонко измельченными твердыми носителями, или и тем, и другим, в необходимых пропорциях, и затем, если это необходимо, формирование полученной смеси в желаемую форму. Традиционные эксципиенты, такие как связующие, наполнители, приемлемые смачивающие вещества, смазывающие вещества для таблетирования и разрыхлители можно использовать в таблетках и капсулах для перорального введения. Жидкие препараты для перорального введения могут быть в форме растворов, эмульсий, водных или масляных суспензий и сиропов. Альтернативно, пероральные препараты могут быть в форме сухого порошка, который можно реструктурировать водой или другим подходящим жидким носителем перед применением. Дополнительные добавки, такие как суспендирующие или эмульгирующие вещества, неводные носители (включая пищевые масла), консерванты и отдушки и красители можно добавлять в жидкие препараты. Парентеральные лекарственные формы можно получить- 16016675 путем растворения соединения по настоящему изобретению в подходящем жидком носителе и стерилизации раствора через фильтр перед заполнением и герметичным закрытием подходящего флакона или ампулы. Это лишь несколько примеров многочисленных подходящих способов, хорошо известных из уровня техники для получения лекарственных форм. Соединение по настоящему изобретению можно включать в фармацевтические композиции с использованием способов, хорошо известных специалистам в данной области. Подходящие фармацевтически приемлемые носители помимо тех, которые указаны в настоящей заявке, известны из уровня техники; например, см. Remington, The Science and Practice of Pharmacy, 20th Ed., 2000, Lippincott WilliamsWilkins, (Editors: Gennaro, A. R., et al.). Хотя и возможно, чтобы для применения в лечении соединение по настоящему изобретению, в его альтернативном применении, вводили в виде неочищенного или чистого химического вещества, однако предпочтительно предоставление соединения или активного ингредиента в виде фармацевтической композиции или композиции, дополнительно включающей фармацевтически приемлемый носитель. Таким образом, настоящее изобретение также обеспечивает фармацевтические композиции, включающие соединение по настоящему изобретению или его фармацевтически приемлемую соль или производное вместе с одним или несколькими фармацевтически приемлемыми носителями и/или профилактическими ингредиентами. Носитель(носители) должен быть "приемлемым" в том смысле, что он должен быть совместимым с другими ингредиентами композиции и не быть чрезмерно вредным для его реципиента. Фармацевтические композиции включают композиции, подходящие для перорального, ректального,назального, местного (включая буккальное и сублингвальное), вагинального или парентерального(включая внутримышечное, подкожное и внутривенное) введения или в форме, подходящей для введения путем ингаляции, инсуффляции или при помощи чрескожного пластыря. Чрескожные пластыри доставляют лекарственное средство с контролируемой скоростью, эффективным образом предоставляя лекарственное средство для абсорбции с минимальным разложением лекарственного средства. Типично,чрескожные пластыри включают непроницаемый слой подложки, один чувствительный к надавливанию адгезив и удаляемый защитный слой с удаляемой прокладкой. Специалистам в данной области должны быть понятны и известны способы, подходящие для получения желаемых эффективных чрескожных пластырей, необходимых специалисту в каждом конкретном случае. Соединения по настоящему изобретению, вместе с традиционным адъювантом, носителем или разбавителем можно, таким образом, формулировать в фармацевтические композиции и включающие их лекарственные формы, и в такой форме их можно использовать в виде твердых веществ, таких как таблетки или заполненные капсулы, или жидкостей, таких как растворы, суспензии, эмульсии, эликсиры,гели или заполненные этими веществами капсулы, все для перорального применения, в форме суппозиториев для ректального введения; или в форме стерильных растворов для инъекций для парентерального(включая подкожное) применения. Такие фармацевтические композиции и стандартные лекарственные формы могут включать традиционные ингредиенты в обычно используемых пропорциях, с или без дополнительных активных соединений или активных веществ, и такие стандартные лекарственные формы могут содержать любое подходящее эффективное количество активного ингредиента, соотносящееся с предполагаемыми для использования пределами суточных доз. Для перорального введения фармацевтическая композиция может быть в форме, например, таблетки, капсулы, суспензии или жидкости. Фармацевтическую композицию предпочтительно получают в виде стандартных лекарственных форм, содержащих определенное количество активного ингредиента. Примерами таких стандартных лекарственных форм являются капсулы, таблетки, порошки, гранулы или суспензии, с традиционными добавками, такими как лактоза, маннит, кукурузный крахмал или картофельный крахмал; со связующими, такими как кристаллическая целлюлоза, производные целлюлозы,аравийская камедь, кукурузный крахмал или желатины; с разрыхлителями, такими как кукурузный крахмал, картофельный крахмал или натрий карбоксиметилцеллюлоза; и со смазывающими веществами,такими как тальк или стеарат магния. Активный ингредиент также можно вводить путем инъекции в виде композиции, где, например, физиологический раствор, декстрозу или воду можно использовать в качестве подходящего фармацевтически приемлемого носителя. Соединения по настоящему изобретению или их сольват или физиологически функциональное производное можно использовать в качестве активных ингредиентов в фармацевтических композициях, в частности, в качестве модуляторов 5-HT2A рецептора. Под термином "активный ингредиент", определенным в контексте "фармацевтической композиции", следует понимать компонент фармацевтической композиции, который обеспечивает основной фармакологический эффект, по сравнению с "неактивным ингредиентом", который, в основном, следует рассматривать как не обеспечивающий какую-либо фармацевтическую пользу. Доза при использовании соединения по настоящему изобретению может варьировать в широких пределах, как это обычно бывает и является известным лечащему врачу, и ее следует подбирать с учетом состояния субъекта в каждом конкретном случае. Она зависит, например, от природы и тяжести заболевания, подлежащего лечению, от состояния пациента, от используемого соединения или от того, является- 17016675 ли заболевание, которое лечат, острым или хроническим, или от того, проводилась ли профилактика заболевания, или от того, вводят ли другие активные соединения в дополнение к соединению по настоящему изобретению. Репрезентативные дозы по настоящему изобретению включают, но не ограничиваются этим, от примерно 0,001 до примерно 5000 мг, от примерно 0,001 до примерно 2500 мг, от примерно 0,001 до примерно 1000 мг, от 0,001 до примерно 500 мг, от 0,001 до примерно 250 мг, от примерно 0,001 до 100 мг, от примерно 0,001 до примерно 50 мг и от примерно 0,001 до примерно 25 мг. В течение суток можно вводить несколько доз, особенно когда необходимо ввести относительно большое количество, например 2, 3 или 4 дозы. В зависимости от конкретного субъекта и от суждения лечащего врача или лица, осуществляющего уход за пациентом, иногда необходимо отступление в большую или меньшую сторону от пределов доз, указанных выше. Количество активного ингредиента или его активной соли, или его производного, необходимое для применения в лечении, варьирует в зависимости не только от выбранной конкретной соли, но также от пути введения, природы состояния, подлежащего лечению, и от возраста и состояния пациента, и, в конечном, это определяет лечащий врач или клиницист. Как правило, специалистам известно, как экстраполировать in vivo данные, полученные в модельной системе, типично животной модели, на другие системы, такие как человек. В некоторых обстоятельствах такие экстраполяции осуществляют просто на основании массы животной модели по сравнению с другой, такой как млекопитающее, предпочтительно человек, однако чаще такие экстраполяции осуществляют не только на основании массы, но также с учетом различных факторов. Репрезентативные факторы включают тип, возраст, массу тела, пол, режим питания и медицинское состояние пациента, тяжесть заболевания, путь введения, фармакологические соображения, такие как активность, эффективность, фармакокинетические свойства и токсикологический профиль конкретного используемого соединения, используется ли система доставки лекарственного средства, или является ли заболевание или состояние, лечение или профилактику которого осуществляют, острым или хроническим, или вводят ли дополнительные активные соединения помимо соединения по настоящему изобретению и как часть комбинированного лекарственного средства. Режим дозирования соединений и/или композиций по настоящему изобретению для лечения состояния заболевания выбирают в соответствии с различными факторами, перечисленными выше. Так, реальный режим дозирования может широко варьировать и поэтому может отклоняться от предпочтительного режима дозирования, и специалистам в данной области должно быть понятно, что дозы и режим дозирования, выходящие за такие типичные пределы, могут быть испытаны и, если это является подходящим, их можно использовать в способах по настоящему изобретению. Желаемая доза удобным образом может быть предоставлена в виде одной дозы или в виде раздельных доз, вводимых с подходящими интервалами, например, в виде двух, трех, четырех или более субдоз в день. Субдоза сама может быть дополнительно разделена, например, на некоторое количество отдельных разделенных по времени введений. Суточную дозу можно подразделить особенно при введении относительно больших количеств, как это считают подходящим, на несколько, например 2, 3 или 4, вводимые части. Если это является подходящим, в зависимости от индивидуального поведения, возможно потребуется отклонение в в большую или меньшую сторону от суточной дозы, указанной выше. Соединения по настоящему изобретению можно вводить в самых различных пероральных и парентеральных лекарственных формах. Для специалистов в данной области должно быть очевидным, что указанные ниже лекарственные формы могут включать, в качестве активного компонента, любое соединение по настоящему изобретению или фармацевтически приемлемую соль соединения по настоящему изобретению. Для получения фармацевтических композиций из соединений по настоящему изобретению выбранный подходящий фармацевтически приемлемый носитель может представлять собой либо твердое вещество, либо жидкость, либо их смесь. Препараты в твердой форме включают порошки, таблетки, пилюли,капсулы, саше, суппозитории и диспергируемые гранулы. Твердый носитель может представлять собой одно или несколько веществ, которые также могут действовать как разбавители, отдушки, солюбилизаторы, смазывающие вещества, суспендирующие вещества, связующие, консерванты, разрыхлители для таблеток или инкапсулирующие вещества. В порошках носитель представляет собой тонко измельченное твердое вещество, которое находится в смеси с тонко измельченным активным компонентом. В таблетках активный компонент смешан с носителем, обладающим необходимой связывающей способностью, в подходящих пропорциях и спрессован с получением желаемой формы и размера. Порошки и таблетки могут содержать различные процентные количества активного соединения. Репрезентативное количество в порошке или таблетке может включать от 0,5 до примерно 90% активного соединения; однако специалистам должно быть известно, когда необходимы количества вне указанных пределов. Подходящие носители для порошков и таблеток включают карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлозу, натрий карбоксиметилцеллюлозу, низкоплавкий воск, масло какао и т.п. Термин "препарат" включает композицию активного соединения с инкапсулирующим веществом в качестве носителя для получения капсулы, в которой активный компонент, с носителями или без носителей, находится в окружении носителя, нахо- 18016675 дящегося, таким образом, в ассоциации с ним. Также включены саше и лепешки. Таблетки, порошки,капсулы, пилюли, саше и лепешки можно использовать в виде твердых форм, подходящих для перорального введения. Для получения суппозиториев низкоплавкий воск, такой как смесь глицеридов жирных кислот или масла какао, сначала расплавляют и активный компонент гомогенно диспергируют в нем путем перемешивания. Расплавленную гомогенную смесь затем выливают в формы удобного размера, дают охладиться, и, таким образом, она затвердевает. Композиции, подходящие для вагинального введения, могут быть представлены в виде пессариев,тампонов, кремов, гелей, паст, пен или спреев, содержащих в дополнение к активному ингредиенту такие носители, которые, как это известно из уровня техники, являются подходящими. Жидкие формы препаратов включают растворы, суспензии и эмульсии, например водные растворы или растворы в воде-пропиленгликоле. Например, парентеральные жидкие препараты для инъекций могут быть сформулированы в виде растворов в водном растворе полиэтиленгликоля. Препараты для инъекций, например, стерильный водный раствор для инъекций или масляные суспензии для инъекций могут быть сформулированы в соответствии с известными способами с использованием подходящих диспергирующих или смачивающих веществ и суспендирующих веществ. Стерильный препарат для инъекций также может представлять собой стерильный раствор или суспензию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Из приемлемых носителей и растворителей, которые можно использовать, следует указать воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла традиционно используют в качестве растворителя или среды для суспендирования. Для этих целей можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, находят применение для получения препаратов для инъекций. Таким образом, соединения по настоящему изобретению могут быть сформулированы в композицию для парентерального введения (например, путем инъекций, например, болюсной инъекции или непрерывной инфузии) и могут быть представлены в виде стандартной лекарственной формы в ампулах,предварительно заполненных шприцах, в виде препаратов для инфузий малого объема или в содержащих несколько доз контейнерах с добавленным консервантом. Фармацевтические композиции могут принимать такие формы как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать агенты для формулирования композиций, такие как суспендирующие, стабилизирующие и/или диспергирующие вещества. Альтернативно, активный ингредиент может быть в форме порошка,полученного путем асептического выделения стерильного твердого вещества или путем лиофилизации из раствора для реструктурирования с использованием подходящего носителя, например стерильной апирогенной воды, перед использованием. Водные композиции, подходящие для перорального применения, можно получить путем растворения или суспендирования активного компонента в воде и добавления подходящих красителей, отдушек,стабилизаторов и загустителей, как это необходимо. Водные суспензии, подходящие для перорального применения, можно получить путем диспергирования тонко измельченного активного компонента в воде с вязким веществом, таким как природные или синтетические камеди, смолы, метилцеллюлоза, натрий карбоксиметилцеллюлоза, или другими, хорошо известными суспендирующими веществами. Также включены препараты в твердой форме, которые предназначены для преобразования, непосредственно перед применением, в жидкие препараты для перорального введения. Такие жидкие формы включают растворы, суспензии и эмульсии. Эти препараты могут содержать, помимо активного компонента, красители, отдушки, стабилизаторы, буферы, искусственные и натуральные подсластители, диспергирующие вещества, загустители, солюбилизирующие вещества и т.п. Для местного нанесения на эпидермис соединения по настоящему изобретению могут быть сформулированы в виде мазей, кремов или лосьонов, или в виде чрескожных пластырей. Мази и кремы, например, могут быть сформулированы с водной или масляной основой, с добавлением подходящих загустителей и/или гелеобразующих веществ. Лосьоны могут быть сформулированы с водной или масляной основой и, как правило, также содержат одно или несколько эмульгирующих веществ, стабилизаторов, диспергирующих веществ, суспендирующих веществ, загустителей или красителей. Композиции, подходящие для местного введения в полость рта, включают лепешки, включающие активное вещество в ароматизированной основе, обычно представляющей собой сахарозу и аравийскую камедь или трагакант; пастилки, включающие активное вещество в инертной основе, такой как желатин и глицерин или сахароза и аравийская камедь; и жидкости для полоскания рта, включающие активный ингредиент в подходящем жидком носителе. Растворы или суспензии вводят непосредственно в полость носа традиционными способами, например, при помощи капельницы, пипетки или спрея. Композиции можно предоставлять в форме, содержащей одну или несколько доз. В последнем случае, когда используют капельницу или пипетку, это- 19016675 достигается путем введения пациентом подходящего, предварительно определенного объема раствора или суспензии. В случае спрея, это достигается, например, при помощи дозировочного насоса, распыляющего отмеренную дозу препарата. Введение в дыхательные пути также можно осуществить при помощи аэрозольного препарата, в котором активный ингредиент представлен в находящейся под давлением упаковке с подходящим пропеллентом. Когда соединения по настоящему изобретению или фармацевтические композиции, включающие их, вводят в виде аэрозолей, например, в виде назальных аэрозолей или путем ингаляции, это осуществляют, например, с использованием спрея, распылителя, насосного распылителя, аппарата для ингаляции, ингалятора с отмеренными дозами или ингалятора сухого порошка. Фармацевтические формы для введения соединений по настоящему изобретению в виде аэрозоля можно получить способами, хорошо известными специалистам в данной области. Для их получения, например, можно использовать растворы или дисперсии соединений по настоящему изобретению в воде, водно-спиртовых смесях или подходящих физиологических растворах с использованием традиционных добавок, например, бензилового спирта или других подходящих консервантов, усилителей абсорбции для повышения биодоступности, солюбилизаторов, диспергирующих веществ и других веществ, и, если это является подходящим, традиционных пропеллентов, например, включающих диоксид углерода, CFC, такие как дихлордифторметан, трихлорфторметан или дихлортетрафторэтан; и т.п. Также удобно, когда аэрозоль содержит поверхностноактивное вещество, такое как лецитин. Дозу лекарственного средства можно контролировать путем обеспечения мерного клапана. В композициях, предназначенных для введения в дыхательные пути, включая интраназальные композиции, соединение, как правило, имеет малый размер частиц, например, порядка 10 мкм или меньше. Такой размер частиц можно получить при помощи способов, известных из уровня техники, например,путем измельчения. Если желательно, можно использовать композиции, приспособленные для замедленного высвобождения активного ингредиента. Альтернативно, активные ингредиенты могут быть предоставлены в форме сухого порошка, например, порошкообразной смеси соединения в подходящей порошковой основе, такой как лактоза, крахмал,производные крахмала, такие как гидроксипропилметилцеллюлоза и поливинилпирролидон (PVP). Удобно, когда порошковый носитель будет образовывать гель в носовой полости. Порошковая композиция может предоставляться в стандартной лекарственной форме, например, в капсулах или картриджах, например, из желатина, или блистерных упаковках, из которых порошок можно вводить при помощи ингалятора. Фармацевтические препараты предпочтительно обеспечиваются в стандартных лекарственных формах. В такой форме препарат разделен на стандартные дозы, содержащие подходящие количества активного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат,упаковку, содержащую дискретные количества препарата, такие как пакетированные таблетки, капсулы и порошки в флаконах или ампулах. Также стандартная лекарственная форма может сама представлять собой капсулу, таблетку, саше или лепешку, или это может быть подходящее количество любого из перечисленного в упакованной форме. Таблетки или капсулы для перорального введения и жидкости для внутривенного введения представляют собой предпочтительные композиции. Некоторые варианты воплощения настоящего изобретения включают способ получения фармацевтической композиции для "комбинированной терапии", включающий смешивание по меньшей мере одного соединения в соответствии с любым из вариантов воплощения соединения, раскрываемых в настоящей заявке, вместе с по меньшей мере одним известным фармацевтическим средством, как описано в настоящей заявке, и фармацевтически приемлемым носителем. Следует указать, что когда модуляторы 5-НТ 2 А рецептора используют в качестве активных ингредиентов в фармацевтической композиции, они предназначены не только для применения для человека, но также и для других млекопитающих, отличных от человека. Действительно, последние достижения в области охраны здоровья животных подтверждают, что следует уделять внимание использованию активных веществ, таких как модуляторы 5-НТ 2 А рецептора, для лечения 5-HT2A-опосредованных заболеваний или расстройств у домашних животных (например, кошек и собак) и других домашних животных (например,таких как коровы, куры, рыбы и т.д.). Специалисты в данной области могут легко оценить применимость таких соединений в таких условиях. Определения Как используется в настоящем описании, термин "алкил" относится к насыщенной углеводородной группе с прямой или разветвленной цепью. Примеры алкильных групп включают метил (Me), этил (Et),пропил (например, н-пропил и изопропил), бутил (например, н-бутил, изобутил, трет-бутил), пентил (например, н-пентил, изопентил, неопентил) и т.п. Алкильная группа может содержать от 1 до примерно 8,от 1 до примерно 6, от 1 до примерно 4, или от 1 до примерно 3 атомов углерода. Как используется в настоящем описании, "алкенил" относится к алкильной группе, содержащей одну или несколько углерод-углеродных двойных связей. Примеры алкенильных групп включают этенил,пропенил, циклогексенил и т.п.- 20016675 Как используется в настоящем описании, "алкинил" относится к алкильной группе, содержащей одну или несколько углерод-углеродных тройных связей. Примеры алкинильных групп включают этинил,пропинил и т.п. Как используется в настоящем описании, "галогеналкил" относится к алкильной группе, содержащей один или несколько галогеновых заместителей. Примеры галогеналкильных групп включают CF3,C2F5, CHF2, CCl3, CHCl2, C2Cl5 и т.п. Алкильная группа, в которой все атомы водорода заменены атомами галогена, может быть указана как "пергалогеналкил". Как используется в настоящем описании, "арил" относится к моноциклическим или полициклическим ароматическим углеводородам, таким как, например, фенил, нафтил, антраценил, фенантренил,инданил, инденил и т.п. В некоторых вариантах воплощения арильные группы содержат от 6 до примерно 20 атомов углерода. Как используется в настоящем описании, "циклоалкил" относится к неароматическим углеводородам, включая циклизованные алкильные, алкенильные и алкинильные группы. Циклоалкильные группы могут включать моно-, би- или полициклические кольцевые системы, а также двойные и тройные связи. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклопентенил, циклогексенил, циклогексадиенил, циклогептатриенил, норборнил, норпинил,норкарнил, адамантил и т.п. В определение циклоалкила также включены фрагменты, которые имеют одно или несколько ароматических колец, конденсированных с (т.е. имеющих связь, общую с) циклоалкильным кольцом, например бензопроизводные пентана, гексана и т.п. Как используется в настоящем описании, "гетеробициклил" означает бициклическое кольцо, определенное в настоящем описании, в котором 1, 2 или 3 атома углерода кольца замещены гетероатомом или группой, выбранной из, но не ограничиваясь этим, группы, состоящей из О, S, S (=O), S(=O)2 и NH,где азот, необязательно, может быть замещен, и 1 или 2 кольцевых атома углерода, необязательно, могут быть замещены оксо- или тиоксогруппой, таким образом, вместе образуя карбонильную или тиокарбонильную группу соответственно. В некоторых вариантах воплощения одно из колец является ароматическим. Примеры гетеробициклической группы включают, но не ограничиваются этим, 2,5 диазабицикло[2.2.1]гепт-2-ил, 7-азабицикло[2.2.1]гепт-7-ил, 1,3-дигидроизоиндолил, 3,4-дигидро-1 Низохинолинил, октагидроциклопента[с]пирролил и т.п. Как используется в настоящем описании, "гетероциклил" относится к группе, которая может представлять собой насыщенную или ненасыщенную карбоциклическую группу, в которой один или несколько образующих кольцо атомов углерода карбоциклической группы заменены гетероатомом, таким как О, S или N. Гетероциклильные группы могут быть ароматическими (например, "гетероарил") или неароматическими (например, "гетероциклоалкил"). Гетероциклильные группы могут соответствовать гидрированным и частично гидрированным гетероарильным группам. Гетерокарбоциклильные группы могут содержать в дополнение к по меньшей мере одному гетероатому от примерно 1 до примерно 20, от примерно 2 до примерно 10 или от примерно 2 до примерно 7 атомов углерода и могут быть присоединены через атом углерода или гетероатом. В некоторых вариантах воплощения гетероциклильные группы могут содержать от 3 до 20, от 3 до 10, от 3 до 7 или от 5 до 7 атомов, образующих кольцо. Кроме того, гетероциклильные группы могут быть замещенными или незамещенными. Примеры гетероциклильных групп включают морфолино, тиоморфолино, пиперазинил, тетрагидрофуранил, тетрагидротиенил, 2,3-дигидробензофурил, 1,3-бензодиоксол, бензо-1,4-диоксан, пиперидинил, пирролидинил, изоксазолидинил, изотиазолидинил, пиразолидинил, оксазолидинил, тиазолидинил, имидазолидинил и т.п.,также как и любая из групп, перечисленных для гетероарила и гетероциклоалкила. Как используется в настоящем описании, "гетероарильные" группы представляют собой моноциклические и полициклические ароматические углеводороды, которые содержат по меньшей мере один гетероатом в кольце, такой как сера, кислород или азот. Гетероарильные группы включают, без ограничений, пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, фурил, хинолил, изохинолил, тиенил, имидазолил, тиазолил, индолил, пирролил, оксазолил, бензофурил, бензотиенил, бензтиазолил, изоксазолил, пиразолил, триазолил, тетразолил, индазолил, 1,2,4-тиадиазолил, изотиазолил, бензотиенил,пуринил, карбазолил, бензимидазолил, 2,3-дигидробензофуранил, 2,3-дигидробензотиенил, 2,3 дигидробензотиенил-S-оксид, 2,3-дигидробензотиенил-S-диоксид, бензоксазолин-2-онил, индолинил,бензодиоксоланил, бензодиоксан и т.п. В некоторых вариантах воплощения гетероарильные группы могут содержать от 1 до примерно 20 атомов углерода, а в других вариантах воплощения от примерно 3 до примерно 20 атомов углерода. В некоторых вариантах воплощения гетероарильные группы содержат от 1 до примерно 4, от 1 до примерно 3 или от 1 до 2 гетероатомов. Как используется в настоящем описании, "гало" или "галоген" включает фтор, хлор, бром и иод. Как используется в настоящем описании, "алкокси" относится к -О-алкильной группе. Примеры алкоксигрупп включают метокси, этокси, пропокси (например, н-пропокси и изопропокси), трет-бутокси и т.п. Как используется в настоящем описании, "галогеналкокси" относится к алкокси, замещенному по меньшей мере одним галогеном. Как используется в настоящем описании, "ацил" относится к карбонильной группе, замещенной Н,- 21016675 алкилом, алкенилом, алкинилом или карбоциклилом. Примеры ацильных групп включают формил или ацетил. Как используется в настоящем описании, "арилалкил" относится к алкильному фрагменту, замещенному арильной группой. Примеры арилалкильных групп включают бензильную, фенетильную и нафтилметильную группы. В некоторых вариантах воплощения арилалкильные группы содержат от 7 до 20 или от 7 до 11 атомов углерода. Как используется в настоящем описании, "гетероциклоалкил" относится к алкилу, замещенному гетероциклилом. Как используется в настоящем описании, "циклоалкилалкил" относится к алкилу, замещенному циклоалкилом. Как используется в настоящем описании, "гетероарилалкил" относится к алкилу, замещенному гетероарилом. Как используется в настоящем описании, термин "взаимодействие" используется, как это известно из уровня техники и, в основном, относится к осуществлению контактирования химических реагентов таким образом, чтобы обеспечить их взаимодействие на молекулярном уровне с достижением химического или физического преобразования по меньшей мере одного химического реагента. Как используется в настоящем описании, термин "замещенный" относится к замене группы водорода неводородной группой в молекуле или группе. Способы, описанные в настоящей заявке, можно отслеживать в соответствии с любым подходящим способом, известным из уровня техники. Например, образование продукта можно отслеживать спектроскопическими средствами, такими как спектроскопия ядерного магнитного резонанса (например, 1 Н или 13 С), инфракрасная спектроскопия, спектрофотометрия (например, УФ-спектрофотометрия) или массспектрометрия, или при помощи хроматографии, такой как высокоэффективная жидкостная хроматография (ВЭЖХ) или тонкослойная хроматография. В некоторых вариантах воплощения получение соединений может включать защиту и удаление защиты у различных химических групп. Для защиты и удаления защиты выбор подходящих защитных групп может легко осуществить специалист в данной области. Химия защитных групп описана, например, в Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Ed., WileySons, 1999, который включен в настоящую заявку посредством ссылки во всей его полноте. Реакции способов, описанных в настоящей заявке, можно осуществлять в подходящих растворителях, выбор которых может может легко осуществить специалист в области органического синтеза. Подходящие растворители могут, по существу, не вступать в реакции с исходными веществами (реагентами),промежуточными соединениями или продуктами при температурах, при которых осуществляют реакции,например, температурах в пределах от температуры замерзания растворителя до температуры кипения растворителя. Реакцию можно осуществлять в одном растворителе или в смеси более чем одного растворителя. В зависимости от конкретной стадии реакции, можно выбрать подходящие растворители для конкретной стадии реакции. В некоторых вариантах воплощения реакции можно осуществлять в отсутствие растворителя, например, когда по меньшей мере один из реагентов представляет собой жидкость или газ. Подходящие растворители могут включать галогенированные растворители, такие как тетрахлорид углерода, бромдихлорметан, дибромхлорметан, бромоформ, хлороформ, бромхлорметан, дибромметан,бутилхлорид, дихлорметан, тетрахлорэтилен, трихлорэтилен, 1,1,1-трихлорэтан, 1,1,2-трихлорэтан, 1,1 дихлорэтан, 2-хлорпропан, гексафторбензол, 1,2,4-трихлорбензол, о-дихлорбензол, хлорбензол, фторбензол, фтортрихлорметан, хлортрифторметан, бромтрифторметан, тетрафторид углерода, дихлорфторметан, хлордифторметан, трифторметан, 1,2-дихлортетрафторэтан и гексафторэтан. Подходящие эфирные растворители включают диметоксиметан, тетрагидрофуран, 1,3-диоксан, 1,4 диоксан, фуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диэтиловый эфир этиленгликоля,диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля, диметиловый эфир триэтиленгликоля, анизол или трет-бутилметиловый эфир. Подходящие протонные растворители могут включать, в качестве примера и без ограничения, воду,метанол, этанол, 2-нитроэтанол, 2-фторэтанол, 2,2,2-трифторэтанол, этиленгликоль, 1-пропанол, 2 пропанол, 2-метоксиэтанол, 1-бутанол, 2-бутанол, изобутиловый спирт, трет-бутиловый спирт, 2 этоксиэтанол, диэтиленгликоль, 1-, 2- или 3-пентанол, неопентиловый спирт, трет-пентиловый спирт,монометиловый эфир диэтиленгликоля, моноэтиловый эфир диэтиленгликоля, циклогексанол, бензиловый спирт, фенол или глицерин. Подходящие апротонные растворители могут включать, в качестве примера и без ограничения, тетрагидрофуран, N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)пиримидинон, 1,3-диметил-2-имидазолидинон, N-метилпирролидинон, формамид, N-метилацетамид, Nметилформамид, ацетонитрил, диметилсульфоксид, пропионитрил, этилформиат, метилацетат, гексахлорацетон, ацетон, этилметилкетон, этилацетат, сульфолан, N,N-диметилпропионамид, тетраметилмочевину, нитрометан, нитробензол или гексаметилфосфорамид. Подходящие углеводородные растворители включают бензол, циклогексан, пентан, гексан, толуол,- 22016675 циклогептан, метилциклогексан, гептан, этилбензол, о, м- или п-ксилол, октан, индан, нонан или нафталин. Сверхкритический диоксид углерода также можно использовать в качестве растворителя. Реакции способов, описанных в настоящей заявке, можно осуществлять при подходящих температурах, которые может легко определить специалист в данной области. Реакционные температуры зависят, например, от точек плавления и кипения реагентов и растворителя, если таковой присутствует; термодинамики реакции (например, сильно экзотермические реакции следует проводить при пониженных температурах); и кинетики реакции (например, для высокоактивируемого энергетического барьера могут потребоваться повышенные температуры). Реакции способов, описанных в настоящей заявке, можно осуществлять на воздухе или в инертной атмосфере. Типично, реакции, включающие реагенты или продукты, которые, по существу, являются реакционноспособными с воздухом, можно осуществлять с использованием чувствительных к воздуху способов синтеза, хорошо известных специалистам в данной области. В некоторых вариантах воплощения получение соединений может включать добавление кислот или оснований для осуществления, например, катализа желаемой реакции или образования солевых форм,таких как кислотно-аддитивные соли. Примеры кислот могут включать неорганические или органические кислоты. Неорганические кислоты включают хлороводородную кислоту, бромоводородную кислоту, серную кислоту, фосфорную кислоту и азотную кислоту. Органические кислоты включают муравьиную кислоту, уксусную кислоту,пропионовую кислоту, бутановую кислоту, метансульфоновую кислоту, п-толуолсульфоновую кислоту,бензолсульфоновую кислоту, пропиоловую кислоту, масляную кислоту, 2-бутиновую кислоту, винилуксусную кислоту, пентановую кислоту, гексановую кислоту, гептановую кислоту, октановую кислоту,нонановую кислоту и декановую кислоту. Примеры оснований включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат лития, карбонат натрия и карбонат калия. Некоторые примеры сильных оснований включают, но не ограничиваются этим, гидроксид, алкоксиды, амиды металлов, гидриды металлов, диалкиламиды металлов и ариламины, где алкоксиды включают литиевые, натриевые и калиевые соли метил-, этил- и третбутилоксидов; амиды металлов включают амид натрия, амид калия и амид лития; гидриды металлов включают гидрид натрия, гидрид калия и гидрид лития; и диалкиламиды металлов включают натриевые и калиевые соли метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, триметилсилил и циклогексилзамещенных амидов. Соединения, описанные в настоящей заявке, могут быть асимметричными (например, имеющими один или несколько стереоцентров). Предполагаются все стереоизомеры, такие как энантиомеры и диастереомеры, если не указано иное. Соединения по настоящему изобретению, которые содержат асимметрически замещенные атомы углерода, могут быть выделены в оптически активной или рацемической формах. Способы получения оптически активных форм из оптически активных исходных веществ известны из уровня техники, такие как разделение рацемических смесей или посредством стереоселективного синтеза. Способы, описанные в настоящей заявке, могут быть стереоселективными, так чтобы любая конкретная реакция, начинающаяся с одним или несколькими хиральными реагентами, обогащенными одним стереоизомером, образовывала продукт, который также обогащен одним стереоизомером. Реакцию можно осуществлять таким образом, чтобы продукт реакции, по существу, сохранял один или несколько хиральных центров, присутствующих в исходных веществах. Реакцию также можно осуществлять таким образом, чтобы продукт реакции содержал хиральный центр, который, по существу, является инвертированным относительно соответствующего хирального центра, присутствующего в исходных веществах. Разделение рацемических смесей соединений можно осуществлять любым из многочисленных способов, известных из уровня техники. Пример такого способа включает фракционированную перекристаллизацию (например, разделение диастереомерной соли) с использованием "кислоты для хирального разделения", которая является оптически активной, солеобразующей органической кислотой. Подходящие агенты разделения для способов фракционированной перекристаллизации, например, представляют собой оптически активные кислоты, такие как D и L формы винной кислоты, диацетилвинная кислота,дибензоилвинная кислота, миндальная кислота, яблочная кислота, молочная кислота или различные оптически активные камфорсульфоновые кислоты, такие как -камфорсульфоновая кислота. Другие агенты разделения, подходящие для способов фракционированной перекристаллизации, включают стереоизомерно чистые формы -метилбензиламина (например, S и R формы или диастереоизомерно чистые формы), 2-фенилглицинол, норэфедрин, эфедрин, N-метилэфедрин, циклогексилэтиламин, 1,2 диаминоциклогексан и т.п. Разделение рацемических смесей также можно осуществлять путем элюирования на колонке с насадкой из оптически активного агента разделения (например, динитробензоилфенилглицина). Подходящую композицию растворителя для элюирования может определить специалист в данной области. Соединения по настоящему изобретению также могут включать все изотопы атомов, присутствую- 23016675 щих в промежуточных соединениях или конечных соединениях. Изотопы включают атомы, имеющие одинаковый атомный номер, но разные массовые числа. Например, изотопы водорода включают тритий и дейтерий. Соединения по настоящему изобретению также могут включать таутомерные формы, такие как кетоенольные таутомеры. Таутомерные формы могут находиться в равновесии или пространственно замкнутыми в одной форме путем соответствующего замещения. Осуществив получение соединений в соответствии со способами, описанными в настоящей заявке,можно использовать обычные процедуры выделения и очистки, такие как концентрирование, фильтрация, экстракция, твердофазная экстракция, перекристаллизация, хроматография и т.п., для выделения желаемых продуктов. Далее настоящее изобретение описано более подробно при помощи конкретных примеров. Представленные ниже примеры предназначены для иллюстративных целей, а не для ограничения изобретения каким-либо образом. Специалистам в данной области будут очевидны различные некритические параметры, которые могут быть изменены или модифицированы с получением, по существу, таких же результатов. Примеры Пример 1. Получение 1-(4-гидрокси-3-(1-метил-1 Н-пиразол-5-ил)фенил)этанона (соединение 2) К перемешиваемому раствору 5-(2-метоксифенил)-1-метил-1 Н-пиразола (5,00 г, 26,56 ммоль) в 1,2 дихлорбензоле (30 мл) добавляли ацетилхлорид (3,13 г, 39,85 ммоль) с последующим добавлением хлорида алюминия (10,63 г, 79,69 ммоль). Реакционная смесь становилась янтарной, и ее нагревали до 55 С в течение 40 мин. Температуру повышали до 80 С и реакционную смесь перемешивали еще в течение 2 ч, после чего получали густую суспензию. ЖХ-МС анализ показал преобразование в 1-(4-гидрокси-3-(1 метил-1 Н-пиразол-5-ил)фенил)этанон и частичное образование О-ацилированного аналога. Реакционную смесь охлаждали до комнатной температуры и медленно гасили водой (50 мл) с получением осадка. Этот осадок фильтровали, промывали водой (30 мл) и гептаном (50 мл) и сушили в вакуумной печи (12 торр) в течение ночи при 60 С с получением соединения (2) в виде белого твердого вещества (3,80 г, 66%). ЖХ-МС: m/z 217 (М+Н)+; 1 Н ЯМР (ДМСО-d6)11,0 (с, 1 Н), 7,92 (д, J=8 Гц, 1 Н), 7,79 (с, 1 Н), 7,46 (с, 1 Н), 7,10 (д, J=8 Гц, 1 Н),6,30 (с, 1 Н), 3,67 (с, 3 Н), 2,51 (с, 3 Н). Пример 2 а. Получение N-(4-метокси-3-(1-метил-1 Н-пиразол-5-ил)фенил)ацетамида (соединение 3) Полифосфорную кислоту (15 г) переносили в 100-мл 3-горлую круглодонную колбу, снабженную механической мешалкой. В реакционную колбу переносили раствор 5-(2-метоксифенил)-1-метил-1 Нпиразола (1,50 г, 7,97 ммоль) в уксусной кислоте (9,57 г, 9,12 мл, 15,9 ммоль), с последующим добавлением гидроксиламингидрохлорида (6,08 г, 8,75 ммоль). Смесь перемешивали в атмосфере азота и нагревали до 80 С в течение 3,5 ч. Добавляли уксусную кислоту (1 мл) и гидроксиламингидрохлорид (0,61 г) и реакционную смесь перемешивали при 80 С в течение еще 2 ч. Реакционную смесь затем нагревали до 100 С и перемешивали в течение ночи. Добавляли дополнительные количества уксусной кислоты (1 мл) и гидроксиламингидрохлорида (0,61 г) и перемешивание при 100 С продолжали в течение еще 1 ч. Реакционную смесь затем охлаждали до комнатной температуры и разбавляли ледяной водой (40 мл) с охлаждением на ледяной бане. рН доводили до 5 добавлением 50% водного раствора NaOH с образованием осадка. Твердое вещество выделяли при помощи фильтрации и осадок на фильтре промывали водой. Неочищенное вещество очищали при помощи кристаллизации из смеси метанол-вода с получением соединения (3) (1,00 г, 51%). ЖХ-МС: m/z 246 (М+Н)+; 1 Н ЯМР (ДМСО-d6):9,9 (с, 1 Н), 7,62 (дд, J1=8 Гц, J2=4 Гц, 1 Н), 7,49 (д, J=4 Гц, 1 Н), 7,43 (с, 1 Н),7,10 (д, J=8 Гц, 1 Н), 6,22 (д, J=4 Гц, 1 Н), 3,75 (с, 3 Н), 3,61 (с, 3 Н), 2,01 (с, 3 Н). К раствору 5-(2-метоксифенил)-1-метил-1 Н-пиразола (2,00 г, 10,62 ммоль) в уксусной кислоте (1,27 г, 1,21 мл, 21,25 ммоль) добавляли пентоксид фосфора (7,7 мас.% в метансульфоновой кислоте, 20 мл) и раствор перемешивали при 60 С в течение 15 мин. Добавляли вторую порцию уксусной кислоты (1,27 г) и реакционную смесь перемешивали при 60 С в течение 10 мин. Добавляли гидроксиламингидрохлорид(1,47 г, 21,25 ммоль) и реакционную смесь перемешивали в течение 40 мин. Добавляли еще одну порцию гидроксиламингидрохлорида (1,47 г, 21,25 ммоль) и реакционную смесь перемешивали при 60 С в течение еще 10 мин. Реакционную смесь охлаждали до комнатной температуры, добавляли ледяную воду (50 мл) с охлаждением на ледяной бане и смесь подщелачивали до рН 5 добавлением 50% водного раствораNaOH. Образовывался смолистый осадок, который постепенно затвердевал. Это вещество фильтровали и осадок на фильтре промывали водой. Продукт кристаллизовали из смеси метанол-вода с получением соединения (3) (1,23 г, 50%). ЖХ-МС: m/z 246 (М+Н)+; 1 Суспензию 1-(4-гидрокси-3-(1-метил-1 Н-пиразол-5-ил)фенил)этанона (2,50 г, 11,56 ммоль) в уксусной кислоте (12,5 мл) перемешивали при 70 С с получением прозрачного раствора. Добавляли гидроксиламингидрохлорид (1,60 г, 23,02 ммоль) с последующим добавлением H2SO4 (98%, 1,25 мл). Температуру увеличивали до 80 С и реакционную смесь перемешивали в течение 30 мин. ЖХ-МС анализ показал образование промежуточного соединения оксима, в то время как исходное вещество не определялось. Добавляли H2SO4 (98%, 5 мл) и реакционную смесь перемешивали при 80 С в течение 30 мин. Добавляли дополнительное количество H2SO4 (2 мл) двумя порциями в течение 2 ч, после чего реакционную смесь перемешивали и нагревали при 80 С в течение еще 4 ч. Добавляли дополнительное количествоH2SO4 (98%, 0,5 мл) и реакционную смесь перемешивали и нагревали при 80 С в течение еще 30 мин. Реакционную смесь затем охлаждали до комнатной температуры и выливали в смесь лед-вода (80 мл). Смесь подщелачивали до рН 4-5 добавлением водного раствора NaOH (50%) с охлаждением на ледяной бане. Продукт выделяли кристаллизацией и фильтровали, промывали водой и сушили с получением соединения (4) в виде не совсем белого порошка (1,83 г, 68%). ЖХ-МС: m/z 232,4 (М+Н)+; 1 Н ЯМР (ДМСО-d6):9,79 (с, 1 Н), 9,68 (с, 1 Н), 7,42 (м, 3 Н), 6,99 (д, J=8 Гц, 1 Н), 6,20 (д, J=4 Гц, 1 Н),3,66 (с, 3 Н), 1,99 (с, 3 Н). Пример 3b. Получение N-(4-гидрокси-3-(1-метил-1 Н-пиразол-5-ил)фенил)ацетамид (соединение 4) В атмосфере азота N,N-диметилацетамид (13,47 кг) переносили в 30-л реакционный сосуд с двойной стенкой и при перемешивании добавляли 1-додекантиол (4,894 кг, 24,18 моль) с последующим добавлением по порциям дополнительного количества этоксида натрия (1,63 кг, 23,97 моль) в течение 1 ч. Температура реакционной смеси достигала 41 С из-за умеренной экзотермы. Температуру постепенно увеличивали до 63 С и добавляли N-(4-метокси-3-(1-метил-1 Н-пиразол-5-ил)фенил)ацетамид (3,504 кг,14,29 моль) и реакционную смесь нагревали до 135-136 С и перемешивали в течение ночи, после чего ЖХ-МС анализ показал отсутствие какого-либо исходного вещества. Реакционную смесь концентрировали путем отгонки растворителя при пониженном давлении. К реакционной смеси при перемешивании добавляли воду (14,41 кг). Порциями добавляли HCl (37%) для доведения рН реакционной смеси до 3 и продукт выделяли кристаллизацией. Суспензию фильтровали и твердый осадок на фильтре промывали водой (26,56 кг), а затем гептаном (25,374 кг). Высушенный твердый осадок (3,26 кг) снова суспендировали в гептане (10,92 кг) и суспензию кипятили с обратным холодильником в течение 1 ч. Часть гептана удаляли при помощи дистилляции, которая азеотропно удаляла остаточную воду в продукте. Суспен- 25016675 зию охлаждали до 20 С и фильтровали. Твердый осадок промывали гептаном и сушили с получением соединения (4) (3,09 кг, 93%). ЖХ-МС; m/z 232 (М+Н). Пример 4. Получение 4-амино-2-(1-метил-1 Н-пиразол-5-ил)фенол (соединение 5) Перемешиваемую суспензию N-(4-гидрокси-3-(1-метил-1 Н-пиразол-5-ил)фенил)ацетамида (1,77 г,7,65 ммоль) в метаноле (7,0 мл) нагревали (45-50 С) с получением прозрачного раствора. К реакционной смеси медленно добавляли H2SO4 (98%, 1,22 мл) и смесь затем кипятили с обратным холодильником в течение 5,5 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении. Остаток разбавляли водой (10 мл), нейтрализовали до рН 7 добавлением водного раствора NaOH (50%) и затем подщелачивали до рН 8 насыщенным водным раствором NaHCO3. Продукт выделяли кристаллизацией, фильтровали и сушили с получением соединения (5) (1,13 г, 78%). ЖХ-МС: m/z 190,2 (М+Н)+; 1N,N-диметилацетамиде (6,5 мл) добавляли NaHCO3 (0,48 г, 5,08 ммоль) и смесь охлаждали до -10 С. По каплям добавляли 3-метоксибензоилхлорид (0,82 мл, 6,00 ммоль) и после завершения добавления реакционную смесь перемешивали при -10 С в течение еще 15 мин и затем при комнатной температуре в течение 1 ч. Добавляли по каплям воду (16,2 мл) и продукт кристаллизовали и выделяли при помощи фильтрации. Твердый осадок на фильтре промывали 10% водным раствором NaHCO3 (220 мл), а затем водой и затем сушили с получением соединения (6) (1,66 г, 90%). ЖХ-МС: m/z 324,3 (М+Н)+; 1 Н ЯМР (ДМСО-d6):10,11 (с, 1 Н), 9,80 (с, 1 Н), 7,64 (д, J=8 Гц, 1 Н), 7,60 (д, J=4 Гц, 1 Н), 7,51 (д,J=8 Гц, 1 Н), 7,47 (т, J=4 Гц, 1 Н), 7,44 (м, 2 Н), 7,14 (д, J=8 Гц, 1 Н), 6,96 (д, J=8 Гц, 1 Н), 6,24 (с, 1 Н), 3,83 (с,3 Н), 3,70 (с, 3 Н). Пример 6. Получение хлорида 4-(2-(4-(3-метоксибензамидо)-2-(1-метил-1 Н-пиразол-5 ил)фенокси)этил)морфолин-4-ия (соединение 7) К перемешиваемому раствору N-(4-гидрокси-3-(1-метил-1 Н-пиразол-5-ил)фенил)-3-метоксибензамида (22,2 г, 0,069 моль) в ТГФ (246 мл) добавляли трифенилфосфин (27,0 г, 0,103 моль). Раствор охлаждали до -15 С и добавляли по каплям диизопропилазодикарбоксилат (20,8 г, 0,103 моль). После завершения добавления смесь нагревали до 5 С и добавляли по каплям 2-морфолиноэтанол(13,5 г, 0,092 моль), поддерживая при этом внутреннюю температуру ниже 10 С. После завершения добавления реакционную смесь оставляли нагреваться до комнатной температуры. Реакция завершалась через 30 мин, в этот момент ТГФ удаляли при помощи дистилляции и остаток растворяли в изопропаноле (225 мл). Раствор нагревали до 70 С при перемешивании; добавляли порциями HCl (37%, 9,9 мл, 0,119 моль), поддерживая при этом внутреннюю температуру между 70 и 80 С. HCl соль продукта выкристаллизовывали при постепенном охлаждении до комнатной температуры. Твердые вещества фильтровали,промывали изопропанолом и сушили с получением соединения (7) (26,0 г, 80%). Перемешиваемый раствор N-(4-гидрокси-З-(1-метил-1 Н-пиразол-5-ил)фенил)-3-метоксибензамида(11,7 кг, содержащий 5,2% воды, 34,3 моль) в ТГФ (107 кг) подвергали дистилляции при атмосферном давлении для удаления приблизительно 70-80% растворителя. Добавляли ТГФ (99 кг) с последующим добавлением трифенилфосфина (14,14 кг, 53,91 моль). Раствор охлаждали до -12 С и порциями добавляли диизопропилазодикарбоксилат (11,02 кг, 52,5 моль), поддерживая при этом внутреннюю температуру в пределах от -10 до 0 С. После завершения добавления смесь перемешивали при температуре от -10 до- 26016675 3 С в течение 40 мин. Порциями добавляли 2-морфолиноэтанол (7,10 кг, 54,13 моль) при 2-6 С. После завершения добавления реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Приблизительно 70-80% ТГФ удаляли с помощью дистилляции и добавляли изопропанол (92 кг). Еще 111 кг смеси растворителя удаляли с помощью дистилляции и добавляли изопропанол (109 кг). Порциями добавляли HCl (37%, 5,70 кг, 57,8 моль), поддерживая при этом внутреннюю температуру реакции между 60 и 70 С. HCl соль продукта выделяли кристаллизацией при охлаждении до комнатной температуры. Твердые частицы фильтровали, промывали изопропанолом и сушили с получением соединения (7) (14,53 кг, 90%). ЖХ-МС: m/z 437 (М+Н)+; 1 Н ЯМР (ДМСО-d6)11,3 (ушир.с, 1 Н), 10,32 (с, 1 Н), 7,91 (дд, J1=8 Гц, J2=4 Гц, 1 Н), 7,75 (д, J=4 Гц,1 Н), 7,54 (д, J=8 Гц, 1 Н), 7,49 (м, 2 Н, 1 Н), 7,44 (т, J=8 Гц, 1 Н), 7,24 (д, J=8 Гц, 1 Н), 7,16 (дд, J1=8 Гц, J2=4 Гц, 1 Н), 6,29 (д, J=4 Гц, 1 Н), 4,46 (т, J=4 Гц, 2 Н), 3,83 (с, 3 Н), 3,82-3,70 (м, 4 Н), 3,69 (с, 3 Н), 3,45 (м, 2 Н),3,15-3,12 (м, 2 Н), 3,00-2,90 (м, 2 Н). Пример 7. Получение 3-фтор-N-(4-гидрокси-3-(1-метил-1 Н-пиразол-5-ил)фенил)бензамида (соединение 8) В атмосфере азота N,N-диметилацетамид (7,83 л) переносили в 30-л реакционный сосуд с двойной стенкой с последующим добавлением 4-амино-2-(1-метил-1 Н-пиразол-5-ил)фенола (1,57 кг, 8,28 моль). Реакционную смесь охлаждали до 8 С и добавляли пиридин (0,65 кг, 8,28 моль). Реакционную смесь далее охлаждали до -6 С и медленно добавляли 3-фторбензоилхлорид (1,312 кг, 8,27 моль), поддерживая при этом температуру реакции ниже 3 С. После завершения добавления 3-фторбензоилхлорида смесь перемешивали при температуре 0-5 С в течение 15 мин и затем при 20 С в течение 75 мин. ЖХ-МС анализ образца реакционной смеси показал полное преобразование в продукт. Медленно добавляли воду(19,58 л), поддерживая при этом температуру реакции на уровне 35 С. Продукт осаждали и суспензию перемешивали при 28 С в течение 15 мин и затем фильтровали. Твердый осадок на фильтре промывали водой (20 л), а затем гептаном (24 л) и сушили при 60 С в вакууме с получением соединения (8) (2,766 кг, содержащее 5,5% воды, 101%). 1 Н ЯМР (ДМСО-d6)10,2 (с, 1 Н), 9,86 (с, 1 Н), 7,83 (д, J=4 Гц, 1 Н), 7,79 (д, J=8 Гц, 1 Н), 7,70 (д, J=8 Гц, 1 Н), 7,62 (м, 2 Н), 7,47 (м, 2 Н), 7,01 (д, J=8 Гц, 1 Н), 3,72 (с, 3 Н). Пример 8. Получение карбоксиформиата 4-ацетил-1-(2-(4-(3-фторбензамидо)-2-(1-метил-1 Нпиразол-5-ил)фенокси)этил)пиперазин-1-ия (соединение 9) В атмосфере азота ТГФ (18 л) переносили в 30-л реакционный сосуд с двойной стенкой. Добавляли 3-фтор-N-(4-гидрокси-3-(1-метил-1 Н-пиразол-5-ил)фенил)бензамид (1,82 кг, 5,84 моль), трифенилфосфин (2,30 кг, 8,77 моль) и 1-(4-(2-гидроксиэтил)пиперазин-1-ил)этанон (1,550 кг, чистота 76,2%, 6,85 моль). Реакционную смесь охлаждали до 15 С и медленно добавляли диизопропилазодикарбоксилат(1,77 кг, 8,77 моль), поддерживая при этом внутреннюю температуру ниже 30 С. Реакционную смесь охлаждали до 20 С и перемешивали в течение 2 ч. Добавляли дополнительные количества трифенилфосфина (0,77 кг, 2,92 моль), 1-(4-(2-гидроксиэтил)пиперазин-1-ил)этанона (0,503 кг 76,2% чистота, 2,23 моль) и диизопропилазодикарбоксилата (0,59 кг, 2,92 моль) и реакционную смесь перемешивали еще в течение 30 мин. Добавляли трифенилфосфин (1,53 кг, 5,84 моль) и диизопропилазодикарбоксилат (1,18 кг, 5,8 5 моль) и реакционную смесь перемешивали в течение еще 35 мин. Добавляли дополнительные количества трифенилфосфина (0,77 кг, 2,92 моль) и диизопропилазодикарбоксилата (0,59 кг, 2,92 моль) и реакционную смесь перемешивали в течение еще 10 мин. ЖХ-МС анализ образца реакционной смеси показал преобразование в продукт, исходное вещество не было обнаружено. Реакционную смесь перемешивали в течение ночи при комнатной температуре. ТГФ (приблизительно 14,4 л) отгоняли при пониженном давлении и добавляли этанол (8 л). Оставшийся ТГФ удаляли с помощью дистилляции (метод замены растворителя). В реактор переносили дополнительное количество этанола (9 л), а затем раствор щавелевой кислоты (0,74 кг, 8,18 моль) в этаноле (3 л) и затем воду (4 л). Соль щавелевой кислоты 3 фтор-N-[3-(2-метил-2 Н-пиразол-3-ил)-4-(2-N-ацетилпиперазинил-4-илэтокси)фенил]бензамида выделяли кристаллизацией после перемешивания смеси при 20 С в течение 2,5 ч. Кристаллизованный продукт Перемешиваемую смесь N-(3-ацетил-4-гидроксифенил)ацетамида (148,8 г, 0,770 моль), диметилформамиддиметилацеталя (206,2 мл, 185,0 г, 1,552 моль) и 2-пропанола (1500 мл) нагревали до 45 С в атмосфере азота. После этого смесь перемешали при 45 С в течение примерно 18 ч, конверсия N-(3 ацетил-4-гидроксифенил)ацетамида в N-(3-(3-(диметиламино)акрилоил)-4-гидроксифенил)ацетамид составила 98% на основании площади пика ВЭЖХ. Добавляли воду (1500 мл) и 1500 мл растворителя затем удаляли отгонкой при пониженном давлении при 55 С. Содержимое реактора охлаждали до 15 С и затем фильтровали. Твердый осадок на фильтре сушили при пониженном давлении при 65 С с получением соединения (11) (167,0 г, 87%), (чистота 98% по данным ВЭЖХ-анализа на основании площади пиков). 1 Н ЯМР (ДМСО-d6):14,07 (с, 1 Н), 9,80 (с, 1 Н), 8,00 (д, J=2,5 Гц, 1 Н), 7,95 (д, J=12,0 Гц, 1 Н), 7,56 В колбу, содержащую метанол (502 мл) при перемешивании при температуре окружающей среды в атмосфере азота добавляли N-(3-(3-(диметиламино)акрилоил)-4-гидроксифенил)ацетамид (51,6 г, 208 ммоль) и затем трифториддиэтилэфират бора (5,22 мл, 5,85 г, 41,2 ммоль). В то время как полученную смесь перемешивали при 2-4 С в атмосфере азота, добавляли метилгидразин (15,32 мл 13,27 г) . После того как содержимое реактора перемешивали в течение ночи при 5 С, конверсия N-(3-(3(диметиламино)акрилоил)-4-гидроксифенил)ацетамида в 87,9:12,1 смесь соединения (4) и его региоизомера 3-(2'-гидрокси-5'-ацетамидофенил)-1-метил-1 Н-пиразола составила 99,5% по данным ВЭЖХанализа на основании площади пиков. Большую часть метанола затем удаляли с помощью дистилляции при пониженном давлении при температуре кожуха 30 С. К маслянистому остатку добавляли гептан(250 мл) и отгонку растворителя при пониженном давлении продолжали вплоть до начала осаждения твердых веществ. Добавляли смесь гептана (126 мл) и этилацетата (377 мл) и полученную суспензию перемешивали при температуре окружающей среды в течение двух часов. Твердый продукт фильтровали и повторно суспендировали в воде (377 мл), предварительно смешанной с 37 мас.% водным раствором хлороводородной кислоты (1,57 мл, 1,89 г, 19,1 ммоль). Полученную суспензию перемешивали в течение 2 ч при температуре окружающей среды и затем фильтровали. Отфильтрованное твердое вещество сушили при пониженном давлении при 65 С с получением соединения (4) (39,4 г, 82%), (чистота 99% по данным ВЭЖХ-анализа на основании площади пиков). 1 В колбу, содержащую смесь N-(4-гидрокси-3-(1-метил-1 Н-пиразол-5-ил)фенил)ацетамида (4, 39,1 г,169 ммоль) и метанола (170 мл), перемешиваемую в атмосфере азота, медленно добавляли концентрированную серную кислоту (23 мл, 42,3 г, 431 ммоль). Когда добавление было завершено, реакционная смесь представляла собой прозрачный раствор при 55 С. После того как перемешиваемую реакционную смесь кипятили с обратным холодильником в атмосфере азота в течение семи часов, большую часть метанола отгоняли при пониженном давлении с использованием бани 70 С. К полученному после дистилляции остатку добавляли воду (80 мл), а затем большую часть воды отгоняли из смеси продукта при пониженном давлении с использованием бани 70 С. Содержание метанола в остатке после дистилляции,- 28016675 определенное интеграцией 1 Н-ЯМР, составило 7,7 мас.% от содержащегося количества соединения 5. К полученному после дистилляции остатку снова добавляли воду (80 мл), большую часть воды затем снова отгоняли из смеси продукта при пониженном давлении с использованием бани 70 С. Содержание метанола в остатке после дистилляции, определенное интеграцией 1 Н-ЯМР, составило 2,2 мас.% от содержащегося количества соединения 5. Полученный от дистилляции остаток разбавляли дополнительным количеством воды (80 мл) и добавляли водный раствор гидроксида натрия (50 мас.%, 41 мл, 62,5 г, 782 ммоль), поддерживая при этом температуру перемешиваемой смеси продукта при 30-35 С с использованием охлаждающей бани. В процессе добавления продукт начинал осаждаться, и рН смеси продукта повышался до 5,8-6,1. Затем добавляли насыщенный водный раствор бикарбоната натрия (50 мл, 53,2 г,55,7 ммоль), поддерживая при этом температуру перемешиваемой смеси продукта при примерно 25 С с использованием охлаждающей бани. В результате, рН смеси продукта повысился до 7. После того как смесь продукта перемешивали при примерно 23 С в течение 2 ч, значение рН упало до 6,2. После еще одного часа перемешивания при примерно 23 С снова добавляли насыщенный водный раствор бикарбоната натрия (25 мл, 26,6 г, 27,9 ммоль), и в результате рН смеси продукта повысился до 7. После перемешивания еще в течение получаса при 23 С смесь продукта фильтровали. Твердый осадок на фильтре промывали водой (380 мл) и сушили в вакууме при 60 С до постоянного веса с получением соединения 5 (29,7 г, выход 93%, чистота 99,40% по данным ВЭЖХ-анализа на основании площади пиков). Пример 12. Получение хлорида 4-(2-(4-(3-метоксибензамидо)-2-(1-метил-1 Н-пиразол-5 ил)фенокси)этил)морфолин-4-ия (соединение 7) Стадия А: Получение N-(4-гидрокси-3-(1-метил-1 Н-пиразол-5-ил)фенил)-3-метоксибензамида (соединение 6) К смеси 4-амино-2-(1-метил-1 Н-пиразол-5-ил)фенола (5, 50,0 г, 264,3 ммоль, 1,00 экв.), бикарбоната натрия (28,9 г, 344 ммоль, 1,30 экв.), и 2-пропанола (200 мл), перемешиваемой в атмосфере азота, добавляли 3-метоксибензоилхлорид (49,6 г, 2 90,8 ммоль, 1,10 экв.) достаточно медленно для поддержания температуры реакционной смеси при 0-5 С, используя охлаждающую рубашку для реактора. Затем полученный коричневый раствор перемешивали при 5 С в течение одного часа и при 10-15 С в течение еще одного часа, после чего достаточно медленно добавляли воду (300 мл), поддерживая при этом температуру реакционной смеси при 20-25 С при помощи охлаждающей рубашки для реактора. Реакционную смесь перемешивали при примерно 23 С в течение еще двух часов и затем фильтровали. Твердый осадок на фильтре промывали водой (3150 мл) и сушили в вакууме при 65 С в течение примерно 16 ч и затем при 75-80 С до постоянного веса с получением соединения 6 (80 г, 247 ммоль, выход 93,6%, чистота 99,24% по данным ВЭЖХ-анализа на основании площади пиков). Содержание воды в соединении 6,полученного с помощью такой процедуры, обычно составляет примерно 0,1 мас.%. Стадия В. Получение хлорида 4-(2-(4-(3-метоксибензамидо)-2-(1-метил-1 Н-пиразол-5 ил)фенокси)этил)морфолин-4-ия (соединение 7) Смесь N-(4-гидрокси-3-(1-метил-1 Н-пиразол-5-ил)фенил)-3-метоксибензамида, полученного способом примера 12, стадия А (6, 50,0 г, 154,6 ммоль, 1,00 экв.) и тетрагидрофурана (ТГФ, 500 мл) перемешивали и нагревали до растворения соединения 6. Полученный раствор охлаждали до примерно 25 С и добавляли трифенилфосфин (52,7 г, 200,9 ммоль, 1,30 экв.). Затем полученный раствор охлаждали до температуры -5-0 С, достаточно медленно добавляли диизопропилазодикарбоксилат (40,6 г, 200,8 ммоль,1,30 экв.) для поддержания температуры перемешиваемой реакционной смеси при -5-0 С при внешнем охлаждении реактора. Полученную смесь перемешивали при примерно 23 С в течение четырех часов и затем охлаждали до 15 С. Затем добавляли 2-морфолиноэтанол (28,4 г, 216,5 ммоль, 1,40 экв.), вызывая нагревание перемешиваемой реакционной смеси до примерно 23 С, при этой температуре перемешивание продолжали в течение двух часов. Большую часть ТГФ отгоняли из реакционной смеси при пониженном давлении и при температуре 60 С. Добавляли 2-пропанол (600 мл) и затем большую часть 2 пропанола отгоняли из смеси продукта при пониженном давлении и при температуре 60 С. Добавляли дополнительное количество 2-пропанола (600 мл) и полученную смесь нагревали до 60 С. К перемешиваемому при 60 С раствору добавляли концентрированный водный раствор хлороводородной кислоты(25,8 г, 21,46 мл, 261 ммоль, 1,69 экв.) для доведения рН до 2,0. Смесь продукта затем охлаждали до примерно 23 С и перемешивали при этой температуре в течение трех часов. Суспензию осажденного
МПК / Метки
МПК: A61P 7/00, A61K 31/415, C07D 231/12
Метки: способы, получения, производного, кристаллическая, фенилпиразола, фенилпиразолов, форма
Код ссылки
<a href="https://eas.patents.su/30-16675-sposoby-polucheniya-fenilpirazolov-i-kristallicheskaya-forma-proizvodnogo-fenilpirazola.html" rel="bookmark" title="База патентов Евразийского Союза">Способы получения фенилпиразолов и кристаллическая форма производного фенилпиразола</a>
Предыдущий патент: Пиридон сульфонамиды и пиридон сульфамиды в качестве ингибиторов mek
Следующий патент: Способ очистки воды
Случайный патент: Способ получения солифенацина