Новая кристаллическая форма производного пиридазино [4,5-в] индола
Формула / Реферат
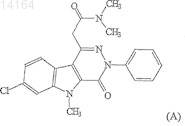
1. Кристаллическая форма II 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4Н-пиридазино[4,5-b]индол-1-ацетамида формулы (А)
характеризующаяся рентгеновской дифрактограммой, содержащей пик при величине 2q, приблизительно составляющем 5,71°.
2. Кристаллическая форма по п.1, рентгеновская дифрактограмма которой дополнительно характеризуется пиками при величинах углов 2q, составляющих приблизительно 11,47 и 9,97°.
3. Кристаллическая форма по п.2, рентгеновская дифрактограмма которой дополнительно характеризуется пиками при величинах углов 2q, составляющих приблизительно 19,21; 18,43; 15,95 и 11,97°.
4. Кристаллическая форма по п.1, по существу, свободная от любого другого полиморфа.
5. Фармацевтическая композиция, содержащая кристаллическую форму по п.1 и один или несколько фармацевтически приемлемых наполнителей.
6. Фармацевтическая композиция, содержащая кристаллическую форму по п.2 и один или несколько фармацевтически приемлемых наполнителей.
7. Способ лечения или предотвращения заболевания или нарушения, связанного с нарушением функций периферических бензодиазепиновых рецепторов, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества кристаллической формы по п.1.
8. Способ лечения или предотвращения заболевания или нарушения, связанного с нарушением функций периферических бензодиазепиновых рецепторов, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества фармацевтической композиции по п.5.
9. Способ лечения или предотвращения нейродегенеративного заболевания, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества кристаллической формы по п.1.
10. Способ лечения или предотвращения нейродегенеративного заболевания, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества фармацевтической композиции по п.5.
11. Способ лечения или предотвращения невропатии, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества кристаллической формы по п.1.
12. Способ лечения или предотвращения невропатии, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества фармацевтической композиции по п.5.
13. Способ лечения или предотвращения рака или опухолей, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества кристаллической формы по п.1.
14. Способ лечения или предотвращения рака или опухолей, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества фармацевтической композиции по п.5.
15. Способ лечения или предотвращения кожного стресса, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества кристаллической формы по п.1.
16. Способ лечения или предотвращения стрессового состояния в области кожи, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества фармацевтической композиции по п.5.
17. Способ лечения или предотвращения ревматоидного артрита, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества кристаллической формы по п.1.
18. Способ лечения или предотвращения ревматоидного артрита, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества фармацевтической композиции по п.5.
19. Способ лечения или предотвращения сердечного заболевания или нарушения сердечной деятельности, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества кристаллической формы по п.1.
20. Способ лечения или предотвращения сердечного заболевания или нарушения сердечной деятельности, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества фармацевтической композиции по п.5.
21. Способ получения кристаллической формы по п.1, включающий стадии смешивания 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4Н-пиридазино[4,5-b]индол-1-ацетамида с метиловым или этиловым спиртом с образованием смеси с концентрацией, составляющей от приблизительно 1 до приблизительно 4 мг/мл, нагревания смеси до температуры в интервале от приблизительно 45 до приблизительно 60°С; фильтрования смеси и выпаривания низшего спирта из фильтрата с помощью тока инертного газа с образованием твердого вещества.
22. Способ получения кристаллической формы по п.1, включающий стадии растворения 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4Н-пиридазино[4,5-b]индол-1-ацетамида в дихлорметане с образованием раствора с концентрацией от приблизительно 30 до приблизительно 50 мг/мл; добавления раствора к этанолу, при объемном отношении дихлорметан:этанол от приблизительно 1:3 до приблизительно 1:4; концентрирования раствора, посредством понижения объема с помощью тока инертного газа на приблизительно 10-40%, до кристаллизации твердого вещества и последующего отделения твердого вещества.
23. Способ получения кристаллической формы по п.1, включающий стадии растворения 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4Н-пиридазино[4,5-b]индол-1-ацетамида в дихлорметане с образованием раствора с концентрацией от приблизительно 20 до приблизительно 50 мг/мл, добавления раствора к гексану, для того чтобы вызвать осаждение твердого вещества и отделение твердого вещества.
Текст
НОВАЯ КРИСТАЛЛИЧЕСКАЯ ФОРМА ПРОИЗВОДНОГО ПИРИДАЗИНО [4,5-В] ИНДОЛА Раскрывается новая кристаллическая форма 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро 4 Н-пиридазино[4,5-b]индол-1-ацетамида; способ получения указанной кристаллической формы 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида; композиции, содержащие указанную форму в смеси с одним или несколькими фармацевтически приемлемыми наполнителями, и применения указанной формы. 014164 Настоящее изобретение относится к новой кристаллической форме, в дальнейшем обозначаемой в описании как кристаллическая форма II 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Нпиридазино[4,5-b]индол-1-ацетамида. Данное изобретение также относится к способам получения такой кристаллической формы и к способам ее использования для предотвращения и лечения заболеваний, связанных с периферическими бензодиазепиновыми рецепторами. Предпосылки создания изобретения 7-Хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамид,имеющий структуру, соответствующую формуле (А) обладает высоким сродством к периферическим бензодиазепиновым рецепторам. Получение, физические свойства и превосходные фармакологические свойства 7-хлор-N,N,5-триметил-4-оксо-3-фенил 3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида описаны, например, в патенте США 6262045 и, в частности, в патенте США 6395729, которые включены в полном объеме в настоящее описание в виде ссылки. Способы, описанные в этих патентах, приводят к выделению 7-хлор-N,N,5-триметил-4-оксо-3 фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида в одной определенной кристаллической форме, обозначаемой в описании как форма I. Ограниченная растворимость кристаллической формы I 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5 дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида как в водных растворах (обычно менее чем 0,01 мг/мл),так и неводных растворителях препарата (обычно менее чем 3 мг/мл) делает затруднительным введение больному и хранение препаратов, содержащих указанное соединение. Предварительные исследования, осуществляемые со стандартными препаратами, приводили к ограниченному всасыванию лекарственного средства. Поэтому существует потребность в новых твердых формах 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида и в новых способах их получения. Сущность изобретения Мы обнаружили, что соединение формулы (А) может находиться в виде двух кристаллических полиморфных модификаций, каждая из которых имеет отчетливо различающиеся физические свойства. Эти две кристаллические полиморфные формы, описанные в данном описании изобретения, в дальнейшем обозначают в описании как форму I и форму II. Соответственно, настоящее изобретение относится к кристаллической полиморфной форме II 7 хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида,представляемой формулой (А), и к композициям, содержащим кристаллическую форму II. Данное изобретение также относится к способам получения кристаллической формы II и к способам ее использования. Краткое описание чертежей На фиг. 1 представлено наложение трех инфракрасных спектров кристаллической формы II 1-хлорN,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида по настоящему изобретению, полученных на ИК-спектрометре с преобразованием Фурье (FTIR). На фиг. 2 сравнивают инфракрасные спектры кристаллической формы I 7-хлор-N,N,5-триметил-4 оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида и кристаллической формы II 7-хлорN,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида, полученные на ИК-спектрометре с преобразованием Фурье (FTIR). Фиг. 3 представляет собой наложение термограмм кристаллических форм I и II 7-хлор-N,N,5 триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида по изобретению, полученных методом дифференциальной сканирующей калориметрии. Фиг. 4 представляет собой рентгеновскую порошковую дифрактограмму кристаллической формы II 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида по настоящему изобретению. Фиг. 5 представляет собой рентгеновскую порошковую дифрактограмму кристаллической формы II 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида по настоящему изобретению. Фиг. 6 представляет собой наложение рентгеновских порошковых дифрактограмм кристаллической формы I и кристаллической формы II 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Нпиридазино[4,5-b]индол-1-ацетамида по настоящему изобретению.-1 014164 Фиг. 7 представляет собой наложение рентгеновских порошковых дифрактограмм кристаллической формы I и кристаллической формы II 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Нпиридазино[4,5-b]индол-1-ацетамида по настоящему изобретению. На фиг. 8 показаны результаты тестирования растворимости, где сравнивают растворимости/скорости растворения кристаллической формы I и кристаллической формы II 7-хлор-N,N,5 триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида в смеси водный 0,25% лаурилсульфат натрия/0,01 М фосфатный буфер (рН 7). Фиг. 9 представляет собой наложение инфракрасных спектров кристаллической формы II 7-хлорN,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида по настоящему изобретению в напряженном состоянии и в отсутствии напряжения, полученных на ИК-спектрометре с преобразованием Фурье (FTIR). Подробное описание изобретения Определения и сокращения Используемые выше и по всему описанию изобретения нижеследующие сокращения, если не оговорено иначе, следует понимать как имеющие нижеследующий смысл: А - АнгстремRPM - об./мин Используемые выше и по всему описанию изобретения нижеследующие термины следует понимать, если не оговорено иначе, как имеющие нижеследующий смысл: Термин "форма I", используемый в описании, предназначен для описания кристаллической формы 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида, которую можно определить, используя описанные в описании отличающие ее характеристики. Иллюстративные данные находятся на фиг. 2, 3 и/или 6. Термин "форма II", используемый в описании, предназначен для описания кристаллической формы 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида, которую можно определить, используя описанные в описании отличающие ее характеристики. Иллюстративные данные находятся на фиг. 1, 2, 3, 4, 5 и/или 6. Способность вещества находиться в нескольких кристаллических формах называют полиморфизмом. Различные кристаллические формы определенного вещества обозначают как "полиморфные модификации". Вообще говоря, на полиморфизм влияет способность молекулы вещества изменять свою конформацию или вступать в различные межмолекулярные или внутримолекулярные взаимодействия, в частности образовывать водородные связи, что находит отражение в различных расположениях атомов в кристаллических решетках различных полиморфных модификаций. В противоположность этому общая внешняя форма вещества, известная как "морфология", относится к внешней конфигурации кристалла и присутствующих плоскостей без отношения к внутренней структуре. Кристаллы могут обнаруживать различную морфологию, основываясь на различных условиях, таких как, например, скорость роста, перемешивание и присутствие примесей. Различные полиморфные модификации вещества могут обладать различными энергиями кристаллической решетки. И, таким образом, в твердом состоянии они могут демонстрировать различные физические свойства, такие как форму, плотность, точку плавления, цвет, устойчивость, растворимость, скорость растворения и так далее. Это может, в свою очередь, воздействовать на устойчивость, скорость растворения и/или биодоступность данного полиморфа и на его пригодность для использования в качестве фармацевтического препарата и в фармацевтических композициях. Кристаллическая форма II 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5b]индол-1-ацетамида имеет ряд преимуществ перед формой I. Например, форма II обладает лучшей растворимостью и более высокой скоростью растворения, чем кристаллическая форма I. Широко известно,что полиморфные формы, обладающие большими растворимостями и скоростями растворения, обычно являются физически менее устойчивыми, чем полиморфы, имеющие меньшие растворимость и скорости растворения. Однако, кристаллическая форма II обладает удивительной физической устойчивостью. Например, форма II не превращается в любую другую форму при хранении в нормальных условиях (комнатная температура) или в нижеследующих напряженных состояниях: при хранении в течение двух месяцев в открытом флаконе при относительной влажности 75% и при 50 С. Устойчивость формы II в таких условиях подтверждена данными ИК Фурье-спектроскопии. Таким образом, настоящее изобретение предлагает новую кристаллическую форму 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Нпиридазино[4,5-b]индол-1-ацетамида, которая обладает лучшей растворимостью, чем известная ранее кристаллическая форма I. В предпочтительном аспекте в изобретении предлагают кристаллическую форму II 7-хлор-N,N,5 триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида, определенную в описании и, по существу, не содержащую любой другой полиморфной модификации. В следующем предпочтительном аспекте, кристаллическая форма II 7-хлор-N,N,5-триметил-4-оксо-2 014164 3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида, определенная в описании, по существу,свободна от примесей. Под термином "по существу, свободна" подразумевают, что кристаллическая форма II содержит менее чем 10%, предпочтительно менее чем 5% и более предпочтительно менее чем 2% любой другой полиморфной модификации или примеси. Способы получения кристаллической формы II являются следующим объектом настоящего изобретения. Кристаллическая форма II может быть получена кристаллизацией 7-хлор-N,N,5-триметил-4-оксо-3 фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида в соответствующих условиях. С помощью контроля условий кристаллизации может быть получена кристаллическая форма II, по существу, не содержащая кристаллической формы I. В большинстве случаев кристаллическую форму II можно получить нагреванием 7-хлор-N,N,5 триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида в низшем спирте, например метаноле или этаноле, при концентрации, составляющей приблизительно 1-4 мг/мл, при достаточной для растворения температуре, например, приблизительно 45-60 С, отфильтровыванием любых нерастворимых примесей, охлаждением фильтрата и затем выпариванием растворителя током инертного газа,такого как азот, с образованием твердого вещества. Альтернативно, кристаллическую форму II получают посредством кристаллизации 1-хлор-N,N,5 триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида, растворяя соединение в дихлорметане при концентрации, приблизительно составляющей от 30 до приблизительно 50 мг/мл, добавляя раствор к этанолу и концентрируя раствор путем уменьшения объема на приблизительно 10-40% с помощью тока инертного газа, такого как азот, чтобы вызвать осаждение твердого вещества. Дополнительно кристаллическую форму II получают, растворяя 7-хлор-N,N,5-триметил-4-оксо-3 фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамид в дихлорметане при концентрации приблизительно от 20 до приблизительно 50 мг/мл, добавляя раствор к гексанам, чтобы вызвать осаждение твердого вещества, и отделяя кристалл путем фильтрования. Кристаллическую форму II также можно получить, используя другую стандартную методику получения кристаллических форм, известную специалистам в данной области техники, такую как кристаллизация из сверхкритической текучей среды, например сверхкритической двуокиси углерода. Настоящее изобретение также относится к фармацевтической композиции, содержащей кристаллическую форму II 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1 ацетамида в комбинации с одним или несколькими фармацевтически приемлемыми наполнителями. Предпочтительные фармацевтические композиции по изобретению включают в себя кристаллическую форму II 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида,по существу, не содержащую кристаллическую форму I, в комбинации с одним или несколькими фармацевтически приемлемыми наполнителями. В еще одном варианте осуществления настоящее изобретение относится к лекарственным формам,содержащим описанные в описании фармацевтические композиции. Лекарственные формы включают в себя, кроме прочих, лекарственные формы, выбранные из группы, состоящей из пилюль, капсул, каплет,таблеток, гранул, взвесей, мазей, лосьонов, суппозиториев и паст. Каждая доза должна содержать количество лекарственного вещества, рассчитанное таким образом, чтобы произвести требуемый терапевтический эффект. Как правило, фармацевтические композиции будут вводить в стандартных лекарственных формах, содержащих от приблизительно 2 до приблизительно 2000 мг лекарственного вещества на массу композиции с предпочтительным интервалом от приблизительно 10 до приблизительно 1000 мг. Фармацевтические композиции по настоящему изобретению предпочтительно содержат терапевтически эффективное количество кристаллического лекарственного вещества. Термин "терапевтически эффективное количество", используемый в описании, обозначает количество лекарственного вещества,присутствующего во вводимой композиции, которое является достаточным для предотвращения развития или некоторого облегчения одного или нескольких симптомов заболевания, подвергаемого лечению. Аналогично термин "терапевтически эффективное количество фармацевтической композиции" обозначает количество такой композиции, которое является достаточным для предотвращения развития или некоторого облегчения одного или нескольких симптомов заболевания, подвергаемого лечению. При установлении эффективного количества лекарственного средства или дозы лечащий диагност учитывает ряд факторов, которые включают в себя, кроме прочих, вид млекопитающего, его размер, возраст и общее состояние здоровья; конкретное заболевание, степень поражения болезнью или тяжесть заболевания,ответную биологическую реакцию данного пациента, путь введения лекарственного средства, характеристики биодоступности введенного препарата, избранный режим дозирования, применение сопутствующего медикаментозного лечения и другие привходящие обстоятельства. Фармацевтические композиции по настоящему изобретению содержат один или несколько фармацевтически приемлемых наполнителей, обычно используемых в данной области. Такие наполнители могут включать в себя одно или несколько наполняющих веществ, разбавителей, например микрокристаллическую целлюлозу, лактозу, маннит, пептизированный крахмал и тому подобное; дезинтегрирующих-3 014164 агентов, например натрийкрахмалгликолат, кросповидон, кроскармелоза-натрий и тому подобное; смазывающих веществ, например стеарат магния, стеарилфумарат натрия и тому подобное; подсластителей,например сахарозу, сахарин и тому подобное; ароматизирующих средств, например перечную мяту, метилсалицилат, цитрусовую отдушку и тому подобное; окрашивающих веществ; консервантов; буферов и других наполнителей, зависящих от пути введения и используемой стандартной формы лекарственного средства. Как будет очевидно специалисту в данной области, фармацевтические композиции по настоящему изобретению могут быть введены вместе с другими терапевтическими и/или профилактическими средствами и/или лекарственными препаратами, которые не являются с ними терапевтически несовместимыми. Все компоненты настоящих композиций должны быть фармацевтически приемлемыми. Термин"Фармацевтически приемлемый" компонент, используемый в описании, определяет собой компонент,который пригоден для использования людьми и/или другими животными при отсутствии чрезмерных вредных побочных эффектов (таких как токсичность, раздражительность и аллергические реакции), с разумно соразмерным соотношением: приносимая польза/риск. Композиции по настоящему изобретению, как правило, вводят обычными путями, известными в данной области техники, пациентам, которые, кроме прочих, являются млекопитающими, например людьми. Например, композиции могут быть введены пациентам орально, в виде, например, твердой или мягкой желатиновой капсулы, таблетки, каплеты или суспензии; ректально или вагинально, например в виде таблетки, суппозитория или вагинального суппозитория, пасты, мази, лосьона или суспензии; или локально, например в виде пасты, мази, лосьона или суспензии. Настоящее изобретение, кроме того, относится к использованию фармацевтических композиций по изобретению в медицине. 7-Хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамид обладает высоким сродством к периферическим бензодиазепиновым рецепторам. В этом качестве он может быть использован для предотвращения или лечения периферических невропатий различных типов, таких как невропатии, вызванные травмой, или ишемические невропатии, инфекционные невропатии, невропатии, связанные с потреблением алкоголя или с потреблением лекарственных средств, или наследственные невропатии, а также состояний мотонейронов, таких как спинальные амиотрофии и боковой амиотрофический склероз. 7-Хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамид также можно использовать для предотвращения или лечения нейродегенеративных заболеваний центральной нервной системы, как острого типа, таких как цереброваскулярные расстройства и черепные и мозговые травмы, так и хронического типа, таких как аутоимунные заболевания (рассеянный склероз), болезнь Альцгеймера, болезнь Паркинсона, а также любое другое заболевание, при котором ожидают терапевтического эффекта при введении нейротрофических факторов. 7-Хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамид также может быть использован для предотвращения или лечения острой или хронической почечной недостаточности, гломерулонефрита, диабетической нефропатии, сердечной ишемии и сердечной недостаточности, инфаркта миокарда, ишемии нижних конечностей, коронароспазма, стенокардии, патологических состояний, связанных с сердечными клапанами, воспалительных сердечных заболеваний, побочных эффектов, вызываемых кардиотоксическими лекарственными препаратами или последствиями сердечной хирургии, артеросклероза и его тромбоэмболических осложнений, рестеноза, отторжения трансплантанта, состояний, связанных с неправильной пролиферацией или миграцией гладких миоцитов. 7-Хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамид обнаруживает фармакологическую активность, модулируя иммунный ответ при экспериментальном ревматоидном артрите у животных, и поэтому также является применимым для предотвращения или лечения ревматоидного артрита. Литературные данные показывают, что периферический бензодиазепиновый рецептор мог бы играть фундаментальную роль при регулировании клеточной пролиферации и процессов канцерогенеза. В общем и по сравнению с нормальными тканями для разных типов рака и опухолей наблюдают повышенную плотность периферических бензодиазепиновых рецепторов. Поэтому 7-хлор-N,N,5-триметил-4 оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамид также может быть использован для предотвращения или лечения опухолей и разных видов рака. Периферические бензодиазепиновые рецепторы также находятся в коже. Вследствие этого 7-хлорN,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамид может быть использован для профилактики или лечения стрессовых состояний в области кожи. Выражение "стрессовое состояние в области кожи" понимают как означающее различные ситуации, которые могли бы вызвать повреждения, в частности, в эпидермисе независимо от вызывающего этот стресс агента. Этот агент, как,например, химический или свободно-радикальный агент, может находиться внутри организма или вне его или же это такой внешний агент, как ультрафиолетовое излучение. Поэтому, настоящее изобретение относится к способу лечения и/или предотвращения заболеваний, связанных с нарушением функций периферических бензодиазепиновых рецепторов. Способ включает введение пациенту, нуждающемуся в-4 014164 таком лечении или в предотвращении заболевания, терапевтически эффективного количества кристаллической формы II по изобретению или терапевтически эффективного количества фармацевтической композиции по настоящему изобретению. В одном варианте осуществления настоящее изобретение относится к способу лечения или предотвращения нейродегенеративного заболевания, который включает введение пациенту, нуждающемуся в таком лечении или в предотвращении заболевания, терапевтически эффективного количества кристаллической формы II по изобретению или терапевтически эффективного количества фармацевтической композиции по настоящему изобретению. Еще один вариант осуществления настоящего изобретения представляет собой способ лечение или предотвращения невропатии, который включает введение пациенту, нуждающемуся в таком лечении или в предотвращении заболевания, терапевтически эффективного количества кристаллической формы II по изобретению или терапевтически эффективного количества фармацевтической композиции по настоящему изобретению. В еще одном варианте осуществления настоящее изобретение относится к способу лечения или предотвращения рака или опухолей, который включает введение пациенту, нуждающемуся в таком лечении или в предотвращении заболевания, терапевтически эффективного количества кристаллической формы II по изобретению или терапевтически эффективного количества фармацевтической композиции по настоящему изобретению. Еще один вариант осуществления изобретения представляет собой способ лечения или предотвращения кожных стрессов, который включает введение пациенту, нуждающемуся в таком лечении или в предотвращении заболевания, терапевтически эффективного количества кристаллической формы II по изобретению или терапевтически эффективного количества фармацевтической композиции по настоящему изобретению. Предпочтительный вариант осуществления изобретения представляет собой способ лечения или предотвращения ревматоидного артрита, который включает введение пациенту, нуждающемуся в таком лечении или в предотвращении заболевания, терапевтически эффективного количества кристаллической формы II по изобретению или терапевтически эффективного количества фармацевтической композиции по настоящему изобретению. Еще один предпочтительный вариант осуществления изобретения представляет собой способ лечения или предотвращения сердечного заболевания или нарушения сердечной деятельности, который включает введение пациенту, нуждающемуся в таком лечении или в предотвращении заболевания, терапевтически эффективного количества кристаллической формы II по изобретению или терапевтически эффективного количества фармацевтической композиции по настоящему изобретению. Предметом настоящего изобретения является использование кристаллической формы II по изобретению при получении лечебных продуктов для лечения заболеваний, зависящих от периферических бензодиазепиновых рецепторов, таких как нейродегенеративные заболевания, невропатии, рак или опухоли,стрессовые состояния в области кожи, ревматоидный артрит или сердечные заболевания или нарушения сердечной деятельности. Далее изобретение будет проиллюстрировано на нижеследующих примерах без ограничения, однако, объема изобретения. Исходное вещество 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Нпиридазино[4,5-b]индол-1-ацетамида, применимое в описанных методиках, включает в себя, кроме прочих, 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамид, получаемый по методикам, описанным в патенте США 6395729. Согласно процедурам, описанным в описании, в качестве исходного материала для получения формы II может быть использована любая форма 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида. В некоторых примерах, таких как используемые для промышленного синтеза, может оказаться полезным вносить в процессе получения кристалл-затравку формы II. Пример 1. Получение кристаллической формы I. 7-Хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамид (230 г) растворяли в N-метил-2-пирролидоне (920 мл) при 110 С. К раствору добавляли теплый этанол (2,5 л,65 С) и твердое вещество отделяли путем фильтрования при 15 С и промывали этанолом. Инфракрасные спектры кристаллической формы I, получаемой, по существу, по этой методике, показаны на фиг. 2. Рентгеновская порошковая дифрактограмма показана на фиг. 6. Пример 2. Получение кристаллической формы II. Способ А. 7-Хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамид растворяли в метаноле при концентрации 4 мг/мл при приблизительно 54 С. Раствор фильтровали горячим и растворитель удаляли выпариванием в токе азота, таким образом отделяя твердое вещество. Микроскопия горячей фазы показала феномен плавления/превращения при температуре, составляющей приблизительно 210 С. На фиг. 1 (способ А) представлен ИК-спектр образца, по существу, полученного по этой методике.-5 014164 Пример 3. Получение кристаллической формы II. Способ В. 7-Хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамид (1 г) растворяли при комнатной температуре в 20 мл дихлорметана (DCM). При комнатной температуре этот раствор добавляли к этанолу (70 мл). Газообразный азот использовали для концентрирования раствора с образованием осадка, уменьшая объем ориентировочно на 25%. Осадок отделяли фильтрованием в течение приблизительно 15-30 мин. На фиг. 1 (способ В) представлен ИК-спектр образца, по существу, полученного по этой методике. На фиг. 4 представлена XRPD (порошковая рентгенограмма) образца, по существу, полученного по этой методике. Пример 4. Получение кристаллической формы II. Способ С. 7-Хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамид (2,4 г) растворяли в дихлорметане (60 мл) при комнатной температуре, используя лопастную мешалку. Этот раствор медленно добавляли к гексанам (400 мл, хроматографическая степень чистоты) при комнатной температуре и перемешивании. Образованный осадок немедленно фильтровали после приблизительно 5 мин. На фиг. 1 (способ С) представлен ИК-спектр образца, по существу, полученного по этой методике. На фиг. 5 представлена порошковая рентгенограмма (XRPD) образца, по существу, получаемого по этой методике. Представленные на фиг. 1 участки ИК-спектров кристаллических продуктов, полученных аналогично описанному в примерах 2-4, являются совмещаемыми, что указывает на то, что эти образцы относятся к одной и той же кристаллической форме. Опыты, описанные ниже, осуществляли на кристаллических продуктах, получаемых, по существу,по методикам, описанным в примерах 1-4. Экспериментальная часть Инфракрасная спектроскопия с Фурье-преобразованием (FTIR) ИК-спектры получали на системе Фурье-спектрометра марки Nicolet 750 Magna. Для анализа лекарственное вещество измельчали вместе с сухим бромидом калия (KBr) при концентрации 1 мг лекарственного вещества/200 мг KBr и при нагрузке в 10000 фунтов (1bs) прессовали диск (200 мг). Как следует из FTIR спектров (см. фиг. 2), форма II 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5 дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида имеет пики около 1656, 1643-1644, 1595, 1522, 1489,1454, 1397, 1325 и 1282 см-1. В частности, пики у 1656 и 1643-1644 см-1 являются характеристическими для формы II. Сравнение ИК-спектров (фиг. 2) кристаллических форм I и II показывает две различные структуры. В частности, амидная область в спектре формы II демонстрирует однозначно определяемые характеристические пики около приблизительно 1643-1644 см-1 и около 1656 см-1, которые отсутствуют в спектре формы I. И дополнительно, полосу формы I приблизительно около 1307 см-1 не наблюдают в спектре любого из образцов формы II, описанных выше. Дифференциальная сканирующая калориметрия (ДСК) Сканы ДСК получали, используя калориметр для дифференциальной сканирующей калориметрии марки Perkin Elmer DSK-7. Перед использованием систему калибровали по индию и олову. Образцы герметизировали в алюминиевых тиглях (затворы с маленьким точечными отверстиями). ДСК термограмму получали при линейной скорости нагревания, составляющей 10 С/мин. ДСК скан для формы I (фиг. 3, верхняя кривая) обнаруживает эндотермический пик приблизительно около 228-235 С, который соответствует точке плавления формы I. ДСК скан для формы II (фиг. 3, нижняя кривая) обнаруживает превращение (кривая экзотермического превращения) в более тугоплавкую кристаллическую форму на интервале температур 200-220 С с последующим эндотермическим плавлением, соответствующем точке плавления формы I. Форма ДСК термограммы в области температур, соответствующей процессу превращения, вероятно, зависит от скорости нагревания, размера частиц и массы образца. Рентгеновская порошковая дифрактометрия (XRPD)XRPD дифрактограммы получали на рентгеновском порошковом дифрактометре марки Bruker D8ADVANCE, используя медное излучение K-альфа. Прибор был оборудован параллельно-лучевой оптикой, а напряжение и силу тока в трубке устанавливали на 40 кВ и 40 мА, соответственно. Исследование образцов осуществляли при скорости сканирования 1,0/мин при изменении угла 2 от 2 до 40. На фиг. 4 и 5 показаны идентичные XRPD дифрактограммы, полученные для разных образцов формы II, а на фиг. 6 приведено сравнение XRPD дифрактограммы формы II и XRPD дифрактограммы формы I. На дифрактограмме формы II обнаруживают оригинальную структуру в сравнении с формой I. На дифрактограмме формы II наблюдают характеристический пик около 5,71 (2), который, однако, отсутствует на дифрактограмме формы I. Отсутствие пика около приблизительно 10,79 (фиг. 7) характеристического пика для формы I показывает, что уровни, значимые для формы I, не обнаружены на дифрактограмме формы II.-6 014164 Специалист в данной области техники поймет, что положения пиков могут незначительно зависеть от высоты образца. Таким образом, описанные здесь положения пиков зависят от изменения угла 2 на плюс или минус (+/-) 0,15. Относительные интенсивности могут меняться в зависимости от размера и морфологии кристалла. В табл. 1 приведены положения характеристических пиков, расстояния d и относительные интенсивности для порошковой рентгеновской дифрактограммы кристаллической формы II. Таблица 1. Положения и относительные интенсивности характеристических пиков на XRPD формы II В частности, пики (выраженные в градусах 2+/-0,15 2) около 11,47; 9,97 и 5,71 являются характеристическими для формы II. В табл. 2 приведены положения характеристических пиков, расстояния d и относительные интенсивности на порошковой рентгеновской дифрактограмме кристаллической формы I. Таблица 2. Положения и относительные интенсивности характеристических пиков на XRPD формы I Тест на растворение Тесты на растворение кристаллической формы I и кристаллической формы II проводили, используя ванну (получаемую от фирмы Distek Inc.) для растворения с перемешиванием лекарственных средств,при скорости вращения мешалки 75 об./мин и спектрофотометр HP 8 4 53 UV, на длине волны 320 нм. Были использованы нижеследующие параметры: концентрация лекарственного вещества составляла 40 мг/л среды; растворяющая среда представляла собой смесь 0,25% лаурилсульфат натрия/0,01M фосфатный буфер (рН 7), температура равнялась 37 С и время отбора проб составляло 10 мин. Стандартные образцы получали, растворяя маточный раствор в метаноле (0,25 мг/мл) с растворяющей средой. Тестирование результатов растворения, приведенное на фиг. 8, показывает, что кристаллическая форма II обладает лучшей растворимостью/растворением в водной смеси 0,25% лаурилсульфат натрия/фосфатный буфер. Тестирование устойчивости Образцы формы II сохраняли при 50 С/75% относительной влажности (открытый стеклянный флакон), чтобы установить, будут ли наблюдаться полиморфные изменения. Образцы анализировали через 2 месяца. Влажность испытательной камеры регулировали с помощью насыщенного водного раствора хлорида натрия. На FTIR спектрах (фиг. 9) образца формы II после нахождения в течение двух месяцев при 50 С/75% относительной влажности (условия напряжения) не наблюдают изменений, указывающих на превращение в форму I. В спектре образца, находящегося в условиях экстремального напряжения, нет доказательств превращения в форму I; характеристическая полоса поглощения формы I около 1307 см-1(показанная на фиг. 2) не появляется. Эти результаты указывают на то, что нет существенного различия между образцами, находящимися в условиях напряжения, и ненапряженными (исходными) образцами. характеризующаяся рентгеновской дифрактограммой, содержащей пик при величине 2, приблизительно составляющем 5,71. 2. Кристаллическая форма по п.1, рентгеновская дифрактограмма которой дополнительно характеризуется пиками при величинах углов 2, составляющих приблизительно 11,47 и 9,97. 3. Кристаллическая форма по п.2, рентгеновская дифрактограмма которой дополнительно характеризуется пиками при величинах углов 2, составляющих приблизительно 19,21; 18,43; 15,95 и 11,97. 4. Кристаллическая форма по п.1, по существу, свободная от любого другого полиморфа. 5. Фармацевтическая композиция, содержащая кристаллическую форму по п.1 и один или несколько фармацевтически приемлемых наполнителей. 6. Фармацевтическая композиция, содержащая кристаллическую форму по п.2 и один или несколько фармацевтически приемлемых наполнителей. 7. Способ лечения или предотвращения заболевания или нарушения, связанного с нарушением функций периферических бензодиазепиновых рецепторов, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества кристаллической формы по п.1. 8. Способ лечения или предотвращения заболевания или нарушения, связанного с нарушением функций периферических бензодиазепиновых рецепторов, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества фармацевтической композиции по п.5. 9. Способ лечения или предотвращения нейродегенеративного заболевания, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества кристаллической формы по п.1. 10. Способ лечения или предотвращения нейродегенеративного заболевания, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества фармацевтической композиции по п.5. 11. Способ лечения или предотвращения невропатии, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества кристаллической формы по п.1. 12. Способ лечения или предотвращения невропатии, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества фармацевтической композиции по п.5. 13. Способ лечения или предотвращения рака или опухолей, который включает введение пациенту,нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества кристаллической формы по п.1. 14. Способ лечения или предотвращения рака или опухолей, который включает введение пациенту,нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества фармацевтической композиции по п.5. 15. Способ лечения или предотвращения кожного стресса, который включает введение пациенту,нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества кристаллической формы по п.1. 16. Способ лечения или предотвращения стрессового состояния в области кожи, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества фармацевтической композиции по п.5. 17. Способ лечения или предотвращения ревматоидного артрита, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества кристаллической формы по п.1. 18. Способ лечения или предотвращения ревматоидного артрита, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества фармацевтической композиции по п.5. 19. Способ лечения или предотвращения сердечного заболевания или нарушения сердечной дея-8 014164 тельности, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества кристаллической формы по п.1. 20. Способ лечения или предотвращения сердечного заболевания или нарушения сердечной деятельности, который включает введение пациенту, нуждающемуся в таком лечении или предотвращении заболевания, терапевтически эффективного количества фармацевтической композиции по п.5. 21. Способ получения кристаллической формы по п.1, включающий стадии смешивания 7-хлорN,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида с метиловым или этиловым спиртом с образованием смеси с концентрацией, составляющей от приблизительно 1 мг/мл до приблизительно 4 мг/мл, нагревания смеси до температуры в интервале от приблизительно 45 до приблизительно 60 С; фильтрования смеси и выпаривания низшего спирта из фильтрата с помощью тока инертного газа с образованием твердого вещества. 22. Способ получения кристаллической формы по п.1, включающий стадии растворения 7-хлорN,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида в дихлорметане с образованием раствора с концентрацией от приблизительно 30 до приблизительно 50 мг/мл; добавления раствора к этанолу, при объемном отношении дихлорметан:этанол от приблизительно 1:3 до приблизительно 1:4; концентрирования раствора, посредством понижения объема с помощью тока инертного газа на приблизительно 10-40%, до кристаллизации твердого вещества и последующего отделения твердого вещества. 23. Способ получения кристаллической формы по п.1, включающий стадии растворения 7-хлорN,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4 Н-пиридазино[4,5-b]индол-1-ацетамида в дихлорметане с образованием раствора с концентрацией от приблизительно 20 до приблизительно 50 мг/мл, добавления раствора к гексану, для того чтобы вызвать осаждение твердого вещества и отделение твердого вещества.
МПК / Метки
МПК: C07D 487/04, A61P 9/04, A61K 31/5025
Метки: новая, индола, пиридазино, форма, 4,5-в, производного, кристаллическая
Код ссылки
<a href="https://eas.patents.su/13-14164-novaya-kristallicheskaya-forma-proizvodnogo-piridazino-45-v-indola.html" rel="bookmark" title="База патентов Евразийского Союза">Новая кристаллическая форма производного пиридазино [4,5-в] индола</a>
Предыдущий патент: Производные хинолина в качестве антибактериальных агентов
Следующий патент: Пневмококковая полисахаридная конъюгатная вакцина
Случайный патент: Устройство и способ оптического воспроизведения изображения особенностей на поверхности руки












