Производные пиримидиниларилмочевины в качестве ингибиторов фактора роста фибробластов (fgf-фактора)
Формула / Реферат
1. Соединение формулы (IA)
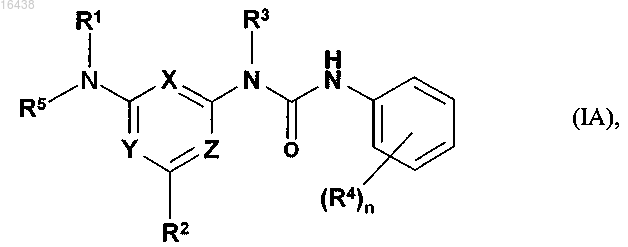
в которой два заместителя из числа X, Y и Z обозначают N (азот), а третий обозначает CH; и
в которой либо R1 обозначает фенил, замещенный гидроксигруппой, фенил-C1-C7-алкилоксигруппой, пиперазин-1-илом или 4-(фенил-C1-C7-алкил)пиперазин-1-илом, или обозначает фенил, замещенный (I) галогеном или C1-C7-алкоксигруппой и дополнительно (II) гидроксигруппой, фенил-C1-C7-алкилоксигруппой, N-моно- либо N,N-ди-(C1-C7-алкил)амино-C1-C7-алкилом, пирролидино-C1-C7-алкоксигруппой, 1-(C1-C7-алкил)пиперидин-4-илом, морфолино-C1-C7-алкоксигруппой, тиоморфолино-C1-C7-алкоксигруппой, пиперазин-1-илом, 4-(фенил-C1-C7-алкил)пиперазин-1-илом, 4-(C1-C7-алкил)пиперазин-1-илом, [4-(C1-C7-алкил)пиперазин-1-ил]-C1-C7-алкилом, N-моно- либо N,N-ди-(C1-C7-алкил)амино-C1-C7-алкоксигруппой, [4-(C1-C7-алкил)пиперазин-1-ил]-C1-C7-алкоксигруппой или [4-(C1-C7-алкил)пиперазин-1-ил]карбонилом;
R2 обозначает водород, C1-C7-алкил, C1-C7-алкоксигруппу или галоген;
R3 обозначает водород, C1-C7-алкил или фенил-C1-C7-алкил;
каждый из R4 независимо от других обозначает C1-C7-алкил, галоген-C1-C7-алкил, галоген или C1-C7-алкоксигруппу;
R5 обозначает водород, C1-C7-алкил или фенил-C1-C7-алкил;
n обозначает 0, 1, 2, 3, 4 или 5;
либо R1 обозначает фенил, замещенный гидроксигруппой, фенил-C1-C7-алкилоксигруппой, пиперазин-1-илом, 4-(фенил-C1-C7-алкил)пиперазин-1-илом, N-моно- либо N,N-ди-(C1-C7-алкил)амино-C1-C7-алкилом, пирролидино-C1-C7-алкоксигруппой, 1-(C1-C7-алкил)пиперидин-4-илом, морфолино-C1-C7-алкоксигруппой, тиоморфолино-C1-C7-алкоксигруппой, 4-(C1-C7-алкил)пиперазин-1-илом, [4-(C1-C7-алкил)пиперазин-1-ил]-C1-C7-алкилом, N-моно- либо N,N-ди-(C1-C7-алкил)амино-C1-C7-алкоксигруппой, [4-(C1-C7-алкил)пиперазин-1-ил]-C1-C7-алкоксигруппой или [4-(C1-C7-алкил)пиперазин-1-ил]карбонилом;
R2 обозначает водород, C1-C7-алкил, C1-C7-алкоксигруппу или галоген;
R3 обозначает водород, C1-C7-алкил или фенил-C1-C7-алкил;
R5 обозначает водород, C1-C7-алкил или фенил-C1-C7-алкил; и
или n обозначает 3, 4 или 5, a R4 выбран из C1-C7-алкила, C1-C7-алкоксигруппы и галогена при условии, что одновременно присутствуют по меньшей мере по одному заместителю из числа C1-C7-алкила, C1-C7-алкоксигруппы и галогена;
или n обозначает 2, и один из заместителей R4 обозначает галоген-C1-C7-алкил, а другой из заместителей R4 обозначает C1-C7-алкоксигруппу;
или n обозначает 3, 4 или 5, a R4 выбран из йода и C1-C7-алкоксигруппы при условии, что одновременно присутствуют по меньшей мере по одному заместителю из числа галогена, йода и C1-C7-алкоксигруппы;
или n обозначает 3, 4 или 5, a R4 выбран из галоген-C1-C7-алкила и C1-C7-алкоксигруппы при условии, что одновременно присутствуют по меньшей мере по одному заместителю из числа галогена, галоген-C1-C7-алкила и C1-C7-алкоксигруппы;
или Y и Z обозначают N (азот) и X обозначает СН;
в которой либо R1 обозначает 3-пиридил, монозамещенный N-C1-C7-алкилпиперазин-1-илом;
R2 обозначает водород;
R3 обозначает водород;
каждый из R4 независимо от других обозначает C1-C7-алкил, галоген-C1-C7-алкил, галоген или C1-C7-алкоксигруппу;
R5 обозначает водород;
n обозначает 1, 2, 3, 4 или 5;
или R1 обозначает 4-(2-морфолин-4-илэтокси)фенил;
R2 обозначает водород;
R3 обозначает водород;
R4 обозначает 2- и 6-хлор и 3- и 5-метоксигруппу;
n обозначает 4;
R5 обозначает водород;
Y и Z обозначают N, а
X обозначает CH;
или R1 обозначает 3-(4-метилпиперазин-1-илметил)фенил;
R2 обозначает водород;
R3 обозначает метил;
R4 обозначает 2- и 6-хлор и 3- и 5-метоксигруппу;
n обозначает 4;
R5 обозначает водород;
Y и Z обозначают N, а
X обозначает CH;
или R1 обозначает 3-(4-этилпиперазин-1-ил)фенил;
R2 обозначает водород;
R3 обозначает метил;
R4 обозначает 2- и 6-хлор и 3- и 5-метоксигруппу;
n обозначает 4;
R5 обозначает водород;
Y и Z обозначают N, а
X обозначает CH;
или R1 обозначает 4-(2-морфолин-4-илэтокси)фенил;
R2 обозначает водород;
R3 обозначает метил;
R4 обозначает 2- и 6-хлор и 3- и 5-метоксигруппу;
n обозначает 4;
R5 обозначает водород;
Y и Z обозначают N, а
X обозначает CH;
или R1 обозначает 4-(1-этилпиперидин-4-ил)фенил;
R2 обозначает водород;
R3 обозначает метил;
R4 обозначает 2- и 6-хлор и 3- и 5-метоксигруппу;
n обозначает 4;
R5 обозначает водород;
Y и Z обозначают N, а
X обозначает CH;
или R1 обозначает 4-(4-этилпиперазин-1-ил)фенил;
R2 обозначает водород;
R3 обозначает этил;
R4 обозначает 2- и 6-хлор и 3- и 5-метоксигруппу;
n обозначает 4;
R5 обозначает водород;
Y и Z обозначают N, а
X обозначает CH;
или R1 обозначает 4-(4-этилпиперазин-1-карбонил)фенил;
R2 обозначает водород;
R3 обозначает метил;
R4 обозначает 2- и 6-хлор и 3- и 5-метоксигруппу;
n обозначает 4;
R5 обозначает водород;
Y и Z обозначают N, а
X обозначает CH;
или его соль.
2. Соединение по п.1 формулы (IA), в которой
два заместителя из числа X, Y и Z обозначают N (азот), а третий обозначает CH; и
в которой либо R1 обозначает фенил, замещенный гидроксигруппой, фенил-C1-C7-алкилоксигруппой, пиперазин-1-илом или 4-(фенил-C1-C7-алкил)пиперазин-1-илом, или обозначает фенил, замещенный (I) галогеном или C1-C7-алкоксигруппой и дополнительно (II) гидроксигруппой, фенил-C1-C7-алкилоксигруппой, N-моно- либо N,N-ди-(C1-C7-алкил)амино-C1-C7-алкилом, пирролидино-C1-C7-алкоксигруппой, 1-(C1-C7-алкил)пиперидин-4-илом, морфолино-C1-C7-алкоксигруппой, тиоморфолино-C1-C7-алкоксигруппой, пиперазин-1-илом, 4-(фенил-C1-C7-алкил)пиперазин-1-илом, 4-(C1-C7-алкил)пиперазин-1-илом, [4-(C1-C7-алкил)пиперазин-1-ил]-C1-C7-алкилом, N-моно- либо N,N-ди-(C1-C7-алкил)амино-C1-C7-алкоксигруппой, [4-(C1-C7-алкил)пиперазин-1-ил]-C1-C7-алкоксигруппой или [4-(C1-C7-алкил)пиперазин-1-ил]карбонилом;
R2 обозначает водород, C1-C7-алкил, C1-C7-алкоксигруппу или галоген;
R3 обозначает водород, C1-C7-алкил или фенил-C1-C7-алкил;
каждый из R4 независимо от других обозначает C1-C7-алкил, гало-C1-C7-алкил, галоген или C1-C7-алкоксигруппу;
R5 обозначает водород, C1-C7-алкил или фенил-C1-C7-алкил;
n обозначает 0, 1, 2, 3, 4 или 5;
либо R1 обозначает фенил, замещенный гидроксигруппой, фенил-C1-C7-алкилоксигруппой, пиперазин-1-илом, 4-(фенил-C1-C7-алкил)пиперазин-1-илом, N-моно- либо N,N-ди-(C1-C7-алкил)амино-C1-C7-алкилом, пирролидино-C1-C7-алкоксигруппой, 1-(C1-C7-алкил)пиперидин-4-илом, морфолино-C1-C7-алкоксигруппой, тиоморфолино-C1-C7-алкоксигруппой, 4-(C1-C7-алкил)пиперазин-1-илом, [4-(C1-C7-алкил)пиперазин-1-ил]-C1-C7-алкилом, N-моно- либо N,N-ди-(C1-C7-алкил)амино-C1-C7-алкоксигруппой, [4-(C1-C7-алкил)пиперазин-1-ил]-C1-C7-алкоксигруппой или [4-(C1-C7-алкил)пиперазин-1-ил]карбонилом;
R2 обозначает водород, C1-C7-алкил, C1-C7-алкоксигруппу или галоген;
R3 обозначает водород, C1-C7-алкил или фенил-C1-C7-алкил;
R5 обозначает водород, C1-C7-алкил или фенил-C1-C7-алкил; и
или n обозначает 3, 4 или 5, и R4 выбран из C1-C7-алкила, C1-C7-алкоксигруппы и галогена при условии, что одновременно присутствуют по меньшей мере по одному заместителю из числа C1-C7-алкила, C1-C7-алкоксигруппы и галогена;
или n обозначает 2, и один из заместителей R4 обозначает галоген-C1-C7-алкил, а другой из заместителей R4 обозначает C1-C7-алкоксигруппу;
или n обозначает 3, 4 или 5, и R4 выбран из йода и C1-C7-алкоксигруппы при условии, что одновременно присутствуют по меньшей мере по одному заместителю из числа йода и C1-C7-алкоксигруппы;
или n обозначает 3, 4 или 5, и R4 выбран из галогена, галоген-C1-C7-алкила и C1-C7-алкоксигруппы при условии, что одновременно присутствуют по меньшей мере по одному заместителю из числа галогена, гало-C1-C7-алкила и C1-C7-алкоксигруппы,
или R1 обозначает 4-(2-морфолин-4-илэтокси)фенил;
R2 обозначает водород;
R3 обозначает водород;
R4 обозначает 2- и 6-хлор и 3- и 5-метоксигруппу;
n обозначает 4;
R5 обозначает водород;
Y и Z обозначают N, а
X обозначает CH;
или R1 обозначает 3-(4-метилпиперазин-1-илметил)фенил;
R2 обозначает водород;
R3 обозначает метил;
R4 обозначает 2- и 6-хлор и 3- и 5-метоксигруппу;
n обозначает 4;
R5 обозначает водород;
Y и Z обозначают N, а
X обозначает CH;
или R1 обозначает 3-(4-этилпиперазин-1-ил)фенил;
R2 обозначает водород;
R3 обозначает метил;
R4 обозначает 2- и 6-хлор и 3- и 5-метоксигруппу;
n обозначает 4;
R5 обозначает водород;
Y и Z обозначают N, а
X обозначает CH;
или R1 обозначает 4-(2-морфолин-4-илэтокси)фенил;
R2 обозначает водород;
R3 обозначает метил;
R4 обозначает 2- и 6-хлор и 3- и 5-метоксигруппу;
n обозначает 4;
R5 обозначает водород;
Y и Z обозначают N, а
X обозначает CH;
или R1 обозначает 4-(1-этилпиперидин-4-ил)фенил;
R2 обозначает водород;
R3 обозначает метил;
R4 обозначает 2- и 6-хлор и 3- и 5-метоксигруппу;
n обозначает 4;
R5 обозначает водород;
Y и Z обозначают N, а
X обозначает CH;
или R1 обозначает 4-(4-этилпиперазин-1-ил)фенил;
R2 обозначает водород;
R3 обозначает этил;
R4 обозначает 2- и 6-хлор и 3- и 5-метоксигруппу;
n обозначает 4;
R5 обозначает водород;
Y и Z обозначают N, а
X обозначает CH;
или R1 обозначает 4-(4-этилпиперазин-1-карбонил)фенил;
R2 обозначает водород;
R3 обозначает метил;
R4 обозначает 2- и 6-хлор и 3- и 5-метоксигруппу;
n обозначает 4;
R5 обозначает водород;
Y и Z обозначают N, а
X обозначает CH;
или его соль.
3. Соединение формулы (IA) по п.1, выбранное из группы, включающей
1-[6-(4-бензилоксифениламино)пиримидин-4-ил]-3-(2,6-дихлор-3,5-диметоксифенил)-1-метилмочевину,
3-(2,6-дихлор-3,5-диметоксифенил)-1-[6-(4-гидроксифениламино)пиримидин-4-ил]-1-метилмочевину,
1-{6-[4-(4-бензилпиперазин-1-ил)фениламино]пиримидин-4-ил}-3-(2,6-дихлор-3,5-диметоксифенил)-1-метилмочевину,
3-(2,6-дихлор-3,5-диметоксифенил)-1-метил-1-[6-(4-пиперазин-1-илфениламино)пиримидин-4-ил]мочевину,
3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[2-фтор-4-(2-пирролидин-1-илэтокси)фениламино]пиримидин-4-ил}-1-метилмочевину,
3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)-2-метоксифениламино]пиримидин-4-ил}-1-метилмочевину,
3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)-3-фторфениламино]пиримидин-4-ил}-1-метилмочевину,
3-(5-метокси-3-трифторметилфенил)-1-{6-[3-хлор-4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил}-1-метилмочевину,
1-{6-[2-хлор-4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил}-3-(2,6-дихлор-3,5-диметоксифенил)-1-метилмочевину и
3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[2-(4-этилпиперазин-1-ил)-2-фторфениламино]пиримидин-4-ил}-1-метилмочевину,
или его соль.
4. Соединение формулы (IA) по п.1, выбранное из группы, включающей
1-(2-хлор-3,5-диметокси-6-метилфенил)-3-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил}мочевину,
3-(2-хлор-3,5-диметокси-6-метилфенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил}-1-метилмочевину,
3-(2-хлор-3,5-диметокси-6-метилфенил)-1-{6-[4-(2-диметиламиноэтокси)фениламино]пиримидин-4-ил}-1-метилмочевину,
3-(2-хлор-3,5-диметокси-6-метилфенил)-1-метил-(6-{4-[2-(4-метилпиперазин-1-ил)этокси]фениламино}пиримидин-4-ил)мочевину,
3-(2-хлор-6-йод-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил}-1-метилмочевину,
3-(2-хлор-3,5-диметокси-6-метилфенил)-1-{6-[4-(4-изопропилпиперазин-1-ил)фениламино]пиримидин-4-ил}-1-метилмочевину,
3-(2-хлор-3,5-диметокси-6-метилфенил)-1-[6-(3-диметиламинометилфениламино)пиримидин-4-ил]-1-метилмочевину,
3-(2-хлор-3,5-диметокси-6-метилфенил)-1-{6-[3-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил}-1-метилмочевину,
3-(2-хлор-3,5-диметокси-6-метилфенил)-1-{6-[4-(2-пирролидин-1-илэтокси)фениламино]пиримидин-4-ил}-1-метилмочевину,
3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[3-фтор-4-(2-пирролидин-1-илэтокси)фениламино]пиримидин-4-ил}-1-метилмочевину,
3-(2,4-дихлор-5-метокси-3-трифторметилфенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил}-1-метилмочевину и
3-(5-метокси-3-трифторметилфенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил}-1-метилмочевину,
или его соль.
5. Соединение формулы (IA) по п.1, выбранное из группы, включающей
1-(2,6-дихлор-3,5-диметоксифенил)-3-{6-[4-(2-морфолин-4-илэтокси)фениламино]пиримидин-4-ил}мочевину,
3-(2,6-дихлор-3,5-диметоксифенил)-1-метил-1-{6-[3-(4-метилпиперазин-1-илметил)фениламино]пиримидин-4-ил}мочевину,
3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[3-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил}-1-метилмочевину,
3-(2,6-дихлор-3,5-диметоксифенил)-1-метил-1-{6-[4-(2-морфолин-4-илэтокси)фениламино]пиримидин-4-ил}мочевину,
3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(1-этилпиперидин-4-ил)фениламино]пиримидин-4-ил}-1-метилмочевину,
3-(2,6-дихлор-3,5-диметоксифенил)-1-этил-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил}мочевину и
3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-карбонил)фениламино]пиримидин-4-ил}-1-метилмочевину,
или его соль.
6. Соединение формулы (IA) по п.1, выбранное из группы, включающей
3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[6-(4-этилпиперазин-1-ил)пиридин-3-иламино]пиримидин-4-ил}-1-метилмочевину и
3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[6-(4-изопропилпиперазин-1-ил)пиридин-3-иламино]пиримидин-4-ил}-1-метилмочевину,
или его соль.
7. Соединение формулы (IA) по п.1, которое представляет собой 3-(2,6-дихлор-3,5-диметоксифенил)-1-метил-1-[6-(4-пиперазин-1-илфениламино)пиримидин-4-ил]мочевину или его соль.
8. Фармацевтический препарат, содержащий соединение формулы (IA) или его фармацевтически приемлемую соль по одному из пп.1-7 и по меньшей мере один фармацевтически приемлемый носитель.
9. Применение соединения формулы (IA) или его фармацевтически приемлемой соли по одному из пп.1-7 в ветеринарии или медицине.
10. Применение соединения формулы (IA) или его фармацевтически приемлемой соли по п.1 для приготовления фармацевтического препарата, предназначенного для лечения заболеваний, зависящих от протеинкиназ.
11. Способ получения соединения формулы (IA) по одному из пп.1-7, заключающийся в том, что анилиновое соединение формулы (IIA)
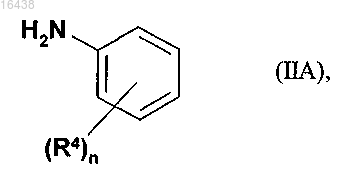
в которой R4 и n имеют указанные для соединения формулы (IA) значения,
подвергают в присутствии содержащего две реакционноспособные группы производного угольной кислоты взаимодействию с амином формулы (IIIA)
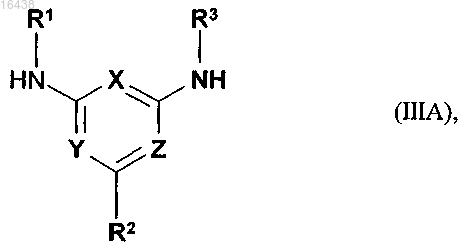
в которой R1, R2, R3, X, Y и Z имеют указанные для соединения формулы (IA) значения, и
затем при необходимости соединение формулы (IA) превращают в другое соединение формулы (IA), соль полученного соединения формулы (IA) переводят в свободное соединение или в другую соль, полученное свободное соединение формулы (IA) переводят в его соль и/или полученную смесь изомеров соединения формулы (IA) разделяют на индивидуальные изомеры.
12. Способ лечения зависящего от тирозинкиназ заболевания, заключающийся во введении в организм нуждающегося в таком лечении человека соединения формулы (IA), его соли по одному из пп.1-7 в эффективном при подобном заболевании количестве.
Текст
ПРОИЗВОДНЫЕ ПИРИМИДИНИЛАРИЛМОЧЕВИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА РОСТА ФИБРОБЛАСТОВ (FGF-ФАКТОРА) В изобретении описаны гетероариларилмочевины формулы (IA) в которой заместители и символы имеют указанные в описании изобретения значения,а также описаны применение таких соединений для лечения зависящих от протеинкиназ заболеваний, фармацевтические препараты, содержащие эти гетероариларилмочевины, способ получения таких новых соединений и способы лечения, заключающиеся в применении подобных гетероариларилмочевин. 016438 Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям, композициям, способам и применению. Изобретение относится, в частности, к новым гетероариларилмочевинам и/или к применению или способам применения соединений, которые можно назвать гетероариларилмочевинами, для лечения заболеваний, зависящих от протеинкиназ, или для приготовления фармацевтических (лекарственных) композиций, пригодных для лечения таких заболеваний. Изобретение относится далее к способам применения таких соединений для лечения указанных заболеваний, к фармацевтическим препаратам, содержащим эти гетероариларилмочевины, и к способам получения таких новых гетероариларилмочевин. Другие объекты настоящего изобретения описаны ниже. Предпосылки создания изобретения Протеинкиназы (РК) представляют собой ферменты, которые катализируют фосфорилирование конкретных остатков серина, треонина или тирозина в клеточных белках. Эти пост-трансляционные модификации белков-субстратов действуют в качестве молекулярного "переключателя", регулирующего клеточную пролиферацию, активацию и/или дифференцировку. Аберрантная или избыточная активность РК обнаружена при многих болезненных состояниях, в том числе при доброкачественных и злокачественных пролиферативных нарушениях. Во многих случаях оказывается возможным осуществлять лечение болезней, например пролиферативных заболеваний, in vitro, а часто in vivo, с использованием ингибиторов РК. Киназы в основном подразделяют на две группы, которые включают киназы, обладающие специфичностью в отношении фосфорилирования серина и треонина, и киназы, обладающие специфичностью в отношении фосфорилирования тирозина. Кроме того, некоторые киназы, которые относят к киназам с так называемой "двойной специфичностью", обладают способностью фофорилировать как остатки тирозина, так и серина/треонина. Протеинкиназы можно характеризовать также по их локализации в клетке. Некоторые киназы представляют собой трансмембранные рецепторные белки, которые обладают способностью связываться с лигандами, находящимися вне клеточной мембраны. Связывание с лигандами изменяет каталитическую активность рецепторных тирозинкиназ. Другие киназы представляют собой нерецепторные белки, у которых отсутствует трансмембранный домен, а еще некоторые киназы представляют собой эктокиназы, у которых каталитический домен находится во внеклеточной (экто) области трансмембранного белка или которые секретируются в виде растворимых внеклеточных белков. Многие киназы участвуют в регуляторных каскадах, где их субстратами могут являться другие киназы, активность которых регулируется их статусом фосфорилирования. Так, активность эффектора,расположенного ниже в пути передачи сигнала, модулируется фосфорилированием, являющимся результатом активации этого пути. Рецепторные протеинтирозинкиназы (RPTK) представляют собой подкласс трансмембранных рецепторов, обладающих присущей им стимулируемой лигандом тирозинкиназной активностью. Активность RPTK строго контролируется. Измененные в результате мутации или имеющие структурные изменения RPTK могут становиться сильными онкогенными белками, которые вызывают клеточную трансформацию или, по меньшей мере, нарушение регуляции. В принципе, все RPTK участвуют в характерном для рака онкогенном нарушении регуляции, что является результатом изменения или расстройства одного или нескольких механизмов самоконтроля, которые гарантируют подавление каталитических доменов, присущее здоровому организму. Более половины известных RPTK в целом ряде случаев обнаружены либо в виде мутантных, либо в виде характеризующихся сверхэкспрессией формах, ассоциированных со злокачественными заболеваниями у человека (включая спорадические случаи; Blume-Jensen и др., Nature 411, 2001, c. 355-365). Сверхэкспрессия RPTK приводит к конститутивной активации киназ в результате повышения концентрации димеров. Примерами являются Neu/ErbB2 и рецептор эпидермального фактора роста (EGFR),которые часто амплифицируются при карциномах молочной железы и легкого, и факторы роста фибробластов (FGFR), ассоциированные со скелетными и пролиферативными нарушениями (Blume-Jensen и др.,2001). Ангиогенез представляет собой механизм, посредством которого формируются новые капилляры из существующих сосудов. При необходимости сосудистая система обладает способностью создавать новые сосудистые сети для поддержания соответствующей функции тканей и органов. Однако у взрослых особей ангиогенез сильно ограничен, он имеет место только в процессе заживления ран и неоваскуляризации эндометрия во время менструации (см. Merenmies и др., Cell GrowthDifferentiation, 8, 1997, c. 310). С другой стороны, нежелательный ангиогенез является отличительным признаком некоторых заболеваний, таких как ретинопатии, псориаз, ревматоидный артрит, связанная с возрастом дегенерация желтого пятна (AMD) и рак (плотные опухоли) (Folkman, Nature Med., 1, 1995, c. 27-31). Протеинкиназы,которые, как установлено, принимают участие в ангиогенном процессе, включают трех представителей семейства рецепторных тирозинкиназ факторов роста: VEGF-R2 (рецептор 2 сосудистого эндотелиального фактора роста 2, который называют также KDR (рецептор со встроенным киназным доменом) иTEK (который называют также Tie-2) представляет собой тирозинкиназный рецептор, экспрессируемый только в эндотелиальных клетках, который, как установлено, играет роль в ангиогенезе. Связывание фактора ангиопоэтина-1 приводит к аутофосфорилированию киназного домена TEK и к процессу трансдукции сигнала, который, вероятно, опосредует взаимодействие эндотелиальных клеток с периэндотелиальными поддерживающими клетками, облегчая тем самым созревание вновь образовавшихся кровеносных сосудов. С другой стороны, фактор ангиопоэтин-2, вероятно, антагонизирует действие ангиопоэтина на TEK и нарушает ангиогенез (Maisonpierre и др., Science, 277, 1977, c. 55-60). Обработка Ad-ExTek, т.е. растворимым экспрессируемым в аденовирусе внеклеточным доменомTie-2, ингибирует метастазы опухоли при введении во время хирургического иссечения первичных опухолей при использовании мышиной модели метастазов опухоли, пригодной в качестве клинической модели (Lin и др., Proc. Natl. Acad. Sci. USA 95, 1998, c. 8829-8834). Ингибирование функции Tie-2 с помощью ExTek может являться результатом секвестрации лиганда, представляющего собой ангиопоэтин,и/или гетеродимеризации с нативным рецептором Tie-2. Это исследование демонстрирует, что нарушение пути передачи сигнала Tie-2, во-первых, может хорошо переноситься здоровыми организмами, а вовторых, может обеспечивать терапевтическое благоприятное воздействие. Хромосома "Philadelphia" является основным отличительным признаком хронического миелолейкоза (CML), и она несет гибридный ген, который содержит N-концевые экзоны гена bcr и основную Cконцевую область (экзоны 2-11) гена c-abl. Генный продукт представляет собой белок с молекулярной массой 210 кДа (p210 Bcr-Abl). Abl-фрагмент белка Bcr-Abl содержит abl-тирозинкиназу, которая строго регулируется в гене c-abl дикого типа, но является конститутивно активируемой в слитом белке Bcr-Abl. Указанная тирозинкиназа с нарушенной регуляцией взаимодействует с целым рядом путей передачи клеточных сигналов, что приводит к трансформации и нарушению регуляции пролиферации клеток (Lugo и др., Science 247, 1990, с. 1079). Обнаружены также мутантные формы белка Bcr-Abl. Опубликован подробный обзор мутантных форм Bcr-Abl (Cowan-Jones и др., Mini Reviews in Medicinal Chemistry, 4, 2004,c. 285-299).EphB4 (который называют также НТК) и его лиганд, ephrinB2 (HTKL), имеют решающее значение для создания и детерминации сосудистой сети. На венозном эпителии происходит специфическая экспрессия EphB4, в то время как на ранних стадиях развития сосудов происходит специфическая и соответствующая экспрессия ephrinB2 на артериальных эндотелиальных клетках. Нарушение функции указанных генов приводит к гибели эмбрионов мышей и у эмбрионов обнаружены идентичные дефекты в формировании капиллярных связей, как в случае дефекта ephrinB2, так и дефекта EphB4. Обе субстанции экспрессируются на первой стадии гематопоэза и развития сосудов в процессе эмбриогенеза. Установлена их важная роль для правильного развития гематопоэза, эндотелия, геангиобласта и примитивной мезодермы. Дефицит EphB4 приводит к изменению результата мезодермальной дифференцировки эмбриональных стволовых клеток. Эктопическая экспрессия EphB4 в ткани молочной железы приводит к нарушенному строению, аномальной функции ткани и предрасположенности к возникновению злокачественного заболевания (см., например, N. Munarini и др., J. Cell. Sci. 115, 2002, c. 25-37). На основе этих и других данных можно предположить, что неадекватная экспрессия EphB4 может принимать участие в развитии злокачественных заболеваний, и поэтому можно ожидать, что ингибирование EphB4 может представлять собой средство борьбы со злокачественными заболеваниями, например раком и т.п.c-Src (также называемая p60 c-Src) представляет собой цитозольную нерецепторную тирозинкиназу.c-Src участвует в трансдукции митогенных сигналов от многочисленных полипептидных факторов роста,таких как эпидермальный фактор роста (EGF) и тромбоцитарный фактор роста (PDGF). Для c-Src характерна сверхэкспрессия при некоторых типах рака молочной железы, рака поджелудочной железы, при нейробластомах и других типах рака. Мутантаная форма c-Src идентифицирована при человеческом раке ободочной кишки. c-Src фосфорилирует целый ряд белков, которые участвуют в регуляции перекрестной информационной связи между внеклеточным матриксом и цитоплазматическим актиновым цитоскелетом. Модуляция активности c-Src может принимать участие в развитии заболеваний, связанных с пролиферацией, дифференцировкой и гибелью клеток (см. Bjorge J.D. и др., Oncogene 19(49), 2000, c. 56205635; Halpern M.S. и др., Proc. Natl. Acad. Sci. USA 93(2), 1996, c. 824-827; Belsches A.P. и др., Frontiers inBioscience [электронная публикация] 2-D501-D518; Zhan X. и др., Chemical Reviews 101, 2001, c. 24772496; Haskell M.D. и др., Chemical Reviews 101, 2001, c. 2425-2440). В настоящее время установлено, что fms-подобная тирозинкиназа 3 (FLT3), рецепторная тирозинкиназа, представляет собой нейромедиатор, имеющий решающее значение в патогенезе миелоидного и некоторых лимфоидных лейкозов. Активация FLT3 на лейкозных клетках с помощью лиганда FLT3 приводит к димеризации рецептора и трансдукции сигнала в путях, усиливающих рост клеток и приводящих к ингибированию апоптоза (Blood, т. 98,3, 2001, c. 885-887). Применению ингибиторов тирозинкиназ для лечения МБЛ препятствует приобретение мутаций в киназном каталитическом домене, и в случае BCR-ABL эти мутации придают устойчивость к иматинибу. Для FLT3 характерна повсеместная экспрессия при МБЛ и в некоторых случаях при остром лимфолейкозе. Активирующие мутации FLT3 обусловливают плохой прогноз для пациентов, страдающих МБЛ. Таким образом, FLT3 является перспективной мишенью для терапевтического вмешательства.PDGFR-рецепторная тирозинкиназа тромбоцитарного фактора роста экспрессируется в целом ряде опухолей, таких как мелкоклеточный рак легкого, рак предстательной железы и глибластома, а также в стромальных и сосудистых компартментах многих опухолей. Экспрессия как PDGF, так и PDGFрецепторов (PDGFR) обнаружена при раке поджелудочной железы (Ebert M. и др., Int J. Cancer, 62, 1995,c. 529-535). Сериновые/треониновые киназы Raf являются основными компонентами модуля пути передачи сигнала Ras/ активируемой митогеном протеинкиназы (MAPK), который контролирует комплекс программ транскрипции в ответ на экзогенные клеточные стимулы. Гены Raf кодируют высококонсервативные серин-треонинспецифические протеининазы, которые, как известно, связываются с онкогеном ras. Они являются частью пути трансдукции сигнала, который, вероятно, состоит из рецепторных тирозинкиназ, p21-ras, протеинкиназ Raf, Mek1- (активатор ERK или MAPKK)-киназ и ERK- (MAPK)-киназ, которые в конце концов фосфорилируют факторы транскрипции. В этом пути киназы Raf активируютсяRas и фосфорилируют и активируют две изоформы киназы митоген-активируемой протеинкиназы (которую обозначают также как Mek1 и Mek2), которые представляют собой треониновые/тирозиновые киназы с двойной специфичностью. Обе изоформы Mek активируют активируемые митогеном киназы 1 и 2(MAPK, которые называют также регулируемыми внеклеточным лигандом киназами 1 и 2 или Erk1 иErk2). MAPK фосфорилируют целый ряд субстратов, включая факторы транскрипции, и в результате принимают участие в их программах транскрипции. Киназа Raf оказывает влияние на Ras/MAPK-путь и регулирует несколько клеточных функций, таких как пролиферация, дифференцировка, выживание, онкогенная трансформация и апоптоз. Как важная роль, так и местоположение Raf в целом ряде путей передачи сигналов продемонстрированы в исследованиях, в которых использовали нарушенную регуляцию и доминантное ингибирование мутантов Raf в клетках млекопитающих, а также в исследованиях, в которых применяли биохимические и генетические технологии для создания модельных организмов. Во многих случаях активация Raf рецепторами, которые симулируют фосфорилирование клеточного тирозина, зависит от активности Ras,что свидетельствует о том, что Ras осуществляет свою функцию выше в пути передачи сигнала по отношению к Raf. После активации Raf-1 фосфорилирует и активирует Mek1, что приводит к распространению сигнала на расположенные по его ходу эффекторы, такие как MAPK (активируемая митогеном протеинкиназа; Crews и др., Cell 74, 1993, с. 215). Сериновые/треониновые киназы Raf считаются первичными эффекторами Ras, которые участвуют в пролиферации клеток животных (Avruch и др., Trends Biochem. Sci. 19, 1994, с. 279). Киназа Raf имеет три различные изоформы Raf-1 (c-Raf), A-Raf и B-Raf, которые отличаются по их способности взаимодействовать с Ras, активировать путь киназы MAPK, их распределению в тканях и субклеточной локализации (Marias и др., Biochem. J. 351, 2000, c. 289-305; Weber и др., Oncogene 19,2000, c. 169-176; Pritchard и др., MoI. Cell. Biol. 75, 1995, c. 6430-6442). В современных исследованиях установлено, что мутация B-Raf в невусе коже является имеющей решающее значение стадией в инициации меланоцитной неоплазии (Pollock и др., Nature Genetics 25,2002, c. 1-2). Кроме того, в наиболее современных исследованиях продемонстрировано, что активирующая мутация в киназном домене B-Raf обнаружена примерно в 66% случаев меланом, 12% случаев карционом ободочной кишки и 14% случаев рака легкого (Davies и др., Nature 417, 2002, c. 949-954; Yuen и др., Cancer Research 62, 2002, c. 6451-6455; Brose и др., Cancer Research 62, 2002, с. 6997-7000). Ингибиторы Raf/MEK/ERK-пути на уровне киназ Raf могут обладать эффективностью в качестве терапевтических агентов, предназначенных для опухолей со сверхэкспрессирующимися или мутантными рецепторными тирозинкиназами, активированными внутриклеточными тирозинкиназами, опухолей с аберрантной экспрессией Grb2 (белок-адаптер, который обеспечивает стимуляцию Ras посредством фактора обмена Sos), а также опухолей, несущих активирующие мутации самой Raf. В проведенных ранее клинических опытах установлено, что ингибиторы киназы Raf-1, которые ингибируют также B-Raf, являются перспективными в качестве терапевтических агентов для лечения рака (Crump, Current Pharmaceutical Design 8, 2002, c. 2243-2248; Sebastien и др., Current Pharmaceutical Design 8, 2002, c. 2249-2253). Как было установлено, нарушение экспрессии Raf в клеточных линиях в результате применения технологии антисмысловой РНК подавляет как Ras-, так и Raf-опосредуемый онкогенез (Kolch и др., Nature 349, 1991, c. 416-428; Monia и др., Nature Medicine 2(6), 1996, c. 668-675). Факторы роста фибробластов. Для нормального роста, а также репарации и ремоделирования тканей требуется специфический и тонкий контроль активирующих факторов роста и их рецепторов. Факторы роста фибробластов (FGF) входят в состав семейства, включающего порядка 20 структурно родственных полипептидов, уровень которых регулируется стадией развития и которые экспрессируются в широком разнообразии тканей.FGF стимулируют пролиферацию, клеточную миграцию и дифференцировку и играют основную роль в развитии скелета и конечностей, заживлении ран, репарации ткани, гематопоэзе, ангиогенезе и онкогенезе (см. обзор у Ornitz, Novartis Found Svmp 232, 2001, c. 63-76; обсуждение на c. 76-80, 272-82). Биологическая активность FGF опосредуется специфическими находящими на клеточной поверхности рецепторами, принадлежащими к RPTK-семейству протеинкиназ. Эти белки состоят из внеклеточ-3 016438 ного лигандсвязывающего домена, одного трансмембранного домена и внутриклеточного тирозинкиназного домена, который фосфорилируется при связывании с FGF. К настоящему времени идентифицировано 4 FGFR: FGFR1 (который обозначают также как Flg, fms-подобный ген, flt-2, bFGFR, N-bFGFR илиCek1), FGFR2 (который обозначают также как Bek (экспрессируемая в бактериях киназа, Bacterial Expressed Kinase), KGFR, Ksam, Ksaml и Cek3), FGFR3 (который обозначают также как Cek2) и FGFR4. Все зрелые FGFR характеризуются общей структурой, включающей аминоконцевой сигнальный пептид, три внеклеточных иммуноглобулинподобных домена (Ig-домен I, Ig-домен II, Ig-домен III), с кислотной областью между Ig-доменами (домен "кислотного бокса"), трансмембанный домен и внеклеточные киназные домены (Ullrich и Schlessinger, Cell 61, 1990, с. 203; Johnson и Williams, Adv. Cancer Res. 60, 1992, c. 1-41). Различные изоформы FGFR имеют различную аффинность к связыванию с различными FGFлигандами, так FGF8 (индуцируемый андрогеном фактор роста) и FGF9 (глиальный активирующий фактор), вероятно, обладают повышенной селективностью в отношении FGFR3 (Chellaiah и др., J. Biol.Chem, 269, 1994, с. 11620). Другой основной класс расположенных на клеточной поверхности сайтов связывания включает сайты связывания гепарансульфатпротеогликанов (HSPG), которые необходимы для высокоаффинного взаимодействия и активации всех представителей семейства FGF. Тканеспецифическая экспрессия структурных вариантов гепарансульфата обусловливает специфичность связи лиганд-рецептор и активность FGF. Связанные с FGFR заболевания. В настоящее время в результате исследований становится известным все возрастающее число связанных со скелетом аномалий, включая ахондроплазию (хондродистрофию), основную форму карликовости человека, которые являются результатом мутаций FGFR. Специфические точковые мутации в различных доменах FGFR1, FGFR2 и FGFR3 ассоциированы с аутосомно-доминантными скелетными человеческими дисплазиями, которые классифицируются как синдромы краниосиностоза и синдромы карликовости (Coumoul и Deng, Birth Defects Research 69, 2003,c. 286-304). Ассоциированные с мутациями FGFR3 скелетные дисплазии включают гипохондриоплазию,серьезную ахондриоплазию с задержкой развития и дерматоз в виде бархатистых бородавчатых разрастаний (акантоз nigricans) (SADDAN) и смертельную дисплазию (TD) (Webster и др., Trends Genetics 13(5), 1997, c. 178-182; Tavormina и др., Am. J. Hum. Genet, 64, 1999, c. 722-731). Мутации FGFR3 характерны также для двух фенотипов краниосиностоза: коронального краниосиностоза Мюнка (Bellus и др., Nature Genetics, 14, 1996, c. 174-176; Muenke и др., Am. J. Hum.Genet., 60,1997, c. 555-564) и синдрома Крузона, сопровождающегося дерматозом в виде бархатистых бородавчатых разрастаний (Meyers и др., Nature Genetics, 11, 1995, c. 462-464). Синдром Крузона ассоциирован со специфическими точковыми мутациями в FGFR2, а семейные и спорадические формы синдрома Пфейффера ассоциированы с мутациями в FGFR1 и FGFR2 (Galvin и др., PNAS USA, 93, 1996, c. 7894-7899;Schell и др., Hum Mol Gen, 4, 1995, c. 323-328). Мутации в FGFR приводят к конститутивной активации мутантных рецепторов и повышению активности рецепторных протеинтирозинкиназ, что приводит к тому, что клетки и ткань теряют способность к дифференцировке. В частности, мутация, приводящая к ахондроплазии, повышает стабильность мутантного рецептора, нарушает взаимосвязь активации рецептора и понижающей регуляции, приводит к ограниченному созреванию хондроцитов и ингибирует рост костной ткани (см. обзор у Vajo и др., Endocrine Reviews,21(1), 2000, c. 23-39). Постоянно возрастает объем сведений о мутациях, активирующих FGFR3, при различных типах рака. Наличие конститутивно активированного FGFR3 при двух обычных типах эпителиального рака, таких как рак мочевого пузыря и шейки матки, а также при множественной миеломе является первым доказательством онкогенной роли FGFR3 при карциномах. Кроме того, согласно самым современным данным обнаружено присутствие активирующих FGFR3 мутаций при многих типах доброкачественных опухолей кожи (Logie и др., Hum Mol Genet, 2005). В настоящее время считается, что FGFR3, вероятно,представляет собой наиболее часто встречающийся мутантный онкоген при раке мочевого пузыря, при этом его мутантные формы встречаются почти в 50% всех случаев рака мочевого пузыря и примерно в 70% случаев поверхностных опухолей мочевого пузыря (Cappellen, и др., Nature Genetics, 23, 1999, c. 1920; van Rhijn, и др., Cancer Research, 61, 2001, сс.1265-1268; Billerey и др., Am. J. Pathol. 18, 2001, c. 19551959, WO 2004/085676). Кроме того, выявлена сверхэкспрессия FGFR3 при раке мочевого пузыря (поверхностном и инвазивном) (Gomez-Roman и др. Clinical Cancer Research, 2005). Установлено, что аберрантная сверхэкспрессия FGFR3 в результате хромосомной транслокацииt(4,14) встречается в 10-25% случаев множественных миелом (Chesi и др., Nature Genetics, 16, 1997,c. 260-264; Richelda и др., Blood, 90, 1997, c. 4061-4070; Sibley и др., BJH, 118, 2002, c. 514-520; Santra и др., Blood, 101, 2003, c. 2374-2476). Активирующие FGFR3 мутации обнаружены в 5-10% случаев множественных миелом с транслокацией t(4,14), и они связаны с развитием опухоли (Chesi и др., Nature Genetics, 16, 1997, c. 260-264; Chesi и др., Blood, 97 (3), 2001, c. 729-736; Intini, и др., BJH, 114, 2001, c. 362364).-4 016438 В этом контексте последствия передачи сигнала FGFR3 являются, по-видимому, часто специфическими в отношении типа клеток. В хондроцитах гиперактивация FGFR3 приводит к ингибированию роста (см. обзор Omitz, 2001), а в клетках миелом она принимает участие в развитии опухолей (Chesi и др.,2001). Установлено, что ингибирование активности FGFR3 является средством лечения опосредуемых Тклетками воспалительных или аутоиммунных заболеваний, например лечения опосредуемых Т-клетками воспалительных или аутоиммунных заболеваний, включая (но не ограничиваясь ими) ревматоидный артрит (RA), артрит, связанный с коллагеном II, рассеянный склероз (MS), системную красную волчанку(SLE), псориаз, юношеский диабет, болезнь Шегрена, заболевание щитовидной железы, саркоидоз, аутоиммунный увеит, воспалительное заболевание кишечника (болезнь Крона и неспецифический язвенный колит), заболевание брюшной полости и тяжелую псевдопаралитическую миастению (см.WO 2004/110487). Нарушения, обусловленные мутациями FGFR3, описаны также в WO 03/023004 и WO 02/102972. Из стимулируемых FGFR3, а также другими FGFR болезней (прежде всего связанных с аномальными уровнями FGF23 в сыворотке), следует упомянуть также аутосомно-доминантные гипофосфатемические рахиты (ADHR), связанные с X-хромосомой гипофосфатемические рахиты (XLH), индуцированную опухолью остеомаляцию (TIO), фиброзную дисплазию костной ткани (FH) (см. также X. Yu и др.,CytokineGrowth Factor Reviews 16, 2005, c. 221-232 и X. Yu и др., Therapeutic Apheresis and Dialysis 9(4), 2005, c. 308-312). Амплификация и/или сверхэкспрессия генов FGFR1, FGFR2 и FGFR4 характерна для рака молочной железы (Penault-Llorca и др., Int J. Cancer, 1995; Theillet и др., Genes Chrom. Cancer, 1993; Adnane и др., Oncogene, 1991; Jaakola и др., Int J. Cancer, 1993; Yamada и др., Neuro Res, 2002). СверхэкспрессияYamaguchi и др., PNAS, 1994; Yamada и др., Neuro Res, 2002). Рак предстательной железы также связан со сверхэкспрессией FGFR1 (Giri и др., Clin Cancer Res, 1999).FGF/FGFR принимают также участие в ангиогенезе. Таким образом, направленное воздействие на систему FGFR также можно рассматривать в качестве антиангиогенной терапии для лечения первичных опухолей, а также метастазов (см., например, Presta и др., CytokineGrowth Factors Reviews 16, 2005,c. 159-178). Описаны также мутации, прежде всего в FGFR3 (например, FGFR3b), ответственные за конститутивную активацию этих рецепторов при плоскоклеточной карциноме ротовой полости (см. Y. Zhang и др., Int. J. Cancer 117, 2005, c. 166-168). Установлено, что повышенный уровень экспрессии (прежде всего в бронхах) FGFR, прежде всегоFGFR1, ассоциирован с хроническим обструктивным заболеванием легких (ХОЗЛ) (см., например, A.Kranenburg и др., J. Pathol. 206, 2005, c. 28-38). Известно, что хромосомные транслокации, затрагивающие локус FGFR1 и приводящие к получению активированных форм FGR-R1, ответственны за связанный с 8p11 миелопролиферативный синдромFGFR4, можно применять для лечения ожирения, диабета и/или связанных с ними заболеваний, таких как метаболический синдром, сердечно-сосудистые заболевания, гипертензия, аберрантные уровни холестерина и триглицеридов, дерматологические нарушения, например инфекции, варикозное расширение вен, дерматоз в виде бархатистых бородавчатых разрастаний, экзема, непереносимость физической нагрузки, диабет типа 2, устойчивость к инсулину, гиперхолестеринемия, желчно-каменная болезнь, ортопедическое повреждение, тромбоэмболическое заболевание, коронарная или сосудистая рестрикция (например, атеросклероз), дневная сонливость, приступы апноэ во сне, последняя стадия болезни почек,заболевание желчного пузыря, подагра, нарушения температуры тела, нарушенный иммунный ответ,нарушенная респираторная функция, инфекции после ранений, бесплодие, заболевание печени, боль в нижней части спины, акушерские и гинекологические осложнения, панкреатит, "удар", осложнение после хирургического вмешательства, недержание мочи при напряжении и/или желудочно-кишечные нарушения (см., например, WO 2005/037235 A2). Установлено, что кислотный фактор роста фибробластов (прежде всего FGF-1) и FGFR1 принимает участие в аберрантной передаче сигналов в ретинобластоме, приводя к пролиферации при связывании сFGF-1 (см., например, S. Siffroi-Fernandez и др., Arch. Ophthalmology 123, 2005, c. 368-376). Доказано, что рост синовиальных сарком ингибируется путем нарушения пути передачи сигнала фактора роста фибробластов (см., например, Т. Ishibe и др., Clin. Cancer Res. 11(7), 2005, c. 2702-2712). Кроме того, можно продемонстрировать роль FGFR в случае саркомы щитовидной железы. Семейство эпидермального фактора роста и связанные с ним заболевания. Рецептор эпидермального фактора роста (EGF-R) и ErbB-2-киназа представляют собой белок тирозинкиназных рецепторов, которые в сочетании с представителями семейства ErbB-3 и ErbB-4 играют-5 016438 основную роль в передаче сигналов в большом количестве клеток млекопитающих, включая, клетки человека, прежде всего эпителиальные клетки, клетки иммунной системы и клетки центральной и периферической нервной системы. Например, в различных типах клеток индуцируемая EGF активация ассоциированной с рецептором протеинтирозинкиназы является предпосылкой клеточного деления и, как следствие, пролиферации клеточной популяции. Наиболее важно, что сверхэкспрессия EGF-R (HER-1) и/илиErbB-2 (HER-2) обнаружена в большом количестве случаев многих опухолей человека. Например, установлено, что сверхэкспрессия EGF-R происходит при различных типах немелкоклеточного рака легкого,плоскоклеточной карциноме (головы и шеи), раке молочной железы, желудка, яичника, ободочной кишки и предстательной железы, а также при глиомах. Установлено, что сверхэкспрессия ErbB-2 может происходить при плоскоклеточной карциономе (головы и шеи), раке молочной железы, желудка и яичника, а также при глиомах. Во всех указанных выше случаях, в которых участвуют протеинкиназы, можно ожидать, что модуляция аберрантной активности (прежде всего ингибирование активности указанной киназы) может оказывать благоприятное воздействие на указанные заболевания. Таким образом, существует пока не удовлетворенная потребность в высокоаффинных и/или селективных молекулах, которые обладают способностью блокировать аберрантную конститутивную активность протеинтирозинкиназ, в частности активность FGFR, тем самым воздействуя на клинические проявления, ассоциированные с вышеуказанными мутациями, и модулируя различные биологические функции. В свете того, что в настоящее время уже известно большое количество ингибиторов протеинкиназ и множество пролиферативных и других связанных с РК заболеваний, существует необходимость в разработке новых классов соединений, которые можно применять в качестве ингибиторов РК и, как следствие,для лечения заболеваний, связанных с этими протеинтирозинкиназами (РТК). Существует потребность в новых классах соединений-ингибиторов РК, имеющих преимущество с позиций фармацевтики. Краткое описание изобретения При создании изобретения было установлено, что предлагаемые в нем соединения, которые более подробно рассмотрены ниже и которые можно отнести к классу гетероариларилмочевин, проявляют способность ингибировать целый ряд протеинтирозинкиназ, прежде всего любую из подобного рода киназ,упомянутых в настоящем описании, главным образом киназу FGFR. В качестве примеров киназ, ингибируемых предлагаемыми в изобретении соединениями, можно назвать, в частности, FGFR1, FGFR2, FGFR3 и FGFR4. Другой киназой, которую способны ингибировать предлагаемые в изобретении соединения, является рецепторная тирозинкиназа VEGF-R, в частности киназа KDR, представляющая собой рецептор VEGF-фактора (VEGF-R2). Предлагаемые в изобретении соединения способны ингибировать одну или более этих и/или других протеинтирозинкиназ и/или способны ингибировать мутанты таких ферментов. С учетом подобной активности предлагаемые в изобретении соединения могут использоваться для лечения заболеваний, связанных прежде всего с аберрантной или избыточной активностью киназ этого типа, главным образом упомянутых выше киназ. Предлагаемые в изобретении соединения могут существовать в различных формах, например в виде свободных кислот, свободных оснований, сложных эфиров и иных пролекарств, солей и таутомеров,при этом все такие различные формы предлагаемых в изобретении соединений включены в объем настоящего изобретения. Объем прав, защищаемых настоящим изобретением, распространяется также на контрафактные или поддельные продукты, которые содержат предлагаемое в изобретении соединение или в которых предполагается его наличие, вне зависимости от того, содержат ли они фактически такое соединение или нет,а также вне зависимости от того, содержится ли в них любое такое соединение в терапевтически эффективном количестве или нет. Таким образом, в объем прав, защищаемых настоящим изобретением, включены упаковки с описанием или инструкциями, содержащими информацию о том, что упаковка содержит предлагаемый в изобретении препарат или предлагаемую в изобретении фармацевтическую композицию, соответственно предлагаемый в изобретении фармацевтический состав и продукт, который представляет собой или содержит либо который предположительно представляет собой или содержит такую композицию, состав или препарат. В настоящем описании и формуле изобретения использование определенных терминов в единственном числе предполагает также возможность их употребления во множественном числе, если из контекста однозначно не следует иное. Различные признаки, характеристики, соединения, химические остатки или группы, упоминаемые при описании конкретного объекта изобретения, варианта осуществления изобретения или иллюстрирующего изобретение примера, применимы к любому иному представленному в настоящем описании объекту изобретения, варианту осуществления изобретения или иллюстрирующему изобретение примеру, за исключением явных несоответствий между ними. В описании настоящего изобретения и в формуле изобретения слова "состоит" и "содержит", а также различные производные от них, например "содержащий", имеют значение "включая, но не ограниваясь" (тем, о чем идет речь), и не подразумевают исключение других остатков, добавок, компонентов или стадий (и не исключают их).-6 016438 Другие объекты и варианты осуществления изобретения рассмотрены в последующем описании и в формуле изобретения. Подробное описание изобретения При создании изобретения было установлено, что предлагаемые в нем новые соединения формулы в которой два заместителя из числа X, Y и Z обозначают N (азот), а третий обозначает CH; и в которой либо R1 обозначает фенил, замещенный гидроксигруппой, фенил-C1-C7 алкилоксигруппой, пиперазин-1-илом или 4-(фенил-C1-C7-алкил)пиперазин-1-илом, или обозначает фенил, замещенный (I) галогеном или C1-C7-алкоксигруппой и дополнительно (II) гидроксигруппой, фенилC1-C7-алкилоксигруппой, N-моно- либо N,N-ди-(C1-C7-алкил)амино-C1-C7-алкилом, пирролидино-C1-C7 алкоксигруппой, 1-(C1-C7-алкил)пиперидин-4-илом, морфолино-C1-C7-алкоксигруппой, тиоморфолиноC1-C7-алкоксигруппой,пиперазин-1-илом,4-(фенил-C1-C7-алкил)пиперазин-1-илом,4-(C1-C7 алкил)пиперазин-1-илом, [4-(C1-C7-алкил)пиперазин-1-ил]-C1-C7-алкилом, N-моно- либо N,N-ди-(C1-C7 алкил)амино-C1-C7-алкоксигруппой, [4-(C1-C7-алкил)пиперазин-1-ил]-C1-C7-алкоксигруппой или [4-(C1C7-алкил)пиперазин-1-ил]карбонилом;R3 обозначает водород, C1-C7-алкил или фенил-C1-C7-алкил; каждый из R4 независимо от других обозначает C1-C7-алкил, галоген-C1-C7-алкил, галоген или C1C7-алкоксигруппу;R5 обозначает водород, C1-C7-алкил или фенил-C1-C7-алкил; или n обозначает 3, 4 или 5, а R4 выбран из C1-C7-алкила, C1-C7-алкоксигруппы и галогена при условии, что одновременно присутствуют по меньшей мере по одному заместителю из числа C1-C7-алкила,C1-C7-алкоксигруппы и галогена; или n обозначает 2, и один из заместителей R4 обозначает галоген-C1-C7-алкил, а другой из заместителей R4 обозначает C1-C7-алкоксигруппу; или n обозначает 3, 4 или 5, a R4 выбран из йода и C1-C7-алкоксигруппы при условии, что одновременно присутствуют по меньшей мере по одному заместителю из числа галогена, йода и C1-C7 алкоксигруппы; или n обозначает 3, 4 или 5, a R4 выбран из галоген-C1-C7-алкила и C1-C7-алкоксигруппы при условии, что одновременно присутствуют по меньшей мере по одному заместителю из числа галогена, галоген-C1-C7-алкила и C1-C7-алкоксигруппы; или Y и Z обозначают N (азот) и X обозначает CH,в которой либо R1 обозначает 3-пиридил, монозамещенный N-C1-C7-алкилпиперазин-1-илом;R3 обозначает водород; каждый из R4 независимо от других обозначает C1-C7-алкил, галоген-C1-C7-алкил, галоген или C1C7-алкоксигруппу;X обозначает CH; или их соли, пригодны для терапии заболеваний, связанных с активностью протеинкиназ, прежде всего заболеваний, для лечения которых могут использоваться соединения-модуляторы протеинтирозинкиназ,главным образом соединения-модуляторы FGFR. В соответствии с этим настоящее изобретение также относится к одному или более таким соединениям формулы (IA) и их солям, а также к указанному выше применению, способам и фармацевтическим композициям. В настоящем изобретении предлагаются, в частности, соединения формулы (IA), в которой два заместителя из числа X, Y и Z обозначают N (азот), а третий обозначает CH; и в которой либо R1 обозначает фенил, замещенный гидроксигруппой, фенил-C1-C7 алкилоксигруппой, пиперазин-1-илом или 4-(фенил-C1-C7-алкил)пиперазин-1-илом, или обозначает фенил, замещенный (I) галогеном или C1-C7-алкоксигруппой и дополнительно (II) гидроксигруппой, фенилC1-C7-алкилоксигруппой, N-моно- либо N,N-ди-(C1-C7-алкил)амино-C1-C7-алкилом, пирролидино-C1-C7 алкоксигруппой, 1-(C1-C7-алкил)пиперидин-4-илом, морфолино-C1-C7-алкоксигруппой, тиоморфолино-8 016438 пиперазин-1-илом,4-(фенил-C1-C7-алкил)пиперазин-1-илом,4-(C1-C7C1-C7-алкоксигруппой,алкил)пиперазин-1-илом, [4-(C1-C7-алкил)пиперазин-1-ил]-C1-C7-алкилом, N-моно- либо N,N-ди-(C1-C7 алкил)амино-C1-C7-алкоксигруппой, [4-(C1-C7-алкил)пиперазин-1-ил]-C1-C7-алкоксигруппой или [4-(C1C7-алкил)пиперазин-1-ил]карбонилом;R3 обозначает водород, C1-C7-алкил или фенил-C1-C7-алкил; каждый из R4 независимо от других обозначает C1-C7-алкил, гало-C1-C7-алкил, галоген или C1-C7 алкоксигруппу;R5 обозначает водород, C1-C7-алкил или фенил-C1-C7-алкил, и или n обозначает 3, 4 или 5, и R4 выбран из C1-C7-алкила, C1-C7-алкоксигруппы и галогена при условии, что одновременно присутствуют по меньшей мере по одному заместителю из числа C1-C7-алкила,C1-C7-алкоксигруппы и галогена; или n обозначает 2, и один из заместителей R4 обозначает галоген-C1-C7-алкил, а другой из заместителей R4 обозначает C1-C7-алкоксигруппу; или n обозначает 3, 4 или 5, и R4 выбран из йода и C1-C7-алкоксигруппы при условии, что одновременно присутствуют по меньшей мере по одному заместителю из числа йода и C1-C7-алкоксигруппы; или n обозначает 3, 4 или 5, и R4 выбран из галогена, галоген-C1-C7-алкила и C1-C7-алкоксигруппы при условии, что одновременно присутствуют по меньшей мере по одному заместителю из числа галогена, гало-C1-C7-алкила и C1-C7-алкоксигруппы,или R1 обозначает 4-(2-морфолин-4-илэтокси)фенил;X обозначает CH; и в каждом случае соли соединения формулы (IA) (значения заместителей и индексов в которой указаны выше и ниже). Предпочтительно соединение формулы (IA) представляет собой соединение, выбранное из группы,включающей 1-[6-(4-бензилоксифениламино)пиримидин-4-ил]-3-(2,6-дихлор-3,5-диметоксифенил)-1 метилмочевину,3-(2,6-дихлор-3,5-диметоксифенил)-1-[6-(4-гидроксифениламино)пиримидин-4-ил]-1 метилмочевину,1-6-[4-(4-бензилпиперазин-1-ил)фениламино]пиримидин-4-ил-3-(2,6-дихлор-3,5 диметоксифенил)-1-метилмочевину,3-(2,6-дихлор-3,5-диметоксифенил)-1-метил-1-[6-(4-пиперазин-1-илфениламино)пиримидин-4 ил]мочевину,3-(2,6-дихлор-3,5-диметоксифенил)-1-6-[2-фтор-4-(2-пирролидин-1-илэтокси)фениламино]пиримидин-4-ил-1-метилмочевину,3-(2,6-дихлор-3,5-диметоксифенил)-1-6-[4-(4-этилпиперазин-1-ил)-2-метоксифениламино]пиримидин-4-ил-1-метилмочевину,3-(2,6-дихлор-3,5-диметоксифенил)-1-6-[4-(4-этилпиперазин-1-ил)-3-фторфениламино]пиримидин 4-ил-1-метилмочевину,3-(5-метокси-3-трифторметилфенил)-1-6-[3-хлор-4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил-1-метилмочевину,1-6-[2-хлор-4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил-3-(2,6-дихлор-3,5 диметоксифенил)-1-метилмочевину и 3-(2,6-дихлор-3,5-диметоксифенил)-1-6-[2-(4-этилпиперазин-1-ил)-2-фторфениламино]пиримидин 4-ил-1-метилмочевину,или его соль. Более предпочтительно соединение формулы (IA) представляет собой соединение, выбранное из группы, включающей 1-(2-хлор-3,5-диметокси-6-метилфенил)-3-6-[4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4 илмочевину,3-(2-хлор-3,5-диметокси-6-метилфенил)-1-6-[4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4 ил-1-метилмочевину,3-(2-хлор-3,5-диметокси-6-метилфенил)-1-6-[4-(2-диметиламиноэтокси)фениламино]пиримидин-4 ил-1-метилмочевину,3-(2-хлор-3,5-диметокси-6-метилфенил)-1-метил-(6-4-[2-(4-метилпиперазин-1 ил)этокси]фениламинопиримидин-4-ил)мочевину,3-(2-хлор-6-йод-3,5-диметоксифенил)-1-6-[4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4 ил-1-метилмочевину,3-(2-хлор-3,5-диметокси-6-метилфенил)-1-6-[4-(4-изопропилпиперазин-1 ил)фениламино]пиримидин-4-ил-1-метилмочевину,- 10016438 3-(2-хлор-3,5-диметокси-6-метилфенил)-1-[6-(3-диметиламинометилфениламино)пиримидин-4-ил]1-метилмочевину,3-(2-хлор-3,5-диметокси-6-метилфенил)-1-6-[3-(4-этилпиперазин-1-ил)фениламино]пиримидин-4 ил-1-метилмочевину,3-(2-хлор-3,5-диметокси-6-метилфенил)-1-6-[4-(2-пирролидин-1-илэтокси)фениламино]пиримидин-4-ил-1-метилмочевину,3-(2,6-дихлор-3,5-диметоксифенил)-1-6-[3-фтор-4-(2-пирролидин-1-илэтокси)фениламино]пиримидин-4-ил-1-метилмочевину,3-(2,4-дихлор-5-метокси-3-трифторметилфенил)-1-6-[4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил-1-метилмочевину и 3-(5-метокси-3-трифторметилфенил)-1-6-[4-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил 1-метилмочевину,или его соль. Еще более предпочтительно соединение формулы (IA) представляет собой соединение, выбранное из группы, включающей 1-(2,6-дихлор-3,5-диметоксифенил)-3-6-[4-(2-морфолин-4-илэтокси)фениламино]пиримидин-4 илмочевину,3-(2,6-дихлор-3,5-диметоксифенил)-1-метил-1-6-[3-(4-метилпиперазин-1 илметил)фениламино]пиримидин-4-илмочевину,3-(2,6-дихлор-3,5-диметоксифенил)-1-6-[3-(4-этилпиперазин-1-ил)фениламино]пиримидин-4-ил 1-метилмочевину,3-(2,6-дихлор-3,5-диметоксифенил)-1-метил-1-6-[4-(2-морфолин-4-илэтокси)фениламино]пиримидин-4-илмочевину,3-(2,6-дихлор-3,5-диметоксифенил)-1-6-[4-(1-этилпиперидин-4-ил)фениламино]пиримидин-4-ил 1-метилмочевину,3-(2,6-дихлор-3,5-диметоксифенил)-1-этил-1-6-[4-(4-этилпиперазин-1-ил)фениламино]пиримидин 4-илмочевину и 3-(2,6-дихлор-3,5-диметоксифенил)-1-6-[4-(4-этилпиперазин-1-карбонил)фениламино]пиримидин 4-ил-1-метилмочевину,или его соль. Наиболее предпочтительно соединение формулы (IA) представляет собой соединение, выбранное из группы, включающей 3-(2,6-дихлор-3,5-диметоксифенил)-1-6-[6-(4-этилпиперазин-1-ил)пиридин-3-иламино]пиримидин 4-ил-1-метилмочевину и 3-(2,6-дихлор-3,5-диметоксифенил)-1-6-[6-(4-изопропилпиперазин-1-ил)пиридин-3 иламино]пиримидин-4-ил-1-метилмочевину,или его соль. И, наконец, предпочтительное соединение формулы (IA) представляет собой 3-(2,6-дихлор-3,5 диметоксифенил)-1-метил-1-[6-(4-пиперазин-1-илфениламино)пиримидин-4-ил]мочевину или его соль. Используемые термины и понятия. В контексте настоящего описания общие термины и понятия, используемые выше и ниже, предпочтительно имеют следующие значения, если не указано иное. Определение "низший" или "(низш.)" либо приставка "C1-C7" означает остаток, содержащий в цепи до 7 атомов углерода включительно, прежде всего до 4 атомов углерода включительно. Алкильные и алифатические остатки содержат, в частности, 1, 2, 3 или 4 атома углерода. Соответствующие остатки могут быть линейными или разветвленными с одной или несколькими боковыми цепями. Под термином "низший алкил" или "C1-C7-алкил" предпочтительно подразумевается линейный или разветвленный алкил, содержащий от 1 до 7 атомов углерода, предпочтительно 1, 2, 3 или 4 атома углерода, например, бутил, такой как н-бутил, втор-бутил, изобутил или трет-бутил, пропил, такой как нпропил или изопропил, этил или метил. Предпочтительным низшим алкилом является метил, этил или изопропил. Под употребляемыми во множественном числе "соединениями", "солями" и т.п. подразумеваются также единственное соединение, единственная соль и т.д. При наличии в R1 фенила в качестве кольца, связывающего R1 с NR в соединении формулы (IA),заместитель гидроксигруппа,фенил-C1-C7-алкилоксигруппа,пиперазин-1-ил,4-(фенил-C1-C7 алкил)пиперазин-1-ил, N-моно- либо N,N-ди-(C1-C7-алкил)амино-C1-C7-алкил, пирролидино-C1-C7 алкоксигруппа, 1-(C1-C7-алкил)пиперидин-4-ил, морфолино-C1-C7-алкоксигруппа, тиоморфолино-C1-C7 алкоксигруппа, 4-(C1-C7-алкил)пиперазин-1-ил, [4-(C1-C7-алкил)пиперазин-1-ил]-C1-C7-алкил, N-монолибо N,N-ди-(C1-C7-алкил)амино-C1-C7-алкил, N-моно- либо N,N-ди-(C1-C7-алкил)амино-C1-C7 алкоксигруппа, [4-(C1-C7-алкил)пиперазин-1-ил]-C1-C7-алкоксигруппа или [4-(C1-C7-алкил)пиперазин-1 ил]карбонил предпочтительно находится в положении 3 или 4 относительно связи с NR3. Любые асимметрические атомы углерода могут находиться в (R)-, (S)- или (R,S)-конфигурации,- 11016438 предпочтительно в (R)- или (S)-конфигурации. Остатки с любой ненасыщенностью находятся в цис-,транс- или (цис, транс)-положении. Предлагаемые в изобретении соединения могут, таким образом, существовать в виде смесей изомеров или в виде чистых изомеров, предпочтительно в виде энантиомерночистых диастереомеров. Изобретение относится также к возможным таутомерам предлагаемых в нем соединений. С учетом тесной взаимосвязи между соединениями формулы (IA) в свободной форме и в форме их солей, включая те соли, которые могут использоваться в качестве промежуточных продуктов, например,при очистке или идентификации предлагаемых в изобретении новых соединений, и таутомерами или смесями таутомеров и их солями при любом упоминании выше и в последующем описании таких соединений под ними подразумеваются также, если это уместно и целесообразно и если не указано иное, соответствующие таутомеры этих соединений или соли любого из них. Таутомеры могут, например, существовать в тех случаях, когда амино- или гидроксигруппа, содержащая по меньшей мере один химически связанный водород, связана с атомами углерода, которые присоединены к смежным атомам двойными связями (например, кето-енольная или имино-анаминная таутомерия). Выражение "соединение, его таутомер или их соль" или аналогичное выражение означает "соединение, его таутомер или соль такого соединения и/или его таутомера". Под галогеном ("гало") подразумевается прежде всего фтор, хлор, бром или йод, в первую очередь(предпочтительно в соединениях формулы I) фтор, хлор или йод. Под "гало-C1-C7-алкилом" подразумевается C1-C7-алкил, один или более атомов водорода которого замещены атомами галогена, например трифторметил. Под[4-(C1-C7 алкил)пиперазин-1-ил]-C(=O)-. Настоящее изобретение относится к соединениям приведенной выше формулы (IA) и их солям. В соответствии с этим в одном из вариантов в изобретении предлагаются продукты, представляющие собой соединения формулы (IA) и/или их соли. Под "солями" подразумеваются прежде всего фармацевтически приемлемые соли соединений формулы (IA) (или любой их приведенной в качестве примера формулы), главным образом при образовании ими солеобразующих групп. Солеобразующие группы представляют собой группы или остатки, обладающие основными или кислотными свойствами. Соединения по меньшей мере с одной основной группой или по меньшей мере одним основным остатком, например азотсодержащей основной группой или азотсодержащим основным остатком, таким как аминогруппа, вторичная аминогруппа, не образующая пептидную связь, или третичная аминогруппа, могут образовывать кислотно-аддитивные соли, например, с неорганическими кислотами, такими как соляная кислота, серная кислота или фосфорная кислота, или с приемлемыми органическими карбоновыми или сульфоновыми кислотами, например с алифатическими моно- либо дикарбоновыми кислотами, такими как трифторуксусная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, гидроксималеиновая кислота, яблочная кислота, винная кислота, лимонная кислота или щавелевая кислота, либо аминокислотами,такими как аргинин или лизин, ароматическими карбоновыми кислотами, такими как бензойная кислота,2-феноксибензойная кислота, 2-ацетоксибензойная кислота, салициловая кислота, 4-аминосалициловая кислота, ароматическими и алифатическими карбоновыми кислотами, такими как миндальная кислота или коричная кислота, гетероароматическими карбоновыми кислотами, такими как никотиновая кислота или изоникотиновая кислота, алифатическими сульфоновыми кислотами, такими как метан-, этан- либо 2-гидроксиэтансульфоновая кислота, или ароматическими сульфоновыми кислотами, такими, например,как бензол-, n-толуол- либо нафталин-2-сульфоновая кислота. При наличии нескольких основных групп возможно также образование кислотно-аддитивных солей с одной или несколькими кислотами. Соединения с кислотной группой, карбоксигруппой или фенольной гидроксигруппой могут образовывать соли с металлами или аммониевые соли, в частности соли с щелочными или щелочноземельными металлами, например натриевые, калиевые, магниевые или кальциевые соли, или аммониевые соли с аммиаком или приемлемыми органическими аминами, такими как третичные моноамины,например триэтиламином либо три-(2-гидроксиэтил)амином, либо гетероциклическими основаниями,например N-этилпиперидином или N,N'-диметилпиперазином. Возможны также смеси солей. Соединения, содержащие одновременно кислотные и основные группы, могут образовывать внутренние соли. Для выделения или очистки соединений, а также в случае соединений, которые используются в последующем синтезе в качестве промежуточных, возможно также применение фармацевтически неприемлемых солей, например пикратов. Однако в терапевтических целях могут использоваться только фармацевтически приемлемые, нетоксичные соли, которые поэтому предпочтительны. С учетом тесной взаимосвязи между предлагаемыми в изобретении новыми соединениями в свободной форме и таковыми в форме их солей, включая те соли, которые могут использоваться в качестве промежуточных продуктов, например, при очистке или идентификации предлагаемых в изобретении- 12016438 новых соединений, при любом упоминании выше и в последующем описании свободных соединений (в том числе соединений формулы (IA), промежуточных соединений и исходных соединений) под ними подразумеваются также, если это уместно и целесообразно, соответствующие соли, гидраты, сольваты и/или кристаллические формы подобных соединений. Соединения формулы (IA) или (любых их приведенных в качестве примера формул) обладают, как это описано выше и ниже, ценными фармакологическими свойствами. Биологические исследования. Эффективность предлагаемых в изобретении соединений в качестве ингибиторов, подавляющих активность рецепторных тирозинкиназ Bcr-Abl, с-KIT, EphB4, EGF-R, VEGF-R2 (KDR), FGF-R, Tie-2 (Tek),Ret, PDGFR, raf, FLT3, c-src и/или FGFR3, можно проиллюстрировать на примере рассмотренных ниже экспериментов. В последующем описании под "ингибиторами", "действующими веществами" или аналогичными выражениями подразумеваются соединения формулы (IA). Анализ активности в отношении Bcr-Abl. Мышиные миелоидные клетки-предшественники линии 32Dcl3, трансфектированные несущимCancer Institue, Бостон, шт. Массачусетс, США). Клетки экспрессируют слитый белок Bcr-Abl, содержащий конститутивно активную киназу abl и не зависящий от фактора роста, стимулирующего пролиферацию. Клетки размножают в среде RPMI 1640 (AMIMED), содержащей 10% фетальной телячьей сыворотки (ФТС), 2 мМ глутамин (фирма Gibco) ("полная среда") и готовят рабочий маточный раствор, замораживая аликвоты по 2106 клеток на пузырек в среде для замораживания (95% ФТС, 5% ДМСО (фирмаSIGMA. После оттаивания клетки подвергают максимум 10-12 пассажам для подготовки к экспериментам. Для осуществления ELISA применяют антитело к SH3-домену Abl, каталожный 06-466 фирмыAb PY20, меченное щелочной фосфатазой (PY10(AP, фирмы ZYMED (каталожный 03-7722). В качестве соединения, с которым проводят сравнение и эталонного соединения (референс-соединения) применяют N-5-[4-(4-метилпиперазинометил)бензоиламидо]-2-метилфенил-4-(3-пиридил)-2-пиримидинамин в форме метансульфоната (мономезилат) (STI571) (поступающий в продажу под названием Gleevec илиGlivec, фирма Novartis). Маточный раствор концентрацией 10 мМ готовят в ДМСО и хранят при -20C. Для проведения клеточных анализов маточный раствор разводят полной средой, используя 2 стадии(1:100 и 1:10), получая исходную концентрацию 10 мМ, после чего осуществляют серийные трехкратные разведения полной средой. При использовании указанной процедуры не возникает никаких проблем с растворимостью. Аналогично подготавливают тестируемые соединения. Для анализа 200000 32D-bcr/ablклеток в 50 мкл высевают на лунку 96-луночных круглодонных планшетов для культуры тканей. К клеткам добавляют в трех повторностях по 50 мкл полученного после серийных трехкратных разведений раствора тестируемого соединения. Конечная концентрация тестируемого соединения составляет, например, от 5 до 0,01 мкМ. Необработанные клетки используют в качестве контроля. Соединение инкубируют с клетками в течение 90 мин при 37C, 5% CO2 с последующим центрифугированием планшетов для культуры тканей при 1300 об/мин (центрифуга типа Beckman GPR) и удаляют супернатанты путем осторожной аспирации, стараясь не удалить какой-либо части клеточного дебриса. Клеточный дебрис лизируют, добавляя 150 мкл буфера для лизиса (50 мМ Трис/HCl, pH 7,4, 150 мМ хлорид натрия, 5 мМ ЭДТК, 1 мМ ЭГТК (этиленгликолевая тетраацетиловая кислота), 1% NP-40 (неионогенный детергент,фирма Roche Diagnostics GmbH, Маннгейм, Германия), 2 мМ орто-ванадат натрия, 1 мМ фенилметилсульфонилфторид (ФМСФ), 50 мкг/мл апротина и 80 мкг/мл леупептина), и либо немедленно используют для осуществления ELISA, либо хранят при -20C до применения. Антителом к SH3-домену Abl из расчета 200 нг в 50 мкл ЗФР на лунку сенсибилизуют черные планшеты для ELISA (черные планшеты типаPackard HTRF-96; 6005207) в течение ночи при 4C. После трехкратной отмывки с использованием 200 мкл/лунку ЗФР, содержащего 0,05% Твин 20 (ЗФРТ) и 0,5% TopBlock (фирма Juro, каталожный номер ТВ 232010), оставшиеся белковые сайты связывания блокируют с использованием 200 мкл/лунку ЗФРТ, 3% TopBlock в течение 4 ч при комнатной температуре с последующей инкубацией с 50 мкл лизатов необработанных или обработанных тестируемым соединением клеток (20 мкг общего белка на лунку) в течение 3-4 ч при 4C. После трехкратной отмывки добавляют по 50 мкл/лунку антитела PY20(AP)(фирма Zymed), разведенного до концентрации 0,5 мкг/мл блокирующим буфером и инкубируют в течение ночи (4C). При осуществлении всех стадий инкубации планшеты накрывают крышками для планшетов (фирма Costar, каталожный номер 3095). И, наконец, планшеты отмывают еще трижды буфером для отмывки и один раз деионизированной водой, после чего добавляют по 90 мкл/лунку субстрата для АР CPDStar RTU с эмералдом (Emerald) II. Планшеты запечатывают крышками для планшетов PackardTop Seal (каталожный 6005185) и инкубируют в течение 45 мин при комнатной температуре в темноте и оценивают люминисценцию, измеряя количество импульсов в секунду (CPS) с помощью сцинтилляционного счетчика для микропланшетов Packard Top Count (фирма Top Count). Для осуществления конечной оптимизированной версии ELISA по 50 мкл лизатов клеток, выращенных, обработанных и лизиро- 13016438 ванных в 96-луночных планшетах для культуры тканей, переносят из этих планшетов непосредственно на планшеты для ELISA, которые предварительно сенсибилизируют 50 нг/лунку кроличьим поликлональным антителом к SH3-домену abl Ab 06-466 фирмы Upstate. Концентрацию антитела к фосфотирозину Ab PY20(AP) можно снижать до 0,2 мкг/мл. Отмывку, блокирование и инкубацию с люминисцентным субстратом осуществляют согласно описанному выше методу. Количественную оценку осуществляют следующим образом: рассчитывают разницу между данными, полученными с помощью ELISA(CPS) с использованием лизатов необработанных 32D-bcr/abl-клеток, и данными анализа фона (все компоненты, но без клеточного лизата), и принимают за 100%, что соответствует конститутивно фосфорилированному белку Bcr-Abl, присутствующему в этих клетках. Активность соединения в отношении активности киназы Bcr-Fbl выражают в виде процента снижения фосфорилирования Bcr-Abl. Значения IC50 определяют из кривых зависимости ответа от дозы путем графической интер- или экстраполяции. Для соединений, предлагаемых в изобретении, значения IC50 предпочтительно составляют от 15 нМ до 500 мМ, наиболее предпочтительно от 15 нМ до 200 мкМ. Для осуществления клеточных анализов соединения растворяют в ДМСО и разводят полной средой, получая исходную концентрацию 10 мкМ, с последующим осуществлением серийных 3-кратных разведений полной средой. 32D- или Ba/F3-клетки, экспрессирующие либо Bcr-Abl дикого типа "wt",либо мутанты Bcr-Abl (например, T-315-I), посеянные из расчета 200000 клеток в 50 мкл полной среды,высевают в лунку 96-луночных круглодонных планшетов для культуры тканей. К клеткам добавляют в трех повторностях по 50 мкл полученного после серийных трехкратных разведений раствора тестируемого соединения. Необработанные клетки используют в качестве контроля. Соединение инкубируют с клетками в течение 90 мин при 37C, 5% CO2 с последующим центрифугированием планшетов для культуры тканей при 1300 об/мин (центрифуга типа Beckman GPR) и удаляют супернатанты путем осторожной аспирации, стараясь не удалить какой-либо части клеточного дебриса. Клеточный дебрис лизируют,добавляя 150 мкл буфера для лизиса (50 мМ Трис/HCl, pH 7,4, 150 мМ хлорид натрия, 5 мМ ЭДТК, 1 мМ ЭГТК, 1% NP-40, 2 мМ орто-ванадат натрия, 1 мМ ФМСФ, 50 мкг/мл апротинина и 80 мкг/мл леупептина), и либо немедленно используют для осуществления ELISA, либо хранят в замороженном состоянии на планшетах при -20C до применения. Кроличьим поликлональным антителом к SH3-домену abl Ab 06-466 фирмы Upstate из расчета 50 нг в 50 мкл ЗФР на лунку сенсибилизуют черные планшеты для ELISA (черные планшеты типа PackardHTRF-96; 6005207) в течение ночи при 4C. После трехкратной отмывки с использованием 200 мкл/лунку ЗФР, содержащего 0,05% Твин 20 (ЗФРТ) и 0,5% TopBlock (фирма Juro) оставшиеся белковые сайты связывания блокируют с использованием 200 мкл/лунку ЗФРТ, 3% TopBlock в течение 4 ч при комнатной температуре с последующей инкубацией с 50 мкл лизатов необработанных или обработанных тестируемым соединением клеток (20 мкг общего белка на лунку) в течение 3-4 ч при 4C. После трех отмывок добавляют по 50 мкл/лунку антитела к фосфотирозину Ab PY20(AP), меченное щелочной фосфатазой (фирма Zymed), разведенное до концентрации 0,2 мкг/мл блокирующим буфером, и инкубируют в течение ночи (4C). При осуществлении всех стадий инкубации планшеты покрывают крышками для планшетов (фирма Costar, каталожный номер 3095). И, наконец, планшеты отмывают еще трижды буфером для отмывки и один раз деионизированной водой, после чего добавляют по 90 мкл/лунку субстрата для АР CPDStar RTU с эмералдом II. Планшеты, которые тотчас же запечатывают крышками для планшетов Packard Top Seal, инкубируют в течение 45 мин при комнатной температуре в темноте и оценивают люминисценцию, измеряя количество импульсов в секунду (CPS) с помощью сцинтилляционного счетчика для микропланшетов Packard Top Count (фирма Top Count). Рассчитывают разницу между данными, полученными с помощью ELISA (CPS) с использованием лизатов необработанных 32D-bcr/abl-клеток, и данными анализа фона (все компоненты, но без клеточного лизата), и принимают за 100%, что соответствует конститутивно фосфорилированному белку Bcr-Abl, присутствующему в этих клетках. Активность соединение в отношении активности киназы Bcr-Abl выражают в виде процента снижения фосфорилирования Bcr-Abl. Значения IC50 (и IC90) определяют из кривых зависимости ответа от дозы путем графической экстраполяции. Соединения, предлагаемые в изобретении, в данном опыте предпочтительно могут иметь значенияIC50 от 50 нМ до 500 мкМ, характеризующие аутофосфорилирование и ингибирование IL-3-зависимой пролиферации мутантов Bcr-Abl в трансфектированных Ba/F3 клетках, в частности в T315I. Клетки линии 32Dcl3 получают из Американской коллекции типовых культур (АТСС CRL11346), а клетки линии Ba/F3 получают из немецкой коллекции микроорганизмов и клеточных культур (DSMZ,Брауншвейг, DSMZ No. ACC 300).Palacios и др., Cell, 41, 1985, с. 727, PubMed ID 3924409. Клетки линии Ba/F3.p210 и мышиные гематопоэтические клетки линии 32Dcl3, (клетки линии 32D р 210) получают путем трансфекции IL-3-зависимой мышиной гематопоэтической линии клеток Ba/F3 вектором pGD, который содержит кДНК p210BCR-ABL (B2A2).Okuda K., Golub T.R., Gilliland D.G., Griffin J.D., "p210BCR-ABL, p190BCR-ABL, and TEL/ABL activate similar signal transduction pathways in hematopoietic cell lines", Oncogene 13, 1996, c. 1147-1152. Анализ активности в отношении с-KIT. Бакуловирусный донорский вектор pFbacG01 фирмы GIBCO используют для создания рекомбинантного бакуловируса, который экспрессирует аминокислотный фрагмент, состоящий из аминокислот 544-976, цитоплазматического киназного домена человеческой c-Kit. Кодирующие последовательности цитоплазматического домена c-Kit амплифицируют с помощью ПЦР на основе библиотеки кДНК человеческой матки (фирма Clontech). Амплифицированный ДНК-фрагмент и вектор pFbacG01 создают в виде, пригодном для лигирования, путем расщепления с помощью BamH1 и EcoRI. Лигирование указанных ДНК-фрагментов позволяет получать бакуловирусную донорскую плазмиду c-Kit. Получение вирусов, экспрессию белков в Sf9-клетках и очистку слитых с GST (глутатион-S-трансфераза) белков осуществляют следующим образом. Получение вируса. Предназначенным для переноса вектором pFbacG01-c-Kit, который содержит домен киназы c-Kit, трансфектируют клетки линии DH10Bac (фирма GIBCO) и трансфектированные клетки высевают на агаровые планшеты для селекции. Колонии, у которых отсутствует вставка слитой последовательности в вирусном геноме (содержащиеся в бактериях), имеют голубой цвет. Отбирают индивидуальную колонию белого цвета и вирусную ДНК (бакмида) выделяют из бактерий путем стандартных процедур очистки плазмид. Затем клетки линии Sf9 или клетки линии Sf21 из Американской коллекции типовых культур трансфектируют вирусной ДНК на матрасах площадью 25 см 2, используя реагент целлфектин (Cellfectin). Определение маломасштабной экспрессии в Sf9-клетках. Содержащие вирус среды собирают из культуры трансфектированных клеток и применяют для заражения для повышения их титра. Содержащие вирус среды после двух циклов заражения применяют для крупномасштабной (полупромышленной) экспрессии белка. Для крупномасштабной экспрессии белка круглые планшеты для культуры тканей площадью 100 см 2 засевают из расчета 5107 клеток/планшет и заражают 1 мл содержащих вирус сред(примерно 5 MOI (множественность заражения. Через 3 дня клетки соскабливают с планшета и центрифугируют при 500 об/мин в течение 5 мин. Клеточный дебрис, полученный из 10-20 планшетов площадью 100 см 2, ресуспендируют в 50 мл охлажденного на льду буфера для лизиса (25 мМ Трис-HCl, pH 7,5, 2 мМ ЭДТК, 1% NP-40, 1 мМ ДТТ, 1 мМ ФМСФ). Клетки перемешивают на льду в течение 15 мин и центрифугируют при 5000 об/мин в течение 20 мин. Очистка меченного с помощью GST белка. Полученные после центрифугирования клеточные лизаты вносят в 2-миллилитровую глутатион-сефарозную колонку (фирма Pharmacia) и промывают трижды 10 мл 25 мМ Трис-HCl, pH 7,5, 2 мМ ЭДТК, 1 мМ ДТТ, 200 мМ NaCl. Меченный с помощью GST белок элюируют путем 10 внесений (каждый раз по 1 мл) раствора, содержащего 25 мМ Трис-HCl, pH 7,5,10 мМ восстановленный глутатион, 100 мМ NaCl, 1 мМ ДТТ, 10% глицерина, и хранят при -70C. Анализ киназной активности. Анализы тирозинпротеинкиназ с использованием очищенной GST-cKit, осуществляют в конечном объеме 30 мкл, содержащем 200-1800 нг белка фермента (в зависимости от удельной активности), 20 мМ Трис-HCl, pH 7,6, 3 мМ MnCl2, 3 мМ MgCl2, 1 мМ ДТТ, 10 мкМ Na3VO4,5 мкг/мл поли(Glu,Tyr) 4:1, 1% ДМСО, 1,0 мкМ АТФ и 0,1 мкКи[33P]-АТФ. Активность анализируют в присутствии ингибиторов или без них, оценивая включение 33P из [33P]-АТФ в субстрат, представляющий собой поли(Glu,Tyr) 4:1. Анализ (30 мкл) осуществляют в 96-луночных планшетах при температуре окружающей среды в течение 20 мин в описанных ниже условиях и прекращают, добавляя 20 мкл 125 мМ ЭДТК. Затем 40 мкл реакционной смеси переносят на мембрану из поливинилиденфторида(ПВДФ) типа Immobilon (фирма Millipore, Бэдфорд, шт. Массачусетс, США), предварительно пропитанную в течение 5 мин метанолом, промывают водой и пропитывают в течение 5 мин 0,5% H3PO4 и устанавливают на вакуумный коллектор с отсоединенным устройством для создания вакуума. После нанесения пятен всех образцов создают вакуум и каждую лунку промывают 200 мкл 0,5% H3PO4. Мембраны удаляют и четырехкратно промывают на шейкере 1,0% H3PO4 и однократно этанолом. Радиоактивность мембран оценивают после их сушки при температуре окружающей среды, помещая в счетчик, имеющий формат, пригодный для 96-луночных планшетов, типа Packard TopCount, и добавляя 10 мкл/лунку Microscint (фирма Packard). Значения IC50 рассчитывают путем линейного регрессионного анализа процента ингибирования для каждого соединения, с использованием взятых с дублированием 4 концентраций (как правило, 0,01, 0,1 и 10 мкМ). Одну единицу киназной активности определяют как 1 нмоль 33PАТФ, перенесенный из [33P]-АТФ на белок-субстрат в мин на мг белка при 37C. Для соединений формулы (IA), предлагаемых в изобретении, значения IC50 могут составлять предпочтительно от 50 нМ до 500 мкМ.- 15016438 Анализ для оценки активности в отношении EphB4. Эффективность соединений формулы (IA) в качестве ингибиторов рецепторных киназ эфрина В 4 (EphB4) можно продемонстрировать следующим образом. Создание на основе системы Bac-to-Bac (фирма Invitrogen Life Technologies, Базель. Швейцария),несущих слитый GST экспрессионных векторов. Полные цитоплазматические кодирующие областиEphB-класса амплифицируют с помощью ПЦР на основе библиотек кДНК человеческой плаценты или головного мозга соответственно. Создают рекомбинантные бакуловирусы, которые экспрессируют аминокислотный фрагмент 566-987 человеческого EphB4-рецептора (база данных SwissProt, регистрационный номер P54760). Последовательность GST клонируют в векторе pFastBac1 (фирма Invitrogen LifeEphB4-рецептора соответственно клонируют в 3'-рамке считывания с последовательностью GST в этом модифицированном векторе FastBac1 с получением донорского вектора pBac-to-Bac. Осуществляют инокуляцию с использованием индивидуальных колоний, образовавшихся в результате трансформации,с получением выращенных в течение ночи культур, которые применяют для маломасштабного создания плазмид. Рестрикционный анализ плазмидной ДНК позволяет выявлять несколько колоний, которые содержат вставки ожидаемого размера. Путем автоматического секвенирования подтверждают правильность вставки и области фланкирующей векторной последовательности длиной примерно 50 пар оснований на обеих цепях. Получение вирусов. Вирусы для каждой из киназ создают согласно протоколу поставщика (фирмаGIBCO), если не указано иное. В целом метод состоит в следующем: векторами для переноса, содержащими киназные домены, трансфектируют линию клеток DH10Bac (фирма GIBCO) и высевают на агаровые планшеты для селекции. Колонии, у которых отсутствует вставка слитой последовательности в вирусном геноме (содержащиеся в бактериях), имеют голубой цвет. Отбирают индивидуальную колонию белого цвета и вирусную ДНК (бакмида) выделяют из бактерий путем стандартных процедур очистки плазмид. Затем клетки линии Sf9 или клетки линии Sf21 трансфектируют вирусной ДНК на матрасах площадью 25 см 2, используя реагент целлфектин согласно протоколу. Очистка меченных с помощью GST киназ. Полученные после центрифугирования клеточные лизаты вносят в 2-миллилитровую глутатион-сефарозную колонку (фирма Pharmacia) и промывают трижды 10 мл 25 мМ Трис-HCl, pH 7,5, 2 мМ ЭДТК, 1 мМ ДТТ, 200 мМ NaCl. Меченные с помощью GST белки элюируют путем 10 внесений (каждый раз по 1 мл) раствора, содержащего 25 мМ Трис-HCl, pH 7,5,10 мМ восстановленный глутатион, 100 мМ NaCl, 1 мМ ДТТ, 10% глицерина, и хранят при -70C. Анализ киназной активности. Киназную активность анализируют в присутствии ингибиторов или без них, оценивая включение 33P из [33P]-АТФ в субстрат, представляющий собой полимер глутаминовой кислоты и тирозина (поли(Glu,Tyr. Анализы киназ с использованием очищенного конъюгата GSTEphB (30 нг) осуществляют в течение 30 мин при температуре окружающей среды в конечном объеме 30 мкл раствора, содержащего 20 мМ Трис-HCl, pH 7,5, 10 мМ MgCl2, 3-50 мМ MnCl2, 0,01 мМ Na3VO4,1% ДМСО, 1 мМ ДТТ, 3 мкг/мл поли(Glu,Tyr) 4:1 (фирма Sigma; Сент-Люис, шт. Миссури, США) и 2,03,0 мкМ АТФ (-[33P]-АТР, 0,1 мкКи). Анализ прекращают, добавляя 20 мкл 125 мМ ЭДТК. Затем 40 мкл реакционной смеси переносят на ПВДФ-мембрану типа Immobilon (фирма Millipore, Бэдфорд, шт. Массачусетс, США), предварительно пропитанную в течение 5 мин метанолом, промывают водой и пропитывают в течение 5 мин 0,5%-ной H3PO4 и устанавливают на вакуумный коллектор с отсоединенным устройством для создания вакуума. После нанесения пятен всех образцов создают вакуум и каждую лунку промывают 200 мкл 0,5%-ной H3PO4. Мембраны удаляют и четырехкратно промывают на шейкере 1,0% H3PO4 и однократно этанолом. Радиоактивность мембран оценивают после их сушки при температуре окружающей среды, помещая в счетчик, имеющий формат, пригодный для 96-луночных планшетов,типа Packard TopCount, и добавляя 10 мкл/лунку Microscint (фирма Packard). Значения IC50 рассчитывают путем линейного регрессионного анализа процента ингибирования для каждого соединения с использованием взятых с дублированием 4 концентраций (как правило, 0,01, 0,1, 1 и 10 мкМ). Одну единицу протеинкиназной активности определяют как 1 нмоль 33P-АТФ, перенесенный из [33P]-АТФ на белоксубстрат в мин на мг белка при 37C. Для соединений формулы (IA), предлагаемых в изобретении, значения IC50 могут составлять предпочтительно от 50 нМ до 500 мкМ. Анализ для оценки активности в отношении EGF-R. Ингибирование тирозинкиназной активностиEGF-R можно продемонстрировать с помощью известных методов, например, с использованием рекомбиантного внутриклеточного домена EGF-рецептора (EGF-R ICD; см., например, у Е. McGlynn и др., Europ. J. Biochem. 207, 1992, c. 65-275). По сравнению с контролем без ингибитора соединения формулы(IA) ингибируют ферментативную активность на 50% (IC50), например, в концентрации от 0,05 до 500 мкМ. Аналогично ингибированию тирозинкиназной активности EGF-R или вместо нее соединения формулы (IA) ингибируют также других представителей этого семейства рецепторов, например ErbB-2. Ингибирующая активность (IC50) составляет от примерно 0,01 до 500 мкМ. Ингибирование тирозинкиназыErbB-2(HER-2) можно определять, например, аналогично методу, описанному для протеинтирозинкина- 16016438 зы EGF-R (см. С. House и др., Europ. J. Biochem. 140, 1984, c. 363-367). Киназу ErbB-2 можно выделять и демонстрировать ее активность с помощью известных протоколов, например, описанных у T. Akiyama и др., Science 232, 1986, с. 1644). Анализ для оценки активности в отношении VEGF-R2 (KDR). Ингибирование индуцируемогоVEGF аутофосфорилирования рецептора можно подтверждать также в экспериментах in vitro в клетках,таких как трансфектированные CHO-клетки, постоянно экспрессирующие человеческий рецептор VEGFR2 (KDR), которые высевают в полную культуральную среду (содержащую 10% фетальной телячьей сыворотки, ФТС) в 6-луночные планшеты для культуры клеток и инкубируют при 37C и 5% CO2 до достижения ими примерно 80%-ной конфлюэнтности. Затем подлежащие тестированию соединения растворяют в культуральной среде (без ФТС, но содержащей 0,1% бычьего сывороточного альбумина) и добавляют к клеткам. (Контроль содержит среду без тестируемых соединений). После инкубации в течение 2 ч при 37C добавляют рекомбинантный VEGF; конечная концентрация VEGF составляет 20 нг/мл. После дополнительной 5-минутной инкубации при 37C клетки промывают дважды охлажденным на льду ЗФР(забуференный фосфтатом физиологический раствор) и немедленно лизируют, добавляя по 100 мкл буфера для лизиса на лунку. Затем лизаты центрифугируют для удаления клеточных ядер и концентрации белков в суператанте определяют с помощью поступающего в продажу набора для анализа белков (фирма BIORAD). После этого лизаты можно использовать либо непосредственно, либо при необходимости хранить при -20C. Для оценки фосфорилирования VEGF-R2 осуществляют сэндвич-ELISA: моноклональное антитело к VEGF-R2 (например, МАт 1495.12.14; полученное от Н. Towbin, фирма Novartis или сопоставимое с ним моноклональное антитело) иммобилизуют на планшетах для ELISA черного цвета (OptiPlateHTRF-96 фирмы Packard). Затем планшеты отмывают и оставшиеся свободные связывающие белок сайты насыщают 3% TopBlock (фирма Juro, каталожныйТВ 232010) в забуференном фосфатом физиологическом растворе, содержащем Tween 20 (полиоксиэтилен(20)сорбитанмонолаурат, фирмаICI/Uniquema) (ЗФРТ). Затем клеточные лизаты (по 20 мкг белка на лунку) инкубируют в этих планшетах в течение ночи при 4C в сочетании с антителом к фосфотирозину, сшитому с щелочной фосфатазой(PY20:AP фирмы Zymed). Затем связывание (на вновь отмытых планшетах) антитела к фосфотирозину с иммобилизованным фосфорилированным рецептором демонстрируют с использованием люминисцентного субстрата для AP (CDP-Star, готовый к применению, содержащий эмерланд II; фирма Applied Biosystems). Люминисценцию оценивают с помощью сцинтилляционного счетчика для микропланшетовPackard Top Count. Разница между сигналом позитивного контроля (стимуляция VEGF) и негативного контроля (без стимуляции VEGF) соответствует индуцируемому VEGF фосфорилированию VEGF-R2(100%). Активность тестируемых субстанций рассчитывают в виде процента ингибирования индуцируемого VEGF фосфорилирования VEGF-R2, где концентрацию субстанции, при которой индуцируется ингибирование, составляющее половину от максимального, определяют как IC50 (ингибирующая доза, при которой ингибирование составляет 50%). При использовании соединений формулы (IA), предлагаемых в изобретении, значения IC50 предпочтительно могут составлять от 20 нм до 500 мкМ. Анализ для оценки активности в отношении рекомбинантных протеинкиназ Ret (Ret-Men2A), Tie-2Ret. Бакуловирусный донорский вектор pFB-GSTX3 применяют для создания рекомбинантного бакуловируса, экспрессирующего аминокислотный фрагмент 658-1072 внутрицитоплазматического киназного домена человеческой киназы Ret-Men2A, который соответствует киназному домену Ret дикого типа. Кодирующую последовательность цитоплазматического домена Ret амплифицируют с помощью ПЦР из плазмиды pBABEpuro RET-Men2A, полученной от д-ра James Fagin, College of Medicine, University ofCincinnati (медицинский колледж Университета Цинциннати) (совместная работа с фирмой Novartis). Амплифицированные ДНК-фрагменты и вектор pFB-GSTX3 создают в виде, пригодном для лигирования, путем расщепления SalI и KpnI. Лигирование указанных ДНК-фрагментов позволяет получать бакуловирусную донорскую плазмиду pFB-GX3-Ret(-Men2A).Tie-2/Tek. Бакуловирусный донорский вектор pFbacG01 применяют для создания рекомбинантного бакуловируса, экспрессирующего аминокислотный фрагмент, состоящий из аминокислот 773-1124 цитоплазматического киназного домена человеческой Tek, слитого на N-конце с GST (получена от д-раMarm, Institute of Molecular Medicine (Институт молекулярной медицины, Фрейбург, Германия на основе научного сотрудничества). Тек повторно клонируют в векторе для переноса pFbacG01 путем расщепления EcoRI и встраивания путем лигирования в растепленный с помощью EcoRI pFbacG01 (FBGTie2/Tek).FGFR-3-K650E. Бакуловирусный донорский вектор pFastBacGST2 применяют для создания рекомбинантного бакуловируса, экспрессирующего аминокислотный фрагмент, состоящий из аминокислот(ак) 411-806 цитоплазматического домена человеческого FGFR-3, слитого на N-конце с GST (получено от д-ра Jim Griffin, Dana Farber Cancer Institute, Бостон, США на основе научного сотрудничества). ДНК,кодирующую аминокислоты 411-806, амплифицируют с помощью ПЦР, встраивают в вектор pFastBac- 17016438GT2, получая pFB-GT2-FGFR3-wt. Эту плазмиду применяют в свою очередь для создания вектора, кодирующего FGFR3(411-806) с мутацией К 650, с помощью набора для сайтнаправленного мутагенезаStratagene XL с получением pFB-GT2-FGFR3-К 650 Е. Получение вирусов, экспрессию белков в Sf9 клетках и очистку слитых с GST белков осуществляют согласно методам, описанным в следующих разделах. Получение вирусов. Векторами для переноса, содержащими киназные домены, трансфектируют линию клеток DH10Bac (фирма GIBCO) и трансфектированные клетки высевают на агаровые планшеты для селекции. Колонии, у которых отсутствует вставка слитой последовательности в вирусном геноме(содержащиеся в бактериях), имеют голубой цвет. Отбирают индивидуальную колонию белого цвета и вирусную ДНК (бакмида) выделяют из бактерий путем стандартных процедур очистки плазмид. Затем клетки линии Sf9 или клетки линии Sf21 трансфектируют вирусной ДНК на матрасах площадью 25 см 2,используя реагент целлфектин. Определение маломасштабной экспрессии в Sf9-клетках. Содержащую вирус среду собирают из культуры трансфектированных клеток и применяют для заражения для повышения их титра. Содержащие вирус среды после двух циклов заражения применяют для крупномасштабной экспрессии белка. Для крупномасштабной экспрессии белка круглые планшеты для культуры тканей площадью 100 см 2 засевают из расчета 5107 клеток/планшет и заражают 1 мл содержащей вирус среды (примерно 5 MOI). Через 3 дня клетки соскабливают с планшета и центрифугируют при 500 об/мин в течение 5 мин. Клеточный дебрис, полученный из 10-20 планшетов площадью 100 см 2, ресуспендируют в 50 мл охлажденного на льду буфера для лизиса (25 мМ Трис-HCl, pH 7,5, 2 мМ ЭДТК, 1% NP-40, 1 мМ ДТТ, 1 мМ ФМСФ). Клетки перемешивают на льду в течение 15 мин и центрифугируют при 5000 об/мин в течение 20 мин. Очистка меченных с помощью GST белков. Полученный после центрифугирования клеточный лизат вносят в 2-миллилитровую глутатион-сефарозную колонку (фирма Pharmacia) и промывают трижды 10 мл 25 мМ Трис-HCl, pH 7,5, 2 мМ ЭДТК, 1 мМ ДТТ, 200 мМ NaCl. Меченные с помощью GST белки элюируют путем 10 внесений (каждый раз по 1 мл) раствора, содержащего 25 мМ Трис-HCl, pH 7,5,10 мМ восстановленный глутатион, 100 мМ NaCl, 1 мМ ДТТ, 10% глицерина и хранят при -70C. Оценка ферментативной активности. Анализы тирозинпротеинкиназ с использованием любых очищенных GST-Ret, GST-Tek или GST-FGFR-3-K650E, осуществляют в конечном объеме 30 мкл, содержащем в случае Ret 15 нг GST-Ret, 20 мМ Трис-HCl, pH 7,5, 1 мМ MnCl2, 10 мМ MgCl2, 1 мМ ДТТ,3 мкг/мл поли(Glu,Tyr) 4:1, 1% ДМСО и 2,0 АТФ (-[33P]-АТФ, 0,1 мкКи). Для анализа Tek используют 150 нг GST-Tek, 20 мМ Трис-HCl, pH 7,5, 3 мМ MnCl2, 3 мМ MgCl2, 1 мМ ДТТ, 0,01 мМ Na3VO4,250 мкг/мл ПЭГ 20000, 10 мкг/мл поли(Glu,Tyr) 4:1, 1% ДМСО и 4,0 мкМ АТФ(-[33P]-АТФ, 0,1 мкКи). Для анализа FGFR-3-K650E используют 10 нг GST-FGFR-3-K650E, 20 мМ Трис-HCl, pH 7,5, 3 мМMnCl2, 3 мМ MgCl2, 1 мМ ДТТ, 0,01 мМ ПЭГ 20000, 10 мкг/мл поли(Glu,Tyr) 4:1, 1% ДМСО и 4,0 мкМ АТФ(-[33P]-АТФ, 0,1 мкКи). Активность анализируют в присутствии ингибиторов или без них, оценивая включение 33P из [33P]-АТФ в поли(Glu,Tyr) 4:1. Анализ осуществляют в 96-луночных планшетах при температуре окружающей среды в течение 30 мин в описанных ниже условиях и прекращают, добавляя 50 мкл 125 мМ ЭДТК. Затем 60 мкл реакционной смеси переносят на ПВДФ-мембрану типа Immobilon(фирма Millipore), предварительно пропитанную в течение 5 мин метанолом, промывают водой и пропитывают в течение 5 мин 0,5%-ной H3PO4 и устанавливают на вакуумный коллектор с отсоединенным устройством для создания вакуума. После нанесения пятен всех образцов создают вакуум и каждую лунку промывают 200 мкл 0,5% H3PO4. Мембраны удаляют и четырехкратно промывают на шейкере 1,0%ной H3PO4 и однократно этанолом. Радиоактивность мембран оценивают после их сушки при температуре окружающей среды, помещая в счетчик, имеющий формат, пригодный для 96-луночных планшетов,типа Packard TopCount, и добавляя 10 мкл/лунку Microscint (фирма Packard). Значения IC50 рассчитывают путем линейного регрессионного анализа процента ингибирования для каждого соединения с использованием взятых с дублированием 4 концентраций (как правило, 0,01, 0,1, 1 и 10 мкМ). Одну единицу киназной активности определяют как 1 нмоль 33P-АТФ, перенесенный из [33P]-АТФ на белоксубстрат в мин на мг белка при 37C. Значения IC50 соединений формулы (IA), предлагаемых в изобретении, могут составлять предпочтительно от 50 нМ до 500 мкМ.FGFR3 (ферментативный анализ). Анализ киназной активности очищенного FGFR3 (фирма Upstate) осуществляют в конечном объеме 10 мкл, содержащем 0,25 мкг/мл фермента в буфере для киназ (30 мМ Трис-HCl pH 7,5, 15 мМ MgCl2,4,5 мМ MnCl2, 15 мкМ Na3VO4 и 50 мкг/мл БСА) и субстраты (5 мкг/мл биотин-поли-EY(Glu, Tyr) (фирма CIS-US, Inc.) и 3 мкМ АТФ). Готовят два раствора: первый раствор, содержащий фермент FGFR3 в буфере для киназ, который сначала вносят по 5 мкл в лунки 384-луночного планшета типа ProxiPlate(фирма Perkin-Elmer) и в который затем добавляют 50 нл соединений, растворенных в ДМСО, после чего в каждую лунку добавляют по 5 мкл второго раствора, который содержит субстрат (поли-EY) и АТФ в буфере для киназ. Реакционные смеси инкубируют при комнатной температуре в течение 1 ч, реакцию прекращают, добавляя 10 мкл идентифицирующей смеси HTRF, которая содержит 30 мМ Трис-HCl pH 7,5, 0,5 М KF, 50 мМ ЭДТК, 0,2 мг/мл БСА, 15 мкг/мл стрептавидина-XL665 (фирма CIS-US, Inc.) и- 18016438 150 нг/мл криптата, конъюгированного с антителом к фосфотирозину (фирма CIS-US, Inc.). После инкубации в течение 1 ч при комнатой температуре для обеспечения взаимодействия стерептавидина-биотина определяют флуоресцентные сигналы с временным разрешением на устройстве типа Analyst GT (фирмаMolecular Devices Corp.). Значения IC50 рассчитывают линейным регрессионным анализом процента ингибирования каждым соединением с использованием 12 концентраций (разведение 1:3 от 50 мкМ до 0,28 нМ). В этом анализе значения IC50 соединений формулы (IA), предлагаемых в изобретении, могут составлять предпочтительно от 2 нМ до 400 мкМ, более предпочтительно от 5 нМ до 100 мкМ.FGFR3 (клеточный анализ). У соединений, предлагаемых в изобретении (формулы (IA, оценивают способность ингибировать пролиферацию клеток, трансформированных Ba/F3-TEL-FGFR3, которая зависит от киназной активности FGFR3 в клетках. Ba/F3-TEL-FGFR3-клетки культивируют вплоть до достижения концентрации 800000 клеток/мл в суспензионной культуре с использованием среды RPMI 1640, дополненной 10% фетальной бычьей сыворотки, в качестве культуральной среды. Клетки вносят в лунки 384-луночных планшетов из расчета 5000 клеток/лунку в 50 мкл культуральной среды. Соединения, предлагаемые в изобретении, растворяют и разбавляют в диметилсульфоксиде (ДМСО). Путем серийных разведений 1:3 в ДМСО получают 12 точек, создавая градиент концентраций, как правило, от 10 мМ до 0,05 мкМ. К клеткам добавляют 50 нл разведенных соединений и инкубируют в течение 48 ч в термостате для культуры клеток. К клеткам добавляют краситель AlamarBlue (фирма TREK Diagnostic Systems), который можно применять для мониторинга восстанавливающих условий окружающий среды, созданных пролиферирующими клетками, в конечной концентрации 10%. После инкубации в течение еще 4 ч при 37C в термостате для культуры клеток, определяют флуоресцентные сигналы восстановленного AlamarBlue(длина волны возбуждения 530 нм, длина волны испускания 580 нм) с помощью устройства типа AnalystGT (фирма Molecular Devices Corp.). Значения IC50 рассчитывают линейным регрессионным анализом процента ингибирования каждым соединением с использованием 12 концентраций. Значения IC50 соединений формулы (IA), предлагаемых в изобретении, могут составлять предпочтительно от 2 нМ до 400 мкМ. Радиоферментативный анализ связывания с фильтром с исподьзованием панели "Upstate KinaseProfiler". Оценивают способность соединений, предлагаемых в изобретении, ингибировать индивидуальных представителей панели киназ (частичный перечень киназ включает (но не ограничиваясь ими): Abl, BCRAbl, BMX, FGFR3, Lck, JNK1, JNK2, CSK, RAF, MKK6 и P38). Согласно указанного общему протоколу соединения оценивают с дублированием в конечной концентрации 10 мкМ. Следует отметить, что состав буфера для киназ и субстратов являются различными для разных киназ, включенных в панель "UpstateKinaseProfiler". Смешивают на льду в пробирке эппендорфа буфер для киназ (2,5 мкл, 10-содержащий при необходимости MnCl2) (50 мМ, 5 мкл), активную киназу (0,001-0,01 ед.; 2,5 мкл), специфический для киназы субстрат или поли(Glu4-Tyr)-пептид (5-500 мкМ или 0,01 мг/мл) в буфере для киназ. Добавляют смесь Mg/АТФ (10 мкл; 67,5 мМ (или 33,75 мМ) MgCl2, 450 мкМ (или 225 мкМ) АТФ и 1 мкКи/мкл[33P]-АТФ (3000 Ки/ммоль) и реакционную смесь инкубируют примерно при 30C в течение примерно 10 мин. Реакционную смесь наносят точками (по 20 мкл) на квадрат размером 2 см 2 см на Р 81 (фосфоцеллюлоза, для положительно заряженных пептидных субстратов) или на бумаге Whatman No. 1 (для пептидного субстрата Poly(Glu4-Tyr. Анализируемые квадраты четырехкратно промывают, каждый раз по 5 мин, 0,75%-ной фосфорной кислотой и однократно промывают ацетоном в течение 5 мин. Анализируемые квадраты переносят в сцинтилляционный флакон, добавляют 5 мл сцинтилляционной смеси и количественно оценивают включение 32 Р (cpm, импульсы в мин) в пептидный субстрат с помощью сцинтилляционного счетчика фирмы Beckman. Для каждой реакции рассчитывают процент ингибирования. Соединения формулы (IA) могут ингибировать также другие тирозинпротеинкиназы, прежде всего такие как киназа c-Src, которая принимает участие в регуляции роста и трансформации в клетках животных, прежде всего в клетках млекопитающих, включая клетки человека. Приемлемый анализ описан уAndrejauskas-Buchdunger и др., Cancer Res. 52, 1992, c. 5353-5358. С использованием указанной тестсистемы установлено, что значения IC50 соединений формулы (IA), характеризующие ингибирование cSrc, составляют, например, от 0,05 до 500 мкМ. Кроме того, соединения формулы (IA) могут ингибировать также B-Raf (V599E). Активность B-RafV599E анализируют в присутствии ингибиторов или без них, оценивая включение 33P из [33P]-АТФ в(His)-IB. Тестируемое соединение растворяют в ДМСО (10 мМ) и хранят при -20C. Свежеприготовленные серийные разведения получают с использованием ДМСО и дополнительно разводят чистой водой для приготовления 3-кратных изучаемых растворов в 3% ДМСО. Применяемый для анализа конечный объем (30 мкл) содержит 10 мкл изучаемого раствора (1% ДМСО), 10 мкл анализируемой смеси(20 мМ Трис-HCl, pH 7,5, 3 мМ MnCl2, 3 мМ MgCl2, 1 нМ ДТТ, 3 мкг/мл (His)-IB, 1% ДМСО и 3,5 мкМ АТФ [33P]-АТФ, 0,1 мкКи) и 10 мкл разведения фермента (600 нг GST-B-Raf-V599E). Программируют стадии пипетирования, которые осуществляют с использованием роботов MultiPROBE Iix, MultiPROBEIILx или HamiltonSTAR в 96-луночном формате. Анализ осуществляют с использованием известного из литературы метода (см. С. Garcia-Echeverria и др., Cancer Cel 5, 2004, c. 231-239), прекращая реакцию путем добавления 20 мкл 125 мМ ЭДТК. Захват (иммобилизацию) фосфорилированных пептидов с использованием метода связывания с фильтром осуществляют следующим образом: 40 мкл реакционной смеси переносят на ПВДФ-мембрану типа Immobilon, предварительно пропитанную в течение 5 мин метанолом, промывают водой и пропитывают в течение 5 мин 0,5%-ной H3PO4 и устанавливают на вакуумный коллектор с отсоединенным устройством для создания вакуума. После нанесения пятен всех образцов создают вакуум и каждую лунку промывают 200 мкл 0,5%-ной H3PO4. Мембраны удаляют и четырехкратно промывают на шейкере 1,0%-ной H3PO4 и однократно этанолом. Радиоактивность мембран оценивают после их сушки при температуре окружающей среды, помещая в счетчик, имеющий формат,пригодный для 96-луночных планшетов, типа Packard TopCount, и добавляя 10 мкл/лунку Microscint. Планшеты в конце концов запечатывают и подсчитывают радиоактивность с помощью сцинтилляционного счетчика для микропланшетов (типа TopCount NXT, TopCount NXT HTS). В случае применения экспресс-анализа с использованием планшетов киназную реакцию сначала осуществляют в пластиковых(на основе полистерола) планшетах и затем через 60 мин прекращают, добавляя 20 мкл 125 мМ ЭДТК. Для захвата (иммобилизации) (60 мин, КТ) биотинилированный субстрат переносят в покрытые никелем планшеты для экспресс-анализа. Анализируемые планшеты отмывают трижды ЗФР и сушат при комнатной температуре. После этого планшеты запечатывают и подсчитывают радиоактивность с помощью сцинтилляционного счетчика для микропланшетов (типа TopCount NXT, TopCount NXT HTS). ЗначенияIC50 рассчитывают с помощью линейного регрессионного анализа процента ингибирования соединением либо с дублированием с использованием четырех концентраций (как правило, 0,01, 0,1, 1 и 10 мкМ), либо на основе 8 индивидуальных точек, предназначенных для определения IC50, начиая с 10 мкМ, с последующим разведением 1:3. Установлено, что значения IC50 соединений формулы (IA), характеризующие ингибирование B-Raf, составляют от 0,05 до 500 мкМ. Рецепторная киназа FLT3. Для поиска соединений, мишенью которых является FLT3, можно применять два различных типа анализов. Киназную активность Flt3 определяют следующим образом. Бакуловирусный донорский векторpFbacG01 (фирма GIBCO) применяют для создания рекомбинатного бакуловируса, экспрессирующего аминокислотный фрагмент, состоящий из аминокислот 563-993 цитоплазматического киназного домена человеческой Flt3. Кодирующую последовательность цитоплазматического домена Flt3 амплифицируют с помощью ПЦР с использованием библиотек человеческих кДНК (фирма Clontech). Амплифицированные ДНК-фрагменты и вектор pFbacG01 создают в виде, пригодном для лигирования, путем расщепления с помощью BamH1 и HindIII. Встраивание путем лигирования указанных ДНК-фрагментов позволяет получать бакуловирусную донорскую плазмиду Flt-3(1.1). Получение вирусов, экспрессию белков вSf9-клетках и очистку слитых с GST-белков осуществляют следующим образом. Получение вируса. Предназначенным для переноса вектором pFbacG01-Flt-3, который содержит домен киназы Flt3, трансфектируют клетки линии DH10Bac (фирма GIBCO) и трансфектированные клетки высевают на агаровые планшеты для селекции. Колонии, у которых отсутствует вставка слитой последовательности в вирусном геноме (содержащиеся в бактериях), имеют голубой цвет. Отбирают индивидуальную колонию белого цвета и вирусную ДНК (бакмида) выделяют из бактерий путем стандартных процедур очистки плазмид. Затем клетки линии Sf9 или клетки линии Sf21 (Американская коллекция типовых культур) трансфектируют вирусной ДНК на матрасах, используя реагент целлфектин. Определение маломасштабной экспрессии в Sf9-клетках. Содержащую вирус среду собирают из культуры трансфектированных клеток и применяют для заражения для повышения их титра. Содержащую вирус среду после двух циклов заражения применяют для крупномасштабной (полупромышленной) экспрессии белка. Для крупномасштабной экспрессии белка круглые планшеты для культуры тканей площадью 100 см 2 засевают из расчета 5107 клеток/планшет и заражают 1 мл содержащей вирус среды(примерно 5 MOI). Через 3 дня клетки соскабливают с планшета и центрифугируют при 500 об/мин в течение 5 мин. Клеточный дебрис, полученный из 10-20 планшетов площадью 100 см 2 каждый, ресуспендируют в 50 мл охлажденного на льду буфера для лизиса (25 мМ Трис-HCl, pH 7,5, 2 мМ ЭДТК, 1%NP-40, 1 мМ ДТТ, 1 мМ ФМСФ). Клетки перемешивают на льду в течение 15 мин и центрифугируют при 5000 об/мин в течение 20 мин. Очистка меченного с помощью GST белка. Полученные после центрифугирования клеточные лизаты вносят в 2-миллилитровую глутатион-сефарозную колонку (фирма Pharmacia) и промывают трижды 10 мл 25 мМ Трис-HCl, pH 7,5, 2 мМ ЭДТК, 1 мМ ДТТ, 200 мМ NaCl. Меченный с помощью GST белок элюируют путем 10 внесений (каждый раз по 1 мл) раствора, содержащего 25 мМ Трис-HCl, pH 7,5,10 мМ восстановленный глутатион, 100 мМ NaCl, 1 мМ ДТТ, 10% глицерина, и хранят при -70C. Оценка ферментативной активности. Анализы тирозинпротеинкиназ с использованием очищеннойGST-Flt2, осуществляют в конечном объеме 30 мкл, содержащем 200-1800 нг белка фермента (в зависимости от удельной активности), 20 мМ Трис-HCl, pH 7,6, 3 мМ MnCl2, 3 мМ MgCl2, 1 мМ ДТТ, 10 мкМNa3VO4, 3 мкг/мл поли(Glu,Tyr) 4:1, 1% ДМСО, 6,0 мкМ АТФ и 0,1 мкКи[33P]-АТФ. Активность анализируют в присутствии ингибиторов или без них, оценивая включение 33P из [33P]-АТФ в субстрат, представляющий собой поли(Glu,Tyr) 4:1. Анализ (30 мкл на лунку) осуществляют в 96-луночных планшетах при температуре окружающей среды в течение 20 мин в описанных ниже условиях и прекращают, добавляя 20 мкл 125 мМ ЭДТК. Затем 40 мкл реакционной смеси переносят на ПВДФ-мембрану типа Immobilon (фирма Millipore, Бэдфорд, шт. Массачусетс, США), предварительно пропитанную в течение 5 мин метанолом, промывают водой и пропитывают в течение 5 мин 0,5%-ной H3PO4 и устанавливают на вакуумный коллектор с отсоединенным устройством для создания вакуума. После нанесения пятен всех образцов создают вакуум и каждую лунку промывают 200 мкл 0,5%-ной H3PO4. Мембраны удаляют и четырехкратно промывают на шейкере 1,0%-ной H3PO4 и однократно этанолом. Радиоактивность мембран оценивают после их сушки при температуре окружающей среды, помещая в счетчик, имеющий формат, пригодный для 96-луночных планшетов, типа Packard TopCount, и добавляя 10 мкл/лунку Microscint (фирма Packard). Значения IC50 рассчитывают путем линейного регрессионного анализа процента ингибирования для каждого соединения, с использованием взятых с дублированием 4 концентраций (как правило, 0,01, 0,1, 1 и 10 мкМ). Одну единицу киназной активности определяют как 1 нмоль РАТФ, перенесенный из [33P]-АТФ на белок-субстрат в мин на мг белка при 37C. Для соединений формулы (IA), предлагаемых в изобретении, значения IC50 могут составлять предпочтительно от 0,05 до 500 мкМ. В другом или дополнительном варианте для идентификации ингибиторов мутантных рецепторов тирозинкиназы FLT3 можно применять анализ, основанный на использовании клеток. Общий метод заключается в сравнении воздействий предполагаемых ингибиторов на клеточные линии, пролиферация которых зависит от мутанта FLT3, относительно клеточных линий, пролиферация которых не зависит от мутанта FLT3. Применяют следующие линии клеток, которые экспрессируют две различные формы мутантной активированной FLT3: клетки линии Ba/F3-FLT3-ITD, экспрессирующие мутант FLT3 с "внутренней тандемной дубликацией" (Internal Tandem Duplication (ITD в расположенном рядом с мембраной домене рецептора; клетки линии Ba/F3-FLT3-D835Y, экспрессирующие FLT3-рецептор, который содержит мутацию,приводящую к замене аспарагина в положении 835 на тирозин. Установлено, что предпочтительные соединения формулы (IA) могут ингибировать пролиферацию как клеток линии Ba/F3-FLT3-ITD, так и Ba/F3-D835Y, что характеризуется значениями IC50 от 50 нМ до 500 мкМ, но с другой стороны, они, как правило, не ингибируют рост нетрансформированных Ba/F3 клеток при концентрациях вплоть до 500 нМ, и ростингибирующее действие соединения формулы (IA) в отношении клеток линии Ba/F3-FLT3-ITD можно делать обратимым, добавляя высокие концентрации IL3 для получения альтернативного сигнала, влияющего на жизнеспособность. Установлено, что в концентрациях, которые требуются для ингибирования линий клеток, пролиферация которых зависит от FLT3,соединения формулы (IA) не обладают цитотоксичностью в отношении некоторых линий клеток человеческого лейкоза и лимфомы, которые не содержат мутантных FLT3-рецепторов (обладающие гиперактивностью киназы), что позволяет предположить, что лекарственное средство обладает неожиданного высоким уровнем специфичности в качестве цитотоксического агента. В целом, полученные результаты свидетельствуют о том, что соединения формулы (IA) могут представлять собой эффективные ингибиторы тирозинкиназной активности мутантных FLT3-рецепторов и являются перспективными кандидатами для применения при лечения пациентов, которые имеют мутантные FLT3-рецепторы. В частности, соединения формулы (IA) могут ингибировать тирозинкиназную активность FLT3-рецептора в концентрациях от 0,05 до 500 мкМ. На основе описанных выше опытов по оценке ингибирующего действия установлено, что соединение формулы (IA) (или любое из приведенной в качестве примера формулы), предлагаемое в изобретении, обладает терапевтической эффективностью, прежде всего в отношении нарушений, зависящих(прежде всего восприимчивых к модуляции, более предпочтительно ингибированию) от протеинкиназы,прежде всего пролиферативных заболеваний, таких как заболевания, упомянутые выше в разделе "Краткое изложение сущности изобретения". Проведены также эксперименты для демонстрации противоопухолевой активности соединений формулы (I) in vivo. Например, для оценки того, может ли соединение формулы (IA) ингибировать рост карциномы мочевого пузыря, можно применять следующую тест-систему: Линию клеток человеческого переходно-клеточного рака мочевого пузыря RT-112 применяют в качестве модели in vivo для оценки активности in vivo соединений, предлагаемых в изобретении. Эта линия клеток была получена в 1973 г. на основе клеток женщины (неизвестного возраста), страдающей первичной карциномой мочевого пузыря, не подвергавшейся лечению. В этой линии клеток экспрессируются высокие уровни FGFR3. 5106 клеток в матригеле инокулируют подкожно в бок самок бестимусных мышей (n=8) и дают развиться опухоли. Размеры опухолей оценивают вручную каждые 2-3 дня с помощью кронциркуля. В качестве критерия здоровья животных оценивают вес животных.- 21016438 Обработку ингибиторами начинают, когда объемы опухолей достигают 100 мм 3 (7 дней). Мышей случайным образом разделяют на группы в зависимости от объема опухолей и обрабатывают наполнителем (NMP/ПЭГ 300) или тестируемым соединением (n=8) в течение 14 дней. Путь введения представляет собой оральное чреззондовое кормление и схема применения представляет собой 1 день/7 недель. Противоопухолевую активность рассчитывают как T/C % среднее изменение объема опухолей обработанных животных / среднее изменение объема опухолей у контрольных животных)100). Размеры ксенотрансплантатов опухолей оценивают вручную с помощью кронциркуля и объем опухоли рассчитывают с помощью формулы (WНL)/6, где ширина (W), высота (H) и длина (L) представляют собой три самых больших диаметра (размера). Статистическую обработку поводят с помощью программы SigmaStat 2.03. Если в эксперимент включают больше двух групп животных, то статистический анализ осуществляют на основе абсолютных объемов или веса тела в день проведения оценки на основе критерия однонаправленного дисперсионного анализа. Для сравнения контрольной группы со всеми другими группами обработки применяют апостериорный критерий Дуннета. В том случае, когда осуществляют сравнение всех групп между собой, применяют апостериорный критерий Тьюки и SNK (Стьюдента-Ньюмена-Кеулса). Образцы опухоли иссекают и моментально замораживают в жидком N2. Опухоли измельчают в замороженном виде. Аликвоту замороженного порошка лизируют в буфере для экстракции на основе 1% тритона, содержащем ингибиторы протеазы и фосфатазы. Лизаты осветляют центрифугированим и определяют концентрацию белка. Белковый лизат используют для определения степени ингибированияFGFR-рецептора и его каскада в опухолях. Соединения формулы (IA), описанные в настоящем изобретении, могут ингибировать рост опухолей и индуцировать их регресс в дозах, равных или превышающих 10 мг/кг. В качестве примеров киназ, которые, как установлено, ингибируются соединениями формулы (IA),можно упомянуть с-Abl и Bcr-Abl, в частности можно отметить ингибирование Bcr-Abl. Другая ингибируемая киназа представляет собой рецепторную тирозинкиназу VEGF-R, в частности KDR, представляющую собой VEGF-рецепторную тирозинкиназу (VEGF-R2). Соединения, предлагаемые в настоящем изобретении, ингибируют также мутантные формы киназ Bcr-Abl. Описанные соединения можно применять для ингибирования одной или нескольких указанных и/или других протеинтирозинкиназ и/или нерецепторной тирозинкиназы Raf, и/или для ингибирования мутантов указанных ферментов. С учетом указанной активности соединения можно применять для лечения заболеваний, связанных с указанными типами киназ, прежде всего аберрантной или избыточной активности прежде всего упомянутых типов киназ. Способность модулировать указанную протеинкиназную активность предпочтительно относится к ингибированию указанной протеинкиназной активности. Например, в качестве ингибиторов активности VEGF-рецепторных тирозинкиназ соединения, предлагаемые в изобретении, могут прежде всего ингибировать рост кровеносных сосудов и в результате обладать, например, эффективностью в отношении многочисленных заболеваний, ассоциированных с нарушенной регуляцией ангиогенеза, прежде всего заболеваний, которые вызываются неоваскуляризацией глаза, прежде всего ретинопатий, таких как диабетическая ретинопатия или связанная с возрастом дегенерация желтого пятна, в отношении псориаза, гемангиобластомы, такой как гемангиома, пролиферативных заболеваний мезангиальных клеток, таких как хронические или острые болезни почек, например диабетическая нефропатия, злокачественный нефросклероз, синдромы тромботической микроангиопатии или отторжение трансплантата или прежде всего воспалительное заболевание почек, такое как гломеруорнефрит, прежде всего мезангопролиферативный гломерулонефрит, гемолитический-уремический синдром, диабетическая нефропатия, гипертензивный нефросклероз, в отношении атеромы, артериального рестеноза, аутоиммунных заболеваний, диабета, эндометриоза, хронической астмы и прежде всего неопластических болезней (плотные опухоли, но также лейкозы и другие "жидкие опухоли", прежде всего опухоли, экспрессирующие c-Kit, KDR, Flt-1 или Flt-3), прежде всего такие, как рак молочной железы,рак ободочной кишки, рак легкого (прежде всего мелкоклеточный рак легкого), рак предстательной железы или саркома Капоши. Соединение формулы (IA) (или любой из приведенных в качестве примера формулы) (или его N-оксид) ингибирует рост опухолей и прежде всего его можно применять для предупреждения метастатического распространения опухолей и роста микрометастазов. Одним из классов киназ-мишеней соединений, предлагаемых в настоящем изобретении, являются мутанты Bcr-Abl. Следует специально упомянуть такие мутанты, как Glu255 лизин, Glu255 валин илиThr315 изолейцин, наиболее предпочтительным является мутант Thr315 изолейцин. Другие мутанты Bcr-Abl представляют собой Met244Val, Phe317Leu, Leu248Val,Met343Thr, Gly250Ala, Met351Thr, Gly250Glu, Glu355Gly, Gln252His, Phe358Ala,Gln252Arg, Phe359Val, Tyr253His, Val379Ile, Tyr253Phe, Phe382Leu, Glu255Lys,Leu387Met, Glu255Val, His396Pro, Phe311Ile, His396Arg, Phe311Leu, Ser417Tyr,Thr315Ile, Glu459Lys и Phe486Ser. Соединения формулы (IA) наиболее предпочтительно применять для лечения МБЛ посредством ингибирования тирозинкиназного домена Flt-3. Дополнительным вариантом осуществления настоящего- 22016438 изобретения является способ лечения миелобластного лейкоза (МБЛ), заключающийся в том, что вводят в терапевтически эффективном количестве заявляемое соединение. Соединения формулы (IA) (или их соли, прежде всего фармацевтически приемлемые соли) благодаря их способности ингибировать FGFR наиболее пригодны для лечения (прежде всего аномалий) роста, репарации, ремоделирования тканей; клеточной миграции, клеточной диференцировки, развития скелета и/или конечностей, заживления ран, трансдукции сигнала, гематопоэза и/или ангиогенеза, а также онкогенеза или для лечения опухолей или различных типов рака, включая метастазы и образование метастазов, прежде всего для лечения человеческих опухолей, таких как немелкоклеточный рак легкого,плоскоклеточная карцинома (головы и шеи), рак молочной железы, рак желудка, например, поджелудочной железы, аденокарциномы яичника, рак ободочной кишки и/или предстательной железы, а также астроцитомы, глиомы, рак мочевого пузыря, различные типы эпителального рака, например, мочевого пузыря или шейки матки, множественная миелома, плоскоклеточная карцинома (головы и шеи), такая как плоскоклеточная карцинома ротовой полости, ретинобластома, саркома, такая как синовиальная карцинома и/или опухоли кожи; для лечения связанного с 8p11 миелопролиферативного синдрома (эозинофильный миелопролиферативный синдром, EMS); для лечения скелетных аномалий, человеческой карликовости, включая ахондроплазию, синдромы краниосиностоза и синдромы карликовости, скелетной дисплазии, включая гипохондриоплазию, серьезную ахондриоплазию с задержкой развития и дерматоз в виде бархатистых бородавчатых разрастаний, смертельную дисплазию, фенотипы краниосиностоза, например, корональный краниосиностоз Мюнка или синдром Крузона, сопровождающийся дерматозом в виде бархатистых бородавчатых разрастаний, синдром Пфейффера, ограниченное созревание хондроцитов, ингибирование роста костной ткани; для лечения воспалительных или аутоиммунных заболеваний,таких как ревматоидный артрит (RA), артрит, связанный с коллагеном II, рассеянный склероз (MS), системная красная волчанка (SLE), псориаз, юношеский диабет, болезнь Шегрена, заболевание щитовидной железы, саркоидоз, аутоиммунный увет, воспалительное заболевание кишечника (болезнь Крона и неспецифический язвенный колит), заболевание брюшной полости и тяжелая псевдопараплитическая миастения; для лечения аутосомно-доминантных гипофосфатемических рахитов (ADHR), сцепленных с Xхромосомой гипофосфатемических рахитов (XLH), индуцированной опухолью остеомаляции (TIO),фиброзной дисплазии костной ткани (FH); для лечения хронического обструктивного заболевания легких(ХОЗЛ); для лечения ожирения, диабета и/или связанных с ними заболеваний, таких как метаболический синдром, сердечно-сосудистые заболевания, гипертензия, аномальные уровни холестерина и триглицеридов, дерматологические нарушения (например, инфекции, варикозное расширение вен, дерматоз в виде бархатистых бородавчатых разрастаний, экзема, непереносимость физической нагрузки, диабет типа 2, устойчивость к инсулину, гиперхолестеринемия, желчно-каменная болезнь, ортопедическое повреждение, тромбоэмболическое заболевание, коронарная или сосудистая рестрикция (например, атеросклероз), дневная сонливость, приступы апноэ во сне, последняя стадия болезни почек, заболевание желчного пузыря, подагра, нарушения температуры тела, пониженный иммунный ответ, пониженная респираторная функция, инфекции после ранений, бесплодие, заболевание печени, боль в нижней части спины,акушерские и гинекологические осложнения, панкреатит, "удар", осложнение после хирургического вмешательства, недержание мочи при напряжении и/или желудочно-кишечные нарушения. Метод усиления локализованного неохондрогенеза в хряще млекопитающего, заключающийся в местной обработке хряща некоторыми ингибиторами киназ, описан в WO 2006/038112. При создании изобретения неожиданно было установлено, что представленные в описании соединения формулы (IA) можно применять аналогичным образом. Так, в настоящем изобретении предложен способ усиления локализованного неохондрогенеза в хряще млекопитающего, заключающийся в местной обработке хряща описанными выше производными мочевины формулы (IA) или их фармацевтически приемлемыми солями, гидратами, сольватами, сложными эфирами, N-оксидами защищенных производных, индивидуальными изомерами и смесями изомеров или их пролекарствами в количестве, эффективном для усиления локализованного неохондрогенеза. Соединение формулы (IA) в контексте его способности усиливать неохондрогенез можно применять также для лечения остеоартрита. Понятие "лечение" включает также профилактику, в том числе превентивное лечение, например,пациентов, у которых обнаружены мутации или изменения, свидетельствующие о том, что они могут быть предрасположены к развитию заболевания, или предпочтительно терапевтическое (включая (но не ограничиваясь ими) паллиативное, исцеляющее, облегчающее симптомы, уменьшающее симптомы, подавляющее заболевание или симптомы, замедляющее развитие, регулирующее киназы и/или ингибирующее киназы) лечение указанных заболеваний, прежде всего одного или нескольких из указанных выше заболеваний. Лечение животных является предпочтительным. Животное предпочтительно представляет собой теплокровное животное, более предпочтительно млекопитающее. Человек (который обычно также подпадает под общее понятие "животное") предпочтительно представляет собой пациента или индивидуума,который (например, из-за некоторой мутации или по другим причинам) имеет риск предрасположенности к указанному выше или ниже заболеванию.- 23016438 Фармацевтические препараты, способы и применение. Настоящее изобретение относится также к фармацевтическим композициям, которые содержат соединение формулы (IA) (или любой его приведенной в качестве примера формулы) или его фармацевтически приемлемую соль в качестве действующего вещества и которые могут использоваться прежде всего для лечения указанных выше заболеваний. Предлагаемые в изобретении фармакологически приемлемые соединения могут использоваться,например, для приготовления фармацевтических композиций, содержащих в фармацевтически эффективном количестве соединение формулы (IA) (или любой его приведенной в качестве примера формулы) или его фармацевтически приемлемую соль в качестве действующего вещества совместно или в смеси с одним или более неорганическими или органическими твердыми или жидкими фармацевтически приемлемыми носителями в значительном количестве. Изобретение относится также к фармацевтической композиции, пригодной для введения в организм теплокровного животного, прежде всего человека (или в клетки либо линии клеток из организма теплокровного животного, прежде всего человека, например, лимфоциты), в целях лечения или - в более широком варианте осуществления изобретения - в целях предупреждения (профилактики) заболевания, восприимчивого к ингибированию протеинтирозинкиназ, прежде всего одного из указанных выше заболеваний, при которых предпочтительно применение соединения формулы (IA) (или любой его приведенной в качестве примера формулы), и содержащей предлагаемое в изобретении новое соединение формулы (IA) (или любой его приведенной в качестве примера формулы) либо его фармацевтически приемлемую соль в количестве, эффективном для подобного ингибирования, совместно с по меньшей мере одним фармацевтически приемлемым носителем. Особенно предпочтительны фармацевтические композиции для введения в организм теплокровных животных энтеральным путем, в частности назальным, буккальным, ректальным или прежде всего пероральным путем, и парентеральным путем, в частности внутривенным, внутримышечным или подкожным путем. Такие фармацевтические композиции содержат действующее вещество индивидуально либо, что более предпочтительно, совместно с фармацевтически приемлемым носителем. Доза действующего вещества зависит от заболевания, подлежащего лечению, и от особенностей индивидуума, его возраста,веса тела и индивидуального состояния здоровья, от индивидуальных фармакокинетических показателей, а также пути введения в организм. Настоящее изобретение относится прежде всего к фармацевтическим композициям, содержащим соединение формулы (IA) (или любой его приведенной в качестве примера формулы) или его фармацевтически приемлемую соль (может быть их гидрат или сольват) и по меньшей мере один фармацевтически приемлемый носитель. Настоящее изобретение относится далее к фармацевтическим композициям для применения в профилактических или прежде всего терапевтических целях путем их введения в организм человека или животного, к способу их приготовления (прежде всего в виде композиций для лечения опухолей) и к способу лечения (прежде всего опухолевых) заболеваний, в первую очередь указанных выше заболеваний. Изобретение относится также к способам приготовления фармацевтических препаратов, содержащих в качестве действующего вещества (активного начала) соединения формулы (IA) (или любой их приведенной в качестве примера формулы), и к применению соединений формулы (IA) (или любой их приведенной в качестве примера формулы) в этих целях. Предлагаемые в изобретении фармацевтические композиции содержат от примерно 1 до примерно 95% действующего вещества, содержание которого в дозированных лекарственных формах при этом в предпочтительном варианте составляет от примерно 20 до примерно 90%, а в лекарственных формах недозированного типа в предпочтительном варианте составляет от примерно 5 до примерно 20%. В качестве примера дозированных лекарственных форм можно назвать таблетки с покрытием и без покрытия,ампулы, флаконы, суппозитории или капсулы. В качестве примера других лекарственных форм можно назвать мази, кремы, пасты, пены, настойки, спреи и аналогичные лекарственные формы. Содержание действующего вещества, например, в капсулах должно составлять от примерно 0,05 до примерно 1,0 г. Предлагаемые в изобретении фармацевтические композиции приготавливают известными способами, например, обычными методами смешения, гранулирования, нанесения покрытия, растворения или лиофилизации. Предпочтительно применение растворов действующего вещества, а также суспензий или дисперсий, прежде всего изотонических водных растворов, дисперсий или суспензий, которые, например, в случае лиофилизированных композиций, содержащих действующее вещество индивидуально либо совместно с носителем, можно приготавливать непосредственно перед применением. Фармацевтические композиции могут быть стерилизованными и/или могут содержать вспомогательные вещества, например, консерванты, стабилизаторы, смачиватели и/или эмульгаторы, солюбилизаторы, соли для регулирования осмотического давления и/или буферы. Подобные фармацевтические композиции приготавливают известными способами, например, традиционными методами растворения и лиофилизации. Указанные растворы или суспензии могут содержать загустители или солюбилизаторы, такие как натриевая соль карбоксиметилцеллюлозы, карбоксиметилцеллюлоза, декстран, поливинилпирролидон или желатин.- 24016438 Суспензии в масле содержат в качестве масляного компонента растительные, синтетические или полусинтетические масла, обычно используемые для инъекций. В качестве примеров при этом можно назвать прежде всего жидкие эфиры жирных кислот, содержащие в качестве кислотного компонента длинноцепную жирную кислоту с 8-22, прежде всего с 12-22, атомами углерода, например, лауриновую кислоту, тридециловую кислоту, миристиновую кислоту, пентадециловую кислоту, пальмитиновую кислоту, маргариновую кислоту, стеариновую кислоту, арахиновую кислоту, бегеновую кислоту или соответствующие ненасыщенные кислоты, в частности олеиновую кислоту, элаидиновую кислоту, эруковую кислоту, брассидиновую кислоту или линолевую кислоту, при необходимости с добавкой антиокислителей, например, витамина E, -каротина или 3,5-ди-трет-бутил-4-гидрокситолуола. Спиртовой компонент таких эфиров жирных кислот имеет максимум 6 атомов углерода и представляет собой одно- либо многоатомный, например, одно-, двух- или трехатомный, спирт, в частности, метанол, этанол, пропанол, бутанол или пентанол либо их изомеры, но прежде всего гликоль и глицерин. В качестве примера эфиров жирных кислот можно, таким образом, назвать следующие: этилолеат, изопропилмиристат, изопропилпальмитат, "Labrafil M 2375" (полиоксиэтиленглицеринтриолеат, продукт фирмы Gattefoss, Париж),"Miglyol 812" (триглицерид насыщенных жирных кислот с цепью длиной от C8 до C12, продукт фирмыHls AG, Германия), но прежде всего растительные масла, такие как хлопковое масло, миндальное масло, оливковое масло, касторовое масло, кунжутное масло, соевое масло и главным образом арахисовое масло. Композиции для инъекций приготавливают обычным путем в стерильных условиях, в которых также композиции разливают по ампулам или флаконам и запаивают их. Фармацевтические композиции для перорального применения (приема внутрь) можно приготавливать смешением действующего вещества с твердыми носителями, при необходимости гранулированием полученной смеси и переработкой смеси, при необходимости после добавления к ней приемлемых вспомогательных веществ, в таблетки, ядра (сердцевины) драже или капсулы. Такие смеси можно также внедрять или включать в полимерные носители, которые обеспечивают диффузию или высвобождение из них действующих веществ в мерных количествах. В качестве носителей можно использовать прежде всего наполнители, такие как сахара, в частности лактоза, сахароза, маннит или сорбит, производные целлюлозы и/или фосфаты кальция, например, трикальцийфосфат или гидрофосфат кальция, связующие, такие как крахмальные пасты из, например, кукурузного, пшеничного, рисового или картофельного крахмала, желатин, трагакант, метилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и/или поливинилпирролидон,и/или при необходимости разрыхлители, такие как вышеуказанные крахмалы и/или карбоксиметилкрахмал, поперечно-сшитый поливинилпирролидон, агар, альгиновую кислоту или ее соль, такую как альгинат натрия. К числу вспомогательных веществ относятся прежде всего регуляторы текучести и смазывающие вещества, например кремниевая кислота, тальк, стеариновая кислота или ее соли, такие как стеарат магния или стеарат кальция, и/или полиэтиленгликоль. На ядра драже наносят соответствующие,необязательно энтеросолюбильные, покрытия, для чего помимо прочего используют концентрированные растворы сахаров, которые могут содержать аравийскую камедь, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, либо пленкообразующие растворы в приемлемых органических растворителях или же для нанесения энтеросолюбильных покрытий используют растворы соответствующих производных целлюлозы, таких как фталат этилцеллюлозы или фталат гидроксипропилметилцеллюлозы. Капсулы представляют собой капсулы с сухим содержимым, изготавливаемые из желатина, и мягкие неразъемные капсулы, изготавливаемые из желатина и пластификатора, такого как глицерин или сорбит. Капсулы с сухим содержимым могут содержать действующее вещество в виде гранул, например, совместно с наполнителями, такими как лактоза, связующими, такими как крахмалы, и/или скользящими веществами, такими как тальк или стеарат магния, а также при необходимости совместно со стабилизаторами. В мягких капсулах действующее вещество в предпочтительном варианте содержится в виде раствора или суспензии в приемлемых масляных вспомогательных веществах, таких как жирные масла, парафиновое масло или жидкие полиэтиленгликоли, при этом возможно также добавление стабилизаторов и/или антибактериальных средств. В таблетки, покрытия драже или в материал капсул можно также добавлять красители или пигменты, используемые, например, для указания назначения таких лекарственных форм или для обозначения разных доз действующего вещества. На сердцевины таблеток можно наносить соответствующие, необязательно энтеросолюбильные,покрытия, для чего помимо прочего используют концентрированные растворы сахаров, которые могут содержать аравийскую камедь, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана,либо пленкообразующие растворы в приемлемых органических растворителях или же для нанесения энтеросолюбильных покрытий используют растворы соответствующих производных целлюлозы. Фармацевтические композиции для перорального применения (приема внутрь) могут также представлять собой твердые капсулы из желатина, а также мягкие неразъемные (герметично запечатанные) капсулы из желатина и пластификатора. Твердые капсулы могут содержать действующее вещество в виде гранул, например, в смеси с наполнителями, связующими и/или скользящими веществами и необязательно в смеси со стабилизаторами. В мягких капсулах действующее вещество в предпочтительном ва- 25016438 рианте содержится в виде раствора или суспензии в пригодных жидких вспомогательных веществах, к которым можно также добавлять стабилизаторы и ПАВ. Фармацевтические композиции, пригодные для ректального применения представляют собой, например, суппозитории, в которых действующее вещество содержится в соответствующей основе. Для парентерального применения наиболее пригодны водные растворы действующего вещества в водорастворимой форме, например в форме водорастворимой соли, или водные инъекционные суспензии, которые содержат загустители, например натриевую соль карбоксиметилцеллюлозы, сорбит и/или декстран, а также при необходимости стабилизаторы. Действующее вещество, необязательно совместно со вспомогательными веществами, может быть также представлено в виде лиофилизата, который добавлением пригодных для этой цели растворителей можно переводить в раствор непосредственно перед парентеральным введением в организм. Растворы, используемые, например, для парентерального введения в организм, могут также представлять собой инфузионные растворы. Настоящее изобретение относится также к способу или методу лечения одного из указанных выше заболеваний (патологических состояний), предпочтительно заболевания, восприимчивого к ингибированию тирозинкиназ, более предпочтительно упомянутых выше тирозинкиназ, особенно предпочтительно киназы FGFR, прежде всего соответствующего опухолевого заболевания. Соединения формулы (IA) (или любой их приведенной в качестве примера формулы) или их N-оксиды (включая также их соли, сложные эфиры или иные производные) можно в профилактических или терапевтических целях вводить в организм нуждающегося в этом животного, предпочтительно теплокровного животного, например человека,как таковые или прежде всего в составе фармацевтических композиций, предпочтительно в количестве,эффективном для борьбы с подобными заболеваниями. Суточная доза предлагаемого в изобретении соединения при его введении в организм индивидуума весом около 70 кг составляет, например, от примерно 0,001 до 12 г, предпочтительно от примерно 0,1 до примерно 3 г. Выражение "примерно" в предпочтительном варианте означает отклонение от каждого из указанных значений в ту или иную сторону максимум на 10%, особенно предпочтительно не более чем на 1%. Под заболеванием, "восприимчивым к ингибированию тирозинкиназ", подразумевается заболевание, при котором применение предлагаемых в изобретении соединений позволяет добиться некоторого улучшения. В настоящем изобретении предлагается также способ лечения зависящего от протеинкиназ заболевания, заключающийся во введении в организм теплокровного животного, например человека, одного или нескольких цитостатических или цитотоксических соединении, например, Glivec, в сочетании с предлагаемым в изобретении соединением в одно или в разное время. Выражение "в одно время" означает "с небольшим временным интервалом" или "непосредственно одно за другим". Настоящее изобретение относится также в первую очередь к применению соединения формулы (IA)(или любой его приведенной в качестве примера формулы) или его N-оксида либо их фармацевтически приемлемой соли, прежде всего соединения формулы (IA) (или любой его приведенной в качестве примера формулы), указанного как предпочтительное, или его фармацевтически приемлемой соли, как такового или в составе фармацевтического препарата с по меньшей мере одним фармацевтически приемлемым носителем для терапии, а также профилактики одного или нескольких указанных выше заболеваний, предпочтительно заболевания, восприимчивого к ингибированию протеинкиназы, более предпочтительно опухолевого заболевания, наиболее предпочтительно лейкоза, восприимчивого к ингибированию тирозинкиназы Abl. Используемые в каждом случае предпочтительные дозировки, композиции и способы приготовления фармацевтических препаратов (медикаментов) описаны выше. Соединение формулы (IA) (или любой его приведенной в качестве примера формулы) может оказаться также предпочтительным использовать в комбинации с антипролиферативными средствами других типов. К числу таких антипролиферативных средств относятся, но не ограничиваясь только ими, ингибиторы ароматазы, антиэстрогены, ингибиторы топоизомеразы I, ингибиторы топоизомеразы II, проявляющие активность в отношении микротрубочек средства, алкилирующие средства, ингибиторы гистондеацетилазы, ингибиторы фарнезилтрансферазы, ингибиторы COX-2, ингибиторы ММР, ингибиторыmTOR, противоопухолевые антиметаболиты, соединения платины, соединения, снижающие активность протеинкиназы и активность АТФазы, другие антиангиогенные соединения, агонисты гонадорелина, антиандрогены, бенгамиды, бисфосфонаты, антипролиферативные антитела, темозоломид (TEMODAL),эстероиды типа дексаметазона, ингибиторы протеасомы типа велкейда и/или талидомид. Под "ингибиторами ароматазы" в контексте настоящего описания подразумеваются соединения, которые подавляют продуцирование эстрогенов, т.е. превращение субстратов - андростендиона и тестостерона - в эстрон и эстрадиол соответственно. К таким ингибиторам относятся, но не ограничиваясь только ими, стероиды, прежде всего экземестан и форместан, а также, в частности, нестероидные средства, прежде всего аминоглютетимид, ворозол, фадрозол, анастрозол и главным образом летрозол. Экземестан можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, вы- 26016438 пускаемого под товарным знаком AROMASIN. Форместан можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком LENTARON. Фадрозол можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком AFEMA. Анастрозол можно использовать,например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком ARIMIDEX. Летрозол можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком FEMARA или FEMAR. Аминоглютетимид можно использовать, например, в виде его имеющегося на рынке препарата, например,препарата, выпускаемого под товарным знаком ORIMETEN. Предлагаемые в изобретении соединения в комбинации с противоопухолевым средством, которым является ингибитор ароматазы, наиболее целесообразно использовать для лечения опухолей груди с положительными рецепторами гормонов. Под "антиэстрогенами" в контексте настоящего описания подразумеваются соединенияантагонисты, которые ослабляют действие эстрогенов на уровне их рецепторов. К таким антиэстрогенам относятся, но не ограничиваясь только ими, тамоксифен, фулвестрант, ралоксифен и ралоксифена гидрохлорид. Тамоксифен можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком NOLVADEX. Ралоксифена гидрохлорид можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком EVISTA. Фулвестрант можно использовать в составе фармацевтической композиции, описанной в US 4659516, или его можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком FASLODEX. Под "ингибиторами топоизомеразы I" в контексте настоящего описания подразумеваются, но не ограничиваясь только ими, топотекан, иринотекан, 9-нитрокамптотецин и макромолекулярные конъюгаты камптотецина PNU-166148 (соединение A1 в WO 99/17804). Иринотекан можно использовать, например,в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знакомCAMPTOSAR. Топотекан можно использовать, например, в виде его имеющегося на рынке препарата,например, препарата, выпускаемого под товарным знаком HYCAMTIN. Под "ингибиторами топоизомеразы II" в контексте настоящего описания подразумеваются, но не ограничиваясь только ими, антрациклины доксорубицин (включая его липосомальный препарат, например, CAELYX), эпирубицин, идарубицин и неморубицин, антрахиноны митоксантрон и лозоксантрон и подофиллотоксины этопозид и тенипозид. Этопозид можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком ETOPOPHOS. Тенитгозид можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком VM 26-BRISTOL. Доксорубицин можно использовать,например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком ADRIBLASTIN. Эпирубицин можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком FARMORUBICIN. Идарубицин можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата,выпускаемого под товарным знаком ZAVEDOS. Митоксантрон можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком NOVANTRON. Под "проявляющими активность в отношении микротрубочек средствами" подразумеваются стабилизирующие и дестабилизирующие микротрубочки средства, включая, но не ограничиваясь только ими,таксаны паклитаксел и доцетаксел, алкалоиды барвинка, например винбластин, прежде всего винбластина сульфат, винкристин, прежде всего винкристина сульфат, а также винорелбин, дискодермолид и эпотилоны, такие как эпотилон B и эпотилон D. Доцетаксел можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком TAXOTERE. Винбластина сульфат можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком VINBLASTIN R.P Винкристина сульфат можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата,выпускаемого под товарным знаком FARMISTIN. Под "алкилирующими средствами" в контексте настоящего описания подразумеваются, но не ограничиваясь только ими, циклофосфамид, ифосамид и мелфалан. Циклофосфамид можно использовать,например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком CYCLOSTIN. Ифосамид можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком HOLOXAN. Под "ингибиторами гистондеацетилазы" подразумеваются соединения, которые ингибируют гистондеацетилазу и которые обладают антипролиферативной активностью. Под "ингибиторами фарнезилтрансферазы" подразумеваются соединения, которые ингибируют фарнезилтрансферазу и которые обладают антипролиферативной активностью.- 27016438 Под "ингибиторами COX-2" подразумеваются соединения, которые ингибируют фермент циклооксигеназу типа 2 (COX-2, ЦОГ-2) и которые обладают антипролиферативной активностью, такие как целекоксиб (Celebrex), рофекоксиб (Vioxx) и лумиракоксиб (COX189). Под "ингибиторами ММР" подразумеваются соединения, которые ингибируют матриксную металлопротеиназу (MMP) и которые обладают антипролиферативной активностью. Под "ингибиторами mTOR" подразумеваются соединения, которые ингибируют молекулу-мишень рапамицина у млекопитающих (mTOR) и которые обладают антипролиферативной активностью, такие как сиролимус (Rapamune), эверолимус (Certican), CCI-779 и ABT578. Под "противоопухолевыми антиметаболитами" подразумеваются, но не ограничиваясь только ими,5-фторурацил, тегафур, капецитабин, кладрибин, цитарабин, флударабина фосфат, фторуридин, гемцитабин, 6-меркаптопурин, гидроксимочевина, метотрексат, эдатрексат и соли этих соединений, а также ZD 1694 (RALTITREXED), LY231514 (ALIMTA), LY264618 (LOMOTREXOL) и OGT719. Под "соединениями платины" в контексте настоящего описания подразумеваются, но не ограничиваясь только ими, карбоплатин, цисплатин и оксалиплатин. Карбоплатин можно использовать, например,в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знакомCARBOPLAT. Оксалиплатин можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком ELOXATIN. Под "соединениями, снижающими активность протеинкиназы и другими антиангиогенными соединениями" в контексте настоящего описания подразумеваются, но не ограничиваясь только ими, соединения, которые снижают активность, например, васкулярного эндотелиального фактора роста или фактора роста сосудистого эндотелия (VEGF), эпидермального фактора роста (EGF), киназы c-Src, протеинкиназы C, тромбоцитарного фактора роста (PDGF), киназы Bcr-Abl, киназы c-Kit, киназы Flt-3, рецептора инсулиноподобного ростового фактора I (IGF-IR) и циклинзависимых киназ (CDK), ингибиторы фосфатидилинозитол-3-киназы (Pl3K) и ингибиторы протеинкиназы B (РКВ) (например, описанные в WO 2005/054238 и WO 2005/054237), ингибиторы хитшокового белка 90 (HSP90) (фермента АТФазы) и антиангиогенные соединения, обладающие иным механизмом действия, отличным от снижения протеинкиназной активности. К соединениям, которые снижают активность VEGF-фактора, относятся прежде всего соединения,которые ингибируют рецептор VEGF-фактора, прежде всего тирозинкиназную активность рецептораM.S. O'Reilly и др., Cell, 79, 1994, c. 315-328, и Endostatin, описанный у M.S. O'Reilly и др., Cell, 88,1997, c. 277-285. К соединениям, которые снижают активность EGF-фактора, относятся прежде всего соединения,которые ингибируют рецептор EGF-фактора, прежде всего тирозинкиназную активность рецептора EGFфактора, и соединения, связывающиеся с EGF-фактором, и, в частности, соединения, в общем и конкретно описанные в WO 97/02266, ЕР 0564409, WO 99/03854, ЕР 0520722, ЕР 0566226, ЕР 0787722,ЕР 0837063, WO 98/10767, WO 97/30034, WO 97/49688, WO 97/38983 и главным образом в WO 96/33980. К соединениям, которые снижают активность киназы c-Src, относятся, но не ограничиваясь только ими, подавляющие активность протеинтирозинкиназы c-Src соединения, описанные ниже, и ингибиторы опосредующего белок-белковое взаимодействие SH2-домена, описанные, например, в WO 97/07131 иWO 97/08193. К соединениям, подавляющим активность протеинтирозинкиназы c-Src, относятся, но не ограничиваясь только ими, соединения, относящиеся к структурным классам пирролопиримидинов, прежде всего пирроло[2,3-d]пиримидинов, пуринов, пиразопиримидинов, прежде всего пиразо[3,4-d]пиримидинов,пиразопиримидинов, прежде всего пиразо[3,4-d]пиримидинов, и пиридопиримидинов, прежде всего пиридо[2,3-d]пиримидинов. В предпочтительном варианте под такими соединениями подразумеваются таковые, описанные в WO 96/10028, WO 97/28161, WO 97/32879 и WO 97/49706. К соединениям, снижающим активность протеинкиназы C, относятся прежде всего производные стауроспоринов, описанные в EP 0296110 (соответствующий фармацевтический препарат описан вWO 00/48571) и представляющие собой ингибиторы протеинкиназы C. К числу других особых соединений, которые снижают протеинкиназную активность и которые можно использовать в комбинации с предлагаемыми в изобретении соединениями, относятся иматиниб(Gleevec/Glivec), PKC412, Iressa (ZD1839), PKI166, РТК 787, ZD6474, GW2016, CHIR-200131, CEP7055/CEP-5214, CP-547632, KRN-633 и SU5416. К антиангиогенным соединениям, обладающим иным механизмом действия, отличным от снижения протеинкиназной активности, относятся, например, но не ограничиваясь только ими, талидомид(THALOMID), целекоксиб (Celebrex) и ZD6126. Под "агонистами гонадорелина" в контексте настоящего описания подразумеваются, но не ограничиваясь только ими, абареликс, гозерелин и гозерелина ацетат. Гозерелин описан в US 4100274 и может использоваться, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком ZOLADEX. Абареликс можно использовать в составе фармацевтической композиции, описанной в US 5843901. Под "антиандрогенами" в контексте настоящего описания подразумеваются, но не ограничиваясь только ими, бикалутамид (CASODEX), который можно использовать в составе фармацевтической композиции, описанной в US 4636505. Под "бенгамидами" подразумеваются собственно бенгамиды и их производные с антипролиферативными свойствами. Под "бисфосфонатами" в контексте настоящего описания подразумеваются, но не ограничиваясь только ими, этидроновая кислота, клодроновая кислота, тилудроновая кислота, памидроновая кислота,алендроновая кислота, ибандроновая кислота, ризедроновая кислота и золедроновая кислота. "Этидроновую кислоту" можно использовать, например, в виде ее имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком DIDRONEL. "Клодроновую кислоту" можно использовать,например, в виде ее имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком BONEFOS. "Тилудроновую кислоту" можно использовать, например, в виде ее имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком SKELID. "Памидроновую кислоту" можно использовать, например, в виде ее имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком AREDIA. "Алендроновую кислоту" можно использовать, например, в виде ее имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком FOSAMAX. "Ибандроновую кислоту" можно использовать, например, в виде ее имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком BONDRANAT. "Ризедроновую кислоту" можно использовать, например, в виде ее имеющегося на рынке препарата, например,препарата, выпускаемого под товарным знаком ACTONEL. "Золедроновую кислоту" можно использовать, например, в виде ее имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком ZOMETA. Под "антипролиферативными антителами" в контексте настоящего описания подразумеваются, но не ограничиваясь только ими, трастузумаб (Herceptin), трастузумаб-DM1, эрлотиниб (Tarceva), бевацизумаб (Avastin), ритуксимаб (Rituxan), PRO64553 (антитело к CD40) и антитело 2C4. Для лечения миелобластного лейкоза (МБЛ) соединения формулы (IA) (или любой их приведенной в качестве примера формулы) можно использовать в комбинации со стандартными методами лечения лейкоза, прежде всего в комбинации с методами лечения МБЛ. Соединения формулы (IA) (или любой их приведенной в качестве примера формулы) можно, в частности, применять в комбинации, например, с ингибиторами фарнезилтрансферазы и/или иными лекарственными средствами, используемыми для лечения МБЛ, такими как даунорубицин, адриамицин, Ara-C, VP-16, тенипозид, митоксантрон, идарубицин, карбоплатин и PKC412. Данные о структуре действующих веществ, обозначенных кодовыми номерами, непатентованными названиями или торговыми наименованиями, можно получить в последнем издании стандартного справочника "The Merck Index" либо в базах данных, например, в международных патентных базах данных (в частности, в IMS World Publications). Указанные выше соединения, которые можно использовать в комбинации с соединением формулы(IA) (или любой его приведенной в качестве примера формулы), можно получать и применять аналогично тому, как это известно в данной области, например, аналогично тому, как это описано в указанных выше литературных источниках. Выражение "совместное применение", соответственно "совместное введение в организм" или "комбинированное применение", соответственно "комбинированное введение в организм" либо иное аналогичное выражение в контексте настоящего описания означает возможность введения выбранных терапевтических средств в организм одного пациента и предполагает применение схем лечения, при которых используемые в комбинации между собой терапевтические средства не обязательно должны вводиться в организм одним и тем же путем или в одно и то же время. Под упоминаемым в последующем описании или ниже термином "применение" (в форме глагола или существительного) (относящимся к применению соединения формулы (IA) или его (прежде всего фармацевтически приемлемой) соли) подразумевается (если не указано иное или если из контекста не следует иное) соответственно один или несколько следующих вариантов осуществления изобретения: применение в лечении заболевания, восприимчивого к модуляции (прежде всего ингибированию) протеинкиназы (прежде всего протеинтирозинкиназы), применение для приготовления фармацевтических композиций, предназначенных для применения в лечении заболевания, восприимчивого к модуляции(прежде всего ингибированию) протеинкиназы, способы применения одного или нескольких соединений формулы (IA) в лечении восприимчивого к модуляции (прежде всего ингибированию) протеинкиназы
МПК / Метки
МПК: A61K 31/506, C07D 401/04, C07D 239/32, C07D 413/10
Метки: фибробластов, качестве, fgf-фактора, роста, ингибиторов, производные, пиримидиниларилмочевины, фактора
Код ссылки
<a href="https://eas.patents.su/30-16438-proizvodnye-pirimidinilarilmocheviny-v-kachestve-ingibitorov-faktora-rosta-fibroblastov-fgf-faktora.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиримидиниларилмочевины в качестве ингибиторов фактора роста фибробластов (fgf-фактора)</a>
Предыдущий патент: Ингибитор jnk для лечения эндометриоза и содержащая его фармацевтическая композиция
Следующий патент: Диафрагменный насос и способ выравнивания давления в нем
Случайный патент: Таблетка ii прессованной жевательной резинки












