Новые низкомолекулярные ингибиторы mdm2 и их применение
Номер патента: 16145
Опубликовано: 28.02.2012
Авторы: Чэнь Цзяньюн, Ван Шаомэн, Юй Шанхай, Цинь Дунгуан
Формула / Реферат
1. Соединение, имеющее формулу X
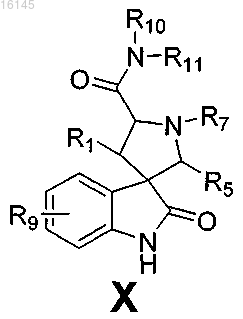
или его фармацевтически приемлемая соль,
где R1 представляет собой C6-14арил, необязательно замещенный одной или двумя галогеногруппами;
R5 представляет собой C1-18алкил, необязательно замещенный C3-8циклоалкилом, C6-14арилом или C1-6алкоксигруппой, C3-8циклоалкил; или C2-18алкенил;
R7 представляет собой H или CO2R';
R' представляет собой C1-18алкил;
R9 представляет собой 6-хлор- и 5-фторгруппу;
R10 представляет собой атом водорода и
R11 представляет собой C3-8циклоалкил-C1-6алкил, где указанный C3-8циклоалкил необязательно замещен одной или двумя гидроксигруппами; или моноцикло-C3-8гетероцикло-C1-6алкил, где указанный моноцикло-C3-8гетероцикло необязательно замещен одной или двумя гидроксигруппами; или дигидрокси-C1-6алкильную группу, не содержащую гидроксильную группу в положении 3 алкильной группы; либо R10 и R11 вместе образуют моноцикло-C3-8гетероциклогруппу, необязательно замещенную C1-6алкилом.
2. Соединение по п.1, имеющее одну из формул XI-XXVI
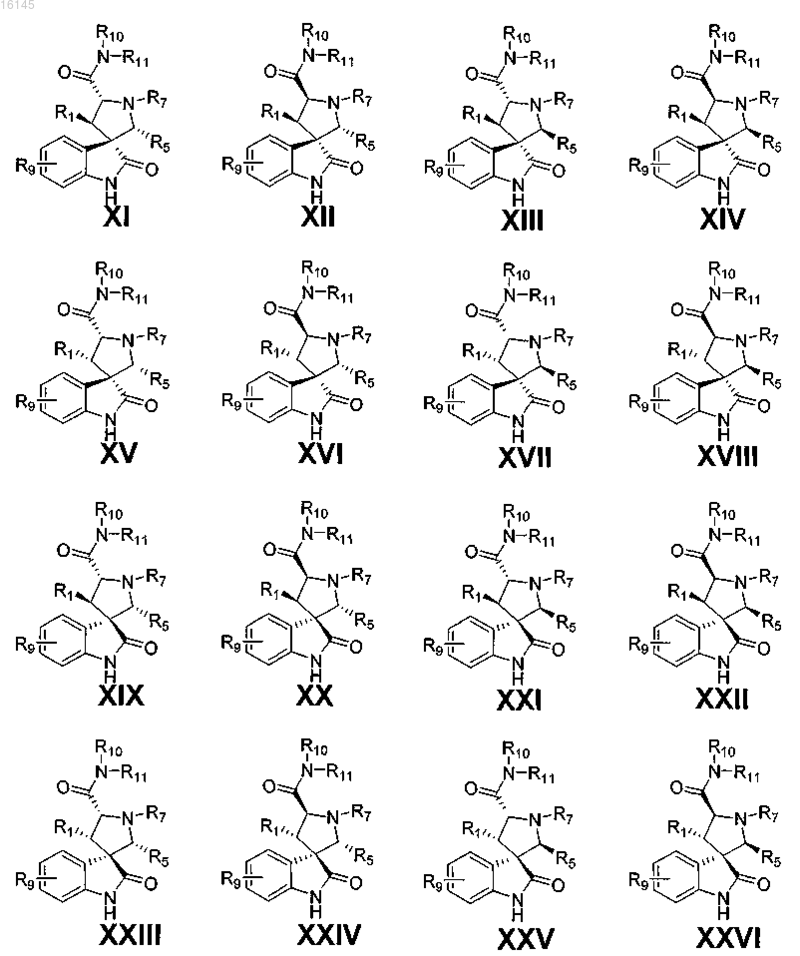
или его фармацевтически приемлемая соль.
3. Соединение по п.2, имеющее формулу XI или формулу XXVI
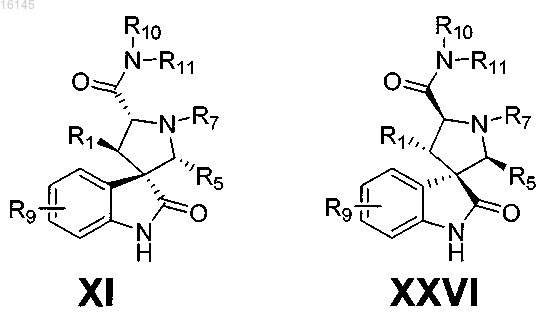
или его фармацевтически приемлемая соль.
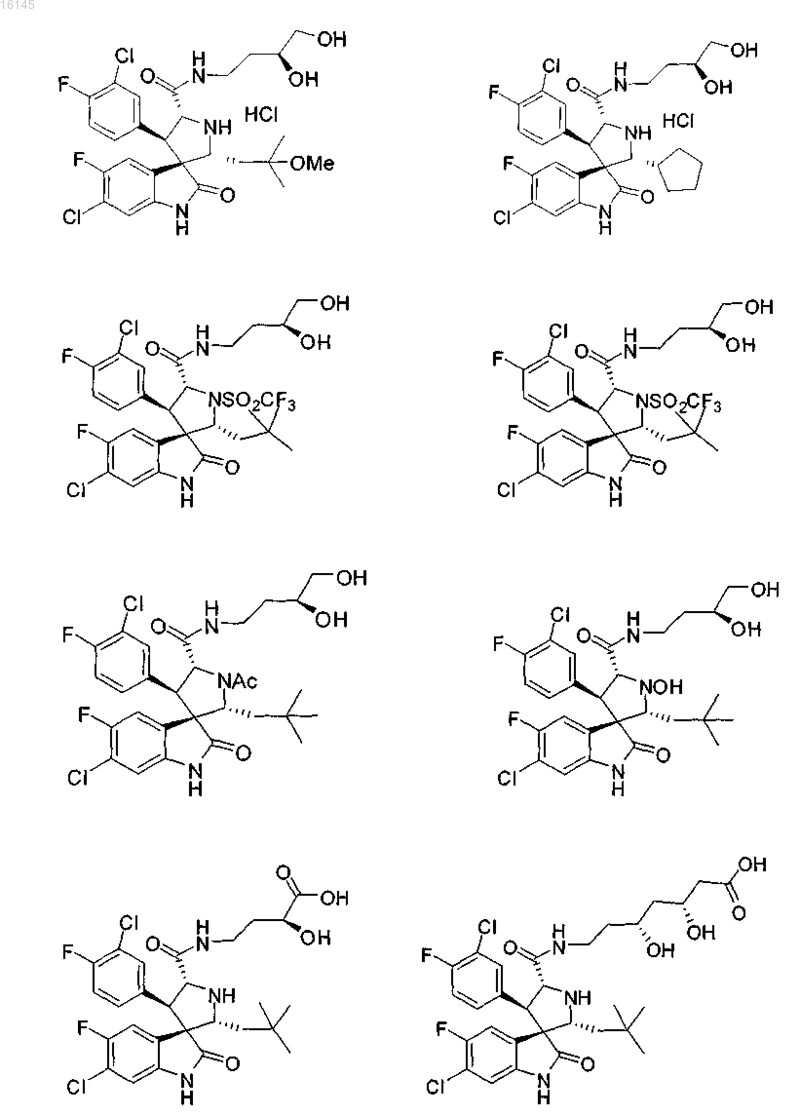
4. Соединение, выбранное из группы, состоящей из
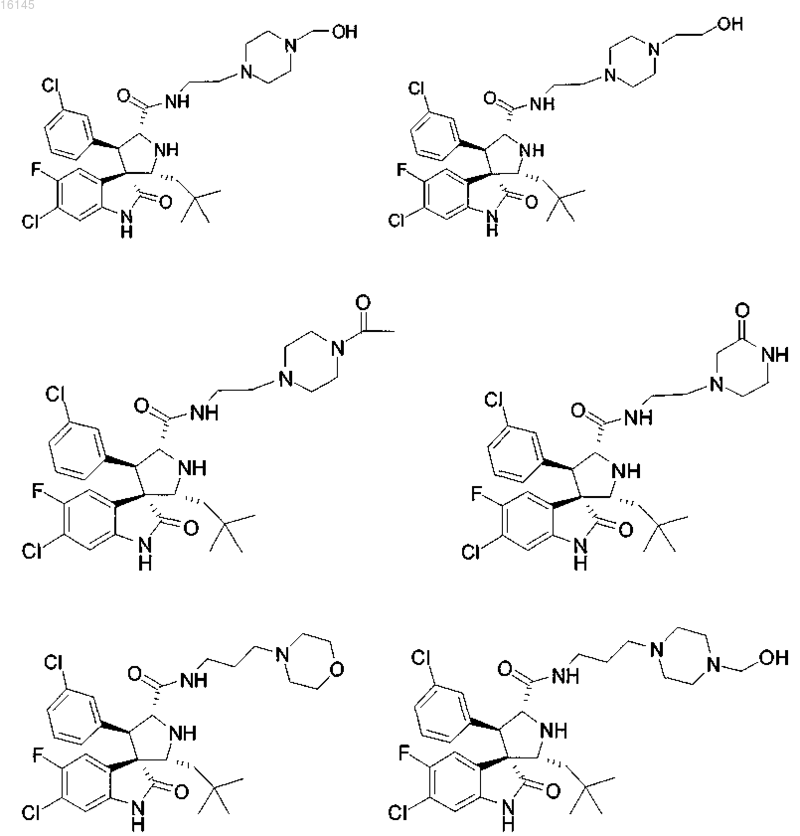
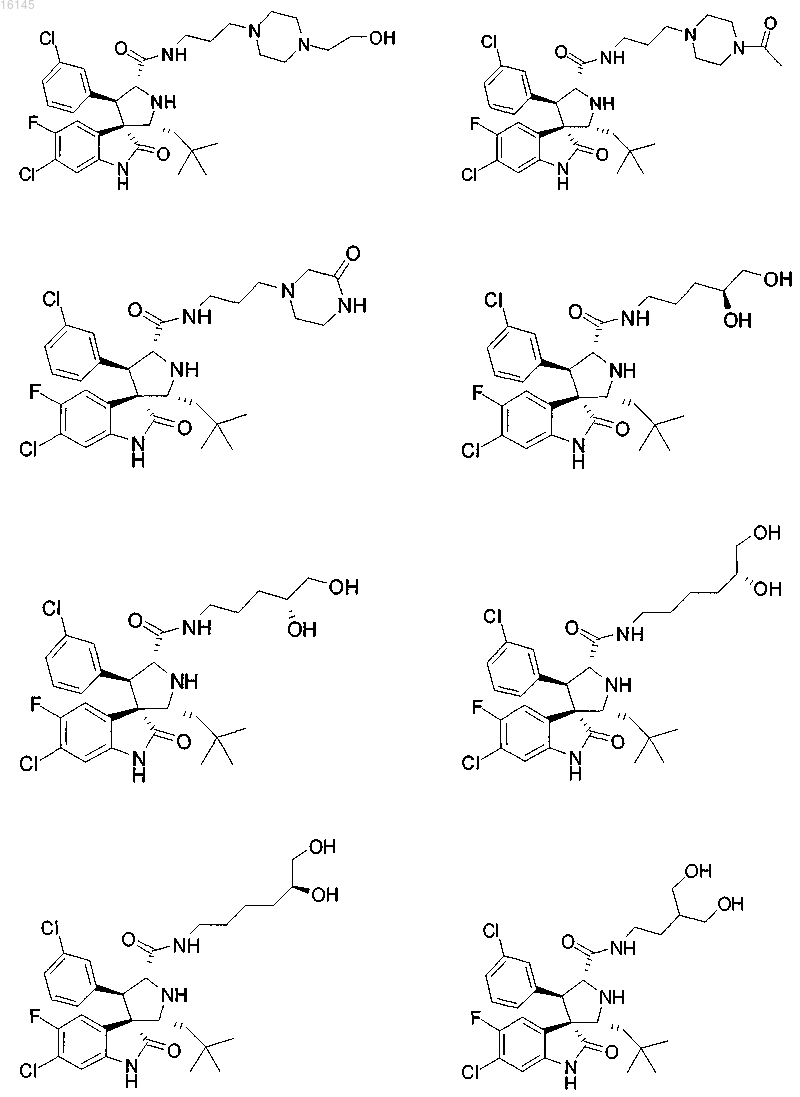
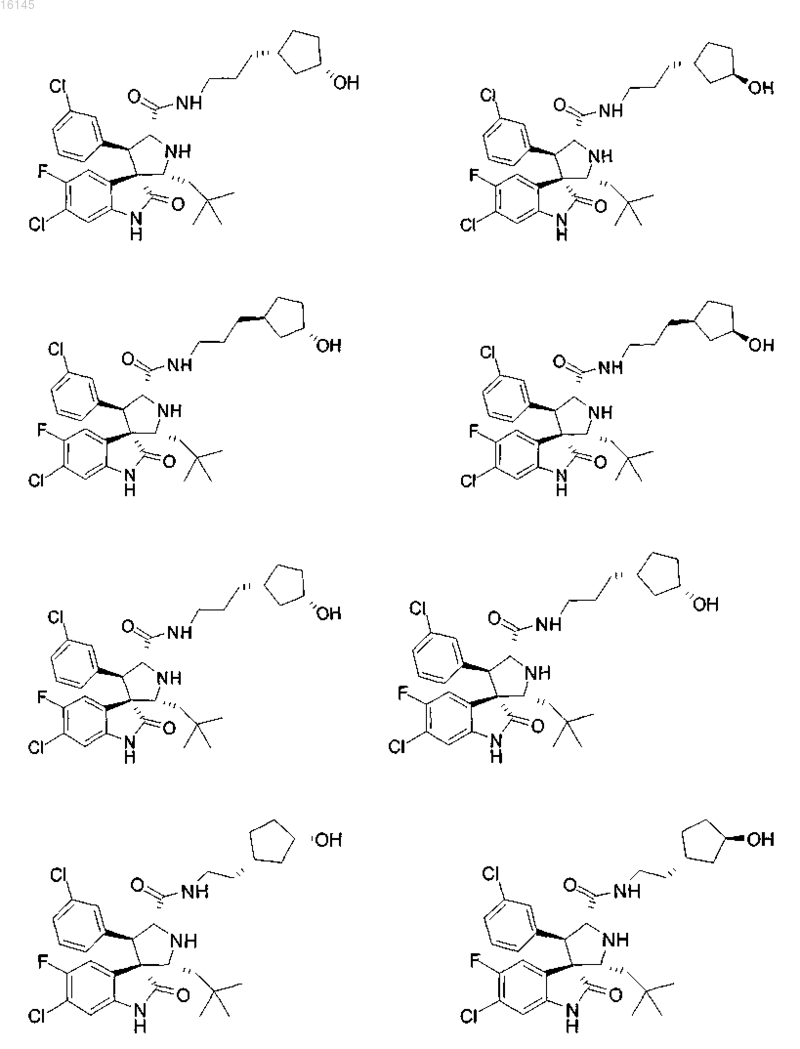
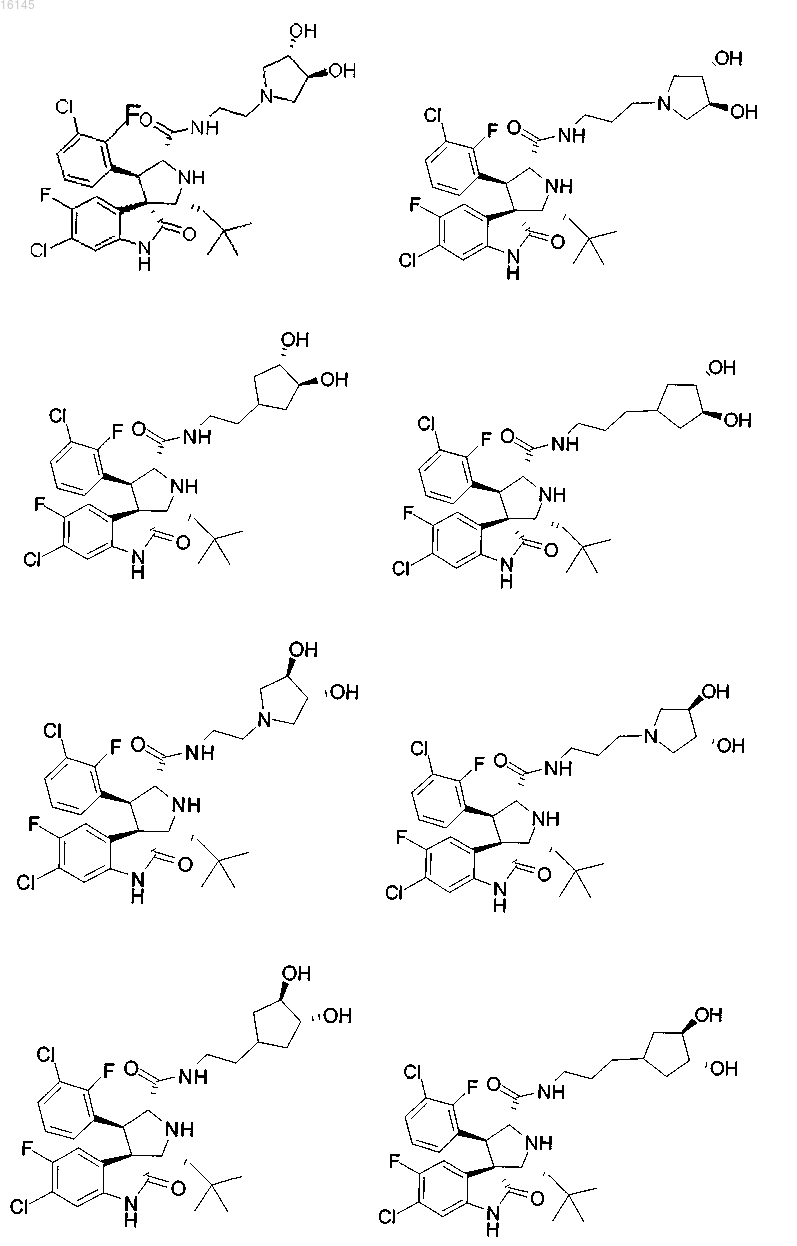

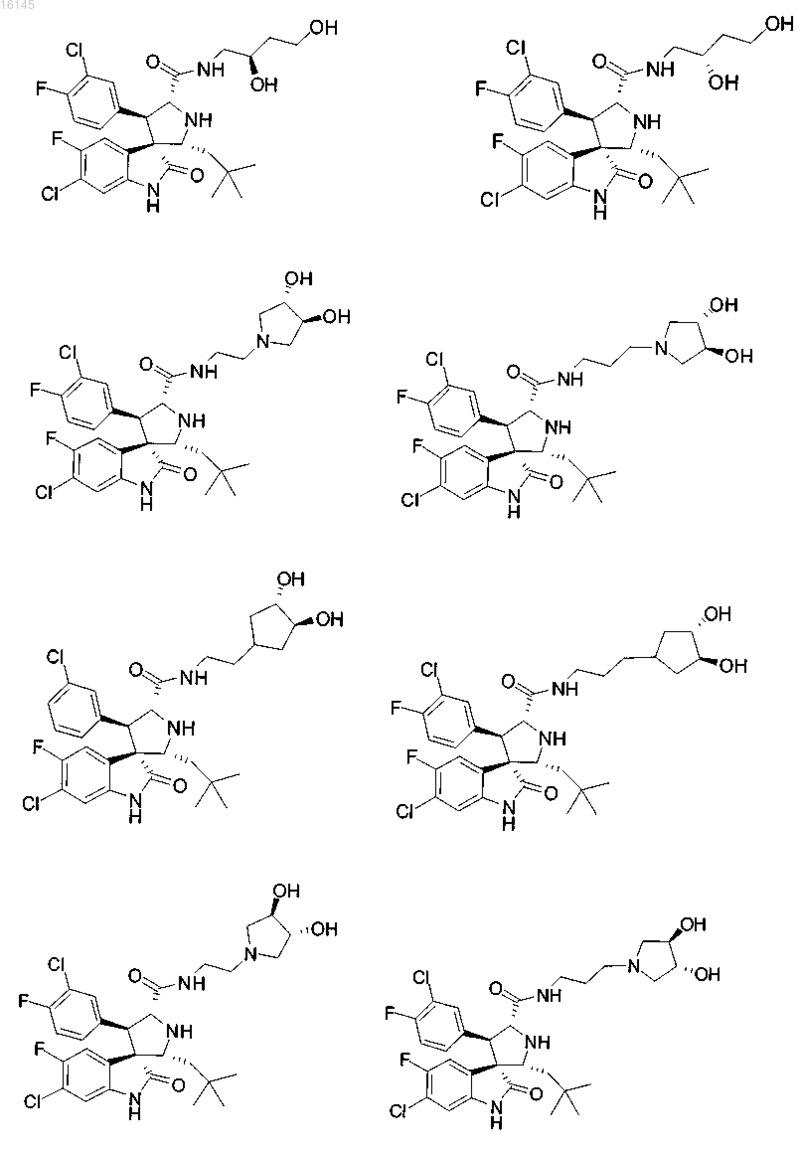



или его фармацевтически приемлемая соль.
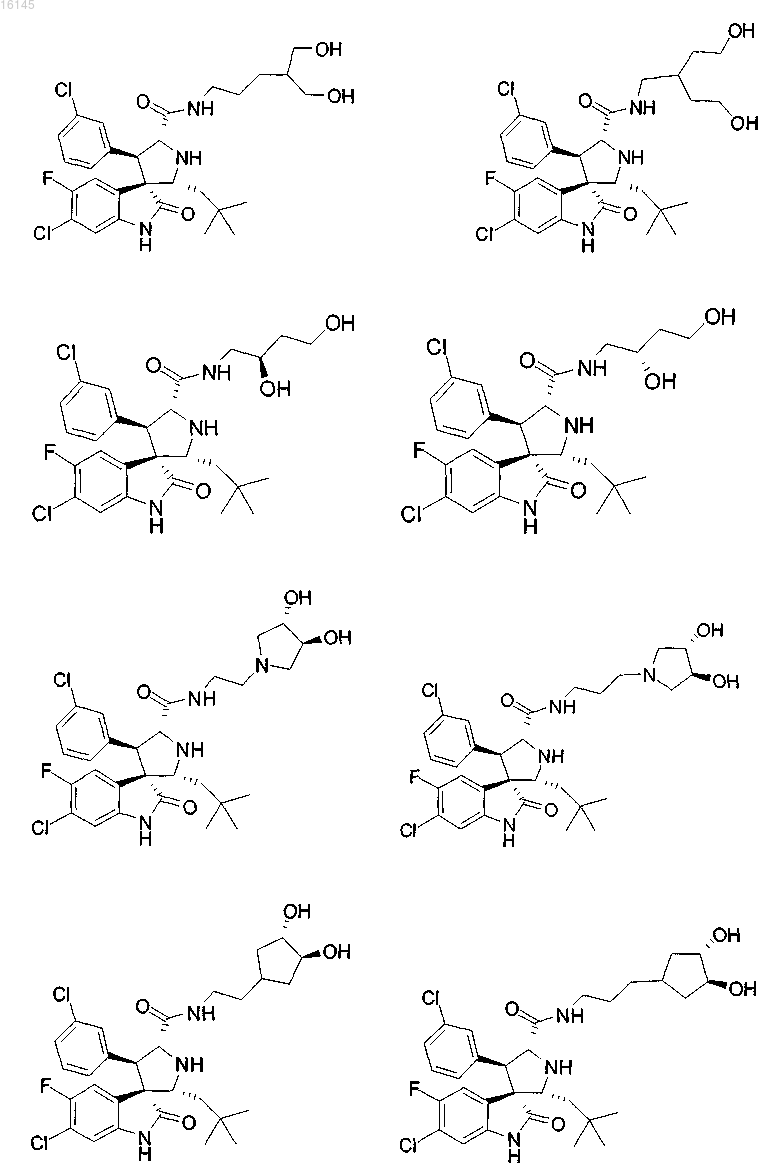
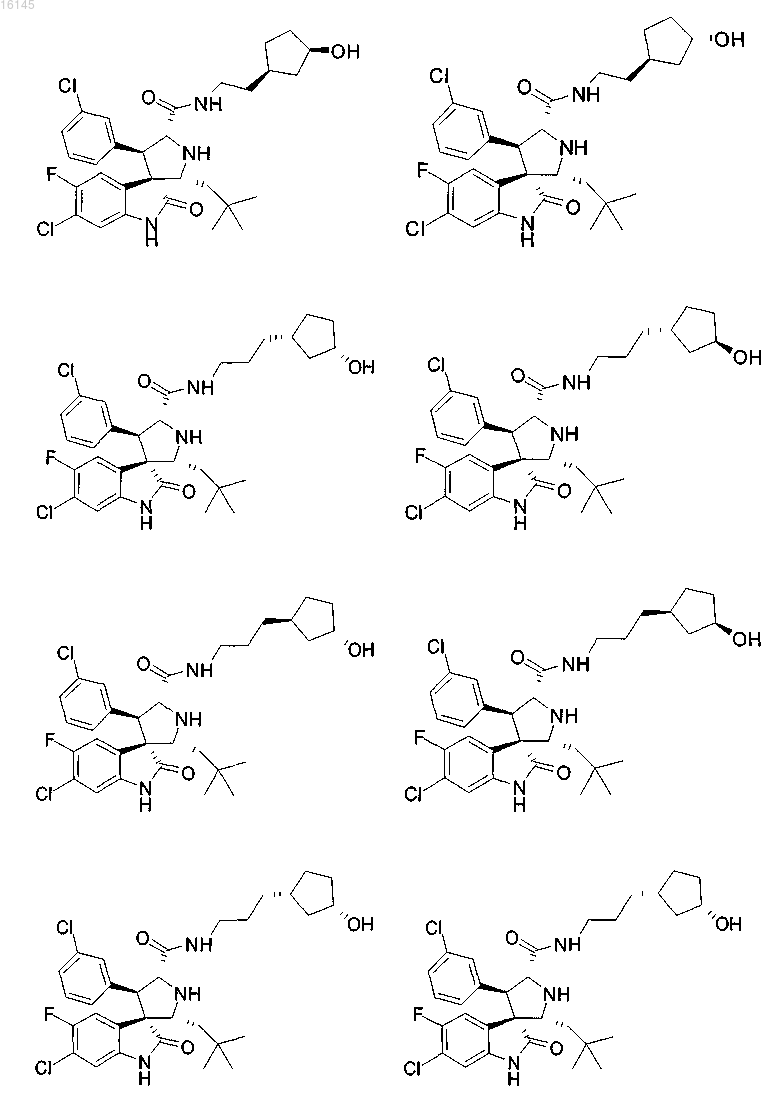
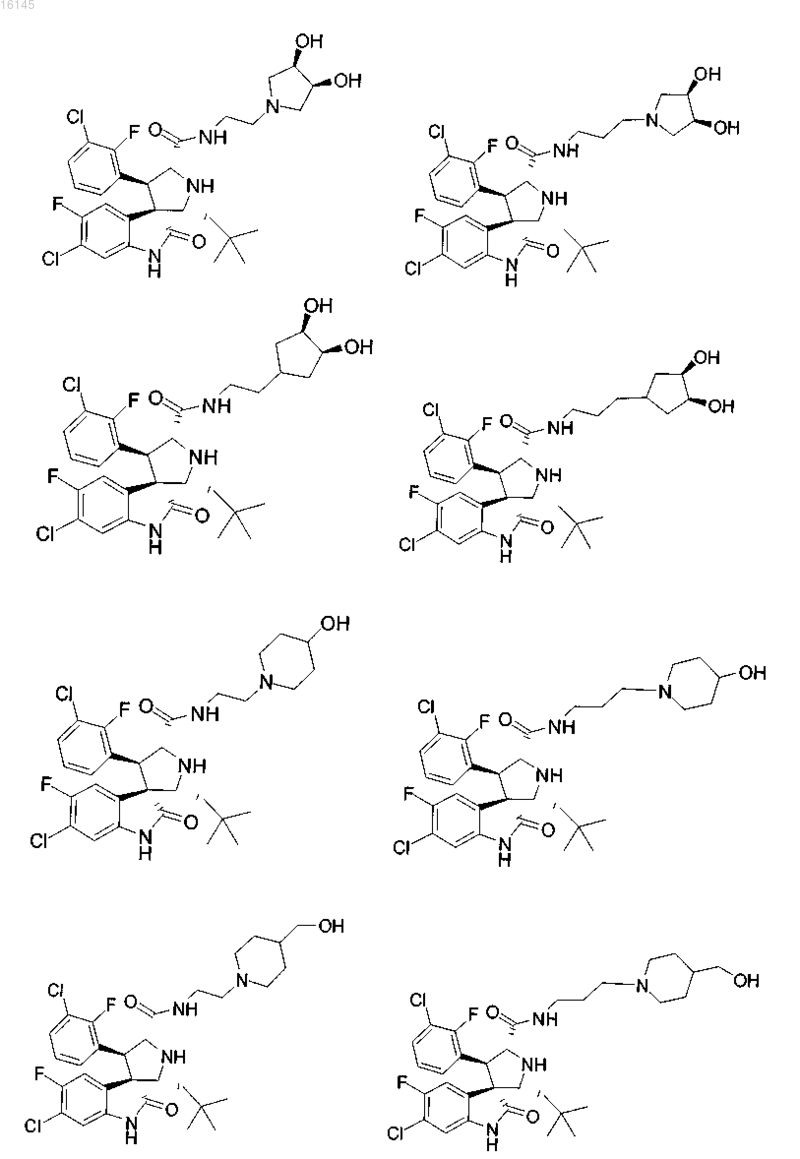
5. Соединение, выбранное из группы, состоящей из
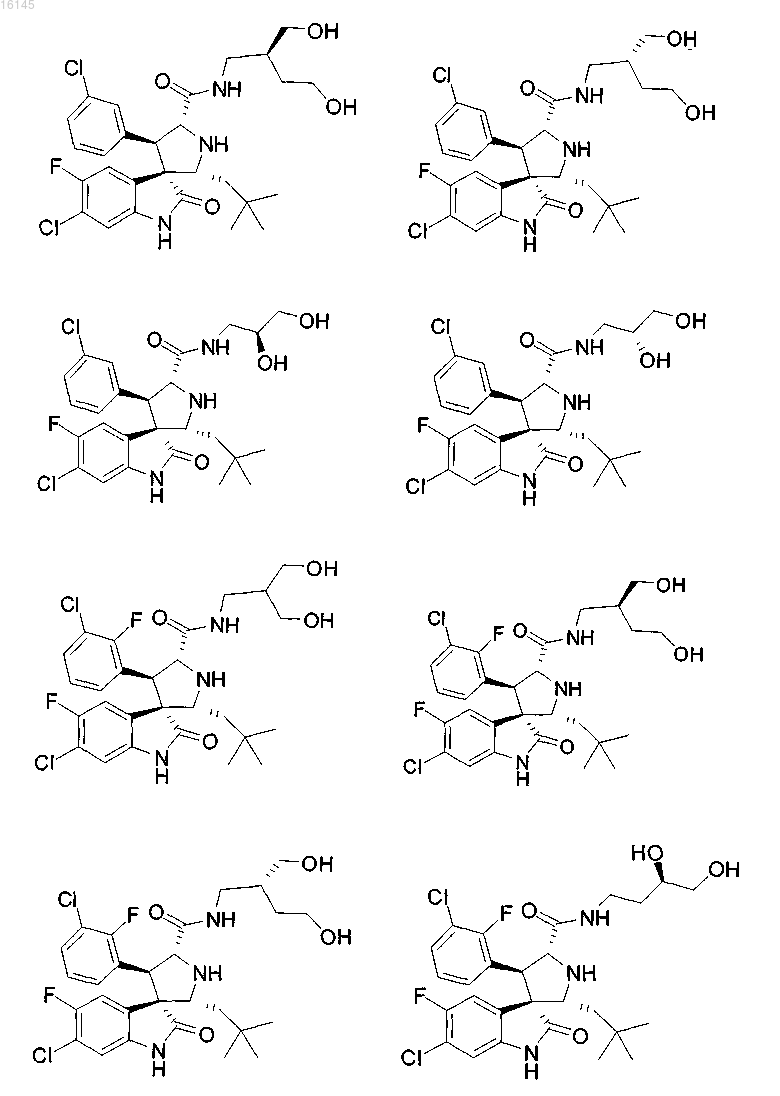
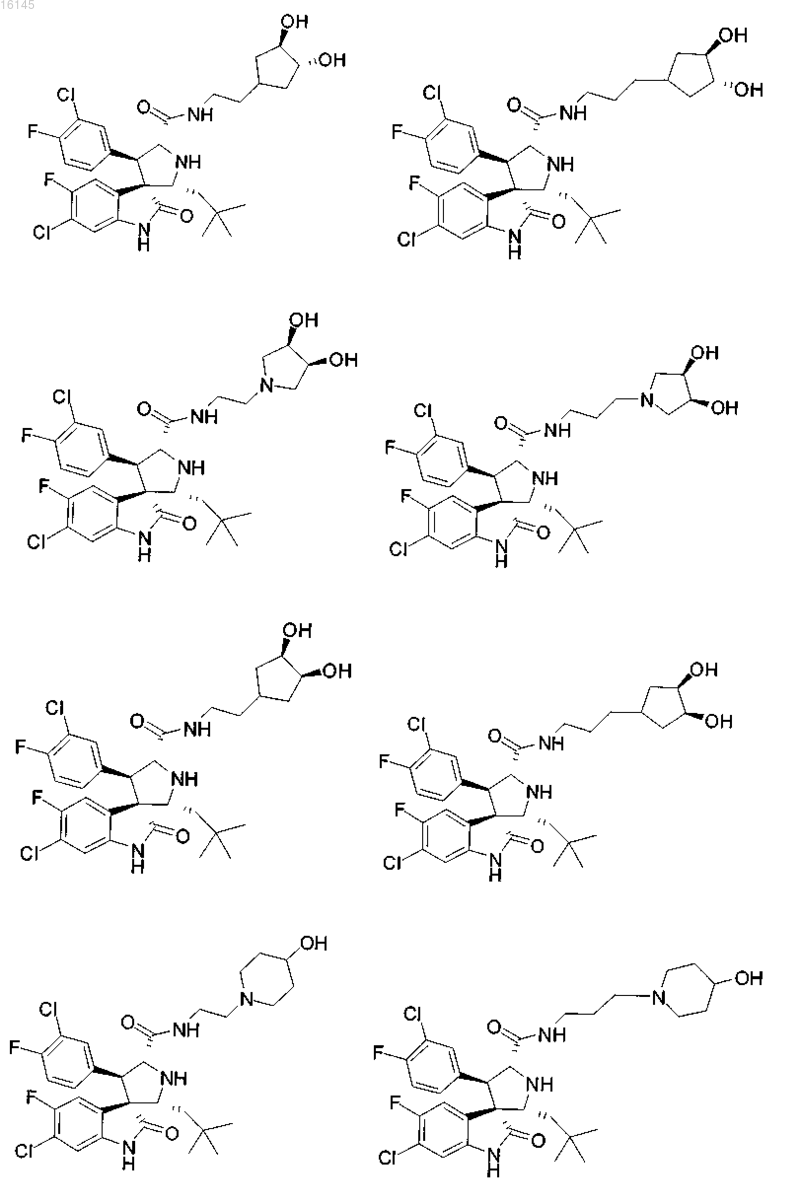
или его фармацевтически приемлемая соль.
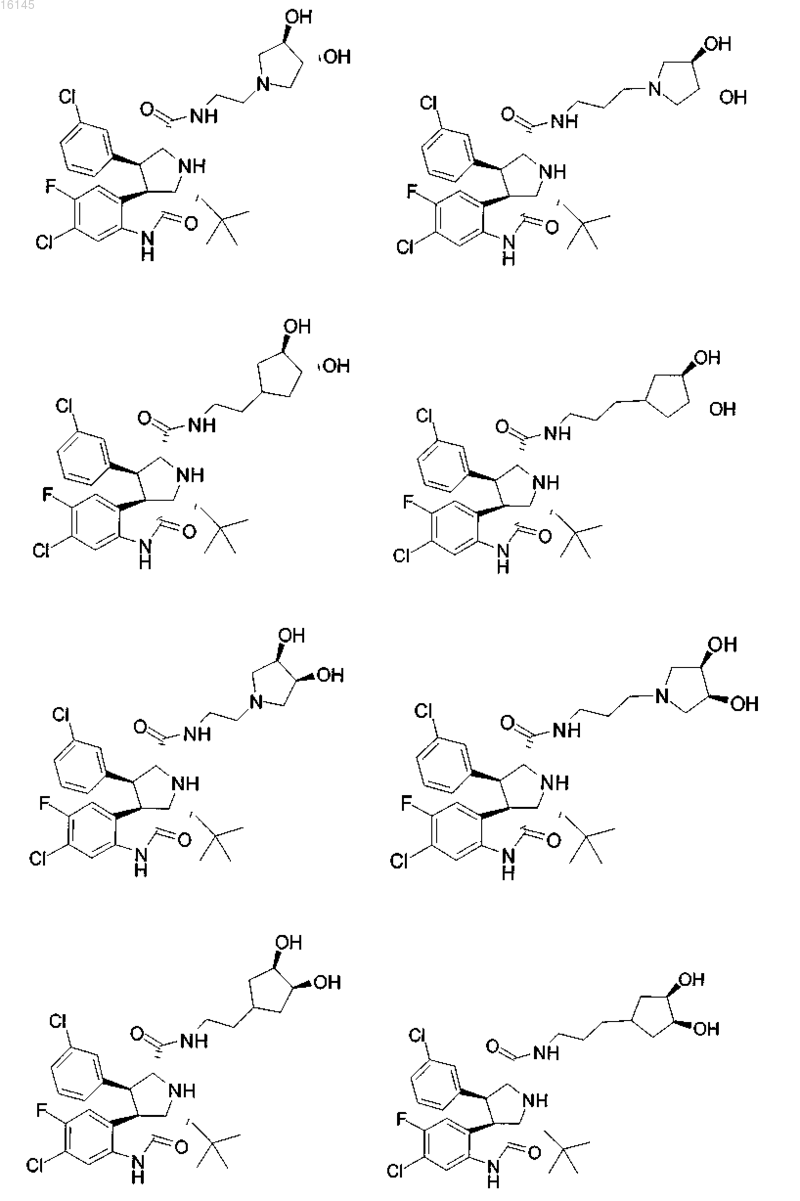
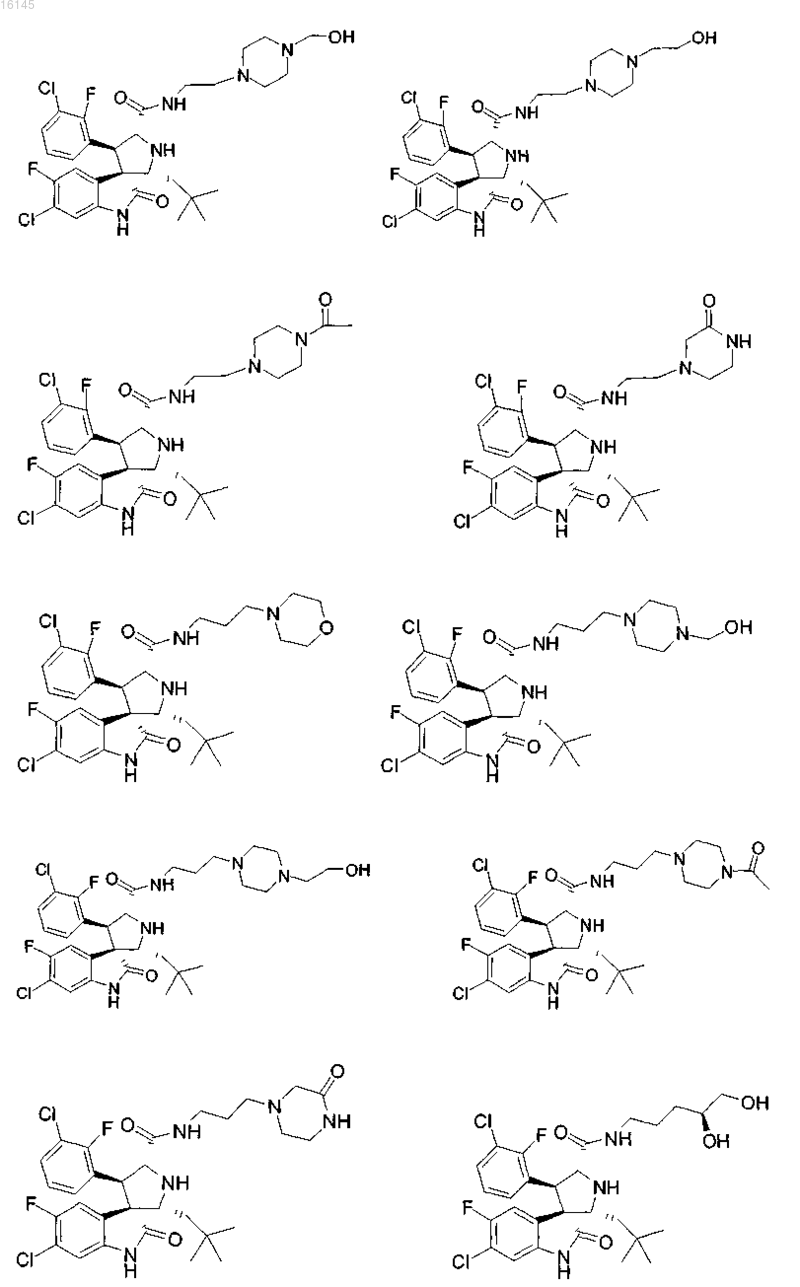
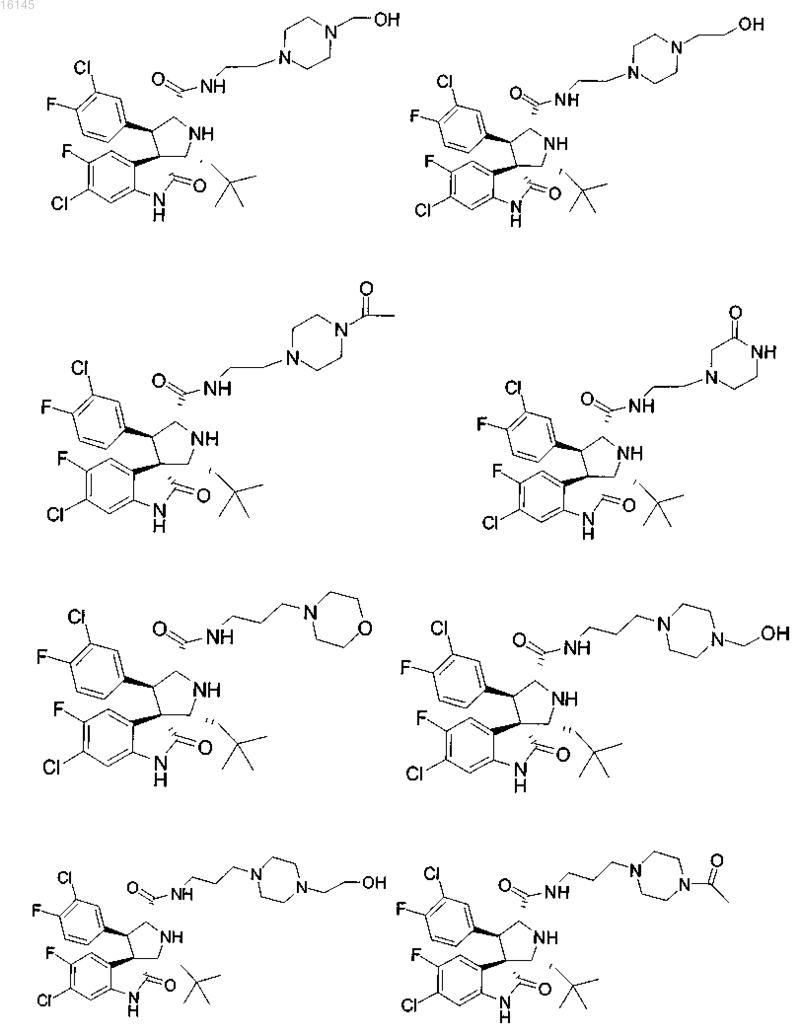
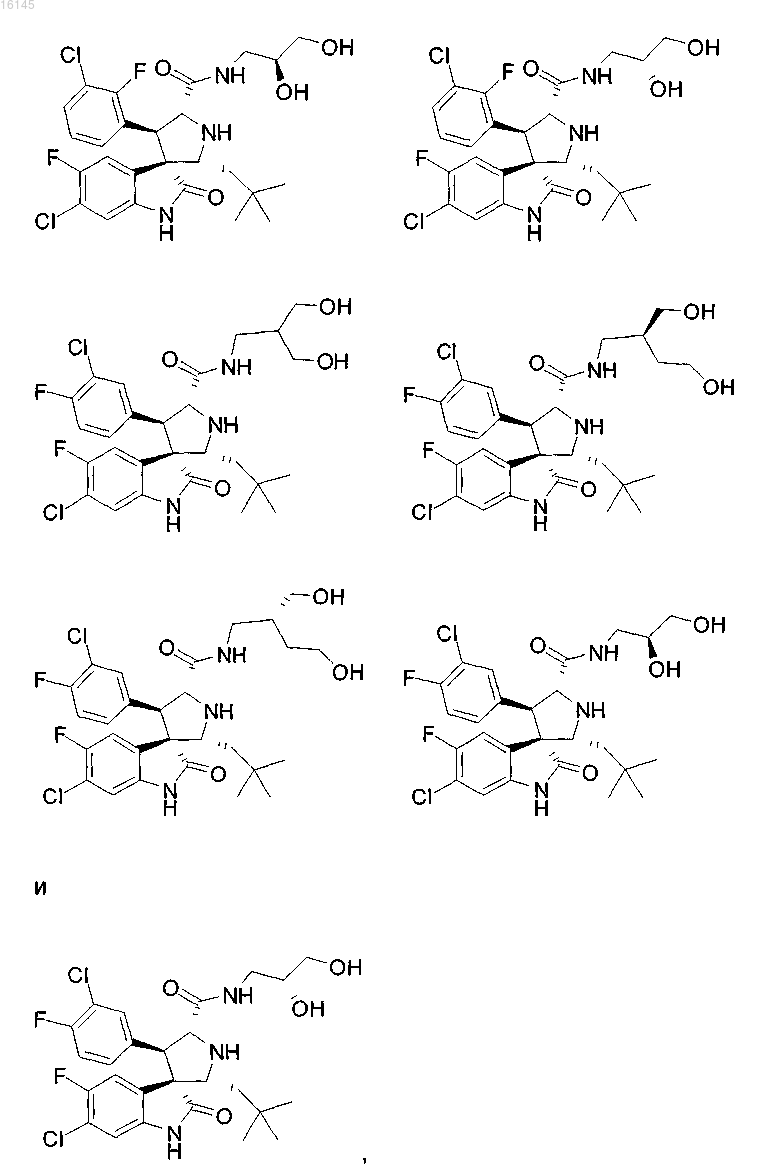
6. Соединение, выбранное из группы, состоящей из
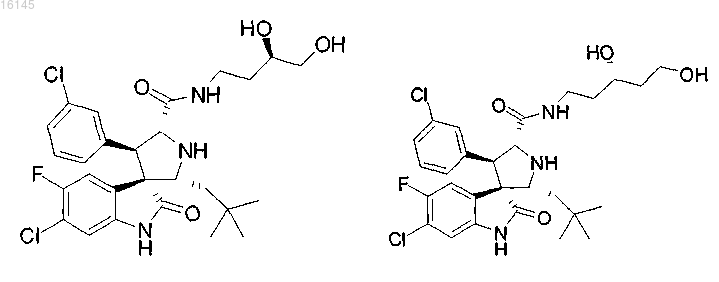
или его фармацевтически приемлемая соль.
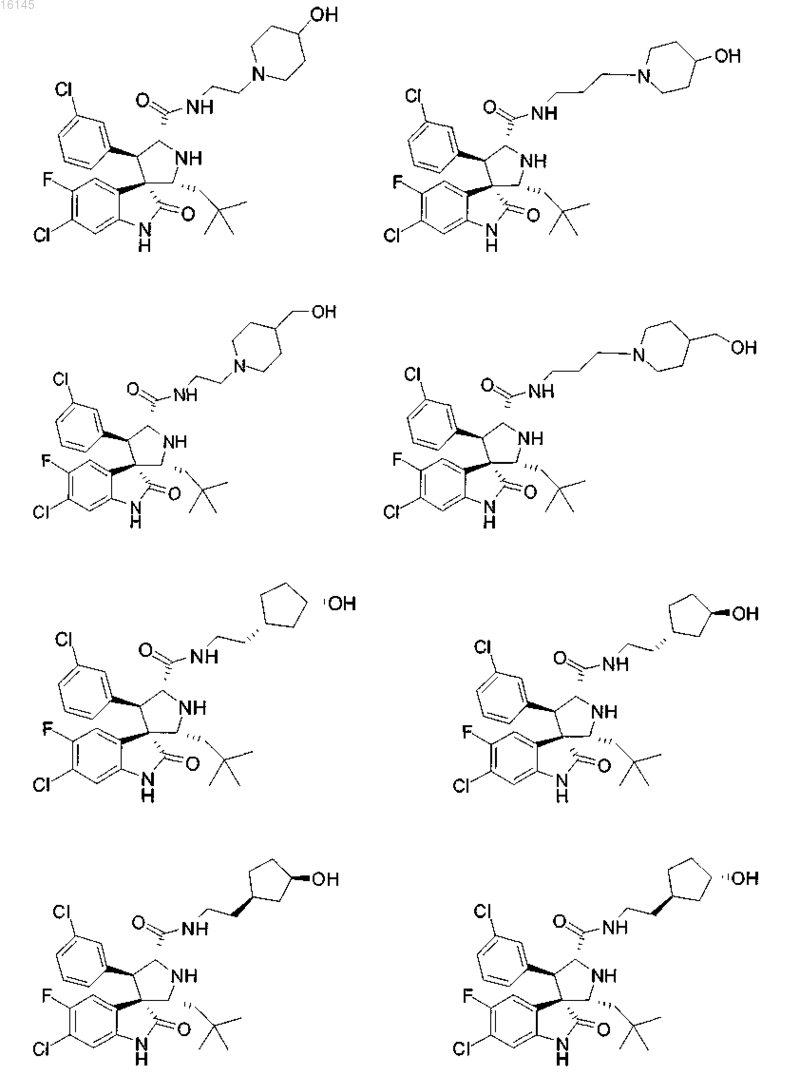
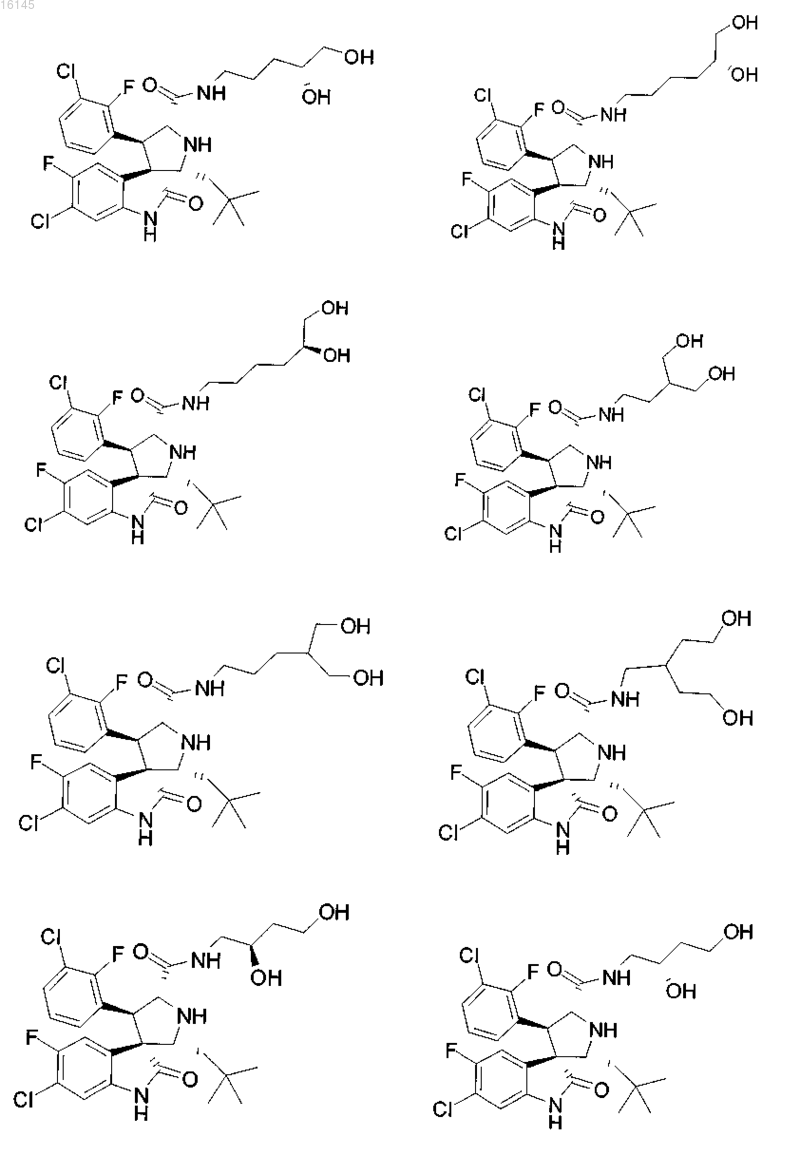
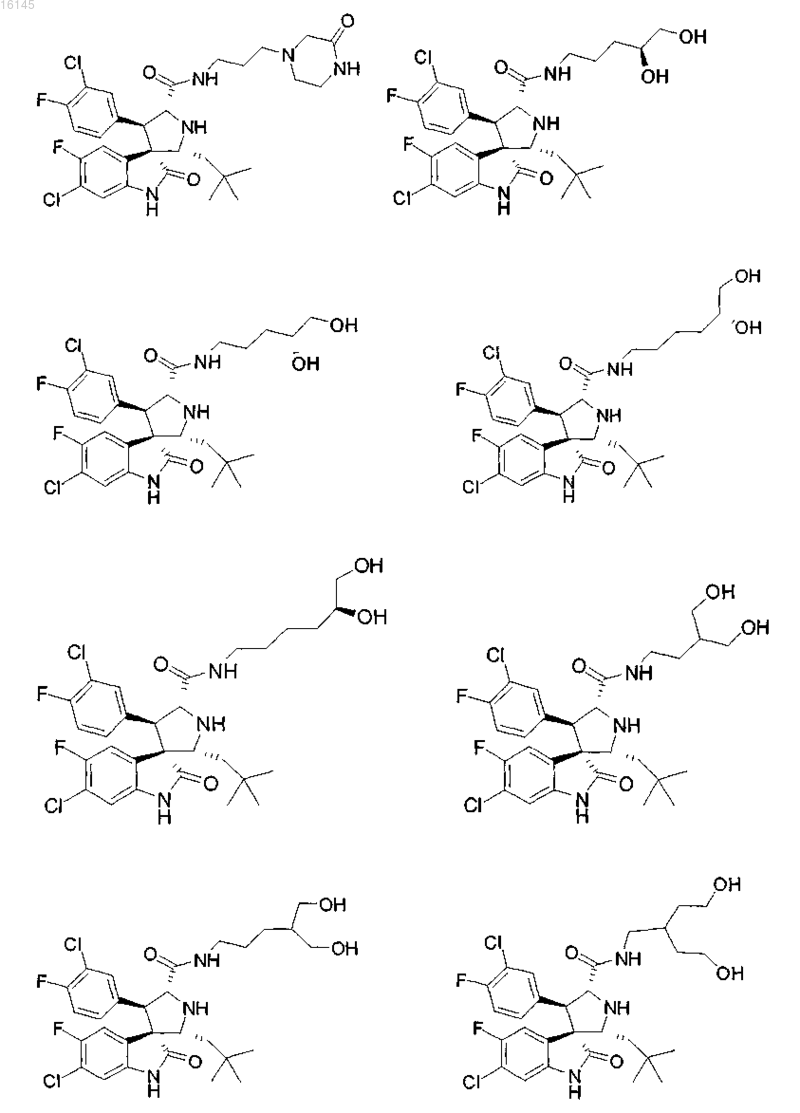
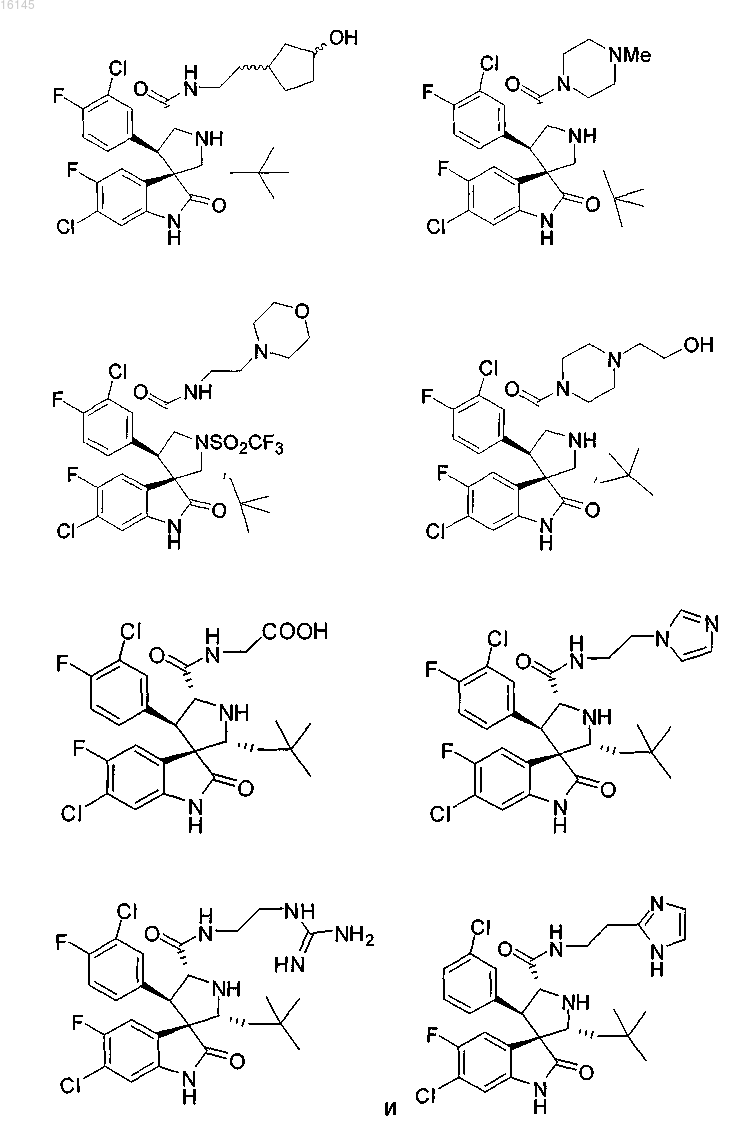
7. Соединение, выбранное из группы, состоящей из

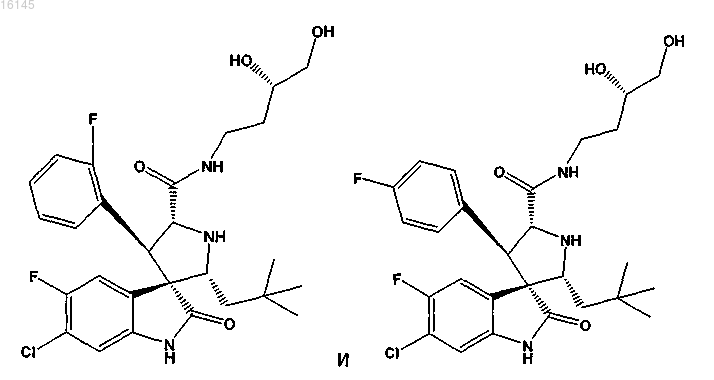
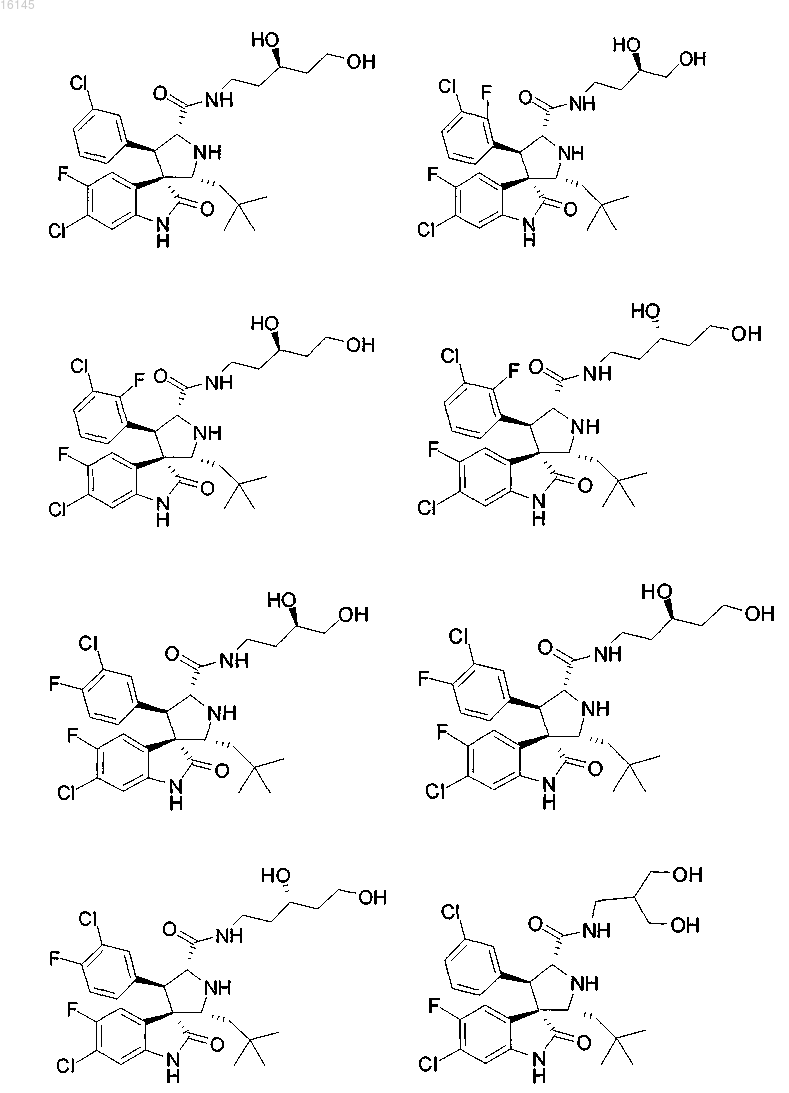
или его фармацевтически приемлемая соль.
8. Соединение, представляющее собой
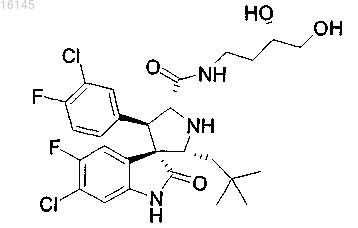
или его фармацевтически приемлемая соль.
9. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8 и фармацевтически приемлемый носитель.
10. Способ ингибирования роста и/или деления клетки, индукции апоптоза и/или индукции остановки клеточного цикла в клетке, при котором клетку приводят в контакт с соединением по любому из пп.1-8.
11. Способ придания клетке чувствительности к дополнительному агенту(агентам), при котором клетку приводят в контакт с соединением по любому из пп.1-8.
12. Способ по п.11, дополнительно включающий приведение клетки в контакт с химиотерапевтическим агентом.
13. Способ лечения или облегчения рака у животного, при котором указанному животному вводят терапевтически эффективное количество соединения по любому из пп.1-8.
14. Способ по п.13, при котором дополнительно вводят химиотерапевтический агент.
15. Способ по п.13, где рак характеризуется экспрессией функционального p53 или белков, родственных p53.
16. Способ ингибирования взаимодействия между p53 или белками, родственными p53, и MDM2 или белками, родственными MDM2, в клетке, при котором клетку подвергают воздействию соединения по любому из пп.1-8.
17. Способ ингибирования роста гиперпролиферативной клетки, содержащей функциональный p53 или белки, родственные p53, при котором клетку подвергают воздействию соединения по любому из пп.1-8.
18. Набор, содержащий соединение по любому из пп.1-8 и инструкции по введению животному указанного соединения.
19. Набор по п.18, дополнительно содержащий химиотерапевтический агент.
20. Набор по п.18, где указанные инструкции относятся к введению указанного соединения животному, имеющему рак.
Текст
НОВЫЕ НИЗКОМОЛЕКУЛЯРНЫЕ ИНГИБИТОРЫ MDM2 И ИХ ПРИМЕНЕНИЕ Настоящее изобретение имеет отношение к низкомолекулярным веществам, которые являются ингибиторами взаимодействия p53 и MDM2. Изобретение также имеет отношение к применению этих веществ для подавления клеточного роста, индукции гибели клеток, индукции остановки клеточного цикла и/или повышения чувствительности клеток к другим агентам.(71)(73) Заявитель и патентовладелец: ДЗЕ РИДЖЕНТС ОФ ДЗЕ ЮНИВЕРСИТИ ОФ МИЧИГАН (US) 016145 Настоящая заявка притязает на приоритет предварительной заявки на патент США, серийный номер 60/841150, заполненной 08/03/2006, которая для справки полностью включена в настоящую заявку. Предпосылки к изобретению Область изобретения Область настоящего изобретения - химия лекарственных соединений. В частности, изобретение имеет отношение к низкомолекулярным веществам, которые являются антагонистами взаимодействияp53 и MDM2, а также к их использованию для лечения онкологических и других заболеваний. Введение Агрессивный фенотип опухолевых клеток является результатом множества различных генетических и эпигенетических повреждений, которые приводят к нарушению регуляции межклеточных сигнальных механизмов (Ponder, Nature 411:336 (2001. Общей чертой всех опухолевых клеток является нарушение выполнения программы апоптоза и отсутствие нормального апоптоза вследствие нарушения его механизмов (Lowe и at al., Carcinogenesis 27:485 (2000. Неспособность опухолевых клеток выполнять программу апоптоза вследствие нарушения механизмов нормального апоптоза часто связана с возрастанием устойчивости к химиотерапии, облучению или иммуноиндуцированному апоптозу. Первичная или приобретенная устойчивость опухолей человека различного происхождения к существующим протоколам лечения вследствие нарушения механизмов апоптоза является серьезной проблемой современной онкологии (Lowe и at al., Carcinogenesis 21:485 (2000), Nicholson, Nature 407:810 (2000. Следовательно, усилия, направленные на разработку и развитие новых молекулярных специфических противоопухолевых лекарственных средств, способных увеличить выживаемость и качество жизни пациентов с опухолевыми заболеваниями, должны включать разработку стратегий, воздействующих на резистентность опухолевых клеток к апоптозу. В этом отношении многообещающей терапевтической стратегией по созданию новых противоопухолевых препаратов является воздействие на ключевые отрицательные регуляторы, которые играют основную роль в прямом подавлении апоптоза в опухолевых клетках. Супрессор опухолевого роста p53 играет основную роль в контроле над клеточной прогрессией и апоптозом (Vogelstein и at al., Nature 408:307 (2000. Этот ген - привлекательная терапевтическая мишень для создающихся лекарственных средств, поскольку стимуляция его противоопухолевой активности приводит к эрадикации опухолевых клеток (Vogelstein и at al., Nature 408:307 (2000), Chene, Nat. Rev.Cancer 5:102 (2003. Новый способ стимуляции активности гена p53 - это ингибирование его взаимодействия с белком MDM2 при помощи небелковых низкомолекулярных ингибиторов (Chene, Nat. Rev. Cancer 5:102 (2003); Vassilev и at al., Science 505:844 (2004. MDM2 и p53 являются частью петли, саморегулирующейся по принципу обратной связи (Wu и at al., Genes Dev. 7:1126 (1993. Транскрипция MDM2 активируется p53, a MDM2, в свою очередь, подавляет активность p53 по меньшей мере по трем различным механизмам (Wu и at al., Genes Dev. 7:1126 (1993. Первый механизм: белок MDM2 непосредственно связывается с доменом трансактивации p53 и ингибирует p53-опосредованную трансактивацию. Второй механизм: белок MDM2 содержит сигнальную последовательность ядерного экспорта и, связываясь с p53, индуцирует ядерный экспорт p53, предотвращая связывание p53 с целевыми ДНК. Третий механизм: белок MDM2 является убихитин-лигазой Е 2 и, связываясь с p53, способен вызывать разрушениеp53. Следовательно, действуя как мощный эндогенный клеточный ингибитор активности p53, MDM2 эффективно подавляет p53-опосредованные апоптоз, остановку клеточного цикла и репарацию ДНК(Chene, Nat. Rev. Cancer 5:102 (2003); Vassilev и at al., Science 505:844 (2004. Высокоаффинные белковые ингибиторы были успешно разработаны в прошлом (Garcia-Echeverria и at al., Med. Chem. 43:3205 (2000. Однако эти ингибиторы не могут быть лекарственными средствами вследствие низкой проницаемости клеточных мембран в отношении этих веществ и низкой биодоступности этих соединений in vivo. Несмотря на интенсивные усилия фармацевтической промышленности,успех поиска хорошо проникающих, мощных небелковых низкомолекулярных ингибиторов был очень ограничен. Следовательно, необходим небелковый, низкомолекулярный ингибитор взаимодействияMDM2 и p53, который смог бы стать лекарственным средством. Создание небелковых низкомолекулярных ингибиторов взаимодействия MDM2 и p53 в настоящее время рассматривается как привлекательная стратегия создания противоопухолевого средства (Chene,Nat. Rev. Cancer 5:102 (2003); Vassilev и at al., Science 505:844 (2004. Структурные основы этого взаимодействия изучены при помощи рентгеновской кристаллографии (Kussie и at al., Science 274:948(1996. Структура кристаллов показывает, что взаимодействие MDM2 и p53 главным образом опосредовано тремя гидрофобными остатками (Фен 19, Три 23 и Лей 26) p53 и маленькой, глубокой гидрофобной нишей в молекуле MDM2. Гидрофобная ниша является идеальным местом для воздействия низкомолекулярного ингибитора, способного нарушить взаимодействие MDM2 и p53 (Chene, Nat. Rev. Cancer 5:102(2003. Резюме изобретения Хорошо известно, что неспособность опухолевых клеток (или поддерживающих клеток) к апоптозу вследствие наличия генетических дефектов или в ответ на воздействие индукторов апоптоза, таких как противоопухолевые препараты или облучение, является основным фактором появления и прогрессии опухоли. Индукцию апоптоза опухолевых клеток или поддерживающих клеток (т.е. неоваскулярных кле-1 016145 ток в системе кровоснабжения опухоли) можно считать универсальным механизмом действия практически всех эффективных противоопухолевых лекарственных средств или облучения, применяющихся в клинической практике на сегодняшний день. Одной из причин неспособности клеток к апоптозу является уменьшение в этих клетках супрессорной активности p53, что во многом опосредовано действиемMDM2 на p53 в опухолевых клетках с функциональным p53. Подавление активности p53 приводит к повреждению механизма апоптоза, а также механизма регуляции клеточного цикла. Настоящее изобретение предполагает, что воздействие на животных с опухолевым заболеванием терапевтически эффективных концентраций препарата (препаратов) (т.е. низкомолекулярных веществ),которые увеличивают активность p53 и p53-связанных белков (т.е. p63, р 73) путем подавления взаимодействия p53 или p53-связанных белков с MDM2 или MDM2-связанными белками (т.е. MDMX), приведет к полному подавлению роста опухолевых клеток или поддерживающих клеток и/или сделает популяцию этих клеток более чувствительной к индукции клеточной смерти противоопухолевыми препаратами или облучением. В частности, ингибиторы, о которых идет речь в изобретении, могут увеличивать время полужизни p53 путем нарушения взаимодействия p53 и MDM2, которое в норме способствует разрушению p53. Настоящее изобретение предполагает, что подавление взаимодействия p53 или p53 связанных белков и MDM2 и MDM2-связанных белков соответствует потребности в лечении различных видов опухолей - как в виде монотерапии для индукции подавления клеточного роста, апоптоза и/или остановки клеточного цикла опухолевых клеток, так и в виде совместного применения с дополнительными препаратами, такими как другие препараты, индуцирующие гибель клеток или прерывающие клеточный цикл лучевой терапией (комбинированной терапией). Также предполагается, что это приводит к увеличению доли опухолевых клеток (или поддерживающих клеток), более склонных к выполнению программы апоптоза, по сравнению с соответствующей долей клеток опухоли животных, получающих лечение только одним противоопухолевым препаратом или только лучевой терапией. В определенных вариантах реализации данного изобретения комбинированная терапия животных терапевтически эффективными количествами соединения, представленного в изобретении, и другим противоопухолевым препаратом или лучевой терапией приводит к более выраженному ответу со стороны опухоли и большей клинической эффективности по сравнению с животными, которые получали лечение только этим соединением или другим противоопухолевым препаратом либо облучением по отдельности. Другими словами, данные соединения снижают порог апоптоза всех клеток, поэтому возрастает доля клеток, которые успешно выполняют программу апоптоза в ответ на повышение активности апоптоза, применение противоопухолевых препаратов или облучения. С другой стороны, соединения настоящего изобретения будут использоваться для обеспечения возможности назначения более низкой, а значит, менее токсичной и более переносимой дозы противоопухолевого препарата/облучения. Дозы всех одобренных к использованию противоопухолевых препаратов и облучения известны, и в настоящем изобретении предлагают различные комбинации этих средств с представленными соединениями. Кроме того, поскольку соединения, представленные в настоящем изобретении, могут хотя бы частично стимулировать апоптотическую и подавляющую клеточный цикл активность p53 и p53-связанных белков, воздействие на опухолевые клетки (или поддерживающие клетки) терапевтически эффективных количеств данных соединений должно совпадать во времени с попытками заставить клетки выполнять программу апоптоза в ответ на противоопухолевую или лучевую терапию. Таким образом, в некоторых вариантах реализации изобретения применение соединений, представленных в настоящем изобретении, в определенное время в связи с применением других средств предоставляет возможность особенно эффективного терапевтического воздействия. В других вариантах применения данного изобретения ингибиторы взаимодействия p53 или p53 связанных белков и MDM2 и MDM2-связанных белков могут защитить нормальные клетки от токсических эффектов определенных химиотерапевтических средств и облучения, возможно, благодаря способности ингибиторов вызывать остановку клеточного цикла. В частности, ингибиторы, представленные в данном изобретении, могут вызывать остановку клеточного цикла в клетках с p53 дикого типа, не влияя на опухолевые клетки с мутантными или отсутствующими p53. Дифференциальный защитный эффект может позволить провести более эффективное лечение опухоли благодаря применению более высоких доз и более длительного курса терапии химиотерапевтических средств или применению схем лечения без увеличения токсического побочного эффекта такого лечения. Настоящее изобретение имеет отношение к соединениям, которые могут быть использованы для подавления взаимодействия p53 или р 52-связанных белков и MDM2 и MDM2-связанных белков и для увеличения чувствительности клеток к индукторам апоптоза и/или остановки клеточного цикла. В одном из вариантов реализации изобретения соединения имеют формулу X или их фармацевтически приемлемую соль,где R1 представляет собой C6-14 арил, необязательно замещенный одной или двумя галогеногруппаR10 представляет собой атом водорода иR11 представляет собой C3-8 циклоалкил-C1-6 алкил, где указанный C3-8 циклоалкил необязательно замещен одной или двумя гидроксигруппами; или моноцикло-C3-8 гетероцикло-C1-6 алкил, где указанный моноцикло-C3-8 гетероцикло необязательно замещен одной или двумя гидроксигруппами; или дигидрокси-C1-6 алкильную группу, не содержащую гидроксильную группу в положении 3 алкильной группы; либо R10 и R11 вместе образуют моноцикло-C3-8 гетероциклогруппу, необязательно замещеннуюC1-6 алкилом. Настоящее изобретение имеет отношение к соединениям, представленным формулой X, которые являются ингибиторами взаимодействия p53 или p53-связанных белков и MDM2 и MDM2-связанных белков. Изобретение имеет отношение к применению этих соединений для индукции остановки клеточного цикла и/или апоптоза в клетках, содержащих функциональный p53 или p53-связанные белки. Изобретение также имеет отношение к использованию этих соединений для повышения чувствительности клеток к дополнительным средствам, таким как индукторы апоптоза и/или остановки клеточного цикла,а также для хемопротекции нормальных клеток путем индукции остановки клеточного цикла перед началом применения химиотерапевтических средств. В одном из вариантов реализации настоящего изобретения это изобретение имеет отношение к способам создания резистентности нормальных клеток по отношению к химиотерапевтическим препаратам или другим способам лечения, путем контакта этих клеток с соединением изобретения. В одном из вариантов реализации настоящего изобретения это изобретение имеет отношение к способам защиты нормальных клеток животных с гиперпролиферативными заболеваниями от токсических побочных эффектов химиотерапевтических препаратов или других средств лечения путем назначения этим животным соединения изобретения. В определенном варианте реализации изобретения оно направлено на лечение, уменьшение, профилактику нарушений, побочных эффектов или состояний, вызванных назначением химиотерапевтических препаратов, в нормальных неопухолевых клетках путем применения у животных, получающих химиотерапию, соединения, представленного в настоящем изобретении. К примерам таких нарушений и состояний, вызванных химиотерапией, относятся воспаление слизистых оболочек, стоматит, сухость во рту, диспепсические явления и облысение. Соединения изобретения используются для лечения, уменьшения или профилактики нарушений,вызванных индукцией апоптоза клеток, т.е. нарушений, характеризующихся нарушением регуляции апоптоза, в том числе гиперпролиферативные заболевания (опухоли). В определенных вариантах реализации данного изобретения эти соединения могут использоваться для лечения, уменьшения или профилактики опухолей, характеризующихся резистентностью к противоопухолевой терапии (т.е. опухолей с хеморезистентными, гормонрезистентными клетками, клетками, резистентными к лучевой терапии, и т.д.). В других вариантах реализации настоящего изобретения эти соединения могут использоваться для лечения гиперпролиферативных заболеваний, характеризующихся экспрессией функционального p53 или p53-связанных белков. В других вариантах реализации данного изобретения оно имеет отношение к использованию этих соединений для защиты нормальных (т.е. негиперпролиферативных) клеток от токсических побочных эффектов химиотерапевтических препаратов и других средств лечения путем индукции остановки клеточного цикла в этих клетках. Настоящее изобретение представляет лекарственные композиции, включающие соединение согласно формуле X в терапевтически эффективном количестве, необходимом для индукции апоптоза в клетках или повышения чувствительности клеток к индукторам апоптоза. Настоящее изобретение представляет наборы, включающие соединение согласно формуле X, а также инструкции по применению этого соединения у животных. Эти наборы могут включать и другие те-3 016145 рапевтические средства, т.е. противоопухолевые препараты или апоптозмодулирующие препараты. Изобретение также представляет способы получения соединений согласно формуле X. Подробное описание изобретения Настоящее изобретение имеет отношение к соединениям, соответствующим формуле X, которые являются ингибиторами взаимодействия p53 или p53-связанных белков и MDM2 или MDM2-связанных белков. Подавляя угнетающий эффект MDM2 или MDM2-связанных белков на p53 или p53-связанные белки, эти соединения увеличивают чувствительность клеток к индукторам апоптоза и/или остановки клеточного цикла, а также при некоторых обстоятельствах сами индуцируют апоптоз или остановку клеточного цикла. Следовательно, это изобретение имеет отношение к способам повышения чувствительности клеток к индукторам апоптоза и/или остановки клеточного цикла, а также к способам индукции апоптоза и/или остановки клеточного цикла, включающим контакт этих клеток с соединением, соответствующим формуле X, по отдельности или в сочетании с дополнительными агентами (индукторами апоптоза или прерывателями клеточного цикла). Изобретение также имеет отношение к способам лечения, уменьшения или профилактики нарушений у животных, вызванных индукцией апоптоза, включающим применение у животных соединения, соответствующего формуле X, и дополнительных агентов индукторов апоптоза. К таким нарушениям относятся состояния, характеризующиеся нарушением регуляции апоптоза и пролиферацией клеток, экспрессирующих функциональный p53 или p53-связанные белки. В других вариантах реализации изобретения оно имеет отношение к способам защиты нормальных (негиперпролиферативных) клеток животных от токсических побочных эффектов химиотерапевтических препаратов или способов лечения, включающим применение у животных соединения, соответствующего формуле X. Использующиеся здесь термины "противоопухолевый агент" и "противоопухолевый препарат" соответствуют всем лекарственным средствам (например, химиотерапевтическим соединениям и/или молекулярным лекарственным соединениям), способам антисмысловой терапии, лучевой терапии, хирургическим вмешательствам, которые используются при лечении гиперпролиферативных заболеваний,таких как опухолевые заболевания (например, у млекопитающих). Использующийся здесь термин "пролекарство" соответствует фармакологически неактивному производному молекулы лекарства, требующему биотрансформации (как спонтанной, так и ферментной) в целевой физиологической системе, что приведет к высвобождению или превращению (ферментному,физиологическому, механическому, электромагнитному) пролекарства в активное лекарство (активный препарат). Пролекарства создаются для преодоления проблем, связанных с устойчивостью, токсичностью, недостаточной специфичностью или ограниченной биодоступностью. Примером пролекарства является активное лекарство с защитной химической группой (т.е. группой, которая обратимо подавляет активность этого лекарства). Некоторые пролекарства являются вариантами или производными соединений, которые включают в свой состав группы, отщепляющиеся при определенных метаболических условиях. Эти пролекарства становятся фармакологически активными in vivo и in vitro при растворении в физиологических условиях, при ферментном разрушении или при других биохимических превращениях(например, фосфорилировании, гидрогенизации, дегидрогенизации, гликозилировании). Пролекарства обладают преимуществами в растворимости, тканевой совместимости или свойством замедленного высвобождения в организме млекопитающих (примеры: Bundgard, Design of Products, p. 7-9, 21-24, Elsevier,Amsterdam (1985); Silverman, The Organic Chemistry of Drug Design and Drug Action, p. 352-401, AcademicPress, San Diego, CA (1992. Часто пролекарства являются производными кислот, такими как эфиры,получающиеся при взаимодействии родительской кислоты с соответствующим спиртом (например, низшим алканолом), амиды, получающиеся при взаимодействии родительской кислоты с амином, или же представлены ацилированными производными основаниями, получающимися при соединении с основными группами (например, низшие алкиламиды). Использующийся здесь термин "фармакологически приемлемая соль" соответствует любой соли(полученной при взаимодействии с кислотой или основанием) соединения настоящего изобретения, являющейся физиологически совместимой с организмом целевого животного (например, млекопитающего). Соли соединений настоящего изобретения могут являться солями органических и неорганических кислот и оснований. К примерам кислот относятся хлороводородная, бромоводородная, серная, азотная,перхлорная, фумаровая, малеиновая, фосфорная, гликолевая, молочная, салициолвая, яблочная, толуен-рсульфоновая, винная, уксусная, лимонная, метансульфоновая, этансульфоновая, муравьиная, бензойная,малоновая, сульфоновая, нафтален-2-сульфоновая, бензенсульфоновая и другие подобные кислоты. Некоторые кислоты, такие как щавелевая, не являющиеся фармакологически приемлемыми, могут быть задействованы в получении промежуточных продуктов при синтезе соединений изобретения и их фармакологически приемлемых кислых солей. К примерам оснований относятся гидроксиды щелочных металлов (например, натрия), гидроксиды щелочно-земельных металлов (например, магния), аммиак и соединения с формулой NW4+, где W - это алкил с 1-4 атомами C, и другие подобные соединения. К примерам солей относятся ацетат, адипат, альгинат, аспартат, бензоат, бензенсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсуль-4 016145 фат, этансульфонат, фумарат, фторогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, хлорид, бромид, иодид, 2-гидроксиэтансульфонат, лактат, малеат, мезилат, метансульфонат, 2 нафталенсульфонат, никотинат, оксалат, пальмоат, пектинат, персульфат, фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат, ундеканоат и другие подобные соли. К другим примерам солей относятся анионы соединений настоящего изобретения, связанные с такими катионами,как Na+, NH4+, NW4+, где W - это алкильная группа с 1-4 атомами C, и другие подобные соли. Предполагается, что при терапевтическом использовании соли соединения настоящего изобретения являются фармакологически приемлемыми. Тем не менее, соли кислот и оснований, не являющиеся фармакологически приемлемыми, также могут оказаться полезными, например, при получении или очистке фармакологически приемлемого соединения. Использующийся здесь термин "терапевтически эффективное количество" соответствует количеству лекарственного препарата, достаточному для уменьшения проявления одного или большего числа симптомов нарушения, предотвращения прогрессирования нарушения или вызывания регрессии нарушения. Например, в отношении к лечению опухолевых заболеваний в одном из вариантов реализации изобретения терапевтически эффективное количество будет соответствовать количеству лекарственного средства, которое снижает скорость опухолевого роста, уменьшает объем опухоли, уменьшает число метастазов, увеличивает время прогрессии опухоли, увеличивает время выживания по меньшей мере на 5%,по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%,по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%,по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%,по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%,по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 100%. Использующиеся здесь термины "увеличивать чувствительность", "увеличение чувствительности" соответствуют увеличению восприимчивости клетки животного или клетки в животном организме при помощи применения первого агента (например, соединения, представленного формулой X) к биологическим эффектам второго агента (например, к стимуляции или замедлению определенных клеточных функций: деления клеток, клеточного роста, пролиферации, инвазии, ангиогенезу, некрозу или апоптозу). Эффект увеличения чувствительности первым агентом в отношении целевой клетки может быть выражен как различия между биологическим эффектом (например, стимуляцией или торможением клеточных определенных клеточных функций: клеточного роста, пролиферации, инвазии, ангиогенеза или апоптоза), наблюдаемым при применении второго агента в сочетании с первым агентом или без него. Ответ при повышении чувствительности клетки может быть увеличен по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 150%, по меньшей мере на 200%, по меньшей мере на 250%,по меньшей мере на 300%, по меньшей мере на 350%, по меньшей мере на 400%, по меньшей мере на 450%, по меньшей мере на 500% по сравнению с ответом в отсутствие первого агента. Использующийся здесь термин "нарушение регуляции апоптоза" соответствует любому отклонению от способности (например, предрасположенности) клетки к гибели через апоптоз. Нарушение регуляции апоптоза вызывается или связано с различными условиями, к которым относятся аутоиммунные расстройства (например, системная красная волчанка, ревматоидный артрит, болезнь "трансплантат против хозяина", миастения гравис, синдром Шегрена), хронические воспалительные заболевания (например, псориаз, астма или болезнь Крона), гиперпролиферативные заболевания (например, опухоли, Bклеточные лимфомы, T-клеточные лимфомы), вирусные инфекции (например, герпес, папиллома, ВИЧ) и другие состояния, такие как остеоартрит и атеросклероз. Необходимо отметить, что когда нарушение регуляции вызвано или связано с вирусной инфекцией, то эта вирусная инфекция может не определяться ко времени появления или обнаружения нарушения регуляции. Это значит, что нарушение регуляции,вызванное вирусной инфекцией, может появляться даже после исчезновения симптомов инфекции. Использующийся здесь термин "функциональный p53" соответствует p53 дикого типа, который экспрессируется в нормальных, высоких и низких количествах, а также мутантному p53, активность которого составляет по меньшей мере 5% активности p53 дикого типа, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% активности p53 дикого типа или больше. Использующийся здесь термин "p53-связанный белок" соответствует белку, который характеризуется по меньшей мере 25% гомологичностью последовательности по сравнению с p53, обладает супрессивной активностью по отношению к опухолям и подавляется при взаимодействии и MDM2 или MDM2 связанными белками. К примерам p53-связанных белков относятся p63, р 73 и некоторые другие белки. Использующийся здесь термин "MDM2-связанный белок" соответствует белку, который характеризуется по меньшей мере 25% гомологичностью последовательности по сравнению с MDM2, взаимодействует с p53 или p53-связанными белками и подавляет их активность. К примерам MDM2-связанных белков относится MDMX и HDM2, а также другие белки. Использующийся здесь термин "гиперпролиферативное заболевание" соответствует любому со-5 016145 стоянию, при котором локализованная популяция пролиферирующих клеток животного не подчиняется обычным ограничителям нормального роста. К примерам гиперпролиферативных нарушений относятся опухоли, новообразования, лимфомы и другие подобные состояния. Новообразование считается доброкачественным, если оно не является инвазивным или не образует метастазы, и злокачественным, если является инвазивным или образует метастазы. Метастатическая клетка - это клетка, которая обладает способностью к инвазии и разрушению других структур тела. Гиперплазия - эта форма клеточной пролиферации, которая заключается в увеличении числа клеток ткани или органа без значительного нарушения структуры или функции. Метаплазия - это форма контролируемого клеточного роста, при котором полностью дифференцированные клетки одного типа замещаются дифференцированными клетками другого типа. Патологический рост активированных лимфоидных клеток часто приводит к появлению аутоиммунных расстройств или хронических воспалительных заболеваний. Использующийся здесь термин "аутоиммунное расстройство" соответствует такому состоянию, при котором в организме образуются антитела или иммунные клетки к собственным молекулам, клеткам и тканям организма. К примерам таких аутоиммунных расстройств относятся аутоиммунная гемолитическая анемия, аутоиммунный гепатит,болезнь Бергера, или IgA-нефропатия, брюшной спру, синдром хронической усталости, болезнь Крона,дерматомиозит, фибромиалгия, болезнь "трансплантат против хозяина", болезнь Грэйва, тиреоидит Хашимото, идиопатическая тромбопеническая пурпура, красный плоский лишай, множественный склероз,миастения гравис, псориаз, ревматическая лихорадка, ревматический артрит, склеродерма, синдром Шегрена, системная красная волчанка, сахарный диабет I типа, язвенно-некротический колит, витилиго и другие подобные заболевания. Использующийся здесь термин "опухолевое заболевание" соответствует любому ненормальному клеточному росту как доброкачественному, так и злокачественному. Использующийся здесь термин "нормальная клетка" соответствует клетке, которая не характеризуется ненормальным клеточным ростом или делением. Нормальные клетки являются неопухолевыми и не вовлечены в гиперпролиферативное заболевание или расстройство. Использующийся здесь термин "противоопухолевый препарат" соответствует любому соединению,которое замедляет пролиферацию, рост или распространение целевой (например, злокачественной) опухоли. Использующиеся здесь термины "предотвращать", "предотвращение" или "профилактика" соответствуют заболеванию с образованием патологических клеток (например, гиперпролиферативных или опухолевых клеток) у животных. Профилактика может быть полной, например полное отсутствие патологических клеток в организме субъекта. Профилактика может также быть частичной, например, когда число патологических клеток в организме субъекта меньше по сравнению с числом клеток, которые бы образовались без этого вмешательства. Использующийся здесь термин "апоптозмодулирующие агенты" соответствует агентам, которые участвуют в модуляции (например, ингибировании, уменьшении, увеличении, способствовании, стимулировании) апоптоза. К примерам апоптозмодулирующих агентов относятся белки, которые включают в свой состав домен гибели клеток, такой как Fas/CD95, TRAMP, TNF R1, DR1, DR2, DR3, DR4, DR5, DR6,FADD и RIP, а также другие домены гибели клеток. К другим примерам апоптозмодулирующих агентов относятся TNF, лиганд Fas, антитела к Fas/CD95 и другим рецепторам семейства TNF, TRAIL (известный также как лиганд Apo2, или Apo2/TRAIL), антитела к TRAIL-R1 или TRAIL-R2, Blc-2, p53, BAX,BAD, Akt, CAD, киназа PI3, PP1 и каспазные белки. К модулирующим агентам также относятся агонисты и антагонисты рецепторов семейства TNF и лиганды семейства TNF. Апоптозмодулирующие агенты могут быть растворимыми или связанными с мембранами (например, лиганд или рецептор). К апоптозиндуцирующим агентам относятся также индукторы апоптоза, такие как TNF или TNF-связанный лиганд, в частности лиганд TRAMP, лиганд Fas/CD95, лиганд TNFR-1, или TRAIL. В одном из аспектов настоящего изобретения ингибитором взаимодействия p53 и MDM2 является соединение, соответствующее формуле X или его фармацевтически приемлемая соль,где R1 представляет собой C6-14 арил, необязательно замещенный одной или двумя галогеногруппа-6 016145 ми;R10 представляет собой атом водорода иR11 представляет собой C3-8 циклоалкил-C1-6 алкил, где указанный C3-8 циклоалкил необязательно замещен одной или двумя гидроксигруппами; или моноцикло-C3-8 гетероцикло-C1-6 алкил, где указанный моноцикло-C3-8 гетероцикло необязательно замещен одной или двумя гидроксигруппами; или дигидрокси-C1-6 алкильную группу, не содержащую гидроксильную группу в положении 3 алкильной группы; либо R10 и R11 вместе образуют моноцикло-C3-8 гетероциклогруппу, необязательно замещеннуюC1-6 алкилом. К примерам замещенных циклоалкилалкильных групп относятся алкилы C1-6, замещенные циклоалкильной группой, как это описано ниже, которая, в свою очередь, замещена одной или большим числом гидроксильных групп. К примерам гетероциклоалкильных групп относятся алкилы C1-6, замещенные моноциклогетероциклоалкильной группой, как это описано ниже. К частным примерам циклоалкилалкильных групп относятся 2-(3-гидроксициклопентил)этиламинои 3-(3-гидроксициклопентил)пропиламиногруппы. Гидроксильные группы могут иметь R- или Sконфигурации. К частным примерам замещенных гетероциклоалкильных групп относятся 2-(1 морфолинил)этиламино- и 3-(1-морфолинил)пропиламиногруппы. К частным примерам дигидроксиалкиламинных групп относятсяS-4,5 дигидроксипентиламино- и 4-гидрокси-3-(метилгидрокси)бутиламиногруппы. Ожидается, что если гидроксильная группа в 3-положении алкильной группы отсутствует, то соединение может проявлять свойства высокой устойчивости при его получении. Не ограничиваясь какойлибо теорией, высокая устойчивость может объясняться отсутствием нуклеофильной 3-гидроксигруппой,которая может замещать аминогруппу в амиде, образуя при этом 6-членное эфирсодержащее кольцо. Считается, что дигидроксиалкильные группы, не содержащие 3-гидроксигруппы, не будут вступать в такую реакцию, будут более устойчивыми и окажутся способными дать более высокий выход конечного продукта. В другом варианте реализации изобретения соединения, соответствующие формуле X, описываются формулами XI-XXVI-7 016145 Частные варианты реализации настоящего изобретения включают без ограничения следующие соединения или их фармацевтически приемлемые соли К другим частным вариантам реализации настоящего изобретения относятся без ограничения следующие соединения или их фармацевтически приемлемые соли- 27016145 К пригодным алкильным группам относятся алкильные группы C1-18 с прямой и разветвленной цепью, а именно метил, этил, пропил, изопропил, трет-бутил, втор-бутил, 3-пентил, адамантил, нормобутил и 3-гексил. К пригодным алкенильным группам относятся алкенильные группы C2-18 с прямой и разветвленной цепью, а именно этенил, пропенил, изопропенил, бутенил, изобутенил и гексенил. К пригодным алкенильным группам относятся алкенильные группы C2-18, a именно этинил, пропинил, бутенил и 2-бутинил. К пригодным циклоалкильным группам относятся циклоалкильные группы C3-8. К типичным циклоалкильным группам относятся циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. К пригодным арильным группам относятся арильные группы C6-18, а именно фенил, нафтил, фенантернил, антраценил, инденил, азуленил, бифенил, бифениленил и фторенил. К пригодным гетероарильным группам относятся тиенил, бензо[b]тиенил, нафто[2,3-b]тиенил, тиантренил, фурил, пиранил, изобензофуранил, хроменил, ксантенил, феноксантенил, 2H-пирролил, пирролил, имидазолил, пиразолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолизинил, изоиндолил, 3H-индолил, индолил, индазолил, пуринил, 4H-хинолизинил, изохинолил, хинолил, фтальзинил,нафтиридинил, хинозалинил, хиннолинил, птеридинил, карбазолил, -карболинил, фенантридинил, акридинил, перимидинил, фенантролинил, феназинил, изотиазолил, фенотиазолил, изоксазолил, фуразанил, феноксазинил, 1,4-дигидрохиноксалин-2,3-дион, 7-аминоизокумарин, пиридо[1,2-a]пиримидин-4-он,1,2-бензоизоксазол-3-ил, бензимидазолил, 2-оксиндилол и 2-оксобензимидазолил. Если гетероарильная группа содержит атом азота в кольце, то этот атом азота может участвовать в образовании N-оксида, например пиридил-N-оксида, пиразинил-N-оксида, пиримидинил-N-оксида и других подобных соединений. К пригодным гетероциклическим группам относятся моноциклические гетероциклические группы,такие как тетрагидрофуранил, пиранил, пиперидинил, пиперазинил, пирролидинил, имидазолидинил,имидазолинил, морфолинил, пиразолидинил, пиразолинил и другие подобные группы. К мультициклогетероциклическим группам относятся индолинил, изоиндилинил, хинуклидинил, хроманил, изохроманил, тетроноил, тетрагидроизохиниолинил, а также гетероциклические группы, сшитые с гетероарильным кольцом, например замещенный или незамещенный 5,6-дигидро-8H-[1,2,4]триазоло[4,3A]пиразинил. К заместителям относятся один или несколько алкилов; галоген; галогеналкил; циклоалкил; арил,замещенный или незамещенный одним или несколькими низшими алкилами, низшими алкоксигруппами, метилендиоксигруппами, галогенами, галогеналкилами, аминосульфонилами, арилами или гетероарилами; арилоксигруппа, замещенная или незамещенная одним или несколькими алкилами, низшими алкоксигруппами, метилендиоксигруппами, галогенами, галогеналкилами, аминосульфонилами, арилами или гетероарилами; аралкил; гетероарил, замещенный или незамещенный одним или несколькими алкилами, низшими алкоксигруппами, метилендиоксигруппами, галогенами, галогеналкилами, аминосульфонилами, арилами или гетероарилами; гетероарилоксигруппа, замещенная или незамещенная одним или несколькими алкилами, низшими алкоксигруппами, метилендиоксигруппами, галогенами, галогеналкилами, аминосульфонилами, арилами или гетероарилами; алкоксигруппа; алкилтиогруппа; арилтиогруппа; амидогруппа; аминогруппа; аминоалкил; алкиламиногруппа; ацилоксигруппа; арилацилоксигруппа,замещенная или незамещенная одним или несколькими алкилами, низшими алкоксигруппами, метилендиоксигруппами, галогенами, галогеналкилами, аминосульфонилами, арилами или гетероарилами; дифенилфосфенилоксигруппа, замещенная или незамещенная одним или несколькими алкилами, низшими алкоксигруппами, метилендиоксигруппами, галогенами, галогеналкилами, аминосульфонилами, арилами или гетероарилами; гетероциклическая группа, замещенная или незамещенная одним или несколькими алкилами, низшими алкоксигруппами, метилендиоксигруппами, галогенами, галогеналкилами, аминосульфонилами, арилами или гетероарилами, аминокислотнозамещенными сульфонилами, сульфонилами,замещенными производными аминокислот; гетероциклоацил, замещенный или незамещенный одним или несколькими алкилами, низшими алкоксигруппами, метилендиоксигруппами, галогенами, галогеналкилами, аминосульфонилами, арилами или гетероарилами; гетероциклоалкоксигруппа, замещенная или незамещенная одним или несколькими алкилами, низшими алкоксигруппами, метилендиоксигруппами, галогенами, галогеналкилами, аминосульфонилами, арилами или гетероарилами; частично ненасыщенный гетероциклоалкил, замещенный или незамещенный одним или несколькими алкилами, низшими алкоксигруппами, метилендиоксигруппами, галогенами, галогеналкилами, аминосульфонилами,арилами или гетероарилами; частично ненасыщенная гетероциклоалкилоксигруппа, замещенная или незамещенная одним или несколькими алкилами, низшими алкоксигруппами, метилендиоксигруппами,галогенами, галогеналкилами, аминосульфонилами, арилами или гетероарилами. Определенные соединения настоящего изобретения могут существовать в виде стереоизомеров, в том числе и оптических изомеров. Изобретение включает все стереоизомеры как чистые отдельные препараты стереоизомеров, так и обогащенные каждым изомером препараты, а также рацемические смеси таких стереоизомеров и отдельные энантиомеры, которые можно разделить хорошо известными специалистам способами.- 28016145 Соединения и способы настоящего изобретения становятся более понятными при помощи следующих схем синтеза, которые иллюстрируют способы получения соединений изобретения. Исходные материалы могут быть получены в виде коммерческих препаратов или получены по способам, представленным в литературе и известным специалистам. Специалистам в данной области совершенно ясно, что соединения, о которых шла речь выше, могут быть синтезированы при замене соответствующих реагентов в синтезах, приведенных ниже. Соединения, имеющие общую структуру, соответствующую формуле X, синтезируются с использованием асимметрического 1,3-диполярного циклоприсоединения в качестве ключевого этапа (схема 1). Схема 1 Реагенты и условия: a) CH2Cl2-CH2-CH3CN, KF-Al2O3, микроволны или орошение метанолом, пиперидином; b) молекулярные сита 4, толуен, 70C; с) амин, r.t.; d) Pb(OAc)4, CH2-Cl2-MeOH (1:1), 0C или аммония церия(IV) нитрат (CAN), CH3CN, K2CO3, r.t. Один из аспектов изобретения имеет отношение к способам получения ингибитора MDM2. В одном из вариантов реализации изобретения оно имеет отношение к способам получения соединения с формулой X, представленным:a) конденсированием соединения с формулой 1 и соединения с формулой 2, например, в растворителе или смеси растворителей (например, CH2Cl2 и CN3CN) в присутствии микроволн и катализатора(например, молекулярного сита 4) при повышенной температуре (например, около 70C), что приводит к образованию соединения с формулой 6; иc) обработкой соединения с формулой 6 окислителем (например, Pb(OAc)4, аммония серия нитратом) в растворителе или смеси растворителей (например, CH2Cl2 и MeOH, CH3CN) при подходящей температуре (например, около 0C или комнатная температура), что приводит к образованию соединения с формулой X.
МПК / Метки
МПК: A61K 31/407, A61K 31/497, C07D 209/96, C07D 211/06, A61P 35/00, A61K 31/5377
Метки: новые, применение, ингибиторы, низкомолекулярные
Код ссылки
<a href="https://eas.patents.su/30-16145-novye-nizkomolekulyarnye-ingibitory-mdm2-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Новые низкомолекулярные ингибиторы mdm2 и их применение</a>
Предыдущий патент: Способ получения гранулированного диаммонийфосфата
Следующий патент: Гербицидное средство, способ борьбы с нежелательным ростом растений и применение
Случайный патент: Применение фармацевтической композиции, содержащей цинк-гиалуроновый комплекс, для предотвращения и лечения цистита, способ и набор












