Соединения для лечения гепатита с
Номер патента: 15978
Опубликовано: 30.01.2012
Авторы: Джентлс Роберт Дж., Енг Кап-Сан, Бергстрём Карл П., Мартин Скотт У.
Формула / Реферат
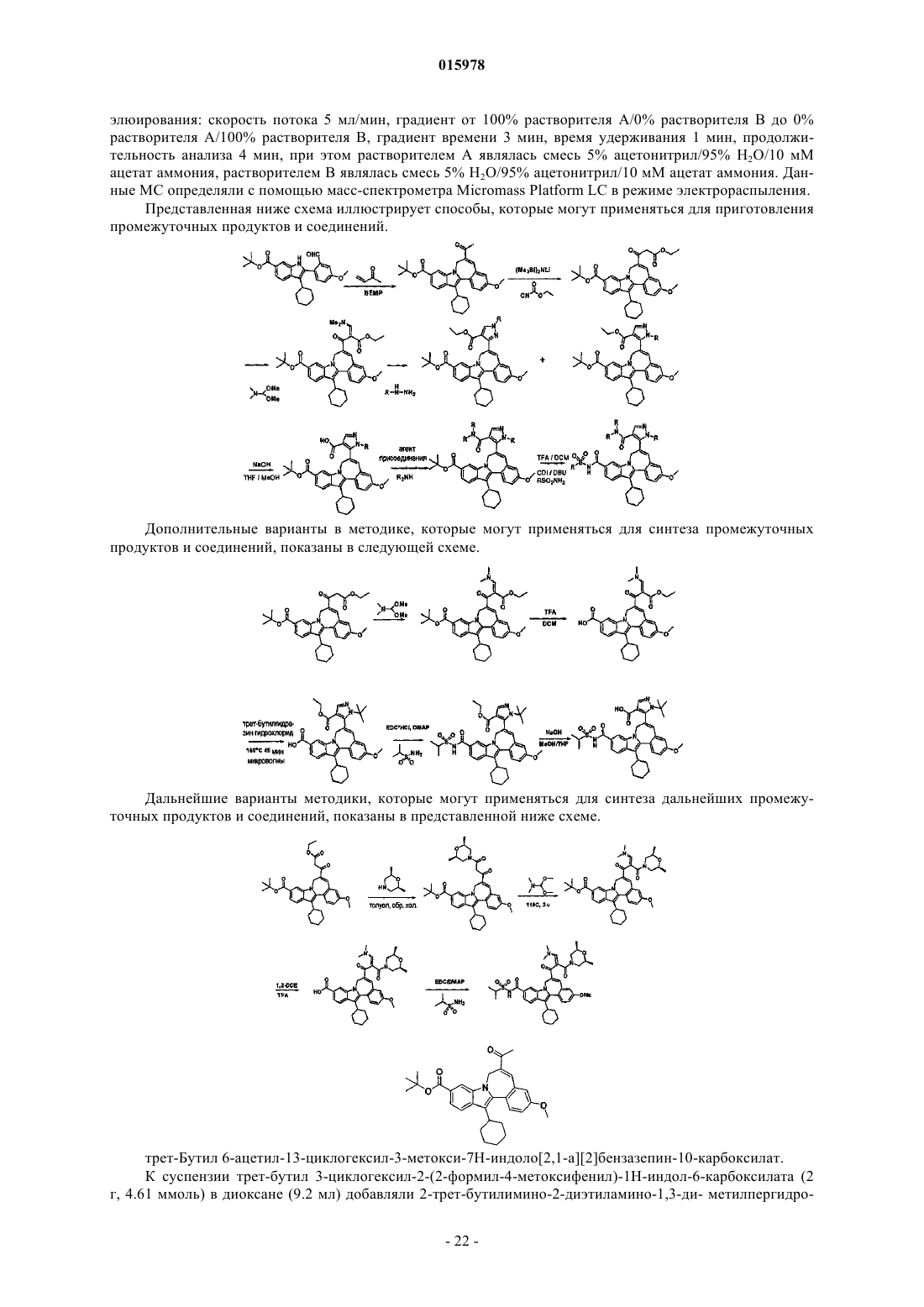
1. Соединение формулы I
в которой
R1 представляет собой CO2R5 или CONR6R7;
R2 представляет собой фуранил, пирролил, тиенил, пиразолил, изоксазолил, изотиазолил, имидазолил, оксазолил, тиазолил, оксадиазолил, триазолил или тетразолил и является замещенным 0-2 заместителями, выбранными из оксо, амино, С1-С6алкилтио, С1-С6алкила и галогенС1-С6алкила, и 1 заместителем, выбранным из CO2R5, CON(R12)2 и COR13;
R3 представляет собой водород, галогено, С2-С6алкенил, гидрокси, бензилокси или С1-С6алкокси;
R4 представляет собой С3-С7циклоалкил;
R5 представляет собой водород или С1-С6алкил;
R6 представляет собой водород, С1-С6алкил, С1-С6алкилSO2, С3-С7циклоалкилSO2, галогенС1-С6алкилSO2, (R9)(R10)NSO2 или (R11)SO2;
R7 представляет собой водород или С1-С6алкил;
R8 представляет собой водород, С1-С6алкил, С3-С7циклоалкил, (С3-С7циклоалкил)С1-С6алкил, C1-С6алкилкарбонил, C3-C7циклоалкилкарбонил, галогенС1-С6алкилкарбонил, С1-С6алкоксикарбонил, C1-С6алкилSO2, С3-С7циклоалкилSO2, галогенС1-С6алкилSO2, аминокарбонил, (С1-С6алкиламино)карбонил, (диС1-С6алкиламино)карбонил, бензил, бензилоксикарбонил или пиридинил;
R9 представляет собой водород или С1-С6алкил;
R10 представляет собой водород или С1-С6алкил;
R11 представляет собой азетидинил, пирролидинил, пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил, гомопиперазинил или гомоморфолинил и является замещенным 0-1 С1-С6алкильными заместителями;
R12 представляет собой водород, С1-С6алкил, С1-С6алкоксиС1-С6алкил, аминоС1-С6алкил, (C1-С6алкиламино)С1-С6алкил, (диС1-С6алкиламино)С1-С6алкил или (R11)C1-С6алкил;
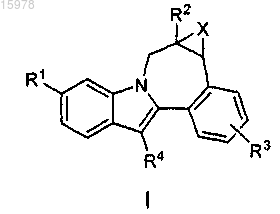
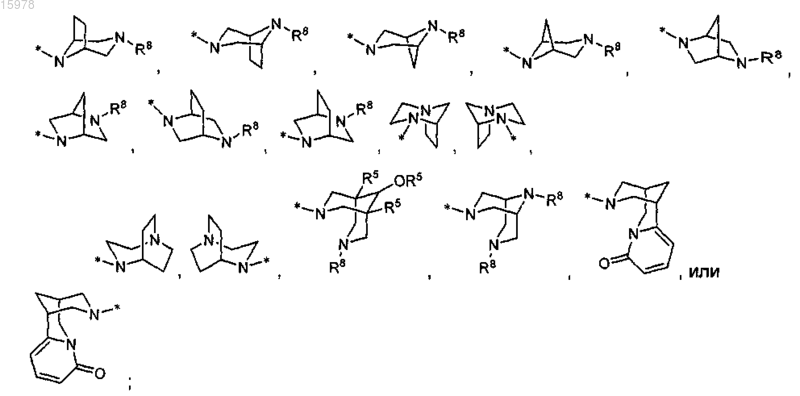
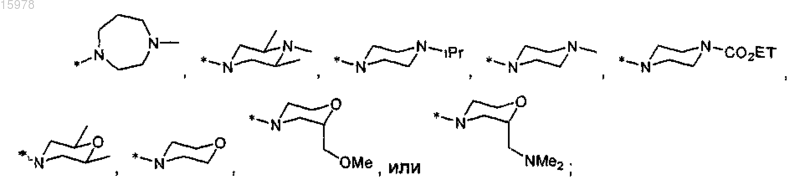
R13 представляет собой азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил, гомопиперазинил или гомоморфолинил и является замещенным 0-3 заместителями, выбранными из С1-С6алкила, С1-С6алкоксиС1-С6алкила, амино, C1-С6алкиламино, диС1-С6алкиламино, R11, аминоС1-С6алкила, (С1-С6алкиламино)C1-С6алкила, (диС1-С6алкиламино)С1-С6алкила, (R11)С1-С6алкилаилиCO2R5;
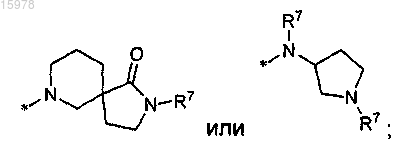
или R13 представляет собой
или R13 представляет собой
или R13 представляет собой [4.3.0] или [3.3.0] бициклический диамин, присоединенный к карбонилу посредством одного атома азота, и является замещенным 0-2 R8 заместителями;
или R13 представляет собой
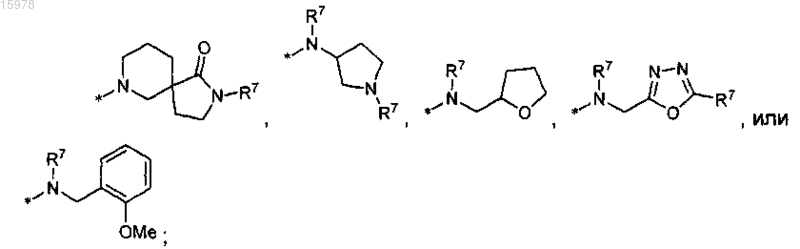
R14 представляет собой водород, С1-С6алкил, С3-С7циклоалкил, (С3-С7циклоалкил)С1-С6алкил, аминоС1-С6алкил, (С1-С6алкиламино)С1-С6алкил, (диС1-С6алкиламино)С1-С6алкил или бензил;
R15 представляет собой водород, С1-С6алкил, С3-С7циклоалкил, (С3-С7циклоалкил)С1-С6алкил, аминоС1-С6алкил, (С1-С6алкиламино)С1-С6алкил, (диС1-С6алкиламино)С1-С6алкил или бензил;
или NR14R15, взятые вместе, представляют собой азетидинил, пирролидинил, пиперидинил, пиперазинил, N-(алкил)пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил или гомоморфолинил;
R16 представляет собой водород или С1-С6алкил;
R17 представляет собой водород, С1-С6алкил или С3-С7циклоалкил; и
X является метиленом, связью или отсутствует;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором
R2 представляет собой фуранил, пирролил, тиенил, пиразолил, изоксазолил, изотиазолил, имидазолил, оксазолил, тиазолил, оксадиазолил, триазолил или тетразолил и являются замещенными 0-2 заместителями, выбранными из оксо, амино, С1-С6алкила и галогенС1-С6алкила и 1 заместителем, выбранным из CO2R5, CON(R12)2 и COR13; и
R13 представляет собой азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил, гомопиперазинил или гомоморфолинил и является замещенным 0-3 заместителями, выбранными из С1-С6алкила, С1-С6алкоксиС1-С6алкила, амино, С1-С6алкиламино, диС1-С6алкиламино, R11, аминоС1-С6алкила, (С1-С6алкиламино)С1-С6алкила, (диС1-С6алкиламино)С1-С6алкила, (R11)С1-С6алкила или CO2R5;
или R13 представляет собой
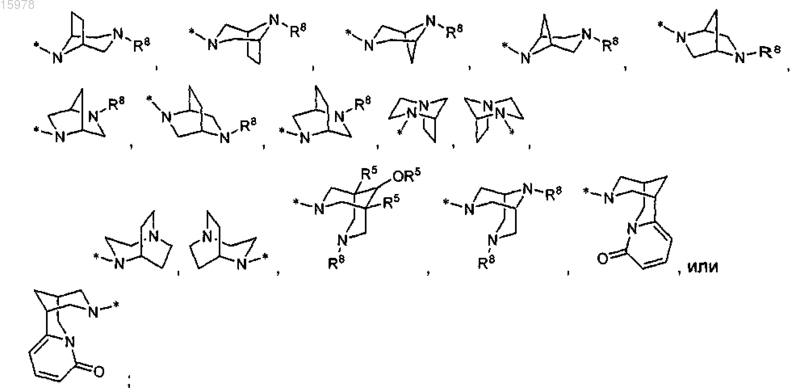
или R13 представляет собой

или R13 представляет собой [4.3.0] или [3.3.0] бициклический диамин, присоединенный к карбонилу посредством одного атома азота и является замещенным 0-2 R8 заместителями,
или R13 представляет собой
или его фармацевтически приемлемая соль.
3. Соединение по п.1, в котором
R2 представляет собой фуранил, пирролил, тиенил, пиразолил, оксазолил, тиазолил, изоксазолил, изотиазолил, оксадиазолил, триазолил или тетразолил и является замещенными 0-2 заместителями, выбранными из оксо, амино, С1-С6алкила, и 1 заместителем, выбранным из CO2R6, CON(R12)2 и COR13,
R11 представляет собой азетидинил, пирролидинил, пиперидинил, пиперазинил, N-C1-С6алкилпиперазинил, морфолинил, тиоморфолинил, гомопиперидинил, гомопиперазинил или гомоморфолинил; и
R13 представляет собой азетидииил, пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил, гомопиперазинил или гомоморфолинил и является замещенным 0-3 заместителями, выбранными из С1-С6алкила, амино, С1-С6алкиламино, диС1-С6алкиламино, R11, аминоС1-С6алкила, (С1-С6алкиламино)С1-С6алкила, (диС1-С6алкиламино)С1-С6алкила, (R11)С1-С6алкила;
или его фармацевтически приемлемая соль.
4. Соединение по п.1, в котором R1 представляет собой CONR6R7; R6 представляет собой C1-С6алкилSO2, С3-С7циклоалкилSO2, галогенС1-С6алкилSO2, (R9)(R10)NSO2 или (R11)SO2; и R7 является водородом.
5. Соединение по п.1, в котором R3 представляет собой водород.
6. Соединение по п.1, в котором R3 представляет собой метокси.
7. Соединение по п.1, в котором R4 представляет собой циклогексил.
8. Соединение по п.1, в котором R6 представляет собой С1-С6алкилSO2, С3-С7циклоалкилSO2, (R9)(R10)NSO2 или (R11)SO2.
9. Соединение по п.1, в котором R2 представляет собой пиразолил, замещенный 2 заместителями, выбранными из С1-С6алкила и галогенС1-С6алкила и 1 COR13 заместителя;
R13 представляет собой
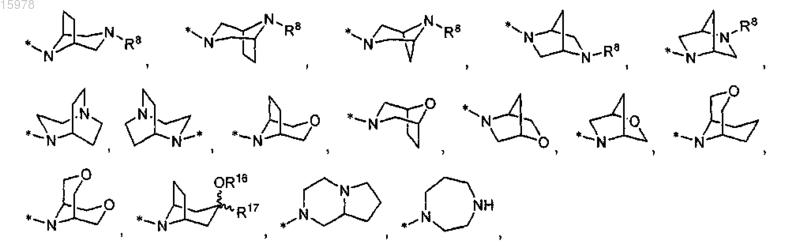
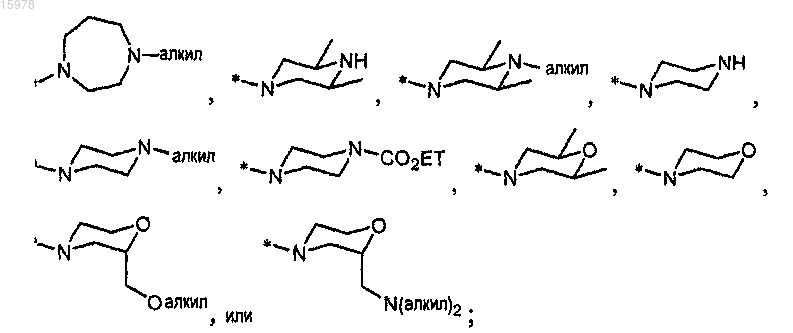
R8 представляет собой водород или С1-С6алкил;
R16 представляет собой водород или С1-С6алкил и
R17 представляет собой С1-С6алкил;
или его фармацевтически приемлемая соль.
10. Соединение по п.1, в котором X является метиленом.
11. Соединение по п.1, в котором X отсутствует.
12. Соединение по п.1, в котором X является связью.
13. Соединение по п.12, в котором R1 представляет собой CONR6R7;
R2 представляет собой пиразолил, замещенный 2 заместителями, выбранными из С1-С6алкила и галогенС1-С6алкила, и 1 COR13 заместителя, в котором R13 представляет собой
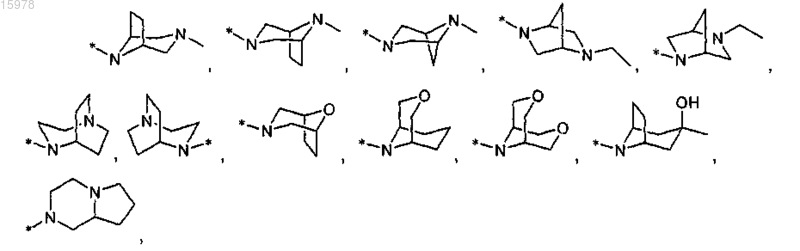
R3 представляет собой водород или метокси;
R4 представляет циклогексил;
R6 представляет собой С1-С6алкилSO2, С3-С7циклоалкилSO2, галогенС1-С6алкилSO2, (R9)(R10)NSO2, или (R11)SO2; и R7 представляет собой водород; или его фармацевтически приемлемая соль.
14. Соединение по п.1, выбранное из группы, состоящей из следующих соединений:
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-3-метокси-6-[2-(метосикарбонил)-3-тиенил]-, 1,1-диметилэтиловый эфир;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 6-(4-карбокси-1-метил-1H-пиразол-5-ил)-13-циклогексил-3-метокси-;
7H-инодоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-(1,4-диазабицикло[3.2.2]нон-4-илкарбонил)-1-метил-1H- пиразол-5-ил]-3-метокси-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-[(1R,5S)-8-метил-3,8-диазабицикло[3.2.1]окт-3-ил]карбонил]-1H-пиразол-5-ил]-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(1S,4S)-5-этил-2,5-диазабицикло[2.2.1]гепт-2-ил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-3-метокси-6-[4-(метоксикарбонил)-6-илиазолил]-, 1,1-диметилэтиловый эфир;
3-тиофенкарбоновая кислота, 2-[13-циклогексил-3-метокси-10-[[[(1-метилэтил)сульфонил]амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-(1-метилэтил)-4-[(3,4,5-триметил-1-пиперазинил)карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[[(1R,5S)-3-метил-3,8-диазабицикло[3.2.1]окт-8-ил]карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-3-метокси-6-[4-(метоксикарбонил)-1,3-диметил-1H-пиразол-5-ил]-, 1,1-диметилэтиловый эфир;
1H-пиразол-4-карбоновая кислота, 5-[13-циклогексил-3-метокси-10-[[[(2-метилпропил)сульфонил]амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-1,3-диметил-;
1H-пиррол-3-карбоновая кислота, 2-[13-циклогексил-3-метокси-10-[[[(1-метилэтил)сульфонил]амино]карбонил]-7H-индоло[2,1-а][2]бензазепин-6-ил]-1-(1-метилэтил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[(8-метил-3,8-диазабицикло[3.2.1]окт-3-ил)карбонил]-1-(2,2,2-трифторэтил)-1H-пиразол-5-ил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-4-(4-морфолинилкарбонил)-3-(трифторметил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[[(2S)-2-(метоксиметил)-4-морфолинил]карбонил]-1-метил-3-(трифторметил)-1H-пиразол-5-ил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-4-[(4-метил-1-пиперазинил)карбонил]-3-(трифторметил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(1S,4S)-5-этил-2,5-диазабицикло [2.2.1]гепт-2-ил]карбонил]-1-метил-3-(трифторметил)-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[1-этил-3-метил-4-(8-окса-3-азабицикло [3.2.1]окт-3-илкарбонил)-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-[(диметиламино)сульфонил]-3-метокси-6-[1-метил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[2-[(диметиламино)карбонил]-3-тиенил]-N-[(диметиламино)сульфонил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-3-метокси-6-[4-(метоксикарбонил)-5-оксазолил]-, 1,1-диметилэтиловый эфир;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-3-метокси-6-[4-(4-морфолинилкар=бонил)-5-оксазолил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-(4-морфолинилкарбонил)-5-оксазолил]-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-[[метил(1-метил-3-пирролидинил)амино]карбонил]-1H-пиразол-5-ил]-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[2-[(диметиламино)метил]-4-морфолинил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-[[(1R,5S)-3-метил-3,8-диазабицикло[3.2.1]окт-8-ил]карбонил]-1H-пиразол-5-ил]-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-(3,7-диокса-9-азабицикло[3.3.1]нон-9-илкарбонил)-1-метил-1H-пиразол-5-ил]-3-метокси-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-4-[[4-(1-метилэтил)-1-пиперазинил]карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-4-[[4-(1-пирролидинил)-1-пиперидинил]карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[[(2S)-2-(метоксиметил)-4-морфолинил]карбонил]-1-метил-1H-пиразол-5-ил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-4-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[3-(диметиламино)-1-пиперидинил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-1H-пиразол-5-ил]-N-[(1-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-(3,7-диокса-9-азабицикло[3.3.1]нон-9-илкарбонил)-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[(гексагидропирроло[1,2-а]пиразин-2(1H)-ил)карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[[2-(метоксиметил)-4-морфолинил]карбонил]-1-метил-1H-пиразол-5-ил]-N-[(1-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-(циклопентилсульфонил)-3-метокси-6-[1-метил-4-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-1H-пиразол-5-ил]-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-(3,7-диокса-9-азабицикло[3.3.1]нон-9-илкарбонил)-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, N-(циклобутилсульфонил)-13-циклогексил-3-метокси-6-[1-метил-4-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[(8-метил-3,8-диазабицикло[3.2.1]окт-3-ил)карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-(3,7-диокса-9-азабицикло[3.3,1]нон-9-илкарбонил)-1-(1-метилэтил)-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[1-циклопропил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
1H-пиррол-3-карбоновая кислота, 2-[13-циклогексил-3-метокси-10-[[[(1-метилэтил)сульфонил]амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-, этиловый эфир;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-4-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-3-(трифторметил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[1-(1,1-диметилэтил)-4-[[(3R,5S)-3,4,5-триметил-1-пиперазинил]карбонил]-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-[(диметиламино)сульфонил]-3-метокси-6-[2-(4-морфолинилкарбонил)-3-тиенил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[1-этил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-[(диметиламино)сульфонил]-6-[1-этил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 6-[4-(7-азабицикло[2.2.1]гепт-7-илкарбонил)-1-метил-1H-пиразол-5-ил]-13-циклогексил-3-метокси-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1 -метил-4-[(4-метил-1-пиперазинил)карбонил]-1H-пиразол-5-ил]-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[3-(диметиламино)-1-пирролидинил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 6-[4-(7-азабицикло[2.2.1]гепт-7-илкарбонил)-1-метил-1H-пиразол-5-ил]-13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-4-[(8-метил-3,8-диазабицикло[3.2.1]окт-3-ил)карбонил]-1H-пиразол-5-ил]-;
1H-пиразол-4-карбоновая кислота, 5-[10-[[(циклобутилсульфонил)амино]карбонил]-13-циклогексил-3-метокси-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-метил-, этиловый эфир;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-(циклопентилсульфонил)-6-[4-[[3-(диметиламино)-1-пиперидинил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-(циклопентилсульфонил)-6-[4-[(гексагидропирроло[1,2-а]пиразин-2(1H)-ил)карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-;
1H-пиразол-4-карбоновая кислота, 5-[13-циклогексил-3-метокси-10-[[[(2-метилпропил)сульфонил]амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-метил-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[[(2S)-2-(метоксиметил)-4-морфолинил]карбонил]-1-метил-1H-пиразол-5-ил]-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[3-(диметиламино)-1-пиперидинил]карбонил]-1-метил-1Н-пиразол-5-ил]-3-метокси-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-(циклопентилсульфонил)-3-метокси-6-[1-метил-4-(3-окса-9-азабицикло[3.3.1]нон-9-илкарбонил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(1R,4R)-5-этил-2,5-диазабицикло [2.2.1]гепт-2-ил]карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-3-метокси-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-(1-метилэтил)-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[(3-метил-8-азабицикло [3.2.1]окт-2-ен-8-ил)карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-N-[(1-метилэтил)сульфонил]-;
1H-пиразол-4-карбоновая кислота, 5-[13-циклогексил-10-[[(диметиламино)сульфонил]амино]карбонил]-3-метокси-7H-индоло[2,1-a][2]бензазепин-6-ил]-1,3-диметил-, метиловый эфир;
1H-пиразол-4-карбоновая кислота, 5-[13-циклогексил-3-метокси-10-[[[(1-метилэтил)сульфонил]амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-1,3-диметил-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[4-(4-морфолинилкарбонил)-1-(2,2,2-трифторэтил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-1-(2,2,2-трифторэтил)-1H-пиразол-5-ил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-(2,2,2-трифторэтил)-4-[[(3R,5S)-3,4,5-триметил-1-пиперазинил]карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-3-метил-1-(1-метилэтил)-1H-пиразол-5-ил]-3-метокси-H-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[3-метил-1-(1-метилэтил)-4-[(4-метил-1-пиперазинил)карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[3-метил-1-(1-метилэтил)-4-[[(3R,5S)-3,4,5-триметил-1-пиперазинил]карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-1-этил-3-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-3-метокси-6-[1-метил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-3-метокси-6-[1-(1-метилэтил)-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-[(3-метил-3,8-диазабицикло[3 2.1]окт-8-ил)карбонил]-1H-пиразол-5-ил]-N-(1-пирролидинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[4-(4-морфолинилкарбонил)-5-оксазолил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[1-этил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-3-метокси-N-(1-пирролидинилсульфонил)-морфолин;
4-[[13-циклогексил-6-[1-этил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-3-метокси-7H-индоло[2,1-a][2]бензазепин-10-ил]карбонил]-;
1H-пиразол-4-карбоновая кислота, 5-[13-циклогексил-3-метокси-10-[[[(1-метилэтил)сульфонил]амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-метил-,этиловый эфир;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[(гексагидро-4-метил-1H-1,4-диазепин-1-ил)карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-(4-морфолинилсульфонил)-;
1-пиперазинкарбоновая кислота, 4-[[5-[13-циклогексил-3-метокси-10-[[(4-морфолинилсульфонил)амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-метил-1H-пиразол-4-ил]карбонил]-, этиловый эфир;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-[[4-(1-пирролидинил)-1-пиперидинил]карбонил]-1H-пиразол-5-ил]-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[[(2S)-2-(метоксиметил)-4-морфолинил]карбонил]-1-метил-1H-пиразол-5-ил]-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-(3,7-диокса-9-азабицикло[3.3.1]нон-9-илкарбонил)-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[[[(2-метоксифенил)метил](1-метилэтил)амино]карбонил]-1-метил-1H-пиразол-5-ил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-(циклопентилсульфонил)-6-[4-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-(циклопентилсульфонил)-6-[4-[[(18,48)-5-этил-2,5-диазабицикло[2.2.1]гепт-2-ил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-(3-окса-9-азабицикло[3.3.1]нон-9-илкарбонил)-1H-пиразол-5-ил]-N-[(1-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, N-(циклобутилсульфонил)-13-циклогексил-3-метокси-6-[1-метил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-(3,7-диокса-9-азабицикло[3.3.1]нон-9-илкарбонил)-1-(1-метилэтил)-1H-пиразол-5-ил]-3-метокси-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-(1-метилэтил)-4-[[(3R,5S)-3,4,5-триметил-1-пиперазинил]карбонил]-1H-пиразол-5-ил]-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[[(2S)-2-(метоксиметил)-4-морфолинил]карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-N-[(1-метилэтил)сульфонил]-;
1H-пиразол-4-карбоновая кислота, 5-[13-циклогексил-3-метокси-10-[[[(2-метилпропил)сульфонил]амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-1,3-диметил-, метиловый эфир;
1H-пиразол-4-карбоновая кислота, 5-[13-циклогексил-3-метокси-10-[[[(1-метилэтил)сульфонил]амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-1,3-диметил-, метиловый эфир;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[1,3-диметил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-3-метокси-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[3-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-1-(1-метилэтил)-1H-пиррол-2-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогеисил-3-метокси-6-[1-(1-метилэтил)-3-(4-морфолинилкарбонил)-1H-пиррол-2-ил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[[(2S)-2-(метоксиметил)-4-морфолинил]карбонил]-1-(2,2,2-трифторэтил)-1H-пиразол-5-ил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[(3-гидрокси-3-метил-8-азабицикло[3.2.1]окт-8-ил)карбонил]-1-(2,2,2-трифторэтил)-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-[(диметиламино)сульфонил]-3-метокси-6-[4-(4-морфолинмлкарбонил)-5-оксазолил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[(гексагидропирроло[1,2-а]пиразин-2(1H)-ил)карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(1S,4S)-5-этил-2,5-диазабицикло[2.2.1]гепт-2-ил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[[2-(диметиламино)этил]метиламино]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[(гексагидропирроло[1,2-а]пиразин-2(1H)-ил)карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
1H-пиразол-4-карбоновая кислота, 5-[13-циклогексил-3-метокси-10-[[[(2-метилпропил)сульфонил]амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-метил-, этиловый эфир;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[[(5-этил-1,3,4-оксадиазол-2-ил)метил](1-метилэтил)амино]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-N-[(1-метилпропил)сульфонил]-;
1H-пиразол-4-карбоновая кислота, 5-[10-[[(циклобутилсульфонил)амино]карбонил]-13-циклогексил-3-метокси-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-метил-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-(циклопентилсульфонил)-6-[4-(3,7-диокса-9-азабицикло[3.3 1]нон-9-илкарбонил)-1-метил-1H-пиразол-5-ил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(2-метилпропил)сульфонил]-6-[1-метил-4-[[(3R,5S)-3,4,5-триметил-1-пиперазинил]карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[(2,6-диметил-4-морфолинил)карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[(3-метил-8-азабицикло [3.2.1]окт-2-ен-8-ил)карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[3-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-1-(1-метилэтил)-1H-пиррол-2-ил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-(1-метилэтил)-3-[(4-пропил-1-пиперазинил)карбонил]-1H-пиррол-2-ил]-N-[(1-метилэтил)сульфонил]-;
3-фуранкарбоновая кислота, 2-[13-циклогексил-3-метокси-10-[[[(1-метилэтил)сульфонил]амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-, этиловый эфир;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-4-[(8-метил-3,8-диазабицикло[3.2.1]окт-3-ил)карбонил]-3-(трифторметил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-[(диметиламино)сульфонил]-3-метокси-6-[1-метил-4-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-[(диметиламино)сульфонил]-3-метокси-6-[1-(1-метилэтил)-4-(4-марфолинилкарбонил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 6-(4-карбокси-5-оксазолил)-13-циклогексил-3-метокси-, 10-(1,1-диметилэтил) эфир;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[1-этил-4-[(4-метил-1-пиперазинил)карбонил]-1H-пиразол-5-ил]-3-метокси-N-(1-пирролидинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[1-этил-4-[(4-метил-1-пиперазинил)карбонил]-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-(циклопропилсульфонил)-3-метокси-6-[4-(4-морфолинилкарбонил)-5-оксазолил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(3-ендо)-3-гидрокси-3-метил-8-азабицикло[3.2.1]окт-8-ил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-4-[(4-метил-1-пиперазинил)карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-4-[[(3R,5S)-3,4,5-триметил-1-пиперазинил]карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-(циклопентилсульфонил)-6-[4-[[этил(1-метилэтил)амино]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-(3-окса-9-азабицикло[3,3.1]нон-9-илкарбонил)-1H-пиразол-5-ил]-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[(5-этил-2,5-диазабицикло[2.2.1]гепт-2-ил)карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, N-(циклобутилсульфонил)-13-циклогексил-6-[4-[[3-(диметиламино)-1-пиперидинил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-4-[[(1-метилэтил)[(тетрагидро-2-фуранил)метил]амино]карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[[(1R,5S)-8-метил-3,8-диазабицикло[3.2.1]окт-3-ил]карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[[(2S)-2-(метоксиметил)-4-морфолинил]карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-3-метокси-8-[4-(метоксикарбонил)-1,3-диметил-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[1,3-диметил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-1-(2,2,2-трифторэтил)-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(1S,4S)-5-этил-2,5-диазабицикло[2.2.1]гепт-2-ил]карбонил]-1-(2,2,2-трифторэтил)-1H-пиразол-5-ил]-3-метокси-N-[(1-мутилэтил)сульфонил]-;
7Н-индоло[2,1-а][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-1-метил-3-(трифторметил)-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-3-(трифторметил)-4-[[(3R,5S)-3,4,5-триметил-1-пиперазинил]карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][21бензазепин-10-карбоксамид, 13-циклогексил-N-(циклопропилсульфонил)-3-метокси-6-[1-метил-4-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-3-метокси-6-[4-(4-морфолинилкарбонил)-5-оксазолил]-, 1,1-диметилэтиловый эфир;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[4-(этоксикарбонил)-1-метил-1H-пиразол-5-ил]-3-метокси-, 1,1-диметилэтиловый эфир;
1H-пиразол-4-карбоновая кислота, 5-[13-циклогексил-3-метокси-10-[[[(1-метилэтил)сульфонил]амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-метил-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[3-(диметиламино)-1-пирролидинил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-[(1-оксо-2,7-диазаспиро[4.5]дек-7-ил)карбонил]-1H-пиразол-5-ил]-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[[(2-метоксиэтил)(1-метилэтил)амино]карбонил]-1-метил-1H-пиразол-5-ил]-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-[[(3R,5S)-3,4,5-триметил-1-пиперазинил]карбонил]-1H-пиразол-5-ил]-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[[(2-метоксиэтил)(1-метилэтил)амино]карбонил]-1-метил-1H-лиразол-5-ил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(3-ендо)-3-гидрокси-3-метил-8-азабицикло[3.2.1]окт-8-ил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[(диметиламино)карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-(циклопентилсульфонил)-3-метокси-6-[1-метил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(1S,4S)-5-этил-2,5-диазабицикло[2.2.1]гепт-2-ил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[3-(диметиламино)-1-пиперидинил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-(циклопентилсульфонил)-3-метокси-6-[1-метил-4-[[(3R,5S)-3,4,5-триметил-1-пиперазинил]карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, N-(циклобутилсульфонил)-13-циклогексил-6-[4-[[(1S,4S)-5-этил-2,5-диазабицикло[2.2.1]гепт-2-ил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, N-(циклобутилсульфонил)-13-циклогексил-6-[4-[(гексагидропирроло[1,2-а]пиразин-2(1H)-ил)карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-(1-метилэтил)-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[4-[(3-метил-3,6-диазабицикло[3.1.1]гепт-6-ил)карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-3-метокси-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(3-ендо)-3-гидрокси-3-метил-8-азабицикло[3.2.1]окт-8-ил]карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-3-метокси-N-[(1-метил этил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(3-ендо)-3-гидрокси-3-метил-8-азабицикло[3.2.1]окт-8-ил]карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-3-метокси-N-[(2-метилпропил)сульфонил]-;
1H-пиррол-3-карбоновая кислота, 2-[13-циклогексил-3-метокси-10-[[[(1-метилэтил)сульфонил]амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-(1-метилэтил)-, этиловый эфир;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[4-(3-окса-9-азабицикло[3.3.1]нон-9-илкарбонил)-1-(2,2,2-трифторэтил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-а][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-1,3-диметил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[1-(1,1-диметилэтил)-4-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-4-(8-окса-3-азабицикло[3.2.1]окт-3-илкарбонил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-4-(8-окса-3-азабицикло[3.2.1]окт-3-илкарбонил)-3-(трифторметил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[3-метил-1-(1-метилэтил)-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-3-метокси-6-[1-метил-4-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[4-(этоксикарбонил)-1-метил-1H-пиразол-5-ил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-[[4-(1-метилэтил)-1-пиперазинил]карбонил]-1H-пиразол-5-ил]-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[3-(диметиламино)-1-пиперидинил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-[[2-(1-пиперидинилметил)-1-пирролидинил]карбонил]-1H-пиразол-5-ил]-N-(4-морфолинилсульфонил)-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[1-метил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 6-[4-[[[2-[бис(1-метилэтил)амино]этил](1-метилэтил)амино]карбонил]-1-метил-1H-пиразол-5-ил]-13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-(циклопентилсульфонил)-3-метокси-6-[4-[[(2S)-2-(метоксиметил)-4-морфолинил]карбонил]-1-метил-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилпропил)сульфонил]-6-[1-метил-4-[(3,4,5-триметил-1-пиперазинил)карбонил]-1H-пиразол-5-ил]-;
1H-пиразол-4-карбоновая кислота, 5-[13-циклогексил-3-метокси-10-[[[(1-метилпропил)сульфонил]амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-метил-, этиловый эфир;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[(гексагидропирроло[1,2-а]пиразин-2(1H)-ил)карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[1-метил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-N-[(2-метилпропил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, N-(циклобутилсульфонил)-13-циклогексил-3-метокси-6-[1-метил-4-[[(3R,5S)-3,4,5-триметил-1-пиперазинил]карбонил]-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, N-(циклобутилсульфонил)-13-циклогексил-3-метокси-6-[1-метил-4-(3-окса-9-азабицикло[3.3.1]нон-9-илкарбонил)-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, N-(циклобутилсульфонил)-13-циклогексил-6-[4-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-1-метил-1H-пиразол-5-ил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, N-(циклобутилсульфонил)-13-циклогексил-6-[4-(3,7-диокса-9-азабицикло[3.3.1]нон-9-илкарбонил)-1-метил-1H-пиразол-5-ил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, N-(циклобутилсульфонил)-13-циклогексил-3-метокси-6-[4-[[(2S)-2-(метоксиметил)-4-морфолинил]карбонил]-1-метил-1H-пиразол-5-ил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[3-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-2-тиенил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[4-(этоксикарбонил)-2-(метилтио)-5-тиазолил]-3-метокси-, 1,1-диметилэтиловый эфир;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(13)-5-этил-2,5-диазабицикло[2.2.1]гепт-2-ил]карбонил]-1-(1-метилэтил)-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-N-[(диметиламино)сульфонил]-6-[1,3-диметил-4-(4-морфолинилкарбонил)-1H-пиразол-5-ил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[1,3-диметил-4-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[1-(1,1-диметилэтил)-4-(этоксикарбонил)-1H-пиразол-5-ил]-3-метокси-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-6-[3-[(3-метил-3,8-диазабицикло[3.2.1]окт-8-ил)карбонил]-2-фуранил]-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-3-метокси-N-[(1-метилэтил)сульфонил]-6-[3-(4-морфолинилкарбонил)-2-фуранил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[4-[[(2R,6S)-2,6-диметил-4-морфолинил]карбонил]-1-(2-метилпропил)-1H-пиразол-5-ил]-3-метокси-N-[(1-метилэтил)сульфонил]-;
7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[1-этил-4-(метоксикарбонил)-3-метил-1H-пиразол-5-ил]-3-метокси-;
5H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[3-[(диметиламино)карбонил]-5-метил-4H-1,2,4-триазол-4-ил]-N-[(диметиламино)сульфонил]-6,7-дигидро-3-метокси- и
5H-индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[3-[(диметиламино)карбонил]-4H-1,2,4-триазол-4-ил]-N-[(диметиламино)сульфонил]-6,7-дигидро-3-метокси-;
или их фармацевтически приемлемые соли.
15. Фармацевтическая композиция, включающая терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемой соли, и фармацевтически приемлемый носитель.
16. Способ лечения гепатита C, включающий введение пациенту терапевтически эффективного количества соединения по п.1.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ГЕПАТИТА С Изобретение охватывает соединения формулы I а также композиции и способы применения соединений. Соединения обладают активностью по отношению к вирусу гепатита C (HCV) и являются эффективными в лечении инфицированных 015978 Предпосылки создания изобретения Вирус гепатита C (HCV) является основным человеческим патогеном, которым инфицировано около 170 миллионов человек во всем мире - примерно в пять раз больше, чем инфицировано вирусом иммунодефицита человека типа 1. У значительной части инфицированных HCV людей развивается прогрессирующее заболевание печени, включая цирроз и гепатоцеллюлярную карциному (Lauer, G. M.;HCV представляет собой вирус с одноцепочечной рибонуклеиновой кислотой (РНК) с позитивной полярностью. На основании сравнения расшифрованной аминокислотной последовательности и значительного сходства в 5'-нетранслируемой области, HCV был классифицирован как самостоятельный род в семействе Флавивирусов. Все члены семейства Флавивирусов имеют заключенные в оболочку вирионы,которые содержат геном, представленный одноцепочечной РНК с позитивной полярностью, кодирующий все известные вирусоспецифические белки посредством трансляции одной непрерывной открытой рамки считывания. Была выявлена высокая гетерогенность генома HCV на уровне нуклеотидной и кодирующей аминокислотной последовательности. Охарактеризовано по меньшей мере шесть главных генотипов и описано более 50 субтипов вируса. Главные генотипы HCV отличаются по их распределению в мире, и клиническая значимость генетической гетерогенности HCV остается расплывчатой, несмотря на многочисленные исследования возможного влияния генотипов на патогенез и терапию. Одноцепочечная РНК генома HCV составляет в длину приблизительно 9500 нуклеотидов и имеет одну открытую рамку считывания (ORF), кодирующую один большой полипротеин, состоящий примерно из 3000 аминокислот. В инфицированных клетках этот полипротеин расщепляется на множестве сайтах протеазами клетки-хозяина и вирусными протеазами для получения структурных и неструктурных(NS) белков. В случае HCV синтез зрелых неструктурных белков (NS2, NS3, NS4A, NS4B, NS5A, иNS5B) осуществляется двумя вирусными протеазами. Полагают, что первая является металлопротеазой и расщепляет в NS2-NS3 участке; вторая является сериновой протеазой, содержащейся в N-концевом домене NS3 (также называемом NS3 протеазой), и опосредует все последующие расщепления в 5'-3' направлении NS3, как в цис, в сайте расщепления NS3-NS4A, так и в транс, для оставшихся сайтов NS4ANS4B, NS4B-NS5A, NS5A-NS5B. Белок NS4A выполняет множество функций, выступая в качестве кофактора для NS3 протеазы, и вероятно способствует локализации в мембране NS3 и других компонентов репликации вируса. Образование комплекса белка NS3 с NS4A считается необходимым для процессинга,усиливая протеолитическую активность на всех сайтах. Белок NS3 также проявляет нуклеозидтрифосфатазную и РНК геликазную активности. Белок NS5B (также называемый полимераза HCV) является РНКзависимой РНК полимеразой, которая вовлечена в репликацию HCV. Белок NS5B HCV описан в "Structural Analysis of the Hepatitis C Virus RNA Polymerase in Complex with Ribonucleotides" (Bressanelli; S. etal., Journal of Virology 2002, 3482-3492; и Defrancesco and Rice, Clinics in Liver Disease 2003, 7,211-242. В настоящее время самая эффективная терапия HCV использует комбинацию альфа-интерферона и рибавирина, вызывая устойчивый эффект у 40% пациентов (Poynard, T. et al. Lancet 1998, 352, 14261432). Последние клинические результаты показали, что в качестве монотерапии пегилированный альфаинтерферон превосходит немодифицированный альфа-интерферон (Zeuzem, S. et al. N. Engl. J. Med. 2000,343, 1666-1672). Однако даже при экспериментальных терапевтических режимах, включающих комбинацию пегилированного альфа-интерферона и рибавирина, основная часть пациентов не имеет устойчивого снижения вирусной нагрузки. Таким образом, существует четкая и важная потребность в развитии эффективной терапии для лечения HCV инфекции. Сущность изобретения Один объект изобретения представляет собой соединение формулы IR2 представляет собой фуранил, пирролил, тиенил, пиразолил, изоксазолил, изотиазолил, имидазолил, оксазолил, тиазолил, оксадиазолил, триазолил или тетразолил и является замещенным 0-2 заместителями, выбранными из оксо, амино, алкилтио, алкила и галогеналкила, и 1 заместителем, выбранным изR5 представляет собой водород или алкил;R7 представляет собой водород или алкил;R9 представляет собой водород или алкил;R10 представляет собой водород или алкил;R11 представляет собой азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил, гомопиперазинил или гомоморфолинил и является замещенным 0-1 алкильными заместителями;R13 представляет собой азетидинил, пирролидинил пиперидинил, пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил, гомопиперазинил или гомоморфолинил и является замещенным 0-3 заместителями, выбранными из алкила, алкоксиалкила, амино, алкиламино, диалкиламино, R11, аминоалкила, (алкиламино)алкила, (диалкиламино)алкила, (R11)алкила или CO2R5; или R13 представляет собой или R13 представляет собой [4.3.0] или [3.3.0] бициклический диамин, присоединенный к карбонилу посредством одного атома азота, и является замещенным 0-2 R8 заместителями; или R13 представляет собойR16 представляет собой водород или алкил;R17 представляет собой алкил или циклоалкил иX представляет собой метилен, связь или отсутствует; или его фармацевтически приемлемые соли. Другой аспект изобретения представляет собой соединение формулы I, в которойR2 представляет собой фуранил, пирролил, тиенил, пиразолил, изоксазолил, изотиазолил, имидазолил, оказолил, тиазолил, оксадиазолил, триазолил или тетразолил и является замещенным 0-2 заместителями, выбранными из оксо, амино, алкила или галогеналкила и 1 заместителем, выбранным из CO2R5,CON(R12)2 и COR13;R5 представляет собой водород или алкил;R7 представляет собой водород или алкил;R9 представляет собой водород или алкил;R10 представляет собой водород или алкил;R11 представляет собой азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил, гомопиперазинил или гомоморфолинил и является замещенным 0-1 алкильными заместителями;R13 представляет собой азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил, гомопиперазинил или гомоморфолинил и является замещенным 0-3 заместителями, выбранными из алкила, алкоксиалкила, амино, алкиламино, диалкиламино, R11, аминоалкила, (алкиламино)алкила, (диалкиламино)алкила, (R11) алкила или CO2R5; или R13 представляет собой или R13 представляет собой [4.3.0] или [3.3.0] бициклический диамин, присоединенный к карбонилу посредством одного атома азота, и является замещенным 0-2 R8 заместителями; или R13 представляет собойR16 представляет собой водород или алкил;X представляет собой метилен, связь или отсутствует; или его фармацевтически приемлемые воли. Другой аспект изобретения представляет собой соединение формулы I, в которой:R2 представляет собой фуранил, тиенил, пиразолил, оксазолил, тиазолил, изоксазолил, изотиазолил,оксадиазолил, триазолил или тетразолил и является замещенным 0-2 заместителями, выбранными из оксо, амино или алкила и 1 заместителем, выбранным из CO2R5, CON(R12)2 и COR13;R5 представляет собой водород или алкил;R7 представляет собой водород или алкил;R9 представляет собой водород или алкил;R10 представляет собой водород или алкил;R13 представляет собой азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил, гомопиперазинил или гомоморфолинил и является замещенным 0-3 заместителями, выбранными из алкила, амино, алкиламино, диалкиламино, R11, аминоалкила, (алкиламино)алкила, (диалкиламино)алкила или (R11) алкила; или R13 представляет собой или R13 представляет собой [4.3.0] или [3.3.0] бициклический диамин, присоединенный к карбонилу посредством одного атома азота, и является замещенным 0-2 R8 заместителями; или R13 представляет собойR16 представляет собой водород или алкил;R17 представляет собой водород, алкил или циклоалкил иX представляет собой метилен, связь или отсутствует; или его фармацевтически примемлемые соли. Другой аспект изобретения представляет собой соединение формулы I, в которой R1 представляет собой CONR6R7; R6 представляет собой алкил SO2, циклоалкил SO2, галогеналкил SO2, (R9)2NSO2 илиR7 является водородом. Другой аспект изобретения представляет собой соединение формулы I, в которой R3 является водородом. Другой аспект изобретения представляет собой соединение формулы I, в которой R3 является метокси. Другой аспект изобретения представляет собой соединение формулы I, в которой R4 является циклогексилом. Другой аспект изобретения представляет собой соединение формулы I, в которой R6 является алкилSO2, циклоалкил SO2, (R9)(R10)NSO2 или (R11)SO2. Другой аспект изобретения представляет собой соединение формулы I, в которой R2 является пиразолилом, замещенным 2 заместителями, выбранными из алкила и галогеналкила, и 1 COR13 заместителемR8 представляет собой водород или алкил; R16 представляет собой водород или алкил; и R17 представляет собой алкил. Другой аспект изобретения представляет собой соединение формулы I, в которой X является метиленом. Другой аспект изобретения представляет собой соединение формулы I, в которой X является связью. Другой аспект изобретения представляет собой соединение формулы I, в которой X отсутствует. Другой аспект изобретения представляет собой соединение формулы I согласно следующей стереохимии. Другой аспект изобретения представляет собой соединение формулы I согласно следующей стереохимии. Другой аспект изобретения представляет собой соединение формулы I согласно следующей стереохимии. Другой аспект изобретения представляет собой соединение формулы I согласно следующей стереохимии. Любой диапазон любой переменной, включающей R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13,R , R15, R16, R17 и X может использоваться независимо друг от друга в диапазоне любого другого примера переменной. Если не указано иное, эти термины означают следующее. "Алкил" означает прямую или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода. "Алкенил" означает прямую или разветвленную алкильную группу, содержащую от 2 до 6 атомов углерода по меньшей мере с одной двойной связью. "Циклоалкил" означает моноциклическую кольцевую систему, содержащую от 3 до 7 атомов углерода. "Гидроксиалкил", "алкокси" и другие термины с замещенным алкильным фрагментом включают прямые и разветвленные изомеры, состоящие из 1-6 атомов углерода для алкильного фрагмента."Галогеналкил" и "галогеналкокси" включают все галогенированные изомеры от моногалогензамещенного алкила до пергалогензамещенного алкила. "Арил" включает карбоциклические и гетероциклические ароматические заместители. Термины, заключенные в скобки, предназначены для разъяснения родства связей опытным в данной области специалистам. Например, термин, такой как R)алкил),означает алкильный заместитель, кроме того, замещенный заместителем R. Изобретение включает все фармацевтически приемлемые формы солей соединений. Фармацевтически приемлемые соли являются такими солями, в которых противоионы не оказывают значительного влияния на физиологическую активность или токсичность соединений и фактически выполняют функцию фармакологических эквивалентов. Эти соли могут быть изготовлены согласно общепринятым органическим технологиям, которые используют выпускаемые в промышленности реагенты. Некоторые соли в анионной форме включают ацетат, ацистрат, бесилат, бромид, хлорид, цитрат, фумарат, глюкуронат,гидробромид, гидрохлорид, гидроиодид, иодид, лактат, малеат, мезилат, нитрат, памоат, фосфат, сукцинат, сульфат, тартрат, тозилат и ксинофоат. Некоторые соли в катионной форме включают аммоний,алюминий, бензатин, висмут, кальций, холин, диэтиламин, диэтаноламин, литий, магний, меглюмин, 4 фенилциклогексиламин, пиперазин, калий, натрий, трометамин и цинк. Некоторые из соединений изобретения содержат асимметрические атомы углерода (см., например,соединение ниже). Изобретение включает все стереоизомерные формы, включая энантиомеры и диастереомеры, а также смеси стереоизомеров, такие как рацематы. Некоторые стереоизомеры могут быть изготовлены способами, известными в данной области. Стереоизомерные смеси соединений и родственных промежуточных соединений могут быть разделены на отдельные изомеры согласно способам, широко известным в данной области. 14-6 015978 Синтез Соединения могут быть изготовлены способами, известными в данной области, включая способы,описанные выше. Некоторые реагенты и промежуточные продукты хорошо известны в данной области. Другие реагенты и промежуточные продукты могут быть изготовлены способами, известными в данной области, с помощью доступных материалов. Переменные (например, пронумерованные "R" заместители), использующиеся для описания синтеза соединений, предназначены только лишь для иллюстрации приготовления соединения, и не следует их путать с переменными, использующимися в формуле или в других разделах заявки. Использующиеся в схемах сокращения в целом следуют правилам, установленным в данной области техники. Показанная ниже схема иллюстрирует способы, которые могут использоваться для изготовления промежуточных продуктов и соединений. Или же последовательность реакции может быть изменена, как показано ниже.-7 015978 7H-Индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-3-метокси-6-(фенилсульфонил)-, трет-бутиловый эфир. В раствор 3-циклогексил-2-(2-формил-4-метоксифенил)-1H-индол-6-карбоксилата (6.00 г, 1.38 ммоль) в диоксане (28.0 мл) и BEMP (7.97 мл, 27.6 ммоль) добавляли фенилвинилсульфон (27.6 г, 2.21 ммоль). Полученную смесь перемешивали в герметичной пробирке в микроволновой печи при 120C в течение 15 мин. Полученный раствор концентрировали при пониженном давлении. Хроматография концентрата на силикагеле (CH2Cl2) позволила получить названное соединение в количестве 6.36 г (79%) в виде желтого масла. MS m/z 584 (MH+). 1H ЯМР (500 МГц, хлороформ-d)ppm 1.18-1.33 (1H, m), 1.341.45 (2H, m), 1.49-57 (1H, m), 1.64 (9H, s.), 1.74-1.82 (2H, m), 1.90-2.09 (4H, m), 2.73 (1H, m), 3.93 (3H, s),4.38 (1H, широкий d), 5.08 (1H, br. d), 7.09 (1H, d, J=2.75 Гц), 7.12-7.18 (3H, m), 7.22 (1H, d, J=7.45 Гц),7.30 (1H, s), 7.48 (1H, d, J=8.85 Гц), 7.54 (1H, dd, J=8.55, 1.22 Гц), 7.61 (2H, m), 7.67 (1H, d, J=8.55), 8.01 7H-Индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-3-метокси-6-(трибутилстаннил)-, 1,1-диметилэтиловый эфир. 1,1-Диметилэтил 13-циклогексил-3-(метилокси)-6-(трибутилстаннил)-7H-индоло [2,1-a][2] бензазепин-10-карбоксилат. 7H-Индоло[2,1-a][2]бензазепин-10-карбоновую кислоту,13-циклогексил-3-метокси-6-(фенилсульфонил)-, 1,1-диметилэтиловый эфир (1.00 г, 1.71 ммоль) растворяли в 26 мл бензола вместе с бис(трибутилолово) (2.8 мл, 5.54 ммоль), гидридом трибутилолова (136 мкл, 0.513 ммоль) и триэтиламином (1.05 мл, 7.5 ммоль). Азот барботировали примерно в течение 10 мин через раствор, затем в реакционную смесь добавляли 2,2'-азобисизобутиронитрил (AIBN) (96 мг, 0.58 ммоль). Реакционную смесь нагревали с обратным холодильником в атмосфере азота в течение 2 ч. Реакция сопровождалась ЖХ-МС при следующих условиях ВЭЖХ: оборудование фирмы Shimadzu для аналитической ВЭЖХ с использованием Discovery VP программного обеспечения: %A = 5% ацетонитрила, 95% воды, 10 ммоль ацетата аммония, %B = 95% ацетонитрила, 5% воды, 10 ммоль ацетата аммония; начальное %B = 0; конечное %B = 100; градиент = 3 мин; длительность анализа = 10 мин; скорость потока = 5 мл/мин; длина волны = 220 нм; колонка = Waters Xterra, 3 мм 50 мм, S7. В реакцию вводили гидрид трибутилолова (0.45 мл, 1.7 ммоль) и AIBN (95 мг, 0.58 ммоль), нагревали с обратным холодильником в течение 2 ч и анализировали протекание реакции. В реакционную смесь вводили AIBN (99 мг, 0.60 ммоль) и нагревали с обратным холодильником дополнительно 6 ч, используя таймер. Ход реакции анализировали методом ЖХ-МС,затем в реакционную смесь добавляли гидрид трибутилолова (1.0 мл, 3.8 ммоль) и AIBN (97 мг, 0.59 ммоль), и нагревали с обратным холодильником в течение 2 ч 20 мин. Ход реакции анализировали методом ЖХ-МС и добавляли AIBN (97 мг, 0.59 ммоль). Реакционную смесь нагревали в течение 1 ч в атмосфере азота с обратным холодильником и охлаждали, а затем анализировали методом ЖХ-МС. Летучие компоненты удаляли в вакууме и реакционную смесь очищали колоночной хроматографией на колонкеC18, заполненной 190 г YMC GEL ODS-A, 120A, размер сферических частиц 75 мкм. Остаток (6.67 г желтого масла) растворяли в минимальном количестве дихлорметана и раствор наносили на колонку с обращенной фазой, заполненной в смеси 10% дихлорметана в ацетонитриле. Начальное элюирование проводили 10% дихлорметаном в ацетонитриле с последующим элюированием 15% дихлорметаном в ацетонитриле. Хроматографию оценивали методом TCX с помощью пластинки TCX толщиной 200 мкм с обратимой фазой 1"3" Whatman MKC18F, элюируя 15% дихлорметаном в ацетонитриле. Наблюдение за соединением выполняли с помощью УФ-лампы при 254 нм и окрашивании йодом TCX пластин. Фракции продукта собирали и летучие компоненты удаляли в вакууме для получения 647 мг (52%) в виде бледно желтой пены. 1H ЯМР (500 МГц, хлороформ-d)ppm 0.71-0.83 (m, 9H) 0.85-0.96 (m, 3H) 0.95-1.08(m, 6H) 1.15-1.27 (m, 7H) 1.27-1.49 (m, 11H) 1.53 (s, 5H) 1.60-1.67 (m, 9H) 1.68-1.82 (m, 2H) 1.84-1.96 (m,1H) 1.96-2.16 (m, 3H) 2.74-2.91 (m, 1H) 3.90 (s, 3H) 4.16-4.40 (m, 1H) 4.82-5.03 (m, 1H) 6.72-6.90 (m, 2H) 6.96 (dd, J=8.55, 2.44 Гц, 1H) 7.43 (d, J=8.55 Гц, 1H) 7.66 (dd, J=8.39, 1.37 Гц, 1H) 7.81 (d, J=8.55 Гц, 1H) 8.04 (s, 1H) ЖХ-МС: Оборудование Shimadzu для аналитической ВЭЖХ с использованием программного обеспечения Discovery VP: %А = 5% ацетонитрила, 95% воды, 10 ммоль ацетата аммония; начальное %В= 0; конечное %В = 100; градиент = 3 мин; длительность анализа =10 мин; скорость потока = 5 мл/мин; длина волны = 220 нм; колонка = Waters Xterra, 350 мм, S7; время удерживания = 4.2 мин, MS m/z 734(MH+). 7H-Индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-3-метокси-6-(трибутилстаннил)-, 1,1-диметилэтиловый эфир. 1,1-Диметилэтил 13-циклогексил-3-(метилокси)-6-(трибутилстаннил)-7H-индоло[2,1-a][2]бензазепин-10-карбоксилат. Установку, состоящую из трехгорлой колбы, оснащенной газоподводящей трубкой для аргона, об-8 015978 ратным холодильником и капельной воронкой, высушивали над пламенем горелки и затем охлаждали в потоке аргона. В колбу затем загружали бензол (5 мл) и 7H-индоло[2,1-a][2]бензазепин-10-карбоновую кислоту, 13-циклогексил-3-метокси-6-(фенилсульфонил)-, 1,1-диметилэтиловый эфир 1 (500 мг, 0.857 ммоль). Полученную смесь подвергали воздействию ультразвука в атмосфере аргона в течение 5 мин(для удаления кислорода) и затем нагревали с обратным холодильником. После чего в капельную воронку вносили раствор три-н-бутил-олова гидрида (0.459 мл, 1.713 ммоль) и 2,2'-азобис(2-метилпропионитрила) (52.0 мг, 0.317 ммоль) в дегазированном бензоле (5 мл). Примерно 2.5 мл этого раствора добавляли по каплям в течение 30 мин, и полученный раствор перемешивали при нагревании с обратным холодильником в течение 1.5 ч. Остальной раствор медленно добавляли по каплям примерно в течение 30 мин, и нагревание продолжали дополнительно 1.5 ч. Затем смесь выпаривали при пониженном давлении для удаления летучих компонентов. Остаток суспендировали в гексане и наносили на картридж Biotage с силикагелем, и затем погружали на колонку с силикагелем, уравновешенную 100% гексаном. После чего продукт элюировали ступенчатым градиентом растворителей этилацетат-гексан: 0-100%, затем 298%, затем 5-95%. Гомогенные фракции объединяли и выпаривали для получения желтого масла. Полученный продукт помещали в высокий вакуум на ночь для получения указанного соединения в виде вязкого желтого масла. [373 мг, 57%]. Продукт хранили в атмосфере азота в холодильнике. трет-Бутил 13-циклогексил-6-(4-(этоксикарбонил)-1,3-оксазол-2-ил)-3-метокси-7H-индоло[2,1-a][2] бензазепин-10-карбоксилат. 1,1-Диметилэтил 13-циклогексил-3-(метилокси)-6-(трибутилстаннил)-7H-индоло[2,1-a][2]бензазепин-10-карбоксилат (266 мг, 0.36 ммоль) растворяли в 3.4 мл 1,4-диоксана в 2 драм флаконе. Этил-2 хлороксазол-4-карбоксилат (83.4 мг, 0.47 ммоль) растворяли в реакционной смеси с последующим добавлением бис(трифенилфосфин)палладия(II) хлорида (17.7 мг, 0.025 ммоль). Реакционную смесь помещали в атмосферу азота и нагревали в масляной ванне при 100C в течение 17 ч, после чего охлаждали и анализировали методом ЖХ-МС. В реакционную смесь добавляли бис(трифенилфосфин)палладия(II) хлорид (10 мг, 0.014 ммоль). Реакционную смесь помещали в атмосферу азота и нагревали дополнительно в течение 5 ч при 100C. Реакционную смесь концентрировали в вакууме и осадок адсорбировали на силикагеле, очищали колоночной хроматографией на силикагеле, элюируя градиентом от дихлорметана до 2% этилацетата в дихлорметане для получения 233 мг желтого твердого продукта. 1H ЯМР (500 МГц,хлороформ-d)ppm 1.13-1.37 (m, 4H) 1.37-1.44 (m, 4H) 1.46-1.55 (m, 1H) 1.64 (s, 9H) 1.68-1.81 (m, 2H) 1.83-1.98 (m, 3H) 1.98-2.13 (m, 3H) 2.74-2.88 (m, 1H) 3.91 (s, 3H) 4.34-4.48 (m, 3H) 5.84-6.00 (m, 1H) 7.00(d, J=2.44 Гц, 1H) 7.08 (dd, J=8.55, 2.75 Гц, 1H) 7.53 (d, J=8.85 Гц, 1H) 7.69 (dd, J=8.55, 1.22 Гц, 1H) 7.74 (s,1H) 7.82 (d, J=8.24 Гц, 1H) 8.21 (s, 1H) 8.30 (s, 1H); LC-MS: Аналитическое оборудование Shimadzu для ВЭЖХ с использованием программного обеспечения Discovery VP: %A = 10% метанола, 95% воды, 0.1% трифторуксусной кислоты %B = 90% метанола, 10% воды, 0.1% трифторуксусной кислоты; начальное 7H-Индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[4-(этоксикарбонил)-2 оксазолил]-3-метокси-. трет-Бутил 13-циклогексил-6-(4-(этоксикарбонил)-1,3-оксазол-2-ил)-3-метокси-7H-индоло[2,1-a][2] бензазепин-10-карбоксилат (109 мг, 0.19 ммоль) растворяли в 2 мл 1,2-дихлорэтана и в реакцию добавляли 2 мл трифторуксусной кислоты. Летучие компоненты удаляли и продукт высушивали в вакууме для получения 102 мг желтого твердого вещества: 1H ЯМР (500 МГц, хлороформ-d)ppm 1.11-1.37 (m, 4H) 1.42 (t, J=7.02 Гц, 4H) 1.48-1.62 (m, 1H) 1.77 (d, J=10.07 Гц, 2H) 1.86-2.13 (m, 4H) 2.73 -2.90 (m, 1H) 2.98-9 015978 3.39 (m, 6H) 3.92 (s, 3H) 4.30-4.53 (m, 3H) 5.87-6.03 (m, 1H) 7.02 (d, J=2.44 Гц, 1H) 7.09 (dd, J=8.70, 2.59 Гц, 1H) 7.75 (s, 1H) 7.79 (dd, J=8.39, 1.37 Гц, 1H) 7.88 (d, J=8.55 Гц, 1H) 8.24 (s, 1H) 8.50 (s, 1H); Данные ЖХ-МС: Оборудование Shimadzu для аналитической ВЭЖХ с использованием программного обеспечения Discovery VP: %A = 5% ацетонитрила, 95% воды, 10 ммоль ацетата аммония; %B = 95% ацетонитрила, 5% воды, 10 ммоль ацетата аммония; начальное %B = 0; конечное %B = 100; градиент = 2 мин; длительность анализа = 3 мин; скорость потока = 5 мл/мин; длина волны = 220 нм; колонка = Phenomenex Этил 2-(13-циклогексил-10-диметиламино)сульфонил)карбамоил)-3-метокси-7H-индоло[2,1-a][2] бензазепин-6-ил)-1,3-оксазол-4-карбоксилат. Этил 2-(13-циклогексил-10-диметиламино)сульфонил)карбамоил)-3-метокси-7H-индоло[2,1-a][2] бензазепин-6-ил)-1,3-оксазол-4-карбоксилат.7H-индоло[2,1-a][2]бензазепин-10-карбоновую кислоту, 13 циклогексил-6-[4-(этоксикарбонил)-2-оксазолил]-3-метокси- (115 мг, 0.22 ммоль) растворяли в 3 мл безводного тетрагидрофурана (THF) и в реакцию добавляли 1,1'-карбонилдиимидазол (61 мг, 0.38 ммоль). Реакционную смесь перемешивали в атмосфере азота в течение 1 ч 20 мин при комнатной температуре,затем нагревали с обратным холодильником в течение 45 мин. Реакцию охлаждали и добавляли диметилсульфамид (186 мг, 1.49 ммоль) с последующим введением 1,8-диазабицикло[5.4.0]ундек-7-ена (39 мкл,0.26 ммоль) (DBU). Реакционную смесь нагревали при 55C в течение 16 ч в атмосфере азота. Реакционную смесь разделяли между дихлорметаном и 0.1 М раствором мононатрия фосфата. Дихлорметановый экстракт отмывали 0.1 М раствором мононатрия фосфата, затем высушивали над сульфатом натрия. Летучие компоненты удаляли в вакууме для получения 167 мг сырого желтого продукта. Половину сырого образца растворяли в смеси ацетонитрила и метанола и очищали обращенно-фазовой препаративной ВЭЖХ в следующих условиях: система Shimadzu для препаративной ВЭЖХ с использованием программного обеспечения Discovery VP: %A = 10% ацетонитрила, 90% воды, 0.1% TFA; %B = 90% ацетонитрила, 10% воды, 0.1% TFA; начальное %B = 50; конечное %B = 100; градиент=12 мин; длительность анализа =17 мин; скорость потока = 25 мл/мин; длина волны=220 нм; колонка = Waters Sunfire 19100 мм. Время удерживания = от 12.25 до 17 мин (увеличивается в зависимости от растворимости). Получали 25.2 мг аморфного твердого вещества желтого цвета. 1H ЯМР (500 МГц, хлороформ-d)ppm 1.18-1.30(m, 2H) 1.34-1.46 (m, 5H) 1.47-1.62 (m, 1H) 1.70-1.85 (m, 2H) 1.86 -2.21 (m, 4H) 2.72-2.92 (m, 1H) 3.07 (s,6H) 3.92 (s, 3H) 4.08-4.34 (m, 2H) 4.41 (q, J=7.22 Гц, 3H) 5.75-5.99 (m, 1H) 7.02 (d, J=2.75 Гц, 1H) 7.10 (dd,J=8.70, 2.59 Гц, 1H) 7.45-7.65 (m, 2H) 7.71 (s, 1H) 7.89 (d, J=8.55 Гц, 1H) 8.20 (s, 1H) 8.29 (s, 1H) 9.36 (s,1H); ЖХ-МС: система Shimadzu для аналитической ВЭЖХ с использованием программного обеспечения 13-Циклогексил-N-диметиламино)сульфонил)-3-метокси-6-(4-3-метил-3,8-диазабицикло[3.2.1] окт-8-ил)карбонил)-1,3-оксазол-2-ил)-7H-индоло[2,1-a][2]бензазепин-10-карбоксамид. Этил 2-(13-циклогексил-10-диметиламино)сульфонил)карбамоил)-3-метокси-7H-индоло[2,1-a][2] бензазепин-6-ил)-1,3-оксазол-4-карбоксилат (35.7 мг, 0.056 ммоль) растворяли в 0.6 мл THF в 2 драм флаконе. Тетрабутиламмоний гидроксид (170 мкл, 0.17 ммоль) в виде 1M раствора в метаноле добавляли в реакцию. Реакционную смесь накрывали и перемешивали в течение 3 ч при комнатной температуре. Реакционную смесь разделяли между 1N соляной кислотой и дихлорметаном. Органическую фазу отмывали 1N раствором соляной кислоты и высушивали над сульфатом натрия. Материал концентрировали до сухого состояния, высушивапи в вакууме и использовали без дальнейшей очистки. Продукт гидролиза- 10015978 при комнатной температуре в атмосфере азота примерно 50 мин, после чего добавляли DMAP (37.9 мг,0.31 ммоль) с последующим введением 3-метил-3,8-диаза-бицикло[3.2.1]октан дигидрохлорида (23 мг,0.11 ммоль). Реакционную смесь перемешивали в течение 4 ч при комнатной температуре в атмосфере азота до полного завершения реакции, после чего добавляли к 20 мл воды и экстрагировали дихлорметаном, отмывали органический слой водой и высушивали над сульфатом натрия до получения 50 мг сырого продукта. Продукт очищали препаративной ВЭЖХ в следующих условиях: система Shimadzu для препаративной ВЭЖХ с использованием программного обеспечения Discovery VP: %A = 10% ацетонитрила,90% воды, 0.1% TFA; %B = 90% ацетонитрила, 10% воды, 0.1% TFA; начальное %B = 30; нонечное %B = 100; градиент = 12 мин; длительность анализа = 20 мин; скорость потока = 25 мл/мин; длина волны = 220 нм; колонка = Waters Sunfire 19 мм 100 мм. Время удерживания = 6.1 мин. Фракции продукта концентрировали в вакууме для получения 30.5 мг указанного соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, хлороформ-d)ppm 1.09-1.30 (m, 1H) 1.31-1.61 (m, 3H) 1.68-1.85 (m, 2H) 1.872.20 (m, 5H) 2.26-2.44 (m, 2H) 2.51-2.66 (m, 1H) 2.77-2.90 (m, 1H) 2.91-3.01 (m, 3H) 3.04 (s, 6H) 3.12 (d,J=11.90 Гц, 1H) 3.23 (d, J=11.60 Гц, 1H) 3.78 (d, J=12.21 Гц, 1H) 3.94 (s, 3H) 4.24 (d, J=13.12 Гц, 1H) 4.43(d, J=14.34 Гц, 1H) 5.01 (d, J=5.80 Гц, 1H) 5.13-5.47 (m, 1H) 5.85 (d, J=14.04 Гц, 1H) 6.02 (s, 1H) 7.03 (d,J=2.75 Гц, 1H) 7.12 (dd, J=8.70, 2.59 Гц, 1H) 7.25-7.32 (m, 1H) 7.56 (d, J=8.55 Гц, 1H) 7.69 (s, 1H) 7.88 (d,J=8.24 Гц, 1H) 8.18 (s, 1H) 8.28 (s, 1H) 8.52 (s, 1H) 11.72 (s, 1H); ЖХ-МС: система Shimadzu для аналитической ВЭЖХ с использованием программного обеспечения Discovery VP: %A = 5% ацетонитрила, 95% воды, 10 ммоль ацетата аммония; %B = 95% ацетонитрила, 5% воды, 10 ммоль ацетата аммония; начальное %B = 0; конечное %B = 100; градиент = 2 мин; длительность анализа = 3 мин; скорость потока = 5 мл/мин; длина волны = 220 нм; колонка = Phenomenex Luna, 350 мм, S10; время удерживания=1.7 мин,MS m/z 711(MH-), m/z713(MH+). 13-Циклогексил-N-диметиламино)сульфонил)-3-метокси-6-(4-3-метил-3,8-диазабицикло[3.2.1] окт-8-ил)карбонил)-1,3-оксазол-2-ил)-6,7-дигидро-5H-индоло[2,1-a][2]бензазепин-10-карбоксамид. 13-Циклогексил-N-диметиламино)сульфонил)-3-метокси-6-(4-3-метил-3,8-диазабицикло[3.2.1] окт-8-ил)карбонил)-1,3-оксазол-2-ил)-7H-индоло[2,1-a][2]бензазепин-10-карбоксамид (26.5 мг, 0.037 ммоль) растворяли в 1 мл THF и добавляли 0.3 мл метанола с последующим введением 10 мг 10% палладия на углерод. Реакционную смесь помещали в атмосферу водорода при 1 атмосфере (баллон) и перемешивали в течение 18 ч при комнатной температуре. Реакционную смесь фильтровали через пробку из целита и промывали ацетонитрилом. Летучие компоненты удаляли из фильтрата в вакууме, остаток растворяли в ацетонитриле и очищали препаративной ВЭЖХ в следующих условиях: система Shimadzu для препаративной ВЭЖХ с использованием программного обеспечения Discovery VP: %A = 10% ацетонитрила, 90% воды, 0.1% TFA; %B = 90% ацетонитрила, 10% воды, 0.1% TFA; начальное %B = 30; конечное= 220 нм; колонка = Waters Sunfire 19100 мм; время удерживания = 5.3 мин. Указанное соединение выделяли в виде соли TFA, получая 17.6 мг. 1H ЯМР (500 МГц, хлороформ-d)ppm 1.20-1.33 (m, 1.1 Н) 1.33-1.54 (m, 2.1H) 1.65 (t,J=10.99 Гц, 1.1H) 1.74- 1.86 (m, 1.9H) 1.89-2.11 (m, 5.6H) 2.11-2.44 (m, 3.0 Н) 2.71-2.86 (m, 3.2H) 2.87-2.98 (m, 2.9H) 2.98-3.10 (m, 7.7H) 3.08-3.45 (m, 6.1H) 3.72-3.83 (m, 0.9H) 3.82-3.93(m, 3.1H) 3.92-4.00 (m, 0.8H) 4.05 (dd, J=14.80, 5.65 Гц, 0.8H) 4.55-5.12 (m, 2.6H) 5.60 (d, J=12.82 Гц, 0.3H) 6.64 -7.12 (m, 2.0H) 7.29-7.62 (m, 1.8H) 7.77-7.97 (m, 1.2H) 7.97-8.43 (m, 1.2H) 8.55-9.33 (m, 0.7H) 11.70 (s,0.5H). ЖХ-МС: система Shimadzu для аналитической ВЭЖХ с использованием программного обеспечения Discovery VP: %A = 5% ацетонитрила, 95% воды, 10 ммоль ацетата аммония; %B = 95% ацетонитрила, 5% воды, 10 ммоль ацетата аммония; начальное %B = 0; конечное %В = 100; градиент = 3 мин; длительность анализа = 5 мин; скорость потока = 5 мл/мин; длина волны = 220 нм; колонка = Gemini, 4.6 мм 50 мм, S10; время удерживания = 2.2 мин, MS m/z 715(MH+), m/z 713(MH-).- 11015978 1H-Индоло[2,1-a][2]бензазепин-10-карбоновую кислоту,13-циклогексил-3-метокси-6(трибутилстаннил)-, 1,1-диметилэтиловый эфир (140 мг, 0.19 ммоль) растворяли в 2 мл 1,4-диоксана вместе с метил 3-бромтиофен-2-карбоксилатом (79 мг, 0.36 ммоль) в 2 драм флаконе. В реакцию добавляли бис(трифенилфосфин)палладия дихлорид (9.2 мг, 0.013 ммоль). Реакционную смесь помещали в атмосферу азота и нагревали до 100C в течение 4.5 ч. Реакционную смесь охлаждали, фильтровали через 0.45 мкм нейлоновый шприцевой фильтр и летучие компоненты удаляли в вакууме для получения 226 мг желтого масла. Указанное соединение очищали хроматографией на силикагеле, элюируя 30% гексаном в дихлорметане для получения 73 мг (66%) продукта. 1H ЯМР (500 МГц, хлороформ-d)ppm 0.92 (t,J=7.32 Гц, 2H) 1.24-1.44 (m, 6H) 1.57 (s, 9H) 1.58 -1.71 (m, 2H) 1.77 (d, J=8.85 Гц, 2H) 1.85-1.99 (m, 1H) 2.00-2.17 (m, 3H) 2.83-2.93 (m, 1H) 3.82 (s, 3H) 3.88 (s, 3H) 4.71 (s, 1H) 5.10 (s, 1H) 6.80 (s, 1H) 6.83 (d,J=4.88 Гц, 1H) 6.90 (d, J=2.75 Гц, 1H) 7.01 (dd, J=8.55, 2.75 Гц, 1H) 7.40 (d, J=5.19 Гц, 1H) 7.51 (d, J=8.85 Гц, 1H) 7.63 (dd, J=8.55, 1.22 Гц, 1H) 7.82 (d, J=8.55 Гц, 1H) 7.88 (s, 1H); ЖХ-МС: система Shimadzu для аналитической ВЭЖХ с использованием программного обеспечения Discovery VP: %A = 10% ацетонитрила, 90% воды, 0.1% трифторуксусной кислоты; %B = 90% ацетонитрила, 10% воды, 0.1% трифторуксусной кислоты; начальное %B = 0; конечное %B = 100; градиент = 2 мин; длительность анализа = 5 мин; скорость потока = 5 мл/мин; длина волны= 220 нм; колонка = Phenomenex Luna, 3.050 мм, S10; время удерживания = 2.95 мин, MS m/z 584(MH+). 7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 6-(2-карбокси-3-тиенил)-13-циклогексил-3 метокси-, 10-(1,1-диметилэтил) эфир. 7H-индоло[2,1-a][2]бензазепин-10-карбоновую кислоту,13-циклогексил-3-метокси-6-[2(метоксикарбонил)-3-тиенил]-, 1,1-диметилэтиловый эфир (65 мг, 0.11 ммоль) растворяли в 1 мл THF в 2 драм флаконе. В этот раствор добавляли 1.0 М раствор тетрабутиламмония гидроксида (0.33 мл, 0.33 ммоль) в метаноле. Реакционную смесь накрывали и перемешивали при комнатной температуре в течение 3 ч, затем контролировали с помощью ВЭЖХ. В реакционную смесь дополнительно вводили 1.0 М раствор тетрабутиламмония гидроксида (0.10 мл, 0.1 ммоль) в метаноле и перемешивали накрытой при комнатной температуре дополнительно в течение 21 ч. Реакционную смесь разделяли между дихлорметаном и 0.1 М раствором лимонной кислоты. Водную фазу экстрагировали дихлорметаном, и органические экстракты объединяли и высушивали над сульфатом натрия. Летучие соединения удаляли в вакууме для получения 72 мг сырого продукта. ЖХ-МС: система Shimadzu для аналитической ВЭЖХ с использованием программного обеспечения Discovery VP: %A = 5% ацетонитрила, 95% воды, 10 ммоль ацетата аммония; %B = 95% ацетонитрила, 5% воды, 10 ммоль ацетата аммония; начальное %B = 0; конечное %B 7H-Индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[2-[(диэтиламино)карбонил]-3-тиенил]-3-метокси-, 1,1-диметилэтиловый эфир. 7H-Индоло[2,1-a][2]бензазепин-10-карбоновую кислоту, 6-(2-карбокси-3-тиенил)-13-циклогексил-3 метокси-, 10-(1,1-диметилэтиловый) эфир (36 мг, 0.063 ммоль) растворяли в 0.7 мл безводного DMF и в реакцию вводили TBTU (36.5 мг, 0.114 ммоль). Реакционную смесь помещали в атмосферу азота и перемешивали при комнатной температуре в течение 1.5 ч. Затем в реакционной смеси растворяли DMAP (29 мг, 0.24 ммоль) и добавляли диэтиламин (26 мкл, 0.25 ммоль). Реакционную смесь помещали в атмосферу азота и перемешивали в течение 21 ч при комнатной температуре. Реакционную смесь добавляли в 15 мл воды и водную суспензию экстрагировали дихлорметаном. Органическую фазу последовательно отмывали 0.1 М раствором лимонной кислоты, водой и высушивали над сульфатом натрия, фильтровали и летучие компоненты удаляли в вакууме для получения янтарного масла. Система Shimadzu для аналитической ВЭЖХ с использованием программного обеспечения Discovery VP: %A = 10% метанола, 90% 7H-Индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[2-[(диэтиламино)карбонил]-3-тиенил]-3-метокси-. 7H-Индоло[2,1-a][2]бензазепин-10-карбоновую кислоту, 13-циклогексил-6-[2-[(диэтиламино)карбонил]-3-тиенил]-3-метокси-, 1,1-диметилэтиловый эфир (39 мг, 0.06 ммоль) растворяли в 1 мл 1,2 дихлорэтана и добавляли 1 мл трифторуксусной кислоты. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем удаляли в вакууме летучие компоненты. Продукт реакции многократно растворяли в бензоле и летучие компоненты удаляли в вакууме для облегчения удаления остаточного количества TFA. Масса продукта составила 39 мг в виде аморфного твердого вещества. СистемаShimadzu для аналитической ВЭЖХ с использованием программного обеспечения Discovery VP: %A = 5% ацетонитрила, 95% воды, 10 ммоль ацетата аммония; %B = 95% ацетонитрила, 5% воды, 10 ммоль ацетата аммония; начальное %B = 0; конечное %B = 100; градиент = 3 мин; длительность анализа = 5 мин; скорость потока =5 мл/мин; длина волны = 220 нм; колонка = Phenomenex Luna, 3.050 мм, S10. время удерживания = 2.31 мин, MS m/z 569(MH+). 7H-Индоло[2,1-a][2]бензазепин-10-карбоксамид, 13-циклогексил-6-[2-[(диэтиламино)карбонил]-3 тиенил]-N-[(диметиламино)сульфонил]-3-метокси-. 7H-индоло[2,1-a][2]бензазепин-10-карбоновой кислоты, 13-циклогексил-6-[2-[(диэтиламино)карбонил]-3-тиенил]-3-метокси- (36.7 мг, 0.064 ммоль) растворяли в THF (1 мл) и в реакционную смесь добавляли карбонилдиимидазол (19 мг, 0.117 ммоль). Реакционную смесь перемешивали в атмосфере азота при комнатной температуре в течение 1.5 ч. Затем реакционную смесь нагревали до 60C в течение 1.5 ч, после чего охлаждали и добавляли диметилсульфамид (55 мг, 0.444 ммоль) с последующим DBU (13.3 мкл, 0.089 ммоль). Реакционную смесь помещали в атмосферу азота и нагревали при температуре от 65 до 70C в течение ночи. Реакционную смесь охлаждали и разделяли между дихлорметаном и 1N водным раствором соляной кислоты. Водную фазу заново экстрагировали дихлорметаном, органические слои объединяли и отмывали последовательно 1N водным раствором соляной кислоты, 0.1 М водным раствором NaH2PO4. Дихлорметановую фазу высушивали над сульфатом натрия, фильтровали и удаляли летучие соединения в вакууме для получения 47 мг коричневой пленки. Образец растворяли в смеси ацетонитрил/DMF (1:1), очищали на колонке Waters Sunfire PrepC18 OBD, 5 мкм, 19 мм 100 мм и измерения проводили с помощью SPD-10AV UV-Vis детектора при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 25 мл/мин, градиент от 50% растворителя A/50% растворителя B до 0% растворителя A/100% растворителяB, градиент времени 15 мин при длительности анализа 25 мин с помощью системы растворителей: %A = 10% ацетонитрила, 90% воды, 0.1% TFA; %B = 90% ацетонитрила, 10% воды, 0.1% TFA. Растворитель удаляли из фракции продукта в вакууме для получения 18.1 мг аморфного желтого твердого вещества. 1H ЯМР (500 МГц, хлороформ-d)ppm 0.53 (br.s, 3H) 0.96 (br.s, 3H) 1.04-1.44 (m, 4H) 1.51 (d, J=10.07 Гц,1H) 1.78 (d, J=9.46 Гц, 2H) 1.88-2.13 (m, 4H) 2.40-2.52 (m, 1H) 2.80-2.97 (m, 3H) 3.05 (s, 6H) 3.57 (br.s, 1H) 3.89 (s, 3H) 4.49 (d, J=14.65 Гц, 1H) 5.20 (d, J=14.04 Гц, 1H) 6.93 (d, J=2.75 Гц, 1H) 6.98 (s, 1H) 7.02 (dd,J=8.70, 2.59 Гц, 1H) 7.11 (d, J=5.19 Гц, 1H) 7.38 (d, J=4.88 Гц, 1H) 7.41-7.52 (m, 2H) 7.86 (d, J=8.55 Гц, 1H) 8.01 (s, 1H) 9.18 (s, 1H); ЖХ-МС время удерживания 2.19 мин; 673 m/z (MH-). ЖХ данные записавали на жидкостном хроматографе Shimadzu LC-10AS, оборудованном колонкой Waters Xterra MS 7u C18 3.050 мм с использованием SPD-10AV UV-Vis детектора при длине волны детектирования 220 нм Условия элюирования были следующие: скорость потока 5 мл/мин, градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 3 мин, время удерживания 1 мин и длительность анализа 4 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95%H2O/10 мМ ацетата аммония и растворителем B являлась смесь 5% H2O/95% ацетонитрила/10 мМ ацетата аммония. МС данные определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления. трет-Бутил 13-циклогексил-3-метокси-6-(2-(4-морфолинилкарбонил)-3-тиенил)-7H-индоло[2,1-a][2] бензазепин-10-карбоксилат. В 2 драм склянке 7H-индоло[2,1-а][2]бензазепин-10-карбоновую кислоту, 6-(2-карбокси-3-тиенил)13-циклогексил-3-метокси-, 10-(1,1-диметилэтил) эфир (33.7 мг, 0.059 ммоль) и O-(1H-бензотриазол-1 ил)-N,N,N',N'-тетраметилурониум-тетрафторборат (34.2 мг, 0.106 ммоль) растворяли в DMF (0.7 мл) для получения прозрачного желтого раствора. Реакционную смесь помещали в атмосферу азота и перемешивали при комнатной температуре в течение 1 ч 20 мин. DMAP (28.9 мг, 0.237 ммоль) растворяли в реакционной смеси, затем добавляли морфолин (10 мкл, 0.121 ммоль). Реакционную смесь помещали в атмосферу азота и перемешивали при комнатной температуре в течние 2 дней. Реакционную смесь вливали в 15 мл воды. Происходило образование бледно желтого осадка. Экстрагировали в дихлорметан. Раствор дихлорметана отмывали 0.1 М водным раствором лимонной кислоты, повторно экстрагировали водный раствор с помощью дихлорметана. Объединенные дихлорметановые фазы отмывали 1 водой и высушивали над сульфатом натрия. Летучие компоненты удаляли в вакууме для получения 45 мг указанного продукта в виде желтого масла. Оборудование Shimadzu для аналитической ВЭЖХ с использованием программного обеспечения Discovery VP: %A = 10% метанола, 90% воды, 0.1% трифторуксусной кислоты; %B = 90% метанола, 10% воды, 0.1% трифторуксусной кислоты; начальное %B = 50; конечное %B = 100; градиент = 6 мин; длительность анализа = 6 мин; скорость потока = 5 мл/мин; длина волны = 220 нм; колонка = Phenomenex Luna, 3.0 мм 50 мм, S10: время удерживания = 4.38 мин, MS m/z 639(MH+). 13-Циклогексил-3-метокси-6-(2-(4-морфолинилкарбонил)-3-тиенил)-7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота. В 2 драм склянке трет-бутил 13-циклогексил-3-метокси-6-(2-(4-морфолинилкарбонил)-3-тиенил)7H-индоло[2,1-a][2]бензазепин-10-карбоксилат (37.7 мг, 0.059 ммоль) растворяли в 1,2-дихлорэтане (1 мл) и TFA (1 мл, 12.98 ммоль). Реакционную смесь помещали в атмосферу азота и перемешивали при комнатной температуре в течение 1.5 ч. Реакционную смесь переносили в грушевидную колбу емкостью 25 мл, используя бензол для ополаскивания. Летучие компоненты удаляли в вакууме. Растворяли продукт в бензоле и выпаривали на ротационном испарителе для содействия удалению следовых количествTFA. Получали 41 мг указанного соединения в виде желто-коричневой пленки. Результаты анализа ЖХМС подтвердили продукт, который использовали без дальнейшей очистки на следующей стадии. ЖХМС: оборудование Shimadzu для аналитической ВЭЖХ с использованием программного обеспечения- 14015978 В 2 драм склянке растворяли 13-циклогексил-3-метокси-6-(2-(4-морфолинилкарбонил)-3-тиенил)7H-индоло[2,1-a][2]бензазепин-10-карбоновую кислоту (38 мг, 0.065 ммоль) в 1 мл безводного THF и добавляли CDI (19.03 мг, 0.117 ммоль). Реакционную смесь помещали в атмосферу азота и перемешивали при комнатной температуре примерно 1 ч. Реакционную смесь нагревали в атмосфере азота при 65C в течение 1 ч, затем охлаждали до комнатной температуры и добавляли N,N-диметилсульфамид (44 мг,0.357 ммоль), а затем DBU (13.8 мкл, 0.092 ммоль). Реакционную смесь накрывали и нагревали в атмосфере азота в течение ночи при 65C. Анализ аликвоты методом ЖХ-МС показал завершение реакции. В реакционную смесь добавляли дополнительно диметилсульфамид (19 мг, 0.153 ммоль) и DBU (13.8 мкл,0.092 ммоль). Реакционную смесь помещали в атмосферу азота и нагревали при 69C в течение 3.25 ч. Анализ реакционной смеси методом ЖХ-МС показал завершение реакции. Реакционную смесь разделяли между дихлорметаном и 1N водным раствором соляной кислоты. Водный слой экстрагировали дихлорметаном. Органические слои объединяли и отмывали последовательно 1N водным раствором соляной кислоты, затем 0.1 М раствором мононатрийфосфата (NaH2PO4) и высушивали над сульфатом натрия. Летучие компоненты удаляли в вакууме для получения желтого масла/пленки. Указанное сырое соединение высушивали в вакууме в течение ночи при комнатной температуре. Масса сырого продукта составила 43 мг в виде желтого/коричневого твердого вещества. Растворяли в смеси ацетонитрила иDMF, и очищали обращенно-фазовой ВЭЖХ при следующих условиях: оборудование Shimadzu для препаративной ВЭЖХ с использованием программного обеспечения Discovery VP: %A = 10% ацетонитрила,90% воды, 0.1% TFA; %B = 90% ацетонитрила, 10% воды, 0.1% TFA; начальное %B = 50; конечное %B = 100; градиент = 15 мин; длительность анализа = 25 мин; скорость потока = 52 мл/мин; длина волны = 220 нм: колонка = Waters Sunfire, 19100 мм, S7. Время собирания продукта=от 9.72 мин до 10.49 мин. Летучие компоненты удаляли в вакууме из фракции продукта для получения 14.2 мг указанного соединения в виде желтого твердого вещества. 1H ЯМР (500 МГц, хлороформ-d)ppm 1.17-1.30 (m, 1H) 1.32-1.50 (m,2H) 1.55 (d, J=11.29 Гц, 1H) 1.78 (d, J=10.99 Гц, 2H) 1.90-2.16 (m, 4H) 2.42-2.58 (m, 1H) 2.60-2.86 (m, 4H) 2.85-2.94 (m, 2H) 2.95 -3.04 (m, 2H) 3.06 (s, 6H) 3.10-3.30 (m, 1H) 3.91 (s, 3H) 4.56 (d, ,J=14.65 Гц, 1H) 5.09(d, J=14.65 Гц, 1H) 6.87 (s, 1H) 6.93 (d, J=2.75 Гц, 1H) 7.05 (dd, J=8.70, 2.59 Гц, 1H) 7.08 (d, J=4.88 Гц, 1H) 7.45 (d, J=4.88 Гц, 1H) 7.47-7.54 (m, 2H) 7.83 (s, 1H) 7.91 (d, J=8.55 Гц, 1H) 9.59 (s, 1H). ЖХ-МС: оборудование Shimadzu для аналитической ВЭЖХ с использованием программного обеспечения Discovery VP: 7H-Индоло[2,1-a][2]бензазепин-10-карбоновую кислоту, 13-циклогексил-3-метокси-6-(трибутилстаннил)-, 1,1-диметилэтиловый эфир (203 мг, 0.277 ммоль) растворяли в 1,4-диоксане (2.7 мл) в 2-5 мл сосуде конической формы для СВЧ с магнитной мешалкой. В реакцию добавляли этил 5-бром-2(метилтио)тиазол-4-карбоксилат (171 мг, 0.606 ммоль) и бис(трифенилфосфин)палладия(II) хлорид (14.9 мг, 0.021 ммоль). Реакционную смесь помещали в атмосферу азота и нагревали до 100C в течение 17.5 ч. Анализ реакционной смеси методом ВЭЖХ показал всего лишь примерно 45% конверсии исходного материала. Дополнительный катализатор бис(трифенилфосфин)палладия(II) хлорид (5.7 мг) добавляли в реакционную смесь и реакционную смесь нагревали в атмосфере азота при 110C в течение 23 ч. Летучие компоненты удаляли из реакционной смеси в вакууме и сырую реакционную смесь растворяли в 8 мл смеси DMF/ацетонитрил и очищали четырехкратным ведением 2 мл с помощью обращено-фазовой ВЭЖХ. Образец очищали на системе Shimadzu для жидкостной хроматографии высокого давления, используя программное обеспечение Discovery VP, сопряженное с блоком управления SCL-10A, автосэмплером SIL-10A и коллектором фракций FRC-10A. Образец растворяли в ацетонитриле и DMF, очищали на колонке Waters Sunfire Prep C18 OBD, 5 мкм, 19 мм 100 мм и измерения проводили с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 25 мл/мин, градиент от 40% растворителя A/60% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 15 мин при длительности анализа 30 мин, с помощью системы растворителей: %A = 10% ацетонитрила, 90% воды, 0.1% TFA %B = 90% ацетонитрила, 10% воды, 0.1% TFA. Время удерживания продукта = 26.6 мин. Летучие компоненты фракций продукта уда- 15015978 ляли в вакууме с помощью вакуумного концентратора SpeedVac в режиме умеренного нагревания. 1H ЯМР (500 МГц, хлороформ-d)ppm 1.16-1.26 (m, 1H) 1.30 (t, J=7.02 Гц, 3H) 1.33-1.56 (m, 3H) 1.60 (s, 10H) 1.63-1.83 (m, 5H) 1.94 (br.s, 1H) 1.98-2.16 (m, 3H) 2.71 (s, 3H) 2.82-2.92 (m, 1H) 3.90 (s, 3H) 4.28 (q, J=7.02 Гц, 2H) 4.53 (d, J=14.95 Гц, 1H) 5.52 (d, J=14.65 Гц, 1H) 6.98 (d, J==2.75 Гц, 1H) 7.03 (dd,J=8.85, 2.75 Гц, 1H) 7.49-7.54 (m, 2H) 7.65 (dd, J=8.55, 1.53 Гц, 1H) 7.81 (d, J=8.55 Гц, 1H) 8.13 (d, J=1.22 Гц, 1H). ЖХ-МС: время удерживания 3.08 мин; 645m/z (MH+). ЖХ данные записывали на высокоэффективном жидкостном хроматографе Shimadzu LC-10AS, оборудованном колонкой Phenomenex-Luna 10u C18 3.0 х 50 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 5 мл/мин, градиент от 100% растворителя A/ 0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 3 мин, время выдерживания 1 мин, длительность анализа 4 мин, при этом растворителем A являлась смесь 5% ацетонитрил /95%H2O/10 мМ ацетат аммония и растворителем B являлась смесь 5% H2O/95% ацетонитрил /10 мМ ацетат аммония. МС данные определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления. Представленная ниже схема иллюстрирует способы, которые могут применяться для приготовления промежуточных продуктов и соединений. 10-(трет-бутоксикарбонил)-13-циклогексил-3-метокси-7H-индоло[2,1-a][2]бензазепин-6-карбоновая кислота. Растворяли 10-(1,1-диметилэтил) 6-метил 13-циклогексил-3-(метилокси)-7H-индоло[2,1-a][2] бензазепин-6.10-дикарбоксилат (5.53 г, 11.02 ммоль) в THF (70 мл) при нагревании, добавляли DMF (20 мл) для поддержания растворимости, оставляли охлаждаться до комнатной температуры, после чего добавляли 1.0 М раствор гидроксида тетрабутиламмония в метаноле (33.1 мл, 33.1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем добавляли 0.1N водный раствор соляной кислоты с последующим 0.1 М водным раствором NaH2PO4. Фазы разделяли, последовательно отмывали органический слой 1.0N водным раствором соляной кислоты, 0.1 М водным растворомNaH2PO4. Водный раствор повторно экстрагировали 1 этилацетатом. Фракции этилацетата объединяли и последовательно отмывали 0.1 М водным раствором NaH2PO4 и солевым раствором. Высушивали над сульфатом магния, фильтровали и растворители удаляли в вакууме для получения ярко-желтого твердого вещества. Высушивали продукт в вакууме при комнатной температуре для получения 5.21 г (97%). 1H- 16015978 ЯМР (500 МГц, хлороформ-d)ppm 1.12-1.28 (m, 2H) 1.28-1.45 (m, 2H) 1.46-1.60 (m, 2H) 1.63 (s, 9H) 1.66-1.96 (m, 4H) 1.96-2.16 (m, 3H) 2.76-2.84 (m, 1H) 3.91 (s. 3H) 4.18 (br.s., 1H) 5.66 (br.s, 1H) 7.00 (d,J=2.44 Гц, 1H) 7.10 (dd, J=8.55, 2.75 Гц, 1H) 7.53 (d, J=8.54 Гц, 1H) 7.65 -7.71 (m, 1H) 7.82 (d, J=8.24 Гц,1H) 7.93 (s, 1H) 8.22 (s, 1H). ЖХ-МС время удерживания 1.47 мин; 486 m/z (MH-). ЖХ данные записывали на высокоэффективном жидкостном хроматографе фирмы Shimadzu LC-10AS, оборудованном колонкой Waters Xterra MS 7u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования: скорость потока 5 мл/мин, градиент от 100% растворителя A/ 0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 2 мин, время выдерживания 1 мин, длительность анализа 3 мин, при этом растворителем A являлась смесь 5% ацетонитрил / 95% H2O /10 мМ ацетат аммония и растворителем B являлась смесь 5% H2O/95% ацетонитрил /10 мМ ацетат аммония. МС данные определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления.[2]бензазепин-6-карбоновой кислоты (1.00 г, 2.051 ммоль) растворяли в DMF (10 мл) и в реакционную смесь добавляли карбонат калия (0.624 г, 4.51 ммоль) с последующим метил изоцианоацетатом (0.24 мл,2.64 ммоль). Реакционную смесь перемешивали в атмосфере азота при комнатной температуре примерно в течение 5 мин, затем охлаждали до 0C. Дифенилфосфорил азид (0.5 мл, 2.320 ммоль) медленно добавляли в реакционную смесь в течение 10 мин. Реакционную смесь перемешивали при 0C в атмосфере азота и оставляли медленно нагреваться до комнатной температуры в течение ночи. Реакционную смесь разбавляли 100 мл смеси бензол/этилацетат (1:1) и отмывали водой. Водный слой реэкстрагировали этилацетатом. Органические экстракты объединяли и отмывали последовательно 0.1 М водным раствором лимонной кислоты, насыщенным водным бикарбонатом натрия и затем солевым раствором и высушивали над сульфатом магния. Фильтровали и удаляли летучие компоненты в вакууме. Хроматографировали на колонке, заполненной суспензией 43.4 г силикагеля в смеси 5% этилацетат/дихлорметан. Элюировали смесью 5% этилацетат/дихлорметан. Объединение чистых фракций продукта и удаление летучих компонентов в вакууме позволило получить 215 мг аморфного твердого вещества желтого цвета. Объединение менее чистых фракций позволило получить дополнительно 189 мг продукта с чистотой более 92%. 1H ЯМР (500 МГц,хлороформ-d)ppm 1.11-1.29 (m, 2H) 1.30-1.48 (m, 3H) 1.57 (s, 2H) 1.61 (s, 10H) 1.69-1.80 (m, 2H) 1.861.98 (m, 1H) 1.99-2.13 (m, 4H) 2.76-2.90 (m, 1H) 3.92 (s, 3H) 3.98 (s, 3H) 4.47 (d, J=12.82 Гц, 1H) 5.84 (d,J=14.65 Гц, 1H) 7.02 (d, J=2.44 Гц, 1H) 7.07 (dd, J=8.55, 2.75 Гц, 1H) 7.53 (d, J=8.55 Гц, 1H) 7.65-7.71 (m,1H) 7.82 (d, J=8.24 Гц, 1H) 7.87 (s, 1H) 8.08 (s, 1H) 8.16 (s, 1H). ЖХ-МС время удерживания 2.75 мин; m/z(MH+). Данные ЖХ записывали на высокоэффективном жидкостном хроматографе Shimadzu LC-10AS,оснащенном колонкой Waters Xterra MS 7u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования: скорость потока 5 мл/мин, градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 3 мин, время удерживания 0 мин, длительность анализа 3 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/10 мМ ацетат аммония и растворителем B являлась смесь 5% H2O/95% ацетонитрил/10 мМ ацетат аммония. Данные МС определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления.(3.0 мл) и в реакционную смесь добавляли гидроксид тетрабутиламмония (1.1 мл, 1.100 ммоль) (1.0 М раствор в метаноле). Реакционную смесь помещали в атмосферу азота и перемешивали при комнатной- 17015978 температуре в течение 2 ч. В реакционную смесь добавляли 0.1 М водный раствор NaH2PO4 с последующим введением 0.1N водного раствора соляной кислоты. Продукт экстрагировали в этилацетате, и органическую фазу отмывали последовательно 0.1N водным раствором соляной кислоты, 0.1 М водным раствором NaH2PO4, солевым раствором и высушивали над сульфатом магния. Раствор продукта фильтровали, растворитель удаляли и продукт высушивали в вакууме для получения 191 мг желтого твердого вещества. 1H ЯМР (500 МГц, хлороформ-d)ppm 0.77-0.94 (m, 1H) 1.12-1.31 (m, 3H) 1.30-1.59 (m, 5H) 1.62 (s, 9H) 1.76 (d, J=11.29 Гц, 2H) 1.87-2.18 (m, 4H) 2.76-2.90 (m, 1H) 3.91 (s, 3H) 4.45 (d, J=14.04 Гц, 1H) 6.03 (d, J=12.21 Гц, 1H) 7.03 (d, J=2.44 Гц, 1H) 7.08 (dd, J=8.55, 2.75 Гц, 1H) 7.53 (d, J=8.85 Гц, 1H) 7.68 (d,J=8.24 Гц, 1H) 7.82 (d, J=8.55 Гц, 1H) 7.91 (s, 1H) 8.21 (d, J=5.80 Гц, 2H). ЖХ-МС время удерживания 1.86 мин; m/z 553 (MH-). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Waters Xterra MS 7u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования: скорость потока 5 мл/мин, градиент от 100% растворителя A/0% растворителя В к 0% растворителя A/100% растворителя В, градиент времени 3 мин,время удерживания 1 мин, длительность анализа 4 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/10 мМ ацетат аммония и растворителем B являлась смесь 5% H2O 95% ацетонитрил/10 мМ ацетат аммония. Данные МС определяли с помощью масс-спектрометра Micromass Platform трет-Бутил 13-циклогексил-3-метокси-6-(4-(4-морфолинилкарбонил)-1,3-оксазол-5-ил)-7Hиндоло[2,1-a][2]бензазепин-10-карбоксилат. 5-(10-(трет-Бутоксикарбонил)-13-циклогексил-3-метокси-7H-индоло[2,1-a][2]бензазепин-6-ил)-1,3 оксазол-4-карбоновой кислоты (185 мг, 0.334 ммоль) растворяли в DMF (3.2 мл), и добавляли Oбензотриазол-1-ил-N,N,N',N'-тетра-метилуроний тетрафторборат (193 мг, 0.600 ммоль). Накрытую реакционную смесь перемешивали при комнатной температуре в течение 25 мин и в реакционной смеси растворяли DMAP (163 мг, 1.334 ммоль), затем добавляли морфолин (0.058 мл, 0.667 ммоль). Реакционную смесь накрывали и перемешивали при комнатной температуре в течение ночи. Реакционную смесь вливали в 30 мл воды и экстрагировали дихлорметаном. Органический слой отмывали последовательно 0.1 М водным раствором лимонной кислоты, 0.1 М водным раствором NaH2PO4, затем высушивали над безводным сульфатом натрия. Образец фильтровали, летучие компоненты удаляли и образец высушивали в вакууме для получения 227 мг аморфного твердого оранжевого вещества. 1H ЯМР (500 МГц, хлороформ-d)ppm 1.16-1.50 (m, 7H) 1.53-1.61 (m, 6H) 1.62 (s, 10H) 1.76 (d, J=10.38 Гц, 2H) 1.83-2.15 (m, 5H) 3.40-3.84 (m, 7H) 3.83 -3.95 (m, 5H) 4.40 (d, J=11.60 Гц, 1H) 5.64 (d, J=12.21 Гц, 1H) 6.97 (d, J=2.75 Гц, 1H) 7.05 (dd, J=8.39, 2.59 Гц, 1H) 7.50 (d, J=8.55 Гц, 1H) 7.53 (s, 1H) 7.65 (d, J=8.24 Гц, 1H) 7.77-7.86 (m, 2H) 7.97-8.04 (m, 1H) 8.10 (s, 1H). ЖХ-МС время удерживания 2.64 мин m/z 624 (MH+). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Waters Xterra MS 7u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Использовали следующие условия элюирования: скорость потока 5 мл/мин, градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 3 мин, время удерживания 2 мин, и длительность анализа 5 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95%H2O/10 мМ ацетата аммония и растворителем B являлась смесь 5% H2O/95% ацетонитрил/10 мМ ацетат аммония. Данные МС определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления.[2,1-a][2]бензазепин-10-карбоксилат (203 мг, 0.325 ммоль) растворяли в 1,2-дихлоэтане (3 мл) в добавляли TFA (3 мл, 38.9 ммоль). Реакционную смесь помещали в атмосферу азота при 25C на 2 ч. Летучие- 18015978 компоненты удаляли в вакууме и остаток растворяли в 80 мл этилацетата при нагревании. Раствор отмывали 1N водным раствором соляной кислоты (240 мл), солевым раствором и высушивали над сульфатом магния. Полученный раствор фильтровали, летучие компоненты удаляли и образец высушивали в вакууме при комнатной температуре в течение ночи для получения 179 мг (97%) желтого твердого вещества. 1H ЯМР (500 МГц, хлороформ-d)ppm 0.74-1.03 (m, 4H) 1.06-1.31 (m, 6H) 1.32-1.50 (m, 3H) 1.56 (d,J=9.16 Гц, 2H) 1.77 (d, J=8.85 Гц, 2H) 1.86-2.18 (m, 5H) 2.83-2.91 (m, 1H) 3.60 (s, 3H) 3.64-3.89 (m, 4H) 3.88-3.93 (m, 4H) 3.95-4.08 (m, 1H) 4.43 (d, J=15.56 Гц, 1H) 5.64 (d, J=14.95 Гц, 1H) 6.99 (d, J=2.75 Гц, 1H) 7.07 (dd, J=8.70, 2.59 Гц, 1H) 7.48-7.56 (m, 2H) 7.85 -7.94 (m, 2H) 8.15 (s, 1H). ЖХ-МС время удерживания 1.65 мин; 568 m/z (MH+). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Waters Xterra MS 7u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 5 мл/мин,градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 3 мин, время удерживания 1 мин, длительность анализа 4 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/10 мМ ацетат аммония, растворителем B являлась смесь 5%H2O/95% ацетонитрил/10 мМ ацетат аммония. Данные МС определяли с помощью масс-спектрометра 13-циклогексил-N-(диметилсульфамоил)-3-метокси-6-(4-(4-морфолинилкарбонил)-1,3-оксазол-5 ил)-7H-индоло[2,1-a][2]бензазепин-10-карбоксамид. В 2 драм склянке 13-циклогексил-3-метокси-6-(4-(4-морфолинилкарбонил)-1,3-оксазол-5-ил)-7Hиндоло[2,1-a][2]бензазепин-10-карбоновой кислоты (40 мг, 0.070 ммоль) растворяли в THF (1 мл) и в реакционную смесь добавляли CDI (23.8 мг, 0.147 ммоль). Реакционную смесь помещали в атмосферу азота и перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь затем нагревали при 60C в течение 1 ч, охлаждали и вводили N,N-диметилсульфамид (46.5 мг, 0.375 ммоль) с последующим введением DBU (0.014 мл, 0.092 ммоль). Реакционную смесь помещали в атмосферу азота и нагревали в течение ночи (16 ч) при 60C. Реакционную смесь анализировали методом ВЭЖХ и дополнительно вводили N,N-диметилсульфамид (22.9 мг, 0.184 ммоль) и DBU (0.015 мл, 0.099 ммоль), после чего реакционную смесь нагревали до 70C в атмосфере азота в течение 5 ч. Реакционную смесь разделяли между 1N водным раствором соляной кислоты и дихлорметаном. Органическую фазу последовательно отмывали 1N водным раствором соляной кислоты и 0.1 М водным раствором NaH2PO4 и высушивали над сульфатом натрия. Растворитель удаляли в вакууме для получения 46 мг сырого продукта. Указанное соединение очищали на высокоэффективном жидкостном хроматографе фирмы Shimadzu с использованием программного обеспечения Discovery VP, сопряженного с блоком управления SCL-10A, автосэмплеромSIL-10A и коллектором фракций FRC-10A. Образец растворяли в смеси ацетонитрил/DMF (1:1), очищали на колонке Waters Sunfire Prep C18 OBD, 5 мкм, 19 мм 100 мм и измерения проводили с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 25 мл/мин, градиент от 70% растворителя A/30% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 12 мин при длительности анализа 20 мин. Система растворителей: %A = 10% ацетонитрила, 90% H2O, 0.1% TFA, %B = 90% ацетонитрила, 10% воды, 0.1%(s, 0.9H) 9.88 (s, 0.1H) 12.11 (s, 0.1H). ЖХ-МС время удерживания 1.40 мин; 672 m/z (MH-). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Waters Xterra MS 7uC18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования: скорость потока 5 мл/мин, градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 2 мин, время удерживания 1 мин, длительность анализа 3 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/10 мМ ацетат аммония, растворителем B являлась смесь 5% H2O/95% ацетонитрил/10 мМ ацетат аммония. Данные МС определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления. 13-циклогексил-ил-(изопропилсульфонил)-3-метокси-6-(4-(4-морфолинилкарбонил)-1,3-оксазол-5 гт.)-7H-индоло[2,1-a][2]бензазепин-10-карбоксамид. 13-циклогексил-3-метокси-6-(4-(4-морфолинилкарбонил)-1,3-оксазол-5-ил)-7H-индоло[2,1-a][2] бензазепин-10-карбоновой кислоты (40.8 мг, 0.072 ммоль) растворяли в THF (1 мл) и в реакционную смесь добавляли CDI (26 мг, 0.160 ммоль). Реакционную смесь помещали в атмосферу азота и перемешивали при комнатной температуре в течение 50 мин, затем нагревали в масляной ванне при 60C в течение 1.5 ч. Реакционную смесь охлаждали и добавляли пропан-2-сульфонамид (46 мг, 0.373 ммоль) с последующим DBU (0.022 мл, 0.144 ммоль). Реакционную смесь помещали в атмосферу азота и нагревали при 65C в течение ночи (16 ч). Реакционную смесь разделяли между дихлорметаном и 1.0N водным раствором соляной кислоты. Органический слой последовательно отмывали 1N водным раствором соляной кислоты, 0.1 М водным раствором NaH2PO4. Органический слой высушивали над сульфатом натрия и растворитель удаляли в вакууме для получения 50 мг аморфного твердого желтого вещества. Указанное вещество очищали на высокоэффективном жидкостном хроматографе фирмы Shimadzu с использованием программного обеспечения Discovery VP, сопряженного с блоком управления SCL-10A, автосэмплером SIL-10A и коллектором фракций FRC-10A. Образец растворяли в смеси ацетонитрил/DMF (1:1),очищали на колонке Waters Sunfire Prep C18 OBD, 5 мкм, 19100 мм и измерения проводили с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 25 мл/мин, градиент от 70% растворителя A/30% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 12 мин при длительности анализа 15 мин. Система растворителей: %A = 10% ацетонитрила, 90% воды, 0.1% TFA, %B = 90% ацетонитрила, 10% воды, 0.1%TFA. Удаление растворителей и сушка в вакууме позволили получить 28.3 мг желтого твердого вещества. 1H ЯМР (500 МГц, хлороформ-d)ppm 1.15-1.28 (m, 1.2H) 1.29-1.60 (m, 10.9H) 1.59-1.85 (m, 6.7H) 1.86-2.15 (m, 4.7H) 2.78-2.87 (m, 1.0H) 3.37-3.50 (m, 1.4H) 3.51-3.89 (m, 7.3H) 3.91 (s, 3.3H) 4.02-4.12 (m,1.5H) 4.15-4.26 (m, 0.9H) 4.42 (d, J=13.73 Гц, 0.9H) 4.54 (d, J=15.26 Гц, 0.1H) 5.54 (d, J=14.65 Гц, 0.9H) 6.57(d, J=14.04 Гц, 0.1 Н) 6.97 (d, J=2.44 Гц, 0.9H) 7.07 (dd., J=8.55, 2.44 Гц, 1.0H) 7.28 -7.35 (m, 0.3H) 7.487.54 (m, 2.0H) 7.62-7.67 (m, 1.0H) 7.75 (d, J=7.93 Гц, 0.1H) 7.82 (s, 1.0H) 7.87 (d, J=8.55 Гц, 1.0H) 8.21 (s,0.9H) 8.31 (s, 0.2H) 8.48 (s, 1.0H) 8.94 (d, J=9.15 Гц, 0.1H) 9.46 (s, 0.9H) 9.86 (s, 0.1H). ЖХ-МС время удерживания 1.26 мин; 671 m/z (MH-). Данные ЖХ записывали на жидкостном хроматографе ShimadzuUV-Vis при длине волны детектирования 220 нм. Условия элюирования: скорость потока 5 мл/мин, градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 2 мин, время удерживания 1 мин, длительность анализа 3 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/10 мМ ацетат аммония, растворителем B являлась смесь 5%H2O/95% ацетонитрил/10 мМ ацетат аммония. Данные МС определяли с помощью масс-спектрометра 13-Циклогексил-3-метокси-6-(4-(4-морфолинилкарбонил)-1,3-оксазол-5-ил)-N-(4-морфолинилсульфонил)-7H-индоло[2,1-a][2]бензазепин-10-карбоксамид. 13-Циклогексил-3-метокси-6-(4-(4-морфолинилкарбонил)-1,3-оксазол-5-ил)-7H-индоло[2,1-a][2] бензазепин-10-карбоновую кислоту (40.8 мг, 0.072 ммоль) растворяли в THF(1 мл) и в реакционную смесь добавляли CDI (26 мг, 0.160 ммоль). Реакционную смесь помещали в атмосферу азота и перемешивали при комнатной температуре в течение 50 мин, затем нагревали в масляной ванне при 60C в течение 1.5 ч. Реакционную смесь охлаждали и добавляли пропан-2-сульфонамид (46 мг, 0.373 ммоль) с последующим DBU (0.022 мл, 0.144 ммоль). Реакционную смесь помещали в атмосферу азота и нагревали при 65C в течение ночи (16 ч). Реакционную смесь разделяли между дихлорметаном и 1.0N водным раствором соляной кислоты. Органический слой отмывали последовательно 1N водным раствором соляной кислоты, 0.1 М водным раствором NaH2PO4. Органический слой высушивали над сульфатом натрия и- 20015978 растворитель удаляли в вакууме для получения 50 мг аморфного жестого твердого вещества. Указанное вещество очищали на высокоэффективном жидкостном хроматографе фирмы Shimadzu с использованием программного обеспечения Discovery VP, сопряженного с блоком управления SCL-10A, автосэмплером SIL-10A и коллектором фракций FRC-10A. Образец растворяли в смеси ацетонитрил/DMF (1:1),очищали на колонке Waters Sunfire Prep C18 OBD, 5 мкм, 19 мм 100 мм и измерения проводили с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 25 мл/мин, градиент от 70% растворителя A/30% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 12 мин при длительности анализа 15 мин. Система растворителей: %A = 10% ацетонитрила, 90% воды, 0.1% TFA, %B = 90% ацетонитрила, 10% воды, 0.1%TFA. Удаление растворителей и сушка в вакууме позволили получить 28.3 мг желтого твердого вещества. 1H ЯМР (500 МГц, хлороформ-d)ppm 1.15-1.28 (m, 1.3H) 1.30-1.46 (m, 2.4H) 1.48-1.61 (m, J=16.48 Гц, 1.2H) 1.77 (d, J=9.77 Гц, 2.3H) 1.87 -2.15 (m, 4.8H) 2.22-2.52 (m, 4.6H) 2.78-2.90 (m, 1.1H) 3.37-3.72 (m,8.9H) 3.76 (s, 6.2H) 3.80-3.89 (m, 3.2H) 3.91 (s, 3.6H) 4.08 (s, 0.3H) 4.13-4.23 (m, 1.0H) 4.42 (d, J=13.73 Гц,0.9H) 4.65 (d, J=14.95 Гц, 0.1H) 5.55 (d, J=14.04 Гц, 1.0H) 6.97 (d, J=2.44 Гц, 1.0H) 7.07 (dd, J=8.70, 2.59 Гц,1.0H) 7.27-7.33 (m, 0.2H) 7.38 (s, 0.1H) 7.46-7.55 (m, 2.0H) 7.60 (d, J=9.77 Гц, 1.0H) 7.78 (d, J=8.24 Гц,0.1H) 7.83 (s, 1.0H) 7.87 (d, J=8.55 Гц, 1H) 8.07 (s, 0.1H) 8.10 (d, J=4.27 Гц, 0.1H) 8.31 (d, J=8.54 Гц, 0.1H) 8.42 (s, 0.9H) 8.94 (d, J=9.16 Гц, 0.1H) 9.55 (s, 0.9H) 9.60 (s, 0.1H). ЖХ-МС время удерживания 1.63 мин; 714 m/z (MH-). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Waters Xterra MS 7u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 5 мл/мин, градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/ 100% растворителя B, градиент времени 3 мин, время удерживания 1 мин, длительность анализа 4 мин. при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/10 мМ ацетат аммония, растворителем B являлась смесь 5% H2O/95% ацетонитрил/10 мМ ацетат аммония. Данные МС определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления. 13-Циклогексил-N-(циклопропилсульфонил)-3-метокси-6-(4-(4-морфолинилкарбонил)-1,3-оксазол 5-ил)- 7H-индоло[2,1-a][2]бензазепин-10-карбоксамид. 13-Циклогексил-3-метокси-6-(4-(4-морфолинилкарбонил)-1,3-оксазол-5-ил)-7H-индоло[2,1-a][2] бензазепин-10-карбоновую кислоту (40 мг, 0.070 ммоль) растворяли в THF (1 мл) и в реакционную смесь добавляли CDI (26 мг, 0.160 ммоль). Реакционную смесь помещали в атмосферу азота и перемешивали при комнатной температуре в течение 1 ч 50 мин, затем нагревали на масляной ванне при 65C в течение 1 ч 10 мин. Реакционную смесь охлаждали и добавляли циклопропансульфонамид (48 мг, 0.396 ммоль),затем DBU (0.022 мл, 0.146 ммоль). Реакционную смесь помещали в атмосферу азота и нагревали при 68C в течение ночи (18 ч). Реакционную смесь разделяли между дихлорметаном и 1.0N водным раствором соляной кислоты. Органический слой отмывали последовательно 1N водным раствором соляной кислоты, 0.1 М водным раствором NaH2PO4. Органический слой высушивали над сульфатом натрия, и растворитель удаляли в вакууме для получения 62 мг аморфного желтого твердого вещества. Указанное вещество очищали на высокоэффективном жидкостном хроматографе фирмы Shimadzu с использованием программного обеспечения Discovery VP, сопряженного с блоком управления SCL-10A, автосэмплером SIL-10A и коллектором фракций FRC-10A. Образец растворяли в смеси ацетонитрил/DMF (1:1),очищали на колонке Waters Sunfire Prep C18 OBD, 5 мкм, 19100 мм и измерения проводили с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 25 мл/мин, градиент от 70% растворителя A/30% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 15 мин при длительности анализа 20 мин. Система растворителей: %A = 10% ацетонитрила, 90% воды, 0.1% TFA, %B = 90% ацетонитрила, 10% воды, 0.1%TFA. Удаление растворителей и сушка в вакууме позволили получить 30.8 мг указанного соединения в виде желтого аморфного твердого вещества. 1H ЯМР (500 МГц, хлороформ-d)ppm 0.99-1.28 (m, 4.0H) 1.29-1.45 (m, 3.9H) 1.47-1.68 (m, 7.9H) 1.75 (m, 2.3H) 1.84-2.17 (m, 4.5H) 2.77-2.88 (m, 1.0H) 3.14-3.23 (m,1.2H) 3.33-3.89 (m, 8.3H) 3.91 (s, 3.3H) 4.09 (s, 0.5H) 4.17 (s, 0.9H) 4.42 (d, J=14.34 Гц, 0.9H) 5.54 (d,J=15.56 Гц, 0.9H) 6.60 (d, 0.1H) 6.97 (d, J=2.44 Гц, 1.0H) 7 07 (dd, J=8.55, 2.75 Гц, 1.0H) 7.27-7.35 (m, 0.3H) 7.49 (s, 1.0H) 7.52 (d, J=8.85 Гц, 1.0H) 7.64 (dd, J=8.55, 1.53 Гц, 1.0H) 7.75 (d, J=7.94 Гц, 0.2H) 7.82 (s,1.0H) 7.87 (d, J=8.55 Гц, 1.0H) 8.21 (s, 0.1H) 8.31-8.36 (m, 0.3H) 8.43 (d, J=1.53 Гц, 1.0H) 8.95 (d, J=9.16 Гц,0.2H) 9.61 (s, 1.0H) 9.82 (s, 0.1H). ЖХ-МС время удерживания 1.59 мин; 669 m/z (MH-). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Waters Xterra MS 7u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия- 21015978 элюирования: скорость потока 5 мл/мин, градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 3 мин, время удерживания 1 мин, продолжительность анализа 4 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/10 мМ ацетат аммония, растворителем B являлась смесь 5% H2O/95% ацетонитрил/10 мМ ацетат аммония. Данные МС определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления. Представленная ниже схема иллюстрирует способы, которые могут применяться для приготовления промежуточных продуктов и соединений. Дополнительные варианты в методике, которые могут применяться для синтеза промежуточных продуктов и соединений, показаны в следующей схеме. Дальнейшие варианты методики, которые могут применяться для синтеза дальнейших промежуточных продуктов и соединений, показаны в представленной ниже схеме. трет-Бутил 6-ацетил-13-циклогексил-3-метокси-7H-индоло[2,1-a][2]бензазепин-10-карбоксилат. К суспензии трет-бутил 3-циклогексил-2-(2-формил-4-метоксифенил)-1H-индол-6-карбоксилата (2 г, 4.61 ммоль) в диоксане (9.2 мл) добавляли 2-трет-бутилимино-2-диэтиламино-1,3-ди- метилпергидро- 22015978 диазафосфорин (2.00 мл, 6.92 ммоль), затем бут-3-ен-2-она (0.756 мл, 9.23 ммоль) в 20 мл сосуд для СВЧ. Гетерогенную реакционную смесь помещали в атмосферу азота и нагревали в микроволновой печи при 120C в течение 40 мин. Данную реакцию проводили еще два раза и последний раз с трет-бутил-3 циклогексил-2-(2-формил-4-метоксифенил)1H-индол-6-карбоксилатом (2.51 г, 5.79 ммоль), растворенным в диоксане (11.5 мл), добавляли BEMP (2.5 мл, 8.64 ммоль) с последующим добавлением бут-3-ен-2 она (0.95 мл, 11.46 ммоль). Каждую часть реакции обрабатывали, в то время как следующий цикл выполнялся в микроволновой печи. Обработка заключалась в разделении реакционной смеси между этилацетатом и 1N водным раствором соляной кислоты в 250 мл сортировочной воронке. Водную фазу повторно экстрагировали один раз этилацетатом и органические фазы объединяли и отмывали последовательно 1N водным раствором соляной кислоты, 0.1 М раствором NaH2PO4 и солевым раствором. Раствор затем объединяли с предыдущим раствором в 1 л колбе Эрленмейера, содержащей сульфат магния. Фильтровали и удаляли летучие компоненты, высушивали в вакууме при комнатной температуре в течение ночи для получения 10.67 г желто-оранжевой пены. Адсорбировали сырой продукт на 25 г силикагеля с помощью дихлорметана, летучие компоненты удаляли в вакууме. Хроматографировали на колонке,заполненной суспензией 299 г силикагеля в смеси 20% этилацетата в гексане, и элюировали 20% этилацетатом в гексане. Полученные хроматографией чистые фракции продукта объединяли и растворители удаляли в вакууме. Остаток растворяли в бензоле и удаляли в вакууме для облегчения удаления следовых количеств этилацетата. Указанное соединение в виде желтой пены/аморфного твердого вещества высушивали в вакууме в течение ночи при комнатной температуре для получения 6.83 г (71.7%). 1H ЯМР(500 МГц, хлороформ-d)ppm 1.12-1.29 (m, 1H) 1.30-1.61 (m, 4H) 1.64 (s, 10H) 1.67-2.00 (m, 4H) 1.982.19 (m, 3H) 2.43 (s, 3H) 2.75-2.87 (m, 1H) 3.85-4.01 (m, 4H) 5.86 (s, 1H) 7.00 (d, J=2.75 Гц, 1H) 7.11 (dd,J=8.55, 2.75 Гц, 1H) 7.35 (s, 1.8 Н, бензол) 7.69 (dd, J=8.55, 1.53 Гц, 1H) 7.82 (d, J=8.24 Гц, 1H) 8.24 (s, 1H). ЖХ-МС время удерживания 3.28 мин; m/z (MH+). Данные ЖХ записывали на жидкостном хроматографеSPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования: скорость потока 5 мл/мин, градиент от 30% растворителя A/70% растворителя B до 0% растворителя A/100% растворительB, градиент времени 5 мин, время выдерживания 1 мин, длительность анализа 6 мин, при этом растворителем A являлась смесь 10% MeOH/90% H2O/0.1% трифторуксусная кислота и растворителем B являлась смесь 10% H2O/90% MeOH/0.1% трифторуксусная кислота. Данные МС определяли с помощью массспектрометра Micromass Platform LC в режиме электрораспыления.LHMDS (5.41 мл, 5.41 мл) в THF (15.0 мл) при -78C и перемешивали в течение 15 мин. К полученному раствору при -78C добавляли этилцианоформиат (0.510 мл, 5.15 ммоль) и перемешивание продолжали в течение 30 мин. Добавляли насыщенный водный раствор NH4Cl (50 мл) и водный слой экстрагировалиCHCl3 (250 мл). Органическую фазу высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Хроматография концентрата на силикагеле (2:1 метиленхлорид:гексан) позволила получить указанное соединение (1.75 г, 61%) в виде желтого масла. MS m/z 558 (MH+). Предыдущие реакции, которые протекали аналогично вышеуказанной реакции, и в которых исходный материал 7Hиндоло[2,1-a][2]бензазепин-10-карбоновая кислота, 6-ацетил-13-циклогексил-3-метокси-, 1,1-диметилэтиловый эфир все еще присутствовал, разделяли при следующих условиях. Эта методика описывает отделение трет-бутил 13-циклогексил-6-(3-этокси-3-оксопропаноил)-3-метокси-7H-индоло[2,1-a][2]бензазепин-10-карбоксилата (требуемый продукт) от исходного материала кетона, трет-бутил-6-ацетил-13 циклогексил-3-метокси-7H-индоло[2,1-a][2]бензазепин-10-карбоксилата. Предполагалось, что общая масса материалов составляет 2.6 г. 3.9 г смеси образца в виде оранжевого масла растворяли в дихлорметане и адсорбировали на 10 г силикагеля. Летучие компоненты удаляли в вакууме с помощью роторного испарителя. Образец, который был адсорбирован на силикагеле, наносили на колонку с 294 г силикагеля,который представлял собой суспензию в смеси 30% диэтилового эфира в гексане. Слой песка помещали на верхнюю часть адсорбированного образца для облегчения введения растворителя. Примерный размер заполнения колонки силикагелем был следующим: диаметр 75 ммвысота 175 мм. Продукт элюировали градиентом от 30% диэтилового эфира в гексане до 35% диэтилового эфира в гексане, до 40% диэтило- 23015978 вого эфира в гексане. Элюировали приблизительно 1 л смеси 30% Et2O/гексан, затем 1 л смеси 35%Et2O/гексан и в конце смесью 40% Et2O/гексан. Объемы собранных фракций составили примерно от 125 до 150 мл. Продукты фракций объединяли и летучие компоненты удаляли и указанный кетоэфир высушивали в вакууме для получения 1.63 г желто-оранжевого аморфного твердого вещества. 1H ЯМР(m, 1.0H) 3.64-3.79 (m, 0.8H) 3.88 (s, 0.7H) 3.90 (s, 0.7H) 3.92 (s, 2.6H) 3.94-4.06 (m, 0.7H) 4.12 (q, J=7.22 Гц, 1.9H) 4.21-4.33 (m, 0.7H) 4.39 (q, J=7.12 Гц, 0.2H) 5.67 (s, 0.2H) 5.71-5.90 (m, 0.7H) 6.95-7.02 (m, 1.0H) 7.06 (dd, J=8.55, 2.75 Гц, 0.2H) 7.12 (dd, J=8.70, 2.59 Гц, 0.82H) 7.46-7.57 (m, 1.2H) 7.64 (s, 0.8H) 7.69 (d,J=8.55 Гц, 0.9H) 7.76-7.85 (m, 0.9H) 8.14 (s, 0.2H) 8.22 (s, 0.8H) 12.40 (s, 0.1H). ЖХ-МС время удерживания 2.78 мин; 556 m/z (MH-). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS,оснащенном колонкой Waters Xterra 7u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 5 мл/мин,градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 3 мин, время удерживания 1 мин, длительность анализа 4 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/10 мМ ацетат аммония и растворителем B являлась смесь 5%H2O/95% ацетонитрил/0.1% 10 мМ ацетат аммония. Данные МС определяли с помощью массспектрометра Micromass Platform LC в режиме электрораспыления. трет-Бутил 13-циклогексил-6-2E,Z)-3-(диметиламино)-2-(этоксикарбонил)-2-пропеноил)-3-метокси-7H-индоло[2,1-a][2]бензазепин-10-карбоксилат. трет-Бутил 13-циклогексил-6-(3-этокси-3-оксопропаноил)-3-метокси-7H-индоло[2,1-a][2]бензазепин-10-карбоксилат (1.63 г, 2.92 ммоль) растворяли в N,N-диметилформамид диметилацетале (7.0 мл,52.7 ммоль) в 50 мл колбе с плоским дном. Реакционную смесь помещали в атмосферу азота и нагревали в масляной ванне с обратным холодильником (110C) в течение 2.75 ч. Реакционную смесь охлаждали в атмосфере азота и летучие компоненты испаряли в вакууме для получения оранжевой пены. TCX анализ(SiO2 пластина, элюирование - 50% диэтиловый эфир в гексане) подтвердил завершение реакции. Этот материал высушивали в вакууме при комнатной температуре в течение ночи для получения 1.87 г енаминового промежуточного продукта в виде оранжевой янтарной пены, которую использовали без дальнейшей очистки для следующей стадии. ЖХ-МС промежуточного енамина: ЖХ-МС время удерживания 2.81 мин; 613 m/z (MH+). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Phenomenex-Luna 10u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования: скорость потока 5 мл/мин, градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 2 мин, время удерживания 1 мин, длительность анализа 3 мин, при этом растворителем A являлась смесь 10% MeOH/90% H2O/0.1% трифторуксусная кислота и растворителем B являлась смесь 10% H2O/90%MeOH/0.1% трифторуксусная кислота. Данные МС определяли с помощью масс-спектрометра Micromass 7H-Индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[4-(этоксикарбонил)-1 метил-1H-пиразол-5-ил]-3-метокси-, 1,1-диметилэтиловый эфир и 7H-индоло[2,1-a][2]бензазепин-10 карбоновая кислота, 13-циклогексил-6-[4-(этоксикарбонил)-1-метил-1H-пиразол-3-ил]-3-метокси-, 1,1 диметилэтиловый эфир. Промежуточный енамин, трет-бутил 13-циклогексил-6-2E,Z)-3-(диметиламино)-2-(этоксикарбонил)-2-пропеноил)-3-метокси-7H-индоло[2,1-a][2]бензазепин-10-карбоксилат (1.83 г, 2.99 ммоль) растворяли в чистом этаноле (10 мл). В течение нескольких минут растворения в этаноле реакционная смесь становилась гетерогенной с образованием желто-оранжевого осадка с тонкими частицами. В реакционную смесь добавляли метилгидразин (0.173 мл, 3.29 ммоль) и реакционную смесь помещали в атмосферу- 24015978 азота с конденсатором. Реакционную смесь нагревали до 80C, при этом смесь оставалась гетерогенной при 80C. Дополнительно добавляли 5 мл чистого этанола и реакционную смесь перемешивали при 80C в течение 15 мин. Реакционная смесь все еще оставалась гетерогенной, затем добавляли 1,4-диоксан (5 мл), после чего реакционная смесь медленно становилась гомогенной. Реакционную смесь нагревали в течение 2 ч, затем охлаждали и летучие компоненты удаляли в вакууме для получения оранжевой янтарной пены. Остаток растворяли в бензоле и затем летучие компоненты удаляли в вакууме и образец высушивали при комнатной температуре в течение ночи в вакууме для получения 1.79 г желтого аморфного твердого вещества/пены. ЖХ-МС анализ показал два возможных изомерных продукта. 102 мг сырого продукта очищали обращено-фазовой препаративной ВЭЖХ. Образец очищали на системе жидкостной хроматографии высокого давления Shimadzu с использованием программного обеспечения Discovery VP,сопряженного с блоком управления SCL-10A, автосэмплером SIL-10A и коллектором фракций FRC-10A. Образец растворяли в смеси ацетонитрил/DMF (1:1) (4 мл), очищали на колонке Waters Sunfire Prep C18OBD, 5 мкм, 19100 мм и измерения проводили с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 мн. Условия элюирования были следующие: скорость потока 25 мл/мин, градиент от 25% растворителя A/75% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 10 мин при длительности анализа 20 мин с использованием системы растворителей: %A = 10% ацетонитрила, 90% воды, 0.1% TFA, %B = 90% ацетонитрила, 10% воды, 0.1% TFA. Первым продуктом элюирования являлся 7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[4(этоксикарбонил)-1-метил-1H-пиразол-5-ил]-3-метокси-, 1,1-диметилэтиловый эфир со временем удерживания 11.7 мин со следовыми количествами продукта 7H-индоло[2,1-a][2]бензазепин-10-карбоновой кислоты, 13-циклогексил-6-[4-(этоксикарбонил)-1-метил-1H-пиразол-3-ил]-3-метокси-, 1,1-диметилэтиловым эфиром со временем удерживания 14.5 мин. 7H-Индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[4-(этоксикарбонил)-1 метил-1H-пиразол-5-ил]-3-метокси-, 1,1-диметилэтиповый эфир. 1H ЯМР (500 МГц, хлороформ-d)ppm 1.13-1.27 (m, 1H) 1.30 (t, J=7.02 Гц, 3H) 1.34-1.55 (m, 3H) 1.58 (s, 9H) 1.61-1.84 (m, 3H) 1.85-2.00 (m, 1H) 1.99-2.18 (m, 3H) 2.86 (t, J-11.75 Гц, 1H) 3.28 (s, 3H) 3.90 (s, 3H) 4.27 (d, J=4.27 Гц, 2H) 4.71 (s, 1H) 4.97 (s,1H) 6.77 (s, 1H) 6.93 (d, J=2.44 Гц, 1H) 7.07 (dd, J=8 55, 2.44 Гц, 1H) 7.65 (d, J=8.55 Гц, 1H) 7.79-7.88 (m,2H) 7.97 (s, 1H). ЖХ-МС время удерживания 3.92 мин; 596 m/z (MH+). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Phenomenex-Luna 10u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 5 мл/мин, градиент от 70% растворителя A/30% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 5 мин, время удерживания 1 мин, длительность анализа 6 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/10 мМ ацетат аммония и растворителем B являлась смесь 5% H2O/95% ацетонитрила/ 10 мМ ацетата аммония. Данные МС определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления. 7H-Индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[4-(этоксикарбонил)-1 метил-1H-пиразол-3-ил]-3-метокси-, 1,1-диметилэтиловый эфир. 1H ЯМР (500 МГц, хлороформ-d)ppm 1.13-1.26 (m, 1H) 1.30 (t, J=7.17 Гц, 3H) 1.33-1.60 (m, 3H) 1.61 (s, 9H) 1.64-1.83 (m, 3H) 1.91 (s, 2H) 1.982.16 (m, 3H) 2.82 -2.91 (m, 1H) 3.90 (s, 3H) 3.94 (s, 3H) 4.20-4.30 (m, 2H) 4.41 (d, J=14.04 Гц, 1H) 5.76 (d,J=14.04 Гц, 1H) 6.96-7.03 (m, 2H) 7.49-7.54 (m, 1H) 7.64 (dd, J=8.39, 1.37 Гц, 1H) 7.79 (d, J=8.55 Гц, 1H) 7.84 (s, 1H) 7.90 (s, 1H) 8.26 (s, 1H). ЖХ-МС время удерживания 4.26 мин; 596 m/z (MH+). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Phenomenex-Luna 10u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 5 мл/мин, градиент от 70% растворителя A/30% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 5 мин, время удерживания 1 мин, длительность анализа 6 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95%H2O/10 мМ ацетат аммония и растворителем B являлась смесь 5% H2O/95% ацетонитрила/10 мМ ацетата аммония. Данные МС определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления. Остаток образца (1.615 г) адсорбировали на 4 г силикагеля с помощью дихлорметана и хроматографировали колонке, заполненной суспензией 50 г силикагеля в смеси 2% этилацетата в дихлорметане и элюировали 2% этилацетатом в дихлорметане. Первым компонентом элюирования являлся побочный продукт, 7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[4(этоксикарбонил)-1-метил-1H-пиразол-3-ил]-3-метокси-, 1,1-диметилэтиловый эфир, выделено 179 мг. Второй компонент, 7H-индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[4(этоксикарбонил)-1-метил-1H-пиразол-5-ил]-3-метокси-, 1,1-диметилэтиловый эфир был главным компонентом для элюирования и его получали в количестве 966 мг. 7H-Индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[4-(этоксикарбонил)-1 метил-1H-пиразол-5-ил]-3-метокси-. 7H-Индоло [2,1-a] [2] бензазепин-10-карбоновую кислоту, 13-циклогексил-6-[4-(этоксикарбонил)-1 метил-1H-пиразол-5-ил]-3-метокси-, 1,1-диметилэтиловый эфир (53 мг, 0.089 ммоль) растворяли в 1,2 дихлорэтане (2 мл) в атмосфере азота. Затем добавляли трифторуксусную кислоту (2 мл, 26.0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2.5 ч. Летучие компоненты удаляли в вакууме и остаток растворяли в бензоле, после чего полученный раствор выпаривали при пониженном давлении для удаления остаточного количества TFA. Этот процесс повторяли один раз. Это позволило получить указанное соединение в виде желтого твердого вещества (46.2 мг). 1H ЯМР (500 МГц, хлороформ-d)ppm 1.12 -1.26 (m, 1H) 1.31 (t, J=7.02 Гц, 3H) 1.40 (s, 2H) 1.51-1.89 (m, 3H) 1.87-2.23(m, 4H) 2.87 (t, J=11.29 Гц, 1H) 3.29 (s, 3H) 3.91 (s, 3H) 4.27 (br.s, 2H) 4.73 (br.s, 1H) 4.97 (br.s, 1H) 6.78 (s,1H) 6.94 (d, J=2.14 Гц, 1H) 7.08 (dd, J=8.55, 2.44 Гц, 1H) 7.54 (d, J=8.85 Гц, 1H) 7.77 (d, J=8.24 Гц, 1H) 7.86-7.95 (m, 2H) 7.98 (s, 1H) 8.36 (br.s, 2H). ЖХ-МС время удерживания 1.84 мин; 538 m/z (MH-). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PhenomenexLuna 10u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 5 мл/мин, градиент от 70% растворителя A/30% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 5 мин, время удерживания 0 мин, длительность анализа 5 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/10 мМ ацетат аммония и растворителем B являлась смесь 5% H2O/95% ацетонитрила/10 мМ ацетата аммония. Данные МС определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления. 1H-Пиразол-4-карбоновая кислота, 5-[13-циклогексил-3-метокси-10-(1-метилэтил)сульфонил] амино]карбонил]-7H-индоло [21-а][2]бензазепин-6-ил]-1-метил-этиловый эфир. 7H-Индоло[2,1-a][2]бензазепин-10-карбоновую кислоту, 13-циклогексил-6-[4-(этоксикарбонил)-1 метил-1H-пиразол-5-ил]-3-метокси- (981 мг, 1.818 ммоль) растворяли в THF (18 мл). Карбонилдиимидазол (649 мг, 4.00 ммоль) добавляли в реакцию. Реакционную смесь помещали в атмосферу азота и перемешивали при комнатной температуре в течение 45 мин, затем нагревали с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали в атмосфере азота и вводили в реакцию пропан-2-сульфамид(1164 мг, 9.45 ммоль) с последующим DBU (0.548 мл, 3.64 ммоль). Затем реакционную смесь погружали в масляную ванну при 80C в атмосфере азота и нагревали в течение ночи при 70-80C. Реакционную смесь затем разбавляли этилацетатом и органический слой отмывали последовательно 1.0N водным раствором соляной кислоты, 0.1 М водным раствором NaH2PO4 и солевым раствором. Органический слой высушивали над MgSO4, фильтровали и удаляли летучие компоненты в вакууме для получения желтой пены, которую высушивали в вакууме при комнатной температуре в течение ночи для получения 1.170 г желтого аморфного твердого вещества. Анализ протонного спектра выявил присутствие в образце пропан-2-сульфонамида (1.41 ppm, d, 500 МГц, CDCl3). Сырой образец растворяли в примерно 200 мл дихлорметана и отмывали 2125 мл воды, затем последовательно 1N водным раствором соляной кислоты,20.1 М NaH2PO4, затем снова 1N водным раствором соляной кислоты. Раствор дихлорметана высушивали над сульфатом натрия, фильтровали и летучие компоненты удаляли, после чего продукт высушивали в вакууме при комнатной температуре в течение ночи для получения 1.046 г (89%) указанного соединения в виде желтого аморфного твердого вещества. 1H ЯМР (500 МГц, хлороформ-d)ppm 0.80-0.90 (m,1H) 1.20-1.27 (m, 4H) 1.30 (t, J=7.02 Гц, 4H) 1.32-1.43 (m, 3H) 1.46 (d, J=7.02 Гц, 6H) 1.53-1.64 (m, 3H) 1.79(d, J=9.77 Гц, 3H) 1.85-2.13 (m, 5H) 2.81-2.91 (m, 1H) 3.90 (s, 3H) 4.00-4.10 (m, 1H) 4.24 (s, 2H) 4.71 (d,J=12.21 Гц, 1H) 4.99 (d, J=16.48 Гц, 1H) 6.77 (s, 1H) 6.94 (d, J=2.44 Гц, 1H) 7.08 (dd, J=8.55, 2.75 Гц, 1H) 7.38 (dd, J=8.55, 1.22 Гц, 1H) 7.52 (d, J=8.85 Гц, 1H) 7.76 (d, J=1.22 Гц, 1H) 7.86-7.92 (m, 2H) 8.26 (br.s,1H). ЖХ-МС время удерживания 1.79 мин; 643 m/z (MH-). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Phenomenex-Luna 10u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования: скорость- 26015978 потока 5 мл/мин, градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 3 мин, время удерживания 1 мин, длительность анализа 4 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/10 мМ ацетат аммония и растворителем B являлась смесь 5% H2O/95% ацетонитрила/10 мМ ацетата аммония. Данные МС определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления. 1H-Пиразол-4-карбоновая кислота, 5-[13-циклогексил-3-метокси-10-(1-метилэтил)сульфонил] амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-метил-. 1H-Пиразол-4-карбоновую кислоту, 5-[13-циклогексил-3-метокси-10-(1-метилэтил)сульфонил] амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-метил-, этиловый эфир (1.044 г, 1.619 ммоль) растворяли в THF (11 мл) при нагревании. Затем добавляли DMF (5 мл) и смесь осторожно нагревали для обеспечения растворения. После чего смесь охлаждали до комнатной температуры и вводили тетрабутиламмония гидроксид(6.5 мл, 6.50 ммоль) (1.0 М раствор в метаноле). Полученную смесь затем перемешивали при комнатной температуре в атмосфере азота в течение 2.5 ч, и развитие реакции контролировали с помощью ЖХ-МС. Результаты показали преобладание метилового и этилового эфиров. Затем смесь перемешивали дополнительно в течение 3 ч, после чего вводили еще 2.0 мл (2 ммоль) тетрабутиламмония гидроксида (1.0 М раствор в метаноле) и реакционную смесь перемешивали в атмосфере азота в течение еще 2 дней. Последовательные анализы показали 22% конверсии реакционной смеси в требуемый кислый продукт. Летучие компоненты (метанол, этанол, THF) удаляли из реакции в вакууме (30C) с помощью роторного испарителя. В реакцию добавляли 200 мкл 10N водного раствора гидроксида натрия и 4 мл THF. Реакционную смесь перемешивали путем помещения в роторный испаритель, осторожно нагревали (25C, 3 ч), затем добавляли примерно 6 мл THF и нагревали при 35C в течение 3 ч и с помощью системы House vacuum удаляли летучие компоненты, образовавшиеся в результате гидролиза. Анализ реакции методом ЖХ-МС показал примерно 83% конверсии в кислый продукт. Реакцию перемешивали в течение ночи при комнатной температуре, и последовательный анализ не показал дополнительной конверсии в продукт. Дополнительно 4.0 мл 1.0 М тетрабутиламмония гидроксида в метаноле вводили в реакцию. Реакционную смесь помещали на роторный испаритель, и летучие компоненты удаляли в вакууме и нагревание продолжали при 40-45C в течение примерно 6 ч. Реакционную смесь затем обрабатывали путем добавления в реакцию 1N водного раствора соляной кислоты (100 мл) и затем смесь ополаскивали в 500 мл разделительной воронке с помощью этилацетата, доводя объем органической фазы примерно до 200 мл. Реакционную смесь разделяли между этилацетатом и 1.0N водным раствором соляной кислоты. Органический слой отмывали 3 (300 мл каждый) 1.0N водным раствором соляной кислоты, затем солевым раствором и высушивали над MgSO4, фильтровали и летучие компоненты удаляли в вакууме для получения 1.03 г желтой пленкообразующей пены. Образец высушивали в вакууме при комнатной температуре до 0.92 г(92%) указанного соединения. ЖХ-МС время удерживания 1.48 мин; 615 m/z (MH-). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Phenomenex-Luna 10u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 5 мл/мин, градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 3 мин, время удерживания 1 мин, длительность анализа 4 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95%H2O/10 мМ ацетат аммония и растворителем B являлась смесь 5% H2O/95% ацетонитрила/10 мМ ацетата аммония. Данные МС определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления. Другой способ приготовления указанного соединения описан ниже. Растворяли 1H-пиразол-4-карбоновую кислоту, 5-[13-циклогексил-3-метокси-10-(1-метилэтил) сульфонил]амино]карбонил]-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-метил-, этиловый эфир (1.044 г,1.619 ммоль) в предварительно перемешанном растворе THF (20 мл), MeOH (20 мл) и гидроксида натрия(20 мл, 20.00 ммоль). Реакционная смесь была гомогенной, и смесь перемешивали при комнатной температуре в атмосфере азота в течение 26 ч, затем концентрировали в вакууме с помощью роторного испарителя при температуре ванны 20C. Реакционную смесь вливали в 1N водный раствор соляной кислоты и экстрагировали этилацетатом. Объединенные органические слои отмывали последовательно 1N водным раствором соляной кислоты и солевым раствором, затем высушивали над сульфатом магния, фильтровали и растворитель удаляли в вакууме. Сырой продукт высушивали в вакууме при комнатной темпе- 27015978 ратуре для получения 1.68 г оранжевого аморфного твердого вещества. Сырой продукт растворяли в хлороформе (примерно 50 мл) при нагревании и добавляли гексан до тех пор, пока некоторое количество материала не начинало осаждаться, но растворялось заново при завихрении (примерно 10-12 мл гексана). Смесь оставляли медленно охлаждаться до комнатной температуры и затем оставляли при комнатной температуре на несколько часов. Осадок из очень тонких частиц фильтровали с помощью воронки Бюхнера и высушивали в вакууме при комнатной температуре для получения 819 мг (45%) очищенного продукта в виде ярко желтого аморфного твердого вещества. Указанное соединение в количестве 4.6 мг растворяли в CDCl3 (2 мл) при добавлении примерно 5 капель CD3OD для облегчения растворения для сбора данных 1H ЯМР. 1H ЯМР (500 МГц, хлороформ-d / CD3OD)ppm 1.11-1.39 (m, 3H) 1.41 (d, J=7.02 Гц,6H) 1.47-1.65 (m, 1H) 1.75 (d, J=8.85 Гц, 2H) 1.82-2.27 (m, 13H) 2.77-2.90 (m, 1H) 3.28 (s, 3H) 3.88 (s, 3H) 3.97 -4.06 (m, 1H) 4.66 (s, 1H) 5.01 (s, 1H) 6.76 (s, 1H) 6.92 (d, J=2.75 Гц, 1H) 7.04 (dd, J=8.70, 2.59 Гц, 1H) 7.47-7.54 (m, 2H) 7.81 (d, J=1.22 Гц, 1H) 7.86 (d, J=8.54 Гц, 1H) 7.91 (s, 1H). ЖХ-МС время удерживания 1.39 мин; 615 m/z (MH-). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Phenomenex-Luna 10u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 5 мл/мин, градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 3 мин, время удерживания 1 мин, длительность анализа 4 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/ 10 мМ ацетат аммония и растворителем B являлась смесь 5% H2O/95% ацетонитрила/ 10 мМ ацетата аммония. Данные МС определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления. 7H-Индоло[2,1-a][2]бензазепин-10-карбоновая кислота, 13-циклогексил-6-[4-(этоксикарбонил)-1 метил-1H-пиразол-3-ил]-3-метокси-. 7H-Индоло[2,1-a][2]бензазепин-10-карбоновую кислоту, 13-циклогексил-6-[4-(этоксикарбонил)-1 метил-1H-пиразол-3-ил]-3-метокси-, 1,1 -диметилэтиловый эфир (176 мг, 0.295 ммоль) растворяли в 1,2 дихлорэтане (3 мл), помещали реакционную смесь в атмосферу азота и затем вводили трифторуксусную кислоту (3 мл, 38.9 ммоль). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 2 ч 20 мин, затем удаляли летучие компоненты в вакууме. Продукт растворяли в смеси бензола и дихлорметана, затем удаляли летучие компоненты в вакууме. Повторяли растворение в бензоле и дихлорметане и удаляли летучие компоненты для облегчения удаления следовых количеств трифторуксусной кислоты. Указанное соединение высушивали в вакууме при комнатной температуре для получения 164 мг желтого аморфного твердого вещества. 1H ЯМР (500 МГц, хлороформ-d)ppm 1.01-1.29(s, 3H) 3.97 (s, 3H) 4.27 (q, J=7.22 Гц, 2H) 4.41 (d, J=14.34 Гц, 1H) 5.84 (d, J=14.34 Гц, 1H) 6.97-7.08 (m,2H) 7.54 (d, J=8.24 Гц, 1H) 7.76 (d, J=8.55 Гц, 1H) 7.85 (d, J=8.54 Гц, 1H) 7.91 (s, 1H) 7.95 (s, 1H) 8.50 (s,1H). ЖХ-МС время удерживания 2.08 мин; 538 m/z (MH-). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Phenomenex-Luna 10u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 5 мл/мин, градиент от 70% растворителя A/30% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 5 мин, время удерживания 1 мин, длительность анализа 6 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/10 мМ ацетат аммония и растворителем B являлась смесь 5% H2O/95% ацетонитрила/10 мМ ацетата аммония. Данные МС определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления. 1H-Пиразол-4-карбоновая кислота, 3-[13-циклогексил-10-(диметиламино)сульфонил]амино]карбонил]-3-метокси-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-метил-, этиловый эфир. 7H-Индоло[2,1-a][2]бензазепин-10-карбоновую кислоту, 13-циклогексил-6-[4-(этоксикарбонил)-1 метил-1H-пиразол-3-ил]-3-метокси- (60 мг, 0.111 ммоль) растворяли в THF (1.0 мл), затем в реакцию вводили карбонил-диимидазол (42 мг, 0.259 ммоль). Реакционную смесь перемешивали в атмосфере азо- 28015978 та в течение 1 ч при комнатной температуре. Реакционную смесь затем нагревали до 70C в течение 1 ч,затем охлаждали и в реакцию добавляли N,N-диметилсульфамид (70 мг, 0.564 ммоль) с последующимDBU (0.034 мл, 0.222 ммоль). Реакционную смесь вновь помещали в атмосферу азота и нагревали при 70C в течение 16.5 ч. Реакционную смесь разбавляли этилацетатом и последовательно отмывали 1.0N водным раствором соляной кислоты, 0.1 М водным раствором NaH2PO4 и снова 1.0N водным раствором соляной кислоты, и в конце солевым раствором. Органическую фазу высушивали над сульфатом магния,фильтровали, растворитель удаляли и продукт высушивали в вакууме при комнатной температуре для получения 70 мг аморфного желтого твердого вещества. 1H ЯМР (500 МГц, хлороформ-d)ppm 0.760.95 (m, 2H) 1.12-1.26 (m, 5H) 1.32 (t, J=7.17 Гц, 3H) 1.38 (s, 2H) 1.51-1.61 (m, 4H) 1.67-1.81 (m, 3H) 1.872.01 (m, 2H) 2.01-2.11 (m, 3H) 2.82-2.92 (m, 1H) 3.06 (s, 6H) 3.91 (s, 3H) 3.96 (s, 3H) 4.26 (d, J=7.02 Гц, 2H) 4.42 (d, J=14.34 Гц, 1H) 5.75 (d, J=14.04 Гц, 1H) 6.99-7.05 (m, 2H) 7.38 (d, J=8.24 Гц, 1H) 7.52 (d, J=8.24 Гц,1H) 7.85 (d, J=8.55 Гц, 1H) 7.89-7.96 (m, 2H) 8.18 (s, 1H) 8.36 (br.s, 1H). ЖХ-МС время удерживания 2.34 мин; 644 m/z (MH-). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Phenomenex-Luna 10u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 5 мл/мин, градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 3 мин, время удерживания 1 мин, длительность анализа 4 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/10 мМ ацетатаммония и растворителем B являлась смесь 5%H2O/95% ацетонитрила/10 мМ ацетата аммония. Данные МС определяли с помощью масс-спектрометра 1H-Пиразол-4-карбоновая кислота, 3-[13-циклогексил-10-(диметиламино)сульфонил]амиио]карбонил]-3-метокси-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-метил-. 1H-Пиразол-4-карбоновую кислоту, 3-[13-циклогексил-10-(диметиламино)сульфонил]амино]карбонил]-3-метокси-7H-индоло[2,1-a][2]бензазепин-6-ил]-1-метил-, этиловый эфир (66 мг, 0.102 ммоль) растворяли в THF (1 мл) и в реакцию добавляли 1.0 М раствор гидроксида тетрабутиламмония (0.41 мл,0.410 ммоль) в метаноле. Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 4 ч и затем анализировали методом ЖХ-МС. Реакционную смесь концентрировали в вакууме на роторном испарителе, затем в реакционную смесь добавляли 1 мл THF и реакционную смесь снова помещали в атмосферу азота. Реакционную смесь помещали в водяную ванну при 40C и перемешивали в течение ночи. Иногда в течение ночи нагревательный элемент на водяной ванне выходил из строя, и утром наблюдали комнатную температуру реакционной смеси. Анализ ЖХ-МС показывал завершение реакции. Реакционную смесь разбавляли этилацетатом и последовательно отмывали 1.0N водным раствором соляной кислоты, затем снова 1.0N водным раствором соляной кислоты и в конце солевым раствором. Органический слой высушивали над сульфатом магния, фильтровали и растворитель удаляли в вакууме. Указанное соединение высушивали в вакууме для получения 63 мг аморфного желтого твердого вещества. 1H ЯМР (500 МГц, хлороформ-d)ppm 0.81-0.97 (m, 3H) 1.18-1.30 (m, 4H) 1.301.65 (m, 6H) 1.66-1.83 (m, 3H) 1.84-2.10 (m, 6H) 2.84-2.92 (m, 3H) 3.04 (s, 6H) 3.88 (s, 3H) 3.97 (s, 3H) 4.43(d, J=14.34 Гц, 1H) 5.68 (d, J=13.73 Гц, 1H) 6.99 (d, J=2.75 Гц, 1H) 7.02 (dd, J=8.55, 2.44 Гц, 1H) 7.35 (d,J=8.24 Гц, 1H) 7.52 (d, J=8.55 Гц, 1H) 7.77 (s, 1H) 7.83 (d, J=8.24 Гц, 1H) 7.98 (s, 1H) 8.15 (s, 1H) 8.71 (s,1H). ЖХ-МС время удерживания 1.58 мин; 616 m/z (MH-). Данные ЖХ записывали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Phenomenex-Luna 10u C18 3.050 мм с помощью детектора SPD-10AV UV-Vis при длине волны детектирования 220 нм. Условия элюирования были следующие: скорость потока 5 мл/мин, градиент от 100% растворителя A/0% растворителя B до 0% растворителя A/100% растворителя B, градиент времени 3 мин, время удерживания 1 мин, длительность анализа 4 мин, при этом растворителем A являлась смесь 5% ацетонитрил/95% H2O/10 мМ ацетат аммония и растворителем B являлась смесь 5% H2O/95% ацетонитрила/ 10 мМ ацетата аммония. Данные МС определяли с помощью масс-спектрометра Micromass Platform LC в режиме электрораспыления.
МПК / Метки
МПК: A61K 31/55, C07D 487/04, A61P 31/14
Метки: соединения, лечения, гепатита
Код ссылки
<a href="https://eas.patents.su/30-15978-soedineniya-dlya-lecheniya-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения для лечения гепатита с</a>
Предыдущий патент: Композиция и способ для очистки воды
Следующий патент: Способ оборудования вертикальных шахтных стволов подъемными сосудами
Случайный патент: Фраксиностерин - 24β-этилхолеста-20-карбокси-6(7),8(9)-диен 3β-ола и его производное