Замещенные производные 4-гидрокси-фенилалкановой кислоты с агонистической активностью по отношению к ppar-гамма
Номер патента: 1403
Опубликовано: 26.02.2001
Авторы: Коллинз Джон Лорен, Эриксон Грег Алан, Кобб Джеффри Эдмонд, Хенке Брэд Ричард, Уиллсон Тимоти Марк, Босуэлл Грэйди Ивэн, Мук Роберт Энтони Мл., Брэкин Маркус, Дитон Дейвид Норман, О`кэллэхэн Джон Марк, Шарп Мэттью Джуд, Кэлдор Истван
Формула / Реферат
1. Соединение, имеющее формулу (I)
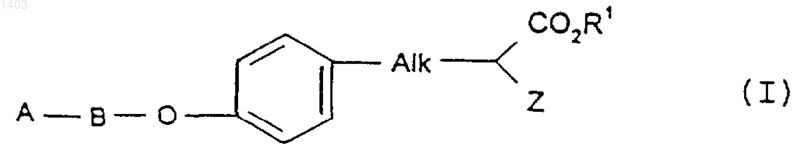
где А выбран из группы, содержащей:
(i) фенил, причем указанный фенил возможно замещен одним или более чем одним атомом галогена, С1-6алкилом, С1-3алкокси, С1-3фторалкокси, нитрилом или -NR7R8, где R7 и R8 независимо представляют собой водород или С1-3алкил;
(ii) 5- или 6-членную гетероциклическую группу, содержащую, по меньшей мере, один гетероатом, выбранный из кислорода, азота и серы, и возможно замещенную одним или более чем одним атомом галогена, С1-3алкилом, С1-3алкоксигруппой, С0-3алкилен-NR9R10 (где каждый из R9 и R10 независимо представляет собой водород, С1-3алкил, -SО2С1-3алкил либо -СO2С1-3алкил, -SО2NНС1-3алкил), С0-3алкилен-СО2Н, С0-3алкиленСO2С1-3алкилом, -OCH2C(O)NH2, -С1-3фторалкилом, -CN или -SС1-6алкилом; и
(iii) конденсированное бициклическое кольцо
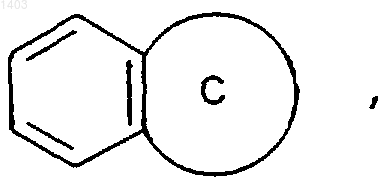
в котором кольцо С представляет собой гетероциклическую группу, определенную выше в пункте (ii), причем бициклическое кольцо присоединяется к группе В через кольцевой атом кольца С;
В выбран из группы, содержащей:
(iv) C1-6алкилен;
(v) -MC1-6алкилен или С1-6алкиленМС1-6алкилен, где М представляет собой О, S или -NR2, причем R2 представляет собой водород или С1-3алкил;
(vi) 5- или 6-членную гетероциклическую группу, содержащую, по меньшей мере, один гетероатом азота и возможно, по меньшей мере, один дополнительный гетероатом, выбранный из кислорода, азота и серы, и возможно замещенную C1-3алкилом; и
(vii) Het-C1-6алкилен, где Het представляет собой гетероциклическую группу, определенную выше в пункте (vi);
Alk представляет собой С1-3алкилен;
R1 представляет собой водород или С1-3алкил;
Z выбран из группы, содержащей:
(viii) -(С1-3алкилен)фенил, причем фенил возможно замещен одним или более чем одним атомом галогена; и
(ix) -NR3R4, где R4 представляет собой водород или С1-3алкил, а R4 представляет собой -Y-(C=O)-T-R5 или -Y-(СН(ОН))-T-R5, где
(а) Y представляет собой связь, C1-6алкилен, C2-6алкенилен, C4-6циклоалкилен либо циклоалкенилен, гетероциклическую группу, определенную выше в пункте (vi), или фенил, возможно замещенный одной или более чем одной С1-3алкильной группой и/или одним или более чем одним атомом галогена;
(б) Т представляет собой связь, С1-3алкиленоксигруппу, -О- или -N(R6)-, где R6 представляет собой водород или С1-3алкил;
(в) R5 представляет собой С1-6алкил, C4-6циклoaлкил либо циклоалкенил, фенил (возможно замещенный одним или более чем одним атомом галогена, C1-3алкилом, С1-3алкоксигруппой, С0-3алкилен-NR9R10, где каждый
из R9 и R10 независимо представляет собой водород, С1-3алкил, -SO2-С1-3алкил либо -СО2С1-3алкил, -SO2NHC1-3алкил, C0-3алкиленСО2Н, C0-3алкиленCO2C1-3aлкилoм или -ОСН2С(О)NH2), 5- или 6-членную гетероциклическую группу, определенную выше в пункте (ii), бициклическое конденсированное кольцо
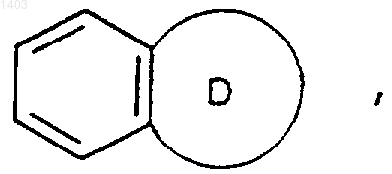
в котором кольцо D представляет собой 5- или 6-членную гетероциклическую группу, содержащую, по меньшей мере, один гетероатом, выбранный из кислорода, азота и серы, и возможно замещенную группой (=O), при этом бициклическое кольцо присоединяется к Т через кольцевой атом кольца D, или -С1-6алкиленМR11, причем М представляет собой О, S или -NR2, где R2 и R11 независимо представляют собой водород или C1-3алкил;
или его таутомерная форма, и/или его фармацевтически приемлемые соль либо сольват.
2. Соединение по п.1, где каждая из указанных 5- или 6-членных гетероциклических групп независимо выбрана из группы, содержащей имидазолидинил, пиперидил, пиперазинил, пирролидинил, морфолинил, пиридил, пиридазинил, пиримидинил, пиразинил, пирролил, пиразолил, имидазолил, пиранил, фурил, тиенил, оксазолил, изоксазолил, оксадиазолил, тиазолил, тиадиазо-лил, триазолил или тетразолил, каждый из которых возможно замещен заместителями, перечисленными в п.1.
3. Соединение по п.1 или 2, где А представляет собой фенил, пиридил, пиперазинил или бензоксазолил, каждый из которых возможно замещен одним или более чем одним C1-3алкилом.
4. Соединение по п.3, где А представляет собой фенил, пиперазинил или пиридил.
5. Соединение по любому из пп.1-4, где В представляет собой С1-3алкилен, -N(СН3)С1-3алкилен или НеtС1-6алкилен, где Het представляет собой 5-членную гетероциклическую группу, содержащую, по меньшей мере, один атом азота и возможно, по меньшей мере, один дополнительный гетероатом, выбранный из кислорода и серы, замещенную или незамещенную С1-3алкилом.
6. Соединение по п.5, где В представляет собой -N(СН3)(СН2)2, оксазолил-С1-6алкилен, где указанный оксазолил возможно замещен С1-3алкилом, или тиазолил, который возможно замещен С1-3алкилом.
7. Соединение по любому из пп.1-6, где Alk представляет собой метилен.
8. Соединение по любому из пп.1-7, где R1 представляет собой водород, метил или этил.
9. Соединение по п.8, где R1 представляет собой водород.
10. Соединение по любому из пп.1-9, где Z представляет собой -NR3R4, где R3 и R4 такие, как определены в п.1.
11. Соединение по п.10, где R3 представляет собой водород.
12. Соединение по п.10 или 11, где R4 представляет собой -Y(C=O)-T-R5, где R5 такой, как определено в п.1.
13. Соединение по п.8, где Y представляет собой фенил, возможно замещенный одной или более чем одной С1-3алкильной группой и/или одним или более чем одним атомом галогена.
14. Соединение по п.9, где Т представляет собой связь или -О-.
15. Соединение по пп.12, 13 или 14, где R5 представляет собой С1-3алкил или фенил (возможно замещенный одним или более чем одним атомом галогена либо одной или более чем одной С1-3алкильной группой).
16. Соединение по п.10, где указанный NH и указанный (С=O) располагаются на Y (который является фенилом) в орто-положении относительно друг друга, Т представляет собой связь или -О-, R5 представляет собой С1-6алкил или фенил (возможно замещенный одним или более чем одним: атомом галогена, С1-3алкилом, С1-3алкоксигруппой, С0-3алкилен-NR9R10, каждый из R9 и R10 независимо представляет собой водород, С1-3алкил, -SО2С1-3алкил либо -СО2С1-3алкил, -SО2NHС1-3алкил, С0-3алкиленСО2Н, С0-3алкиленCO2C1-3алкилом или -OCH2C(O)NH2).
17. Соединение по п.15 или 16, где R4 представляет собой
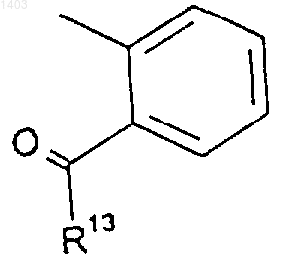
где R13 представляет собой фенил или ОСН3.
18. Соединение по п.1 формулы (Iа)
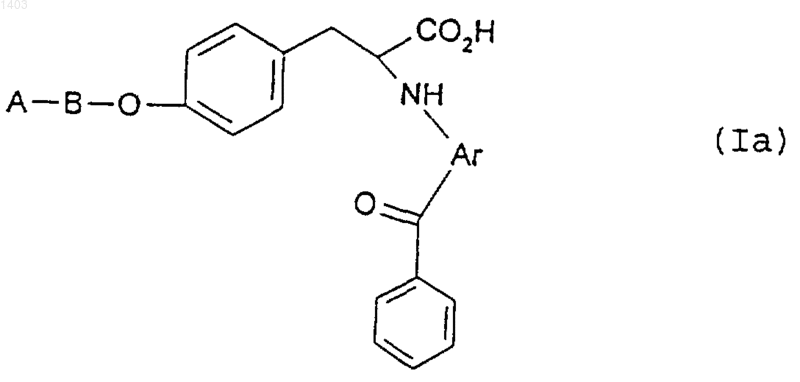
где А и В такие, как описаны в п.1, а Аr представляет собой фенил либо 5- или 6-членную гетероарильную группу, содержащую, по меньшей мере, гетероатом, выбранный из кислорода, азота и серы, и возможно замещенную одним или более чем одним атомом галогена, С1-3алкилом, С1-3алкоксигруппой, С0-3алкилен-NR9R10 (где каждый из R9 и R10 независимо представляет собой водород, С1-3алкил, -SО2С1-3алкил либо -СО2С1-3алкил, -SО2NНС1-3алкил), С0-3алкиленСО2Н, C0-3алкиленCO2C1-3алкилом -OCH2C(O)NH2, -С1-3фторалкилом, -CN или -SС1-6алкилом; и его сольваты.
19. Соединение по п.1, имеющее формулу (I)
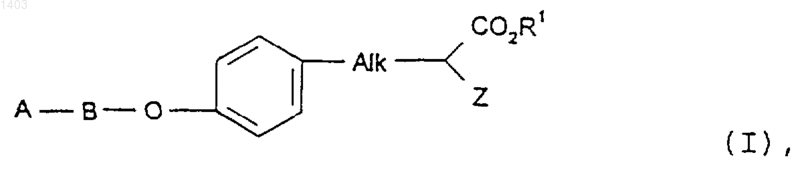
где А выбран из группы, содержащей
(i) фенил, возможно замещенный одним или более чем одним атомом галогена;
(ii) 5- или 6-членную гетероциклическую группу, содержащую, по меньшей мере, один гетероатом, выбранный из кислорода, азота и серы, и возможно замещенную одним или более чем одним атомом галогена, С1-3алкилом, С1-3алкоксигруппой, С0-3алкилен-NR9R10 (где каждый из R9 и R10 независимо представляет собой водород, С1-3алкил, -SO2C1-3алкил либо -СО2С1-3алкил, -SO2NHC1-3алкил), C0-3алкиленСО2Н, C0-3алкиленСО2С1-3алкилом, -OCH2C(O)NH2, -С1-3фторалкилом, -CN или -SС1-6алкилом; и
(iii) конденсированное бициклическое кольцо
в котором кольцо С представляет собой гетероциклическую группу, определенную выше в пункте (ii), причем бициклическое кольцо присоединяется к группе В через кольцевой атом кольца С;
В выбран из группы, содержащей:
(iv) С1-6алкилен;
(v) -NR2C1-6алкилен, где R2 представляет собой водород или С1-3алкил;
(vi) 5- или 6-членную гетероциклическую группу, содержащую, по меньшей мере, один гетероатом азота и возможно, по меньшей мере, один дополнительный гетероатом, выбранный из кислорода, азота и серы, и возможно замещенную С1-3алкилом; и
(vii) Het-C1-6алкилен, где Het представляет собой гетероциклическую группу, определенную выше в пункте (vi);
Alk представляет собой С1-3алкилен;
R1 представляет собой водород или С1-3алкил;
Z выбран из группы, содержащей:
(viii) -(С1-3алкилен)фенил, причем фенил возможно замещен одним или более чем одним атомом галогена; и
(ix) -NR3R4, где R3 представляет собой водород или С1-3алкил, а R4 представляет собой -Y-(C=O)-T-R5 или -Y-(СН(ОН))-T-R5, где
(а) Y представляет собой связь, С1-6алкилен, С2-6алкенилен, C4-6циклоaлкилeн либо циклоалкенилен, гетероциклическую группу, определенную выше в пункте (vi), или фенил, возможно замещенный одной или более чем одной С1-3алкильной группой, и/или одним или более чем одним атомом галогена;
(б) Т представляет собой связь, С1-3алкиленоксигруппу, -О- или -N(R6)-, где R6 представляет собой водород или С1-3алкил;
(в) R5 представляет собой С1-6алкил, C4-6циклoaлкил либо циклоалкенил, фенил, возможно замещенный одним или более чем одним атомом галогена, либо одной или более чем одной С1-3алкильной группой, 5- или 6-членную гетероциклическую группу, определенную выше в пункте (ii), или бициклическое конденсированное кольцо

в котором кольцо D представляет собой 5- или 6-членную гетероциклическую группу, содержащую, по меньшей мере, один гетероатом, выбранный из кислорода, азота и серы, и возможно замещенную (=O), при этом бициклическое кольцо присоединяется к Т через кольцевой атом кольца D;
или его таутомерная форма, и/или его фармацевтически приемлемые соль либо сольват.
20. Соединение по п.1, выбранное из группы, содержащей
3-(4-бензилокси-фенил)-2(S)-(1-метил-3-оксо-3-фенил-пропениламино)-пропионовой кислоты дициклогексиламиновую соль;
3-(4-бензилокси-фенил)-2(S)-(1-метил-3-оксо-3-фенил-пропениламино)-пропионовой кислоты метиловый эфир;
2(S)-(2-бензоил-циклогекс-1-ениламино)-3-(4-бензилокси-фенил)-пропионовой кислоты дициклогексиламиновую соль;
2-(2-бензоилфениламино)-3-(4-бензилоксифенил)-пропионовую кислоту;
3-(4-бензилокси-фенил)-2-(2-бензилокси-фениламино)-пропионовой кислоты метиловый эфир;
3-(4-бензилокси-фенил)-2-(фенилкарбамоил-фениламино)-пропионовой кислоты метиловый эфир;
3-(4-бензилокси-фенил)-2-[2-(пиперидин-1-карбонил)-фениламино]-пропионовой кислоты метиловый эфир;
2-(3-бензоил-тиофен-2-ил-амино)-3-(4-бензилокси-фенил)-пропионовую кислоту;
2-(2-бензоил-тиофен-3-ил-амино)-3-(4-бензилокси-фенил)-пропионовую кислоту;
3-(4-бензилокси-фенил)-2(S)-[(4-оксо-4Н-хромен-3-карбонил)-амино]-пропионовой кислоты метиловый эфир;
2-(2-бензоил-фениламино)-3-{4-[2-(метил-пиридин-2-ил-амино)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(метил-пиридин-2-ил-амино)-этокси]-фенил}-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-{4-[2-(метил-пиридин-2-ил-амино)-этокси]-фенил}-пропионовой кислоты этиловый эфир;
2-(1-метил-3-оксо-3-фенил-пропениламино)-3-{4-[2-(метил-пиридин-2-ил-амино)-этокси]-фенил}-пропионовой кислоты дициклогексиламиновую соль;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-(2-бензоил-фениламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-(2-бензоил-фениламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2(S)-(1-метил-3-оксо-3-фенил-пропениламино)-пропионовой кислоты дициклогексиламиновую соль;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2(S)-[3-(3-иод-фенил)-1-метил-3-оксо-пропениламино]-пропионовой кислоты дициклогексиламиновую соль;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-(2-бензоил-4-метил-фениламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-(2-бензоил-4-хлор-фениламино)-пропионовую кислоту;
3-[4-(1-бензоксазол-2-ил-пирролидин-3-илокси)-фенил]-2-(2-бензоил-фениламино)-пропионовую кислоту;
3-[4-(1-бензоксазол-2-ил)-пирролидин-2R-ил-метокси)-фенил]-2-(2-бензоил-фениламино)-пропионовую кислоту;
3-[4-(1-бензоксазол-2-ил)-пирролидин-2S-ил-метокси)-фенил]-2-(2-бензоил-фениламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-(2-циклогексанкарбонил-фениламино)-пропионовую кислоту;
3-{4-[2-бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-(2-бензоил-тиофен-3-иламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-бензил-пропионовой кислоты трифторацетат;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-(2-бром-бензил)-пропионовой кислоты трифторацетат;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2(S)-[(4-оксо-4Н-хромен-3-карбонил)-амино]-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-{4-[2-(4-хлорфенил)-тиазол-4-ил-метокси]-фенил}-пропионовую кислоту;
3-[4-(2-бензимидазол-1-ил-этокси)-фенил]-2-(2-бензоил-фениламино)-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(5-метил-2-(4-метокси)-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(5-метил-2-(4-фтор)-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(5-метил-2-(5-метил-тиен-2-ил)-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(5-метил-1-фенил-1Н-пиразол-3-ил)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(5-метил-2-пиперидин-1-ил-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(5-метил-2-морфолин-4-ил-тиазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(5-метил-2-(4-пиридил)-тиазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(2-диметиламино-5-метил-тиазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(5-метил-2-(5-метилизоксазол-3-ил)-тиазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-(4-{2-[5-метил-2-(4-метил[1,2,3]-тиадиазол-5-ил)-тиазол-4-ил]-этокси}-фенил)-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-(4-{2-[5-метил-2-(4-метилпиперазин-1-ил)-тиазол-4-ил]-этокси}-фенил)-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-(4-{2-[2-(3-диметиламино-пропиламино)-5-метилтиазол-4-ил]-этокси}-фенил)-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-(4-{2-[2-(2-метокси-этиламино)-5-метил-тиазол-4-ил]-этокси}-фенил)-пропионовую кислоту;
2-(1-карбокси-2-{4-[2-(5-метил-2-фенил-тиазол-4-ил)-этокси]-фенил}-этиламино)-бензойной кислоты метиловый эфир;
2-(1-карбокси-2-{4-[2-(4-хлорфенилсульфанил)-этокси]-фенил}-этиламино)-бензойной кислоты метиловый эфир;
2-{1-карбокси-2-[4-(1-фенилпирролидин-2-ил-метокси)-фенил]-этиламино}-бензойной кислоты метиловый эфир;
3-{4-[2-(бензоксазол-2-ил-метиламино)-этокси]-фенил}-2-(2-циклопентанкарбонил-фениламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метиламино)-этокси]-фенил}-2-(2-циклогептанкарбонил-фениламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-(2-циклогексанкарбонил-5-фторфениламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-(4-циклогексанкарбонил-2-метил-2Н-пиразол-3-иламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-(3-бензоил-тиофен-2-иламино)-пропионовую кислоту;
2-(2-циклогексанкарбонил-фениламино)-3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2-(2-циклогексанкарбонил-фениламино)-3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
3-[4-(1-бензоксазол-2-ил-пирролидин-3-илокси)-фенил]-2-(2-бензоил-фениламино)-пропионовую кислоту;
3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-2(S)-[2-(пиридин-4-карбонил)-фениламино]-пропионовую кислоту;
3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-2(S)-[2-(пиридин-N-оксид-4-карбонил)-фениламино]-пропионовую кислоту;
3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-2(S)-[2-(пиридин-3-карбонил)-фениламино]-пропионовую кислоту;
3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-2(S)-[2-(пиридин-N-оксид-3-карбонил)-фениламино]-пропионовую кислоту;
2S-(2-бензоил-фениламино)-3-{4-[2-(5-метил-3-фенил-пиразол-1-ил)-этокси]-фенил}-пропионовую кислоту;
2S-(2-бензоил-фениламино)-3-[4-(1-пиридин-2-ил-пирролидин-2S-ил-метокси)-фенил]-пропионовую кислоту;
2S-(2-бензоил-фениламино)-3-{4-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)-этокси]-фенил}-пропионовую кислоту;
2S-(2-бензоил-фениламино)-3-{4-[2-(3-фуран-2-ил-5-метил-пиразол-1-ил)-этокси]-фенил}-пропионовую кислоту;
2S-(2-бензоил-фениламино)-3-{4-[2-(5-метил-3-фенил[1,2,4]триазол-1-ил)-этокси]-фенил}-пропионовую кислоту;
2S-(2-бензоил-фениламино)-3-{4-[2-(3-метоксиметил-5-метил-2-фенил-3Н-имидазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2S-(2-бензоил-фениламино)-3-{4-[2-(5-метил-2-фенил-3Н-имидазол-4-ил)-этокси]-фенил}-пропионовой кислоты гидрохлоридную соль;
2S-(2-бензоил-фениламино)-3-{4-[2-(5-метил-2-фенил-тиазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(5-метил-2-(3-метил-тиен-2-ил)-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-{4-[2-(5-нитро-2-пиридилокси)-этокси]-фенил}-1-метоксикарбонил-этиламино)-бензойную кислоту;
2(S)-(2-{4-[2-(5-хлор-2-пиридилсульфанил)-этокси]-фенил}-1-метоксикарбонил-этиламино)-бензойную кислоту;
2(S)-(2-{4-[2-(N-этил-2-метилтолуидино)-этокси]-фенил}-1-метоксикарбонил-этиламино)-бензойную кислоту;
3-[4-(3-бензоксазол-2-ил-тиазолидин-4(R)-ил-метокси)-фенил]-2(S)-(2-бензоил-фениламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-[2-(4-трифторметил-бензоил)] -фениламино-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-[2-(2-тиофенкарбонил)] -фениламино-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-[2-(3-тиофенкарбонил)] -фениламино-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-[2-(3-трифторметилбензоил)] -фениламино-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-[2-(2-трифторметилбензоил)] -фениламино-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-[2-(3-метокси-бензоил)] -фениламино-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-[2-(2-метокси-бензоил)] -фениламино-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-[2-(3-метилбензоил)] -фениламино-пропионовую кислоту;
2-[2-(4-диметиламинометил-бензоил)-фениламино]-3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовой кислоты гидрохлорид;
2-[2-(4-аминометил-бензоил)-фениламино]-3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовой кислоты гидрохлорид;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-[2-(2,6-диметилбензоил)] -фениламино-пропионовую кислоту;
3-(2-{1-карбокси-2-[4-(2-{5-метил-2-фенил-оксазол-4-ил}-этокси)-фенил]-этиламино}-бензоил бензойную кислоту;
2-[2-(3-гидроксиметил-бензоил)-фениламино]-3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2-[2-(3-аминометил-бензоил)-фениламино]-3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовой кислоты гидрохлорид;
2-[2-(3-диметиламинометил-бензоил)-фениламино]-3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовой кислоты гидрохлорид;
2(S)-(1-карбокси-2-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-этиламино)-бензойной кислоты метиловый эфир;
2(S)-(1-карбокси-2-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-этиламино)-бензойной кислоты 2-аминоэтиламида гидрохлорид;
2(S)-(1-карбокси-2-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-этиламино)-бензойной кислоты 3-аминопропиламида гидрохлорид;
2-(1-карбокси-2-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-этиламино)-бензойной кислоты метиламид;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-[2-(3-гидрокси-бензоил)-фениламино]-пропионовую кислоту;
3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-2-[2-(4-пропилсульфамоил-бензоил)-фениламино]-пропионовую кислоту;
2-[2-(3-амино-бензоил)-фениламино]-3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2-[2-(3-метансульфониламино-бензоил)-фениламино]-3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2-[2-(3-метоксикарбониламино-бензоил)-фениламино]-3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2-[2-(3-гидрокси-бензоил)-фениламино]-3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2-[2-(3-карбаноилметокси-бензоил)-фениламино]-3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(5-метил-2-пиридин-4-ил-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-(4-{2-[5-метил-2-(4-метил-пиперазин-1-ил)-тиазол-4-ил]-этокси}-фенил)-пропионовой кислоты гидрохлорид;
2(S)-(2-бензоил-фениламино)-3-(4-{2-[5-метил-2-(4-трет-бутоксикарбонил-пиперазин-1-ил)-тиазол-4-ил]-этокси}-фенил)-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(5-метил-2-пиперазин-1-ил-тиазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-(4-{2-[5-метил-2-(4-метилсульфонил-пиперазин-1-ил)-тиазол-4-ил]-этокси}-фенил)-пропионовую кислоту;
2(S)-(1-карбокси-2-{4-[2-(4-диметиламино-фенил)-этокси]-фенил}-этиламино)-бензойной кислоты метиловый эфир;
2(S)-[1-метоксикарбонил-2-(4-{2-[5-метил-2-(4-метил-пиперазин-1-ил)-тиазол-4-ил]-этокси}-фенил)-этиламино]-бензойную кислоту;
2(S)-(1-карбокси-2-{4-[2-(4-хлор-фенил)-этокси]-фенил}-этил-амино)-бензойной кислоты метиловый эфир;
2(S)-(1-карбокси-2-{4-[2-(4-трифторметокси-фенил)-этокси]-фенил}-этиламино)-бензойной кислоты метиловый эфир;
3-{4-[2-(бензоксазол-2-ил-метиламино)-этокси]-фенил}-3-(4-бен-зоил-тиениламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метиламино)-этокси]-фенил}-2-(2-(4-бифенилкарбонил)-фениламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метиламино)-этокси]-фенил}-2-(2-(4-метокси-бензоил)-фениламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метиламино)-этокси]-фенил}-2-(2-(4-метил-бензоил)-фениламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метиламино)-этокси]-фенил}-2-(2-(2-метил-бензоил)-фениламино)-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-{4-[2-(4-хлор-фенил)-этокси]-фенил}-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-{4-[2-(4-метил-тиазол-5-ил)-этокси]-фенил}-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-{4-[2-(4-хлор-фенилсульфанил)-этокси]-фенил}-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-[4-(4-изопропил-бензилокси)-фенил]-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-[4-(4-хлор-бензилокси)-фенил]-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-{4-[3-(4-метокси-фенил)-пропокси]-фенил}-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-{4-[2-(4-диметиламино-фенил)-этокси]-фенил}-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-{4-[2-(4-бром-фенокси)-этокси]-фенил}-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-{4-[2-(5-нитро-пиридин-2-ил-окси)-этокси]-фенил}-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-(4-{2-[3-(6-метил-пиридин-2-ил)-пропокси]-этокси}-фенил)-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-[4-(2-пиридин-3-ил-этокси)-фенил]-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-{4-[2-(3-метил-6-оксо-6Н-пиридазин-1-ил)-этокси]-фенил}-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-{4-[2-(4-трифторметокси-фенил)-этокси]-фенил}-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-{4-[2-(3-циано-фенокси)-этокси]-фенил}-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-{4-[2-(6-метокси-пиридин-2-ил-сульфанил)-этокси]-фенил}-пропионовую кислоту;
2-(2-бензоил-фениламино)-3-{4-[1-(4-нитрофенил)-пирролидин-2-ил-метокси]-фенил}-пропионовую кислоту.
21. Соединение по п.20, выбранное из группы, содержащей
2(S)-(1-карбокси-2-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-этиламино)-бензойной кислоты метиловый эфир;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2(S)-(2-бензоил-фениламино)-пропионовую кислоту;
3-{4-[2-(бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-(2-циклогексанкарбонил-фениламино)-пропионовую кислоту;
3-{4-[2-бензоксазол-2-ил-метил-амино)-этокси]-фенил}-2-(2-бензоил-тиофен-3-ил-амино)-пропионовую кислоту;
2(S)-[1-метоксикарбонил-2-(4-{2-[5-метил-2-(4-метил-пиперазин-1-ил)-тиазол-4-ил]-этокси}-фенил)-этиламино]-бензойную кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(метил-пиридин-2-ил-амино)-этокси]-фенил}-пропионовую кислоту;
2(S)-(2-бензоил-фениламино)-3-{4-[2-(5-метил-2-фенил-оксазол-4-ил)-этокси]-фенил}-пропионовую кислоту;
и его фармацевтически приемлемые соли и сольваты.
22. Фармацевтическая композиция, содержащая соединение по любому из пп.1-21 или его фармацевтически приемлемые соль либо сольват вместе с фармацевтически приемлемым носителем.
23. Применение соединения по любому из пп.1-21 для терапии.
24. Способ лечения или профилактики PPAR-гаммаопосредованного заболевания или состояния, при котором вводят соединение по любому из пп.1-21.
25. Способ снижения содержания глюкозы в крови, при котором вводят соединение по любому из пп.1-21.
26. Способ лечения или профилактики гипергликемии, дислипидемии, диабета типа II, диабета типа I, гипертриглицеридемии, синдрома X, устойчивости к инсулину, сердечной недостаточности, диабетической дислипидемии, гиперлипидемии, гиперхолестеремии, гипертензии, ожирения, анорексии, булимии, нервно-психической анорексии и сердечно-сосудистых заболеваний, в особенности атеросклероза, при котором вводят соединение по любому из пп.1-21.
27. Применение соединения по любому из пп.1-21 для производства лекарственного препарата для лечения PPAR-гаммаопосредованного заболевания.
28. Применение соединения по любому из пп.1-21 для производства лекарственного препарата для лечения пациентов, нуждающихся в снижении уровня глюкозы в крови.
29. Применение соединения по любому из пп.1-21 для производства лекарственного препарата для лечения гипергликемии, дислипидемии, диабета типа II, диабета типа I, гипертриглицеридемии, синдрома X, устойчивости к. инсулину, сердечной недостаточности, диабетической дислипидемии, гиперлипидемии, гиперхолестеремии, гипертензии, ожирения, анорексии, булимии, нервно-психической анорексии и сердечно-сосудистых заболеваний, в особенности атеросклероза.
30. Способ получения соединений по п.1, включающий стадию, на которой соединение формулы А-В-Х приводят во взаимодействие с соединением формулы (II)
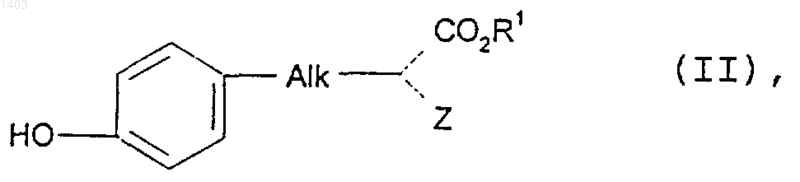
где А, В, Alk, R1 и Z такие, как определены в п.1, а В содержит C1-6алкиленовую группу, а Х представляет собой уходящую группу или гидроксильную группу.
31. Способ по п.30, отличающийся тем, что Х представляет собой гидроксильную группу, галогенид или алкил- либо арил-сульфонилоксигруппу, А представляет собой фенил, пиридил или бензоксазолил, В представляет собой указанный Het-C1-6алкилен, a Z представляет собой -NH-Y(C=O)-T-R5, где Y представляет собой фенил, возможно замещенный одной или более чем одной С1-3алкильной группой и/или одним или более чем одним атомом галогена, Т представляет собой связь или -О-, а R представляет собой С1-6алкил или фенил (возможно замещенный одним или более чем одним атомом галогена, С1-3алкилом, С1-3алкокси группой, С0-3алкилен-NR9R10, где каждый из R9 и R10 независимо представляет собой водород, С1-3алкил, -SО2С1-3алкил или -СО2С1-3алкил, -SО2NНС1-3алкил, С0-3алкиленСO2Н, С0-3алкиленСО2С1-3алкилом или -ОСН2С(O)NH2).
32. Способ по п.30 или 31, отличающийся тем, что R1 представляет собой водород, а Х представляет собой галогенид или алкил- либо арил-сульфонилоксигруппу.
33. Способ по п.32, отличающийся тем, что указанное соединение А-В-Х и указанное соединение формулы (II) представляют собой
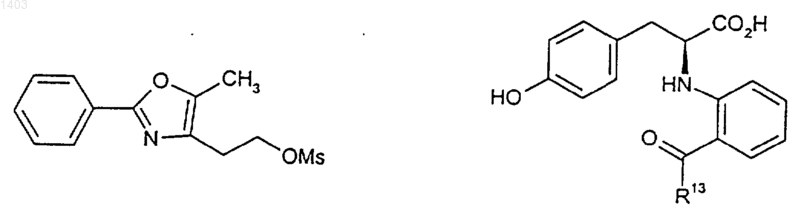
где OMs является мезилатной уходящей группой, а R13 представляет собой фенил или группу -ОСН3.
34. Способ по п.30 или 31, отличающийся тем, что R1 представляет собой С1-3алкил, а Х представляет собой гидроксильную группу.
35. Способ по п.34, отличающийся тем, что указанная реакция представляет собой реакцию Мицунобу с последующим гидролизом описанной группы алкилового эфира до соответствующей кислоты без выделения эфира.
36. Способ по п.35, отличающийся тем, что указанную реакцию Мицунобу осуществляют в реакционной смеси, содержащей толуол.
37. Способ по любому из пп.34-36, отличающийся тем, что указанное соединение А-В-Х и указанное соединение формулы (II) представляют собой
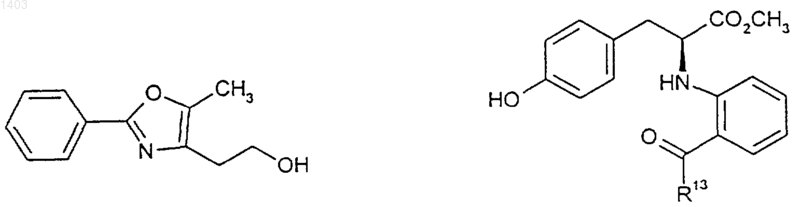
где R13 представляет собой фенил или группу -ОСН3.
38. Способ по п.30 или 31, отличающийся тем, что в соединении формулы (II) Z представляет собой
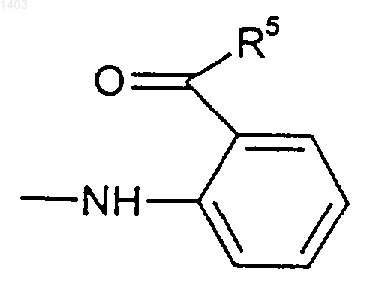
и соединение формулы (II) получено таким образом, что его получение включает стадию, на которой сначала получают соединение формулы (II), где Z представляет собой

за чем следует стадия, на которой его дегидрируют с катализатором дегидрирования в присутствии акцептора водорода.
39. Способ по п.38, отличающийся тем, что указанный акцептор водорода представляет собой ароматическое нитросоединение.
Текст
1 Настоящее изобретение относится к некоторым новым соединениям, к способам их получения, к содержащим их фармацевтическим композициям и к их использованию в медицине. В частности, оно относится к соединениям, которые проявляют активирующее действие,включая агонистическую активность, по отношению к гамма-рецептору, активированному пероксисомным пролифератором (PPAR-гамма),что дает им возможность модулировать уровни содержания глюкозы в крови у млекопитающих. Лечение диабета типа II или неинсулинзависимого сахарного диабета (NIDDM) остается неудовлетворительным, несмотря на широко распространенное применение инсулина, сульфонилмочевин (например, хлорпропамида, толбутамида, толазамида) и бигуанидов (например,фенформина, метформина) в качестве пероральных гипогликемических агентов. Обычно лечение NIDDM начинается с сочетания диеты и физической нагрузки с последующим применением пероральных гипогликемических агентов(например, сульфонилмочевин) и, в более тяжелых случаях, применением инсулина. К сожалению, имеющиеся гипогликемические агенты вызывают разнообразные нежелательные токсические эффекты, которые ограничивают их применимость при лечениии NIDDM. Таким образом, налицо очевидная необходимость создания новых гипогликемических агентов, которые могут обладать меньшей токсичностью или достигать цели там, где другие агенты оказываются неэффективными. В последнее десятилетие в модельных опытах по NIDDM на животных соединения,известные под названием тиазолидиндионы (см. например Патенты США под номерами 5089514, 4342771, 4367234, 4340605, 5306726),проявили себя как эффективные антидиабетические агенты, повышающие чувствительность к инсулину тканей-мишеней (скелетных мышц,печени, жировой ткани), а также снижающие уровень липидов и инсулина у этих модельных животных. Недавно было показано, что тиазолидиндион троглитазон оказывает такие же благотворные эффекты как на людей с ослабленной толерантностью к глюкозе, метаболическим состоянием, которое предшествует развитиюNIDDM (J.J. Nolan et. al., N. Eng . J. Med. 11881193, 331 (1994. Поскольку механизм действия этого класса соединений неизвестен (тиазолидиндионы не вызывают увеличения секреции инсулина или увеличения количества либо аффинности связывающих инсулин рецепторных сайтов), предполагают, что тиазолидиндионы усиливают развитие пост-рецепторных событий инсулин-сигнального каскада (J.R. Colca and 2 Кроме этого, тиазолидиндионы индуцируют in vitro дифференциацию адипоцитов клеточных линий преадипоцитов (A. Hiragun et. al.,J. Cell. Physiol. 124-130, 134 (1988); R.F. Kleitzenet. al., Mol. Pharmacol. 393-398, 41 (1992. Обработка клеточных линий преадипоцитов тиазолидиндион пиоглитазоном приводит к усилению экспрессии адипоцит-специфических генов аР 2 и адипсина, равно как и транспортных белков глюкозы - GLUT-1 и GLUT-4, что является подтверждением того, что наблюдаемые in vivo гипогликемические эффекты, вызываемые тиазолидиндионами, могут быть опосредованы через жировую ткань. Недавно был открыт орфановый член стероид/тироид/ретиноидного рецепторного надсемейства лиганд-активированных транскрипционных факторов,названный гаммарецептором, активированным пероксисомным пролифератором (PPAR-гамма). PPAR-гамма входит в подсемейство близкородственныхPPARs, кодируемых независимыми генами (С.PPAR-альфа, PPAR-гамма и NUC-1. Эти PPARs регулируют экспрессию генов-мишеней путем связывания с элементами последовательности ДНК, названными PPAR-отвечающими элементами (PPRE). На сегодняшний день PPRE идентифицированы в энхансерах ряда генов, кодирующих белки, которые регулируют метаболизм липидов, что подтверждает основную рольPPAR в адипогенном сигнальном каскаде и липидном гомеостазе (Н. Keller and W. Wahli,Trends Endocrin. Met. 291-296, 4 (1993. Недавно сообщалось, что тиазолидиндионы являются сильнодействующими и селективными активаторами PPAR-гамма и связываются непосредственно с PPAR-гамма-рецептором (J.М. Lehmannet. al., J. Biol. Chem. 12953-12956, 270 (1995), что является доказательством того, что PPAR-гамма является возможной мишенью терапевтического действия тиазолидиндионов. Авторами настоящей работы открыта новая группа соединений, связывающихся и активирующих PPAR-гамма-рецептор. Эти соединения, кроме того, показывают хорошую активность в отношении понижения уровня глюкозы в крови и могут, ввиду этого, быть использованы для лечения и/или профилактики гипергликемии, дислипидемии, и в частности, найти применение для лечения диабета типа II. Отмечается также, что данные соединения могут быть использованы для лечения и/или профилактики других заболеваний, включая диабет типа I, гипертриглицеридемию, синдромX, устойчивость к инсулину, сердечную недостаточность, диабетическую дислипидемию, ги 3 перлипидемию, гиперхолестеремию, гипертензию и сердечно-сосудистое заболевание, в особенности атеросклероз. Кроме этого, указанные соединения могут быть полезны для регулирования аппетита и приема пищи субъектов, страдающих заболеваниями, такими как ожирение,анорексия, булимия и нервно-психическая анорексия. Таким образом, согласно настоящему изобретению предложены соединения, имеющие формулу (I)(i) фенил, причем указанный фенил возможно замещен одной или более чем одной группой из следующих: атомом галогена, C1-6 алкилом, C1-3 алкокси, С 1-3 фторалкокси, нитрилом или -NR7R8, где R7 и R8 независимо представляют собой водород или C1-3 алкил;(ii) 5- или 6-членную гетероциклическую группу, содержащую по меньшей мере один гетероатом, выбранный из кислорода, азота и серы; и возможно замещенную одним или более чем одним атомом галогена, С 1-3 алкилом, С 1-3 алкоксигруппой, С 0-3 алкилен-NR9R10 (где каждый из R9 и R10 независимо представляет собой водород, С 1-3 алкил, -SО 2 С 1-3 алкил либо -СО 2 С 1-3 алкил, -SО 2NНС 1-3 алкил), C0-3 алкиленСО 2 Н, C0-3 алкилен СО 2 С 1-3 алкилом, -OCH2C(O)NH2, -С 1-3 фторалкилом, -CN или -SС 1-6 алкилом;и в котором кольцо С представляет собой гетероциклическую группу, определенную выше в пункте (ii), причем бициклическое кольцо присоединяется к группе В через кольцевой атом кольца С; В выбран из группы, содержащей-NR2, причем R2 представляет собой водород или C1-3 алкил;(vi) 5- или 6-членную гетероциклическую группу, содержащую, по меньшей мере, один гетероатом азота и, возможно, по меньшей мере,один дополнительный гетероатом, выбранный из кислорода, азота и серы, и возможно замещенную С 1-3 алкилом; и(vii) Het-C1-6 алкилен, где Het представляет собой гетероциклическую группу, определенную выше в пункте (vi); Alk представляет собой С 1-3 алкилен;R1 представляет собой водород или C1-3 алкил;(viii) -(C1-3 алкилен)фенил, причем фенил возможно замещен одним или несколькими атомами галогена; и(ix) -NR3R4, где R3 представляет собой водород или C1-3 алкил, а R4 представляет собой(а) Y представляет собой связь, С 1-6 алкилен, С 2-6aлкенилен, С 4-6 циклоалкилен либо циклоалкенилен, гетероциклическую группу, такую как определена выше в пункте (vi), или фенил,возможно замещенный одной или более чем одной C1-3 алкильной группой и/или одним или более чем одним атомом галогена;(б) Т представляет собой связь, C1-3 алкиленоксигруппу, -О- или -N(R6)-, где R6 представляет собой водород или C1-3 алкил;(в) R5 представляет собой C1-6 алкил, С 4-6 циклоалкил либо циклоалкенил, фенил (возможно замещенный одной или более чем одной группой из следующих: атомом галогена, C1-3 алкилом, C1-3 алкоксигруппой, С 0-3 алкиленNR9R10 (где каждый из R9 и R10 независимо представляет собой водород,C1-3 алкил,-SО 2 С 1-3 алкил либо -СО 2 С 1-3-алкил, -SO2NНС 1-3 алкил), С 0-3aлкиленСО 2 Н, С 0-3aлкилен-СО 2 С 1-3 алкилом или -OCH2C(O)NH2), 5- или 6-членную гетероциклическую группу, как определена выше в пункте (ii), бициклическое конденсированное кольцо в котором кольцо D представляет собой 5- или 6-членную гетероциклическую группу, содержащую, по меньшей мере, один гетероатом, выбранный из кислорода, азота и серы, и возможно замещенную (=O), при этом бициклическое кольцо присоединяется к Т через кольцевой атом кольца D; или -С 1-6 алкиленМR11, причем М представляет собой О, S или -NR2, где R2 и R11 независимо представляют собой водород или C13 алкил; или их таутомерная форма, и/или их фармацевтически приемлемые соль либо сольват. Специалисты в данной области признают существование у соединений формулы (I) стереоцентров. В соответствии с этим настоящее изобретение охватывает все возможные стереоизомеры и геометрические изомеры формулы(I), и охватывает не только рацемические соединения, но также и оптически активные изомеры. Если соединение формулы (I) желательно в виде единичного этантиомера, его можно получить либо разделением конечного продукта, либо с помощью стереоспецифического синтеза или из изомерно чистого исходного материала, или из любого подходящего промежуточного соединения. Разделение конечного продукта, промежуточного соединения или исходного материала может быть осуществлено любым подходящим методом, известным специалистам. См. например, Stereochemistry of Carbon Compounds byE.L. Eliel (Mcgraw Hill, 1962) и Tables of Resolving Agents by S.H. Wilen. Вдобавок, если возможно образование таутомеров соединений формулы (I), настоящее изобретение включает все таутомерные формы соединений. Специалистам в данной области следует также иметь в виду, что соединения по настоящему изобретению можно использовать в форме их фармацевтически приемлемых соли или сольвата. Физиологически приемлемые соли соединений формулы (I) охватывают общепринятые соли, образованные из фармацевтически приемлемых неорганических или органических кислот либо оснований, равно как и четвертичные аммониевые соли, полученные присоединением кислоты. Более конкретные примеры подходящих солей кислот включают соли следующих кислот: соляной, бромистоводородной,серной, фосфорной, азотной, перхлорной, фумаровой, уксусной, пропионовой, янтарной, гликолевой, муравьиной, молочной, малеиновой,винной, лимонной, памовой, малоновой, гидроксималеиновой, фенилуксусной, глутаминовой,бензойной, салициловой, толуолсульфоновой,метансульфоновой,нафталин-2-сульфоновой,бензолсульфоновой, гидроксинафтойной, иодистоводородной, яблочной, стероевой, дубильной и им подобным. Другие кислоты, как например щавелевая, не являясь сами по себе фармацевтически приемлемыми, могут быть полезны в процессе приготовления солей, полезных в качестве промежуточных соединений при получении соединений по изобретению или их фармацевтически приемлемых солей. Более конкретные примеры подходящих солей оснований включают соли натрия, лития, калия, магния,алюминия,кальция,цинка,N,N1 дибензилэтилендиамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, Nметилглюкамина и прокаина. Последующие упоминания соединения по изобретению охватывают как соединения формулы (I), так и их фармацевтически приемлемые соли и сольваты. Используемые здесь термины С 1-3 алкил или алкилен и C1-6 алкил или алкилен подразумевают соединения, содержащие, соответственно, от 1 до 3 или от 1 до 6 атомов углерода, и соответственно включают алкильные или алкиленовые группы с прямой и разветвленной цепью, обычно метильную, метиленовую, этильную и этиленовую группы, и пропиловую,пропиленовую, бутиловую и бутиленовую группы с прямой и разветвленной цепью. Используемый здесь термин С 2-6 алкенил или алкенилен подразумевает соединения, содержащие от 2 до 6 атомов углерода, и соответственно включает алкениловые и алкениленовые группы с прямой и разветвленной цепью, в частности,пропилен или ему подобные. Используемый здесь термин C1-3 алкиленокси обозначает -O-C1-3 алкилен-, где С 1-3 алки 001403 6 лен по существу аналогичен определенному выше, например -O-CH2- и т.д. Термины C4-6 циклоaлкил, C4-6 циклoaлкилeн, C4-6 циклoaлкeнил и С 4-6 циклоалкенилен охватывают циклические группы, содержащие от 4 до 6 атомов углерода, как, например,циклопентан, циклопентилен, циклогексан, циклогексилен, циклогексен и циклогексенилен. Используемый здесь термин галоген включает фтор, хлор, бром и иод. Используемый здесь термин 5- или 6 членная гетероциклическая группа охватывает 5- или 6-членные незамещенные гетероциклоалкильные группы и замещенные либо незамещенные гетероарильные группы, например замещенные или незамещенные имидазолидинил, пиперидил, пиперазинил, пирролидинил, морфолинил, пиридил, пиридазинил, пиримидинил, пиразинил, пирролил, пиразолил,имидазолил, пиранил, фурил, тиенил, оксазолил,изоксазолил, оксадиазолил, тиазолил, тиадиазолил, триазолил или тетразолил. Под замещенной гетероциклической группой понимают 5- или 6-членную гетероарильную группу, замещенную одним или более чем одним атомом галогена, C1-3 алкилом, C1-3 алкоксигруппой, C0-3aлкилeн-NR9R10 (где каждый изR9 и R10 независимо представляют собой водород, С 1-3 алкил, -SO2C1-3 алкил либо -CO2-C1-3 алкил, -SО 2NНС 1-3 алкил), С 0-3 алкиленСО 2 Н, С 0-3 алкиленСО 2-C1-3 алкилом, -ОСН 2 С(O)NН 2, -C1-3 фторалкилом, -CN или -SC1-6 алкилом. В вышеприведенной формуле (I), в случае,когда Y представляет собой связь, атом азота в группе -NR3R4 связан напрямую с -(С=O) или-N(R3)-(C=O)-T-R5 или -N(R3)(CH(OH-T-R5. Подобным же образом, в случае когда Т представляет собой связь, -(С=O) или -(СН(ОН группы R4 связан напрямую с R5, т.е. Z представляет собой -N(R3)-Y-(C=O)-R5 или -N(R3)-Y(СН(ОН-R5. Возможно, когда оба, Y и Т, представляют собой связь, таким образом Z представляет собой -N(R3)-(C=O)-R5 или -N(R3)(СН(ОН-R5. А может представлять собой любую группу из фенила, гетероарила (например, пиридила) или где конденсированное кольцо С представляет собой 5-членную гетероарильную группу, содержащую, по меньшей мере, один гетероатом азота и возможно дополнительный гетероатом,выбранный из азота и кислорода (например оксазолил, имидазолил). В частности, А представляет собой фенил, пиридил, пиперазинил или бензоксазолил, каждый из которых может быть возможно замещенным одним или более чем одним C1-3 алкилом, в особенности, фенилом,пиперазинилом или пиридилом. 7 В, соответственно, представляет собой любую группу из C1-3 алкилена (например, метилена), -N(СН 3)C1-3 алкилена (например, -N(СН 3)(СН 2)2-) или Het-C1-6 алкилена, где Het представляет собой 5-членную гетероциклическую группу, содержащую, по меньшей мере, один гетероатом азота и возможно, по меньшей мере,один дополнительный гетероатом, выбранный из кислорода и серы (например, пирролидинил,оксазолил и тиазолил), и вероятно замещенный-N(СН 3)(CH2)2, оксазолил-С 1-6 алкилен, причем оксазолил возможно замещен C1-3 алкилом, или тиазолил, который возможно замещен C1-3 алкилом. Целесообразно, когда Alk представляет собой метилен. Целесообразно, когда R1 представляет собой водород, метил или этил, в особенности,водород.Z, соответственно, может представлять собой -(C1-3 алкилен)фенил, замещенный одним или несколькими атомами галогена, такой как возможно замещенный бензил. Z предпочтительно представляет собой -NR3R4, по существу как описано здесь ранее. R3 обычно представляет собой водород. Как описано здесь ранее, R4 представляет собой -Y-(C=O)-T-R5 или -Y(CH(OH-T-R5, в особенности -Y-(C=O)-T-R5, а отдельные группировки, представленные в R4,включают:Y представляет собой фенил (возможно замещенный одним или более чем одним атомом галогена либо одним или более чем однимC1-3 алкилом, например, метильными группами),Т представляет собой связь или атом кислорода,а R5 представляет собой С 1-3 алкил или фенил(возможно замещенный одним или более чем одним атомом галогена либо одной или более чем одной C1-3 алкильной группой);Y представляет собой гетероциклическую группу, по существу такую как описана здесь ранее (например тиенил), Т представляет собой связь, а R5 представляет собой фенил (возможно замещенный одним или более чем одним атомом галогена либо одной или более чем одной С 1-3 алкильной группой);Y представляет собой С 2-6 алкенилен- (например, пропилен), Т представляет собой связь,a R5 представляет собой фенил (возможно замещенный одним или более чем одним атомом галогена);Y представляет собой фенил, Т представляет собой связь, а R5 представляет собой гетероциклическую группу, по существу такую как описана здесь ранее (например, пиперидил);Y представляет собой связь, Т представляет собой связь, а R5 представляет собой бициклическое кольцо по существу такое как описано здесь ранее (например, D представляет собой 6-членное гетероциклическое кольцо, в частности, пиранил,замещенный (С=О;NH и указанный (С=О) располагаются на Y (который является фенилом) в орто-положении относительно друг друга, Т представляет собой связь или -О-, R5 представляет собой C1-6 алкил или фенил (возможно замещенный одним или более чем одним атомом галогена, С 1-3 алкилом,C1-3 алкоксигруппой, С 0-3 алкилен-NR9R10, где каждый из R9 и R10 независимо представляют собой водород, С 1-3 алкил, -SO2C1-3 алкил либо(O)NН 2). Особенно подходит, когда Y представляет собой фенил, Т представляет собой связь или где R13 представляет собой фенил или ОСН 3. Соответствующую подгруппу соединений по настоящему изобретению можно представить формулой (Iа) где А и В по существу такие как описаны здесь ранее, а Аr представляет собой фенил либо 5 или 6-членную гетероарильную группу, содержащую, по меньшей мере, один гетероатом, выбранный из кислорода, азота и серы; и возможно замещенную одним или более чем одним атомом галогена, С 1-3 алкилом, С 1-3 алкоксигруппой, C0-3 алкилен-NR9R10 (где каждый из R9 и R10 независимо представляет собой водород, С 1-3 9 частности, А в формуле (Iа) представляет собой фенил или пиридил. Кроме того, В в формуле(Iа) подходящим образом выбирают из -NR2 С 1-6 алкилена, по существу аналогичного описанному здесь ранее, и Het-C1-6 алкилена, возможно замещенного C1-3 алкилом, по существу описанным здесь ранее. В частности, В в формуле (Iа) представляет собой -N(СН 3)(CH2)2- или оксазолил-С 1-6 алкилен, причем оксазолил возможно замещен С 1-3 алкилом, например, метилом. Конкретная подгруппа соединений формулы I представляет собой соединения формулы(i) фенил, возможно замещенный одним или более чем одним атомом галогена;(ii) 5- или 6-членную гетероциклическую группу, содержащую, по меньшей мере, один гетероатом, выбранный из кислорода, азота и серы; и возможно замещенную одним или более чем одним атомом галогена, С 1-3aлкилом, С 1-3 алкоксигруппой, С 0-3 алкилен-NR9R10 (где каждый из R9 и R10 независимо представляет собой водород, С 1-3 алкил, -SО 2 С 1-3 алкил либо -СО 2 С 13 алкил, -SО 2 NHС 1-3 алкил, C0-3 алкиленСО 2 Н, C03 алкилен СО 2 С 1-3 алкилом, -OCH2C(O)NH2, -С 13 фторалкилом, -CN или -SС 1-6 алкилом; и в котором кольцо С представляет собой гетероциклическую группу, как определено выше в пункте (ii), причем бициклическое кольцо присоединяется к группе В через кольцевой атом кольца С; В выбран из группы, содержащей(v) -NR2 С 1-6 алкилен, где R2 представляет собой водород или C1-3 алкил;(vi) 5- или 6-членную гетероциклическую группу, содержащую, по меньшей мере, один гетероатом азота и возможно, по меньшей мере,один дополнительный гетероатом, выбранный из кислорода, азота и серы, и возможно замещенную C1-3 алкилом; и(vii) Het-C1-6 алкилен, где Het представляет собой гетероциклическую группу, как определено выше в пункте (vi);R1 представляет собой водород или С 1-3 алкил;(viii) -(C1-3 алкилен)фенил, причем фенил возможно замещен одним или более чем одним атомом галогена; и(ix) -NR3R4, где R3 представляет собой водород или C1-3 алкил, а R4 представляет собой Y-(C=O)-T-R5 или -Y-(CH(OH-T-R5, где(a) Y представляет собой связь, С 1-6 алкилен, С 2-6aлкенилен, С 4-6 циклоалкилен либо цик 001403 10 лоалкенилен, гетероциклическую группу, как определено выше в пункте (vi), или фенил, возможно замещенный одной или более чем однойC1-3 алкильной группой и/или одним или более чем одним атомом галогена;(б) Т представляет собой связь, C1-3 алкиленоксигруппу, -О- или -N(R6)-, где R6 представляет собой водород или C1-3 алкил;(в) R5 представляет собой C1-6 алкил, С 4-6 циклоалкил либо циклоалкенил, фенил, возможно замещенный одним или более чем одним атомом галогена либо одной или более чем одной C1-3 алкильной группой, 5- или 6-членную гетероциклическую группу, как определено выше в пункте (ii), или бициклическое конденсированное кольцо в котором кольцо D представляет собой 5- или 6-членную гетероциклическую группу, содержащую, по меньшей мере, один гетероатом, выбранный из кислорода, азота и серы, и возможно замещенную (=O), при этом бициклическое кольцо присоединяется к Т через кольцевой атом кольца D; или их таутомерная форма, и/или их фармацевтически приемлемые соль либо сольват. Конкретные соединения по изобретению включают 3-(4-бензилокси-фенил)-2(S)-(1-метил-3 оксо-3-фенил-пропениламино)-пропионовой кислоты дициклогексиламиновую соль; 3-(4-бензилокси-фенил)-2(S)-(1-метил-3 оксо-3-фенил-пропениламино)-пропионовой кислоты метиловый эфир; 2(S)-(2-бензоил-циклогекс-1-ениламино)3-(4-бензилокси-фенил)-пропионовой кислоты дициклогексиламиновую соль; 2-(2-бензоилфениламино)-3-(4-бензилоксифенил)-пропионовую кислоту; 3-(4-бензилокси-фенил)-2-(2-бензилоксифениламино)-пропионовой кислоты метиловый эфир; 3-(4-бензилокси-фенил)-2-(фенилкарбамоил-фениламино)-пропионовой кислоты метиловый эфир; 3-(4-бензилокси-фенил)-2-[2-(пиперидин 1-карбонил)-фениламино]-пропионовой кислоты метиловый эфир; 2-(3-бензоил-тиофен-2-ил-амино)-3-(4 бензилокси-фенил)-пропионовую кислоту; 2-(2-бензоил-тиофен-3-ил-амино)-3-(4 бензилокси-фенил)-пропионовую кислоту; 3-(4-бензилокси-фенил)-2(S)-[(4-оксо-4 Нхромен-3-карбонил)-амино]-пропионовой кислоты метиловый эфир; 2-(2-бензоил-фениламино)-3-4-[2-(метилпиридин-2-ил-амино)-этокси]-фенилпропионовую кислоту; 3-4-[2-(бензоксазол-2-ил-метиламино)этокси]-фенил-2-(2-(4-метокси-бензоил)фениламино)-пропионовую кислоту; 3-4-[2-(бензоксазол-2-ил-метиламино)этокси]-фенил-2-(2-(4-метил-бензоил)фениламино)-пропионовую кислоту; 3-4-[2-(бензоксазол-2-ил-метиламино)этокси]-фенил-2-(2-(2-метил-бензоил)фениламино)-пропионовую кислоту; 2-(2-бензоил-фениламино)-3-4-[2-(4-хлорфенил)-этокси]-фенил-пропионовую кислоту; 2-(2-бензоил-фениламино)-3-4-[2-(4 метил-тиазол-5-ил)-этокси]-фенил-пропионовую кислоту; 2-(2-бензоил-фениламино)-3-4-[2-(4-хлорфенилсульфанил)-этокси]-фенил-пропионовую кислоту; 2-(2-бензоил-фениламино)-3-[4-(4-изопропил-бензилокси)-фенил]-пропионовую кислоту; 2-(2-бензоил-фениламино)-3-[4-(4-хлорбензилокси)-фенил]-пропионовую кислоту; 2-(2-бензоил-фениламино)-3-[4-[3-(4 метокси-фенил)-пропокси]-фенил-пропионовую кислоту; 2-(2-бензоил-фениламино)-3-4-[2-(4 диметиламино-фенил)-этокси]-фенилпропионовую кислоту; 2-(2-бензоил-фениламино)-3-4-[2-(4 бром-фенокси)-этокси]-фенил-пропионовую кислоту; 2-(2-бензоил-фениламино)-3-4-[2-(5 нитро-пиридин-2-илокси)-этокси]-фенилпропионовую кислоту; 2-(2-бензоил-фениламино)-3-(4-2-[3-(6 метил-пиридин-2-ил)-пропокси]-этоксифенил)-пропионовую кислоту; 2-(2-бензоил-фениламино)-3-[4-(2 пиридин-3-ил-этокси)-фенил]-пропионовую кислоту; 2-(2-бензоил-фениламино)-3-4-[2-(3 метил-6-оксо-6 Н-пиридазин-1-ил)-этокси]фенил-пропионовую кислоту; 2-(2-бензоил-фениламино)-3-4-[2-(4 трифторметокси-фенил)-этокси]-фенилпропионовую кислоту; 2-(2-бензоил-фениламино)-3-4-[2-(3 циано-фенокси)-этокси]-фенил-пропионовую кислоту; 2-(2-бензоил-фениламино)-3-4-[2-(6 метокси-пиридин-2-илсульфанил)-этокси]фенил-пропионовую кислоту; 2-(2-бензоил-фениламино)-3-4-[1-(4 нитрофенил)-пирролидин-2-ил-метокси]фенил-пропионовую кислоту. Конкретная подгруппа соединений по настоящему изобретению включает 2(S)-(1-карбокси-2-4-[2-(5-метил-2 фенил-оксазол-4-ил)-этокси]-фенил-этиламино)-бензойной кислоты метиловый эфир; 3-4-[2-(бензоксазол-2-ил-метил-амино)этокси]-фенил-2(S)-(2-бензоил-фениламино)пропионовую кислоту; 17 3-4-[2-(бензоксазол-2-ил-метил-амино)этокси]-фенил-2-(2-циклогексанкарбонилфениламино)-пропионовую кислоту; 3-4-[2-бензоксазол-2-ил-метил-амино)этокси]-фенил-2-(2-бензоил-тиофен-3-иламино)-пропионовую кислоту; 2(S)-[1-метоксикарбонил-2-(4-2-[5-метил 2-(4-метил-пиперазин-1-ил)-тиазол-4-ил]этокси-фенил)-этиламино]-бензойную кислоту; 2(S)-(2-бензоил-фениламино)-3-4-[2(метил-пиридин-2-ил-амино)-этокси]-фенилпропионовую кислоту; 2(S)-(2-бензоил-фениламино)-3-4-[2-(5 метил-2-фенил-оксазол-4-ил)-этокси]-фенилпропионовую кислоту; и их фармацевтически приемлемые соли и сольваты. Кроме того, согласно данному изобретению предложено соединение формулы (I) или(Iа) либо его фармацевтически приемлемые соль или сольват для применения в терапии и, в частности, при лечении людей. Согласно другому аспекту настоящего изобретения предложено применение соединения формулы (I) или (Iа) либо его фармацевтически приемлемых соли или сольвата для производства лекарственного препарата для лечения состояний, при которых изменение воздействий PPAR-гамма оказывается терапевтически благоприятным. Согласно еще одному аспекту настоящего изобретения предложен способ лечения млекопитающих, включая человека, в частности, при лечении состояний, при которых изменение воздействий PPAR-гамма оказывается терапевтически благоприятным, при этом способ заключается во введении пациенту терапевтически эффективного количества соединения формулы (I) или (Iа) либо его фармацевтически приемлемых соли или сольвата. Специалистам следует иметь в виду, что упомянутая здесь ссылка на лечение распространяется на профилактику, равно как и на лечение установленных заболеваний или симптомов. Кроме того, следует иметь в виду, что количество соединения по изобретению, требуемое для лечения, будет меняться в зависимости от природы состояния, которое лечат, и возраста и состояния пациента, и в итоге будет на усмотрении лечащего врача или ветеринара. Однако в основном дозы, используемые для лечения взрослого человека, находятся в интервале 0,025000 мг в день, например 1-1500 мг в день. Желаемая доза может быть удобно представлена в виде разовой дозы или в виде разделенных доз,вводимых через соответствующие интервалы,например в виде двух, трех, четырех или более субдоз в день. Несмотря на то, что в терапевтических целях соединения по настоящему изобретению можно вводить в виде неочищенного химического вещества, предпочтительно все же пред 001403 18 ставлять активный ингредиент в виде фармацевтического препарата. В соответствии с этим,настоящим изобретением, кроме того, предложен фармацевтический препарат, содержащий соединение формулы (I) или (Iа) либо его фармацевтически приемлемые соль или сольват вместе с одним или более чем одним фармацевтически приемлемым носителем и возможно другими терапевтическими и/или профилактическими ингредиентами. Носитель(ли) должен быть "приемлемым" в смысле совместимости с другими ингредиентами препарата и не должен быть вредными для реципиента. Настоящим изобретением, кроме того, предложен способ получения фармацевтического препарата, содержащего соединение формулы (I) или (Iа),при котором соединение формулы (I) или (Iа) либо его фармацевтически приемлемую соль смешивают с одним или более чем одним фармацевтически приемлемым носителем и возможно другими терапевтическими и/или профилактическими ингредиентами. Препараты по настоящему изобретению главным образом включают препараты, приготовленные для перорального, трансбуккального, парентерального, трансдермального, ингаляционного, интраназального, чресслизистого,имплантантного или ректального введения, однако, предпочтительным является пероральный способ введения. Препараты для трансбуккального введения могут быть в форме таблеток или лепешек, приготовленных традиционным способом. Таблетки и капсулы для перорального введения могут содержать традиционные эксципиенты, такие как связывающие агенты (например, сироп, аравийскую камедь, желатин,сорбит, трагакант, крахмальный растительный клей или поливинилпирролидон), наполнители(например лактозу, сахар, микрокристаллическую целлюлозу, маисовый крахмал, фосфат кальция или сорбит), смазывающие вещества(например, стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль или диоксид кремния), разрыхлители (например, картофельный крахмал или натрий крахмал гликолят) или увлажняющие агенты, такие как лаурилсульфат натрия. Таблетки могут быть покрыты оболочкой в соответствии с методами, хорошо известными специалистам. С другой стороны, соединения по настоящему изобретению могут быть введены в жидкие препараты для перорального введения, такие как, например, водные или масляные суспензии, растворы, эмульсии, сиропы или эликсиры. Более того, препараты, содержащие данные соединения, могут быть представлены в виде сухого продукта для смешивания с водой или другим подходящим разбавителем перед применением. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, например, сироп сорбита, метилцеллюлозу, глюкозный/сахарный 19 сироп, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия или гидрогенизированные пищевые жиры; эмульгаторы, такие как лецитин, моноолеат сорбитана или аравийскую камедь; неводные разбавители (которые могут содержать пищевые масла), например, миндальное масло, фракционированное кокосовое масло, масляные эфиры,пропиленгликоль или этиловый спирт; и консерванты, например, метил- или пропил-парагидроксибензоаты либо сорбиновую кислоту. Такие препараты могут быть изготовлены в виде суппозиториев, например, содержащих традиционные основы для суппозиториев, такие как масло какао или другие глицериды. Вдобавок, препараты по настоящему изобретению могут быть изготовлены для парентерального введения посредством инъекции или непрерывной инфузии. Препараты для инъекций могут быть в такой форме, как суспензии, растворы или эмульсии в масляных или в водных разбавителях, и могут содержать такие составляющие препарата, как суспендирующие, стабилизирующие и/или диспергирующие агенты. С другой стороны, активный ингредиент может быть в виде порошка для смешивания с подходящим разбавителем (например со стерильной апирогенной водой) перед применением. Препараты по изобретению можно также приготовить в виде депо препарата. Такие препараты пролонгированного действия могут вводиться посредством имплантации (например подкожно или внутримышечно) или внутримышечной инъекции. В соответствии с этим для приготовления препаратов соединения по изобретению можно объединять с подходящими полимерными или гидрофобными материалами(например эмульсией в приемлемом масле), ионообменными смолами или такими умеренно растворимыми производными как, например,умеренно растворимые соли. Препараты по изобретению могут содержать 0,1-99% активного ингредиента, обычно 30-95% для таблеток и капсул и 3-50% для жидких препаратов. Далее согласно настоящему изобретению предложены способы получения соединений формулы (I). Если не оговорено особо, А, В,Alk, R1 и Z (и последующие заместители, представленные при этом) по существу такие как описано здесь ранее. Согласно общему способу (А) соединение формулы (I) может быть приготовлено из соединения формулы (II) либо непосредственно, либо косвенным путем с помощью одно- или многостадийной реакции посредством взаимодействия с соединением формулы А-В-Х, в котором Х представляет со 001403 20 бой уходящую группу или гидроксильную группу, а В представляет собой группу, содержащую С 1-6 алкилен, при этом В такой, что Х связан с C1-6 алкиленом непосредственно. Соответствующие условия реакции описываются ниже и в сопровождающих примерах. См. также, например, Chung et al., SelectiveReact. Vol. 42, p. 335 (1992). Например, А предпочтительно представляет собой фенил, пиридил, бензоксазолил или пиперазинил, каждый их которых возможно может быть замещен одной или более чем одной С 1-3 алкильной группой. Более предпочтительно,когда А представляет собой фенил, пиридил,бензоксазолил (пиперазинил). В предпочтительно представляет собойHet-C1-6 алкилен, как описано здесь ранее, а Z предпочтительно представляет собой -NH-Y(C=О)-T-R5, где Y представляет собой фенил,возможно замещенный одной или более чем одной C1-3 алкильной группой и/или одним или более чем одним атомом галогена; Т представляет собой связь или -О-, a R5 представляет собой C1-6 алкил или фенил (возможно замещенный одним или более чем одним атомом галогена, C1-3 алкилом, C1-3 алкоксигруппой, С 0-3 алкилен-NR9R10, где каждый из R9 и R10 независимо представляет собой водород,C1-3 алкил,-SО 2 С 1-3 алкил,-SО 2NНС 1-3 алкил,С 0-3 алкиленCO2 Н,С 0-3aлкиленCO2 С 1-3 алкилом или-OCH2 С(O)NH2). Более предпочтительно, когда Х представляет собой галогенидную группу или алкиллибо арилсульфоноксильную группу, а R1 представляет собой водород. Еще более предпочтительно, если соединения формулы АВХ и формулы (II) представляют собой где OMs является мезилатной уходящей группой, а R13 представляет собой фенил или группу ОСН 3. Взаимодействие между АВХ и соединением формулы (II), у которого R1 является C1-3 алкильной группой, предпочтительно метилом,а Х - гидроксильной группой, включает в себя реакцию Мицунобу с последующим гидролизом группы алкилового эфира до соответствующей кислоты без выделения эфира. Предпочтительно, если реакционная смесь Мицунобу содержит толуол. Более предпочтительно, когда соединения формул АВХ и (II) представляют собой где R13 представляет собой фенил или группу ОСН 3. Когда Z представляет собой следующее соединение то соединение формулы (II) получают таким образом, что сначала получают соединение формулы (II), где Z является за чем следует дегидрирование с катализатором дегидрирования и в присутствии акцептора водорода. Данный акцептор водорода предпочтительно представляет собой ароматическое нитросоединение. Соединение формулы (I) может быть получено реакцией с А-В-Х, при этом В такой, что Х связан с C1-6 алкиленом непосредственно, как описано выше, и где Х представляет собой гидроксильную группу или подходящую уходящую группу типа галогена или алкил- либо арилсульфонилоксигруппы (например, мезилата). С другой стороны, в случае, когда В представляет собой -NR2 С 1-6 алкилен, соединение формулы (I) может быть получено из соединения формулы (II) через защищенное промежуточное соединение, которое, соответственно,может быть представлено формулой (III) где Р представляет собой защитную группу, как,например, алкоксикарбонил, в частности, третбутоксикарбонил или ему подобная группа, используя описанные здесь далее в сопровождающих примерах методики и известные специалистам реакции установления и снятия защиты, например как описано в T.W. GreenChemistry, John WileySons. Соединение формулы (II) может, например, быть получено из соединения формулы 22 ный дикетон сначала приводят во взаимодействие с амином с последующим дегидрированием в присутствии металлического катализатора и акцептора водорода. Предпочтительные акцепторы водорода представляют собой ароматические нитросоединения, которые легко восстанавливаются, к примеру пара-нитротолуол. Если желательно, чтобы R1 являлся водородом, то соединение, R1 в котором представляет собой алкил, можно подвергнуть гидролизу, например при щелочных условиях в смеси воды и полярного апротонного растворителя. Соединение формулы (IV) имеется в продаже или может быть получено, как описано в J. Med. Chem. 1978, 21(5), 430-437. Согласно еще одному общему способу (В) соединение формулы (I) может быть получено из соединения формулы (V) соответственно взаимодействием с NR3R4 Н. Например, эта реакция может быть осуществлена при температуре дефлегмации в присутствии металлического катализатора, например родиевого катализатора (димера ацетата родия) и соответственно углеводородного растворителя,например толуола или ему подобного. Следует отметить, что в результате осуществления способа (В) получаются соединения формулы (I), в которых Z представляет собой -NR3R4. Соединение формулы (V) может быть получено диазотированием соединения формулы Целесообразно проводить реакцию диазотирования при температуре дефлегмации в присутствии нитрита, например, изоамилнитрита. Соединения формулы (VI) могут иметься в продаже, например, O-бензил-тирозин метиловый эфир. С другой стороны, соединения формулы (VI) могут быть получены из известных исходных материалов, например, галогенида бензоксазола и аминоспирта, как будет описано здесь далее в сопутствующих примерах. Однако соединение формулы (I) может быть получено непосредственно из соединения формулы (VI) с помощью общего способа (С). Например, соединение формулы (VI) может быть приведено во взаимодействие с дикетоном общей формулы СН 3-(СН 2)n-(С=O)-СН 2-(C=O)T-R5, где n есть целое число, выбранное из чисел от 0 до 3, таким образом, чтобы получить соединение формулы (I), у которого Z представляет собой -NН-С 2-6 алкенилен-(С=O)-Т-R5. В еще одном воплощении соединение формулы(VI) может быть ацилировано взаимодействием с R5-(С=О)-X, где Х представляет собой подходящую уходящую группу, по существу как описана здесь ранее, соответственно в присутствии 23 основания, например третичного амина, такого как триэтиламин или ему подобного. Согласно еще одному способу (D) соединение формулы (I) может быть получено из соединения формулы (VII) путем взаимодействия с сильным основанием,соответственно с амидом щелочного металла, с последующим взаимодействием с соединением формулы Z-X, у которого Х представляет собой подходящую уходящую группу, аналогичную описанной здесь прежде. В частности, способ(D) используется при получении соединений формулы (I), у которых Z представляет собой-(С 1-3 алкилен)фенил, по существу описанный здесь ранее. Соответственно, реакцию проводят в присутствии эфирного растворителя, например, тетрагидрофурана, при перемешивании в течение нескольких часов. Соответственно, соединение формулы(VII) может быть получено из соединений формул (VIII) и (IX) где Р может представлять собой подходящую защитную группу, по существу такую как описана здесь ранее. Соединения формулы (IX) имеются в продаже. Соединения формулы (VIII) могут быть получены из известных исходных материалов с использованием методик, например, ссылка на которые дана выше, начинающихся с галогенида бензоксазола и аминоспирта. Согласно еще одному общему способу (Е) соединение формулы (I) может быть получено циклизацией соединения формулы (X) с выходом соединения формулы (I), в котором А представляет собой бициклическое кольцо при этом С является 5- или 6-членным гетероциклическим кольцом, содержащим два гетероатома азота, и при этом циклизация проводится в кислой среде. Соответственно, соединение формулы (X) может быть получено из соединения формулы 24 металла, например, карбоната калия или ему подобного. Х представляет собой уходящую группу, по существу такую как описана здесь ранее, в частности мезилатную группу. Соединение формулы (XI) может быть получено из соединения формулы (XII) соответственно путем взаимодействия, например с алкил- или арилсульфонилгалогенидом,например, метансульфонилхлоридом, соответственно в присутствии эфирного растворителя,например, тетрагидрофурана, и третичного амина, например триэтиламина. Соединение формулы (XII) может быть,соответственно, получено из соединения формулы (II), по существу как описано здесь ранее,например, путем взаимодействия с карбонатом алкилена в присутствии карбоната щелочного металла, например, карбоната калия. Согласно еще одному аспекту настоящего изобретения соединение формулы (I) может быть превращено в другое соединение формулы(I). Конкретная реакция взаимопревращения включает в себя превращение соединения формулы (I), в котором R1 представляет собой С 1-3 алкил, в соединение формулы (I), где R1 представляет собой водород, с использованием гидролитических методик, например, с гидроксидом щелочного металла, в присутствии эфирного растворителя, например, тетрагидрофурана, и спиртового растворителя, например, метанола или ему подобного. Специалистам следует иметь в виду, что соединения, которые подпадают под общую формулу (I), в некоторых случаях могут описываться здесь далее в разделе промежуточных соединений, поскольку они оказываются полезными для получения других соединений формулы (I). Для любого из описанных выше общих способов получения и любой из общих схем получения бывает необходима и/или желательна защита чувствительных и реакционноспособных групп. Защитные группы применяют согласно стандартным способам органического синтезаGroups in Organic Synthesis, John WileySons). Эти группы удаляют на подходящей стадии синтеза, применяя известные специалистам способы. Так, например, аминогруппы могут быть защищены группой, выбранной из аралкила(например, бензила), ацила или сульфонила,например, аллилсульфонила, трет-бутоксикарбонила, фталимида либо тозила; последующее удаление защитной группы достигается, когда это необходимо, путем гидролиза или гидрогенолиза в стандартных условиях. Так, например, трет-бутилкарбонильные группы могут быть удалены гидролизом в кислых условиях. Гидроксильные и карбоксильные группы могут 25 быть защищены традиционными гидроксил- и карбоксилзащитными группами. Примеры подходящих гидроксил- и карбоксилзащитных групп включают в себя группы, выбранные из алкила, например, метила, тpeт-бутила или метоксиметила; аралкила, например, бензила, дифенилметила или трифенилметила; гетероциклических групп, таких как тетрагидропиранил,ацил, например, ацетил или бензоил, и силильных групп, таких как триалкилсилил, например,трет-бутилдиметилсилил. Гидроксилзащитные группы могут быть удалены традиционными способами. Так, например, алкил, силил, ацил и гетероциклические группы можно удалить путем гидролиза в кислых или щелочных условиях. Аралкильные группы, такие как трифенилметил, также могут быть удалены гидролизом в кислых условиях. Аралкильные группы, такие как бензил, могут быть расщеплены путем гидрогенолиза в присутствии катализатора на основе благородного металла, такого как палладийна-угле. Силильные группы также могут быть удалены традиционно с использованием источника фторид-ионов, такого как фторид тетра-нбутиламмония. Многие из описанных выше реакций и путей синтеза могут быть осуществлены на твердой подложке. Например, R1 в формуле (II) может представлять собой подходящую твердофазную подложку, например, R1 может представлять собой 2-хлортритилхлорид-полистирольную смолу. По окончании необходимых реакций желаемое соединение формулы (I) может быть выделено путем отделения от твердофазной подложки. Приведенные далее примеры иллюстрируют способы синтеза некоторых индивидуальных соединений по настоящему изобретению и являются конкретным приложением описанных выше общих способов получения таких соединений. В соответствии с этим, раздел примеры никоим образом не следует рассматривать как ограничивающий сферу настоящего, рассмотренного здесь изобретения. Используемые при описании настоящего изобретения символы и обозначения в приведенных способах получения, схемах и примерах согласуются с таковыми, применяемыми в современной научной литературе, например вJournal of the American Chemical Society. Кроме отдельно оговоренных случаев, все исходные материалы были получены от торговых поставщиков и использовались без дополнительной очистки. Более конкретно, в примерах и на протяжении всего описания могут применяться следующие обозначения: г (граммы); мг (миллиграммы); л (литры); мл (миллилитры); мкл(бис(2-оксо-3-оксазолидинил)фосфиновый хлорид); ВОС (трет-бутилоксикарбонил); DCC (дициклогексилкарбодиимид); Cbz (бензилоксикарбонил); NаНСО 3 (насыщенный водный бикарбонат натрия). Все ссылки на эфир относятся к диэтиловому эфиру; солевой раствор означает насыщенный водный раствор NaCl. Температура, за исключением отдельно оговоренных случаев, выражена в С (стоградусная шкала). Все реакции проводят при комнатной температуре,за исключением особо оговоренных случаев. Спектры 1 Н ЯМР регистрируют на приборах марок Varian VXR-300, Varian Unity-300 илиVarian Unity-400. Значения химических сдвигов выражены в миллионных долях (ррm, в -единицах). Константы взаимодействия представлены в единицах герц (Гц). Картина расщепления дается как s, синглет; d, дублет; t, триплет; q, квартет; т, мультиплет; br, широкий. Масс-спектры (MS) низкого разрешения регистрируют на спектрометрах JOEL JMSAX505HA, JOEL SX-102 или SCIEX-APIiii. Все масс-спектры взяты в колебании положительного иона под действием электроспрэй-ионизации (ES), химической ионизации(CI), электронного удара (EI) или бомбардировки быстрыми атомами (FAB). Инфракрасные спектры (ИК) получают на спектрометре маркиNicolet 510 FT-IR с использованием 1-мм NaCLкюветы. Данные по вращению регистрируют на поляриметре марки Реrkin-Elmer 241. Ход всех реакций контролируют с помощью тонкослойной хроматографии на 0,25 мм пластинках силикагеля (60F-254) фирмы E.Merck; визуализацию осуществляют с помощью УФ-света, 7%ного раствора фосфомолибденовой кислоты или пара-анисового альдегида в этаноле. Колоночную флэш-хроматографию проводят на силикагеле (230-400 меш, Merck). Продукты очищают препаративной обращенно-фазовой жидкостной хроматографией высокого давления (ОФ-ЖХВД), используя либо Waters Model 3000 Delta Prep, снабженный радиальным картриджем Delta-pak (C18, 300 А,15 м, 47 мм х 300 мм), либо систему фирмыPharmacia LKB, используя Merck Lobar силикагелевые или обращенно-фазовые колонки С 18. Во всех случаях применяют линейные градиенты и скорость потока 10-100 мл/мин (t0 = 5,0 27 мин). Все растворители содержат 0,1%-нуюTFA. Аналитической чистоты достигают с помощью ОФ-ЖХВД, применяя либо системуWaters 600 Е, снабженную диодным спектрометром Waters 990 (I интервал 200-400 нм), либо систему Hewlett Packard 1050, снабженную диодным спектрометром. В качестве неподвижной фазы применяют или колонки Dynamax C8 (25 см х 4,1 мм), Dynamax 60A C18 (25 см х 4,6 мм),Vydac C18 (5 м; 4,6 мм х 250 мм), или колонкуRainin C18 (5 м; 4,6 мм х 250 мм). Скорость потока составляет от 1,0 до 1,5 мл/мин (to = 2,8 или 3,0 мин), а сами системы растворителей такие же, как описаны ранее. Энантиомерной чистоты добиваются, используя либо колонкуChiralpak OD (25 см х 4,6 мм), на системе для ЖХВД Hewlet Packard серии 1050, оборудованной диодным спектрометром, или на системеSupercritical Fluid (SFC) с использованием в качестве подвижной фазы смеси СО 2/метанол. Промежуточные соединения Промежуточное соединение 1. 3-(4-Бензилоксифенил)-2-диазопропионовой кислоты метиловый эфир. Раствор, содержащий 2,5 г (8,77 ммоля) метилового эфира O-бензилтирозина, 1,03 г(8,77 ммоля) изоамилнитрита и 1,57 г (26,2 ммоля) ледяной уксусной кислоты в хлороформе (65 мл), перемешивают и кипятят с обратным холодильником в течение 15 мин, после чего охлаждают до комнатной температуры. Раствор концентрируют до масла, остаток растворяют вEtOAc (100 мл) и промывают 5%-ным раствором NаНСО 3. Органическую фазу затем высушивают (MgSO4), фильтруют и концентрируют до масла, которое хроматографируют на силикагеле, используя смесь гексан/EtOAc (1:1) и получая указанное в заголовке соединение. 1 Н ЯМР (СDСl3)7.43-7.31 (m, 5H), 7.14 (d, 2H,J=8.7), 6.90 (m, 2 Н), 5.03 (s, 2H), 3.76 (s, 3 Н),3.56 (s, 2H). Промежуточное соединение 2. 2-(4-Бензилоксибензил)-3-гидрокси-3-фенил-2,3-дигидро-1H-индол-2-карбоновой кислоты метиловый эфир. К раствору, содержащему 250 мг (0,84 ммоля) промежуточного соединения 1 и 316 мг(1,59 ммоля) 2-аминобензофенона в толуоле (5 мл), при температуре дефлегмации добавляют 1 мг (0,002 ммоля; 0,24 экв.) димера ацетата родия(II). Полученный раствор кипятят с обратным холодильником в течение 10 мин, охлаждают до комнатной температуры, выливают в 2 н НСl (10 мл) и экстрагируют EtOAc. Органическую фазу высушивают (MgSO4), фильтруют,концентрируют и хроматографируют на силикагеле, используя смесь гексан/EtOAc (3:1) и получая указанное в заголовке соединение в виде масла желтого цвета. 1 Н ЯМР (СDСl3)7.62 (s,1H), 7.60 (s, 1H), 7.43-7.24 (m, 9H), 7.11-7.09 (d, 001403(0,57 ммоля) (2-амино-тиофен-3-ил)-фенилметанона (Robba, M., et al. Bull. Soc. Chim. Fr. 1974, 12(2), 2864-2870) в 10 мл толуола, при температуре 80 С. Смесь нагревают до температуры дефлегмации в течение 5 мин, затем охлаждают до комнатной температуры. Растворитель удаляют при пониженном давлении и остаток очищают флэш-хроматографией, используя в качестве элюента CH2Cl2 (неразбавленный) и получая 120 мг указанного в заголовке соединения. ТСХ (CH2Cl2): Rf=0,40. Промежуточное соединение 4. 2-(2-Бензоил-тиофен-3-ил-амино)-3-(4-бензилокси-фенил)пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (280 мг) получают из 600 мг (2,02 ммоля) промежуточного соединения 1 (Kawamatsu Y. et al.(1,00 ммоля) (3-амино-тиофен-2-ил)-фенилметанона (Kiehne H. (Bayer A.G.) Ger. Offen 1945964 (March 25, 1971 согласно способу получения промежуточного соединения 3 с последующей очисткой флэш-хроматографией, используя CH2Cl2 (неразбавленный) в качестве элюента; ТСХ (CH2Cl2 (неразбавленный:Rf=0,45. Промежуточное соединение 5. N-2-(Nметиламиноэтанол)-1,3-бензоксазол. К перемешиваемому раствору, содержащему 10 г (133 ммоля) N-метиламиноэтанола,при температуре 0 С по каплям добавляют 10 г(65,2 ммоля) 2-хлорбензоксазола. Полученный раствор перемешивают в течение 1 ч, разбавляют водой (250 мл) и экстрагируют EtOAc. Органическую фазу промывают солевым раствором,высушивают (MgSО 4), фильтруют и концентрируют, получая 12,2 г масла рыжеватокоричневой окраски, которое затвердевает при стоянии, т.пл. 56-58 С. Промежуточное соединение 6. N-2-[(Nметиламиноэтил-1-метилсульфонат)-1,3-бензоксазол]. К перемешиваемому раствору, содержащему 22 г (114,6 ммоля) промежуточного соединения 5 и 14,43 г (126 ммоля) метансульфонилхлорида в дихлорметане (100 мл),при температуре 0 С по каплям добавляют 17,6 мл (126,3 ммоля) TEA. Полученную суспензию перемешивают в течение 1 ч и разбавляют водой (200 мл) и 1 М раствором Н 3 РО 4 (100 мл). Органическую фазу отделяют, высушивают(MgSО 4), фильтруют и концентрируют, получая 20 г твердого вещества белого цвета, т.пл. 9496 С. Промежуточное соединение 7. 2-Амино-34-[2-(бензоксазол-2-ил-метил-амино)-этокси]фенил-пропионовой кислоты метиловый эфир. К перемешиваемому раствору, содержащему 3,61 г (18,5 ммоля) (S)-тирозинметилового эфира и 0,81 г (20,4 ммоля) гидрида натрия(60%-ной суспензии в минеральном масле) в 50 мл DMF, при комнатной температуре добавляют 5,0 г (18,5 ммоля) промежуточного соединения 6. Полученный раствор нагревают до 100 С в течение 2 ч. После охлаждения до комнатной температуры реакцию в растворе останавливают добавлением воды и смесь экстрагируют EtOAc. Объединенные органические фазы высушивают(MgSО 4) и растворитель удаляют in vacuо. Остаток очищают хроматографией на силикагеле,используя в качестве элюента смесь гексан/(МН). Промежуточное соединение 8. 2(S)-Амино-3-4-[2-(бензоксазол-2-ил-метил-амино)этокси]-фенил-пропионовая кислота. 13,5 мл (13,5 ммоля) 1 н. раствора гидроксида натрия добавляют к перемешиваемому раствору, содержащему 5,00 г (13,5 ммоля) промежуточного соединения 7 (Faller A. et al. WO 94/29285) в 25 мл МеОН, и полученный раствор перемешивают в течение 12 ч при комнатной температуре. МеОН удаляют при пониженном давлении, а остаток разбавляют 25 мл воды. Раствор трижды экстрагируют эфиром (по 25 мл), после чего водную фазу подкисляют с помощью 14 мл 1 н. соляной кислоты. Полученное твердое вещество белого цвета отфильтровывают, промывают водой (3 х 25 мл) и высушивают при пониженном давлении, получая 4,02 г указанного в заголовке соединения; MS (API+) низкого разрешения m/е 356 (МН+). Промежуточное соединение 9. 2-Диазо-34-[2-(бензоксазол-2-ил-метил-амино)-этокси]фенил-пропионовой кислоты метиловый эфир. Реакцию проводят за противовзрывным экраном. К перемешиваемому раствору, содержащему 1,45 г промежуточного соединения 7 и 0,7 мл (11,8 ммоля) ледяной уксусной кислоты в 40 мл хлороформа, добавляют 0,5 мл (3,93 ммоля) изоамилнитрита. Полученный раствор нагревают до температуры 60 С в течение 0,25 ч. Раствор после нагревания меняет окраску до оранжевой/коричневой. Раствор охлаждают до комнатной температуры, экстрагируют водой и промывают насыщенным раствором бикарбоната натрия. Органические фазы далее высушивают (MgSО 4) и растворитель удаляют in vacuo,получая с количественным выходом указанное в заголовке соединение, которое используют без 30 дальнейшей очистки; MS (ES) низкого разрешения m/е 381 (МН+), 353. Промежуточное соединение 10. 3-4-[2(Бензоксазол-2-ил-метил-амино)-этокси]-фенил-2-(2-бензоил-фениламино)-пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (110 мг) получают из 0,17 г (0,5 ммоля) промежуточного соединения 9 и 0,11 г (0,5 ммоля) 2-аминобензофенона согласно способу получения промежуточного соединения 3 с последующей очисткой хроматографией на силикагеле, используя смесь EtOAc/гексан (градиент от 3:7 до 1:1); MS(ES) низкого разрешения m/е 550 (МН+). Промежуточное соединение 11. 3-4-[2(Бензоксазол-2-ил-метил-амино)-этокси]фенил-2-(2-6 ензоил-4-метил-фениламино)пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (100 мг) получают из 0,13 г (0,3 ммоля) промежуточного соединения 9 и 0,10 г (0,5 ммоля) 2-амино-5 метилбензофенона согласно способу получения промежуточного соединения 3 с последующей очисткой хроматографией на силикагеле, используя смесь EtOAc/гексан (градиент от 3:7 до 1:1); MS (ES) низкого разрешения m/е 564(2-амино-фенил)-циклогексил-метанона согласно способу получения промежуточного соединения 3 с последующей очисткой колоночной флэш-хроматографией на силикагеле,используя в качестве элюента смесь гексан/(3-амино-тиофен-2-ил)-фенил-метанона согласно способу получения промежуточного соединения 3 с последующей очисткой колоночной флэш-хроматографией на силикагеле,используя в качестве элюента смесь гексан/(7,77 ммоля; 1,0 экв.) 60%-ной дисперсии гидрида натрия в масле. Полученный раствор перемешивают 5 мин и к нему добавляют 2,31 г (8,55 ммоля; 1,1 экв.) промежуточного соединения 6. Полученный раствор оставляют нагреваться до комнатной температуры и перемешивают в течение 19 ч, после чего реакцию останавливают добавлением H2O. Реакционную смесь экстрагируют EtOAc. Органический слой высушивают(MgSО 4) и растворители удаляют in vacuo. Очистка колоночной флэш-хроматографией на силикагеле с использованием в качестве элюента смеси гексан/EtOAc в соотношении 1:1 позволяет получить 1,61 г указанного в заголовке соединения в виде прозрачного масла; MS (ES) низкого разрешения m/е 355 (МН+). Промежуточное соединение 15. 3-4-[2(Бензоксазол-2-ил-метил-амино)-этокси]фенил-2-бензил-пропионовой кислоты метиловый эфир. К перемешиваемому раствору, содержащему 502,2 мг (1,42 ммоля) промежуточного соединения 14 в 10 мл THF, при -78 С добавляют 1,70 мл (1,70 ммоля; 1,2 экв.) 1,0 М раствораNaHMDS в THF. Полученный раствор перемешивают в течение 15 мин и к нему добавляют 315,1 мг (1,84 ммоля; 1,3 экв.) бензилбромида в 4,0 мл THF. Полученный раствор оставляют нагреваться в бане до комнатной температуры и перемешивают в течение 4 ч, после чего реакцию останавливают с помощью H2O. Реакционную смесь экстрагируют EtOAc. Органический слой высушивают (MgSO4) и растворители удаляют in vacuо. Очистка с помощью колоночной флэш-хроматографии на силикагеле с использованием в качестве элюента смеси гексан/EtOAc в соотношении 3:2 позволяет получить 90,8 мг указанного в заголовке соединения в виде прозрачного масла;LDA в циклогексане. Полученный раствор перемешивают в течение 15 мин и к нему добавляют 846,3 мг (3,39 ммоля; 1,2 экв.) 2-бромбензилбромида в 4,0 мл THF. Полученный раствор оставляют нагреваться в бане до комнатной температуры и перемешивают в течение 4 ч,после чего реакцию останавливают с помощьюH2O. Реакционную смесь экстрагируют EtOAc. Органический слой высушивают (MgSО 4) и растворители удаляют in vacuо. Очистка колоночной флэш-хроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 3:2 в качестве элюента позволяет получить(Cantello В.С.С. et al. J. Med. Chem. 1994, 37,3977-3985) в 50 мл безводного этилового спирта. Смесь перемешивают при 20 С в течение 2 ч. К смеси добавляют 10 мл воды и ее перемешивают в течение 30 мин. Этиловый спирт удаляют при пониженном давлении, к остатку добавляют 50 мл воды и 100 мл диэтилового эфира. Смесь перемешивают в течение 30 мин, после чего к ней добавляют дополнительные 100 мл эфира. Фазы разделяют, органическую фазу трижды экстрагируют 100 мл воды, высушивают над безводным сульфатом магния, затем фильтруют. Фильтрат концентрируют при пониженном давлении, получая 5,06 г указанного в заголовке соединения; ТСХ (гексан/EtOAc (1:1: Rf=0,50. Промежуточное соединение 18. [2-(4 Бромметил-фенокси)-этил]-метил-пиридин-2 ил-амин. Трифенилфосфин дибромид (422 мг; 1,0 ммоля) добавляют к перемешиваемому раствору, содержащему 258 мг (1 ммоль) промежуточного соединения 17 в 10 мл метиленхлорида,при температуре 5 С. Смесь перемешивают в течение 30 мин и оставляют нагреваться до 20 С, после чего к ней добавляют дополнительные 422 мг (1 ммоль) трифенилфосфина дибромида в виде одной порции. Смесь перемешивают дополнительные 30 мин, затем добавляют 20 мл метиленхлорида и раствор охлаждают до 0 С. К смеси добавляют 30 мл насыщенного водн. раствора бикарбоната натрия и ее перемешивают в течение 30 мин. Фазы разделяют,водную фазу дважды экстрагируют 20 мл метиленхлорида, далее органические фазы объединяют, высушивают над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении, поддерживая температуру ниже 20 С. Остаток очищают флэш-хроматографией, используя смесь гексан/EtOAc(4:1) в качестве элюента. Фракции концентрируют при пониженном давлении при температуре 15-20 С, получая 260 мг указанного в заголовке соединения; ТСХ (гексан/EtOAc (1:1:Rf=0,90. Промежуточное соединение 19. 2-Бензгидрилиденамино-3-4-[2-(метил-пиридин-2-иламино)-этокси]-фенил-пропионовой кислоты этиловый эфир. Раствор 4,0 г (71,4 ммоля) гидроксида калия в 4 мл воды добавляют к охлажденному(0 С) раствору, содержащему 3,50 г (10,9 ммо 33 ля) промежуточного соединения 18, 3,70 г (13,8 ммоля) N-(дифенилметилен)-глицина этилового эфира и 4,3 г (16,1 ммоля) тетрабутиламмония гидросульфата, в течение 5 мин. Полученную смесь желтого цвета перемешивают в течение 1 ч при 5-10 С, затем добавляют 10 г безводного сульфата магния и суспензию фильтруют. Фильтрат концентрируют при пониженном давлении без использования внешнего подогрева. Остаток наносят на заполненную силикагелем колонку, которую предварительно промывают смесью растворителей, содержащей гексан/ЕtOАс/NЕt3 (40:10:1). Очистка флэш-хроматографией с использованием смесей гексан/EtOAc (4:1), затем гексан/EtOAc (2:1) позволяет получить 5,66 г указанного в заголовке соединения: ТСХ (гексан/EtOAc (5:1: Rf=0,30. Промежуточное соединение 20. 2-Амино 3-4-[2-(метил-пиридин-2-ил-амино)-этокси]фенил-пропионовой кислоты этиловый эфир. К перемешиваемому раствору, содержащему 5,66 г (11,1 ммоля) промежуточного соединения 19 в 200 мл этанола, добавляют 20 мл конц. соляной кислоты при 20 С в продолжение 15 мин и смесь перемешивают при комнатной температуре в течение одного часа. К данному раствору по каплям добавляют 400 мл насыщенного раствора бикарбоната натрия и по мере прекращения выделения диоксида углерода добавляют 200 мл метиленхлорида. Фазы разделяют и водную фазу трижды экстрагируют 100 мл метиленхлорида. Органические фазы объединяют, высушивают с сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении и остаток очищают флэшхроматографией, в качестве элюента используя смеси растворителей гексан/EtOAc (1:1), EtOAc(гексан/EtOAc (1:1: Rf=0,10. Промежуточное соединение 21. 3-Гидрокси-2-4-[2-(метил-пиридин-2-ил-амино)-этокси]-бензил-3-фенил-2,3-дигидро-1 Н-индол-2 карбоновой кислоты этиловый эфир. Указанное в заголовке соединение (310 мг) получают из 291 мг (0,85 ммоля) промежуточного соединения 20 согласно способу получения промежуточного соединения 1 с последующим взаимодействием с 197 мг (1 ммолем) 2 аминобензофенона согласно способу получения промежуточного соединения 3 с последующей очисткой флэш-хроматографией на силикагеле,используя в качестве элюента смеси гексан/EtOAc (4:1), затем гексан/EtOAc (1:1); 34 перемешивают 5 ч при 20 С, затем при пониженном давлении удаляют МеОН. К смеси добавляют 240 мг (2 ммоля) бисульфата натрия в 5 мл воды и суспензию перемешивают при 20 С в течение 30 мин. Осадок фильтруют и трижды промывают 5 мл воды. Фильтрат подводят до значения рН=5 с помощью насыщенного раствора бикарбоната натрия, осадок фильтруют и трижды промывают 5 мл воды. Твердые осадки объединяют и высушивают при пониженном давлении, получая 115 мг указанного в заголовке соединения: ТСХ (EtOH (неразб.: Rf=0,05. Промежуточное соединение 23. (s)-2-(2 Бензоил-фениламино)-3-(4-гидрокси-фенил)пропионовой кислоты метиловый эфир. Перемешиваемую смесь, содержащую 92 г(0,45 моля) 2-бензоил-циклогексанона (Denny,W.A. et. al. J. Med. Chem. 1978, 21(5), 430-437),78 г (0,40 моля) L-тирозинметилового эфира,17,0 г палладия на активированном угле (10%ного), кипятят с обратным холодильником в течение 2 ч в 1 л анизола, удаляя получающуюся воду с помощью аппарата Дина-Старка. Смесь охлаждают до 80 С, отфильтровываютPd/C и трижды промывают 50 мл анизола. Смесь охлаждают до 40 С, добавляют 1 л гексана и хранят при -20 С в продолжение 48 ч. Твердое вещество отфильтровывают, пять раз промывают 200 мл гексана, получая 89,0 г неочищенного (S)-2-(2-бензоил-фениламино)-3-(4 гидрокси-фенил) -пропионовой кислоты метилового эфира. Это твердое вещество смешивают с 220 мл МеОН, суспензию кипятят с обратным холодильником в течение 30 мин. Смесь охлаждают до 0 С, продукт фильтруют и дважды промывают 50 мл холодного (-20 С) МеОН,затем высушивают при пониженном давлении,получая 67,4 г указанного в заголовке соединения, т.пл. 185-186 С; MS (ESP+) низкого разрешения m/е 376 (МН+). Промежуточное соединение 24. 2-(N-третБутоксикарбонил-N-метил-амино)-этанол. Раствор, содержащий 10 г (0,133 моля) 2(метиламино)-этанола в 266 мл CH2Cl2, при 25 С обрабатывают 29,1 г (0,133 моля) BOC2O. После перемешивания в течение 3 ч реакционную смесь концентрируют in vacuо. Очистка хроматографией на силикагеле с элюированием смесью гексан/EtOAc (1:1/Е 1:2/Е 1:4) дает 23,3 г (100%) указанного в заголовке соединения в виде прозрачного масла: MS (ES) низкого разрешения m/е 198 (MNa+). Промежуточное соединение 25. 2(S)-(2 Бензоил-фениламино)-3-4-[2-(трет-бутоксикарбонил-метил-амино)-этокси]-фенилпропионовой кислоты метиловый эфир. Раствор, содержащий 1,5 г (3,99 ммоля) промежуточного соединения 23, 770 мг (4,39 ммоля; 1,1 экв.) промежуточного соединения 24 и 1,57 г (5,99 ммоля; 1,5 экв.) трифенилфосфина в 40 мл THF, при температуре 25 С обрабатывают, добавляя по каплям 0,944 мл (5,99 ммоля; 35 1,5 экв.) DEAD. Реакционную смесь перемешивают при температуре 25 С в течение 48 ч и далее концентрируют in vacuo. Остаток очищают колоночной флэш-хроматографией на силикагеле, используя смесь гексан/EtOAc (2:1) в качестве элюента и получая 1,37 г (65%) указанного в заголовке соединения в виде вязкого масла желтого цвета; MS (ES) низкого разрешения m/е 555 (MNa+), 533 (МН+). Промежуточное соединение 26. 2(S)-(2 Бензоил-фениламино)-3-4-[2-(метил-пиридин 2-ил-амино)-этокси]-фенил-пропионовой кислоты метиловый эфир. Раствор, содержащий 2,56 г (4,81 ммоля) промежуточного соединения 25 в 56 мл CH2Cl2,при температуре 25 С обрабатывают 56 мл (0,73 моля; 152 экв.) TFA. После перемешивания в течение 30 мин раствор нейтрализуют насыщенным раствором NaHCO3, затем твердымNаНСО 3 и далее экстрагируют CH2Cl2. Объединенные органические фазы высушивают(Na2SO4), фильтруют и концентрируют in vacuo. Неочищенный амин незамедлительно используют в последующей реакции. Раствор, содержащий 2,08 г (4,81 ммоля) указанного выше неочищенного амина в 480 мл 2-фторпиридина,кипятят с обратным холодильником в течение 16 ч и далее концентрируют in vacuo. Очистка колоночной флэш-хроматографией на силикагеле с использованием смеси гексан/EtOAc (2:1) в качестве элюента дает 1,85 г (76%) указанного в заголовке соединения в виде масла желтого цвета: MS (CI) низкого разрешения m/е 511 (МН+),510 (М+). Промежуточное соединение 27. 3-4-[2(Бензоксазол-2-ил-метил-амино)-этокси]фенил-2(S)-(2-бензоилфениламино)-пропионовой кислоты метиловый эфир. Раствор, содержащий 319 мг (0,60 ммоля) промежуточного соединения 25 в 7 мл CH2Cl2,при 25 С обрабатывают 7 мл (90,9 ммоля; 152 экв.) TFA. После перемешивания в течение 30 мин раствор нейтрализуют насыщенным раствором NаНСО 3 и экстрагируют CH2Cl2. Объединенные органические фазы высушивают(Na2SO4), фильтруют и концентрируют in vacuo. К раствору указанного выше амина 259 мг (0,60 ммоля) в 6 мл THF при 25 С добавляют 0,250 млNаНСО 3 и экстрагируют EtOAc. Объединенные органические фазы высушивают (Na2SO4),фильтруют и концентрируют in vacuo. Очистка колоночной флэш-хроматографией с элюированием смесью гексан/EtOAc (2:1/Е 1:1) дает 244 мг (74 %) указанного в заголовке соединения в виде твердого вещества желтого цвета; MS (ES) низкого разрешения m/е 572 (MNa+), 550THF, и фильтрат концентрируют in vacuo. Остаток растворяют в 10 мл пиридина и обрабатывают 1,9 г (9,89 ммоля; 1 экв.) паратолуолсульфонил-хлорида. По окончании перемешивания в течение 24 ч реакционную смесь выливают в H2O и продукт экстрагируютEtOAc. Объединенные органические фазы высушивают (MgSO4), фильтруют и концентрируют in vacuo. Очистка колоночной флэшхроматографией на силикагеле с элюированием смесью гексан/ EtOAc (2:1) дает 2,76 г (75%) указанного в заголовке соединения в виде твердого вещества белого цвета; 1 Н ЯМР (CDCl3,300 МГц)7.67 (d, 2H, J=12.3), 7.33-6.94 (m,6H), 4.46 (dd, 1H, J=7.8, 16.2), 4.30-4.10 (m, 2H),3.60 (m, 2 Н), 2.16 (s, 3H), 2.25-1.90 (m, 4 Н); MS(2:1: Rf=0,28. Промежуточное соединение 29. Толуол-4 сульфоновой кислоты 1-бензоксазол-2-илпирролидин-2R-илметиловый эфир. Указанное в заголовке соединение (1,6 г) получают из 1,0 г (9,89 ммоля) D-пролинола согласно способу получения промежуточного соединения 28 с последующей очисткой посредством растирания твердого вещества со смесью гексан/EtOAc (1:1); MS (ES) низкого разрешения m/е 395 (MNa+), 373 (МН+). Промежуточное соединение 30. 3-[4-(1 Бензоксазол-2-ил)-пирролидин-2S-ил-метокси)фенил]-2-(2-бензоил-фениламино)-пропионовой кислоты метиловый эфир. Раствор, содержащий 2,0 г (5,33 ммоля) промежуточного соединения 23 и 1,98 г (5,33 ммоля; 1 экв.) Промежуточного соединения 28 в 21,3 мл DMF, при 25 С обрабатывают в атмосфере азота 2,08 г (6,4 ммоля; 1,2 экв.) Cs2CO3. Реакционную смесь нагревают до 80 С и перемешивают 24 ч. После охлаждения до 25 С реакционную смесь выливают в H2O и смесь гексан/EtOAc (1:1) и экстрагируют смесью гексан/EtOAc (1:1). Объединенные органические фазы высушивают (Na2SO4), фильтруют и концентрируют in vacuo. Очистка колоночной флэш-хроматографией на силикагеле с элюированием смесью гексан/EtOAc (1,5:1) дает 2,26 г(74%) указанного в заголовке соединения в виде твердого вещества желтого цвета; MS (ES) низкого разрешения m/е 598 (MNa+), 576 (МН+). 37 Промежуточное соединение 31. 3-[4-(1 Бензоксазол-2-ил)-пирролидин-2R-ил-метокси)фенил]-2-(2-бензоил-фениламино)-пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (285 мг) получают из 0,25 г (0,67 ммоля) промежуточного соединения 23 и 0,248 г (0,67 ммоля; 1 экв.) промежуточного соединения 29 согласно способу получения промежуточного соединения 30 с последующей очисткой колоночной флэшхроматографией на силикагеле с элюированием смесью гексан/EtOAc (1,5:1); MS (ES) низкого разрешения m/е 598 (MNa+), 577 (МН+). Промежуточное соединение 32. 1-Бензоксазол-2-ил-пирролидин-3-ол. К перемешиваемому раствору, содержащему 5,1 мл (44,6 ммоля) 2-хлорбензоксазола в 35 мл THF, при 0 С добавляют 4,28 г (49,0 ммоля; 1,1 экв.) (R)-3-гидроксипирролидина и 4,42 мл (32 ммоля; 0,72 экв.) триэтиламина. Полученный раствор перемешивают в течение 12 ч при комнатной температуре, осадок отфильтровывают, промывают THF (3 х 5 мл) и фильтрат концентрируют in vacuo. Очистка колоночной флэш-хроматографией на силикагеле с использованием сначала смеси гексан/EtOAc в соотношении 1:1, а затем EtOAc в качестве элюента позволяет получить 3,74 г указанного в заголовке соединения; MS (ESP) низкого разрешенияm/е 205 (МН+). Промежуточное соединение 33. Метансульфоновой кислоты 1-бензоксазол-2-илпирролидин-3-иловый эфир. К перемешиваемому раствору, содержащему 3,74 г (18,3 ммоля) промежуточного соединения 32 в 30 мл пиридина, добавляют 1,37 мл (17,8 ммоля; 0,93 экв.) метансульфонилхлорида. Полученный раствор перемешивают при комнатной температуре в течение 3 ч, после чего реакцию останавливают в ледяной водеDCM (3 х 50 мл). Объединенные органические экстракты последовательно промывают насыщенным раствором NаНСО 3, солевым раствором, высушивают (MgSO4) и растворители удаляют in vacuo. Очистка растиранием с изопропиловым спиртом позволяет получить 3,71 г указанного в заголовке соединения; MS (ESP) низкого разрешения m/е 283 (МН+). Промежуточное соединение 34. 3-[4-(1 Бензоксазол-2-ил-пирролидин-3-илокси)фенил]-2-(2-бензоил-фениламино)-пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (156 мг) получают из 188 мг (0,50 ммоля) промежуточного соединения 23 и 155 мг (0,55 ммоля; 1,1 экв.) промежуточного соединения 33 согласно способу получения промежуточного соединения 30 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc сначала в соотношении 3:1, а затем в соотношении 1:1 в качестве элю 001403THF, охлаждают до 0 С и обрабатывают 0,21 мл диэтилазодикарбоксилата (1,33 ммоля; 2,0 экв.). Реакционную смесь оставляют на 18 ч нагреваться до комнатной температуры, концентрируют in vасuо, очищают флэшхроматографией на силикагеле (7:3, гексан/EtOAc). Это позволяет получить 0,26 г (70%) указанного в заголовке соединение в виде пены желтого цвета, т.пл. 55-60 С; MS (ES) низкого разрешения m/е 561 (МН+). Промежуточное соединение 36. 2-(2 Бензоил-фениламино)-3-4-[2-(4-хлорфенил)тиазол-4-илметокси]-фенил)-пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (210 мг) получают из 150 мг (0,40 ммоля) промежуточного соединения 23 и 107 мг (0,44 ммоля; 1,1 экв.) 4-хлорметил-2-(4-хлорфенил)тиазола согласно способу получения промежуточного соединения 30 с последующей очисткой колоночной флэш-хроматографией на силикагеле, используя смесь гексан/EtOAc в соотношении 8:1 в качестве элюента;(10,60 ммоля; 10,0 экв.) этиленкарбоната и 175 мг (1,28 ммоля; 1,2 экв.) K2CO3 в 10 мл DMF,нагревают с перемешиванием до 95 С в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры, выливают в 100 мл Et2O и экстрагируют H2O (2 х 50 мл). Органический слой отделяют, высушивают (MgSO4) и растворители удаляют in vacuo. Очистка твердого вещества желтого цвета колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 2:1 в качестве элюента позволяет получить 440 мг указанного в заголовке соединения в виде прозрачного масла желтого цвета; 1H ЯМР (СDСl3, 300 МГц)8.90 (d, 1H, J=7.5), 7.60 (m, 2H), 7.527.31 (m, 5 Н), 7.20 (dd, 2H, J=2.2, 6.5), 6.83 (dd,2H, J=2.2, 6.5), 6.60 (m, 2H), 4.51 (s, 1H), 4.38(dd, 1H, J=5.9, 5.9), 4.04 (m, 2H), 3.94 (m, 2H),3.70 (s, 3 Н), 3.17 (m, 2H). Промежуточное соединение 38. 2-(2 Бензоил-фениламино)-3-[4-(2-метансульфо 39 нилокси-этокси)-фенил]-пропионовой кислоты метиловый эфир. К перемешиваемому раствору, содержащему 350 мг (0,83 ммоля) промежуточного соединения 37 в 8 мл THF, при комнатной температуре добавляют 0,23 мл (1,67 ммоля; 2,0 экв.)Et3N с последующим добавлением 0,13 мл (1,67 ммоля; 2,0 экв.) метан-сульфонилхлорида. Полученную смесь перемешивают 90 мин при комнатной температуре, затем нагревают до 45 С в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры, выливают в 50 мл Et2O и экстрагируют H2O (2 х 50 мл). Органический слой отделяют, высушивают (К 2 СО 3) и растворители удаляют in vacuo, что позволяет получить 430 мг указанного в заголовке соединения в виде прозрачного масла желтого цвета,которое используют без дальнейшей очистки;(М+). Промежуточное соединение 39. 3-4-[2-(2 Амино-фениламино)-этокси]-фенил-2-(2 бензоил-фениламино)-пропионовой кислоты метиловый эфир. К перемешиваемому раствору, содержащему 425 мг (0,85 ммоля) промежуточного соединения 38 в 5 мл безводного DMF, при комнатной температуре добавляют 590 мг (4,27 ммоля; 5,0 экв.) К 2 СО 3 и 462 мг (4,27 ммоля; 5,0 экв.) 1,2-фенилендиамина. Полученный раствор нагревают до 80 С в течение 17 ч. Реакционную смесь охлаждают до комнатной температуры,выливают в 50 мл Et2O и последовательно экстрагируют 1 н. НСl (1 х 20 мл), NаНСО 3 (1 х 20 мл) и H2O (2 х 50 мл). Органический слой отделяют, высушивают (К 2 СО 3) и растворители удаляют in vacuo. Очистка неочищенного материала колоночной флэш-хроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 2:1 в качестве элюента позволяет получить 90 мг указанного в заголовке соединения в виде прозрачного масла желтого цвета,которое обесцвечивается в процессе стояния и которое следует использовать незамедлительно после очистки; MS (CI) низкого разрешения m/е 511 (МН+), 510 (М+). Промежуточное соединение 40. 3-[4-(2 Бензимидазол-1-ил-этокси)-фенил]-2-(2 бензоил-фениламино)-пропионовой кислоты метиловый эфир. К перемешиваемому раствору, содержащему 90 мг (0,18 ммоля) промежуточного соединения 39 в 3 мл триэтилортоформиата, добавляют 5 мг пара-толуолсульфокислоты, что приводит к образованию осадка белого цвета. Эту суспензию нагревают с перемешиванием до 80 С в течение 2 ч, в процессе чего большая часть осадка исчезает. Реакционную смесь охлаждают до комнатной температуры, выливают в 20 мл смеси Еt2 О/дихлорметан (1:1) и экстрагируют 1 н NaOH (1 x 20 мл). Органический слой промывают H2O (1 x 20 мл), отделяют, вы 001403vacuo. Очистка неочищенного продукта колоночной флэш-хроматографией на силикагеле с использованием EtOAc в качестве элюента позволяет получить 94 мг указанного в заголовке соединения в виде прозрачного масла желтого цвета; MS (CI) низкого разрешения m/е 521(МН+), 520 (М+). Промежуточное соединение 41. 1-(3 Иодфенил)-бутан-1,3-дион. Гидрид натрия (60%-ный) (4,0 г; 100 ммолей) добавляют к перемешиваемому раствору,содержащему 13,8 г (50 ммолей) этилового эфира 3-иодбензойной кислоты и 12 мл (160 ммолей) ацетона в 25 мл безводного THF. Смесь перемешивают при 25 С в течение 20 мин, затем медленно нагревают до 30 С. Начинается экзотермическая реакция и температуру поддерживают ниже 30 С с помощью водяной бани. Через 1 ч выделение водорода прекращается, смесь охлаждают до 5 С и реакцию останавливают с помощью 150 мл 3%-ного водного раствора соляной кислоты. К раствору добавляют 200 мл эфира, после чего производят разделение фаз. Органическую фазу трижды промывают 100 мл воды, высушивают с помощью безводного сульфата магния и фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток смешивают с 200 мл гексана, далее осадок отфильтровывают и трижды промывают 50 мл гексана. Фильтрат концентрируют при пониженном давлении и очищают флэшхроматографией на силикагеле, применяя в качестве элюента гексан (неразбавленный) и далее смесь гексан/EtOAc (4:1) и получая 7,0 г указанного в заголовке соединения, которое кристаллизуют из гексана при -40 С; ТСХ (гексан/EtOAc (4:1: Rf=0,65. Промежуточное соединение 42. [2-(4 Метокси-фенил)-5-метил-оксазол-4-ил]уксусной кислоты метиловый эфир. Смесь 725 мг(4,80 ммоля) 4 метоксибензамида и 1,0 г (4,80 ммоля) метил 4 бром-S-оксо-пентаноата нагревают без растворителя при 120 С в течение 2 ч. Полученную темную суспензию охлаждают до комнатной температуры, разбавляют 2 мл дихлорметана и очищают колоночной флэш-хроматографией на силикагеле, используя смесь гексан/EtOAc в соотношении 3:1 в качестве элюента, что позволяет получить 189 мг указанного в заголовке соединения в виде твердого вещества желтого цвета; MS (FAB) низкого разрешения m/е 285(МН+), 284 (М+). Промежуточное соединение 43. 2-[2-(4 Метокси-фенил)-5-метил-оксазол-4-ил]-этанол. К перемешиваемому раствору, содержащему 185 мг (0,71 ммоля) промежуточного соединения 42 в 5 мл THF, при 0 С добавляют 0,71 мл (0,71 ммоля; 1,0 экв.) 1,0 М раствора LiAlH4 в THF. Полученный раствор перемешивают при комнатной температуре в течение 45 41 мин, далее охлаждают до 0 С и реакцию останавливают, осторожно добавляя 0,027 мл H2O, с последующим добавлением 0,027 мл 15%-ногоNaOH и 0,080 мл H2O. Полученную суспензию фильтруют для удаления твердого материала и фильтрат концентрируют in vacuo, что позволяет получить 164 мг указанного в заголовке соединения в виде масла светло-желтой окраски; 1 Н ЯМР (CDCl3, 400 МГц)7.92 (d, 2H, J=8.8),6.94 (d, 2H, J= 8.8), 3.92 (dt, 2H, J=5.7, 11.5), 3.86(s, 3H). Промежуточное соединение 44. 2(S)-(2 Бензоил-фениламино)-3-4-[2-(5-метил-2-(4 метокси)-фенил-оксазол-4-ил)-этокси]-фенилпропионовой кислоты метиловый эфир. К перемешиваемому раствору, содержащему 195 мг (0,74 ммоля; 1,05 экв.) трифенилфосфина в 5 мл THF, при 0 С по каплям добавляют 117 мг (0,67 ммоля; 0,95 экв.) диэтилазодикарбоксилата. Полученный раствор светложелтой окраски перемешивают при комнатной температуре в течение 5 мин, затем по каплям добавляют к раствору, содержащему 265 мг(0,71 ммоля) промежуточного соединения 23 и 165 мг (0,71 ммоля) промежуточного соединения 43 в 5 мл THF. Полученный раствор перемешивают 18 ч при комнатной температуре и далее растворитель удаляют in vacuo. Остаток интенсивно перемешивают в течение 1 ч в 30 мл двухфазного раствора диэтиловый эфир/1 нLiOH (2:1) для селективного удаления остаточного промежуточного соединения 23. Слои разделяют и органический слой промывают H2O,высушивают (MgSO4) и растворитель удаляютin vacuo. Очистка твердого вещества желтого цвета колоночной флэш-хроматографией на силикагеле с использованием смеси гексан/ EtOAc в соотношении 2:1 в качестве элюента позволяет получить 200 мг указанного в заголовке соединения в виде твердого вещества желтого цвета; MS (FAB) низкого разрешения m/е 591(МН+). Промежуточное соединение 45. [2-(4 Фтор-фенил)-5-метил-оксазол-4-ил]-уксусной кислоты метиловый эфир. Раствор, содержащий 667 мг (4,80 ммоля) 4-фторбензамида и 1,0 г (4,80 ммоля) метил 4 бром-3-оксо-пентаноата в 6 мл безводного толуола, нагревают при 120 С в течение 16 ч. Полученную темную суспензию охлаждают до комнатной температуры, разбавляют 10 млEtOAc и промывают NаНСО 3 (1 х 10 мл). Органический слой отделяют, высушивают (MgSO4) и растворители удаляют in vacuo. Очистка материала колоночной флэш-хроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 4:1 в качестве элюента позволяет получить 308 мг указанного в заголовке соединения в виде прозрачного масла; 1 Н ЯМР(CDCl3, 400 МГц)7.97 (m, 2H), 7.11 (m, 2 Н) ,3.73 (s, 3H), 3.56 (s, 2 Н), 2.36 (s, 3H). Промежуточное соединение 46. 2-[2-(4 Фтор-фенил)-5-метил-оксазол-4-ил]-этанол. Указанное в заголовке соединение получают из 300 мг (1,20 ммоля) промежуточного соединения 45 аналогично способу получения промежуточного соединения 43, что дает 248 мг указанного в заголовке соединения в виде твердого вещества белого цвета; MS (FAB) низкого разрешения m/е 221 (M+). Промежуточное соединение 47. 2(S)-(2 Бензоил-фениламино)-3-4-[2-(5-метил-2-(4 фтор)-фенил-оксазол-4-ил)-этокси]-фенилпропионовой кислоты метиловый эфир. Указанное в заголовке соединение (298 мг) получают из 407 мг (1,08 ммоля) промежуточного соединения 23 и 240 мг (1,08 ммоля) промежуточного соединения 46 аналогично способу получения промежуточного соединения 44 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 2:1 в качестве элюента; MS (FAB) низкого разрешенияm/е 580 (МН+), 579 (М+). Промежуточное соединение 48. 2-(5 Метил-1-фенил-1 Н-пиразол-3-ил)-этанол. К перемешиваемому раствору, содержащему 150 мг (0,96 ммоля) метил 3,5 диоксогексаноата в 5 мл МеОН, при комнатной температуре добавляют 104 мг (0,96 ммоля) фенилгидразина с последующим добавлением 10 мг пара-толуолсульфокислоты. Реакционную смесь перемешивают 15 мин при комнатной температуре, затем кипятят с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют 10 мл EtOAc и промывают NаНСО 3 (1 х 10 мл). Органический слой отделяют, высушивают(MgSO4) и растворители удаляют in vacuo. Очистка материала колоночной флэш-хроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 3:1 в качестве элюента позволяет получить 180 мг циклизованного метилового эфира. Данный материал далее восстанавливают аналогично способу получения промежуточного соединения 43; 1 Н ЯМР (CDCl3, 400 МГц)7.41 (m, 5 Н), 6.10 (s,1H), 3.81 (t, 2H, J=6.5), 2.89 (t, 2H, J=6.5), 2.32 (s,3 Н). Промежуточное соединение 49. 2(S)-(2 Бензоил-фениламино)-3-4-[2-(5-метил-1 фенил-1 Н-пиразол-3-ил)-этокси]-фенилпропионовой кислоты метиловый эфир. Указанное в заголовке соединение (100 мг) получают из 275 мг (0,74 ммоля) промежуточного соединения 23 и 150 мг (0,74 ммоля) промежуточного соединения 48 согласно способу получения Промежуточного соединения 44 с последующей очисткой колоночной флэшхроматографией на силикагеле с использовани 43 ем градиентного элюирования смесью гексан/EtOAc в соотношении от 4:1 до 2:1; MS(3,35 ммоля) метил 4-бром-3-оксо-пентаноата в 3 мл безводного DMF, нагревают при 120 С в течение 15 ч. Полученную темную суспензию охлаждают до комнатной температуры, разбавляют 10 мл EtOAc и промывают H2O (1 x 10 мл). Органический слой отделяют, высушивают(MgSО 4) и растворители удаляют in vacuo. Очистка материала колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 2:1 в качестве элюента позволяет получить 192 мг указанного в заголовке соединения в виде масла оранжевого цвета; MS (FAB) низкого разрешения m/е 240 (МН+), 239 (М+). Промежуточное соединение 51. 2-[5 метил-2-пиперидин-1-ил-оксазол-4-ил]-этанол. Указанное в заголовке соединение (145 мг) получают из 190 мг (0,80 ммоля) промежуточного соединения 50 согласно способу получения промежуточного соединения 43; 1H ЯМР(s, 3H), 1.71 (m, 6H). Промежуточное соединение 52. 2(S)-(2 Бензоил-фениламино)-3-4-[2-(5-метил-2 пиперидин-1-ил-оксазол-4-ил)-этокси]-фенилпропионовой кислоты метиловый эфир. Указанное в заголовке соединение (280 мг) получают из 250 мг (0,67 ммоля) промежуточного соединения 23 и 140 мг (0,67 ммоля) промежуточного соединения 51 согласно способу получения промежуточного соединения 44 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 2:1 в качестве элюента; MS (FAB) низкого разрешенияm/е 568 (МН+), 567 (М+). Промежуточное соединение 53. 1-Морфолинтиокарбоксамид. К перемешиваемому раствору, содержащему 2,0 г (11,20 ммоля; 1,15 экв.) тиокарбонилимидазола в 30 мл THF, при комнатной температуре добавляют 932 мг (10,70 ммоля) морфолина. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, затем нагревают до 55 С в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и приблизительно 20 мл THF удаляют in vacuo,затем к ней добавляют 10 мл 2,0 М раствора аммиака в МеОН, сосуд с реакционной смесью герметично закрывают и его содержимое перемешивают 15 ч. Далее добавляют дополнительные 10 мл 2,0 М аммиака в МеОН и реакцион 001403 44 ную смесь перемешивают в теплой водяной бане в течение 8 ч, в течение которых появляется белый осадок. Осадок отфильтровывают, промывают диэтиловым эфиром, собирают и высушивают, получая 745 мг указанного в заголовке соединения; MS (FAB) низкого разрешения m/е 147 (МН+) . Промежуточное соединение 54. 2-(2-Морфолин-4-ил-5-метил-тиазол-4-ил)-уксусной кислоты метиловый эфир. Смесь, содержащую 375 мг (2,56 ммоля) промежуточного соединения 53 и 536 мг (2,56 ммоля) метил 4-бром-3-оксо-пентаноата в 5 мл абсолютного этанола, кипятят с обратным холодильником в течение 5 ч. Реакционную смесь охлаждают до комнатной температуры и этанол удаляют in vacuo. Остаток разбавляют 10 млEtОAc и промывают NаНСО 3 (1 х 10 мл). Органический слой отделяют, высушивают (MgSO4) и растворители удаляют in vacuo. Очистка материала колоночной флэш-хроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 2:1 в качестве элюента позволяет получить 590 мг указанного в заголовке соединения в виде прозрачного масла; 1 Н ЯМР (CDCl3, 400 МГц) 5 3.79 (m, 4H), 3.69 (s,3 Н), 3.47 (s, 2H), 3.38 (m, 4H), 2.23 (s, 3H). Промежуточное соединение 55. 2-[5 Метил-2-морфолин-1-ил-оксазол-4-ил]-этанол. Указанное в заголовке соединение (487 мг) получают из 590 мг (2,27 ммоля) промежуточного соединения 54 согласно способу получения промежуточного соединения 43; 1 Н ЯМР(CDCl3, 400 МГц)4.29 (t, 1H, J=5.9), 3.90 (d,2H, J=5.9), 3.82 (m, 6 Н), 3.37 (m, 4H), 2.68 (t, 2H,J=5.4), 2.22 (s, 3 Н). Промежуточное соединение 56. 2(S)-(2 Бензоил-фениламино)-3-4-[2-(5-метил-2 морфолин-4-ил-тиазол-4-ил)-этокси]-фенилпропионовой кислоты метиловый эфир. Указанное в заголовке соединение (810 мг) получают из 760 мг (2,02 ммоля) промежуточного соединения 23 и 480 мг (2,02 ммоля) промежуточного соединения 55 согласно способу получения промежуточного соединения 44 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 2:1 в качестве элюента; 1 Н ЯМР (СDСl3, 400 МГц)8.89 (d, 1 Н, J=7.3), 7.59 (d, 2H, J=8.6), 7.47 (m,3 Н), 7.33 (dd, 1H, J=7.2, 7.2), 7.17 (d, 2H, J=8.6),6.82 (d, 2H, J=8.6), 6.63 (d, 1H, J=8.5), 6.57 (dd,1H, J=7.5, 7.5), 4.37 (dd, 1H, J=7.2, 13.3), 4.15 (t,2H, J= 7.1), 3.78 (m, 4H), 3.69 (s, 3H), 3.36 (m,4H), 3.19 (dd, 1H, J=6.0, 13.9), 3.11 (dd, 1H,J=7.3, 13.9), 2.93 (t, 2H, J= 7.1), 2.23 (S, 3H). Промежуточное соединение 57. [2-(2 Пириндин-4-ил)-5-метил-тиазол-4-ил]-уксусной кислоты метиловый эфир. Смесь, содержащую 800 мг (5,79 ммоля) тиоизоникотинамида и 1,21 г (5,79 ммоля) ме 45 тил 4-бром-3-оксо-пентаноата в 20 мл смеси толуол/абсолютный этанол в соотношении 1:1,нагревают до 100 С в течение 18 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют 20 мл EtOAc и промывают NaHCO3 (1 х 10 мл). Органический слой отделяют,высушивают (MgSO4) и растворители удаляютin vacuo. Очистка материала колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 1:1 качестве элюента позволяет получить 630 мг указанного в заголовке соединения в виде твердого вещества оранжевого цвета; 1 Н ЯМР (CDCl3,400 МГц)8.64 (d, 2 Н, J=6.1), 7.70 (d, 2H,J=6.1), 3.82 (s, 2H), 3.71 (s, 3 Н), 2.45 (s, 3H). Промежуточное соединение 58. 2-[5 Метил-2-(4-пиридил)-тиазол-4-ил]-этанол. Указанное в заголовке соединение получают из 620 мг (2,50 ммоля) промежуточного соединения 57 согласно способу получения промежуточного соединения 43 с последующей очисткой колоночной флэш-хроматографией на силикагеле с использованием градиентного элюирования от EtOAc до смеси EtOAc/MeOH в соотношении 30:1 в качестве элюента; 1 Н ЯМР(t, 2H, J=5.8), 2.46 (s, 3 Н). Промежуточное соединение 59. 2(S)-(2 Бензоил-фениламино)-3-4-[2-(5-метил-2-(4 пиридил)-тиазол-4-ил)-этокси]-фенилпропионовой кислоты метиловый эфир. Указанное в заголовке соединение получают из 255 мг (0,68 ммоля) промежуточного соединения 23 и 150 мг (0,68 ммоля) промежуточного соединения 58 согласно способу получения промежуточного соединения 44 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 3:2 в качестве элюента. Анализ (C34H31N3 О 4S). Вычислено: С, 70,69; Н, 5,41; N, 7,27. Обнаружено: С,70,44; Н, 5,50; N, 7,03. Промежуточное соединение 60. [2-(2 Диметиламино)-5-метил-тиазол-4-ил]-уксусной кислоты метиловый эфир. Смесь, содержащую 750 мг (7,20 ммоля; 1,5 экв.) N,N-диметилтиомочевины и 1,00 г (4,80 ммоля) метил 4-бром-3-оксо-пентаноата в 10 мл диоксана, нагревают до температуры дефлегмации в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют 20 мл EtOAc и промывают NaHCO3 (1 x 10 мл). Органический слой отделяют, высушивают(МgSO4) и растворители удаляют in vacuo. Очистка материала колоночной флэш-хроматографией на силикагеле с использованием градиентного элюирования от смеси гексан/EtOAc в соотношении 1:5 до смеси EtOAc/MeOH в соотношении 20:1 качестве элюента позволяет получить 210 мг указанного в заголовке соединения 46 в виде масла желтого цвета; MS (FAB) низкого разрешения m/е 216 (МН+), 215 (М+). Промежуточное соединение 61. 2-[2 Диметиламино-5-метил-оксазол-4-ил]-этанол. Указанное в заголовке соединение получают из 210 мг (0,98 ммоля) промежуточного соединения 60 согласно способу получения промежуточного соединения 43; MS (FAB) низкого разрешения m/е 188 (MH+), 187 (М+). Промежуточное соединение 62. 2(S)-(2 Бензоил-фениламино)-3-4-[2-(2-диметиламино 5-метил-тиазол-4-ил)-этокси]-фенил-пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (168 мг) получают из 390 мг (1,00 ммоля) промежуточного соединения 23 и 185 мг (1,00 ммоля) промежуточного соединения 61 согласно способу получения промежуточного соединения 44 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием первоначально смеси гексан/EtOAc в соотношении 2:1 в качестве элюента для удаления неполярных примесей, а затем смеси хлороформ/МеОН для элюирования желаемого продукта; MS (FAB) низкого разрешения m/е 544(М+) . Промежуточное соединение 63. 5-Метилизоксазол-3-тиокарбоксамид. Суспензию, содержащую 525 мг (4,16 ммоля) 5-метилизоксазол-3-карбоксамида и 1,85 г (4,58 ммоля; 1,1 экв.) реагента Лавессона в 15 мл безводного толуола, нагревают до температуры дефлегмации в течение 5 ч, при этом реакционная смесь становится прозрачной и желтой. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют in vacuo. Очистка материала колоночной флэш-хроматографией на силикагеле с использованием градиентного элюирования от смеси гексан/EtOAc в соотношении 5:1 до смеси гексан/EtOAc в соотношении 1:1 в качестве элюента с последующим растиранием с ацетонитрилом, фильтрованием для удаления твердых побочных продуктов реагента Лавессона и удалением растворителя позволяет получить 614 мг указанного в заголовке соединения в виде масла желтого цвета; 1H ЯМР (CDCl3, 300 МГц)8.05 (s, br, 2H),6.52 (s, 1H), 2.46 (s, 3 Н). Промежуточное соединение 64. 2-[5 Метил-2-(5-метил-изоксазол-3-ил)-оксазол-4 ил]-уксусной кислоты метиловый эфир. Указанное в заголовке соединение (375 мг) получают из 591 мг (4,15 ммоля) промежуточного соединения 63 и 950 мг (4,47 ммоля; 1,10 экв.) метил 4-бром-3-оксо-пентаноата согласно способу получения промежуточного соединения 45 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 5:1 в качестве элюента; MS (FAB) низкого разрешения 47 Промежуточное соединение 65. 2-[5 Метил-2-(5-метил-изоксазол-3-ил)-оксазол-4 ил]-этанол. Указанное в заголовке соединение (187 мг) получают из 375 мг (1,49 ммоля) промежуточного соединения 64 согласно способу получения промежуточного соединения 43; 1 Н ЯМР(CDCl3, 400 МГц)6.50 (s, 1H), 3.97 (m, 2H),3.46 (t, 1H, J=6.2), 2.92 (t, 2H, J=5.6), 2.49 (s, 3H),2.44 (s, 3H). Промежуточное соединение 66. 2(S)-(2 Бензоил-фениламино)-3-4-[2-(5-метил-2-(5 метил-изоксазол-3-ил)-тиазол-4-ил)-этокси]фенил-пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (470 мг) получают из 530 мг (1,45 ммоля) промежуточного соединения 23 и 317 мг (1,45 ммоля) промежуточного соединения 65 согласно способу получения промежуточного соединения 44 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием градиентного элюирования от смеси гексан/EtOAc в соотношении 4:1 до смеси гексан/EtOAc в соотношении 2:1 в качестве элюента; MS (FAB) низкого разрешения m/е 582(МН+). Промежуточное соединение 67. [5-Метил 2-(4-метил[1,2,3]тиадиазол-5-ил)-оксазол-4-ил]уксусной кислоты метиловый эфир. Указанное в заголовке соединение (560 мг) получают из 1,0 г (7,00 ммоля) 4-метил-1,2,3 тиадиазол-5-карбоксамида и 2,97 г (7,35 ммоля; 1,05 экв.) реагента Лавессона согласно способу получения промежуточного соединения 63 с последующим применением методики, описанной для получения промежуточного соединения 45, и очистки колоночной флэш-хроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 4:1 в качестве элюента; MS (FAB) низкого разрешения m/е 270(M+) . Промежуточное соединение 68. 2-[5-Метил-2-(4-метил[1,2,3]тиадиазол-5-ил)-оксазол-4 ил]-этанол. Указанное в заголовке соединение (350 мг) получают из 560 мг (2,08 ммоля) промежуточного соединения 67 согласно способу получения промежуточного соединения 43 с последующей очисткой колоночной флэш-хроматографией на силикагеле с использованием смеси хлороформ/МеОН в соотношении 9:1 качестве элюента; 1H ЯМР (СDСl3, 400 МГц)3.99 (m, 2 Н),3.02 (s, br, 1H), 2.94 (m, 5H), 2.49 (s, 3H). Промежуточное соединение 69. 2(S)-(2 Бензоил-фениламино)-3-(4-2-[5-метил-2-(4 метил[1,2,3]тиадиазол-5-ил)-тиазол-4-ил]этокси-фенил)-пропионовая кислота. Указанное в заголовке соединение (235 мг) получают из 560 мг (1,49 ммоля) промежуточного соединения 23 и 360 мг (1,49 ммоля) промежуточного соединения 68 согласно способу 48 получения промежуточного соединения 44 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием градиентного элюирования от смеси гексан/EtOAc в соотношении 4:1 до смеси гексан/EtOAc в соотношении 3:1 в качестве элюента; 1 Н ЯМР (CDCl3, 400 МГц)8.88 (d,1H, J=7.3), 7.59 (dd, 2H, J= 1.6, 8.4), 7.48 (m, 3 Н),7.33 (dd, 1H, J=7.3, 7.3), 7.17 (d, 2H, J=8.5), 6.80(s, 3H), 3.16 (m, 4H), 2.92 (s, 3H), 2.50 (s, 3 Н). Промежуточное соединение 70. [5-Метил 2-(4-метил-пиперазин-1-ил)-тиазол-4-ил]уксусной кислоты метиловый эфир. Указанное в заголовке соединение (490 мг) получают из 18,7 г (104,8 ммоля) тиокарбонилдиимидазола и 10 г (99,8 ммоля) 1-метилпиперазина согласно способу получения промежуточного соединения 53 с последующим применением методики, описанной для получения промежуточного соединения 60, и очистки колоночной флэш-хроматографией на силикагеле с использованием смеси MeOH/EtOAc (3:17) в качестве элюента; ТСХ (MeOН/ЕtOAc 1:9:Rf=0,15. Промежуточное соединение 71. 2-[5-метил-2-(4-метил-пиперазин-1-ил)-тиазол-4-ил]этанол. Указанное в заголовке соединение (2,20 г) получают из 2,87 г (8,10 ммоля) промежуточного соединения 70 согласно способу получения промежуточного соединения 43 с последующей очисткой колоночной флэш-хроматографией на силикагеле с использованием смеси хлороформ/МеОН в соотношении 10:1 в качестве элюента; 1H ЯМР (СDСlз, 400 МГц)4.42 (s, br,1H), 3.85 (m, 2H), 3.41 (m, 4H), 2.67 (t, 2H,J=5.4), 2.49 (m, 4H) , 2.34 (s, 3H), 2.20 (s, 3 Н). Промежуточное соединение 72. [2-(3 Диметиламино-пропиламино)-5-метил-тиазол-4 ил]-уксусной кислоты метиловый эфир. Указанное в заголовке соединение (854 мг) получают из 1,0 г (6,20 ммоля) 3-диметиламинопропилтиомочевины и 1,30 г (6,20 ммоля) метил 4-бром-3-оксо-пентаноата согласно способу получения промежуточного соединения 45;MS (FAB) низкого разрешения m/е 272 (М+). Промежуточное соединение 73. 2-[2-(3 Диметиламино-пропиламино)-5-метил-тиазол-4 ил]-этанол. Указанное в заголовке соединение (608 мг) получают из 850 мг (3,14 ммоля) промежуточного соединения 72 согласно способу получения промежуточного соединения 43; 1 Н ЯМР(2,48 ммоля) промежуточного соединения 23 и 600 мг (2,48 ммоля) промежуточного соединения 73 в 25 мл безводного толуола, нагревают до 95 С в течение 15 мин, что приводит к растворению промежуточного соединения 23 и получению прозрачного желтого раствора. К этому раствору в течение 5 мин по каплям добавляют 452 мг (2,60 ммоля; 1,05 экв.) диэтилазодикарбоксилата. Реакционную смесь оставляют охлаждаться до комнатной температуры и перемешивают 16 ч. Толуол удаляют in vacuо и остаток очищают колоночной флэш-хроматографией на силикагеле с использованием смеси EtOAc/MeOH в соотношении 1:1 с 1%-ным гидроксидом аммония в качестве элюента, что позволяет получить 770 мг указанного в заголовке соединения в виде масла желтого цвета;MS (FAB) низкого разрешения m/е 602 (МН+),601 (М+). Промежуточное соединение 75. 2-[2-(2 Метокси-этиламино)-5-метил-тиазол-4-ил]этанол. Указанное в заголовке соединение (800 мг) получают из 750 мг (5,59 ммоля) 2-метоксиэтилтиомочевины и 1,17 г (5,59 ммоля) метил 4 бром-3-оксо-пентаноата согласно способу получения промежуточного соединения 60 с последующим применением методики, описанной для получения промежуточного соединения 43, и очистки колоночной флэш-хроматографией на силикагеле с использованием смеси хлороформ/МеОН в соотношении 9:1 в качестве элюента; 1H ЯМР (CDCl3, 400 МГц)3.82 (t, 2H,J=5.5), 3.58 (t, 2 Н, J=6.9), 3.41 (m, 2H), 3.36 (s,3H), 2.65 (t, 2H, J= 6.9), 2.19 (s, 3H). Промежуточное соединение 76. 2(S)-(2 Бензоил-фениламино)-3-(4-2-[2-(2-метоксиэтил-амино)-5-метил-тиазол-4-ил]-этоксифенил)-пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (907 мг) получают из 1,38 г (3,70 ммоля) промежуточного соединения 23 и 800 мг (3,70 ммоля) промежуточного соединения 75 согласно способу получения промежуточного соединения 74 с последующей очисткой на MPLC (Merck Lobar 50 способу получения промежуточного соединения 3 с последующей очисткой колоночной хроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 7:3 в качестве элюента; MS (ES) низкого разрешения m/е 542,1(2-амино-фенил)-циклогептил-метанона и 15 мг ацетата родия согласно способу получения промежуточного соединения 3 с последующей очисткой колоночной флэш-хроматографией на силикагеле с использованием смеси гексан/(2-амино-4-фтор-фенил)-циклогептил-метанона и 10 мг ацетата родия согласно способу получения промежуточного соединения 3 с последующей очисткой колоночной флэш-хроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 7:3 в качестве элюента; MS (ES) низкого разрешения m/е 574,0(5-амино-1-метил-1 Н-пиразол-4-ил)-циклогексил-метанона и 10 мг ацетата родия согласно способу получения промежуточного соединения 3 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 7:3 в качестве элюента; MS (ES) низкого разрешения(2-амино-тиофен-3-ил)-фенил-метанона и 5 мг ацетата родия согласно способу получения Промежуточного соединения 3 с последующей(2-амино-фенил)-циклогексил-метанона и 69 мг ацетата родия согласно способу получения Промежуточного соединения 3 с последующей очисткой колоночной флэш-хроматографией на силикагеле с использованием в качестве элюента от DCM до смеси диэтиловый эфир/DCM в соотношении 1:99; MS (ES) низкого разрешенияm/е 567,4 (МН+). Энантиомеры этого материала затем разделяют на Prep OD-колонке. Энантионер 1: данные ЯМР, MS, ЖХВД идентичны рацемату. Энантиомер 2: данные ЯМР, MS,ЖХВД идентичны рацемату. Промежуточное соединение 84. (S)(-)-1 Бензил-пирролидин-3-ил-метансульфонат. К (S)(-)-1-бензил-3-пирролидинолу (5 г; 28,2 ммоля) в пиридине (40 мл) по каплям добавляют метансульфонилхлорид (2,03 мл; 26,2 ммоля; 0,93 экв.). Реакционную смесь перемешивают 3 ч, выливают в ледяную воду (100 мл) и экстрагируют DCM (3 x 50 мл). Объединенные органические экстракты промывают насыщенным водным раствором NаНСО 3, солевым раствором и высушивают (MgSO4), получая 3 г указанного в заголовке соединения; MS (ES) низкого разрешения m/е 256,0 (МН+). Промежуточное соединение 85. 2-(2 Бензолил-фениламино)-3-[4-(1-бензил-пирролидин-3-ил-окси)-фенил]-пропионовой кислоты метиловый эфир. К перемешиваемому раствору, содержащему 1,0 г (2,66 ммоля) промежуточного соединения 23 в 30 мл DMF, добавляют 0,95 г (2,95 ммоля; 1,1 экв.) карбоната цезия и 747 мг (2,93 ммоля; 1,1 экв.) промежуточного соединения 84. Полученный раствор перемешивают 24 ч при температуре 45 С, затем реакцию останавливают добавлением 10 мл воды. Реакционную смесь выливают в 25 мл EtOAc и 25 мл Et2O и экстрагируют H2O (3 х 10 мл). Органический слой высушивают (MgSО 4) и растворители удаляют in vaсuо. Очистка колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc в соотношении 7:3 в качестве элюента позволяет получить 0,68 г указанного в заголовке соединения; MS (API) низкого разрешения m/е 535,1 (МН+). Промежуточное соединение 86. 3-[4-(1 Бензоксазол-2-ил-пирролидин-3-илокси)-фенил]-2-(2-бензоил-фениламино)-пропионовой кислоты метиловый эфир.(0,24 мл; 2,24 ммоля; 2 экв.). Реакционную смесь перемешивают при 0 С в течение 30 мин и затем концентрируют досуха. Полученный остаток растворяют в МеОН (100 мл), кипятят с обратным холодильником в течение 2,5 ч и концентрируют досуха. К этому неочищенному материалу (0,71 г; 1,12 ммоля) добавляют триэтиламин (0,47 мл; 3,36 ммоля; 3 экв.). Реакционную смесь перемешивают 5 мин, затем к ней по каплям добавляют 2-хлор-бензоксазол в THF(2 мл). Реакционную смесь перемешивают 12 ч при комнатной температуре, концентрируют inEt2O/DCM в соотношении 10:90 в качестве элюента позволяет получить 200 мг указанного в заголовке продукта; MS (ES) низкого разрешения m/е 562,1 (МН+). Промежуточное соединение 87. 3-4-[2-(5 Метил-2-фенил-оксазол-4-ил)-этокси]-фенил 2(S)-[2-(пиридин-4-карбонил)-фениламино]пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (2,92 г) получают из промежуточного соединения 120(3,65 г; 9,61 ммоля) и 2-(пиридин-4-карбонил)циклогексанона (2,92 г; 9,61 ммоля) согласно способу получения промежуточного соединения 23 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием смеси DCM/MeOH в соотношении 98:2 в качестве элюента; MS (ES) низкого разрешенияm/е 546,0 (МН+). Промежуточное соединение 88. 3-4-[2-(5 Метил-2-фенил-оксазол-4-ил)-этокси]-фенил 2-[2-(пиридин-N-оксид-4-карбонил)-фениламино]-пропионовой кислоты метиловый эфир. К промежуточному соединению 87 (200 мг; 0,36 ммоля) в DCM (5 мл) при комнатной температуре добавляют mMСРВА (185 мг; 1,07 ммоля; 3 экв.). Через 24 ч реакционную смесь концентрируют in vacuo. Очистка колоночной флэш-хроматографией на силикагеле с использованием смеси DCM/MeOH в соотношении от 98:2 до 90:10 в качестве элюента позволяет получить 90 мг указанного в заголовке соединения; MS (ES) низкого разрешения m/е 578,1(МH+). Промежуточное соединение 89. 3-4-[2-(5 метил-2-фенил-оксазол-4-ил)-этокси]-фенил 2(S)-[2-(пиридин-3-карбонил)-фениламино]пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (540 мг) получают из промежуточного соединения 120(1,30 г; 2,63 ммоля) и 2-(пиридин-3-карбонил)циклогексанона (1,07 г; 5,26 ммоля) согласно способу получения промежуточного соединения 23 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием в качестве элюента первоначально гексана, аMS (ES) низкого разрешения m/е 562,2 (МН+). Промежуточное соединение 90. 2-(5 Метил-3-фенил-пиразол-1-ил)-этанол. Раствор, содержащий 497 мг (3,14 ммоля) 3-метил-5-фенил-пиразола в 12,6 мл DMF, при 0 С обрабатывают 138 мг NaH (3,45 ммоля; 60%-ным в масле). После перемешивания в течение 15 мин добавляют 1,38 г (15,7 ммоля) этиленкарбоната и реакционную смесь нагревают до 25 С и перемешивают в течение ночи. Реакционную смесь разбавляют H2O и продукт экстрагируют смесью гексан/EtOAc (1:1). Объединенные органические фазы высушивают(MgSО 4), фильтруют и концентрируют in vacuo. Остаток очищают колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc (1:3) в качестве элюента,получая 305 мг (48%) указанного в заголовке соединения; MS (ES) низкого разрешения m/е 225 (MNa+), 203 (МН+). Промежуточное соединение 91. 2S-(2-Бензоил-фениламино)-3-4-[2-(5-метил-3-фенилпиразол-1-ил)-этокси]-фенил-пропионовой кислоты метиловый эфир. Раствор, содержащий 169 мг (0,45 ммоля) промежуточного соединения 23, 100 мг (0,49 ммоля) промежуточного соединения 90 и 177 мг(0,67 ммоля) DEAD, производя добавление по каплям. Реакционную смесь перемешивают при 25 С в течение 24 ч, затем концентрируют invacuo. Остаток очищают колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc (2:1) в качестве элюента,получая 116 мг (46%) указанного в заголовке соединения в виде вязкого желтого масла; MS(МН+). Промежуточное соединение 92. 2S-(2 Бензоил-фениламино)-3-[4-(1-трет-бутоксикарбонил-пирролидин-2S-ил-метокси)-фенил]пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (1,62 г) получают из 2,82 г (7,5 ммоля) промежуточного соединения 23 и 1,66 г (8,25 ммоля) N-третбутоксикарбонил-L-пролинола согласно способу получения промежуточного соединения 91 с последующей очисткой колоночной флэшхроматографией на силикагеле с элюированием смесью гексан/EtOAc (3:1); MS (ES) низкого разрешения m/е 581 (MNa+), 559 (МН+). Промежуточное соединение 93. 2S-(2 Бензоил-фениламино)-3-[4-(1-пиридин-2-илпирролидин-2S-ил-метокси)-фенил]пропионовой кислоты метиловый эфир. Раствор, содержащий 2,95 г (5,3 ммоля) промежуточного соединения 92 в 62 мл CH2Cl2,обрабатывают 62 мл трифторуксусной кислоты и перемешивают 1 ч. Реакционную смесь разбавляют CH2Cl2 и подщелачивают насыщеннымCH2Cl2 и объединенные органические слои высушивают (Na2SO4), фильтруют и концентрируют in vacuo. Остаток растворяют в 210 мл 2 фторпиридина и кипятят с обратным холодильником в течение 24 ч. По охлаждении до 25 С реакционную смесь концентрируют in vacuo и остаток очищают колоночной флэшхроматографией на силикагеле, элюируя смесью гексан/EtOAc (2:1) и получая 1,2 г (42%) указанного в заголовке соединения в виде вязкого желтого масла; MS (ES) низкого разрешения m/е 558 (MNa+), 536 (МН+). Промежуточное соединение 94. 2-(1 Метил-4-фенил-1 Н-имидазол-2-ил)-этанол. Раствор, содержащий 674 мг (4,26 ммоля) 1-метил-4-фенил-имидазола (Kashima С., HaradaY., Hosomi A. Heterocycles (1993) 35, 433) в 8,5 мл THF, при -78 С обрабатывают 1,9 мл (4,69 ммоля) 2,5 М раствором н-BuLi в гексане. По окончании перемешивания в течение 10 мин к нему добавляют 1,1 мл (21,3 ммоля) этиленоксида. Реакционную смесь перемешивают в течение 5 мин, затем нагревают до 25 С и перемешивают в течение 1 ч. По охлаждении до 0 С добавляют 1,1 мл (21,3 ммоля) этиленоксида и реакционную смесь нагревают до 25 С и перемешивают в течение ночи. Реакционную смесь выливают в H2O и экстрагируют Et2O. Объединенные органические фазы высушивают(Na2SO4), фильтруют и концентрируют in vacuo. Остаток очищают колоночной флэш-хроматографией на силикагеле с использованием смеси EtOAc/MeOH (95:5) и собранный продукт перекристаллизовывают из смеси CH2Cl2/EtOAc, получая 178 мг (21%) указанного в заголовке соединения в виде твердого вещества белого цвета; MS (ES) низкого разрешения m/е 225 (MNa+), 203 (MH+). Промежуточное соединение 95. 2S-(2 Бензоил-фениламино)-3-4-[2-(1-метил-4-фенил-1 Н-имидазол-2-ил)-этокси]-фенил-пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (90 мг) получают из 93 мг (0,25 ммоля) промежуточного соединения 23 и 50 мг (0,25 ммоля) промежуточного соединения 94 согласно способу получения промежуточного соединения 91 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc (1:3) в качестве элюента;(14,07 ммоля) гидразина. Реакционную смесь перемешивают в течение 24 ч, затем концентрируют in vacuo. Остаток очищают колоночной флэш-хроматографией на силикагеле с исполь 55 зованием смеси гексан/EtOAc (1:1) в качестве элюента, получая 1,02 г (98%) указанного в заголовке соединения; MS (CI) низкого разрешения m/е 149 (МН+). Промежуточное соединение 97. 2-(3-Фуран-2-ил-5-метил-пиразол-1-ил)-этанол. Указанное в заголовке соединение (189 мг) получают из 1,01 г (6,82 ммоля) промежуточного соединения 96 согласно способу получения промежуточного соединения 90 с последующей очисткой колоночной флэш-хроматографией на силикагеле с использованием смеси гексан/(1987) 28, 5133) согласно способу получения Промежуточного соединения 90 с последующей очисткой колоночной флэш-хроматографией на силикагеле с использованием смеси EtOAc/MeOH (95:5) в качестве элюента и перекристаллизовывают из Et2O; MS (CI) низкого разрешения m/е 204 (МН+). Промежуточное соединение 99. 2S-(2 Бензоил-фениламино)-3-4-[2-(5-метил-3-фенил-[1,2,4]триазол-1-ил)-этокси]-фенил-пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (186 мг) получают из 196 мг (0,52 ммоля) промежуточного соединения 23 и 106 мг (0,52 ммоля) промежуточного соединения 98 согласно способу получения промежуточного соединения 44 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc (1:1/Е 1:2) в качестве элюента; MS (ES) низкого разрешения m/е 583(MNa+), 561 (MH+). Промежуточное соединение 100. 3-Метоксиметил-5-метил-2-фенил-3 Н-имидазол. К раствору, содержащему 1,0 г (6,32 ммоля) 4-метил-2-фенилимидазола в 25 мл DMF,при 0 С добавляют 278 мг NaH (6,95 ммоля; 60%-ного в масле). После перемешивания в течение 5 мин к смеси добавляют 0,528 мл (6,95 ммоля) хлорметилметилового эфира, реакционную смесь нагревают до 25 С и перемешивают в течение 4 ч. Реакционную смесь выливают вH2O и продукт экстрагируют смесью гексан/EtOAc (1:1). Объединенные органические слои высушивают (Na2SO4), фильтруют и концентрируют in vacuo. Очистка колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc (5:95) в качестве элюента позволяет получить 816 мг (64%) указанного в заголовке соединения; MS (ES) низкого разрешения m/е 225 (MNa+), 203 (МН+). 56 Промежуточное соединение 101. 2-(3 Метоксиметил-5-метил-2-фенил-3 Н-имидазол 4-ил)-этанол. Указанное в заголовке соединение (433 мг) получают из 710 мг (3,51 ммоля) промежуточного соединение 100 согласно способу получения промежуточного соединения 94 с последующей очисткой колоночной флэш-хроматографией на силикагеле с использованием смеси EtOAc/MeOH (93:7) в качестве элюента; MS(MH+). Промежуточное соединение 102. 2S-(2 Бензоил-фениламино)-3-4-[2-(3-метоксиметил 5-метил-2-фенил-3 Н-имидазол-4-ил)-этокси]фенил-пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (347 мг) получают из 314 мг (0,84 ммоля) промежуточного соединения 23 и 207 мг (0,84 ммоля) промежуточного соединения 101 согласно способу получения промежуточного соединения 44 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием смеси EtOAc/гексан (3:1) в качестве элюента,что позволяет получить 347 мг (69%) указанного в заголовке соединения; MS (ES) низкого разрешения m/е 604 (MNa+), 626 (МН+). Промежуточное соединение 103. 2-(3 Триметилсилилэтоксиметил-5-метил-2-фенил 3 Н-имидазол-4-ил)-этанол. Раствор, содержащий 1,04 г (6,57 ммоля) 2 фенил-3-метил-имидазола в 25 мл DMF, при 0 С обрабатывают 289 мг NaH (7,23 ммоля; 60%ным в масле). После перемешивания в течение 5 мин к смеси добавляют 1,28 мл (7,23 ммоля) 2(триметилсилил)-этоксиметилхлорида. Реакционную смесь перемешивают в течение 10 мин,затем нагревают до 25 С и перемешивают в течение ночи. Реакционную смесь выливают вH2O и продукт экстрагируют смесью гексан/EtOAc (1:1). Объединенные органические слои высушивают (Na2SО 4), фильтруют и концентрируют in vacuo. Остаток очищают колоночной флэш-хроматографией на силикагеле с использованием смеси EtOAc/MeOH (98:2) в качестве элюента, получая 1,18 г (62 %) защищенного промежуточного соединения. Этот материал далее превращают в указанное в заголовке соединение (851 мг) согласно способу получения промежуточного соединения 94 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием смеси EtOAc/MeOH (95:5/Е 9:1) в качестве элюента; MS (ES) низкого разрешения m/е 233(МН+). Промежуточное соединение 104. 2S-(2 Бензоил-фениламино)-3-4-[2-5-метил-2 фенил-3 Н-имидазол-4-ил)-этокси]-фенилпропионовой кислоты метиловый эфир. Указанное в заголовке соединение (542 мг) получают из 931 мг (2,48 ммоля) промежуточного соединения 23 и 825 мг (2,48 ммоля) про 57 межуточного соединения 103 согласно способу получения промежуточного соединения 44 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc (2:1/Е 1:1) в качестве элюента, что позволяет получить 867 мг неочищенного промежуточного соединения. Раствор,содержащий 830 мг (1,2 ммоля) этого материала в 12 мл СН 3 СN при 0 С обрабатывают 0,222 мл(1,8 ммоля) BF3OEt2. После перемешивания в течение 30 мин при 0 С, а затем при 25 С в течение 1 ч к смеси добавляют дополнительные 0,444 мл (3,6 ммоля) BF3OEt2. После перемешивания в течение еще 1 ч добавляют еще 0,444 мл(3,6 ммоля) BF3OEt2 и перемешивание продолжают в течение 35 мин. Реакционную смесь выливают в насыщенный раствор NаНСО 3 и продукт экстрагируют EtOAc. Объединенные органические слои высушивают (Na2SO4), фильтруют и концентрируют in vacuo. Остаток очищают колоночной флэш-хроматографией на силикагеле с использованием смеси гексан/EtOAc (1:1) в качестве элюента; MS (ES) низкого разрешенияm/е 560 (МН+). Промежуточное соединение 105. 5-Метил 2-фенил-4-тиазолуксусной кислоты метиловый эфир. Указанное в заголовке соединение (827 мг) получают из 1,0 г (4,78 ммоля) метил 4-бром-3 оксо-пентаноата и 2,6 г (19,14 ммоля) тиобензамида согласно способу получения промежуточного соединения 42 с последующей очисткой колоночной флэш-хроматографией на силикагеле с использованием смеси гексан/EtOAc (3:1) в качестве элюента; MS (ES) низкого разрешенияm/е 270 (MNa+), 248 (MH+). Промежуточное соединение 106. 2-(5 Метил-2-фенил-тиазол-4-ил)-этанол. Указанное в заголовке соединение (538 мг) получают из 817 мг (3,30 ммоля) промежуточного соединения 105 согласно способу получения промежуточного соединения 43 с последующей очисткой колоночной флэш-хроматографией на силикагеле с использованием смеси гексан/EtOAc (1:2) в качестве элюента; MS (ES) низкого разрешения m/е 242 (MNa+), 219 (МН+). Промежуточное соединение 107. 2S-(2 Бензоил-фениламино)-3-4-[2-(5-метил-2 фенил-тиазол-4-ил)-этокси]-фенил-пропионовой кислоты метиловый эфир. Указанное в заголовке соединение (378 мг) получают из 348 мг (0,93 ммоля) промежуточного соединения 23 и 203 мг (0,93 ммоля) промежуточного соединения 106 согласно способу получения промежуточного соединения 43 с последующей очисткой колоночной флэшхроматографией на силикагеле с использованием смеси гексан/EtOAc (3:1) в качестве элюента; 58 Промежуточное соединение 108. Метил 3(5-метил-2-тиениламино)-4-оксопентаноат. Суспензию, состоящую из 19,3 г (0,136 моля) 5-метил-2-тиофенкарбоновой кислоты в 200 мл толуола, обрабатывают 10,9 мл (0,15 моля) тионилхлорида. Полученную смесь нагревают до 70 С в течение 16 ч, затем концентрируют in vacuo. Полученное масло порциями добавляют в раствор, содержащий 25,0 г (0,136 моля) гидрохлорида b-метиласпарагиновой кислоты в 80 мл пиридина, при 0 С с такой скоростью, чтобы поддержать температуру 10 С. По окончании добавления раствор оставляют перемешиваться при 25 С в течение 1 ч, обрабатывают 50 мл уксусного ангидрида и нагревают до 90 С в течение 2 ч. Далее смесь охлаждают до 25 С, выливают в 700 мл 1 н. НСl и трижды экстрагируют EtOAc. Объединенные органические фазы трижды промывают 3 н. НСl, один раз водой, один раз 5%-ным водным растворомNаНСО 3 и окончательно солевым раствором. Раствор высушивают (Na2SO4), затем хроматографируют на силикагеле, элюируя смесью гексан/EtOAc в соотношении 3:2 и получая 9,1 г(25%) указанного в заголовке соединения в виде прозрачного масла желтого цвета; MS (ES+) m/е 270 (МН+). Промежуточное соединение 109. (5-Метил-2-(5-метил-2-тиенил)-оксазо-4-ил)-уксусной кислоты метиловый эфир. Раствор, содержащий 3,97 г (14,7 ммоля) Промежуточного соединения 108 в 100 мл безводного ацетонитрила, обрабатывают 4,1 мл(44,2 ммоля) фосфористого оксихлорида и нагревают до температуры дефлегмации в течение 5 ч. Раствор охлаждают до 25 С и темное масло отделяют декантацией от жидкой смолы, находящейся на дне колбы. Раствор концентрируютin vacuо и разбавляют водой и EtOAc. Водный слой насыщают КНСО 3, слои разделяют и раствор дважды экстрагируют EtOAc. Объединенные органические фазы высушивают (Na2SO4) и концентрируют in vacuo, получая масло оранжевого цвета, которое хроматографируют на силикагеле, элюируя смесью дихлорметан/EtOAc в соотношении 20:1. Остаток после концентрирования in vacuo повторно хроматографируют через силикагель, элюируя смесью гексан/EtOAc в соотношении 2:1 и получая 2,94 г (79%) указанного в заголовке соединения в виде масла розовато-оранжевой окраски; MS(API+) m/е 252 (МН+). Промежуточное соединение 110. 2-(5 Метил-2-(5-метил-2-тиенил)-оксазол-4-ил)этанол. Указанное в заголовке соединение (1,05 г) получают из 2,94 г (11,7 ммоля) промежуточного соединения 109 согласно способу получения промежуточного соединения 43 с последующей очисткой хроматографией на силикагеле с элюированием смесью гексан/EtOAc в соотношении 1:1; MS (API+) m/е 224 (МH+). 59 Промежуточное соединение 111. 2(S)-(2 Бензоил-фениламино)-3-4-[2-(5-метил-2-(5 метил-2-тиенил)-оксазол-4-ил)-этокси]-фенилпропионовой кислоты метиловый эфир. Указанное в заголовке соединение (440 мг) получают из 700 мг (3,13 ммоля) промежуточного соединения 110 и 1,18 г (3,13 ммоля) промежуточного соединения 23 согласно способу получения промежуточного соединения 44 с последующей очисткой хроматографией на силикагеле с элюированием смесью толуол/EtOAc в соотношении 20:1; MS (ES+) m/е 581 (MH+);TCX (PhMe/EtOAc (90:10: Rf=0,25. Промежуточное соединение 112. 2(S)-(2 Бензоил-фениламино)-3-4-[2-(5-метил-2-(3 метил-тиен-2-ил)-оксазол-4-ил)-этокси]-фенилпропионовой кислоты метиловый эфир. Указанное в заголовке соединение (100 мг) получают из 3,7 г метилового эфира (5-метил-2(3-метил-2-тиенил)-оксазо-4-ил)-уксусной кислоты (полученного так же, как промежуточное соединение 109) согласно способу получения промежуточного соединения 43 с последующим взаимодействием с 375 мг (1,0 ммоля) промежуточного соединения 23 согласно способу получения промежуточного соединения 44 и дальнейшей очисткой хроматографией на силикагеле с элюированием смесью толуол/EtOAc в соотношении 95:5; MS (ES+) m/е 581 (МН+); ТСХ(PhMe/EtOAc (90:10: Rf= 0,38. Промежуточное соединение 113. 2-(2-Иодфенил)-3-4-[2-(бензоксазол-2-ил-метил-амино)этокси]-фенил-пропионовой кислоты метиловый эфир. К раствору, содержащему 2,88 г (13,15 ммоля) 2-иоданилина, перемешиваемому в 50 мл толуола при температуре 25 С в атмосфере азота, добавляют 26,3 мл 0,1 М раствора промежуточного соединения 10 в толуоле, с последующим добавлением 58 мг (0,132 ммоля) димера ацетата родия(II). Полученный раствор перемешивают в течение 16 ч при 25 С, затем концентрируют in vacuo до темно-коричневого масла. Неочищенный продукт хроматографируют на силикагеле, элюируя CH2Cl2 и получая 1,12 г (75 %) указанного в заголовке соединения; MS (API) m/е 573 (МН+), 572 (М+). Промежуточное соединение 114. 4(R)Гидроксиметил-тиазолидин-3-карбоновой кислоты трет-бутиловый эфир. Раствор, содержащий 4,66 г (20 ммолей) NBoc-тиопролина и 3,84 мл (22 ммоля) DIEA,растворенного в 10 мл THF, охлаждают до 0 С и обрабатывают 2,1 мл (22 ммолями) этилхлорформиата. По истечении 30 мин при комнатной температуре отфильтровывают осадок белого цвета, раствор охлаждают до 0 С и к нему по каплям добавляют раствор, содержащий 8,32 г(220 ммолей) боргидрида натрия в 30 мл H2O. Реакционную смесь перемешивают в течение 24 ч, далее охлаждают до 0 С и реакцию останавливают, добавляя по каплям уксусную кислоту. 60 Затем продукт экстрагируют EtOAc, объединенные органические фазы последовательно промывают бикарбонатом натрия и лимонной кислотой, высушивают с сульфатом магния,фильтруют и растворители удаляют in vacuo,получая 2,33 г указанного в заголовке соединения; MS (ES+) m/е 242 (М+23), 120 (М-Вос+1). Промежуточное соединение 115. 4(R)-4[2(S)-(2-Бензоил-фениламино)-2-метоксикарбонил-этил]-феноксиметил-тиазолидин-3 карбоновой кислоты трет-бутиловый эфир. К раствору, содержащему 1,20 г (5,48 ммоля) промежуточного соединения 114, 2,05 гTHF, по каплям при температуре 0 С добавляют 0,95 мл (6,03 ммоля) DEAD. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, растворители удаляют in vacuo и неочищенную смесь очищают колоночной хроматографией на силикагеле с использованием смеси EtOAc/гексан в соотношении 1:3 в качестве элюента, что позволяет получить 530 мг указанного в заголовке соединения; MS (ES+)m/е 599 (М+23). Промежуточное соединение 116. 3-[4-(3 Бензоксазол-2-ил-тиазолидин-4(R)-илметокси)фенил]-2(S)-(2-бензоил-фениламино)-пропионовой кислоты метиловый эфир. Промежуточное соединение 115 (500 мг; 0,868 ммоля) обрабатывают 5 мл 4 н. НСl в диоксане в течение 1,5 ч. Растворители затем упаривают и неочищенную гидрохлоридную соль растворяют в 20 мл дихлорметана. К этому раствору добавляют 767 мг (5,0 ммоля) хлорбензоксазола и 1,29 г (10,0 ммоля) DIEA и полученный раствор оставляют перемешиваться при комнатной температуре в течение 36 ч. Летучие соединения далее удаляют in vacuo, а твердый остаток очищают колоночной флэшхроматографией на силикагеле с использованием смеси EtOAc/гексан в соотношении 1:1 в качестве элюента, что позволяет получить 128 мг указанного в заголовке соединения; MS (ES+)m/е 594 (МН+). Промежуточное соединение 117. 2(S)-(2 Бензоил-фениламино)-3-(4-гидроксифенил)пропионовая кислота. Указанное в заголовке соединение (1,63 г) получают из 1,79 г (4,66 ммоля) промежуточного соединения 23 согласно способу получения соединения из примера 32; MS (ES+) m/е 384
МПК / Метки
МПК: A61P 3/10, C07D 263/56, C07C 229/36, A61K 31/42
Метки: замещенные, производные, агонистической, кислоты, активностью, ppar-гамма, отношению, 4-гидрокси-фенилалкановой
Код ссылки
<a href="https://eas.patents.su/30-1403-zameshhennye-proizvodnye-4-gidroksi-fenilalkanovojj-kisloty-s-agonisticheskojj-aktivnostyu-po-otnosheniyu-k-ppar-gamma.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные 4-гидрокси-фенилалкановой кислоты с агонистической активностью по отношению к ppar-гамма</a>
Предыдущий патент: Тетракарбон
Следующий патент: Производные ациклических нуклеозидов.


































