Антагонисты рецептора гистамина-3
Номер патента: 13602
Опубликовано: 30.06.2010
Авторы: Чандрасекаран Рамалакшми Йегна, Вагер Тревис Т., Батлер Тодд Уилльям
Формула / Реферат
1. Соединение формулы I
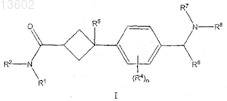
или его фармацевтически приемлемая соль,
где R1и R2, каждый независимо, выбран из группы, включающей
водород;
С1-С8-алкил, необязательно замещенный 1-4 галогенами;
С1-С4-алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из ОН, одного до четырех С1-С4-алкила, С3-С7-циклоалкила, С1-С4-диалкиламино, С6-С14-арила, необязательно замещенного галогеном и необязательно замещенного группой С6-С10-арилокси, необязательно замещенной одним-двумя галогенами; и 5-10-членного гетероарила, необязательно замещенного С6-С10-арильной группой и необязательно замещенного одной-тремя С1-С4-алкильными группами;
С3-С7-циклоалкил;
С6-С14-арил;
-(С0-С3)алкил-О-(C1-C3)алкил, необязательно замещенный (C1-С3)алкилом;
-(C1-С3)алкил-С(=O)O-(C1-C3)алкил;
3-8-членный гетероциклоалкил, необязательно замещенный одной или несколькими С1-С4-алкилкарбонильными группами;
С6-С10-арилсульфонил, необязательно замещенный одним или несколькими С1-С2-алкилами;
5-10-членный гетероарил и
С6-С14-арил-С0-С4алкилен-O-С0-С4-алкил, где каждый С0-С4-алкил и каждый С0-С4-алкилен необязательно замещен одним-четырьмя алкилами;
или необязательно R1 и R2вместе с азотом, к которому они присоединены, образуют 4-, 5-, 6- или 7-членное насыщенное или ненасыщенное алифатическое кольцо, где один из атомов углерода в указанном алифатическом кольце необязательно заменен на О, S, NR3 или СО и где указанное кольцо необязательно конденсировано с С6-С10-ариленом и необязательно замещено на углероде кольца заместителем, выбранным из группы, включающей
-ОН, 5-10-членный гетероарил, необязательно замещенный одним или несколькими атомами галогена и необязательно замещенный одним или несколькими С1-С2-алкилами,
С1-С4-алкокси, необязательно замещенный одним или несколькими С1-С2-алкокси и необязательно замещенный одним или несколькими С1-С4-диалкиламинокарбонилами, и
один или два С1-С4-алкила, необязательно и независимо замещенные одним или несколькими C1-С2-алкокси;
где R3представляет собой
водород;
С1-С8-алкил, необязательно замещенный 1-4 галогенами;
5-10-членный гетероарил, необязательно замещенный заместителем, выбранным из группы, состоящей из галогена, С1-С4-алкила, С1-С2-алкокси, С6-С10-арила, С1-С4-алкиламинокарбонила и циано;
С1-С4-алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из С1-С2-алкоксикарбонила, 5-10-членного гетероарила, необязательно замещенного одним или несколькими С1-С2-алкилами, одним-четырьмя С1-С4-алкилами, С3-С7-циклоалкиламином и С6-С14-арилом;
С6-С10-арил, необязательно замещенный одним или двумя С1-С2-алкилами;
С1-С4-алкилкарбонил;
или С6-С14-арил-С0-С4алкилен-О-С0-С4алкил, где каждый С0-С4-алкил и каждый С0-С4-алкилен необязательно замещен одним-четырьмя С1-С4-алкилами;
R4 независимо выбран из группы, состоящей из водорода, C1-С4-алкила, С1-С4-алкоксила, галогена, нитрила, -SO2C1-C4, -SO2NHC1-С4и -C(=O)NHC1-C4;
n равно 0, 1, 3 или 4;
R5 представляет собой ОН, -О(C1-С3)алкил, галоген или водород;
R6 представляет собой водород, С1-С4-алкил, необязательно замещенный 1-4 галогенами, или С3-С7-циклоалкил-С0-С4-алкил;
R7 представляет собой водород, С1-С8-алкил, необязательно замещенный 1-4 галогенами, или С3-С7-циклоалкил-С0-С4-алкил, где каждый С0-С4 необязательно замещен одним-четырьмя С1-С4-алкилами; и
R8 представляет собой водород, С1-С8-алкил, необязательно замещенный 1-4 галогенами, или С3-С7-циклоалкил-С0-С4-алкил;
или необязательно R7 и R8вместе с азотом, к которому они присоединены, образуют 4-, 5-, 6- или 7-членное гетероциклическое кольцо, где указанное гетероциклическое кольцо необязательно замещено одним или двумя С1-С4-алкилами и где один из атомов углерода указанного гетероциклического кольца, который отделен по меньшей мере двумя атомами от указанного азота в указанном гетероциклическом кольце, необязательно заменен на О, S, NR9или С=O, где R9 представляет собой водород, С1-С8-алкил, необязательно замещенный 1-4 галогенами, или С3-С7-циклоалкил-С0-С4-алкил и где каждый С0-С4 необязательно замещен одним-четырьмя С1-С4-алкилами.
2. Соединение формулы I по п.1, где R7 и R8 вместе с азотом, к которому они присоединены, образуют 4-, 5-, 6- или 7-членное гетероциклическое кольцо, где указанное гетероциклическое кольцо необязательно замещено одним или двумя С1-С4-алкилами и где один из атомов углерода указанного гетероциклического кольца, который отделен по меньшей мере двумя атомами от указанного азота в указанном гетероциклическом кольце, необязательно заменен на О, S, NR9или С=O, где R9 представляет собой водород, С1-С8-алкил, необязательно замещенный 1-4 галогенами, или С3-С7-циклоалкил-С0-С4-алкил и где каждый С0-С4 необязательно замещен одним-четырьмя С1-С4-алкилами.
3. Соединение формулы I по п.2, где R7 и R8вместе с азотом, к которому они присоединены, образуют 5- или 6-членный насыщенный гетероцикл.
4. Соединение формулы I по п.3, где указанный насыщенный гетероцикл представляет собой пирролидинильную группу.
5. Соединение формулы I по п.2, где R1 представляет собой водород; R4 и R5независимо представляют собой водород или F; R6 представляет собой водород или С1-С6-алкил.
6. Соединение формулы I по п.1, где R5 представляет собой Н или F.
7. Соединение формулы I по п.2, где R5представляет собой Н или F.
8. цис-Циклобутильный изомер или транс-циклобутильный изомер формулы I по п.1.
9. цис-Циклобутильный изомер или транс-циклобутильный изомер формулы I по п.2.
10. Соединение формулы I по п.1, где соединение выбрано из группы, включающей
диметиламид цис-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
цис-[3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутил]пирролидин-1-илметанон;
этилметиламид цис-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
метиламид цис-3-(3-хлор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
метиламид цис-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
диметиламид цис-3-(2,3-дихлор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
этиламид цис-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
изобутиламид цис-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты и
цис-(3-азабицикло[3.2.2]нон-3-ил)-[3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутил]метанон;
диметиламид транс-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
транс-[3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутил]пирролидин-1-илметанон;
этилметиламид транс-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
метиламид транс-3-(3-хлор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
метиламид транс-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
транс-{3-[3-хлор-4-((R)-2-метилпирролидин-1-илметил)фенил]циклобутил}пирролидин-1-илметанон;
диметиламид транс-3-(2,3-дихлор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
этиламид транс-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
изобутиламид транс-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
транс-(3-азабицикло[3.2.2]нон-3-ил)-[3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутил]метанон;
цис-[3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутил]пирролидин-1-илметанон;
диметиламид цис-3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
цис-[3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутил]пиперидин-1-илметанон;
изобутилметиламид цис-3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
циклопропилметиламид цис-3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
цис-[3-(3,5-дифтор-4-пирролидин-1-илметилфенил)-3-фторциклобутил]пирролидин-1-илметанон;
метиламид цис-3-(2,6-дифтор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
изобутиламид цис-3-(5-хлор-2-фтор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
этиламид цис-3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
метил(тетрагидропиран-4-илметил)амид цис-3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
метиламид цис-3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
цис-{3-[3-хлор-4-((R)-2-метилпирролидин-1-илметил)фенил]-3-фторциклобутил}пирролидин-1-илметанон;
циклопропилметилметиламид цис-3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
диметиламид цис-3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
этиламид цис-3-фтор-3-[3-фтор-4-((S)-2-метилпирролидин-1-илметил)фенил]циклобутанкарбоновой кислоты;
цис-[3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутил]-(2,3-дигидро-5Н-бензо[f][1,4]оксазепин-4-ил)метанон;
этиламид цис-3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
этилметиламид цис-3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
метил(3-метилпиридин-2-илметил)амид цис-3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
этиламид цис-3-фтор-3-[3-фтор-4-((R)-2-метилпирролидин-1-илметил)фенил]циклобутанкарбоновой кислоты;
изобутиламид цис-3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
цис-[3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутил]пирролидин-1-илметанон;
диметиламид цис-3-(2,3-дихлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
транс-[3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутил]пирролидин-1-илметанон;
диметиламид транс-3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
транс-[3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутил]пиперидин-1-илметанон;
изобутилметиламид транс-3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
циклопропилметиламид транс-3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
транс-[3-(3,5-дифтор-4-пирролидин-1-илметилфенил)-3-фторциклобутил]пирролидин-1-илметанон;
метиламид транс-3-(2,6-дифтор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
изобутиламид транс-3-(5-хлор-2-фтор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
этиламид транс-3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
метил(тетрагидропиран-4-илметил)амид транс-3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
метиламид транс-3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
транс-{3-[3-хлор-4-((R)-2-метилпирролидин-1-илметил)фенил]-3-фторциклобутил}пирролидин-1-илметанон;
циклопропилметилметиламид транс-3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
диметиламид транс-3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
этиламид транс-3-фтор-3-[3-фтор-4-((S)-2-метилпирролидин-1-илметил)фенил]циклобутанкарбоновой кислоты;
транс-[3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутил]-(2,3-дигидро-5Н-бензо[f][1,4]оксазепин-4-ил)метанон;
этиламид транс-3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
этилметиламид транс-3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
метил(3-метилпиридин-2-илметил)амид транс-3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты;
этиламид транс-3-фтор-3-[3-фтор-4-((R)-2-метилпирролидин-1-илметил)фенил]циклобутанкарбоновой кислоты;
изобутиламид транс-3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;
транс-[3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутил]пирролидин-1-илметанон;
диметиламид транс-3-(2,3-дихлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты.
11. Способ лечения расстройства или состояния, которые можно лечить антагонизацией рецепторов гистамина-3, где способ включает введение млекопитающему, нуждающемуся в таком лечении, соединения формулы I, описанного в п.1.
12. Способ по п.11, где расстройство или состояние выбрано из группы, состоящей из депрессии, расстройств настроения, шизофрении, тревожных расстройств, расстройств познавательной способности, болезни Альцгеймера, расстройства дефицита внимания, расстройства гиперактивности и дефицита внимания, психотических расстройств, расстройств сна, ожирения, головокружения, эпилепсии, укачивания, респираторных заболеваний, аллергии, реакций дыхательных путей, вызванных аллергией, аллергического ринита, назальной гиперемии, аллергической гиперемии, гиперемии, гипотензии, сердечно-сосудистого заболевания, заболеваний желудочно-кишечного тракта, гипер- и гипоподвижности и секреции кислоты в желудочно-кишечном тракте, причем способ включает введение млекопитающему, нуждающемуся в таком лечении, соединения формулы I, описанного в п.1.
13. Способ по п.12, где расстройство или состояние выбрано из группы, состоящей из тревожных расстройств, расстройства гиперактивности и дефицита внимания, расстройства дефицита внимания, респираторных заболеваний, ожирения, расстройств познавательной способности и психотических расстройств.
14. Способ по п.12, где расстройство или состояние представляет собой респираторное заболевание, выбранное из группы, состоящей из респираторного дистресс-синдрома взрослых, острого респираторного дистресс-синдрома, бронхита, хронического бронхита, хронического обструктивного заболевания легких, кистозного фиброза, астмы, эмфиземы, ринита и хронического синусита.
15. Способ получения соединения формулы I по п.1, где способ включает стадию взаимодействия соединения формулы 4
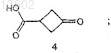
с металлорганическим реагентом, полученным из соединения формулы 2
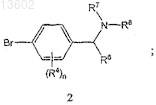
с последующим непосредственным образованием амида с получением соединения формулы I.
Текст
013602 Уровень изобретения Данное изобретение относится к соединениям формулы I, описанным в настоящем документе, к фармацевтической композиции, содержащей такие соединения, к способу получения таких соединений и способам лечения нарушений или состояний, которые можно лечить антагонизацией рецепторов гистамина-3 (Н 3), применяя такие соединения. Гистамин является хорошо известным медиатором в гиперчувствительных реакциях (например, аллергия, сенная лихорадка и астма), которые обычно лечатся антагонистами или "антигистаминами" гистамина. Также было установлено, что рецепторы гистамина существуют по меньшей мере в двух видах,обозначаемых как рецепторы H1 и Н 2. Третий рецептор гистамина (рецептор Н 3), как полагают, играет роль в нейротрансмиссии в центральной нервной системе, где рецептор Н 3, как думают, расположен пресинаптически на гистаминэгрических нервных окончаниях (Nature, 302, S.32-837 (1983. Существование рецептора Н 3 было подтверждено созданием селективных агонистов и антагонистов рецептора Н 3 (Nature, 327, 117-123 (1987 и затем было показано регулирование высвобождения нейротрансмиттеров как в центральной нервной системе, так и в периферических органах, особенно в легких, сердечно-сосудистой системе и желудочнокишечном тракте. Ряд заболеваний или состояний можно лечить лигандами рецептора гистамина-3, где лиганд Н 3 может представлять собой антагонист, агонист или частичный агонист, смотри: (Imamura et al., Circ. Res.,(1996) 78, 475-481); (Imamura et. al., Circ. Res., (1996) 78, 863-869); (Lin et al., Brain Res. (1990) 523, 325330); (Monti et al., Neuropsychopharmacology (1996) 15, 31, 35); (Sakai et al., Life Sci. (1991) 48, 2397-2404);(Dimitriadou et al., "Functional relationship between mast cells and C-sensitive nerve fibres evidenced by histamine H3-receptor modulation in rat lung and spleen", Clinical Science, 87(2):151-63, (1994). Такие заболевания или состояния включают сердечно-сосудистые нарушения, а именно острый инфаркт миокарда; процессы памяти, деменцию и расстройства познавательной способности, такие как болезнь Альцгеймера и растройство гиперактивности и дефицита внимания; неврологические нарушения, такие как болезнь Паркинсона, шизофрения, депрессия, эпилепсия и приступы или конвульсии; рак, такой как рак кожи,медуллярная карцинома щитовидной железы и меланома; респираторные расстройства, такие как астма; расстройства сна, такие как нарколепсия; вестибулярную дисфункцию, такую как болезнь Меньера; расстройства желудочно-кишечного тракта, воспаление, мигрень, укачивание, ожирение, боль и септический шок. Антагонисты рецептора Н 3 ранее также были описаны, например, в WO 03/050099, 02/0769252,02/12224 и опубликованной патентной заявке US2005/0171181 A1. Рецептор гистамина Н 3 (H3R) регулирует высвобождение гистамина и других нейротрансмиттеров, включающих серотонин и ацетилхолин. H3R является специфичным относительно нейронов и ингибирует высвобождение некоторых моно-1 013602 аминов, таких как гистамин. Селективный антагонизм H3R рецептора поднимает уровни гистамина головного мозга и ингибирует такие активности, как потребление пищи, сводя до минимума неспецифические периферические последствия. Антагонисты рецептора повышают синтез и высвобождение церебрального гистамина и других моноаминов. Данным механизмом они вызывают пролонгированное бодрствование, повышенную познавательную деятельность, снижение потребления пищи и нормализацию вестибулярных рефлексов. Таким образом, данный рецептор представляет собой важную мишень для новых терапий при болезни Альцгеймера, расстройствах настроения и нарушениях познавательной способности, включающих расстройство гиперактивности и дефицита внимания (ADHD), расстройство дефицита внимания (ADD), недостаточность/отсутствие познавательной способности, ожирение, головокружение, шизофрению, эпилепсию, расстройства сна, нарколепсию и укачивание и различные формы тревоги. Большинство антагонистов рецептора гистамина Н 3 на сегодняшний день напоминает гистамин наличием имидазольного цикла, который может быть замещенным, как описано, например, в WO 96/38142. Неимидазольные нейроактивные соединения, такие как бета-гистамины (Arrang, Eur. J. Pharm. 1985,111:72-84), показали некоторую активность рецептора гистамина Н 3, но слабой силы. ЕР 978512 и 0982300 А 2 раскрывают неимидазольные алкиламины в качестве антагонистов рецептора гистамина Н 3.WO 02/12224 (Ortho McNeil Pharmaceuticals) описывает неимидазольные бициклические производные в качестве лигандов рецептора гистамина Н 3. Другие антагонисты рецептора были описаны в WO 02/32893 и 02/06233. Соединения данного изобретения являются высокоселективными для рецептора Н 3 (по сравнению с другими рецепторами гистамина) и обладают замечательными свойствами распределения как лекарственные средства (фармакокинетика). В частности, соединения данного изобретения селективно отличаютH3R от других подтипов рецептора H1R, H2R. Ввиду повышенного уровня интереса к агонистам, обратным агонистам и антагонистам рецептора гистамина Н 3 в данной области, новые соединения, которые взаимодействуют с рецептором гистамина Н 3, были бы очень желательным вкладом в данную область. Настоящее изобретение обеспечивает такой вклад в область, при этом оно основывается на выявленном факте, что новый класс циклобутильных обратных амидов имеет высокую и специфическую аффинность к рецептору гистамина Н 3 и исключительный лекарственный профиль. Сущность изобретения Данное изобретение относится к соединению формулы I или к их фармацевтически приемлемой соли,где R1 и R2, каждый независимо, выбран из группы, включающей водород; С 1-С 8-алкил, необязательно замещенный 1-4 галогенами; С 1-С 4-алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из ОН, одного до четырех С 1-С 4-алкила, С 3-С 7-циклоалкила, С 1-С 4-диалкиламино, С 6-С 14-арила,необязательно замещенного галогеном и необязательно замещенного группой С 5-С 10-арилокси, необязательно замещенной одним-двумя галогенами, и 5-10-членного гетероарила, необязательно замещенного С 6-С 10-арильной группой и необязательно замещенного одной-тремя С 1-С 4-алкильными группами; С 3-С 7-циклоалкил; С 6-С 14-арил;-(C1-C3)алкил-С(=O)О-(С 1-С 3)алкил; 3-8-членный гетероциклоалкил, необязательно замещенный одной или несколькими С 1-С 4-алкилкарбонильными группами; С 6-С 10-арилсульфонил, необязательно замещенный одним или несколькими С 1-С 2-алкилами; 5-10-членный гетероарил и С 6-С 14-арил-С 0-С 4-алкилен-O-С 0-С 4-алкил, где каждый С 0-С 4-алкил и каждый С 0-С 4-алкилен необязательно замещен одним-четырьмя алкилами; или необязательно R1 и R2, вместе с азотом, к которому они присоединены, образуют 4-, 5-, 6- или 7-членное насыщенное или ненасыщенное алифатическое кольцо, где один из атомов углерода в указанном алифатическом кольце необязательно заменен на О, S, NR3 или СО и где указанное кольцо необязательно конденсировано с С 6-С 10-ариленом и необязательно замещено на углероде кольца заместителем,-2 013602 выбранным из группы, включающей-ОН, 5-10-членный гетероарил, необязательно замещенный одним или несколькими атомами галогена и необязательно замещенный одним или несколькими С 1-С 2-алкилами,С 1-С 4-алкокси, необязательно замещенный одним или несколькими С 1-С 2-алкокси и необязательно замещенный одним или несколькими С 1-С 4-диалкиламинокарбонилами, и один или два С 1-С 4-алкила, необязательно и независимо замещенные одним или несколькимиC1-С 2-алкокси; где R3 представляет собой водород; С 1-С 8-алкил, необязательно замещенный 1-4 галогенами; 5-10-членный гетероарил, необязательно замещенный заместителем, выбранным из группы, состоящей из галогена, C1-С 4-алкила, С 1-С 2-алкокси, С 6-С 10-арила, С 1-С 4-алкиламинокарбонила и циано; С 1-С 4-алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из C1-С 2-алкоксикарбонила, 5-10-членного гетероарила, необязательно замещенного одним или несколькими С 1-С 2-алкилами, одним-четырьмя С 1-С 4-алкилами, С 3-С 7-циклоалкилом и С 6-С 14-арилом; С 6-С 10-арил, необязательно замещенный одним или двумя C1-С 2-алкилами; С 1-С 4-алкилкарбонил; или С 6-С 14-арил-С 0-С 4-алкилен-O-С 0-С 4-алкил, где каждый С 0-С 4-алкил и каждый С 0-С 4-алкилен необязательно замещен одним-четырьмя С 1-С 4-алкилами;R4 независимо выбран из группы, состоящей из водорода, С 1-С 4-алкила, С 1-С 4-алкоксила, галогена,нитрила, -SO2C1-C4, -SO2NHC1-С 4 и -C(=O)NHC1-C4;R8 представляет собой водород, С 1-С 8-алкил, необязательно замещенный 1-4 галогенами, или С 3-С 7 циклоалкил-С 0-С 4-алкил; или необязательно R7 и R8, вместе с азотом, к которому они присоединены, образуют 4-, 5-, 6- или 7-членное гетероциклическое кольцо, где указанное гетероциклическое кольцо необязательно замещено одним или двумя С 1-С 4-алкилами и где один из атомов углерода указанного гетероциклического кольца,который отделен по меньшей мере двумя атомами от указанного азота в указанном гетероциклическом кольце, необязательно заменен на О, S, NR9 или С=O, где R9 представляет собой водород, С 1-С 8-алкил,необязательно замещенный 1-4 галогенами, или С 3-С 7-циклоалкил-С 0-С 4-алкил и где каждый С 0-С 4-алкил необязательно замещен одним-четырьмя С 1-С 4-алкилами. Предпочтительный вариант осуществления изобретения включает такие соединения формулы I, гдеR7 и R8, вместе с азотом, к которому они присоединены, образуют 4-, 5-, 6- или 7-членное гетероциклическое кольцо, где указанное гетероциклическое кольцо необязательно замещено одним или двумя С 1-С 4-алкилами и где один из атомов углерода указанного гетероциклического кольца, который отделен по меньшей мере двумя атомами от указанного азота в указанном гетероциклическом кольце, необязательно заменен на О, S, NR9 или С=O, где R9 представляет собой водород, С 1-С 8-алкил, необязательно замещенный 1-4 галогенами, или С 3-С 7-циклоалкил-С 0-С 4-алкил, и где каждый С 0-С 4-алкил необязательно замещен одним-четырьмя С 1-С 4-алкилами. Более предпочтительный вариант осуществления изобретения включает такие соединения формулыI, где R7 и R8, вместе с азотом, к которому они присоединены, образуют 5- или 6-членный насыщенный гетероцикл. Самый предпочтительный вариант осуществления изобретения включает такие соединения формулы I, где R7 и R8, вместе с азотом, к которому они присоединены, образуют пирролидиновую группу. Другой вариант осуществления изобретения включает такие соединения формулы I, где R1 представляет собой водород; R4 и R5 независимо представляют собой водород или F; R6 представляет собой водород или С 1-С 6-алкил. Другой вариант осуществления изобретения включает такие соединения формулы I, где R5 представляет собой Н. Другой вариант осуществления изобретения включает такие соединения формулы I, где R5 представляет собой F. Другой вариант осуществления изобретения включает цис-циклобутильные изомеры формулы I. Другой вариант осуществления изобретения включает трансциклобутильные изомеры формулы I. Самый предпочтительный вариант осуществления данного изобретения включает следующие как цис-, так и транс-соединения формулы I: диметиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты;[3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутил]пирролидин-1-илметанон и диметиламид 3-(2,3-дихлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты. Данное изобретение относится также к фармацевтической композиции для лечения расстройства или состояния, которые можно лечить антагонизацией рецепторов гистамина-3, причем композиция содержит соединение формулы I и необязательно фармацевтически приемлемый носитель. Данное изобретение относится также к способу лечения расстройства или состояния, которые можно лечить антагонизацией рецепторов гистамина-3, причем способ предусматривает введение млекопитающему, нуждающемуся в таком лечении, соединения формулы I. Данное изобретение относится также к способу лечения расстройства или состояния, выбранных из группы, состоящей из депрессии, расстройств настроения, шизофрении, тревожных расстройств, расстройств познавательной способности, болезни Альцгеймера, расстройства дефицита внимания (ADD),расстройства гиперактивности и дефицита внимания (ADHD), психотических расстройств, расстройств сна, ожирения, головокружения, эпилепсии, укачивания, респираторных заболеваний, аллергии, реакций дыхательных путей, вызванных аллергией, аллергического ринита, назальной гиперемии, аллергической гиперемии, гиперемии, гипотензии, сердечно-сосудистого заболевания, заболеваний желудочнокишечного (ЖК) тракта, гипер- и гипоподвижности и секреции кислоты в желудочно-кишечном тракте,причем способ предусматривает введение млекопитающему, нуждающемуся в таком лечении, соединения формулы I. Данное изобретение относится также к фармацевтической композиции для лечения аллергического ринита, назальной гиперемии или аллергической гиперемии, содержащей (а) антагонистическое для рецептора Н 3 соединение формулы I или его фармацевтически приемлемую соль; (b) антагонист рецептораH1 или его фармацевтически приемлемую соль; (с) фармацевтически приемлемый носитель; в которой-4 013602 вышеприведенные активные ингредиенты (а) и (b) присутствуют в количествах, которые делают композицию эффективной в лечении аллергического ринита, назальной гиперемии и аллергической гиперемии. Данное изобретение относится также к фармацевтической композиции для лечения ADD, ADHD,депрессии, расстройств настроения или расстройств познавательной способности, содержащей (а) антагонистическое для рецептора Н 3 соединение формулы I или его фармацевтически приемлемую соль; (b) блокатор обратного захвата нейротрансмиттеров или его фармацевтически приемлемую соль; (с) фармацевтически приемлемый носитель; в которой вышеприведенные активные ингредиенты (а) и (b) присутствуют в количествах, которые делают композицию эффективной в лечении депрессии, расстройств настроения или расстройств познавательной способности. Данное изобретение относится также к способу получения соединения согласно формуле I, где способ включает стадию взаимодействия соединения формулы 4 с металлорганическим реагентом, полученным из соединения формулы 2 с последующим непосредственным образованием амида с получением соединения формулы I. В общей формуле I согласно данному изобретению, когда радикал является моно- или полизамещенным, указанный заместитель(и) может быть расположен в любом желаемом положении(ях), если не указано иначе. Таким образом, когда радикал является полизамещенным, указанные заместители могут быть одинаковыми или различными, если не указано иначе. Антагонисты рецептора гистамина-3 (Н 3) изобретения применимы для лечения, в особенности,ADD, ADHD, ожирения, тревожных расстройств и респираторных заболеваний. Респираторные заболевания, которые можно лечить по данному изобретению, включают респираторный дистресс-синдром взрослых, острый респираторный дистресс-синдром, бронхит, хронический бронхит, хроническое обструктивное заболевание легких, кистозный фиброз, астму, эмфизему, ринит и хронический синусит. Фармацевтическая композиция и способ данного изобретения могут также применяться для предупреждения рецидива в нарушении и состоянии, описанных в предыдущих разделах. Профилактика такого рецидива сопровождается введением млекопитающему, нуждающемуся в такой профилактике, соединения формулы I, описанной выше. Раскрываемые соединения могут также применяться как часть комбинированной терапии, включающей их введение в виде отдельных единиц или объединенных в одну систему доставки, которая использует эффективную дозу антагонистического для рецептора гистамина Н 3 соединения формулы I и эффективную дозу антагониста рецептора гистамина H1, такого как цетиризин (Zyrtec), хлорфенирамин (Chlortrimeton), лоратидин (Claritin), фексофенадин (Allegra) или деслоратадин (Clarinex) для лечения аллергического ринита, назальной гиперемии и аллергической гиперемии. Раскрываемые соединения могут также применяться как часть комбинированной терапии, включающей их введение в виде отдельных единиц или объединенных в одну систему доставки, которая использует эффективную дозу антагонистического для гистамина Н 3 соединения формулы I и эффективную дозу блокатора обратного захвата нейротрансмиттера. Примеры блокаторов обратного захвата нейротрансмиттера будут включать селективные ингибиторы обратного захвата серотонина (SSRI), такие как сертралин (Zoloft), флуоксетин (Prozac) и пароксетин (Paxil), или неселективные ингибиторы обратного захвата серотонина, дофамина или норэпинефрина для лечения ADD, ADHD, депрессии, расстройств настроения или расстройств познавательной способности. Соединения данного изобретения могут содержать оптические центры и поэтому могут существовать в различных энантиомерных конфигурациях. Формула I, описанная выше, включает все энантиомеры, диастереомеры и другие стереоизомеры соединений, изображенных в структурной формуле I, а также их рацемические и другие смеси. Индивидуальные изомеры могут быть получены известными способами, такими как оптическое разделение, оптически селективная реакция или хроматографическое разделение при получении конечного продукта или его промежуточного соединения. Данное изобретение также включает соединения, меченные изотопами, которые являются идентичными соединениям, описанным в формуле I, но фактически один или несколько атомов которых заменены атомом, имеющим атомную массу или массовый номер, иной чем атомная масса или массовый номер, обычно встречающийся в природе. Примеры изотопов, которые могут быть введены в соединения данного изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как 2 Н, 3 Н, 13 С, 11 С, 14 С, 15N, 18 О, 17O, 15O, 31 Р, 32 Р, 35S, 18F и 36Cl, 123I соответственно. Соеди-5 013602 нения данного изобретения и фармацевтически приемлемые соли указанных соединений, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов, входят в объем данного изобретения. Некоторые соединения данного изобретения, меченные изотопами, например соединения, в которые включены радиоактивные изотопы, такие как 3 Н и 14 С, применимы в анализах распределения лекарственного средства и/или субстрата в тканях. Тритированные, т.е. 3 Н, и углерод-14, т.е. 14 С, изотопы особенно предпочтительны по простоте их получения и детектируемости. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может дать определенное терапевтическое преимущество вследствие более высокой метаболической стабильности, например от повышенного периода полураспада in vivo или от потребления сниженных доз, и, следовательно, может быть предпочтительным при некоторых обстоятельствах. Замещение позитрон-испускающими изотопами, такими как 11 С, 18F, 15O и 13N, может применяться в исследованиях методом позитронной эмиссионной топографии (PET) для изучения степени заполненности субстратом рецептора. Тревожные расстройства включают, например, генерализованное тревожное расстройство, паническое расстройство, PTSD, и социальное тревожное расстройство. Расстройства настроения включают,например, депрессивное настроение, смешанное тревожное и депрессивное настроение, повреждение проводимости и смешанное повреждение проводимости и депрессивное настроение. Расстройства познавательной способности включают, например, в дополнение к ADHD, расстройство дефицита внимания(ADD) или другую корректировку внимания или нарушения познавательной способности, обусловленные общими медицинскими состояниями. Психотические нарушения включают, например, шизоаффективные расстройства и шизофрению; расстройства сна включают, например, нарколепсию и энурез. Примерами расстройств или состояний, которые можно лечить соединением, композицией и способом данного изобретения, являются также следующие расстройства: депрессия, включающая, например,депрессию у раковых пациентов, депрессию у пациентов с болезнью Паркинсона, депрессию после инфаркта миокарда, депрессию у пациентов с вирусом иммунодефицита человека (HIV), субсиндромальную симптоматическую депрессию, депрессию у бесплодных женщин, педиатрическую депрессию,большую депрессию, разовую эпизодическую депрессию, рецидивирующую депрессию, детскую депрессию, вызванную злоупотреблением чем-либо, послеродовую депрессию, DSM-IV большую депрессию, не поддающуюся лечению большую депрессию, тяжелую депрессию, психотическую депрессию,послешоковую депрессию, невропатическую боль, маниакальный депрессивный психоз, включающий маниакальный депрессивный психоз со смешанными эпизодами и маниакальный депрессивный психоз с депрессивными эпизодами, сезонное аффективное расстройство, биполярную депрессию ВР I, биполярную депрессию ВР II или большую депрессию с дистимией; дистимия; фобии, включающие, например,агорафобию, социальную фобию или простые фобии; расстройства питания, включающие, например,нервную анорексию или нервную булимию; зависимости от химических веществ, включающие привыкание к алкоголю, кокаину, амфетамину и другим психомоторным стимуляторам, морфину, героину или другим опиоидным агонистам, фенобарбиталу и другим барбитуратам, никотину, диазепаму, бензодиазепинам и другим психотропным веществам; болезни Паркинсона, включающие, например, деменцию при болезни Паркинсона, паркинсонизм, вызванный нейролептиками, или поздние дискинезии; головная боль, включающая, например, головную боль, связанную с сосудистыми нарушениями; синдром отмены; возрастные расстройства эрудиции и памяти; апатия; биполярное расстройство; синдром хронической усталости; хронический или острый стресс; нарушение проводимости; циклотимия; соматические расстройства, такие как нарушение психогенной природы, конверсионное расстройство, болевое расстройство, ипохондрия, телесное дисморфическое расстройство, недифференцируемое расстройство и соматический NOS; недержание; ингаляционные нарушения; интоксикации; мания; стойкое расстройство; периферическая невропатия; посттравматическое стрессовое расстройство; дисфоническое расстройство в поздней фазе желтого тела, специфические расстройства развития, синдром "poop out" SSRI или недостаточность у пациента поддерживать удовлетворительную реакцию на лечение с помощью SSRI после начального периода удовлетворительного ответа; и тиковые расстройства, включая болезнь Туретта. В качестве примера млекопитающее, нуждающееся в лечении или профилактике, может представлять собой человека. В качестве другого примера млекопитающее, нуждающееся в лечении или профилактике, может представлять млекопитающее, иное чем человек. Фармацевтически приемлемые соли соединений формулы I включают их кислотно-аддитивные и основные соли. Подходящие кислотно-аддитивные соли образуются из кислот, которые дают нетоксичные соли. Примеры включают ацетаты, аспартаты, бензоаты, безилаты, бикарбонаты/карбонатны, бисульфаты/сульфаты, бораты, камзилаты, цитраты, эдизилаты, эзилаты, формиаты, фумараты, глюкептаты, глюконаты, глюкуронаты, гексафторфосфаты, гибензаты, гидрохлориды/хлориды, гидробромиды/бромиды,гидроиодиды/иодиды, изетионаты, лактаты, малаты, малеаты, малонаты, мезилаты, метилсульфаты, нафтилаты, 2-напсилаты, никотинаты, нитраты, оротаты, оксалаты, пальмитаты, памоаты, фосфаты/гидрофосфаты/дигидрофосфаты, сахараты, стеараты, сукцинаты, тартраты, тозилаты и трифторацетаты.-6 013602 Подходящие основные соли образуются из оснований, которые дают нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Могут быть также получены полусоли кислот и оснований, например полусульфаты и полусоли кальция. Для обзора подходящих солей смотри "Handbook of Pharmaceutical Salts: Properties, Selection andUse" by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Соединения изобретения могут существовать как в несольватированной, так и в сольватированной формах. Термин "сольват" используют в данном документе для описания молекулярного комплекса, содержащего соединение изобретения и стехиометрическое количество молекул одного или нескольких фармацевтически приемлемых растворителей, например этанола. Термин "гидрат" использован, когда указанный растворитель представляет собой воду. Включенными в объем изобретения являются комплексы, такие как клатраты, комплексы включения лекарственное средство-хост, где в противоположность вышеприведенным сольватам лекарственное средство и хост присутствуют в стехиометрических или не стехиометрических количествах. Также включенными являются комплексы лекарственного средства, содержащие два или более органических и/или неорганических компонентов, которые могут находиться в стехиометрических или не стехиометрических количествах. Полученные комплексы могут быть ионизированными, частично ионизированными или неионизированными. Для обзора таких комплексов смотри J. Pharm. Sci., 64 (8), 1269-1288 by Haleblian. (August, 1975). Ниже в данном описании все ссылки на соединения формулы I включают ссылки на их соли, сольваты и комплексы и на сольваты и комплексы их солей. Соединения изобретения охватывают соединения формулы I, определенные в данном описании выше, включая все их полиморфы и кристаллические образования и их изомеры (включая оптические,геометрические и таутомерные изомеры), указанные в данном описании ниже, и соединения формулы I,меченные изотопами. Соединения формулы I, содержащие один или несколько асиметрических атомов углерода, могут существовать как два или несколько стереоизомеров. Когда структурные изомеры являются взаимообратимыми из-за низкого энергетического барьера, может иметь место таутомерная изомерия ("таутомерия"). Она может происходить в форме протонной изомерии в соединениях формулы I, содержащих, например, имино, кето или оксимную группу, или так называемой валентной таутомерии в соединениях,которые содержат ароматическую группу. Это означает, что отдельное соединение может проявлять более одного типа изомерии. Включенными в объем данного изобретения являются все стереоизомеры, геометрические изомеры и таутомерные формы соединений формулы I, включая соединения, проявляющие более одного типа изомерии, и их смеси из одного или нескольких типов. Также включенными являются кислотноаддитивные и основные соли, где противоион является оптически активным, например d-лактатом илиl-лизином, или рацемическим, например dl-тартратом или dl-аргинином. Если не указано иначе, термин "гало", как используется в данном описании, включает фтор, хлор,бром и иод. Если не указано иначе, термин "(C1-C4)алкил", как используется в данном описании, включает насыщенную с прямой цепью или разветвленную углеводородную группу, имеющую от 1 до 4 атомов углерода, и включает, например, метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Он также используется, если алкильная группа несет заместители или представляет собой заместитель для другой группы, например в группах -О-(C1-C4)алкил и -С(О)(C1-C4)алкил. Если не указано иначе, термин "(C1-C4)алкокси", как используется в данном описании, включает линейные или разветвленные алкоксигруппы и включает, например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси. Если не указано иначе, термин "(C2-C6)алкилен", как используется в данном описании, включает двухвалентный радикал, полученный из линейного или разветвленного алкана, содержащего от 2 до 6 атомов углерода. Примеры (С 2-С 6)алкиленовых радикалов представляют собой метилен, этилен (1,2 этилен или 1,1-этилен), триметилен (1,3-пропилен), тетраметилен (1,4-бутилен), пентаметилен и гексаметилен. Если не указано иначе, термин "(С 3-С 6)циклоалкил", как используется в данном описании, включает насыщенную моноциклическую карбоциклическую группу, имеющую от 3 до 6 атомов углерода, и включает циклопропил, циклобутил, циклопентил и циклогексил. Если не указано иначе, термин "насыщенный гетероцикл", как используется в данном описании,включает насыщенные моноциклические группы, имеющие от 4 до 7 членов в кольце, который содержит 1 атом азота. Примеры насыщенных гетероциклов представляют собой азетидинил, пирролидинил и пиперидинил. Если не указано иначе, термин "гетероароматический", как используется в данном описании, включает моноциклические или бициклические гетероароматические группы, имеющие от 5 до 9 и от 5 до 10-7 013602 членов в кольце, соответственно, которые содержат 1, 2, 3 или 4 гетероатома(ов), выбранных из азота,кислорода и серы. Гетероароматическая группа может быть незамещенной, монозамещенной или дизамещенной. Примеры гетероарильных групп включают, но без ограничения только ими, тиофенил, фуранил, пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, пиранил, пиридинил, пиразинил, пиримидинил, пиридазинил, триазинил, тиадиазинил, изобензофуранил, бензофуранил, хроменил, индолизинил, изоиндолил, индолил,индазолил, пуринил, хинолинил, изохинолил, циннолинил, фталазинил, нафтиридинил, хиназолинил,хиноксалинил, бензоксазолил, бензотиазолил, бензимидазолил, бензофуранил, бензотиофенил, пирролопиразинил, пирролопиридинил и имидазопиридинил. Подробное описание изобретения Соединения формулы I согласно изобретению могут быть получены по общей процедуре, показанной на схеме 1. Схема 1 На схеме 1 соединения формулы (1) получают следующим образом. Стадия А. Арилбромид общей структуры 2 превращают в металлоорганический реагент, такой как литийорганический реагент, магнийорганический галогенид, церийорганический, титанорганический, цинкорганический, медьорганический или алюминийорганический реагент. Предпочтителен магнийорганический галогенид (реагент Гриньяра) и литийорганический реагент. Например, литийорганический реагент может быть получен взаимодействием арилбромида (2) с н-BuLi. Реакцию обычно осуществляют в реакционно-инертном растворителе, таком как тетрагидрофуран, при температуре от примерно -78 С до примерно комнатной температуры. К данному литийорганическому реагенту при примерно -78 С добавляют раствор 3-оксоциклобутанкарбоновой кислоты (J. Org. Chem. 1988, 53, 3841 и J. Org. Chem. 1996, 61,2174), предварительно охлажденный до -78 С, при этом предпочтительный растворитель представляет собой тетрагидрофуран. После окончания добавления реакционной смеси дают медленно нагреться до комнатной температуры, получая соединение общей структуры 3. Стадия В. Промежуточное соединение общей структуры 3 может быть подвергнуто взаимодействию с первичным или вторичным амином общей формулы HNR1R2, где R1 и R2 принимают значения, определенные в описании амина, в присутствии конденсирующего реагента, такого как дициклогексилкарбодиимид, карбонилдиимидазол, ангидрид трипропилфосфоновой кислоты, алкилхлорформиат, хлоридрид бис-(2-оксо-3-оксазолидинил)фосфиновой кислоты, бензортиазол-1-илокси-трис(диметиламино)фосфоний гексафторфосфат или любых других стандартных литературных реагентов в присутствии триалкиламинового основания, такого как триэтиламин или диизапропилэтиламин, где ангидрид трипропилфосфоновой кислоты и триэтиламин являются предпочтительной комбинацией в реакционно-инертном растворителе, при этом предпочтителен этилацетат от -78 до 40 С, при этом предпочтительна комнатная температура с получением N-ацилированных соединений общей структуры 4 соединения формулы I. Стадия С. Элиминирование бензилового спирта (4) осуществляют взаимодействием (4) с кислотой, предпочтительно с трифторуксусной кислотой, либо в неразбавленном, либо в реакционно-инертном растворителе, таком как метиленхлорид или 1,2-дихлорэтан, при температуре реакционной смеси от примерно комнатной температуры до температуры кипения примененного растворителя с обратным холодильником,-8 013602 где примерно 75 С является предпочтительной температурой взаимодействия, с получением соединения общей структуры 5. Стадия D. Восстановление циклобутена (5) может быть осуществлено взаимодействием (5) в реакционноинертном растворителе, где предпочтительные растворители представляют собой этиловый спирт и этилацетат. Восстановление может быть осуществлено использованием газообразного водорода при примерно 45 фунт/кв.дюйм и катализатора, где предпочтительные катализаторы гидрирования представляют собой катализатор Вилькинсона [хлортрис(трифенилфосфин)родий(I)] или палладий, 5-10 мас.% на активированном угле, с получением (6), соединения общей формулы I. Стадия Е. Превращение бензиламинов общей структуры (6) в бензилхлориды общей структуры (7) осуществляют с применением условия, описанного в литературе, например Nevill C.R., Fuchs P.L., SYNCAV,Synth. Commun., EN, 20, 5, 1990, 761-772). Взаимодействие (6) с этилхлорформиатом в реакционноинертном растворителе, где 1,2-дихлорэтан или метиленхлорид являются предпочтительными, при температуре реакционной смеси от примерно -78 С до комнатной температуры, где комнатная температура является предпочтительной, приводит к бензилхлоридам общей структуры (7). Стадия F. Взаимодействие бензилхлорида (7) с первичным или вторичным амином общей формулы HNR1R2,где R1 и R2 принимают значения, определенные в описании амина, в реакционно-инертном растворителе,где 1,2-дихлорэтан или метиленхлорид являются предпочтительными, в присутствии третичного аминного основания, при этом предпочтителен триэтиламин, при температуре реакционной смеси от примерно комнатной температуры до температуры кипения примененного растворителя с обратным холодильником, при этом предпочтительна температура примерно 55 С, дает (8), соединение общей формулы I. Схема 2 На схеме 2 соединения формулы 1 получают следующим образом. Стадия G. Этерификация Фишера может быть осуществлена при использовании стандартных условий, которые описаны в литературе и известны специалистам в данной области. Например, взаимодействие гидроксильного производного (4) с алкилгалогенидом, таким как алкилхлорид, алкилбромид или алкилиодид,в присутствии основания, при этом предпочтителен NaH, и в присутствии NaI или NaBr, в реакционноинертном растворителе, где диметилформамид является предпочтительным, при температуре реакционной смеси от комнатной температуры до 100 С, при этом предпочтительна температура 65 С, дает (8),соединение формулы I. Стадия Е. На схеме 3 соединения формулы (1) получают следующим образом. Стадия Н. Взаимодействие соединения общей структуры (4) с фторирующим реагентом дает соединения общей формулы 13. Несколько реагентов опубликовано для превращения спиртов в алкилфториды, например Caldwell, Charles G. et al. (Bioorg. Med. Chem. Lett., EN, 14, 5, 2004, 1265-1268) использует BAST. Другие примеры в литературе используют DAST для прямого превращения спиртов в алкилфториды. Взаимодействие гидроксильного производного (3) с трифторид-[бис-(2-метоксиэтил)амино]сера в реакционно-инертном растворителе, где метиленхлорид или тетрагидрофуран являются предпочтительными,при температуре реакционной смеси от примерно -78 С до комнатной температуры, дает (11), соединение формулы I. Стадия Е.(Смотри вышеприведенную стадию F). Иллюстративные соединения формулы I в соответствии с данным изобретением являются следующими:[3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутил]пирролидин-1-илметанон; диметиламид 3-(2,3-дихлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты; диметиламид 3-(2,3-дихлор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты; 3-[3-хлор-4R)-2-метилпирролидин-1-илметил)фенил]-3-гидроксициклобутилпирролидин-1 илметанон; этиламид 3-(3-хлор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты; этиламид 3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты; 3-[3-хлор-4R)-2-метилпирролидин-1-илметил)фенил]-3-фторциклобутилпирролидин-1-илметанон; 3-[3-хлор-4-R)-2-метилпирролидин-1-илметил)фенил]циклобутилпирролидин-1-илметанон; диметиламид 3-(2,3-дихлор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты; этиламид 3-фтор-3-[3-фтор-4S)-2-метилпирролидин-1-илметил)фенил]циклобутанкарбоновой кислоты; этиламид 3-фтор-3-[3-фтор-4R)-2-метилпирролидин-1-илметил)фенил]циклобутанкарбоновой кислоты; этиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты; изобутиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты и 3-азабицикло[3.2.2]нонан-3-ил(3-(3-фтор-4-(пирролидин-1-илметил)фенил)3-гидроксициклобутил)метанон. В примерах ниже представленные термины предназначены для того, чтобы иметь следующее общеизвестное значение: Растворители приобретали и использовали без очистки. Выходы рассчитывали по продукту, считающемуся гомогенным по данным тонкослойной хроматографии и ЯМР. Тонкослойную хроматографию выполняли на пластинках Merck Kieselgel 60 F 254, элюируя указанными растворителями, проявляли с помощью 254 нм УФ-лампы и окрашивали либо водным раствором KMnO4, либо этанольным раствором 12-молибдофосфорной кислоты. Флэш-колоночную хроматографию выполняли, если не оговорено иначе, с использованием предварительно упакованных Biotage и ISCO колонок, применяя указанный размер. Спектры ядерного магнитного резонанса (ЯМР) снимали на Unity 400 или 555 при 400 МГц или 500 МГц для 1 Н, соответственно, и 100 или 125 МГц для 13 С ЯМР соответственно. Химические сдвиги для протонного 1 Н ЯМР спектра представлены в частях на миллион относительно синглета CDCl3 при 7,24 м.д. Химические сдвиги для 13 С ЯМР спектра даны в м.д. нижнего поля относительно центральной линии триплета CDCl3 при 77,0 м.д. Анализы масс-спектров производили на APCI Gilson 215, микромассспектрометре ZMD (50% ацетонитрил/50% вода). ВЭЖХ выполняли согласно следующим методам.RF линзы (V): 0,5; источник температуры (С): 120; температура десольватации (С): 360; поток газовой десольватации (л/ч): 450; поток газового пучка (л/ч): 150; LM (низкомолекулярное) разрешение: 15; НМRF линзы (V): 0,5; источник температуры (С): 120; температура десольватации (С): 360; поток газовой десольватации (л/ч): 450; поток газового пучка (л/ч): 150; LM (низкомолекулярное) разрешение: 15; НМRF линзы (V): 0,5; источник температуры (С): 120; температура десольватации (С): 360; поток газовой десольватации (л/ч): 450; поток газового пучка (л/ч): 150; LM (низкомолекулярное) разрешение: 15; НМPDA (Waters 996) комплекты; начальная/конечная длина волны (нм): 200/600; разрешение: 1,2; частота отбора пробы: 1; каналы: TIC, 254 и 220 нм. Следующие промежуточные соединения могут быть получены по приведенным методикам. Промежуточное соединение 1. 1-(2,3-Дихлорбензил)пирролидин.NaHB(OAc)3 (15,1 г, 0,0714 ммоль) добавляли при интенсивном перемешивании порциями к раствору 2,3-дихлорбензальдегида (10 г, 0,057 ммоль) и пирролидина (5,97 мл, 0,0714 ммоль) в CH2Cl2(200 мл). Реакционную смесь интенсивно перемешивали в течение ночи. Затем добавляли 5 н. NaOH(50 мл) и слои разделяли. Продукт экстрагировали из водного слоя с помощью CH2Cl2 (250 мл). Объединенные экстракты промывали 5 н. NaOH (50 мл), водой, насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали. Остаток перегоняли в вакууме, получая указанное в заголовке соединение (10,5 г, 90%) в виде неокрашенной жидкости (т.кип. 80-84 С/0,5 мм Hg). ЖХ/МС данные: 229,9,230,9, 231,9 (M+Н) (вычислено для C11H13Cl2N 230,14). 2 Н ЯМР данные: (DMSO-d6):7,52 (дд, 1 Н, J1=1,5 Гц, J2=7,8 Гц), 7,46 (дд, 1 Н, J1=1,5 Гц, J2=7,8 Гц), 7,33 (т, 1 Н, J=7,8 Гц), 3,70 (с, 2H), 2,46-2,52 (м, 4 Н),1,66-1,75 (м, 4 Н). Пример 1. 3-[2,3-Дихлор-4-(пирролидин-1-илметил)фенил]-3-гидрокси-N,N-диметилциклобутанкарбоксамид. 1,3 М раствор втор-BuLi в циклогексане (3,7 мл, 4,8 ммоль) добавляли на протяжении 5 мин к раствору промежуточного соединения 1, 1-(2,3-дихлорбензил)пирролидина (1,0 г, 4,4 ммоль) и TMEDA(0,73 мл, 4,8 ммоль) в абсолютном ТГФ (10 мл) в токе аргона при температуре от -90 до -100 С. Реакционную смесь перемешивали при температуре от -85 до -90 С в течение 30 мин. Затем раствор 3-оксо- 13013602 циклобутанкарбоновой кислоты (250 мг, 2,2 ммоль) (J. Org. Chem., 1988, 53, 3841 и J. Org. Chem., 1996,61, 2174) в ТГФ (2 мл) добавляли по каплям на протяжении 2 мин при -100 С. Смесь затем нагревали до 0 С в течение 30 мин и упаривали досуха. Остаток растворяли в ДМФА (10 мл) и добавляли гидрохлорид диметиламина (410 мг, 5,0 ммоль). Затем порциями добавляли ВОР (1,3 г, 3,0 ммоль) при охлаждении на водяной бане. Реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Исчезновение исходной гидроксикислоты контролировали с помощью ЖХ/МС. Реакционную массу упаривали досуха при 1 мм Hg. Добавляли воду (10 мл), Et2O (15 мл) и насыщенный раствор K2CO3 (5 мл). Слои разделяли и водный слой экстрагировали Et2O (220 мл). Объединенный органический слой сушили надNa2SO4 и выпаривали. Остаток очищали хроматографией (30 мл силикагеля 63/100 мкм, CHCl3/МеОН 100:090:10). Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,30 г, 37%). ЖХ/МС данные: 371,0, 372,0, 373,0HCl, простой эфир. В 8 мл закрывающийся сосуд помещали 3-[2,3-дихлор-4-(пирролидин-1 илметил)фенил]-3-гидрокси-N,N-диметилциклобутанкарбоксамид (60 мг, 0,161 ммоль) и 0,5 мл МеОН. Затем добавляли 0,2 мл 2 М HCl в простом эфире, упаривали и сушили, получая масло, которое повторно растворяли в 1 мл DCM, упаривали и сушили с получением 62 мг белой гигроскопичной твердой HCl соли. ЖХМС (М+Н): 371,1; 1H ЯМР (300 МГц, ДМСО-d6):10,57 (ушир.с, 1 Н), 7,80 (д, J=8,1 Гц, 1 Н),7,73 (д, J=8,2 Гц, 1 Н), 4,57 (д, J=5,64 Гц, 2 Н), 3,50-3,70 (м, 3 Н), 3,40-3,50 (м, 3 Н), 2,90-2,97 (м, 2 Н), 2,86 (с,3 Н), 2,83 (с, 3 Н), 2,69-2,75 (м, 1 Н), 2,03-2,07 (м, 2 Н), 1,80-1,94 (м, 2 Н). Промежуточное соединение 2. 3-[2,3-Дихлор-4-(пирролидин-1-илметил)фенил]-N,N-диметилциклобут-2-ен-1-карбоксамид, трифторацетат. Раствор 3-[2,3-дихлор-4-(пирролидин-1-илметил)фенил]-3-гидрокси-N,N-диметилциклобутанкарбоксамида (250 мг, 0,673 ммоль) и TFA (1,04 мл, 13,5 ммоль) в 5 мл DCE кипятили с обратным холодильником в аргоне в течение 6 ч, затем добавляли дополнительное количество TFA (1,04 мл,13,5 ммоль) и смесь кипятили с обратным холодильником в течение 20 ч. Смесь упаривали досуха. Согласно ЖХМС данным реакционная смесь содержала до 70% указанного в заголовке соединения (353,354, 355 (М+Н) (вычислено для C18H22Cl2N2O 353,29. Смесь использовали на следующей стадии без дополнительной очистки. Пример 2. транс-3-[2,3-Дихлор-4-(пирролидин-1-илметил)фенил]-N,N-диметилциклобутанкарбоксамид, гидрохлорид. К раствору промежуточного соединения 2, трифторацетату 3-[2,3-дихлор-4-(пирролидин-1-илметил)фенил]-N,N-диметилциклобут-2-ен-1-карбоксамида (0,673 ммоль) в 5 мл этанола добавляли хлортрис(трифенилфосфин)родий(I) (63 мг, 0,0673 ммоль). Смесь гидрировали (40 фунт/кв.дюйм Н 2, 50 С) в течение 3 ч; реакцию контролировали с помощью ЖХМС. Смесь упаривали досуха, затем к остатку добавляли 5 мл 1 н. HCl и раствор экстрагировали этилацетатом (25 мл), органические слои отбрасывали. 10 N NaOH (1 мл) добавляли к водному слою и водный раствор экстрагировали этилацетатом (35 мл). Органический слой сушили и выпаривали в вакууме. Остаток очищали хроматографией (SiO2 63/100 мкм,10 г, CHCl3/гексан 80:20100:0, CHCl3/МеОН 100:090:10). Фракции, содержащие продукт, выпаривали. Остаток растворяли в 2 мл простого эфира и к раствору добавляли 0,1 мл смеси 4 н. HCl/диоксан при перемешивании. Смесь упаривали, остаток сушили в вакууме с получением указанного в заголовке соединения (74 мг, 28%) в виде белого твердого вещества. ЖХМС данные: 355, 356 и 357 (M+Н)+ (вычислено для C18H24Cl2N2O 355,31). 1H ЯМР данные (CD3OD):7,69 (д, 1 Н, J=8,1 Гц), 7,58 (д, 1 Н, J=8,1 Гц),4,62 (с, 2 Н), 3,88-3,98 (м, 1 Н), 3,54-3,63 (м, 2 Н), 3,35-3,45 (м, 1 Н), 3,25-3,34 (м, 2 Н+МеОН), 2,99 (с, 6 Н),2,71-2,79 (м, 2 Н), 2,42-2,52 (м, 2 Н), 2,16-2,27 (м, 2 Н), 1,98-2,12 (м, 2 Н). Пример 3. 3-[2,3-Дихлор-4-(пирролидин-1-илметил)фенил]-3-фтор-N,N-диметилциклобутанкарбоксамид, гидрохлорид. В 8-мл закрывающийся сосуд, снабженный магнитной стержневой мешалкой и мембранной крышкой, помещали деоксофтор (Aldrich, 85,5 мг, 0,387 ммоль) и 3 мл безводного DCM в атмосфере азота. Затем смесь охлаждали до -75 С и к ней добавляли раствор примера 1,3-[2,3-дихлор-4-(пирролидин-1 илметил)фенил]-3-гидрокси-N,N-диметилциклобутанкарбоксамид (130 мг, 0,350 ммоль) в 2 мл безводного DCM. Смесь перемешивали в течение 1 ч при -75 С, затем брали пробу для ЖХМС, которая показала 60% превращение. Затем добавляли деоксофтор (Aldrich, 85,5 мг, 0,387 ммоль), перемешивали в течение 10 мин при -75 С, нагревали до 0 С и гасили насыщенным Na2CO3 (2 мл). ЖХМС показывала полное превращение. Затем добавляли 1 мл 2 н. NaOH и DCM слой отделяли, сушили над Na2SO4 и выпаривали. Сырое масло очищали на колонке (от DCM 99%, NH4OH 1% до DCM 98%, МеОН 1%, NH4OH 1%,Rf=0,51 в DCM 99%, NH4OH 1%) с получением 117 мг (90%) продукта в виде неокрашенного масла. Данный продукт растворяли в 0,5 мл МеОН, затем к раствору добавляли 0,3 мл 2 М HCl в простом эфире, выпаривали и сушили, получая масло, которое снова растворяли в 1 мл DCM, упаривали и сушили с получением указанного в заголовке соединения (118 мг) в виде белого гигроскопичного твердого веще- 14013602 ства, HCl соли. ЖХМС (М+Н): 373,3; 1H ЯМР (300 МГц, ДМСО-d6):10,27 (ушир.с, 1 Н), 7,81 (д, J=7,71 Гц, 1 Н), 7,65 (дд, J1=8,1 Гц, J2=2,07 Гц, 1 Н), 4,59 (д, J=5,64 Гц, 2 Н), 3,62-3,71 (м, 6 Н), 3,45-3,50 (м, 2 Н),2,95 (с, 3 Н), 2,85-2,88 (м, 1 Н), 2,80 (с, 3 Н), 2,00-2,10 (м, 2 Н), 1,80-1,91 (м, 2 Н). Промежуточное соединение 3. 4-Бром-1-(бромметил)-2-хлорбензол. 4-Бром-2-хлор-1-метилбензол (CAS 89794-02-5, 30 г, 0,15 моль) и N-бромсукцинимид (26 г, 0,15 моль) смешивали в CCl4 (300 мл). Азо-бис-(2-метилпропионитрил) (0,3 г) добавляли порциями при интенсивном перемешивании и кипячении с обратным холодильником. Смесь кипятили с обратным холодильником в течение 30 мин и охлаждали. Осадок отфильтровывали и отбрасывали. Фильтрат выпаривали. Остаток перегоняли при 1 мм Hg, т.кип.75 С, получая указанное в заголовке соединение (28 г, 65%). 1 Н ЯМР данные (CDCl3): 57,57 (д, J=1,9 Гц, 1 Н ArH), 7,39 (дд, 1 Н, J1=1,9 Гц, J2=8,1 Гц, ArH), 7,31 (д, 1 Н,J=1,9 Гц, ArH), 4,53 (с, 2 Н, ArCH2). Промежуточное соединение 4. (2R)-1-(4-Бром-2-хлорбензил)-2-метилпирролидин. Промежуточное соединение 3, 4-бром-1-(бромметил)-2-хлорбензол (15,4 г, 55 ммоль) добавляли к смеси (2R)-2-метилпирролидина HBr (9,0 г, 55 ммоль), карбоната калия (18 г, 130 ммоль) и 150 мл диметилформамида при охлаждении льдом. Смеси давали нагреться до комнатной температуры и перемешивание продолжали в течение ночи. Смесь упаривали. Добавляли воду (4 00 мл) с последующим добавлением 5 M NaHSO4 для достижения рН 2. Органический слой отделяли. Водную фазу экстрагировалиEt2O (2200 мл). Органические слои отбрасывали. Водную фракцию подщелачивали с помощью K2CO3 до рН 12 и подвергали экстракции Et2O (2300 мл). Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 (100 г) и выпаривали в вакууме. Остаток перегоняли при 1 мм Hg, т.кип. 95 С, получая указанное в заголовке соединение (12,25 г, 79%). ЖХ/МС данные: 289,9 и 287,9 (M)+ (вычислено для C12H15BrClN 288,6). 1H ЯМР данные (ДМСО-d6):7,66 (д, 1 Н, J=1,9 Гц, Ar-Н); 7,52 (дд, 1 Н, J1=1,9 Гц, J2=8,0 Гц, Ar-Н), 7,43 (д, 1 Н, J=8,1 Гц, Ar-Н), 3,91 (д, 1 Н, J=14,4 Гц), 2,28 (д, 2 Н,J=8,5 Гц); 2,78-2,85 (м, 1 Н); 2,42-2,49 (м, 1 Н); 2,11 (дд, 1 Н, J1=8,8 Гц, J2=17,6 Гц); 1,87-1,97 (м, 1 Н); 1,571,67 (м, 2 Н); 1,27-1,39 (м, 1 Н); 1,08 (д, 3 Н, J=5,9 Гц). Промежуточное соединение 5. Пирролидин гидрохлорид. 4 н. HCl/диоксан (70,5 мл) добавляли к раствору пирролидина (20 г, 0,28 моль) в диоксане (20 мл). Реакционную смесь упаривали. Остаток перекристаллизовывали из Et2O, отделяли фильтрованием, промывали простым эфиром и сушили, получая указанное в заголовке соединение (28,5 г, 96%) в виде белых кристаллов. 1 Н ЯМР данные (ДМСО-d6):9,40 (ушир.с, 2H, NH+); 3,00-3,13 (м, 4 Н); 1,77-1,85 (м, 4H). Пример 4. 1-(3-Хлор-4-[(2R)-2-метилпирролидин-1-ил]метилфенил)-3-(пирролидин-1-илкарбонил)циклобутанол. 2,7 М раствор н-BuLi в гептане (3,6 мл, 9,6 ммоль) добавляли в течение 5 мин к раствору промежуточного соединения 4, (2R)-1-(4-бром-2-хлорбензил)-2-метилпирролидина (2,52 г, 8,8 ммоль) в абсолютном ТГФ (20 мл) в токе аргона при температуре от -78 до -80 С. Реакционную смесь перемешивали при температуре от -78 до -80 С в течение 15 мин. Затем раствор 3-оксоциклобутанкарбоновой кислоты(500 мг, 4,4 ммоль) в абсолютном ТГФ (4 мл) добавляли по каплям на протяжении 5 мин при -80 С. Смесь нагревали до 0 С в течение 1 ч и упаривали досуха. Остаток растворяли в ДМФА (10 мл), добавляли промежуточное соединение 5, пирролидин HCl (520 мг, 4,8 ммоль). Затем порциями добавляли ВОР(2,2 г, 4,8 ммоль) при охлаждении на бане со льдом. Реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Исчезновение исходной гидроксикислоты контролировали с помощью ЖХ/МС. Реакционную массу упаривали досуха при 1 мм Hg. Добавляли воду (100 мл), EtOAc (50 мл) и насыщенный раствор K2CO3 (до рН 10). Слои разделяли и водный слой экстрагировали EtOAc (250 мл). Объединенный органический слой промывали водой (50 мл), насыщенным солевым раствором, сушили над Na2SO4 и выпаривали. Остаток очищали хроматографией (60 мл силикагеля 63/100 мкм, гексан/CHCl3 20:800:100, затем CHCl3/MeOH 100:090:10). Фракции, содержащие продукт, собирали и концентрировали с получением указанного в заголовке соединения (1,03 г, 63%). ЖХ/МС данные: 377,2 и 379,2 (М)+ (вычислено для C21H29ClN2O2 376,93). 1H ЯМР данные:7,51 (с, 1 Н, Ar-Н); 7,42-7,49 (м, 2 Н,Ar-Н), 5,75 (с, 1 Н, ОН); 3,96 (д, 1 Н, J=13,7 Гц), 3,25-3,35 (м, 1 Н+Н 2 О); 2,78-2,90 (м, 2 Н); 2,53-2,60 (м, 2 Н); 2,43-2,52 (м, 1 Н+ДМСО); 2,06-2,16 (м, 1 Н); 1,88-1,97 (м, 1 Н); 1,80-1,87 (м, 2 Н); 1,72-1,79 (м, 2 Н); 1,571,67 (м, 2 Н); 1,29-1,40 (м, 1 Н); 1,11 (д, 3 Н, J=5,8 Гц, СН 3). Промежуточное соединение 6. (2R)-1-2-Хлор-4-[3-(пирролидин-1-илкарбонил)циклобут-1-ен-1 ил]бензил-2-метилпирролидин, трифторацетат. Раствор соединения примера 4, 1-(3-хлор-4-[(2R)-2-метилпирролидин-1-ил]метилфенил)-3(пирролидин-1-илкарбонил)циклобутанол (400 мг, 1,0 6 ммоль) и TFA (1,64 мл, 21,2 ммоль) в 4 мл DCE кипятили с обратным холодильником в аргоне в течение 6 ч, затем добавляли дополнительное количество TFA (1,64 мл, 21,2 ммоль) и смесь кипятили с обратным холодильником в течение. 24 ч. Смесь упаривали досуха. Согласно данным ЖХМС реакционная смесь содержала до 80% указанного в заголовке соединения (359, 360, 361 (М+Н) (вычислено для C21H27ClN2O 358,92. Полученную смесь использовали на следующей стадии без дополнительной очистки. Пример 5. (2R)-1-2-Хлор-4-[транс-3-(пирролидин-1-илкарбонил)циклобутил]бензил-2-метилпир- 15013602 ролидин, гидрохлорид. К раствору промежуточного соединения 6, трифторацетату (2R)-1-2-хлор-4-[3-(пирролидин-1 илкарбонил)циклобут-1-ен-1-ил]бензил-2-метилпирролидина (1,06 ммоль) в 5 мл этанола добавляли хлортрис(трифенилфосфин)родий(I) (100 мг, 0,106 ммоль). Смесь гидрировали (40 фунт/кв.дюйм Н 2,50 С) в течение 3 ч. Реакцию контролировали с помощью ЖХМС. Смесь упаривали досуха, затем к остатку добавляли 5 мл 1 н. HCl и раствор экстрагировали этилацетатом (25 мл), органические слои отбрасывали. 10 н. NaOH (1 мл) добавляли к водному слою и водный раствор экстрагировали этилацетатом(35 мл). Органический слой сушили и выпаривали в вакууме. Остаток очищали хроматографией (SiO2 63/100 мкм, 10 г, CHCl3/гексан 80:20100:0, CHCl3/МеОН 100:090:10). Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении. Остаток растворяли в 2 мл простого эфира и к раствору добавляли 0,1 мл смеси 4 н. HCl/диоксан при перемешивании. Растворитель выпаривали,остаток сушили в вакууме с получением HCl соли указанного в заголовке соединения (80 мг, 20%) в виде темно-желтого аморфного вещества. ЖХМС данные: 361 и 363 (М+Н)+ (вычислено для C21H29ClN2O 360,93). 1H ЯМР данные (CD3OD):7,63 (д, 1 Н, J=7,5 Гц), 7,50 (с, 1 Н), 7,39 (д, 1 Н, J=7,5 Гц), 4,75 (д, 1 Н,J=13,3 Гц), 4,31 (д, 1 Н, J=13,3 Гц), 3,63-3,77 (м, 2 Н), 3,34-3,52 (м, 7 Н), 2,64-2,75 (м, 2 Н), 2,33-2,49 (м, 3 Н),1,72-2,20 (м, 7 Н), 1,51 (д, 3 Н, J=6,3 Гц). Пример 6.(2R)-1-2-Хлор-4-[цис-1-фтор-3-(пирролидин-1-илкарбонил)циклобутил]бензил-2 метилпирролидин, HCl. Раствор соединения примера 4, 1-(3-хлор-4-[(2R)-2-метилпирролидин-1-ил]метилфенил)-3(пирролидин-1-илкарбонил)циклобутанол (250 мг, 0,66 ммоль) в 2 мл CH2Cl2 добавляли в течение 5 мин к раствору деоксофтора (282 мг, 1,27 ммоль) в CH2Cl2 (1 мл) в токе аргона при температуре от -78 до-80 С. Реакционную смесь перемешивали при температуре от -78 до -80 С в течение 1 ч. Смеси давали нагреться до 0 С. Через 2 ч добавляли воду (50 мл) с последующим добавлением 10 н. NaOH, рН 10. Слои отделяли и водный слой экстрагировали CH2Cl2 (230 мл). Объединенный органический слой промывали насыщенным солевым раствором, сушили над Na2SO4 и выпаривали. Остаток очищали хроматографией (10 мл силикагеля 63/100 мкм, гексан/CH2Cl2 20:800:100, затем CH2Cl2/изо-PrOH 100:095:5). Фракции, содержащие продукт, собирали и концентрировали. Остаток растворяли в простом эфире (3 мл) и к раствору затем добавляли смесь 4 н. HCl/диоксан (0,125 мл), упаривали и сушили в вакууме с получением HCl соли указанного в заголовке соединения (158 мг, 57%) в виде желтого масла. ЖХ/МС данные: 379,2 и 381,2 (М+Н)+ (вычислено для C21H28ClFN2O 378,92). 1H ЯМР данныеCDI (8,1 г, 50 ммоль) добавляли к раствору 3-оксоциклобутанкарбоновой кислоты (5 г, 44 ммоль) при интенсивном перемешивании и охлаждении на бане со льдом при 0 С в течение 5 мин. Реакционную смесь нагревали до 25 С, перемешивали при данной температуре в течение 1 ч, охлаждали и добавляли морфолин (4,5 мл, 50 ммоль). Реакционную смесь нагревали до 25 С, перемешивали при данной температуре в течение 3 ч и упаривали в вакууме. Остаток хроматографировали на SiO2 (600 мл,40-63 мкм, CCl4CHCl35% изо-PrOH), получая соединение 4 (6,5 г, 81%) в виде неокрашенного масла, которое затвердевало в холодильнике. ЖХ МС-данные: М+ 184,1 и 185,1 (вычислено для-78 С (баня ацетон/сухой лед) медленно добавляли по стенке колбы раствор н-BuLi (2,6 мл, 6,5 ммоль,2,5 М ТГФ). Через 15 мин медленно добавляли раствор промежуточного соединения 7, 3-(морфолин-4 илкарбонил)циклобутанона (1,0 г, 5,4 ммоль, в 7 мл ТГФ), предварительно охлажденный до -78 С. Через 30 мин реакцию гасили охлаждением с 1 н. HCl (20 мл). Данную смесь разбавляли EtOAc, затем слои отделяли и органический слой отбрасывали. Водный слой подщелачивали 1 N NaOH и экстрагировали смесью CHCl3/изо-PrOH (3:1). Органический слой сушили над MgSO4, фильтровали и концентрировали, получая желтое масло. Данный продукт очищали флэш-хроматографией с использованием 40 г ISCO колонки, элюируя градиентом из 3, 5, 10, 20, 30% МеОН/CHCl3 с 0,1% NH4OH. Фракцию, содержащую продукт, собирали и концентрировали в вакууме при пониженном давлении, получая указанное в заголовке соединение (379 мг, 20% выход): Rf=0,3 (30% МеОН/CH2Cl2); LRMS m/z вычислено для- 16013602 и ацетонитрил (2750 мл). Смесь охлаждали на водяной бане до 10 С, затем твердый 4-бром-2 фторбензилбромид (MATRIX, Cat. : 1707, 375 г, 1,4 моль) добавляли 6 порциями, поддерживая температуру ниже 20 С. Смесь перемешивали при к.т. в течение 4 ч. Растворитель удаляли в вакууме. Затем добавляли 2 л насыщенного водного Na2CO3 и 500 мл воды и смесь экстрагировали с помощью DCM (3700 мл). Экстракт сушили над Na2SO4 и выпаривали. Полученное светло-желтое масло перегоняли в вакууме (1 мм, т.кип. 125 С), получая 324,5 г (90%) продукта в виде неокрашенного масла. ЖХМСH ЯМР (300 МГц, CDCl3):7,19-7,31 (м, 3 Н), 3,63 (м, 2 Н), 2,53 (м, 4 Н), 1,78 (м, 4H). Промежуточное соединение 9. 3-[3-Фтор-4-(пирролидин-1-илметил)фенил]-3-гидроксициклобутанкарбоновая кислота. В 2-л 3-горлую RB колбу, снабженную механической мешалкой, капельной воронкой, термометром и вводом для газообразного азота, помещали промежуточное соединение 8, 1-(4-бром-2-фторбензил)пирролидин (69,86 г, 0,27 моль) и 700 мл безводного ТГФ. Систему наполняли струей азота и охлаждали до 85 С жидким азотом на бане эфир/МеОН (1:1). Затем H-BuLi (10 М в гексане, 30 мл, 0,298 моль) добавляли по каплям через капельную воронку при Т -80 С. Смесь перемешивали при данной температуре в течение дополнительных 15 мин, затем раствор 3-оксоциклобутанкарбоновой кислоты (высушенной в вакууме в течение 2 дней, 15,4 г, 0,135 моль) в 300 мл безводного ТГФ добавляли по каплям через капельную воронку, поддерживая Т -80 С. Смеси давали нагреться до к.т. и упаривали. Остаток смешивали с 500 мл воды и промывали простым эфиром (2300 мл). Затем водный раствор подкисляли до рН 1 концентрированной HCl и промывали простым эфиром (2300 мл). Затем водный раствор нейтрализовали до рН 6-5 с помощью NaOH и упаривали три раза совместно с изо-PrOH (300 мл каждый раз). Затем смесь упаривали совместно с ТГФ (200 мл) и сушили, получая смолистый остаток, содержащий продукт с неорганическими солями. ЖХМС (M+Н): 294,4. Данный продукт использовали непосредственно на следующей стадии. Пример 8. N-[2-Фтор-4-[1-гидрокси-3-(пирролидин-1-илкарбонил)циклобутил]бензилпирролидин. В 2-л 3-горлую RB колбу, снабженную механической мешалкой, капельной воронкой, термометром и вводом для газообразного азота, помещали промежуточное соединение 9, 3-[3-фтор-4-(пирролидин-1 илметил)фенил]-3-гидроксициклобутанкарбоновую кислоту (0,135 моль, сырой продукт из вышеприведенного промежуточного соединения), 500 мл безводного ТГФ и DIEA (34,8 г, 0,27 моль). Первоначально нерастворимую смесь перемешивали в течение 1,5 ч до образования однородной суспензии. Затем добавляли 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфоринан-2,4,6-триоксид (50% раствор в EtOAc,104,5 мл, 0,164 моль) и перемешивали в течение 5 мин. (Указание: наблюдали экзотермический эффект,достигаемый 45-50 С). Затем добавляли пирролидин (28,2 мл, 24,0 г, 0,337 моль). (Указание: наблюдали более сильный экзотермический эффект, достигаемый 70-80 С). Смесь перемешивали при к.т. в течение 12 ч, затем ее упаривали. Остаток смешивали с 500 мл насыщенного Na2CO3 и 200 мл воды. Смесь экстрагировали DCM (5300 мл), экстракт сушили над Na2SO4, выпаривали и сушили, получая 33,4 г (71% по двум стадиям) чистого указанного в заголовке соединения (ЖХМС (М+Н): 347,1). 1 Н ЯМР (300 МГц,CDCl3):7,37 (т, J=7,37 Гц, 1 Н), 7,17-7,26 (м, 2 Н), 3,68 (с, 2 Н), 3,53 (т, J=6,78 Гц, 2 Н), 3,44 (т, J=6,58 Гц,2 Н), 3,03-3,14 (м, 1 Н), 2,79-2,87 (м, 2 Н), 2,5-2,6 (м, 6 Н), 1,87-2,00 (м, 4 Н), 1,75-1,80 (м, 4 Н). Пример 9. N-2-Фтор-4-[1-фтор-3-(пирролидин-1-илкарбонил)циклобутил]бензилпирролидин гидрохлорид. В 2-л 3-горлую RB колбу, снабженную механической мешалкой, капельной воронкой, термометром и вводом для газообразного азота, помещали соединение примера 8, N-2-фтор-4-[1-гидрокси-3(пирролидин-1-илкарбонил)циклобутил]бензилпирролидин (43,0 г, 0,124 моль) и 1 л безводного DCM в атмосфере азота. Смесь охлаждали до -75 С на бане сухой лед/ацетон, затем к ней добавляли по каплям деоксофтор (Aldrich, 33,0 г, 27,5 мл, 0,149 моль). Смесь нагревали до 0 С и перемешивали при данной температуре в течение 30 мин. Затем смесь гасили 350 мл насыщенного Na2CO3 и экстрагировали с помощью DCM (3300 мл). Экстракт сушили над Na2SO4 и выпаривали. Полученное сырое масло очищали на колонке (силикагель, простой эфир 60%, гексан 30%, МеОН 5%, Et3N 5%, Rf=0,37 в простом эфире 60%, гексане 30%, МеОН 5%, NH4OH 5%) с получением 29,0 г (67%) указанного в заголовке соединения. 1 Н ЯМР (300 МГц, CDCl3):7,39 (т, J=7,64 Гц, 1 Н), 7,21 (д, J=7,92 Гц, 1 Н), 7,14 (д, J=10,9 Гц, 1 Н), 3,67(с, 2 Н), 3,40-3,61 (м, 5 Н), 2,66-3,00 (м, 4 Н), 2,50-2,55 (м, 4 Н), 1,80-2,00 (м, 4 Н), 1,75-1,80 (м, 4 Н). Свободное основание продукта (29,0 г) растворяли в 500 мл простого эфира, затем к данному раствору добавляли по каплям 83 мл смеси 2 М HCl/эфир, перемешивали в течение 30 мин, фильтровали и сушили в вакууме, получая 32,5 г гидрохлоридной соли (ЯМР: содержит приблизительно 4,5% цис-изомера). Затем данный продукт растворяли в 200 мл воды, подщелачивали с помощью NaOH до рН 10, экстрагировали DCM (3300 мл), упаривали и очищали снова на колонке с получением 25,0 г свободного основания продукта (ЯМР: содержит приблизительно 3,5% цис-изомера). Затем эти 25 г свободного основания превращали в HCl соль, как указано выше. Соль HCl перекристаллизовывали растворением в смеси 250 мл EtOAc/50 мл МеОН при 60 С, охлаждением до к.т. и перемешиванием в течение 2 ч. Осадок собирали фильтрованием и сушили с получением 8,0 г первой порции (ЯМР: содержит при- 17013602 близительно 3% цис-изомера). Оставшуюся маточную жидкость концентрировали в вакууме до 100 мл,затем к остатку добавляли 100 мл EtOAc и перемешивали в течение 30 мин. Осадок фильтровали, объединяли с первой порцией и сушили в вакууме в течение 2 суток, получая 18,86 г соли HCl (ЯМР: содержит приблизительно 3% цис-изомера). (ЖХМС (M+Н): 349,5). 1 Н ЯМР (300 МГц, CDCl3):12,66(237 мл, 0,37 моль, 50 мас.%, EtOAc). Через 1 ч реакцию гасили насыщенным раствором NaHCO3 и экстрагировали EtOAc и CH2Cl2. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали. Очистку данного продукта проводили флэш-колоночной хроматографией с применениемBiotage 75 л колонки, элюируя градиентом из 2-50% EtOAc/гексанов. Фракции, содержащие продукт,собирали и концентрировали с получением указанного в заголовке соединения (52 г, 68% выход) в виде белого твердого вещества: Rf=0,23 (40% EtOAc/гексаны); LRMS m/z вычислено для C11H10BrClFNO,306,6, найдено, 306, 308, 310 (М+1) APCI; 1H ЯМР (300 МГц, CDCl3):7,53 (д, J=6,2 Гц, 1,Н), 7,02 (д,J=7,9 Гц, 1 Н), 3,54 (ист. т, J=6,6 Гц, 2 Н), 3,13 (ист. т, J=6,6 Гц, 2 Н), 1,92-1,83 (м, 4 Н); 100 МГц 13 С ЯМР(CDCl3) 164,5, 158,1 (д, JC-F=249,5 Гц), 138,2, 134,3, 126,0, 115,5 (д, JC-F=25,5 Гц), 110,3 (д, JC-F=22,5 Гц),47,0, 45,8, 26,0, 24,6. Промежуточное соединение 11. 1-(4-Бром-2-хлор-5-фторбензил)пирролидин. К промежуточному соединению 10, 1-(4-бром-2-хлор-5-фторбензоил)пирролидину (48,0 г, 156,5 ммоль) в ТГФ (200 мл) при к.т. медленно добавляли раствор комплекса ВН 3. ТГФ (400 мл, 400 ммоль, 1 M ТГФ). Полученную реакционную смесь нагревали при 65 С (масляная баня) в течение 16 ч и затем реакционную смесь охлаждали до к.т. и медленно гасили с помощью МеОН (добавление по каплям). Реакционную смесь нагревали при кипении с обратным холодильником в течение 2 ч, охлаждали до к.т. и концентрировали при пониженном давлении. Данный продукт переводили в EtOAc и затем медленно гасили с помощью 6 н. HCl, затем нейтрализовали водным NaOH (15%). Слои отделяли и водный слой снова экстрагировали EtOAc. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистку данного продукта проводили флэш-колоночной хроматографией с применением Biotage 75 л колонки, эюируя градиентом из 5, 10% МеОН/CH2Cl2. Фракции, содержащие продукт, собирали и концентрировали с получением указанного в заголовке соединения (43 г, 94% выход) в виде светло-желтого масла: Rf=0,6 (10% MeOH/CH2Cl2); LRMS m/z вычислено для C11H12BrClFN,292,6, найдено, 292, 294, 296 (М+1) APCI; 1 Н ЯМР (300 МГц, CDCl3):7,51 (д, J=6, 6 Гц, 1 Н), 7,33 (д,J=9,5 Гц, 1 Н), 3,66 (с, 2 Н), 2,59-2,55 (м, 4 Н), 1,82-1,79 (м, 4 Н); 100 МГц 13 С ЯМР (CDCl3)158,3 (д,JC-F=247,2 Гц), 139,3, 133,3, 128,9, 117,8 (д, JC-F=24,9 Гц), 107,3 (д, JC-F=22, 6 Гц), 56,7, 54,4, 23,9. Пример 10. Изобутиламид 3-(5-хлор-2-фтор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты. К промежуточному соединению 11, 1-(4-бром-2-хлор-5-фторбензил) пирролидину (4,0 г,13,7 ммоль) в ТГФ (34 мл) при -78 С (баня ацетон/сухой лед) добавляли раствор H-BuLi (5,5 мл, 13,7 ммоль, 2,5 М ТГФ). Через 15 мин добавляли через канюлю предварительно охлажденный (-78 С) раствор 3-оксоциклобутанкарбоновой кислоты (0,78 г, 6,8 ммоль, в 5 мл ТГФ). Реакционной смеси давали медленно нагреваться при к.т. на протяжении ночи. По прошествии приблизительно 16 ч добавляли изобутиламин (1,4 мл, 13,7 ммоль), затем 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфоринан-2,4,6-триоксид(50% раствор в EtOAc, 6,6 мл, 10,2 ммоль). Через 1 ч реакционную смесь разбавляли EtOAc и затем гасили с помощью 1 н. NaOH. Слои отделяли и водный слой снова экстрагировали EtOAc. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистку данного продукта проводили флэш-колоночной хроматографией с применением 120 г ISCO колонки, эюируя 5% MeOH/CH2Cl2 с 0,1% NH4OH. Фракции, содержащие продукт, собирали и концентрировали с получением указанного в заголовке соединения (400 мг, 15% выход) в виде желтого пенистого вещества: Rf=0,23 (10% MeOH/CH2Cl2); LRMS m/z вычислено для C20H28ClFN2O2, 382,9, найдено, 383,385 (М+Н) APCI; 1 Н ЯМР (300 МГц, CDCl3):7,37 (д, J=7,0 Гц, 1 Н), 7,20 (д, J=11,6 Гц, 1 Н), 6,25-6,22(ушир.м, 2 Н), 3,68 (с, 2 Н), 3,09-2,84 (м, 5 Н), 2,57 (ист. ушир.с, 4 Н), 2,46-2,43 (м, 2 Н), 1,79-1,70 (м, 5 Н); 0,88 (д, J=6,6 Гц, 6 Н); 100 МГц 13 С ЯМР (CDCl3)177,5, 159,5 (д, JC-F=247,2), 138,3, 132,1, 128,2, 117,9 (д,JC-F=24,7 Гц), 73,2, 56,5, 54,3, 47,4, 40,1, 34,6, 28,7, 23,8, 20,3. Пример 11. Изобутиламид 3-(5-хлор-2-фтор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты. К 3 мл CH2Cl2 при -78 С (баня ацетон/сухой лед) добаляли BAST (251 мкл, 1,4 ммоль), затем раствор соединения примера 10, изобутиламида 3-(5-хлор-2-фтор-4-пирролидин-1-илметилфенил)-3 гидроксициклобутанкарбоновой кислоты (350 мг, 0,91 ммоль в 2 мл CH2Cl2). Через 1 ч реакцию гасили- 18013602 насыщенным раствором бикарбоната натрия и затем разбавляли с помощью EtOAc. Слои отделяли и водный слой снова экстрагировали EtOAc. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистку данного продукта проводили флэшхроматографией с применением 40 г ISCO колонки, элюируя 5% МеОН/CH2Cl2. Фракции, содержащие продукт, собирали и концентрировали с получением указанного в заголовке соединения как смеси изомеров (223 мг, 63% выход) в виде желтого масла: Rf=0,45 (10% МеОН/CH2Cl2). Моно соль HCl получали растворением указанного в заголовке соединения в EtOAc и добавлением 2 н. HCl эфирного раствора(1,2 экв.). Полученное твердое вещество перемешивали 2 ч и затем фильтровали и сушили при пониженном давлении с получением соли НС 1 указанного в заголовке соединения в виде желтого твердого вещества: LRMS m/z вычислено для C20H27ClF2N2O, 384,9, найдено, 386, 388 (М+Н) APCI; 1 Н ЯМР смеси изомеров, диагностические пики главного изомера (300 МГц, CD3OD):7,62 (дд, J=7,0, 1,6 Гц, 1 Н), 7,54 (д,J=11,2 Гц, 1 Н), 4,47 (с, 2 Н), 3,59-3,47 (м, 2 Н), 3,43 (ист. пент, J=7,3 Гц, 1 Н), 3,31-3,02 (м) при MeOH,3,01-2,77 (м, 6 Н), 2,24-2,20 (м, 2 Н), 2,06-2,00 (м, 2 Н), 1,78-1,71 (м, 1 Н), 0,89 (д, J=7,0 Гц, 6 Н). Пример 12. Этиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты. н-Бутиллитий (2,5 М/гексаны, 251 мл, 0,628 моль) добавляли по каплям на протяжении 30 мин к охлажденному до -78 С раствору 1-(4-бром-2-фторбензил)пирролидина (162,0 г, 0,63 моль) в ТГФ (1,8 л). После перемешивания при -78 С в течение 2 ч в реакционную смесь добавляли с помощью канюли охлажденный до -78 С раствор 3-оксоциклобутанкарбоновой кислоты (35,8 г, 0,31 моль) в ТГФ (400 мл) в течение 25 мин. Полученный темно-оранжевый раствор медленно нагревали при комнатной температуре на протяжении 16 ч. ЖХ/МС смеси показала промежуточную кислоту 294,2 (М+Н). Этиламин (2M в ТГФ, 315 мл, 0,630 моль) и Т 3 Р (50 мас.% в EtOAc, 224 мл, 0,376 моль) добавляли с 200 мл промывочного ТГФ. После перемешивания в течение 1 ч при комнатной температуре добавляли насыщенный NaHCO3(1000 мл), затем воду (500 мл). Фазы отделяли и водную фазу экстрагировали с помощью EtOAc(2500 мл). Объединенные органические фазы промывали насыщенным солевым раствором и сушили над MgSO4. Концентрирование приводило к 161,8 г оранжевого масла, которое разделяли на две порции и очищали SiO2 флэш-хроматографией (4"5,5 колонки, упакованные EtOAc). Каждую колонку промывали 3 л EtOAc для удаления продукта с более высоким Rf и затем массу требуемого продукта получали элюированием с помощью 3 л 25% MeOH/EtOAc. Концентрирование фракций, содержащих продукт, с обеих колонок давало 48,8 г (49% выход) этиламида 3-(3-фтор-4-пирролидин-1-илметилфенил)-3 гидроксициклобутанкарбоновой кислоты в виде вязкого светло-оранжевого масла, которое медленно кристаллизовалось до воскообразного твердого вещества при извлечении. 1 Н ЯМР (CDCl3)7,35 (т,J=7,9 Гц, 1 Н), 7,20-7,14 (м, 2 Н), 5,67 (ушир.с, 1 Н), 5,57 (ушир.с, 1 Н), 3,66 (д, J=1,3 Гц, 2 Н), 3,37-3,30 (м,2H), 2,84-2,70 (м, 3 Н), 2,53-2,44 (м, 6 Н), 1,83-1,70 (м, перекрывающийся с водой, 4 Н), 1,16 (т, J=7,3 Гц,3 Н); LRMS m/z вычислено для C18H25FN2O2 320,4, найдено, 321,3 (М+Н) APCI. Пример 13. Этиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты. К соединению примера 12, этиламиду 3-(3-фтор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты (17 г, 53,1 ммоль) в 200 мл DCE при к.т. добавляли TFA (80,7 мл, 1,1 моль) и затем реакционную смесь нагревали при 80 С (масляная баня). Через 15 ч реакционную смесь концентрировали до приблизительно 45 г и использовали без дополнительной очистки. Сырую соль TFA из вышеуказанной реакционной смеси разбавляли EtOH (500 мл), помещали в сосуд Парра, продували N2 и затем добавляли 10% Pd/уголь (2,5 г, 14 мас.%). Полученную реакционную смесь гидрировали с помощью Н 2 (45 фунт/кв.дюйм) при к.т. Через 1,5 ч реакционную смесь продували N2, затем фильтровали через целит (Celite) и концентрировали при пониженном давлении. Полученное масло разбавляли EtOAc и затем медленно гасили насыщенным раствором бикарбоната натрия. Слои отделяли и водный слой снова экстрагировали EtOAc. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистку данного продукта проводили перекристализацией. Сырое указанное в заголовке соединение обрабатывали минимальным количеством теплого EtOAc и оставляли охлаждаться до приблизительно 0 С (холодильник). Твердое вещество фильтровали, сушили при пониженном давлении, получая указанное в заголовке соединение (4 г, 24% выход) в виде белого твердого вещества: Rf=0,21 (10% МеОН/CH2Cl2); LRMS m/z вычислено для C18H25FN2O, 304,4, найдено, 305,3; 1 Н ЯМР (300 МГц, CDCl3):7,30 (ист. т, J=7,9 Гц, 1 Н), 6,98 (дд, J=7,9, 1,6 Гц, 1 Н), 6,92 (дд, J=12,0, 1,6 Гц, 1 Н), 5,36 (ушир.с, 1 Н), 3,67 (с, 2 Н), 3,42-3,26 (м, 3 Н), 2,94-2,85 (м, 1 Н), 2,57-2,50 (м, 6 Н), 2,42-2,33 (м,2 Н), 1,82-1,74 (м, 4H), 1,14 (т, J=7,5 Гц, 3 Н); структура подтверждена рентгеновской кристаллографией и была определена как цис. Пример 14. Этилметиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты. н-Бутиллитий (2,5 М/гексаны, 140 мл, 0,350 моль) добавляли по каплям по стенкам реакционной колбы на протяжении 25 мин к охлажденному до -78 С раствору промежуточного соединения 8, 1-(4 бром-2-фторбензил)пирролидина (90,0 г, 0,349 моль) в ТГФ (1 л). После перемешивания при -78 С в течение 2,5 ч в реакционную смесь добавляли с помощью канюли охлажденный до -78 С раствор 3-оксо- 19013602 циклобутанкарбоновой кислоты (19,9 г, 174,5 ммоль) в ТГФ (200 мл) в течение 15 мин. Полученный темно-оранжевый раствор медленно нагревали при комнатной температуре на протяжении 16 ч. ЖХ/МС смеси показала промежуточную кислоту 294,2 (М+Н). Этилметиламин (30 мл, 0,349 моль) и Т 3 Р(50 мас.% в EtOAc, 125 мл, 0,210 моль) добавляли с 200 мл промывочного ТГФ. После перемешивания в течение 1,5 ч при комнатной температуре добавляли насыщенный NaHCO3 (500 мл), затем воду (500 мл). Фазы отделяли и водную фазу экстрагировали с помощью EtOAc (700 мл). Объединенные органические фазы промывали насыщенным солевым раствором и сушили над MgSO4. Концентрирование приводило к 89,0 г оранжевого масла, которое очищали SiO2 флэш-хроматографией (4"7 колонка, упакованная EtOAc). Колонку промывали 4 л EtOAc для удаления продукта с более высоким Rf и затем массу требуемого продукта получали элюированием с помощью 4 л 25% MeOH/EtOAc. Концентрирование фракций, содержащих продукт, давало 35,15 г (60%) указанного в заголовке соединения, этилметиламида 3(3-фтор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты в виде вязкого светло-оранжевого масла, которое медленно кристаллизовалось до воскообразного твердого вещества при извлечении: ЯМР (CDCl3) 1:1 смесь ротамеров,7,35 (т, J=7,7 Гц, 1 Н), 7,23-7,15 (м, 2 Н), 5,08 и 4,84(м, 1 Н), 2,97 и 2,95 (синглет, 3 Н суммарный), 2,84-2,77 (м, 2 Н), 2,57-2,52 (м, 6 Н), 1,79-1,72 (м, 4 Н), 1,181,04 (м, 3 Н). Промежуточное соединение 12. N-Этил-3-(3-фтор-4-(пирролидин-1-илметил)фенил)-N-метилциклобут-2-енкарбоксамид, трифторацетатная соль. Этилметиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты (пример 14, 35,15 г, 105,1 ммоль) растворяли в смеси 1,2-дихлорэтана (1 л) и трифторуксусной кислоты (150 мл) и кипятили с обратным холодильником в течение 16 ч. Полученный темно-коричневый раствор охлаждали и концентрировали с получением коричневого масла (94,46 г) сырого указанного в заголовке соединения, трифторацетатной соли N-этил-3-(3-фтор-4-(пирролидин-1-илметил)фенил)-Nметилциклобут-2-енкарбоксамида, с остаточной TFA, которое использовали на следующей стадии без очистки. Пример 15. Этилметиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты. Сосуд для гидрирования промывали этанолом, продували азотом и загружали 50 мл этанола, 10% палладием на угле (10 г) и раствором неочищенного промежуточного соединения 12, трифторацетатной соли N-этил-3-(3-фтор-4-(пирролидин-1-илметил)фенил)-N-метилциклобут-2-енкарбоксамида (182,0 г) в этаноле (1,5 л). Данную смесь затем встряхивали в атмосфере водорода (45 фунт/кв.дюйм) при комнатной температуре в течение 1,5 ч, фильтровали через 2 пад диатомовой земли и промывали этанолом(500 мл). Фильтрат концентрировали, получая оранжевое масло, которое растворяли в EtOAc (500 мл) и промывали раствором K2CO3 (60 г) в воде (400 мл) и затем насыщенным солевым раствором (200 мл),сушили над MgSO4 и концентрировали с получением 66,26 г оранжевого масла. Данный продукт очищали флэш-хроматографией на 4"5,5 колонке с силикагелем (упакованная CH2Cl2), промыванием сначала 2,5 л CH2Cl2 и затем элюированием с помощью 3 л 5% МеОН/CH2Cl2. Фракции чистого продукта концентрировали с получением 41,75 г (58%) указанного в заголовке соединения 95% чистоты. Концентрирование менее очищенных фракций давало 9,98 г продукта 85-90% чистоты: Rf=0,17 (20%CHCl3, 1 Н), 6,98-6,94 (м, 1 Н), 6,92-6,88 (м, 1 Н), 3,62 (д, J=0,8 Гц, 2 Н), 3,42-3,14 (перекрывающиеся мультиплеты, 4 Н), 2,92 и 2,89 (синтлеты, 3 Н суммарные) 2,58-2,35 (м, 8 Н), 1,80-1,70 (м, 4 Н), 1,14 и 1,08 (триплеты, J=7,2 Гц, 3 Н суммарные). Более очищенный продукт (41,75 г, 131,11 ммоль) растворяли в EtOAc (1 л) и к раствору добавляли смесь 2 н. HCl/диэтилового эфира (80 мл, 160 ммоль) за 1 мин с интенсивным перемешиванием. Через 30 мин собирали светло-оранжевый слегка окрашенный осадок, промывали его EtOAc и сушили при продувании азота, получая соответствующую HCl соль (36,15 г). Данный продукт объединяли с другими порциями (39,72 г общая масса) и растворяли в смеси МеОН (30 мл) и EtOAc (50 мл) с интенсивным нагреванием. Затем к перемешиваемой смеси добавляли по каплям EtOAc (550 мл) на протяжении 15 мин. После дополнительного 15-минутного перемешивания при комнатной температуре твердые вещества фильтровали, промывали 200 мл EtOAc и сушили в атмосфере азота с получением 32,98 г гидрохлоридной соли указанного в заголовке соединения в виде белого кристаллического твердого вещества: т.пл. 196-196,5 С; 1 Н ЯМР (CDCl3) 1:1 смесь ротамеров,12,69 (ушир.с, 1 Н), 7,79 (т, J=7,9 Гц, 1H), 7,07-7,00- 20013602 Пример 16. Этиламид 3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты. Раствор соединения примера 12, этиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты (48,7 г, 152,0 ммоль) в CH2Cl2 (450 мл) добавляли по стенкам реакционной колбы в течение 50 мин к охлажденному до -78 С раствору трифторид-[бис-(2-метоксиэтил)амино]сера (42,0 мл, 227,8 ммоль) в CH2Cl2 (375 мл). После перемешивания в течение 2,5 ч при-78 С охлаждающую баню удаляли и смесь перемешивали в течение 16 ч при комнатной температуре. С перемешиванием порциями осторожно добавляли водный NaHCO3 до полного оседания пены. Затем добавляли K2CO3 для установления рН 8. Фазы отделяли и водную фазу экстрагировали двумя дополнительными порциями по 100 мл CH2Cl2. Органические фазы объединяли, сушили над MgSO4 и концентрировали с получением темного оранжево-коричневого масла (50,2 г). Данный сырой материал концентрировали на 100 г силикагеля и затем очищали флэш-хроматографией на 4"6 колонке с силикагелем с пропиткой EtOAc. Колонку элюировали 3 л EtOAc и 10% MeOH/EtOAc каждого. Самые очищенные фракции концентрировали с получением 20,82 г указанного в заголовке соединения в виде оранжевого окрашенного твердого вещества, GC/MS которого показала 94% чистоту с 6% соответствующего транс-изомера. Повторную очистку данной порции и менее очищенных фракций осуществляли либо повторной MeOH/EtOAc колоночной хроматографией, либо хроматографией на ChiralcelOD колонке(10 см 50 см), используя 93:7 гептан:изопропиловый спирт со скоростью потока 460 мл/мин. Данные повторно хроматографированные продукты затем растирали в смеси 10% этиловый эфир/гексаны (8 мл/г) с получением 28,2 г (58%) указанного в заголовке соединения 95+% чистоты: Rf=0,23 (20%MeOH/EtOAc); 1 Н ЯМР (CDCl3)7,38 (т, J=7,7 Гц, 1 Н), 7,20 (д, J=8,3 Гц, 1 Н), 7,13 (дд, J=10,8, 1,6 Гц,1 Н), 5,43 (ушир.с, 1 Н), 3,66 (с, 2 Н), 3,33-3,18 (м, 3 Н), 2,92-2,78 (м, 2 Н), 2,76-2,64 (м, 2 Н), 2,58-2,48 (м,4 Н), 1,81-1,70 (м, 4 Н), 1,13 (т, J=7,3 Гц, 3 Н). Гидрохлоридную соль указанного в заголовке соединения получали добавлением 53 мл смеси 2 н.HCl/этиловый эфир к перемешиваемому раствору свободного основания в 650 мл EtOAc. После перемешивания в течение 2 ч собирали белый осадок, промывали его EtOAc и сушили в токе азота: т.пл. 196,5197,5 С; 1H ЯМР (MeOH-d4)7,60 (т, J=7,7 Гц, 1 Н), 7,46-7,40 (м, 2 Н), 4,46 (с, 2 Н), 3,56-3,50 (м, 2 Н), 3,37C18H24F2N2OHCl: С 60,25, Н 7,02, N 7,81. Найдено С 60,15, Н 7,32, N 7,60. Промежуточное соединение 13. 1-(3,5-Дифторбензил)пирролидин. 3,5-Дифторбензальдегид (2,0 мл, 18,24 ммоль), пирролидин (1,8 мл, 21,56 ммоль) и триацетоксиборогидрид натрия (5,8 г, 27,4 ммоль) перемешивали в ТГФ (50 мл) в течение 16 ч при комнатной температуре. Добавляли насыщенный водный NaHCO3 (30 мл) и после перемешивания в течение 30 мин добавляли EtOAc (50 мл), органическую фазу отделяли и промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали с получением 2,65 г (74%) 1-(3,5-дифторбензил)пирролидина в виде слабо мутного масла: 1 Н ЯМР (CDCl3)6,88-6,83 (м, 1 Н), 6,68-6,63 (м, 2 Н), 3,59 (с, 2 Н), 2,53-2,48 (м, 4 Н),1,80-1,77 (м, 4 Н). Промежуточное соединение 14. 3-(2,6-Дифтор-4-(пирролидин-1-илметил)фенил)-3-гидрокси-Nметилциклобутанкарбоксамид. 2,2,6,6-Тетраметилпиперидин (1,86 мл, 11,0 ммоль) добавляли к охлажденному до -78 С раствору н-бутиллития (2,5 М в гексанах, 4,4 мл, 11,0 ммоль) в гексанах (12 мл) и ТГФ (25 мл). Полученную смесь перемешивали в течение 10 мин и затем промежуточное соединение 13, 1-(3,5-дифторбензил)пирролидин (2,17 г, 11,0 ммоль) в 3 мл ТГФ добавляли по стенкам колбы в течение 1 мин. После перемешивания в течение 2,5 ч в реакционную смесь добавляли с помощью канюли охлажденный до -78 С раствор 3-оксоциклобутанкарбоновой кислоты (0,63 г, 5,5 ммоль) в ТГФ (10 мл). Данной смеси давали медленно нагреваться до комнатной температуре и перемешивали в течение 16 ч. Затем добавляли метиламин(2,0 М в ТГФ, 5,5 мл, 11,0 моль) и Т 3 Р (50 мас.% в EtOAc, 3,9 мл, 6,55 моль). После 2 ч перемешивания добавляли насыщенный водный NaHCO3 и смесь экстрагировали в EtOAc, сушили над MgSO4 и концентрировали с получением желтовато-коричневого масла. Силикагельная флэш-хроматография с применением сначала 3%, затем 15% MeOH/CH2Cl2 приводила к 99 мг (5,5%) указанного в заголовке соединения,3-(2,6-дифтор-4-(пирролидин-1-илметил)фенил)-3-гидрокси-N-метилциклобутанкарбоксамида в виде воскообразного белого твердого вещества: Rf=0,036 (CH2Cl2); 1 Н ЯМР (CDCl3)6,84-6,78 (м, 2 Н), 6,25-6,20- 21013602 промежуточного соединения 14, 3-(2,6-дифтор-4-(пирролидин-1-илметил)фенил)-3-гидрокси-N-метилциклобутанкарбоксамида (0,099 г, 0,305 ммоль) в CH2Cl2 (2 мл) и полученной смеси давали нагреваться до комнатной температуры и перемешивали в течение 18 ч. Реакционную смесь выливали в насыщенный водный NaHCO3 и экстрагировали с помощью CH2Cl2 (215 мл), сушили над MgSO4 и концентрировали с получением 92 мг светло-желтого масла: Rf=0,21 (20% MeOH/EtOAc). Силикагельная флэшхроматография с применением EtOAc и затем 5 и 10% MeOH/EtOAc для элюирования приводила к 66 мг(67% выход) указанного в заголовке соединения. LRMS m/z вычислено для C17H21F3N2O, 326,4, найдено,327,4 (М+Н), 307,4 (M+H-HF) APCI; 1 Н ЯМР (CDCl3)6,87 (д, J=8,7 Гц, 2 Н), 5,42 (ушир.с, 1 Н), 3,56 (м,2 Н), 3,32 (р, J=8,5 Гц, 1 Н), 3,06-2,78 (м, 7 Н), 2,50 (ушир.с, 4 Н), 1,79 (ушир.с, 4 Н). Промежуточное соединение 15. 3-(3-Фтор-4-пирролидин-1-илметил)фенил)-3-гидроксициклобутанкарбоновая кислота. н-Бутиллитий (2,5 М/гексаны, 75 мл, 0,195 моль) добавляли по каплям по стенкам реакционной колбы на протяжении 5 мин к охлажденному до -78 С раствору 1-(4-бром-2-фторбензил)пирролидина(50,0 г, 0,194 моль) в ТГФ (500 мл). После перемешивания при -78 С в течение 1 ч в реакционную смесь добавляли с помощью канюли охлажденный до -78 С раствор 3-оксоциклобутанкарбоновой кислоты(11,0 г, 96,4 ммоль) в ТГФ (150 мл) в течение 10 мин. Полученный темно-оранжевый раствор медленно нагревали при комнатной температуре на протяжении 16 ч. ЖХ/МС смеси показала указанное в заголовке соединение 294,2 (М+Н). Данный продукт использовали в виде неочищенного раствора без обработки,предполагая 0,12 М концентрацию указанного в заголовке соединения. Пример 18. Метиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты. 0,12 М ТГФ раствор промежуточного соединения 15, 3-(3-фтор-4-пирролидин-1-илметил)фенил)3-гидроксициклобутанкарбоновой кислоты (160 мл, 19,3 ммоль) смешивали с метиламином (2,0 М в ТГФ, 20 мл, 40 ммоль) и Т 3 Р (50 мас.% в EtOAc, 13,8 мл, 23,2 ммоль) и перемешивали при комнатной температуре в течение 20 ч. Смесь подщелачивали насыщенным водным NaHCO3 и к ней добавлялиEtOAc (50 мл). Фазы отделяли и водную фазу экстрагировали снова с помощью EtOAc. Объединенные органические фазы промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали с получением оранжевого масла (8,6 г). Флэш-хроматография на 2"4 колонке с силикагелем с промыванием сначала EtOAc (1 л) и 10% MeOH/EtOAc (500 мл) для удаления примесей с более высоким Rf с последующим элюированием дополнительными 500 мл 10% MeOH/EtOAc и 500 мл 20% MeOH/EtOAc приводила к 3,14 г (53%) указанного в заголовке соединения в виде вязкого оранжевого масла, которое медленно затвердевало до воскообразного твердого вещества: Rf=0,30, 20% MeOH/EtOAc; 1 Н ЯМР(CDCl3)177,5, 161,3 (д, JC-F=246,2 Гц), 147,3 (д, JC-F=7,1 Гц), 131,6 (д, JC-F=4,9 Гц), 124,2 (д, JC-F=15,0 Гц),120,6 (д, JC-F=3,3 Гц), 112,3 (д, JC-F=23,3 Гц), 74,0 (д, JC-F=1,9 Гц), 54,04, 52,6 (д, JC-F=1,5 Гц), 41,2, 32,9,26,8, 23,6; LRMS m/z вычислено для C17H23FN2O2, 306,4, найдено, 307,4 (М+Н) APCI. Пример 19. Диметиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты. 0,12 М ТГФ раствор промежуточного соединения 15, 3-(3-фтор-4-(пирролидин-1-илметил)фенил)3-гидроксициклобутанкарбоновой кислоты (160 мл, 19,3 ммоль) смешивали с диметиламином (2,0 М в ТГФ, 20 мл, 40 ммоль) и Т 3 Р (50 мас.% в EtOAc, 13,8 мл, 23,2 ммоль) и перемешивали при комнатной температуре в течение 20 ч. Смесь подщелачивали насыщенным водным NaHCO3 и к ней добавлялиEtOAc. Фазы отделяли и водную фазу экстрагировали снова с помощью EtOAc (50 мл). Объединенные органические фазы промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали с получением оранжевого масла (8,6 г). Флэш-хроматография на 2"4 колонке с силикагелем с промыванием сначала EtOAc (1 л) и 10% MeOH/EtOAc (500 мл) для удаления примесей с более высоким Rf с последующим элюированием дополнительными 500 мл 10% MeOH/EtOAc и 500 мл 20% MeOH/EtOAc приводила к 3,58 г (58%) указанного в заголовке соединения в виде вязкого оранжевого масла, которое медленно затвердевало до воскообразного твердого вещества: Rf=0,17 (20% MeOH/EtOAc); 1H ЯМР(CDCl3)7,36 (т, J=7,9 Гц, 1 Н), 7,23-7,15 (м, 2 Н), 4,70 (ушир.с, 1 Н), 3,66 (с, 2 Н), 3,21-3,12 (м, 1 Н), 3,00 (3,3 Н), 2,99 (с, 3 Н), 2,84-2,78 (м, 2 Н), 2,57-2,43 (м, 6 Н), 1,80-1,74 (м, перекрывающийся с водой, 4 Н); 13 С ЯМР (CDCl3)175,8, 161,3 (д, JC-F=246,2 Гц), 147,4 (д, JC-F=7,1 Гц), 131,6 (д, JC-F=4,5 Гц), 124,3 (д,JC-F=15 Гц), 120,7 (д, JC-F=3,0 Гц), 112,4 (д, JC-F=23,3 Гц), 73,3 (д, JC-F=1,1 Гц), 54,03, 52,6 (д, JC-F=1,1 Гц),41,1, 37,4, 36,2, 28,5, 23,6; LRMS m/z вычислено для C18H25FN2O2, 320,4, найдено, 321,4 (М+Н) APCI. Пример 20. Изобутиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты. 0,12 М ТГФ раствор промежуточного соединения 15, 3-(3-фтор-4-(пирролидин-1-илметил)фенил)3-гидроксициклобутанкарбоновой кислоты (160 мл, 19,3 ммоль) смешивали с изобутиламином (3,8 мл,38,2 ммоль) и Т 3 Р (50 мас.% в EtOAc, 13,8 мл, 23,2 ммоль) и перемешивали при комнатной температуре в течение 20 ч. Смесь подщелачивали насыщенным водным NaHCO3 и к ней добавляли EtOAc (50 мл).- 22013602 Фазы отделяли и водную фазу экстрагировали снова с помощью EtOAc. Объединенные органические фазы промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали с получением оранжевого масла. Флэш-хроматография на 2"4 колонке с силикагелем с промыванием сначала EtOAc(1 л) и 10% MeOH/EtOAc (500 мл) для удаления примесей с более высоким Rf с последующим элюированием дополнительными 500 мл 10% MeOH/EtOAc и 500 мл 20% MeOH/EtOAc приводила к 4,22 г (63%) указанного в заголовке соединения в виде воскообразного оранжевого твердого вещества: Rf=0,3 (30%MeOH/EtOAc); 1 Н ЯМР (CDCl3)7,34 (т, J=7,9 Гц, 1 Н), 7,20-7,13 (м, 2 Н), 5,84 (ушир.с, 1 Н), 3,66 (д,JH-F=1,3 Гц, 2 Н), 3,11 (т, J=6,4 Гц, 2 Н), 2,84-2,76 (м, 3 Н), 2,55-2,45 (м, 6 Н), 1,81-1,72 (м, 4 Н), 0,91-0,87 (d при 0,90 (J=6,6 Гц, 6 Н) перекрывающийся м (1 Н; LRMS m/z вычислено для C20H29FN2O2, 348,5, найдено, 349,4 (М+Н) APCI. Пример 21. Метиламид 3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты. Трифторид-[бис-(2-метоксиэтил)амино]сера (0,29 мл, 1,57 ммоль) добавляли при 0 С к раствору соединения примера 18, метиламида 3-(3-фтор-4-(пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты (0,40 г, 1,31 ммоль) в CH2Cl2 (8 мл). Данной смеси давали нагреться до комнатной температуры и перемешивали в течение 18 ч и затем смесь выливали в насыщенный водный NaHCO3. Органическую фазу отделяли, сушили над MgSO4 и концентрировали с получением оранжевого масла(0,40 г). Флэш-хроматография на 1,5"2 колонке с силикагелем с промыванием сначала 200 мл EtOAc,2 и 5% MeOH/EtOAc каждого для удаления примесей с более высоким Rf с последующим элюированием дополнительными 400 мл 10% MeOH/EtOAc и 200 мл 20% MeOH/EtOAc приводила к 0,244 г (61%) указанного в заголовке соединения в виде оранжевого масла: Rf=0,11 (20% MeOH/EtOAc).HCl соль указанного в заголовке соединения получали в EtOAc с 1,5 экв. 2 н. HCl/этиловый эфир. Гигроскопичное белое твердое вещество собирали и сушили в атмосфере азота: 1 Н ЯМР (MeOH-d4)7,60 (т, J=7,9 Гц, 1 Н), 7,45-7,40 (м, 2 Н), 4,46 (с, 2 Н), 3,60-3,45 (м, 2 Н), 3,37 (р, J=8,7 Гц, 1 Н), 3,24-3,14 (м,2 Н), 2,87-2,67 (с при 2,72 (3 Н) перекрывающийся мультиплет (4 Н, 2,22-2,10 (м, 2 Н), 2,02-1,97 (м, 2 Н); 13 С ЯМР (MeOH-d4)175,6, 161,5 (д, JC-F=248,8 Гц), 147,4 (дд, JC-F=24,1, 7,1), 133,1 (д, JC-F=2,6 Гц), 121,4APCI. Пример 22. Диметиламид 3-фтор-3-(3-фтор-4 -пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты. Раствор примера 19, диметиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты (0,40 г, 1,25 ммоль) в CH2Cl2 (4 мл) добавляли к охлажденному до -78 С раствору трифторид-[бис-(2-метоксиэтил)амино]сера (0,28 мл, 1,52 ммоль) в CH2Cl2 (4 мл). Через 1 ч добавляли дополнительную порцию трифторид-[бис-(2-метоксиэтил)амино]сера (0,050 мл) и раствор перемешивали в течение дополнительных 15 мин, затем добавляли насыщенный водный NaHCO3 и смесь перемешивали при комнатной температуре в течение 16 ч. Фазы отделяли и водный слой экстрагировалиCH2Cl2. Объединенные органические слои сушили над MgSO4 и концентрировали с получением 296 мг светло-оранжевого масла. Флэш-хроматография на 1,5"1,5 колонке с силикагелем с промыванием сначала 200 мл EtOAc для удаления примесей с более высоким Rf, затем с элюированием 200 мл 20%HCl соль указанного в заголовке соединения получали в EtOAc с 1,5 экв. 2 н. HCl/этиловый эфир с получением белого твердого вещества: 1 Н ЯМР (MeOH-d4)7,59 (т, J=7,9 Гц, 1 Н), 7,38-7,32 (м, 2 Н), 4,44APCI. Пример 23. Этилметиламид 3-фтор-3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты. Раствор примера 14, этилметиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты (0,40 г, 1,20 ммоль) в CH2Cl2 (4 мл) добавляли к охлажденному до -78 С раствору трифторид-[бис-(2-метоксиэтил)амино]сера (0,27 мл, 1,46 ммоль) в CH2Cl2 (4 мл). Через 1 ч добавляли насыщенный водный NaHCO3 (10 мл) и смесь перемешивали при комнатной температуре в течение 16 ч. Фазы отделяли и водный слой экстрагировали CH2Cl2. Объединенные органические слои сушили над MgSO4 и концентрировали с получением 296 мг светло-оранжевого масла. Флэш-хроматография на 1,5"1,5 колонке с силикагелем с промыванием сначала 200 мл EtOAc для удаления примесей с более высоким Rf, затем с элюированием 200 мл 10 и 20% MeOH/EtOAc приводила к 0,242 г (61%) указанного в заголовке соединения в виде светло-желтого масла: Rf=0,24 (20% MeOH/EtOAc). LRMS m/z вычисленоHCl соль указанного в заголовке соединения получали в EtOAc с 1,5 экв. 2 н. HCl/этиловый эфир с получением светло-желтого твердого вещества: 1 Н ЯМР (МеОН-d4)1:1 смесь ротомеров, 7,58 (т,J=7,7 Гц, 1 Н), 7,40-7,33 (м, 2 Н), 4,44 (с, 2 Н), 3,79-3,67 (м, 1 Н), 3,49 (ушир.с, 2 Н), 3,42-3,34 (м, 2 Н), 3,21(5 мл). После перемешивания в течение 15 мин прекращалось выделение всего газа и к смеси добавляли метилиодид (0,06 мл, 0,96 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 ч, затем гасили водой и экстрагировали в EtOAc. Экстракт промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали с получением указанного в заголовке соединения в виде светло-желтого масла (0,13 г): Rf=0,16 (20% MeOH/EtOAc); LRMS m/z вычислено для C20H29FN2O2,348,5, найдено, 349,4 (M+H) APCI.HCl соль указанного в заголовке соединения получали в EtOAc с 1,5 экв. 2 н. HCl/этиловый эфир с получением белого твердого вещества: 1 Н ЯМР (MeOH-d4)1:1 смесь ротомеров, 7,67 (т, J=7,7 Гц, 1 Н),7,46 (д, J=8,3 Гц, 1 Н), 7,42 (дт, J=11,2, 1,9 Гц, 1 Н), 4,48 (с, 2 Н), 3,55 (ушир.с, 2 Н), 3,42-3,18 (мультиплеты,перекрывающиеся с МеОН, 4 Н), 3,02-2,95 (м, 1 Н), 2,94-2,90 (перекрывающийся -ОСН 3 синглет при 2,94 и оптометрические -NCH3 синглеты при 2,94 и 2,90, 6 Н суммарный), 2,67-2,54 (м, 4 Н), 2,18 (ушир.с, 2 Н),2,03 (ушир.с, 2 Н), 1,13 и 1,08 (триплеты, J=7,3 Гц, 3 Н суммарный); 13 С ЯМР (MeOH-d4)(смесь ротомеров) 173,93, 173,84, 163,09, 160,61, 148,64, 148,57, 133,20, 133,18, 123,02, 117,39, 117,20, 114,13, 114,08,113,91, 133,86, 76,72, 76,63, 53,88, 50,80, 50,77, 49,78, 43,97, 42,76, 36,58, 36,24, 33,64, 32,17, 27,87, 27,32,22,67, 12,87, 11,28; LRMS m/z вычислено для C20H29FN2O2, 348,5, найдено, 349,4 (M+H) APCI. Промежуточное соединение 16. 3-(3-Фтор-4-пирролидин-1-ил)метил)фенил)-N-изобутилциклобут-2-енкарбоксамид. Раствор примера 20, изобутиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты (3,71 г, 10,64 ммоль) в трифторуксусной кислоте (20 мл) и 1,2-дихлорэтане(120 мл) кипятили с обратным холодильником в течение 21 ч и концентрировали с получением 8,6 г сырой трихлорацетатной соли 3-(3-фтор-4-пирролидин-1-ил)метил)фенил)-N-изобутилциклобут-2-енкарбоксамида и остаточной TFA в виде темного красно-коричневого масла. Диагностические 1 Н ЯМР сигналы:7,48 (т, J=7,7 Гц, 1 Н), 7,23 (д, частично перекрытый сигналом CHCl3, 1 Н), 7,09 (дд, J =10,3, 1,5 Гц, 1 Н), 6,38 (д, J=0,8 Гц, 1 Н), 4,33 (д, J=5,0 Гц, 1 Н), 3,77 (ушир.с, 2 Н), 3,68 (д, J=4,6 Гц, 1 Н), 3,20-3,07 (м,3 Н), 2,98 (ушир.с, 2 Н), 2,83 (дд, J=13,3, 1,7 Гц, 1 Н), 2,19-2,07 (м, 4 Н), 0,90 (д, J=7,1 H, 6H). Пример 25. Изобутиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты. Неочищенное промежуточное соединение 16, 3-(3-фтор-4-пирролидин-1-ил)метил)фенил)-N-изобутилциклобут-2-енкарбоксамид, полученный выше, растворяли в EtOH (100 мл) и помещали в сосуд для гидрирования, содержащий 10% палладий на угле, суспендированный в EtOH (5 мл). Смесь встряхивали при комнатной температуре в атмосфере водорода при 45 фунт/кв.дюйм в течение 2 ч, фильтровали через диатомовую землю с промыванием EtOH и концентрировали с получением оранжевого масла. Масло растворяли в EtOAc (150 мл) и промывали водным раствором K2CO3 и насыщенным солевым раствором, сушили над MgSO4 и концентрировали с получением 3,29 г воскообразного оранжевого твердого вещества. Флэш-хроматография на 2,5"4 колонке с силикагелем с элюированием с помощью 1000 млEtOAc и 500 мл 10% MeOH/EtOAc приводила к 1,90 г (54%) указанного в заголовке соединения в виде желтого окрашенного твердого вещества: Rf=0,26 (20% MeOH/EtOAc).HCl соль указанного в заголовке соединения получали добавлением 1,2 экв. 2 н. HCl/этиловый эфир к свободному основанию в растворе EtOAc. Полученное гигроскопичное, стеклообразное, светлооранжевое твердое вещество имело: 1 Н ЯМР (MeOH-d4)7,49 (т, J=8,1 Гц, 1 Н), 7,20-7,17 (м, 2 Н), 4,41 (с,2 Н), 3,55-3,45 (м, 3 Н), 3,21-3,15 (м, 2 Н), 3,09 (р, 8,7 Гц, 1 Н), 2,98 (д, J=6,6 Гц, 2 Н), 2,57-2,50 (сим. мульт.,2 Н), 2,31 (дкв., J=9,7, 2,5 Гц, 2 Н), 2,22-2,10 (м, 2 Н), 2,05-1,95 (м, 2 Н), 1,75 (гепт, J=6,8 Гц, 1 Н), 0,88 (д,J=6,6 Гц, 6 Н); 13 С ЯМР (CDCl3)176,1, 161,64 (д, JC-F=248,1 Гц), 150,7 (д, JC-F=7,9 Гц), 132,8 (д,JC-F=3,4 Гц), 123,2 (д, JC-F=3,0 Гц), 115,7 (д, JC-F=5,4 Гц), 113,8 (д, JC-F=21,8 Гц), 53,73, 50,9, 50,8, 35,2, 34,9,32,5, 28,4, 22,6, 19,3; LRMS m/z вычислено для C20H29FN2O, 332,5, найдено, 333,5 (М+Н) APCI.- 24013602 Пример 26. 3-Азабицикло[3.2.2]нонан-3-ил(3-(3-фтор-4-(пирролидин-1-илметил)фенил)-3-гидроксициклобутил)метанон. ТГФ раствор неочищенного промежуточного соединения 15, 3-(3-фтор-4-(пирролидин-1 илметил)фенил)-3-гидроксициклобутанкарбоновой кислоты (5,3 ммоль, 0,12 М ТГФ) смешивали с 3 азабицикло[3.2.2]нонаном (1,00 г, 7,99 ммоль) и Т 3 Р (50 мас.% в EtOAc, 3,8 мл, 6,38 ммоль) и перемешивали при комнатной температуре в течение 30 мин. Смесь подщелачивали насыщенным водным NaHCO3 и затем добавляли EtOAc (50 мл). Фазы отделяли и водную фазу экстрагировали снова с помощьюEtOAc. Объединенные органические слои промывали насыщенным солевым раствором, сушили надMgSO4 и концентрировали с получением густого оранжевого масла (1,86 г). Флэш-хроматография на 2"5 колонке с силикагелем с промыванием сначала EtOAc (500 мл), затем с элюированием 500 мл 25% MeOH/EtOAc приводила к указанному в заголовке соединению (0,59 г 28% выход) в виде воскообразного желтого твердого вещества: LRMS, m/z вычислено для C24H33FN2O2, 400,5, найдено, 401,1 (М+Н)(16 мл) кипятили с обратным холодильником в течение 20 ч и концентрировали с получением сырой трихлорацетатной соли 3-азабицикло[3.2.2]нонан-3-ил(3-(3-фтор-4-(пирролидин-1-илметил)фенил)циклобут 2-енил)метанона в виде темного пурпурно-коричневого масла с остаточной TFA. Данный продукт растворяли в EtOH (40 мл) и помещали в сосуд для гидрирования, содержащий 10% палладий на угле (93 мг),суспендированный в EtOH (3 мл). Смесь встряхивали при комнатной температуре в атмосфере водорода при 48 фунт/кв.дюйм в течение 2 ч, фильтровали через диатомовую землю с промыванием EtOH и концентрировали, получая оранжевое масло. Масло растворяли в EtOAc и промывали водным растворомHCl соль получали добавлением 1,5 экв. 2 н. HCl/этиловый эфир к свободному основанию в растворе EtOAc. Полученное белое твердое вещество собирали и сушили, получая HCl соль указанного в заголовке соединения: 1 Н ЯМР (CDCl3)12,68 (ушир.с, 1 Н), 7,80 (т, J=7,7 Гц, 1 Н), 7,19-6,97 (м, 2 Н), 4,21LRMS m/z вычислено для C24H33FN2O, 384,5, найдено, 385,5 (М+Н) APCI. Промежуточное соединение 17. 3-(3-Хлор-4-пирролидин-1-ил)метил)фенил)-3-гидроксициклобутанкарбоновая кислота. 2,5 М раствор н-BuLi в гексанах (101 мл, 254 ммоль) добавляли в течение 15 мин к раствору 1-(4 бром-2-хлорбензил)пирролидина (69,6 г, 254 ммоль) в абсолютном ТГФ (450 мл) в токе азота при -78 С. Реакционную смесь перемешивали при -78 С в течение 30 мин. Затем к смеси добавляли по каплям охлажденный до -78 С раствор 3-оксоциклобутанкарбоновой кислоты (14,4 г, 126,7 ммоль) в течение 10 мин при -78 С. Смесь медленно нагревали до к.т., оставляли перемешиваться в течение 18 ч и использовали полученный раствор. LRMS m/z вычислено для C16H20NClO3, 309,8, найдено, 308,1 (М-Н) APCI. Пример 28. Метиламид 3-(3-хлор-4-пирролидин-1-ил)метил)фенил)-3-гидроксициклобутанкарбоновой кислоты. К раствору неочищенного промежуточного соединения 17, 3-(3-хлор-4-пирролидин-1-ил)метил)фенил)-3-гидроксициклобутанкарбоновой кислоты (666 мл, 121,5 ммоль) добавляли 2,0 М метиламина (95 мл, 190 ммоль, в ТГФ) и Т 3 Р (50 мас.% раствор в EtOAc, 96,6 мл, 152 ммоль). Полученную реакционную смесь перемешивали при к.т. в течение 1 ч и затем к ней добавляли 300 мл 1 н. NaOH и 400 мл EtOAc и слои отделяли. Водный слой снова экстрагировали EtOAc (2500 мл) и объединенные органические слои сушили над MgSO4 и выпаривали. Остаток очищали флэш-хроматографией использованием 75 л Biotage колонки, элюируя градиентами из 5, 8, 10, 15% MeOH/CHCl3 с 0,25% NH4OH. Фракции, содержащие продукт, собирали и концентрировали в вакууме при пониженном давлении, получая указанное в заголовке соединение (18,9 мг, 48% выход). Rf=0,35 (20% МеОН/CH2Cl2 + 0,2%TFA (48 мл, 627 ммоль) добавляли к DCE раствору (202 мл) примера 28, метиламида 3-(3-хлор-4 пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты (10 г, 31,4 ммоль), полученную смесь нагревали при 75 С в течение 18 ч и концентрировали, получая TFA соль 3-(3-хлор-4(пирролидин-1-ил)метилфенил)-N-метилциклобут-2-енкарбоксамида. Данную соль перерастворяли в абсолютном EtOH (130 мл), затем к раствору добавляли катализатор Вилькинсона (1,5 г) и реакционную смесь подвергали гидрированию при 60 С с использованием Н 2 при 45 фунт/кв.дюйм. После 2-ч периода реакции реакционную смесь концентрировали и остаток перерастворяли в 1 н. HCl (100 мл) и экстрагировали дважды с помощью EtOAc (2100 мл). Водный слой затем подщелачивали с помощью 1 н. NaOH(100 мл) и экстрагировали EtOAc (2500 мл). Объединенные органические фазы сушили над MgSO4 и концентрировали с получением сырого продукта. Продукт очищали флэш-хроматографией с использованием 120 г ISCO колонки, элюируя градиентом из 5, 10 и 15% МеОН/СН 2 С 12 с 0,25% NH4OH. Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении, получая смесь цис- и транс-изомеров (4,6 мг, 48% выход). Изомеры разделяли препаративной хроматографией на Chiralcel OD(10 см 50 см) колонке при скорости потока 295 мл/мин и применении смеси гептан/IPA (90/10) в качестве элюента с выделением транс- (3,6 г) и цис-изомеров (0,52 г). Пример 29. Метиламид транс-3-(3-хлор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты: Rf=0,50 (20% МеОН/CH2Cl2+0,2% NH4OH); LRMS m/z вычислено для C17H23ClN2O, 306,8, найдено, 307,4 (М+1) APCI; 400 МГц 1 Н ЯМР (CDCl3)7,42 (д, J=7,8 Гц,1 Н), 7,20 (д, J=l,6 Гц, 1 Н), 7,09 (дд,J=7,8, 1,2 Гц, 1 Н), 5,76 (ушир.с, 1 Н), 3,83 (с, 2 Н), 3,76-3,67 (м, 1 Н), 2,98-2,90 (м, 1 Н), 2,82 (д, J=5,1 Гц,3 Н), 2,80-2,62 (м, 6 Н), 2,36-2,26 (м, 2 Н), 1,87-1,78 (м, 4 Н); 100 МГц 13 С ЯМР (CDCl3)146,7, 134,2, 131,3,176,1, 127,5, 125,3, 56,3, 54,3, 54,1, 36,5, 36,3, 32,1, 26,6, 23,6. Пример 30. Метиламид цис-3-(3-хлор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты: Rf=0,50 (20% МеОН/CH2Cl2 + 0,2% NH4OH); LRMS m/z вычислено для C17H23ClN2O, 306,8, найдено, 307,4 (М+1) APCI; 400 МГц 1 Н ЯМР (CDCl3)7,30 (д, J=7,9 Гц, 1 Н), 7,15 (д, J=1,2 Гц, 1 Н), 7,03 (дд,J=7,8, 1,2 Гц, 1 Н), 6,48 (ушир.с, 1 Н), 3,63 (с, 2 Н), 3,30-3,19 (м, 1 Н), 2,94-2,84 (м, 1 Н), 2,70 (д, J=5,0 Гц,3 Н), 2,52-2,26 (м, 8 Н), 1,74-1,66 (м, 4 Н). Пример 31. Диметиламид 3-(3-хлор-4-пирролидин-1-ил)метилфенил)-3-гидроксициклобутанкарбоновой кислоты. К раствору неочищенного промежуточного соединения 17, 3-(3-хлор-4-пирролидин-1-ил)метилфенил)-3-гидроксициклобутанкарбоновой кислоты (4,3 мл, 0,65 ммоль) добавляли диметиламин в ТГФ(0,65 мл, 1,29 ммоль, 2,0 М ТГФ) и Т 3 Р (50 мас.% раствор в EtOAc, 0,62 мл, 0,97 ммоль). Полученную реакционную смесь перемешивали при к.т. в течение 1 ч и затем к ней добавляли 25 мл 1 н. NaOH и 100 мл EtOAc и слои отделяли. Водный слой снова экстрагировали EtOAc (260 мл), объединенные органические слои сушили над MgSO4 и выпаривали. Остаток очищали флэш-хроматографией с использованием 40 г ISCO колонки, элюируя с помощью 5% МеОН/CH2Cl2 с 0,25% NH4OH. Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (112 мг, 52% выход). Rf=0,65 (20% МеОН/CH2Cl2 + 0,2% NH4OH); LRMS m/z вычислено для C18H25ClN2O2, 336,8, найдено, 337,1 (M+1) APCI; 400 МГц 1H ЯМР (CDCl3)(д, J=l,7 Гц, 1 Н), 7,46 7,40 (д, J=7,9 Гц, 1 Н), 7,33[3-(3-Хлор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутил]пиперидин-1 илметанон. К раствору неочищенного промежуточного соединения 17, 3-(3-хлор-4-пирролидин-1-ил)метил)фенил)-3-гидроксициклобутанкарбоновой кислоты (4,3 мл, 0,65 ммоль) добавляли пиперидин(0,13 мл, 1,29 ммоль) и Т 3 Р (50 мас.% раствор в EtOAc, 0,62 мл, 0,97 ммоль). Полученную реакционную смесь перемешивали при к.т. в течение 1 ч и затем к ней добавляли 25 мл 1 н. NaOH и 100 мл EtOAc и слои отделяли. Водный слой снова экстрагировали EtOAc (260 мл), объединенные органические слои сушили над MgSO4 и выпаривали. Остаток очищали флэш-хроматографией с использованием 40 гISCO колонки, элюируя с помощью 5% МеОН/CH2Cl2 с 0,25% NH4OH. Фракции, содержащие продукт,собирали и концентрировали при пониженном давлении, получая указанное в заголовке соединение- 26013602 Пример 33. Изобутилметиламид 3-(3-хлор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты. К раствору неочищенного промежуточного соединения 17, 3-(3-хлор-4-пирролидин-1-ил)метил)фенил)-3-гидроксициклобутанкарбоновой кислоты (4,3 мл, 0,65 ммоль) добавляли N-метилизобутиламин (0,15 мл, 1,29 ммоль) и Т 3 Р (50 мас.% раствор в EtOAc, 0,62 мл, 0,97 ммоль). Полученную реакционную смесь перемешивали при к.т. в течение 1 ч и затем к ней добавляли 25 мл 1 н. NaOH и 100 мл EtOAc и слои отделяли. Водный слой снова экстрагировали EtOAc (260 мл), объединенные органические слои сушили над MgSO4 и выпаривали. Остаток очищали флэш-колоночной хроматографией с использованием 40 г ISCO колонки, элюируя с помощью 5% МеОН/CH2Cl2 с 0,25% NH4OH. Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (108 мг, 44% выход). Rf=0,80 (20% МеОН/CH2Cl2 + 0,2% NH4OH); LRMS m/z вычислено для C21H31ClN2O2, 378,9, найдено, 379,1 (М+1) APCI; 400 МГц 1 Н ЯМР (CDCl3) 1:1 смесь ротомеров,7,47-7,45 (м, 1 Н), 7,42 (д, J=7,9 Гц, 1 Н), 7,36-7,30 (м, 1 Н), 3,71 (с, 2 Н), 3,20-3,02 (м, 3 Н), 2,92 и 2,90 (2 с, 3 Н суммарный), 2,80-2,70 (м, 2 Н), 2,60-2,50 (м, 6 Н), 1,95-1,80 (м, 1 Н), 1,78-1,70 (м, 4 Н), 0,76-0,58(м, 6 Н); 100 МГц 13 С ЯМР (CDCl3) 1:1 смесь ротомеров, список линий 176,6, 175,8, 146,4, 135,2, 135,1,134,0, 130,9, 130,8, 126,4, 123,7, 123,6, 73,5, 73,3, 57,9, 56,7, 55,6, 54,3, 41,4, 41,0, 36,1, 35,0, 29,0, 28,2,27,9, 26,9, 23,7, 20,2, 20,1. Пример 34. Циклопропилметиламид 3-(3-хлор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты. К раствору неочищенного промежуточного соединения 17, 3-(3-хлор-4-пирролидин-1-ил)метилфенил)-3-гидроксициклобутанкарбоновой кислоты (4,3 мл, 0,65 ммоль) добавляли аминометилциклопропан (0,112 мл, 1,29 ммоль) и Т 3 Р (50% раствор в EtOAc, 0,62 мл, 0,97 ммоль). Полученную реакционную смесь перемешивали при к.т. в течение 1 ч и затем к ней добавляли 25 мл 1 н. NaOH и 100 мл EtOAc и слои отделяли. Водный слой снова экстрагировали EtOAc (260 мл), объединенные органические слои сушили над MgSO4 и выпаривали. Остаток очищали флэш-колоночной хроматографией с использованием 40 гISCO колонки, элюируя с помощью 5% МеОН/CH2Cl2 с 0,25% NH4OH. Фракции, содержащие продукт,собирали и концентрировали при пониженном давлении, получая указанное в заголовке соединение(CDCl3)176,7, 146,1, 135,3, 133,9, 130,8, 126,3, 123,6, 74,0, 56,7, 54,3, 44,9, 41,1, 40,7, 33,1, 23,7, 10,8, 3,7. Пример 35. Метил(тетрагидропиран-4-илметил)амид 3-(3-хлор-4-пирролидин-1-илметилфенил)-3 гидроксициклобутанкарбоновой кислоты. К раствору неочищенного промежуточного соединения 17, 3-(3-хлор-4-пирролидин-1-ил)метил)фенил)-3-гидроксициклобутанкарбоновой кислоты (4,3 мл, 0,65 ммоль) добавляли гидрохлорид метил(тетрагидропиран-4-илметил)амина (200 мг, 1,21 ммоль), триэтиламин (0,108 мл, 0,78 ммоль) и Т 3 Р(50% раствор в EtOAc, 0,62 мл, 0,97 ммоль). Полученную реакционную смесь перемешивали при к.т. в течение 1 ч, затем к ней добавляли 25 мл 1 н. NaOH и 100 мл EtOAc и слои отделяли. Водный слой снова экстрагировали EtOAc (260 мл), объединенные органические слои сушили над MgSO4 и выпаривали. Остаток очищали флэш-колоночной хроматографией с использованием 40 г ISCO колонки, элюируя с помощью 5% МеОН/CH2Cl2 с 0,25% NH4OH. Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (87 мг, 32% выход). Rf=0,80APCI; 400 МГц 1 Н ЯМР (CDCl3) 1:1 смесь ротомеров, диагностические пики,3,98-3,88 (м, 2 Н), 3,73 (с,2 Н), 2,95 (с, 3 Н), 2,62-2,54 (м, 6 Н), 1,70-1,46 (м, 2 Н), 1,38-1,17 (м, 2 Н). Пример 36. Циклопропилметилметиламид 3-(3-хлор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты. К раствору неочищенного промежуточного соединения 17, 3-(3-хлор-4-пирролидин-1-ил)метил)фенил)-3-гидроксициклобутанкарбоновой кислоты (4,3 мл, 0,65 ммоль) добавляли гидрохлорид циклопропилметилметиламина (61 мг, 0,51 ммоль), триэтиламин (0,18 мл, 1,29 ммоль) и Т 3 Р (50% раствор в EtOAc, 0,62 мл, 0,97 ммоль). Полученную реакционную смесь перемешивали при к.т. в течение 1 ч и затем к ней добавляли 25 мл 1 н. NaOH и 100 мл EtOAc и слои отделяли. Водный слой снова экстрагировали EtOAc (260 мл), объединенные органические слои сушили над MgSO4 и выпаривали. Остаток очищали флэш-колоночной хроматографией с использованием 40 г ISCO колонки, элюируя с помощью 5% MeOH/CH2Cl2 с 0,25% NH4OH. Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (71 мг, 29% выход). Rf=0,50 (15% МеОН/CH2Cl2 + 0,2% NH4OH); LRMS m/z вычислено для C21H29ClN2O2, 376,9, найдено, 377,2 (М+1)APCI; 400 МГц 1 Н ЯМР (CDCl3) 1:1 смесь ротомеров, диагностические пики,3,75 (с, 2 Н), 3,02 и 3,01 (2 синглеты, 3 Н суммарный), 2,62-2,54 (м, 6 Н), 1,82-1,74 (м, 4 Н); 100 МГц 13 С ЯМР (CDCl3) 1:1 смесь рото- 27013602 меров, список пиков 175,9, 175,7, 146,4, 146,3, 135,2, 134,0, 130,9, 130,8, 126,5, 126,4, 123,7, 73,7, 73,5,56,7, 54,6, 54,3, 52,4, 41,3, 41,0, 35,5, 34,5, 29,0, 28,5, 23,7, 10,5, 9,5, 3,8, 3,6. Пример 37. [3-(3-Хлор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутил]-(2,3-дигидро-5 Нбензо[f][1,4]оксазепин-4-ил)метанон. К раствору неочищенного промежуточного соединения 17, 3-(3-хлор-4-пирролидин-1 ил)метил)фенил)-3-гидроксициклобутанкарбоновой кислоты (4,3 мл, 0,65 ммоль) добавляли гидрохлорид 2,3,4,5-тетрагидробензо[f][1,4]оксазепина (239 мг, 1,29 ммоль), триэтиламин (0,18 мл, 1,29 ммоль) и Т 3 Р (50% раствор в EtOAc, 0,62 мл, 0,97 ммоль). Полученную реакционную смесь перемешивали при к.т. в течение 1 ч и затем к ней добавляли 25 мл 1 н. NaOH и 100 мл EtOAc и слои отделяли. Водный слой снова экстрагировали EtOAc (260 мл), объединенные органические слои сушили над MgSO4 и выпаривали. Остаток очищали флэш-колоночной хроматографией с использованием 40 г ISCO колонки,элюируя с помощью 5% МеОН/CH2Cl2 с 0,25% NH4OH. Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении, получая указанное в заголовке соединение, 104 мг, 37% выход.Rf=0,50 (15% МеОН/CH2Cl2 + 0,2% NH4OH); LRMS m/z вычислено для C25H29ClN2O3, 440,9, найдено,441,2 (М+1) APCI; 100 МГц 13 С ЯМР (CDC13) 1:1 смесь ротомеров, диагностические пики,175,4, 173,9,159,5, 159,3, 134,2, 134,1, 131,4, 131,3, 122,0, 121,3, 121,0, 74,9, 72,6, 72,2, 56,3, 54,1, 53,9, 49,3, 48,7, 41,2,41,0, 28,8, 28,5, 23,7, 23,6. Пример 38. Метил (3-метилпиридин-2-илметил)амид 3-(3-хлор-4-пирролидин-1-илметилфенил)-3 гидроксициклобутанкарбоновой кислоты. К раствору неочищенного промежуточного соединения 17, 3-(3-хлор-4-пирролидин-1 ил)метил)фенил)-3-гидроксициклобутанкарбоновой кислоты (4,3 мл, 0,65 ммоль) добавляли метил(3 метилпиридин-2-илметил)амин (17 6 мг, 1,29 ммоль) и Т 3 Р (50% раствор в EtOAc, 0,62 мл, 0,97 ммоль). Полученную реакционную смесь перемешивали при к.т. в течение 1 ч, затем к ней добавляли 25 мл 1 н.NaOH и 100 мл EtOAc и слои отделяли. Водный слой снова экстрагировали EtOAc (260 мл), объединенные органические слои сушили над MgSO4 и выпаривали. Остаток очищали флэш-колоночной хроматографией использованием 40 г ISCO колонки, элюируя с помощью 5% МеОН/CH2Cl2 с 0,25%NH4OH. Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (127 мг, 46% выход). Rf=0,30 (15% МеОН/CH2Cl2 + 0,2% NH4OH);TFA (9,9 мл, 128 ммоль) добавляли к DCE раствору (64 мл) примера 19, диметиламида 3-(3-фтор-4 пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты (2,05 г, 6,4 ммоль), смесь нагревали при 75 С в течение 18 ч и концентрировали для уменьшения объема, получая TFA соль промежуточного диметиламида 3-(3-фтор-4-пирролидин-1-илметилфенил)циклобут-2-енкарбоновой кислоты. Данное соединение перерастворяли в абсолютном EtOH (64 мл), затем к раствору добавляли катализатор Вилькинсона (296 мг) и данную смесь подвергали гидрированию при 60 С с использованием Н 2 при 45 фунт/кв.дюйм. После 1 ч 45 мин периода реакции смесь концентрировали для уменьшения объема и остаток перерастворяли в 1 н. HCl (50 мл) и экстрагировали дважды с помощью EtOAc (2120 мл). Водный слой затем подщелачивали с помощью 15% водн. NaOH (40 мл) и экстрагировали EtOAc(3200 мл). Объединенные органические фазы сушили над MgSO4 и концентрировали для уменьшения объема с получением сырого продукта. Продукт очищали флэш-хроматографией использованием 120 гISCO колонки и 4% MeOH/CH2Cl2 с 0,1% NH4OH. Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (1,0 г, 51% выход).TFA (10,2 мл, 133 ммоль) добавляли к DCE раствору (66 мл) примера 8, N-2-фтор-4-[1-гидрокси-3(пирролидин-1-илкарбонил)циклобутил]бензилпирролидина (2,3 г, 6,7 ммоль), смесь нагревали при 75 С в течение 18 ч и концентрировали для уменьшения объема, получая TFA соль промежуточного[3-(3-фтор-4-пирролидин-1-илметилфенил)циклобут-2-енил]пирролидин-1-илметанона. Данное соединение перерастворяли в абсолютном EtOH (67 мл), затем к раствору добавляли катализатор Вилькинсона(308 мг) и смесь подвергали гидрированию при 60 С с использованием Н 2 при 45 фунт/кв.дюйм. После- 28013602 1 ч 45 мин периода реакции смесь концентрировали для уменьшения объема, остаток перерастворяли в 1 н. HCl (50 мл) и экстрагировали дважды с помощью EtOAc (2120 мл). Водный слой затем подщелачивали с помощью 15% водн. NaOH (40 мл) и экстрагировали EtOAc (3200 мл). Объединенные органические фазы сушили над MgSO4 и концентрировали для уменьшения объема с получением сырого продукта. Продукт очищали флэш-хроматографией с использованием 120 г ISCO колонки и 4% МеОН/CH2Cl2 с 0,1% NH4OH. Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (1,1 г, 50% выход). Rf=0,40 (10% МеОН/CH2Cl2 + 0,2% NH4OH); LRMS m/z вычислено для C20H27FN2O, 330,4, найдено, 331,4 (М+1) APCI; 400 МГц 1 Н ЯМР (CDCl3)7,30 (т, J=7,6 Гц, 1 Н), 6,97 (дд, J=l,3, 7,9 Гц, 1 Н), 6,91 (дд, J=1,3, 11,2 Гц, 1 Н),3,66 (с, 2 Н), 3,73-3,63 (м, 1 Н), 3,50 (т, J=6,7 Гц, 2 Н), 3,31 (т, J=6,5 Гц, 2 Н), 3,22-3,14 (м, 1 Н), 2,77-2,69 (м,2H), 2,58-2,51 (м, 4 Н), 2,38-2,28 (м, 2 Н), 1,97-1,81 (м, 4 Н), 1,80-1,74 (м, 4 Н); 100 МГц 13 С ЯМР (CDCl3)173,4, 161,4 (д, JC-F=246,5 Гц), 147,4, 131,6 (д, JC-F=4,50 Гц), 122,1, 113,2 (д, JC-F=22,6 Гц), 112,5, 54,1, 52,7,46,2, 46,1, 36,1, 34,6, 31,5, 26,3, 24,5, 23,6. Пример 41. Изобутиламид 3-(3-фтор-4-пирролидин-1-илметилфенил)циклобутанкарбоновой кислоты.TFA (14 мл, 184 ммоль) добавляли к DCE раствору (80 мл) примера 20, изобутиламида 3-(3-фтор-4 пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты (3,2 г, 9,2 ммоль), смесь нагревали при 75 С в течение 18 ч и концентрировали для уменьшения объема, получая TFA соль промежуточного изобутиламида 3-(3-фтор-4-пирролидин-1-илметилфенил)циклобут-2-енкарбоновой кислоты. Данное соединение перерастворяли в абсолютном EtOH (90 мл), затем к раствору добавляли катализатор Вилькинсона (424 мг) и смесь подвергали гидрированию при 60 С с использованием Н 2 при 45 фунт/кв.дюйм. После 2 ч периода реакции смесь концентрировали для уменьшения объема и остаток перерастворяли в 1 н. HCl (60 мл) и экстрагировали дважды с помощью EtOAc (2120 мл). Водный слой затем подщелачивали с помощью 15% водн. NaOH (40 мл) и экстрагировали EtOAc (3200 мл). Объединенные органические фазы сушили над MgSO4 и концентрировали для уменьшения объема с получением сырого продукта. Продукт очищали флэш-хроматографией с использованием 120 г ISCO колонки и 4 и 8%MeOH/CH2Cl2 с 0,1% NH4OH. Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (885 мг, 26% выход). Rf=0,30 (10% МеОН/СН 2 С 12 + 0,2% NH4OH); LRMS m/z вычислено для C20H29FN2O, 332,4, найдено, 333,5 (М+1) APCI; 400 МГц 1 Н ЯМР (CDCl3)7,22 (т, J=7,9 Гц, 1 Н), 6,87 (дд, J=0,8, 8,7 Гц, 1 Н), 6,82 (дд, J=1,2, 16,2 Гц, 1 Н),6,08 (м), 3,72-3,61 (м, 1 Н), 3,57 (с, 2 Н), 3,04 (т, J=6,3 Гц, 2 Н), 3,02-2,82 (м, 1 Н), 2,65-2,56 (м, 2 Н), 2,50-2,43TFA (13 мл, 169 ммоль) добавляли к DCE раствору (71 мл) примера 12, этиламида 3-(3-фтор-4 пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты (2,7 г, 8,4 ммоль), смесь нагревали при 75 С в течение 18 ч и концентрировали для уменьшения объема, получая соль TFA промежуточного этиламида 3-(3-фтор-4-пирролидин-1-илметилфенил)циклобут-2-енкарбоновой кислоты. Данное соединение перерастворяли в абсолютном EtOH (84 мл), затем к раствору добавляли катализатор Вилькинсона (390 мг) и смесь подвергали гидрированию при 60 С с использованием Н 2 при 45 фунт/кв.дюйм. После 2 ч периода реакции смесь концентрировали для уменьшения объема и остаток перерастворяли в 1 н. HCl (60 мл) и экстрагировали дважды с помощью EtOAc (2120 мл). Водный слой затем подщелачивали с помощью 15% водн. NaOH (40 мл) и экстрагировали EtOAc (3250 мл). Объединенные органические фазы сушили над MgSO4 и концентрировали для уменьшения объема с получением сырого продукта. Продукт очищали флэш-хроматографией с использованием 120 г ISCO колонки и 4 и 8% МеОН/CH2Cl2 с 0,1% NH4OH. Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (1,0 г, 39% выход). Rf=0,30 (10% МеОН/CH2Cl2 + 0,2% NH4OH); LRMS m/z вычислено для C18H25FN2O, 304,4, найдено, 305,5 (М+1) APCI; 400 МГц 1H ЯМР (CDCl3)7,13 (т, J=7,9 Гц, 1 Н), 6,79 (дд, J=l,2, 7,9 Гц, 1 Н), 6,82 (дд, J=11,2, 0,8 Гц, 1 Н),6,68 (м, 1 Н), 3,64-3,53 (м, 1 Н), 3,48 (с, 2 Н), 3,20-3,10 (м, 2 Н), 2,94-2,84 (1 Н), 2,58-2,50 (м, 2 Н), 2,44-2,32TFA (13,5 мл, 175 ммоль) добавляли к DCE раствору (87 мл) примера 14, этилметиламида 3-(3 фтор-4-пирролидин-1-ил)метилфенил)-3-гидроксициклобутанкарбоновой кислоты (2,9 г, 8,74 ммоль),смесь нагревали при 75 С в течение 18 ч и концентрировали для уменьшения объема, получая TFA соль промежуточного этилметиламида 3-(3-фтор-4-пирролидин-1-илметилфенил)циклобут-2-енкарбоновой кислоты. Данное соединение перерастворяли в абсолютном EtOH (87 мл), затем к раствору добавляли- 29013602 катализатор Вилькинсона (404 мг) и смесь подвергали гидрированию при 60 С с использованием Н 2 при 45 фунт/кв.дюйм. После 2 ч периода реакции смесь концентрировали для уменьшения объема и остаток перерастворяли в 1 н. HCl (60 мл) и экстрагировали дважды с помощью EtOAc (2120 мл). Водный слой затем подщелачивали с помощью 15% водн. NaOH (40 мл) и экстрагировали EtOAc (3250 мл). Объединенные органические фазы сушили над MgSO4 и концентрировали для уменьшения объема с получением сырого продукта. Продукт очищали флэш-хроматографией с использованием 120 г ISCO колонки и 4 и 8% МеОН/CH2Cl2 с 0,1% NH4OH. Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении, получая указанное в заголовке соединение (1,4 г, 44% выход). Rf=0,30 (10% МеОН/CH2Cl2 + 0,2% NH4OH); LRMS m/z вычислено для C19H27FN2O, 318,4, найдено, 319,5 (М+1) APCI; 400 МГц 1 Н ЯМР (CDCl3)7,19 (т, J=7,9 Гц, 1 Н), 6,85 (дд, J=1,3, 7,9 Гц, 1 Н), 6,79 (дд, J=1,3, 11,2 Гц, 1 Н),3,58-3,44 (м, 1 Н), 3,52 (с, 2 Н), 3,33 (кв., J=2,9 Гц, 1 Н), 3,20-3,07 (м, 2 Н), 2,83 (с, 3 Н), 2,76 (с, 3 Н), 2,66-2,56(CDCl3) 1:1 смесь ротомеров,174,2, 173,9, 161,2 (д, JC-F=246,5 Гц), 147,1, 131,4, 123,3 (д, JC-F=15,0 Гц),121,9, 113,1 (д, JC-F=21,8 Гц), 54,0, 52,6, 43,9, 42,6, 36,0, 35,8, 34,1, 33,6, 33,0, 32,7, 31,8, 31,6, 23,6, 13,8,12,4. Пример 44. [3-(3-Хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутил]пиперидин-1-илметанон. Раствор примера 32, [3-(3-хлор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутил]пиперидин 1-илметанон (106 мг, 0,28 ммоль) в дихлорметане (5 мл) охлаждали до -78 С и добавляли по каплям к охлажденному до -78 С раствору BAST (0,1 мл, 0,31 ммоль) в дихлорметане (5 мл) в атмосфере азота. После 1 ч перемешивания при -78 С реакционную смесь выливали в насыщенный водн. NaHCO3 (15 мл) и перемешивали в течение 15 мин. Слои отделяли и после еще двух экстракций водной фазы с помощьюCH2Cl2 (220 мл) объединенные органические экстракты сушили над MgSO4 и концентрировали при пониженном давлении с получением масла в остатке. Масло очищали флэш-хроматографией с использованием 12 г ISCO колонки и 2% МеОН/CH2Cl2 с выделением указанного в заголовке соединения(28 мг, 26% выход). Rf=0,30 (5% МеОН/CH2Cl2); LRMS m/z вычислено для C21H28 ClFN2O, 378,9, найдено, 379,4, 359,4 (М+1) и (M+1-HF) APCI; 400 МГц 1 Н ЯМР (CDCl3)7,50-7,46 (м, 1 Н), 7,40 (ушир.с, 1 Н),7,28 (дд, J=1,3, 7,9 Гц, 1 Н), 3,74 (с, 2 Н), 3,70-3,52 (м, 3 Н), 3,38-3,32 (м, 2 Н), 2,96-2,80 (м, 2 Н), 2,78-2,66 (м,2 Н), 2,64-2,54 (м, 4 Н), 1,84-1,74 (м, 4 Н), 1,68-1,60 (м, 2 Н), 1,58-1,50 (м, 4 Н). Пример 45. Изобутилметиламид 3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты. Раствор примера 33, изобутилметиламид 3-(3-хлор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты (102 мг, 0,27 ммоль) в дихлорметане (5 мл) охлаждали до -78 С и добавляли по каплям к охлажденному до -78 С раствору BAST (0,06 мл, 0,30 ммоль) в дихлорметане (5 мл) в атмосфере азота. После 1 ч перемешивания при -78 С реакционную смесь выливали в насыщенный водн.NaHCO3 (15 мл) и перемешивали в течение 15 мин. Слои отделяли и после еще двух экстракций водной фазы с помощью CH2Cl2 (220 мл) объединенные органические экстракты сушили над MgSO4 и концентрировали при пониженном давлении с получением масла в остатке. Масло очищали флэшхроматографией с использованием 12 г ISCO колонки и 2% МеОН/CH2Cl2 с выделением указанного в заголовке соединения (24 мг, 23% выход). Rf=0,30 (5% МеОН/CH2Cl2); LRMS m/z вычислено дляC21H30ClFN2O, 380,9, найдено, 381,4, 361,4 (М+1) и (M+1-HF) APCI; 400 МГц 1 Н ЯМР (CDCl3) 1:1 смесь ротомеров, диагностические пики,3,74 (с, 2 Н), 3,56-3,51 (м, 1 Н), 3,21 (д, J=7,9 Гц, 1 Н), 3,07 (д, J=7,5 Гц,1 Н), 2,62-2,54 (м, 4 Н), 2,00-1,88 (м, 1 Н), 1,85-1,75 (м, 4 Н); 100 МГц 13 С ЯМР (CDCl3) 1:1 смесь ротомеров, 173,7, 173,4, 136,8, 134,0, 130,8, 125,8, 125,8, 123,3, 123,2, 57,2, 56,8, 55,5, 54,4, 35,6, 34,2, 31,0, 39,2,27,6, 26,9, 23,8, 20,2, 20,1. Пример 46. Циклопропилметиламид 3-(3-хлор-4-пирролидин-1-илметилфенил)-3-фторциклобутанкарбоновой кислоты. Раствор примера 34, циклопропилметиламид 3-(3-хлор-4-пирролидин-1-илметилфенил)-3-гидроксициклобутанкарбоновой кислоты (92 мг, 0,25 ммоль) в дихлорметане (5 мл) охлаждали до -78 С и добавляли по каплям к охлажденному до -78 С раствору BAST (0,05 мл, 0,28 ммоль) в дихлорметане (5 мл) в атмосфере азота. После 1 ч перемешивания при -78 С реакционную смесь выливали в насыщенный водн.NaHCO3 (15 мл) и перемешивали в течение 15 мин. Слои отделяли и после еще двух экстракций водной фазы с помощью CH2Cl2 (220 мл) объединенные органические экстракты сушили над MgSO4 и концентрировали при пониженном давлении с получением масла в остатке. Масло очищали флэшхроматографией с использованием 12 г ISCO колонки и 2% МеОН/CH2Cl2 с выделением указанного в заголовке соединения (47 мг, 51% выход). Rf=0,35 (5% МеОН/СН 2 С 12); LRMS m/z вычислено для
МПК / Метки
МПК: C07D 207/04, A61K 31/165, C07C 237/24
Метки: рецептора, гистамина-3, антагонисты
Код ссылки
<a href="https://eas.patents.su/30-13602-antagonisty-receptora-gistamina-3.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты рецептора гистамина-3</a>
Предыдущий патент: Производные 5-пиридазинил-1-азабицикло [3.2.1] октана, их получение и применение в терапии
Следующий патент: Добавка к цементу с двойной функцией
Случайный патент: Соединительное устройство для вала


































