Производные 5-фенилпентановой кислоты в качестве ингибиторов матричной металлопротеиназы для лечения астмы и других заболеваний
Номер патента: 13539
Опубликовано: 30.06.2010
Авторы: Кхера Манож Кумар, Саттигери Висваджанани Джитендра, Дастидар Сунанда Г., Рэй Абхиджит, Волети Среедхара Рао, Палле Венката П.
Формула / Реферат
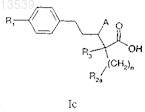
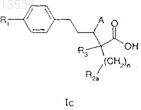
1. Соединение формулы Ic

в которой n имеет значение от 1 до 2;
R1 представляет собой необязательно замещенный (С1-С6)алкил, (С2-C6)алкенил, (С2-С6)алкинил, (С3-С8)циклоалкил, (С6-С14)арил, (С3-С10)гетероциклил, содержащий один или более гетероатомов, таких как N, О или S, (С3-С10)гетероарил, содержащий один или более гетероатомов, таких как N, О или S, (С6-С14)аралкил, (C1-С6)алкокси, арилокси, алкенилокси или алкинилокси;
R2a представляет собой NR4R5, NHC(=Y)R4, NHC(=Y)NR5Rx, NHC(=O)OR4, NHSO2R4, амидино или гуанидин, где
Y представляет собой атом кислорода или серы,
R4 представляет собой (C1-С6)алкил, (С2-C6)алкенил, (С2-C6)алкинил, (С3-С8)циклоалкил, (С6-С14)арил, (С3-С10)гетероциклил, содержащий один или более гетероатомов, таких как N, О или S, (С6-С14)аралкил, гетероарил(С1-С3)алкил, гетероциклил(С1-С3)алкил или циклоалкил(С1-С3)алкил;
R5 представляет собой водород или R4,
R4 и R5необязательно образуют вместе (С3-С10)гетероциклическое кольцо, содержащее один или более гетероатомов, таких как О, N или S, и
Rx представляет собой R4или -SO2N(R4)2;
R3 представляет собой водород, фтор, (С1-С6)алкил, (С3-C8)циклоалкил или (С6-С14)аралкил;
А представляет собой необязательно ОН, OR4, -OC(=O)NR4R5, О-ацил, NH2, NR4R5, -NHC(=Y)R4, -NHC(=Y)NR5Rx, -NHC(=O)OR4, -NHSO2R4;
при условии, что R2a не выбираются из
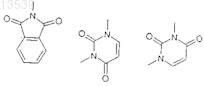
2. Соединение по п.1 структурной формулы Ic

где R1представляет собой необязательно замещенный (С3-С10)гетероарил, содержащий один или более гетероатомов, таких как N, О или S.
3. Соединение по п.1 структурной формулы Ic

где R2a представляет собой группу формулы
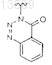
4. Соединение по п.1 структурной формулы Ic

где R1представляет собой замещенный (С6-С14)арил.
5. Соединение по п.1 структурной формулы Ic
где R1представляет собой замещенный фенил.
6. Соединение по п.1 структурной формулы Ic
где R1представляет собой замещенный (С3-С10)гетероарил, содержащий один или более гетероатомов, таких как N, О или S.
7. Соединение, которое представляет собой
5-бифенил-4-ил-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 1),
2-(2-{[(бензилокси)карбонил]амино}этил)-5-бифенил-4-ил-3-гидроксипентановая кислота (соединение № 11),
5-бифенил-4-ил-3-гидрокси-2-{2-[(фенилацетил)амино]этил}пентановая кислота (соединение № 45),
5-бифенил-4-ил-3-гидрокси-2-[2-(1-оксофталазин-2(1H)-ил)этил]пентановая кислота (соединение № 47),
5-бифенил-4-ил-3-гидрокси-2-[2-(2'-оксоспиро[циклопропан-1,3'-индол]-1'(2'H)-ил)этил]пентановая кислота (соединение № 49),
3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]-5-[4'-(трифторметил)бифенил-4-ил]пентановая кислота (соединение № 59),
5-(3',4'-дифторбифенил-4-ил)-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 60),
3-гидрокси-5-(4'-метоксибифенил-4-ил)-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 64),
5-(4'-хлорбифенил-4-ил)-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 65),
3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 67),
3-гидрокси-5-(4'-метилбифенил-4-ил)-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]пентановая кислота (соединение № 68),
5-(4'-хлорбифенил-4-ил)-3-гидрокси-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]пентановая кислота (соединение № 69),
3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]-5-[4'-(трифторметокси)бифенил-4-ил]пентановая кислота (соединение № 70),
5-(4'-фторбифенил-4-ил)-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 71),
3-гидрокси-5-(4'-метилбифенил-4-ил)-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 72),
5-(4'-цианобифенил-4-ил)-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 73),
5-(4'-фторбифенил-4-ил)-3-гидрокси-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]пентановая кислота (соединение № 74),
3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]пентановая кислота (соединение № 75),
5-(4'-этилбифенил-4-ил)-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 76),
3-гидрокси-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-[4'-(трифторметил)бифенил-4-ил]пентановая кислота (соединение № 77),
5-бифенил-4-ил-3-гидрокси-2-[2-(1-оксо-4-фенил-4а,8а-дигидрофталазин-2(1H)ил)этил]пентановая кислота (соединение № 84),
5-бифенил-4-ил-3-гидрокси-2-[2-(3-оксо-2,3-дигидро-4H-1,4-бензоксазин-4-ил)этил]пентановая кислота (соединение № 85),
5-бифенил-4-ил-2-{2-[(3aR,7aS)-1,3-диоксо-1,3,3а,4,7,7а-гексагидро-2H-изоиндол-2-ил]этил}-3-гидроксипентановая кислота (соединение № 86),
5-бифенил-4-ил-2-(2-{[(4-фторфенил)сульфонил]амино}этил)-3-гидроксипентановая кислота (соединение № 87),
5-бифенил-4-ил-2-(2-{[(3-фторфенил)ацетил]амино}этил)-3-гидроксипентановая кислота (соединение № 88),
5-бифенил-4-ил-2-{2-[(4-фторбензоил)амино]этил}-3-гидроксипентановая кислота (соединение № 89),
5-бифенил-4-ил-3-гидрокси-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]пентановая кислота (соединение № 90),
5-бифенил-4-ил-3-гидрокси-2-[2-(1-оксо-1,3-дигидро-2H-изоиндол-2-ил)этил]пентановая кислота (соединение № 91),
5-бифенил-4-ил-2-[2-({[(4-фторфенил)амино]карбонил}амино)этил]-3-гидроксипентановая кислота (соединение № 92),
5-бифенил-4-ил-2-[2-(4,4-диметил-2,6-диоксопиперидин-1-ил)этил]-3-гидроксипентановая кислота (соединение № 93),
5-бифенил-4-ил-2-[2-(7,9-диоксо-8-азаспиро[4.5]дец-8-ил)этил]-3-гидроксипентановая кислота (соединение № 94),
2-(3-бифенил-4-ил-1-гидроксипропил)пент-4-иновая кислота (соединение № 95),
5-бифенил-4-ил-3-гидрокси-2-[2-(2-оксо-1,3-бензоксазол-3(2H)-ил)этил]пентановая кислота (соединение № 96),
2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]пентановая кислота (соединение № 97),
5-бифенил-4-ил-2-[2-(5,6-дихлор-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение № 102),
5-бифенил-4-ил-2-[2-(2,4-диоксо-1,4-дигидрохиназолин-3(2H)-ил)этил]-3-гидроксипентановая кислота (соединение № 103),
5-бифенил-4-ил-2-[2-(1,3-диоксо-1,3-дигидро-2H-пирроло[3,4-с]пиридин-2-ил)этил]-3-гидроксипентановая кислота (соединение № 104),
2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(3',4'-дифторбифенил-4-ил)-3-гидроксипентановая кислота (соединение № 105),
(2R,3S+2S,3R)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-фторбифенил-4-ил)-3-гидроксипентановая кислота (соединение № 106),
(2R,3S+2S,3R)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[4'-(трифторметил)бифенил-4-ил]пентановая кислота (соединение № 107),
(2R,3R+2S,3S)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-фторбифенил-4-ил)-3-гидроксипентановая кислота (соединение № 108),
(2R,3R+2S,3S)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[4'-(трифторметил)бифенил-4-ил]пентановая кислота (соединение № 109),
(2R,3R+2S,3S)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-метилбифенил-4-ил)пентановая кислота (соединение № 113),
(2R,3S+2S,3R)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-метилбифенил-4-ил)пентановая кислота (соединение № 114),
(2R,3R+2S,3S)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-метоксибифенил-4-ил)пентановая кислота (соединение № 115),
(2R,3R+2S,3S)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-хлорбифенил-4-ил)-3-гидроксипентановая кислота (соединение № 116),
(2R,3S+2S,3R)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-хлорбифенил-4-ил)-3-гидроксипентановая кислота (соединение № 117),
(2R,3S+2S,3R)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-метоксибифенил-4-ил)пентановая кислота (соединение № 118),
5-бифенил-4-ил-3-гидрокси-2-[2-(7-метил-4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 120),
5-бифенил-4-ил-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение № 121),
(2R,3S)-5-бифенил-4-ил-3-гидрокси-2-[2-(1H-индол-3-ил)этил]пентановая кислота (соединение № 122),
(2R,3R)-5-бифенил-4-ил-3-гидрокси-2-[2-(1H-индол-3-ил)этил]пентановая кислота (соединение № 123),
5-бифенил-4-ил-3-гидрокси-2-[2-(1-оксо-1,3-дигидро-2H-изоиндол-2-ил)бутил]пентановая кислота (соединение № 124),
(2R,3S)-3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 133),
(2S,3R)-3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 134),
(2R,3R)-3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 135) или
(2S,3S)-3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 136).
8. Соединение по п.7, которое представляет собой
5-бифенил-4-ил-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4Н)-ил)этил]пентановая кислота (соединение № 1) или
2-(2-{[(бензилокси)карбонил]амино}этил)-5-бифенил-4-ил-3-гидроксипентановая кислота (соединение № 11).
9. Соединение по п.7, которое представляет собой
3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]-5-[4'-(трифторметил)бифенил-4-ил]пентановая кислота (соединение № 59),
5-(3',4'-дифторбифенил-4-ил)-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 60),
3-гидрокси-5-(4'-метоксибифенил-4-ил)-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 64),
5-(4'-хлорбифенил-4-ил)-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 65),
3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 67),
5-(4'-хлорбифенил-4-ил)-3-гидрокси-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]пентановая кислота (соединение № 69),
3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]-5-[4'-(трифторметокси)бифенил-4-ил]пентановая кислота (соединение № 70),
3-гидрокси-5-(4'-метилбифенил-4-ил)-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 72),
3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]пентановая кислота (соединение № 75),
5-(4'-этилбифенил-4-ил)-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 76),
3-гидрокси-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этип]-5-[4'-(трифторметил)бифенил-4-ил]пентановая кислота (соединение № 77),
5-бифенил-4-ил-3-гидрокси-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]пентановая кислота (соединение № 90),
2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]пентановая кислота (соединение № 97),
5-бифенил-4-ил-2-[2-(5,6-дихлор-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение № 102),
(2R,3S+2S,3R)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[4'-(трифторметил)бифенил-4-ил]пентановая кислота (соединение № 107),
(2R,3R+2S,3S)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[4'-(трифторметил)бифенил-4-ил]пентановая кислота (соединение № 109),
(2R,3R+2S,3S)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-метоксибифенил-4-ил)пентановая кислота (соединение № 115),
(2R,3R+2S,3S)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-хлорбифенил-4-ил)-3-гидроксипентановая кислота (соединение № 116),
(2R,3S+2S,3R)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-хлорбифенил-4-ил)-3-гидроксипентановая кислота (соединение № 117),
(2R,3S+2S,3R)-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-метоксибифенил-4-ил)пентановая кислота (соединение № 118),
(2R,3S)-3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 133),
(2S,3R)-3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 134) или
(2S,3S)-3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение № 136).
10. Применение соединения по п.1 для использования в медицине.
11. Применение соединения по п.1 для лечения животного или человека, страдающего воспалительными заболеваниями или связанными с ними патологиями.
12. Применение соединения по п.1 для получения агента для лечения воспалительных заболеваний или связанных с ними патологий.
13. Применение соединения по п.11, используемое для лечения воспалительных заболеваний или связанных с ними патологий, которые включают астму, ревматоидный артрит, COPD, ринит, остеоартрит, псориатический артрит, псориаз, легочный фиброз, воспаление легких, острый респираторный дистрессовый синдром, периодонтит, рассеянный склероз, гингивит, атеросклероз, неоинтимальную пролиферацию, которая приводит к рестенозу и ишемической сердечной недостаточности, инсульт, почечные заболевания и опухолевые метастазы.
14. Способ получения соединения формулы VIII, включающий:
а) реакцию соединения формулы II

где hal представляет собой Cl, Br или I;
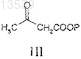
с соединением формулы III
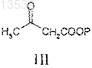
где Р представляет собой алкил или аралкил, выбранный из трет-бутила, этила, метила или бензила;
с получением соединения формулы IV
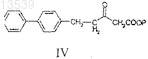
b) реакцию соединения формулы IV с соединением формулы V
![]()
где А" выбран из (С6-С14)аралкила, гетероциклил(C1-С3)алкила, гетероарил(C1-С3)алкила или (С3-С8)циклоалкил(С1-С3)алкила и
Hal представляет собой галоген, выбранный из Cl, Br или I;
с получением соединения формулы VI
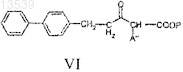
с) восстановление соединения формулы VI с получением соединения формулы VII
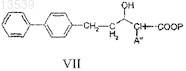
d) снятие защитных групп с соединения формулы VII с получением соединения формулы VIII
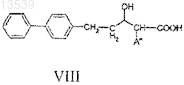
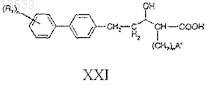
15. Способ получения соединения формулы XXI, включающий:
а) реакцию соединения формулы IX
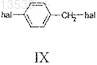
с соединением формулы III
с получением соединения формулы X
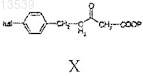
b) реакцию соединения формулы X с соединением формулы XI
![]()
с получением соединения формулы XII
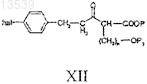
с) восстановление соединения формулы XII с получением соединения формулы XIII
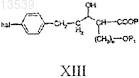
d) реакцию соединения формулы XIII с соединением формулы XIV
с получением соединения формулы XV
е) снятие защитных групп с соединения формулы XV с получением соединения формулы XVI
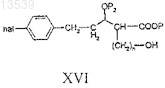
f) превращение соединения формулы XVI в соединение формулы XVII
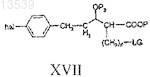
реакцией с соединением формулы L-hal;
g) реакцию соединения формулы XVII с соединением формулы М-А' или А' с получением соединения формулы XVIII
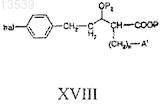
h) реакцию соединения формулы XVIII с соединением формулы XIX
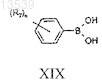
с получением соединения формулы XX
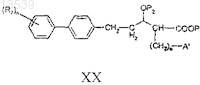
i) снятие защитных групп с соединения формулы XX с получением соединения формулы XXI
где Р представляет собой алкил или аралкил, выбранный из трет-бутила, этила или метила или бензила;
P1 представляет собой силильную защитную группу, выбранную из трет-бутилдиметилсилана, трет-бутилдифенилсилана или триизопропилсилана;
Р2 представляет собой аралкил или гетероциклил, выбранный из бензила, 4-метоксибензила, 2,4,6-триметоксибензила или тетрагидропиранила;
hal, или галоген, представляет собой Cl, Br или I;
LG представляет собой уходящую группу, такую как мезил, тозил или трифлил или галогенид (hal);
А' представляет собой (С6-С14)арил, (С3-С10)гетероарил, содержащий один или более гетероатомов, таких как N, О или S, (С3-С10)гетероциклил, содержащий один или более гетероатомов, таких как N, О или S, или (С3-С8)циклоалкил и М представляет собой атом металла, выбранный из калия, лития или натрия;
R7 представляет собой водород, галоген (F, Cl, Br, I), гидрокси, -COOR4, (C1-С4)алкил, (С2-С6)алкенил, (С2-С6)алкинил, (С3-С8)циклоалкил, (C1-С5)алкокси, (С2-С6)алкенилокси, (С2-С6)алкинилокси, (С6-С14)арилокси, гетероциклилокси, гетероарилокси, (С3-С8)циклоалкилокси, ацил, тиоацил, циано, нитро, амино, -СНО,
-OCF3, -CF3, -SCF3, -NR4R5, -C(=Y)NR4R5, -NHC(=Y)R4, -NHC(=Y)NR5Rx, -NHC(=O)OR4, -NHSO2R4,
-(SO)mR4, (C6-С14)арил, (С3-C10)гетероциклил, содержащий один или более гетероатомов, таких как N, О или S, (С3-С10)гетероарил, содержащий один или более гетероатомов, таких как N, О или S, гетероциклил(С1-С3)алкил или гетероарил(С1-С3)алкил, которые далее необязательно могут быть замещены;
R4 представляет собой (C1-С6)алкил, (С2-С6)алкенил, (С2-С6)алкинил, (С3-C8)циклоалкил, (С6-С14)арил, (С3-С10)гетероциклил, содержащий один или более гетероатомов, таких как N, О или S, (С3-С10)гетероарил, содержащий один или более гетероатомов, таких как N, О или S, (С6-С14)аралкил, гетероарил(С1-С3)алкил, гетероциклил(С1-С3)алкил или (С3-С8)циклоалкил(С1-С3)алкил;
m имеет значение 0-2;
R5 представляет собой водород или R4 и
Rx представляет собой R4или -SO2N(R4)2.
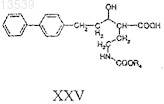
16. Способ получения соединения формулы XXV, включающий:
а) реакцию соединения формулы IV
где Р представляет собой алкил или аралкил, выбранный из трет-бутила, этила, метила или бензила;

с соединением формулы XXII
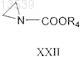
R4 представляет собой (C1-С6)алкил, (С2-С6)алкенил, (С2-С6)алкинил, (С3-С8)циклоалкил, (С6-С14)арил, (С3-С10)гетероциклил, содержащий один или более гетероатомов, таких как N, О или S, (С3-С10)гетероарил, содержащий один или более гетероатомов, таких как N, О или S, (С6-С14)аралкил, гетероарил(С1-С3)алкил, гетероциклил(С1-С3)алкил или (С3-С8)циклоалкил(С1-С3)алкил;
с получением соединения формулы XXIII
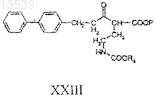
b) восстановление соединения формулы XXIII с получением соединения формулы XXIV
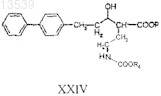
с) снятие защитных групп с соединения формулы XXIV с получением соединения формулы XXV
17. Способ получения соединения формулы XXXI, включающий:
а) реакцию соединения формулы XXIV
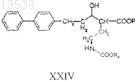
с соединением формулы XXVI
![]()
с получением соединения формулы XXVII
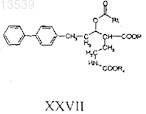
где Р представляет собой алкил или аралкил, выбранный из трет-бутила, этила, метила или бензила;
Rt представляет собой (С1-С6)алкил, (С6-С14)арил, (С3-С8)циклоалкил, (С6-С14)аралкил, гетероциклил(С1-С3)алкил или гетероарил(С1-С3)алкил; и
R4 представляет собой (С1-С6)алкил, (С2-С6)алкенил, (С2-С6)алкинил, (С3-С8)циклоалкил, (С6-С14)арил, (С3-С10)гетероциклил, содержащий один или более гетероатомов, таких как N, О или S, (С3-С10)гетероарил, содержащий один или более гетероатомов, таких как N, О или S, аралкил, гетероарил(С1-С3)алкил, гетероциклил(С1-С3)алкил или (С3-С8)циклоалкил(С1-С3)алкил;
b) снятие защитных групп с соединения формулы XXVII с получением соединения формулы XXVIII
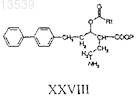
где Р и Rt являются такими, как определено выше;
с) получение производного соединения формулы XXVIII с соединением формулы RD, где RD представляет собой R4COhal, halCOOR4, R4SO2hal или (R4)N=C(=Y), hal представляет собой Cl, Br или I и Y представляет собой атом кислорода или серы; с получением соединения формулы XXIX
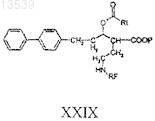
где RF и Р имеют значения, как указано выше;
d) снятие защитных групп с соединения формулы XXIX с получением соединения формулы XXX
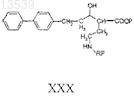
е) снятие защитных групп с соединения формулы XXX с получением соединения формулы XXXI
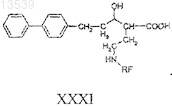
18. Способ получения соединения формулы XXXIV, включающий:
а) восстановление соединения формулы XXXII
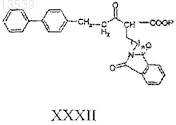
где Р представляет собой защитную группу;
с получением соединения формулы XXXIII
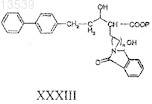
b) гидролиз соединения формулы ХХХIII с получением соединения формулы XXXIV
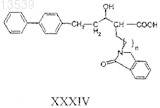
19. Способ разделения соединения формул VIII, XXI, XXV, XXXI или XXXIV на диастереомерные пары или отдельные диастереомеры препаративной тонкослойной хроматографией или ВЭЖХ (высокоэффективной жидкостной хроматографией), используя колонку с ахиральным или хиральным наполнителем.
Текст
013539 Область изобретения Настоящее изобретение относится к определенным бета-гидроксикислотам и к способам их получения. Настоящее изобретение также относится к фармакологическим композициям, содержащим соединения настоящего изобретения, и к способам лечения астмы, ревматоидного артрита, COPD, ринита, остеоартрита, псориатического артрита, псориаза, легочного фиброза, воспаления легких, острого респираторного дистрессового синдрома, периодонтита, рассеянного склероза, гингивита, атеросклероза, неоинтимальной пролиферации, которая приводит к рестенозу и ишемической сердечной недостаточности,инсульта, заболеваний почек, опухолевых метастаз и других воспалительных заболеваний, характеризующихся сверхэкспрессией и сверхактивацией матричной металлопротеиназы, используя соединения по изобретению. Предпосылки изобретения Металлопротеиназы (ММР) представляют собой встречающееся в природе суперсемейство протеиназ (ферментов), обнаруженное в большинстве млекопитающих. Суперсемейство состоит по крайней мере из 26 членов цинксодержащих ферментов, производимых многочисленными типами клеток и проявляющих структурные и функциональные особенности. Основываясь на структурных и функциональных особенностях, протеиназы классифицируют на различные семейства и подсемейства (Hopper,NM, 1994, FEBS), такие как коллагеназы (ММР-1, ММР-13), желатиназы (ММР-2, ММР-9), металлоэластазы (ММР-12), МТ-MMP (ММР-14, ММР-15) и шеддазы, такие как TNF-превращающие ферменты(ТАСЕ, АСЕ). Считается, что металлопротеиназы играют важную роль в гиперволемии процессов физиологических заболеваний, которые включают реконструкцию, такую как эмбриональное развитие, костеобразование и маточную модернизацию в течение менструации. Одной из важных биологических функцийMMP является катализ последовательности соединительных тканей или внеклеточного матрикса благодаря их способности гидролизовать различные компоненты тканей или матрикса. Кроме их роли в разрушении соединительной ткани, MMP всегда включены в активацию зимогена (про) формы других ММР, тем самым индуцируя активацию ММР. Они также участвуют в биосинтезе альфа-TNF, который участвует в многочисленных патологических состояниях. ММР-12, также известная как макрофагэластаза или металлоэластаза, экспрессируется в активированных макрофагах и, как было показано, секретируется альвеолярными макрофагами у курильщиков, а также в пенистых клетках в атеросклеротических бляшках. Исследования мышей с ММР-12 показали развитие значительной эмфиземы, тем самым подтверждая ее роль в COPD. ММР-9 (желатиназа В, коллагеназа типа IV, 92 кДа) является одним из членов семейства ММР, который высвобождается в виде профермента и далее активируется каскадом протеазы in vivo. Концентрация ММР-9 повышается при заболеваниях, таких как астма, интерстициальный легочный фиброз (IPF), респираторный дистрессовый синдром у взрослых (AKDS) и при хроническом обструктивном легочном заболевании (COPD). Благодаря ее протеолитической способности ММР-9 участвует в реконструировании ткани легочных путей и легких при хронических воспалительных заболеваниях, таких как острая астма и COPD. ММР-9 также является физиологически важной благодаря ее способности регулировать усвоение компонентов внеклеточного матрикса, а также активность других протеаз и цитокинов. ММР-9 секретируется в нейтрофилах,макрофагах, остеокластах, которые легко индуцируются цитокинами и факторами роста и играют роль в различных физиологических и патологических процессах. Сверхэкспрессия, или сверхактивация MMP, или дисбаланс между MMP и природным (т.е. эндогенным) тканевым ингибитором матричной металлопротеиназы (TIMP) связаны с патогенезом заболеваний, характеризующихся последовательностью соединительной ткани или внеклеточного матрикса. Примеры воспалительных состояний и аутоиммунных заболеваний, для которых соединения по изобретению проявляют потенциально полезные эффекты, включают заболевания респираторного тракта, такие как астма (включая вызванные аллергеном астматические реакции), циститный фиброз, бронхит(включая хронический бронхит), хроническое обструктивное легочное заболевание (COPD), респираторный дистрессовый синдром у взрослых (ARDS), хроническое легочное воспаление, ринит и воспалительные заболевания верхних дыхательных путей (URID), повреждение легких, вызванное вентилятором,силикоз, легочный саркоидоз, идиопатический легочный фиброз, бронхолегочная дисплазия, артрит, например, ревматоидный артрит, остеоартрит, инфекционный артрит, псориатический артрит, травматический артрит, краснушный артрит, синдром Рейтера, подагрический артрит и простетический суставный подагрический острый синивит, спондилит и неартикулярные воспалительные состояния, например,грыжа межпозвоночного диска/поясничная грыжа/выпадение межпозвоночного диска, бурсит, тендонит,теносиновитический фибромиалгический синдром и другие воспалительные состояния, связанные с растяжением связок и региональным скелетно-мышечным растяжением, воспалительные заболевания желудочно-кишечного тракта, например язвенный колит, дивертикулит, болезнь Крона, воспалительные заболевания кишечника, синдром раздраженного кишечника и гастрит, рассеянный склероз, системная красная волчанка, аутоиммунная экзокринопатия, аутоиммунный энцефаломиелит, диабеты, опухолевый ангиогенез и метастазы, рак, включая карциному груди, толстой кишки, прямой кишки, легких, почек, яичников, желудка, матки, поджелудочной железы, печени, ротовой полости, гортани и простаты, меланома,-1 013539 острая и хроническая лейкемия, периодонтальное заболевание, нейродегенеративное заболевание, болезнь Альцгеймера, болезнь Паркинсона, эпилепсия, мышечная дегенерация, паховая грыжа, дистрофия сетчатки, диабетическая ретинопатия, дистрофия желтого пятна, воспаление глаз, заболевания резорбции кости, остеопороз, остеопетроз, реакция отторжения аллографта хозяина, сепсис, эндотоксемия, синдром токсического шока, туберкулез, обыкновенная интерстициальная и криптогенная организованная пневмония, бактериальный менингит, системная кахексия, кахексия, вызванная инфекцией или злокачественным образованием, кахексия, вызванная синдромом приобретенного иммунодефицита (СПИД), малярия,проказа, лейшманиоз, болезнь Лима, гломерулонефрит, гломерулосклероз, почечный фиброз, печеночный фиброз, панкреатит, гепатит, эндометриоз, боль, например, связанная с воспалением и/или травмой,воспалительные заболевания кожи, например, дерматит, кожные язвы, псориаз, экзема, системное вальвулитное сосудистое слабоумие, тромбоз, атеросклероз, рестеноз, репервузионная травма, отверждение бляшек, миокардит, аневризм, инсульт, легочная гипертензия, модернизация левого желудочка и сердечная недостаточность. Заболевания особого интереса включают COPD, и воспалительные заболевания дыхательного тракта, и суставные и сосудистые заболевания. Специалисту в данной области техники ясно, что ссылка на лечение предполагает профилактику, а также лечение упомянутых состояний. Ингибирование активности одной или нескольких MMP может быть полезным при таких заболеваниях или состояниях, например различных воспалительных и аллергических заболеваниях, таких как воспаление суставов, воспаление ЖК тракта, воспаление кожи, коллагеновая модернизация и т.д. Были проведены исследования на идентификацию ингибиторов, которые являются селективными,например, в отношении некоторых подтипов ММР. Ингибитор MMP с улучшенной эффективностью может устранить потенциальные побочные эффекты, связанные с ингибированием ММР, которые не участвуют в патогенезе излечиваемого заболевания. Кроме того, применение более селективных ингибиторов MMP требует введения меньшего количества ингибитора для лечения заболевания по сравнению с другим лечением, которые после введения разделяются in vivo на несколько ММР. Кроме того, введение более низкого количества соединения будет улучшать предел безопасности между дозой ингибитора,необходимой для терапевтической активности, и дозой ингибитора, при которой наблюдается токсичность. Разработка и терапевтическое применение ингибиторов MMP показала, что, для того чтобы молекула была эффективным ингибитором класса ферментов ММР, необходимо наличие функциональной группы (например, карбоновой кислоты, гидроксаминовой кислоты или сульфгидрильной группы), способной хелатироваться с активным сайтом Zn2+ иона (Whittaker и др., Chem. Rev., 1999, 99, 2735-76). В WO 04/110974 описаны соединения и их физиологически функциональные производные в качестве ингибиторов ферментов матричной металлопротеиназы. В WO 04/113279 описаныингибиторы матричной металлопротеиназы. В патенте US 6350885 описаны трициклические гетероароматические соединения и их производные в качестве ингибиторов матричных металлопротеиназ. В WO 98/09940 описаны бифенильные бутановые кислоты и их производные в качестве ингибиторов матричных металлопротеиназ. В J. Med. Chem., 1968, vol. 11(6), 1139-1144 описан синтез и противовоспалительная активность 4-(п-бифенилил)-3-гидроксибутановой кислоты и аналогичных соединений. В WO 96/15096 описаны защищенные 4-биарилбутановые или 5-биарилпентановые кислоты и производные в качестве ингибиторов матричной металлопротеиназы. Сущность изобретения Настоящее изобретение раскрывает новый класс соединений, которые являются двойными ингибиторами ММР-9/12 и имеют желаемые профили активности. Соединения настоящего изобретения обладают полезной активностью, селективностью и/или фармакологическими профилями. В одном варианте осуществления предложены ингибиторы матричной металлопротеазы, которые могут быть полезны в качестве безопасных и эффективных терапевтических или профилактических агентов для лечения различных воспалительных и аллергических заболеваний. Также предложены способы получения таких соединений. В другом варианте осуществления предложены фармацевтические композиции, содержащие такие соединения вместе с приемлемыми носителями, эксципиентами или разбавителями, которые могут быть полезны для лечения воспалительных и аутоиммунных заболеваний. Также описаны рацематы, энантиомеры, диастереомеры, ротационные изомеры, N-оксиды, полиморфы, фармацевтически приемлемые соли и фармацевтически приемлемые сольваты этих соединений,пролекарства и метаболиты, обладающие тем же видом активности, а также фармацевтические композиции, содержащие соединения, их метаболиты, рацематы, энантиомеры, диастереомеры, конформационные изомеры, N-оксиды, полиморфы, сольваты или их фармацевтически приемлемые соли, в комбинации с фармацевтически приемлемым носителем и необязательно включающие эксципиенты. Другие варианты осуществления приведены далее в следующем описании и частично будут ясны из описания или могут быть выяснены при осуществлении изобретения.-2 013539 В соответствии с одним вариантом осуществления предложены соединения структурной формулы I где n имеет значение от 1 до 5;R1 может представлять собой необязательно замещенный алкил, алкенил, алкинил, циклоалкил,арил, гетероциклил, гетероарил, аралкил, алкокси, арилокси, алкенилокси или алкинилокси;R2 может представлять собой алкенил, алкинил, арил, гетероциклил, гетероарил, циклоалкил,NR4R5, -NHC(=Y)R4, -NHC(=Y)NR5Rx, -NHC(=O)OR4, -NHSO2R4, C(=Y)NR4R5, С(=О)OR6 (где Y может представлять собой атом кислорода или серы), OR5, -OC(=O)NR4R5, О-ацил, S(O)mR4, -SO2N(R4)2, циано,амидино или гуанидино [где R4 может представлять собой алкил, алкенил, алкинил, циклоалкил, арил,гетероциклил, гетероарил, аралкил, гетероарилалкил, гетероциклилалкил или циклоалкилалкил; m имеет значение 0-2; R5 может представлять собой водород или R4; Rx может представлять собой R4 илиR3 может представлять собой водород, фтор, алкил, циклоалкилалкил или аралкил; А может представлять собой ОН, OR4, -OC(=O)NR4R5, О-ацил, NH2, NR4R5, -NHC(=Y)R4,-NHC(=Y)NR5Rx, -NHC(=O)OR4, -NHSO2R4. В одном варианте осуществления изобретение относится к соединениям общей формулы Ia где А 1 может представлять собой OH, -OC(=O)NR4R5, NH2, NR4R5, -NHC(=Y)R4, -NHC(=Y)NR5Rx,-NHC(=O)OR4, -NHSO2R4;n, R1, R2, R3 и R4 могут быть такими, как определено выше. В другом варианте осуществления изобретение относится к соединениям общей формулы Ib где R1a может представлять собой арил или гетероарил;n, R2, R3 и А могут быть такими, как определено выше. В другом варианте осуществления изобретение относится к соединениям общей формулы Ic где R2a может представлять собой NR4R5, -NHC(=Y)R4, -NHC(=Y)NR5Rx, -NHC(=O)OR4, -NHSO2R4,амидино или гуанидино [где Y может представлять собой атом кислорода или серы и R4 может представлять собой алкил, алкенил, алкинил, циклоалкил, арил, гетероциклил, гетероарил, аралкил, гетероарилалкил, гетероциклилалкил или циклоалкилалкил и m имеет значение 0-2; R5 представляет собой водород или R4; R4 и R5 вместе могут необязательно образовывать гетероциклическое кольцо, содержащее один или несколько гетероатомов, таких как О, N или S, и Rx представляет собой R4 или -SO2N(R4)2];-3 013539 В еще одном варианте осуществления изобретение относится к соединениям, которые включают,например, следующие: 5-бифенил-4-ил-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение 1),5-(4'-трет-бутилбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 2),5-(4'-бутилбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 3),5-(4'-хлорбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 4),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-трифторметоксибифенил-4 ил)пентановая кислота (соединение 5),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-этоксибифенил-4-ил)-3-гидроксипентановая кислота (соединение 6),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-формилбифенил-4-ил)-3-гидроксипентановая кислота (соединение 7),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(2',4',6'-триметоксибифенил-4 ил)пентановая кислота (соединение 8),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-пропоксибифенил-4 ил)пентановая кислота (соединение 9),5-(3',4'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 10),2-(2-[(бензилокси)карбонил]аминоэтил)-5-бифенил-4-ил-3-гидроксипентановая кислота (соединение 11),5-бифенил-4-ил-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 12),(2R,3S+2S,3R)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-формилбифенил-4-ил)-3 гидроксипентановая кислота (соединение 13),(2R,3R+2S,3S)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-формилбифенил-4-ил)-3 гидроксипентановая кислота (соединение 14),(2R,3R+2S,3S)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(2',4',6'триметоксибифенил-4-ил)пентановая кислота (соединение 15),(2R,3S+2S,3R)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(2',4',6'триметоксибифенил-4-ил)пентановая кислота (соединение 16),(2R,3S+2S,3R)-5-(4'-ацетилбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3 гидроксипентановая кислота (соединение 17),(2R,3R+2S,3S)-5-(4'-ацетилбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3 гидроксипентановая кислота (соединение 18),(2R,3S+2S,3R)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-пропоксибифенил-4-ил)пентановая кислота (соединение 19),(2R,3R+2S,3S)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-пропоксибифенил-4-ил)пентановая кислота (соединение 20),(2R,3S+2S,3R)-5-(3',4'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]3-гидроксипентановая кислота (соединение 21),(2R,3R+2S,3S)-5-(3',4'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]3-гидроксипентановая кислота (соединение 22),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-метоксибифенил-4 ил)пентановая кислота (соединение 23),5-(2',3'-диметилбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 24),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[3'-(трифторметил)бифенил-4 ил]пентановая кислота (соединение 25),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-этилбифенил-4-ил)-3-гидроксипентановая кислота (соединение 26),5-(3',5'-дихлорбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 27),5-[4'-хлор-3'-(трифторметил)бифенил-4-ил]-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3 гидроксипентановая кислота (соединение 28),5-(2',5'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 29),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[2'-(трифторметокси)бифенил 4-ил]пентановая кислота (соединение 30),-4 013539 2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[4'-(метилтио)бифенил-4 ил]пентановая кислота (соединение 31),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-фтор-3'-метилбифенил-4-ил)-3 гидроксипентановая кислота (соединение 32),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(3'-изопропилбифенил-4 ил)пентановая кислота (соединение 33),5-(3',4'-диметилбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 34),5-(2',6'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 35),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-фторбифенил-4-ил)-3-гидроксипентановая кислота (соединение 36),5-(3',5'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 37),5-(3'-хлор-4'-фторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 38),5-(3',4'-диметоксибифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 39),5-(3'-хлорбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 40),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(3'-метилбифенил-4 ил)пентановая кислота (соединение 41),5-(2',3'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 42),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(2'-фтор-3'-метоксибифенил-4-ил)-3 гидроксипентановая кислота (соединение 43),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(3'-фтор-4'-метилбифенил-4-ил)-3 гидроксипентановая кислота (соединение 44),5-бифенил-4-ил-3-гидрокси-2-2-[(фенилацетил)амино]этилпентановая кислота(2S,3S)-3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)ил)этил]пентановая кислота (соединение 136). В другом варианте осуществления изобретение включает разделение отдельных энантиомерных или диастереомерных пар или отдельных диастереомеров. Специалист в данной области техники изобретения может необязательно выбрать один или несколько путей для получения хирально чистых соединений. Настоящее изобретение включает разделение определенного набора соединений либо в виде диастереомерных пар, либо в виде отдельных диастереомеров препаративной жидкостной хроматографией и/или ВЭЖХ, используя при необходимости колонку с ахиральным или хиральным наполнителем. В другом варианте осуществления настоящее изобретение относится к терапевтически эффективной дозе соединения формулы I в комбинации с одним или несколькими другими терапевтическими агентами, использующимися для лечения различных воспалительных и аллергических заболеваний. Примеры таких терапевтических агентов включают, но не ограничиваются ими: 1) противовоспалительные агенты, экспериментальные или коммерчески доступные, такие как(i) нестероидные противовоспалительные агенты пироксикам, диклофенак, пропионовые кислоты, фенаматы, пиразолоны, салицилаты, ингибиторы PDE-4/p38 MAP киназы/катепсина,(ii) ингибиторы лейкотриенов LTC4/LTD4/LTE4/LTB4, ингибиторы 5-липоксигеназы и антагонисты рецептора PAF, (iii) ингибиторы Сох-2, (iv) ингибиторы MMP и (v) ингибиторы интерлейкина-1; 2) антигипертензивные агенты, такие как (i) ингибиторы АСЕ, например эналаприл, лизиноприл,валсартан, телмисартан и хинаприл, (ii) антагонисты и агонисты рецептора ангиотензина II, например лосартан, кандесартан, ирбесартан, валсартан и эпросартан, (iii) -блокаторы и (iv) блокаторы кальциевых каналов; 3) иммунодепрессанты, такие как циклоспорин, азатиоприн и метотрексат, и противовоспалительные кортикостероиды. К использующимся здесь терминам применяются следующие определения. Термин "алкил", если не указано иное, обозначает монорадикальную разветвленную или неразветвленную насыщенную углеводородную цепь, содержащую от 1 до 20 атомов углерода. Этот термин может быть представлен группами, такими как метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторбутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, н-децил, тетрадецил и им подобными. Алкильные группы могут быть замещены далее одним или несколькими заместителями, выбранными из алкенила, алкинила, алкокси, циклоалкила, циклоалкенила, ацила, ациламино, ацилокси, алкоксикарбониламино, азидо, циано, галогена, гидрокси, оксо, тиокарбонила, карбокси, карбоксиалкила, арила,гетероциклила, гетероарила, арилтио, тиола, алкилтио, арилокси, нитро, аминосульфонила, СООН,аминокарбониламино, -NHC(=O)Rf, -NRfRq, -C(=O)NRfRq, -NHC(=O)NRfRq, -С(=О)гетероарила,С(=О)гетероциклила, -O-C(=O)NRfRq где Rf и Rq независимо выбраны из алкила, алкенила, циклоалкила, циклоалкенила, арила, аралкила, гетероциклила, гетероарила, гетероциклилалкила, гетероарилалкила, нитро или -SO2R6 (где R6 представляет собой алкил, алкенил, алкинил, циклоалкил, аралкил, арил,гетероциклил, гетероарил, гетероарилалкил или гетероциклилалкил). Если иное не предусмотрено определением, алкильные заместители могут быть далее замещены 1-3 заместителями, выбранными из алкила, карбокси, -NRfRq, -C(=O)NRfRq, -OC(=O)NRfRq, -NHC(=O)NRfRq(где R6 является таким, как определено выше); или алкильная группа также может прерываться 1-5 атомами групп, независимо выбранных из кислорода, серы или -NRa- где Ra выбран из водорода, алкила,циклоалкила, алкенила, циклоалкенила, алкинила, арила, ацила, аралкила, -С(=О)ORf (где Rf является таким, как определено выше), SO2R6 (где R6 является таким, как определено выше) или -C(=O)NRfRq (гдеRf и Rq являются такими, как определено выше). Если иное не предусмотрено описанием, все заместители могут быть замещены далее 1-3 заместителями, выбранными из алкила, карбокси, -NRfRq,-C(=O)NRfRq, -O-C(=O)NRfRq (где Rf и Rq являются такими, как определено выше), гидрокси, алкокси,галогена, CF3, циано и -SO2R6 (где R6 является таким, как определено выше); или алкильная группа, как определено выше, имеет два заместителя, как определено выше, а также прерывается 1-5 атомами или группами, как определено выше. Термин "алкенил", если не указано иное, обозначает монорадикальную разветвленную или неразветвленную ненасыщенную углеводородную группу, содержащую от 2 до 20 атомов углерода с цис-,транс- или геминальной конфигурацией. В случае, когда алкенил присоединен к гетероатому, двойная связь не может находиться в альфа-положении по отношению к гетероатому. Алкенильные группы могут быть замещены далее одним или несколькими заместителями, выбранными из алкила, алкинила, алкокси, циклоалкила, циклоалкенила, ацила, ациламино, ацилокси, -NHC(=O)Rf, -NRfRq, -C(=O)NRfRq,-NHC(=O)NRfRq, -O-C(=O)NRfRq (где Rf и Rq являются такими, как определено выше), алкоксикарбониламино, азидо, циано, галогена, гидрокси, оксо, тиокарбонила, карбокси, арилтио, тиола, алкилтио, арила, аралкила, арилокси, гетероциклила, гетероарила, гетероциклилалкила, гетероарилалкила, аминосульфонила, аминокарбониламино, алкоксиамино, нитро или SO2R6 (где R6 является таким, как определено выше). Если другое не предусмотрено описанием, алкенильные заместители необязательно могут быть замещены далее 1-3 заместителями, выбранными из алкила, карбокси, гидрокси, алкокси, галогена, -CF3,циано, -NRfRq, -C(=O)NRfRq, -O-C(=O)NRfRq (где Rf и Rq являются такими, как определено выше) и-SO2R6 (где R6 является таким, как определено выше). Термин "алкинил", если не указано иное, обозначает монорадикальный ненасыщенный углеводород, присоединен к гетероатому, тройная связь не может находиться в альфа-положении по отношению к гетероатому. Алкинильные группы могут быть замещены далее одним или несколькими заместителями,выбранными из алкила, алкенила, алкокси, циклоалкила, циклоалкенила, ацила, ациламино, ацилокси,алкоксикарбониламино, азидо, циано, галогена, гидрокси, оксо, тиокарбонила, карбокси, арилтио,тиола, алкилтио, арила, аралкила, арилокси, аминосульфонила, аминокарбониламино, нитро, гетероциклила, гетероарила, гетероциклилалкила, гетероарилалкила, -NHC(=O)Rf, -NRfRq, -NHC(=O)NRfRq,-C(=O)NRfRq, -O-C(=O)NRfRq (где Rf и Rq являются такими, как определено выше) или -SO2R6 (где R6 является таким, как определено выше). Если иное не предусмотрено описанием, алкинильные заместители необязательно могут быть замещены далее 1-3 заместителями, выбранными из алкила, карбокси, карбоксиалкила, гидрокси, алкокси, галогена, CF3, -NRfRq, -C(=O)NRfRq, -NHC(=O)NRfRq, -C(=O)NRfRq (гдеRf и Rq являются такими, как определено выше), циано или -SO2R6 (где R6 является таким, как определено выше). Термин "аралкил", если не указано иное, обозначает алкиларил, присоединенный через алкильную группу (где алкил является таким, как определено выше), и алкильная группа содержит 1-6 атомов углерода и арил является таким, как определено выше. Примеры аралкильных групп включают бензил, этилфенил и им подобные. Термин "арил", если не указано иное, обозначает карбоциклические ароматические группы, например фенильное, бифенильное или нафтильное кольцо, и им подобные, необязательно замещенные 1-3 заместителями, выбранными из галогена (например, F, Cl, Br, I), гидрокси, алкила, алкенила, алкинила,циклоалкила, алкокси, ацила, арилокси, CF3, циано, нитро, COORe (где Re представляет собой водород,алкил, алкенил, циклоалкил, аралкил, гетероциклилалкил, гетероарилалкил), NHC(=O)Rf, -NRfRq,-C(=O)NRfRq, -NHC(=O)NRfRq, -O-C(=O)NRfRq (где Rf и Rq являются такими, как определено выше),-SO2R6 (где R6 является таким, как определено выше), карбокси, гетероциклила, гетероарила, гетероциклилалкила, гетероарилалкила или аминокарбониламино. Арильная группа необязательно может быть конденсирована с циклоалкильной группой, где циклоалкильная группа необязательно может содержать гетероатомы, выбранные из О, N или S. Термин "арилокси" обозначает группу О-арил, где арил является таким, как определено выше. Термин "гетероарил", если не указано иное, обозначает ароматическую циклическую структуру, содержащую 5 или 6 атомов в цикле, или бициклическую ароматическую группу, содержащую от 8 до 10 атомов в цикле, с одним или несколькими гетероатомами, независимо выбранными из N, О или S, необязательно замещенную 1-4 заместителями, выбранными из галогена (например, F, Cl, Br, I), гидрокси, алкила, алкенила, алкинила, циклоалкила, ацила, карбокси, арила, алкокси, аралкила, циано, нитро, гетероциклила, гетероарила, -NRfRq, -CH=NOH, -(CH2)wC(=O)Rg где w имеет значение 0-4 и Rg представляет собой водород, гидрокси, ORf, NRfRq, -NHORz или -NHOH, -C(=O)NRfRq и -NHC(=O)NRfRq, -SO2R6,-O-C(=O)NRfRq, -O-C(=O)Rf, -O-C(=O)ORf (где R6, Rf и Rq являются такими, как определено выше, и Rz представляет собой алкил, циклоалкил, арил, гетероарил, гетероциклил, гетероарилалкил или гетероциклилалкил). Если иное не предусмотрено описанием, заместители присоединены к атому кольца, т.е. ато-9 013539 му углерода или гетероатому в кольце. Примеры гетероарильных групп включают оксазолил, имидазолил, пирролил, 1,2,3-триазолил, 1,2,4-триазолил, тетразолил, тиазолил, оксадиазолил, бензоимидазолил,тиадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, тиенил, изоксазолил, триазинил, фуранил, бензофуранил, индолил, бензотиазолил или бензоксазолил и им подобные. Термин "гетероциклил", если не указано иное, обозначает неароматическую моноциклическую или бициклическую циклоалкильную группу, содержащую от 5 до 10 атомов, где 1-4 атома в кольце замещены гетероатомами, выбранными из О, S или N, и необязательно представляет собой бензоконденсированный или конденсированный гетероарил, содержащий 5-6 атомов в кольце, и/или необязательно является замещенным, где заместители выбраны из галогена (например, F, Cl, Br, I), гидрокси, алкила, алкенила, алкинила, циклоалкила, ацила, арила, алкокси, алкарила, циано, нитро, оксо, карбокси, гетероциклила, гетероарила, -O-C(=O)Rf, -O-C(=O)ORf, -C(=O)NRfRq, SO2R6, -O-C(=O)NRfRq, -NHC(=O)NRfRq,-NRfRq (где R6, Rf и Rq являются такими, как определено выше) или гуанидина. Гетероциклил необязательно может включать кольца, содержащие одну или несколько двойных связей. Если иное не предусмотрено описанием, заместители присоединены к атому в цикле, т.е. атому углерода или гетероатому в цикле. Также, если иное не предусмотрено описанием, гетероциклильное кольцо необязательно может содержать одну или несколько олефиновых связей. Примеры гетероциклильных групп включают оксазолидинил, тетрагидрофуранил, дигидрофуранил, дигидропиридинил, дигидроизоксазолил, дигидробензофурил, азабициклогексил, дигидроиндолил, пиридинил, изоиндол 1,3-дион, пиперидинил или пиперазинил. Термин "циклоалкил", если не указано иное, обозначает циклические алкильные группы, содержащие от 3 до 20 атомов углерода, имеющие одно циклическое кольцо или несколько конденсированных колец, которые необязательно могут содержать одну или несколько олефиновых связей, если иное не предусмотрено описанием. Такие циклоалкильные группы могут включать, например, однокольцевые структуры, включая циклопропил, циклобутил, циклооктил, циклопентенил и им подобные, или структуры из нескольких колец, включая адамантанил и бицикло[2.2.1]гептан, или циклические алкильные группы, которые конденсированы с арильной группой, например индан, и им подобные. Спиро- и конденсированные циклические структуры также могут быть включены. Циклоалкильные группы могут быть замещены далее одним или несколькими заместителями, выбранными из алкила, алкенила, алкинила, алкокси, циклоалкила, циклоалкенила, ацила, ациламино, ацилокси, алкоксикарбониламино, азидо,циано, галогена, гидрокси, оксо, тиокарбонила, карбокси, карбоксиалкила, арилтио, тиола, алкилтио,арила, аралкила, арилокси, аминосульфонила, аминокарбониламино, -NRfRq, -NHC(=O)NRfRq,-NHC(=O)Rf, -C(=O)NRfRq, -O-C(=O)NRfRq (где Rf и Rq являются такими, как определено выше), нитро,гетероциклила, гетероарила, гетероциклилалкила, гетероарилалкила или SO2R6 (где R6 является таким,как определено выше). Если иное не предусмотрено описанием, циклоалкильные заместители необязательно могут быть замещены далее 1-3 заместителями, выбранными из алкила, карбокси, гидрокси, алкокси, галогена, CF3, -NRfRq, -C(=O)NRfRq, -NHC(=O)NRfRq, -OC(=O)NRfRq (где Rf и Rq являются такими,как определено выше), циано или -SO2R6 (где R6 является таким, как определено выше)."Циклоалкилалкил" обозначает алкилциклоалкильную группу, присоединенную через алкильную группу, где алкил и циклоалкил являются такими, как определено выше. Термин "циклоалкилалкил" обозначает циклоалкильную группу, присоединенную через алкильную группу, где алкил содержит от 1 до 6 атомов углерода и циклоалкил является таким, как определено выше."Гетероарилалкил" обозначает алкилгетероарильную группу, присоединенную через алкильную группу, где алкил и гетероарил являются такими, как определено выше."Гетероциклилалкил" обозначает алкилгетероциклильную группу, присоединенную через алкильную группу, где алкил и гетероциклил являются такими, как определено выше."Амин", если не указано иное, обозначает -NH2."Замещенный амино", если не предполагается иное, обозначает группу -N(Rk)2, где каждый Rk независимо выбран из группы водорода, при условии, что обе Rk группы не представляют собой водород(обозначаемый как "амино"), алкила, алкенила, алкинила, аралкила, циклоалкила, арила, гетероарила,гетероциклила, гетероциклилалкила, гетероарилалкила, ацила, S(O)mR6 (где m и R6 являются такими, как определено выше), -C(=Rv)NRxRy (где Rv представляет собой О или S и Rx и Ry являются такими, как определено выше) или -NHC(=Rv)NRyRx (где Rv, Ry и Rx являются такими, как определено выше). Если иное не предусмотрено описанием, все аминозаместители необязательно могут быть далее замещены 1-3 заместителями, выбранными из алкила, аралкила, циклоалкила, арила, гетероарила, гетероциклила, карбокси, -COOR7 (где R7 является таким, как определено выше), гидрокси, алкокси, галогена, CF3, циано,-C(=Rv)NRxRy (где Rv является таким, как определено выше), -O(C=O)NRxRy, -OC(=Rv)NRxRy (где Rx, Ry и"Замещенный тиокарбонил" обозначает -C(=S)R", где R" выбран из алкила, циклоалкила, арила,- 10013539 аралкила, гетероарила, гетероциклила, гетероарилалкила или гетероциклилалкила, амина или замещенного амина. Термин "галоген" обозначает фтор, хлор, бром или йод. Термин "уходящая группа" обозначает группы, которые проявляют или потенциально проявляют свойства лабильности в условиях синтеза, а также легко отделяются от синтезируемых продуктов при определенных условиях. Примеры уходящих групп включают, но не ограничиваются ими, галоген (например, F, Cl, Br, I), трифлаты, тозилаты, мезилаты, алкокси, тиоалкокси или гидроксирадикалы и им подобные. Термин "защитные группы" обозначает группы, которые предотвращают химические реакции в участке молекулы, позволяя осуществить легкий процесс химической модификации такой молекулы. Если не указано иное, защитные группы могут использоваться в группах, таких как гидрокси, амино или карбокси. Примеры защитных групп приведены в издании T.W. Greene и P.G.M. Wuts, "Protective Groupsin Organic Synthesis", 2nd Ed., John Wiley and Sons, New York, N.Y., которое приведено здесь в качестве ссылки. Виды применяемых карбоксильных защитных групп, аминозащитных групп или гидроксизащитных групп не являются критическими, важно, чтобы модифицированные группа/группа являлись стабильными в условиях последующих реакций и могли быть удалены без нарушения остатка молекулы. Соединения настоящего изобретения могут содержать один или несколько асимметричных атомов углерода и таким образом могут существовать в форме рацемических смесей, энантиомеров и диастереомеров. Эти соединения также могут существовать в виде конформеров/ротамеров. Все такие изомерные формы этих соединений включены в настоящее изобретение. Каждый стереогенный атом углерода может находиться в R- или S-конфигурации. Хотя конкретные соединения, представленные в примерах в описании, могут быть приведены в конкретной стереохимической конфигурации, соединения с противоположной стереохимией при любом данном хиральном центре или их смеси составляют часть изобретения. Термин "фармацевтически приемлемые соли", образующие часть настоящего изобретения, включает соли карбоновой кислоты, которые могут быть получены реакцией соединения с подходящим основанием с получением соответствующих основных аддитивных солей. Примерами таких оснований являются гидроксиды щелочных металлов, включая гидроксид калия, гидроксид натрия и гидроксид лития; гидроксиды щелочно-земельного металла, такие как гидроксид магния и гидроксид кальция. Также включены другие соли органических оснований, такие как лизин, аргинин, гуанидин, этаноламин, холин и им подобные; неорганических оснований, например, соли аммония или замещенного аммония. Если возможно, соединения настоящего изобретения могут также образовывать кислотные аддитивные соли с органическими и неорганическими кислотами, например гидрогалогениды, такие как гидрохлорид, гидробромид, гидройодид; с другими минеральными кислотами и их соответствующими солями, такими как сульфат, нитрат, фосфат и т.д.; и алкил- и моноарилсульфонаты, такие как этансульфонат, толуолсульфонат и бензолсульфонат; и другими органическими кислотами и их соответствующими солями, такими как ацетат, тартрат, малеат, сукцинат, цитрат и т.д. Подробное описание изобретения Соединения настоящего изобретения могут быть получены методами, хорошо известными в органической химии и знакомыми специалисту в области техники данного изобретения. Кроме того, описанным здесь способом можно получить соединения настоящего изобретения, однако он может быть не единственным способом, которым приведенные соединения могут быть получены. Кроме того, рассмотренные здесь различные стадии синтеза могут осуществляться в альтернативной последовательности для получения желаемых соединений. Схема I- 11013539 Соединения формулы VIII могут быть получены, например, в соответствии со следующей схемой синтеза, приведенной на схеме I. Так, соединение формулы II (где hal представляет собой Cl, Br или I) может подвергаться реакции с соединением формулы II [где Р представляет собой алкил (например,трет-бутил, этил или метил) или аралкил (например, бензил)] с получением соединения формулы IV, которое при реакции с соединением формулы V (где hal является таким, как определено выше, и А" представляет собой аралкил, гетероциклилалкил, гетероарилалкил или циклоалкилалкил) может образовывать соединение формулы VI. Соединение формулы VI при восстановлении может образовывать соединение формулы VII, которое после снятия защитных групп приводит к получению соединения формулыVIII. Реакция соединения формулы II с соединением формулы III с получением соединения формулы IV может осуществляться в присутствии основания или их комбинации, например гидрида натрия, бутиллития или литийдиизопропиламида, в органическом растворителе, например тетрагидрофуране, диметилформамиде, диоксане или диэтиловом эфире. Реакция соединения формулы IV с соединением формулы V с получением соединения формулы VI может осуществляться в присутствии основания, например трет-бутоксида калия, (метоксида)этоксида натрия, гидрида натрия, диизопропиламида лития, бутиллития или гексаметилдисилазида лития/натрия/калия, необязательно в присутствии катализатора, например йодида тетрабутиламмония или бромида тетрабутиламмония, в подходящем органическом растворителе, например трет-бутаноле, этаноле, тетрагидрофуране, диметилформамиде, диэтиловом эфире или диоксане. Соединение формулы VI подвергают восстановлению с получением соединения формулы VII в присутствии восстанавливающего агента, например боргидрида натрия или боргидрида лития, в органическом растворителе, например метаноле, этаноле, пропаноле, изопропиловом спирте и/или тетрагидрофуране. Гидролиз соединения формулы VII с получением соединения формулы VIII, когда Р представляет собой трет-бутил, может осуществляться с использованием кислот, например трифторуксусной кислоты или хлористо-водородной кислоты, в органическом растворителе или системе растворителей, включающей, например, дихлорметан, дихлорэтан, ТГФ или диоксан в воде. Схема II- 12013539 Соединение формулы XXI может быть получено, например, способом синтеза, приведенным, например, на схеме II. Так, соединение формулы IX (где hal является таким, как определено выше) при реакции с соединением формулы III (где Р является таким, как определено выше) может приводить к получению соединения формулы X, которое может подвергаться реакции с соединением формулы XI (где hal и n являются такими, как определено выше, и P1 представляет собой силильную защитную группу, например трет-бутилдиметилсилан, трет-бутилдифенилсилан или триизопропилсилан, с получением соединения формулы XII, которое может подвергаться восстановлению с получением соединения формулыXIII. Соединение формулы XIII при реакции с соединением формулы XIV [где Р 2 представляет собой аралкил (например, бензил, 4-метоксибензил или 2,4,6-триметоксибензил) или гетероциклил (например,тетрагидропиранил)] может образовывать соединение формулы XV, которое может подвергаться селективному снятию защитных групп с получением соединения формулы XVI, которое затем может быть превращено в соединение формулы XVII (где LG представляет собой уходящую группу, такую как мезил, тозил или трифлил или галогенид (hal), как определено выше) либо реакцией с соединением формулы L-hal (где L представляет собой метансульфонил, п-толуолсульфонил и hal является таким, как определено выше), либо реакцией с ангидридом трифторметансульфокислоты, либо реакцией с трифенилфосфином и источником галогенида, таким как тетрабромистый углерод или йод. Соединение формулыXVII может подвергаться реакции с соединением формулы М-А' (где А' представляет собой арил, гетероарил, гетероциклил или циклоалкил и М представляет собой металл, например калий, литий или натрий) или реакции А' в присутствии основания с получением соединения формулы XVIII. Соединение формулы XVIII может подвергаться реакции с соединением формулы XIX (где n имеет значение от 1 до 5 и R7 представляет собой водород, галоген (F, Cl, Br, I), гидрокси, -СООН, -COOR4 (где R4 является таким, как определено выше), алкил, алкенил, алкинил, циклоалкил, алкокси, алкенилокси, алкинилокси,арилокси, гетероциклилокси, гетероарилокси, циклоалкилокси, ацил, тиоацил, циано, нитро, амино,-СНО, -OCF3, -CF3, -SCF3, -NR4R5, -C(=Y)NR4R5, -NHC(=Y)R4, -NHC(=Y)NR5Rx, -NHC(=O)OR4,-NHSO2R4, -(SO)mR4 (где R4, R5, Rx, Y и m являются такими, как определено выше), арил, гетероциклил,гетероарил, гетероциклилалкил или гетероарилалкил, которые далее могут быть необязательно замещены) с получением соединения формулы XX, с которого могут быть сняты защитные группы, с получением соединения формулы XXI. Реакция соединения формулы IX с соединением формулы III с получением соединения формулы X может осуществляться аналогично реакции соединения формулы II и соединения формулы III с получением соединения формулы IV. Реакция соединения формулы X с соединением формулы XI с получением соединения формулы XII может осуществляться аналогично реакции соединения формулы IV с соединением формулы V с получением соединения формулы VI. Восстановление соединения формулы XII с получением соединения формулы XIII может осуществляться аналогично восстановлению соединения формулы VI с получением соединения формулы VII. Реакция соединения формулы XIII с соединением формулы XIV с получением соединения формулыXV может осуществляться в присутствии кислоты Льюиса, например трифторида бора, трифторметансульфокислоты, камфорсульфоновой кислоты, пиридин-п-толуолсульфоната или тритилперхлората, в органическом растворителе, например тетрагидрофуране, диметилформамиде, диэтиловом эфире или диоксане. Селективное снятие защитных групп с соединения формулы XV с получением соединения формулы XVI может осуществляться с помощью агента для снятия защитных групп, например тетрабутиламмонийфторида или фторида калия, в органическом растворителе, например тетрагидрофуране, диметилформамиде, диэтиловом эфире или диоксане. Соединение формулы XVI может подвергаться реакции с соединением формулы L-hal, ангидридом трифторметансульфокислоты или реакцией с трифенилфосфином и источником галогенида, таким как тетрабромистый углерод или йод, с получением соединения формулы XVII, необязательно в присутствии основания, например триэтиламина, пиридина, N-метилморфолина или диизопропилэтиламина, в органическом растворителе, например дихлорметане, дихлорэтане или тетрагидрофуране. Реакция соединения формулы XVII с соединением формулы М-А' с получением соединения формулы XVIII может осуществляться в органическом растворителе, например тетрагидрофуране, диметилсульфоксиде, диметилформамиде, ацетонитриле, диоксане, диметилацетамиде. Альтернативно, реакция соединения формулы XVII с соединением формулы А' с получением соединения формулы XVIII может осуществляться в присутствии основания, например гидрида натрия, трет-бутоксида калия, метоксида(этоксида) натрия, в органическом растворителе, например тетрагидрофуране, диметилсульфоксиде,диметилформамиде, ацетонитриле, диоксане, диметилацетамиде. Реакция соединения формулы XVIII с соединением формулы XIX может осуществляться в присутствии металлического катализатора, такого как тетракис-(трифенилфосфин)палладий(0),тетракис-(трициклогексилфосфин)палладий(0), тетракис-(три-трет-бутилфосфин)палладий(0) или ацетат палладия и трифенилфосфин, в присутствии основания, такого как карбонат калия или карбонат цезия, в органическом растворителе, таком как толуол, диметилсульфоксид, диметилформамид, тетрагидрофу- 13013539 ран, диоксан или диэтиловый эфир. Снятие защитных групп с соединения формулы XX с получением соединения формулы XXI может осуществляться аналогично способу для соединения формулы VII с получением соединения формулы Соединения формул XXV и XXXI могут быть получены, например, способом синтеза, приведенным, например, на схеме III. Так, соединение формулы IV (где Р является таким, как определено выше) может подвергаться реакции с соединением формулы XXII (где R4 является таким, как определено выше) с получением соединения формулы XXIII, которое Путь a - при восстановлении может приводить к получению соединения формулы XXIV, с которого далее могут быть сняты защитные группы с получением соединения формулы XXV, или Путь b - при реакции с соединением формулы XXVI (где Rt представляет собой алкил, арил, циклоалкил, аралкил, гетероциклилалкил или гетероарилалкил) приводит к получению соединения формулыXXVII, которое может подвергаться снятию защитных групп с получением соединения формулы XXVIII,которое может подвергаться получению N-производных с соединением формулы RD [где RD представляет собой R4COhal, halCOOR4, R4SO2hal или (R4)N=C(=Y), где Y представляет собой О или S) с получением соединения формулы XXIX (где RF представляет собой R4CO-, R4SO2-, R4OCO- или(R4)NH-C(=Y)-], которое может подвергаться снятию защитных групп с получением соединения формулы XXX, которое может подвергаться дальнейшему снятию защитных групп с получением соединения формулы XXXI. Реакция соединения формулы IV с соединением формулы XXII с получением соединения формулыXXIII может осуществляться в присутствии основания, например трет-бутоксида калия, гидрида натрия,метоксида (этоксида) натрия, диизопропиламида лития и/или бутиллития, в органическом растворителе,например тетрагидрофуране, диметилформамиде, диэтиловом эфире или диоксане. Восстановление соединения формулы XXIII с получением соединения формулы XXIV может осуществляться аналогично восстановлению соединения формулы VI с получением соединения формулы VII.- 14013539 Снятие защитных групп с соединения формулы XXIV (путь a) с получением соединения формулыXXV может осуществляться аналогично методу для соединения формулы VII с получением соединения формулы VIII. Реакция соединения формулы XXIV (путь b) с соединением формулы XXVI с получением соединения формулы XXVII может осуществляться с помощью конденсирующих агентов, таких как EDCI или ДЦК, в присутствии основания, такого как диметиламинопиридин, N-метилморфолин или диизопропилэтиламин, в органическом растворителе, таком как дихлорметан, дихлорэтан, хлороформ и тетрахлористый метилен. Снятие защитных групп с соединения формулы XXVII с получением соединения формулы XXVIII может осуществляться в присутствии агента для снятия защитных групп, например палладия на угле, в присутствии газообразного водорода, или палладия на угле с источником газообразного водорода, например формиата аммония, циклогексена или муравьиной кислоты. Получение N-производных соединения формулы XXVIII с соединением формулы RD (где RD представляет собой R4COhal или halCOOR4) с получением соединения формулы XXIX (где RF представляет собой R4CO-, R4OCO-) может осуществляться в присутствии основания, например пиридина,N-метилморфолина, N-этилдиизопропиламина, триэтиламина или карбоната калия. Получение N-производных соединения формулы XXVIII с соединением формулы RD (где RD представляет собой R4SO2hal) с получением соединения формулы XXIX (где RF представляет собой R4SO2-) может осуществляться в присутствии основания, например триэтиламина, N-этилдиизопропиламина,N-метилморфолина или пиридина, в органическом растворителе, например дихлорметане, дихлорэтане,тетрахлористом углероде или хлороформе. Получение N-производных соединения формулы XXVIII с соединением формулы RD (где RD представляет собой (R4)N=C(=Y с получением соединения формулы XXIX (где RF представляет собой(R4)NH-C(=Y)-) может осуществляться необязательно в присутствии основания, например триэтиламина,N-этилдиизопропиламина, N-метилморфолина или пиридина, в органическом растворителе, например дихлорметане, дихлорэтане, тетрахлористом углероде или хлороформе. Снятие защитных групп с вторичной гидроксильной защитной группы, такой как ацильная группа,с соединения формулы XXIX с получением соединения формулы XXX может осуществляться в присутствии основания, например гидроксида лития, гидроксида натрия, гидроксида калия, в органическом растворителе, например метаноле, тетрагидрофуране, воде или их смесях. Снятие защитных групп с соединения формулы XXX с получением соединения формулы XXXI может осуществляться с помощью кислот, например трифторуксусной кислоты или хлористоводородной кислоты, в органическом растворителе или в системе растворителей, например дихлорметане, хлороформе, дихлорэтане, ТГФ или диоксане в воде. Схема IV Соединения формулы XXXIV могут быть получены, например, следуя методике синтеза приведенной, например, на схеме IV. Так, соединение формулы XXXII может подвергаться восстановлению с получением соединения формулы XXXIII, которое может быть подвергнуто ионному гидрированию, где С=О восстанавливают до СН 2 с последующим гидролизом с получением соединения формулы XXXIV. Соединение формулы XXXII может подвергаться восстановлению с получением соединения формулы XXXIII в присутствии восстанавливающего агента, например боргидрида натрия или боргидрида лития, в органическом растворителе, например метаноле, этаноле, пропаноле, изопропиловом спирте и/или тетрагидрофуране. Превращение соединения формулы XXXIII в соединение формулы XXXIV может осуществляться в условиях ионного гидрирования, где С=О восстанавливается до СН 2, с последующим гидролизом in situ- 15013539 эфирной группы (когда Р представляет собой трет-бутил). Условия ионного гидрирования, которые могут использоваться, включают реакцию соединения формулы XXXIII с боргидридом натрия или триэтилсилана с кислотой, например трифторуксусной кислотой, в органическом растворителе, например дихлорметане, дихлорэтане или ТГФ, и чувствительная к кислоте в условиях in situ трет-бутильная группа может быть удалена с получением соединения формулы XXXIV. Следующие иллюстрирующие соединения были получены с помощью описанных выше схем I-IV: 5-бифенил-4-ил-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение 1),5-(4'-трет-бутилбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 2),5-(4'-бутилбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 3),5-(4'-хлорбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 4),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-трифторметоксибифенил-4 ил)пентановая кислота (соединение 5),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-этоксибифенил-4-ил)-3-гидроксипентановая кислота (соединение 6),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-формилбифенил-4-ил)-3-гидроксипентановая кислота (соединение 7),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(2',4',6'-триметоксибифенил-4 ил)пентановая кислота (соединение 8),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-пропоксибифенил-4 ил)пентановая кислота (соединение 9),5-(3',4'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 10),2-(2-[(бензилокси)карбонил]аминоэтил)-5-бифенил-4-ил-3-гидроксипентановая кислота (соединение 11),5-бифенил-4-ил-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 12),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-метоксибифенил-4 ил)пентановая кислота (соединение 23),5-(2',3'-диметилбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 24),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[3'-(трифторметил)бифенил-4 ил]пентановая кислота (соединение 25),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-этилбифенил-4-ил)-3-гидроксипентановая кислота (соединение 26),5-(3',5'-дихлорбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 27),5-[4'-хлор-3'-(трифторметил)бифенил-4-ил]-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3 гидроксипентановая кислота (соединение 28),5-(2',5'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 29),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[2'-(трифторметокси)бифенил 4-ил]пентановая кислота (соединение 30),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[4'-(метилтио)бифенил-4 ил]пентановая кислота (соединение 31),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-фтор-3'-метилбифенил-4-ил)-3 гидроксипентановая кислота (соединение 32),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(3'-изопропилбифенил-4 ил)пентановая кислота (соединение 33),5-(3',4'-диметилбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 34),5-(2',6'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 35),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-фторбифенил-4-ил)-3-гидроксипентановая кислота (соединение 36),5-(3',5'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 37),5-(3'-хлор-4'-фторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 38),- 16013539 5-(3',4'-диметоксибифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 39),5-(3'-хлорбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 40),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(3'-метилбифенил-4 ил)пентановая кислота (соединение 41),5-(2',3'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 42),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(2'-фтор-3'-метоксибифенил-4-ил)-3 гидроксипентановая кислота (соединение 43),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(3'-фтор-4'-метилбифенил-4-ил)-3 гидроксипентановая кислота (соединение 44),5-бифенил-4-ил-3-гидрокси-2-2-[(фенилацетил)амино]этилпентановая кислота(соединение 124). В приведенных выше схемах при использовании конкретных оснований, кислот, растворителей,конденсирующих агентов, восстанавливающего агента, агента для снятия защитных групп, гидролизующих агентов, металлических катализаторов и т.д. ясно, что также могут использоваться другие кислоты,основания, растворители, конденсирующие агенты, восстанавливающий агент, агент для снятия защитных групп, гидролизующие агенты, металлические катализаторы и т.д., известные специалисту в данной области техники. Аналогично, температура реакции и время реакций могут изменяться в соответствии с требованиями конкретного процесса. Соединения, полученные в соответствии со схемами I-IV, могут содержать один или несколько асимметричных атомов углерода и могут быть разделены на диастереомерные пары или отдельные диастереомеры препаративной тонкослойной хроматографией и/или ВЭЖХ, используя при необходимости колонку с ахиральным или хиральным наполнителем. Следующие иллюстрирующие соединения были разделены на диастереомерные пары или отдельные диастереомеры:(2S,3S)-3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)ил)этил]пентановая кислота (соединение 136). Примеры, приведенные далее, демонстрируют общую методику синтеза соединений по изобретению. Примеры приведены для иллюстрации конкретного аспекта раскрытия и не ограничивают объем настоящего изобретения. Экспериментальная часть Общая методика. Синтез 3-(2-бромэтил)-1,2,3-бензотриазин-4(3H)-она. К раствору соединения 1,2,3-бензотриазин-4(3H)-она (500 мг) (коммерчески доступный) в диметилформамиде (13 мл) добавляли безводный карбонат калия (2,8 г) и перемешивали в течение 20 мин. К раствору добавляли дибромэтан (2 г) и перемешивали реакционную смесь сначала при комнатной температуре в течение нескольких минут и затем при 60 С в течение 2 ч. Полученное таким образом твердое вещество отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток разбавляли водой и экстрагировали этилацетатом. Органический слой отделяли, промывали водой и насыщенным раствором хлорида натрия и высушивали безводным сульфатом натрия. Растворитель упаривали при пониженном давлении и полученный таким образом остаток очищали колоночной хроматографией, используя 20% этилацетат в гексане в качестве элюента для получения указанного в заголовке соединения (590 мг). Синтез 4-(бромметил)бифенила. Тетрабромистый углерод (8,99 г) и трифенилфосфин (7,11 г) добавляли к перемешиваемому раствору бифенил-4-илметанола (5,00 г) в дихлорметане (100 мл) при комнатной температуре и перемешивали реакционную смесь в течение приблизительно 2 ч при той же температуре. Растворитель упаривали- 20013539 при пониженном давлении и полученный таким образом остаток очищали колоночной хроматографией,используя 5% диэтиловый эфир в гексане в качестве элюента для получения указанного в заголовке соединения (6,37 г). Схема I, методика. Пример 1. Синтез 5-бифенил-4-ил-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение 1). Стадия 1. Синтез трет-бутил-5-бифенил-4-ил-3-оксопентаноата. Раствор трет-бутилацетоацетата (7,2 г) в тетрагидрофуране (80 мл) добавляли к перемешиваемому раствору гидрида натрия (1,33 г) в тетрагидрофуране (60 мл) при 0 С в атмосфере азота. Реакционную смесь перемешивали в течение 10 мин, затем по каплям добавляли н-бутиллитий (23 мл, 2,5 М раствор в гексане) в течение 10 мин. Полученную реакционную смесь перемешивали в течение 10 мин. Раствор 4-(бромметил)бифенила (12,5 г) в тетрагидрофуране (60 мл) добавляли в течение 10 мин и полученный раствор перемешивали при 0 С в течение приблизительно 2 ч. К полученной смеси добавляли хлористоводородную кислоту (6 М, 15 мл), затем экстрагировали смесь диэтиловым эфиром. Органические слои объединяли, промывали водой и насыщенным раствором хлорида натрия и высушивали безводным сульфатом натрия. Растворитель упаривали при пониженном давлении и полученный таким образом остаток очищали колоночной хроматографией на силикагеле, используя 8% этилацетат-гексан в качестве элюента для получения указанного в заголовке соединения (7,5 г). Стадия 2. Синтез трет-бутил 5-бифенил-4-ил-3-оксо-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)ил)этил]пентаноата. К раствору соединения (300 мг), полученного на стадии 1, в сухом тетрагидрофуране (4 мл) и третбутаноле (4 мл) при 0 С добавляли трет-бутоксид калия (104 мг) и перемешивали в течение 20 мин. К полученной реакционной смеси добавляли 3-(2-бромэтил)-1,2,3-бензотриазин-4(3H)-он (235 мг) и йодид тетрабутиламмония (349 мг) и смесь далее перемешивали в течение 30 мин при 0 С, затем перемешивали при комнатной температуре в течение 30 мин и, наконец, при 80 С в течение 5-6 ч. Растворитель упаривали при пониженном давлении и полученный таким образом остаток разбавляли водой и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором хлорида натрия, высушивали безводным сульфатом натрия и отфильтровывали. Растворитель упаривали при пониженном давлении и полученный таким образом остаток очищали колоночной хроматографией, используя 20% этилацетат в гексане в качестве элюента для получения указанного в заголовке соединения (240 мг). Стадия 3. Синтез трет-бутил 5-бифенил-4-ил-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)ил)этил]пентаноата. К раствору соединения (240 мг), полученного на стадии 2, в метаноле (4-5 мл) при -10 С добавляли боргидрид натрия (44 мг). Реакционную смесь перемешивали в течение 2 ч при температуре в области от-10 до -2 С. Растворитель упаривали при пониженном давлении и полученный таким образом остаток переносили в насыщенный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором хлорида натрия и высушивали безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный таким образом остаток очищали колоночной хроматографией, используя 30% этилацетат в гексане в качестве элюента для получения указанного в заголовке соединения (100 мг). Стадия 4. Синтез 5-бифенил-4-ил-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановой кислоты. К раствору соединения (100 мг), полученного на стадии 3, в дихлорметане (2 мл) при 0 С добавляли трифторуксусную кислоту (8 мл) и реакционную смесь перемешивали в течение 2-3 ч и затем при комнатной температуре в течение 3 ч. Растворитель и избыток реагентов упаривали при пониженном давлении и полученный таким образом остаток очищали препаративной тонкослойной хроматографией (элюент этилацетат) для получения указанного в заголовке соединения (40 мг). Масс-спектр (m/z): 444,1 (М 1). Следующие иллюстрирующие аналоги получали аналогично: 5-бифенил-4-ил-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 12),2-(3-бифенил-4-ил-1-гидроксипропил)-6-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)гексановая кислота (соединение 46),5-бифенил-4-ил-3-гидрокси-2-[2-(1-оксофталазин-2(1H)-ил)этил]пентановая кислота (соединение 47),5-бифенил-4-ил-2-[3-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)пропил]-3-гидроксипентановая кислота (соединение 48),5-бифенил-4-ил-3-гидрокси-2-[2-(2'-оксоспиро[циклопропан-1,3'-индол]-1'(2'H)-ил)этил]пентановая кислота (соединение 49),5-бифенил-4-ил-3-гидрокси-2-[2-(1-оксо-4-фенил-4 а,8 а-дигидрофталазин-2(1H)-ил)этил]пентановая кислота (соединение 84),5-бифенил-4-ил-3-гидрокси-2-[2-(3-оксо-2,3-дигидро-4H-1,4-бензоксазин-4-ил)этил]пентановая(соединение 94),2-(3-бифенил-4-ил-1-гидроксипропил)пент-4-иновая кислота (соединение 95),5-бифенил-4-ил-3-гидрокси-2-[2-(2-оксо-1,3-бензоксазол-3(2H)-ил)этил]пентановая кислота (соединение 96),5-бифенил-4-ил-2-[2-(5,6-дихлор-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 102),5-бифенил-4-ил-2-[2-(2,4-диоксо-1,4-дигидрохиназолин-3(2H)-ил)этил]-3-гидроксипентановая кислота (соединение 103),5-бифенил-4-ил-2-[2-(1,3-диоксо-1,3-дигидро-2H-пирроло[3,4-с]пиридин-2-ил)этил]-3-гидроксипентановая кислота (соединение 104),5-бифенил-4-ил-3-гидрокси-2-[2-(7-метил-4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение 120) и 5-бифенил-4-ил-2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 121). Схема II, методика. Пример 2. Синтез 5-(4'-хлорбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-3 гидроксипентановой кислоты (соединение 4). Стадия 1. Синтез трет-бутилового эфира 5-(4-бромфенил)-3-оксопентановой кислоты. трет-Бутилацетоацетат (23,8 мл) добавляли по каплям в течение 15 мин к перемешиваемой суспензии гидрида натрия (8,9 мг) в тетрагидрофуране при 0 С в атмосфере азота. После перемешивания в течение 20 мин добавляли н-бутиллитий в гексане (111 мл), затем перемешивание продолжали в течение 10 мин. Полученный раствор обрабатывали по каплям раствором 4-бромбензилбромида (14,19 г) в тетрагидрофуране (100 мл) и затем нагревали до комнатной температуры. Реакционную смесь перемешивали в течение 40 мин при комнатной температуре и затем гасили HCl (6 М, 5 мл). Полученную смесь экстрагировали диэтиловым эфиром. Органические фазы объединяли, промывали насыщенным раствором хлорида натрия и высушивали безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный таким образом остаток очищали флеш-хроматографией, используя 5% этилацетат в гексане в качестве элюента для получения указанного в заголовке соединения (37 г). Стадия 2. Синтез 1,1-диметилэтил 2-(2-[(1,1-диметилэтил)(диметил)силил]оксиэтил)-5-(4 бромфенил)-3-оксопентаноата. Раствор соединения (9,7 г), полученного на стадии 1, в диметилформамиде (25 мл) добавляли по каплям в течение 20 мин к перемешиваемой суспензии гидрида натрия (1,42 г) в диметилформамиде(25 мл) при 0 С в атмосфере азота и реакционную смесь перемешивали в течение 20 мин. К смеси добавляли (2-бромэтокси)-трет-бутилдиметилсилан (8,50 г) по каплям в течение 20 мин при 0 С, затем реакционную смесь нагревали при 70 С в течение 3-4 ч. После охлаждения до комнатной температуры реакционную смесь гасили водой. Остаток разделяли между насыщенным водным раствором хлорида аммония и дихлорметаном. Органические фазы объединяли, промывали водой и насыщенным раствором хлорида натрия, высушивали безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный таким образом остаток очищали колоночной хроматографией, используя 8% этилацетат в гексане в качестве элюента для получения указанного в заголовке соединения (9,5 г). Стадия 3. Синтез 1,1-диметилэтил 2-(2-[(1,1-диметилэтил)(диметил)силил]оксиэтил)-3-гидрокси 5-(бромфенил)пентаноата. Боргидрид натрия (0,46 г) добавляли порциями к перемешиваемому раствору соединения (4,2 г),полученного на стадии 2, в метаноле (50 мл) при 0 С в атмосфере азота и реакционную смесь перемешивали в течение приблизительно 2 ч. Смесь гасили насыщенным водным раствором хлорида аммония(100 мл) и экстрагировали диэтиловым эфиром. Органические слои объединяли, промывали водой и насыщенным раствором хлорида натрия, высушивали безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный таким образом остаток очищали колоночной хроматографией, используя 25% этилацетат в гексане в качестве элюента для получения указанного в заголовке соединения- 22013539 Стадия 4. Синтез 1,1-диметилэтил 2-(2-[(1,1-диметилэтил)(диметил)силил]оксиэтил)-5-(4 бромфенил)-3-([4-(метилокси)фенил]метилокси)пентаноата. Трифтористый эферат бора (5,0 мл) добавляли к перемешиваемому раствору соединения (4,0 г), полученного на стадии 3, и 4-метоксибензил 2,2,2-трихлорэтанимидоат (3,26 г) в тетрагидрофуране (40 мл) при 0 С в атмосфере азота. Реакционную смесь нагревали до комнатной температуры, при которой перемешивание продолжали в течение 2 ч. Растворитель упаривали при пониженном давлении и полученный таким образом остаток очищали колоночной хроматографией, используя 20% этилацетат в гексане в качестве элюента для получения указанного в заголовке соединения (3,8 г). Стадия 5. Синтез 1,1-диметилэтил 2-(2-гидроксиэтил)-5-(4-бромфенил)-3-([4-(метилокси)фенил]метилокси)пентаноата. Раствор фторида тетра-н-бутиламмония (0,45 мл) добавляли по каплям в течение 15 мин к перемешиваемому раствору соединения (200 мг), полученного на стадии 4, в тетрагидрофуране (5 мл) при 0 С в атмосфере азота. Реакционную смесь нагревали до комнатной температуры, при которой перемешивание продолжали в течение 2 ч. Летучие примеси упаривали при пониженном давлении и полученный таким образом остаток разделяли между этилацетатом и водой. Фазы отделяли и водный слой промывали этилацетатом. Органические слои объединяли, промывали водой и насыщенным раствором хлорида натрия,высушивали безводным сульфатом натрия и концентрировали при пониженном давлении для получения указанного в заголовке соединения (120 мг). Стадия 6. Синтез 1,1-диметилэтил 5-(4-бромфенил)-3-([4-(метилокси)фенил]метилокси)-2-2[(метилсульфонил)окси]этилпентаноата. Метансульфонилхлорид (0,63 мл) добавляли одной порцией к перемешиваемому раствору соединения (2,99 г), полученного на стадии 5, и триэтиламина (2,6 мл) в дихлорметане (50 мл) при комнатной температуре в атмосфере азота и перемешивали при комнатной температуре в течение 1 ч. Сырую смесь разделяли между насыщенным водным раствором лимонной кислоты и дихлорметаном. Фазы разделяли и органический слой концентрировали при пониженном давлении для получения указанного в заголовке соединения (3,2 г). Стадия 7. Синтез 1,1-диметилэтил 2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4 бромфенил)-3-([4-(метилокси)фенил]метилокси)пентаноата. Фталимид калия (1,25 г) добавляли одной порцией к перемешиваемому раствору соединения (3,5 г),полученного на стадии 6, в диметилформамиде (25 мл) при комнатной температуре в атмосфере азота. Полученный раствор нагревали при 80 С в течение 2 ч и затем охлаждали до комнатной температуры. Летучие примеси упаривали при пониженном давлении и полученный таким образом остаток разделяли между дихлорметаном и водой. Слои отделяли и органическую фазу упаривали досуха при пониженном давлении. Полученный таким образом остаток очищали колоночной хроматографией, используя 20% этилацетат в гексане в качестве элюента для получения указанного в заголовке соединения (2,45 г). Стадия 8. Синтез трет-бутил 5-(4'-хлорбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2 ил)этил]-3-[(4-метоксибензил)окси]пентаноата. К раствору соединения (200 мг), полученного на стадии 7, (4-хлорфенил)борной кислоты (90 мг) и карбоната калия (133 мг) в диметилформамиде (3 мл) добавляли тетракис-(трифенилфосфин)палладий(0)(18,5 мг) и реакционную смесь перемешивали в течение 6 ч при 100 С. Полученную реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органический слой отделяли, промывали водой и насыщенным раствором хлорида натрия, высушивали безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный таким образом остаток очищали колоночной хроматографией, используя 20% этилацетат в гексане в качестве элюента для получения указанного в заголовке соединения(116 мг). Стадия 9. Синтез 5-(4'-хлорбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3 гидроксипентановой кислоты. К раствору соединения (120 мг), полученного на стадии 8, в дихлорметане (5 мл) добавляли трифторуксусную кислоту (2 мл) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Растворитель упаривали при пониженном давлении и полученный таким образом остаток очищали препаративной тонкослойной хроматографией (элюент: 60% этилацетат в гексане) для получения указанного в заголовке соединения (68 мг). Масс-спектр (m/z): 478,0 (М 1). Следующие иллюстрирующие соединения были получены аналогично: 5-(4'-трет-бутилбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 2),5-(4'-бутилбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 3),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-трифторметоксибифенил-4 ил)пентановая кислота (соединение 5),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-этоксибифенил-4-ил)-3-гидроксипентановая кислота (соединение 6),- 23013539 2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-формилбифенил-4-ил)-3-гидроксипентановая кислота (соединение 7),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(2',4',6'-триметоксибифенил-4 ил)пентановая кислота (соединение 8),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-пропоксибифенил-4 ил)пентановая кислота (соединение 9),5-(3',4'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 10),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-метоксибифенил-4 ил)пентановая кислота (соединение 23),5-(2',3'-диметилбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 24),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[3'-(трифторметил)бифенил-4 ил]пентановая кислота (соединение 25),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-этилбифенил-4-ил)-3-гидроксипентановая кислота (соединение 26),5-(3',5'-дихлорбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 27),5-[4'-хлор-3'-(трифторметил)бифенил-4-ил]-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3 гидроксипентановая кислота (соединение 28),5-(2',5'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 29),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[2'-(трифторметокси)бифенил 4-ил]пентановая кислота (соединение 30),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[4'-(метилтио)бифенил-4 ил]пентановая кислота (соединение 31),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-фтор-3'-метилбифенил-4-ил)-3 гидроксипентановая кислота (соединение 32),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(3'-изопропилбифенил-4 ил)пентановая кислота (соединение 33),5-(3',4'-диметилбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 34),5-(2',6'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 35),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(4'-фторбифенил-4-ил)-3-гидроксипентановая кислота (соединение 36),5-(3',5'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 37),5-(3'-хлор-4'-фторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 38),5-(3',4'-диметоксибифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 39),5-(3'-хлорбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 40),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(3'-метилбифенил-4 ил)пентановая кислота (соединение 41),5-(2',3'-дифторбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановая кислота (соединение 42),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(2'-фтор-3'-метоксибифенил-4-ил)-3 гидроксипентановая кислота (соединение 43),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(3'-фтор-4'-метилбифенил-4-ил)-3 гидроксипентановая кислота (соединение 44),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-гидроксибифенил-4 ил)пентановая кислота (соединение 50),3-гидрокси-5-(4'-метоксибифенил-4-ил)-2-[2-(3-метил-2,6-диоксо-3,6-дигидропиримидин-1(2H)ил)этил]пентановая кислота (соединение 51),5-(4'-хлорбифенил-4-ил)-3-гидрокси-2-[2-(3-метил-2,6-диоксо-3,6-дигидропиримидин-1(2H)ил)этил]пентановая кислота (соединение 52),5-(4'-фторбифенил-4-ил)-3-гидрокси-2-[2-(3-метил-2,6-диоксо-3,6-дигидропиримидин-1(2H)ил)этил]пентановая кислота (соединение 53),5-[4-(5-хлор-2-тиенил)фенил]-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3 гидроксипентановая кислота (соединение 54),- 24013539 4'-[4-карбокси-6-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)-3-гидроксигексил]бифенил-4 карбоновая кислота (соединение 55),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[4'-(метоксикарбонил)бифенил 4-ил]пентановая кислота (соединение 56),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[4'-(трифторметил)бифенил-4 ил]пентановая кислота (соединение 57),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[4-(6-метоксипиридин-3 ил)фенил]пентановая кислота (соединение 58),3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]-5-[4'-(трифторметил)бифенил-4 ил]пентановая кислота (соединение 59),5-(3',4'-дифторбифенил-4-ил)-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение 60),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(3'-фторбифенил-4-ил)-3-гидроксипентановая кислота (соединение 61),5-[4'-(бензилокси)-3'-фторбифенил-4-ил]-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3 гидроксипентановая кислота (соединение 62),5-[4'-(бензилокси)бифенил-4-ил]-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3 гидроксипентановая кислота (соединение 63),3-гидрокси-5-(4'-метоксибифенил-4-ил)-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение 64),5-(4'-хлорбифенил-4-ил)-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение 65),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-(4'-метилбифенил-4 ил)пентановая кислота (соединение 66),3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)ил)этил]пентановая кислота (соединение 67),3-гидрокси-5-(4'-метилбифенил-4-ил)-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2 ил)этил]пентановая кислота (соединение 68),5-(4'-хлорбифенил-4-ил)-3-гидрокси-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2 ил)этил]пентановая кислота (соединение 69),3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]-5-[4'-(трифторметокси)бифенил-4 ил]пентановая кислота (соединение 70),5-(4'-фторбифенил-4-ил)-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение 71),3-гидрокси-5-(4'-метилбифенил-4-ил)-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение 72),5-(4'-цианобифенил-4-ил)-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение 73),5-(4'-фторбифенил-4-ил)-3-гидрокси-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2 ил)этил]пентановая кислота (соединение 74),3-гидрокси-5-[4-(6-метоксипиридин-3-ил)фенил]-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2Hизоиндол-2-ил)этил]пентановая кислота (соединение 75),5-(4'-этилбифенил-4-ил)-3-гидрокси-2-[2-(4-оксо-1,2,3-бензотриазин-3(4H)-ил)этил]пентановая кислота (соединение 76),3-гидрокси-2-[2-(5-метил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-[4'(трифторметил)бифенил-4-ил]пентановая кислота (соединение 77),2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[4-(6 метоксипиридин-3-ил)фенил]пентановая кислота (соединение 97),5-4-[6-(диметиламино)пиридин-3-ил]фенил-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2 ил)этил]-3-гидроксипентановая кислота (соединение 98),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидрокси-5-[4'-(метилсульфонил)бифенил 4-ил]пентановая кислота (соединение 99),5-[4'-(аминокарбонил)бифенил-4-ил]-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3 гидроксипентановая кислота (соединение 100),5-[4-(1-бензил-1H-пиразол-4-ил)фенил]-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3 гидроксипентановая кислота (соединение 101),2-[2-(5-трет-бутил-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(3',4'-дифторбифенил-4-ил)-3 гидроксипентановая кислота (соединение 105),2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-5-(3'-фтор-4'-метоксибифенил-4-ил)-3 гидроксипентановая кислота (соединение 110) и(4 мл) и трет-бутиловом спирте (4 мл) при 0 С в инертной атмосфере добавляли трет-бутоксид калия(98 мг) и перемешивали в течение 20 мин. К раствору при 0 С затем добавляли йодид н-тетрабутиламмония (27 мг) и бензилазиридин-1-карбоксилат (130 мг) и реакционную смесь перемешивали в течение 5 мин. Полученную реакционную смесь нагревали до комнатной температуры и затем нагревали при 70 С в течение 2 ч. Растворитель упаривали при пониженном давлении и полученный таким образом остаток переносили в воду и экстрагировали этилацетатом. Объединенные органические слои промывали водой и насыщенным раствором хлорида натрия, высушивали безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный таким образом остаток очищали колоночной хроматографией, используя 20% этилацетат в гексане в качестве элюента для получения указанного в заголовке соединения (60 мг). Стадия 2. Синтез трет-бутил 2-(2-[(бензилокси)карбонил]аминоэтил)-5-бифенил-4-ил-3-гидроксипентаноата. К раствору соединения (100 мг), полученного на стадии 1, в метаноле (2 мл) при температуре в области от -10 до -2 С добавляли боргидрид натрия (9 мг) и смесь перемешивали в течение 40 мин при той же температуре. Растворитель упаривали при пониженном давлении и полученный таким образом остаток гасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом. Объединенные органические слои промывали водой и насыщенным раствором хлорида натрия, высушивали безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный таким образом остаток очищали колоночной хроматографией, используя 5% метанол в дихлорметане в качестве элюента для получения указанного в заголовке соединения (80 мг). Стадия 3. Синтез 2-(2-[(бензилокси)карбонил]аминоэтил)-5-бифенил-4-ил-3-гидроксипентановой кислоты. К раствору соединения (40 мг), полученного на стадии 2, в сухом дихлорметане (10 мл) при 0 С добавляли трифторуксусную кислоту (0,5 мл) и анизол (0,05 мл) и перемешивали в течение 4 ч. Растворитель и избыток реагентов упаривали при пониженном давлении, и полученный таким образом остаток очищали колоночной хроматографией, используя 60% этилацетат в гексане в качестве элюента для получения указанного в заголовке соединения (25 мг). Масс-спектр (m/z): 448,1 (М 1). Схема III, методика пути (b). Пример 4. Синтез 5-бифенил-4-ил-2-(2-[(4-фторфенил)сульфонил]аминоэтил)-3-гидроксипентановой кислоты (соединение 87). Стадия 1. Синтез 4-[(бензилокси)карбонил]амино-1-(2-бифенил-4-илэтил)-2-(трет-бутоксикарбонил)бутилбензоата. Бензойную кислоту (48,5 мг), 4-диметиламинопиридин (24,3 мг) и триэтиламин (0,08 мл) добавляли к раствору трет-бутил 2-(2-[(бензилокси)карбонил]аминоэтил)-5-бифенил-4-ил-3-гидроксипентаноата(200 мг) в дихлорметане (5 мл) при 0 С и реакционную смесь перемешивали в течение 15 мин. Добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид (152 мг) и реакционную смесь перемешивали в течение ночи. Реакционную смесь переносили в дистиллированную воду и экстрагировали дихлорметаном(20 мл). Органический слой промывали разбавленным раствором бикарбоната натрия, насыщенным раствором хлорида натрия, раствор высушивали безводным сульфатом натрия и упаривали в вакууме. Полученный таким образом остаток очищали колоночной хроматографией, используя 10% этилацетат в гексане в качестве элюента для получения указанного в заголовке соединения (180 мг). Стадия 2. Синтез 4-амино-1-(2-бифенил-4-илэтил)-2-(трет-бутоксикарбонил)бутилбензоата. 10% палладий на угле (100 мг) добавляли к раствору соединения (170 мг), полученного на стадии 1,в этилацетате (10 мл) и реакционную смесь перемешивали в атмосфере водорода (40 psi) в течение 4 ч,затем фильтровали через целит. Фильтрат затем концентрировали при пониженном давлении для получения указанного в заголовке соединения (100 мг). Стадия 3. Синтез 1-(2-бифенил-4-илэтил)-2-(трет-бутоксикарбонил)-4-[(4-фторфенил)сульфонил]аминобутилбензоата. 4-Фторбензолсульфонилхлорид (62 мг) и триэтиламин добавляли при 0 С к раствору соединения(150 мг), полученного на стадии 2, в дихлорметане (5 мл) и реакционную смесь перемешивали в течение 3 ч. Реакционную смесь разбавляли дистиллированной водой и экстрагировали дихлорметаном (15 мл). Органический слой промывали водой, холодным разбавленным раствором хлористо-водородной кислоты и насыщенным раствором хлорида натрия, высушивали безводным сульфатом натрия и упаривали- 26013539 при пониженном давлении. Полученный таким образом остаток очищали колоночной хроматографией,используя 10% этилацетат в гексане в качестве элюента для получения указанного в заголовке соединения (100 мг). Стадия 4. Синтез трет-бутил 5-бифенил-4-ил-2-(2-[(4-фторфенил)сульфонил]аминоэтил)-3 гидроксипентаноата. Водный раствор гидроксида лития (18 мг в 1 мл воды) добавляли к раствору соединения (100 мг),полученного на стадии 3, в смеси тетрагидрофуран:метанол:вода (3:1:1,5 мл). Полученную реакционную смесь перемешивали в течение ночи. Реакционную смесь концентрировали и полученный таким образом остаток разбавляли водой, подкисляли разбавленным раствором хлористо-водородной кислоты и экстрагировали этилацетатом. Органический слой промывали дистиллированной водой и насыщенным раствором хлорида натрия, высушивали безводным сульфатом натрия и концентрировали при пониженном давлении для получения указанного в заголовке соединения (94 мг). Стадия 5. Синтез 5-бифенил-4-ил-2-(2-[(4-фторфенил)сульфонил]аминоэтил)-3-гидроксипентановой кислоты. Трифторуксусную кислоту (0,5 мл) добавляли к раствору соединения (100 мг), полученного на стадии 4, в дихлорметане (5 мл) и реакционную смесь перемешивали в течение 2 ч. Реакционную смесь затем концентрировали. Остаток насыщали газообразным азотом и высушивали в высоком вакууме и очищали препаративной тонкослойной хроматографией, используя 12% метанол в дихлорметане для получения указанного в заголовке соединения (30 мг). Масс-спектр (m/z): 494,1 (М 23). Пример 5. Синтез 5-бифенил-4-ил-2-(2-[(3-фторфенил)ацетил]аминоэтил)-3-гидроксипентановой кислоты (соединение 88). Стадия 1. Синтез 1-(2-бифенил-4-илэтил)-2-(трет-бутоксикарбонил)-4-[(4-фторбензоил)амино]бутилбензоата. 4-Фторбензойную кислоту (45 мг), N-метилморфолин (0,05 мл), гидроксибензотриазол (51,5 мг) добавляли к раствору 4-амино-1-(2-бифенил-4-илэтил)-2-(трет-бутоксикарбонил)бутилбензоата (150 мг),полученного в примере 3, стадия 2, в сухом диметилформамиде (2 мл) при 0 С, добавляли 1-этил-3-(3'диметиламинопропил)карбодиимид (92 мг) и реакционную смесь перемешивали в течение ночи. Реакционную смесь переносили в дистиллированную воду и экстрагировали этилацетатом. Органический слой промывали дистиллированной водой и насыщенным раствором хлорида натрия и высушивали безводным сульфатом натрия, затем упаривали при пониженном давлении. Полученный таким образом остаток очищали колоночной хроматографией, используя 10% этилацетат в гексане в качестве элюента для получения указанного в заголовке соединения (120 мг). Стадия 2. Синтез трет-бутил 5-бифенил-4-ил-2-2-[(4-фторбензоил)амино]этил-3-гидроксипентаноата. Водный раствор гидроксида лития (22 мг) добавляли к раствору соединения (120 мг), полученного на стадии 1, в смеси тетрагидрофуран:метанол:вода (3:1:1,5 мл) и реакционную смесь перемешивали в течение ночи. Реакционную смесь концентрировали и полученный таким образом остаток переносили в дистиллированную воду, подкисляли разбавленным раствором хлористо-водородной кислоты и экстрагировали этилацетатом. Органический слой промывали дистиллированной водой и насыщенным раствором хлорида натрия и высушивали безводным сульфатом натрия. Растворитель упаривали при пониженном давлении для получения указанного в заголовке соединения (100 мг). Стадия 3. Синтез 5-бифенил-4-ил-2-2-[(4-фторбензоил)амино]этил-3-гидроксипентановой кислоты. Трифторуксусную кислоту (0,5 мл) добавляли к раствору соединения (100 мг), полученного на стадии 2, в дихлорметане (5 мл) и реакционную смесь перемешивали в течение 2 ч. Реакционную смесь затем концентрировали. Остаток насыщали газообразным азотом и высушивали в высоком вакууме и очищали препаративной тонкослойной хроматографией, используя 12% метанол в дихлорметане для получения указанного в заголовке соединения (30 мг). Масс-спектр (m/z): 458,1 (М 23). Аналогично были получены следующие иллюстрирующие соединения: 5-бифенил-4-ил-3-гидрокси-2-2-[(фенилацетил)амино]этилпентановая кислота (соединение 45) и 5-бифенил-4-ил-2-2-[(4-фторбензоил)амино]этил-3-гидроксипентановая кислота (соединение 89). Пример 6. Синтез 5-бифенил-4-ил-2-[2-([(4-фторфенил)амино]карбониламино)этил]-3-гидроксипентановой кислоты (соединение 92). Стадия 1. Синтез 1-(2-бифенил-4-илэтил)-2-(трет-бутоксикарбонил)-4-([(4-фторфенил)амино]карбониламино)бутилбензоата. 4-Фторфенилизоцианат (29 мг) добавляли к раствору 4-амино-1-(2-бифенил-4-илэтил)-2-(третбутоксикарбонил)бутилбензоата (100 мг), полученного в примере 3, стадия 2, в сухом дихлорметане при 0 С в атмосфере аргона и реакционную смесь перемешивали в течение 1 ч. Реакционную смесь высушивали в высоком вакууме для получения указанного в заголовке соединения (130 мг).- 27013539 Стадия 2. Синтез 5-бифенил-4-ил-2-[2-([(4-фторфенил)амино]карбониламино)этил]-3-гидроксипентановой кислоты. Водный раствор гидроксида лития (22 мг в 1 мл) добавляли к раствору соединения (130 мг), полученного на стадии 1, в смеси тетрагидрофуран:метанол:вода (3:1:1,5 мл) и реакционную смесь перемешивали при 40 С в течение ночи. Реакционную смесь концентрировали и полученный таким образом остаток переносили в дистиллированную воду, подкисляли разбавленным раствором хлористоводородной кислоты и экстрагировали этилацетатом. Органический слой промывали дистиллированной водой и насыщенным раствором хлорида натрия и высушивали безводным сульфатом натрия. Растворитель упаривали при пониженном давлении для получения указанного в заголовке соединения (40 мг). Масс-спектр (m/z): 473 (М 23); 451,1 (М+1). Схема IV. Методика. Пример 7. Синтез 5-бифенил-4-ил-3-гидрокси-2-[2-(1-оксо-1,3-дигидро-2H-изоиндол-2-ил)этил]пентановой кислоты (соединение 91). Стадия 1. Синтез трет-бутил 5-бифенил-4-ил-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]3-оксопентаноата. Указанное в заголовке соединение получали методикой, описанной в примере 1, стадия 2, используя 2-(2-бромэтил)-1H-изоиндол-1,3(2H)-дион вместо 3-(2-бромэтил)-1,2,3-бензотриазин-4(3H)-она. Стадия 2. Синтез трет-бутил 5-бифенил-4-ил-3-гидрокси-2-[2-(1-гидрокси-3-оксо-1,3-дигидро-2Hизоиндол-2-ил)этил]пентаноата. К раствору соединения (165 мг), полученного на стадии 1, в сухом метаноле и ТГФ (1:1,8 мл) при-20 С добавляли боргидрид натрия (38 мг) и реакционную смесь перемешивали при КТ в течение 3 ч и затем при 45 С в течение 1 ч. Реакционную смесь охлаждали до 0 С и гасили насыщенным раствором хлорида аммония. Растворители упаривали в вакууме и остаток переносили в воду и экстрагировали этилацетатом. Объединенные органические экстракты промывали водой и насыщенным раствором хлорида натрия и высушивали безводным сульфатом натрия. Растворитель упаривали при пониженном давлении для получения указанного в заголовке сырого соединения (165 мг). Стадия 3. Синтез 5-бифенил-4-ил-3-гидрокси-2-[2-(1-оксо-1,3-дигидро-2H-изоиндол-2-ил)этил]пентановой кислоты. К раствору соединения (160 мг), полученного на стадии 2, в трифторуксусной кислоте (2 мл) при комнатной температуре добавляли боргидрид натрия (36 мг) и перемешивали в течение 1 ч. Летучие примеси упаривали при пониженном давлении и остаток очищали препаративной ТСХ, используя 10% метанол-ДХМ в качестве подвижной фазы (100 мг). Масс-спектр (m/z): 430,0 (М+1). Аналогично получали следующее иллюстрирующее соединение: 5-бифенил-4-ил-3-гидрокси-2-[2-(1-оксо-1,3-дигидро-2H-изоиндол-2-ил)бутил]пентановая кислота(соединение 124). Пример 8. Разделение (2R,3S) и (2S,3R)-5-(4'-хлорбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2Hизоиндол-2-ил)этил]-3-гидроксипентановой кислоты (соединение 80) и (2R,3R) и (2S,3S)-5-(4'хлорбифенил-4-ил)-2-[2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этил]-3-гидроксипентановой кислоты (соединение 81). Соединение 4 (30 мг) загружали на препаративную тонкослойную хроматографию и пластину ТСХ элюировали 30% ацетоном в дихлорметане в качестве мобильной фазы. Полоски желаемого диастереомера собирали отдельно. Силикагель индивидуальных полосок, содержащий пары индивидуального соединения, загружали на короткую колонку и хроматографически очищали элюированием 5% метанолом в ДХМ, получая соответствующие указанные в заголовке соединения. Соединение 80: 6 мг. Соединение 81: 16 мг. Аналогично отделяли следующие пары иллюстрирующих диастереомеров:Module I Plus с детектором UV 486, используя колонку Chiralcel OJ-H (250 4,6); подвижная фаза: 60:40 0,1% ТФУК в смеси гексан: этанол; скорость потока 0,7 мл/мин, время пропускания 60 мин. Следующие иллюстрирующие отдельные диастереомеры отделяли, используя условия хиральной ВЭЖХ:NCE/стандарты получали (содержание 10 мМ) в 100% ДМСО и последующие разбавления осуществляли в 50% ДМСО-50% TCNB (50 мМ Tris, 10 мМ CaCl2, 150 мМ NaCl, 0,05% Brij-35, pH 7,5). 1 мкл соединения и 88 мкл TCNB добавляли в лунки 96-луночной планшеты до достижения желаемой конечной концентрации NCE (конечная концентрация ДМСО не должна превышать 0,5%). 1 мкл активированных рекомбинантных MMP добавляли в каждую лунку (20-100 нг/100 мкл реакционной смеси), кроме"отрицательной лунки". (ММР-1, 9 и 14 ферменты нуждались в предварительной активации). Для этого первичный фермент инкубировали с АРМА, конечная концентрация 1 мМ, в течение 1 ч при 37 С. Инкубирование осуществляли при комнатной температуре в течение 4-5 мин. Реакцию инициировали с помощью 10 мкл 100 мкМ субстрата (ES001: Аликвоты непосредственно перед использованием разбавляли в TCNB; содержание: 2 мМ) и наблюдали повышение флуоресценции при длине волны возбуждения 320 нм, затем при излучении 405 нм в течение 25-30 циклов. Повышение флуоресценции (RFU) рассчитывали для положительных, отрицательных и NCE/стандартных ячеек. Рассчитывали процентное ингибирование по сравнению с контролями и значения IC50 определяли с помощью программного обеспечения Graph-prism. Активности в отношении ММ 9 показали значения IC50 от около 10 мкМ до около 2 нМ, или от около 1 мкМ до около 2 нМ, или от около 650 до около 2 нМ, или от около 300 до около 2 нМ, или от около 100 до около 2 нМ, или от около 50 до около 2 нМ, или от около 30 до около 2 нМ, или от около 20 до около 2 нМ, или от около 15 до около 2 нМ по сравнению с 1,5 нМ для маримасата. Активности в отношении ММ 12 показали значения IC50 от около 10 мкМ до около 0,4 нМ, или от около 1 мкМ до около 0,4 нМ, или от около 300 до около 0,4 нМ, или от около 100 до около 0,4 нМ, или от около 50 до около 0,4 нМ, или от около 30 до около 0,4 нМ, или от около 20 до около 0,4 нМ, или от около 15 до около 0,4 нМ, или от около 7 до около 0,4 нМ по сравнению с 0,9 нМ для маримасата. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы Ic в которой n имеет значение от 1 до 2;R1 представляет собой необязательно замещенный (С 1-С 6)алкил, (С 2-C6)алкенил, (С 2-С 6)алкинил,(С 3-С 8)циклоалкил, (С 6-С 14)арил, (С 3-С 10)гетероциклил, содержащий один или более гетероатомов, таких как N, О или S, (С 3-С 10)гетероарил, содержащий один или более гетероатомов, таких как N, О или S,(С 6-С 14)аралкил, (C1-С 6)алкокси, арилокси, алкенилокси или алкинилокси;Y представляет собой атом кислорода или серы,R4 представляет собой (C1-С 6)алкил, (С 2-C6)алкенил, (С 2-C6)алкинил, (С 3-С 8)циклоалкил,(С 6-С 14)арил, (С 3-С 10)гетероциклил, содержащий один или более гетероатомов, таких как N, О или S,(С 6-С 14)аралкил, гетероарил(С 1-С 3)алкил, гетероциклил(С 1-С 3)алкил или циклоалкил(С 1-С 3)алкил;R5 представляет собой водород или R4,R4 и R5 необязательно образуют вместе (С 3-С 10)гетероциклическое кольцо, содержащее один или более гетероатомов, таких как О, N или S, иR3 представляет собой водород, фтор, (С 1-С 6)алкил, (С 3-C8)циклоалкил или (С 6-С 14)аралкил; А представляет собой необязательно ОН, OR4, -OC(=O)NR4R5, О-ацил, NH2, NR4R5, -NHC(=Y)R4,-NHC(=Y)NR5Rx, -NHC(=O)OR4, -NHSO2R4; при условии, что R2a не выбираются из
МПК / Метки
МПК: C07D 207/40, C07D 237/32, C07D 209/48, C07D 265/28, C07D 249/18, C07D 213/64, C07D 209/12, C07D 239/96, C07D 211/88, C07D 263/58, C07D 239/54
Метки: матричной, качестве, других, лечения, ингибиторов, астмы, 5-фенилпентановой, производные, заболеваний, кислоты, металлопротеиназы
Код ссылки
<a href="https://eas.patents.su/30-13539-proizvodnye-5-fenilpentanovojj-kisloty-v-kachestve-ingibitorov-matrichnojj-metalloproteinazy-dlya-lecheniya-astmy-i-drugih-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 5-фенилпентановой кислоты в качестве ингибиторов матричной металлопротеиназы для лечения астмы и других заболеваний</a>
Предыдущий патент: Добавки к средствам для мытья тела
Следующий патент: Целлюлазы, нуклеиновые кислоты, кодирующие их, и способы их получения и применения
Случайный патент: Способ получения фитокомпозиции