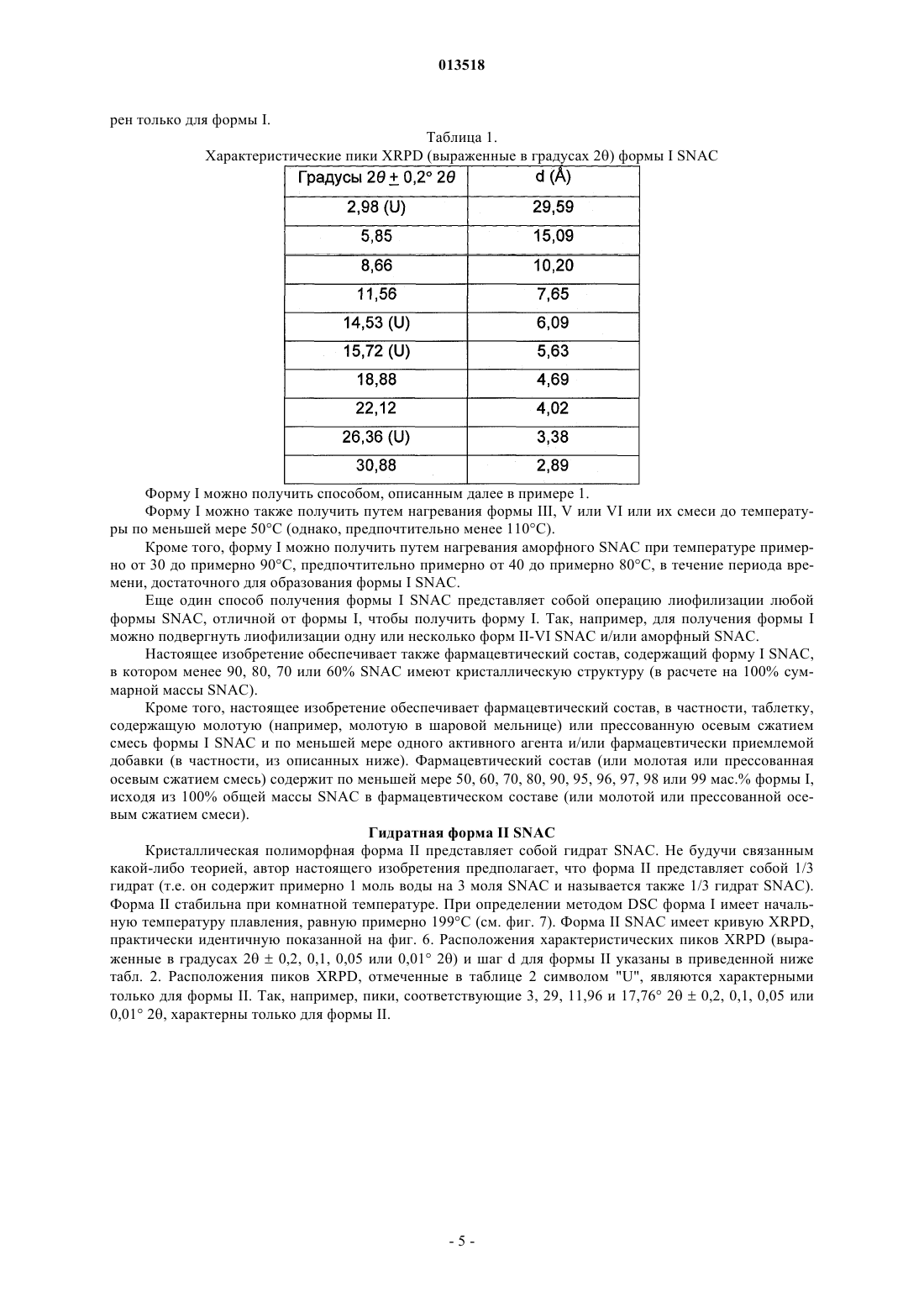
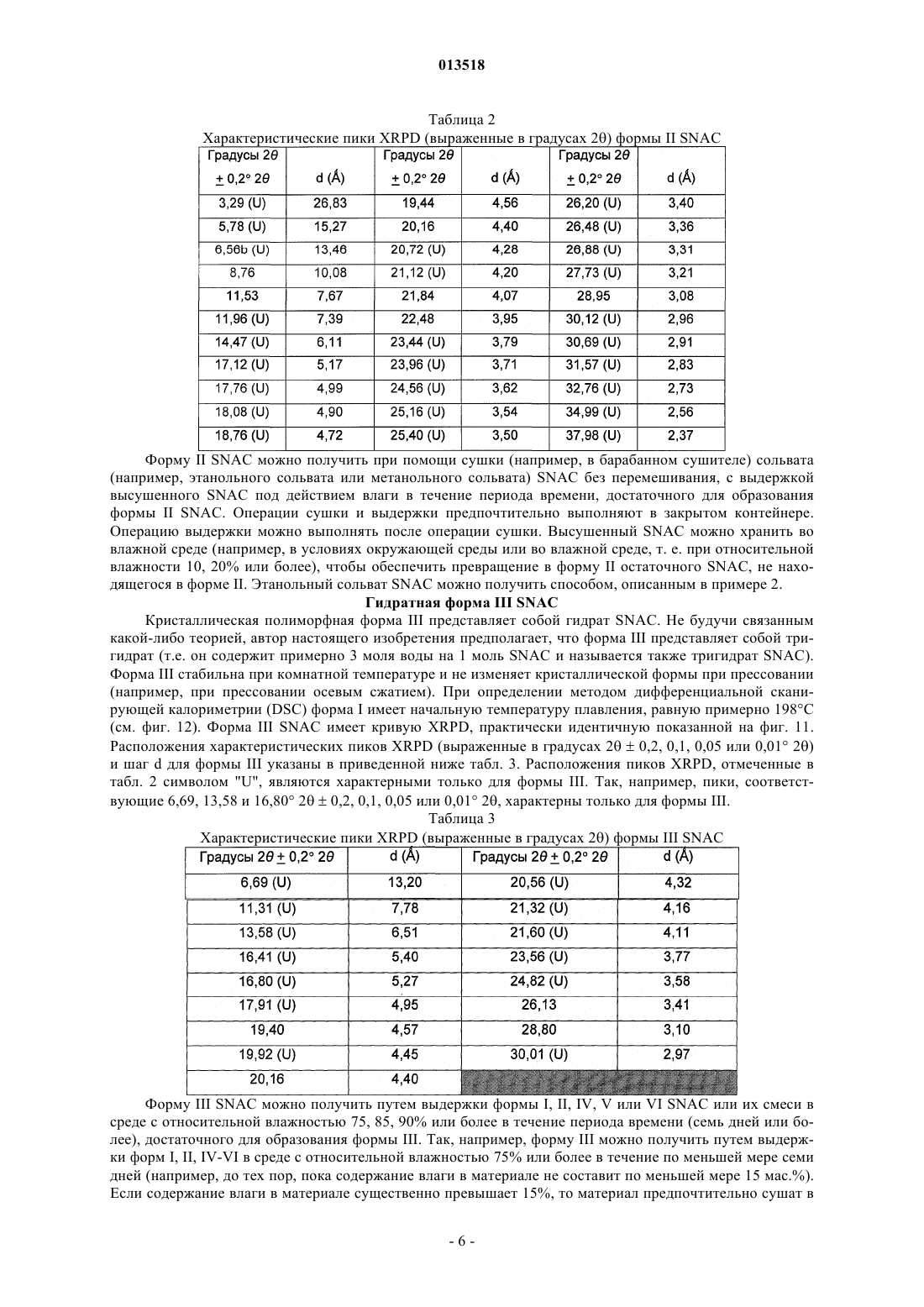
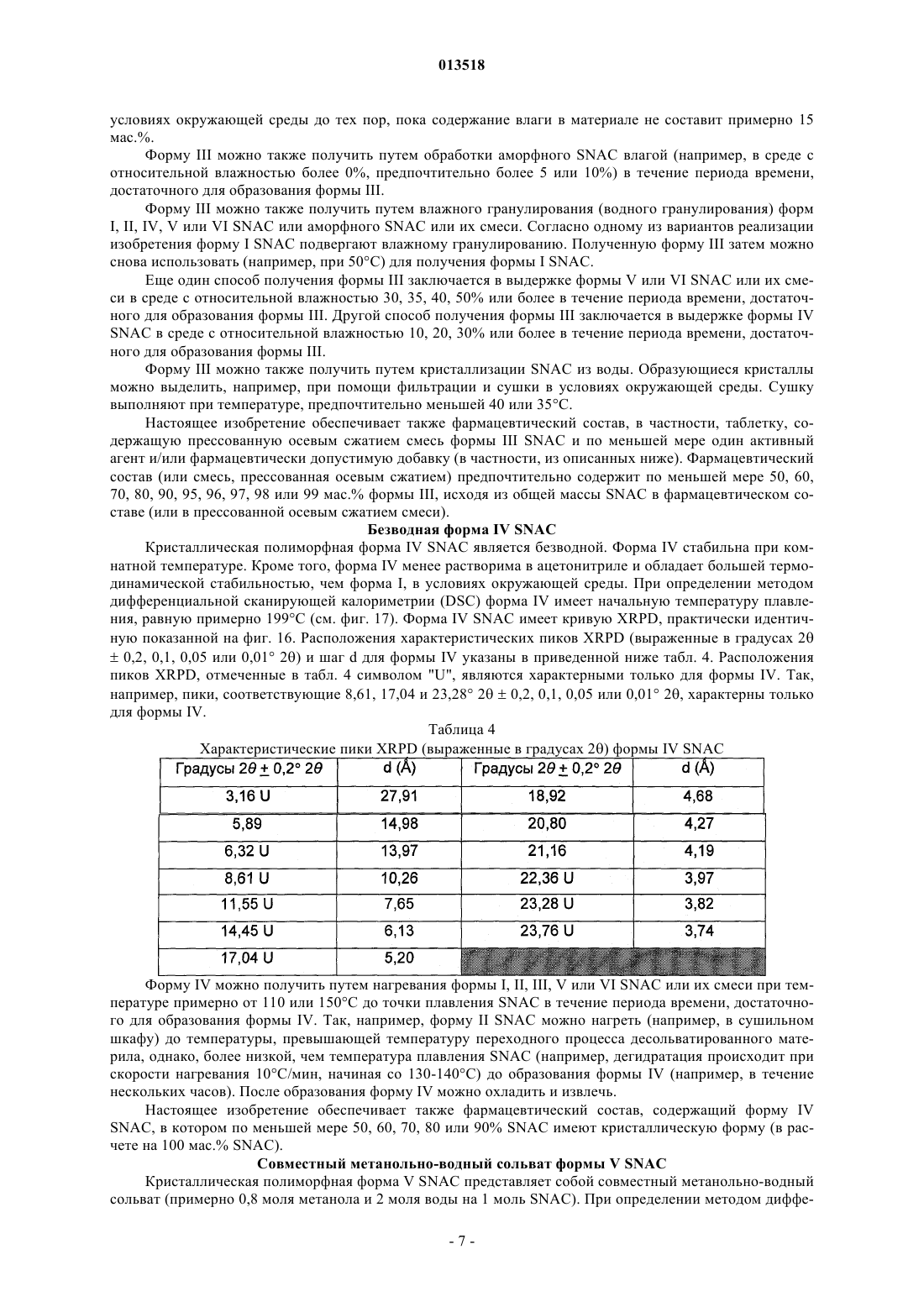
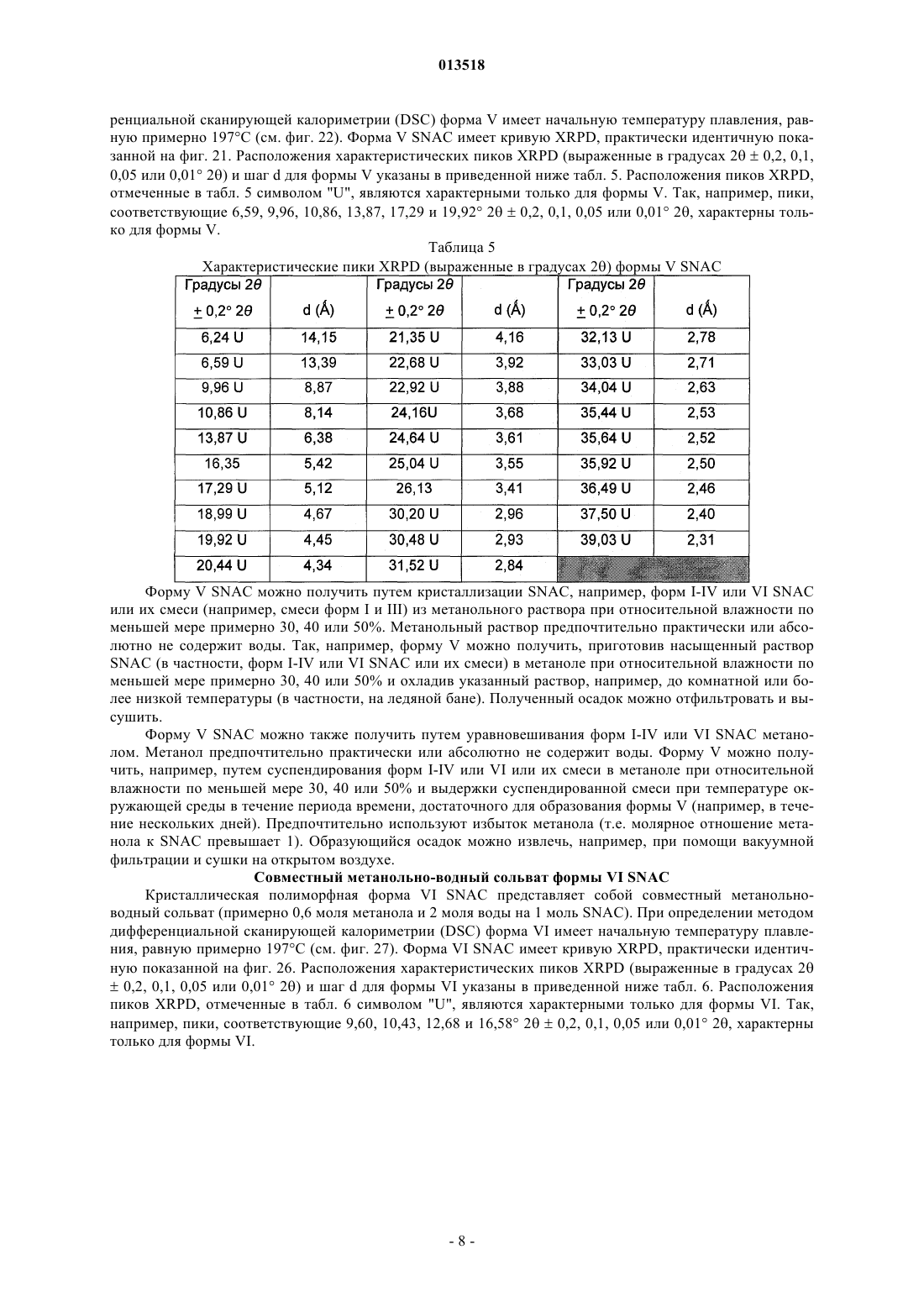
Кристаллические полиморфные формы n-[8(2-гидроксибензоил)амино]каприлата натрия
Номер патента: 13518
Опубликовано: 30.06.2010
Авторы: Харрис Джамила, Сингх Брахма, Левчик Галина, Маджуру Шингай
Формула / Реферат
1. N-[8-(2-гидроксибензоил)амино]каприлат натрия 1/3 гидрат (SNAC 1/3 гидрат).
2. Кристаллический полиморф N-[8-(2-гидроксибензоил)амино]каприлата натрия гидрата (форма II SNAC), имеющий спектр рентгеновской дифракции на порошке с пиками, соответствующими значениям углов 2q ± 0,2° 2q, равным 3,29, 11,96 и 17,76.
3. Кристаллический полиморф по п.2, имеющий спектр рентгеновской дифракции на порошке, по существу, соответствующий показанному на фиг. 6.
4. Кристаллический полиморф по п.2, отличающийся тем, что имеет начальную температуру плавления, определенную способом дифференциальной сканирующей калориметрии, примерно 199°С.
5. N-[8-(2-гидроксибензоил)амино]каприлат натрия тригидрат (SNAC тригидрат).
6. Кристаллический полиморф N-[8-(2-гидроксибензоил)амино]каприлата натрия гидрата (форма III SNAC), имеющий спектр рентгеновской дифракции на порошке с пиками, соответствующими значениям углов 2q ± 0,2° 2q, равным 6,69, 13,58 и 16,80.
7. Кристаллический полиморф по п.6, имеющий спектр рентгеновской дифракции на порошке, по существу, соответствующий показанному на фиг. 11.
8. Кристаллический полиморф по п.6, отличающийся тем, что имеет начальную температуру плавления, определенную способом дифференциальной сканирующей калориметрии, примерно 198°С.
9. Кристаллический безводный полиморф N-[8-(2-гидроксибензоил)амино]каприлата натрия (безводная форма IV SNAC), имеющий спектр рентгеновской дифракции на порошке с пиками, соответствующими значениям углов 2q ± 0,2° 2q, равным 8,61, 17,04 и 23,28.
10. Кристаллический полиморф по п.9, имеющий спектр рентгеновской дифракции на порошке, по существу, соответствующий показанному на фиг. 16.
11. Кристаллический полиморф по п.9, отличающийся тем, что имеет начальную температуру плавления, определенную способом дифференциальной сканирующей калориметрии, примерно 198°С.
12. Совместный метанольно-водный сольват N-[8-(2-гидроксибензоил)амино]каприлата натрия.
13. Совместный метанольно-водный сольват N-[8-(2-гидроксибензоил)амино]каприлата натрия, в котором отношение метанола к воде и к N-[8-(2-гидроксибензоил)амино]каприлату натрия составляет примерно 0,8:2:1.
14. Кристаллический полиморф совместного метанольно-водного сольвата N-[8-(2-гидроксибензоил)амино] каприлата натрия (форма V SNAC), имеющий спектр рентгеновской дифракции на порошке с пиками, соответствующими значениям углов 2q ± 0,2° 2q, равным 6,59, 9,96, 10,86, 13,87, 17,29 и 19,92.
15. Кристаллический полиморф по п.14, имеющий спектр рентгеновской дифракции на порошке, по существу, соответствующий показанному на фиг. 21.
16. Кристаллический полиморф по п.14, отличающийся тем, что имеет начальную температуру плавления, определенную способом дифференциальной сканирующей калориметрии, примерно 197°С.
17. Совместный этанольно-водный сольват N-[8-(2-гидроксибензоил)амино]каприлата натрия.
18. Совместный этанольно-водный сольват N-[8-(2-гидроксибензоил)амино]каприлата натрия, в котором отношение этанола к воде и к N-[8-(2-гидроксибензоил)амино]каприлату составляет примерно 0,6:2:1.
19. Кристаллический полиморф совместного этанольно-водного сольвата N-[8-(2-гидроксибензоил)амино] каприлата натрия (форма VI SNAC), имеющий спектр рентгеновской дифракции на порошке с пиками, соответствующими значениям углов 2q ± 0,2° 2q, равным 9,60, 10,43, 12,68 и 16,58.
20. Кристаллический полиморф по п.19, имеющий спектр рентгеновской дифракции на порошке, по существу, соответствующий показанному на фиг. 26.
21. Кристаллический полиморф по п.14, отличающийся тем, что имеет начальную температуру плавления, определенную способом дифференциальной сканирующей калориметрии, примерно 197°С.
22. Аморфный N-[8-(2-гидроксибензоил)амино]каприлат натрия, характеризующийся спектром рентгеновской дифракции на порошке, по существу, соответствующим показанному на фиг. 43, и/или кривой дифференциальной сканирующей калориметрии, по существу, соответствующей показанной на фиг. 44, и/или кривой термогравиметрического анализа, по существу, соответствующей показанной на фиг. 45, и/или ИК-спектром, по существу, соответствующим показанному на фиг. 46.
23. Фармацевтический состав, содержащий (А) (1) кристаллический полиморф по пп.1-21 или (2) аморфный N-[8-(2-гидроксибензоил)амино]каприлат натрия по п.22, а также (В) активный агент.
24. Фармацевтический состав по п.23, отличающийся тем, что активный агент представляет собой гепарин.
25. Фармацевтический состав по п.23, отличающийся тем, что активный агент представляет собой гепарин с низкой молекулярной массой.
26. Способ введения активного агента животному, которое нуждается в соответствующем лечении, включающий операцию введения фармацевтического состава по п.23.
27. Способ по п.26, отличающийся тем, что активный агент представляет собой гепарин.
28. Способ получения формы I SNAC, включающий операцию нагревания формы III, V, VI или их смеси по меньшей мере до 50°С с образованием формы I SNAC в течение времени, достаточного для образования формы I SNAC.
29. Способ по п.28, отличающийся тем, что формы III, V, VI SNAC или их смеси нагревают до температуры в пределах примерно от 50 до примерно 110°С в течение времени, достаточного для образования формы I SNAC.
30. Способ получения формы I SNAC, включающий операцию нагревания аморфного SNAC в пределах примерно от 30 до примерно 90°С в течение времени, достаточного для образования формы I SNAC.
31. Способ по п.30, отличающийся тем, что аморфный SNAC нагревают до температуры в пределах примерно от 40 до примерно 80°С.
32. Способ получения формы I SNAC, включающий операцию лиофилизации какой-либо формы SNAC, отличной от формы I, для получения формы I.
33. Способ по п.32, отличающийся тем, что включает лиофилизацию одной или нескольких форм II-VI SNAC и/или аморфного SNAC для получения формы I.
34. Способ получения формы II SNAC, включающий операцию сушки сольвата SNAC без перемешивания и воздействие на высушенный материал влаги в течение времени, достаточного для образования формы II SNAC.
35. Способ по п.34, отличающийся тем, что сольват представляет собой этанольный сольват или метанольный сольват.
36. Способ получения формы III SNAC, включающий операцию выдержки формы I, II, IV, V или VI SNAC или аморфного SNAC в среде с относительной влажностью 75% или более в течение времени, достаточного для образования формы III.
37. Способ получения формы III SNAC, включающий операцию влажного гранулирования формы I SNAC в течение времени, достаточного для получения формы III.
38. Способ получения формы III SNAC, включающий операцию выдержки формы V или VI SNAC или их смеси в среде с относительной влажностью 30% или более в течение времени, достаточного для образования формы III.
39. Способ получения формы III SNAC, включающий операцию выдержки формы VI SNAC в среде с относительной влажностью 10% или более в течение времени, достаточного для образования формы III.
40. Способ получения формы III SNAC, включающий операцию воздействия влаги на аморфный SNAC в течение времени, достаточного для образования формы III.
41. Способ получения формы III SNAC, включающий операцию кристаллизации SNAC из воды.
42. Способ получения формы IV SNAC, включающий операцию нагревания формы I, II, IV, V или VI SNAC или их смеси до температуры в пределах примерно от 110°С до точки плавления SNAC в течение времени, достаточного для образования формы IV.
43. Способ по п.42, отличающийся тем, что форму II SNAC нагревают до температуры в пределах примерно от 150°С до точки плавления SNAC в течение времени, достаточного для образования формы IV.
44. Способ получения формы V SNAC, включающий операцию кристаллизации SNAC из метанольного раствора при относительной влажности по меньшей мере примерно 30%.
45. Способ по п.42, отличающийся тем, что метанольный раствор, по существу, не содержит воды.
46. Способ получения формы V SNAC, включающий операцию уравновешивания форм I-IV или VI SNAC метанолом.
47. Способ по п.46, отличающийся тем, что уравновешивание выполняют при отсутствии воды.
48. Способ получения формы V SNAC, включающий операцию диспергирования форм I-IV или VI или их смеси в метаноле при относительной влажности по меньшей мере 30% и поддержания диспергированной смеси при температуре окружающей среды в течение времени, достаточного для образования формы V.
49. Способ получения формы VI SNAC, включающий операцию кристаллизации SNAC из этанольного раствора при относительной влажности по меньшей мере примерно 30%.
50. Способ по п.49, отличающийся тем, что этанольный раствор, по существу, не содержит воды.
51. Способ получения формы VI SNAC, включающий операции получения насыщенного раствора SNAC в этаноле при относительной влажности по меньшей мере 30% и охлаждения полученного раствора при комнатной или более низкой температуре.
52. Способ по п.51, отличающийся тем, что указанный способ реализуют при отсутствии воды.
53. Способ получения формы VI SNAC, включающий операцию диспергирования форм I-IV в этаноле при относительной влажности по меньшей мере около 30%.
54. Фармацевтический состав, содержащий молотую смесь формы I SNAC и по меньшей мере одного активного агента или фармацевтически допустимой добавки.
55. Фармацевтический состав, содержащий прессованную осевым сжатием смесь формы I SNAC и по меньшей мере одного активного агента или фармацевтически допустимой добавки.
56. Фармацевтический состав, содержащий прессованную осевым сжатием смесь формы III SNAC и по меньшей мере одного активного агента или фармацевтически приемлемой добавки.
57. Способ получения аморфного SNAC, содержащий операцию дегидратации формы III, V или VI SNAC в течение времени, достаточного для образования аморфного SNAC.
58. Способ по п.57, отличающийся тем, что форму III, V или VI SNAC обезвоживают в вакууме.
59. Способ по п.57, отличающийся тем, что форму III обезвоживают с получением аморфного SNAC.
Текст
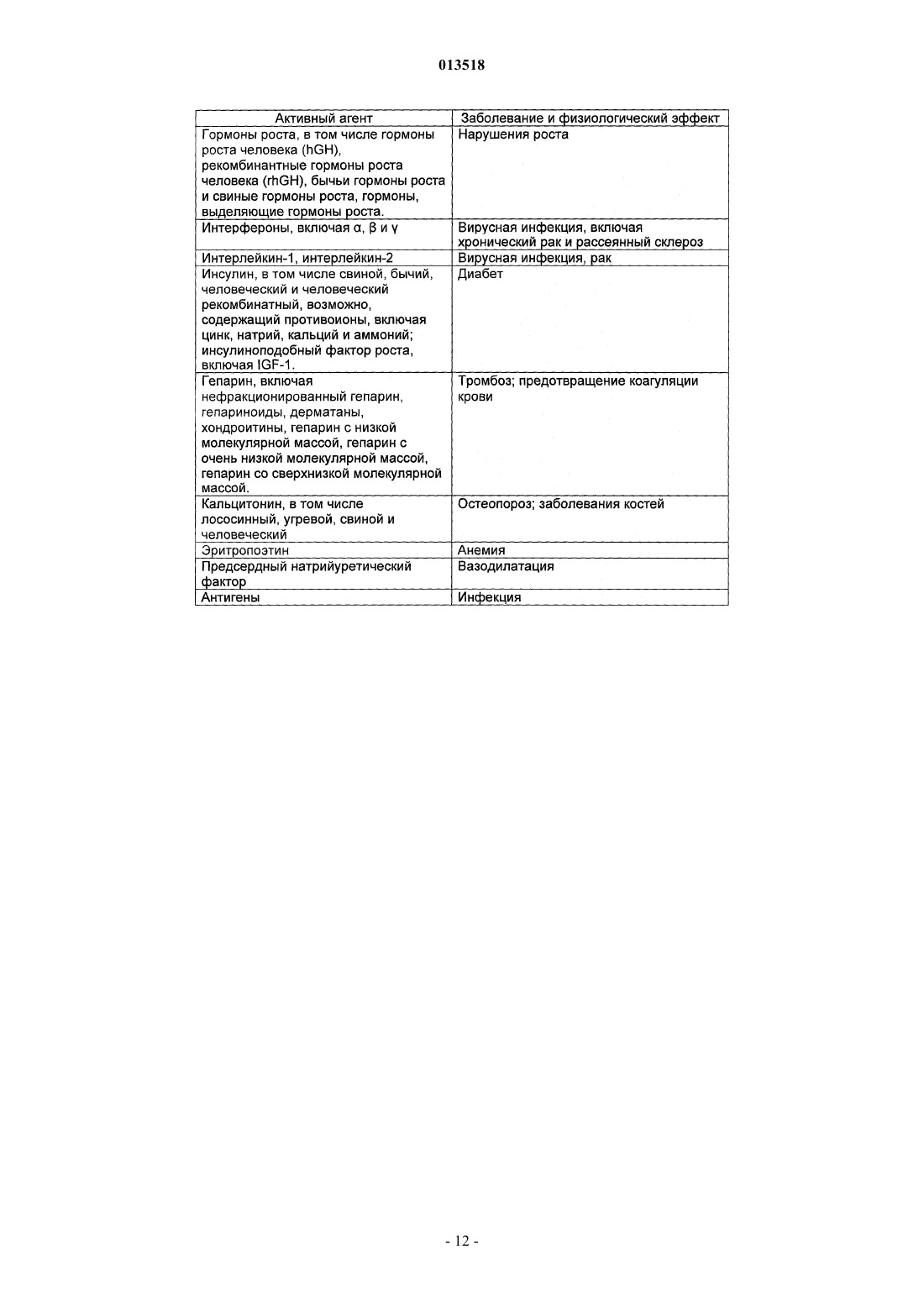
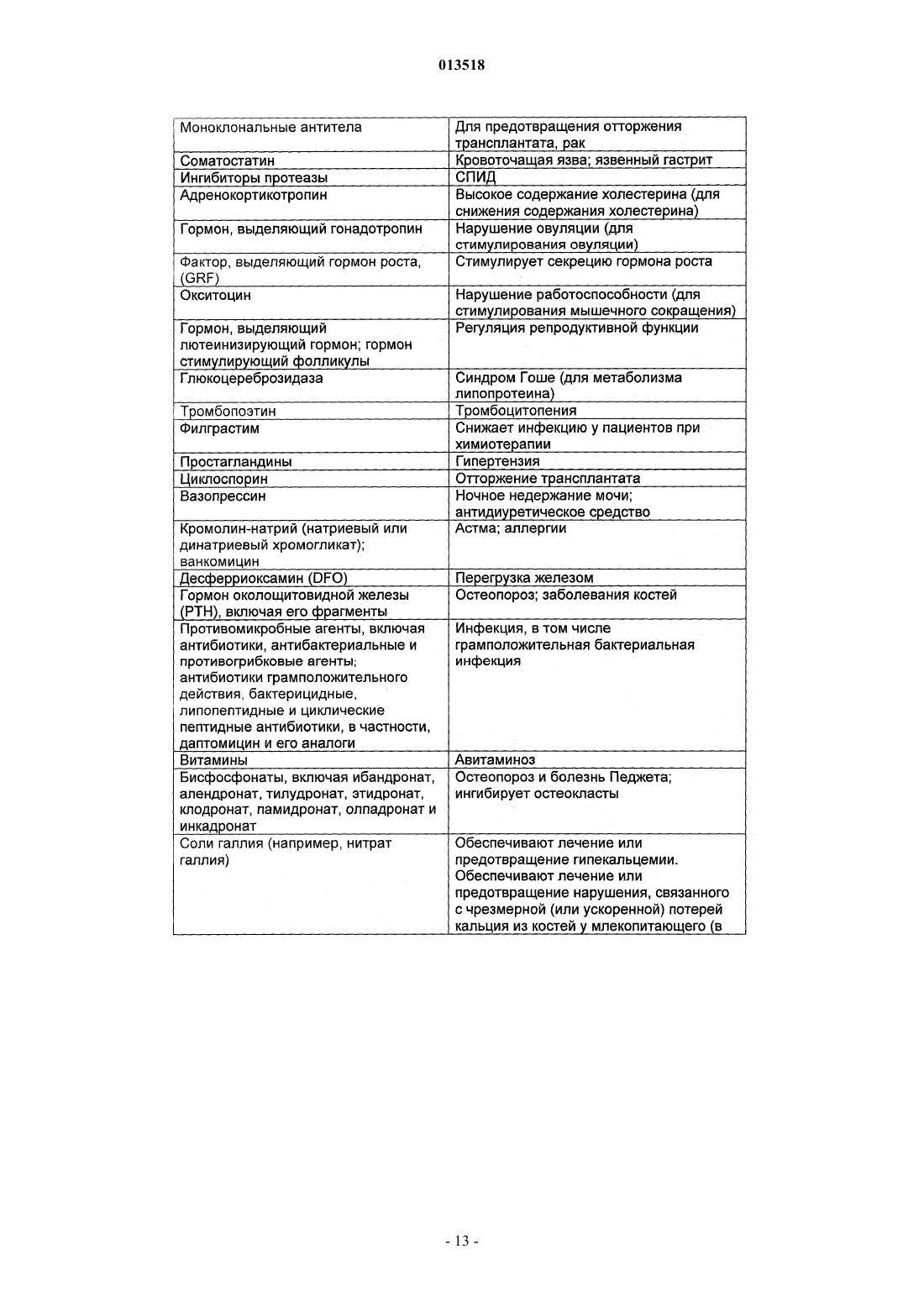
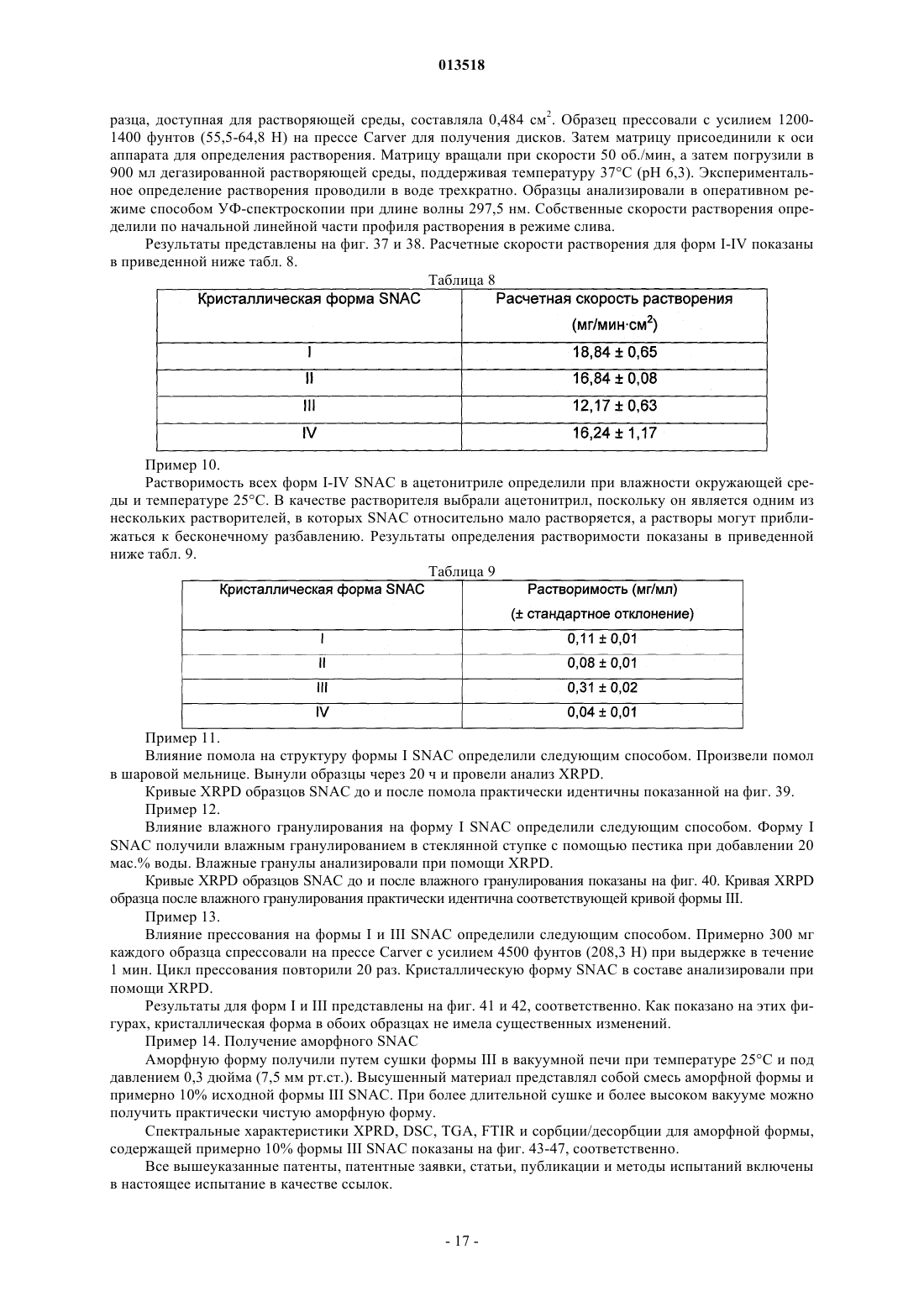
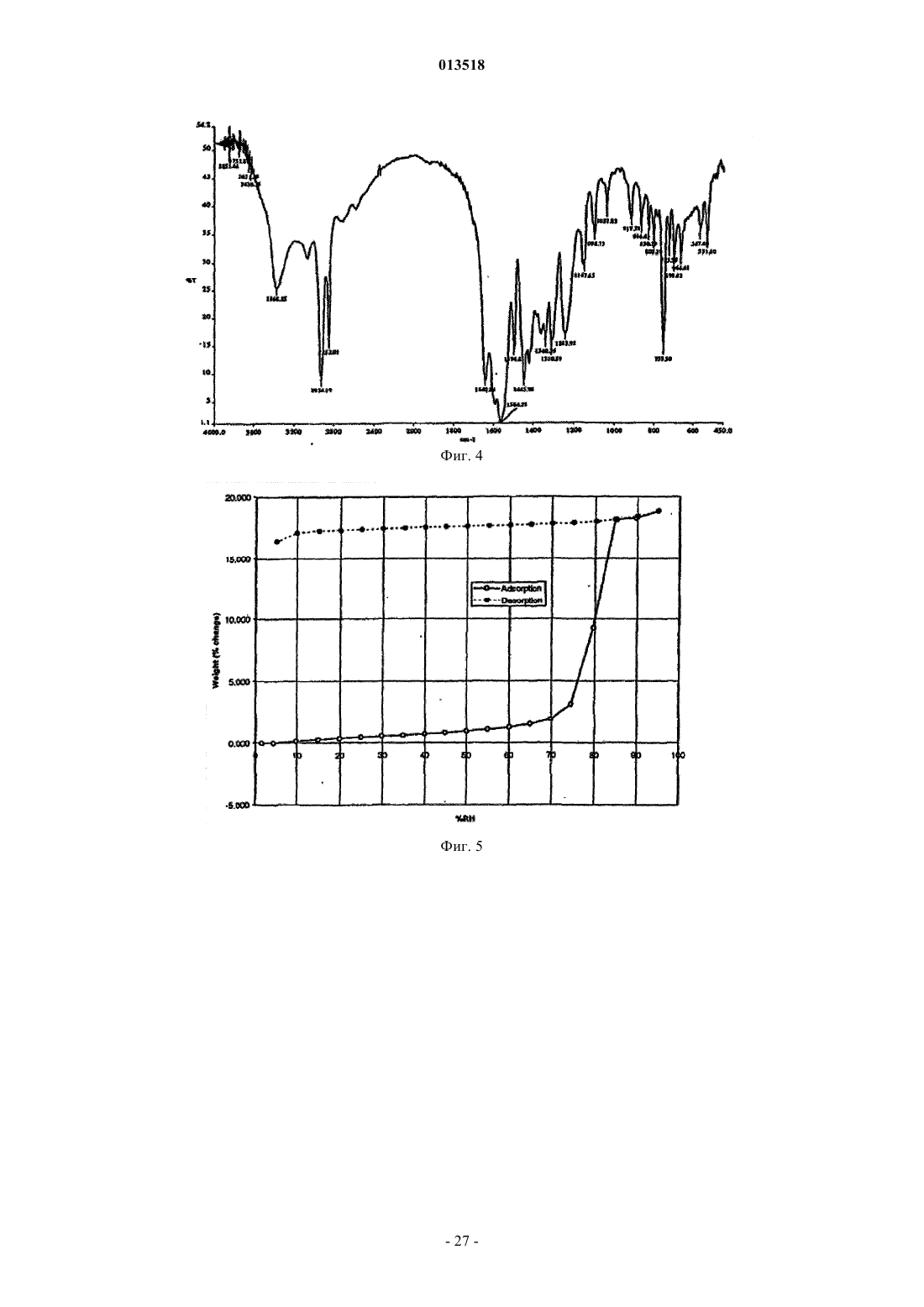
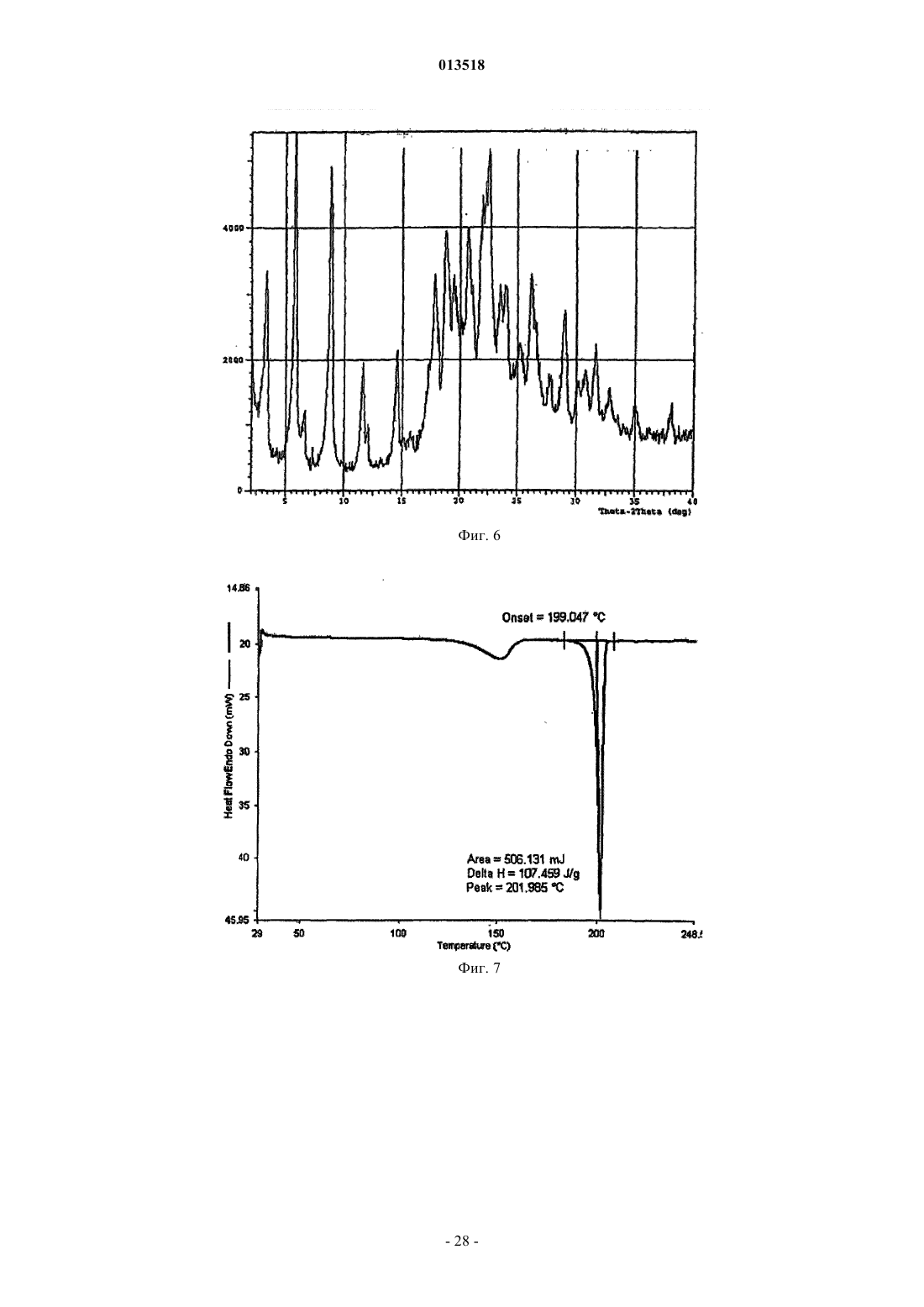
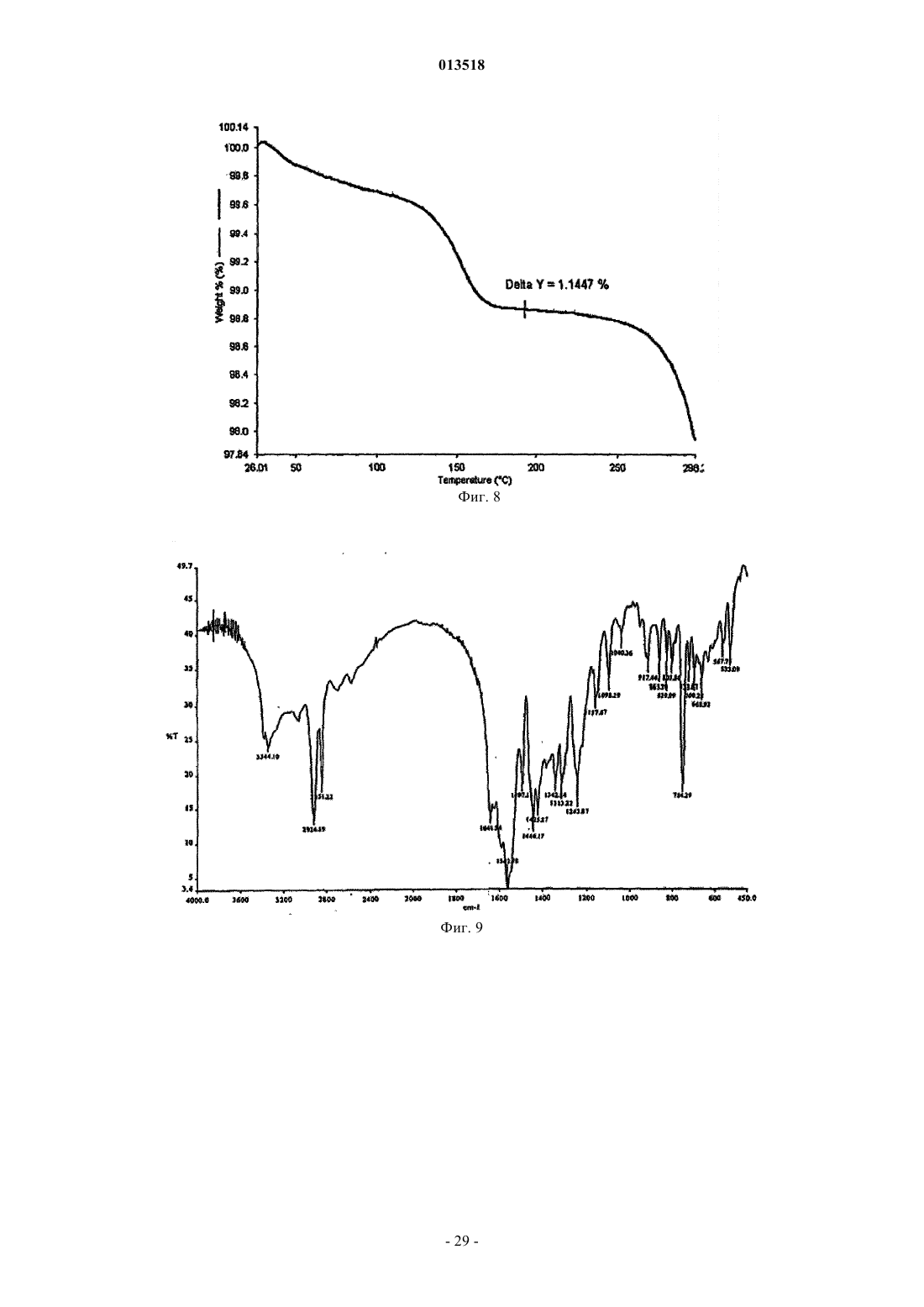
013518 Настоящая заявка испрашивает приоритет согласно предварительной заявке США 60/569476, зарегистрированной 6 мая 2004 г., и предварительной заявке США 60/619418, зарегистрированной 15 октября 2004 г. Обе указанные заявки включены в настоящее описание в качестве ссылки. Область изобретения Настоящее изобретение относится к кристаллическим полиморфным формам N-[8-(2 гидроксибензоил)амино]каприлата натрия, к аморфному N-[8-(2-гидроксибензоил)амино]каприлату натрия, к содержащим их фармацевтическим составам, к способам их получения и к способам доставки активных агентов в указанных составах. Предпосылки изобретения Патент США 5650386 описывает N-[8-(2-гидроксибензоил)амино]каприловую кислоту и ее соли,а также их применение для доставки различных активных агентов. Краткое описание изобретения Настоящее изобретение относится к полиморфным формамN-[8-(2 гидроксибензоил)амино]каприлата натрия ("SNAC"), включая два гидрата, совместный метанольноводный сольват и совместный этанольно-водный сольват SNAC. Один из вариантов реализации изобретения представляет собой фармацевтический состав, содержащий (А) (1) одну или несколько форм I-VI SNAC и/или (2) аморфный SNAC, а также (В) активный агент, в частности, гепарин. В предпочтительном варианте реализации фармацевтический состав содержит по меньшей мере примерно 20, 30, 40, 50, 60, 70, 80, 90, 95, 96, 97, 98, 99, 99,1, 99,2, 99,3, 99,4, 99,5,99,6, 99,7, 99,8 или 99,9 мас.% одной из форм I-VI SNAC или аморфного SNAC, исходя из 100% общей массы SNAC в фармацевтическом составе. Согласно другому предпочтительному варианту реализации фармацевтический состав содержит по меньшей мере примерно 20, 30, 40, 50, 60, 70, 80, 90, 95, 96, 97,98, 99, 99,1, 99,2, 99,3, 99,4, 99,5, 99,6, 99,7, 99,8 или 99,9 мас.% одной из форм I-VI SNAC, исходя из 100% общей массы кристаллического SNAC в фармацевтическом составе. Еще один вариант реализации изобретения представляет собой способ введения или обеспечения доставки активного агента животному (в частности, человеку) путем введения фармацевтического состава согласно изобретению. Следующий вариант реализации изобретения представляет собой способ лечения тромбоза у животного (в частности, у человека), которое нуждается в таком лечении, путем перорального введения противотромбозной эффективной дозы фармацевтического состава согласно настоящему изобретению,содержащего гепарин. Еще один вариант реализации изобретения представляет собой способ получения формы I SNAC,включающий операцию нагревания формы III, V или VI SNAC или их смеси по меньшей мере до 50 С(однако, предпочтительно менее 110 С) в течение периода времени, достаточного для образования формы I SNAC. Следующий вариант реализации изобретения представляет собой способ получения формы I SNAC,включающий операцию нагревания аморфного SNAC при температуре примерно от 30 до примерно 90 С, предпочтительно примерно от 40 до примерно 80 С, в течение периода времени, достаточного для образования формы I SNAC. Следующий вариант реализации изобретения представляет собой способ получения формы I SNAC,включающий операцию лиофилизации любой формы SNAC, отличной от формы I, с получением формыI. Так, например, способ может включать лиофилизацию одной или нескольких форм II-VI SNAC или аморфного SNAC для получения формы I. Еще один вариант реализации изобретения представляет собой фармацевтический состав, содержащий молотую (например, молотую в шаровой мельнице) или прессованную осевым сжатием смесь формы I SNAC и по меньшей мере одного активного агента и/или фармацевтически допустимой добавки(в частности, из описанных ниже). Фармацевтический состав можно получить путем помола (например, в шаровой мельнице) или прессования (например, прессования осевым сжатием) смеси формы I SNAC и по меньшей мере одного активного агента и/или фармацевтически допустимой добавки. Следующий вариант реализации изобретения представляет собой способ получения формы IISNAC, включающий операцию сушки (например, в сушильном барабане) сольвата (например, метанольного сольвата или этанольного сольвата) SNAC без перемешивания, с последующей выдержкой высушенного SNAC под действием влаги в течение периода времени, достаточного для образования формы IISNAC. Операции сушки и выдержки предпочтительно выполняют в закрытом контейнере. ВысушенныйSNAC можно хранить во влажной среде, чтобы обеспечить превращение в форму II остаточного SNAC,не находящегося в форме II. Еще один вариант реализации изобретения представляет собой фармацевтический состав, в частности, таблетку, содержащую прессованную осевым сжатием смесь формы II SNAC и по меньшей мере одного активного агента и/или фармацевтически допустимой добавки (в частности, из описанных ниже). Фармацевтический состав можно получить путем прессования (например, прессования осевым сжатием) смеси формы II SNAC и по меньшей мере одного активного агента и/или фармацевтически допустимой добавки.-1 013518 Следующий вариант реализации изобретения представляет собой способ получения формы IIISNAC, включающий операцию выдержки формы I, II, IV, V или VI SNAC или их смеси в среде с относительной влажностью 75, 80, 85, 90% или более в течение периода времени, достаточного для образования формы III. Следующий вариант реализации изобретения представляет собой способ получения формы IIISNAC, включающий операцию обработки аморфного SNAC влагой (например, в среде с относительной влажностью более 0%, предпочтительно более 5 или 10%) в течение периода времени, достаточного для образования формы III. Следующий вариант реализации изобретения представляет собой способ получения формы IIISNAC, включающий операцию мокрого гранулирования форм I, II, IV, V или VI SNAC или аморфногоSNAC или их смеси (с одним или несколькими активными агентами и/или фармацевтически допустимыми добавками (в частности, из описанных ниже) или без них) в течение периода времени, достаточного для образования формы III. Согласно одному из вариантов реализации изобретения форму I SNAC получают способом влажного гранулирования. Следующий вариант реализации изобретения представляет собой способ получения формы IIISNAC, включающий операцию выдержки формы V или VI SNAC или их смеси в среде с относительной влажностью 30, 35, 40, 50% или более в течение периода времени, достаточного для образования формыIII. Следующий вариант реализации изобретения представляет собой способ получения формы IIISNAC, включающий операцию выдержки формы IV SNAC в среде с относительной влажностью 10, 20,30% или более в течение периода времени, достаточного для образования формы III. Еще один вариант реализации изобретения представляет собой способ получения формы III SNAC,включающий операцию кристаллизации SNAC из воды. Следующий вариант реализации изобретения представляет собой способ получения формы IIISNAC, включающий операцию влажного гранулирования формы I SNAC в течение периода времени,достаточного для образования формы III. Еще один вариант реализации изобретения представляет собой фармацевтический состав, в частности, таблетку, содержащую прессованную осевым сжатием смесь формы III SNAC и по меньшей мере одного активного агента и/или фармацевтически допустимой добавки (в частности, из описанных ниже). Фармацевтический состав можно получить путем прессования (например, прессования осевым сжатием) смеси формы III SNAC и по меньшей мере одного активного агента и/или фармацевтически допустимой добавки. Следующий вариант реализации изобретения представляет собой способ получения формы IVSNAC, включающий операцию нагревания формы I, II, III, V или VI SNAC или их смеси при температуре примерно от 110 или 150 С до точки плавления SNAC (например, 150 или 170 С) в течение периода времени, достаточного для образования формы IV. Следующий вариант реализации изобретения представляет собой способ получения формы VSNAC, включающий операцию кристаллизации SNAC из метанольного раствора при относительной влажности по меньшей мере 30, 40 или 50%. Метанол предпочтительно практически или абсолютно не содержит воды. Не будучи связанным какой-либо теорией, автор предполагает метанольный сольват в течение некоторого времени заменяет метанол на атмосферную воду, образуя метанольно-водный сольват формы V. Так, например, форму V можно получить, приготовив насыщенный раствор SNAC (в частности, форм I-IV или VI SNAC или их смеси) в метаноле при относительной влажности по меньшей мере 30, 40 или 50% и охладив указанный раствор, например, до комнатной или более низкой температуры (в частности, на ледяной бане). Полученный осадок можно отфильтровать и высушить. Следующий вариант реализации изобретения представляет собой способ получения формы VSNAC, включающий операцию уравновешивания форм I-IV или VI SNAC с метанолом. Метанол предпочтительно практически или абсолютно не содержит воды. Форму V можно получить, например, путем суспендирования форм I-IV или VI или их смеси в метаноле при относительной влажности 30, 40 или 50% и выдержки суспендированной смеси при температуре окружающей среды в течение периода времени, достаточного для образования формы V (например, в течение нескольких дней). Следующий вариант реализации изобретения представляет собой способ получения формы VSNAC, включающий операцию кристаллизации SNAC из этанольного раствора при относительной влажности по меньшей мере 30, 40 или 50%. Этанольный раствор предпочтительно практически или абсолютно не содержит воды. Форму V можно получить, например, приготовив насыщенный растворSNAC (в частности, форм I-IV или VI SNAC или их смеси) в этаноле при относительной влажности по меньшей мере 30, 40 или 50% и охладив указанный раствор до комнатной или более низкой температуры. Следующий вариант реализации изобретения представляет собой способ получения формы VISNAC, включающий операцию суспендирования форм I-V в этаноле при относительной влажности по меньшей мере 10, 20 или 30%. Этанол предпочтительно практически или абсолютно не содержит воды. Форму VI можно получить, например, путем добавления форм I-V в этанол для образования осадка и-2 013518 выдержки суспендированной смеси при температуре окружающей среды в течение периода времени,достаточного для образования формы VI. И еще один вариант реализации изобретения представляет собой способ получения аморфногоSNAC путем обезвоживания формы III SNAC (например, в вакууме) в течение периода времени, достаточного для образования аморфного SNAC. Краткое описание фигур Фиг. 1, 6, 11, 16, 21, 26 и 43 представляют собой рентгеновские порошковые дифрактограммы (Xray powder diffractograms, XRPDs) форм I-VI SNAC и аморфного SNAC (содержащего 10% формы IIISNAC), соответственно, полученных в примерах 1-6 и 14. Фиг. 2, 7, 12, 17, 22, 27 и 44 представляют результаты анализов дифференциальной сканирующей калориметрии (differential scanning calorimetry, DSC) форм I-VI SNAC и аморфного SNAC (содержащего 10% формы III SNAC), соответственно, полученных в примерах 1-6 и 14. Фиг. 3, 8, 13, 18, 23, 28 и 45 представляют результаты термогравиметрических анализов (thermogravimetric analyses, TGAs) форм I-VI SNAC и аморфного SNAC (содержащего 10% формы III SNAC), соответственно, полученных в примерах 1-6 и 14. Фиг. 4, 9, 14, 19, 24, 29 и 46 представляют собой кривые, полученные способом инфракрасной спектроскопии с преобразованием Фурье (Fourier-transform infrared (FTIR) spectra) форм I-VI SNAC и аморфного SNAC (содержащего 10% формы III SNAC), соответственно, полученных в примерах 1-6 и 14. Фиг. 5, 10, 15, 20, 25, 30 и 47 представляют собой спектры адсорбции/десорбции влаги для форм IVI SNAC и аморфного SNAC (содержащего 10% формы III SNAC), соответственно, полученных в примерах 1-6 и 14. Фиг. 31 и 32 представляют собой графики зависимости концентрации гепарина в плазме яванских макак от времени после перорального введения капсул с формой I или III SNAC и гепарином, полученные в примере 7. Фиг. 33 представляет собой график зависимости концентрации гепарина в плазме яванских макак от времени после перорального введения капсул с формой I или III SNAC и гепарином, полученный в примере 7. Фиг. 34 и 35 представляют собой графики зависимости концентрации гепарина в плазме яванских макак от времени после перорального введения капсул с формой I или III SNAC и гепарином, полученные в примере 8. Фиг. 36 представляет собой график зависимости концентрации гепарина в плазме яванских макак от времени после перорального введения капсул с формой I или III SNAC и гепарином, полученный в примере 7. Фиг. 37 представляет собой график зависимости растворения гранулы формы I или III SNAC в деионизованной воде при 37 С от времени в течение 15 мин (пример 9). Фиг. 38 представляет собой график зависимости растворения гранулы формы I, II, III или IV SNAC в деионизованной воде при 37 С от времени в течение 15 мин (пример 9). Фиг. 39 представляет собой XRPDs формы I SNAC до и после помола в шаровой мельнице (пример 11). Фиг. 40 представляет собой XRPDs формы I SNAC до и после влажного гранулирования (пример 12). Фиг. 41 представляет собой XRPDs формы I SNAC до и после прессования (пример 13). Фиг. 42 представляет собой XRPDs формы III SNAC до и после прессования (пример 13). Подробное описание изобретения Определения Термин "полиморф" относится к формам вещества, которые имеют кристаллографические отличия. Термин "гидрат", используемый в настоящем описании, включает, в частности, но без ограничения,(1) вещество, содержащее воду, объединенную в молекулярную форму, и (2) вещество, содержащее одну или несколько молекул кристаллизационной воды, или кристаллический материал, содержащий свободную воду. Термин "SNAC", используемый в настоящем описании, относится к натриевой соли N-[8-(2 гидроксибензоил)амино]каприловой кислоты. Если не указано иного, то термин "SNAC", используемый в настоящем описании, относится ко всем полиморфам SNAC. Термин "SNAC 1/3 гидрат", используемый в настоящем описании, относится к кристаллической форме SNAC, в которой одна молекула воды связана с тремя молекулами SNAC. Термин "SNAC тригидрат", используемый в настоящем описании, относится к кристаллической форме SNAC, в которой три молекулы воды связаны с каждой молекулой SNAC. Термин "сольват", используемый в настоящем описании, включает, в частности, но без ограничения, молекулярный или ионный комплекс молекул или ионов растворителя с молекулами или ионамиSNAC. Термин "совместный сольват", используемый в настоящем описании, включает, в частности, но без ограничения, молекулярный или ионный комплекс молекул или ионов двух или нескольких растворителей с молекулами или ионами SNAC. Термин "агент доставки", используемый в настоящем описании, относится к SNAC, включая его кристаллические полиморфные формы.-3 013518 Термин "эффективная доза лекарственного средства" представляет собой дозу активного агента(например, гепарина), эффективную для лечения или предотвращения состояния живого организма, в который вводят лекарственное средство, в течение некоторого периода времени, например, обеспечивает терапевтический эффект в течение желаемого интервала между введением лекарственного средства. Как известно специалистам в данной области техники, эффективная доза изменяется в зависимости от способа введения, используемого наполнителя и возможности совместного применения с другими агентами для лечения соответствующего состояния. Термины "лечить", "лечение" или "подвергнутый лечению" относятся к введению активного агента с целью лечения, излечения, облегчения, смягчения, изменения, улучшения или влияния на состояние(например, на болезнь), на симптомы состояния или на предрасположение к состоянию."Эффективная доза агента доставки" представляет собой дозу агента доставки, которая способствует адсорбции желаемого количества активного агента при введении его каким-либо способом (например,способом, рассматриваемым в данной заявке, включая, в частности, но без ограничения пероральный(например, в желудочно-кишечный тракт через биологическую мембрану), назальный, пульмональный,дермальный, вагинальный и/или окулярный способ). Термин "гепарин", используемый в настоящем описании, относится ко всем формам гепарина,включая, в частности, но без ограничения, нефракционированный гепарин, гепариноиды, дерматаны,хондроитины, гепарин с низкой молекулярной массой (например, тинзапарин (включая натриевый тинзапарин, гепарин с очень низкой молекулярной массой и гепарин со сверхнизкой молекулярной массой. Предпочтительным типом гепарина является нефракционированный гепарин, в частности, натриевый гепарин (например, натриевый гепарин USP (соответствующий требованиям Фармакопеи США. Термин "гепарин с низкой молекулярной массой" в общем случае относится к гепарину, в котором по меньшей мере 80% (мас.) гепарина имеет молекулярную массу примерно от 3000 до примерно 9000 Да. Неограничивающие примеры гепарина с низкой молекулярной массой включают тинзапарин, эноксаприн и дальтипарин. Тинзапарин разрешен Управлением по контролю за продуктами и лекарствами США (Foodand Drug Administration, FDA) для лечения острого симптоматического глубокого тромбоза вен с эмболией легких или без нее при введении в сочетании с варфарином натрия. Натриевую соль тиназапарина поставляет компания Pharmion Corporation of Boulder, Колорадо, под торговой маркой Innohep. Термин"гепарин с очень низкой молекулярной массой" в общем случае относится к гепарину, в котором по меньшей мере 80% (по массе) гепарина имеет молекулярную массу примерно от 1500 до примерно 5000 Да. Неограничивающие примеры гепарина с очень низкой молекулярной массой включают бемипарин. Термин "гепарин со сверхнизкой молекулярной массой" в общем случае относится к гепарину, в котором по меньшей мере 80% (мас.) гепарина имеет молекулярную массу примерно от 1000 до примерно 2000 Да. Неограничивающие примеры гепарина со сверхнизкой молекулярной массой включают фондипаринукс. Термин "инсулин" относится ко всем формам инсулина, включая, в частности, но без ограничения,инсулин, полученный из природного сырья, и синтетические формы инсулина, описанные, в частности, в патентах США 4421685, 5474978 и 5534488, все из которых полностью включены в настоящее описание в качестве ссылки. Термин "AUC" (Area Under Curve), используемый в настоящем описании, относится к площади,расположенной под кривой зависимости концентрации препарата в плазме от времени, которую рассчитывают по формуле трапеций в течение всего периода введения препарата, например, в течение 24 ч. Термин "среднее", предшествующий значению фармакокинетического параметра (например, средний пик), означает среднее арифметическое значение фармакокинетического параметра, если не указано иного. Термин "примерно", используемый в настоящем описании, означает в пределах 10% данной величины, предпочтительно в пределах 5% и более предпочтительно в пределах 1% данной величины. В альтернативном смысле термин "примерно" означает, что значение может содержаться в пределах научно допустимых границ погрешности для данного типа величины, зависимых от точности измерения, которую можно получить при использовании доступных измерительных средств. Безводная форма I SNAC Кристаллическая полиморфная форма I SNAC является безводной. Форма I стабильна при комнатной температуре и не изменяет кристаллической формы при помоле (например, при помоле в шаровой мельнице) или при прессовании (например, при прессовании осевым сжатием). Однако форма I превращается в форму III при влажном гранулировании с достаточным количеством влаги в течение достаточного периода времени. При определении методом дифференциальной сканирующей калориметрии (DSC) форма I имеет начальную температуру плавления, равную примерно 198 С (см. фиг. 2). Форма I SNAC имеет кривую XRPD, практически идентичную показанной на фиг. 1. Расположения характеристических пиков (выраженные в градусах 20,2, 0,1, 0,05 или 0,01 2) и шаг d для формы I указаны в приведенной ниже табл. 1. Расположения пиков, отмеченные в табл. 1 символом "U", являются характерными только для формы I. Так, например, пик, соответствующий 2,9820,2, 0,1, 0,05 или 0,01 2, характе-4 013518 рен только для формы I. Таблица 1. Характеристические пики XRPD (выраженные в градусах 2) формы I SNAC Форму I можно получить способом, описанным далее в примере 1. Форму I можно также получить путем нагревания формы III, V или VI или их смеси до температуры по меньшей мере 50 С (однако, предпочтительно менее 110 С). Кроме того, форму I можно получить путем нагревания аморфного SNAC при температуре примерно от 30 до примерно 90 С, предпочтительно примерно от 40 до примерно 80 С, в течение периода времени, достаточного для образования формы I SNAC. Еще один способ получения формы I SNAC представляет собой операцию лиофилизации любой формы SNAC, отличной от формы I, чтобы получить форму I. Так, например, для получения формы I можно подвергнуть лиофилизации одну или несколько форм II-VI SNAC и/или аморфный SNAC. Настоящее изобретение обеспечивает также фармацевтический состав, содержащий форму I SNAC,в котором менее 90, 80, 70 или 60% SNAC имеют кристаллическую структуру (в расчете на 100% суммарной массы SNAC). Кроме того, настоящее изобретение обеспечивает фармацевтический состав, в частности, таблетку,содержащую молотую (например, молотую в шаровой мельнице) или прессованную осевым сжатием смесь формы I SNAC и по меньшей мере одного активного агента и/или фармацевтически приемлемой добавки (в частности, из описанных ниже). Фармацевтический состав (или молотая или прессованная осевым сжатием смесь) содержит по меньшей мере 50, 60, 70, 80, 90, 95, 96, 97, 98 или 99 мас.% формы I,исходя из 100% общей массы SNAC в фармацевтическом составе (или молотой или прессованной осевым сжатием смеси). Гидратная форма II SNAC Кристаллическая полиморфная форма II представляет собой гидрат SNAC. Не будучи связанным какой-либо теорией, автор настоящего изобретения предполагает, что форма II представляет собой 1/3 гидрат (т.е. он содержит примерно 1 моль воды на 3 моля SNAC и называется также 1/3 гидрат SNAC). Форма II стабильна при комнатной температуре. При определении методом DSC форма I имеет начальную температуру плавления, равную примерно 199 С (см. фиг. 7). Форма II SNAC имеет кривую XRPD,практически идентичную показанной на фиг. 6. Расположения характеристических пиков XRPD (выраженные в градусах 20,2, 0,1, 0,05 или 0,01 2) и шаг d для формы II указаны в приведенной ниже табл. 2. Расположения пиков XRPD, отмеченные в таблице 2 символом "U", являются характерными только для формы II. Так, например, пики, соответствующие 3, 29, 11,96 и 17,76 20,2, 0,1, 0,05 или 0,01 2, характерны только для формы II. Форму II SNAC можно получить при помощи сушки (например, в барабанном сушителе) сольвата(например, этанольного сольвата или метанольного сольвата) SNAC без перемешивания, с выдержкой высушенного SNAC под действием влаги в течение периода времени, достаточного для образования формы II SNAC. Операции сушки и выдержки предпочтительно выполняют в закрытом контейнере. Операцию выдержки можно выполнять после операции сушки. Высушенный SNAC можно хранить во влажной среде (например, в условиях окружающей среды или во влажной среде, т. е. при относительной влажности 10, 20% или более), чтобы обеспечить превращение в форму II остаточного SNAC, не находящегося в форме II. Этанольный сольват SNAC можно получить способом, описанным в примере 2. Гидратная форма III SNAC Кристаллическая полиморфная форма III представляет собой гидрат SNAC. Не будучи связанным какой-либо теорией, автор настоящего изобретения предполагает, что форма III представляет собой тригидрат (т.е. он содержит примерно 3 моля воды на 1 моль SNAC и называется также тригидрат SNAC). Форма III стабильна при комнатной температуре и не изменяет кристаллической формы при прессовании(например, при прессовании осевым сжатием). При определении методом дифференциальной сканирующей калориметрии (DSC) форма I имеет начальную температуру плавления, равную примерно 198 С(см. фиг. 12). Форма III SNAC имеет кривую XRPD, практически идентичную показанной на фиг. 11. Расположения характеристических пиков XRPD (выраженные в градусах 20,2, 0,1, 0,05 или 0,01 2) и шаг d для формы III указаны в приведенной ниже табл. 3. Расположения пиков XRPD, отмеченные в табл. 2 символом "U", являются характерными только для формы III. Так, например, пики, соответствующие 6,69, 13,58 и 16,80 20,2, 0,1, 0,05 или 0,01 2, характерны только для формы III. Таблица 3 Характеристические пики XRPD (выраженные в градусах 2) формы III SNAC Форму III SNAC можно получить путем выдержки формы I, II, IV, V или VI SNAC или их смеси в среде с относительной влажностью 75, 85, 90% или более в течение периода времени (семь дней или более), достаточного для образования формы III. Так, например, форму III можно получить путем выдержки форм I, II, IV-VI в среде с относительной влажностью 75% или более в течение по меньшей мере семи дней (например, до тех пор, пока содержание влаги в материале не составит по меньшей мере 15 мас.%). Если содержание влаги в материале существенно превышает 15%, то материал предпочтительно сушат в-6 013518 условиях окружающей среды до тех пор, пока содержание влаги в материале не составит примерно 15 мас.%. Форму III можно также получить путем обработки аморфного SNAC влагой (например, в среде с относительной влажностью более 0%, предпочтительно более 5 или 10%) в течение периода времени,достаточного для образования формы III. Форму III можно также получить путем влажного гранулирования (водного гранулирования) формI, II, IV, V или VI SNAC или аморфного SNAC или их смеси. Согласно одному из вариантов реализации изобретения форму I SNAC подвергают влажному гранулированию. Полученную форму III затем можно снова использовать (например, при 50 С) для получения формы I SNAC. Еще один способ получения формы III заключается в выдержке формы V или VI SNAC или их смеси в среде с относительной влажностью 30, 35, 40, 50% или более в течение периода времени, достаточного для образования формы III. Другой способ получения формы III заключается в выдержке формы IVSNAC в среде с относительной влажностью 10, 20, 30% или более в течение периода времени, достаточного для образования формы III. Форму III можно также получить путем кристаллизации SNAC из воды. Образующиеся кристаллы можно выделить, например, при помощи фильтрации и сушки в условиях окружающей среды. Сушку выполняют при температуре, предпочтительно меньшей 40 или 35 С. Настоящее изобретение обеспечивает также фармацевтический состав, в частности, таблетку, содержащую прессованную осевым сжатием смесь формы III SNAC и по меньшей мере один активный агент и/или фармацевтически допустимую добавку (в частности, из описанных ниже). Фармацевтический состав (или смесь, прессованная осевым сжатием) предпочтительно содержит по меньшей мере 50, 60,70, 80, 90, 95, 96, 97, 98 или 99 мас.% формы III, исходя из общей массы SNAC в фармацевтическом составе (или в прессованной осевым сжатием смеси). Безводная форма IV SNAC Кристаллическая полиморфная форма IV SNAC является безводной. Форма IV стабильна при комнатной температуре. Кроме того, форма IV менее растворима в ацетонитриле и обладает большей термодинамической стабильностью, чем форма I, в условиях окружающей среды. При определении методом дифференциальной сканирующей калориметрии (DSC) форма IV имеет начальную температуру плавления, равную примерно 199 С (см. фиг. 17). Форма IV SNAC имеет кривую XRPD, практически идентичную показанной на фиг. 16. Расположения характеристических пиков XRPD (выраженные в градусах 20,2, 0,1, 0,05 или 0,01 2) и шаг d для формы IV указаны в приведенной ниже табл. 4. Расположения пиков XRPD, отмеченные в табл. 4 символом "U", являются характерными только для формы IV. Так,например, пики, соответствующие 8,61, 17,04 и 23,28 20,2, 0,1, 0,05 или 0,01 2, характерны только для формы IV. Таблица 4 Характеристические пики XRPD (выраженные в градусах 2) формы IV SNAC Форму IV можно получить путем нагревания формы I, II, III, V или VI SNAC или их смеси при температуре примерно от 110 или 150 С до точки плавления SNAC в течение периода времени, достаточного для образования формы IV. Так, например, форму II SNAC можно нагреть (например, в сушильном шкафу) до температуры, превышающей температуру переходного процесса десольватированного материла, однако, более низкой, чем температура плавления SNAC (например, дегидратация происходит при скорости нагревания 10 С/мин, начиная со 130-140 С) до образования формы IV (например, в течение нескольких часов). После образования форму IV можно охладить и извлечь. Настоящее изобретение обеспечивает также фармацевтический состав, содержащий форму IVSNAC, в котором по меньшей мере 50, 60, 70, 80 или 90% SNAC имеют кристаллическую форму (в расчете на 100 мас.% SNAC). Совместный метанольно-водный сольват формы V SNAC Кристаллическая полиморфная форма V SNAC представляет собой совместный метанольно-водный сольват (примерно 0,8 моля метанола и 2 моля воды на 1 моль SNAC). При определении методом диффе-7 013518 ренциальной сканирующей калориметрии (DSC) форма V имеет начальную температуру плавления, равную примерно 197 С (см. фиг. 22). Форма V SNAC имеет кривую XRPD, практически идентичную показанной на фиг. 21. Расположения характеристических пиков XRPD (выраженные в градусах 20,2, 0,1,0,05 или 0,01 2) и шаг d для формы V указаны в приведенной ниже табл. 5. Расположения пиков XRPD,отмеченные в табл. 5 символом "U", являются характерными только для формы V. Так, например, пики,соответствующие 6,59, 9,96, 10,86, 13,87, 17,29 и 19,92 20,2, 0,1, 0,05 или 0,01 2, характерны только для формы V. Таблица 5 Характеристические пики XRPD (выраженные в градусах 2) формы V SNAC Форму V SNAC можно получить путем кристаллизации SNAC, например, форм I-IV или VI SNAC или их смеси (например, смеси форм I и III) из метанольного раствора при относительной влажности по меньшей мере примерно 30, 40 или 50%. Метанольный раствор предпочтительно практически или абсолютно не содержит воды. Так, например, форму V можно получить, приготовив насыщенный растворSNAC (в частности, форм I-IV или VI SNAC или их смеси) в метаноле при относительной влажности по меньшей мере примерно 30, 40 или 50% и охладив указанный раствор, например, до комнатной или более низкой температуры (в частности, на ледяной бане). Полученный осадок можно отфильтровать и высушить. Форму V SNAC можно также получить путем уравновешивания форм I-IV или VI SNAC метанолом. Метанол предпочтительно практически или абсолютно не содержит воды. Форму V можно получить, например, путем суспендирования форм I-IV или VI или их смеси в метаноле при относительной влажности по меньшей мере 30, 40 или 50% и выдержки суспендированной смеси при температуре окружающей среды в течение периода времени, достаточного для образования формы V (например, в течение нескольких дней). Предпочтительно используют избыток метанола (т.е. молярное отношение метанола к SNAC превышает 1). Образующийся осадок можно извлечь, например, при помощи вакуумной фильтрации и сушки на открытом воздухе. Совместный метанольно-водный сольват формы VI SNAC Кристаллическая полиморфная форма VI SNAC представляет собой совместный метанольноводный сольват (примерно 0,6 моля метанола и 2 моля воды на 1 моль SNAC). При определении методом дифференциальной сканирующей калориметрии (DSC) форма VI имеет начальную температуру плавления, равную примерно 197 С (см. фиг. 27). Форма VI SNAC имеет кривую XRPD, практически идентичную показанной на фиг. 26. Расположения характеристических пиков XRPD (выраженные в градусах 20,2, 0,1, 0,05 или 0,01 2) и шаг d для формы VI указаны в приведенной ниже табл. 6. Расположения пиков XRPD, отмеченные в табл. 6 символом "U", являются характерными только для формы VI. Так,например, пики, соответствующие 9,60, 10,43, 12,68 и 16,58 20,2, 0,1, 0,05 или 0,01 2, характерны только для формы VI. Форму VI можно получить путем кристаллизации SNAC (например, форм I-V или их смеси) из этанольного раствора при относительной влажности по меньшей мере примерно 30, 40 или 50%. Так, например, форму VI можно получить, приготовив насыщенный раствор SNAC (в частности, форм I-VSNAC или их смеси) в этаноле при относительной влажности по меньшей мере примерно 30, 40 или 50% и охладив указанный раствор, например, до комнатной или более низкой температуры (в частности, на ледяной бане). Полученный осадок можно отфильтровать и высушить. Форму VI можно получить, например, путем суспендирования форм I-V в этаноле при относительной влажности по меньшей мере примерно 10, 20 или 30%. Так, например, форму VI можно получить путем добавления форм I-V в этанол для образования осадка и выдержки суспендированной смеси при температуре окружающей среды в течение времени, достаточного для образования формы VI (например,несколько дней). Полученный осадок можно отфильтровать и высушить на воздухе. Аморфный SNAC Аморфный SNAC не стабилен в условиях окружающей среды и превращается в форму III под действием влаги. Аморфный SNAC можно получить путем дегидратации формы III SNAC (например, в вакууме) в течение времени, достаточного для образования аморфного SNAC. Аморфный SNAC можно получить также путем дегидратации формы V или VI SNAC (например, в вакууме) в течение времени,достаточного для образования аморфного SNAC. Кристаллы, полученные в результате вышеуказанных процедур, можно извлечь одним из способов,известных специалистам в данной области техники. Активные агенты Активные агенты, пригодные для применения согласно настоящему изобретению, включают биологически активные агенты и химические активные агенты, в частности, но без ограничения, пестициды,фармакологически активные агенты и терапевтически активные агенты. Пригодные биологически или химически активные агенты включают, в частности, но без ограничения, белки, полипептиды, пептиды, гормоны, полисахариды, в частности, смеси мукополисахариды, углеводы, липиды, мелкие полярные органические молекулы (т.е. полярные органические молекулы,имеющие молекулярную массу 500 Да или менее), другие органические соединения, в частности, соединения, которые сами по себе не проходят (или только часть введенной дозы которых проходит) сквозь слизистую оболочку желудочно-кишечного тракта и/или которые являются чувствительными к химическому расщеплению кислотами и ферментами в желудочно-кишечном тракте, или их любые сочетания. Другие примеры включают, в частности, но без ограничения, следующие агенты синтетического,природного или рекомбинантного происхождения: гормоны роста, в том числе гормоны роста человека(hGH), рекомбинантные гормоны роста человека (rhGH), бычьи гормоны роста (hGH), свиные гормоны роста; гормоны, выделяющие гормон роста; фактор, выделяющий гормон роста (например, аналог g GRфактора); интерфероны, в том числе ,и ; интерлейкин-1; интерлейкин-2; инсулин, в том числе свиной, бычий человечий и человечий рекомбинант, возможно, содержащий противоионы, включая цинк,натрий, кальций и аммоний; инсулиноподобный фактор роста, в том числе IGF-I; гепарин, включая нефракционированный гепарин, гепариноиды, дерматаны, хондроитины, гепарин с низкой молекулярной массой, гепарин с очень низкой молекулярной массой и гепарин со сверхнизкой молекулярной массой; кальцитонин, в том числе лососинный, угревой, свиной и человечий; эритропоэтин; предсердный натрийуретический фактор; антигены; моноклональные антитела; соматостатин; ингибиторы протеазы;-9 013518 адренокортикотропин, гормон, выделяющий гонадотропин; окситоцин; гормон, выделяющий лейцинирующий гормон; гормон, стимулирующий фолликулы; глюкоцереброзидазу; тромбопоэтин; филграстим; простагландины; циклоспорин; вазопрессин; кромолиннатрий (натриевый или динатриевый хромогликат); ванкомицин; десферриоксамин (desferrioxamine, DFO); бисфосфонаты, включая ибандронат, алендронат, тилудронат, этидронат, клодронат, памидронат, олпадронат и инкадронат, а также из фармацевтически допустимые соли (например, ибандронат натрия); соли галлия (в частности, нитрат галлия, нонагидрат нитрата галлия и мальтолат галлия); ацикловир и его фармацевтически приемлемые соли (например, ацикловир натрия); паращитовидный гормон (parathyroid hormone, PTH), включая его фрагменты; противомигреневые агенты, в частности, BIBN-4096BS, и другие кальцитонинные антагонисты генсвязанных белков; противомикробные агенты, включая антибиотики (в том числе, антибиотики грамположительного действия, бактерицидные, липопептидные и циклические пептидные антибиотики, в частности, даптомицин), антибактериальные и противогрибковые агенты; витамины; аналоги, фрагменты, миметические или модифицированные полиэтиленгликолем производные указанных соединений или их любые сочетания. Согласно одному из вариантов реализации изобретения активный агент представляет собой ибандронат или его фармацевтически приемлемые соли (например, ибандронат натрия). Согласно другому варианту реализации изобретения активный агент представляет собой соль галлия, в частности, нитрат галлия или нонагидрат нитрат галлия. Согласно еще одному варианту реализации изобретения активный агент представляет собой ацикловир или его фармацевтически приемлемую соль (например, ацикловир натрия). Согласно еще одному варианту реализации изобретения активный агент представляет собой инсулин. Фармацевтические составы Фармацевтический состав предпочтительно является твердым и может быть получен в твердой лекарственной форме. Твердая лекарственная форма может представлять собой капсулу, таблетку или частицы, в частности, порошок или саше. Порошок может иметь форму саше, содержание которого смешивают с жидкостью перед введением. Твердая лекарственная форма может представлять собой также систему местной доставки, в частности, мазь, крем или полутвердый состав. Указанные твердые лекарственные формы могут включать систему непрерывного или регулируемого выделения. Твердая лекарственная форма предназначена предпочтительно для перорального введения. Порошок может быть упакован в капсулы или спрессован в таблетки, использоваться в порошкообразной форме или вводиться в мазь, крем или полутвердый состав. Способы получения твердых лекарственных форм хорошо известны специалистам в данной области техники. Содержание агента доставки в твердой лекарственной форме представляет собой эффективную дозу для доставки и может быть определено для каждого конкретного соединения или биологически, или химически активного агента способами, известными специалистам в данной области техники. После введения активный агент, присутствующий в составе или стандартной лекарственной форме,включается в процесс циркуляции. Биологическую усвояемость агента можно легко определить, измеряя известную фармакологическую активность в крови, например, увеличение времени свертывания крови под действием гепарина или уменьшение концентрации циркулирующего кальция, которое вызывается кальцитонином. Альтернативно можно непосредственно измерить уровень циркуляции самого активного агента. Твердая лекарственная форма может включать фармацевтически приемлемые добавки, в частности,формообразующие агенты, носители, разбавители, стабилизаторы, пластификаторы, связующие вещества, глиданты, дезинтегранты, наполнители, смазки, красители, пленкообразующие агенты, ароматизаторы, консерванты, растворители, поверхностно-активные агенты и любые комбинации вышеуказанных веществ. Эти добавки предпочтительно являются фармацевтически приемлемыми добавками, которые описаны в литературе, в частности, Remington's, The Science and Practice of Pharmacy, (Gennaro, A.R., ed.,19th edition, 1995, Mack Pub. Co.), включенной в данное описание в качестве ссылки. Пригодные связующие вещества включают, в частности, но без ограничения, крахмал, желатин, сахара (например, сахарозу, мелассу и лактозу), двухосновный дигидрат фосфата кальция, природные и синтетические камеди (аравийскую камедь), альгинат натрия, карбоксиметилцеллюлозу, метилцеллюлозу, поливинилпирролидон, полиэтиленгликоль, этилцеллюлозу и воски. Пригодные глиданты включают, в частности, но без ограничения, тальк и диоксид кремния (кремнезем) (например, пирогенный кремнезем и коллоидальный диоксид кремния). Пригодные дезинтегранты, включают, в частности, но без ограничения, крахмалы, натриевый гликолят крахмала, натрий кроскармелозу, кросповидон, глины, целлюлозы (например, очищенную целлюлозу, метилцеллюлозу, натрий карбоксиметилцеллюлозу), альгинаты, пептизированные кукурузные крахмалы и камеди (в частности, камедь агар-агара, гуара, плодов рожкового дерева, карайи, пектина и трагаканта). Предпочтительным дезинтегрантом является натриевый гликолят крахмала. Пригодные наполнители включают, в частности, но без ограничения, крахмалы (в частности, рисовый крахмал), микрокристаллическую целлюлозу, лактозу (например, моногидрат лактозы), сахарозу,декстрозу, маннитол, сульфат кальция, вторичный кислый сульфат кальция и средний сульфат кальция.- 10013518 Пригодные смазки включают, в частности, но без ограничения, стеариновую кислоту, стеараты (в частности, стеарат кальция и стеарата магния), тальк, борную кислоту, бензоат натрия ацетат натрия,фумарат натрия хлорид натрия, полиэтиленгликоль, гидрогенизированное хлопковое и касторовое масла. Пригодные поверхностно-активные агенты включают, в частности, но без ограничения, лаурилсульфат натрия, гидроксилированный соевый лецитин, полисорбаты и блок-сополимеры пропиленоксида и этиленоксида. Системы доставки Содержание активного агента в составе для введения согласно настоящему изобретению представляет собой дозу, эффективную для реализации назначения конкретного активного агента применительно к определенным показаниям. Содержание активного агента в составах обычно представляет собой фармакологически, биологически, терапевтически или химически эффективную дозу. Однако это содержание может быть меньшим, чем в том случае, когда состав используют в форме единичного дозирования,поскольку стандартная лекарственная форма может содержать множество составов агента доставки/активного агента или может содержать разделенную фармакологически, биологически, терапевтически или химически эффективную дозу. При этом суммарную эффективную дозу можно ввести в кумулятивных единицах, содержащих в сумме эффективную дозу активного агента. Требуемую суммарную дозу активного агента можно определить способами, известными специалистам в данной области техники. Однако, поскольку составы согласно изобретению могут доставлять активные агенты более эффективно, чем другие составы или составы, содержащие только активный агент,возможно введение субъекту более низких доз биологически или химически активных агентов, чем использовавшиеся ранее в известных стандартных лекарственных формах или системах доставки, при обеспечении таких же уровней концентрации в крови и/или терапевтических эффектов. В общем случае отношение масс агента доставки и активного агента лежит в пределах примерно от 0,1:1 до примерно 1000:1, предпочтительно примерно от 1:1 до примерно 300:1. Отношение масс изменяется в зависимости от активного агента и конкретного показания для введения активного агента. Агенты доставки согласно настоящему изобретению обеспечивают доставку биологически и химически активных агентов, в частности, в пероральных, сублингвальных, буккальных, интрадуоденальных,внутриободочно-кишечных, ректальных, вагинальных, мукозальных, пульмонарных, интраназальных и окулярных системах. Соединения и составы согласно изобретению полезны для введения биологически или химически активных агентов любым животным, включая, в частности, но без ограничения, птиц, например цыплят,млекопитающих, например грызунов, коров, свиней, собак, кошек, приматов, и в особенности человека, а также насекомых. Указанные соединения и составы особенно предпочтительны для доставки химически или биологически активных агентов, которые в противном случае оказались бы разложившимися или менее эффективными вследствие условий, возникающих прежде, чем активный агент достигает объектной зоны (т.е. зоны, в которой активный агент должен выделяться из состава носителя) в организме животного, которому их вводят. Соединения и составы согласно настоящему изобретению можно применять, в частности, для перорального введения активных агентов, в особенности тех, которые обычно не могут быть введены пероральным способом или тех, для которых желательно улучшить способ доставки. Составы, содержащие указанные соединения и активные агенты, полезны для доставки активных агентов в выбранные биологические системы с повышенной или улучшенной биологической усвояемостью активного агента по сравнению с введением активного агента без агента доставки. Доставку можно усовершенствовать, доставляя большее количество активного агента в течение определенного периода времени или доставляя активный агент в заданный период времени (чтобы обеспечить ускоренную или задержанную доставку), или доставляя активный агент в определенное время или в течение определенного периода времени (чтобы обеспечить непрерывную доставку). Другой вариант реализации настоящего изобретения представляет собой способ лечения или предотвращения заболевания или достижения желаемого физиологического эффекта, как указано в приведенной ниже таблице, у животного путем введения состава согласно настоящему изобретению. Специфические показания для активных агентов можно найти в работе Physicians' Desk Reference (54th Ed.,2000, Medical Economics Company, Inc., Montvale, NJ), которая включена в данное описание в качестве ссылки. Активные агенты, указанные в приведенной ниже таблице, включают их аналоги, фрагменты,миметики, а также производные, модифицированные полиэтиленгликолем. Приведенные далее примеры иллюстрируют настоящее изобретение, не ограничивая его. Все проценты представляют собой массовые доли, если не указано иного. Дифференциальная Сканирующая Калориметрия (DSC) Указанные температуры плавления определяли способом дифференциальной сканирующей калориметрии (DSC), если не указано иного. Указанные значения получили при помощи программного обеспечения Perkin Elmer Pyris I для Windows. Прибор калибровали для измерения температуры, используя температуры плавления индия и цинка, а для измерения энтальпии - энтальпию плавления индия. Контроль калибровки производили обычным способом при помощи индиевого стандарта. Образцы поместили в алюминиевый контейнер с плотно закрывающейся крышкой, в которой имелось миниатюрное отверстие. Затем образцы нагревали в атмосфере азота от 30 до 250 со скоростью 10 С/мин. Немолотые образцы перед анализом слегка растерли пестиком в ступке, чтобы улучшить тепловой контакт с поверхностью контейнера. Анализ рентгеновской дифракции на порошке (XRPD) Рентгеновский дифракционный анализ на порошке (XRPD) проводили, используя порошковый дифрактометр Shimadzu XRD-6000 производства Shimadzu Scientific Instruments, Inc. of Columbia, Мэриленд. Прибор калибровали при помощи порошка кремния, при этом тестирование со стандартом NIST- 14013518 675, имеющим малый угол дифракции, подтвердило правильность калибровки. Образцы облучали излучением Cu К ( = 1,54056 ). Немолотые образцы слегка растерли пестиком в ступке, чтобы получить образец для анализа с гладкой, ровной поверхностью. При определении кристаллической структуры образцов, в качестве характеристической зоны использовали дифракционную картину в диапазоне значений 2 от 2 до 40. Термогравиметрический анализ (Thermoqravimetric analysis. TGA) Термогравиметрический анализ натрия 4-CNAB проводили, используя термогравиметрический анализатор Perkin-Elmer TGA7 с программным обеспечением Pyris I для Windows. Для измерения температуры прибор калибровали по точкам Кюри алюмеля и никеля. Образцы нагревали в атмосфере азота от 30 до 300 С и записывали процентное изменение массы как функцию от температуры. Перед анализом немолотые образцы слегка растерли пестиком в ступке, чтобы уменьшить влияние размера частиц и улучшить контакт с внутренней поверхностью платинового держателя образца. Сорбция/десорбция влаги Сорбционный анализ проводили, используя симметричный паровой анализатор SGA-100 (изготовитель VTI Corporation of Hialeah, Флорида). Прибор калибровали, используя PVP (поливинилпирролидон) и NaCl. Перед анализом образцы (кроме сольватов) сушили до постоянной массы при 60 С. Образцы сольватов до проведения анализа не сушили. Определяли равновесное содержание влаги в образце при изменении относительной влажности от 5 до 95% и затем снова до 5% при 25 С. Инфракрасная спектроскопия с преобразованием Фурье (FTIR) Анализ методом FTIR проводили на приборе Perkin Elmer Spectrum BX FT-IR, используя дискиKBr. 1 мг образца диспергировали в 150 мг KBr. Разрешение составляло 4 см-1. Проводили усреднение для 32 сканограмм. Пример 1. Получение формы I SNAC Форму I SNAC получили, как описано ниже. Свободную кислоту SNAC (N-[8-(2 гидроксибензоил)амино]каприловую кислоту) получили из соответствующих исходных материалов способом, описанным в примере 1 Международной публикацииWO 00/59863, которая полностью включена в данное описание в качестве ссылки. Форму I SNAC получили из свободной кислоты SNAC способом, также описанным в примере 12 Международной публикацииWO 00/59863. В чистый реактор объемом 300 галлонов (1135,5 л) загрузили 321 л этанола, денатурированного 0,5% толуола. При перемешивании добавили 109 кг (сухой) свободной кислоты SNAC. Реактор нагрели до 28 С и выдержали при температуре более 25 С. Приготовили раствор, содержащий 34 л воды, очищенной согласно требованиям Фармакопеи США, и 15,78 кг гидроксида натрия, охладили до 24 С и добавили в реактор при перемешивании в течение 15 мин, поддерживая температуру реакции 25-35 С. Смесь перемешали в течение следующих 15 мин. В соседний реактор загрузили 321 л этанола, который денатурировали 0,5% толуола. Реактор нагрели до 28 С при помощи циркуляционного водонагревателя. В течение 30 мин раствор из первого реактора добавили во второй реактор, поддерживая температуру выше 25 С. Содержимое перемешали и добавили 418 л гептана. Реакционную смесь охладили до 10 С, содержимое центрифугировали, а затем промыли 60 л гептана. Продукт отобрали и высушили в печи Стокса при 82 С в вакууме под давлением 26 дюймов (637 мм рт ст.) в течение примерно 65 ч. В результате получили 107,5 кг SNAC (т.е. натриевой соли N-[8-(2-гидроксибензоил)амино]каприловой кислоты). Спектральные характеристики XPRD, DSC, TGA, FTIR и сорбции/десорбции формы I показаны на фиг. 1-5, соответственно. Пример 2. Получение формы II SNAC Форму II SNAC получили, как описано ниже. Повторили процедуру, описанную в примере 1, за исключением последней операции сушки. Полученный этанольный сольват SNAC высушили в сушильном барабане и агломерировали (образовались гранулы). SNAC вынули из сушильного барабана, смололи в измельчителе Comil (изготовитель Quadro Engineering Inc. of Waterloo, Онтарио, Канада) и высушили на лотке. SNAC хранили в течение по меньшей мере 3 лет в двухслойном полиэтиленовом мешке, помещенном в барабан из нержавеющей стали. Спектральные характеристики XPRD, DSC, TGA, FTIR и сорбции/десорбции формы II показаны на фиг. 6-10, соответственно. Пример 3. Получение формы III SNAC Форму III получили, подвергнув форму I выдержке в среде с относительной влажностью 90% до тех пор, пока форму I стало невозможно обнаружить при помощи XRPD. Затем материал высушили в вытяжном шкафу до содержания влаги примерно 15 мас.%. Спектральные характеристики XPRD, DSC, TGA, FTIR и сорбции/десорбции формы III показаны на фиг. 11-15, соответственно. Пример 4. Получение формы IV SNAC Форму IV получили путем нагревания формы II в течение 3 ч в сушильном шкафу при 170 С. Со- 15013518 гласно DSC полученная форма IV имела начальную температуру плавления около 198 С и спектральные характеристики XPRD, DSC, TGA, FTIR и сорбции/десорбции, показанные на фиг. 16-20. Пример 5. Получение формы V SNAC Форму V SNAC получили путем суспендирования формы I SNAC в метаноле в течение одной недели. Полученный осадок отфильтровали в вакууме и высушили на воздухе в течение 1 ч. Согласно DSC полученная форма IV имела начальную температуру плавления около 197 С и спектральные характеристики XPRD, DSC, TGA, FTIR и сорбции/десорбции, показанные на фиг. 21-25. Пример 6. Способ получения формы VI SNAC Форму VI SNAC получили путем суспендирования формы I SNAC в этаноле в течение одной недели. Полученный осадок отфильтровали в вакууме и высушили на воздухе в течение 1 ч. Согласно DSC полученная форма IV имела начальную температуру плавления около 197 С и спектральные характеристики XPRD, DSC, TGA, FTIR и сорбции/десорбции, показанные на фиг. 26-30. Пример 7. Получение капсул, содержащих форму I или III SNAC и гепарин USP Капсулы (размер 1, изготовитель Capsugel of Morris Plains, NJ), содержащие SNAC (форма I или III) и гепарин USP (30000 международных единиц (IU, как показано в табл. 7, получили следующим образом. SNAC (форму I или III, полученную в примерах 1 и 3) и гепарин просеяли через сито с размером ячеек 35 (35 меш). Взвесили соответствующее количество гепарина и SNAC и перенесли в чистую сухую стеклянную ступку на 8 унций (228,8 г). Объем SNAC, эквивалентный объему гепарина, добавили в ступку и перемешали пестиком в течение 2 мин. Добавили в смесь остаток SNAC и снова перемешали в течение 2 мин. Заполнили капсулы смесью, содержащей соответствующую дозу. Таблица 7 Введение капсул яванским макакам (Масаса fascicularis, Cynomolgus monkey) Яванским макакам (средняя масса 4,1 кг у самцов и 3,0 кг у самок) не давали корм по меньшей мере в течение 24 ч до введения капсул. 3 капсулы, содержащие SNAC/гепарин, вставили в наконечник трубки и продули воздух, чтобы ввести капсулы в желудок. Через два часа после введения капсул возобновили кормление. Доступ к воде не ограничивали в течение всего эксперимента. Пробы цельной крови объемом примерно 1,3 мл отбирали в цитратные трубки перед введением капсул, а также через 10, 20, 30, 50 мин и 1, 1,5, 2, 3, 4 и 6 ч после введения. Пробы крови центрифугировали в течение 10 мин при скорости 2500 об./мин, и 250 мкл полученной плазмы использовали для проведения анализа фактора Ха при помощи прибора Organon Teknika COAG-А-МАТЕ МТХ/МТХ II. Стандартный диапазон для анализа составлял 02 IU/мл гепарина. Результаты, полученные для форм I и III SNAC с гепарином, показаны на фиг. 31 и 32, соответственно. Результаты усреднили в соответствии с полом и массой обезьян. Иными словами, на указанных фигурах представлены данные для четырех обезьян (самец 3,9 кг, самец 4,2 кг, самка 3,2 кг и самка 2,9 кг). Результаты для всех обезьян и для обеих форм SNAC в каждый момент времени усреднены и представлены на фиг. 33. Пример 8. Получение капсул, содержащих форму I или III SNAC и гепарин USP Капсулы (размер 1, изготовитель Capsugel of Morris Plains, Нью-Джерси), содержащие SNAC (форма I или III) и гепарин USP (30,000 международных единиц (IU, как показано в приведенной выше табл. 7, получили в соответствии с процедурой, описанной в примере 7. Введение капсул яванским макакам Процедуру, описанную в примере 7, повторили для двух самцов обезьян со средней массой 5,6 кг и 2 самок обезьян со средней массой 6,9 кг. Результаты, полученные для форм I и III SNAC с гепарином, показаны на фиг. 34 и 35, соответственно. Результаты усреднили в соответствии с полом и массой обезьян. Иными словами, на указанных фигурах представлены данные для четырех обезьян (самец 5,7 кг, самец 5,6 кг, самка 7,6 кг и самка 6,3 кг). Результаты для всех обезьян и для обеих форм SNAC в каждый момент времени усреднены и представлены на фиг. 36. Пример 9. Собственную скорость растворения для форм I-IV SNAC, полученных в примерах 1-4, определили следующим способом. Собственную скорость растворения гранул форм l-IV SNAC определили при помощи аппарата Вуда. Образец формы I, II, III или IV SNAC массой 300 мг получили в матрице. Площадь поверхности об- 16013518 разца, доступная для растворяющей среды, составляла 0,484 см 2. Образец прессовали с усилием 12001400 фунтов (55,5-64,8 Н) на прессе Carver для получения дисков. Затем матрицу присоединили к оси аппарата для определения растворения. Матрицу вращали при скорости 50 об./мин, а затем погрузили в 900 мл дегазированной растворяющей среды, поддерживая температуру 37 С (рН 6,3). Экспериментальное определение растворения проводили в воде трехкратно. Образцы анализировали в оперативном режиме способом УФ-спектроскопии при длине волны 297,5 нм. Собственные скорости растворения определили по начальной линейной части профиля растворения в режиме слива. Результаты представлены на фиг. 37 и 38. Расчетные скорости растворения для форм I-IV показаны в приведенной ниже табл. 8. Таблица 8 Пример 10. Растворимость всех форм I-IV SNAC в ацетонитриле определили при влажности окружающей среды и температуре 25 С. В качестве растворителя выбрали ацетонитрил, поскольку он является одним из нескольких растворителей, в которых SNAC относительно мало растворяется, а растворы могут приближаться к бесконечному разбавлению. Результаты определения растворимости показаны в приведенной ниже табл. 9. Таблица 9 Пример 11. Влияние помола на структуру формы I SNAC определили следующим способом. Произвели помол в шаровой мельнице. Вынули образцы через 20 ч и провели анализ XRPD. Кривые XRPD образцов SNAC до и после помола практически идентичны показанной на фиг. 39. Пример 12. Влияние влажного гранулирования на форму I SNAC определили следующим способом. Форму ISNAC получили влажным гранулированием в стеклянной ступке с помощью пестика при добавлении 20 мас.% воды. Влажные гранулы анализировали при помощи XRPD. Кривые XRPD образцов SNAC до и после влажного гранулирования показаны на фиг. 40. Кривая XRPD образца после влажного гранулирования практически идентична соответствующей кривой формы III. Пример 13. Влияние прессования на формы I и III SNAC определили следующим способом. Примерно 300 мг каждого образца спрессовали на прессе Carver с усилием 4500 фунтов (208,3 Н) при выдержке в течение 1 мин. Цикл прессования повторили 20 раз. Кристаллическую форму SNAC в составе анализировали при помощи XRPD. Результаты для форм I и III представлены на фиг. 41 и 42, соответственно. Как показано на этих фигурах, кристаллическая форма в обоих образцах не имела существенных изменений. Пример 14. Получение аморфного SNAC Аморфную форму получили путем сушки формы III в вакуумной печи при температуре 25 С и под давлением 0,3 дюйма (7,5 мм рт.ст.). Высушенный материал представлял собой смесь аморфной формы и примерно 10% исходной формы III SNAC. При более длительной сушке и более высоком вакууме можно получить практически чистую аморфную форму. Спектральные характеристики XPRD, DSC, TGA, FTIR и сорбции/десорбции для аморфной формы,содержащей примерно 10% формы III SNAC показаны на фиг. 43-47, соответственно. Все вышеуказанные патенты, патентные заявки, статьи, публикации и методы испытаний включены в настоящее испытание в качестве ссылок. Фиг. 39. Влияние помола в шаровой мельнице на кривую XRPD формы I Фиг. 40. Влияние мокрого гранулирования на кривую XRPD формы I- 22013518 Фиг. 41. Влияние прессования на кривую XRPD формы I Фиг. 42. Влияние прессования на кривую XRPD формы IIISNAC), имеющий спектр рентгеновской дифракции на порошке с пиками, соответствующими значениям углов 20,2 2, равным 3,29, 11,96 и 17,76. 3. Кристаллический полиморф по п.2, имеющий спектр рентгеновской дифракции на порошке, по существу, соответствующий показанному на фиг. 6. 4. Кристаллический полиморф по п.2, отличающийся тем, что имеет начальную температуру плавления, определенную способом дифференциальной сканирующей калориметрии, примерно 199 С. 5. N-[8-(2-Гидроксибензоил)амино]каприлат натрия тригидрат (SNAC тригидрат). 6. Кристаллический полиморф N-[8-(2-гидроксибензоил)амино]каприлата натрия гидрата (форма IIISNAC), имеющий спектр рентгеновской дифракции на порошке с пиками, соответствующими значениям углов 20,2 2, равным 6,69, 13,58 и 16,80. 7. Кристаллический полиморф по п.6, имеющий спектр рентгеновской дифракции на порошке, по существу, соответствующий показанному на фиг. 11. 8. Кристаллический полиморф по п.6, отличающийся тем, что имеет начальную температуру плавления, определенную способом дифференциальной сканирующей калориметрии, примерно 198 С. 9. Кристаллический безводный полиморф N-[8-(2-гидроксибензоил)амино]каприлата натрия (безводная форма IV SNAC), имеющий спектр рентгеновской дифракции на порошке с пиками, соответствующими значениям углов 20,2 2, равным 8,61, 17,04 и 23,28. 10. Кристаллический полиморф по п.9, имеющий спектр рентгеновской дифракции на порошке, по существу, соответствующий показанному на фиг. 16. 11. Кристаллический полиморф по п.9, отличающийся тем, что имеет начальную температуру плавления, определенную способом дифференциальной сканирующей калориметрии, примерно 198 С.- 23013518 12. Совместный метанольно-водный сольват N-[8-(2-гидроксибензоил)амино]каприлата натрия. 13. Совместный метанольно-водный сольват N-[8-(2-гидроксибензоил)амино]каприлата натрия, в котором отношение метанола к воде и к N-[8-(2-гидроксибензоил)амино]каприлату натрия составляет примерно 0,8:2:1. 14. Кристаллический полиморф совместного метанольно-водного сольвата N-[8-(2 гидроксибензоил)амино]каприлата натрия (форма V SNAC), имеющий спектр рентгеновской дифракции на порошке с пиками, соответствующими значениям углов 20,2 2, равным 6,59, 9,96, 10,86, 13,87,17,29 и 19,92. 15. Кристаллический полиморф по п.14, имеющий спектр рентгеновской дифракции на порошке, по существу, соответствующий показанному на фиг. 21. 16. Кристаллический полиморф по п.14, отличающийся тем, что имеет начальную температуру плавления, определенную способом дифференциальной сканирующей калориметрии, примерно 197 С. 17. Совместный этанольно-водный сольват N-[8-(2-гидроксибензоил)амино]каприлата натрия. 18. Совместный этанольно-водный сольват N-[8-(2-гидроксибензоил)амино]каприлата натрия, в котором отношение этанола к воде и к N-[8-(2-гидроксибензоил)амино]каприлату составляет примерно 0,6:2:1. 19. Кристаллический полиморф совместного этанольно-водного сольватаN-[8-(2 гидроксибензоил)амино]каприлата натрия (форма VI SNAC), имеющий спектр рентгеновской дифракции на порошке с пиками, соответствующими значениям углов 20,2 2, равным 9,60, 10,43, 12,68 и 16,58. 20. Кристаллический полиморф по п.19, имеющий спектр рентгеновской дифракции на порошке, по существу, соответствующий показанному на фиг. 26. 21. Кристаллический полиморф по п.14, отличающийся тем, что имеет начальную температуру плавления, определенную способом дифференциальной сканирующей калориметрии, примерно 197 С. 22. Аморфный N-[8-(2-гидроксибензоил)амино]каприлат натрия, характеризующийся спектром рентгеновской дифракции на порошке, по существу, соответствующим показанному на фиг. 43, и/или кривой дифференциальной сканирующей калориметрии, по существу, соответствующей показанной на фиг. 44, и/или кривой термогравиметрического анализа, по существу, соответствующей показанной на фиг. 45, и/или ИК-спектром, по существу, соответствующим показанному на фиг. 46. 23. Фармацевтический состав, содержащий (А) (1) кристаллический полиморф по пп.1-21 или (2) аморфный N-[8-(2-гидроксибензоил)амино]каприлат натрия по п.22, а также (В) активный агент. 24. Фармацевтический состав по п.23, отличающийся тем, что активный агент представляет собой гепарин. 25. Фармацевтический состав по п.23, отличающийся тем, что активный агент представляет собой гепарин с низкой молекулярной массой. 26. Способ введения активного агента животному, которое нуждается в соответствующем лечении,включающий операцию введения фармацевтического состава по п.23. 27. Способ по п.26, отличающийся тем, что активный агент представляет собой гепарин. 28. Способ получения формы I SNAC, включающий операцию нагревания формы III, V, VI или их смеси по меньшей мере до 50 С с образованием формы I SNAC в течение времени, достаточного для образования формы I SNAC. 29. Способ по п.28, отличающийся тем, что формы III, V, VI SNAC или их смеси нагревают до температуры в пределах примерно от 50 до примерно 110 С в течение времени, достаточного для образования формы I SNAC. 30. Способ получения формы I SNAC, включающий операцию нагревания аморфного SNAC в пределах примерно от 30 до примерно 90 С в течение времени, достаточного для образования формы ISNAC. 31. Способ по п.30, отличающийся тем, что аморфный SNAC нагревают до температуры в пределах примерно от 40 до примерно 80 С. 32. Способ получения формы I SNAC, включающий операцию лиофилизации какой-либо формыSNAC, отличной от формы I, для получения формы I. 33. Способ по п.32, отличающийся тем, что включает лиофилизацию одной или нескольких формII-VI SNAC и/или аморфного SNAC для получения формы I. 34. Способ получения формы II SNAC, включающий операцию сушки сольвата SNAC без перемешивания и воздействие на высушенный материал влаги в течение времени, достаточного для образования формы II SNAC. 35. Способ по п.34, отличающийся тем, что сольват представляет собой этанольный сольват или метанольный сольват. 36. Способ получения формы III SNAC, включающий операцию выдержки формы I, II, IV, V или VISNAC или аморфного SNAC в среде с относительной влажностью 75% или более в течение времени,достаточного для образования формы III. 37. Способ получения формы III SNAC, включающий операцию влажного гранулирования формы ISNAC в течение времени, достаточного для получения формы III. 38. Способ получения формы III SNAC, включающий операцию выдержки формы V или VI SNAC или их смеси в среде с относительной влажностью 30% или более в течение времени, достаточного для образования формы III. 39. Способ получения формы III SNAC, включающий операцию выдержки формы VI SNAC в среде с относительной влажностью 10% или более в течение времени, достаточного для образования формы III. 40. Способ получения формы III SNAC, включающий операцию воздействия влаги на аморфныйSNAC в течение времени, достаточного для образования формы III. 41. Способ получения формы III SNAC, включающий операцию кристаллизации SNAC из воды. 42. Способ получения формы IV SNAC, включающий операцию нагревания формы I, II, IV, V илиVI SNAC или их смеси до температуры в пределах примерно от 110 С до точки плавления SNAC в течение времени, достаточного для образования формы IV. 43. Способ по п.42, отличающийся тем, что форму II SNAC нагревают до температуры в пределах примерно от 150 С до точки плавления SNAC в течение времени, достаточного для образования формы IV. 44. Способ получения формы V SNAC, включающий операцию кристаллизации SNAC из метанольного раствора при относительной влажности по меньшей мере примерно 30%. 45. Способ по п.42, отличающийся тем, что метанольный раствор, по существу, не содержит воды. 46. Способ получения формы V SNAC, включающий операцию уравновешивания форм I-IV или VISNAC метанолом. 47. Способ по п.46, отличающийся тем, что уравновешивание выполняют при отсутствии воды. 48. Способ получения формы V SNAC, включающий операцию диспергирования форм I-IV или VI или их смеси в метаноле при относительной влажности по меньшей мере 30% и поддержания диспергированной смеси при температуре окружающей среды в течение времени, достаточного для образования формы V. 49. Способ получения формы VI SNAC, включающий операцию кристаллизации SNAC из этанольного раствора при относительной влажности по меньшей мере примерно 30%. 50. Способ по п.49, отличающийся тем, что этанольный раствор, по существу, не содержит воды. 51. Способ получения формы VI SNAC, включающий операции получения насыщенного раствораSNAC в этаноле при относительной влажности по меньшей мере 30% и охлаждения полученного раствора при комнатной или более низкой температуре. 52. Способ по п.51, отличающийся тем, что указанный способ реализуют при отсутствии воды. 53. Способ получения формы VI SNAC, включающий операцию диспергирования форм I-IV в этаноле при относительной влажности по меньшей мере около 30%. 54. Фармацевтический состав, содержащий молотую смесь формы I SNAC и по меньшей мере одного активного агента или фармацевтически допустимой добавки. 55. Фармацевтический состав, содержащий прессованную осевым сжатием смесь формы I SNAC и по меньшей мере одного активного агента или фармацевтически допустимой добавки. 56. Фармацевтический состав, содержащий прессованную осевым сжатием смесь формы III SNAC и по меньшей мере одного активного агента или фармацевтически приемлемой добавки. 57. Способ получения аморфного SNAC, содержащий операцию дегидратации формы III, V или VISNAC в течение времени, достаточного для образования аморфного SNAC. 58. Способ по п.57, отличающийся тем, что форму III, V или VI SNAC обезвоживают в вакууме. 59. Способ по п.57, отличающийся тем, что форму III обезвоживают с получением аморфного
МПК / Метки
МПК: C07C 235/46, A61P 9/00, A61K 31/609, A61P 7/02
Метки: формы, n-[8(2-гидроксибензоил)амино]каприлата, кристаллические, натрия, полиморфные
Код ссылки
<a href="https://eas.patents.su/30-13518-kristallicheskie-polimorfnye-formy-n-82-gidroksibenzoilaminokaprilata-natriya.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллические полиморфные формы n-[8(2-гидроксибензоил)амино]каприлата натрия</a>
Предыдущий патент: Применение козьей сыворотки, полученной иммунизацией козы вич, для изготовления лекарственных средств
Следующий патент: Противобактериальный или педикулоцидный препарат, содержащий аллицин
Случайный патент: Способ гидрокрекинга и способ получения минерального масла