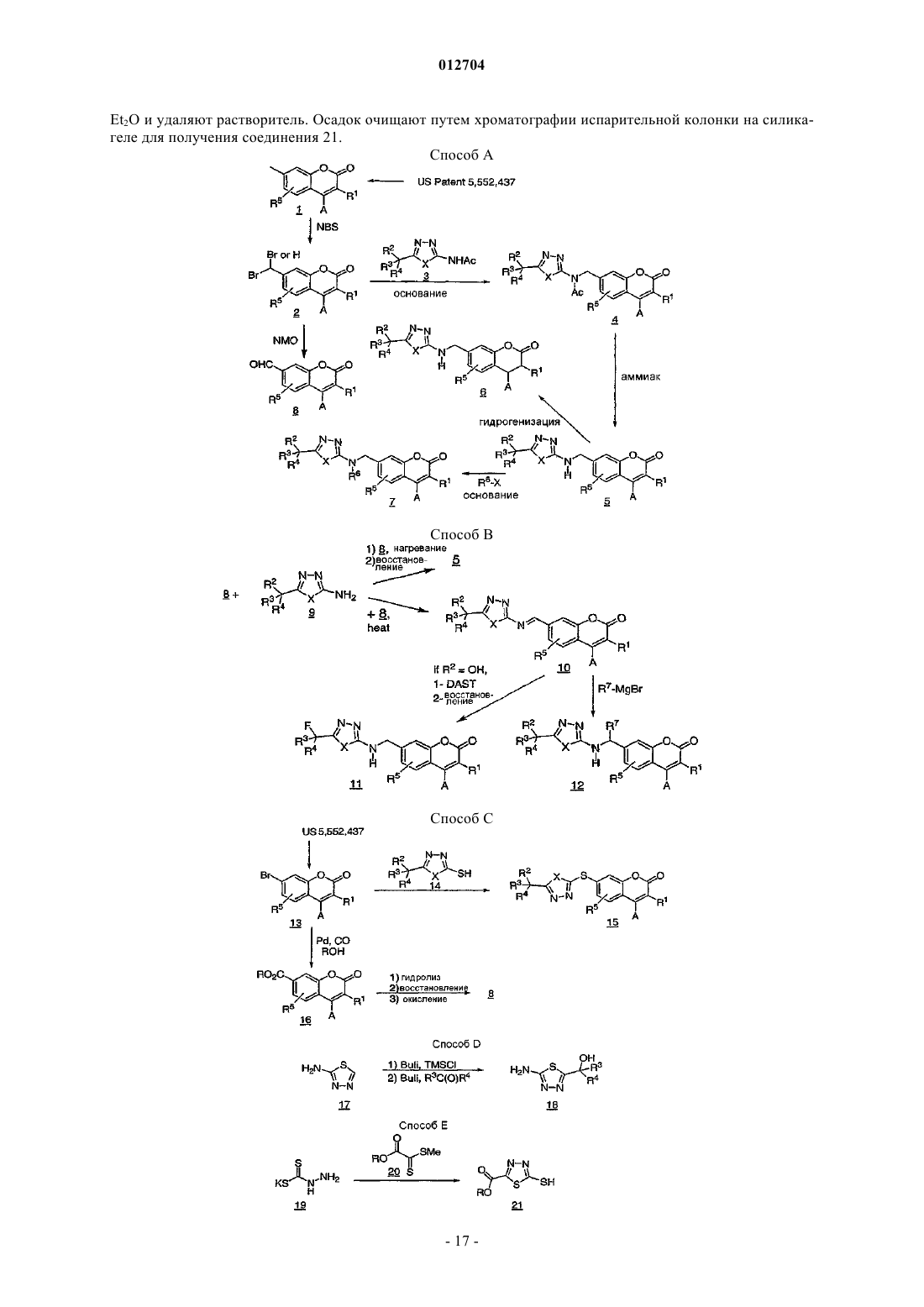
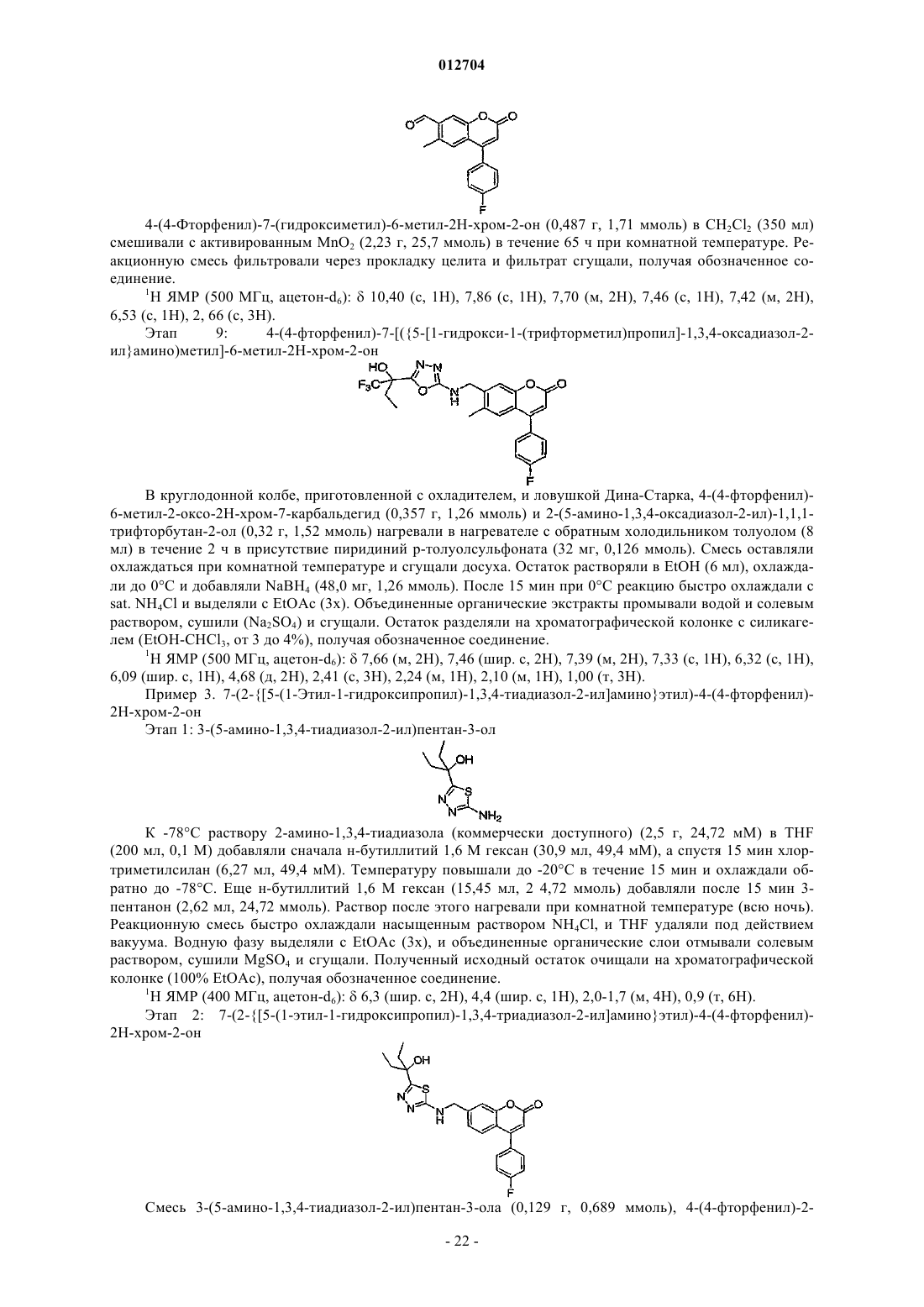
Новые фармацевтические соединения
Номер патента: 12704
Опубликовано: 30.12.2009
Авторы: Жюто Элен, Гаро Ив, Гримм Эрих Л., Блуэн Марк, Лалиберт Себастьен, Фриезен Ришар, Ганьон Марк, Макэй Брюс
Формула / Реферат
1. Соединение, имеющее структурную формулу I
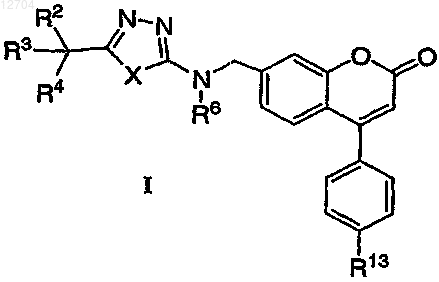
где X представляет собой -O-;
R1 выбирают из группы, состоящей из -Н, -C1-6алкила и -С3-6циклоалкила;
R2 выбирают из группы, состоящей из -Н, -ОН, -F, -C1-3алкила, -OC1-3алкила и -ОС(О)-C1-3алкила;
R3 выбирают из группы, состоящей из -Н, -С1-6алкила, -C1-6алкила, замещенного одним или несколькими фторами, -C1-6алкила, замещенного R9, -С2-6алкенила, -С3-6циклоалкила, -С5-7циклоалкенила и -Z;
R4 выбирают из группы, состоящей из -Н, -C1-6алкила, -C1-6алкила, замещенного одним или несколькими фторами, -C1-6алкила, замещенного R9, -С2-6алкенила, -С3-6циклоалкила, -С5-7циклоалкенила и -Z;
или R3 и R4 вместе представляют оксо;
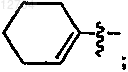
или R3 и R4 связываются с углеродом, к которому они присоединяются для образования кольца, выбранного из группы, состоящей из -С3-6циклоалкилового кольца и -С5-7циклоалкенилового кольца, обеспечивающего при связывании R3 и R4 с углеродом, к которому они присоединяются для образования
С5-7циклоалкенилового кольца, без двойной связи в С-1 положении кольца;
или R2, R3 и R4 связаны с углеродом, к которому они присоединяются для образования циклоалкенилового кольца, выбранного из

и
R6 выбирают из группы, состоящей из (а) -Н, (b) -С1-4алкила, (с) -С(О)С1-4алкила и (d) -С(О)фенила, необязательно замещенного -C1-4алкилом;
R9 выбирают из группы, состоящей из -COOR1, -C(O)H, -CN, CR1R1OH, -OR1, -S-C1-6алкила и
-S-С3-6циклоалкила;
R10 выбирают из группы, состоящей из -Н, -С1-6алкила, -С3-6циклоалкила и -COOR1;
R11 выбирают из группы, состоящей из -Н, -С1-6алкила и -С3-6циклоалкила;
R13 отсутствует или выбирают из группы, состоящей из (i) -F, (ii) -Cl, (iii) -C1-3алкила, необязательно замещенного одним или несколькими гало, (iv) -OC1-3алкила, необязательно замещенного одним или несколькими гало, (v) -ОС3-6циклоалкила, (vi) -СН2ОН, (vii) -COOR1, (viii) -CN и (ix) -NR10R11;
Z выбирают из группы, состоящей из:
(a) 5-членного ароматического кольца, содержащего (i) один или несколько атомов углерода, (ii) один гетероатом, выбранный из кислорода и серы, и (iii) ноль, один, два или три атома азота,
(b) 5-членного ароматического кольца, содержащего один или несколько атомов углерода и от одного до четырех атомов азота,
(c) 6-членного ароматического кольца, содержащего углеродные атомы и один, два или три атома азота;
(d) фенила, и
(e) -СН2-фенила и -СН2-диоксоланила,
и где Z представлен дополнительно моно- или дизамещенным заместителем, независимо выбранным в каждом случае из группы, состоящей из (i) -F, (ii) -Cl, (iii) -C1-3алкила, необязательно замещенного одним или несколькими гало, (iv) -OC1-3алкила, необязательно замещенного одним или несколькими гало, (v) -ОС3-6циклоалкила, (vi) -CH2OH, (vii) -COOR1, (viii) -CN и (ix) -NR10R11;
и его фармацевтически приемлемые соли, эфиры и сольваты.
2. Соединение по п.1, выбранное из группы, состоящей из
4-(4-фторфенил)-7-{[{5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-ил}(изопропил)амино]метил}-2Н-хром-2-она;
N-{[4-(4-фторфенил)-2-оксо-2Н-хром-7-ил]метил}-N-{5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-ил}ацетамида;
4-(4-фторфенил)-7-({[5-(1-гидрокси-1-фенилэтил)-1,3,4-оксадиазол-2-ил]амино}метил)-2Н-хром-2-она;
4-(4-фторфенил)-7-[({5-[2,2,2-трифтор-1-гидрокси-1-(трифторметил)этил]-1,3,4-оксадиазол-2-ил}амино)метил]-2Н-хром-2-она;
4-(4-фторфенил)-7-[({5-[(1S)-2,2,2-трифтор-1-гидрокси-1-метилэтил]-1,3,4-оксадиазол-2-ил}амино)метил]-2Н-хром-2-она;
4-(4-фторфенил)-7-{[{5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-ил}(метил)амино]метил}-2Н-хром-2-она;
4-(4-фторфенил)-7-[({5-[(1R)-2,2,2-трифтор-1-гидрокси-1-метилэтил]-1,3,4-оксадиазол-2-ил}амино)метил]-2Н-хром-2-она;
4-(4-фторфенил)-7-({[5-(2,2,3,3,3-пентафтор-1-гидрокси-1-метилпропил)-1,3,4-оксадиазол-2-ил]амино}метил)-2Н-хром-2-она;
4-(4-фторфенил)-7-({[5-(1-гидроксициклопентил)-1,3,4-оксадиазол-2-ил]амино}метил)-2Н-хром-2-она;
4-(4-фторфенил)-7-[({5-[гидрокси(фенил)метил]-1,3,4-оксадиазол-2-ил}амино)метил]-2Н-хром-2-она;
4-(4-фторфенил)-7-({[5-(1-гидрокси-1-метилпропил)-1,3,4-оксадиазол-2-ил]амино}метил)-2Н-хром-2-она;
7-({[5-(1-этилпропил)-1,3,4-оксадиазол-2-ил]амино}метил)-4-(4-фторфенил)-2Н-хром-2-она;
4-(4-фторфенил)-7-[({5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-ил}амино)метил]-2Н-хром-2-она;
(+)-4-(4-фторфенил)-7-[({5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-ил}амино)метил]-2Н-хром-2-она;
(-)-4-(4-фторфенил)-7-[({5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-ил}амино)метил]-2Н-хром-2-она;
7-(1-{[5-(1-этил-1-гидроксипропил)-1,3,4-оксадиазол-2-ил]амино}этил)-4-(4-фторфенил)-2Н-хром-2-она;
7-({[5-(1-этил-1-фторпропил)-1,3,4-оксадиазол-2-ил]амино}метил)-4-(4-фторфенил)-2Н-хром-2-она;
7-{[(5-циклобутил-1,3,4-оксадиазол-2-ил)амино]метил}-4-(4-фторфенил)-2Н-хром-2-она;
7-{[(5-циклопентил-1,3,4-оксадиазол-2-ил) амино]метил}-4-(4-фторфенил)-2Н-хром-2-она;
7-{[[5-(1-этил-1-гидроксипропил)-1,3,4-оксадиазол-2-ил](метил)амино]метил}-4-(4-фторфенил)-2Н-хром-2-она;
7-({[5-(1-этил-1-гидроксипропил)-1,3,4-оксадиазол-2-ил]амино}метил)-4-(4-метоксифенил)-2Н-хром-2-она;
7-({[5-(1-этил-1-гидроксипропил)-1,3,4-оксадиазол-2-ил]амино}метил)-4-фенил-2Н-хром-2-она;
7-[({5-[дициклопропил(гидрокси)метил]-1,3,4-оксадиазол-2-ил}амино)метил]-4-(4-фторфенил)-2Н-хром-2-она;
7-({[5-(1-этил-1-гидроксипропил)-1,3,4-оксадиазол-2-ил]амино}метил)-4-(4-фторфенил)-2Н-хром-2-она;
N-[5-(1-этил-1-гидроксипропил)-1,3,4-оксадиазол-2-ил]-N-{[4-(4-фторфенил)-2-оксо-2Н-хром-7-ил]метил}ацетамида;
и его фармацевтически приемлемые соли.
3. Соединение по п.1, выбранное из группы, состоящей из
4-(4-фторфенил)-7-[({5-[(1S)-2,2,2-трифтор-1-гидрокси-1-метилэтил]-1,3,4-оксадиазол-2-ил}амино)метил]-2Н-хром-2-она;
7-({[5-(1-этил-1-гидроксипропил)-1,3,4-оксадиазол-2-ил]амино}метил)-4-(3-фторфенил)-2Н-хром-2-она;
4-(4-фторфенил)-7-[({5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-ил}амино)метил]-2Н-хром-2-она;
(-)-4-(4-фторфенил)-7-[({5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-ил}амино)метил]-2Н-хром-2-она;
и его фармацевтически приемлемые соли.
4. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
5. Соединение 4-(4-фторфенил)-7-[({5-[(1S)-2,2,2-трифтор-1-гидрокси-1-метилэтил]-1,3,4-оксадиазол-2-ил}амино)метил]-2Н-хром-2-он и его фармацевтически приемлемые соли.
6. Соединение (-)-4-(4-фторфенил)-7-[({5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-ил}(метил)амино)метил]-2Н-хром-2-он и его фармацевтически приемлемые соли.
7. Соединение (-)-4-(4-фторфенил)-7-[({5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-ил}амино)метил]-2Н-хром-2-он и его фармацевтически приемлемые соли.
8. Соединение по п.1, где
R2 представляет собой -ОН;
R3 представляет собой -СН3, -СН2СН3, -C1-2алкил, замещенный фтором, и циклопропил;
R4 представляет собой СН3, -СН2СН3, -C1-2алкил, замещенный фтором, циклопропил и
-СН2СООС1-4алкил,
и его фармацевтически приемлемые соли.
Текст
012704 Область применения Настоящее изобретение относится к новым соединениям, которые применяют в качестве ингибиторов лейкотриенового биосинтеза. Предпосылки изобретения В течение многих лет ингибирование биосинтеза лейкотриенов являлось активной областью фармацевтического исследования. Лейкотриены составляют группу местно воздействующих гормонов, вырабатываемых в живых системах из арахидоновой кислоты. Лейкотриены представляют собой сильнодействующие сокращающие и воспалительные медиаторы, полученные в результате ферментативного окисления арахидоновой кислоты 5-липоксигеназой. Известно, что существует класс ингибиторов биосинтеза лейкотриенов, которые действуют путем подавления ингибирования 5-липоксигеназы (5-LO). Большинство лейкотриенов представляют собой лейкотриены В 4 (сокращенно LTB4), LTC4, LTD4 иLTE4. Биосинтез этих лейкотриенов начинается с действия фермента 5-липоксигеназы на арахидоновую кислоту для получения эпоксида, известного как лейкотриен А 4(LTA4), который превращается в другие лейкотриены путем последующих ферментативных стадий. Дальнейшие подробности биосинтеза, а также метаболизм лейкотриенов можно найти в книге Leukotrxenes and Lipoxygenases, ed. J. Rokach, Elsevier,Amsterdam (1989). Действие лейкотриенов в живых системах и их участие в различных болезненных состояниях также обсуждается в книге Rokach. В большинстве случаев 5-LO ингибиторы необходимы для лечения аллергических ринитов, астмы и воспалительных заболеваний, включая артрит. Примером 5-LO ингибитора является лекарственный препарат zileuton (ZYLOFT), который необходим для лечения астмы. Совсем недавно сообщалось, что 5LO может быть главным виновником в атерогенном процессе; см. Mehrabian, М. et al., Circulation Research, 2002 Jul. 26, 91 (2):120-126. Несмотря на значительные терапевтические достижения в лечении и профилактике патологических состояний, вызванных 5-LO ингибированием, необходимы дальнейшие варианты лечения. Настоящее изобретение обеспечивает новые 5-LO ингибиторы, которые применяют для ингибирования биосинтеза лейкотриенов. Сущность изобретения Настоящее изобретение относится к соединениям формулы Ia, которые представляют собой ингибиторы биосинтеза лейкотриенов, способы их получения, способы и фармацевтические композиции для использования этих соединений у млекопитающих, особенно у людей. Соединения формулы Ia используются в качестве фармацевтических средств, замедляющих или останавливающих развитие атеросклероза. Следовательно, настоящее изобретение относится к способу лечения атеросклероза, который включает остановку или замедление распространения атеросклеротической болезни, после того как оно становится клинически выраженным, включая применение терапевтически эффективного количества соединения формулы Ia для пациента, нуждающегося в лечении такого рода. Настоящее изобретение также относится к способам профилактики или снижения риска развития атеросклероза и осложнений атеросклеротической болезни, включающим применение профилактически эффективного количества соединения формулы Ia пациенту, который подвергается риску развития атеросклероза или имеет осложнение атеросклеротической болезни. Кроме того, настоящее изобретение включает применение соединений формулы Ia в качестве противоастматических, противоаллергических, противовоспалительных и защищающих клетку веществ. Они также применяются при лечении ангины, церебрального спазма, гломерулярного нефрита, гепатита,эндотоксикоза, увеита и отторжения аллотрансплантата. Настоящее изобретение относится к способам лечения, включающим применение терапевтически эффективного количества соединения формулы Ia для пациента, нуждающегося в вышеупомянутом лечении. Далее настоящее изобретение относится к применению соединения формулы Ia в комбинации с другими терапевтически эффективными веществами. Дополнительные варианты осуществления станут понятными из следующего подробного описания. Подробное описание изобретения Новые ингибиторы биосинтеза лейкотриенов настоящего изобретения представляют собой соединения структурной формулы Ia и фармацевтически приемлемые соли, сложные эфиры и сольваты, где выбирают из одной и двойной связи; А выбирают из группы, состоящей из:(a) 5-членного ароматического кольца, содержащего (i) один или несколько атомов углерода, (ii) один гетероатом, выбранный из кислорода и серы, и (iii) ноль, один, два или три атома азота,(b) 5-членного ароматического кольца, содержащего один или несколько атомов углерода и от одного до четырех атомов азота,(c) 6-членного ароматического кольца, содержащего атомы углерода и один, два или три атома азота;(d) системы двуядерного ароматического кольца, выбранного из бензотиэнил, индолил, гуинолинил и нафталенил;(f) -СН 2-фенила; и где А является дополнительно моно- или дизамещенным заменой, независимо выбранной в каждом случае из группы, состоящей из следующего: (i) -F, (ii) -Cl, (iii) -C1-3 алкил, дополнительно замещенный одним или несколькими гало, например, включающий -CF3, (iv) -OC1-3 алкил, дополнительно замещенный одним или несколькими гало, например, включающий -OCHF2 и -OCF3, (v) -ОС 3-6 циклоалкил,(vi) -CH2OH, (vii) -COOR1, (viii) -CN и (ix) -NR10R11;(a) -NR6-CHR7 и -NR8-C(O)-, где азот в Y связан с 5-членной гетероциклической молекулой формулы Ia и углерод в Y связан с двуядерной гетероциклической молекулой формулы Ia;R3 выбирают из группы, состоящей из следующего: -Н, -C1-6 алкил, -C1-6 алкил, замещенный одним или несколькими фторами, включающими, но ими не ограничиваясь, например, -C1-6 перфторалкил, такой как -CF3 и -CF2CF3, -C1-6 алкил, замещенный R9, -С 2-6 алкенил, -С 3-6 циклоалкил, -С 5-7 циклоалкенил и -Z;R4 выбирают из группы, состоящей из следующего: -Н, -C1-6 алкил, -C1-6 алкил, замещенный одним или несколькими фторами, включающими, но ими не ограничиваясь, например, -С 1-6 перфторалкил, такой как -CF3 и - CF2CF3, -C1-6 алкил, замещенный R9, -С 2-6 алкенил, -С 3-6 циклоалкил, -С 5-7 циклоалкенил и -Z; или R3 и R4 вместе обозначают оксо; или R3 и R4 соединены углеродом, к которому они присоединяются, образуя кольцо, выбраны из группы, состоящей из -С 3-6 циклоалкилового кольца и -С 5-7 циклоалкенилового кольца, однако когда R3 иR4 соединены углеродом, к которому они присоединяются, образуя -С 5-7 циклоалкениловое кольцо, без двойной связи в С-1 положении в кольце; или R2, R3 и R4 соединены углеродом, к которому они присоединяются, образуя циклоалкениловое кольцо, выбранное изR5 отсутствует или представляет собой замену, выбранную из группы, состоящей из -С 1-6 алкила,-С 3-6 циклоалкила и гало;R7 выбирают из группы, состоящей из (а) -Н, (b) -С 1-4 алкила, (с) -С 3-6 циклоалкила, (d) фенила, дополнительно моно- или дизамещенного заменой, независимо выбранной в каждом случае из группы, состоящей из -С 1-4 алкила, -F и -Cl, и (е) 5-членного ароматического кольца, содержащего (i) один или несколько атомов углерода, (ii) один гетероатом, выбранный из кислорода и серы, и (iii) ноль, один, два или три атомов азота;(a) 5-членного ароматического кольца, содержащего (i) один или несколько атомов углерода, (ii) один гетероатом, выбранный из кислорода и серы, и (iii) ноль, один, два или три атома азота,(b) 5-членного ароматического кольца, содержащего один или несколько атомов углерода и от одного до четырех атомов азота,(c) 6-членного ароматического кольца, содержащего углеродные атомы и один, два или три атома азота;(e) -СН 2-фенила и -СН 2-диоксоланила,-2 012704 и где Z является дополнительно моно- или дизамещенной заменой, независимо выбранной в каждом случае из группы, состоящей из (i) -F, (ii) -Cl, (iii) -C1-3 алкила, добавочно замещенного одним или несколькими гало, например, включающими -CF3, (iv) -ОС 1-3 алкила, добавочно замещенного одним или несколько гало, (v) -ОС 3-6 циклоалкила, (vi) -СН 2 ОН, (vii) -COOR1, (viii) -CN и (ix) -NR10R11. В одном варианте осуществления данного изобретения представлены соединения в объеме формулы Ia, имеющей структурную формулу IbR13 отсутствует или замещен в 3- или 4-положении и выбран из группы, состоящей из следующего:(i) -F, (ii) -Cl, (iii) -C1-3 алкил, добавочно замещенный одним или несколько гало, например, включает-CF3, (iv) -OC1-3 алкил, добавочно замещенный одним или несколько гало, например, включая -OCHF2 и-OCF3, (v) -OC3-6 циклоалкил, (vi) -CH2OH, (vii) -COOR1, (viii) -CN и (ix) -NR10R11; и остающиеся переменные, как определено в формуле Ia. В группе этого варианта осуществления R13 выбирают из группы, состоящей из -F, -OCF3, -OCHF2,-CN, -СН 3 и -ОСН 3, и в подклассе R13 представлен -F. В другой группе этого варианта осуществления представлены соединения в объеме формулы Ib,имеющей структурную формулу I и фармацевтически приемлемые соли, эфиры и сольваты, где переменные представлены в формуле I, как определено в формуле Ib. В другой группе этого варианта осуществления представлены соединения в объеме формулы Ia,имеющей структурную формулу IcR13 отсутствуют или замещены в 3- или 4-положении и выбраны из группы, состоящей из следующего: (i) -F, (ii) -Cl, (iii) -C1-3 алкил, добавочно замещенный одним или несколькими гало, например,включающими -CF3, (iv) -OC1-3 алкил, добавочно замещенный одним или несколькими гало, например,включающими -OCHF2 и -OCF3, (v) -ОС 3-6 циклоалкил, (vi) -CH2OH, (vii) -COOR1, (viii) -CN и(ix) -NR10R11; и остающиеся переменные, как определено в формуле Ia. В группе этого варианта осуществления R13 выбирают из группы, состоящей из -F, -OCF3, -OCHF2,-CN, -СН 3 и -ОСН 3, и в подклассе R13 представлен -F. В другой группе этого варианта осуществления представлены соединения формулы Ia, где А выбирают из группы, состоящей из:a) 5-членного ароматического кольца, содержащего (i) один или несколько атомов углерода, (ii) один гетероатом, выбранный из кислорода и серы, и (iii) ноль, один, два или три атома азота,b) 5-членного ароматического кольца, содержащего один или несколько атомов углерода и от одного до четырех атомов азота,c) 6-членного ароматического кольца, содержащего атомы углерода и один, два или три атома азота, иd) фенила,-3 012704 и где А является незамещенным, моно- или дизамещенным, как описано в формуле Ia. В группе этого варианта осуществления А является незамещенным, моно- или дизамещенным, как описано в формуле Ia, и выбраны из группы, состоящей из тиенила, фуранила, оксазолила, тиазолила, тетразолила, пиридинила и фенила и, в частности, тиазолила, пиридинила и фенила. В подклассе этого варианта осуществления, А выбирают из фенила, добавочно замещенного в 3- или 4-положении заместителя, выбранного из -F, -OCF3, -OCHF2, -CN, -СН 3 и -ОСН 3, и добавочно замещенного во 2-положении -F. Конкретнее А представлен 4-фторфенилом. В другом варианте осуществления данного изобретения представлены соединения формул Ia, Ib, Ic и I, где X представлен -S-. В другом варианте осуществления представлены соединения формул Ia, Ib, Ic и I, где X представлен -О-. В другом варианте осуществления данного изобретения представлены соединения формулы Ia, гдеY выбирают из -NR6-CHR7 и -NR8-C(O)-. В группе этого варианта осуществления Y представлен -NR6CHR7-, и в подклассе Y представлен -NR6-CH2-. В другом варианте осуществления представлены соединения формулы Ia, где Y выбирают из -S- и -О-. В другом варианте осуществления данного изобретения представлены соединения формулы Ia, где представляет собой двойную связь. В другом варианте осуществления данного изобретения представлены соединения формулы Ia, гдеR1 выбирают из -Н и -C1-6 алкила. В группе этого варианта осуществления R1 выбирают из -Н и -СН 3 и в еще одном подклассе R1 представлен -Н. В другом варианте осуществления данного изобретения представлены соединения формул Ia, Ib, Ic и I, где R2 выбирают из группы, состоящей из -Н, -ОН, -F, -C1-3 алкила, -ОСН 3 и -ОС(О)СН 3. В группе этого варианта осуществления R2 выбирают из -Н и -ОН и более конкретно из -ОН. В другом варианте осуществления данного изобретения представлены соединения формул Ia, Ib, Ic и I, где R3 выбирают из группы, состоящей из -Н, -C1-6 алкила, -С 1-6 алкила, замещенных одним или несколькими фторами, -С 3-6 циклоалкила и фенила. В группе этого варианта осуществления R3 выбирают из-СН 3, -С 2 Н 5, -C1-2 алкила, замещенных фтором, в частности -CF3 и -CF2CF3, и циклопропила. В другом варианте осуществления данного изобретения представлены соединения формул Ia, Ib, Ic и I, где R4 выбирают из группы, состоящей из -Н, -С 1-6 алкила, -С 1-6 алкила, замещенных одним или несколькими фторами, -C1-6 алкила, замещенного R9, и -С 3-6 циклоалкила. В группе этого варианта осуществления R4 выбирают из группы, состоящей из -СН 3, -С 2 Н 5, -С 1-2 алкила, замещенных фтором, в частности-CF3 и -CF2CF3, циклопропила и -CH2COOC1-4 алкила. В другом варианте осуществления данного изобретения представлены соединения формул Ia, Ib, Ic и I, где R3 и R4 вместе представлены оксо, или R3 и R4 вместе с углеродом, с которым они соединены,представляют -С 3-6 циклоалкиловое кольцо. В другом варианте осуществления данного изобретения представлены соединения формул Ia, Ib иIc, где R5 выбирают из -Н, -СН 3, -F и -Cl. В группе этого варианта осуществления R5 выбирают из -Н и-СН 3. В другом варианте осуществления данного изобретения представлены соединения формул Ia, Ib и I,где R6 выбирают из группы, состоящей из -Н, -СН 3 и -СОСН 3. В группе этого варианта осуществления R6 представлен -Н. В другом варианте осуществления данного изобретения представлены соединения формул Ia и Ib,где R7 выбирают из группы, состоящей из -Н и -С 1-4 алкил. В подклассе этого варианта осуществления R7 представлен -Н. В другом варианте осуществления данного изобретения представлены соединения формулы Ia, гдеR8 представлен -Н. В другом варианте осуществления данного изобретения представлены соединения формул Ia, Ib, Ic и I, где R9 представлен -COOR1, в частности -СООС 1-6 алкил. В другом варианте осуществления данного изобретения представлены соединения формул Ia, Ib, Ic и I, где R10 выбирают из -Н и -C1-6 алкила. В другом варианте осуществления данного изобретения представлены соединения формул Ia, Ib, Ic и I, где R11 выбирают из -Н и -C1-6 алкила. В другом варианте осуществления данного изобретения представлены соединения формул Ia, Ib, Ic и I, где Z является незамещенным, моно- или дизамещенным, как описано в формуле Ia, и выбран из группы, состоящей из фенила, бензила, пиридинила, тиазолила, диоксоланила и тетразолила. В группе этого варианта осуществления Z является незамещенным, моно- или дизамещенным и выбран из группы,состоящей из фенила, пиридинила и тиазолила. Соединения в этом изобретении включают, но ими не ограничиваются, следующие соединения: 4-бром-N-[4-(4-фторфенил)-2-оксо-2 Н-хром-7-ил]метил-N-5-[1-гидрокси-1(трифторметил)пропил]-1,3,4-оксадиазол-2-илбензамид; М+1=646 и 648; полученное способами А и В; 4-(4-фторфенил)-7-[5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2 ил(изопропил)амино]метил-2 Н-хром-2-он; М+1=506; полученное способами А и D; 7-[(5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-иламино)метил]-4-(2-метил-1,3-4 012704 триазол-4-ил)-2 Н-хром-2-он; М+1=467; полученное способами С и А; 4-(4-фторфенил)-7-[(5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-иламино)метил]6-метил-2 Н-хром-2-он; М+1=478; полученное способами С и А и В;N-[5-(1-этил-1-гидроксипропил)-1,3,4-оксадиазол-2-ил]-N-[4-(4-фторфенил)-2-оксо-2 Н-хром-7 ил]метилацетамид; М+1=466; полученное способом А; 7-([5-(1-этил-1-гидроксипропил)-1,3,4-триадиазол-2-ил]аминометил)-4-(4-фторфенил)-2 Н-хром-2 он; М+1=440; полученное способами В и D; 7-[(5-трет-бутил-1,3,4-тиадиазол-2-ил)амино]метил-4-(4-фторфенил)-2 Н-хром-2-он; М-1=408; полученное способом В; 7-(5-[дициклопропил(гидрокси)метил]-1,3,4-триадиазол-2-илтио)-4-пиридин-3-ил-2 Н-хром-2-он; М+1=450; полученное способами С и Е; 7-(5-[дициклопропил(гидрокси)метил]-1,3,4-триадиазол-2-илтио)-4-(4-фторфенил)-2 Н-хром-2-он; М+1=467; полученное способами С и Е; 7-[5-(1-этил-1-гидроксипропил)-1,3,4-триадиазол-2-ил]тио-4-(4-фторфенил)-2 Н-хром-2-он; М+1=443; полученное способами С и Е; и фармацевтически приемлемые соли, эфиры и сольваты, когда это уместно. Предполагают, что соединения данного изобретения, включающие соединения, упомянутые как таковые "формулы I", "формулы Ia", "формулы Ib", "формулы Ic" или любые другие характерные структурные формулы, используемые здесь для описания соединений данного изобретения, включают соединения, попадающие в область каждой из этих структурных формул, включающих фармацевтически приемлемые соли, эфиры и сольваты, где такие соли, эфиры и сольваты возможны. Термин "фармацевтически приемлемые соли" относится к солям, приготовленным из фармацевтически приемлемых нетоксических основ, таких как, например, хлористый натрий, который можно приготовить с использованиемNaOH. Фармацевтически приемлемые эфиры доступных гидрокси или карбоновых кислотных групп могут образовываться в той же степени. Примеры фармацевтически приемлемых эфиров включают, но ими не ограничиваются, -С 1-4 алкил и -С 1-4 алкил, замещенные фенил-, диметиламино- и ацетиламино. Некоторые соединения, описанные здесь, содержат один или несколько ассиметричных (хиральных) центров и могут, таким образом, существовать как рацемические смеси и оптические изомеры,включающие энантиообогащенные смеси, единичные энантиомеры, диастереомеры и смеси из диастереомеров. Настоящее изобретение предназначается для понимания всех возможных энантиомеров и диастереомеров, а также их рацемических и составляющих, энантиомерно чистых и значительно очищенных форм, и фармацевтически приемлемых их солей. Кроме того, некоторые из кристаллических форм соединений настоящего изобретения могут существовать как полиморфы и как таковые нацелены на включение в настоящее изобретение. К тому же некоторые из соединений настоящего изобретения могут образовывать сольваты с водой или простые органические растворители. Такие сольваты и гидраты подобны заключенным в объем настоящего изобретения. Некоторые соединения, описанные здесь, содержат олефиновые двойные связи. Изобретение включает и Е, и Z геометрические изомеры. Соединения данного изобретения можно разделить на их индивидуальные диастереоизомеры с помощью, например, фракционной кристаллизации из подходящих растворителей, например метилен хлорид/гексаны или EtOAc/гексаны, или через посредство хиральной хроматографии с использованием оптически активной постоянной фазы. Абсолютную стереохимию можно определить по рентгенокристаллографии кристаллизованных продуктов или кристаллизованных промежуточных продуктов, которые-6 012704 являются производными, если необходимо, с реагентом, содержащим стереогенический центр известной конфигурации. В ином случае, любой стереомер соединения данного изобретения можно получить путем стереоспецифического синтеза, использующего оптически чистый исходный материал или реагенты известной абсолютной конфигурации. Предполагают, что при использовании здесь "алкил" включает насыщенные алифатические углеводородные группы как с разветвленными, так и неразветвленными цепями, имеющие конкретно указанное количество атомов углерода, например метил (Me), этил (Et), н-пропил (Pr), н-бутил (Bu), н-пентил, нгексил, и их изомеры, такие как изопропил (i-Pr), изобутил (i-Bu), секбутил (s-Bu), трет-бутил (t-Bu), изопентил, изогексил и т.п. "Циклоалкил" означает моноциклическое насыщенное карбоциклическое кольцо, содержащее конкретно указанное количество атомов углерода, например 3, 4, 5 или 6 атомов углерода. Примеры циклоалкилов включают циклопропил, циклобутил, циклопентил и циклогексил. Термин "С 1-6 алкенил" при использовании здесь относится к прямой или разветвленной 2-6 углеродной цепи как минимум с одной углерод-углерод двойной связью. Примеры алкенилов включают, но ими не ограничиваются, винил (-СН-СН 2), аллил, изопропенил, пентенил, гексенил, гептенил, 1-пропенил, 2 бутенил, 2-метил-2-бутенил и т.п. Термин "С 5-7 циклоалкенил" при использовании здесь означает неароматическое моноциклическое кольцо, имеющее от 5 до 7 атомов углерода в кольце как минимум с одной углерод-углерод двойной связью. В определении вышеупомянутых переменных R3 и R4 могут быть связаны с углеродом, к которому они присоединяются, образуя -C5-7 циклоалкениловое кольцо, где нет двойной связи в С-1 положении кольца. Предполагают, что С-1 положение является кольцевым углеродом в циклоалкениловом кольце,который связывается с центром оксадиазолилового или триадиазолилового кольца в характерных структурных формулах, изображенных здесь. В этой ситуации С-1 также связывается с R2. Это продемонстрировано ниже с использованием примера, где R3 и R4 связаны с углеродом, к которому они присоединяются, образуя 3,4-циклопентениловое кольцо, см. (а): Термин "необязательно замещенный" означает "незамещенный или замещенный", и, следовательно,характерные структурные формулы, описанные здесь, включают соединения, содержащие указанный дополнительный заместитель, а также и соединения, которые не содержат дополнительный заместитель. Например, фраза "-С(О)фенил, дополнительно замещенный -С 1-4 алкилом" включает незамещенный-С(О)фенил и -С(О)фенил, замещенный -С 1-4 алкилом. Каждая переменная независимо определяется каждый раз, это происходит в определениях характерной структурной формулы. Например, когда R9 представлен -CR1R1OH, R1 независимо выбирается в каждом случае, и каждый R1 может быть одинаковым или отличающимся. Предполагают, что использование термина "замещенный" включает моно- и полизамещение в указанной молекуле, если не указано особо. Монозамещенная молекула содержит один заместитель, между тем как полизамещенная молекула содержит более чем один заместитель, где каждый атом углерода, а также и гетероатом, такой как азот, если присутствует, т.е. доступен для замещения в молекуле, может независимо быть замещенным, моно- или полизамещенным и который приводит к созданию устойчивой структуры. Например, "-C1-6 алкил дополнительно замещенный фтором" включает -СН 3, -CH2F, -CHF2 и-CF3. Термины "гало" или "галоген" предназначены для включения фтора, хлора, брома и йода, если не указано иначе. Фтор и хлор предпочтительны, фтор наиболее предпочтителен. Примеры 5-членных ароматических колец в определениях А и Z включают, но ими не ограничиваются, тиенил, фуранил, оксазолил, тиазолил, пирролил, пиразолил, имидазолил, и тетразолил, представленные структурными формулами ниже Примеры 6-членных ароматических колец, содержащих углерод и один, два или три -N- в определении А и Z, включают, но ими не ограничиваются, пиридинил, пиримидинил, пиразинил и триазинил,представленные структурными формулами ниже Способность соединений данного изобретения ингибировать биосинтез лейкотриенов делают их полезными для профилактики или изменения симптомов, вызванных лейкотриенами в человеке. Это ингибирование биосинтеза лейкотриенов у млекопитающих показывает, что эти соединения и их лекарственные препараты используются для лечения, профилактики или улучшения атеросклероза у млекопитающих и особенно у людей. Следовательно, соединения данного изобретения можно использовать для-7 012704 лечения атеросклероза, включая применение терапевтически эффективного количества соединения данного изобретения пациентом, нуждающимся в таком лечении. Еще один вид данного изобретения включает способ профилактики или уменьшения риска развития атеросклероза, включая применение профилактически эффективного количества соединения данного изобретения пациентом, нуждающегося в таком лечении. Атеросклероз характеризуется накоплением атеросклеротических бляшек, содержащих холестерин и липиды, внутри слоя стенок артерий большого и среднего размера. Атеросклероз включает болезни сосудов и состояния, которые распознаются и понимаются врачом, практикующим в соответствующей области медицины. Атеросклеротическое сердечно-сосудистое заболевание, включающее рестеноз после реваскуляризационных процедур, ишемическую болезнь сердца (также известную, как болезнь коронарной артерии или ишемическая болезнь сердца), церебраваскулярную болезнь, включающую мультиинфарктную деменцию, и болезнь периферических сосудов, включающую эректильную дисфункцию, представляет собой все клинические проявления атеросклероза, и, следовательно, включается терминами "атеросклероз" и "атеросклеротическая болезнь". Соединение настоящего изобретения можно применять для профилактики или уменьшения риска случаев или рецидива, где существует потенциальная возможность, осложнения ишемической болезни сердца (CHD), цереброваскулярного осложнения, и/или перемежающейся хромоты. Предполагают, что осложнения ишемической болезни сердца включают смерть от CHD, миокардиального инфаркта (т.е. инфаркта миокарда), и от процедур коронарной реваскуляризации. Предполагают, что цереброваскулярные осложнения включают ишемический или геморрагический инсульт (также известных, как цереброваскулярные осложнения) и транзиторные ишемические атаки. Перемежающаяся хромота представляет собой клиническое проявление болезни периферических сосудов. Предполагают, что термин "осложнение атеросклеротической болезни" для использования здесь включает осложнения ишемической болезни сердца, цереброваскулярные осложнения и перемежающуюся хромоту. Предполагают, что люди, которые раньше подвергались одному или нескольким нелетальным осложнениям атеросклеротической болезни, являются теми, для кого существует потенциальная возможность рецидива такого рода осложнения. Таким образом, настоящее изобретение также предоставляет способ для профилактики или уменьшения риска первой или следующего случая осложнения атеросклеротической болезни, включающего использование профилактически эффективного количества соединения данного изобретения пациентом с риском такого рода осложнения. Пациент может уже иметь атеросклеротическую болезнь во время применения или может иметь риск ее развития. Способ данного изобретения предназначен для профилактики или уменьшения нового атеросклеротического повреждения или бляшкообразования, и профилактики или уменьшения развития существующих повреждений или бляшек, а также вызывать регрессию существующих повреждений или бляшек. Таким образом, один аспект данного изобретения включает способ остановки или замедления развития атеросклероза, включая остановку или замедление развития атеросклеротической бляшки, включая применение терапевтически эффективного количества соединения данного изобретения пациентом, нуждающимся в таком лечении. Этот способ также включает остановку или замедление развития атеросклеротических бляшек существующих во время начала текущего лечения (то есть, "существующие атеросклеротические бляшки"), а также остановку или замедление образования новых атеросклеротических бляшек у пациентов с атеросклерозом. Другой аспект данного изобретения включает способ регрессии атеросклероза, включая регрессию атеросклеротических бляшек, существующих во время начала текущего лечения, включающий использование терапевтически эффективного количества соединения данного изобретения пациентом, нуждающимся в таком лечении. Другой аспект данного изобретения включает способ предотвращения или уменьшения риска разрыва атеросклеротической бляшки, включающий использование терапевтически эффективного количества соединения данного изобретения пациентом, нуждающимся в таком лечении. Другой аспект данного изобретения включает способ лечения, профилактики или улучшения стенокардии и/или миокардиальной ишемии, включая использование терапевтически или профилактически эффективного количества, по обстоятельствам, соединений данного изобретения пациентом, нуждающимся в таком лечении. Кроме того, активность настоящих соединений в качестве ингибиторов биосинтеза лейкотриенов делает их полезными для лечения, профилактики или улучшения: 1) легочных нарушений, включающих болезни, такие как астма, хронические бронхиты и болезни, связанные с обструкцией дыхательных путей, 2) аллергий и аллергических реакций, таких как аллергические риниты, контактные дерматиты, аллергические коньюктивиты и прочие, 3) воспалений, таких как артриты или воспалительная сосудистая болезнь, 4) болей, 5) воспалений кожи, таких как аллергическая экзема и прочие, 6) сердечно-сосудистых нарушений, таких как гипертензия, тромбоцитарная агрегация и прочие, 7) почечной недостаточности,возникающей в результате ишемии, вызванной иммунологической или химической (циклоспорин) этиологией, 8) мигрени или гистаминовой головной боли, 9) офтальмологических заболеваний, таких как увеиты, 10) гепатитов, вызванных химическими, иммунологическими или инфекционными стимулами,11) травматических или шоковых состояний, таких как ожоговые поражения, эндотоксикоз и прочие,-8 012704 12) отторжения аллотрансплантата, 13) предотвращения побочных действий, связанных с терапевтическим применением цитокинов, таких как интерлекин II и фактор некроза опухолей, 14) хронических болезней легких, таких как муковисцидоз, бронхиты и другие болезни малых и больших дыхательных путей, 15) холециститов, 16) множественного склероза, 17) пролиферации миобластических лейкозных клеток и 18) угрей. Таким образом, соединения настоящего изобретения также можно использовать для лечения или профилактики состояний болезни млекопитающих (главным образом, человека), таких как эрозивный гастрит; эрозивный эзофагит; диарея; мозговой спазм; преждевременные роды; самопроизвольный аборт; дисменорея; ишемия; вредный фактор, вызывающий повреждение или некроз ткани печени, поджелудочной железы, почки, или миокарда; паренхиматозное повреждение печени, вызванное гепатотоксическими веществами, такими как CCl4 и D-галактозамин; ишемическая почечная недостаточность; болезнь,вызванная повреждением печени; соль желчной кислоты, вызванная повреждением поджелудочной железы или желудка; повреждение клеток, вызванное травмой или стрессом; и почечная недостаточность,вызванная глицерином. Ингибиторы биосинтеза лейкотриенов также действуют как ингибиторы опухолевого метастазирования и проявляют цитопротективное действие. Цитопротективную активность соединения можно наблюдать и у животных, и у человека, наблюдается повышенная устойчивость желудочно-кишечной слизистой к вредному воздействию сильных раздражителей, например, эффекты аспирина или индометацина, вызывающие язву. В дополнение к уменьшению эффекта нестероидных противовоспалительных лекарств на желудочно-кишечный тракт, было показано при изучении животных, что цитопротективные соединения будут предотвращать желудочные повреждения, вызванные оральным введением сильных кислот, сильных оснований, этанола, гипертонических солевых растворов, и прочие. Для измерения цитопротективной способности можно использовать два способа исследования. Эти способы исследования представлены:(B) способом исследования язвы, вызванной индометацином, и описываются в европейском патенте ЕР 140684. В частности, соединения изобретения возможно полезны для уменьшения эрозии желудка,вызванной совведением селективного ингибитора циклооксигеназы-2, такого как рофекоксиб (VIOXX),эторикоксиб (ARCOXIA), целекоксиб (CELEBREX) и вальдекоксиб (BEXTRA), и аспирина в малой дозе. Кроме того, соединения данного изобретения можно также использовать для лечения хронической обструкционной легочной болезни (COPD). Как описано в S. Kilfeather, Chest, 2002, vol 121, 197, полагают, что дыхательная нейтрофилия у пациентов COPD является источником воспаления и связана с дыхательной коррекцией. Присутствие нейтрофилов опосредуется частично LTB4, и лечение настоящими соединениями можно использовать для уменьшения нейтрофильного воспаления у пациентов с COPD. Кроме того, соединения данного изобретения можно использовать для лечения болезни Альцгеймера; см. Manev, H. and Manev, R., "5-Lipoxygenase (ALOX5) and FLAP (ALOX5AP) gene polymorphisms asfactors in vascular pathology and Alzheimer's болезнь," Medical Hypotheses (2006) 66, p. 501-503. Термин "пациент" включает млекопитающих, в частности людей, которые используют текущую активность веществ для профилактики или лечения медицинских заболеваний. Применение лекарства пациентом также включает как самостоятельное введение, так и введение пациенту другим человеком. Пациенту может требоваться лечение существующей болезни или медицинского состояния, или может требоваться профилактическое лечение для профилактики или уменьшения риска болезней и медицинского состояния, вызванного подавлением биосинтеза лейкотриенов. Предполагают, что термин "терапевтически эффективное количество" означает такое количество лекарства или терапевтического вещества, которое будет вызывать биологический или медицинский ответ ткани, системы, животного или человека, что необходимо для ученого, ветеринара, медицинского доктора или другого клинициста. Предполагают, что термин "профилактически эффективное количество" означает такое количество фармацевтического лекарства, которое будет предотвращать или уменьшать риск случаев биологического или медицинского осложнения в ткани, системе, животном или человеке, что необходимо для предотвращения ученым, ветеринаром, медицинским доктором или другим специалистом. Размер профилактического или терапевтического количества соединения этого изобретение будет,конечно, изменяться в зависимости от происхождения тяжести заболевания для излечивания и от специфичности соединения и его способа применения. Это также будет изменяться в зависимости от возраста,веса и индивидуальной реакции пациента. В большинстве случаев, интервал суточной дозы различается для противоастматического, противовоспалительного, противоаллергического или противоатеросклеротического использования, и как правило, используется не для цитопротекции, положение в диапазоне от примерно 0,001 до 100 мг на кг массы тела у млекопитающих, предпочтительно 0,01 до 10 мг на каждый кг и еще предпочтительнее 0,1 до 1 мг на каждый кг, единовременно или небольшими дозами. С другой стороны, иногда возможно понадобится использование дозировки за пределами этих лимитов. В качестве примеров, общее количество ежедневной дозы соединения может быть выбрано из, но ими не ограни-9 012704 чиваться, 1, 5, 10, 15, 20, 25, 50, 75, 100, 125, 150, 200 и 250 мг единовременно или раздельно суточной дозы. В ситуации, где применяется оральный состав, подходящий диапазон доз варьирует для противоастматического, противовоспалительного, противоаллергического или противоатеросклеротического использования, например, от примерно 0,01 до примерно 100 мг соединения данного изобретения на каждый кг массы тела в сутки, предпочтительно от примерно 0,1 до примерно 10 мг на кг и для цитопротектического использования от 0,1 до 100 мг (предпочтительно от примерно 1 до 100 мг и наиболее предпочтительно от примерно 10 до примерно 100 мг) соединения настоящего изобретения на каждый кг массы тела в сутки. Для использования здесь композиции используются для внутривенного введения, подходящего диапазона дозы варьируют для противоастматического, противовоспалительного, противоатеросклеротического или противоаллергического использования от примерно 0,001 до примерно 25 мг (предпочтительно от 0,01 до примерно 1 мг) соединения данного изобретения на каждый кг массы тела в сутки и для цитопротективного использования от примерно 0,1 до примерно 100 мг (предпочтительно от примерно 1 до примерно 100 мг и наиболее предпочтительно от примерно 1 до примерно 10 мг) соединения данного изобретения на каждый кг массы тела в сутки. Для лечения болезней зрительного аппарата можно использовать офтальмологический препарат для глаза, включающий введение 0,001-1 вес.% растворов или суспензии соединения данного изобретения в подходящей офтальмологической форме. Точное количество соединения данного изобретения, которое используют в качестве цитопротективного вещества, будет зависеть от того, помимо прочего, применяется ли для лечения поврежденных клеток или предотвращения будущего повреждения, на природу поврежденных клеток (например, желудочно-кишечное изъязвление против нефротического некроза), и на природу этиологического фактора. Например, применение соединения данного изобретения для избегания будущего повреждения предполагает совместное применение соединения данного изобретения с NSAID, что в противном случае может вызывать такого рода повреждение (например, индометацин). Для такого использования соединение данного изобретения применяют от 30 мин до более чем 30 мин после введения NSAID. Предпочтительно применяют раньше или одновременно с NSAID (например, в составе лекарственной формы). Фармацевтические композиции настоящего изобретения содержат соединение данного изобретения в качестве активного компонента и фармацевтически приемлемый носитель и дополнительно другие терапевтические компоненты. Любой подходящий способ введения можно использовать для обеспечения млекопитающего, главным образом человека, эффективной дозой соединения настоящего изобретения. Например, может использоваться оральный, ректальный, местный, парентеральный, глазной, легочный,назальный и прочие. Лекарственные формы включают таблетки, пастилки, дисперсии, суспензии, растворы, капсулы, кремы, мази, аэрозоли и прочие. Для использования при лечении или профилактике атеросклероза и связанными с болезнью осложнениями, предпочтительна оральная рецептура. Композиции включают композиции пригодные для орального, ректального, локального, парентерального (включает подкожные, внутримышечные, и внутривенные), глазного (офтальмологическое),легочного (назальной или внутриротовой ингаляции), или назального введения, хотя наиболее походящий способ введения в любом данном случае будет зависеть от природы и тяжести состояний, которые лечат, и от природы активного компонента. Их можно удобно представлять в единице лекарственной формы и получать любыми способами, хорошо известными специалисту в данной области фармацевтики. Для применения при вдыхании соединения настоящего изобретения удобно использовать в форме представления аэрозольного спрея из герметичной тары или аэрозольного аппарата. Соединения также получают в виде порошков, рецептуру которых можно разработать и порошковые сочетания могут вдыхаться с помощью ингаляционного аппарата вдувания порошка. Предпочтительная система доставки для ингаляции представляет собой ингаляционный аэрозоль с измеренной дозой (MDI), рецептуру которого можно разработать в виде суспензии или раствора смеси настоящего изобретения в удобных пропеллентах, таких как фторкарбоны или гидрокарбоны. Подходящие местные рецептуры смеси настоящего изобретения включают трансдермальные приспособления, аэрозоли, кремы, мази, лосьоны, присыпки и прочие. При практическом использовании соединения настоящего изобретения можно сочетать в виде активного компонента в однородной смеси с фармацевтическим носителем в соответствии с принятыми фармацевтическими способами смешивания. Носитель можно получать большего числа форм, зависящих от формы получения, желательной для введения, например, орально или парентерально (включая внутривенно). При приготовлении составов для оральных лекарственных композиций можно применять любую обычную фармацевтическую среду, такую как, например, воду, гликоли, масла, спирты, ароматизаторы, консервирующие вещества, красящие вещества и прочие, в случае оральных жидких препаратов,таких как, например, суспензии, эликсиры и растворы; или носители, такие как крахмал, сахара, микрокристаллическая целлюлоза, разбавители, грануляты, смягчители, связующие вещества, разделяющие вещества и прочие, в случае оральных твердых препаратов, таких как, например, порошки, капсулы и таблетки, с твердыми оральными препаратами, которые предпочтительнее жидких препаратов. Благода- 10012704 ря легкости их применения, таблетки и капсулы представляют наиболее предпочтительной оральной единицей лекарственной композиции, в случае которых очевидно используются твердые фармацевтические носители. При необходимости таблетки можно покрывать стандартными водными и неводными способами. Кроме того, простые лекарственные композиции, указанные выше, соединения настоящего изобретения также можно применять способами контролируемого высвобождения и/или средствами доставки,такими как описаны в патентах US 3845770; US 3916899; US 3536809; US 3598123; US 3630200; US 4008719 и US 5366738, открытие включено сюда посредством ссылки. Фармацевтические композиции настоящего изобретения, пригодные для орального применения,могут быть представлены в виде дискретных компонентов, таких как капсулы, крахмальные капсулы или таблетки, каждая содержащая установленную заранее дозу активного компонента, в виде порошка или гранул, или в виде раствора или суспензии в водосодержащей жидкости, не водосодержащей жидкости,водомасляной жидкой эмульсии. Такие композиции можно получать любыми фармацевтическими способами, но все способы включают этапы внесения соединения активного компонента с носителем, который составляет один или несколько необходимых компонентов. Обычно композиции получают путем равномерного и однородного смешивания активного компонента с жидкими носителями или разделяют твердые носители или и то, и другое, и затем, если необходимо, образуя продукт в желательном представлении. Например, таблетку можно получать сжатием или прессованием, дополнительно с одним или несколькими добавочными компонентами. Прессованные таблетки можно получить прессованием в соответствующем аппарате, активный компонент в сыпучей форме, такой как порошок или гранулы, дополнительно смешанные со связывающим веществом, смягчителем, инертным разбавителем, поверхностно-активным или диспергирующим веществом. Полученные под давлением таблетки можно получить под давлением в соответствующем аппарате, смесь порошкового соединения увлажняли инертным жидким разбавителем. Желательно, каждая таблетка, крахмальная капсула или капсула содержит от примерно 1 до примерно 500 мг активного компонента. Следующее представляет собой примеры характерных фармацевтических лекарственных дозированных композиций для соединений данного изобретения. Настоящее изобретение также включает способ получения фармацевтической композиции, включающей комбинирование соединения данного изобретения с фармацевтически приемлемым носителем. К тому же включенное соединение представляет собой фармацевтическую композицию, которую получают комбинированием соединения данного изобретения с фармацевтически приемлемым носителем. Терапевтически эффективное количество соединения данного изобретения можно использовать для получения лекарства необходимого для лечения и профилактики любого описанного здесь медицинского заболевания. Например, соединение данного изобретения можно использовать для получения лекарства необходимого для лечения астмы, аллергий и аллергических состояний, воспаления, COPD или эрозивного гастрита. Кроме того, лекарство может быть полезно для профилактики или уменьшения риска развития атеросклеротической болезни, останавливая или замедляя прогрессию атеросклеротической болезни, как только она станет клинически обнаруживаемой, и предотвращая или уменьшая риск первого или следующего случая осложнения атеросклеротической болезни. Лекарство, содержащее соединение данного изобретения, также можно получить с одним или несколькими дополнительными активными веществами, такими как описанные ниже. Одно или несколько дополнительных активных веществ можно использовать в сочетании с соединениями данного изобретения в одной лекарственной рецептуре, или активные вещества сочетания можно вводить пациенту в раздельных лекарственных рецептурах, которое учитывает одновременное или последовательное введение активных веществ. В дополнение к соединениям данного изобретения, фармацевтические композиции настоящего изобретения также могут содержать другие активные вещества (то есть, компоненты), такие как ингибиторы циклооксигеназы, нестероидные противовоспалительные лекарства (NSAIDs), периферические болеутоляющие вещества, такие как зомепирак, дифлунизал и подобные. Весовое соотношение соединения данного изобретения ко второму активному компоненту может варьироваться и будет зависеть от эффективной дозы каждого компонента. Обычно используют эффективную дозу каждого. Таким образом, например, при сочетании соединения данного изобретения с NSAID весовое соотношение вышеуказанного соединения с NSAID обычно будет варьировать от примерно 1000:1 до примерно 1:1000, предпочтительно от примерно 200:1 до примерно 1:200. Сочетания соединения данного изобретения и других активных компонентов также обычно будет находиться в вышеуказанной области, но в каждом случае должна использоваться эффективная доза каждого активного компонента.NSAID можно разделить на пять групп: (1) производные пропионовой кислоты; (2) производные уксусной кислоты; (3) производные фенаминовой кислоты; (4) оксикамы и (5) производные бифенилкарбоксиловой кислоты; или их фармацевтически приемлемые соли. Производные пропионовой кислоты, которые могут быть использованы, включают: аминопрофен,беноксапрофен, буклоксиновая кислота, карпрофен, фенбуфен, фенопрофен, флурпрофен, флурбипрофен, ибупрофен, индопрофен, кетопрофен, миропрофен, напроксен, оксапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновая кислота и тиоксапрофен. Структурно родственные производные пропионовой кислоты, обладающие сходными обезболивающими и противовоспалительными свойствами, как предполагается, также включаются в эту группу. Таким образом, "производные пропионовой кислоты",как определено здесь, представляют собой ненаркотические анальгетики/нестероидные противовоспалительные лекарства, имеющие свободную -СН(СН 3)СООН или -СН 2 СН 2 СООН группу (которая дополнительно может быть в форме группы фармацевтически приемлемой соли, например -СН(СН 3)COO-Na+ или -CH2CH2COO-Na+), обычно присоединенную непосредственно или через функцию карбонила к циклической системе, предпочтительно к ароматической циклической системе. Производные уксусной кислоты, которые могут быть использованы, включают индометацин, который предпочтительнее NSAID, ацеметацин, алклофенак, клиданак, диклофенак, фенклофенак, фенклосиновая кислота, фентиазак, фурофенак, ибуфенак, изоксепак, окспинак, сулиндак, тиопинак, толметин,зидометацин и зомепирак. Структурно родственные производные уксусной кислоты, обладающие сходными обезболивающими и противовоспалительными свойствами, как предполагается, также включаются в эту группу. Таким образом, "производные уксусной кислоты", как определено здесь, представляют собой ненаркотические анальгетики/нестероидные противовоспалительные лекарства, имеющие свободную -СН 2 СООН группу (которая дополнительно может быть в форме группы фармацевтически приемлемой соли, например -CH2COO-Na+), обычно присоединенную непосредственно к циклической системе,- 12012704 предпочтительно к ароматической или гетероароматической циклической системе. Производные фенаминовой кислоты, которые могут быть использованы, включают следующее: флуфенамовая кислота, меклофенамовая кислота, мефенамовая кислота, нифлумовая кислота и толфенамовая кислота. Структурно родственные производные фенаминовой кислоты, обладающие сходными обезболивающими и противовоспалительными свойствами, как предполагается, также включаются в эту группу. Таким образом, "производные фенаминовой кислоты", как определено здесь, представляют собой ненаркотические анальгетики/нестероидные противовоспалительные лекарства, которые включают основную структуру которые могут быть связаны с различными заместителями и в которых свободная -СООН группа может иметь форму группы фармацевтически приемлемой соли, например -COO-Na+. Производные бифенилкарбоксиловой кислоты, которые могут быть использованы, включают дифлунизал и флуфенизал. Структурно родственные производные бифенилкарбоксиловой кислоты, обладающие сходными обезболивающими и противовоспалительными свойствами, как предполагается, также включаются в эту группу. Таким образом, "производные бифенилкарбоксиловой кислоты", как определено здесь, представляют собой ненаркотические анальгетики/нестероидные противовоспалительные лекарства, которые включают основную структуру которые могут быть связаны с различными заместителями и в которых свободная -СООН группа может иметь форму группы фармацевтически приемлемой соли, например -COO-Na+. Оксикамы, которые могут быть использованы в настоящем изобретении, включают изоксикам, пироксикам, судоксикам и теноксикам. Структурно родственные оксикамы, обладающие сходными обезболивающими и противовоспалительными свойствами, как предполагается, также включаются в эту группу. Таким образом, "оксикамы", как определено здесь, представляют собой ненаркотические анальгетики/нестероидные противовоспалительные лекарства, которые имеют общую формулу где R представлен ариловой или гетероариловой циклической системой. Также могут использоваться следующие NSAID: амфенак натрия, аминопрофен, анитразафен, антрафенин, ауранофин, бендазаклизинат, бензиданин, бепрозин, броперамол, буфезолак, цинметацин, ципроквазон, клоксемат, дазидамин, дебоксамет, дельметацин, детомидин, дексиндопрофен, диацереин,дифисаламин, дифенпирамид, эморфазон, энфенамовая кислота, эноликам, эпиризол, этерсалат, этодолак, этофенамат, фанетизолмезилат, фенклорак, фендозал, фенфлумизол, фепразон, флоктафенин, флуниксин, флуноксапрофен, флупроквазон, фопиртолин, фосфозал, фурклопрофен, глюкаметацин, гуаимезал, ибупроксам, изофезолак, изониксим, изопрофен, изоксикам, лефетамин HCl, лефлуномид, лофемизол, кальций лоназолак, лотифазол, локсопрофен, лизин клониксинат, меклофенамат натрия, мезеклазон,набуметон, никтиндол, нимезулид, орпаноксин, оксамитацин, оксападол, перизоксал цитрат, пимепрофен, пиметацин, пипроксен, пирозолак, пирфенидон, проглуметацин малеат, проквазон, пиридоксипрофен, судоксикам, талметацин, тальнифлумат, теноксикам, тиазолинобутазон, тиелавин В, тиарамид HCl,тифламезол, тимегадин, толпадол, триптамид, и уфенамат. Также могут использоваться следующиеNSAID, обозначенные фирменным кодовым номером (см., например, Pharmaprojects): 480156S, АА 861,AD1590, AFP802, AFP860, AI77B, АР 504, AU8001, ВРРС, BW540C, CHINOIN 127, CN100, ЕВ 382,EL508, F1044, GV3658, ITF182, KCNTEI6090, KME4, LA2851, MR714, MR897, MY309, ONO3144, PR823,PV102, PV108, R830, RS2131, SCR152, SH440, SIR133, SPAS510, SQ27239, ST281, SY6001, ТА 60, TAI901 (4-бензоил-1-инданкарбоновая кислота), TVX2706, U60257, UR2301 и WY41770. Наконец, NSAID, которые также могут использоваться, включают салицилаты, специфически ацетилсалициловую кислоту и фенилбутазоны, и их фармацевтически приемлемые соли. В дополнение к индометаицину, другими предпочтительными NSAIDs являются ацетилсалициловая кислота, диклофенак, фенбуфен, фенопрофен, флурбипрофен, ибупрофен, кетопрофен, напроксен,фенилбутазон, пироксикам, силиндак и толметин. Фармацевтические композиции, содержащие соединения данного изобретения, также может содержать ингибиторы биосинтеза лейкотриенов, таких как описаны в европейских патентах ЕР 138481(24 апреля, 1985), ЕР 115394 (8 августа, 1984), ЕР 136893 (10 апреля, 1985) и ЕР 140709 (8 мая, 1985),которые включены в данный документ посредством ссылки. Соединения данного изобретения также можно использовать в сочетании с антагонистами лейкотриенов, такими как описаны в европейском патенте ЕР 106565 (25 апреля, 1984) и европейском патенте- 13012704 ЕР 104885 (4 апреля, 1984), которые включены в данный документ посредством ссылки, и другими известными специалисту в данной области, такими как описаны в европейских патентных заявках 56172(21 июля, 1982) и 61800 (10 января, 1982); и в патентном описании U.K.2058785 (15 апреля, 1981),которые включены в данный документ посредством ссылки. Фармацевтические композиции, содержащие соединения данного изобретения, также могут включать в качестве второго активного компонента антагонисты простагландинов, такие как описаны в европейском патенте ЕР 11067 (28 мая, 1980), или антагонистов тромбоксанов, такие как описаны в патентеUS 4237160. Они также могут содержать ингибиторы гистидиндекарбоксилазы, такие как фторметилгистидин, описанный в патенте US 4325961. Соединения данного изобретения также можно успешно сочетать с антагонистом H1- или Н 2-рецептора, таким как, например, ацетомазол, аминотриадиазолами, описанными в европейском патенте ЕР 40696 (2 декабря, 1981), бенадрилом, циметидином,фамотидином, фрамамином, гистадилом, фенерганом, ранитидином, терфенадином и прочими соединениями, такими как описаны в патентах US 4283408; US 4362736 и US 4394508. Фармацевтические композиции также могут содержать ингибитор K+/Н+ АТФазы, такой как омепразол, описанный в патентеUS 4255431 и прочие. Соединения данного изобретения также можно успешно сочетать с большинством клеточных стабилизирующих веществ, таких как 1,3-бис-(2-карбоксихром-5-илокси)-2-гидроксипропан и родственные соединения, описанные в Британских патентных описаниях GB 1144905 и GB 1144906. Еще одна полезная фармацевтическая композиция включает соединения данного изобретения в сочетании с антагонистами серотонина, такими как метисергид, антагонистами серотонина, описанными в Nature,316, 12 6-131 (1985), и прочие. Каждая ссылка, относящаяся к этому разделу, включена в данный документ посредством ссылки. Другие предпочтительные фармацевтические композиции содержат соединения данного изобретения в сочетании с антихолинергетиками, такими как ипратропий бромид, бронходилятаторами, такими как бета-антагонист сальбутамол, метапротеренол, тербуталин, фенотерол и прочие, и противоастматический лекарственный теофиллин, холинтеофиллинат, и энпрофиллин, кальциевый антагонист нифедипин, дилтиазем, нитрендипин, верапамин, нимодипин, фелодипин и т.д., и кортикостероиды, гидрокортизон, метилпреднизолон, бетаметазон, дексаметазон, беклометазон и прочие. Кроме того, дополнительные активные вещества, такие как антиатеросклеротические вещества,можно использовать в сочетании с соединениями данного изобретения. Дополнительное активное вещество или вещества могут представлять собой повреждающие липиды соединения, такие как ингибиторыHMG-CoA редуктазы, или вещества, обладающие другими фармацевтическими активностями, или вещества, которые обладают как липидповреждающими эффектами, так и другими фармацевтическими активностями. Примеры ингибиторов HMG-CoA редуктазы, необходимые для этой цели, включают статины в лактонизированных и дигидрокси открытых кислотных формах и их фармацевтически приемлемые соли и эфиры, включают, но ими не ограничиваются, ловастатин (MEVACOR; см. патент US 4342767); симвастатин (ZOCOR; см. патент US 4444784); дигидрокси открытая кислотная форма симвастатина, в частности его соли аммония или кальция; правастатин, в частности его соль натрия (PRAVACHOL; см. патент US 4346227); флувастатин, в частности его соль натрия (LESCOL; см. патент US 5354772); аторвастатин, в частности его соль кальция (LIPITOR; см. патент US 5273995); нисвастатин, также обозначенный как NK-104 (см. РСТ номер международной публикации WO 97/23200); и розувастатин(CRESTOR; см. патент US 5260440). Дополнительные активные вещества, которые могут применяться в сочетании с соединением данного изобретения, включают, но ими не ограничиваются, ингибиторыHMG-CoA синтазы; ингибиторы абсорбции холестерина, такие как эзетимиб (ZETIA), который представляет собой 1-(4-фторфенил)-3(R)-[3(S)-(4-фторфенил)-3-гидроксипропил]-4(S)-(4-гидроксифенил)-2 азетидинон, описанный в патентах US Re. 37721 и US 5846966; ингибиторы белка переносчика холестеринового эфира (СЕТР), например, JTT-705 (Japan Tobacco Company) и торцетрапиб (Pfizer); ингибиторы скваленэпоксидазы; ингибиторы скваленсинтетазы (также известные, как ингибиторы скваленсинтазы); ацил-коэнзим А: ингибиторы холестерин ацилтрансферазы (АСАТ), включающие селективные ингибиторы АСАТ-1 или АСАТ-2, а также и парные ингибиторы АСАТ 1 и -2; ингибиторы микросомального белка транспортера триглицеридов (МТР); пробукол; ниацин; секвестранты желчных кислот; LDL (липопротеины низкой плотности) рецепторные индукторы; ингибиторы агрегации тромбоцитов, например,гликопротеин IIb/IIIa фибриноген рецепторные антагонисты и аспирин; антагонисты человеческого пероксисомного активирующего пролиферацию рецептора гамма (PPAR), включающего соединения,обычно обозначаемые как глитазоны, например, троглитазон, пиоглитазон и розиглитазон и, включающие эти соединения, включенные в структурный класс, известный как тиазолидинедионы, а также иPPAR агонисты вне тиазолидинедионового структурного класса; PPAR агонисты, такие как клофибрат, фенофибрат, включая микроизмельченный фенофибрат, и гемфиброзил; PPAR парные / агонисты,такие как мураглитазар; витамин В 6 (также известный как пиридоксин) и их фармацевтически приемлемые соли, такие как соль HCl; витамин B12 (также известный как цианкобаламин); фолиевая кислота или ее фармацевтически приемлемая соль или эфир, такие как соль натрия и метилглукаминовая соль; витамины антиоксидантов, такие как витамин С и Е и бета-каротин; бета-блокаторы; антагонисты ангиотен- 14012704 зина II, такие как лозартан; ингибиторы ангеотензин превращающего ферменты, такие как эналоприл и каптоприл; блокаторы кальциевых каналов, такие как нифедипин и дилтиазам; эндотелиальные антагонисты; вещества которые увеличивают экспрессию гена АВС 1; FXR и LXR лиганды, включая и ингибиторы, и антагонисты; соединения бисфосфоната, такие как алендронат натрия; и ингибиторы циклооксогеназы-2, такие как рофекоксиб и целекоксиб. Соединения этого изобретение можно исследовать с использованием следующих способов определения их ингибирующей активности биосинтеза лейкотриенов млекопитающих. Было показано, что характерные исследованные соединения данного изобретения представляют собой ингибиторы биосинтеза лейкотриенов, большинство которых имеет IC50 меньше чем или равное 4 мкМ в способе исследования фермента 5-липоксигеназы человека, описанном ниже, с предпочтительным соединением, исследованным в этом способе, имеющем IC50 меньше чем или равное 0,100 мкМ. Было показано, что характерные исследованные соединения обладают активностью как ингибиторы 5-LO в способе исследования цельной крови 5-липоксогеназы человека, описанном ниже, большинство которых имеет IC50 меньше чем или равное 4 мкМ, и предпочтительные соединения имеют IC50 меньше чем или равное 0,500 мкМ. Способ исследования фермента 5-липоксигеназы человека. Активность 5-липоксигеназы измеряли с использованием спектрометрического способа; рекомбинантная 5-липоксигеназа человека как источник фермента. 5-липоксигеназу человека выделяли из Sf9 клеток, зараженных рекомбинантным бакуловирусом rvH5LO (8-1), содержащим кодирующую последовательность для 5-липоксигеназы человека, как описано Percival et al., (Eur. J. Biochem 210, 109-117,1992). Ферментную активность измеряли с использованием спектрометрического способа оптимальной скорости образования связанного диена (поглощение при 238 нм), используя способ, описанный в Riendeau et al. (Biochem. Pharmacol. 38, 2313-2321, 1989) с незначительными модификациями. Инкубационная смесь содержала 25 ммоль фосфата калия, pH 7,5, 0,1 ммоль EDTA, 0,3 ммоль CaCl2, 24 мкг/мл фосфотидилхолина, 0,1 ммоль АТФ, 0,5 ммоль DTT, 20 мкМ арахидоновой кислоты (2 мкл из 100-кратного раствора в этаноле), ингибитор (2 мкл аликвоты из 100-кратного раствора в DMSO) и аликвоту выделенной 5-липоксигеназы. Реакции инициировались добавлением выделенной 5-липоксигеназы и скорость образования связанного диена поддерживали в течение 5 мин при комнатной температуре. Реакцию проводили в Costar UV плашке (Cat.3635) и коэффициенты поглощения при 238 нм регистрировали с помощьюsoftware. Ферментную активность вычисляли из оптимальной скорости реакции линейным приближением увеличения поглощения при 238 нм в течение 36 с. Когда скорость образования диена низкая (0,01 единиц поглощения/мин), линейное приближение производится в течение 180 с. Результаты выражаются в виде процента ингибирования скорости реакции по сравнению с контролями (обычно между 0,0010,005 единиц поглощения/мин), содержащими растворитель DMSO. Способ исследования 5-липоксигеназы человека цельной крови. Свежую кровь собирали в гепариновые пробирки венопункцией добровольцев, давших согласие. Эти добровольцы не имели никаких наблюдаемых воспалительных заболеваний и не принимали никаких нестероидных противовоспалительных лекарств по крайней мере 4 дня до сдачи крови. Плазму отделяли от крови у каждого добровольца с помощью центрифугирования приблизительно 10 мл крови. 50 ммоль исходного раствора ионофора кальция А 23187 (Sigma, St Louis, Mo., USA) в DMSO разводили 40 кратно с каждой плазмой волонтера, до получения 1,25 ммоль рабочего раствора. Каждую аликвоту крови 250 мкл преинкубировали либо с 0,5 мкл растворителя (DMSO), либо с исследуемыми соединениями вDMSO при 37 С в течение 15 мин. Потом добавили 5 мкл либо плазмы, либо 1,25 ммоль рабочего раствора (для каждого эксперимента, кровь и плазму брали от того же добровольца), приводя конечную концентрацию 25 мкМ А 23187. Смесь крови инкубировали при 37 С в течение 30 мин, затем центрифугировали при 1500g при 4 С в течение 10 мин. Надосадочную плазму собирали из всех образцов и хранили при 4 С. Все образцы надосадочной плазмы исследовали на продукцию лейкотриена В 4 (LTB4),используя кит для ферментного иммуносорбентного способа исследования LTB4 (EIA) из Assay Designs(Ann Arbor, Mich., USA) в соответствии с инструкциями производителя. Соединения данного изобретения можно получать, используя общие синтетические способы, известные в данной области, включая способы, описанные в патенте US 5552437 и РСТ публикации WO 2004/108720, опубликованной 16 декабря 2004 г., обе публикации включены в данный документ посредством ссылки целиком. Синтетические подходы, изложенные в следующих способах, схемах реакции и примерах, приводятся с целью иллюстрации. Группы, обозначенные "R" в общих схемах, а также растворители, температуры и другие условия реакций могут выбираться или изменяться специалистом в данной области. Функциональные группы можно либо защитить, либо заменить другими функциональными группами. Например, амин группы могут ацилироваться ацилхлоридом и/или ангидридом со слабым основанием, таким как K2CO3 или азотистое основание. Эфиры могут замещаться третичными спиртами с реактивом Гриньяра или реагентов алкил лития. Некоторые использованные здесь сокращения включают: Ас - ацил; AIBN - 2,2'-азобисизобутиронитрил; BuLI - н-бутиллитий; CAN - церий нитрат аммония; DAST - диэтиламиносульфур трифторид;THF - тетрагидрофуран; TMSCN - триметилсилил цианид. Оксадиазолы можно получить, например, в соответствии с литературными способами и материалами, использованными при экспертизе заявки в них, с соответствующим исходным материалом, как изложено далее: White, A.D., et al. J. Med. Chem., (1996) 39, 4382; Futaki, K. Tosa, S., Chem. Pharm. Bull. (1960) 8, 908; Chem. Abstr. (1966) 64, 3558a. Триадиазолы можно получить, например, в соответствии с литературными способами и материалами, использованными при экспертизе заявки в них, с соответствующим исходным материалом, как изложено далее: Werber G., Buccheri F., Marino M.L., J. Hetero. Chem. (1975) 12, 581; Pandey V.K. et al., Ind. J.WO 2004/108720. Метильная группа превращается в моно- или дибром 2 с NBS; нагревание в инертном растворителе, таком как CCl4, в присутствии радикального инициатора, такого как пероксид бензоила,AIBN или света. Соединение моноброма 2 обрабатывается избытком NMO при приблизительно 100 С в растворителе, подобном диоксану, до полного превращения в альдегид 8. Альтернативно, аналог диброма 2, обработанный AgNO3 в диоксановой воде в возвратном потоке, за короткое время образовывал альдегид 8. Альдегид 8 также получают из аналога диброма 2 в горячем растворе NH4OAc в НОАс (воду можно добавлять). Смесь 4 получали при комнатной температуре из смеси 2 (монобром) и 3 в инертном растворителе,таком как DMF, в присутствии слабого основания, такого как K2CO3. Ацетил удаляли основанием, таким как NH4OH, в THF-воде до выхода соединения 5. Свободный NH превращается в N-алкилы, Nалкилоилы или N-арилоилы с алкилгалоидами, алифатическими ацилгалоидами или ароматическими ацилгалоидами посредством слабого основания в инертном растворителе, каком как DCM. Двойную связь кумарина 5 восстанавливали до простой связи с водородом под давлением (40-60 фунт/кв.дюйм) и нагреванием (40-60 С) с катализатором, таким как палладий в угле, в соответствующем растворителе для гидрогенизации, подобном этанолу. Гидрогенизацию можно завершить в любой момент в любой последовательности. Способ В (см. схему ниже). Альдегид 8 и амин 9 нагревают в колбе с обратным холодильником вместе с или без кислотного катализатора, такого как PPTS, в растворителе для образования постоянно кипящей смеси, таком как толуол, до выхода имина 10. Этот имин восстанавливали NaBH4 или другим для освобождения NH 5 в этаноле или метаноле. Если R2=OH, то имин 10 обрабатывали DAST в DCM при -78 С, доводили до комнатной температуры и затем вливали раствор NaBH4 в этаноле до получения фторсодержащего аналога 11. Альтернативно, имин 10 вступает в реакцию с реактивом Гриньяра между -95 и -78 С в THF или эфире. Смесь доводили до 0 С и тушили NH4Cl до выхода 12. Способ С (см. схему ниже). Кумарин 13 обрабатывали тиолом 14 и неорганическим основанием, таким как K2CO3, в DMF илиNMP между 80-120 С до получения соединения 15. Альтернативно, тиол 14 несколько минут обрабатывали KOH в метаноле и растворитель удаляли высушиванием. К этой соли калия добавляли кумарин 13 вNMP и смесь нагревали до 80-120 С до выхода 15. Кумарин 16 получали в катализируемой палладием реакции соединения 13 в MeOH-DMSO (ca. 1:2) под давлением СО при 60 С с основанием, таким как триэтиламин, до завершения. Способ D (см. схему ниже). К -78 С THF раствору 17 добавляют BuLi с последующим хлортриметилсиланом. Температуру устанавливают -20 С, охлаждают обратно до -78 С и BuLi добавляют с последующим реагентом, содержащим карбонильную группу до выхода 18. Способ E (см. схему ниже). Раствор R-(метилтио)(тиоксо)ацетата 20, где R представлен алкилом (см. Z. Chem. 1977, vol. 17,366), и соль калия и гидразиндитиокарбоновой кислоты 19 (см. J. Am. Chem. Soc. 1983, 105, 2287) в EtOH нагревают с обратным холодильником всю ночь. После охлаждения реакционную смесь экстрагируютEt2O и удаляют растворитель. Осадок очищают путем хроматографии испарительной колонки на силикагеле для получения соединения 21. Способ А- 17012704 7-Бром-4-трифторметансульфонилоксикумарин 25 можно получить, как показано ниже в способе F. Описание получения 25 также находится в способе, описанном в патенте US 5552437 в схеме I колонки 17-18 (см. структуру V) в ней и разделе, озаглавленном "Получение кумаринов", начинающемся с колонки 58 в ней. Бромфенол 22 может ацетилироваться обработкой смеси 22 и ацетилхлорида в присутствии основания, такого как пиридин, в растворителе, таком как дихлорметан до выхода соответствующего ацетата, который, при нагревании без примесей с кислотой Льюиса, такой как хлорид алюминия, дает ацилпроизводное 23. Реакция 23 с первым неорганическим основанием, таким как гидрид натрия, в органическом растворителе, таком как бензол, с последующим прибавлением карбоната, такого как диэтилкарбонат, приводит к образованию промежуточного продукта 24. Промежуточное соединение 24 изменяют дальше с использованием трифторметансульфонового ангидрида, в присутствии амина, такого как триэтиламин, в нейтральном растворителе, таком как дихлорметан, до соответствующего трифлата 25. Способ F. К 80 С суспензии NaH (60 г, 1500 ммоль, 60%) в толуоле добавляли 1-(2-гидрокси-4 метилфенил)этанол (100 г, 666 ммоль; также известный как 2'-гидрокси-4'-метилацетофенон) в 800 мл толуола в течение 1 ч. Это сопровождалось добавлением по каплям диэтилкарбоната (157 г, 1,3 ммоль) в 1000 мл толуола в течение 1 ч. Реакционную смесь оставляли при 80 С на всю ночь. После охлаждения при комнатной температуре раствор вливали в 1,6 л HCl (2N). Образовавшийся осадок фильтровали, собирали и смешивали с МеОН (минимальное количество). После фильтрации обозначенную смесь высушивали всю ночь (при 55 С, под высоким вакуумом) до выхода обозначенного соединения. 1 Н ЯМР (400 МГц, DMSO-d6):12,45 (1 Н, с), 7,58 (1 Н, д), 7,13 (2 Н, м), 6,53 (1 Н, с) и 2,39 (3 Н, с). Этап 2: 4-(4-фторфенил)-7-метил-2 Н-хром-2-он К -30 С раствору 4 гидрокси-7-метил-2 Н-хром-2-он (50 г, 284 ммоль) и триэтиламина (48,8 г,482 ммоль) добавляли Tf2O (128,1 г, 454 ммоль) в 120 мл CH2Cl2 очень медленно (внутренняя температура-30 С). После 30 мин смешивания раствор доводили до 0 С и блокировали NH4Cl. После экстракцииCH2Cl2 органическую фазу отмывали Н 2 О (3 х), высушивали MgSO4 и удаляли растворитель. Полученный осадок смешивали в гексановом эфире (9/1). После фильтрации промежуточное соединение трифлата высушивали. 1 Н ЯМР (400 МГц, ацетон-d6):7,68 (1 Н, д), 7,37 (2 Н, м), 6,61 (1 Н, с) и 2, 52 (3 Н, с). Смесь трифталата (40 г, 130 ммоль), р-фторфенилбороновой кислоты (21,8 г, 156 ммоль), Pd(OAc)2(0,87 г, 3,9 ммоль), трициклогексилфосфин (1,31 г, 4,7 ммоль) и фторид калия (24,9 г, 428 ммоль) в 500 мл THF смешивали при комнатной температуре всю ночь. Смесь фильтровали через целит и удаляли растворитель. Заготовку затем очищали через небольшой блок силикагеля с использованием CH2Cl2. Растворитель удаляли и образующейся осадок смешивали с CH2Cl2-гексаном (1/9). После фильтрации продукт высушивали для выхода обозначенного соединения. 1 Н ЯМР (400 МГц, ацетон-d6):7,62 (2 Н, м), 7,39 (3 Н, м), 7,25 (1 Н, с), 7,15 (1 Н, д), 6,29 (1 Н, с) и 2,45 (3 Н, с). Этап 3: 7-(бромметил)-4-(4-фторфенил)-2 Н-хром-2-он Смесь 4-(4-фторфенил)-7-метил-2 Н-хром-2-он (24,0, 94,3 ммоль), NBS (18,5 г, 103,8 ммоль) и пероксида бензоила (1,14 г, 4,72 ммоль) в 470 мл CCl4 помещали кипятить с обратным холодильником. Раствор отставляли на всю ночь и затем горячим фильтровали. Один раз удаляли охлажденный до комнат- 18012704 ной температуры растворитель, смесь растворяли в CH2Cl2 и проводили очистку через небольшой блок силикагеля с использованием гексан-EtOAc от (8/2) до (1/1). Растворитель удаляли и растирали в порошок с гексан-EtOAc и фильтровали до получения обозначенного соединения. Оставшийся растворитель удаляли для получения дополнительной смеси загрязненной некоторым исходным материалом или смесью диброма. 1 Н ЯМР (400 МГц, ацетон-d6):7,67 (2 Н, м), 7,55 (1 Н, с), 7,50 (1 Н, д), 7,40 (3 Н, м), 6,40 (1 Н, с) и 4,75 (2 Н, с). Пример 1 В. 4-(4-Фторфенил)-7-[(5-[(1S)-2,2,2-трифтор-1-гидрокси-1-метилэтил]-1,3,4-оксадиазол 2-иламино)метил]-2 Н-хром-2-он. Этап 1: метил(2S)-3,3,3-трифтор-2-гидрокси-2-метилпропаноат К раствору (S)-3,3,3-трифтор-2-гидрокси-2-метилпропионовой кислоты (3,0 г, 17,4 ммоль) в 60 мл эфира добавили раствор диазометана в эфире до окрашивания в желтый цвет. Реакционную смесь далее смешивали 30 мин при комнатной температуре и сгущали до высушивания для получения обозначенного соединения. 1 Н ЯМР (400 МГц, ацетон-d6):5,67 (с, 1 Н), 3,85 (с, 3 Н), 1,57 (с, 3 Н). Этап 2: (2S)-3,3,3-трифтор-2-гидрокси-2-метилпропангидразид К раствору метил(2S)-3,3,3-трифтор-2-гидрокси-2-метилпропаноата (3,26 г, 19,0 ммоль) добавляли гидразинмоногидрат (2,1 мл). Смесь нагревали при 130 С в течение 90 мин и охлаждали до комнатной температуры. После выпаривания досуха осадок очищали на небольшом блоке силикагеля (100% EtOAc) для получения обозначенного соединения. Этап 3: (2S)-2-(5-амино-1,3,4-оксадиазол-2-ил)-1,1,1-трифторпропан-2-ол(17 мл) добавляли бромциан (1,87 г, 17,7 ммоль) и бикарбонат калия (1,82 г, 18,1 ммоль). Реакционную смесь смешивали 30 мин при комнатной температуре до образования белого осадка. Осадок фильтровали и отмывали водой с последующей смесью эфир-гексанов (1:1) до получения обозначенного соединения. 1 Н ЯМР (400 МГц, ацетон-d6):6,57 (шир. с, 2 Н), 6,20 (шир. с, 1 Н), 1,80 (с, 3 Н). Этап 4: 4-(4-фторфенил)-2-оксо-2 Н-хром-7-карбальдегид 7-(Бромметил)-4-(4-фторфенил)-2 Н-хром-2-он можно приготовить, как описано в примере 1 А; это получение также описаны в патенте US 5552437. 7-(Бромметил)-4-(4-фторфенил)-2 Н-хром-2-он (11,42 г,34,3 ммоль) и NMO (13,9 г, 102,8 ммоль) в 110 мл диоксана нагревали с обратным холодильником в течение 6 ч. Раствор охлаждали до комнатной температуры и растворитель удаляли. Сырую смесь разводили в EtOAc и отмывали NH4Claq, водой, соленой водой и высушивали MgSO4. Растворитель удаляли до выхода обозначенной смеси. 1 Н ЯМР (400 МГц, ацетонов):10,20 (1 Н, с), 7,95 (1 Н, с), 7,85 (1 Н, м), 7,68 (3 Н, м), 7,38 (2 Н, м) и 6,51 (1 Н, с). Этап 5: 4-(4-фторфенил)-7-[(5-[(1S)-2,2,2-трифтор-1-гидрокси-1-метилэтил]-1,3,4-оксадиазол-2 иламино)метил]-2 Н-хром-2-он Раствор предварительного альдегида (210 мг, 0,78 ммоль), (2S)-2-(5-амино-1,3,4-оксадиазол-2-ил)1,1,1-трифторпропан-2-ол (200 мг, 1,02 ммоль) и PPTS (20 мг, 0,08 ммоль) в 2 мл толуола нагревали с- 19012704 обратным холодильником с ловушкой Дина-Старка в течение 4 ч. Реакционную смесь охлаждали и выпаривали досуха. Далее добавляли сухой этанол (2 мл) и смесь охлаждали 0 С. Борогидрат натрия (30 мг,0,78 ммоль) добавляли и полученную смесь смешивали при 0 С в течение 30 мин. Реакционную смесь разделяли между водным NH4Cl и EtOAc. Органическую фазу отмывали солевым раствором, сушили безводным MgSO4, сгущали и очищали на колонке с силикагелем (хлороформ-этанол; 95:5) для получения обозначенного соединения. 1 Н ЯМР (400 МГц, ацетон-d6):7,65 (м, 2 Н), 7,5 (м, 3 Н), 7,39 (м, 3 Н), 6,35 (с, 1 Н), 6,22 (с, 1 Н), 4,70 К суспензии 5-метокси-2-метиланилина (5,00 г, 36,4 ммоль) в воде (144 мл) при 10 С добавили концентрированную H2SO4 (56 мл) до тех пор, пока сохраняется внутренняя температура ниже 25 С. После 1 ч при комнатной температуре смесь охлаждали до 3 С и раствор нитрит натрия (3,77 г, 54,7 ммоль) в воде (20 мл) добавили по каплям в течение 30 мин, держали внутреннюю температуру ниже 5 С. После 1 ч при 3 С в желтую гетерогенную смесь наливали 5 С раствор CuBr (52,0 г, 364 ммоль) в 48% водныйHBr (260 мл). Темную смесь нагревали при 60 С в течение 2 ч, охлаждали при комнатной температуре и выделяли с Et2O (3 х) (твердый Na2S2O3 добавили в процесс выделения для частичного обесцвечивания). Объединенные органические соединения промывали 1 N NaOH (3 х), 10% водным Na2S2O3 и солевым раствором, сушили (Na2SO4) и сгущали для получения обозначенного соединения, как оранжевую жидкость, которая использовалась в дальнейшем очищении в следующем этапе. 1 Н ЯМР (500 МГц, ацетон-d6):7,24 (д, 1 Н), 7,14 (д, 1 Н), 6,87 (дд, 1 Н), 3,80 (с, 3 Н), 2,31 (с, 3 Н). Этап 2: (4-бром-2-метокси-5-метилфенил) (4-фторфенил)метанон 4-Фторбензоил хлорид (1,40 мл, 11,9 ммоль) добавляли по каплям в суспензию AlCl3 (1,73 г,13,0 ммоль) в 1,2-дихлорэтане (30 мл) при комнатной температуре. После 15 мин раствор 3-бром-4 метиланизол (2,17 г, 10,8 ммоль) в 1,2-дихлорэтане (3 мл) добавляли по каплям. Получившуюся смесь смешивали в течение 2 ч, наливали 200 мл ледяной воды, смешивали в течение 20 мин и выделяли сCHCl3 (3 х). Объединенные органические соединения промывали 5% водным NaHCO3, солевым раствором, сушили (Na2SO4) и сгущали. Остаток подвергали хроматографии с силикагелем (EtOAc - гексан,5:95), получая обозначенное соединение. 1 Н ЯМР (400 МГц, ацетон-d6):7,86 (м, 2 Н), 7,38 (с, 1 Н), 7,31-7,26 (м, 3 Н), 3,76 (с, 3 Н), 2,39 (с, 3 Н). Этап 3: (4-бром-2-гидрокси-5-метилфенил) (4-фторфенил)метанон(6 мл) добавляли в течение 10 мин при 0 С к раствору BBr3 (1,05 мл, 11,1 ммоль) в таком же растворителе (14 мл), и полученную смесь смешивали при 0 С. После 1,5 ч в реакционную смесь наливали 200 мл холодной воды, энергично смешивали в течение 10 мин и выделяли с CHCl3 (3 х). Объединенные органические экстракты промывали водой и солевым раствором, сушили (Na2SO4) и сгущали, получая обозначенное соединение. 1 Н ЯМР (500 МГц, ацетон-d6):11,46 (с, 1 Н), 7,88 (м, 2 Н), 7,58 (с, 1 Н), 7,37 (м, 2 Н), 7,32 (с, 1 Н),2,34 (с, 3 Н). Этап 4: 7-бром-4-(4-фторфенил)-6-метил-2 Н-хром-2-он(4-Бром-2-гидрокси-5-метилфенил)(4-фторфенил)метанон (1,61 г, 5,21 ммоль) и метил(трифенилфосфоранилидин)ацетат (2,26 г, 6,77 ммоль) нагревали в нагревателе с обратным холодильником толуолом (15 мл) в течение 24 ч. Реакционную смесь охлаждали до комнатной температуре и сгущали. Полученный желтый осадок помещали в хроматографическую колонку с силикагелем (EtOAc-толуол, 0 до 2%), получая обозначенное соединение. 1 Н ЯМР (500 МГц, ацетон-d6):7,70 (с, 1 Н), 7,66 (м, 2 Н), 7,46 (с, 1 Н), 7,39 (м, 2 Н), 6,39 (с, 1 Н), 2,40DMSO (17 мл) и Et3N (0,828 мл, 5,94 ммоль) последовательно добавляли к суспензии 7-бром-4-(4 фторфенил)-6-метил-2 Н-хром-2-она (0,990 г, 2,97 ммоль) и Pd(dppf)Cl2CH2Cl2 (0,485 г, 0,594 ммоль) в МеОН (10 мл). Смесь нагревали при 65 С под давлением окиси углерода в течение 18 ч. Реакционную смесь охлаждали до комнатной температуре, наливали в воду (200 мл) и выделяли с CHCl3 (3 х). Объединенные органические экстракты промывали водой и солевым раствором, сушили (Na2SO4) и сгущали. Остаток разделяли на хроматографической колонке с силикагелем (EtOAc-толуол, от 3 до 5%), получая обозначенное соединение. 1 Н ЯМР (500 МГц, ацетон-d6):7,85 (с, 1 Н), 7,69 (м, 2 Н), 7,44 (с, 1 Н), 7,40 (м, 2 Н), 6,47 (с, 1 Н), 3,94THF (23 мл) добавляли 1 N раствор LiOH (11,6 мл, 11,6 ммоль), и смесь нагревали до 65 С в течение 16 ч. При комнатной температуре смесь нейтрализовали 1 N HCl и сгущали. Остаток смешивали с THF(25 мл) и 2 N HCl (50 мл) в течение 16 ч. Произведенный осадок собирали фильтрацией, промывали водой и сушили, получая обозначенное соединение, которое использовали без дальнейшей очистки. 1 Н ЯМР (500 МГц, ацетон-d6):13,40 (шир. с, 1 Н), 7,80 (с, 1 Н), 7,64 (м, 2 Н), 7,44 (м, 2 Н), 7,32 (с,1 Н), 6,54 (с, 1 Н), 2, 48 (с, 3 Н). Этап 7: 4-(4-фторфенил)-7-(гидроксиметил)-6-метил-2 Н-хром-2-он Изобутилхлорформат (0,775 мл, 5,97 ммоль) добавляли по каплям к 4-(4-фторфенил)-6-метил-2 оксо-2 Н-хром-7-карбоновой кислоте (0,594 г, 1,99 ммоль) и Et3N (1,11 мл, 7,96 ммоль) в THF (13 мл) при 0 С. Спустя 1 ч быстро добавили свежеприготовленный раствор NaBH4 0,377 г, 9,96 ммоль) в воде (10 мл). Реакционную смесь смешивали при 0 С в течение 1 ч, быстро охлаждали, используя NH4Cl и выделяли с EtOAc (3 х). Объединенные органические экстракты промывали 1 N HCl, 5% NaHCO3 и солевым раствором, сушили (Na2SO4) и сгущали. Остаток разделяли на хроматографической колонке с силикагелем (EtOAc-CHCl3, 30:70, затем 35:65, затем 40:60), получая обозначенное соединение. 1 Н ЯМР (400 МГц, ацетон-d6):7,65 (м, 2 Н), 7,53 (с, 1 Н), 7,38 (м, 2 Н), 7,26 (с, 1 Н), 6,30 (с, 1 Н), 4,76 4-(4-Фторфенил)-7-(гидроксиметил)-6-метил-2 Н-хром-2-он (0,487 г, 1,71 ммоль) в CH2Cl2 (350 мл) смешивали с активированным MnO2 (2,23 г, 25,7 ммоль) в течение 65 ч при комнатной температуре. Реакционную смесь фильтровали через прокладку целита и фильтрат сгущали, получая обозначенное соединение. 1 Н ЯМР (500 МГц, ацетон-d6):10,40 (с, 1 Н), 7,86 (с, 1 Н), 7,70 (м, 2 Н), 7,46 (с, 1 Н), 7,42 (м, 2 Н),6,53 (с, 1 Н), 2, 66 (с, 3 Н). Этап 9: 4-(4-фторфенил)-7-[(5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2 иламино)метил]-6-метил-2 Н-хром-2-он В круглодонной колбе, приготовленной с охладителем, и ловушкой Дина-Старка, 4-(4-фторфенил)6-метил-2-оксо-2 Н-хром-7-карбальдегид (0,357 г, 1,26 ммоль) и 2-(5-амино-1,3,4-оксадиазол-2-ил)-1,1,1 трифторбутан-2-ол (0,32 г, 1,52 ммоль) нагревали в нагревателе с обратным холодильником толуолом (8 мл) в течение 2 ч в присутствие пиридиний р-толуолсульфоната (32 мг, 0,126 ммоль). Смесь оставляли охлаждаться при комнатной температуре и сгущали досуха. Остаток растворяли в EtOH (6 мл), охлаждали до 0 С и добавляли NaBH4 (48,0 мг, 1,26 ммоль). После 15 мин при 0 С реакцию быстро охлаждали сsat. NH4Cl и выделяли с EtOAc (3 х). Объединенные органические экстракты промывали водой и солевым раствором, сушили (Na2SO4) и сгущали. Остаток разделяли на хроматографической колонке с силикагелем (EtOH-CHCl3, от 3 до 4%), получая обозначенное соединение. 1 Н ЯМР (500 МГц, ацетон-d6):7,66 (м, 2 Н), 7,46 (шир. с, 2 Н), 7,39 (м, 2 Н), 7,33 (с, 1 Н), 6,32 (с, 1 Н),6,09 (шир. с, 1 Н), 4,68 (д, 2 Н), 2,41 (с, 3 Н), 2,24 (м, 1 Н), 2,10 (м, 1 Н), 1,00 (т, 3 Н). Пример 3. 7-(2-[5-(1-Этил-1-гидроксипропил)-1,3,4-тиадиазол-2-ил]аминоэтил)-4-(4-фторфенил)2 Н-хром-2-он Этап 1: 3-(5-амино-1,3,4-тиадиазол-2-ил)пентан-3-ол(200 мл, 0,1 М) добавляли сначала н-бутиллитий 1,6 М гексан (30,9 мл, 49,4 мМ), а спустя 15 мин хлортриметилсилан (6,27 мл, 49,4 мМ). Температуру повышали до -20 С в течение 15 мин и охлаждали обратно до -78 С. Еще н-бутиллитий 1,6 М гексан (15,45 мл, 2 4,72 ммоль) добавляли после 15 мин 3 пентанон (2,62 мл, 24,72 ммоль). Раствор после этого нагревали при комнатной температуре (всю ночь). Реакционную смесь быстро охлаждали насыщенным раствором NH4Cl, и THF удаляли под действием вакуума. Водную фазу выделяли с EtOAc (3 х), и объединенные органические слои отмывали солевым раствором, сушили MgSO4 и сгущали. Полученный исходный остаток очищали на хроматографической колонке (100% EtOAc), получая обозначенное соединение. 1 Смесь 3-(5-амино-1,3,4-тиадиазол-2-ил)пентан-3-ола (0,129 г, 0,689 ммоль), 4-(4-фторфенил)-2- 22012704 оксо-2 Н-хром-7-карбальдегида (0,200 г, 0,746 ммоль) и уксусной кислоты (1,94 мкл, 0,138 ммоль) в бензоле (2,5 мл) смешивали всю ночь при нагревании с обратным холодильником с ловушкой Дина-Старка. После охлаждения смесь растворяли в THF (5 мл) и добавляли натрий триацетоксиборгидрид (0,731 г,3,45 ммоль). Смесь затем смешивали при 45 С в течение 3 ч. Реакцию быстро охлаждали насыщенным раствором NaHCO3 и разделяли между EtOAc и водой. Органический слой сушили MgSO4, фильтровали и сгущали. Полученный исходный остаток очищали на хроматографической колонке (Гексан-EtOAcMeOH, 50:50:0 до 0:98:2) получая обозначенное соединение. 1 Н ЯМР (400 МГц, ацетон-d6):8,7 (м, 2 Н), 7,5 (с, 1 Н), 7,45 (с, 1 Н), 7,4 (м, 3 Н), 6,35 (с, 1 Н), 4,75 (с,2 Н), 4,5 (шир. с, 1 Н), 2,0-1,75 (м, 4 Н), 0,9 (т, 6 Н). Пример 4. 7-([5-(1-Этил-1-фторпропил)-1,3,4-оксадиазол-2-ил]аминометил)-4-(4-фторфенил)-2 Нхром-2-он. Этап 1 а: 3-(5-амино-1,3,4-оксадиазол-2-ил)пентан-3-ол К раствору этилбромида магния (200 ммоль) в 300 мл THF при 0 С добавляли суспензию этил 5 амино-1,3,4-оксадиазол-2-карбоксилата (8,00 г, 50,9 ммоль; Chemical Abstract, 1966, 64, 3558 а) в THF. Реакционную смесь доводили до комнатной температуры и после 30 мин быстро охлаждали с NH4Cl. После выделения с EtOAc и высушивания MgSO4 растворитель удаляли. Заготовку, полученную таким образом, растирали в порошок, фильтровали и сушили, получая обозначенное соединение. Этап 1b: 3-(5-амино-1,3,4-оксадиазол-2-ил)пентан-3-ол Смесь метил 2-этил-2-гидроксибутаноата (19,7 г, 134,7 М) и гидрата гидразина (14 мл) нагревали до 130 С в течение 4 ч. Смесь охлаждали при комнатной температуре, и остаток реагента удаляли под действием вакуума до выхода гидразида. Этот гидразид и KHCO3 (13,8 г, 138 ммоль) в 150 мл воды добавляли частями BrCN (13,8 г, 131 ммоль). После 90 мин смешивания белое твердое тело фильтровали, промывали с эфиром и сушили, получая обозначенное соединение. 1 Н ЯМР (400 МГц, ацетон-d6):6,20 (шир. с, 2 Н), 4,25 (с, 1 Н), 1,85 (м, 4 Н), 0,88 (т, 6 Н). Этап 2: 7-([5-(1-этил-1-гидроксипропил)-1,3,4-оксадиазол-2-ил]аминометил)-4-(4-фторфенил)-2 Нхром-2-он Смесь 3-(5-амино-1,3,4-оксадиазол-2-ил)пентан-3-ола (0,446 г, 2,6 ммоль) и 4-(4-фторфенил)-2 оксо-2 Н-хром-7-карбальдегида (0,350 г, 1,3 ммоль) в 5 мл толуола нагревали с обратным холодильником с ловушкой Дина-Старка всю ночь. После охлаждения при комнатной температуре растворитель удаляли и исходный имин разводили в этаноле (8 мл) при 0 С. Твердый NaBH4 (49 мг) добавляли в раствор и после 30 мин помешивания добавляли водный NH4Cl для разрушения избыточного гидрида. После разведения EtOAc-солевым раствором, органическую фазу сушили с MgSO4. Очищали на силикагеле с толуол-EtOAc (2:8), получая обозначенное соединение. 1 Н ЯМР (400 МГц, ацетон-d6):7,67 (м, 2 Н), 7,48 (м, 2 Н), 7,37 (м, 3 Н), 7,19 (шир. т, 1 Н), 6,33 (с,1 Н), 4,66 (м, 2 Н), 4,31 (с, 1 Н), 1,85 (м, 4 Н), 0,85 (т, 6 Н). Этап 3: 7-([5-(1-этил-1-фторпропил)-1,3,4-оксадиазол-2-ил]аминометил)-4-(4-фторфенил)-2 Нхром-2-он Раствор имина, полученный в предыдущем этапе (270 мг, 0,641 ммоль), в CH2Cl2 добавляли по каплям в раствор (диэтиламино) серный трифторида (100 мкл, 0,77 ммоль) в CH2Cl2, предварительно охлажденный до -78 С. Раствор смешивали при -78 С 5 мин и нагревали до комнатной температуры. Спустя 40 мин при комнатной температуре реакционную смесь быстро фильтровали в растворе NaBH4 (0,20 г,5,3 ммоль) в EtOH (10 мл), и энергично смешивали при комнатной температуре 5 мин. Реакционную смесь разделяли между EtOAc и насыщенным водным раствором NH4OAc/NaCl. Фазы разделяли и вод- 23012704 ную фазу выделяли с EtOAc. Объединенные органические фазы сушили на безводном MgSO4, фильтровали и сгущали в вакууме. Остаток хроматографировали на силикагеле (20-60% EtOAc/гексан), получая обозначенное соединение. 1 Н ЯМР (400 МГц, ацетон-d6):7,60-7,67 (м, 2 Н), 7,43-7,52 (м, 3 Н), 7,34-7,40 (м, 3 Н), 6,32 (с, 1 Н),4,68 (д, 2 Н), 1,95-2,17 (м, 4 Н), 0,91 (т, 6 Н). Пример 5. 7-(1-[5-(1-Этил-1-гидроксипропил)-1,3,4-оксадиазол-2-ил]аминоэтил)-4-(4-фторфенил)-2 Н-хром-2-онTHF при -90 С добавляли метилмагний бромид (0,79 ммоль). Реакционную смесь доводили до 0 С и охлаждали с NH4Cl. После выделения с EtOAc высушивали с MgSO4 и выпаривали, сырьевой материал очищали на силикагеле с толуол-EtOAc (2:8), получая обозначенное соединение. 1 Н ЯМР (400 МГц, ацетон-d6):7,66 (м, 2 Н), 7,35-7,52 (м, 5 Н), 7,19 (д, 1 Н), 6,33 (с, 1 Н), 4,95 (м, 1 Н),4,23 (с, 1 Н), 1,72 (м 4 Н), 1,63 (д, 3 Н), 0,80 (м, 6 Н). Пример 6 А. 7-Бром-4-пиридин-3-ил-2 Н-хром-2-он можно получать, как указано дальше. Коммерчески доступный 7-гидрокси-4-(3-пиридил)кумарин (1,48 г, 6,19 ммоль) и трифенилфосфиндибромид (5,22 г, 12,4 ммоль) нагревали в песочной ванне при 320-350 С в течение 1,5 ч. Охлажденный осадок поглощался этанолом (200 мл) и силикагелем (100 г), и испарялся досуха. Хроматографическая колонка (толуол/ацетон; 80:20) приводила к получению 7-бром-4-пиридин-3-ил-2 Н-хром-2-она. Пример 6 В. 7-(5-[Дициклопропил(гидроксил)метил]-1,3,4-тиадиазол-2-илтио)-4-пиридин-3-ил 2 Н-хром-2-он. Этап 1: этил(метилтио)(тиоксо)ацетат К смеси серы (5,23 г, 163 ммоль) в DMF (100 мл) добавляли триэтиламин (34,1 мл, 245 ммоль) и этилхлорацетат (10 г, 81,6 ммоль). После 3,5 ч йодометан (5,59 мл, 89,8 ммоль) добавляли и смесь смешивали 1 ч при комнатной температуре. Добавляли Et2O-вода и разделяли органические слои. Органическую фазу промывали водой (3 х), солевым раствором, сушили до полного обезвоживания Na2SO4 и растворитель удаляли до образования обозначенного соединения, которое использовалось без дальнейшей очистки в следующем этапе. 1 Н ЯМР (400 МГц, ацетон-d6): 4,38 (кв., 2 Н), 2,72 (с, 3 Н), 1,34 (т, 3 Н). Этап 2: этил 5-меркапто-1,3,4-тиадиазол-2-карбоксилат Этил(метилтио)(тиоксо)ацетат (20,0 г, 122 ммоль) и калий гидразинкарбодитиоат (R.S. Drago et al.,JACS (1983) 105, 2287) (17,8 г, 122 ммоль) нагревали с обратным холодильником всю ночь с этанолом(500 мл). Раствор сгущали и добавляли EtOAc. Органическую фазу промывали 1 М HCl, солевым раствором и сушили до полного обезвоживания Na2SO4. Растворитель испаряли и остаток очищали на силикагеле (гексан-ацетон, 80:20) до образования обозначенного соединения. 1 Н ЯМР (400 МГц, ацетонов): 4,43 (кв., 2 Н), 1,38 (т, 3 Н). Этап 3: дициклопропил(5-меркапто-1,3,4-тиадиазол-2-ил)метанол К раствору циклопропилмагнийбромида (37 мл, 0,5 M/THF, 18,4 ммоль) при 0 С медленно добавляли THF раствор этил 5-меркапто-1,3,4-тиадиазол-2-карбоксилата (1 г, 5,3 ммоль). Когда половину раствора добавили, охлаждающую ванну удалили и добавили остальную часть раствора. Смесь смешивали при комнатной температуре в течение 4 ч, затем разделяли между водными NH4Cl и Et2O. Слои разделяли и водяную фазу выделяли с Et2O. Объединенные органические слои промывали соляным раствором и- 24012704 сушили до полного обезвоживания Na2SO4. Растворитель испаряли и остаток хроматографировали на силикагеле (гексан:ацетон, 95:5) до образования обозначенного соединения. 1KOH (0,089 г, 1,59 ммоль) добавляли в раствор дициклопропил(5-меркапто-1,3,4-тиадиазол-2 ил)метанол (0,363 г, 1,60 ммоль) в сухой МеОН. Когда получили раствор, реакционную смесь сгущали досуха. Затем добавляли сухой толуол, и смесь сгущали досуха снова. Остаток растворяли в NMP, 7 бром-4-пиридин-3-ил-2 Н-хром-2-он (400 мг, 1,32 ммоль) добавляли и итоговую смесь смешивали при 120 С в течение 16 ч. Реакционную смесь охлаждали и разделяли между водными NH4OAc и EtOAc. Органическую фазу промывали солевым раствором, сушили до обезвоживания Na2SO4, сгущали и очищали на силикагелевой колонке (толуол-ацетон, 90:10 до 70:30) до образования обозначенного соединения. 1 Н ЯМР (400 МГц, ацетон-d6):8,82 (д, 1 Н), 8,72 (с, 1 Н), 7,81 (дт, 1 Н), 7,64 (с, 1 Н), 7,58-7,50 (м,1 Н), 7,48-7,41 (м, 2 Н), 6,46 (с, 1 Н), 2,57 (с, 1 Н), 1,40-1,31 (м, 2 Н), 0,69-0,57 (м, 6 Н), 0,50-0,44 (м, 1 Н). Пример 7. (+) и (-)-4-(4-Фторфенил)-7-[(5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол 2-иламино)метил]-2 Н-хром-2-он. Этап 1: этил 2-гидрокси-2-(трифторметил)бутануат К -78 С раствору этил трифторпирувата (129,0 г 758 ммоль) в эфире добавляли по каплям 90 мин раствор EtMgBr 3,0 М в эфире (252 мл). Раствор наносили в течение 1 ч на са. -10 С и переливали 2 л насыщенного NH4Cl. Слои разделяли и водную фазу выделяли эфиром (3500 мл). Объединенные органические фазы сушили MgSO4, и удаляли растворитель. Перегоняли при 50-65 С (30 мм Hg) до образования обозначенного соединения. 1 Н ЯМР (400 МГц, ацетон-d6):5,4 (с, 1 Н), 4,35 (кв., 2 Н), 2,07 (м, 1 Н), 1,83 (м, 1 Н), 1,3 (т, 3 Н) и 0,93 Этиловый эфир из этапа 1 (50,04 г, 250 ммоль) и гидрат гидразина (25,03 г, 50 ммоль) нагревали до 80 С на 18 ч. Остаток гидразина удаляли под действием вакуума, и заготовку фильтровали через подушку силикагеля с EtOAc-гексаном (са. 3 л) до образования обозначенного соединения. 1 Н ЯМР (400 МГц, ацетон-d6):9,7 (с, 1 Н), 6,10 (с, 1 Н), 2,25 (м, 1 Н), 1,85 (м, 1 Н) и 0, 95 т, (3 Н). Этап 3: 2-(5-амино-1,3,4-оксадиазол-2-ил)-1,1,1-трифторбутан-2-ол К гидразиду (34,07 г, 183 ммоль) из этапа 2 в 275 мл воды добавляли KHCO3 (18,33 г, 183 ммоль) после BrCN (19,39 г, 183 ммоль) частями. После 3 ч твердую фазу фильтровали, промывали с холодной водой и сушили до образования обозначенного соединения. Добавочное соединение может восстанавливаться в водной фазе при экстракции (эфир-гексан, 1:1). 1 Н ЯМР (400 МГц, ацетон-d6):6,54 (с, 2 Н), 6,01 (с, 1 Н), 2,22 (м, 1 Н), 2,08 (м, 1 Н) и 0,99 (м, 3 Н). Этап 4: 4-(4-фторфенил)-7-[(5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2 иламино)метил]-2 Н-хром-2-он Смесь оксадиазола (14,41 г, 68,2 ммоль) из этапа 3 и 4-(4-фторфенил)-2-оксо-2 Н-хром-7- 25012704 карбальдегида (14,1 г, 52,5 ммоль) в толуоле (160 мл) с 10% PPTS доводили до кипения с обратным холодильником и запустили на всю ночь. Система оборудовалась ловушкой Дина-Старка для сбора воды. Растворитель удаляли и полученное неочищенное масло (1 Н ЯМР (400 МГц, ацетон-d6):9,33 (1 Н, с,имин разбавляли в EtOH (ca. 75 мл) при 0 С. К этому раствору добавляли NaBH4 (1,9 г) частями и реакцию быстро охлаждали раствором NH4Cl через 45 мин. Смесь насыщали с NaCl и выделяли с EtOAc(3200 мл). Органические фазы объединяли и сушили с MgSO4. Очистка путем хроматографии на силикагеле с использованием толуол-EtOAc (55:45) приводила к образованию обозначенного соединения. 1 Н ЯМР (400 МГц, ацетон-d6):7,65 (м, 2 Н), 7,50 (м, 3 Н), 7,38 (м, 3 Н), 6,35 (с, 1 Н), 6,06 (с, 1 Н), 4,70(м, 2 Н), 2,21 (м, 1 Н), 2,11 (м, 1 Н) и 0,98 (т, 3 Н). Этап 5: разделение на хиральной HPLC колонке (+) и (-) энантиомеров 4-(4-фторфенил)-7-[(5-[1 гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-иламино)метил]-2 Н-хром-2-онаAD(R) препаративную (5 см 50 см) HPLC колонку (элюировали с EtOH/гексан, 30/70 с УФ определением при 280 нм). Энантиомеры разделяли с быстрым элюированием энантиомера, имеющего время удерживания 34 мин для (-)-энантиомера, и медленное элюирование энантиомера, имеющего время удерживания 49 мин для (+)-энантиомера. Пример 8. 4-(4-Фторфенил)-7-[5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2 ил(метил)амино]метил-2 Н-хром-2-он. Этап 1: 4-(4-фторфенил)-7-[5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2 ил(метил)амино]метил-2 Н-хром-2-он(-) изомер 4-(4-фторфенил)-7-[(5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2 иламино)метил]-2 Н-хром-2-она (0,100 г, 0,22 ммоль), метил йодид (2 мл) и K2CO3 (0,061 г 0,44 ммоль) нагревали до 50 С до исчезновения исходного материала. Смесь охлаждали при комнатной температуре и разводили EtOAc-вода. Органический слой разделяли, сушили и удаляли растворитель. Очистка на силикагеле (толуол-ацетон, 8:2) приводила к образованию обозначенного соединения. 1 Н ЯМР (400 МГц, ацетон-d6):7,68 (м, 2 Н), 7,51 (д, 1 Н), 7,48 (с, 1 Н), 7,39 (м, 3 Н), 6,49 (с, 1 Н), 6,32 Этап 1: 7-бром-4-(1-этоксивинил)-2 Н-хром-2-он. К раствору 7-бром-4-трифторметансульфонилоксикумарина (5,1 г, 13,7 ммоль) в диоксане добавляли трибутил(1-этоксивинил)тин (4,8 мл, 14,2 ммоль), (Ph3P)4Pd (0,7 90 г, 0,7 ммоль) и LiCl (1,74 г,41 ммоль). Смесь нагревали с обратным холодильником в течение 4 ч, охлаждали и разделяли между водной NH4Cl и EtOAc. Слои разделяли и водную фазу экстрагировали с EtOAc. Объединенные органические слои отмывали солевыми растворами и сушили безводным Na2SO4. Растворитель испаряли и остаток хроматографировали на силикагеле (CH2Cl2/EtOAc; 95:5) и измельчали в гексан/Et2O, что приводило к образованию обозначенного соединения. Этап 2: 7-бром-4-(бромацетил)-2 Н-хром-2-он. К раствору 7-бром-4-(1-этоксивинил)-2 Н-хром-2-она (2,0 г, 6,8 ммоль) в THF и Н 2 О добавляли Nбромсукцинимид (1,3 г, 14,2 ммоль) с помешиванием в течение 30 мин. Толуол добавляли и растворитель выпаривали. Остаток хроматографировали на силикагеле (гексан/EtOAc; 80:20), что приводило к образованию обозначенного соединения.- 26012704 Этап 3: 7-бром-4-(2-метил-1,3-тиазол-4-ил)-2 Н-хром-2-он. К раствору 7-бром-4-(бромацетил)-2 Н-хром-2-она (0,605 г, 1,7 ммоль) в DMF добавляли тиоацетамид (0,138 г, 1,8 ммоль). Смесь смешивали 24 ч при комнатной температуре и при 100 С оставляли на ночь. Охлаждали один раз при комнатной температуре, разделяли между водной NH4Cl и EtOAc. Слои разделяли и водную фазу экстрагировали с EtOAc. Общие органические слои промывали солевым раствором и сушили на безводном Na2SO4. Растворитель выпаривали и остаток разделяли с гексаген/Et2O,что приводило к образованию обозначенного соединения. Пример 9 В. 7-[(5-[1-Гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-иламино) метил]-4(2-метил-1,3-тиазол-4-ил)-2 Н-хром-2-он. Этап 1: метил 4-(2-метил-1,3-тиазол-4-ил)-2-оксо-2 Н-хром-7-карбоксилат К раствору 7-бром-4-(2-метил-1,3-тиазол-4-ил)-2 Н-хром-2-она (1,17 г, 3,63 ммоль) в DMSO (21 мл) и метанол (12 мл) добавляли триэтиламин (1,0 мл, 7,26 ммоль) и [Pd(dppf)Cl2]2-CH2Cl2 (0,593 г,0,73 ммоль). Реакционную смесь смешивали всю ночь при 65 С в сосуде с окисью углерода. После охлаждения при комнатной температуре реакционную смесь разводили EtOAc-CH2Cl2 (9:1), промывали водой(3 х) и солевым раствором. Органическую фазу сушили посредством MgSO4 и выпаривали досуха. Остаток очищали на силикагеле (гексан -EtOAc, 8:2), что приводило к образованию обозначенного соединения. 1 Н ЯМР (400 МГц, ацетон-d6):8,45 (м, 1 Н), 8,12 (с, 1 Н), 7,92 (м, 2 Н), 6,80 (с, 1 Н), 3, 97 (с, 3 Н), 2,85THF (33 мл) добавляли гидроксид лития 1 М (16,6 мл, 16,6 ммоль). Реакцию нагревали при 65 С в течение 90 мин, охлаждали при комнатной температуре и испаряли. Раствор HCl 2N затем добавляли к остатку и смесь смешивали в течение 1 ч. Порошок фильтровали, что приводило к образованию обозначенного соединения. 1 Н ЯМР (400 МГц, DMSO-d6):8,37 (м, 1 Н), 8,28 (с, 1 Н), 7,87 (м, 2 Н), 6,85 (с, 1 Н), 2,80 (с, 3 Н). Этап 3: 7-(гидроксиметил)-4-(2-метил-1,3-тиазол-4-ил)-2 Н-хром-2-он(0,94 мл, 7,23 ммоль) каждые 15 мин. Реакционную смесь смешивали при 0 С в течение 1 ч и добавляли борогидрид натрия (0,456 г, 12,0 ммоль) в воде (12 мл). Реакционную смесь смешивали 1 ч при 0 С, быстро охлаждали раствором NH4Cl и экстрагировали с EtOAc. Органическую фазу отмывали солевым раствором, повторно сушили MgSO4 и выпаривали досуха. Остаток очищали хроматографией на силикагелеCH2Cl2 (7 мл) добавляли MnO2 (1,85 г, 21,2 ммоль) и смешивали при комнатной температуре 4 ч. Добав- 27012704 ляли вторую часть MnO2 (1,85 г, 21,2 ммоль) и через 3 ч реакционную смесь фильтровали на целите, выпаривали досуха и очищали тритурацией в CH2Cl2-MeOH (9:1), что приводило к образованию обозначенного соединения. 1 Н ЯМР (400 МГц, ацетон-d6):10,12 (с, 1 Н), 8,45 (м, 1 Н), 8,31 (с, 1 Н), 7,95 (с, 1 Н), 7,85 (м, 1 Н), 6,9 К раствору 4-(2-метил-1,3-тиазол-4-ил)-2-оксо-2 Н-хром-7-карбальдегида (0,200 г, 0,74 ммоль) и 2(5-амино-1,3,4-оксадиазол-2-ил)-1,1,1-трифторбутан-2-ола (0,202 г, 0,96 ммоль) в толуоле (2 мл) добавляли PPTS (0,019 г, 0,07 ммоль). Реакционную смесь нагревали с обратным холодильником с ловушкой Дина-Старка в течение 6 ч. После выпаривания остаток разводили в EtOH (2 мл), охлаждая до 0 С и добавляли борогидрид натрия (28 мг, 0,74 ммоль). Через 15 мин реакцию резко охлаждали насыщенным раствором NH4Cl, экстрагировали с EtOAc, затем промывали водой и солевым раствором. Растворитель испаряли и остаток хроматографировали на силикагеле (хлороформ-этанол, 95:5), что приводило к образованию обозначенного соединения. 1 Н ЯМР (400 МГц, ацетон-d6):8,27 (д, 1 Н), 8,09 (с, 1 Н), 7,45 (м, 3 Н), 6,66 (с, 1 Н), 6,08 (с, 1 Н), 4,7(д, 2 Н), 2,83 (с, 3 Н), 2,22 (м, 1 Н), 2,10 (м, 1 Н), 0,98 (м, 3 Н). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее структурную формулу IR3 выбирают из группы, состоящей из -Н, -С 1-6 алкила, -C1-6 алкила, замещенного одним или несколькими фторами, -C1-6 алкила, замещенного R9, -С 2-6 алкенила, -С 3-6 циклоалкила, -С 5-7 циклоалкенила иR4 выбирают из группы, состоящей из -Н, -C1-6 алкила, -C1-6 алкила, замещенного одним или несколькими фторами, -C1-6 алкила, замещенного R9, -С 2-6 алкенила, -С 3-6 циклоалкила, -С 5-7 циклоалкенила и-Z; или R3 и R4 вместе представляют оксо; или R3 и R4 связываются с углеродом, к которому они присоединяются для образования кольца, выбранного из группы, состоящей из -С 3-6 циклоалкилового кольца и -С 5-7 циклоалкенилового кольца, обеспечивающего при связывании R3 и R4 с углеродом, к которому они присоединяются для образования С 5-7 циклоалкенилового кольца, без двойной связи в С-1 положении кольца; или R2, R3 и R4 связаны с углеродом, к которому они присоединяются для образования циклоалкенилового кольца, выбранного из иR13 отсутствует или выбирают из группы, состоящей из (i) -F, (ii) -Cl, (iii) -C1-3 алкила, необязательно замещенного одним или несколькими гало, (iv) -OC1-3 алкила, необязательно замещенного одним или несколькими гало, (v) -ОС 3-6 циклоалкила, (vi) -СН 2 ОН, (vii) -COOR1, (viii) -CN и (ix) -NR10R11;(a) 5-членного ароматического кольца, содержащего (i) один или несколько атомов углерода, (ii) один гетероатом, выбранный из кислорода и серы, и (iii) ноль, один, два или три атома азота,(b) 5-членного ароматического кольца, содержащего один или несколько атомов углерода и от одного до четырех атомов азота,(c) 6-членного ароматического кольца, содержащего углеродные атомы и один, два или три атома азота;(e) -СН 2-фенила и -СН 2-диоксоланила,и где Z представлен дополнительно моно- или дизамещенным заместителем, независимо выбранным в каждом случае из группы, состоящей из (i) -F, (ii) -Cl, (iii) -C1-3 алкила, необязательно замещенного одним или несколькими гало, (iv) -OC1-3 алкила, необязательно замещенного одним или несколькими гало, (v) -ОС 3-6 циклоалкила, (vi) -CH2OH, (vii) -COOR1, (viii) -CN и (ix) -NR10R11; и его фармацевтически приемлемые соли, эфиры и сольваты. 2. Соединение по п.1, выбранное из группы, состоящей из 4-(4-фторфенил)-7-[5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2 ил(изопропил)амино]метил-2 Н-хром-2-она;N-[5-(1-этил-1-гидроксипропил)-1,3,4-оксадиазол-2-ил]-N-[4-(4-фторфенил)-2-оксо-2 Н-хром-7- 29012704 ил]метилацетамида; и его фармацевтически приемлемые соли. 3. Соединение по п.1, выбранное из группы, состоящей из 4-(4-фторфенил)-7-[(5-[(1S)-2,2,2-трифтор-1-гидрокси-1-метилэтил]-1,3,4-оксадиазол-2 иламино)метил]-2 Н-хром-2-она; 7-([5-(1-этил-1-гидроксипропил)-1,3,4-оксадиазол-2-ил]аминометил)-4-(3-фторфенил)-2 Н-хром-2 она; 4-(4-фторфенил)-7-[(5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2-иламино)метил]2 Н-хром-2-она;(-)-4-(4-фторфенил)-7-[(5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2 иламино)метил]-2 Н-хром-2-она; и его фармацевтически приемлемые соли. 4. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель. 5. Соединение 4-(4-фторфенил)-7-[(5-[(1S)-2,2,2-трифтор-1-гидрокси-1-метилэтил]-1,3,4 оксадиазол-2-иламино)метил]-2 Н-хром-2-он и его фармацевтически приемлемые соли. 6. Соединение (-)-4-(4-фторфенил)-7-[(5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2 ил(метил)амино)метил]-2 Н-хром-2-он и его фармацевтически приемлемые соли. 7. Соединение (-)-4-(4-фторфенил)-7-[(5-[1-гидрокси-1-(трифторметил)пропил]-1,3,4-оксадиазол-2 иламино)метил]-2 Н-хром-2-он и его фармацевтически приемлемые соли. 8. Соединение по п.1, гдеR4 представляет собой СН 3, -СН 2 СН 3, -C1-2 алкил, замещенный фтором, циклопропил и-СН 2 СООС 1-4 алкил,и его фармацевтически приемлемые соли.
МПК / Метки
МПК: A61K 31/4245, A61K 31/433, C07D 413/12, C07D 417/12, A61P 19/02
Метки: соединения, новые, фармацевтические
Код ссылки
<a href="https://eas.patents.su/30-12704-novye-farmacevticheskie-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Новые фармацевтические соединения</a>
Предыдущий патент: Производные пиримидина и их применение в качестве модуляторов cb2
Следующий патент: Проппант и способ его получения
Случайный патент: Способ и устройство для сжижения природного газа