Ингибиторы каспазы, содержащие изоксазолиновый цикл
Номер патента: 12080
Опубликовано: 28.08.2009
Авторы: Ли Сун-Хва, Чанг Хие-Киунг, Квон Тае-Сик, Шин Хиун-Ик, Дзеонг Хее-Киунг, Ли Киу-Воонг, Ким Ае Ри, Ким Хо-Дзун, Ли Тае-Соо, Парк Тае-Кио, Ли Санг-Киун, Дзанг Йонг-Дзин, Ким Мин-Дзунг, Парк Хее-Донг, Парк Дзунг-Гиу, Хео Тае-Хо, Парк Ми-Дзеонг, Ким Хва-Донг, Ох Йеонг-Соо, Парк Ки Соок, Чой Хиеонг-Воок, Мин Киеонг-Сик, Ли Дзае-Хоон, Ким Сунг-Суб, Ким Соо-Хиеон, Парк Чеол-Вон
Формула / Реферат
1. Соединение следующей формулы (1)
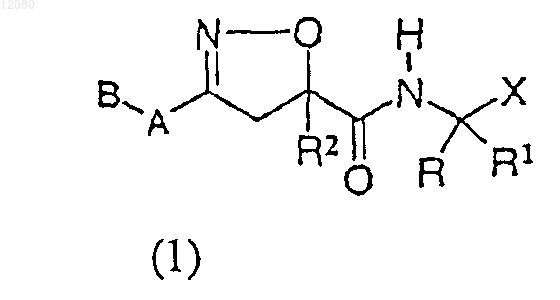
в которой
I) R представляет H,
II) R1 представляет остаток боковой цепи любой из природных аминокислот;
и соединение формулы (1) может находиться в форме конкретного диастереомера или их смесей, когда атом углерода, с которым связан R1, становится стереоцентром за счет R1-группы; или соединение формулы (1) может иметь защитную группу в виде эфира (-CO2R3, где R3 представляет -SAC), или может находиться в виде фармацевтически приемлемой соли, когда R1 является остатком боковой цепи аминокислоты, содержащим карбоксильную группу; или соединение формулы (1) может также находиться в виде фармацевтически приемлемой соли, когда R1 является остатком боковой цепи аминокислоты, содержащим основную группу,
III) R2 представляет H, -SAC, -SCAC или -SAC-Ar; и соединение формулы (1) может находиться в форме конкретного диастереомера или их смесей, когда атом углерода, с которым связан R2, становится стереоцентром за счет R2-группы;
IV) А представляет -(CH2)n- (n=0-4) или -О-(CH2)n- (n=0-4),
V) В представляет -Ar и
VI) X представляет -C(=O)CH2OR11, где R11 является -SAC, -SCAC, -Ar или -SAC-Ar;
-С(=O)CH2OC(=O)R12, где R12 является -SAC, -SCAC, -Ar или -SAC-Ar; -CH=CH-CO2R13, где R13 является -SAC, -SCAC, -Ar или -SAC-Ar; -CH=CH-SO2R14, где R14 является -SAC, -SCAC, -Ar или -SAC-Ar;
-С(=O)CH=CH2 или -COCH2-W, где W представляет -F, -Cl, -Br, -I, или имеет следующие формулы:
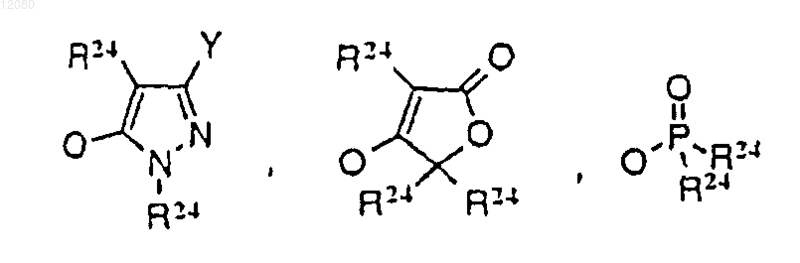
в которых
Y представляет H или CF3,
R24 представляет H, -SAC, -SAC-Ar или -Ar, его соль или стереоизомер, причем SAC означает углеводород, имеющий 1-8 атомов углерода; SCAC означает циклический радикал, имеющий 3-10 атомов углерода; -Ar включает ароматическую и гетероароматическую группы, где ароматическая группа означает 5-15-членный одиночный или конденсированный ненасыщенный цикл, а гетероароматическая группа означает 5-15-членный одиночный или конденсированный ненасыщенный цикл, содержащий 1-5 гетероатомов, выбранных из группы, состоящей из атомов кислорода, серы и азота; и SAC-Ar означает линейный или разветвленный алкил, имеющий 1-8 атомов углерода и замещенный группой -Ar.
2. Соединение по п.1, в котором R1 представляет -CH2COOH или -CH2COOR3 (R3=SAC).
3. Соединение по п.1, в котором R2 представляет H или -SAC.
4. Соединение по п.1, в котором X представляет -С(=O)CH2OAr, -С(=O)CH2OC(=O)Ar или -COCH2-W, где W представляет -F, -Cl, -Br или -I.
5. Соединение по п.1, в котором
I) R представляет H,
II) R1 представляет -CH2COOH или -CH2COOR3 (R3=SAC),
III) R2 представляет H или -SAC,
IV) А представляет -(CH2)n- (n=0-4) или -O-(CH2)n- (n=0-4),
V) В представляет -Ar и
VI) X представляет -COCH2F, -COCH2Cl, -COCH2Br, -COCH2I, -COCH2OAr или -COCH2OCOAr.
6. Соединение по п.1, которое выбрано из следующей группы, состоящей из:
(1) (3S)-5-[(2,6-дихлорбензоил)окси]-3-({[5-метил-3-фенил-4,5-дигидро-5-изоксазолил]карбонил} амино)-4-оксопентановой кислоты (Iaa);
(2) (3S)-3-({[5-метил-3-фенил-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксо-5-феноксипентановой кислоты (Ibb);
(3) (3S)-3-({[5-этил-3-фенил-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентановой кислоты (Icc);
(4) (3S)-3-({[5-этил-3-(1-нафтил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентановой кислоты (Idd);
(5) (3S)-3-({[5-этил-3-(2-нафтил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентановой кислоты (Iee);
(6) (3S)-3-({[5-этил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентановой кислоты (Iff);
(7) 3-({[5-этил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Igg);
(8) этил 3-({[5-этил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентаноата (Ihh);
(9) 5-фтор-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксопентановой кислоты (Iii);
(10) 3-({[5-этил-3-(4-хинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Ijj);
(11) 3-({[3-(бензотиофен-2-ил)-5-этил-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Ikk);
(12) (3S)-3-({[3-(l,3-диметил-1Н-индол-2-ил)-5-этил-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентановой кислоты (Ill);
(13) 3-({[3-(1,3-диметил-1Н-индол-2-ил)-5-этил-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Imm);
(14) (3S)-3-({[5-этил-3-(1-нафтилметил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентановой кислоты (Inn);
(15) (3S)-5-[(2,6-дихлорбензоил)окси]-3-[({5-этил-3-[2-(1-нафтил)этил]-4,5-дигидро-5-изоксазолил} карбонил)амино]-4-оксопентановой кислоты (Ioo);
(16) (3S)-3-[({5-этил-3-[(1-нафтилокси)метил]-4,5-дигидро-5-изоксазолил}карбонил)амино]-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентановой кислоты (Ipp);
(17) (3S)-3-{[(3-{[(4-хлор-1-нафтил)окси]метил}-5-этил-4,5-дигидро-5-изоксазолил)карбонил] амино}-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентановой кислоты (Iqq);
(18) (3S,4E)-6-этокси-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-6-оксо-4-гексеновой кислоты (Irr);
(19) (3S,4E)-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-(метилсульфонил)-4-пентеновой кислоты (Iss);
(20) 5-фтор-3-({[(5S)-3-(1-изохинолинил)-5-пропил-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксопентановой кислоты (Itt);
(21) 3-({[(5S)-5-этил-3-(1-нафтил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Iuu);
(22) 3-({[(5S)-5-этил-3-(2-хинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Ivv);
(23) 3-({[(5R)-5-этил-3-(3-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Iww);
(24) 3-({[5-этил-3-(8-хинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Ixx);
(25) 3-({[5-этил-3-(3-хинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Iyy);
(26) 5-фтор-3-({[(5R)-5-изопропил-3-(2-хинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксопентановой кислоты (Izz);
(27) 3-({[5-этил-3-(2-изопропилфенил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Iaa1);
(28) 3-[({3-[3-(трет-бутил)фенил]-5-этил-4,5-дигидро-5-изоксазолил}карбонил)амино]-5-фтор-4-оксопентановой кислоты (Iaa2);
(29) 3-[({3-[4-(трет-бутил)фенил]-5-этил-4,5-дигидро-5-изоксазолил}карбонил)амино]-5-фтор-4-оксопентановой кислоты (Iaa3);
(30) 5-фтор-3-({[(5R)-5-изопропил-3-(2-изопропилфенил)-4,5-дигидро-5-изоксазолил]карбонил} амино)-4-оксопентановой кислоты (Iaa4);
(31) 3-[({(5R)-3-[3-(трет-бутил)фенил]-5-изопропил-4,5-дигидро-5-изоксазолил}карбонил)амино]-5-фтор-4-оксопентановой кислоты (Iaa5);
(32) 3-{[(3-[1,1'-бифенил]-3-ил-5-изопропил-4,5-дигидро-5-изоксазолил)карбонил]амино}-5-фтор-4-оксопентановой кислоты (Iaa6);
(33) 3-({[5-этил-3-(2-пиридинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Iaa7);
(34) 3-[({3-[4-(трет-бутил)-2-пиридинил]-5-этил-4,5-дигидро-5-изоксазолил}карбонил)амино]-5-фтор-4-оксопентановой кислоты (Iaa8);
(35) 3-[({(5R)-3-[4-(трет-бутил)-2-пиридинил]-5-изопропил-4,5-дигидро-5-изоксазолил}карбонил) амино]-5-фтор-4-оксопентановой кислоты (Iaa9);
(36) 3-({[5-этил-3-(4-изобутил-2-пиридинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Iaa10);
(37) 3-({[3-(4-ацетил-2-пиридинил)-5-этил-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Iaa11);
(38) 3-({[3-(4-циклопропил-2-пиридинил)-5-этил-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Iaa12);
(39) 3-({[3-(4-циклопентил-2-пиридинил)-5-этил-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Iaa13);
(40) 3-({[(5R)-3-(4-циклопентил-2-пиридинил)-5-изопропил-4,5-дигидро-5-изоксазолил]карбонил} амино)-5-фтор-4-оксопентановой кислоты (Iaa14);
(41) 3-({[3-(4-циклогексил-2-пиридинил)-5-этил-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Iaa15);
(42) 3-({[5-этил-3-(5,6,7,8-тетрагидро-1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Iaa16);
(43) 5-фтор-3-({[5-изопропил-3-(4-фенил-2-пиридинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксопентановой кислоты (Iaa17);
(44) (3S)-5-[(дифенилфосфорил)окси]-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксопентановой кислоты (Iaa18);
(45) (3S)-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксо-5-{[1-фенил-3-(трифторметил)-1Н-пиразол-5-ил]окси}пентановой кислоты (Iaa19);
(46) (3S)-5-[(4-бензил-5-оксо-2,5-дигидро-3-фуранил)окси]-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксопентановой кислоты (Iaa20);
(47) (3S)-5-(изобутирилокси)-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксопентановой кислоты (Iaa21);
(48) (3S)-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксо-5-гексеновой кислоты (Iaa22);
(49) (3S)-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксо-5-(2-пиридинилокси)пентановой кислоты (Iaa23);
(50) (3S)-3-({[5-этил-3-(2-изопропилфенил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксо-5-(2-пиридинилокси)пентановой кислоты (Iaa24);
(51) 2-{[(3S)-4-карбокси-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил] карбонил}амино)-2-оксобутил]окси}-1-метилпиридиния трифторметансульфоната (Iaa25);
(52) 2-{[(3S)-4-карбокси-3-({[5-этил-3-(2-изопропилфенил)-4,5-дигидро-5-изоксазолил]карбонил} амино)-2-оксобутил]окси}-1-метилпиридиния трифторметансульфоната (Iaa26);
(53) 3-({[3-(5-хлор-1-метил-1Н-индол-2-ил)-5-изопропил-4,5-дигидро-5-изоксазолил]карбонил} амино)-5-фтор-4-оксопентановой кислоты (Iaa27);
(54) 3-({[3-(1,5-диметил-1Н-индол-2-ил)-5-изопропил-4,5-дигидро-5-изоксазолил]карбонил}амино)-5-фтор-4-оксопентановой кислоты (Iaa28) и
(55) (3S)-5-фтор-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил} амино)-4-оксопентановой кислоты (Iii-1).
7. Соединение по п.1, которое представляет 5-фтор-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксопентановую кислоту (Iii).
8. Соединение следующей формулы (1a):
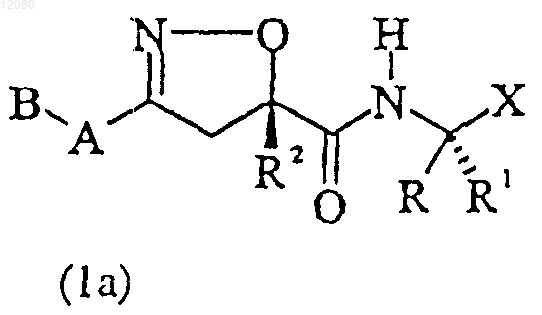
в которой А, В, R, R1, R2 и X имеют значения, определенные в п.1.
9. Соединение по п.8, которое представляет (3S)-5-фтор-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксопентановую кислоту (Iii-1).
10. Способ получения соединения (Iii-1), определенного в п.9, который включает стадии растворения смеси (3S)-5-фтор-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксопентановой кислоты и (3R)-5-фтор-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксопентановой кислоты в метил-трет-бутиловом эфире, добавления небольшого количества кристаллической (3S)-5-фтор-3-({[(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил}амино)-4-оксопентановой кислоты в качестве затравки с получением кристаллов и перекристаллизации данных кристаллов из системы растворителей этилацетат/н-гексан.
11. Терапевтическая композиция для предотвращения воспаления и апоптоза, содержащая ингибирующее каспазу соединение формулы (1), его соль или стереоизомер, определенные в п.1, в качестве активного ингредиента вместе с фармацевтически приемлемым носителем.
12. Композиция по п.11 для предотвращения воспаления и апоптоза с целью лечения деменции, мозгового инсульта, повреждения мозга в результате СПИДа, диабета, язвы желудка, церебрального нарушения в результате гепатита, индуцированных гепатитом заболеваний печени, острого гепатита, скоротечной печеночной недостаточности, цирроза печени, сепсиса, отторжения органа при трансплантации, ревматоидного артрита или апоптоза клеток сердца в результате ишемических заболеваний сердца.
13. Композиция по п.11 для предотвращения воспаления и апоптоза с целью лечения острого гепатита или цирроза печени.
14. Композиция по п.11 для предотвращения воспаления и апоптоза с целью лечения ревматоидного артрита.
15. Композиция по п.11, которую изготавливают в виде препарата для перорального введения, инъекционного препарата или пластыря.
16. Композиция по п.11, содержащая соединение (Iii), определенное в п.7, в качестве активного ингредиента.
17. Композиция по п.11, содержащая соединение (Iii-1), определенное в п.9, в качестве активного ингредиента.
18. Способ получения терапевтической композиции для предотвращения воспаления и апоптоза, определенной в п.11, включающий смешивание ингибирующего каспазу соединения формулы (1), его соли или стереоизомера, определенных в п.1, с фармацевтически приемлемым носителем.
19. Способ предотвращения воспаления или апоптоза, включающий введение эффективного количества ингибирующего каспазу соединения формулы (1), его соли или стереоизомера, определенных в п.1, пациенту, страдающему от воспаления и апоптоза.
20. Применение ингибирующего каспазу соединения формулы (1), его соли или стереоизомера, определенных в п.1, для предотвращения воспаления и апоптоза.
Текст
012080 Область техники, к которой относится изобретение Настоящее изобретение относится к производному изоксазолина, пригодному в качестве ингибитора различных каспаз, включая каспазу-1 [интерлейкин-1 превращающий фермент, ICE] и каспазу-3[апопаин/СРР-32], способу его получения и терапевтической композиции для предотвращения воспаления и апоптоза, включающей его. Уровень техники Каспаза представляет собой новый вид цистеинпротеазы в форме 22, исследованный в течение последних 10 лет. К настоящему времени известно примерно 14 ее видов. Каспаза-1 (ICE), одна из них,представляет вид цитокинов и принимает участие в превращении неактивного проинтерлейкина-1 в активный интерлейкин-1. Интерлейкин-1 состоит из интерлейкина-1 и интерлейкина-1, оба синтезируются в моноцитах в виде предшественника, имеющего молекулярную массу 31 кДа. Только проинтерлейкин-1 активируется под действием ICE. Положениями, подвергающимися гидролизу под действием каспазы-1, являются Asp27-Gly28 и Asp116-Ala117. Гидролиз последнего положения приводит к образованию интерлейкина-1. Сообщалось, что интерлейкин-1 действует в качестве важного медиатора в развитии воспаления (1,3). Каспаза-1 впервые была открыта в 1989 г. двумя независимыми исследовательскими группами, ее трехмерную пространственную структуру определили с помощью рентгеновской кристаллографии. Интенсивно исследовалась каспаза-3 (СРР-32) в отношении ее роли или механизма действия, и ее трехмерную пространственную структуру определили в 1996 г. (2). Каспаза-3 (апопаин), активированная из прокаспазы-3, гидролизует фрагмент (P4)Asp-X-X-Asp(P1), и известные субстраты включают поли(АДФ-рибоза)полимеразу, U1 70000 Mr небольшой ядерный рибонуклеопротеин и каталитическую субъединицу 460000 Mr, ДНК-зависимой протеинкиназы и т.д. С помощью рентгеновского исследования было подтверждено, что структура каспазы-7 очень схожа с таковой у каспазы-3 (4). Каспаза-8 и каспаза-9 активируют каспазы-3,6,7, и известно, что данные каспазы принимают участие в каскаде развития апоптоза. С помощью рентгеновских исследований в 1999 г. (5) была определена структура каспазы-8, и, в частности, ее ингибиторы можно преимущественно использовать для лечения заболеваний, связанных с апоптозом. Ингибиторы каспазы представляют соединения, которые ингибируют активность каспазы и, таким образом, контролируют такие симптомы, как воспаление, апоптоз и т.д., вызванные активностью каспазы. Заболевания или симптомы, которые можно лечить или ослаблять введением ингибиторов, включают следующие: ревматоидный артрит, воспалительное заболевание кишечника, синдром трансплантат против хозяина, сепсис, остеоартрит, остеопороз, острая и хроническая миелоидная лейкемия, менингит,сальпингит, септический шок, холангит, колит, энцефалит, эндокардит, гломерулонефрит, гепатит, миокардит, панкреатит, сахарный диабет типа 1, рассеянный склероз, болезнь Альцгеймера, болезнь Паркинсона, цирроз печени (6). Среди известных в настоящее время ингибиторов каспаз наиболее распространенными необратимыми ингибиторами являются следующие: Оба вышеуказанных ингибитора проявляют свою активность на основе общего механизма действия, заключающегося в том, что они необратимо инактивируют фермент с ингибированием апоптоза клеток (необратимый ингибитор широкого спектра действия). Сообщалось, что необратимый ингибитор обладает значительно более высокой ингибирующей активностью при сравнении обратимых и необратимых ингибиторов (7). Сообщалось, что оба, IDN-1965 производства IDUN Со. и МХ-1013 производстваMaxim Co., проявляют активность на модели апоптоза клеток при повреждении печени (8, 9). Данные препараты в настоящее время находятся на стадии доклинических испытаний. Необратимый ингибиторIDN-6556, недавно имелись сообщения о его структуре, в настоящее время находится на стадии клинических испытаний фазы II в качестве терапевтического средства при повреждении печени (10, 11).role of the lymphocyte. Hotchkiss RS, Chang KC, Swanson P.E., Tinsley K.W., Hui J.J., Klender P., Xanthoudakis S., Roy S., Black C., Grimm E., Aspiotis R., Han Y., Nicholson D.W., Karl I.E. Отторжение органов во время трансплантации: Xenotransplantation 2001 May; 8(2):115-24, In vitro(11) Canbay A. et al. J. Pharmacol. Exp. Ther., 2004, 308(3), 1191. The caspase inhibitor IDN-6556 attenuates hepatic injury and fibrosis in the bile duct ligated mouse. Сущность изобретения Авторы настоящего изобретения сконструировали и синтезировали некоторые новые соединения,-2 012080 которые можно использовать в качестве эффективных ингибиторов каспаз и которые имеют характерную структуру и высокую избирательность в отношении подобных ферментов, и определили их связывающую способность и ингибирующую активность для каспаз. В результате авторы установили, что соединение следующей формулы (1) соответствует таким требованиям, и создали настоящее изобретение.I) R представляет H,II) R1 представляет остаток боковой цепи любой из природных аминокислот; и соединение формулы (1) может находиться в форме конкретного диастереомера или их смесей,когда атом углерода, с которым связан R1, становится стереоцентром за счет R1-группы; или соединение формулы (1) может иметь защитную группу в виде эфира (-CO2R3, где R3 представляет -SAC), или может находиться в виде фармацевтически приемлемой соли, когда R1 является остатком боковой цепи аминокислоты, содержащим карбоксильную группу; или соединение формулы (1) может также находится в виде фармацевтически приемлемой соли, когда R является остатком боковой цепи аминокислоты, содержащим основную группу,III) R2 представляет H, -SAC, -SCAC или -SAC-Ar; и соединение формулы (1) может находиться в форме конкретного диастереомера или их смесей, когда атом углерода, с которым связан R2, становится стереоцентром за счет R2-группы;-С(=O)CH=CH2 или -COCH2-W, где W представляет -F, -Cl, -Br, -I, или имеет следующую формулу:Y представляет H или CF3,R24 представляет H, -SAC, -SAC-Ar или -Ar. Следовательно, настоящее изобретение обеспечивает новое производное изоксазолина формулы (1),его соль или стереоизомер, обладающее ингибирующей активностью в отношении каспаз. Другим предметом изобретения является обеспечение способа получения соединения формулы (1),его соли или стереоизомера. Также еще одним предметом настоящего изобретения является обеспечение композиции, применения или способа ингибирования каспаз, в частности терапевтической композиции, применения или способа предотвращения воспаления и апоптоза, включающих соединение формулы (1), его соль или стереоизомер в качестве активного ингредиента вместе с фармацевтически приемлемым носителем. Краткое описание фигур На фиг. 1 показана ингибирующая активность соединения (Iii) в отношении фиброза печени, возникшего в результате застоя желчи: а) на фиг. 1 представляет вариант симуляции операции, b) представляет вариант операции BDL, когда вводили только растворитель после наложения лигатуры на желчный проток, с) представляет вариант, когда соединение (Iii) вводили перорально в дозе 3 мг/кг дважды в сутки в течение 1 недели через неделю после наложения лигатуры на желчный проток, и d) представляет вариант, когда соединение (Iii) вводили перорально в дозе 10 мг/кг дважды в сутки в течение 1 недели через неделю после наложения лигатуры на желчный проток. На фиг. 2 показана ингибирующая активность соединения (Iii) в отношении апоптоза клеток печени, возникшего в результате застоя желчи: а) на фиг. 2 представляет вариант симуляции операции,b) представляет вариант операции BDL, когда вводили только растворитель после наложения лигатуры на желчный проток, с) представляет вариант, когда соединение (Iii) вводили перорально в дозе 3 мг/кг дважды в сутки в течение 1 недели через неделю после наложения лигатуры на желчный проток, d) представляет вариант, когда соединение (Iii) вводили перорально в дозе 10 мг/кг дважды в сутки в течение 1 недели через неделю после наложения лигатуры на желчный проток и е) представляет график,показывающий количество клеток печени, подвергшихся апоптозу, в каждой опытной группе. Подробное описание предпочтительного варианта осуществления изобретения Перед подробным описанием настоящего изобретения вначале даются определения следующимa) простая алкильная цепь (далее - SAC) означает углеводород, имеющий 1-8 атомов углерода в линейной или разветвленной изомерной форме;b) простая циклоалкильная цепь (далее - SCAC) означает циклический радикал, имеющий 3-10 атомов углерода;c) арильная группа (далее - Ar) включает ароматическую и гетероароматическую группы. Ароматическая группа означает 5-15-членный одиночный или конденсированный ненасыщенный цикл. Гетероароматическая группа означает ароматическую группу, содержащую 1-5 гетероатомов, выбранных из группы, состоящей из атомов кислорода, серы и азота. Арильная группа включает фенил, бифенил, 1-нафтил, 2-нафтил, пиридинил, N-алкилпиридиний,пиримидинил, хинолинил, бензотиенил, индолил, пиразинил, изоиндолил, изохинолил, хиназолинил,хиноксалинил, фталазинил, имидазолинил, изоксазолил, пиразолил, оксазолил, тиазолил, индолизинил,индазолил, бензотиазолил, бензимидазолил, бензофуранил, тиенил, пирролил, оксадиазолил, тиадиазолил, триазолил, тетразолил, оксазолопиридинил, имидазопиридинил, изотиазолил, циннолинил, карбазолил, изохроманил, хроманил, тетрагидроизохинолинил, изоиндолинил, изобензотетрагидрофуранил, изобензотетрагидротиенил, изобензотиенил, бензоксазолил, пиридопиридинил, бензотетрагидрофуранил,бензотетрагидротиенил, пуринил, бензодиоксолил, триазинил, феноксазинил, фенотиазинил, птеридинил, бензотиазолил, имидазопиридинил, имидазотиазолил, дигидробензизоксазинил, бензизоксазинил,бензоксазинил, дигидробензизотиопиранил, бензопиранил, бензотиопиранил, кумаринил, изокумаринил,хромонил, хроманонил, пиридинил-N-оксид, тетрагидрохинолинил-N-оксид, дигидрохинолинил, дигидрохинолинонил, дигидроизохинолинонил, дигидрокумаринил, дигидроизокумаринил, изоиндолинонил,бензодиоксанил, бензоксазолинонил, N-алкилпиридий, пирролил-N-оксид, пиримидинил-N-оксид, пиразинил-К-оксид, хинолинил-N-оксид, индолил-N-оксид, индолинил-N-оксид, изохинолил-N-оксид, хиназолинил-N-оксид, хиноксалинил-N-оксид, фталазинил-N-оксид, имидазолинил-N-оксид, изоксазолил-Nоксид, оксазолил-N-оксид, тиазолил-N-оксид, индолизинил-N-оксид, индазолил-N-оксид, бензотиазолилN-оксид, бензимидазолил-N-оксид, пирролил-N-оксид, оксадиазолил-N-оксид, тиадиазолил-N-оксид,триазолил-N-оксид, тетразолил-N-оксид и т.д.;d) простая алкильная цепь, замещенная арилом (далее - SAC-Ar), означает линейный или разветвленный алкил, имеющий 1-8 атомов углерода и замещенный вышеуказанной арильной группой;e) природная аминокислота включает следующее: глицин, аланин, валин, лейцин, изолейцин, серин,треонин, цистеин, метионин, пролин, аспарагиновую кислоту, аспарагин, глутаминовую кислоту, глутамин, лизин, аргинин, гистидин, фенилаланин, тирозин и триптофан;f) защитная группа простого эфира представляет углеводород, имеющий 1-8 атомов углерода в линейной или разветвленной изомерной форме. Кроме того, настоящее описание включает следующие сокращения:N,N-диметилформамид: ДМФА 1-(3-диметиламинопропил)-3-этилкарбодиимид: EDC 1-гидроксибензотриазол гидрат: HOBt трифторуксусная кислота: TFA трет-бутоксикарбонил: Вос бензилоксикарбонил: Cbz метил: Me этил: Et эквивалент: экв. Заместители, входящие в вышеуказанную формулу (1), конкретно имеют следующие значения.I) R представляет H,II) R1 представляет остаток боковой цепи любой из природных аминокислот; и соединение формулы (1) может находиться в форме конкретного диастереомера или их смесей, когда атом углерода, с которым связан R1, становится стереоцентром за счет R1-группы; или соединение формулы (1) может иметь защитную группу в виде эфира (-CO2R3, где R3 представляет -SAC), или может находиться в виде фармацевтически приемлемой соли, когда R1 является остатком боковой цепи аминокислоты, содержащим карбоксильную группу; или соединение формулы (1) может также находится в виде фармацевтически приемлемой соли, когда R1 является остатком боковой цепи аминокислоты, содержащим основную группу,III) R2 представляет H, -SAC, -SCAC, -Ar, -SAC-Ar; и соединение формулы (1) может находиться в форме конкретного диастереомера или их смесей, когда атом углерода, с которым связан R2, становится стереоцентром за счет R2-группы;-С(=O)CH=CH2 или -COCH2-W, где W представляет -F, -Cl, -Br, -I или имеет следующую формулу:Y представляет H или CF3,R24 представляет H, -SAC, -SAC-Ar или -Ar. Предпочтительными соединениями среди соединений формулы (1), представленной выше, являются таковые, в которыхX представляет -С(=O)CH2OAr, -С(=O)CH2OC(=O)Ar или -COCH2-W, где W представляет -F, -Cl,-Br или -I. Более предпочтительными соединениями среди соединений формулы (1), представленной выше,являются таковые, в которыхI) R представляет H,II) R1 представляет -CH2COOH или -CH2COOR3 (R3=SAC),III) R2 представляет H или -SAC,IV) А представляет -(CH2)n- (n=0-4) или -O-(CH2)n- (n=0-4),V) В представляет -Ar,VI) X представляет -COCH2F, -COCH2Cl, -COCH2Br, -COCH2I, -COCH2OAr или -COCH2OCOAr. Особенно предпочтительными соединениями являются таковые, выбранные из следующей группы,состоящей из(55) (3S)-5-фтор-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил амино)-4-оксопентановой кислоты (Iii-1). Соединение формулы (1) по настоящему изобретению имеет два (2) асимметричных атома углерода, и таким образом может находиться в форме его стереоизомера, включая диастереомер. Особенно предпочтительными соединениями среди стереоизомеров являются таковые, имеющие следующую формулу (1a): и таким образом другим предметом настоящего изобретения является обеспечение соединения формулы (1a) в форме стереоизомера. Среди соединений формулы (1a), например, соединение (3S)-5-фтор-3-([(5R)-5-изопропил-3-(1 изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-4-оксопентановая кислота (Iii) можно получить способом, включающим стадии растворения смеси (3S) и (3R) в метил-трет-бутиловом эфире, добавления небольшого количества кристаллической(3S)-5-фтор-3-([(5R)-5-изопропил-3-(1 изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-4-оксопентановой кислоты в качестве затравки с получением кристаллов и перекристаллизации данных кристаллов из системы растворителей этилацетат/н-гексан. Наиболее предпочтительными соединениями формул (1) и (1a) являются 5-фтор-3-([(5R)-5 изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-4-оксопентановая кислота(Iii) и (3S)-5-фтор-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-4-оксопентановая кислота (Iii-1). Способы получения нового производного изоксазолина формулы (1), которые проявляют ингибирующую активность в отношении каспаз, представлены на последующих схемах реакций 1-5. Однако представленные на последующих схемах реакций являются только типичными способами, используемыми в настоящем изобретении. Без ограничения можно менять последовательность манипуляций, и таким образом, способы не ограничиваются теми, которые поясняются ниже. Схема реакций 1 На схеме реакций 1, представленной выше, альдегид (II) подвергают взаимодействию с гидрохлоридом гидроксиламина и карбонатом натрия в смеси растворителей спирт-вода с получением оксима (III)(смеси син- и антиоксимов). Полученный оксим (III) обрабатывают NCS (N-хлорсукцинимидом) в диметилформамиде с получением гидроксамоилхлорида (IV). Полученный таким образом гидроксамоилхлорид (IV) подвергают взаимодействию с акрилатом (V) с получением производного изоксазолина (VI),-7 012080 которое затем гидролизуют, если необходимо, с получением производного изоксазолина со снятой защитой (VII). Если требуется, то оксим (III), акрилат (V) и NaOCl можно подвергнуть взаимодействию в реакционном сосуде (in situ) с непосредственным получением производного изоксазолина (VI) (смотри получения 16 и 17). Схема реакций 2 на которой А, В, R, R1, R2, R11, R12 и W имеют значения, определенные выше. На схеме реакций 2, представленной выше, производное карбоновой кислоты (VII) подвергают конденсации с производным аспарагиновой кислоты (VIII) (см. последующую схему реакций 3) с получением соединения (IX), которое затем подвергают окислению Десс-Мартина периодинаном и снятию защиты, если необходимо, с получением желаемого соединения формулы (1). Функциональную группу Z в соединении (I) на схеме реакций 2 можно получить в несколько стадий, как представлено в качестве примера в получениях 5 и 7, после того, как производное карбоновой кислоты (VII) с левой стороны соединяют с (-трет-Bu) метиловым эфиром аспарагиновой кислоты. Иначе, как представлено на последующей схеме реакций 3, вначале синтезируют соединение (VIII), уже имеющее желаемую группу Z, и конденсируют с соединением (VII) (источник: WO 00/23421). Кроме того, когда W представляет F, то рацемическое соединение можно получить способом, описанным в Tetrahedron Letters, 1994, 35 (52), 9693-9696. Схема реакций 3 на которой Z имеет значения, определенные выше. Акрилат (V), используемый в качестве реагента на вышепредставленной схеме реакций 1, можно получить двумя (2) путями. А именно, соединение (XV) легко получить из известного соединения (XIV)(Synthesis, 1982, р. 924), как представлено на последующей схеме реакций 4, или метил(этил)2 изопропилакрилат, соединение (V), можно получить из диметил(диэтил)малоната (J. Chemical Society-8 012080 На последующей схеме реакций 5 представлен способ синтеза для получения соединения, в котором ,-ненасыщенный эфир или ,-ненасыщенный сульфон вводят в положение P1. Согласно этому производное карбоновой кислоты (VII), полученное как представлено на схеме реакций 1, подвергают взаимодействию с аминоспиртом (XVII) с получением соединения (XVI), которое затем подвергают окислению Десс-Мартина и реакции Виттига с получением соединения (I). Схема реакций 5SO2R14, где R13 и R14 имеют значения, определенные выше. Соединение формулы (1) по настоящему изобретению обладает широким спектром ингибирующей активности в отношении каспаз, что показано результатами последующих опытов, и, таким образом, обладает действием для предотвращения воспаления и апоптоза. Таким образом, настоящее изобретение обеспечивает композицию для ингибирования каспаз, в частности терапевтическую композицию для предотвращения воспаления и апоптоза, содержащую соединение формулы (1) в качестве активного ингредиента вместе с фармацевтически приемлемым носителем. Конкретно композиция по настоящему изобретению обладает терапевтическим действием в отношении деменции, мозгового инсульта, повреждения мозга в результате СПИДа, диабета, язвы желудка, церебрального нарушения в результате гепатита, индуцированных гепатитом заболеваний печени, острого гепатита, скоротечной печеночной недостаточности, цирроза печени, сепсиса, отторжения органа при трансплантации, ревматоидного артрита или апоптоза клеток сердца в результате ишемических заболеваний сердца, в частности, особенно гепатита,цирроза печени или ревматоидного артрита. Ингибитор каспаз, в частности соединение формулы (1), для введения можно изготовить в виде различных фармацевтических форм. Для приготовления фармацевтической композиции по настоящему изобретению эффективное количество ингибитора каспаз, в частности соединения формулы (1) или его соли, смешивают с фармацевтически приемлемым носителем, который может иметь различные формы в зависимости от композиции, которую готовят. Ингибирующее каспазу соединение можно формулировать в виде инъекционного раствора для парентерального введения или препарата для перкутанного или перорального введения в зависимости от цели применения. Является особенно преимущественным изготовление композиции в разовой лекарственной форме для простоты введения и однородности дозировки. Для препарата для перорального введения можно использовать любой обычный фармацевтический носитель. Например, можно использовать воду, гликоли, масла, спирты и тому подобное для таких жидких препаратов для перорального введения как суспензии, сиропы, эликсиры и растворы; или можно использовать крахмалы, сахара, каолин, скользящие вещества, связующие вещества, разрыхлители и тому подобное для таких твердых препаратов как порошки, пилюли, капсулы и таблетки. За счет простоты введения таблетки и капсулы являются наиболее преимущественными разовыми лекарственными формами. Также является желательным для таблеток и пилюль формулировать их в покрытый кишечной оболочкой препарат. Для препарата для парентерального введения в качестве носителя обычно используют стерильную воду, хотя можно применять другие ингредиенты, такие как вещества, способствующие растворению. Инъекционные препараты, например стерильную водную или масляную суспензию для инъекций, можно приготовить согласно известным методам с использованием подходящих разрыхлителей, смачивающего вещества или суспендирующего вещества. Растворители, которые можно использовать для приготовления инъекционных препаратов, включают воду, раствор Рингера и изотонический раствор NaCl, и также можно преимущественно использовать стерильное нелетучее масло в качестве растворителя или суспендирующей среды. Для этой цели можно использовать любое вызывающее раздражение нелетучее масло,включая моно-, диглицериды. Для инъекционных растворов можно также использовать жирную кислоту,такую как олеиновая кислота.-9 012080 Для чрескожного введения носитель может включать вещество, усиливающее проникновение и/или подходящее смачивающее вещество, необязательно в сочетании с подходящими добавками, не обладающими значительным раздражающим действием на кожу. Указанные добавки могут способствовать введению через кожу и/или помогать проникновению желаемой композиции. Данные препараты для чрескожного введения применяют различными способами, например в виде трансдермального пластыря,небольшого кусочка пластыря или мази. В тех случаях, когда ингибитор каспаз, в частности соединение формулы (1), используют для клинических целей, то предпочтительно вводить его конкретному пациенту в количестве в пределах от 0,1 до 100 мг на кг массы тела в сутки. Общую суточную дозу можно вводить один или несколько раз. Однако конкретная дозировка для введения индивидуальному пациенту может варьироваться в зависимости от конкретного используемого соединения, массы тела, пола, общего состояния здоровья или рациона конкретного пациента, времени или способа введения, скорости выделения, соотношения смешения агента, тяжести заболевания, которое лечится и т.д. Настоящее изобретение будет конкретнее пояснено последующими примерами. Однако следует понимать, что данные примеры предназначены для иллюстрации настоящего изобретения и ни коим образом не ограничивают объем настоящего изобретения. Получение 1. Оксим бензальдегида. Бензальдегид (5,31 г, 50,0 ммоль) растворяли в смеси этанол (60 мл) - вода (30 мл) и добавляли гидроксиламин гидрохлорид (5,21 г, 1,5 экв.) и безводный карбонат натрия (Na2CO3, 3,97 г, 0,75 экв.) при 0C. Когда образовывалось большое количество твердого вещества примерно через 1 мин, добавляли смесь вода-этанол (1:1, 60 мл) и смесь перемешивали в течение 1 ч. Добавляли насыщенный водный раствор хлорида натрия (100 мл) и смесь экстрагировали дважды этилацетатом (300 мл). Экстракт промывали 1,0 H водным раствором бикарбоната натрия NaHCO3, 100 мл 2), высушивали (безводный Na2SO4) и концентрировали при пониженном давлении с получением указанного в заголовке соединения (6,06 г,выход 99%) в виде белого порошка в виде смеси цис- и транс-изомеров. 1H-ЯМР (500 МГц, CDCl3)8,9 (шир, 1H), 8,1 (с, 1H), 7,5 (м, 2H), 7,3 (м, 3H). Получение 2. Бензальдегид гидроксамоилхлорид. Оксим, полученный в получении 1 (3,00 г, 24,8 ммоль), растворяли в диметилформамиде (100 мл) и добавляли N-хлорсукцинимид (3,47 г, 1,05 экв.). Полученный раствор перемешивали в течение 1 ч на водяной бане примерно при 40C и летучий растворитель удаляли выпариванием при пониженном давлении. Остаток растворяли в смеси этилацетат-гексан (1:1, 150 мл), промывали водой (100 мл 3), высушивали (безводный Na2SO4) и концентрировали при пониженном давлении с получением указанного в заголовке соединения (3,86 г, выход 99%) . Данное соединение использовали в последующей реакции без дополнительной очистки. Получение 3. Метил 5-метил-3-фенил-4,5-дигидро-5-изоксазолкарбоксилат (VIa). Гидроксамоилхлорид, полученный в получении 2 (3,86 г, 24,8 ммоль), и метилметакрилат (4,0 мл,37,2 ммоль, 1,5 экв.) растворяли в сухом диэтиловом эфире (120 мл) в атмосфере азота, смесь выдерживали при -78 С и добавляли триэтиламин (6,9 мл, 2,0 экв.). Смесь перемешивали в течение ночи, в это время она медленно подогревалась до комнатной температуры. Добавляли воду (100 мл) и затем смесь экстрагировали этилацетатом (100 мл 2), промывали водой (100 мл), высушивали (безводный Na2SO4) и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (смесь 15% этилацетат-гексан) с получением указанного в заголовке соединения (5,34 г, выход 98%), которое затем идентифицировали 1H-ЯМР как смесь диастереомеров 1:1. 1H-ЯМР (400 МГц, CDCl3)6, 7 (м, 2H), 6,5 (м, 3H), 3,0 (д, J=16,7 Гц, 1H), 2,9 (с, 3H), 2,3 (д, J=16,7 Гц, 1H), 0,8 (с, 3H). Получение 4. 5-Метил-3-фенил-4,5-дигидро-5-изоксазолкарбоновая кислота (VIIa). Соединение, полученное в получении 3 (соединение VIa, 5,34 г), растворяли в перегнанном тетрагидрофуране (120 мл) и добавляли 1H водный раствор гидроокиси натрия (36,5 мл, 1,5 экв.) . Примерно через 4 ч смесь нейтрализовали 1H водным раствором соляной кислоты и упаривали при пониженном давлении для удаления большей части тетрагидрофурана. Остаток растворяли в избытке этилацетата(700 мл), промывали водой, высушивали (безводный Na2SO4) и концентрировали при пониженном давлении с получением указанного в заголовке соединения (4,77 г, выход 95%) в виде белого порошка. Данное соединение использовали в последующей реакции без дополнительной очистки. Получение 5.(3S)-3-[(Бензилокси)карбонил]амино-5-(трет-бутокси)-2-гидрокси-5-оксопентил-2,6-дихлорбензоат (XIIa). К N-бензилоксикарбонилтрет-бутиласпарагиновой кислоте (5,03 г, 15,6 ммоль) и NMM (1,90 мл,- 10012080 17,1 ммоль) добавляли сухой тетрагидрофуран (60 мл) в атмосфере азота, смесь выдерживали при -15C и к этому добавляли изобутилхлорформиат (2,12 мл, 16,3 экв.). Смесь перемешивали примерно в течение 20 мин. К реакционной смеси, выдерживаемой при 0C, затем добавляли раствор диазометан-эфир (синтезирован из 2,0 экв. 1-метил-3-нитро-1-нитрозогуанидина, 60 мл) с получением диазокетона (= 30 мин). Добавляли смесь 30% HBr/AcOH (6,42 мл, 2,0 экв.) при 0C. Полученную смесь перемешивали (30-60 мин), экстрагировали этилацетатом, дважды промывали насыщенным водным раствором бикарбоната натрия и водным раствором хлорида натрия, высушивали (безводный Na2SO4) и концентрировали при пониженном давлении с получением производного бромметилкетона (соединение X, 6,4 г). Полученное таким образом производное бромметилкетона (соединение X, 4,36 г) и 2,6 дихлорбензойную кислоту (2,28 г, 1,1 экв.) растворяли в диметилформамиде (18 мл), добавляли KF (1,58 г, 2,5 экв.) и смесь перемешивали в течение 2 ч с получением 2,6-дихлорбензоилоксиметилкетона (XIa). Данное соединение растворяли в метаноле (20 мл) и подвергали взаимодействию при добавлении раствора NaBH4 (412 мг) - метанол (40 мл) (-10C - комнатная температура, 2 ч). Реакцию останавливали уксусной кислотой и реакционную смесь упаривали при пониженном давлении для удаления метанола. Остаток экстрагировали этилацетатом (50 мл 2), промывали водой и водным раствором хлорида натрия,высушивали (безводный Na2SO4), концентрировали при пониженном давлении и разделяли-очищали колоночной хроматографией (смесь этилацетат-гексан 1:5) с получением указанного в заголовке соединения (4,80 г, выход 86%) в форме диастереомера. 1(3S)-3-Амино-5-(трет-бутокси)-2-гидрокси-5-оксопентил-2,6-дихлорбензоат (VIIIa). Бензилоксикарбонильную группу соединения, полученного в получении 5, удаляли (Pd/C) в атмосфере баллонного водорода в течение 40 мин с получением указанного в заголовке соединения (выход 100%). 1H-ЯМР (400 МГц, ДМСО-d6)8,2 (шир, 2H), 7,6-7,5 (м, 3H), 6,1 (м, 1H), 4,4-3,9 (м, 3H), 3,0-2,6 (м,2H), 1,4 (с, 9H). Пример 1. (3S)-5-(Трет-бутокси)-3-[(5-метил-3-фенил-4,5-дигидро-5-изоксазолил)карбонил]амино-2,5-диоксопентил 2,6-дихлорбензоат (Ia). Смесь производного карбоновой кислоты, полученного в получении 4 (VIIa, 300 мг, 1,46 ммоль),производного аминоспирта, полученного в получении 6 (VIIIa, 667 мг, 1,1 экв.), и HATU (722 мг, 1,3 экв.) охлаждали до 0C, добавляли триэтиламин (0,82 мл, 4,0 экв.) в растворителе ДМФА (5 мл) и полученную смесь подвергали взаимодействию в течение 5 ч. Растворитель выпаривали при пониженном давлении и остаток экстрагировали этилацетатом (200 мл 2), промывали водой, водным раствором бикарбоната натрия и водным раствором хлорида натрия, высушивали (безводный Na2SO4), концентрировали при пониженном давлении и очищали колоночной хроматографией с получением соединения (IXa)(810 мг, выход 98%). К данному соединению и реактиву Десс-Мартина (1,70 г, 3,0 экв.) добавляли сухой дихлорметан (25 мл) и смесь перемешивали в течение 1 ч при комнатной температуре. Реакцию останавливали изопропиловым спиртом (3 мл). Твердое вещество удаляли фильтрованием через целит при пониженном давлении и фильтрат экстрагировали этилацетатом (20 мл 2), промывали водой, насыщенным водным раствором бикарбоната натрия и водным раствором хлорида натрия, высушивали (безводныйNa2SO4), концентрировали при пониженном давлении и предварительно очищали колоночной хроматографией (смесь 36% этилацетат-гексан) с получением диастереомера указанного в заголовке соединения(м, 1H), 3,8 (м, 1H), 3,2 (м, 1H), 2,9-2,8 (м, 2H), 1,7 (с, 3H), 1,4 (с, 9H). Пример 2. (3S)-5-[(2,6-Дихлорбензоил)окси]-3-[(5-метил-3-фенил-4,5-дигидро-5-изоксазолил)карбонил]амино-4-оксопентановая кислота (Iaa). Соединение, полученное в примере 1 (44 мг), растворяли в дихлорметане (2 мл) и добавляли трифторуксусную кислоту (1 мл) при 0C. Смесь перемешивали в течение 2 ч, при этом она медленно подогревалась до комнатной температуры, и затем концентрировали при пониженном давлении с получением указанного в заголовке соединения (Iaa) в стехиометрическом количестве. 1(м, 1H), 3,8 (м, 1H), 3,2 (м, 1H), 1,7 (м, 3H). Получение 7. Трет-бутил (3S)-3-амино-4-гидрокси-5-феноксипентаноат (VIIIb). К N-бензилоксикарбонилтрет-бутиласпарагиновой кислоте (10,0 г, 31,0 ммоль) и NMM (3,75 мл,1,1 экв.) добавляли сухой тетрагидрофуран (120 мл) в атмосфере азота и смесь выдерживали при -15 С. К этому добавляли изобутилхлорформиат (4,22 мл, 1,05 экв.) и смесь перемешивали примерно в течение 20 мин. Реагенты выдерживали при 0C, затем смешивали с раствором диазометан-эфир (синтезирован из 2,0 экв. 1-метил-3-нитро-1-нитрозогуанидина, 60 мл) с получением производного диазокетона (30 мин).- 11012080 Добавляли смесь 30% HBr/AcOH (12,83 мл, 2,0 экв.) с получением производного бромметилкетона (30-60 мин). Продукт экстрагировали этилацетатом, дважды промывали насыщенным водным раствором бикарбоната натрия и водным раствором хлорида натрия, высушивали (безводный Na2SO4) и концентрировали при пониженном давлении с получением производного бромметилкетона (12,9 г) в стехиометрическом количестве. Полученное таким образом производное бромметилкетона (X, 12,9 г, 31,0 ммоль) и фенол (3,23 г,1,2 экв.) растворяли в диметилформамиде (30 мл), добавляли KF (4,53 г, 2,5 экв.) и смесь перемешивали в течение 2 ч с получением феноксиметилкетона (XIb). Данное соединение растворяли в смеси метанол (40 мл) - ТГФ (100 мл) и подвергали взаимодействию при добавлении раствора NaBH4 (2,35 г) - метанол (40 мл) (-10C - комнатная температура, 2 ч). Реакцию останавливали уксусной кислотой и реакционную смесь упаривали при пониженном давлении для удаления метанола. Остаток экстрагировали этилацетатом (50 мл 2), промывали водой и водным раствором хлорида натрия, высушивали (безводный Na2SO4),концентрировали при пониженном давлении и разделяли-очищали колоночной хроматографией (смесь этилацетат-гексан 1:7) с получением соединения (XIIb, 6,50 г, выход 50%) в форме диастереомера, аминогруппа которого защищена бензилоксикарбонилом. 1H-ЯМР (400 МГц, CDCl3)7,3-7,2 (м, 8H), 5,9 (м, 1H), 5,2 (м, 4H), 4,7 (м, 1H), 2,9 (м, 1H), 2,7 (м,1H), 1,4 (с, 9H). Бензилоксикарбонильную группу полученного выше соединения удаляли (Pd/C) в атмосфере баллонного водорода с получением указанного в заголовке соединения (4,16 г, выход 95%). 1(с, 9H). Пример 3. Трет-бутил (3S)-3-[(5-метил-3-фенил-4,5-дигидро-5-изоксазолил)карбонил]амино-4 оксо-5-феноксипентаноат (Ib). Смесь производного карбоновой кислоты, полученного в получении 4 (VIIa, 273 мг, 1,33 ммоль),аминоспирта, полученного в получении 7 (VIIIb, 412 мг, 1,1 экв.), и HATU (657 мг, 1,3 экв.) охлаждали до 0C, добавляли триэтиламин (0,74 мл, 4,0 экв.) в растворителе ДМФА (5 мл) и полученную смесь подвергали взаимодействию в течение 5 ч. Растворитель выпаривали при пониженном давлении и остаток экстрагировали этилацетатом (200 мл 2), промывали водой, водным раствором бикарбоната натрия и водным раствором хлорида натрия, высушивали (безводный Na2SO4), концентрировали при пониженном давлении и очищали колоночной хроматографией (смесь 30-40% ЕА/гексан) с получением соединения(IXb) (545 мг, выход 88%). К данному соединению и реактиву Десс-Мартина (1,43 г, 3,0 экв.) добавляли сухой дихлорметан (25 мл) и смесь перемешивали в течение 1 ч при комнатной температуре. Реакцию останавливали изопропиловым спиртом (2 мл). Твердое вещество удаляли фильтрованием через целит при пониженном давлении и фильтрат экстрагировали этилацетатом (20 мл 2), промывали водой, насыщенным водным раствором бикарбоната натрия и водным раствором хлорида натрия, высушивали (безводный Na2SO4), концентрировали при пониженном давлении и предварительно очищали колоночной хроматографией (элюент: смесь 25% этилацетат-гексан) с получением диастереомера указанного в заголовке соединения (540 мг, выход 99%). 1(с, 3H), 1,4 (с, 9H). Пример 4. (3S)-3-[(5-Метил-3-фенил-4,5-дигидро-5-изоксазолил)карбонил]амино-4-оксо-5-феноксипентановая кислота (Ibb). Соединение, полученное в примере 3 (530 мг, 1,13 6 ммоль), растворяли в дихлорметане (6 мл) и добавляли трифторуксусную кислоту (3 мл) при 0C. Смесь перемешивали в течение 2 ч, при этом она медленно подогревалась до комнатной температуры, и затем концентрировали при пониженном давлении с получением указанного в заголовке соединения (Ibb) (4 65 мг) в стехиометрическом количестве. 1H-ЯМР (400 МГц, CDCl3)7,5 (м, 2H), 7,3 (м, 3H), 7,1 (NH, 1H), 6,7 (м, 5H), 5,0-4,6 (м, 2H), 4,2 (м,1H), 3,8 (м, 1H), 3,2 (м, 1H), 3,0-2,7 (м, 2H), 1,6 (с, 3H). Получение 8. Этил 2-этилакрилат (XVb). К CuCN (26,9 мг, высушенному заранее в вакууме) добавляли в атмосфере азота примерно 500 мл сухого тетрагидрофурана. Смесь выдерживали при -78C и медленно добавляли 100 мл бромида метилмагния (3,0 M раствор в диэтиловом эфире) при механическом перемешиании. Густую смесь перемешивали примерно в течение 30 мин при -78 С. Этил 2-бромметилакрилат (28,9 г, 150 ммоль, способ синтеза:Vilieras J. and Rambaud M. Synthesis, 1982, 914), растворенный примерно в 30 мл сухого тетрагидрофурана, медленно добавляли к этому. Температуру реакционной смеси медленно повышали до комнатной температуры в течение 2 ч. Реакцию останавливали медленным добавлением насыщенного раствора хлорида аммония (50 мл). Реакционную смесь фильтровали через целит для удаления осадка и затем промывали диэтиловым эфиром. Органический слой промывали водой и насыщенным раствором бикарбоната натрия (300 мл 2), высушивали (безводный Na2SO4) и концентрировали при пониженном давлении- 12012080 с получением 26,7 г (стехиометрическое количество) прозрачной жидкости. Данную жидкость анализировали 1H-ЯМР (500 МГц, CDCl3) и подтверждали, что указанное в заголовке соединение с чистотой примерно 75% мас./мас. 1H-ЯМР (500 МГц, CDCl3)6,12 (1H, с), 5,50 (1H, с), 4,20 (2 Н, кв, J=7,3 Гц), 2,31 (2 Н, квт), 1,28 (3 Н,т, J=7,3 Гц), 1,07 (3 Н, т, J=7,8 Гц). Получение 9. Этил 5-этил-3-фенил-4,5-дигидро-5-изоксазолкарбоксилат (VIb). Соединение из получения 8 (XVa) подвергали взаимодействию по той же методике, описанной в получении 3, с получением указанного в заголовке соединения. 1H-ЯМР (400 МГц, CDCl3)7,6 (м, 2H), 7,4-7,3 (м, 3H), 4,3-4,2 (м, 2H), 4,0 (д, J=17,2 Гц, 1H), 3,4 (д,J=17,2 Гц, 1H), 2,1-2,0 (м, 2H), 1,3 (т, 3H), 1,0 (т, 3H). Получение 10. Трет-бутил (3S)-3-амино-4-гидрокси-5-(2,3,5,6-тетрафторфенокси)пентаноат (VIIIc). 2,3,5,6-тетрафторфенол подвергали взаимодействию по той же методике, описанной в получениях 5 и 6, с получением указанного в заголовке соединения с общим выходом 72%. 1H-ЯМР (400 МГц, ДМСО-d6)8,2 (шир, 2H), 7,6-7,5 (м, 1H), 5,9 (м, 1H), 4,3-4,41 (м, 3H), 3,6 (м,1H), 2,7 (м, 1H), 1,4 (с, 9H). Пример 5. Трет-бутил (3S)-3-[(5-этил-3-фенил-4,5-дигидро-5-изоксазолил)карбонил]амино-4 оксо-5-(2,3,5,6-тетрафторфенокси)пентаноат (Ic). Соединения из получений 9 и 10 подвергали взаимодействию по той же методике, описанной в получении 4 и примере 1, с получением указанного в заголовке соединения. 1(м, 2H), 4,9-4,8 (м, 1H), 3,7 (дд, J=17,6, 17,2 Гц, 1H), 3,3 (1H, д, J=17,2 Гц), 3,0-2,8 (м, 1H), 2,8-2,7 (м, 1H),2,1 (м, 1H), 1,9 (м, 1H), 1,4-1,3 (два с, 9H), 1,0 (м,3H). Пример 6. (3S)-3-[(5-Этил-3-фенил-4,5-дигидро-5-изоксазолил)карбонил]амино-4-оксо-5-(2,3,5,6 тетрафторфенокси) пентановая кислота (Icc). Соединение из примера 5 подвергали взаимодействию по той же методике, описанной в примере 2,с получением указанного в заголовке соединения. 1MC [М+Н]+ 497. Получение 11. Этил 5-этил-3-(1-нафтил)-4,5-дигидро-5-изоксазолкарбоксилат (VIc). 1-Нафтальдегид и этил 2-этилакрилат подвергали взаимодействию по той же методике, описанной в получениях 1, 2 и 3, с получением указанного в заголовке соединения. 1(д, J=17,2 Гц, 1H), 3,4 (д, J=17,2 Гц, 1H), 2,1-2,0 (м, 2H), 1,3 (т, 3H), 1,0 (т, 3H). Пример 7. Трет-бутил (3S)-3-([5-этил-3-(1-нафтил)-4,5-дигидро-5-изоксазолил]карбониламино)-4 оксо-(2,3,5,6-тетрафторфенокси)пентаноат (Id). Соединения из получений 11 и 10 подвергали взаимодействию по той же методике, описанной в получении 4 и примере 1, с получением указанного в заголовке соединения. 1H-ЯМР (400 МГц, CDCl3)8,9 (м, 1H), 7,9-7,8 (м, 3H), 7,6-7,4 (м, 4H), 6,5-6,9 (м, 1H), 5,1-4,9 (м,2H), 4,9 (м, 1H), 3,9 (дд, 1H), 3,5 (д, J=17,2 Гц, 1H), 3,0-2,9 (м, 1H), 2,8 (м, 1H), 2,2 (м, 1H), 2,0 (м, 1H), 1,41,3 (два с, 9H), 1,1 (м, 3H). Пример 8. (3S)-3-([5-Этил-3-(1-нафтил)-4,5-дигидро-5-изоксазолил]карбониламино)-4-оксо-5(2,3,5,6-тетрафторфенокси)пентановая кислота (Idd). Соединение из примера 7 подвергали взаимодействию по той же методике, описанной в примере 2,с получением указанного в заголовке соединения. 1MC [M + MeOH +Na]+ 601. Получение 12. Этил 5-этил-3-(2-нафтил)-4,5-дигидро-5-изоксазолкарбоксилат (VId). 2-Нафтальдегид и этил 2-этилакрилат подвергали взаимодействию по той же методике, описанной в получениях 1, 2 и 3, с получением указанного в заголовке соединения. 1- 13012080 Соединения из получений 12 и 10 подвергали взаимодействию по той же методике, описанной в получении 4 и примере 1, с получением указанного в заголовке соединения. 1(м, 1H), 1,4-1,3 (два с, 9H), 1,1-1,0(м, 3H). Пример 10. (3S)-3-([5-Этил-3-(2-нафтил)-4,5-дигидро-5-изоксазолил]карбониламино)-4-оксо-5(2,3,5,6-тетрафторфенокси)пентановая кислота (Iee). С соединения из примера 9 снимали защиту по той же методике, описанной в примере 2, и изомеры разделяли препаративной TCX с получением следующих двух соединений. Низкополярный диастереомер: 1(м, 1H), 5,0 (шир, 2H), 4,8 (м, 1H), 3,9 (д, J=17,6 Гц, 1H,), 3,6 (д, J=17,6 Гц, 1H,), 2,9-2,7 (м, 2H), 2,1-2,0 (м,1H), 2,0-1,9 (м, 1H), 0,9 (м, 3H). Получение 13. Этил 5-этил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолкарбоксилат (VIe). 1-Изохинолинальдегид и этил 2-этилакрилат подвергали взаимодействию по той же методике, описанной в получениях 1, 2 и 3. Указанное в заголовке соединение в виде активного хирального изомера разделяли ВЭЖХ на хиральной колонке OD (Daicel Chemical Industries, 2,00 см 25 см, OD00CJ-1C005,3% i-PrOH в гексане, 220 нм), которое затем использовали на последующей стадии. 1H-ЯМР (400 МГц, CDCl3)9,25 (м, 1H), 8,55 (д, 1H), 7,85 (д, 1H), 7,74-7,65 (м, 3H), 4,29 (м, 2H),4,13 (д, 1H), 3,71 (д, 1H), 2,11 (м, 2H), 1,33 (т, 3H), 1,06 (т, 3H). Пример 11. Трет-бутил (3S)-3-([5-этил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-4-оксо-(2,3,5,6-тетрафторфенокси)пентаноат (If). Соединения из получений 13 и 10 подвергали взаимодействию по той же методике, описанной в получении 4 и примере 1, с получением указанного в заголовке соединения. 1(м, 1H), 5,30-4,91 (м, 3H), 4,09 (два д, 1H), 3,72 (два д, 1H), 3,04-2,76 (м, 2H), 2,24 (м, 1H), 2,04 (м, 1H),1,45 и 1,35 (два с, 9H), 1,08 (два т, 3H). Пример 12. (3S)-3-([5-Этил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-4 оксо-(2,3,5,6-тетрафторфенокси)пентановая кислота (Iff). Соединение из примера 11 подвергали взаимодействию по той же методике, описанной в примере 2, с получением указанного в заголовке соединения. 1(м, 2H), 0,94 (два т, 3H). Масс: M + H 548. Пример 13. Трет-бутил 3-([5-этил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-5-фтор-4-оксопентаноат (Ig). Соединение из получения 13 и трет-бутил 3-амино-5-фтор-4-гидроксипентаноат подвергали взаимодействию по той же методике, описанной в получении 4 и примере 1, с получением указанного в заголовке соединения. 1H-ЯМР (400 МГц, CDCl3)9,15 (м, 1H), 8,55 (д, 1H), 7,87-7,66 (м, 5H), 5,22-4,89 (м, 3H), 4,12 (два д, 1H), 3,72 (два д, 1H), 3,05-2,75 (м, 2H), 2,22 (м, 1H), 2,04 (м, 1H), 1,45 и 1,34 (два с, 9H), 1,07 (два т, 3H). Пример 14. 3-([5-Этил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-5-фтор-4 оксопентановая кислота (Igg). Соединение из примера 13 подвергали взаимодействию по той же методике, описанной примере 2,с получением указанного в заголовке соединения. 1H-ЯМР (400 МГц, ДМСО-d6)9,03 (м, 1H), 8,67-8,59 (м, 2H), 8,С 8 (д, 1H), 7,97-7,78 (м, 3H), 5,265,07 (м, 2H), 4,75 (м, 1H), 3,94 (два д, 1H), 3,67 (два д, 1H), 2,88-2,58 (м, 2H), 2,07-1,94 (м, 2H), 0,96 (два т,3H). Масс: M + H 402. Пример 15. Этил 3-([5-этил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-5 фтор-4-оксопентаноат (Ihh). Соединение из примера 14 подвергали взаимодействию по методике, описанной в Tetrahedron Letters, 1994, 35 (52), 9693-9696, с получением указанного в заголовке соединения. 1H-ЯМР (400 МГц, CDCl3)9,15 (м, 1H), 8,55 (д, 1H), 7,89-7,67 (м, 5H), 5,23-4,94 (м, 3H), 4,18 (м,- 14012080 2H), 4,11 (два д, 1H), 3,72 (два д, 1H), 3,08-2,82 (м, 2H), 2,22 (м, 1H), 2,05 (м, 1H), 1,29-1,04 (м, 6H). Получение 14. Метил 5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолкарбоксилат) и разделение (VIf). 1-Изохинолинальдегид и метил 2-изопропилакрилат подвергали взаимодействию по той же методике, описанной в получениях 1, 2 и 3, с получением указанного в заголовке соединения. Из полученного таким образом соединения выделяли (5R)-активный хиральный изомер (9,7 мин - 11,7 мин) препаративной ВЭЖХ на хиральной колонке OD (Daicel Chemical Industries, 2,00 см 25 см, OD00CJ-1 COO5, 5% iPrOH в гексане, 14 мл/мин, 220 нм) (другой (5S)-изомер элюировали со временем удерживания 15,3-20,1 мин), которое затем использовали на последующей стадии (см. получение 23 для разделения после гидролиза). 1H-ЯМР (500 МГц, CDCl3)9,24 (м, 1H), 8,55 (д, 1H), 7,85 (д, 1H), 7,72 (т, 3H), 7,67 (м, 2H), 4,11 (д,1H), 3,83 (с, 3H), 3,74 (д, 1H), 2,50 (септет, 1H), 1,07 (д, 3H), 1,02 (д, 3H) . Пример 16. Трет-бутил 5-фтор-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-4-оксопентаноат (Ih). Соединение из получения 14 и трет-бутил 3-амино-5-фтор-4-гидроксипентаноат подвергали взаимодействию по той же методике, описанной в получении 4 и примере 1, с получением указанного в заголовке соединения. 1H-ЯМР (500 МГц, CDCl3)9,14 (м, 1H), 8,55 (д, 1H), 7,87-7,65 (м, 5H), 5,23-4,93 (м, 2 Н), 4,90 (м,1H), 4,05-4,00 (два д, 1H), 3,84-3,79 (два, 1H), 3,06-2,74 (м, 2H), 2,40 (м, 1H), 1,45 и 1,34 (два с, 9H), 1,121,07 (м, 6H). Пример 17. 5-Фтор-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил амино)-4-оксопентановая кислота (Iii). Соединение из примера 16 подвергали взаимодействию по той же методике, описанной в примере 2, с получением указанного в заголовке соединения 5S)-изомер, Iii-u, получали по той же методике). 1H-ЯМР (400 МГц, ДМСО-d6)9,00 (м, 1H), 8,63-8,48 (м, 2H), 8,08 (д, 1H), 7,97 (м, 1H) 7,87-7,76 (м,2H), 5,31-4,82 (шир, 2H), 4,74 (м, 1H), 3,91 (два д, 1H), 3,73 (два д, 1H), 2,88-2,61 (м, 2H), 2,33 (м, 1H),0,98 (м, 6H). Масс: M + H 416. Получение 15. Этил 5-этил-3-(4-хинолинил)-4,5-дигидро-5-изоксазолкарбоксилат (VIg). 4-Хинолинальдегид и этил 2-этилакрилат подвергали взаимодействию по той же методике, описанной в получениях 1, 2 и 3, с получением указанного в заголовке соединения. 1H-ЯМР (400 МГц, CDCl3)8,95 (д, 1H), 8,89 (м, 1H), 8,11 (д, 1H), 7,83 (м, 1H), 7,71 (м, 1H), 7,65 (д,1H), 4,27 (м, 2H), 4,01 (д, 1H), 3,67 (д, 1H), 2,10 (м, 2H), 1,31 (т, 3H), 1,02 (т, 3H). Пример 18. Трет-бутил 3-([5-этил-3-(4-хинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-5 фтор-4-оксопентаноат (Ii). Соединение из получения 15 и трет-бутил 3-амино-5-фтор-4-гидроксипентаноат подвергали взаимодействию по той же методике, описанной в получении 4 и примере 1, с получением указанного в заголовке соединения. 1(два с, 9H), 1,06 (два т, 3H). Пример 19. 3-([5-Этил-3-(4-хинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-5-фтор-4 оксопентановая кислота (Ijj). Соединение из примера 18 подвергали взаимодействию по той же методике, описанной в примере 2, с получением указанного в заголовке соединения. 1H-ЯМР (400 МГц, ДМСО-d6)9,16-9,10 (м, 2H), 8,25-7,86 (м, 5H), 5,20 (шир, 2H), 4,75 (м, 1H),4,00-3,89 (два д, 1H), 3,73 (два д, 1H), 2,87-2,71 (м, 2H), 2,26-2,05 (м, 2H), 1,07 (два т, 3H). Масс: M + H 402. Получение 16. Этил 3-(бензотиофен-2-ил)-5-этил-4,5-дигидро-5-изоксазолкарбоксилат (VIh). Оксим бензотиофен-2-альдегида (400 мг, 2,26 ммоль), полученный по той же методике, описанной в получении 1, растворяли в ТГФ (25 мл) и смесь выдерживали при 0C. Этил 2-этилакрилат (434 мг, 1,5 экв.) и триэтиламин (7 капель) растворяли в ТГФ (5 мл), полученный таким образом раствор медленно добавляли к вышеуказанному и затем добавляли раствор гипохлорита натрия (6,0 мл). Реакционный раствор подогревали до комнатной температуры и перемешивали в течение 4 ч. Добавляли воду (20 мл) и смесь экстрагировали этилацетатом (40 мл 2), промывали водным раствором хлорида натрия (20 мл),высушивали над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (смесь 20% этилацетат-гексан) с получением указанного в заголовке соединения (121 мг, выход 18%). 1H-ЯМР (400 МГц, CDCl3)7,82-7,75 (м, 2H), 7,40-7,32 (м, 3H), 4,28 (м, 2H), 3,90 (д, 1H), 3,31 (д,- 15012080 1H), 2,07 (м, 2H), 1,33 (т, 3H), 1,01 (т, 3H). Пример 20. Трет-бутил 3-([3-(бензотиофен-2-ил)-5-этил-4,5-дигидро-5-изоксазолил]карбонил амино)-5-фтор-4-оксопентаноат (Ij). Соединение из получения 16 и трет-бутил 3-амино-5-фтор-4-гидроксипентаноат подвергали взаимодействию по той же методике, описанной в получении 4 и примере 1, с получением указанного в заголовке соединения. 1(3-([3-(Бензотиофен-2-ил)-5-этил-4,5-дигидро-5-изоксазолил]карбониламино)-5-фтор-4-оксопентановая кислота) (Ikk). Соединение из примера 20 подвергали взаимодействию по той же методике, описанной в примере 2, с получением указанного в заголовке соединения. 1H-ЯМР (400 МГц, ДМСО-d6)8,63 (м, 1H), 8,11-7,79 (м, 3H), 7,47-7,36 (м, 2H), 5,24-5,06 (м, 2H),4,73 (м, 1H), 3,79 (два д, 1H), 3,53 (два д, 1H), 2,83-2,58 (м, 2H), 2,03-1,86 (м, 2H), 0,91 (два т, 3H). Масс: M + H 407. Получение 17. Этил 3-(1,3-диметил-1 Н-индол-2-ил)-5-этил-4,5-дигидро-5-изоксазолкарбоксилат (VIi). Оксим 1,3-диметил-1 Н-индол-2-альдегида (356 мг, 2,07 ммоль) растворяли в дихлорметане (20 мл) и смесь выдерживали при 0C. Этил 2-этилакрилат (345 мг, 1,3 экв.) и триэтиламин (6 капель) растворяли в дихлорметане (5 мл), полученный таким образом раствор медленно добавляли к вышеуказанному и затем добавляли раствор гипохлорита натрия (5,5 мл). Реакционный раствор подогревали до комнатной температуры и перемешивали в течение 4 ч. Добавляли воду (20 мл) и смесь экстрагировали дихлорметаном (40 мл 2), промывали водным раствором хлорида натрия (20 мл), высушивали над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (смесь 15% этилацетат-гексан) с получением указанного в заголовке соединения (230 мг, выход 35%). 1H-ЯМР (400 МГц, CDCl3)7,60 (д, 1H), 7,31 (м, 2H), 7,12 (м, 1H), 4,29 (м, 2H), 3,98 (д, 1H), 3,94 (с,3H), 3,40 (д, 1H), 2,47 (с, 3H), 2,03 (м, 2H), 1,34 (т, 3H), 1,04 (т, 3H). Масс: M + H 315. Пример 22. Трет-бутил (3S)-3-([3-(1,3-диметил-1 Н-индол-2-ил)-5-этил-4,5-дигидро-5-изоксазолил] карбониламино)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентаноат (Iк). Соединения из получений 17 и 10 подвергали взаимодействию по той же методике, описанной в получении 4 и примере 1, с получением указанного в заголовке соединения. 1(т, 1H), 5,12-4,90 (м, 3H), 3,95 (два д, 1H), 3,89 (два с,3H), 3,45 (два д, 1H), 3,03-2,79 (м, 2H), 2,44 (два с,3H), 2,22 (м, 1H), 2,01 (м, 1H), 1,58 и 1,37 (два с, 9H), 1,05 (два т, 3H). Пример 23. (3S)-3-([3-(1,3-Диметил-1 Н-индол-2-ил)-5-этил-4,5-дигидро-5-изоксазолил]карбонил амино)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентановая кислота (Ill). Соединение из примера 22 подвергали взаимодействию по той же методике, описанной в примере 2, с получением указанного в заголовке соединения. 1(шир, 2H), 4,83 (м, 1H), 3,84 (два с,3H), 3,76 (два д, 1H), 3,59 (два д ,1H), 2,91-2,60 (м, 2H), 2,50 (два с,3H), 2,07-1,91 (м, 2H), 0,95 (два т, 3H). Пример 24. Трет-бутил 3-([3-(1,3-диметил-1 Н-индол-2-ил)-5-этил-4,5-дигидро-5-изоксазолил] карбониламино)-5-фтор-4-оксопентаноат (Il). Соединение из получения 17 и трет-бутил 3-амино-5-фтор-4-гидроксипентаноат подвергали взаимодействию по той же методике, описанной в получении 4 и примере 1, с получением указанного в заголовке соединения. 1(два т, 3H). Пример 25. 3-([3-(1,3-Диметил-1 Н-индол-2-ил)-5-этил-4,5-дигидро-5-изоксазолил]карбониламино)-5-фтор-4-оксопентановая кислота (Imm). Соединение из примера 24 подвергали взаимодействию по той же методике, описанной в примере 2, с получением указанного в заголовке соединения. 1- 16012080 Получение 18. Этил 5-этил-3-(1-нафтилметил)-4,5-дигидро-5-изоксазолкарбоксилат (VIj). 1-Нафтилацетальдегид и этил 2-этилакрилат подвергали взаимодействию по той же методике, описанной в получениях 1, 2 и 3, с получением указанного в заголовке соединения. 1(т, 3H), 0,7 (т, 3H). Пример 26. Трет-бутил (3S)-3-([5-этил-3-(1-нафтилметил)-4,5-дигидро-5-изоксазолил]карбонил амино)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентаноат (Im). Соединения из получений 18 и 10 подвергали взаимодействию по той же методике, описанной в получении 4 и примере 1, с получением указанного в заголовке соединения. 1(м, 1H), 1,7 (м, 1H), 1,4 (два с, 9H), 0, 8 (м, 3H) . Пример 27. (3S)-3-([5-Этил-3-(1-нафтилметил)-4,5-дигидро-5-изоксазолил]карбониламино)-4 оксо-5-(2,3,5,6-тетрафторфенокси)пентановая кислота (Inn). Соединение из примера 26 подвергали взаимодействию по той же методике, описанной в примере 2, с получением указанного в заголовке соединения. 1MC: [M+H]+ 516. Пример 28. (3S)-5-(Трет-бутокси)-3-[(5-этил-3-[2-(1-нафтил)этил]-4,5-дигидро-5-изоксазолилкарбонил)амино]-2,5-диоксопентил 2,6-дихлорбензоат (In). 1-Нафтилпропиональдегид и соединение из получения 6 подвергали взаимодействию по той же методике, описанной в получениях 1, 2, 3 и 4 и примере 1, с получением указанного в заголовке соединения. 1H-ЯМР (400 МГц, CDCl3)8,00 (д, 1H), 7,85 (м, 1H), 7,76 (м, 2H), 7,57-7,28 (м, 7H), 7,34-7,27 (м,3H), 5,20-5,05 (м, 2H), 4,94 и 4,88 (два м, 1H), 3,39-3,27 (м, 3H), 2,97-2,72 (м,5H), 2,07 (м, 1H), 1,86 (м,1H), 1,46 и 1,45 (два с, 9H), 1,00 и 0,96 (два т, 3H). Пример 29. (3S)-5-[(2,6-Дихлорбензоил)окси]-3-[(5-этил-3-[2-(1-нафтил)этил]-4,5-дигидро-5-изоксазолилкарбонил)амино]-4-оксопентановая кислота (Ioo). Соединение из примера 28 подвергали взаимодействию по той же методике, описанной в примере 2, с получением указанного в заголовке соединения. 1H-ЯМР (400 МГц, ДМСО-d6)8,45 (шд, 1H), 8,06 (д, 1H), 7,90 (д, 1H), 7,77 (д, 1H), 7,60-7,37 (м,7H), 5,21-5,03 (м, 2H), 4,73 (м, 1H), 3,06 (м, 2H), 2,65 (шд, 4H), 1,91 и 1,74 (два м, 2H), 0,84 (м, 3H). Получение 19. Этил 5-этил-3-[(1-нафтилокси)метил]-4,5-дигидро-5-изоксазолкарбоксилат (VIl). Производное 2-нитроэтанолпиранила (смотри Synthesis, 1993, 12, 1206-1208) и этил 2-этилакрилат подвергали взаимодействию и с полученного продукта снимали защиту с получением этил 5-этил-(3 гидроксиметил)-4,5-дигидро-5-изоксазолкарбоксилата (23%). Данное соединение подвергали бромированию (CBr4, PPh3, 94%) и затем подвергали взаимодействию с 1-нафтолом (NaH, ДМФА, 82%) с получением указанного в заголовке соединения. 1H-ЯМР (400 МГц, CDCl3)8,20 (м, 1H), 7,81 (д, 1H), 7,55-7,42 (м, 3H), 7,36 (м, 1H), 6,88 (д, 1H),5,01 (дд, 2H), 4,22 (м, 2H), 3,61 (д, 1H), 3,07 (д, 1H), 1,97 (м, 2H), 1,27 (т, 3H), 0,93 (т, 3H). Пример 30. (3S)-3-[(5-Этил-3-[(1-нафтилокси)метил]-4,5-дигидро-5-изоксазолилкарбонил)амино]4-оксо-5-(2,3,5,6-тетрафторфенокси)пентановая кислота (Ipp). Соединения из получений 19 и 10 подвергали взаимодействию по той же методике, описанной в получении 4 и в примерах 1 и 2, с получением указанного в заголовке соединения. 1H-ЯМР (400 МГц, ДМСО-d6)8,51 (шир, 1H), 8,13 (м, 1H), 7,87 (м, 1H), 7,54-7,38 (м, 5H), 7,02 (м,1H), 5,18-4,97 (м, 4H), 4,71 (м, 1H), 3,58 (два д, 1H), 3,21 (два д, 1H), 2,68 (м, 2H), 1,97 (м, 1H), 1,81 (м,1H), 0,86 (два т, 3H). Масс: M + H 577. Пример 31. (3S)-3-[(3-[(4-Хлор-1-нафтил)окси]метил-5-этил-4,5-дигидро-5-изоксазолил)карбонил]амино-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентановая кислота (Iqq). Бромпроизводное, полученное в качестве промежуточного продукта в получении 19, и 4-хлор-1 нафтол подвергали взаимодействию по той же методике, описанной в получении 19, с получением этил 5-этил-3-[(4-хлор-1-нафтилокси)метил]-4,5-дигидро-5-изоксазолкарбоксилата, который затем подвергали взаимодействию по той же методике, описанной в получении 4 и примерах 1 и 2, с получением указанного в заголовке соединения. 1(два т, 3H). Масс: M + H 611. Получение 20. Трет-бутил (3S)-3-амино-4-гидроксибутаноат. К N-бензилоксикарбонилтрет-бутиласпарагиновой кислоте (3,0 г, 9,28 ммоль) и NMM (1,12 мл,1,1 экв.) добавляли сухой тетрагидрофуран (20 мл) в атмосфере азота. Реакционный раствор выдерживали при 0C. Добавляли изобутилхлорформиат (1,26 мл, 1,05 экв.) и смесь перемешивали примерно в течение 40 мин. Полученную таким образом суспензию фильтровали в атмосфере азота и полученный раствор добавляли к NaBH4 (702 мг, 2,0 экв.) [смесь метанол (10 мл) - сухой тетрагидрофуран (20 мл)] при-78 С. Полученную смесь медленно подогревали до комнатной температуры (в течение 2 ч). Реакцию останавливали уксусной кислотой (2,3 мл) и реакционный раствор упаривали при пониженном: давлении для удаления метанола. Остаток экстрагировали этилацетатом (50 мл 2), промывали водой и водным раствором хлорида натрия, высушивали (безводный Na2SO4), концентрировали при пониженном давлении и разделяли-очищали колоночной хроматографией (смесь этилацетат-гексан, 1:5) с получением спирта (2,52 г, выход 88%). Бензилоксикарбонильную группу полученного выше соединения удаляли (Pd/C) в атмосфере баллонного водорода с получением указанного в заголовке соединения (выход 100%). 1H-ЯМР (400 МГц, ДМСО-d6)4,60 (шс, 1H), 3,21 (м, 2H), 2,96 (м, 1H), 2,41 (дд, 1H), 2,03 (дд, 1H),1,40 (с, 9H). Получение 21. Трет-бутил (3S)-4-гидрокси-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил] карбониламино)бутаноат (XVI). Соединение из получения 14 подвергали взаимодействию по той же методике, описанной в получении 4, с получением активного производного карбоновой кислоты (VIIf). Смесь указанного активного производного карбоновой кислоты (VIIf, 22 4 мг, 0,7 9 ммоль), аминоспирта, полученного в получении 20 (166 мг, 1,2 экв.), и HATU (390 мг, 1,3 экв.) охлаждали до 0C, добавляли триэтиламин (0,33 мл, 3,0 экв.) в растворителе ДМФА (5 мл) и полученную смесь подвергали взаимодействию в течение 2 ч. Растворитель выпаривали при пониженном давлении и остаток экстрагировали этилацетатом (50 мл 2), промывали водой, водным раствором бикарбоната натрия и водным раствором хлорида натрия, высушивали(безводный Na2SO4), концентрировали при пониженном давлении и очищали колоночной хроматографией (смесь 60-70% ЕА/Нех) с получением указанного в заголовке соединения (330 мг, выход 95%). 1H-ЯМР (400 МГц, CDCl3)9,16 (д, 1H), 8,55 (д, 1H), 7,85 (д, 1H), 7,73-7,70 (м, 3H), 7,56 (NH, д,1H), 4,26 (м, 1H), 4,12 (д, 1H), 4,04 (д, 1H), 3,79 (д, 1H), 3,75 (т, 2H), 2,94 (шс, 1H), 2,57 (м, 2H), 2,41 (м,1H), 1,10 и 1,07 (два д, 6H). Пример 32. 6-(Трет-бутил)1-этил(2 Е,4S)-4-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5 изоксазолил]карбониламино)гексендиоат (Iq). К соединению из получения 21 (107 мг, 0,24 ммоль) и реактиву Десс-Мартина (153 мг, 1,5 экв.) добавляли сухой дихлорметан (4 мл), и смесь перемешивали в течение 1 ч при комнатной температуре и концентрировали при пониженном давлении. К остатку добавляли сухой ТГФ (3 мл) и (карбоэтоксиметилен)трифенилфосфоран) (108 мг, 1,3 экв.) и смесь кипятили с обратным холодильником в течение 2 ч. Реакционную смесь экстрагировали этилацетатом (20 мл 2), промывали водой, насыщенным водным раствором бикарбоната натрия и водным раствором хлорида натрия, высушивали (безводный Na2SO4),концентрировали при пониженном давлении и предварительно очищали препаративной хроматографиейH-ЯМР (500 МГц, CDCl3) большего изомера 9,15 (д, 1H), 8,54 (д, 1H), 7,86 (д, 1H), 7,74-7,62 (м,4H), 6,93 (дд, 1H), 6,00 (дд, 1H), 4,98 (м, 1H), 4,19 (квт, 2H), 4,02 (д, 1H), 3,81 (д, 1H), 2,58 (м, 2H), 2,43 (м,1H), 1,36 (с, 9H), 1,27 (т, 3H), 1,07 и 1,06 (два д, 6H). Пример 33. (3S,4E)-6-Этокси-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-6-оксо-4-гексеновая кислота (Irr). Соединение из примера 32 подвергали взаимодействию по той же методике, описанной в примере 2, с получением указанного в заголовке соединения. 1MC: M + H 454. Пример 34. Трет-бутил (3S,4E)-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-5-(метилсульфонил-4-пентеноат) (Ir). Безводный дихлорметан (4 мл) добавляли к соединению из примера 21 (109 мг, 0,25 ммоль) и реактиву Десс-Мартина (157 мг, 1,5 экв.), и смесь перемешивали в течение 1 ч при комнатной температуре, и концентрировали при пониженном давлении. Реакцию останавливали изопропиловым спиртом (0,5 мл).- 18012080 Твердое вещество удаляли фильтрованием с использованием целита при пониженном давлении. Фильтрат экстрагировали этилацетатом (20 мл 2), промывали водой, насыщенным водным раствором бикарбоната натрия и водным раствором хлорида натрия, высушивали (безводный Na2SO4), концентрировали при пониженном давлении с получением альдегида (540 мг, выход 99%). Диэтилметилсульфонометанфосфонат (113 мг, 2,0 экв., Synthesis, 1969, 170) растворяли в ТГФ (3 мл) и добавляли NaH (60% дисперсия в минеральном масле, 20 мг, 2,0 экв.) и полученный выше альдегид, и смесь кипятили с обратным холодильником в течение 2 ч. После экстракции этилацетатом (20 мл 2) экстракт промывали водой, насыщенным водным раствором бикарбоната натрия и водным раствором хлорида натрия, высушивали (безводный Na2SO4), концентрировали при пониженном давлении и очищали препаративной хроматографией (смесь 60% этилацетат/гексан) с получением указанного в заголовке соединения (52 мг, выход 41%) с соотношением диастереомеров 4:1. 1H-ЯМР (500 МГц, CDCl3) большего изомера 9,14 (д, 1H), 8,55 (д, 1H), 7,86 (д, 1H), 7,76-7,65 (м,4H), 6,92 (дд, 1H), 6,57 (дд, 1H), 5,03 (м, 1H), 4,02 (д, 3,81 (д, 1H), 2,94 (с, 3H), 2,61 (м, 2H), 2,41 (септет,1H), 1,36 (с, 9H), 1,10 и 1,08 (два д, 6H) . Пример 35. (3S,4E)-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-5-(метилсульфонил)-4-пентеновая кислота (Iss). Соединение из примера 34 подвергали взаимодействию по той же методике, описанной в примере 2, с получением указанного в заголовке соединения. 1MC: M + H 460. Способ получения примеров 36-42. Соединения, которые получали взаимодействием (изо)хинолин-альдегида (или 1- или 2 нафтальдегида) и этил 2-этилакрилата (или этил 2-пропилакрилата) по той же методике, описанной в получениях 1, 2 и 3 (или получениях 1 и 16), очищали, если необходимо, препаративной ВЭЖХ с использованием хиральной колонки OD для выделения активных хиральных изомеров. Выделенные активные хиральные или неактивные хиральные изомеры гидролизовали по той же методике, описанной в получении 4, и полученные соединения подвергали взаимодействию с трет-бутил 3-амино-5-фтор-4 гидроксипентаноатом по той же методике, описанной в примерах 1 и 2, с получением указанных в заголовках соединений из последующих примеров 36-42. Пример 36. 5-Фтор-3-([(5S)-3-(1-изохинолинил)-5-пропил-4,5-дигидро-5-изоксазолил]карбонил амино)-4-оксопентановая кислота (Itt). 1(м, 6H). Масс: M + H 416. Способ получения примеров 43-48. Соединения, полученные взаимодействием ароматического альдегида (Bioorg. Med. Chem. Lett.,1996, 6, p. 2173, J. Org. Chem., 1978, 43, 1372) и этил 2-этилакрилата (или этил 2-изопропилакрилата) по той же методике, описанной в получениях 1, 2 и 3 (или получениях 1 и 16), очищали, если необходимо,препаративной ВЭЖХ с использованием хиральной колонки OD для выделения активных хиральных изомеров. Выделенные активные хиральные или неактивные хиральные изомеры гидролизовали по той же методике, описанной в получении 4, и полученные соединения подвергали взаимодействию с третбутил 3-амино-5-фтор-4-гидроксипентаноатом по той же методике, описанной в примерах 1 и 2, с получением указанных в заголовках соединений из последующих примеров 43-48. Пример 43. 3-([5-Этил-3-(2-изопропилфенил)-4,5-дигидро-5-изоксазолил]карбониламино)-5 фтор-4-оксопентановая кислота (Iaa1). 1H-ЯМР (500 МГц, CDCl3)7,69 (с, 1H), 7,48 (д, 1H), 7,41 (д, 1H), 7,35 (т, 1H), 4,74-4,50 (м, 3H),3,69 (д, 1H), 3,40 (д, 1H), 3,06-2,77 (м, 2H), 2,32 (м, 1H), 1,33 (с, 9H), 1,04 (м, 6H). Масс: M + H 421. Пример 48. 3-[(3-[1,1'-Бифенил]-3-ил-5-изопропил-4,5-дигидро-5-изоксазолил)карбонил]амино-5 фтор-4-оксопентановая кислота (Iaa6). 3-Бифенилкарбоксальдегид (см. Synthesis, 2003, 337) использовали в качестве исходного вещества для получения указанного в заголовке соединения. 1H-ЯМР (500 МГц, ДМСО-d6)8,42 (шс, 1H), 7,87 (д, 1H), 7,73-7,69 (м, 4H), 7,52 (м, 1H), 7,45 (м,2H), 7,38 (м, 1H), 5,03 (шс, 2H), 4,63 (м, 1H), 3,73-3,57 (м, 2H), 2,67-2,63 (два м, 2H), 2,22 (м, 1H), 0,89 (м,6H). Масс: M + H 441. Способ получения примеров 49-59. 4-Замещенные пиридин-2-карбоксальдегиды получали способом, описанным в патенте США 6043248, JOC 1982, 47, р. 4315, и их подвергали взаимодействию по той же методике, описанной в- 20012080 получениях 1, 2 и 3 (или получениях 1 и 16). Полученные соединения очищали, если необходимо, препаративной ВЭЖХ с использованием хиральной колонки OD для выделения активных хиральных изомеров. Выделенные активные хиральные или неактивные хиральные изомеры гидролизовали по той же методике, описанной в получении 4, и полученные соединения подвергали взаимодействию с трет-бутил 3 амино-5-фтор-4-гидроксипентаноатом по той же методике, описанной в примерах 1 и 2, с получением указанных в заголовках соединений из последующих примеров 49-59. Пример 49. 3-([5-Этил-3-(2-пиридинил)-4,5-дигидро-5-изоксазолил]карбониламино)-5-фтор-4 оксопентановая кислота (Iaa7). 1H-ЯМР (400 МГц, CDCl3)8,68 (д, 1H), 8,14 (с, 1H), 7,68 (м, 1H), 7,58 (м, 1H), 7,54-7,43 (м, 5H),4,86-4,60 (м, 3H), 3,92-3,87 (два д, 1H), 3,62 (д, 1H), 3,09-2,86 (м, 2H),2,39 (м, 1H), 1,11-1,06 (м, 6 Н). Масс: M + H 442. Способ получения примеров 60-63.(2S)-4-(трет-бутокси)-2-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-4-оксобутановую кислоту [полученную сочетанием соединения (VIIf) с Asp(О-трет-Bu)OMe и гидролизом] подвергали взаимодействию по той же методике, описанной в получении 5, с получением производного бромметилкетона(3S)-5-бром-3-([(5R)-5-изопропил-3-(1 изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-4-оксопентаноата). Данное производное бромметилкетона подвергали взаимодействию с дифенилфосфиновой кислотой в KF/ДМФА (см. получение 5) с получением производного дифенилфосфорилоксиметилкетона, которое затем подвергали взаимодействию по той же методике, описанной в примере 2, с получением указанного в заголовке соединения (соединение из примера 60). Соединения из последующих примеров 61-63 получали из 1-фенил-3-(трифторметил)-1 Н-пиразол 5-ола, 3-бензил-4-гидрокси-2(5H)-фуранона или изомасляной кислоты по той же методике, описанной выше. Пример 60. (3S)-5-[(Дифенилфосфорил)окси]-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-4-оксопентановая кислота (Iaa18). 1H-ЯМР (500 МГц, ДМСО-d6)12,39 (шс, 1H), 8,96 (т, 1H), 8,73 (м, 1H), 8,58 (дд, 1H), 8,04 (д, 1H),7,92 (д, 1H), 7,81 (т, 1H), 7,73 (м, 1H), 4,78 (м, 2H), 4,68 (м, 1H), 3,87 (т, 1H), 3,73-3,68 (два д, 1H), 2,792,60 (два м, 2H), 2,56 (м, 1H), 2,31 (м, 1H), 1,05 (д, 3H), 0,95 (м, 9H). Масс: M + H 484. Пример 64. (3S)-3-([(5R)-5-Изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил амино)-4-оксо-5-гексеновая кислота (Iaa22). Производное амида Вейнреба (2S)-4-(трет-бутокси)-2-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5 дигидро-5-изоксазолил]карбониламино)-4-оксобутановой кислоты (конденсированное производное сN,О-диметилгидроксиламином) и бромид винилмагния подвергали взаимодействию и полученное соединение подвергали взаимодействию по той же методике, описанной в примере 2, с получением указанного в заголовке соединения. 1(д, 1H), 7,92 (д, 1H), 7,83-7,72 (м, 2H), 6,47 (м, 1H), 6,22-6,11 (два дд, 1H), 5,71-5,62 (два дд, 1H), 4,77 (м,1H), 3,90-3,79 (м, 1H), 3,72-3,64 (м, 1H), 2,82 (м, 1H), 2,62-2,49 (м, 1H), 2,30 (м, 1H), 0, 94 (м, 6H). Масс: M + H 410. Получение 22. Трет-бутил (3S)-3-амино-4-гидрокси-5-(2-пиридинилокси)пен-таноат (VIIIf). Производное бромметилкетона X (3,2 г, 7,93 ммоль), промежуточное соединение в получении 5,- 22012080 растворяли в бензоле (30 мл), добавляли Ag2CO3 (2,62 г, 1,2 экв.) и 2-гидроксипиридин (0,93 г, 1,2 экв.) и смесь перемешивали при кипячении с обратным холодильником при 80C в течение 3 суток. Реакционную смесь фильтровали через целит, концентрировали при пониженном давлении и очищали колоночной хроматографией с получением производного 2-пиридинилоксиметилкетона (XIf) (4 66 мг, выход 14%). Полученное таким образом производное 2-пиридинилоксиметилкетона (XIf) (466 мг, 0,548 ммоль) растворяли в смеси растворителей тетрагидрофуран/метанол (3:2 об./об.) (10 мл), добавляли NaBH4 (43 мг, 2,0 экв.) при 0C и смесь перемешивали в течение 30 мин при комнатной температуре. Реакцию останавливали насыщенным раствором хлорида аммония и реакционный раствор концентрировали при пониженном давлении. Остаток экстрагировали этилацетатом, промывали водой и водным раствором хлорида натрия, высушивали (безводный Na2SO4), концентрировали при пониженном давлении с получением соединения (XIIf) (230 мг), где кетонную группу восстанавливали до гидроксильной группы. Бензилоксикарбонильную группу полученного выше соединения удаляли (Pd/C) в атмосфере баллонного водорода в течение 40 мин с получением указанного в заголовке соединения (155 мг, выход 99%). Способ получения примеров 65-66. Соединение VIIf (или VIIu) и VIIIf подвергали взаимодействию по той же методике, описанной в примерах 1 и 2, с получением указанных в заголовках соединений примеров 65-66. В данном случае VIIu представляет 5-этил-3-(2-изопропилфенил)-4,5-дигидро-5-изоксазолкарбоновую кислоту. Пример 65. (3S)-3-([(5R)-5-Изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбонил амино)-4-оксо-5-(2-пиридинилокси)пентановая кислота (Iaa23). 1(3S)-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5 изоксазолил]карбониламино)-4-оксо-5-(2-пиридинилокси)пентаноат (49 мг, 90 мкмоль), полученный после окисления Десс-Мартина в примере 65, растворяли в дихлорметане (2 мл), добавляли метилтрифторметансульфонат (1,1 экв., 10,1 мл) и смесь перемешивали в течение 1 суток при комнатной температуре. После концентрирования при пониженном давлении остаток подвергали той же методике, описанной в примере 2, с получением указанного в заголовке соединения (60 мг). 1(м, 2H), 2,87-2,60 (м, 2H), 2,33 (м, 1H), 0,98 и 0,94 (два д, 6H). Масс: M + H 505,20. Пример 68. 2-[(3S)-4-Карбокси-([5-этил-3-(2-изопропилфенил)-4,5-дигидро-5-изоксазолил]карбониламино)-2-оксобутил]окси-1-метилпиридиний трифторметансульфонат (Iaa26). Промежуточный трет-бутил (3S)-3-([5-этил-3-(2-изопропилфенил)-4,5-дигидро-5-изоксазолил]карбониламино)-4-оксо-5-(2-пиридинилокси)пентаноат (55 мг, 0,105 ммоль), полученный после окисления Десс-Мартина в примере 66, растворяли в дихлорметане (2 мл), добавляли метилтрифторметансульфонат(1,1 экв., 13 мл) и смесь перемешивали в течение 1 суток при комнатной температуре. После концентрирования при пониженном давлении остаток подвергали той же методике, описанной в примере 2, с получением указанного в заголовке соединения (59 мг, выход 94%). 1(м,3H). Масс: M + H 482,17. Способ получения примеров 69-70. Оксим 5-хлор-1-метил-1 Н-индол-2-альдегида или 1,5-диметил-1 Н-индол-2-альдегида подвергали взаимодействию с трет-бутил 3-амино-5-фтор-4-гидроксипентаноатом по той же методике, описанной в получениях 1, 17, 4 и примерах 1, 2, с получением указанных в заголовках примеров 69-70. Пример 69. 3-([3-(5-Хлор-1-метил-1 Н-индол-2-ил)-5-изопропил-4,5-дигидро-5-изоксазолил]карбониламино)-5-фтор-4-оксопентановая кислота (Iaa27).(два с, 3H), 2,34 (м, 1H), 1,05 (м, 6H). Масс: M + H 432. Получение 23. Выделение (5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолкарбоновой кислоты. 5-Изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолкарбоновую кислоту растворяли в ацетоне (190 мл) при нагревании при 60C и добавляли (S)-а-метилбензиламин (14,5 мл, 112 ммоль). Реакционную смесь охлаждали до комнатной температуры и перемешивали в течение 4 ч. Полученный осадок отфильтровывали и три раза промывали ацетоном (40 мл). Полученную таким образом соль (S)-а-метилбензиламина (5R)-5-изопропил-3-(1-изохинолинил)4,5-дигидро-5-изоксазолкарбоновой кислоты растворяли в смеси (150 мл) ацетон-вода (4:1) при нагревании при 90C, охлаждали до комнатной температуры и перемешивали в течение 3 ч. Полученный осадок отфильтровывали и три раза промывали ацетоном (40 мл) с получением чистой соли (S)-аметилбензиламина (5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолкарбоновой кислоты(12,8 г, 24,3%, 99,8% ее). Оптическую чистоту (5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолкарбоновой кислоты определяли с использованием хиральной колонки Cel OD (4,6250 мм, 5 мм). Смесь нгексан/изопропанол/трифторуксусная кислота (92/8/0,1) использовали в качестве подвижной фазы со скоростью 1 мл/мин, температура колонки равнялась 40C, и длина волны детектирования равнялась 225 нм. Определяли два оптических изомера со временем удерживания соответственно 7,8 мин (R-изомер) и 21,1 мин (S-изомер). Пример 71. Выделение соединения (Iii-1). 1) Выделение соединения, используемого в качестве затравки. Два диастереомера из примера 16 разделяли при использовании препаративной жидкостной хроматографии на колонке с силикагелем (диаметр 40 мм, DYNAMAX-100 ). Смесь нгексан/этанол/трифторуксусная кислота (4000/32/2) использовали в качестве подвижной фазы со скоростью 50 мл/мин, и желаемый диастереомер собирали в соотношении 99:1 при времени удерживания 6266 мин при длине волны детектирования 227 нм (два диастереомера широко элюировались при постоянном изменении соотношения до 86 мин). С полученного таким образом диастереомера при соотношении 99:1 снимали защиту и использовали в качестве затравки для разделения. Оптическую чистоту определяли с использованием колонки Atlantis C18 (4,6250 мм, 5 мм). Смесь ацетонитрил/вода/трифторуксусная кислота использовали в качестве подвижной фазы со скоростью 1 мл/мин по следующему градиенту:t=0 мин, 0:100:0,1 3 мин, 20:80:0,1 50 мин, 100:0:0,1. При длине волны детектирования 227 нм определяли два оптических изомера со временем удерживания соответственно 36,6 мин (3S, 5R-изомер) и 37,1 мин (3S, 5R-изомер).(3S)-5-Фтор-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-4-оксопентановая кислота (Iii-1). Сырой трет-бутил 5-фтор-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил] карбониламино)-4-оксопентаноат (366 г) растворяли в метиленхлориде (1,9 кг) и охлаждали до 0C. Добавляли триэтилсилан (2 35 г) и трифторуксусную кислоту (1,88 кг) и перемешивали в течение 1 ч при 0C. Реакционную смесь упаривали при пониженном давлении, повторно растворяли в этилацетате (2,4 кг) и рН доводили до 5,2 добавлением 2 Н водного раствора гидроокиси натрия (3,1 л). Органический слой отделяли и водный слой экстрагировали один раз этилацетатом (2,4 кг). Объединенный органический слой упаривали при пониженном давлении для удаления растворителя, полученный остаток растворяли в метил-трет-бутиловом эфире (530 г) и добавляли небольшое количество кристаллической (3S)-5-фтор-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино)-4-оксопентановой кислоты. После перемешивания в течение 16 ч при комнатной температуре полученный осадок отфильтровывали и промывали смесью метил-трет-бутиловый эфир и н-гексан 9:1 (210 мл). Полученную таким образом (3S)-5-фтор-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5 изоксазолил]карбониламино)-4-оксопентановую кислоту растворяли в этилацетате (240 мл) при нагревании при 50C, медленно добавляли н-гексан (240 мл) и постепенно охлаждали до комнатной температуры. После перемешивания в течение 24 ч при комнатной температуре полученный осадок отфильтровывали и промывали смесью 1:1 этилацетат и н-гексан (30 мл) с получением указанного в заголовке соединения (Iii-1, 46,0 г, 3S/3R=94/6,0). Оптическую чистоту определяли с использованием колонки Luna(4,6250 мм, 5 мм, C18). Смесь ацетонитрил/20 мМ NH4OAc (рН 6) (30/70) использовали в качестве подвижной фазы со скоростью 1 мл/мин. При длине волны детектирования 227 нм определяли два оптических изомера со временем удерживания соответственно 8,0 мин (3R-изомер) и 9,0 мин (3S-изомер). Опыт 1. Определение ингибирующего действия в отношении каспазы. Каспазу-1 и каспазу-8, известные как цистеинпротеазы, в виде 22 экспрессировали, очищали и активировали модифицированным методом, описанным Thornberry, N.A. et al., Nature, 1992, 356, 768.Thornberry, N.A. Methods in Enzymology, 1994, 244, 615, Walker, N.P.C. et al., Cell, 1994, 78, 343 и каспазу 9 также очищали аналогичным методом и тестировали ингибирующую активность в их отношении. Описывая кратко, субъединицы р 10 и р 20 (Thornberry, N.A. et al., Nature, 1992, 356, 768) экспрессировали в E.coli и очищали на никелевой колонке анионообменной хроматографией с получением каспазы-1, каспазы-8 и каспазы-9. Использовали флуоресцентный субстрат AcYVAD-AFC для полученной таким образом каспазы-1, AcDEVD-AFC - для каспазы-8 и AcLEHD-AFC - для каспазы-9 для определения специфической активности синтезированных ингибиторов. Ферментативную реакцию проводили при 25 С при различных концентрациях ингибиторов в буфере, содержащем 50 мМ HEPES (рН 7,50), 10% (мас./об.) сахарозы, 0,1% (мас./об.) CHAPS, 100 мМ NaCl,1 мМ ЭДТА и 10 мМ DTT в присутствии 50 мкМ AcYVAD-AFC для 10 нМ каспазы-1, 50 мкМ AcDEVDAFC для 2,1 нМ каспазы-8 и 150 мкМ AcLEHD-AFC для 200 нМ каспазы-9. Константы ингибирования Ki и Kobs для ингибиторов устанавливали путем измерения скорости реакции во времени с использованием флуоресцентного спектрометра и при получении константы исходной скорости. Значение Ki рассчитывали по графику Lineweaver Burk и значение Kobs по следующему уравнению 1. Уравнение 1Kobs=-ln (1-At/A00)/t,в котором At означает скорость расщепления (%) в момент времени t и А 00 означает максимальную скорость расщепления (%). Использовали флуоресцентный спектрометр Spectra MAX GeminiXS производства Molecular DeviceCo. при длине волны возбуждения 405 нм и длине волны эмиссии 505 нм. Ингибирующую активность ингибиторов в условиях in vivo определяли индукцией апоптоза клетокJurkat (ATCC TIB-152) с использованием Fas-антител (Upstate Biotech 05-201) и при детектировании изменения цвета по методу WST-1, описанному Francoeur A.M. and Assalian A. (1996) Biochemica 3, 19-25 для регистрации количества живых клеток Jurkat при обработке клеток ингибитором. Использовали спектрометр Spectra MAX 340 производства Molecular Device Co. при длине волны поглощения 440 нм.- 26012080 Опыт 2. Терапевтическое действие при индуцированном LPS остром гепатите у мышей. Стадия 1) Получение проб крови. Мышей-самок Balb/c (в возрасте 6 недель, Charles River Laboratory, Osaka, Япония) содержали в условиях при температуре 22 С, 55% относительной влажности и цикле свет-темнота по 12 ч. Корм и воду давали вволю. В апирогенном физиологическом растворе растворяли LPS (липополисахарид) и Dгалактозамин в концентрациях соответственно 0,4 мг/мл и 280 мг/мл и их смесь 1:1 вводили мышам в количестве 5 мл/кг. Сразу же после введения LPS и D-галактозамина мышам внутрибрюшинно вводили растворитель (смесь ПЭГ 400:этанол:твин 80 = 15:7, 5:2, 5 разбавляли в 5 раз физиологическим раствором), в котором было растворено тестируемое соединение, или один растворитель. Через 8 ч после введения препаратов из сердца отбирали пробы крови. Стадия 2) Определение активности аминотрансферазы плазмы крови. Активность АЛТ плазмы крови определяли в пробах крови, полученных на стадии 1, с использованием набора для определения активности АЛT (Asan Pharm. Co., Seoul, Корея) согласно инструкции изготовителя. В результате было установлено, что введение LPS и D-галактозамина максимально повышает активность АЛТ в плазме крови, и тестируемые соединения ингибируют повышенную активность фермента в зависимости от дозы. Основываясь на данных результатах, рассчитывали значения ED50 тестируемых соединений с использованием Prism программного обеспечения GraphPad Co. с получением значений в пределах 0,01-10 мг/кг. Опыт 3. Ингибирующее действие в отношении фиброза печени у крыс SD. Стадия 1) Индукция фиброза печени и введение. Крыс-самцов Spargue-Dawley (в возрасте 6 недель, Korea Biolink) содержали в условиях при температуре 22 С, 55% относительной влажности и цикле свет-темнота по 12 ч. Корм и воду давали вволю. Для наложения лигатуры на желчный проток крыс анестезировали ингаляцией 1% галотана, вскрывали брюшную полость крыс, накладывали лигатуру на дистальный и проксимальный участки желчного протока, иссекали участок между лигатурами, вводили 2 мл физиологического раствора и накладывали швы. Тестируемое соединение (Iii) вводили перорально в дозе 3 мг/кг или 10 мг/кг дважды в сутки. А именно, соединение растворяли в сорастворителе (смесь ПЭГ 400:этанол:твин 80=15:7,5:2,5), разбавляли фосфатным буфером (рН 7,4) в 5 раз и вводили. Крысам контрольной группы вводили раствор без тестируемого соединения. Введение проводили в течение 1 недели через неделю после наложения лигатуры на желчный проток. Стадия 2) Приготовление срезов ткани и окрашивание красителем Сириус красный. После введения крыс подвергали эвтаназии. Пробы печени фиксировали в 10% нейтральном формалине и готовили срезы в парафине толщиной 5 мкм и окрашивали 0,1% красителем Сириус красным(Direct red 80, Sigma). Срезы ткани исследовали под оптическим микроскопом для определения окрашенных в красный цвет коллагеновых волокон, и результаты представлены на фиг. 1. Опыт 4. Ингибирующее действие в отношении апоптоза во время застоя желчи у крыс SD. Тестируемое соединение (Iii) вводили крысам SD с лигированными желчными протоками по методике на стадии 1 опыта 3. Через 2 недели после проведения операции крыс подвергали эвтаназии. Пробы печени фиксировали в 10% нейтральном формалине и готовили срезы в парафине толщиной 5 мкм. Окрашивание TUNEL проводили с использованием набора для детектирования апоптоза in situ Apop TagPeroxidase (Chemicon) согласно инструкции изготовителя. Делали снимки более 10 участков ткани печени, окрашенной TUNEL, при 200-кратном увеличении без какого-либо перекрывания, результаты представлены на фиг. 2. Подсчитывали число клеток с апоптозом в каждой опытной группе, данные представлены в табл. 2. В последующей таблице операция Sham означает вариант, когда желчный проток подвергался воздействию, но не был лигирован, и операция BDL означает вариант, когда после наложения лигатуры на желчный проток вводили только растворитель. Таблица 2. Ингибирующее действие соединения (Iii) в отношении апоптоза клеток печени во время застоя желчи (Единица: клетки с положительным окрашиванием TUNEL/в поле зрения) Заключение При окрашивании TUNEL было показано эффективное ингибирование апоптоза (ингибирование 75%) под действием соединения (Iii) на модели индукции фиброза печени в результате застоя желчи. Кроме того, в результате окрашивания Сириусом красным был выявлен тяжелый фиброз у животных в контрольной группе, но фиброз практически отсутствовал в группе животных, обработанных соединени- 27012080 ем (Iii). Данный результат показывает ингибирующеее действие соединения (Iii) в отношении фиброза печени у крыс и, таким образом, можно предполагать, что соединение (Iii) может проявлять фармакологическую активность в подавлении цирроза печени ингибированием апоптоза клеток печени при клиническом применении. Применение можно расширить не только на цирроз печени в результате застоя желчи, но также на различные заболевания печени, в развитии которых имеет место фиброз печени в результате апоптоза. Опыт 5. Противовоспалительное действие у крыс. Крыс-самцов SD (в возрасте 6 недель, Orient) содержали в условиях при температуре 22 С, 55% относительной влажности и цикле свет-темнота по 12 ч. Корм и воду давали вволю. Перед индукцией отека определяли объем лапы у каждой крысы с помощью плетизмометра. Перед индукцией отека крысам перорально вводили растворитель (смесь ПЭГ 400:этанол:твин 80=15:7,5:2,5 разбавляли в 10 раз фосфатным буфером), в котором было растворено тестируемое соединение, или один растворитель. Каррагенан(гамма) растворяли в концентрации 1% в физиологическом растворе и вводили подкожно в правую заднюю лапу крыс в количестве 100 мкл. Через 3 ч вновь определяли объем правой лапы с помощью плетизмометра. Действие тестируемого соединения было показано по уменьшению отека (%) (см. табл. 3). Уменьшение отека (%) рассчитывали по следующему уравнению 2. Уравнение 2 Уменьшение отека (%)=100(среднее из увеличенного объема лапы в группе с введением растворителя - увеличенный объем лапы в группе с введением тестируемого соединения)/среднее из увеличенного объема лапы в группе с введением растворителя. Таблица 3. Уменьшение отека под действием соединения (Iii). Опыт 6. Терапевтическое действие в отношении ревматоидного артрита у крыс. Крыс-самок Левис (в возрасте 7 недель, Charles River, Япония) содержали в условиях при температуре 22C, 55% относительной влажности и цикле свет-темнота по 12 ч. Корм и воду давали вволю. Коллаген типа II (бычий) растворяли в 0,05 M растворе уксусной кислоты в концентрации 2 мг/мл при 4 С и добавляли такое количество полного адъюванта Фрейнда для эмульгирования раствора при 4 С. 0,1 мл эмульгированного таким образом раствора вводили подкожно в основание хвоста крыс Левис. Через 7 суток вновь вводили эмульгированный раствор таким же образом. Со дня второго введения эмульгированного раствора вводили растворитель (смесь ПЭГ 400:этанол:твин 80 = 15:7, 5:2, 5 разбавляли в 10 раз фосфатным буфером), в котором было растворено тестируемое соединение, или один растворитель перорально крысам каждый день. На 14 сутки после первого введения содержащего коллаген эмульгированного раствора определяли объем правой задней лапы с помощью плетизмометра (см. табл. 4). Уменьшение отека (%) рассчитывали по следующему уравнению 3. Уравнение 3 Уменьшение отека (%)=100(среднее из увеличенного объема лапы в группе с введением растворителя на 14 сутки - увеличенный объем лапы в группе с введением тестируемого соединения на 14 сутки)/среднее из увеличенного объема лапы в группе с введением растворителя на 14 сутки. Затем определяли р-значение по t-тесту Стьюдента по данным увеличения объема лапы на 14 сутки для подтверждения достоверности. Таблица 4. Уменьшение отека лапы.- 28012080 В тесте отека лапы у крыс соединение (Iii) проявляло уменьшающее отек действие в зависимости от дозы примерно на 2, 21 и 23% соответственно для доз 3, 30 и 100 мг/кг. На модели ревматоидного артрита отек лапы достоверно уменьшался (уменьшение примерно на 70%) в группе животных, которым вводили соединение (Iii) на 14 сутки, в то время как в группе отрицательного контроля наблюдали максимальный отек. Следовательно, предусматривается, что соединение (Iii) обладает подавляющим действием в отношении развития воспаления на модели воспалительного заболевания, и таким образом с его помощью можно лечить аутоиммунные воспалительные заболевания. Опыт 7. Сравнение действия с известным соединением. Тестировали соединение (Iii) по настоящему изобретению и LB84068MP (соединение 68), известное по PCT/KR00/01047 (WO 01/21600), и результаты представлены в последующей табл. 5. Таблица 5 Как следует из данных таблицы 5, соединение (Iii) по настоящему изобретению проявило ингибирующую активность в 10 и более раз выше в отношении каспазы-8 и клеток Jurcat по сравнению с соединением LB84068MP и примерно в 100 раз выше на модели LPS-индуцированного острого гепатита (на мышах). Также, касаясь физико-химических свойств, соединение обладает лучшей растворимостью, и,следовательно, его легче использовать в качестве инъекционного препарата. Т.е. соединение по настоящему изобретению проявляет значительно более лучшие эффекты по сравнению с соединениемLB84068MP как в плане активности, так и физико-химических свойств. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение следующей формулы (1)I) R представляет H,II) R1 представляет остаток боковой цепи любой из природных аминокислот; и соединение формулы (1) может находиться в форме конкретного диастереомера или их смесей,когда атом углерода, с которым связан R1, становится стереоцентром за счет R1-группы; или соединение формулы (1) может иметь защитную группу в виде эфира (-CO2R3, где R3 представляет -SAC), или может находиться в виде фармацевтически приемлемой соли, когда R1 является остатком боковой цепи аминокислоты, содержащим карбоксильную группу; или соединение формулы (1) может также находиться в виде фармацевтически приемлемой соли, когда R1 является остатком боковой цепи аминокислоты, содержащим основную группу,III) R2 представляет H, -SAC, -SCAC или -SAC-Ar; и соединение формулы (1) может находиться в форме конкретного диастереомера или их смесей, когда атом углерода, с которым связан R2, становится стереоцентром за счет R2-группы;-С(=O)CH=CH2 или -COCH2-W, где W представляет -F, -Cl, -Br, -I, или имеет следующие формулы:Y представляет H или CF3,R24 представляет H, -SAC, -SAC-Ar или -Ar, его соль или стереоизомер, причем SAC означает углеводород, имеющий 1-8 атомов углерода; SCAC означает циклический радикал, имеющий 3-10 атомов углерода; -Ar включает ароматическую и гетероароматическую группы, где ароматическая группа означает 5-15-членный одиночный или конденсированный ненасыщенный цикл, а гетероароматическая группа означает 5-15-членный одиночный или конденсированный ненасыщенный цикл, содержащий 1-5 гетероатомов, выбранных из группы, состоящей из атомов кислорода, серы и азота; и SAC-Ar означает линейный или разветвленный алкил, имеющий 1-8 атомов углерода и замещенный группой -Ar. 2. Соединение по п.1, в котором R1 представляет -CH2COOH или -CH2COOR3 (R3=SAC). 3. Соединение по п.1, в котором R2 представляет H или -SAC. 4. Соединение по п.1, в котором X представляет -С(=O)CH2OAr, -С(=O)CH2OC(=O)Ar или -COCH2W, где W представляет -F, -Cl, -Br или -I. 5. Соединение по п.1, в которомVI) X представляет -COCH2F, -COCH2Cl, -COCH2Br, -COCH2I, -COCH2OAr или -COCH2OCOAr. 6. Соединение по п.1, которое выбрано из следующей группы, состоящей из:
МПК / Метки
МПК: C07D 261/04
Метки: цикл, изоксазолиновый, ингибиторы, содержащие, каспазы
Код ссылки
<a href="https://eas.patents.su/30-12080-ingibitory-kaspazy-soderzhashhie-izoksazolinovyjj-cikl.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы каспазы, содержащие изоксазолиновый цикл</a>
Предыдущий патент: Моноклональное антитело к рецептору инсулиноподобного фактора роста i (igf-i) и способы его применения
Следующий патент: Фармацевтическая композиция, содержащая габапентин
Случайный патент: Ингибиторы серин-протеаз, в частности ns3 протеазы вируса гепатита c (hvc)












