Фармацевтические композиции, содержащие ингибиторы агрегации тромбоцитов
Формула / Реферат
1. Фармацевтическая композиция для внутривенного введения пациенту, содержащая
а) фармацевтически эффективное количество соединения формулы
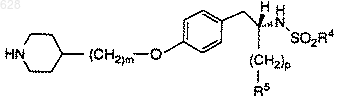
где R4 представляет арил,
C1-10-алкил или C1-10-арилалкил;
R5 представляет
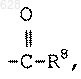
где R8 является гидрокси или C1-10-алкилокси;
р равен нулю или единице; и
m равен целому числу от двух до шести;
и его фармацевтически приемлемых солей;
б) фармацевтически приемлемое количество цитратного буфера, эффективное для обеспечения фармацевтически приемлемого рН; и
в) фармацевтически приемлемое количество агента для регулирования тоничности, эффективное для превращения композиции в, по существу, изотоническую с осмотическим давлением биологической системы пациента.
2. Фармацевтическая композиция по п.1, содержащая
а) фармацевтически эффективное количество соединения формулы
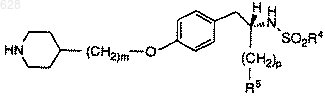
где R4 представляет арил, C1-10-алкил или C1-10-арилалкил;
R5 представляет
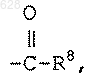
где R8 является гидрокси или C1-10-алкилокси;
р равен нулю или единице; и
m равен целому числу от двух до шести;
и его фармацевтически приемлемых солей;
б) фармацевтически приемлемое количество цитратного буфера, эффективное для обеспечения фармацевтически приемлемого рН примерно от 5 до 7; и
в) примерно 50-500 миллиосмолей агента для регулирования тоничности.
3. Композиция по п.2, содержащая примерно 0,01-0,5 мг/мл соединения формулы
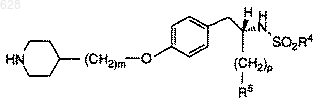
где R4 представляет арил,
C1-10-алкил или C1-10-арилалкил;
R5 представляет
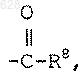
где R8 является гидрокси или C1-10-алкилокси;
р равен нулю или единице; и
m равен целому числу от двух до шести;
и его фармацевтически приемлемых солей;
примерно 2-100 мМ цитратного буфера, примерно 50-500 миллиосмолей вещества для регулирования тоничности и воду.
4. Композиция по п.3, содержащая примерно 0,01-0,5 мг/мл соединения формулы
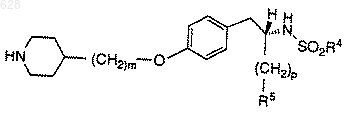
где R4 представляет арил, C1-10-алкил или C1-10-арилалкил;
R5 представляет
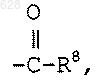
где R8 является гидрокси или C1-10-алкилокси;
р равен нулю или единице; и
m равен целому числу от двух до шести;
и его фармацевтически приемлемых солей;
примерно 2-20 мМ цитратного буфера, примерно 290 миллиосмолей агента для регулирования тоничности и воду.
5. Фармацевтическая композиция по п.4, отличающаяся тем, что указанное соединение является 2-S-(н-бутилсульфониламино)-3-[4-(4-пиперидин-4-ил)бутилокси)фенил] - пропионовой кислотой.
6. Фармацевтическая композиция по п.5, отличающаяся тем, что количество 2-S-(н-бутилсульфониламино)-3-[4-(4-пиперидин-4-ил)бутилокси)фенил]пропионовой кислоты составляет примерно от 0,05 до примерно 0,25 мг/мл, а количество цитратного буфера составляет примерно 2-20 мМ.
7. Фармацевтическая композиция по п.6, отличающаяся тем, что количество 2-S-(н-бутилсульфониламино)-3-[4-(4-пиперидин-4-ил)бутилокси)фенил]пропионовой кислоты составляет примерно 0,25 мг/мл, количество цитратного буфера составляет примерно 10 мМ, количество агента для регулирования тоничности составляет примерно 290 миллиосмолей и рН равен примерно 6.
8. Способ ингибирования агрегации тромбоцитов у млекопитающего, включающий внутривенное введение млекопитающему фармацевтически эффективного количества композиции по п.1.
9. Способ по п.8, отличающийся тем, что млекопитающим является человек.
10. Способ ингибирования агрегации тромбоцитов у млекопитающего, включающий внутривенное введение млекопитающему фармацевтически эффективного количества композиции по п.7.
11. Способ по п.10, отличающийся тем, что млекопитающим является человек.
Текст
1 Предпосылки создания изобретения Настоящее изобретение относится к композициям для ингибирования связывания фибриногена с тромбоцитами и ингибирования агрегации тромбоцитов посредством связывания антагонистов фибриногенового рецептора с фибриногеновым рецепторным сайтом gрIIb/IIIa. Фибриноген представляет собой гликопротеин, присутствующий в плазме крови, который участвует в агрегации тромбоцитов и образовании фибрина. Тромбоциты являются подобными клеткам безъядерными фрагментами, обнаруживаемыми в крови всех млекопитающих, которые также участвуют в свертывании крови. Известно, что взаимодействие фибриногена с рецепторным сайтом IIb/IIIa существенно для нормальной функции тромбоцитов. Когда кровеносный сосуд повреждается при травме или в результате другой причины,тромбоциты прилипают к разрушенной субэндотелиальной поверхности. Прилипшие тромбоциты затем высвобождают биологически активные составляющие и соединяются. Агрегация инициируется связыванием агонистов, таких как тромбин, эпинефрин или АДФ, со специфическими мембранными рецепторами тромбоцитов. Стимуляция с помощью агонистов приводит, в результате, к обнажению латентных фибриногеновых рецепторов на поверхности тромбоцитов и связыванию фибриногена с комплексом гликопротеина и рецептора IIb/IIIa. Известны многие соединения или пептидные аналоги, которые, как полагают, ингибируют агрегацию тромбоцитов посредством ингибирования связывания тромбоцитов фибриногеном. Duggan et аl., патент США 5292756,описывают сульфонамидные антагонисты фибриногенового рецептора, которые полезны для предупреждения и лечения заболеваний, вызванных тромбообразованием. В больничных условиях, когда желательно введение таких соединений, их можно вводить внутривенно (болюс или инфузия), интраперитонеально, подкожно или внутримышечно, причем используют все формы, хорошо известные средним специалистам в области фармации. Соединения могут быть назначены пациентам, когда желательно предупреждение тромбоза посредством ингибирования связывания фибриногена с комплексом мембранного гликопротеина тромбоцитов и рецептора IIb/IIIa. Они полезны при операциях на периферических артериях (артериальные трансплантаты, каротидная эндартерэктомия) и при сердечно-сосудистых операциях, когда манипуляция с артериями и органами и/или взаимодействие тромбоцитов с искусственно образованными поверхностями, ведет к агрегации и расходованию тромбоцитов. Композиции настоящего изобретения являются безопасными, устойчивыми при хранении растворами для внутривенного введения, 000628 2 которые полезны, в частности, для введения ингибиторов агрегации тромбоцитов пациентам,нуждающимся в таком ингибировании. Краткое изложение сущности изобретения Настоящее изобретение представляет фармацевтическую композицию, содержащую а) фармацевтически эффективное количество соединения (называемого также "активный ингредиент") формулы где R8 является гидрокси или C1-10-алкилокси; р равен нулю или единице; иm является целым числом от двух до шести; и его фармацевтически приемлемых солей; б) фармацевтически приемлемое количество цитратного буфера, эффективное, например,для обеспечения рН примерно от 5 до 7; и в) фармацевтически приемлемое количество агента для регулирования тоничности, эффективное для превращения состава, по существу, в изотонический с осмотическим давлением биологической системы пациента. Композиция, по существу, свободна от фосфатного буфера. Термин "по существу, свободна" означает, что количество фосфата таково, что не дает фармацевтически значимого буферирующего действия на рН. Такое количество могут легко установить специалисты в этой области техники, которым известен состав, в который нужно ввести буфер, и фармацевтически приемлемый рН такого состава. В одном из своих классов композиции содержат фармацевтически эффективное количество соединения формулы где R8 является гидрокси или C1-10-алкилокси; р равен нулю или единице; иm является целым числом от двух до шести; и его фармацевтически приемлемой соли; количество цитратного буфера, эффективное для придания рН примерно от 5,8 до 6,2, и при 3 мерно 50-500 миллиосмолей агента для регулирования тоничности. В подклассе таких композиций количество активного лекарственного средства составляет 0,01-0,5 мг/мл, количество цитратного буфера составляет от 2 до 100 мМ, а количество агента для регулирования тоничности составляет примерно 50-500 миллиосмолей. В группе этого подкласса количество цитратного буфера составляет примерно 2-20 мМ, а количество агента для регулирования тоничности - примерно 290 миллиосмолей. Концентрация активного ингредиента композиции представляет эквивалентное количество безводного свободного основания соединения, присутствующего в растворе. В подгруппе этой группы указанное соединение представляет собой 2-S-(нбутилсульфониламино)-3-[4-(4-(пиперидин-4 ил) бутилокси)фенил]пропионовую кислоту. В семействе этой подгруппы количество 2S-(н-бутилсульфониламино)-3-[4-(4-(пиперидин-4-ил)бутилокси)фенил] пропионовой кислоты составляет примерно от 0,05 до 0,25 мг/мл, количество цитратного буфера составляет примерно 2-20 мМ и количество агента для регулирования тоничности составляет примерно 290 миллиосмолей. В конкретном примере этого семейства количество 2-S-(н-бутилсульфониламино)-3-[4-(4(пиперидин-4-ил)бутилокси)фенил]пропионовой кислоты составляет примерно 0,25 мг/мл,количество цитратного буфера составляет примерно 10 мМ и количество агента для регулирования тоничности составляет примерно 290 миллиосмолей, а рН равен примерно 6. Настоящее изобретение также включает способ ингибирования агрегации тромбоцитов у млекопитающего, например человека, включающий внутривенное введение млекопитающему фармацевтически эффективного количества композиции изобретения. В конкретном варианте осуществления этого способа млекопитающее лечат композицией, содержащей 2-S-(н-бутилсульфониламино)-3-[4-(4-(пиперидин-4-ил)бутилокси)фенил]пропионовую кислоту в количестве примерно 0,25 мг/мл, цитратный буфер в количестве примерно 10 мМ и агент для регулирования тоничности в количестве примерно 290 миллиосмолей, с рН примерно 6. Подробное описание изобретения Составы согласно изобретению обеспечивают фармацевтическим композициям повышенную физическую и химическую устойчивость. Одним из преимуществ такой устойчивости является длительный срок хранения готового фармацевтического препарата. Цитратные композиции активного ингредиента устойчивы в течение более 18 месяцев, в то время как фосфатсодержащие составы с тем же активным ингредиентом не устойчивы. Отмечено, например,что через 24 месяца фосфатные композиции 4 содержат видимые частицы, например частицы с размером более 50 мкм. Длительный срок хранения фармацевтического препарата дает значительные экономические выгоды. Другим преимуществом композиций изобретения является большая безопасность готового фармацевтического препарата. Неустойчивость готового препарата вследствие длительного хранения проявляется образованием нерастворимых частиц, которые представляют потенциальную опасность двух типов: опасность попадания нерастворимых частиц в вену пациента и опасность закупоривания проходного фильтра нерастворимыми частицами во время внутривенного введения фармацевтического средства. Прозрачность жидкостей для внутривенного введения при введении в больнице является важным свойством готового препарата. Отсутствие частиц вещества приобретает важное значение с точки зрения возможной биологической опасности, исходящей от вещества в виде частиц. Авторы обнаружили, что соединения общей формулы где R8 является гидрокси или C1-10-алкилокси; р равен нулю или единице; иm является целым числом от двух до шести; и его фармацевтически приемлемые соли, примерами которых являются 2-S-(н-бутилсульфониламино)-3-[4-(4-(пиперидин-4-ил)бутилокси) фенил]пропионовая кислота; 2-S-(бензилсульфониламино)-3-[4-(4-(пиперидин-4-ил)бутилокси)фенил]пропионовая кислота и 2-S-(2-фенетилсульфониламино)-3-[4-(4-(пиперидин-4-ил) бутилокси)фенил]пропионовая кислота и их фармацевтически приемлемые соли, являются значительно более устойчивыми при хранении,когда в их состав для забуферивания композиции вводят цитратный буфер вместо фосфатного буфера. Это открытие удивляет, поскольку специалисты в области фармацевтических композиций обычно применяют фосфатные буферы. Забуференная цитратом композиция настоящего изобретения содержит количество цитрата, эффективное для обеспечения фармацевтически приемлемого рН, например для обеспечения рН окружающей среды в интервале от 5 до 7, предпочтительно в интервале от 5,8 до 6,2, например около 6. Для обеспечения фармацевтически приемлемого количества цитратного 5 буфера, эффективного для достижения нужного рН, можно использовать подходящее количество цитрата натрия и лимонной кислоты. Агенты для регулирования тоничности, в том числе хлорид натрия, применяют для регулирования тоничности под осмотическое давление и предупреждения лизинга клеток крови. Эти агенты сводят к минимуму боль и тромбофлебит, часто испытываемые пациентами при внутривенном введении фармацевтических композиций. Используемое количество таково,чтобы сделать композицию изотонической с осмотическим давлением биологической системы пациента. Выраженное в осмомолярных единицах, предпочтительное количество агента для регулирования тоничности, подходящее для настоящего изобретения, например, хлорида натрия, составляет примерно 50-500 миллиосмолей, предпочтительнее примерно 290 миллиосмолей. В композициях изобретения фармацевтически приемлемую осмолярность можно достичь посредством введения в композицию хлорида натрия в количестве примерно от 1,5 до 15 мг/мл, предпочтительно примерно 9 мг/мл. Такой осмолярности можно также добиться при использовании маннита в количестве примерно от 7 до 75 мг/мл, предпочтительно примерно 50 мг/мл. Другими агентами для регулирования тоничности, которые можно использовать для регулирования тоничности, являются, но не ограничиваются ими, декстроза и другие сахара. Однако состав композиций не ограничивается активным ингредиентом, цитратным буфером и агентом для регулирования тоничности и может также включать другие фармацевтически приемлемые разбавители, эксципиенты или носители. Композиции подходят для длительного хранения в стеклянных емкостях, обычно применяемых в фармацевтической промышленности, например в концентрированной форме в стандартных, согласно фармакопее США, контейнерах из боросиликатного стекла типа I. В общем, процедура получения композиций изобретения включает соединение различных ингредиентов в сосуде для смешивания,например, при комнатной температуре. Активный ингредиент (в форме соли или в форме свободного основания), источники цитратного буфера (например, лимонная кислота и цитрат натрия) и агент для регулирования тоничности соединяют, чтобы получить концентрацию активного ингредиента примерно от 0,01 мг/мл до 0,5 мг/мл. В одном из методов получения композиции в сосуд для смешивания вводят значительную часть конечного продукта - воду (например, примерно 60-100%). Активный ингредиент в количестве, подходящем для получения нужной концентрации в готовом препарате, растворяют в воде. Добавляют цитрат натрия и лимонную кислоту в количествах, достаточных для получения конечной концентрации цитрата 6 примерно от 2 до 20 мМ. Добавляют фармацевтически приемлемое количество агента для регулирования тоничности. Затем добавляют оставшуюся часть воды для достижения нужной конечной концентрации ингредиентов. Количество воды, которое сначала используют при получении композиции, и количество оставшейся воды, которое добавляют в конце процедуры, не влияет на свойства конечного продукта. Эти количества являются предметом выбора специалистов, создавая возможность регулировать рН во время приготовления композиции. Композиции изобретения хранили при 5,30 и 40 С. Через 18 месяцев композиции не показывают признаков образования частиц при измерении с использованием анализа методом непросвечивающей растровой электронной микроскопии, описанного в Национальном справочнике фармакопеи США, The UnitedStates Pharmacopeial Convention, Inc., (Rockville,MD) 1994, pp. 1954-1957. Концентрированные составы композиций можно разбавить во время введения подходящим разбавителем и получить конечную концентрацию, например, примерно 0,01 мг/мл,которая подходит для переноса в инфузионный мешок и использования пациентом, нуждающимся в активном ингредиенте. Термин "фармацевтически приемлемые соли" относится к нетоксичным солям активного ингредиента, которые получают, как правило,посредством взаимодействия свободного основания с подходящей органической или неорганической кислотой. Типичными солями являются следующие соли: ацетат, бензолсульфонат,бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, кальцийэдетат, камсилат, карбонат,хлорид, клавуланат, цитрат, дигидрохлорид,эдетат, эдизилат, эстолат, эзилат, фумарат, глюцептат, глюконат, глутамат, гликолиларсанилат,гексилрезорцинат, гидрабамин, гидробромид,гидрохлорид, гидроксинафтоат, иодид, изотионат, лактат, лактобионат, лаурат, малат, малеат,манделат, мезилат, метилбромид, метилнитрат,метилсульфат, мукат, напсилат, нитрат, олеат,оксалат, памаоат, пальмитат, пантотенат, фосфат дифосфат, полигалактуронат, салицилат,стеарат, субацетат, сукцинат, таннат, тартрат,теоклат, тозилат, триэтиодид, валерат. Активные ингредиенты, включенные в композиции настоящего изобретения, являются хиральными; в объем настоящего изобретения входят рацемические смеси и отдельные энантиомеры общей формулы. Кроме того, в объем настоящего изобретения включаются все диастереомеры соединений общей формулы, в том числе Е-, Z-изомеры. Кроме того, настоящим изобретением охватываются гидраты, а также безводные соединения и полиморфы общей формулы. Термин "фармацевтически эффективное количество" будет означать то количество ак 7 тивного ингредиента, которое будет вызывать биологическую или медицинскую реакцию ткани, системы или животного, которой добивается исследователь или практикующий врач. Термин "алкил" обозначает линейный или разветвленный алкановый радикал, содержащий 1-10 атомов углерода, например, метил, этил, нпропил, изопропил, н-бутил, изобутил, вторбутил, трет-бутил, пентил, изоамил, гексил, октил и подобные радикалы, линейный или разветвленный алкеновый радикал, содержащий 210 атомов углерода, например пропиленил, бутен-1-ил, изобутенил, пентенилен-1-ил, 2,2 метилбутен-1-ил, 3-метилбутен-1-ил, гексен-1 ил, гептен-1-ил и октен-1-ил и подобные радикалы, или линейный или разветвленный алкиновый радикал, содержащий 2-10 атомов углерода,например этинил, пропинил, бутин-1-ил, бутин 2-ил, пентин-1-ил, пентин-2-ил, 3-метилбутин-1 ил, гексин-1-ил, гексин-2-ил, гексин-3-ил, 3,3 диметилбутин-1-ил, и подобные радикалы. Термин "арил" обозначает 5- или 6 членное ароматическое кольцо, содержащее 0, 1 или 2 гетероатома, выбранных из атомов О, N иS, например фенил, пиридин, пиримидин, имидазол, тиофен, оксазол, изоксазол, тиазол и их амино- или галогензамещенные производные. Термин "алкилокси" включает любую алкильную часть, где алкил имеет данное выше определение, например метилокси, пропилокси и бутилокси. Термин "аралкил" включает фенилалкил,пиридилалкил, тиенилалкил, тетразолалкил или оксазолалкил. Обозначение C1-10 относится к алкильному компоненту аралкильного звена. Примерами арилалкила являются бензил, фторбензил, хлорбензил, фенилэтил, фенилпропил,фторфенилэтил, хлорфенилэтил, тиенилметил,тиенилэтил и тиенилпропил. Примерами алкиларила являются толуол, этилбензол, пропилбензол, метилпиридин, этилпиридин, пропилпиридин, бутилпиридин, бутенилпиридин и пентенилпиридин. Композиции изобретения можно вводить пациентам, когда желательно предупреждение тромбоза за счет ингибирования связывания фибриногена с тромбоцитным мембранным комплексом гликопротеина с рецепторомIIb/IIIa. Они полезны при операциях на периферических артериях (артериальные трансплантаты, каротидная эндартерэктомия) и при сердечно-сосудистых операциях, когда манипуляция с артериями и органами и/или взаимодействие тромбоцитов с искусственно созданными поверхностями ведет к агрегации и расходованию тромбоцитов. Агрегированные тромбоциты могут образовать тромбы и тромбоэмболию. Композиции настоящего изобретения можно вводить больным для предупреждения образования тромбозов и тромбоэмболии. Обычно в сердечно-сосудистой хирургии для оксигенации крови используют искусствен 000628 8 ное кровообращение. Тромбоциты прилипают к поверхностям оборудования для искусственного кровообращения. Прилипание зависит от взаимодействия gp IIb/IIIa на мембранах тромбоцита и фибриногена, адсорбированного на поверхности аппарата (Gluszko et al., Amer. J. Physiol.,252 (H), 615-621 (1987. Тромбоциты, выделившиеся с искусственных поверхностей, показывают ослабленную гемостатическую функцию. Композиции изобретения можно вводить для предотвращения прилипания. Другие применения указанных композиций включают предупреждение тромбоцитарного тромбоза, тромбоэмболии и реокклюзии во время и после тромболитической терапии и предупреждение тромбоцитарного тромбоза,тромбоэмболии и реокклюзии после пластической операции на сосудах или шунтирования коронарной артерии. Их также можно применять для предупреждения инфаркта миокарда. Схему приема лекарственных средств с использованием композиций настоящего изобретения выбирают в соответствии с различными факторами, включая тип, вид, возраст, вес,пол и состояние здоровья пациента; тяжесть состояния, которое лечат; способ введения; работу почек и печени пациента; и конкретный используемый активный ингредиент или его соль. Лечащий врач или ветеринар могут легко определить и прописать эффективное количество лекарственного средства, необходимое для предупреждения, противодействия или прекращения развития указанного состояния. При внутривенном введении наиболее предпочтительные дозы активного ингредиента будут находиться в интервале примерно от 0,01 до примерно 0,25 мкг/кг/мин при постоянной скорости инфузии, например, 0,15 мкг/кг/мин. Чтобы ввести такое количество активного ингредиента, композицию изобретения, содержащую 0,05 мг/мл активного ингредиента, следует вводить со скоростью примерно от 0,001 до 0,005 мл/кг/мин, например 0,003 мл/кг/мин. Композиции изобретения, содержащие более высокие концентрации активных ингредиентов,следует вводить с соответственно меньшими скоростями. Пример 1. Композиция 2-S-(н-бутилсульфониламино)-3-[4-(4-пиперидин-4-ил)-бутилокси)фенил] пропионовой кислоты с цитратным буфером. Фармацевтическую композицию, содержащую 2-S-(н-бутилсульфониламино)-3-[4-(4 пиперидин-4-ил)бутилокси)фенил]пропионовую кислоту, цитратный буфер и хлорид натрия,готовят при комнатной температуре с использованием гидрохлорида 2-S-(н-бутилсульфониламино)-3-[4-(4-пиперидин-4-ил)бутилокси) фенил]пропионовой кислоты, с таким расчетом,чтобы получить эквивалентную концентрацию свободного основания 2-S-(н-бутилсульфонил 9 амино)-3-[4-(4-пиперидин-4-ил)бутилокси)фенил]пропионовой кислоты 0,25 мг/мл. В стандартный фармацевтический смеситель загружают 800 г воды. Растворяют в воде 0,28 г гидрохлорида 2-S-(н-бутилсульфониламино)-3-[4-(4-пиперидин-4-ил)бутилокси)фенил]пропионовой кислоты. Добавляют 2,7 г цитрата натрия и 0,16 г лимонной кислоты, чтобы получить концентрацию цитрата 10 мМ. Добавляют 9 г хлорида натрия. Затем добавляют 200 г воды, чтобы получить нужную конечную концентрацию ингредиентов. Получающаяся в результате водная композиция имеет следующий состав. Ингредиент Количество 2-S-(н-Бутилсульфониламино)-3-[4-(4-пиперидин-4-ил) бутилок 0,25 мг/мл си)фенил]пропионовая кислота Цитратный буфер Композицию указанной конечной концентрации хранят в стандартном, согласно фармакопее США, контейнере типа I из боросиликатного стекла при температуре 5, 30 и 40 С. Через 18 месяцев композиция не обнаруживает видимых частиц при измерении с использованием анализа методом непросвечивающей растровой электронной микроскопии. Концентрированную композицию перед введением пациенту разводят в соотношении 4:1, получая в результате конечную концентрацию 0,05 мг/мл. Пример 2. Композиция 2-S-(бензилсульфониламино)3-[4-(4-пиперидин-4-ил)-бутилокси)фенил] пропионовой кислоты с цитратным буфером. Фармацевтическую композицию, содержащую 2-S-(бензилсульфониламино)-3-[4-(4 пиперидин-4-ил)бутилокси)фенил]пропионовую кислоту, цитратный буфер и хлорид натрия,готовят при комнатной температуре с использованием гидрохлорида 2-S-(бензилсульфониламино)-3-[4-(4-пиперидин-4-ил)бутилокси) фенил]пропионовой кислоты, с таким расчетом,чтобы получить эквивалентную концентрацию свободного основания 2-S-(бензилсульфониламино)-3-[4-(4-пиперидин-4-ил)бутилокси) фенил]пропионовой кислоты 0,25 мг/мл. В стандартный фармацевтический смеситель загружают 800 г воды. Растворяют в воде 0,28 г гидрохлорида 2-S-(бензилсульфониламино)-3-[4-(4-пиперидин-4-ил)бутилокси) фенил]пропионовой кислоты. Добавляют 2,7 г цитрата натрия и 0,16 г лимонной кислоты, чтобы получить концентрацию цитрата 10 мМ. Добавляют 9 г хлорида натрия. Затем добавляют 10 200 г воды, чтобы получить нужную конечную концентрацию ингредиентов. Получающаяся в результате водная композиция имеет следующий состав. Ингредиент Количество 2-S-(Бензилсульфониламино)-3-[4-(4-пипери 0,25 мг/мл дин-4-ил)бутилокси) фенил]пропионовая кислота Цитратный буфер 10 мМ Хлорид натрия 9 мг/мл Композицию указанной конечной концентрации хранят в стандартном, согласно фармакопее США, контейнере типа I из боросиликатного стекла при температуре 5, 30 и 40 С. Через 18 месяцев композиция не обнаруживает видимых частиц при измерении с использованием анализа методом непросвечивающей растровой электронной микроскопии. Концентрированную композицию перед введением пациенту разводят в соотношении 4:1, получая в результате конечную концентрацию 0,05 мг/мл. Пример 3. Композиция 2-S-(н-бутилсульфониламино)-3-[4-(4-пиперидин-4-ил)-бутилокси)фенил] пропионовой кислоты с цитратным буфером. Следуют процедуре примера 1, за исключением того, что вместо 0,28 г растворяют в воде 0,05 г гидрохлорида 2-S-(н-бутилсульфониламино)-3-[4-(4-пиперидин-4-ил)бутилокси) фенил]пропионовой кислоты. Композицию указанной конечной концентрации хранят в стандартном, согласно фармакопее США, контейнере типа I из боросиликатного стекла при температуре 5, 30 и 40 С. Через 18 месяцев композиция не обнаруживает видимых частиц при измерении с использованием анализа методом непросвечивающей растровой электронной микроскопии. Перед введением пациенту разведение не требуется. Пример 4. Композиция 2-S-(н-бутилсульфониламино)-3-[4-(4-пиперидин-4-ил)-бутилокси)фенил]пропионовой кислоты с цитратным буфером. Следуют процедуре примера 1, за исключением того, что вместо 0,28 г растворяют в воде 0,5 г гидрохлорида 2-S-(н-бутилсульфониламино)-3-[4-(4-пиперидин-4-ил)бутилокси) фенил]пропионовой кислоты. Композицию указанной конечной концентрации хранят в стандартном, согласно фармакопее США, контейнере типа I из боросиликатного стекла при температуре 5, 30 и 40 С. Видимых частиц не обнаруживают. Перед введением пациенту требуется разведение. 11 Пример 5. Композиция 2-S-(н-бутилсульфониламино)-3-[4-(4-пиперидин-4-ил)бутилокси) фенил] пропионовой кислоты с цитратным буфером. Следуют процедуре примера 1, за исключением того, что в качестве вещества для регулирования тоничности используют 8 г декстрозы, а не хлорид натрия. Композицию указанной конечной концентрации хранят в стандартном,согласно фармакопее США, контейнере типа I из боросиликатного стекла при температуре 5,30 и 40 С. Видимых частиц не обнаруживают. Перед введением пациенту разведение не требуется. Пример 6. Композиция 2-S-(н-бутилсульфониламино)-3-[4-(4-пиперидин-4-ил)бутилокси)фенил] пропионовой кислоты с цитратным буфером. Следуют процедуре примера 1, за исключением того, что в качестве вещества для регулирования тоничности используют 15 г хлорида натрия. Композицию указанной конечной концентрации хранят в стандартном, согласно фармакопее США, контейнере типа I из боросиликатного стекла при температуре 5, 30 и 40 С. Видимых частиц не обнаруживают. Перед введением пациенту разведение не требуется. Пример 7. Композиция 2-S-(н-бутилсульфониламино)-3-[4-(4-пиперидин-4-ил)-бутилокси)фенил]пропионовой кислоты с фосфатным буфером. Чтобы сравнить устойчивость цитратсодержащих композиций и фосфатсодержащих композиций, готовят забуференную фосфатом композицию, содержащую 0,5 мг/мл 2-S-(нбутилсульфониламино)-3-[4-(4-пиперидин-4-ил) бутилокси)фенил]пропионовой кислоты, фосфатный буфер и хлорид натрия, хранят и анализируют на видимые частицы с использованием анализа методом непросвечивающей растровой электронной микроскопии. В стандартный фармацевтический смеситель загружают 800 г воды. Растворяют в воде 0,56 г гидрохлорида 2-S-(бутилсульфониламино)-3-[4-(4-пиперидин-4-ил)бутилокси) фенил] пропионовой кислоты. Добавляют 0,4 г первичного кислого фосфата натрия и 1,02 г вторичного кислого фосфата натрия, чтобы получить концентрацию фосфата 10 мМ. Добавляют 9 г хлорида натрия. Затем добавляют 200 г воды, чтобы получить нужную концентрацию ингредиентов. Получающаяся в результате водная композиция имеет следующий состав. 12 Ингредиент Количество 2-S-(н-Бутилсульфониламино)-3-[4-(4-пиперидин-40,5 мг/мл ил) бутилокси) фенил] пропионовая кислота Фосфатный буфер Хлорид натрия Композицию указанной конечной концентрации хранят в стандартном, согласно фармакопее США, контейнере типа I из боросиликатного стекла при температуре 5, 30 и 40 С. Через 24 месяца в ампулах, хранящихся при 30 и 40 С, наблюдают частицы размером более 50 мкм, видимые без помощи электронной микроскопии. Частицы размером более 50 мкм, видимые без помощи электронной микроскопии, также наблюдают во флаконах, хранящихся в течение 36 месяцев при 30 и 40 С. Образование частиц размером более 10 мкм измеряют с использованием анализа методом непросвечивающей растровой электронной микроскопии, производя "подсчеты" на 125 мл флакон, соответствующие композициям, хранящимся во флаконах в течение 36 месяцев при 5,30 и 40 С. Также определяют подгруппу частиц с размером более 25 мкм. Темп. (С) 5 30 40 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция для внутривенного введения пациенту, содержащая а) фармацевтически эффективное количество соединения формулы где R8 является гидрокси или C1-10-алкилокси; р равен нулю или единице; иm равен целому числу от двух до шести; и его фармацевтически приемлемых солей; б) фармацевтически приемлемое количество цитратного буфера, эффективное для обеспечения фармацевтически приемлемого рН; и в) фармацевтически приемлемое количество агента для регулирования тоничности, эф 13 фективное для превращения композиции в, по существу, изотоническую с осмотическим давлением биологической системы пациента. 2. Фармацевтическая композиция по п.1,содержащая а) фармацевтически эффективное количество соединения формулы где R8 является гидрокси или C1-10-алкилокси; р равен нулю или единице; иm равен целому числу от двух до шести; и его фармацевтически приемлемых солей; б) фармацевтически приемлемое количество цитратного буфера, эффективное для обеспечения фармацевтически приемлемого рН примерно от 5 до 7; и в) примерно 50-500 миллиосмолей агента для регулирования тоничности. 3. Композиция по п.2, содержащая примерно 0,01-0,5 мг/мл соединения формулы где R8 является гидрокси или C1-10-алкилокси; р равен нулю или единице; иm равен целому числу от двух до шести; и его фармацевтически приемлемых солей; примерно 2-100 мМ цитратного буфера, примерно 50-500 миллиосмолей вещества для регулирования тоничности и воду. 4. Композиция по п.3, содержащая примерно 0,01-0,5 мг/мл соединения формулы где R8 является гидрокси или C1-10-алкилокси; р равен нулю или единице; иm равен целому числу от двух до шести; и его фармацевтически приемлемых солей; примерно 2-20 мМ цитратного буфера, примерно 290 миллиосмолей агента для регулирования тоничности и воду. 5. Фармацевтическая композиция по п.4,отличающаяся тем, что указанное соединение является 2-S-(н-бутилсульфониламино)-3-[4-(4 пиперидин-4-ил)бутилокси)фенил] - пропионовой кислотой. 6. Фармацевтическая композиция по п.5,отличающаяся тем, что количество 2-S-(нбутилсульфониламино)-3-[4-(4-пиперидин-4 ил)бутилокси)фенил]пропионовой кислоты составляет примерно от 0,05 до примерно 0,25 мг/мл, а количество цитратного буфера составляет примерно 2-20 мМ. 7. Фармацевтическая композиция по п.6,отличающаяся тем, что количество 2-S-(нбутилсульфониламино)-3-[4-(4-пиперидин-4 ил)бутилокси)фенил]пропионовой кислоты составляет примерно 0,25 мг/мл, количество цитратного буфера составляет примерно 10 мМ,количество агента для регулирования тоничности составляет примерно 290 миллиосмолей и рН равен примерно 6. 8. Способ ингибирования агрегации тромбоцитов у млекопитающего, включающий внутривенное введение млекопитающему фармацевтически эффективного количества композиции по п.1. 9. Способ по п.8, отличающийся тем, что млекопитающим является человек. 10. Способ ингибирования агрегации тромбоцитов у млекопитающего, включающий внутривенное введение млекопитающему фармацевтически эффективного количества композиции по п.7. 11. Способ по п.10, отличающийся тем, что млекопитающим является человек.
МПК / Метки
МПК: A61K 47/02
Метки: фармацевтические, тромбоцитов, ингибиторы, агрегации, композиции, содержащие
Код ссылки
<a href="https://eas.patents.su/8-628-farmacevticheskie-kompozicii-soderzhashhie-ingibitory-agregacii-trombocitov.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические композиции, содержащие ингибиторы агрегации тромбоцитов</a>
Предыдущий патент: Способ получения линейных полиэтиленов низкой плотности
Следующий патент: Оптическое устройство и способ его регулировки
Случайный патент: Конформационно ограниченные бифенильные производные для применения в качестве ингибиторов вируса гепатита с












