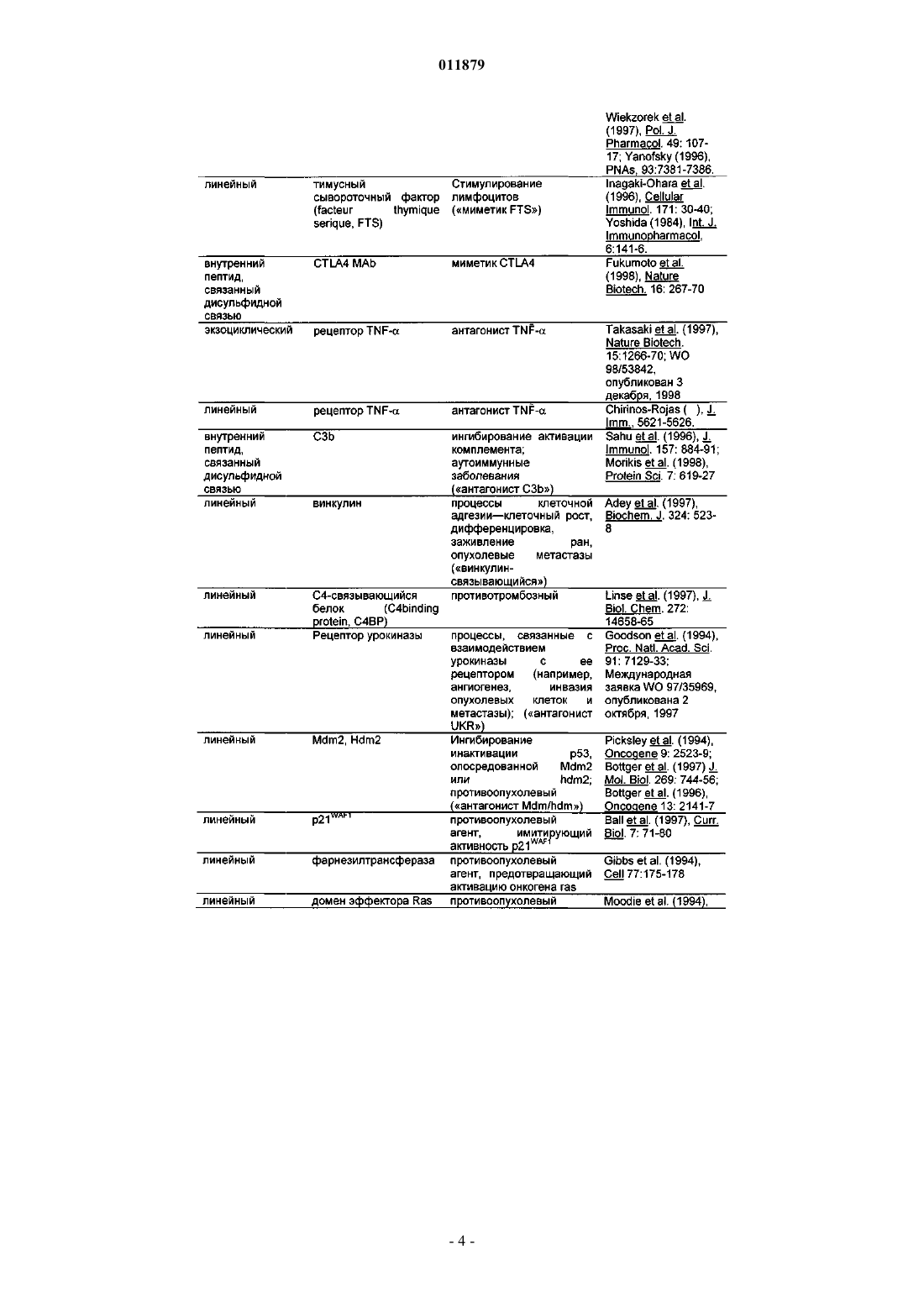
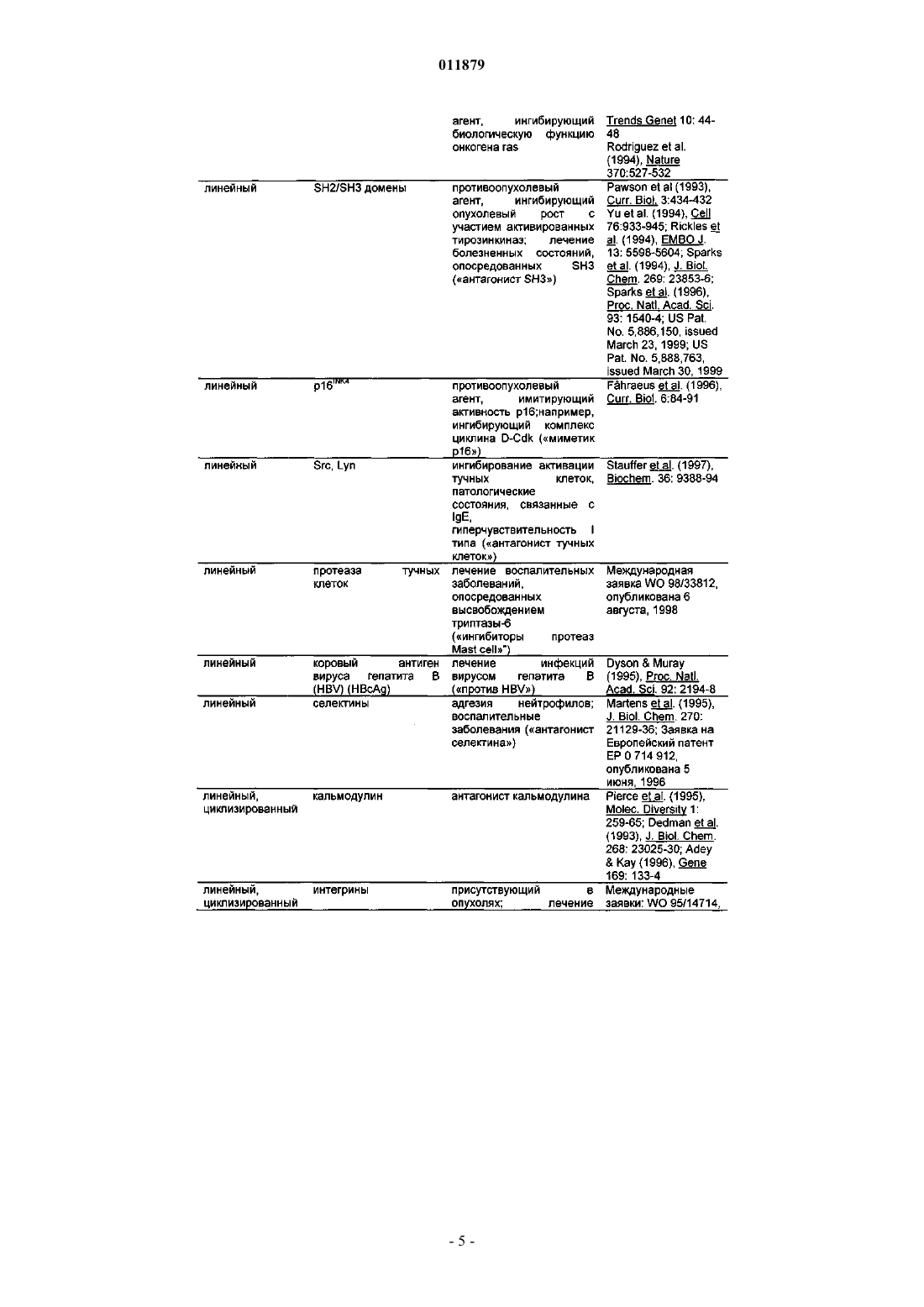
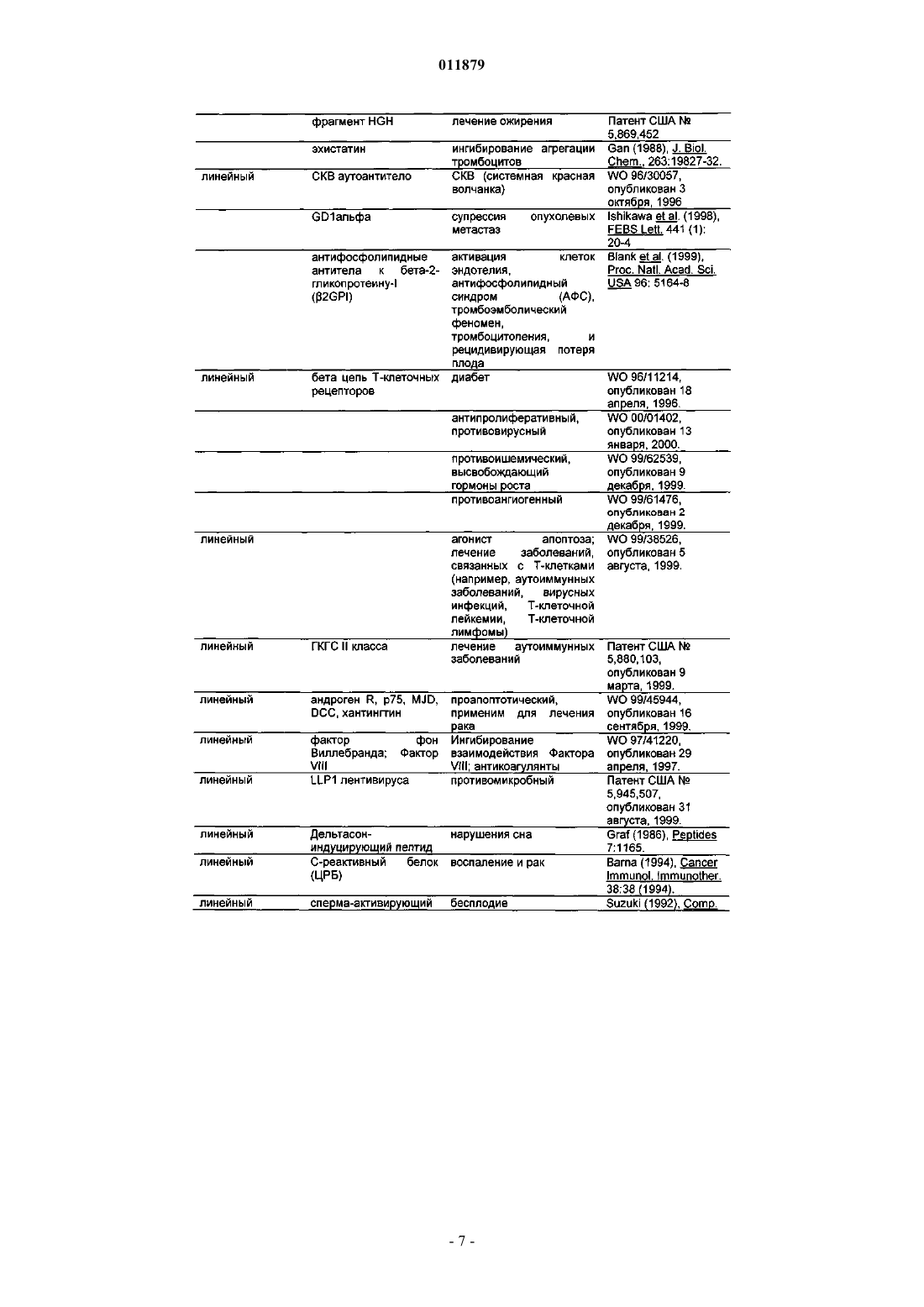
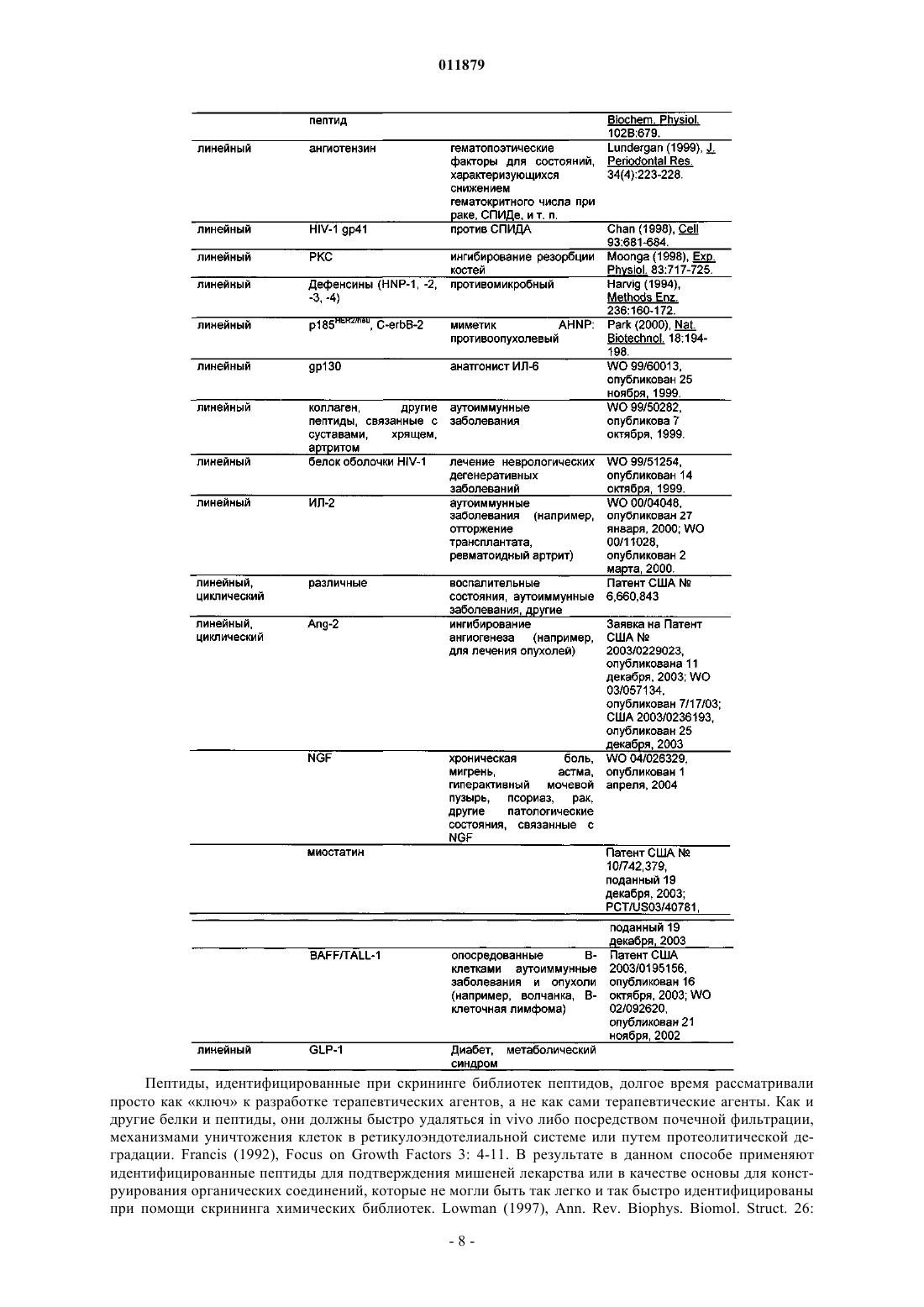
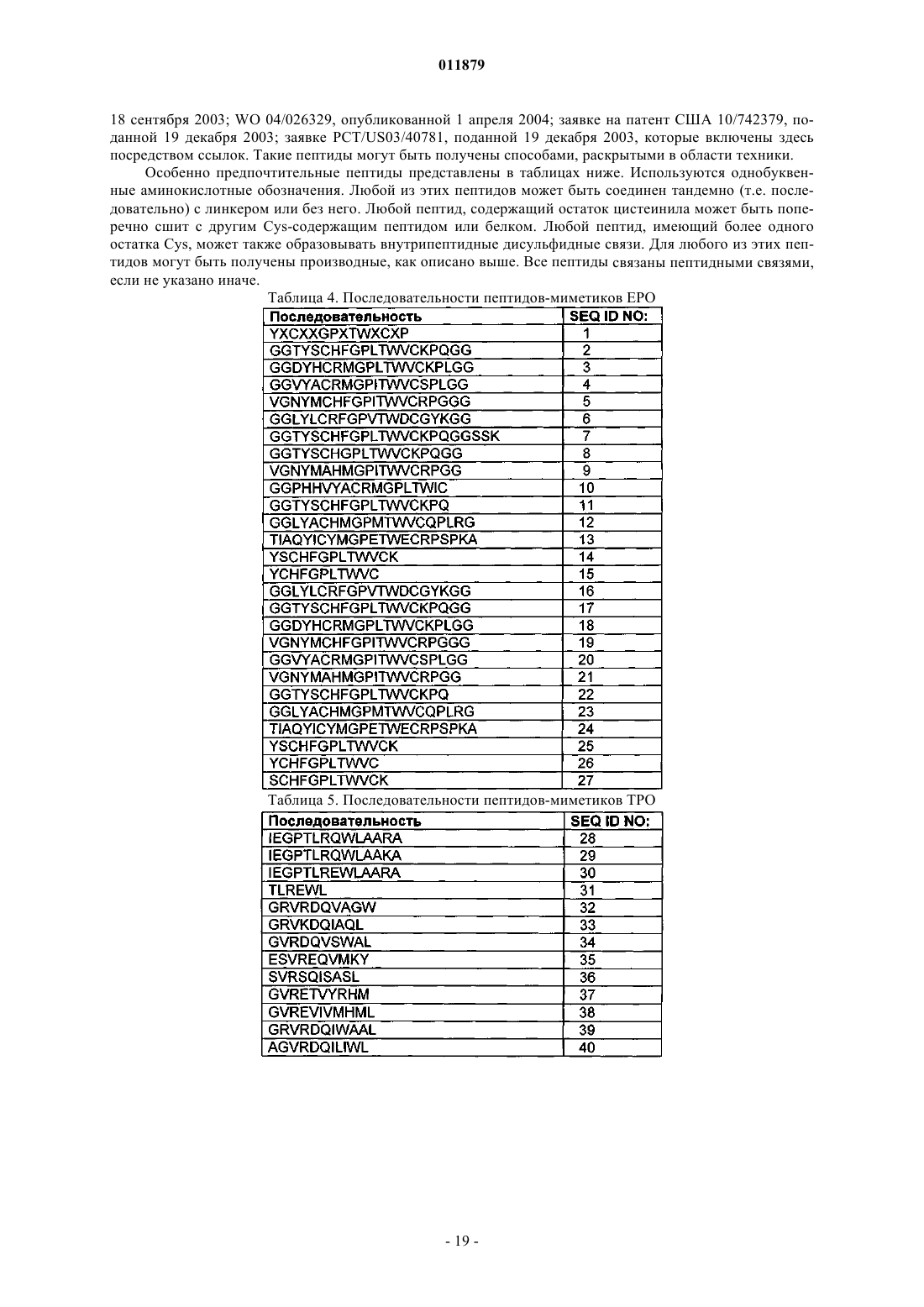
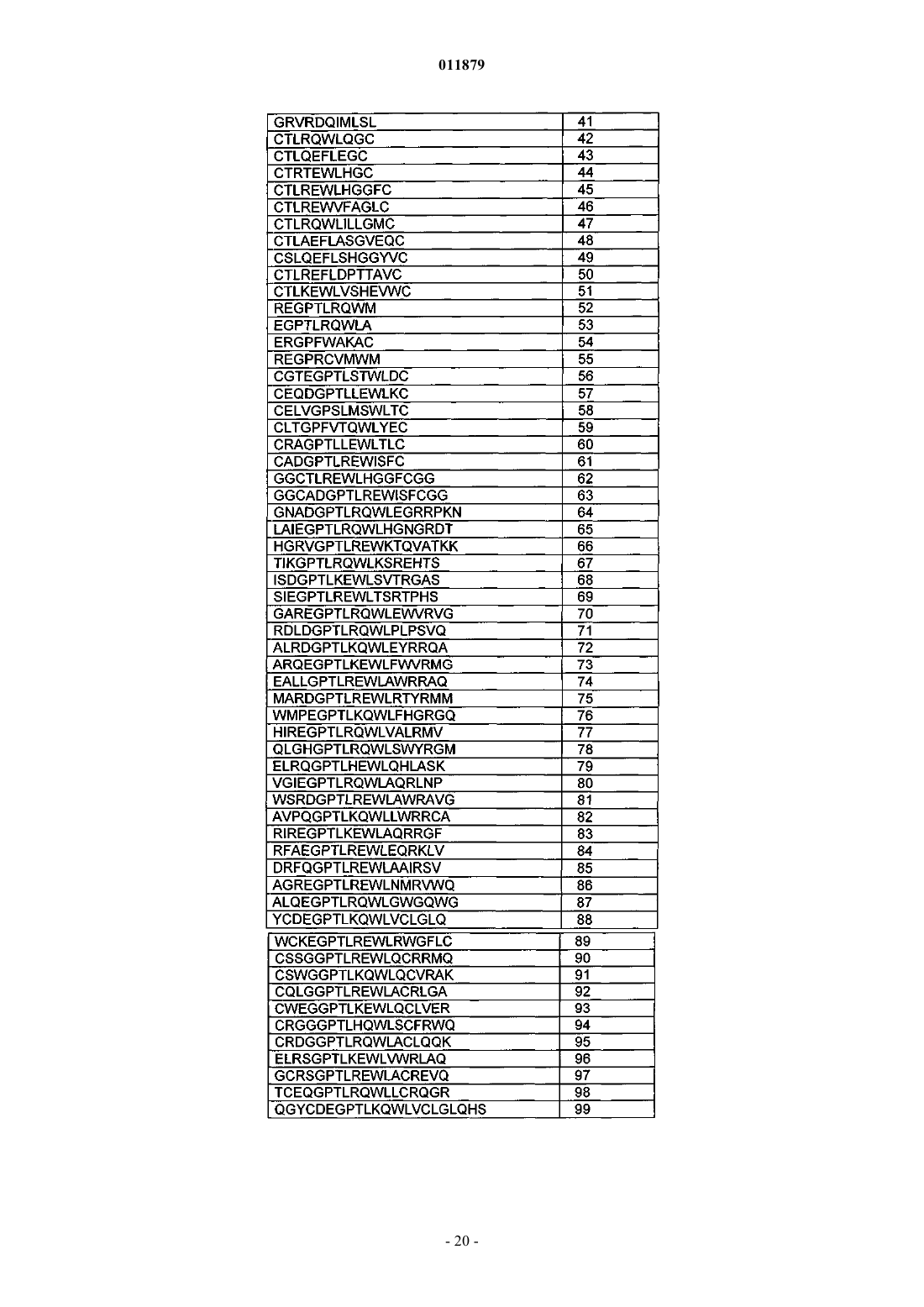
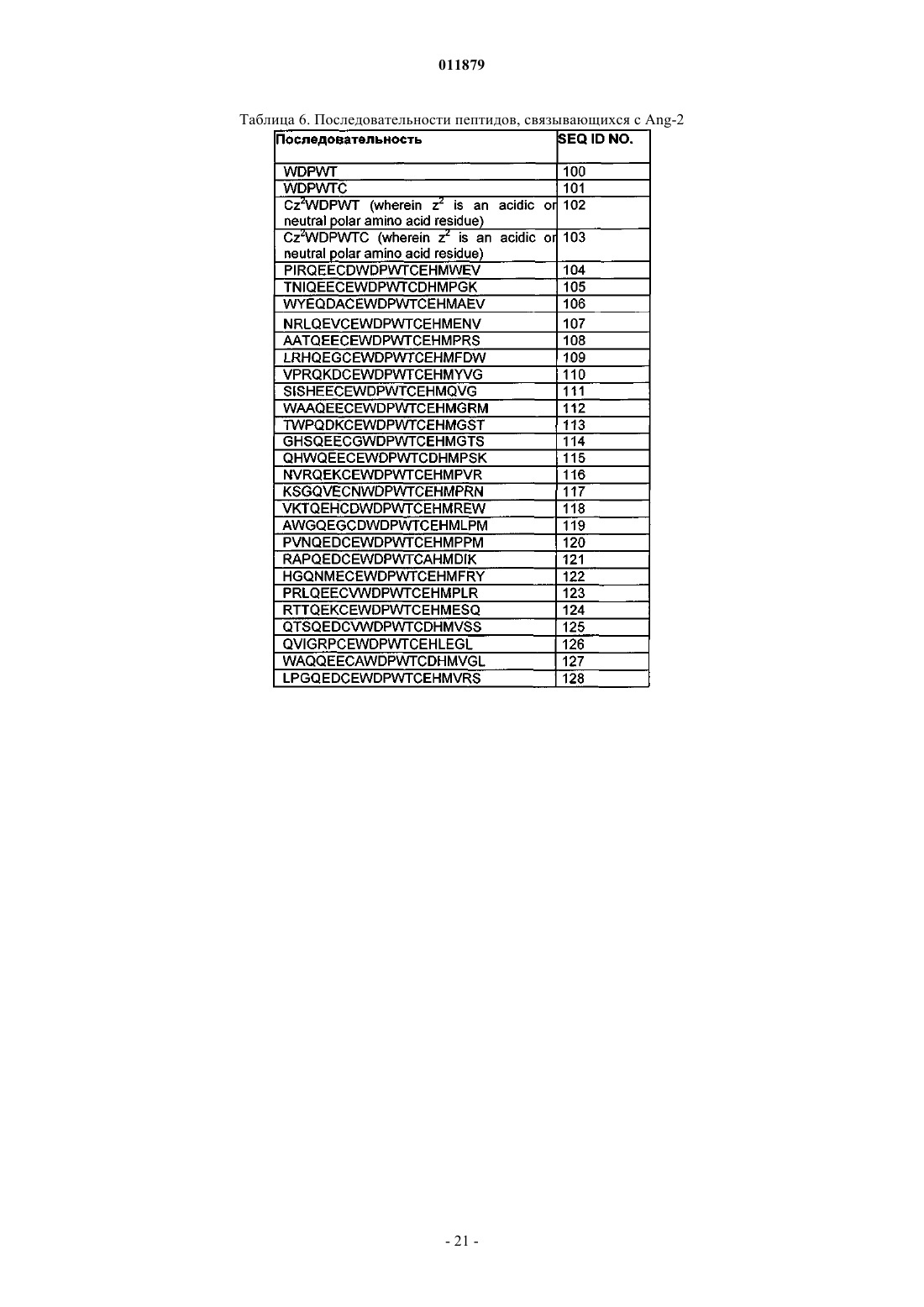
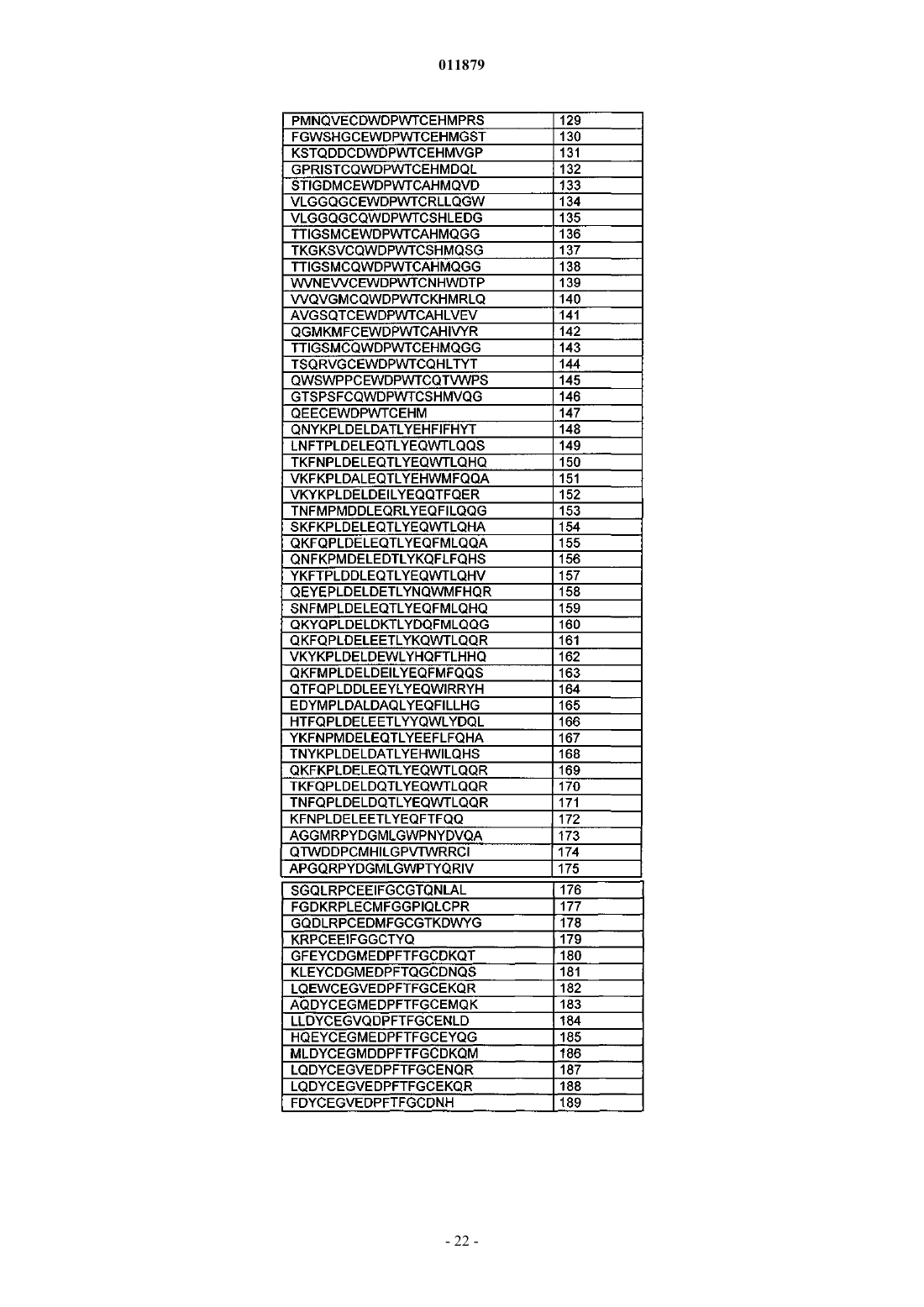
Молекулы с модифицированным fс фрагментом
Формула / Реферат
1. Соединение формулы
![]()
и его мультимеры, где
F1 представляет собой домен Fc, модифицированный таким образом, что содержит по меньшей мере один X3 в участке петли, причем указанный участок петли находится в неконцевой области Fc-домена;
каждый из X1 и X2 независимо выбран из -(L1)с-P1, -(L1)c-P1-(L2)d-P2, -(L1)c-P1-(L2)d-P2-(L3)e-P3 и
-(L1)c-P1-(L2)d-P2-(L3)e-P3-(L4)f-P4;
X3 независимо выбран из -(L5)c-P5, -(L5)c-P5-(L6)d-P6, -(L5)c-P5-(L6)d-P6-(L7)e-Р7 и -(L5)c-P5-(L6)d-P6-(L7)e-P7-(L8)f-P8;
каждый из Р1, Р2, Р3 и Р4 независимо представляет собой последовательность фармакологически активного полипептида или фармакологически активного пептида;
каждый из Р5, Р6, Р7 и Р8 независимо представляет собой последовательность фармакологически активного пептида;
каждый из L1, L2, L3, L4, L5, L6, L7 и L8 независимо представляет собой линкер и
каждый из а, b, с, d, е и f независимо равен 0 или 1.
2. Соединение по п.1, отличающееся тем, что а и b равны 0.
3. Соединение по п.1, отличающееся тем, что Fc домен содержит Fc домен IgG.
4. Соединение по п.3, отличающееся тем, что Fc домен содержит последовательность, выбранную из SEQ ID NO: 599 и 603-607.
5. Соединение по п.1, отличающееся тем, что Fc домен содержит Fc домен IgG1.
6. Соединение по п.5, отличающееся тем, что Fc домен IgG1 содержит SEQ ID NO: 599, а X3 вставлен в последовательность, выбранную из SEQ ID NO: 621, 622, 624, 625, 627, 628, 630, 632, 634 и 636, или заменяет всю или часть этой последовательности.
7. Соединение по п.6, отличающееся тем, что X3 вставлен в последовательность, выбранную из SEQ ID NO: 623, 626, 629, 631, 633, 635 и 637 или заменяет всю или часть этой последовательности.
8. Соединение по п.7, отличающееся тем, что X3 вставлен между парой остатков Leu139/Thr140.
9. Соединение по п.5, отличающееся тем, что Fc домен IgG1 содержит SEQ ID NO: 603, а X3 вставлен в последовательность, выбранную из SEQ ID NO: 621, 622, 624, 625, 627, 628, 630, 632, 634 и 636, или заменяет всю или часть этой последовательности.
10. Соединение по п.9, отличающееся тем, что X3 вставлен между парой остатков Н53/Е54, Y81/N82, N110/K111, L143/Т144, Q171/P172, E173/N174, S185/D186, G187/S188 или G205/N206.
11. Соединение по п.5, отличающееся тем, что Fc домен IgG1 содержит последовательность SEQ ID NO: 604, а X3 вставлен в последовательность, выбранную из SEQ ID NO: 621, 622, 624, 625, 627, 628, 632, 634, 636 и 644, или заменяет всю или часть этой последовательности.
12. Соединение по п.11, отличающееся тем, что X3 вставлен между парой остатков Н53/Е54, Y81/N82, N110/K111, M143/T144, Q171/P172, E173/N174, S185/D186, G187/S188 или G205/N206.
13. Соединение по п.1, отличающееся тем, что Fc домен содержит Fc домен IgG3.
14. Соединение по п.13, отличающееся тем, что Fc домен IgG3 содержит SEQ ID NO: 605, а X3 вставлен в последовательность, выбранную из SEQ ID NO: 614, 621, 622, 624, 627, 639, 641, 644, 645 и 646, или заменяет всю или часть этой последовательности.
15. Соединение по п.14, отличающееся тем, что X3 вставлен между парой остатков Н100/Е101, F128/N129, N157/K158, М190/Т191, Q218/P219, E220/N221, S232/D233, G234/S235 или G252/N253.
16. Соединение по п.1, отличающееся тем, что Fc домен содержит Fc домен IgG2.
17. Соединение по п.16, отличающееся тем, что Fc домен содержит SEQ ID NO: 606 и X3 вставлен в последовательность, выбранную из SEQ ID NO: 621, 622, 624, 632, 636, 639, 640, 642, 644 и 646, или заменяет всю или часть этой последовательности.
18. Соединение по п.17, отличающееся тем, что X3 вставлен между парой остатков Н49/Е50, F77/N78, N106/K107, М139/T140, Q167/P168, E169/N170, S181/D182, G183/S184 или G201/N202.
19. Соединение по п.1, отличающееся тем, что Fc домен содержит Fc домен IgG4.
20. Соединение по п.19, отличающееся тем, что Fc домен содержит SEQ ID NO: 607 и X3 вставлен в последовательность, выбранную из SEQ ID NO: 620, 621, 624, 627, 632, 634, 638, 639, 643 и 644, или заменяет всю или часть этой последовательности.
21. Соединение по п.20, отличающееся тем, что X3 вставлен между парой остатков Q50/E51, F78/N79, N107/K108, M140/Т141, Q168/P169, E170/N171, S182/D183, G184/S185 или G202/N203.
22. Соединение по п.1, отличающееся тем, что Fc домен содержит SEQ ID NO: 608 и X3 вставлен в последовательность, выбранную из SEQ ID NO: 621, 622, 628, 624, 627, 632, 636, 639, 644 и 646, или заменяет всю или часть этой последовательности.
23. Соединение по п.22, отличающееся тем, что X3 вставлен между парой остатков H65/E66, F93/N94, N122/K123, M157/T158, Q185/P188, E189/N190, S201/D202, G203/S207 или G224/N225.
24. Соединение по п.1, отличающееся тем, что X3 содержит последовательность ангиотензин-2 (ang-2)-связывающего пептида.
25. Соединение по п.24, отличающееся тем, что последовательность ang-2-связывающего пептида выбрана из SEQ ID NO: 100-189.
26. Соединение по п.25, отличающееся тем, что последовательность ang-2-связывающего пептида представляет собой SEQ ID NO: 147.
27. Соединение по п.26, отличающееся тем, что F1 содержит Fc домен IgG1.
28. Соединение по п.27, которое имеет последовательность SEQ ID NO: 618.
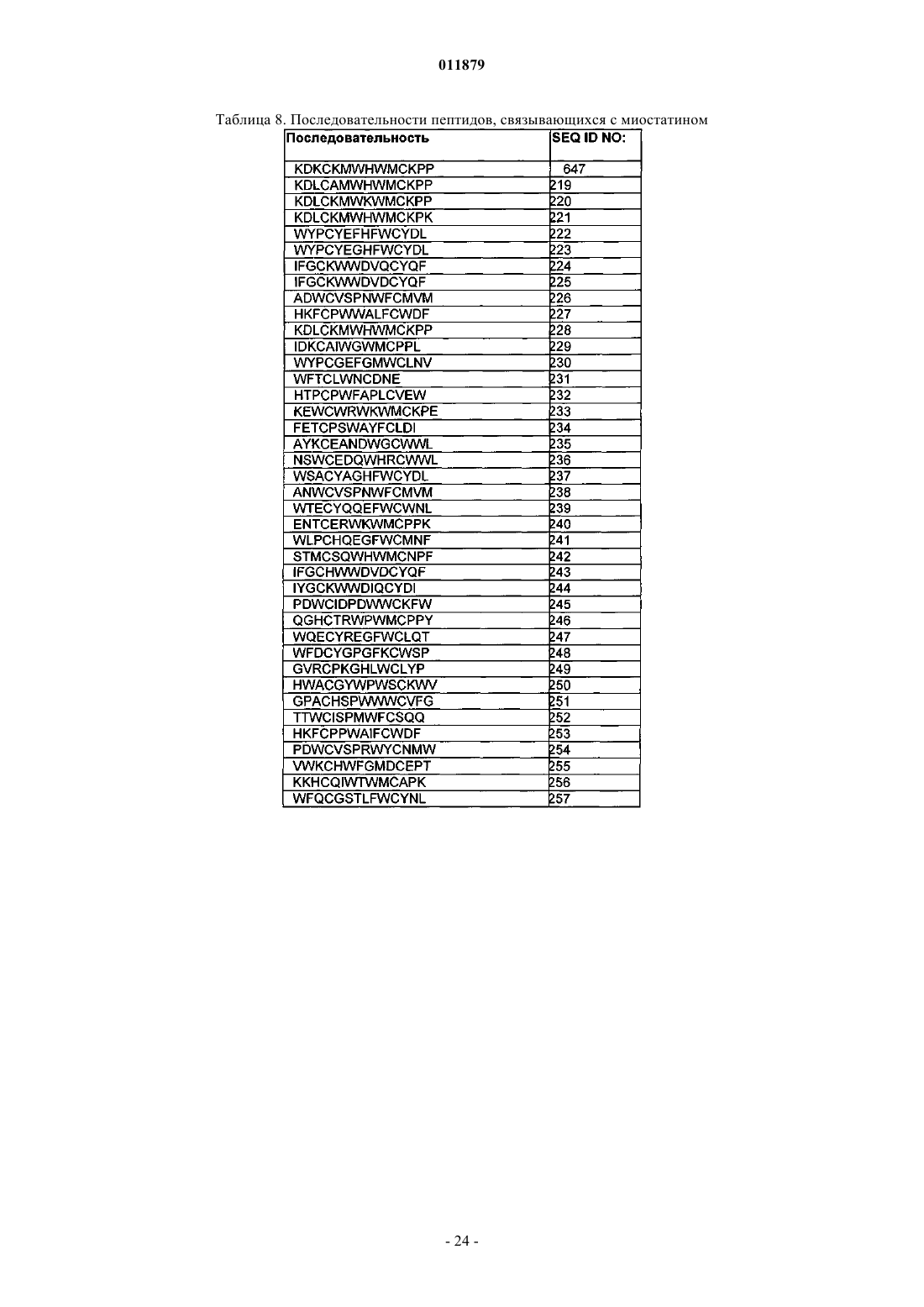
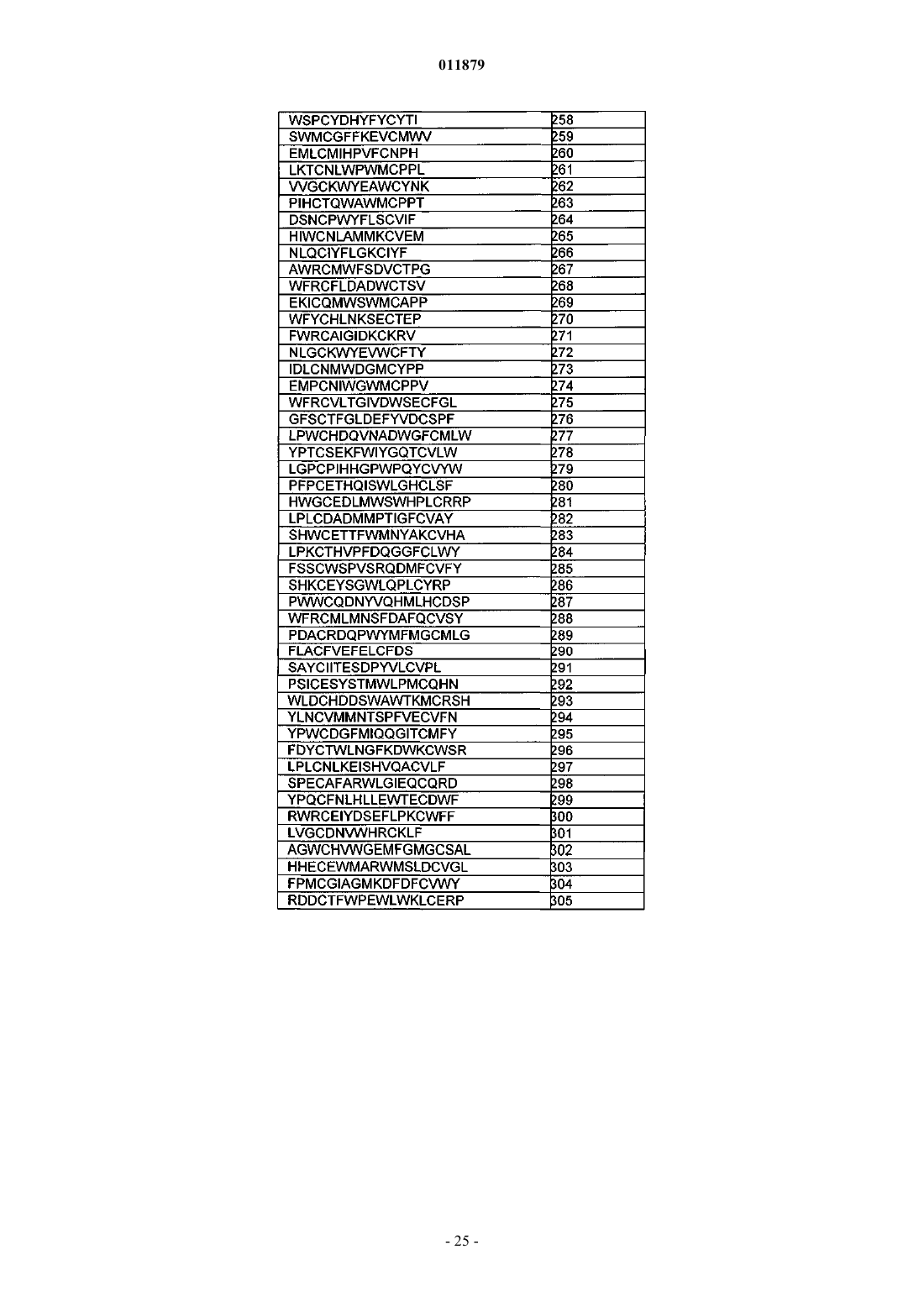
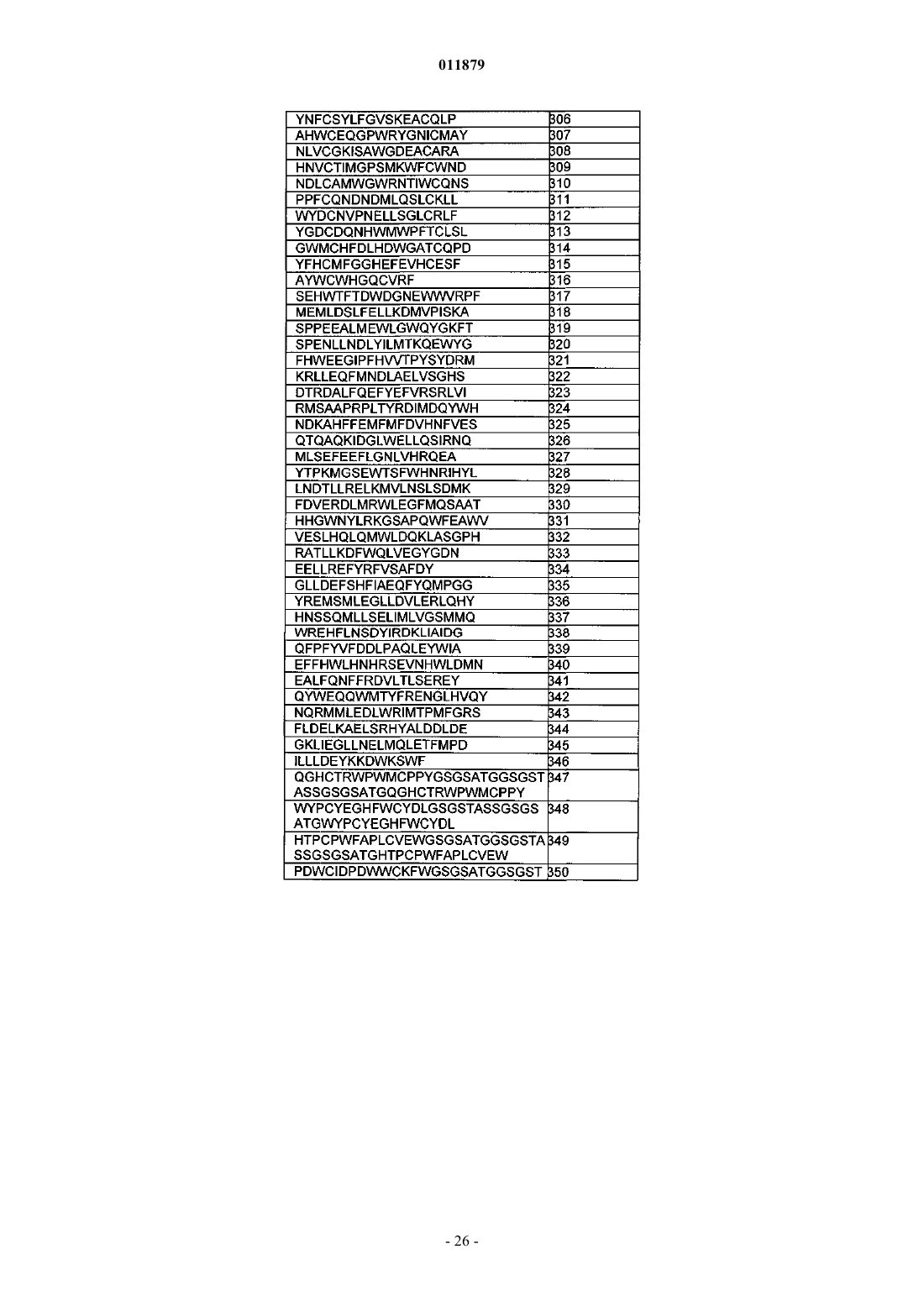
29. Соединение по п.1, отличающееся тем, что X3 содержит последовательность миостатинсвязывающего пептида.
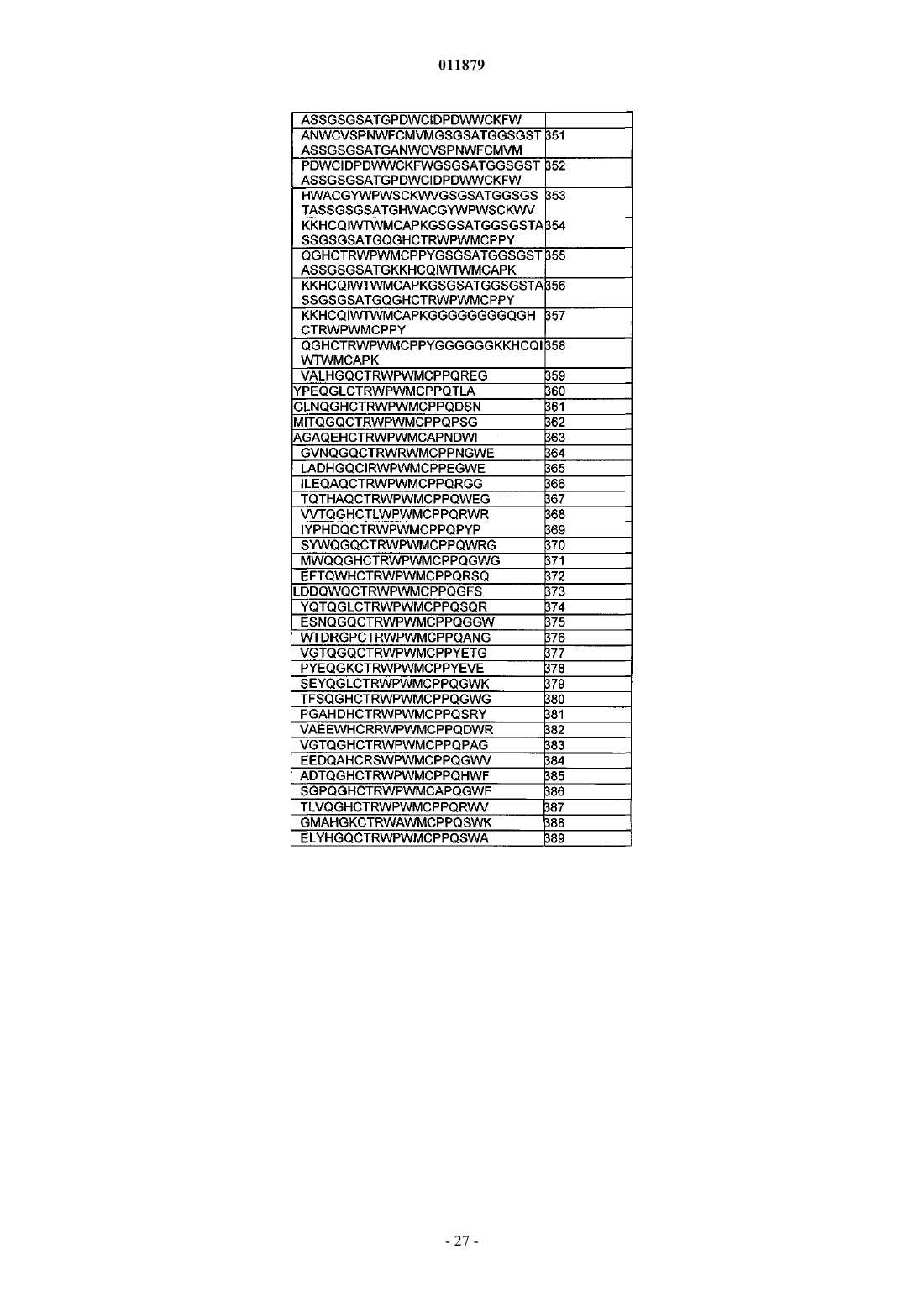
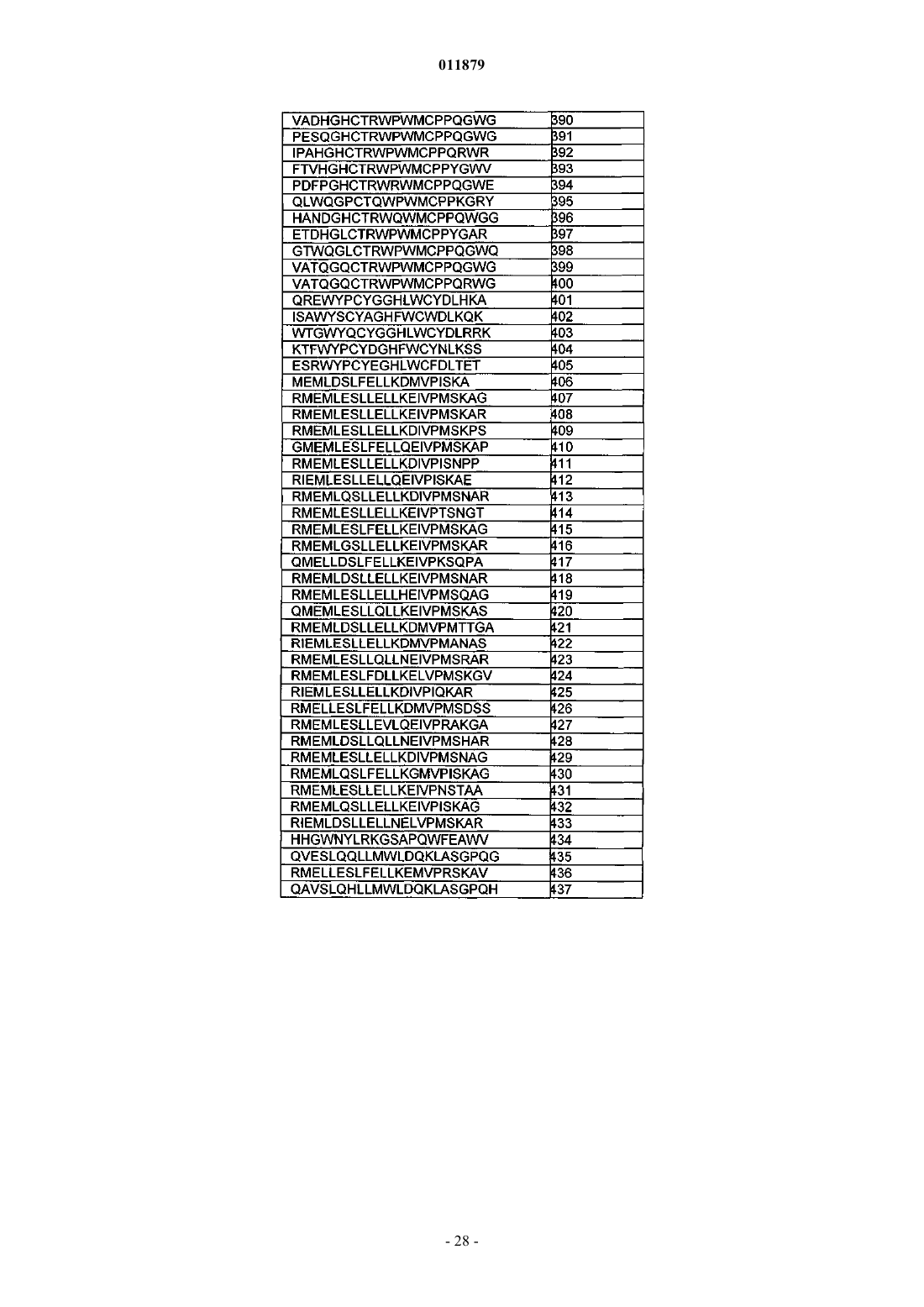
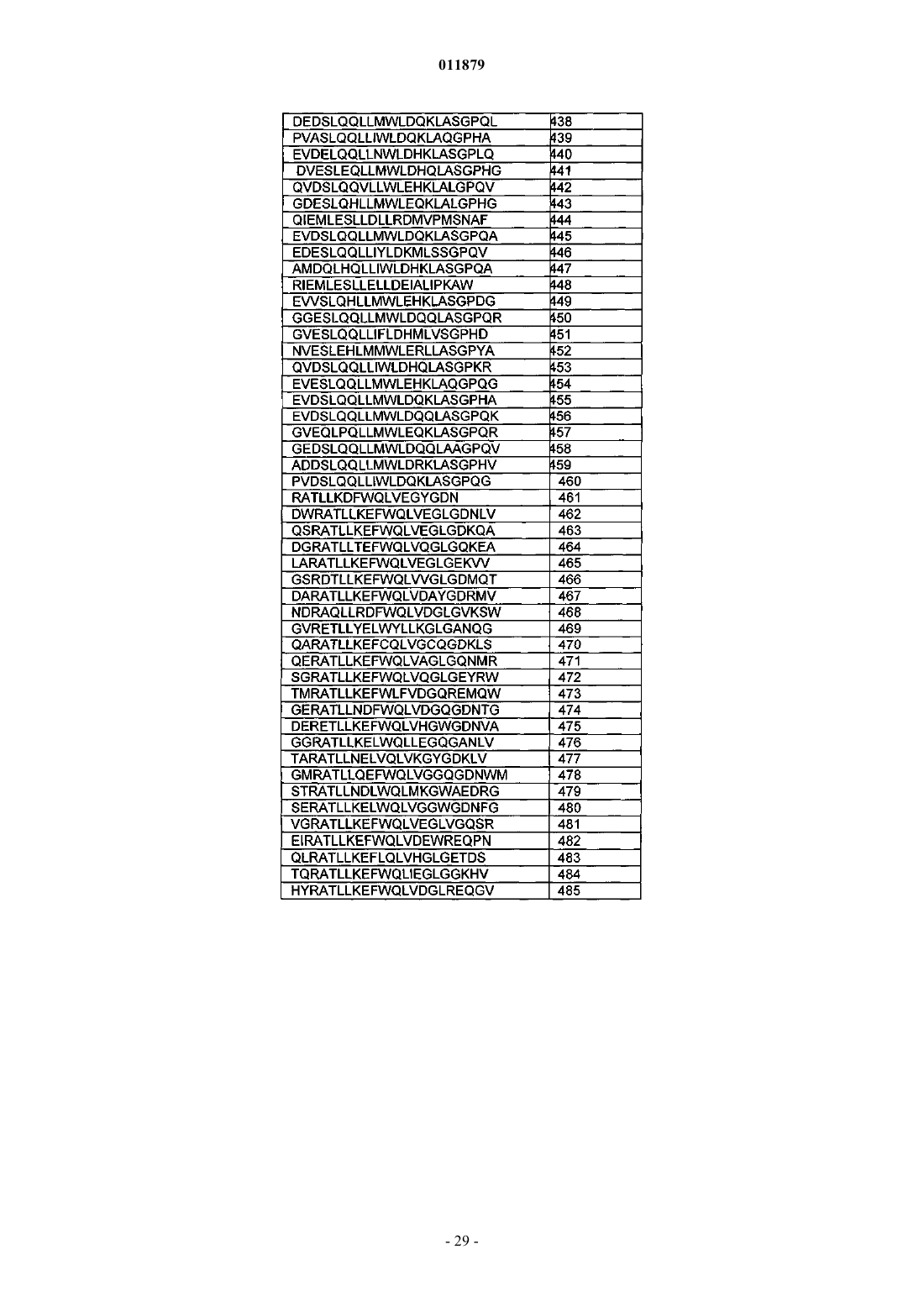
30. Соединение по п.29, отличающееся тем, что последовательность миостатинсвязывающего пептида выбрана из SEQ ID NO: 218-509.
31. Соединение по п.30, отличающееся тем, что последовательность миостатинсвязывающего пептида представляет собой SEQ ID NO: 365.
32. Соединение по п.31, отличающееся тем, что F1 содержит Fc домен IgG1.
33. Соединение по п.32, которое имеет последовательность SEQ ID NO: 612.
34. Соединение по п.1, отличающееся тем, что X3 содержит последовательность пептида-миметика эритропоэтина (ЕРО-миметика).
35. Соединение по п.34, отличающееся тем, что последовательность ЕРО-миметика выбрана из SEQ ID NO: 1-27.
36. Соединение по п.35, отличающееся тем, что последовательность ЕРО-миметика представляет собой SEQ ID NO: 2.
37. Соединение по п.36, отличающееся тем, что F1 содержит Fc домен IgG1.
38. Соединение по п.37, которое имеет последовательность SEQ ID NO: 615.
39. Соединение по п.1, отличающееся тем, что X3 содержит последовательность пептида-миметика тромбопоэтина (ТРО-миметика).
40. Соединение по п.39, отличающееся тем, что последовательность ТРО-миметика выбрана из SEQ ID NO: 28-99.
41. Соединение по п.40, отличающееся тем, что последовательность ТРО-миметика представляет собой SEQ ID NO: 28.
42. Соединение по п.41, отличающееся тем, что F1 содержит Fc домен IgG1.
43. Соединение по п.42, которое имеет последовательность SEQ ID NO: 616.
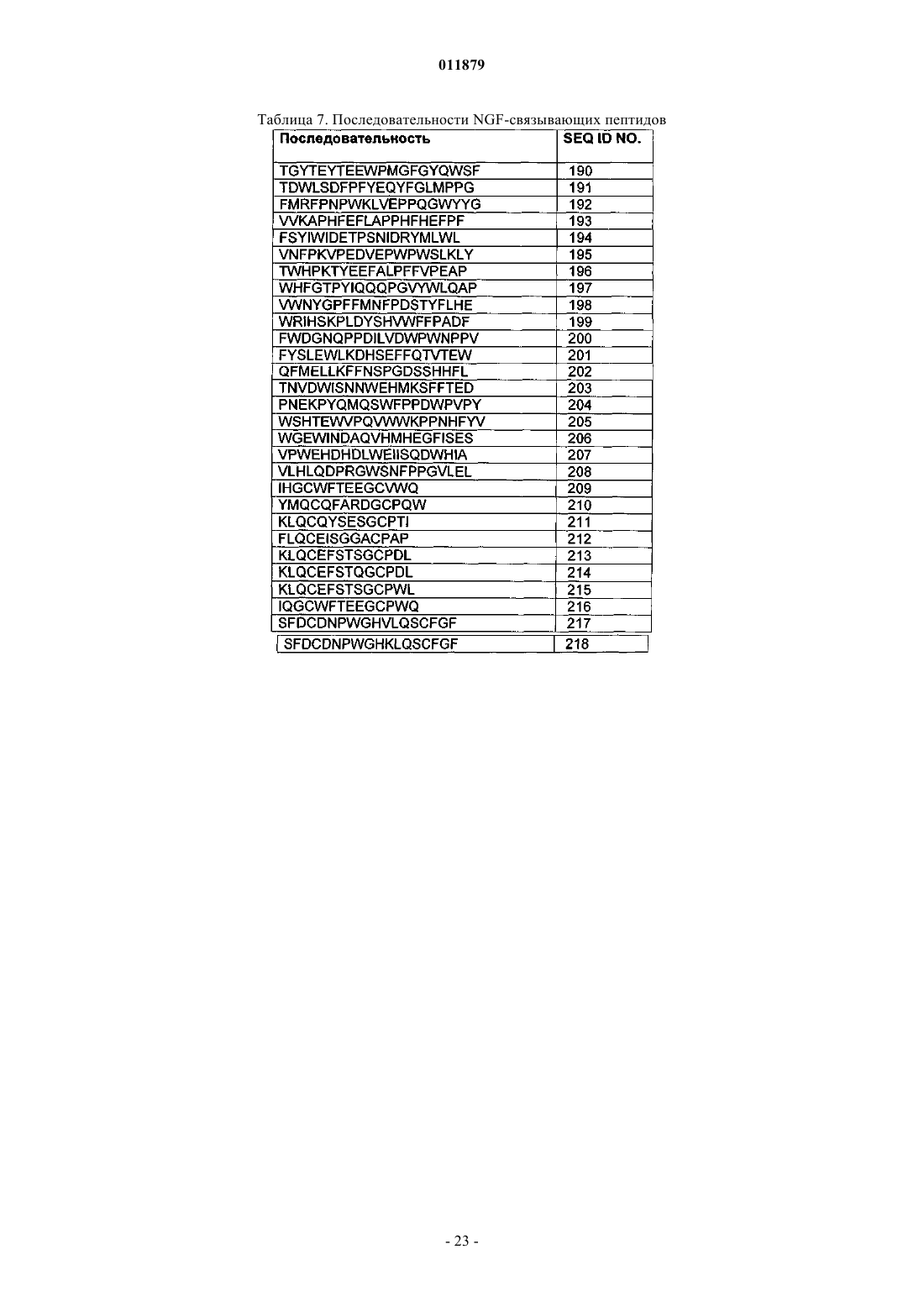
44. Соединение по п.1, отличающееся тем, что X3 содержит последовательность пептида, связывающего фактор роста нейронов (NGF).
45. Соединение вещества по п.44, отличающееся тем, что последовательность пептида, связывающего NGF, выбрана из SEQ ID NO: 190-218.
46. Вещество по п.1, отличающееся тем, что X3 содержит последовательность пептида, связывающего фактор, активирующий В-клетки (BAFF).
47. Соединение вещества по п.46, отличающееся тем, что последовательность пептида, связывающего BAFF, выбрана из SEQ ID NO: 510-594.
48. ДНК, кодирующая соединение по п.1.
49. Вектор экспрессии, который содержит ДНК по п.48.
50. Клетка-хозяин, которая содержит вектор экспрессии по п.49.
51. Клетка по п.50, отличающаяся тем, что представляет собой клетку Е. coli.
52. Способ получения фармакологически активного соединения, который включает:
а) выбор по меньшей мере одного рандомизированного пептида, который модулирует активность представляющего интерес белка; и
б) получение фармакологического агента, который содержит аминокислотную последовательность выбранного пептида в качестве внутренней неконцевой последовательности Fc домена.
53. Способ по п.52, отличающийся тем, что внутренняя последовательность Fc домена представляет собой область петли.
54. Способ по п.52, отличающийся тем, что пептид выбран способом, включающим одну или более методику, выбранную из скрининга в дрожжах, рационального дизайна, структурного анализа белков или скрининга библиотеки фагового дисплея, библиотеки Е. coli дисплея, библиотеки рибосомальных генов или химической пептидной библиотеки.
55. Способ по п.52, отличающийся тем, что получение фармакологического агента осуществляют посредством:
а) получения генетической конструкции, которая содержит нуклеотидную последовательность, кодирующую Fc домен, причем последовательность выбранного пептида вставлена между парой остатков или заменяет один или более аминокислотный остаток в пределах Fc домена; и
б) осуществления экспрессии генетической конструкции.
56. Способ по п.55, отличающийся тем, что указанную генетическую конструкцию экспрессируют в клетке Е. coli.
57. Способ по п.52, отличающийся тем, что представляющий интерес белок представляет собой поверхностный клеточный рецептор.
58. Способ по п.52, отличающийся тем, что представляющий интерес белок имеет линейный эпитоп.
59. Способ по п.52, отличающийся тем, что представляющий интерес белок представляет собой рецептор цитокинов.
60. Способ по п.52, отличающийся тем, что Fc домен представляет собой Fc домен IgG.
61. Модифицированное антитело, содержащее Fc домен, модифицированный таким образом, что он содержит по меньшей мере один X3 в области петли, причем указанный участок петли находится в неконцевой области Fc домена, где
X3 независимо выбран из -(L5)c-P5, -(L5)c-P5-(L6)d-P6, -(L5)c-P5-(L6)d-P6-(L7)e-Р7 и -(L5)c-P5-(L6)d-P6-(L7)e-P7-(L8)f-P8;
каждый из Р5, Р6, Р7 и Р8 независимо представляет собой последовательность фармакологически активных пептидов;
каждый из L5, L6, L7 и L8 независимо представляет собой линкер; и
каждый из с, d, е и f независимо равен 0 или 1.
62. Способ получения модифицированного антитела, который включает:
а) выбор по меньшей мере одного пептида, который модулирует активность представляющего интерес белка; и
б) получение антитела, которое содержит аминокислотную последовательность выбранного пептида в участке петли Fc домена указанного антитела, причем указанный участок петли находится в неконцевой области Fc домена.
Текст
011879 Заявка на данный патент испрашивает приоритет по заявке США 60/612680, поданной 24 сентября 2004 г., включенной в настоящее описание посредством ссылки. Предшествующий уровень техники Успех препарата Enbrel (этанерцепт) ознаменовал собой появление терапевтических агентов, модифицированных присоединением константной области антитела. Антитело состоит из двух функционально независимых частей, вариабельной области, называемой Fab, которая связывается с антигеном,и константной области, называемой Fc, определяющей такие эффекторные функции, как активацию комплемента и взаимодействие с фагоцитами. У Fc большой период полужизни в сыворотке, a Fab является короткоживущим, см. Capon et al. (1989), Nature 337:525-31. При объединении с терапевтическим белком домен Fc может увеличивать период полураспада или придавать такие функции, как связывание с рецептором Fc, связывание с белком А, фиксацию комплемента и, вероятно, даже проникновение через плаценту. Id. В табл. 1 суммирована информация, касающаяся применения гибридных с Fc белков, известных в данной области. Таблица 1. Слияние Fc с терапевтическими белками Совершенно другой подход к разработке терапевтических агентов представляет собой скрининг библиотек пептидов. Взаимодействие белкового лиганда с рецептором зачастую происходит на относительно большом участке поверхности взаимодействия. Однако, как показано на примере гормона роста человека и его рецептора, лишь несколько ключевых участков на поверхности взаимодействия вносят вклад в энергию связывания. Clackson et al. (1995), Science 267: 383-6. Основная часть белкового лиганда обеспечивает правильную топологию эпитопов или выполняет функции, не имеющие отношения к связыванию. Таким образом, лишь молекулы пептидной длины (от 2 до 40 аминокислот) могут связываться с рецептором данного большого белкового лиганда. Подобные пептиды могут имитировать биологическую активность большого белкового лиганда (пептидные агонисты) или путем конкурентного связывания ингибировать биологическую активность большого белкового лиганда (пептидные антагонисты). Эффективным способом идентификации подобных пептидных агонистов и антагонистов оказались библиотеки пептидов, созданные способом фагового дисплея. См., например, работы Scott et al. (1990),Science 249: 386; Devlin et al. (1990), Science 249: 404; патент США 5223409, опубликованный 29 июня 1993; патент США 5733731, опубликованный 31 марта 1998; патент США 5498530, опубликованный 12 марта 1996; патент США 5432018, опубликованный 11 июля 1995; патент США 5338665,опубликованный 16 августа 1994; патент США 5922545, опубликованный 13 июля 1999; WO 96/40987,опубликованная 19 декабря 1996; и WO 98/15833, опубликованная 16 апреля 1998 (все включены в настоящую заявку посредством ссылок). В подобных библиотеках случайные пептидные последовательности представлены через слияние пептида с белком оболочки нитевидного фага. Обычно представленные пептиды являются аффинно очищенными при помощи иммобилизованного на антителе внеклеточного домена рецептора. Удерживаемые фаги можно обогатить путем последовательных циклов аффинной очистки и повторной репродукции. Пептиды, связывающиеся наилучшим образом, можно секвенировать для определения ключевых остатков в пределах одного или более структурно схожих семейств пептидов. См., например, работу Cwirla et al. (1997), Science 276: 1696-9, в кото-1 011879 рой были идентифицированы два различных семейства. На основе первичных последовательностей пептидов можно также предположить, какие остатки можно безошибочно заменить посредством сканирования аланином или путем мутагенеза на уровне ДНК. Для дальнейшей оптимизации последовательности наилучшим образом связывающихся молекул могут быть созданы и проскринированы библиотеки мутантных форм. Lowman (1997), Ann. Rev. Biophys. Biomol. Struct. 26: 401-24. Известны и другие методы исследования пептидов, конкурирующие с методом фагового дисплея. Библиотеку пептидов можно объединить с С-концом lac-репрессора и экспрессировать в Е. coli. С помощью другого метода с применением E.coli возможно осуществить дисплей на наружной клеточной мембране путем слияния с липопротеином, ассоциированным с пептидогликаном (peptidoglycan-associatedlipoprotein, PAL). В дальнейшем эти и схожие с ними способы в совокупности упоминаются как Е. coli дисплей. В другом биологическом подходе для скрининга композиций растворимых пептидов используются дрожжи для экспрессии и секреции. См. Smith et al. (1993), Mol. Pharmacol. 43: 741-8. В дальнейшем способ Смита и соавторов (Smith et al.) и схожие способы упоминаются как скрининг в дрожжах. В другом способе обрывают трансляцию произвольных молекул РНК до диссоциации рибосомы, в результате чего получают библиотеку полипептидов с еще присоединенными к ним молекулами ассоциированных РНК. В дальнейшем этот и схожие с ним способы в совокупности упоминаются как рибосомный дисплей. В других способы применяют химическое связывание пептидов с РНК; см., например,Роберт RobertsSzostak (1997), Proc. Natl. Acad. Sci. USA. 94: 12297-303. В дальнейшем, этот и схожие способы в совокупности упоминаются как РНК-пептидный скрининг. Были разработаны полученные химическими способами пептидные библиотеки, в которых пептиды иммобилизуют на стабильных небиологических материалах, таких как полиэтиленовые стержни или проницаемые для растворителей полимеры. В другой полученной химическими методами библиотеке пептидов используют фотолитографию для сканирования пептидов, иммобилизованных на предметных стеклах. В дальнейшем эти и схожие способы в совокупности упоминаются как химико-пептидный скрининг. Преимущество химикопептидный скрининга может состоять в том, он позволяет применение D-аминокислот и других искусственных аналогов, а также непептидных элементов. Обзор как биологических, так и химических способов приведен в работе WellsLowman (1992), Curr. Opin. Biotechnol. 3: 355-62. В случае известных биоактивных пептидов может быть выполнен рациональный дизайн пептидных лигандов с подходящими терапевтическими свойствами. В таком способе вносят пошаговые изменения в последовательности пептида и определяют влияние замены на биоактивность или прогнозируемую биофизическую характеристику пептида (например, структуру раствора). В дальнейшем эти способы в совокупности упоминаются как рациональный дизайн. В одном из таких способов получают серию пептидов, в каждом из которых заменяют один из остатков на аланин. Эту технику обычно называют аланиновая прогулка ("alanine walk") или аланиновое сканирование ("alanine scan"). Когда заменяют два остатка (последовательных или расположенных отдельно), это называется двойной аланиновой прогулкой ("double alanine walk"). Образующиеся в результате аминокислотные замены могут быть использованы по отдельности или в комбинации с получением новой молекулы пептида с подходящими терапевтическими свойствами. Структурный анализ белок-белкового взаимодействия также можно применять для определения предполагаемых пептидов, имитирующих активность связывания у больших белковых лигандов. В таком способе анализа кристаллическая структура может указывать на особенность и относительную ориентацию ключевых остатков большого белкового лиганда, на основе которых может быть сконструирован пептид. См., например, et al. (1997), Nature Biotech. 15: 1266-70. В дальнейшем эти и схожие способы упоминаются как структурный анализ белка. Такие аналитические способы можно также применять для исследования взаимодействия между рецепторным белком и пептидами, выбранными при помощи фагового дисплея, на основе которых можно предложить дальнейшую модификацию пептидов для увеличения сродства связывания. В принципе можно обнаружить пептидные миметики любого белка с применением способа фагового дисплея и других способов, упоминаемых выше. Эти способы были использованы для картирования эпитопов, для идентификации ключевых аминокислот в белок-белковом взаимодействии, и наконец, для открытия новых терапевтических агентов. Например, Cortese et al. (1996), Curr. Opin. Biotech. 7: 616-21. Библиотеки пептидов сейчас используют чаще всего для иммунологических исследований, например,для картирования эпитопов. Kreeger (1996). The Scientist 10(13): 19-20. Особый интерес представляет применение библиотек пептидов и других технологий для обнаружения фармакологически активных пептидов. Ряд таких пептидов, идентифицированных в данной области техники, приведен в табл. 2. Пептиды описаны в перечисленных публикациях, каждая из которых включена здесь посредством ссылки. Описана фармакологическая активность пептидов, и во многих примерах за ней следует краткое пояснение в круглых скобках. Некоторые из этих пептидов модифицированы(например, с формированием сшитых с С-концов димеров). Обычно библиотеки пептидов скринируют на связывание с рецептором фармакологически активных белков (например, рецептор ЕРО (эритропоэтина. По меньшей мере в одном из примеров (CTLA4), библиотека пептидов проскринирована на связывание с моноклональным антителом. Белки, перечисленные в этой колонке, могут связываться с ассоциированными пептидами (например, рецептор ЕРО, рецептор ИЛ-1) или имитировать ассоциированные пептиды. Ссылки, перечисленные в каждом случае, поясняют, связываются ли пептиды с молекулой или имитируют ее. Пептиды, идентифицированные при скрининге библиотек пептидов, долгое время рассматривали просто как ключ к разработке терапевтических агентов, а не как сами терапевтические агенты. Как и другие белки и пептиды, они должны быстро удаляться in vivo либо посредством почечной фильтрации,механизмами уничтожения клеток в ретикулоэндотелиальной системе или путем протеолитической деградации. Francis (1992), Focus on Growth Factors 3: 4-11. В результате в данном способе применяют идентифицированные пептиды для подтверждения мишеней лекарства или в качестве основы для конструирования органических соединений, которые не могли быть так легко и так быстро идентифицированы при помощи скрининга химических библиотек. Lowman (1997), Ann. Rev. Biophys. Biomol. Struct. 26:-8 011879 401-24; Kay et al. (1998), Drug Disc. Today 3: 370-8. Более поздней разработкой является слияние случайным образом созданных пептидов с Fc доменом. См. Патент США 6660843, опубликованный 9 декабря 2003, Feige et al. (включенный ссылкой в полном объеме). Такие молекулы сейчас известны как пептитела ("peptibodies"). Они включают один или несколько пептидов, соединенных по N-концу, С-концу, по боковой цепи аминокислоты или более чем по одному из этих сайтов. Технология пептител позволяет конструировать терапевтические агенты,которые содержат пептиды, которые имеют мишенью один или несколько лигандов или рецепторов,пептиды, характерные для опухолей, транспортируемые через мембрану пептиды, и т.п. Технология пептител оказалась полезной для конструирования ряда такого рода молекул, включая линейные и связанные дисульфидными мостиками полипептиды, тандемные пептидные мультимеры (т.е. более одного пептида на одной цепи домена Fc). См., например, патент США 6660843; патент США 2003/0195156, опубликованный 16 октября, 2003 (соответствует WO 02/092620, опубликованной 21 ноября, 2002); заявку на патент США 2003/0176352, опубликованной 18 сентября, 2003 (соответствует(соответствует WO 00/24770, опубликованной 4 мая, 2000); заявку на патент США 2003/0229023,опубликованную 11 сентября, 2003; WO 03/057134, опубликованную 17 июля, 2003; заявку на патент США 2003/0236193, опубликованную 25 декабря, 2003 (соответствует PCT/US04/010989, поданного 8 апреля, 2004); патент США 10/666480, поданный 18 сентября, 2003 (соответствует WO 04/026329,опубликованной 1 апреля, 2004), включенные посредством ссылки в полном объеме. Дальнейшее развитие технологий, облегчающих такого рода рациональный дизайн лекарств, внесет полезный вклад в данную область техники. Краткое описание изобретения Настоящее изобретение относится к способу, в котором по меньшей мере один биологически активный пептид включен в качестве внутренней последовательности в домен Fc. Такая внутренняя последовательность может быть добавлена путем вставки (т.е. интеграции между соседними аминокислотами в существующий домен Fc) или путем замены аминокислот в существующем домене Fc (т.е. путем удаления аминокислот в существующей области Fc и добавления аминокислот пептида). В последнем случае не требуется, чтобы количество добавленных аминокислот пептида соответствовало количеству аминокислот, удаленных из прежде существующего домена Fc; например, настоящее изобретение относится к молекуле, в которой были удалены 10 аминокислот и были добавлены 15 аминокислот. В настоящем изобретении фармакологически активные соединения получают способом, включающим: а) выбор по меньшей мере одного пептида, модулирующего активность представляющего интерес белка; и б) получение фармакологического агента, который содержит аминокислотную последовательность выбранного пептида в качестве внутренней последовательности домена Fc. Этот способ можно применять для модификации домена Fc, который уже связан через N- или Сконец или боковую цепь с полипептидом (например, этанерцепт) или с пептидом (например, как описано в заявках на патент США 2003/0195156, 2003/0176352, 2003/0229023 и 2003/0236193; WO 00/24770;WO 04/026329). Описанный способ можно также применять для модификации домена Fc, который является частью антитела (например, адалимумаба, эпратузумаба, инфликсимаба, Герцептина и т.п.). Таким образом, могут быть получены различные молекулы, имеющие дополнительные функции, такие как домен для связывания с эпитопом или дополнительные домены для связывания с эпитопом молекулыпредшественника. Пептид может быть выбран, например, при помощи способа фагового дисплея (который является предпочтительным), способа дисплея на Е. coli, рибосомным дисплеем, РНК-пептидного скрининга, скрининга в дрожжах, химико-пептидного скрининга, рационального дизайна или структурного анализа белков, или может представлять собой природный пептид (например, РТН, GLP-1). Изобретение также относится к молекулам, которые содержат домен Fc, модифицированный посредством включения пептида в качестве внутренней последовательности (предпочтительно в области петли) домена Fc. Молекулы, которые содержат последовательность пептида в своей внутренней области, названы здесь Fc-внутренние пептитела или Fc-внутренние пептидные молекулы. Эти молекулы описаны в тексте ниже.Fc-внутренние пептидные молекулы могут содержать более одной пептидной последовательности,расположенной тандемно, в конкретной внутренней области, и они могут также содержать пептиды в других внутренних областях. Хотя предполагаемые области петель являются предпочтительными, вставки в любые другие нетерминальные области Fc также считаются частью настоящего изобретения. Варианты и производные вышеуказанных соединений (описанные ниже) также охвачены настоящим изобретением. Соединения согласно настоящему изобретению могут быть получены стандартными способами синтеза, способами рекомбинантной ДНК или любыми другими способами для получения пептидов и гибридных белков. Основным способом применения, предусмотренным для Fc-внутренних пептидных молекул, является применение в качестве терапевтических или профилактических агентов. Выбранный пептид может-9 011879 иметь активность, сравнимую активностью (или даже выше ее) природного лиганда, которого имитирует пептид. Кроме того, определенные терапевтические агенты, основанные на природных лигандах, могут индуцировать образование антител к собственным эндогенным лигандам пациента. В противоположность этому уникальная последовательность связанного с разбавителем пептида позволяет избежать данной проблемы, поскольку имеет незначительное сходство (идентичность) или, как правило, не имеет сходства по последовательности с природным лигандом. Кроме того, Fc-внутренние пептитела могут иметь преимущества при ренатурации и очистке молекул, связанных по N- или С-концам с Fc домена. К тому же, Fc-внутренние пептитела могут быть более стабильными как термодинамически, благодаря стабилизации химерных доменов, так и химически, благодаря повышенной устойчивости к протеолитической деградации с участием амино- и карбоксипептидаз. Fc-внутренние пептитела могут также обладать улучшенными фармакокинетическими свойствами. Хотя соединения согласно настоящему изобретению в основной части рассматривают в качестве терапевтических агентов, они могут также быть полезными при скрининге такого рода агентов. Например, можно применять Fc-внутреннее пептитело (например, пептид Fc-петля-SH2 домен) в способах анализа с применением планшетов, покрытых антителами к Fc. Fc-внутренние пептитела могут сделать нерастворимые пептиды растворимыми и, таким образом, применимыми в ряде способов анализа. Соединения согласно настоящему изобретению можно применять для терапевтических или профилактических целей, разрабатывая препараты на их основе с подходящими фармацевтическими носителями, и вводя эффективное количество пациенту, например, человеку (или другому млекопитающему),нуждающемуся в таком лечении. Другие смежные аспекты также включены в настоящее изобретение. Многочисленные дополнительные аспекты и преимущества настоящего изобретения ясны из описания фигур и подробного описания изобретения. Описание фигур На фиг. 1 А, 1 Б и 1 В показаны области петли доменов Fc, которые могут быть модифицированы согласно настоящему изобретению. На данных структурных изображениях СН 2 и СН 3 доменов Fc в качестве области петли можно рассматривать любую часть модели, не обозначенную как -слой (плоские стрелки) или -спираль (цилиндр). На фиг. 1 А показан домен Fc мономерного IgG2a мыши (Файл базы данных белков 111 С,http://www.rcsb.org/pdb/). На данной фигуре показана трехмерная модель домена Fc мономера IgG2a крысы на основе кристаллической структуры, полученной путем дифракции рентгеновских лучей (pdb 111 С). Потенциальные сайты вставок в Fc петле показаны как для СН 2, так и для СН 3 доменов, при этом особо отмечен предпочтительный сайт вставки в Fc петле СН 3 домена. На фиг. 1 Б показан домен Fc мономерного IgG1 мыши (Файл базы данных белков 1IGY). На этой фигуре показана трехмерная модель домена Fc мономера IgG1 мыши на основе кристаллической структуры, полученной путем дифракции рентгеновских лучей (pdb 1IGY). Потенциальные сайты инсерций вFc петле показаны как для СН 2, так и для СН 3 доменов, при этом особо отмечен предпочтительный сайт вставки в Fc петле СН 3 домена. На фиг. 1 В показан домен Fc мономерного IgG1 человека (Файл базы данных белков 1H3 Т). На этой фигуре показана трехмерная модель домена Fc мономера IgG1 мыши на основе кристаллической структуры, полученной путем дифракции рентгеновских лучей (pdb 1H3T). Потенциальные сайты инсерций в Fc петле показаны как для СН 2, так и для СН 3 доменов, при этом особо отмечен предпочтительный сайт втсавки (инсерций) в Fc петле СН 3 домена. Данные структуры показывают высокую степень гомологии вторичной и третичной структур в пределах Fc доменов различных подтипов IgG и между видами. Кристаллические структуры, полученные при помощи рентгеновского излучения, для данных структур можно найти в белковом банке данныхRCSB (http://www.rcsb.org/pdb/). На фиг. 2 А приведена последовательность Fc IgG1 человека (SEQ ID NO: 599), использованная для образования гибридных пептител, при этом предсказанные последовательности петли выделены жирным шрифтом. На фиг. 2 А в контексте последовательности IgG1 человека, использованной в данном изобретении, показаны жирным шрифтом области Fc петли (SEQ ID NO: 621, 622, 624, 625, 627, 628, 630, 632,634 и 636), которые предложены согласно структурам, показанным на фиг. 1 А, 1 Б и 1 В. Любой сайт или все сайты, показанные жирным шрифтом, могут быть пригодными для полного или частичного замещения или вставки пептидных последовательностей и считаются частью данного изобретения. Подчеркнуты особо предпочтительные внутренние сайты (SEQ ID NO: 623, 626, 629, 631, 633, 635, и 637). Одним из предпочтительных сайтов является SEQ ID NO: 631 между Leu139 и Thr140 в петле DELTK (SEQ ID NO: 630). Потенциальные петлевые сайты в других подтипах Ig предполагают на основании выравниваний,приведенных на фиг. 2 Б и 2 В. На фиг. 2 Б и 2 В показано выравнивание последовательностей доменов Fc человека из подклассовIgA, IgM и IgG. На фиг. 2 Б и 2 В представлены примеры аминокислотных последовательностей (SEQ IDNO: 600-607) доменов Fc человека из подтипов IgA, IgM и IgG, которые можно применять в соответствии с настоящим изобретением. Также на фиг. 2 Б и 2 В показана консенсусная последовательность (SEQID NO: 608). На фиг. 2 Б и 2 В также показаны жирным шрифтом предпочтительные внутренние сайты для добавления пептида, которые соответствуют таковым в последовательности Fc, представленной на фиг. 2 А(SEQ ID NO: 599). В частности, на фиг. 2 Б и 2 В показаны следующие предпочтительные сайты: Выравнивание последовательностей на фиг. 2 Б и 2 В позволяет выявить еще два потенциальных сайта вставки в Q167/P168 и/или G183/S184 (с использованием нумерации SEQ ID NO: 599 на фиг. 2 А). Эти позиции соответствуют пробелам в последовательностях IgG, где обнаруживают вставки 2 и 3 остатков в выравнивании последовательностей IgA и IgM. Другие предпочтительные сайты инсерций соответствуют последовательности на фиг. 2 А. Предпочтительные сайты инсерций подчеркнуты на фиг. 2 Б и 2 В и являются следующими: На фиг. 2 Г представлено выравнивание домена Fc IgG1 человека (Amgen Fc, SEQ ID NO: 609), использованного в качестве основы для пептитела с крысиным IgG2A на основании кристаллической структуры комплекса FcRn/Fc (1I1.pdb, SEQ ID NO: 610). Также показана результирующая консенсусная последовательность (SEQ ID NO: 611). На фиг. 3 А представлена аминокислотная последовательность (SEQ ID NO: 612) домена Fc IgG1 человека с инсерцией миостатинсвязывающего белка (SEQ ID NO: 365). В дальнейшем эта молекула упоминается как миостатин-петлевое пептитело или Fc-петлевой-myo7. Встроенный пептид показан жирным шрифтом, глициновые линкеры выделены курсивом. На фиг. 3 Б показана аминокислотная последовательность (SEQ ID NO: 613) связанного по С-концу пептитела, обозначенного как TN8-19-07. Это пептитело содержит ту же пептидную последовательность,что и Fc-петлевой-myo7 (SEQ ID NO: 365). Пептид TN8-19-07 показан жирным шрифтом, глициновые и аланиновые линкеры выделены курсивом. На фиг. 3 В показана аминокислотная последовательность (SEQ ID NO: 615) Fc-внутреннего пептитела, упоминаемого далее как Fc-петлевой-ЕМР. Это пептитело содержит пептид-миметик ЕРО (SEQ IDNO: 2). Встроенный пептид показан жирным шрифтом, глициновые линкеры выделены курсивом. Цистеины, образующие дисульфидные связи, подчеркнуты. На фиг. 3 Г показана аминокислотная последовательность (SEQ ID NO: 616) Fc-внутреннего пептитела, упоминаемого в дальнейшем как Fc-петлевой-АМР 2. Биоактивный пептид (SEQ ID NO: 28), выделен жирным шрифтом, а глициновый линкер выделен курсивом. При встраивании пептида АМР-2 не образуется дисульфидных связей. На фиг. 3 Д показана аминокислотная последовательность (SEQ ID NO: 617) связанного по С-концу пептитела, в дальнейшем упоминаемого как Fc-петлевой-АМР 2-димер. Последовательность терапевтического пептида (SEQ ID NO: 28) этого соединенного тандемно димера терапевтического пептида показана жирным шрифтом, последовательности линкеров выделены курсивом. Эта молекула содержит димер тандемных пептидов той же самой пептидной последовательности, что и в Fc-петлевом -АМР-2.- 12011879 На фиг. 4 А и 4 Б показана экспрессия в Е. coli Fc-петлевого-myo7 и TN8-19-07 способом ДСНПААГ (4-20%). Пробы необработанного клеточного лизата (lys), нерастворимой фракции (insol) и растворимой (sol) фракции как для Fc-петлевого-Муо 7 (6951), так и для TN8-19-07 (6826) показаны в восстановительных гелях. SeeBlue и маркеры молекулярного веса (дорожка 1), лизаты целых клеток (дорожка 2), нерастворимая фракция (дорожка 3) и нерастворимая фракция (дорожка 4). На фиг. 5 показано сравнение способом обращенно-фазной высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) неочищенных реакций ренатурации Fc-петлевого-Муо 7 (6951) и TN8-19-07(6826). Приблизительно 10 мкг пептител наносили непосредственно из реакции ренатурации на колонкуVydak С 4 (5 мкМ, 300 , 4,6250 мм) и элюировали линейным градиентом 40-50% АЦН при 0,5%/мин. На фиг. 6 показано сравнение способом обращенно-фазной высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) конечного очищенного пула Fc-петлевого TN8-19-07 (6951) и Fcкарбоксиконцевого TN8-19-07 (6826). Наносили 10 мкг очищенных пептител на колонку Vydak C4(5 мкМ, 300 , 4,6250 мм) и элюировали линейными 40-50% градиентом АЦН при 0,5%/мин. На фиг. 7 показан анализ конечного очищенного пула Fc-петлевого TN8-19-07 (6951) и Fcкарбоксиконцевого TN8-19-07 (6826) способом ДСН-ПААГ (4-20% гель). Пять мкг каждой пробы наносили следующим образом: 6951 (дорожка 1), 6826 (дорожка 2), SeeBlue + маркеры (дорожка М), восстановленный 6951 (дорожка 3), восстановленный 6826 (дорожка 4). На фиг. 8 показан биоанализ in vitro с использованием клеток для оценки миостатинингибирующих соединений. Fc-петлевой TN8-19-07 (6951) сохраняет полную ингибирующую активность относительно карбоксиконцевого TN8-19-07 пептитела (6826). На фиг. 9 показан вестерн-блот анализ по изучению стабильности in vivo Fc-петлевого TN8-19-07(6951) и карбоксиконцевого TN8-19-07 пептитела (6826). Пул сывороток пяти мышей оценивали в каждой временной точке (0, 4, 24 и 48 ч). Дорожки 1-3 представляют собой стандарты Fc-петлевого TN819-07 в концентрации 2, 5 и 10 нг, соответственно. Дорожки 4 и 5 относятся к Fc-петлевым и карбоксиконцевым пептителам, соответственно, через 4 ч. Дорожки 6 и 7 представляют собой Fc-петлевые против карбоксиконцевых пептител, соответственно, при 24 ч. Дорожки 8 и 9 представляют собой Fc-петлевые против карбоксиконцевых пептител, соответственно, при 48 ч. Дорожки 10-12 представляют собой стандарт карбоксиконцевых пептител в концентрации 2, 5 и 10 нг, соответственно. Гель был получен при прогоне в 1 мм 4-12% ДСН-ПААГ геле в восстанавливающем буфере MES, вестерн-блот проводили с применением конъюгатов козлиных антител к IgG Fc человека с ПХ. Нам фиг. 10 А показана аминокислотная последовательность (SEQ ID NO: 618) домена Fc IgG1 человека с инсерцией Ang2-связывающего пептида (SEQ ID NO: 147). В дальнейшем, эта молекула упоминается как Ang2-петлевое пептитело или Fc-петлевой-Ang2. Биоактивный пептид выделен жирным шрифтом, а глициновый линкер обозначен курсивом. На фиг. 10 Б показана аминокислотная последовательность (SEQ ID NO: 619) связанного по С-концу пептитела, упоминаемого здесь как TN8-Con4. Эта молекула содержит ту же пептидную последовательность, что и Fc-петлевой-Ang 2 (SEQ ID NO: 147). Биоактивный пептид выделен жирным шрифтом, глициновые и аланиновые линкеры выделены курсивом. На фиг. 11 показана экспрессия и распределение в Е. coli Fc-петелевого TN8-Con4 (6888) и карбоксиконцевого TN8-Con4 (5564) пептител способом ДСН-ПААГ. Пробы сырого клеточного лизата (lys),нерастворимой фракции (insol) и растворимой (sol) представлены в восстанавливающих гелях как для для Fc-петлевого-Tn8-Con4 (6888) так и для TN8-Con4 (5564). На фиг. 12 показано сравнение способом ОФ-ВЭЖХ Fc-петлевого Ang2 (6888) и карбоксиконцевого Fc TN8-19-07 (5564) реакции ренатурации. Наносили 20 мкл смеси реакции ренатурации на колонку Vydak С 4 (5 мкМ, 300 , 4,6250 мм) и элюировали линейными градиентом 40-50% АЦН при 0,5%/мин. На фиг. 13 показано сравнение способом ОФ-ВЭЖХ конечных очищенных пулов Fc-петлевогоAng2 (6888) и карбоксиконцевого Fc TN8-Con4 (5564). Десять мкг очищенных пептител помещали на колонку Vydak C4 (5 мкМ, 300 , 4,6250 мм) и элюировали линейными градиентом 40-50% АЦН при 0,5%/мин. На фиг. 14 показан очищенный Fc-петелевой-myo7 и TN8-19-7. На фиг. 15 показан анализ связывания (Biacore) Fc-петлевого-Ang2 и Fc-Ang2-тандема. На фиг. 16 представлены результаты твердофазного иммуноферментного анализа (ИФА) in vitro дляFc-петлевого-Ang2, TN8-Con4 и Fc-Ang2-тандема. На фиг. 17 представлены результаты UT7 анализа влияния эритропоэтина на пролиферацию для Fcпетлевого-ЕМР. В анализе сравнивали активность двух различных молекул Fc-петлевого-ЕМР с активностью эритропоэтина альфа. На фиг. 18 показана экспрессия и распределение в Е. coli Fc-петлевого TN8-AMP2 (6875) пептитела способом ДСН-ПААГ. Пробы необработанных клеточных лизатов (lys), нерастворимой фракции (insol) и растворимой (sol) для Fc-петлевого-AMP2 (6888) показаны в восстанавливающих гелях. На фиг. 19 показан анализ конечного очищенного пула Fc-петлевого-AMP2 (6875) способом ДСН- 13011879 ПААГ (4-20% гель). На дорожку 2 наносили 5 мкг Fc-петлевого-AMP2 пептитела, на дорожку 4-5 мкг восстановленного Fc-петлевого-AMP2 пептитела; на дорожки 1 и 3 нанесены SeeBlue и два маркера молекулярного веса. На фиг. 20 представлены результаты анализа ОФ-ВЭЖХ конечного очищенного пула Fc-петлевогоAMP2 (6875). Десять мкг очищенного пептитела наносили на колонку Vydak C4 (5 мкМ, 300 ,4,6250 мм) и элюировали линейными градиентом 40-50% АЦН при 0,5%/мин. На фиг. 21 показаны результаты биоанализа in vivo на мышах Fc-петлевого-AMP2 и AMG531 антител. Мышам однократно вводили путем подкожной инъекции 50 мкг/кг пептитела или только носитель. Методику анализа см. в примере 9. На фиг. 22 показано несколько подходов для включения 2 биоактивных пептидов в Fc-петлевое пептитело. На фиг. 23 показаны гели ДСН-ПААГ очищенных Fc-петлевых кострукций. Пробы (2 мкг/дорожка) прогоняли +/- в восстанавливающем буфере в Трис-глициновом 4-20% ДСН-ПААГ геле. На фиг. 24 показан ОФ-ВЭЖХ Fc-петлевых конструкций. Подробное описание изобретения Определение терминов Термины, использованные в данном описании, определены, как следует ниже, если не ограничено в особых случаях. При использовании в отношении аминокислотной последовательности термин содержит означает, что соединение может содержать дополнительные аминокислоты либо на N-, либо на С-конце, либо на обоих концах последовательности. Антитело или пептид(ы) антитела относятся к целому антителу, или его связывающему фрагменту, который конкурирует с целым антителом за специфическое связывание и содержит химерные,гуманизированные, полностью человеческие и биспецифические антитела. В определенных способах реализации, связывающие фрагменты получают при помощи способов рекомбинантных ДНК. В других способах реализации связывающие фрагменты получают путем энзиматического химического расщепления целых антител. Связывающие фрагменты включают, но не ограничиваются ими, Fab, Fab', F(ab')2,Fv и одноцепочечные антитела. Термин нативный Fc относится к молекуле или последовательности, включающей последовательность не являющегося антигенсвязывающим фрагмента, полученного при ферментативном гидролизе целого антитела либо в мономерной, либо мультимерной форме, в которую может быть добавлена пептидная путем вставки или замещением области петли. Первоначальный источник иммуноглобулина для нативного Fc имеет предпочтительно человеческое происхождение и может являться любым из иммуноглобулинов, однако IgG1 и IgG2 являются предпочтительными. Нативные Fc' образованы из мономерных полипептидов, которые могут соединяться с образованием димерных или мультимерных форм ковалентными (т.е. при помощи дисульфидных связей) или нековалентными связями. Число внутримолекулярных дисульфидных связей между мономерными субъединицами нативных молекул Fc варьирует от 1 до 4 в зависимости от класса (например, IgG, IgA, IgE) или подкласса (например, IgG1, IgG2, IgG3,IgA1, IgGA2). Одним из примеров нативного Fc является образованный при помощи дисульфидных связей димер, полученный при расщеплении IgG папаином (см. Ellison et al. (1982), Nucleic Acids Res. 10: 4071-9). Термин нативный Fc, как здесь используется, является общим для мономерных, димерных и мультимерных форм. Термин вариант Fc относится к молекуле или последовательности, являющейся модификацией нативного Fc, но при этом включающей сайт связывания с рецептором спасения FcRn. В международных заявках WO 97/34631 (опубликованной 25 сентября 1997) и WO 96/32478 описаны примеры вариантов Fc, а также взаимодействие с рецептором спасения и они включены здесь посредством ссылки. Таким образом, термин вариант Fc включает молекулу или последовательность, которые являются гуманизированными формами нативного Fc отличного от человека животного. Кроме того, нативный Fc содержит сайты, которые могут быть удалены, поскольку они обеспечивают структурные особенности или биологическую активность, не являющиеся необходимыми для гибридных молекул настоящего изобретения. Таким образом, термин вариант Fc включает молекулу или последовательность с недостатком одного или более нативных сайтов или остатков аминокислот Fc, которые влияют на (1) образование дисульфидных связей, (2) несовместимость с выбранными клетками-хозяевами, (3) гетерогенность по Nконцу при экспрессии в выбранных клетках-хозяевах, (4) гликозилирование, (5) взаимодействие с комплементом, (6) связывание с рецептором Fc, за исключением рецептора спасения или (7) антителозависимую клеточную цитотоксичность (АЗКЦ). Варианты Fc описаны более подробно ниже. Термин домен Fc охватывает нативные Fc и молекулы вариантов Fc и последовательности, как определено выше. При использовании в отношении и вариантов Fc и нативных Fc термин домен Fc охватывает молекулы в мономерной или мультимерной форме, либо полученные в результате ферментативной обработки целого антитела или полученные другими способами. Термин мультимерный в применении к домену Fc или молекулам, включающим домены Fc, относится к молекулам, имеющим две или более полипептидных цепи, связанные ковалентно, нековалент- 14011879 но или при помощи как ковалентных, так и нековалентных взаимодействий. Молекулы IgG обычно формируют димеры; IgM-пентамеры; IgD-димеры; a IgA-мономеры, димеры, триммеры или тетрамеры. Мультимеры могут быть сформированы при использовании последовательности и результирующей активности источника нативного Ig Fc или путем образования производных (как определено ниже) такого нативного Fc. Термин димер в приложении к доменам Fc или молекулам, которые содержат Fc домены, относится к молекулам, имеющим две полипептидные цепи, связанные ковалентным или нековалентным способом. Примеры димеров в пределах области данного изобретения представлены в Патенте США 6660843, фиг. 2, который включен здесь посредством ссылки. Термин образование производных и являющийся производным включает способы и образующиеся соединения, соответственно в которых (1) соединение имеет циклическую часть; например, поперечную сшивку между остатками цистеинила в пределах соединения; (2) соединение является поперечно сшитым или имеет сайт образования поперечных сшивок; например, соединение имеет остаток цистеина и, таким образом, формирует поперечно сшитые димеры в культуре или in vivo; (3) одна или более пептидильных связей заменещена непептидильной связью; (4) N-конец замещен на -NRR1, NRC(O)R1,-NRC(O)OR1, -NRS(O)2R1, -NHC(O)NHR, сукцинимид, или замещенный или незамещенный бензилоксикарбонил -NH-, где заместители R и R1 и кольцо являются такими, как определено далее; (5) С-конец замещен на -C(O)R2 или -NR3R4, где R2, R3 и R4 являются такими, как определено далее; и (6) соединения, в которых определенные аминокислоты модифицированы при помощи обработки реагентами, способными реагировать с некоторыми боковыми цепями или концевыми остатками. Производные подробнее описаны ниже. Термин полипептид относится к молекулам, состоящим более чем из 40 аминокислот, либо природных, либо искусственно синтезированных, при условии, что такие молекулы не являются мембраносвязанными. Примеры полипептидов включают ИЛ-1 ра, лептин, растворимые рецепторы TNF 1 и 2 типа(sTNF-R1, sTNF-R2), KGF, EPO, TPO, G-CSF, дарбепоэтин, Fab фрагменты и т.п. Термин пептид относится к молекулам, состоящим от 2 до 40 аминокислот, при этом предпочтительно молекулам из 3-20 аминокислот, наиболее предпочтительно молекулам из 6-15 аминокислот. Примеры пептидов могут быть произвольно синтезированы любым из способов, приведенных выше,введены в библиотеку пептидов (например, библиотека на основе фагового дисплея) или получены при расщеплении белков. Термин рандомизированный, использованный в отношении пептидной последовательности, относится к полностью произвольным последовательностям (например, полученным при помощи техники фагового дисплея) и последовательностям, в которых один или более природных остатков замещены аминокислотным остатком, не встречающимся в данном положении у природной молекулы. Примеры способов для идентификации пептидных последовательностей включают фаговый дисплей, Е. coli дисплей, рибосомный дисплей, скрининг в дрожжах, РНК-пептидный скрининг, химический скрининг, рациональный дизайн, структурный анализ белка, и т.п. Термин фармакологически активный означает, что для описываемого вещества показано, что оно имеет активность, влияющую на медицинские параметры (например кровяное давление, показатели крови, уровень холестерина) или болезненное состояние (например рак, аутоиммунные заболевания). Таким образом, фармакологически активные пептиды включают агонистов или миметиков, как определено ниже. Термины пептид-миметик, пептид-агонист относятся к пептиду, имеющему биологическую активность, сравнимую с белком (например, ЕРО, ТРО, G-CSF), который взаимодействует с представляющим интерес белком. Эти термины, кроме того, охватывают пептиды, которые косвенно имитируют активность интересующего белка, например, потенциируя действие природного лиганда, представляющего интерес белка; см., например, пептиды-миметики G-CSF, указанные здесь в табл. 2 и 7 патента США 6660843, включенного здесь посредством ссылки. Таким образом, термин пептид-миметик ЕРО охватывает любые пептиды, которые могут быть идентифицированы или произведены, как описано в работе Wrighton et al. (1996), Science 273: 458-63, Naranda et al. (1999), Proc. Natl. Acad. Sci. USA 96: 7569-74,или любом другом источнике, указанном в табл. 2, имеющем отношение к миметику ЕРО. Специалисты в данной области техники понимают, что каждый из данных источников позволит выбрать различные пептиды, которые там описаны, следуя описанным процедурам с различными пептидными библиотеками. Термин пептид-антагонист или пептид-ингибитор относится к пептиду, который блокирует или каким-либо образом препятствует биологической активности связанного представляющего интерес белка, или обладает биологической активностью, сравнимой с известным антагонистом или ингибитором связанного интересующего белка. Таким образом, термин пептид-антагонист TNF включает пептиды,которые могут быть идентифицированы или получены, как описано в работе et al. (1997), Nature Biotech. 15: 1266-70 или в любом из источников, указанном в табл. 2, имеющем отношение к антагонисту TNF. Специалисты в данной области техники понимают, что каждый из данных источников позволит выбрать различные пептиды, которые там описаны, следуя описанным процедурам с различными пептидными библиотеками. Термин пептид-миметик ТРО охватывает пептиды, которые могут быть идентифицированы или- 15011879 получены, как описано в работе Cwirla et al. (1997), Science 276: 1696-9 патентах США 5869451 и 5932946; заявке на патент США 2003/0176352, опубликованной 18 сентября 2003; международной публикации WO 03/031589, опубликованной 17 апреля 2003 и в любом другом источнике из Таблицы 2,имеющем отношение к миметику ТРО, а также WO 00/24770, опубликованной 4 мая 2000, которые включены здесь посредством ссылок. Специалисты в данной области техники понимают, что каждый из данных источников позволит выбрать различные пептиды, которые там описаны, следуя описанным процедурам с различными пептидными библиотеками. Термин ang-2-связывающий пептид охватывает пептиды, которые могут быть идентифицированы или получены, как описано в заявке на патент США 2003/0229023, опубликованной 11 декабря 2003;WO 03/057134, опубликованной 7/17/03; США 2003/0236193, опубликованной 25 декабря 2003; и любом другом источнике в табл. 2, имеющем отношение к ang-2. Специалисты в данной области техники понимают, что каждый из данных источников позволит выбрать различные пептиды, которые там описаны,следуя описанным процедурам с различными пептидными библиотеками. Термин NGF-связывающий пептид охватывает пептиды, которые могут быть идентифицированы или получены, как описано в WO 04/026329, опубликованной 1 апреля 2004 и любом другом источнике в табл. 2, имеющем отношение к NGF. Специалисты в данной области техники понимают, что каждый из данных источников позволит выбрать различные пептиды, которые там описаны, следуя описанным процедурам с различными пептидными библиотеками. Термин миостатинсвязывающий пептид охватывает пептиды, которые могут быть идентифицированы или получены, как описано в патенте США 10/742379, поданном 19 декабря 2003 и в любом другом источнике в табл. 2, имеющем отношение к миостатину. Специалисты в данной области техники понимают, что каждый из данных источников позволит выбрать различные пептиды, которые там описаны, следуя описанным процедурам с различными пептидными библиотеками. Кроме того, настоящее изобретение охватывает физиологически приемлемые соли соединений согласно настоящему изобретению. Под физиологически приемлемыми солями понимают любые соли,для которых известно или позднее было показано, что они являются фармацевтически приемлемыми. Некоторыми отдельными примерами являются: ацетат; трифторацетат; гидрогалогениды, такие как гидрохлорид и гидробромид; сульфат; цитрат; тартрат; гликолат; и оксалат. Структура соединений Общая часть В соединениях, полученных в соответствии с настоящим изобретением, пептид может быть присоединен к носителю через N-конец или С-конец пептида. Таким образом, молекулы-наполнителя согласно настоящему изобретению могут быть описаны следующей формулой I: где F1 представляет собой домен Fc модифицированный, таким образом, что он содержит по меньшей мере один X3 в области петли; каждый X1 и X2 независимо выбран из -(L1)c-P1, -(L1)c-P1-(L2)d-Р 2, -(L1)c-P1-(L2)d-Р 2-(L3)е-P3 и -(L1)c1 2(L )e-P7-(L8)f-P8; каждый из Р 1, Р 2, Р 3 и Р 4 независимо представляет собой последовательность фармакологически активного полипептида или фармакологически активного пептида; каждый из Р 5, Р 6, Р 7 и Р 8 независимо представляет собой последовательность фармакологически активного пептида; каждый из L1, L2, L3, L4, L5, L6, L7 и L8 независимо представляет собой линкер; и каждый а, b, с, d, е,и f независимо равен 0 или 1. В предпочтительных способах реализации а и b оба равны нулю, то есть X1 и X2 группы отсутствуют с N-конца или С-конца Fc домена. Специалисты в данной области техники понимают, что в домене Fc может присутствовать более одного заместителя X3, и что множественные заместители X3 могут быть различными; например, содержать различные пептиды Р 5, различные линкеры, присоединенные к одной и той же пептидной последовательности и т.д. Также X1 и X2 могут быть одинаковыми или различными и целые с-f могут различаться для X1, X2 и X3. Таким образом, соединения I включают соединения формул и их мультимеры, где F1 присоединен к С-концу X1; и их мультимеры, где F2 присоединен к N-концу Х 2- 16011879 и их мультимеры, где F1 присоединен к N-концу -(L1)c-Р 1; и и их мультимеры, где F1 присоединен к N-концу -L1-Р 1-L2-Р 2. Пептиды Любое количество пептидов может быть использовано в отношении настоящего изобретения. Предпочтительные пептиды связываются с ангиопротеином-2 (ang-2), миостатином, фактором роста нервов (ФРН, nerve growth factor, NGF), фактором некроза опухолей (ФНО, tumor necrosis factor, TNF),фактором, активирующим В-клетки (В cell activating factor, BAFF, также называемым TALL-1) или имитируют активность ЕРО, ТРО или G-CSF. Также представляют интерес целевые пептиды, включая пептиды, характерные для опухолей, транспортируемые через мембрану пептиды и т.п. Все эти классы пептидов могут быть обнаружены при помощи способов, описанных в источниках, цитируемых в данном описании или других источниках. В частности, техника фагового дисплея применима для получения для применения согласно настоящему изобретению. Установлено, что основанную на аффинности селекцию библиотек произвольных пептидов можно применять для идентификации пептидных лигандов для любого сайта продукта любого гена. Dedman et al. (1993), J. Biol. Chem. 268: 23025-30. Фаговый дисплей особенно хорошо подходит для идентификации пептидов, которые связываются с такими представляющими интерес белками,как рецепторы клеточной поверхности или любыми белками, имеющими линейные эпитопы. Wilson et al.(1998), Can. J. Microbiol. 44: 313-29; Kay et al. (1998), Drug Disc. Today 3: 370-8. Широкий обзор такого рода белков представлен в работе Herz et al. (1997), J. ReceptorSignal Transduction Res. 17(5): 671-776,включенной здесь посредством ссылки. Такие представляющие интерес белки являются предпочтительными для применения в данном изобретении. Особенно предпочтительную группу пептидов представляют белки, которые связываются с рецепторами цитокинов. Цитокины недавно были классифицированы согласно их рецепторному коду. См. работу Inglot (1997), Archivum Immunologiae et Therapiae Experimentalis 45: 353-7, включенную здесь посредством ссылки. Среди этих рецепторов, наиболее предпочтительными являются рецепторы цитокиновCKR (семейство I в табл. 3). Классификация рецепторов представлена в табл. 3. Таблица 3. Классификация рецепторов цитокинов согласно рецепторному коду ИЛ-17 Р - принадлежит к семейству CKR, но не отнесен ни к одному из 4 указанных подсемейств. Другие подтипы ИФН I типа не установлены.- 17011879 Гематопоэтические цитокины, лиганды ИЛ-10 и интерфероны не имеют функциональных внутренних протеинкиназ. Сигнальными молекулами для цитокинов являются JAK-киназы, STAT и схожие нерецепторные молекулы. ИЛ-14, ИЛ-16 и ИЛ-18 были клонированы, но не классифицированы согласно рецепторному коду. 3 Рецепторы TNF (ФНО) используют множество различных внутриклеточных молекул для передачи сигнала, включая домен смерти ("death domain") FAS P и 55 кДа TNF-P, которые вносят вклад в их цитотоксический эффект. NGF/TNF Р может связываться как с NGF и схожими факторами, а также с лигандами as TNF. Для рецепторов хемокинов характерен трансмембранный домен, семь раз пронизывающий мемьрану (7 ТМ, змеевидный). Они сопряжены с G-белками. Отдельные белки, представляющие интерес в качестве мишеней, для создания пептидов согласно настоящему изобретению включают следующие: Примеры пептидов согласно настоящему изобретению представлены в табл. 4-20 патента США 6660843, который представлен здесь посредством ссылки. Дополнительные предпочтительные пептиды представлены в заявк на патент США 2003/0229023, опубликованной 11 декабря 2003; WO 03/057134,опубликованной 17 июля 2003; заявке на патент США 2003/0236193, опубликованной 25 декабря 2003;WO 00/24770, опубликованной 4 мая 2000; заявке на патент США 2003/0176352, опубликованной 18 сентября 2003; WO 03/031589, опубликованной 17 апреля, 2003; заявке на патент США 10/666480, поданной- 18011879 18 сентября 2003; WO 04/026329, опубликованной 1 апреля 2004; заявке на патент США 10/742379, поданной 19 декабря 2003; заявке PCT/US03/40781, поданной 19 декабря 2003, которые включены здесь посредством ссылок. Такие пептиды могут быть получены способами, раскрытыми в области техники. Особенно предпочтительные пептиды представлены в таблицах ниже. Используются однобуквенные аминокислотные обозначения. Любой из этих пептидов может быть соединен тандемно (т.е. последовательно) с линкером или без него. Любой пептид, содержащий остаток цистеинила может быть поперечно сшит с другим Cys-содержащим пептидом или белком. Любой пептид, имеющий более одного остатка Cys, может также образовывать внутрипептидные дисульфидные связи. Для любого из этих пептидов могут быть получены производные, как описано выше. Все пептиды связаны пептидными связями,если не указано иначе. Таблица 4. Последовательности пептидов-миметиков ЕРО Домены Fc Данное изобретение требует присутствия по меньшей мере одного домена Fc, модифицированного посредством включения последовательности пептида. Как упомянуто выше, и нативные Fc, и варианты Fc являются подходящими доменами Fc для применения в области данного изобретения. Нативный Fc может быть в значительной степени модифицирован с образованием варианта Fc согласно настоящему изобретению, при условии, что связывание с рецептором спасения сохранено; см., например, WO 97/34631 и WO 96/32478. В таких вариантах Fc можно удалить один или более сайтов нативного Fc, которые обеспечивают структурные характеристики или функциональную активность, не являющиеся необходимыми для гибридных молекул согласно настоящему изобретению. Эти сайты могут быть удалены, например, замещением или удалением остатков,включением остатков в сайт, или усечением областей, содержащих сайт. Включенный или замещенный остаток может также являться измененными аминокислотами, например пептидометиками или Dаминокислотами. Варианты Fc могут потребоваться во многих случаях, некоторые из которых описаны ниже. Примеры вариантов Fc включают молекулы и последовательности, в которых: 1. Сайты, вовлеченные в формирование дисульфидных связей, удалены. Такое удаление может позволить избежать реакции с другим цистеинсодержащим белками, присутствующими в клетке-хозяине,применяемой для получения молекул по изобретению. Для этого можно отрезать цистеинсодержащий фрагмент на N-конце или можно удалить остатки цистеина или заменить их на другие аминокислоты(например, аланил, серил). В частности, можно удалить N-концевой фрагмент, состоящий из 20 аминокислот последовательности SEQ ID NO: 599 или удалить или заменить остатки цистеина в положении 7 и 10 последовательности SEQ ID NO: 599 Даже если удалены остатки цистеина, одноцепочечные доменыFc тем не менее могут формировать димеры доменов Fc, которые удерживаются вместе за счет нековалентных взаимодействий. 2. Нативный Fc модифицируют, чтобы сделать его более совместимым с выбранной клеткойхозяином. Например, можно удалить последовательность ПА около N-конца типичного нативного Fc,которая может узнаваться гидролитическим ферментом в Е. coli, таким как пролиниминопептидаза. Также можно добавить N-концевой остаток метионина, особенно если молекула экспрессируется в виде рекомбинантного белка в бактериальной клетке, такой как Е. coli. Одним из таких вариантов Fc представляет собой домен Fc последовательности SEQ ID NO: 599 (фиг. 2 А). 3. Часть N-конца нативного Fc удаляют для предотвращения гетерогенности по N-концам при экспрессии в выбранных клетках-хозяинах. Для этого можно удалить любой из первых 20 аминокислотных остатков с N-конца, особенно находящихся в положениях 1, 2, 3, 4 и 5. 4. Один или более сайтов гликозилирования удалены. Остатки, которые обычно гликозилируются(например, аспарагин), могут вызвать цитолитический ответ. Такие остатки могут быть удалены или заменены негликозилируемыми остатками (например, аланином). 5. Удаляют сайты, вовлеченные во взаимодействие с комплементом, такие как C1q-связывающий сайт. Например, можно удалить или заменить последовательность EKK IgG1 человека. Рекрутирование комплемента может не быть полезным для молекул согласно настоящему изобретению, и его можно избежать при применении такого рода вариантов Fc. 6. Удаляют сайты, влияющие на связывание с рецептором Fc, но не с рецептором спасения. На- 30
МПК / Метки
МПК: C12N 1/21, C12N 15/70, C07K 16/00, C07K 19/00, A61K 47/48, C12N 15/62, C07K 14/52, C07K 14/475, C07K 14/505, C07K 14/515
Метки: молекулы, фрагментом, модифицированным
Код ссылки
<a href="https://eas.patents.su/30-11879-molekuly-s-modificirovannym-fs-fragmentom.html" rel="bookmark" title="База патентов Евразийского Союза">Молекулы с модифицированным fс фрагментом</a>
Предыдущий патент: Респираторно-синцитиальный вирус с перекрёстно компенсированным геномным дефицитом
Следующий патент: Рекомбинантный вирус, содержащий ген теломелизина-gfp
Случайный патент: Конструкция для монтажа на стене здания каркасов, предназначенных для крепления панелей, таких как фотоэлектрические панели