Связывающиеся с tall-1 молекулы и их применение
Формула / Реферат
1. Связывающаяся с TALL-1 молекула, содержащая аминокислотную последовательность формулы
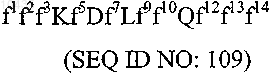
где f1, f2 и f3 отсутствуют или обозначают любые аминокислотные остатки;
f5 обозначает W;
f7 обозначает любой аминокислотный остаток;
f9 обозначает T или I;
f10 обозначает K, R или Н;
f12 обозначает C, нейтральный гидрофобный остаток или основной остаток;
f13 обозначает C, нейтральный гидрофобный остаток или отсутствует и
f14 обозначает любой аминокислотный остаток или отсутствует; при условии, что только один из f1, f2 или f3 может обозначать C и только один из f12, f13 и f14 может обозначать C.
2. Молекула по п.1, отличающаяся тем, что f12 обозначает W, C или R.
3. Молекула по п.1, отличающаяся тем, что f7 обозначает L.
4. Молекула по п.1, отличающаяся тем, что f9 обозначает T.
5. Молекула по п.1, отличающаяся тем, что f10 обозначает K.
6. Молекула по п.1, отличающаяся тем, что f12 обозначает C, а один из f1, f2 и f3 обозначает C.
7. Молекула по п.1, отличающаяся тем, что f13 обозначает V.
8. Молекула по п.1, содержащая аминокислотную последовательность формулы
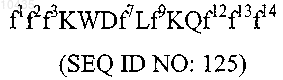
9. Молекула по п.8, содержащая аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 32, 33, 58, 60, 63, 66, 67, 69, 114, 115, 122, 123, 124, 147-150, 152-177, 179, 180 и 187.
10. Связывающаяся с TALL-1 молекула, содержащая аминокислотную последовательность формулы LPGCKWDLLIKQWVCDPL (SEQ ID NO: 33).
11. Молекула, связывающаяся с TALL-1, имеющая формулу
![]()
и его мультимеры,
где V1 обозначает носитель;
X1 и X2, каждый независимо, выбирают из
-(L1)c-P1,
-(L1)c-P1-(L2)d-P2,
-(Ll)c-Pl-(L2)d-P2-(L3)e-P3 и
-(L1)c-P1-(L2)d-P2-(L3)e-P3-(L4)f-P4
один или более из Р1, Р2, Р3 и Р4, каждый независимо, представляют собой SEQ ID NO: 109;
L1, L2, L3 и L4, каждый независимо, обозначают линкеры и
а, b, с, d, e и f, каждый независимо, обозначают 0 или 1, при условии, что по меньшей мере один из а и b обозначает 1.
12. Молекула по п.11, имеющая формулу
![]()
13. Молекула по п.11, имеющая формулу
![]()
14. Молекула по п.11, отличающаяся тем, что V1 обозначает Fc домен.
15. Молекула по п.11, отличающаяся тем, что V1 обозначает IgG Fc домен.
16. Молекула по п.11, отличающаяся тем, что V1 обозначает IgGl Fc домен.
17. Молекула по п.11, отличающаяся тем, что V1 представляет собой последовательность SEQ ID NO: 2.
18. Молекула по п.11, отличающаяся тем, что f5 обозначает W; f7 обозначает L; f10 обозначает K и f13 обозначает V.
19. Молекула по п.11, отличающаяся тем, что L2 имеет более 5 аминокислот.
20. Молекула по п.19, отличающаяся тем, что L2 выбирают из GSGSATGGSGSTASSGSGSATx1x2 (SEQ ID NO: 193) и GSGSATGGSGSTASSGSGSATx1x2GSGSATGGSGSTASSGSGSATx3x4 (SEQ ID NO: 194), где х1 и х3, каждый независимо, обозначают основные или гидрофобные остатки, а х2 и х4, каждый независимо, обозначают гидрофобные остатки.
21. Молекула по п.11, отличающаяся тем, что L2 выбирают из GSGSATGGSGSTASSGSGSATH (SEQ ID NO: 59).
22. Молекула по п.11, отличающаяся тем, что L2 выбирают из GSGSATGGSGSTASSGSGSATGM (SEQ ID NO: 190).
23. Молекула по п.11, отличающаяся тем, что L2 выбирают из GSGSATGGSGSTASSGSGSATGS (SEQ ID NO: 191).
24. Молекула по п.11, отличающаяся тем, что L2 выбирают из GSGSATGGSGSTASSGSGSATHMGSGSATGGSGSTASSGSGSATHM (SEQ ID NO: 192).
25. Молекула по п.11, содержащая последовательность, выбранную из группы, включающей SEQ ID NOS: 32, 33, 58, 60, 63, 66, 67, 69, 114, 115, 122, 123, 124, 147-150, 152-177, 179, 180 и 187.
26. Связывающаяся с TALL-1 молекула, имеющая аминокислотную последовательность

27. Связывающаяся с TALL-1 молекула, имеющая аминокислотную последовательность

28. Связывающаяся с TALL-1 молекула, имеющая аминокислотную последовательность

29. ДНК, кодирующая молекулу по одному из пп.1-28.
30. Вектор экспрессии, содержащий ДНК по п.29.
31. Клетка-хозяин, содержащая вектор экспрессии по п.33.
32. Клетка по п.34, отличающаяся тем, что эта клетка является клеткой Е.coli.
33. Применение молекулы по одному из пп.1 или 11 для приготовления фармацевтической композиции для лечения аутоиммунного заболевания, опосредуемого В-клетками.
34. Применение молекулы по одному из пп.26-28 для приготовления фармацевтической композиции для лечения аутоиммунного заболевания, опосредуемого В-клетками.
35. Применение молекулы по одному из пп.1 или 11 для приготовления фармацевтической композиции для лечения волчанки.
36. Применение молекулы по одному из пп.26-28 для приготовления фармацевтической композиции для лечения волчанки.
37. Применение молекулы по одному из пп.1 или 11 для приготовления фармацевтической композиции для лечения рака, опосредуемого В-клетками.
38. Применение молекулы по одному из пп.26-28 для приготовления фармацевтической композиции для лечения рака, опосредуемого В-клетками.
39. Применение молекулы по одному из пп.1 или 11 для приготовления фармацевтической композиции для лечения В-клеточной лимфомы.
40. Применение молекулы по одному из пп.26-28 для приготовления фармацевтической композиции для лечения В-клеточной лимфомы.
Текст
010435 Предпосылки создания изобретения После многих лет изучения некроза опухолей в 1984 году были, наконец, клонированы факторы некроза опухолевых клеток (TNF)и . Последующие годы явились свидетелями появления суперсемейства цитокинов TNF, включая лиганд fas (FasL), лиганд CD27 (CD27L), лиганд CD30 (CD30L), лиганд CD40 (CD40L), вызывающий апоптоз лиганд, родственный TNF, (TRAIL, также обозначаемыйMed. 188: 1185-90; Shu et al. (1999), J. Leukocyte Biology 65: 680-3. Объединение в это семейство определяется структурой, в частности, на C-конце. Кроме того, многие известные на данный момент члены этого семейства экспрессируют в иммунных компартментах, хотя некоторые также экспрессируют в других тканях и органах. Smith et al. (1994), Cell 76: 959-62. Все лиганды, члены этого семейства, за исключением LT-, относятся к типу II трансмембранных белков, характеризующихся консервативной областью из 150 аминокислот в C-концевом внеклеточном домене. Даже при ограничении до степени идентичности 20-25%, консервативная область из 150 аминокислот скручивается в характеристический -складчатый сэндвич и тримеризуется. Эту консервативную область можно высвободить протеолитически, тем самым получить растворимую функциональную форму. Banner et al. (1993), Cell 73: 431-445. Многие члены этого семейства лигандов экспрессируют в лимфоидных тканях и играют важную роль в развитии и модуляции иммунной системы. Smith et al. (1994). Например, TNF синтезируется,главным образом, макрофагами и является важным медиатором воспалительных реакций и иммунной защиты. TraceyCerami (1994), Ann. Rev. Med. 45: 491-503. Fas-L, экспрессирующий преимущественно в активированной T-клетке, модулирует апоптоз тимоцитов, опосредуемый TCR. Nagata, S.Suda, T.(1995), Immunology Today 16: 39-43; Castrim et al. (1996), Immunity 5: 617-27. CD40L, также экспрессируемый активированными T-клетками, дат основной сигнал B-клеточному выживанию, пролиферации и переключению изотипа иммуноглобулинов. Noelle (1996), Immunity 4: 415-9. Были идентифицированы родственные рецепторы для большинства членов семейства лигандовTNF. Эти рецепторы имеют общие характеристические множественные богатые цистеином повторы внутри внеклеточных доменов и не содержат каталитических мотивов внутри цитоплазматических участков. Smith et al. (1994). Рецепторный сигнал вследствие непосредственного взаимодействия с белками"домена гибели" (например, TRADD, FADD и RIP) или с белками TRAF (например, TRAF2, TRAF3,TRAF5 и TRAF6), запускающими механизм дивергентных (расходящихся) и перекрывающихся путей передачи сигнала например, апоптоза, активации NF-B или активации JXK. Wallach et al. (1999), AnnualReview of Immunology 17: 331-67. Эти события передачи сигнала приводят к гибели, пролиферации, активации или дифференциации клеток. Профиль экспрессии каждого члена семейства рецепторов меняется. Например, TNFR1 экспрессирует в широком спектре тканей и клеток, тогда как рецептор клеточной поверхности OPGL ограничивается, главным образом, остеокластами. Hsu et al. (1999) Proc. Natl. Acad.Sci. USA 96: 3540-5. Недавно ряд исследовательских групп идентифицировали лиганды семейства TNF с той же самой или практически аналогичной последовательностью. Лиганд называют по-разному: нейтрокин(Международная заявка WO 98/18921, опубликованная 7 мая 1998 г.), 63954 (Международная заявкаWO 98/27114, опубликованная 25 июня 1998 г.), TL5 (Европейский патент ЕР 869180, опубликованный 7 октября 1998 г.), NTN-2 (Международные заявки WO 98/55620 и WO 98/55621, опубликованные 10 декабря 1998 г.), TNRL1- (Международная заявка WO 9911791, опубликованная 11 марта 1999 г.),лиганд kay (Международная заявка WO 99/12964, опубликованная 18 марта 1999 г.) и AgP-3 (Предварительные заявки США 60/119906, поданная 12 февраля 1999 г., и 60/166271, поданная 18 ноября 1999 г., соответственно) и TALL-1 (Международная заявка WO 00/68378, опубликованная 16 ноября 2000 г.). Каждый из этих документов вводится в данное описание в качестве ссылки. Далее в данном описании эти лиганды описываются под общим названием TALL-1.TALL-1 является членом суперсемейства лигандов TNF, которые функционально включены в выживание и пролиферацию B-клеток. У трансгенных мышей со сверхэкспрессией TALL-1 наблюдается тяжлая B-клеточная гиперплазия и аутоиммунное заболевание, похожее на волчанку. Khare et al. (2000)PNAS 97(7):3370-3375. Как TACI, так и BCMA служат в качестве поверхностных клеточных рецепторов для TALL-1. Gross et al. (2000), Nature 404: 995-999; Ware (2000), J. Exp. Med. 192(11): F35-F37; WareBiol. 65:680-683; Grass et al. (1995) Blood 85(12): 3378-3404; Smith et al. (1994), Cell 76: 959-962; Патент США 5969102, выданный 19 октября 1999 г.; Международная заявка WO 00/67034, опубликованная 9 ноября 2000 г.; WO 00/40716, опубликованная 13 июля 2000 г.; WO 99/35170, опубликованная 15 июля 1999 г. Оба рецептора экспрессируют на B-клетках и передают сигнал путм взаимодействия с-1 010435 белками TRAF. Кроме этого, как TACI, так и BCMA связываются также с другим членом семейства TNFлигандов, APRIL. Yu et al. (2000), Nature Immunology 1(3):252-256. Было также показано, что APRIL индуцирует пролиферацию B-клеток. До настоящего времени не описано никаких рекомбинантных или модифицированных белков, использующих пептидные модуляторы TALL-1. Рекомбинантные и модифицированные белки представляют собой новый класс терапевтических агентов. Подходящие модификации белковых терапевтических агентов включают комбинацию с "Fc" доменом антитела и связь с полимерами, такими как полиэтиленгликолем (PEG, ПЭГ) и декстран. Такие модификации подробно обсуждаются в опубликованной патентной заявке, озаглавленной "Модифицированные пептиды в качестве терапевтических агентов",WO 00/24782, которая во всей полноте вводится в данное описание в качестве ссылки. Совсем другой поход к созданию терапевтических агентов представляет собой скрининг пептидных библиотек. Взаимодействие белкового лиганда с его рецептором часто происходит на сравнительно большой поверхности контакта. Однако, как показано для человеческого гормона роста и его рецептора,только немногие ключевые остатки на поверхности контакта (интерфейс) вносят вклад в основную часть энергии связывания. Clackson et al. (1995), Science 267: 383-6. Основная масса белкового лиганда просто замещает связывающие эпитопы при правильной топологии или выполняет функции, не относящиеся к связыванию. Таким образом, молекулы только "пептидной" длины (2-40 аминокислот) могут связываться с рецепторным белком данного большого белкового лиганда. Такие пептиды могут имитировать биоактивность большого белкового лиганда ("пептидные агонисты") или за счт конкурентного связывания ингибировать биоактивность большого белкового лиганда ("пептидные антагонисты"). Фаговая библиотека визуализации пептидов возникла как мощный метод идентификации таких пептидных агонистов и антагонистов. См., например, Scott et al. (1990), Science 249: 386; Devlin et al.(1990), Science, 249: 404; патент США 5223409, выданный 29 июня 1993 г.; патент США 5733731, выданный 31 марта 1998 г.; патент США 5498530, выданный 12 марта 1996 г.; патент США 5432018, выданный 11 июля 1995 г.; патент США 5338665, выданный 16 августа 1994 г.; патент США 5922545, выданный 13 июля 1999 г.; Международная заявка WO 96/40987, опубликованная 19 декабря 1996 г. и Международная заявка WO 98/15833, опубликованная 16 апреля 1998 г. (каждый из документов вводится ссылкой во всей полноте). В таких библиотеках случайные пептидные последовательности выявляются путм слияния с оболочечными белками филаментозного фага. Как правило, элюция выявляемых пептидов происходит в соответствии с аффинностью в отношении иммобилизованного целевого белка. Удержанные фаги можно обогащать путм последовательных циклов аффинной очистки и повторного размножения (распространения). Лучшие связывающие пептиды можно секвенировать для идентификации главных остатков в одном или более родственных по структуре семейств пептидов. См., например, Cwirla etal. (1997) Science 276: 1696-9, в этой работе идентифицированы два различных семейства. Пептидные последовательности могут также подсказать, какие остатки можно безопасно заменить путм сканирования аланина (alanine scanning, AS) или используя мутагенез на уровне ДНК. Можно создать "библиотеки мутагенеза" и подвергнуть их скринингу с целью дальнейшей оптимизации последовательности лучших агентов для связывания. Lowman (1997), Ann. Rev. Biophys. Biomol. Struct. 26: 401-24. Для выявления пептидов, которые имитируют связывающую активность больших белковых лигандов, можно также использовать структурный анализ белок-белкового взаимодействия. При таком анализе кристаллическая структура может подсказать идентичность или относительную ориентацию важных остатков большого белкового лиганда, из которого можно взять пептид. См., например, Takasaki et al.(1997), Nature Biotech. 15: 1266-70. Эти аналитические методы можно также применять для исследования взаимодействия между рецепторным белком и пептидами, выбираемыми методом фагового дисплея, который может подсказать дальнейшую модификацию пептидов для увеличения аффинности связывания. При исследовании пептидов с методом фагового дисплея конкурируют другие методы. Пептидную библиотеку можно сливать по карбоксильному концу с репрессором lac и экспрессировать в Е.coli. Другой метод на основе E.coli делает возможным дисплей (визуализацию) на внешней клеточной мембране путм слияния с пептидогликан-ассоциированным липопротеином (PAL). Далее в данном описании эти и родственные методы имеют общее название "E.coli дисплей". В другом методе трансляцию произвольной РНК прекращают перед высвобождением рибосомы, что приводит к библиотеке полипептидов с вс ещ присоединнной соответствующей РНК. Далее в данном описании этот и другие родственные методы в целом называют "рибосомный дисплей" (визуализация, выявление). Другие методы используют пептиды, связанные с РНК; например, технологию PROfusion, Phylos, Inc. См., например, RobertsSzostak (1997), Proc. Natl. Acad. Sci. USA, 94: 12297-303. Далее в данном описании этот метод и родственные методы описываются под общим названием "РНК-пептидный скрининг". Химическим путм были созданы пептидные библиотеки, в которых пептиды иммобилизованы на стабильных, небиологических материалах, таких как полиэтиленовые стержни или проницаемые для растворителя полимеры. Другая созданная химическим путм пептидная библиотека использует фотолитографию для сканирования пептидов, иммобилизованных на стеклянных пластинах (предметных стклах). Далее в данном описании эти и родственные методы указываются под общим названием "химико-пептидный скрининг". Химико-пептидный скрининг может иметь преимущество, так как он позволяет использоватьD-аминокислоты и другие неприродные аналоги, а также непептидные элементы. Обзор как биологических, так и химических методов см. WellsLowman (1992), Curr. Opin. Biotechnol. 3: 355-62. Можно обнаружить пептиды - миметики любого белка, используя методы фагового дисплея, РНК-пептидный скрининг и другие вышеупомянутые методы. Сущность изобретения Настоящее изобретение относится к терапевтическим агентам, которые модулируют активностьTALL-1. Согласно данному изобретению модуляторы TALL-1 могут содержать аминокислотную последовательность формулы где f1, f2 и f3 отсутствуют или обозначают любые аминокислотные остатки;f7 обозначает любой аминокислотный остаток;f12 обозначает C, нейтральный гидрофобный остаток или основной остаток;f13 обозначает C, нейтральный гидрофобный остаток или отсутствует иf14 обозначает любой аминокислотный остаток или отсутствует; при условии, что только один из f1, f2 или f3 может обозначать C и только один из f12, f13 и f14 может обозначать C. Предпочтительно, чтобыf13 обозначал V. Одним из вариантов данной молекулы является молекула, содержащая аминокислотную последовательность формулы Другим вариантом изобретения является связывающаяся с TALL-1 молекула, содержащая аминокислотную последовательность формулы Еще одним вариантом является молекула, связывающаяся с TALL-1, имеющая формулу и его мультимеры,где V1 обозначает носитель;-(L1)c-P1-(L2)d-P2-(L3)e-P3-(L4)f-P4 и один или более из Р 1, Р 2, Р 3 и Р 4, каждый независимо, представляют собой SEQ ID NO: 109;a, b, с, d, е и f, каждый независимо, обозначают 0 или 1, при условии, что по меньшей мере один из а и b обозначает 1. Другими вариантами молекул по изобретению являются связывающаяся с TALL-1 молекула,имеющая аминокислотную последовательность Далее в соответствии с настоящим изобретением модуляторы TALL-1 содержат: а) домен, модулирующий TALL-1 (например, аминокислотную последовательность, отвечающую формулам I(а)-I(i, предпочтительно аминокислотную последовательность Dz2Lz4, или последовательности, образованные из не методом фагового дисплея, РНК-пептидным скринингом или другим, описанным выше методом; и б) "носитель", такой как полимер (например, ПЭГ или декстран) или домен Fc, который является предпочтительным; при этом "носитель" ковалентно связан с доменом, модулирующим TALL-1. Вектор и TALL-1 - модулирующий домен могут быть связаны по N или по C-концу TALL-1 - модулирующего домена, как описано ниже. Предпочтительным "носителем" является домен Fc, а предпочтительным Fc-доменом является Fc домен IgG. Такие Fc-связанные пептиды называются в данном описании "peptibodies" ("пептитела"). Предпочтительные TALL-1 - модулирующие домены содержат аминокислотные последовательности, представленные в данном описании в табл. 1 и 2. Другие TALL-1 - модулирующие домены могут быть получены методом фагового дисплея, РНК-пептидным скринингом и другими указанными в данном описании методами. Далее, настоящее изобретение охватывает способ получения TALL-1-модуляторов, который включает в себя: а) отбор по меньшей мере одного пептида, который связывается с TALL-1; и б) ковалентное связывание указанного пептида с "носителем". Предпочтительным "носителем" является домен Fc. Стадию (а) предпочтительно проводят отбором из пептидных последовательностей, приведнных в табл. 2 или методом фагового дисплея, РНК-пептидным скринингом или другими методами, указанными в данном описании. Соединения по данному изобретению можно получать стандартными синтетическими методами,методами рекомбинантной ДНК или любыми другими методами получения пептидов и слитых белков. Соединения по данному изобретению, которые охватывают непептидные участки, помимо стандартных реакций пептидной химии можно синтезировать обычными реакциями органической химии, когда они применимы. Основным рассматриваемым применением соединений по данному изобретению является применение в качестве терапевтических или профилактических агентов. Пептид, связанный с "носителем",может обладать активностью, сравнимой с активностью - или даже превышающей активность - природного лиганда, которому подражает пептид. Соединения по данному изобретению можно применять для терапевтических или профилактических целей, готовя их в виде препаратов с соответствующими фармацевтическими носителями и вводя эффективное количество больному, например человеку (или другому млекопитающему), нуждающемуся в таком лечении. Другие родственные аспекты также включены в данное изобретение. Многочисленные дополнительные аспекты и преимущества настоящего изобретения станут очевидными после ознакомления с фигурами и подробным описанием изобретения. Краткое описание фигур На фиг. 1 дан пример димеров Fc, которые могут быть получены на основе антитела IgG1, где "Fc" представляет собой любой из вариантов Fc из определения "Fc домен" по данному описанию; "X1" и "X2" обозначают пептиды или линкер-пептидные комбинации по определению в данном описании. Конкретными димерами являются следующие:A, D: Димеры с одним дисульфидным мостиком. IgG1 - антитела, как правило, содержат две дисульфидных связи в шарнирной области антитела. Домен Fc на фиг. 1 А и 1D может образоваться путм усечения между двумя сайтами с дисульфидными связями или заменой цистеинильного остатка нереакционноспособным остатком (например, аланилом). На фиг. 1 А домен Fc связан по аминоконцу пептидов; на фиг. 1D - по карбоксильному концу;B, E: Димеры с двумя дисульфидными мостиками. Такой Fc домен может быть образован усечением исходного антитела таким образом, чтобы сохранить оба цистеинильных остатка в цепях Fc домена,или экспрессией при использовании конструкции, включающей последовательность, кодирующую такойFc домен. На фиг. 1B Fc домен связан по аминоконцу пептидов; на фиг. 1E - по карбоксильному концу;C, F: Нековалентносвязанные димеры. Такой Fc домен может образовываться при элиминировании цистеинильных остатков либо путм усечения, либо путм замены. Может потребоваться элиминировать цистеинильные остатки, чтобы избежать примесей, образующихся при реакции цистеинильного остатка с цистеинильным остатком других белков, присутствующих в клетке-хозяине. Нековалентное связывание Fc доменов достаточно для того, чтобы удержать димер вместе. Другие димеры могут образовываться при использовании Fc доменов из других типов антител (например, IgG2, IgM). На фиг. 2 показана структура предпочтительных соединений по данному изобретению, которая отличается тандемной дупликацией фармакологически активных пептидов. На фиг. 2 А показана одноцепочечная молекула, также эта фигура может представлять собой ДНК-конструкцию этой молекулы. На фиг. 2 В показан димер, в котором линкер-пептидный участок присутствует только в одной цепи димера. На фиг. 2C показан димер, содержащий линкер-пептидный участок в обеих цепях. Димер, показанный на фиг. 2C, образуется спонтанно в некоторых клетках-хозяевах при экспрессии конструкции ДНК,кодирующей одну цепь, показанную на фиг. 3 А. В других клетках-хозяевах клетки можно помещать в условия, благоприятствующие образованию димеров, или димеры можно получать in vitro. На фиг. 3 дан пример нуклеиновой кислоты и аминокислотных последовательностей(SEQ ID NO: 1 и 2 соответственно) Fc человеческого IgG1, которые можно использовать в данном изобретении. На фиг. 4 А-4F показаны нуклеотидные и аминокислотные последовательности (SEQ ID NO: 3-27) S от NdeI до SalI фрагментов, кодирующих пептид и линкер. На фиг. 5A-5M показана нуклеотидная последовательность (SEQ ID NO: 28) вектора pAMG21RANK-Fc, который используется для конструкции Fc-связанных молекул по данному изобретению. Эти фигуры определяют ряд признаков (особенностей) нуклеиновой кислоты, включая: промоторные участки PcopB, PrepA, RNAI, APHII, luxPR и luxPL; мРНК для APHII, luxR; кодирующие последовательности и аминокислотные последовательности белков copB белка, copT,repAI, repA4, APHII, luxR, RANK и Fc; сайты связывания белков copB, CRP;"шпильки" T1, T2, T7 и петля; оператор белка lux; сайты рестрикции для Pflll08I, BglII, ScaI, BmnI, DrdII, DraIII, BstBI, AceIII, AflII, PflMI, BglI, SfiI,BstEII, BspLullI, NspV, BplI, EagI, BcgI, NsiI, BsaI, Psp1406I, AatII, BsmI, NruI, NdeI, ApaLI, Acc65I, KpnI,SalI, AccI, BspEI, AhdI, BspHI, EconI, BsrG1, BmaI, SmaI, SexAl, BamHI и BlhI. На фиг. 6 А и 6 В показана последовательность ДНК (SEQ ID NO: 97), встроенная в pCFM1656 между уникальными сайтами рестрикции AatII (положение 4364 в pCFM1656) и SacII (положение 4585 в pCFM1656) для получения плазмиды экспрессии pAMG21 (ATCC98113). На фиг.7 показано, что "peptibody" ("пептитело") TALL-1 (SEQ ID NO: 70) ингибирует опосредуемую TALL-1 В-клеточную пролиферацию. Очищенные B-клетки (105) мышей В 6 культивируют в тройном повторе 96-луночных планшетах с указанными количествами консенсусного "пептитела" TALL-1 в присутствии 10 нг/мл TALL-1 плюс 2 мкг/мл TALL-1 антитела против IgM. Пролиферацию измеряют по поглощению радиоактивного [3 Н]тимидина в последние 18 ч пульсового режима. Данные представляют собой среднее значениеSD для трх лунок (тройной повтор). На фиг. 8 показано, что димерные "пептитела" TALL-1 N-концевого тандема (SEQ ID NO: 123, 124 в приводимой ниже табл. 5 В) предпочтительны для ингибирования опосредуемой TALL-1-пролиферации(SEQ ID NO: 115 и 122 в табл. 5 В) или родственных димерных "пептител" (SEQ ID NO: 123, 124) в присутствии 10 нг/мл TALL-1 плюс 2 мкг/мл антитела против IgM. Пролиферацию измеряют по поглощению радиоактивного [3 Н]тимидина в последние 18 ч пульсового режима. Данные представляют собой среднее значениеSD для трх лунок (тройной повтор).-5 010435 Фиг. 9. "Пептитело" ACP3 связывается с AGP3 с высоким сродством. Константу равновесной диссоциации (KD) получают нелинейной регрессией конкурентных кривых, используя модель односайтового гомогенного связывания по двум кривым (программное обеспечение KinEx). KD составляет около 4 пМ для "пептитела" AGP3, связывающегося с человеческим AGP3 (SEQ ID NO: 123). Фиг. 10 А и 10 В. Пептитело AGP3 блокирует как человеческий, так и мышиный AGP3 в конкурентном анализе Biacore. Растворимый человеческий белок TACI был иммобилизован в чипах В 1. 1 нМ рекомбинантного человеческого белка AGP3 (верхняя панель) или 5 нМ рекомбинантного мышиного белкаAGP3 (нижняя панель) инкубируют с указанным количеством "пептитела" AGP3 перед инъецированием через поверхность рецептора. Показана относительная реакция связывания человеческого AGP3 и мышиного AGP3 (SEQ ID NO: 123). Фиг. 11 А и 11 В. Пептитело AGP3 блокирует связывание AGP3 со всеми тремя рецепторами TACI,BCMA и BAFFR в конкурентном анализе Biacore. Рекомбинантные растворимые рецепторные белкиTACI, BCMA и BAFFR иммобилизованы на чипе CM5. 1 нМ рекомбинантного человеческого AGP3(верхняя панель) инъецируют через поверхность каждого рецептора. Определяют относительное связывание AGP3. Аналогично, 1 нМ рекомбинантного белка APRIL инкубируют с указанным количеством"пептитела" AGP3 перед инъецированием через поверхность каждого рецептора. "Пептитело" AGP3 не ингибирует связывание APRIL со всеми тремя рецепторами (SEQ ID NO: 123). Фиг. 12 А и 12 В. "Пептитело" AGP3 ингибирует повышение уровней иммуноглобулина мышиной сыворотки, вызванное заражением (стимуляцией) человеческим AGP3. Мыши Balb/c получают ежедневно в течение 7 дней внутрибрюшинные инъекции 1 мг/кг человеческого AGP3 вместе с физиологическим раствором, человеческим Fc или "пептителом" AGP3 в указанных дозах, на 8 день их умерщвляют. Уровень сывороточного общего IgM и IgA определяют методом ELISA (SEQ ID NO: 123). Фиг. 13. Обработка пептителом AGP3 уменьшает тяжесть артрита на мышиной CIA модели. От восьми до двенадцати недель старых самцов DBA/1 иммунизируют бычьим коллагеном типа II (bCII),эмульгированным в полном адъюванте Фрейнда, интрадермально в основание хвоста, и повторно иммунизируют (бустинг) через 3 недели после первоначальной иммунизации с помощью bCII, эмульгированного в неполном адъюванте Фрейнда. Обработку указанной дозой "пептитела" AGP3 начинают со дня бустерной иммунизации в течение 4 недель. Как описано ранее (Khare et al., J. Immunol., 155: 3653-9,1995), все четыре лапы оцениваются по степени тяжести артрита по шкале 0-3 (SEQ ID NO: 123). Фиг. 14. Обработка "пептителом" AGP3 ингибирует образование антител против коллагена на мышиной CIA модели. Образцы сыворотки отбирают через одну неделю после последней обработки (день 35), как описано выше. Уровень антител против коллагена в сыворотке определяют методом ELISA(SEQ ID NO: 123). Фиг. 15 А и 15 В. Обработка "пептителом" AGP3 задерживает начало заболевания протеинурией и повышает выживание при волчанке у мышей NZB/NZW. Пятимесячным мышам NZBx NZBWF1 вводят внутрибрюшинно (интраперитонеально) 3 Х/неделя в течение 8 недель PBS или указанные дозы "пептитела" AGP3 (SEQ ID NO: 123) или человеческих белков Fc. Белок в моче проверяют ежемесячно в течение эксперимента с помощью полосок с реагентом Albustix (Bayer AG). Фиг. 16 А и 16 В показывают нуклеотидную и аминокислотную последовательности предпочтительного связывающего TALL-1 "пептитела" (SEQ ID NO: 189 и 123). Подробное описание изобретения Определение терминов Определение терминов, применяемых в данном описании, даны ниже, если не указано иначе в конкретных случаях. Общие определения. Термин "содержащий (включающий)" означает, что соединение может включать дополнительные аминокислоты по одному из N- или C-концов или по обоим концам данной последовательности. Конечно, эти дополнительные аминокислоты не должны заметно влиять на активность соединения. Кроме того, физиологически приемлемые соли соединений по данному изобретению также охватываются в данном описании. Термин "физиологически приемлемые соли" относятся к любым солям, о фармацевтической приемлемости которых было известно ранее или стало известно позже. Некоторые конкретные примеры суть следующие: ацетат; трифторацетат; гидрогалогениды, такие как гидрохлорид и гидробромид; сульфат; цитрат; тартрат; гликолят и оксалат. Аминокислоты. Термин "кислые остатки" относится к аминокислотным остаткам в D- или L-форме с боковыми цепями, содержащими кислотные (кислые) группы. Примеры кислых остатков включают в себя D и E. Термин "амидный остаток" относится к аминокислотам в D- или L-форме с боковыми цепями, содержащими амидные производные или кислые группы. Примеры остатков включают N и Q. Термин "ароматический остаток" относится к аминокислотным остаткам в D- или L-форме с боковыми цепями, содержащими ароматические группы. Примеры ароматических остатков включают F, Y и W.-6 010435 Термин "основной остаток" относится к аминокислотным остаткам в D- или L-форме с боковыми цепями, содержащими основные группы. Примеры основных остатков включают H, K и R. Термин "гидрофильный остаток" относится к аминокислотным остаткам в D- или L-форме с боковыми цепями, содержащими полярные группы. Примеры гидрофильных остатков включают C, S, T, N и Q. Термин "нефункциональный остаток" относится к аминокислотным остаткам в D- или L-форме с боковыми цепями, которые не содержат кислые, основные или ароматические группы. Примеры нефункциональных аминокислотных остатков включают М, G, А, V, I, L и норлейцин (Nle). Термин "нейтральный гидрофобный остаток" относится к аминокислотным остаткам в D- илиL-форме с боковыми цепями, которые не содержат кислые, основные или полярные группы. Примеры нейтральных полярных аминокислотных остатков включают А, V, L, I, P, W, М и F. Термин "полярный гидрофобный остаток" относится к аминокислотным остаткам в D- или L-форме с боковыми цепями, содержащими полярные группы. Примеры полярных гидрофобных аминокислотных остатков включают T, G, S, Y, C, Q и N. Термин "гидрофобный остаток" относится к аминокислотным остаткам в D- или L-форме с боковыми цепями, которые не содержат основные или кислые группы. Примеры гидрофобных аминокислотных остатков включают А, V, L, I, P, W, M, F, T, G, S, Y, C, Q и N. Пептиды. Термин "пептид" относится к молекулам, содержащим 1-40 аминокислот, причм предпочтительными являются молекулы, содержащие 5-20 аминокислот. Примеры пептидов могут включать домен природной молекулы, модулирующий TALL-1, или рандомизированные последовательности. Термин "рандомизированный", применяемый для названия пептидных последовательностей, относится к полностью произвольным последовательностям (например, отбираемым методами фагового дисплея или РНК-пептидным скринингом) и последовательностям, в которых один или более остатков природной молекулы замещается аминокислотным остатком, не встречающимся в этом положении в природной молекуле. Методы примеров идентификации пептидных последовательностей включают фаговый дисплей, E.coli дисплей, РНК-пептидный скрининг, химический скрининг и т.п. Термин "домен, модулирующий TALL-1" относится к любой аминокислотной последовательности, которая связывается сTALL-1 и содержит природные или рандомизированные последовательности. Домены, модулирующиеTALL-1, можно идентифицировать или получить методом фагового дисплея или другими методами, указанными в данном описании. Термин "антагонист TALL-1" относится к молекуле, которая связывается с TALL-1 и увеличивает или уменьшает один или более аналитических параметров в противоположность действию на эти параметры полноразмерного нативного TALL-1. Такую активность можно определить, например, такими методами анализа, которые описаны в параграфе, озаглавленном "Биологическая активность AGP3", в разделе "Материалы и методы" патентной заявки, называемой "Белки, родственные TNF", WO 00/47740,опубликованной 17 августа 2000 г."Носители" и "пептитела". Термин "носители" относится к молекуле соединения, которое предупреждает распад и/или увеличивает период полужизни, понижает токсичность, понижает иммуногенность или повышает биологическую активность терапевтического белка. Примеры "носителей" включают домен Fc (который является предпочтительным), а также линейный полимер (например, полиэтиленгликоль (ПЭГ), полилизин,декстран и т.д.); разветвлнный полимер (см., например, патент США 4289872, принадлежащийDenkerwalter et. al., выдан 15 сентября 1981 г.; 5229940, патентообладатель Tam, выдан 20 июля 1993 г.; Международную заявку 93/21259, Frechet et al., опубликованную 28 октября 1993 г.); липид; группа холестерина (например, стероид); углевод или олигосахарид (например, декстран); любой природный или синтетический белок, полипептид или пептид, который связывается с "сальваж" (salvage)-рецептором; альбумин, включая человеческий сывороточный альбумин (HSA), домен лейциновой молнии и другие подобные белки и фрагменты белков. Носители дополнительно описываются ниже. Термин "нативный Fc" относится к молекуле или последовательности, содержащей последовательность не-антигенсвязывающего фрагмента, полученного при гидролизе целого антитела, в мономерной или мультимерной форме. Иммуноглобулин, источник нативного Fc, предпочтительно человеческого происхождения и может представлять собой любой иммуноглобулин, хотя предпочтительными являютсяIgG1 и IgG2. Нативные Fc "составляют" из мономерных полипептидов, которые могут быть связаны в димерные или мультимерные формы с помощью ковалентной (т.е. дисульфидными мостиками) и нековалентной ассоциации. Число межмолекулярных дисульфидных связей между мономерными субъединицами нативных молекул Fc в интервале от 1 до 4 в зависимости от класса (например, IgG, IgA, IgE) или подкласса (например, IgG1, IgG2, IgG3, IgA1, IgGA2). Одним из примеров нативного Fc является дисульфид-связанный димер, получаемый при расщеплении IgG под действием папаина (см. Ellison et al.,(1982), Nucleic Acids Res. 10: 4071-9). Термин "нативный Fc" по данному описанию является родовым для мономерной, димерной и мультимерной форм.-7 010435 Термин "вариант Fc" относится к молекуле или последовательности, полученной модификацией нативного Fc, но вс ещ содержащей сайт связывания "сальваж"-рецептора, FcRn. В Международных заявках WO 97/34631 (опубликованной 25 сентября 1997 г.) и WO 96/32478 описаны примеры вариантовFc, а также взаимодействие с "сальваж"-рецептором; эти заявки во всей полноте вводятся ссылками в данное описание. Следовательно, термин "вариант Fc" включает молекулу или последовательность, которая является гуманизированной молекулой или последовательностью нечеловеческого нативного Fc. Кроме того, нативный Fc содержит сайты, которые можно удалить, так как они придают структурные признаки биологической активности, непригодной для слитых молекул по настоящему изобретению. Следовательно,термин "вариант Fc" включает молекулу или последовательность, в которой отсутствует один или более сайтов или остатков нативного Fc, влияющие на (1) образование дисульфидной связи; (2) несовместимость с отобранной клеткой-хозяином; (3) гетерогенность по N-концу при экспрессии в отобранной клетке-хозяине; (4) гликозилирование; (5) взаимодействие с комплементом; (6) связывание с Fc рецептором, иным, нежели "сальваж"-рецептор; или (7) антитело-зависящую клеточную цитотоксичность(ADCC), или участвующие в этих явлениях. Варианты Fc более подробно описаны ниже. Термин "Fc домен" охватывает молекулы и последовательности нативного Fc и вариантов Fc по определению выше. Как и в случае вариантов Fc и нативных Fc, термин "Fc домен" включает молекулы в мономерной или мультимерной форме, полученные расщеплением (гидролизом) целого антитела либо полученные другими способами. Термин "мультимер", применяемый в отношении Fc доменов или молекул, включающих Fc домены, относится к молекулам, содержащим две или более полипептидных цепи, связанные нековалентными взаимодействиями, или за счт как ковалентных, так и нековалентных взаимодействий. МолекулыIgG, как правило, образуют димеры; IgM-пентамеры; IgD-димеры; и IgA-мономеры, димеры, тримеры или тетрамеры. Мультимеры могут образовываться при использовании последовательности и результирующей активности нативного Ig-источника Fc или дериватизацией (как определяется ниже), такого как нативный Fc. Термин "димер" в применении к Fc доменам относится к молекулам, содержащим две полипептидные цепи, связанные ковалентно или нековалентно. Так, примеры димеров в объме данного изобретения показаны на фиг. 1. Термины "дериватизация" и "производный" или "дериватизированный" включают процессы и получаемые соединения, соответственно, в которых (1) соединение содержит циклический участок, например, образованный путм сшивания цистеинильных остатков соединения; (2) соединение является сшитым или содержит сайт для сшивания, например соединение содержит цистеинильный остаток и за счт этого образует сшитые димеры в культуре или in vivo; (3) одна или более пептидильных связей заменяются непептидильными; (4) N-конец замещается на -NRR1, -NRC(O)R1, -NRC(O)OR1, -NRS(O)2R1,-NHC(O)NHR, сукцинимидную группу или замещнный или незамещнный бензилоксикарбонил-NH-,где определение R и R1 и циклических заместителей датся ниже; (5) C-конец замещается на -C(O)R2 или-NR3R4, где значение R2, R3 и R4 дано ниже в данном описании; и (6) соединения, в которых отдельные аминокислотные фрагменты модифицируют, обрабатывая агентами, способными реагировать с отобранными боковыми цепями или концевыми остатками. Более подробное описание производных приводится ниже. Термины "пептитело" и "пептитела" относятся к молекулам, содержащим домен Fc и по меньшей мере один пептид. Такие "пептитела" могут быть мультимерами или димерами или их фрагментами и они могут быть дериватизированы. В данном изобретении молекулы формул II-VI по данному описанию представляют собой "пептитела", когда V является доменом Fc. Структура соединений. Общие замечания. Авторы данного изобретения определяли последовательности, способные связываться с TALL-1 и модулировать его биологическую активность. Эти последовательности можно модифицировать указанными выше методами, с помощью которых можно изменить одну или более аминокислот при сохранении или даже улучшении аффинности связывания пептида. В заявляемых композициях, получаемых по данному изобретению, пептид(ы) можно присоединять к носителю по N- или C-концу пептида. Любой из этих пептидов может связываться в тандем (т.е. последовательно), с линкерами или без линкеров. Таким образом, молекулы носитель-пептид по данному изобретению могут быть описаны следующей формулой: где V1 обозначает носитель (предпочтительно, Fc домен);TALL-1, таких как домены формул I(а)-I(i);a, b, c, d, e и f, каждый независимо, обозначают 0 или 1, при условии, что по меньшей мере один изa и b обозначает 1. Следовательно, соединение формулы II включает предпочтительные соединения формул и их мультимеры, где V1 обозначает Fc домен и присоединн по C-концу А 1; и их мультимеры, где V1 обозначает Fc домен и присоединн по N-концу А 2; и их мультимеры, где V1 обозначает Fc домен и присоединн по N-концу -(L1)c-P1; и и их мультимеры, где V1 обозначает Fc домен и присоединн по N-концу -L1-P1-L2-P2. Пептиды. Пептиды по изобретению применимы в качестве TALL-1 модулирующих доменов в молекулах, соответствующих формулам II-VI. Молекулы соединений по данному изобретению, содержащие такие пептидные последовательности, можно получать известными в технике методами. Предпочтительными пептидными последовательностями являются пептидные последовательности вышеприведнных формул I(а)-I(i), содержащие указанные ниже заместители. Таблица 1 Предпочтительные пептидные заместители Заметна некоторая гомология последовательностей известных рецепторов для TALL-1 с последовательностями предпочтительных пептидов: Любой пептид, содержащий цистеинильный остаток, может перекрстно связываться (сшиваться) с другим Cys-содержащим пептидом, при этом любой из них или они оба могут быть связаны с носителем. Любой пептид, содержащий более одного остатка Cys, может также образовывать внутрипептидную дисульфидную связь. Любой из этих пептидов может быть дериватизирован, как показано ниже в данном описании. Дополнительные применимые пептидные последовательности могут быть получены в результате консервативных и/или неконсервативных модификаций аминокислотных последовательностей, приведнных в табл. 2. Консервативные модификации могут давать пептиды, имеющие функциональные и химические характеристики, аналогичные функциональным и химическим характеристикам пептида, из которого эти модификации получены. Напротив, важные изменения (модификации) функциональных и/или химических характеристик пептидов можно осуществить, выбирая замены в аминокислотной последовательности, которые значительно отличаются по своему влиянию на сохранение (а) структуры молекулярного остова на площади замены, например в виде конформации складки или спирали; (б) заряда или гидрофобности молекулы в сайте-мишени или (в) размера молекулы.- 11010435 Например, "консервативная аминокислотная замена" может включать замену нативного аминокислотного остатка ненативным остатком таким образом, что это мало влияет или не влияет на полярность или заряд аминокислотного остатка в этом положении. Кроме того, любой нативный остаток в полипептиде можно также заместить на аланин, как это было ранее описано для "аланин-сканирующего мутагенеза" (см., например, MacLennan et al., 1998, Acta Physiol. Scand. Suppl. 643: 55-67; Sasaki et al., 1998, Adv.Biophys. 35: 1-24, в которых обсуждается аланин-сканирующий мутагенез). Нужные консервативные замены (консервативные или неконсервативные) могут определить специалисты в данной области техники в тот момент, когда эти замены потребуются. Например, аминокислотные замены можно использовать для идентификации важных остатков пептидной последовательности или для повышения или для понижения аффинности пептидных молекул и молекул носитель-пептид(см. приведнные выше формулы) по данному описанию. Примеры аминокислотных замен приведены в табл. 3. Таблица 3 Аминокислотные замены В некоторых вариантах изобретения консервативные аминокислотные замены также охватывают неприродные аминокислотные остатки, которые вводятся, как правило, химическим пептидным синтезом, а не синтезом в биологических системах. Как отмечается в предыдущем разделе "Определение терминов", природные остатки можно разделить на классы на основе общих свойств боковых цепей, которые могут быть применимы для модификации последовательности. Например, неконсервативные замены могут включать замену члена одного из этих классов на член другого класса. Такие заменяющие остатки можно вводить в участки пептида, которые гомологичны ортологам нечеловеческого происхождения, или в негомологичные участки молекулы. Помимо этого, можно также осуществлять модификации, используя Р или G с целью влияния на ориентацию цепей. При проведении таких модификаций можно принимать во внимание гидропатический индекс аминокислот. Каждой аминокислоте приписывают следующее значение гидропатического индекса, исходя из характеристик их гидрофобности и заряда: изолейцин (+4.5); валин (+4.2); лейцин (+3.8); фенилаланин- 12010435 Важное значение гидропатического индекса аминокислот для придания белку интерактивной биологической функции понятно из уровня техники. Kyte et al., J. Mol. Biol., 157: 105-131 (1982). Известно,что некоторые аминокислоты, имеющие сходный гидропатический индекс или показатель, сохраняют сходную биологическую активность. При осуществлении изменений на основе гидропатического индекса предпочтительными являются замены на аминокислоты, гидропатический индекс которых находится в интервале 2, более предпочтительными являются аминокислоты, гидропатический индекс которых составляет 1, и ещ более предпочтительными являются аминокислоты, гидропатический индекс которых составляет 0,5. Из уровня техники также понятно, что замену подобных аминокислот можно эффективно осуществить, исходя из гидрофильности. Наибольшая местная средняя гидрофильность белка, на которую оказывает влияние гидрофильность прилегающих аминокислот, коррелируется с его иммуногенностью и антигенностью, т.е. с биологическими свойствами белка. Следующие величины гидрофильности установлены для аминокислотных остатков: аргинин (+3.0); лизин (+3.0); аспартат (+3.01); глутамат (+3.01); аспарагин (+0.2); глутамин (+0.2); глицин (0); треонин(-1.8); изолейцин (-1.8); тирозин (-2.3); фенилаланин (-2.5); триптофан (-3.4). Для осуществления замен на основе сходных значений гидрофильности предпочтительными являются аминокислотные замены, величины гидрофильности которых находятся в интервале 2, особенно предпочтительны значения 1 и наиболее предпочтительны значения гидрофильности в интервале 0.5 и даже выше. Можно также идентифицировать эпитопы последовательностей исходя из гидрофильности. Эти области также называют "области эпитопов ядра". Опытный специалист в данной области техники может детерминировать подходящие варианты полипептида, представленные в приведнных выше последовательностях, используя хорошо известные методы. Для идентификации соответствующих участков молекул, которые можно изменять без изменения активности, специалист в данной области техники может сделать мишенью участки, которые, как полагают, не являются важными для активности. Например, если известны аналогичные (сходные) полипептиды с аналогичными (сходными) активностями одного вида или разных видов, специалист в данной области техники может сравнить аминокислотную последовательность пептида с последовательностями сходных пептидов. При таком сравнении можно идентифицировать консервативные остатки и участки молекул среди сходных полипептидов. Очевидна меньшая вероятность того, что изменения на участках пептида, не являющихся консервативными относительно таких сходных пептидов, оказывают побочное(вредное) действие на биологическую активность и/или структуру пептида. Специалист в данной области техники знает также, что даже в относительно консервативных областях можно химическими методами заменить аналогичные аминокислоты на природные остатки при сохранении активности (консервативные аминокислотные замены). Следовательно, даже на участках, которые могут быть важны для биологической активности или для структуры, можно осуществлять аминокислотные замены, не нарушая биологической активности и не оказывая вредного действия на структуру пептида. Кроме того, специалист в данной области техники может просмотреть материал исследований структура-свойства (функция), в которых идентифицируются остатки в сходных пептидах, важные для активности структуры. В результате такого сравнения можно прогнозировать значимость аминокислотных остатков в пептиде, которые соответствуют аминокислотным остаткам, важным для активности или структуры аналогичных пептидов. Специалист в данной области техники может выбрать химически сходные аминокислотные замены для таких, как показывает прогноз, важных аминокислотных остатков пептидов. Специалист в данной области техники может также провести анализ, сравнивая трхмерную структуру и аминокислотную последовательность с трхмерной структурой сходных (аналогичных) полипептидов. На основе этой информации специалист в данной области техники может предсказывать первичную структуру (расположение) аминокислотных остатков пептида в соответствии с его трхмерной структурой. Специалист в данной области техники может выбирать, не внося радикальных изменений в прогнозируемые аминокислотные остатки на поверхности белка, так как такие остатки могут участвовать в важных взаимодействиях с другими молекулами. Кроме того, специалист в данной области техники может создать варианты для тестирования, содержащие одиночную аминокислотную замену каждого заданного аминокислотного остатка. Затем можно провести скрининг вариантов, применяя анализы активности, известные специалистам в данной области техники. Такие данные можно использовать для сбора информации о подходящих вариантах. Например, если обнаруживают, что замена на конкретный аминокислотный остаток приводит в результате к нарушенной, пониженной, без необходимости в этом,или неподходящей активности, варианты с такой заменой следует избегать. Другими словами, на основе информации, собранной в результате таких рутинных экспериментов, специалист в данной области техники может легко определить аминокислоты, дальнейших замен которых, либо самостоятельных, либо в сочетании с другими мутациями, следует избегать.- 13010435 Ряд научных публикаций посвящен предсказанию вторичной структуры. См. Moult J., Curr. Op., inBiotech., 7(4): 422-427 (1996), Chou et al., Biochemistry, 13(2): 222-245 (1974); Chou et al., Biochemistry,113(2): 211-222 (1974); Chou et al., Adv. Enzymol. Relat. Areas Mol. Biol., 47: 45-148 (1978); Chou et al.,Ann. Rev. Biochem., 47: 281-276 и Chou et al., Biophys. J., 26: 367-384 (1979). Кроме того, в настоящее время доступны компьютерные программы, помогающие предсказывать вторичную структуру. Один из методов предсказания вторичной структуры опирается на моделирование на основе гомологии. Например, два полипептида или белка, последовательности которых идентичны более чем на 30% или подобны более чем на 40%, часто имеют сходную структурную топологию. Наблюдаемый в последнее время рост базы данных по структурам белков (PDB) дат больше возможностей для предсказания вторичной структуры, включая возможное число складок в структуре полипептида или белка. Holm et al., Nucl. Acid. Res.,27(1): 244-247 (1999). Было высказано предположение (Brenner et al., Curr. Op. Struct. Biol., 7(3): 369-376(1997, что в данном полипептиде или белке имеется ограниченное число складок и что когда решено критическое число структур, резко возрастает точность предсказания структуры. Дополнительные методы предсказания вторичной структуры включают "натягивание нити"Gribskov et al., Proc. Nat. Acad. Sci., 84(13): 4355-8 (1987, и "эволюционное связывание" (Home , см. выше, и Brenner, см. выше). Носители. По данному изобретению требуется присутствие по меньшей мере одного носителя (V1), присоединнного к пептиду по N-концу, C-концу или по боковой цепи одного из аминокислотных остатков. Можно использовать также несколько носителей; например, домены Fc на каждом конце или Fc на конце ПЭГ - группу на другом конце или в боковой цепи. Примеры носителей включают в себяFc домен; другие белки, полипептиды или пептиды, способные связываться с сальваж (salvage)-рецептором; человеческий сывороточный альбумин (HSA); домен лейциновой молнии (LZ); полиэтиленгликоль (ПЭГ), включая ПЭГ протяжнностью 5, 20 и 30 кДа, а также другие полимеры; декстран и другие молекулы, о которых из уровня техники известно, что они применяются для увеличения периода полужизни и/или для защиты от протеолитического распада или клиренса. Предпочтительным носителем является Fc домен. Fc домен может сливаться по N- или C-концу пептидов или по обоим концам, N и C. Предпочтительным является слияние по N-концу. Как указывается выше, Fc варианты представляют собой подходящие носители в объме данного изобретения. Нативный Fc может быть значительно модифицирован, при этом образуется Fc вариант по данному изобретению при условии, что сохраняется связывание с "сальваж"-рецептором; см., например,Международные заявки WO 97/34631 и WO 96/32478. В таких Fc вариантах можно удалить один или более сайтов нативного Fc, которые придают структурные признаки или функциональную активность, не требующиеся от слитых молекул по изобретению. Можно удалять эти сайты, например, заменой или удалением (делеции) остатков, встраиванием (инсерции) остатки в сайт или отсечением участков, содержащих сайт. Встроенные или заменнные остатки могут также представлять собой изменнные аминокислоты, такие как пептидомиметики или D-аминокислоты. Fc варианты могут быть желательны по многим причинам, некоторые из которых приведены ниже. Примеры Fc вариантов включают молекулы и последовательности, в которых: 1. Сайты, участвующие в образовании дисульфидной связи, удаляются. Такое удаление позволяет избежать реакции с цистеинсодержащими белками, присутствующими в клетке-хозяине, используемой для получения молекул по изобретению. С этой целью цистеинсодержащий сегмент на N-конце можно отсечь или можно цистеиновый остаток вырезать или заменить на другие аминокислоты (например, аланил, серил). В частности, можно отрезать N-концевой сегмент SEQ ID NO: 2, содержащий 20 аминокислот, или делетировать или заменить цистеиновые остатки в положениях 7 и 10 SEQ ID NO: 2. Даже когда удаляют цистеиновые остатки, одноцепочечный Fc домен вс ещ может образовывать димерный Fc домен, который удерживается вместе за счт нековалентной связи. 2. Нативный Fc модифицируют, чтобы сделать его более совместимым с отобранной клеткойхозяином. Например, можно удалить последовательность PA близ N-конца типичного нативного Fc, который можно распознать с помощью пищеварительного фермента в E.coli, такого как иминопептидаза. Можно также добавить N-концевой остаток метионина, особенно, когда молекула рекомбинантно экспрессирует в бактериальной клетке, такой как E.coli. Fc домен последовательности SEQ ID NO: 2 представляет собой один из таких Fc вариантов. 3. Участок N-конца нативного Fc удаляют, чтобы предупредить N-концевую гетерогенность при экспрессии в выбранной клетке-хозяине. С этой целью можно делетировать любой из первых 20 аминокислотных остатков на N-конце, в частности аминокислотные остатки в положениях 1, 2, 3, 4 и 5.- 14010435 4. Удаляют один или более сайтов гликозилирования. Остатки, которые, как правило, гликозилируются (например, аспарагин), могут провоцировать цитолитическую реакцию. Такие остатки можно делетировать или заменять на негликозилируемые остатки (например, аланин). 5. Сайты, участвующие во взаимодействии с комплементом, такие как сайт связывания C1q, удаляют. Например, можно делетировать или заменить последовательность EKK человеческого IgG1. Восстановление дефицита комплемента может быть невыгодным для молекул по данному изобретению и поэтому его следует избегать в случае такого Fc варианта. 6. Удаляют сайты, которые влияют на связывание с рецептором Fc, иным, нежели "сальваж"рецептор. Нативный Fc может содержать сайты для взаимодействия с некоторыми лейкоцитами, это взаимодействие не требуется для слитых молекул по данному изобретению и поэтому эти сайты могут быть удалены. 7. Удаляют сайт ADCC. Сайты ADCC известны в технике; см., например, Molec. Immunol. 29 (5): 633-9 (1992) относительно сайтов ADCC в IgG1. Эти сайты также не нужны для слитых молекул по данному изобретению и поэтому могут быть удалены. 8. Когда нативный Fc происходит из нечеловеческого антитела, нативный Fc можно гуманизировать. Как правило, для гуманизации нативного Fc заменяют выбранные остатки нечеловеческого нативного Fc на остатки, которые обычно находятся в человеческом нативном Fc. Методы гуманизации антител хорошо известны в технике. Предпочтительные Fc варианты включают следующие. В последовательности SEQ ID NO: 2(фиг. 3) лейцин в положении 15 можно заменить на глутамат; глутамат в положении 99 можно заменить на аланин; а остатки лизина в положениях 101 и 103 можно заменить на остатки аланина. Кроме того,один или более остатков тирозина можно заменить на остатки фенилаланина. Альтернативным носителем является белок, полипептид, пептид, антитело, фрагмент антитела или малая молекула (например, пептидомиметик), способные связываться с "сальваж-рецептором". Например, можно использовать в качестве носителя полипептид, как описано в патенте США 5739277, выданный 14 апреля 1998 г. Presta et al. Пептиды можно также отбирать методом фагового дисплея или РНКпептидным скринингом на связывание с "сальваж"-рецептором FcRn. Такие соединения, связывающие"сальваж"-рецептор, также охватываются термином "носитель" и входят в объм данного изобретения. Такие носители отбирают по продолжительному периоду полужизни (например, избегая последовательностей, распознаваемых протеазами) и по пониженной иммуногенности (например, предпочитая неиммуногенные последовательности, как описывается при гуманизации антител). Как отмечается выше, полимерные носители могут также применяться для V1. В настоящее время известны различные способы присоединения химических фрагментов, применимых в качестве носителей, см., например, Международную заявку PCT WO 96/11953, озаглавленную "N-Terminally ChemicallyModified Protein Compositions and Methods", вводимую в данное описание ссылкой во всей полноте. В этой публикации PCT среди прочего описано селективное присоединение водорастворимых полимеров по N-концу белков. Предпочтительным полимерным носителем является полиэтиленгликоль (ПЭГ). Группа ПЭГ может иметь любой подходящий молекулярный вес и может быть линейной или разветвлнной. Средний молекулярный вес ПЭГ предпочтительно находится в интервале примерно от 2 до 100 кДа, более предпочтительно примерно от 5 до 50 кДа, наиболее предпочтительно примерно от 5 до 10 кДа. Группы ПЭГ, как правило, присоединяются к соединениям по изобретению ацилированием или восстановительным алкилированием за счт реакции реакционноспособной группы во фрагменте ПЭГ (например, альдегидная,амино, тиольная или сложноэфирная группа) с реакционноспособной группой соединения по изобретению (например, альдегидной, амино или сложноэфирной группой). Применяемая стратегия ПЭГирования синтетических пептидов заключается в соединении, за счт образования сопряжнной связи в растворе, пептидного и ПЭГ-фрагментов, при этом каждый из них нест определнную функциональную группу, реакционноспособную в отношении другой группы. Пептиды просто получают обычным твердофазным синтезом. Пептиды "предварительно активируют" с помощью соответствующей функциональной группы в конкретном сайте. Предшественники очищают и полностью характеризуют перед реакцией с фрагментом ПЭГ. Сшивание пептида с ПЭГ, как правило, происходит в водной фазе, и его контролируют обращнно-фазовой аналитической ВЭЖХ. ПЭГированные пептиды просто очищаются препаративной ВЭЖХ и характеризуются аналитической ВЭЖХ, аминокислотным анализом и лазерно-десорбционной масс-спектрометрией. Полисахариды представляют собой другой тип водорастворимого полимера, который можно применять для модификации белков. Декстраны представляют собой полисахариды, состоящие из отдельных субъединиц глюкозы, связанных преимущественно 1-6 связями. Сам по себе декстран существует в виде молекул, молекулярный вес которых меняется в большом интервале, и легко доступен декстран с молекулярным весом примерно от 1 до 70 кДа. Декстран является подходящим водорастворимым полимером для применения по данному изобретению в качестве носителя, самостоятельно или в комбинации с другим носителем (например, Fc). См., например, Международные заявки WO 96/11953 иWO 96/05309. Сообщалось о применении декстрана, конъюгированного с терапевтическими или диагно- 15010435 стическими иммуноглобулинами; см., например, Европейский патент 0315456, который вводится ссылкой в данное описание во всей полноте. Когда декстран применяется в качестве носителя по данному описанию, предпочтительным является декстран примерно от 1 до 20 кДа. Линкеры. Любая "линкерная " группа является необязательной. Если эта группа присутствует, е химическое строение не важно, так как прежде всего она служит в качестве спейсера. Линкер предпочтительно состоит из аминокислот, связанных вместе пептидными связями. Так, в предпочтительных вариантах изобретения линкер состоит из 1-30 аминокислот, связанных пептидными связями, причм аминокислоты выбирают из 20 природных аминокислот. Некоторые из этих аминокислот могут быть гликозилированными, что хорошо понимают специалисты в данной области техники. В более предпочтительных вариантах изобретения аминокислоты от 1 до 20 выбирают из глицина, аланина, пролина, аспарагина, глутамина и лизина. Ещ более предпочтительно, когда линкер выбирают из большинства стерически незатрудннных аминокислот, таких как глицин и аланин. Так, предпочтительными линкерами являются полиглицины (в частности, (Gly)4, (Gly)5), поли(Gly-Ala) и полиаланины. Другими специфическими линкерами являютсяGly-Gly-Gly-Lys-Gly-Gly-Gly-Gly (SEQ ID NO: 40). Также предпочтительными являются комбинации Gly и Ala. Приведнные здесь линкеры являются примерами; линкеры, входящие в объм данного изобретения, могут быть значительно длиннее и могут включать другие остатки. Предпочтительными линкерами являются аминокислотные линкеры, содержащие более 5 аминокислот, при этом подходящие линкеры содержат около 500 аминокислот, выбираемых из глицина, аланина, пролина, аспарагина, глутамина, лизина, треонина, серина и аспартата. Наиболее предпочтительными являются линкеры, содержащие около 20-50 аминокислот. Одну группу предпочтительных линкеров составляют линкеры, соответствующие следующим формулам: где х 1 и х 3, каждый независимо, обозначают основные или гидрофобные остатки, а х 2 и х 4, каждый независимо, обозначают гидрофобные остатки. Конкретные предпочтительные линкеры суть Возможны также непептидные линкеры. Например, алкильные линкеры, такие как-NH-(CH2)s-C(O)-, где можно использовать значение s=2-20. Эти алкильные линкеры могут дополнительно иметь в качестве заместителя любую пространственно незатрудннную группу, такую как низший алкил (например, C1-C6), низший ацил, галоген (например, Cl, Br), CN, NH2, фенил и т.д. Примером непептидного линкера является линкер ПЭГ, где n имеет такое значение, что молекулярный вес равен от 100 до 5000 кДа, предпочтительно 100-500 кДа. Пептидные линкеры можно варьировать, образуя производные описанным выше способом. Производные. Авторы также рассматривают дериватизацию пептидной области соединений и/или области соеди- 16010435 нений, являющуюся носителем. Такие производные позволяют повысить растворимость, абсорбцию,биологический период полужизни и т.п. соединений. Фрагменты можно либо элиминировать, либо ослаблять любой нежелательный побочный эффект соединения и т.п. Примеры производных включают соединения, в которых: 1) соединение или некий его участок является циклическим. Например, пептидный участок можно модифицировать таким образом, чтобы он содержал два или более Cys остатков (например, линкер), которые могут циклизоваться с образованием дисульфидной связи; 2) соединение является сшитым или его молекулы способны образовывать перекрстные связи(сшивание). Например, пептидный участок можно модифицировать таким образом, чтобы он содержалCys остаток и поэтому мог образовывать межмолекулярную дисульфидную связь с аналогичной молекулой. Соединение может также сшиваться по C-концу, как приведнная ниже молекула В формуле VIII каждый из "V1" может, как правило, обозначать одну нить домена Fc; 3) одна или более пептидильных [-C(O)NR-] связей (фрагментов) замещается на непептидильную связь. Примерами непептидильных связей являются -CH2-карбамат [-CH2-OC(O)NR-], фосфонат,-CH2-сульфонамид [-CH2S(O)2NR-], мочевина [-NHC(O)NH], -CH2-вторичный амин и алкилированный пептид [-C(O)NR6, где R6 обозначает низший алкил]; 4) N-конец дериватизирован. Как правило, N-конец может быть ацилирован или модифицирован превращением в соответствующий амин. Примеры производных N-концевых групп включают -NRR1(иной, нежели -NH2), -NRC(O)R1, -NRC(O)OR1, -NHS(O)2R1, -NHC(O)NHR1, сукцинимид или бензилоксикарбонил -NH-(CBZ-NH), в которых R и R1, каждый независимо, обозначают водород или низший алкил и фенильное кольцо может иметь от 1 до 3 заместителей, выбираемых из группы, состоящей из(превращают в амид). Примеры производных C-концевых групп включают -C(O)R2, где R2 обозначает низший алкокси, или -NR3R4, где R3 и R4, независимо, обозначают водород или C1-C8 алкил (предпочтительно, C1-C4 алкил); 6) дисульфидный мостик заменяют другим, предпочтительно, более устойчивым сшивающим фрагментом (например, алкиленовым мостиком). См., например, Bhatnagar et al. (1996), J. Med. Chem. 39: 3814-9; Alberts et al. (1993) Thirteen Am. Pep. Symp., 357-9; 7) один или более отдельных аминокислотных остатков модифицирован. Известны различные дериватизирующие агенты, которые специфически реагируют с выбранными боковыми цепями или концевыми остатками, как подробнее описано ниже. Лизинильные остатки или аминоконцевые остатки могут реагировать с ангидридами янтарной или других карбоновых кислот, которые меняют на обратный заряд лизинильных остатков. Другие подходящие реагенты для дериватизации альфа-аминосодержащих остатков включают имидоэфиры, такие как метилпиколинимидат; пиридоксальфосфат; пиридоксаль; хлорборогидрид; тринитробензолсульфокислоту; О-метилизомочевину; 2,4-пентандион и катализируемую трансаминазой реакцию с глиоксилатом. Аргинильные остатки могут быть модифицированы реакцией с любым или с комбинацией нескольких обычных реагентов, включая фенилглиоксаль, 2,3-бутандион, 1,2-циклогександион и нингидрин. Дериватизация аргинильных остатков требует, чтобы реакцию проводили в щелочной среде вследствие высокого значения pKa функциональной группы гуанидина. Кроме того, эти реагенты могут реагировать с группами лизина, а также с эпсилон-аминогруппой аргинина. Очень тщательно изучалась специфическая модификация тирозильных остатков, при этом особый интерес вызвало введение спектральных меток в тирозильные остатки по реакции с ароматическими диазониевыми соединениями или тетранитрометаном. Чаще всего используют N-ацетилимидазол и тетранитрометан для образования О-ацетильтирозильных фрагментов и 3-нитропроизводных соответственно. Карбоксильные группы боковых цепей (аспарагил или глутамил) можно селективно модифицировать реакцией с карбодиимидами (R'-N=C=N-R'), например с 1-циклогексил-3-(2-морфолинил-(4-этилкарбодиимидом или с 1-этил-3-(4-азониа-4,4-диметилпентил)карбодиимидом. Кроме того, остатки аспарагил и глутамил могут быть превращены в аспарагинильный и глутаминильный остатки реакцией с ионами аммония. Глутаминильный и аспарагинильный остатки можно дезаминировать до соответствующих глутамильного и аспарагильного остатков или же можно дезаминировать в слабокислой среде. Любая форма этих остатков входит в объм данного изобретения. Цистеинильные остатки могут быть замещены аминокислотными остатками или другими фрагментами либо с целью элиминировать дисульфидный мостик, либо, наоборот, стабилизировать сшивание- 17010435 Дериватизация с помощью бифункциональных агентов применима для перекрстного связывания (сшивания) пептидов или их функциональных производных с нерастворимой в воде подложкой (матрикс) или с другими макромолекулярными носителями. Общеупотребительные агенты для сшивания включают, например, 1,1-бис-(диазоацетил)-2-фенилэтан, глутаральдегид, N-гидроксисукцинимидоэфиры, эфиры 4-азидосалициловой кислоты, гомобифункциональные имидоэфиры, включая дисукцинимидильные эфиры, такие как 3,3'-дитиобис-(сукцинимидилпропионат), и бифункциональные малеинимиды, такие как бис-N-малеинимидо-1,8-октан. Дериватизирующие агенты, такие как метил-3-[(п-азидофенил)дитио]пропиоимидат, дают фотоактивируемые интермедиаты, которые способны сшиваться на свету. Или же для иммобилизации белков используют реакционноспособные нерастворимые в воде матрицы, такие как активируемые цианогенбромидом углеводы и реакционноспособные субстраты, описанные в патентах США 3969287; 3691016; 4195128; 4247642; 4229537 и 4330440, применяют для иммобилизации белка. Углеводные (олигосахаридные) группы удобно присоединять к сайтам, известным как сайты гликозилирования в белках. Как правило, О-связанные олигосахариды присоединяются к остаткам серина (Ser) или треонина (Thr), тогда как N-связанные олигосахариды присоединяются к остаткам аспарагина (Asn),когда они являются часть последовательности Asn-X-Ser/Thr, где X может быть любой аминокислотой,кроме пролина. X предпочтительно является одной из 19 природных аминокислот, кроме пролина. Структура N-связанных и O-связанных олигосахаридов и остатков сахаров, обнаруживаемых в каждом типе, различна. Один тип сахаров, который обычно находят в обоих случаях, представляет собойN-ацетилнейраминовую кислоту (называемую сиаловой кислотой). Сиаловая кислота является обычно концевым остатком как N-связанных, так и О-связанных олигосахаридов и, вследствие своего отрицательного заряда, может придавать кислые свойства гликозилированному соединению. Такой(ие) сайт(ы) можно включать в линкер соединений по данному соединению и предпочтительно гликозилировать при участии клетки в процессе рекомбинантного продуцирования полипептидных соединений (например, в клетках млекопитающих, таких как CHO, BHK, COS). Однако такие сайты можно дополнительно гликозилировать синтетическими или полусинтетическими методами, известными в технике. Другие возможные модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп остатков серильного или треонильного остатков, окисление атома серы в Cys,метилирование альфа-аминогрупп боковых цепей лизина, аргинина и гистидина. Creighton, Proteins:Structure and Molecule Properties (W.H. FreemanCo., San Francisco), p. 79-86 (1983). Соединения по данному изобретению можно также изменять на уровне ДНК. Последовательность ДНК любого участка соединения можно изменять на кодоны, более совместимые с выбранной клеткойхозяином. Для E.coli, которая является предпочтительной клеткой-хозяином, оптимизированные кодоны известны из уровня техники. Кодоны могут быть замещены таким образом, чтобы элиминировать сайты рестрикции или ввести молчащие сайты рестрикции, которые могут способствовать процессированию ДНК в выбранной клетке-хозяине. Последовательности носителя, линкера и ДНК пептида могут быть модифицированы таким образом, чтобы включить любые из вышеуказанных изменений в последовательностях. Методы получения. Главным образом, соединения по данному изобретению можно получать в трансформированной клетке-хозяине, используя метод рекомбинантной ДНК. Чтобы это осуществить, получают молекулу рекомбинантной ДНК, кодирующей пептид. Методы получения таких молекул ДНК хорошо известны в технике. Например, последовательности, кодирующие пептиды, можно вырезать из ДНК, используя подходящие рестриктазы, или же молекулу ДНК можно синтезировать методами химического синтеза, такими как метод с применением фосфорамидатов. Также можно применять комбинацию этих методов. Изобретение также включает вектор, способный экспрессировать пептиды в соответствующем хозяине. Вектор содержит молекулу ДНК, которая кодирует пептиды, функционально связанные с последовательностью, контролирующей экспрессию. Методы осуществления этого функционального связывания до или после того, как молекула ДНК будет встроена в вектор, хорошо известны. Последовательности, контролирующие экспрессию, включают промоторы, активаторы, энхансеры, операторы, сайты связывания рибосом, инициирующие кодоны (сигналы), терминирующие кодоны (сигналы), кэпы, сигналы полиаденилирования и другие сигналы, участвующие в регуляции транскрипции или трансляции. Полученный вектор, содержащий в себе молекулу ДНК, применяют для трансформации соответствующего хозяина. Эту трансформацию можно осуществлять хорошо известными в технике методами. Для применения на практике данного изобретения можно использовать любые из большого числа доступных и хорошо известных клеток-хозяев. Выбор конкретного хозяина зависит от ряда факторов,известных в технике. Эти факторы включают, например, совместимость с выбранным вектором экспрессии, токсичность пептидов, кодируемых молекулой ДНК, скорость трансформации, лгкость регенерации пептидов, показатели (характеристики) экспрессии, био-безопасность и стоимость. При рассмотрении этих факторов следует понимать, что не все хозяева могут быть одинаково эффективны для экспрессии конкретной последовательности ДНК. В свете этих общих принципов пригодные хозяева микробного происхождения включают бактериальные (такие как Е.coli sp.), дрожжевые (такие как Saccharomycessp.) и другие клетки, такие как грибковые клетки, клетки насекомых, растений, млекопитающих (включая человека) в культуре, или другие хозяева, известные в технике. Затем трансформированные клетки-хозяева культивируют и очищают. Клетки-хозяева культивируют в условиях обычной ферментации таким образом, что экспрессируют заданные соединения. Такие условия ферментации хорошо известны в технике. Наконец, пептиды очищают от культур хорошо известными в технике методами. Эти соединения можно также получать синтетическими методами. Например, можно использовать методы твердофазного синтеза. Соответствующие методы хорошо известны в технике и включают методы, описанные в Merrifield (1973), Chem. Polypeptides, p. 335-61 (Katsoyannis and Panayotis eds.);Young (1969), Solid Phase Peptide Synthesis; патент США. 3941763; Finn et al. (1976), The Proteins (3rd ed.) 2: 105-253; и Erickson et al. (1976), The Proteins (3rd ed.) 2: 257-527. Твердофазный синтез является предпочтительным методом получения индивидуальных пептидов, так как это самый рентабельный метод получения малых пептидов. Соединения, содержащие дериватизированные пептиды или содержащие непептидные группы,можно синтезировать хорошо известными в органической химии синтетическими методами. Применение соединений. Соединения по данному изобретению могут быть особенно полезны для лечения аутоиммунных заболеваний, опосредуемых B-клетками. В частности, соединения по данному изобретению могут применяться для лечения, предупреждения, ослабления, диагноза или прогноза волчанки, включая системную красную волчанку (SLE) и связанные с волчанкой заболевания и состояния. Другие предпочтительные показания включают опосредуемые B-клетками разновидности рака, включая B-клеточную лимфому. Соединения по данному изобретению можно также использовать для лечения воспаления суставов. Воспаления суставов представляют собой хронические заболевания суставов, которые поражают и делают нетрудоспособными, в различной степени, миллионы людей во всм мире. Ревматоидный артрит является заболеванием соединительных суставов, в которых хрящ и кость медленно разрушается под действием пролиферативной, инвазивной ткани, называемой паннус, образующейся из синовиальной мембраны. Заболевание может затрагивать околосуставные структуры, такие как сумки, оболочки сухожилий и оболочки, а также внесуставные ткани, такие как подкожный слой, сердечно-сосудистая система,лгкие, селезнка, лимфатические узлы, скелетные мышцы, нервная система (центральная и периферическая) и глаза (Silberberg (1985), Anderson's Pathology, Kissane (ed.), II: 1828). Остеоартрит представляет собой общее заболевание суставов, характеризующееся дегенеративными изменениями в соединительном хряще и реактивным разрастанием кости и хряща вокруг сустава. Остеоартрит является опосредуемым клетками активным процессом, который может возникать в результате неадекватной реакции хондроцитов на катаболические и анаболические раздражители. Как сообщают, на ранней стадии остеоартрита происходят изменения в некоторых молекулах скелета соединительного хряща (Thionar et al. (1993),Rheumatic disease clinics of North America, Moskowitz (ed.), 19: 635-657 и Shinmei et al. (1992), ArthritisRheum., 35: 1304-1308). Полагают, что TALL-1, TALL-1R и их модуляторы применимы для лечения этих и родственных состояний. Соединения по данному изобретению можно также применять при лечении ряда других заболеваний и состояний, включая острый панкреатит;ALS; болезнь Альцгеймера; астму; атеросклероз; аутоиммунную гемолитическую анемию; рак, в особенности разновидности рака, связанные с B-клетками; кахексию/анорексию; синдром хронической усталости; цирроз (например, первичный билиарный цирроз печени); диабет; лихорадку; гломерулонефрит, включая IgA гломерулонефрит и первичный гломерулонефрит; синдром Гудпасчера; синдром Гийена-Барре-Штроля; гомологичную болезнь; тиреоидит Хашимото; геморрагический шок; гипералгезию; воспалительное заболевание кишечника; воспаления сустава, включая остеоартрит, псориазный артрит и ревматоидный артрит;- 19010435 воспаления, возникающие в результате деформации, растяжения, поражения хряща, травмы, ортопедической хирургической операции, инфекции или других болезненных процессов; инсулинзависимый сахарный диабет; ишемическое поражение, включая церебральную ишемию (например, поражение мозга в результате травмы, эпилепсию, кровотечение или удар, каждый из которых может привести к нейродегенерации); ухудшение учбы; болезни лгких (например, РДСВ (ARDS; множественную миелому; рассеянный склероз; тяжлую псевдопаралитическую миастению; миелогенные (например, AML и CML) и другие виды лейкоза; миопатию (например, метаболизм белка в мышцах, особенно при сепсисе); нейротоксичность (например, вызываемую ВИЧ); остеопороз; боль; болезнь Паркинсона; пузырчатку; полимиозит/дерматомиозит; воспаление лгких, включая аутоиммунное лгочное заболевание; преждевременные роды; псориаз; болезнь Рейтера; поражение при реперфузии; септический шок; побочное действие лучевой терапии; синдром Шегрена; нарушение сна; временное заболевание височно-нижнечелюстного сустава; тромбоцитопению, включая идиопатическую тромбоцитопению и аутоиммунную тромбоцитопению новорожднных; метастазы при опухоли; увеит и васкулит. Соединения по данному изобретению можно вводить самостоятельно или в комбинации с терапевтически эффективным количеством других лекарственных веществ, включая анальгетики, противоревматические лекарственные препараты, облегчающие течение болезни (DMARD), нестероидные противовоспалительные лекарственные препараты (НСПВП, NSAID) и любые иммунные модуляторы и/или модуляторы воспалительных процессов. Так, соединения по данному изобретению можно вводить с модуляторами или другими членами семейства TNF/рецепторы TNF, включая антагонисты TNF,такие как этанерцепт (Enbrel), sTNF-RI, онерцепт (onercept), D2E7 и Remicade; модуляторами фактора роста нервной ткани (NGF); ингибиторами IL-1, включая молекулы IL-1ra, такие как анакинра и молекулы открытых позднее IL1Hy1 и IL-1Hy2; молекулы для "улавливания" IL-1, описанные в патенте США 5844099, выданном 1 декабря 1998 г.; антитела к IL-1; солюбилизированный рецептор IL-1 и т.п.; ингибиторами IL-6 (например, антителами к IL-6); ингибиторами IL-8 (например, антителами к IL-8); ингибиторами IL-18 (например, IL-18 связывающим белком, солюбилизированным IL-18 рецептором или антителами к IL-18); модуляторами интерлейкин-1 - превращающего фермента (ICE); инсулиноподобными факторами роста (IGF-1, IGF-2) и их модуляторы; трансформирующим фактором роста(TGF-, ТФР-), членами семейства TGF- и модуляторамиTGF-; факторами роста фибробластов FGF-1-FGF-10 и модуляторами FGF; остеопротегерином (OPG), аналогами OPG, остеопротективными агентами и антителами к OPGлиганду (OPG-L); костными анаболическими агентами, такими как паратиреоидный гормон (РТН), фрагментами РТН и молекулами, включающими фрагменты РТН (например, РТН (1-34)-Fc); антагонистами PAF; фактором роста кератиноцитов (KGF), KGF-родственными молекулами (например, KGF-2) и модуляторами KGF; ингибиторами COX-2, такими как Celebrex и Vioxx;- 20010435 аналогами простагландинов (например, простагландины группы Е); модуляторами матриксных металлопротеиназ (ММР); модуляторами синтазы оксида азота (NOS), включая модуляторы индуцибельной NOS; модуляторами глюкокортикоидного рецептора; модуляторами глутаматного рецептора; модуляторами уровней липополисахаридов (LPS); п ротивораковые агенты, включая ингибиторы онкогенов (например, fos, jun). Фармацевтические композиции Общие замечания. Настоящее изобретение также включает способы применения фармацевтических композиций соединений по изобретению. Такие фармацевтические композиции могут применяться в виде инъекций или в виде форм для орального, лгочного, назального, трансдермального или других способов введения. В целом данное изобретение охватывает фармацевтические композиции, содержащие эффективные количества соединения по изобретению вместе с фармацевтически приемлемыми растворителями (разбавителями), консервантами, солибюлизирующими веществами, эмульгаторами, адъювантами и/или носителями. Такие композиции включают разбавители, содержащие различные буферные системы (например, Tris-HCl, ацетат, фосфат), имеющие различное значение pH и различную ионную силу; добавки,такие как детергенты и солюбилизирующие агенты (например, Tween 80, Polysorbate 80), антиоксиданты(например, аскорбиновая кислота, метабисульфит натрия), консерванты (например, тимерсол, бензиловый спирт) и наполнители (например, лактоза, маннит); включение материала в конкретные препараты полимерных соединений, такие как полимер молочной кислоты, полигликолевая кислота, или в липосомы. Можно применять гиалуроновую кислоту, это может вызвать пролонгированное действие в процессе кровообращения. Такие композиции могут влиять на физическое состояние, стабильность, скорость высвобождения in vivo и скорость in vivo клиренса белков и производных по данному изобретению. См.,например, Remington's Pharmaceutical Sciences, 18th Ed. (1990, Mack Publishing Co., Easton PA 18042),p. 1435-1712, которые вводятся в данное описание в качестве ссылки во всей полноте. Композиции можно приготовить в жидкой форме или в виде сухого порошка, например в лиофилизированной форме. Также рассматриваются имплантируемые препараты пролонгированного действия в качестве трансдермальных препаратов. Оральные лекарственные формы. В данном описании рассматриваются оральные тврдые лекарственные формы, общее описание которых датся в главе 89 Remington's Pharmaceutical Sciences (1990), 18th Ed., Mack Publishing Co., EastonPA 18042, которая вводится в данное описание в качестве ссылки во всей полноте. Тврдые лекарственные формы включают таблетки, капсулы, пилюли, пастилки или лепшки, крахмальные облатки или гранулы. Также композиции по данному изобретению можно готовить инкапсулированием в липосомы или в протеиноиды (например, в виде протеиноидных микросфер, описанных в патенте США 4925673). Можно применять липосомное инкапсулирование и липосомы могут быть дериватизированы с помощью различных полимеров (см., например, патент США 5013556). Описание возможных тврдых лекарственных форм для применения в терапии дано в главе 10 книги Marshall, K., Modern Pharmaceutics (1979),под редакцией G.S. Banker и C.T. Rhodes, которая вводится в данное описание в качестве ссылки во всей полноте. Как правило, препарат включает соединение по изобретению и инертные ингредиенты, которые способствуют защите от желудочной среды и высвобождению биологически активного вещества в кишечнике. Также конкретно рассматриваются оральные лекарственные формы вышеуказанных соединений по изобретению. Необходимо, чтобы соединения были химически модифицированы, так чтобы доставка через рот была эффективной. В целом, рассматриваемая химическая модификация представляет собой такое связывание по меньшей мере одного фрагмента с самой молекулой, которое способствует (а) ингибированию протеолиза и (б) попаданию (всасывание) в кровоток из желудка или кишечника. Желательным также является повышение общей стабильности соединения и повышение времени циркуляции в организме. Также для этой цели можно применять фрагменты (частицы), используемые в качестве ковалентно связанных носителей по данному изобретению. Примеры таких частиц включают ПЭГ, сополимеры этиленгликоля и пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт,поливинилпирролидон и полипролин. См., например, Abuchovski and Davis, Soluble Polymer-Enzyme Adducts, Enzymes as Drugs (1981), Hocenberg and Roberts, eds., Wiley-Interscience, New York, NY, p. 367-83;Newmark, et al. (1982), J. Appl. Biochem. 4; 185-9. Другими полимерами, которые можно использовать,являются поли-1,3-диоксолан и поли-1,3,6-тиоксокан. Предпочтительными для применения в фармацевтике, как указывается выше, являются фрагменты ПЭГ. Для пероральной доставки лекарственных форм можно также применять соль модифицированной алифатической аминокислоты, такой как N-(8-[2-гидроксибензоил]амино)каприлат (SNAC), в качестве носителя для повышения всасывания терапевтических соединений по данному изобретению. Клиническая эффективность препарата гепарина, содержащая SNAC, продемонстрирована в фазе II исследования, проводимого Emisphere Technologies. См. патент США 5792451 "Композиции и методы для(пер)оральной доставки лекарственных веществ". Соединения по данному изобретению могут включаться в препарат в качестве тонких микрочастиц в форме гранул или шариков размером частиц около 1 мм. Материал для введения в виде капсул можно готовить в виде порошка, слегка прессованной порошковой массы или даже в виде таблеток. Терапевтический препарат можно приготовить прессованием. Также могут быть включены красители и вкусовые добавки. Например, можно приготовить белок(или производное) (например, для инкапсулирования в липосомы или микросферы), а затем добавить в пищевой продукт, такой как охлажднный напиток, содержащий красители и вкусовые добавки. Можно разбавить или увеличить объм соединения по изобретению, добавляя инертное вещество. Эти разбавители могут включать углеводы, в особенности маннит, -лактозу, безводную лактозу, целлюлозу, сахарозу, модифицированные декстраны и крахмал. В качестве наполнителей можно также использовать некоторые неорганические соли, включая трифосфат кальция, карбонат магния и хлорид натрия. Fast-Flo, Emdex, STA-Rx 1500, Emcompress и Avicell представляют собой некоторые промышленные разбавители. В терапевтический препарат в виде тврдой лекарственной формы можно включать дезинтегранты. Вещества, используемые в качестве дезинтегрантов, включают, но без ограничения, крахмал, в том числе промышленный дезинтегрант на основе крахмала, Explotab, "натрий крахмал гликолят", амберлит, натрий карбоксиметилцеллюлозу, "ультрамилопектин", альгинат натрия, желатин, апельсинную корку,кислую карбоксиметилцеллюлозу, природную губку и бентонит. Другую форму дезинтегрантов представляют нерастворимые катионообменные смолы. В качестве дезинтегрантов и связующих можно использовать порошкообразные смолы, такие как агар, камедь карайи или трагаканта. Также в качестве дезинтегрантов применимы альгиновая кислота и е натриевая соль. Для удерживания терапевтического агента в препарате в виде тврдой таблетки могут применяться связующие, которые включают вещества из природных продуктов, такие как акация, трагакант, крахмал и желатин. Другие связующие включают метилцеллюлозу (MC), этилцеллюлозу (EC) и карбоксиметилцеллюлозу (CMC). Для грануляции терапевтического препарата могут применяться спиртовые растворы как поливинилпирролидона (PVP), так и гидроксипропилметилцеллюлозы (HPMC). В состав терапевтического препарата может также входить антифрикционный агент для предотвращения слипания в процессе приготовления препарата. В качестве прослойки между лекарственным веществом и гладкой стенкой можно использовать смазки, смазки могут включать, но без ограничения: стеариновую кислоту, в том числе е кальциевую и магниевую соли, политетрафторэтилен (PTFE), жидкий парафин, растительные масла и воски. Также можно использовать растворимые смазки, такие как лаурилсульфат натрия, лаурилсульфат магния, полиэтиленгликоль различного молекулярного веса,Carbowax 4000 и 6000. Можно добавлять глиданты, которые могут улучшить свойства текучести лекарственного вещества в процессе приготовления препарата и способствуют перестройке в процессе прессования. Глиданты могут включать крахмал, тальк, пирогенный диоксид кремния и гидратированный алюмосиликат. Для того чтобы способствовать растворению соединения по данному изобретению в водной среде, в качестве смачивающего агента можно добавлять поверхностно-активное вещество. Поверхностноактивные вещества могут включать анионные детергенты, такие как лаурилсульфат натрия, диоктилсульфосукцинат натрия и диоктилсульфонат натрия. Можно вводить катионные детергенты; они могут включать бензалконийхлорид или бензэтония хлорид. Список потенциальных неионных детергентов,которые могут входить в состав препарата в качестве поверхностно-активных веществ, включает лауромакрогол 400, полиоксил 40 стеарат, полиоксиэтилен гидрогенизированное касторовое масло 10, 50 и 60,глицерина моностеарат, полисорбат 40, 60, 65 и 80, эфир сахарозы и жирной кислоты, метилцеллюлозу и карбоксиметилцеллюлозу. Эти поверхностно-активные вещества могут присутствовать в препарате белка или производного в виде смеси в различных соотношениях. В состав препарата можно также включать добавки для повышения всасывания соединения. Добавками, предположительно обладающими этими качествами, являются, например, жирные кислоты, олеиновая, линолевая и линоленовая кислоты. Может потребоваться препарат контролируемого действия. Соединение по данному изобретению можно вводить в инертную (основу) матрицу, которая делает возможным высвобождение либо по механизму диффузии, либо по механизму выщелачивания, например,смолы. В состав препарата можно также включать медленно разлагающиеся матрицы, например альгинаты, полисахариды. Другая форма контролируемого высвобождения соединений по данному изобретению представляет собой контролируемое высвобождение по методу на основе терапевтической системыOros (Alza Corp.), т.е. лекарственное вещество помещают в пространство, ограниченное полупроницаемой мембраной, что позволяет воде проходить внутрь через мембрану, а осмотического давление выталкивает лекарственное вещество через единственное маленькое отверстие. Некоторые энтеросолюбильные покрытия также обладают способностью к пролонгированному выделению. В препаратах можно применять другие покрытия. Эти покрытия включают ряд сахаров, которые можно помещать в кристаллизатор (чан) для нанесения покрытия. Терапевтический агент можно также назначать в виде таблетки с плночным покрытием, и материалы, используемые в этом случае, делятся- 22010435 на 2 группы. Первую группу составляют неэнтеросолюбильные вещества и включают метилцеллюлозу,этилцеллюлозу, гидроксиэтилцеллюлозу, метилгидроксиэтилцеллюлозу, гидроксипропилцеллюлозу,гидроксипропилметилцеллюлозу, натрий карбоксиметилцеллюлозу, провидон и полиэтиленгликоли. Вторая группа состоит из энтеросолюбильных материалов, которые обычно представляют собой эфиры фталевой кислоты. Для обеспечения оптимального плночного покрытия можно применять смесь материалов. Покрытие плнкой можно осуществлять в чане для нанесения покрытия, или в псевдоожиженном слое или прессованием. Формы для доставки через лгкие. Также в данном описании рассматривается доставка белка по изобретению (или его производных) через лгкие. Белок (или производное) доставляется в лгкие млекопитающего при вдыхании и проходит через эпителиальную выстилку в кровоток. Другие сообщения об этом включают: Adjei et al., Pharma. Res. (1990) 7: 565-9; Adjei et al. (1990), Internatl. J. Pharmaceutics 63: 135-44 (лейпролида ацетат); Braquet et al. (1989), J. Cardiovasc. Pharmacol. 13 (suppl. 5): s.143-146 (эндотелин-1); Hubbard et al. (1989), Annals Int. Med. 3: 206-12 (1-антитрипсин); Smith et al. (1989), J. Clin. Invest. 84: 1145-6 (1-протеиназа); Oswein et al. (Март 1990), "Aerosolization of Proteins", Proc. Symp. Resp.Immunol. 140: 3482-8 (интерферон- и фактор некроза опухолевых клеток ) и Platz et al., патент США 5284656 (гранулоцитарный колониестимулирующий фактор). С целью практического применения данного изобретения рассматривается большой ряд механических устройств для доставки терапевтических продуктов через лгкие, включая, но без ограничения,пульверизаторы (небулайзеры), ингаляторы для дозированных препаратов и порошковые ингаляторы,все они знакомы специалистам в данной области техники. Некоторые конкретные примеры промышленных устройств, применимых для практического применения по данному изобретению суть: ультрафиолетовый пульверизатор, выпускаемый Mallinckrodt, Inc., St. Louis, Missouri; пульверизатор Acorn II, выпускаемый Marquest Medical Products, Englewood, Colorado; ингалятор для дозированных препаратовVentolin, выпускаемый Glaxo Inc., Research Triangle Park, North Carolina; и порошковый ингалятор Spinhaler, выпускаемый Fisons Corp., Bedford, Massachusetts. Во всех этих устройствах требуется применение препаратов, пригодных для дозирования соединения по изобретению. Как правило, каждый препарат изготовляется конкретно для применяемого типа устройства и, помимо применимых в терапии разбавителей, адъювантов и/или носителей, может содержать газ-вытеснитель. С целью более эффективной доставки к дистальном лгким соединение по изобретению получают преимущественно в форме частиц со средним размером менее 10 мкм (или микрон), наиболее предпочтительно 0,5-5 мкм. Фармацевтически приемлемые носители включают углеводы, такие как трегалоза, маннит, ксилит,сахароза, лактоза и сорбит. Другие ингредиенты для применения в препаратах могут включать DPPC,DOPE, DSPC и DOPC. Могут применяться натуральные или синтетические поверхностно-активные вещества. Может применяться ПЭГ (даже помимо его применения для дериватизации белка или аналога). Могут применяться декстраны, такие как циклодекстран. Могут использоваться соли желчных кислот и другие родственные энхансеры. Могут применяться целлюлоза и производные целлюлозы. Для получения препаратов в буферной системе могут применяться аминокислоты. Рассматривается также применение липосом, микрокапсул или микросфер, комплексов включения или других типов носителей. Препараты, пригодные для применения в пульверизаторах, либо струйных, либо ультразвуковых,как правило, содержат соединение по изобретению, растворнное в воде с концентрацией около 0,1-25 мг биологически активного белка на 1 мл раствора. Препарат может также включать буфер и простой сахар(например, для стабилизации белка и регулирования осмотического давления). С целью уменьшения или предотвращения поверхностной агрегации белка, вызываемой распылением раствора в форме аэрозоля,препарат для пульверизатора может также содержать поверхностно-активное вещество. Составы для применения в ингаляторах для дозированных препаратов, как правило, содержат тонкодисперсный порошок, включающий соединение по изобретению, суспендированное в газе-вытеснителе с помощью поверхностно-активного вещества. В качестве газа-вытеснителя может быть любой обычный материал, применяемый для этой цели, такой как хлорфторуглерод, хлорфторуглеводород, фторуглеводород или углеводород, включая трихлорфторметан, дихлорфторметан, дихлортетрафторэтанол и 1,1,1,2-тетрафторэтан или их комбинации. Подходящие поверхностно-активные вещества включают в себя сорбитан триолеат и лецитин сои. В качестве поверхностно-активного вещества может также применяться олеиновая кислота. Препараты для дозирования с помощью порошкового ингалятора содержат тонкодисперсный сухой порошок, включающий соединение по изобретению; он также может включать наполнитель, такой как лактоза, сорбит, сахароза, маннит, трегалоза или ксилит, в количествах, которые способствуют распылению порошка из прибора в количестве, составляющем, например, 50-90% от веса препарата.- 23010435 Назальные формы доставки. Также рассматривается назальная доставка соединения по изобретению. Назальная форма доставки способствует прохождению белка непосредственно в кровоток после попадания терапевтического продукта в нос, при этом нет необходимости оседания продукта в лгких. Препараты для назальной доставки включают препараты с декстраном или циклодекстраном. Также рассматривается транспорт через слизистую оболочку. Дозировки. Схема прима лекарственного вещества по методу лечения вышеописанных состояний определяется лечащим врачом, принимающим во внимание факторы, которые модифицируют действие лекарственных веществ, например, возраст, состояние, вес тела, пол и диету пациента, тяжесть любой инфекции,время введения и другие применения факторы. Как правило, дневная доза составляет около 0,1-1000 мкг соединения по изобретению на килограмм веса тела, предпочтительно 0,1-150 мкг на 1 кг. Конкретные предпочтительные варианты изобретения Авторы изобретения определили предпочтительные структуры предпочтительных пептидов, перечисленные в табл. 4. Символ может представлять собой любой линкер, указанный в данном описании, или может просто обозначать нормальную пептидную связь (т.е. линкер отсутствует). Тандемные повторы и линкеры для ясности показаны разделнными тире. Таблица 4 Предпочтительные варианты изобретенияV1 обозначает Fc домен по определению выше в данном описании. Помимо последовательностей/структур, перечисленных в табл. 4, авторы изобретения дополнительно рассматривают гетеродимеры, в которых каждый тяж димера Fc связан с отличной пептидной последовательностью; например, в которых Fc связан с другой последовательностью, выбираемой из табл. 2. Все последовательности по данному изобретению можно получать методами, описанными в Международной заявке PCT WO 99/25044. Ниже данное изобретение дополнительно описывается следующими рабочими примерами, которые приводятся скорее в качестве иллюстрации, нежели для ограничения изобретения. Пример 1. Пептиды. Выбор пептидов методом фагового дисплея. 1. Получение на поверхности намагниченных бус.A. Иммобилизация Fc-TALL-1 на намагниченных бусах. Рекомбинантный белок Fc-TALL-1 иммобилизуют на бусах Protein A Dynabeads (Dynal) с концентрацией 8 мкг Fc-TALL-1 на 100 мкг исходных бусин от производителя. С помощью магнита бусины перемещают на одну сторону пробирки и пипеткой отбирают жидкость, бусы дважды отмывают забуференным фосфатом физиологическим раствором (PBS) и снова суспендируют в PBS. Белок Fc-TALL-1 добавляют к отмытым бусинам с вышеуказанной концентрацией и инкубируют при вращении в течение 1 ч при комнатной температуре. Бусы, покрытые Fc-TALL-1, затем блокируют, добавляя альбумин бычьей сыворотки (BSA) до конечной концентрации 1% и инкубируют в течение ночи при 4C при вращении,затем полученные в результате покрытые Fc-TALL-1 бусы дважды отмывают PBST (PBS с 0,05%Tween-20) перед тем, как подвергнуть их селекции.B. Приготовление бус для негативной селекции. Кроме того, готовят также бусы для негативной селекции. Для каждого условия пэннинга 250 мкл исходных бус от производителя подвергают вышеописанной процедуре (раздел 1A), за исключением того, что опускают стадию инкубации с Fc-TALL-1. На последней стадии отмывания бусы делят на пять аликвот по 50 мкл. 2. Селекция фага, связывающего TALL-1.A. Общая стратегия. Для селекции фагов используют две библиотеки нитчатых фагов, TN8-LX (5109 независимых трансформаций) и TN12-I (1,4109 независимых трансформаций) (Dyax Corp.). Элюцию каждой библиотеки проводят либо средой с pH 2, либо с помощью бусин (раздел 2 Е). Следовательно, для "проекта"TALL-1 используют четыре различных условия пэннинга (TN8-IX, элюция средой с pH 2; TN8-LX, элюция с применением бусин; TN12-I, элюция средой с pH 2; TN12-I, элюция с применением бусин). Для каждого условия используют три цикла селекции.B. Негативная селекция. Для каждого условия пэннинга из исходной библиотеки отбирают аликвоты около 100 экв. произвольной библиотеки (51011 бое для TN8-IX и 1.41011 бое для TN12-I) и разводят с помощью PBST до 300 мкл. После последнего отмывания жидкость удаляют из первой 50 мкл аликвоты бусин, приготовленной для негативной селекции (раздел 1B), к бусам прибавляют 300 мкл разведнного члена исходной библиотеки. Полученную смесь инкубируют в течение 10 мин при комнатной температуре при вращении. Супернатант с фагом отбирают с помощью магнита и добавляют во вторую аликвоту 50 мкл для второй стадии негативной селекции. Таким образом осуществляют пять стадий негативной селекции.C. Селекция с применением намагниченных бус, покрытых белком Fc-TALL-1. Супернатант с фагом после последней стадии негативной селекции (раздел 1B) добавляют к бусам,покрытым Fc-TALL-1, после последней стадии отмывания (раздел 1A). Эту смесь инкубируют при вращении в течение 2 ч при комнатной температуре, что делает возможным связывание специфического фага с нацеленным белком. Супернатант отбрасывают и бусы семь раз отмывают PBST.D. Элюция связанного фага средой с pH 2. После последней стадии отмывания (раздел 2C) связанные фаги элюируют с намагниченных бус,добавляя 200 мкл CBST (50 мМ цитрата натрия, 150 мМ хлорида натрия, 0,05% Tween-20, pH 2). После 5-минутной инкубации при комнатной температуре жидкость, содержащую элюированный фаг, отбирают и переносят в другую пробирку. Стадию элюции снова повторяют, добавляя 200 мкл CBST и инкубируя в течение 5 мин. Жидкость от двух стадий элюции объединяют и для нейтрализации pH добавляют 100 мкл 2 М раствора Tris (pH 8). Добавляют 500 мкл солей Min A (60 мМ K2HPO4, 33 мМ KH2PO4,7,6 мМ (NH4)SO4 и 1,7 мМ цитрата натрия), доводя конечный объм до 1 мл.E. Элюция с применением бус ("bead elution"). После последнего отмывания жидкость отбирают (раздел 2C), к бусам прибавляют 1 мл раствора солей Min A. Эту содержащую бусы смесь добавляют прямо в концентрированный образец бактерий для инфицирования (разделы 3A и 3B). 3. Амплификация.A. Приготовление препарата высеянных в плашки клеток. Свежую культуру Е.coli (XL-1 Blue MRF') выращивают до OD600=0,5 в среде LB, содержащей 12,5 мкг/мл тетрациклина. Для каждого условия пэннинга 20 мл этой культуры охлаждают льдом и центрифугируют. Осадок бактерий снова суспендируют в 1 мл раствора солей Min A.B. Трансдукция. Каждую смесь, получаемую различными методами элюции (разделы 2D и 2 Е), прибавляют в концентрированные образцы бактерий (раздел 3 А) и инкубируют при 37C в течение 15 мин. В каждую смесь добавляют 2 мл среды NZCYM (2X NZCYM, 50 мкг/мл ампициллина) и инкубируют в течение 15 мин. 4 мл полученного раствора помещают на большую NZCYM агаровую пластину, содержащую 50 мкл ампициллина, и инкубируют в течение ночи при 37C.C. Сбор (харвестинг) фага. Каждую из смесей бактерии/фаг, которую выращивают в течение ночи на большой NZCYM агаровой пластине (раздел 3 В), соскребают в 35 мл среды LB и агаровую пластину промывают ещ 35 мл среды LB. Полученную смесь бактерии/фаг центрифугируют, чтобы высадить бактерии. 50 мл супернатанта с фагом переносят в свежую пробирку, добавляют 12,5 мл раствора ПЭГ (20% ПЭГ 8000, 3,5 М ацетата аммония) и инкубируют на льду в течение 2 ч для преципитации фага. Осажднные фаги центрифугируют и снова суспендируют в 6 мл буфера для повторного суспендирования фага (250 мМ NaCl, 100 мМTris pH 8, 1 мМ EDTA). Этот раствор фага дополнительно очищают, центрифугированием удаляя оставшиеся бактерии, и осаждают фаг, добавляя 1,5 мл раствора ПЭГ. После стадии центрифугирования осадок фага снова суспендируют в 400 мкл PBS. Этот раствор центрифугируют последний раз, чтобы отделить оставшийся бактериальный дебрис. Полученный препарат фага титруют стандартным методом бляшкообразования (Molecular Cloning, Maniatis et al., 3rd Edition).- 25010435 4. Следующие два цикла селекции и амплификации. Во втором цикле амплифицированный фаг (10 бое) после первого цикла (раздел 3C) используют в качестве исходного фага для проведения стадий селекции и амплификации (разделы 2 и 3). В свою очередь амплифицированный фаг (1010 бое) после 2-го цикла используют в качестве исходного фага для проведения 3-го цикла селекции и амплификации (разделы 2 и 3). После стадий элюции (разделы 2D и 2E) 3-го цикла малую часть элюированного фага помещают на пластину для анализа бляшкообразования(раздел 3C). Отдельные бляшки собирают и помещают в 96-луночные титрационные микропланшеты,содержащие в каждой лунке 100 мкл буфера TE. Эти эталонные (master) планшеты инкубируют при 37C в течение 1 ч с целью осуществить элюцию фага в TE буфер. 5. Клональный анализ (анализ ELISA фага и секвенирование). Клоны фагов анализируют методами ELISA для фагов и секвенированием. Ранговое распределение последовательностей осуществляют исходя из результатов этих двух анализов.A. Анализ фага методом ELISA. Культуру XL-1 Blue MRF' выращивают до тех пор, пока OD600 не достигнет 0,5. Аликвоты по 30 мкл этой культуры помещают в каждую лунку 96-луночного титрационного микропланшета. В каждую лунку добавляют 10 мкл элюированного фага (раздел 4) и бактерии инфицируют в течение 15 мин при комнатной температуре. В каждую лунку добавляют 130 мкл среды LB, содержащей 12,5 мкг/мл тетрациклина и 50 мкг/мл ампициллина. Затем микротитрационный планшет инкубируют в течение ночи при 37C. Рекомбинантный TALL-1 белок (1 мг/мл в PBS) иммобилизуют на поверхности лунок 96 луночных планшетов Maxisorp (NUNC) в течение ночи при 4C. В качестве контроля рекомбинантный белок Fc-Trail иммобилизуют на поверхности отдельного планшета Maxisorp при такой же концентрации, что и белок TALL-1. На следующий день жидкости в планшетах Maxisorp с иммобилизованным белком сливают и каждую лунку блокируют 300 мкг 2% раствора BSA при 37C в течение 1 ч. Раствор BSA отбрасывают и лунки трижды отмывают раствором PBST. После последней стадии отмывания в каждую лунку планшетов Maxisorp с иммобилизованным белком добавляют 50 мкл PBST. Культуры (по 50 мкл) после выдерживания в течение ночи в 96-луночном микротитрационном планшете переносят в соответствующие лунки планшетов с иммобилизованным TALL-1, а также в лунки контрольных планшетов с иммобилизованным на их поверхности белком Fc-Trail. 100 мкл смеси в двух видах планшетов инкубируют в течение 1 ч при комнатной температуре. Жидкости из планшетов Maxisorp отбрасывают и лунки пять раз отмывают PBST. HRP-конъюгированное антитело против М-13 (Pharmacia) разводят до 1:7500, и в каждую лунку планшетов Maxisorp добавляют по 100 мкл разбавленного раствора, и инкубируют 1 ч при комнатной температуре. Жидкость снова отбрасывают и лунки семь раз отмывают PBST. Проводят цветную реакцию, в каждую лунку помещая 100 мкл субстрата тетраметилбензимидина (ТМВ) (Sigma), реакцию прекращают, прибавляя 50 мкл 5N раствора H2SO4. OD600 считывают с помощью планшетного ридера(Molecular Devices). В. Секвенирование фаговых клонов. Для каждого фагового клона методом PCR (ПЦР) получают матрицы для секвенирования. Для амплификации, примерно, 500 нуклеотидных фрагментов используют следующие пары олигонуклеотидов. праймер 1 (5'-CGGCGCAACTATCGGTATCAAGCTG-3') (SEQ ID NO: 56) и праймер 2 (5'-CATGTACCGTAACACTGAGTTTCGTC-3') (SEQ ID NO: 57) Следующие смеси получают для каждого клона. Для осуществления следующей программы: 94C в течение 5 мин; [94C 30 с, 55C 30 с, 72C 45 с]30 циклов; 72C в течение 7 мин; охлаждение до 4C используют термоблок (GeneAmp PCRSystem, Applied Biosystems). Продукт PCR контролируют хроматографией 5 мкл каждой PCR реакционной смеси на 1% агарозном геле. Продукт PGR в оставшихся 45 мкл каждой реакционной смеси очищают с помощью системы QIAquick Multiwell PCR Purification Kit (Quiagen) в соответствии с протоколом изготовителя. Полученный продукт затем секвенируют, используя секвенатор ABI 377 (Perkin-Elmer) в- 26010435 соответствии с протоколом, рекомендуемым изготовителем. 6. Ранговое распределение последовательностей и определение согласованной последовательности.A. Ранговое распределение последовательностей. Пептидные последовательности, транслируемые при использовании вариабельных нуклеотидных последовательностей (раздел 5B), коррелируют с данными ELISA. Клоны, показывающие высокое значение OD450 в луках с иммобилизованным TALL-1 и низкое значение OD450 в лунках с иммобилизованным Fc-Trail, рассматриваются как более важные. Также важными считаются последовательности,встречающиеся много раз. Исходя из этих критериев выбирают последовательности-"кандидаты" для дальнейшего анализа в качестве пептидов и "пептител". Пять и девять предположительно пригодных пептидных последовательностей отбирают из библиотек TN8-IX и TN12-I соответственно.B. Определение согласованной последовательности. Большинство последовательностей, выбираемых при использовании библиотеки TN12-I, содержат в высшей степени консервативный мотив DBL. Этот мотив также наблюдается в последовательностях,выбираемых при использовании библиотеки TN8-IX. Другой мотив, PFPWE (SEQ ID NO: 110), наблюдается также в последовательностях, получаемых на основе библиотеки TN8-IX. Консенсусный пептид, FHDCKWDLLTKQWVCHGL (SEQ ID NO: 58), определяют на основе мотива DBL. Так как пептиды, полученные при использовании библиотеки TN12-I, являются наиболее активными, первичную структуру верхних 26 пептидных последовательностей, выбранных на основе вышеуказанных критериев распределения по рангу (раздел 5A), определяют с помощью мотива DBL. Подчркнутую "аминокислотную последовательность ядра" получают, определяя аминокислоту, которая чаще всего встречается в каждом положении. Два цистеиновых остатка, прилегающих к "коровой" последовательности, являются фиксированными аминокислотами в библиотеке TN12-I. Остальную часть аминокислотной последовательности консенсусного пептида берут из одного из пептидо-"кандидатов",TALL-1-12-10 (табл. 2, SEQ ID NO: 37). Пептид и "пептитело", полученные на основе этой согласованной последовательности, являются наиболее активными в анализе пролиферации В-клеток. Пример 2. "Пептитела". Создают серию ингибирующих "пептител" 12 TALL-1 (табл. 5), в которых мономер каждого пептида слит в рамке считывания с областью Fc человеческого IgG1. Каждое ингибирующее "пептитело"TALL-1 конструируют отжигом пар олигонуклеотидов, показанных в табл. 6, с целью генерировать дуплекс, кодирующий пептид и линкер, состоящий из 5 остатков глицина и одного остатка валина, в виде фрагмента от NdeI до SalI. Эти дуплексные молекулы лигируют в вектор (pAMG21-RANK-Fc, представленный в данном описании), содержащий человеческий ген Fc, также расщепляемый с помощью NdeI иSalI. Полученные лигированные смеси трансформируют электропорацией в Е.coli штамм 2596 (GM221,представлен в данном описании). Клоны подвергают скринингу на способность продуцировать рекомбинантный белковый продукт и обеспечить правильную нуклеотидную последовательность при слиянии генов. Единичный такой клон выбирают для каждого из "пептител". Нуклеотидная и аминокислотная последовательности слитых белков показаны на фиг. 4 А-4F. Таблица 5 Пептидные последовательности и олигонуклеотиды, используемые для получения ингибирующих "пептител" TALL-1- 29010435 Таблица 6 Последовательности олигонуклеотидов, используемые для конструкции "пептител"
МПК / Метки
МПК: C12N 5/10, C07K 14/52, A61P 37/00, A61K 38/19, A61P 35/00, C12N 15/28, C07K 14/525
Метки: tall-1, связывающиеся, применение, молекулы
Код ссылки
<a href="https://eas.patents.su/30-10435-svyazyvayushhiesya-s-tall-1-molekuly-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Связывающиеся с tall-1 молекулы и их применение</a>
Предыдущий патент: Способ получения цитотоксических лимфоцитов
Следующий патент: Способ гомогенного гидрирования дикарбоновых кислот и/или их ангидридов
Случайный патент: Аттенуированный микроорганизм salmonella и способы его применения












