Препаративные формы оральных лекарственных форм мемантина с модифицированным высвобождением
Номер патента: 11446
Опубликовано: 27.02.2009
Авторы: Растоги Сунил К., Периклоу Антониа, Абрамовитц Ваттанапорн, Дедия Махендра Г., Рао Ниранджан, Махашабде Шашанк
Формула / Реферат
1. Твердая оральная лекарственная форма с модифицированным высвобождением, включающая:
(a) по меньшей мере один терапевтически активный ингредиент, выбранный из группы, состоящей из мемантина и фармацевтически приемлемой соли мемантина, и
(b) фармацевтически приемлемый полимерный носитель, оказывающий существенное воздействие на модификацию высвобождения указанного активного ингредиента, где полимерный носитель выбран из полимеров целлюлозы и их производных, включающих гидроксиметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу, полисахариды микрокристаллической целлюлозы и их производные, полиалкиленоксидов, полиэтиленгликолей, хитозана, поли(винилового спирта), ксантановой смолы, сополимеров малеинового ангидрида, поливинилпирролидона, крахмала и полимеров на основе крахмала, мальтодекстринов, поли(2-этил-2-оксазолина), полиэтиленимина, полиуретановых гидрогелей, поперечно-сшитых полиакриловых кислот, эфиров метакриловой кислоты, карбоксивиниловых эфиров и их производных, сополимеров, включающих блок-сополимеры и графт-сополимеры их полимеров и их комбинации, причем указанная лекарственная форма, замедляющая высвобождение указанного терапевтически активного агента от примерно 4 до примерно 24 ч после вхождения указанной лекарственной формы в среду применения, где указанная лекарственная форма имеет скорость растворения более чем примерно 80% после прохождения примерно от 6 до примерно 12 ч после указанного вхождения в среду применения.
2. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, где указанный активный ингредиент представляет собой мемантин гидрохлорид.
3. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, где скорость растворения более чем примерно 80% достигается примерно через 12 ч.
4. Твердая оральная лекарственная форма с модифицированным высвобождением по п.3, включающая активный ингредиент в количестве от примерно 1,0 до примерно 20% (мас./мас.).
5. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, где скорость растворения более чем примерно 80% достигается примерно через 6 ч.
6. Твердая оральная лекарственная форма с модифицированным высвобождением по п.5, где активный ингредиент присутствует в количестве от примерно 1,0 до примерно 35% (мас./мас.).
7. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, где полимерный носитель представляет собой полимерную матрицу.
8. Твердая оральная лекарственная форма с модифицированным высвобождением по п.7, где полимерная матрица представляет собой набухаемую матрицу и включает гидроксипропилметилцеллюлозу.
9. Твердая оральная лекарственная форма с модифицированным высвобождением по п.8, где скорость растворения более чем примерно 80% достигается примерно через 12 ч и где гидроксипропилметилцеллюлоза присутствует в количествах от примерно 50 до примерно 80% (мас./мас.).
10. Твердая оральная лекарственная форма с модифицированным высвобождением по п.8, где скорость растворения более чем примерно 80% достигается примерно через 6 ч и где гидроксипропилметилцеллюлоза присутствует в количествах от примерно 20 до примерно 70% (мас./мас.).
11. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, дополнительно включающая наполнитель.
12. Твердая оральная лекарственная форма с модифицированным высвобождением по п.11, где наполнитель представляет собой моногидрат лактозы.
13. Твердая оральная лекарственная форма с модифицированным высвобождением по п.12, где скорость растворения более чем примерно 80% достигается примерно через 12 ч и где моногидрат лактозы присутствует в количестве от примерно 5 до примерно 50% (мас./мас.).
14. Твердая оральная лекарственная форма с модифицированным высвобождением по п.12, где скорость растворения более чем примерно 80% достигается примерно через 6 ч и где моногидрат лактозы присутствует в количестве от примерно 5 до примерно 75% (мас./мас.).
15. Твердая оральная лекарственная форма с модифицированным высвобождением по п.11, где наполнитель представляет собой микрокристаллическую целлюлозу.
16. Твердая оральная лекарственная форма с модифицированным высвобождением по п.15, где микрокристаллическая целлюлоза присутствует в количестве от примерно 5 до примерно
80% (мас./мас.).
17. Твердая оральная лекарственная форма с модифицированным высвобождением по п.11, где наполнитель представляет собой дикальцийфосфат.
18. Твердая оральная лекарственная форма с модифицированным высвобождением по п.17, где дикальцийфосфат присутствует в количестве от примерно 7 до примерно 40% (мас./мас.).
19. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, дополнительно включающая смазывающий агент.
20. Твердая оральная лекарственная форма с модифицированным высвобождением по п.19, где смазывающим агентом является стеарат магния.
21. Твердая оральная лекарственная форма с модифицированным высвобождением по п.20, где скорость растворения более чем примерно 80% достигается примерно через 12 ч и где стеарат магния присутствует в количестве от примерно 0,8 до примерно 1,2% (мас./мас.).
22. Твердая оральная лекарственная форма с модифицированным высвобождением по п.20, где скорость растворения более чем примерно 80% достигается примерно через 6 ч и где стеарат магния присутствует в количестве от примерно 0,4 до примерно 0,6% (мас./мас.).
23. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, дополнительно включающая один или более компонентов, выбранных из группы, состоящей из носителей, эксципиентов, агентов против сцепления, наполнителей, стабилизирующих агентов, связывающих агентов, красящих веществ и смазывающих агентов.
24. Твердая оральная лекарственная форма с модифицированным высвобождением, включающая:
(a) от примерно 2,5 до примерно 20,0% (мас./мас.) мемантина гидрохлорида;
(b) от примерно 68 до примерно 77% (мас./мас.) гидроксипропилметилцеллюлозы;
(c) от примерно 6,9 до примерно 15% (мас./мас.) моногидрата лактозы;
(d) от примерно 0,8 до примерно 1,3% (мас./мас.) коллоидной двуокиси кремния;
(e) от примерно 3,0 до примерно 5,0% (мас./мас.) талька и
(f) от примерно 0,9 до примерно 1,1% (мас./мас.) стеарата магния;
где скорость растворения мемантина гидрохлорида более чем примерно 80% достигается примерно через 12 ч.
25. Твердая оральная лекарственная форма с модифицированным высвобождением, включающая:
(a) от примерно 5 до примерно 35% (мас./мас.) мемантина гидрохлорида;
(b) от примерно 54 до примерно 65% (мас./мас.) гидроксипропилметилцеллюлозы;
(c) от примерно 7 до примерно 24% (мас./мас.) моногидрата лактозы;
(d) от примерно 0,8 до примерно 1,3% (мас./мас.) коллоидной двуокиси кремния;
(e) от примерно 3,0 до примерно 5,0% (мас./мас.) талька и
(f) от примерно 0,4 до примерно 0,6% (мас./мас.) стеарата магния;
где скорость растворения мемантина гидрохлорида более чем примерно 80% достигается примерно через 6 ч.
26. Твердая оральная лекарственная форма с модифицированным высвобождением, включающая:
(a) от примерно 5 до примерно 35% (мас./мас.) мемантина гидрохлорида;
(b) от примерно 54 до примерно 65% (мас./мас.) гидроксипропилметилцеллюлозы;
(c) от примерно 7 до примерно 40% (мас./мас.) микрокристаллической целлюлозы;
(d) от примерно 0,8 до примерно 1,3% (мас./мас.) коллоидной двуокиси кремния;
(e) от примерно 3,0 до примерно 5,0% (мас./мас.) талька и
(f) от примерно 0,4 до примерно 0,6% (мас./мас.) стеарата магния;
где скорость растворения мемантина гидрохлорида более чем примерно 80% достигается примерно через 6 ч.
27. Твердая оральная лекарственная форма с модифицированным высвобождением, включающая:
(a) от примерно 5 до примерно 35% (мас./мас.) мемантина гидрохлорида;
(b) от примерно 54 до примерно 65% (мас./мас.) гидроксипропилметилцеллюлозы;
(c) ют примерно 7 до примерно 40% (мас./мас.) дикальцийфосфата;
(d) от примерно 0,8 до примерно 1,3% (мас./мас.) коллоидной двуокиси кремния;
(e) от примерно 3,0 до примерно 5,0% (мас./мас.) талька и
(f) от примерно 0,4 до примерно 0,6% (мас./мас.) стеарата магния;
где скорость растворения мемантина гидрохлорида более чем примерно 80% достигается примерно через 6 ч.
28. Твердая оральная лекарственная форма с модифицированным высвобождением по любому из пп.24-27, где указанная твердая оральная лекарственная форма с модифицированным высвобождением представляет собой таблетку.
29. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, где скорость растворения, проявляемая указанной твердой оральной лекарственной формой с модифицированным высвобождением, примерно через 1 ч составляет по меньшей мере от примерно 10 до примерно 25%.
30. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, где скорость растворения, проявляемая указанной твердой оральной лекарственной формой с модифицированным высвобождением, через примерно от 2 до примерно 6 ч составляет по меньшей мере от примерно 30 до примерно 60%.
31. Применение лекарственной формы по п.1 для лечения легкой, умеренной или тяжелой деменции Альцгеймера.
32. Применение лекарственной формы по п.1 для лечения невропатической боли.
33. Способ лечения расстройства, выбранного из группы, состоящей из легкой, умеренной или тяжелой деменции Альцгеймера и невропатической боли, включающий введение твердой оральной лекарственной формы с модифицированным высвобождением по п.1.
34. Способ по п.33, где указанную лекарственную форму вводят 1 раз/день.
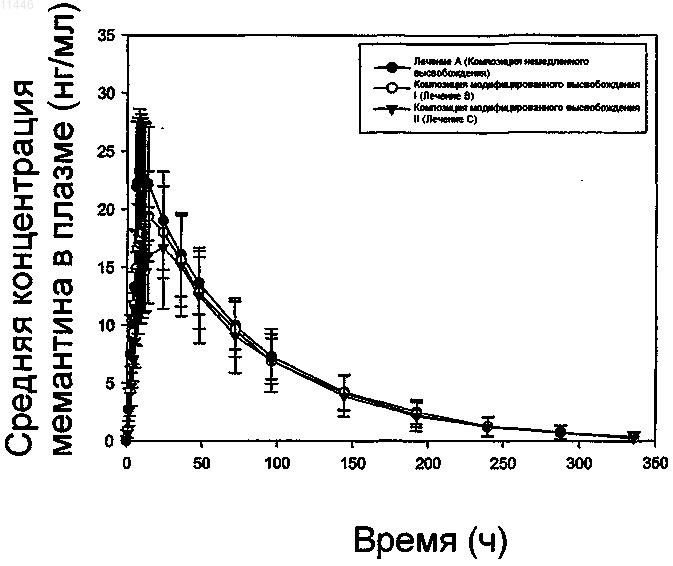
Текст
011446 Перекрестная ссылка на родственные заявки Согласно 119 35 Свода законов США по заявке на данное изобретение заявляется приоритет на основании предварительной заявки на патент США 60/581242, поданной 17 июня 2004 г., которая полностью включена сюда в качестве ссылки. Область техники, к которой относится изобретение Настоящее изобретение относится к фармацевтическим, твердым оральным лекарственным формам, которые проявляют модифицированный профиль высвобождения. Изобретение, в частности, подходит для твердых оральных лекарственных форм, пригодных для приема один раз в день, в которых активным ингредиентом является мемантин, высвобождающих терапевтически эффективное количество активного ингредиента в течение продолжительного периода времени. Описание предшествующего уровня техники Твердые оральные лекарственные композиции или препараты имеют различные профили высвобождения, такие как модифицированный или продолжительный профиль высвобождения, как указано вXXIII Фармакопее США (CDER, FDA, Rockville, MD), или профиль немедленного высвобождения, как указано в руководстве FDA (Федеральной Администрации пищевых продуктов и лекарственных средств США) (Dissolution Testing of Immediate Release Solid Oral Dosage Forms, issued 8/1997, Section IV-A). Например, в руководстве по тестированию профилей модифицированного высвобождения материал растворяется в течение продолжительного периода, и его растворение измеряется в течение времени. Рекомендуется минимум 3 точки времени, и они должны охватить раннюю, среднюю и позднюю стадии профиля растворения. Последнее измерение следует производить в точке времени, когда растворено по меньшей мере 80% препарата (Guidance for Industry, "Extended Release Oral Dosage Forms: Development,Evaluation, and Application of In Vitro/In Vivo Correlations", Food and Drug Administration, CDER,September 1997, p. 17). Адекватное взятие проб следует выполнять, например, через 1, 2 и 4 ч и затем через каждые 2 ч до тех пор, пока не произойдет высвобождение 80% препарата (Guidance for Industry,"SUPAC-MR: Modified Release Solid Oral Dosage Forms", Food and Drug Administration, CDER, September 1997, p. 6). Предпочтительное устройство для определения растворения представляет собой аппарат по Фармакопее США I (барабанный) или II (лопастной), используемые при установленных в руководствах скоростях вращения, например 100 об/мин для (Guidance for Industry, "Extended Release Oral DosageForms: Development, Evaluation, and Application of In Vitro/In Vivo Correlations", Food and Drug Administration, CDER, September 1997, p. 4). Твердые оральные лекарственные формы модифицированного высвобождения обеспечивают возможность длительного высвобождения активного ингредиента в течение продолжительных периодов времени с целью поддержания терапевтически эффективных уровней в плазме в течение аналогично продолжительных интервалов времени и/или для модификации других фармакокинетических свойств активного ингредиента. Твердые лекарственные формы немедленного высвобождения обеспечивают возможность высвобождения большей части или всего активного ингредиента в течение короткого периода времени, например 60 мин или менее, и делают возможным быстрое всасывание препарата. Многофазный профиль высвобождения (т.е. композицию, содержащую по меньшей мере одну препаративную форму немедленного высвобождения и по меньшей мере одну препаративную форму модифицированного высвобождения) можно использовать для получения одной или более комбинаций скоростей высвобождения для достижения более специфических терапевтический целей, например немедленного высвобождения части препарата с последующим продолжительным высвобождением. Однако модулирование скорости высвобождения активного ингредиента необязательно обеспечивает то, что будет обеспечено систематическое достижение длительно сохраняющихся концентраций, создающих эффективные уровни в крови, или что фармакологический эффект будет основываться исключительно на высвобождение препарата. Стало появляться все большее количество препаративных форм лекарственных средств замедленного высвобождения. Это особенно справедливо, когда определенный препарат является относительно растворимым. Для предоставления препаративной формы с замедленным высвобождением растворимых лекарственных средств использовались различные методики составления препаративных форм. Во многих таких препаративных формах содержащая лекарственное средство частица покрыта одним или более задерживающих высвобождение слоев или пленок или диспергирована внутри непрерывной матрицы,такой как полимерная матрица. Слой покрытия или матрица включает относительно нерастворимый материал или материалы, и высвобождение лекарственного средства регулируется посредством сопротивления слоя покрытия или матрицы диффузии лекарственного средства через нее. Высвобождение лекарственного средства из таких препаративных форм приводится в действие, например, градиентом концентрации лекарственного средства в результате проникновения, например, желудочного сока в препаративную форму путем диффузии. Можно использовать один или более образующих пленку полимеров для обеспечения замедленного высвобождения активного вещества путем регулирования скорости диффузии через пленочный барьер(ы). Однако такой подход компрометируется, если во время приема внутрь оральной лекарственной формы пленка преждевременно разрушается, например жеванием, расщеплением или абразией, высво-1 011446 бождая посредством этого избыточное количество активного ингредиента, что может привести к нежелательным эффектам от избыточного однократного выброса при высвобождении лекарственного средства и неспособности лекарственной формы оставаться эффективной в течение требуемого периода времени. При более распространенном подходе к высвобождению, регулируемому матрицей, используются липофильные вещества, например высшие спирты, воски или нерастворимые термопластические материалы. Высвобождение регулируется скоростью диффузии активного ингредиента в окружающую среду и, если сама матрица является разрушаемой, скоростью ее разрушения. Один из недостатков состоит в том, что полное высвобождение препарата из матрицы на практике часто не достигается. Другой недостаток состоит в том, что пропорциональность дозы лекарственных форм нелегко достичь, что, таким образом, требует различных композиций для различной силы действия. Таким образом, композиция матрицы для составления 20 мг лекарственной формы замедленного высвобождения может значительно отличаться от матричной композиции для составления 40 мг лекарственной формы пролонгированного высвобождения. В патенте США 5382601 представлены твердые фармацевтические лекарственные формы, содержащие мемантин, которые проявляют длительный двухфазный профиль высвобождения, причем часть препарата высвобождается немедленно, с последующим пролонгированным высвобождением остального препарата. Матрица этой препаративной формы содержит растворимую в воде и нерастворимую в воде соль казеина, предпочтительно казеинат натрия и кальция. Однако казеин имеет неприятный вкус, он связан с нежелательным эффектом возникновения некоторых побочных эффектов, как раскрыто в патенте США 6413556, и проявляет нестабильность при меняющемся рН. Другая проблема, связанная с казеином, представляет собой возможность заражения коровьим губчатым энцефалитом (BSE), поскольку казеин представляет собой белок, полученный из молока животных. Общий способ модифицированного высвобождения антагонистов рецепторов N-метил-D-аспартата(NMDA) был описан в патенте США 6194000. Этот способ также включает получение компонента немедленного высвобождения и компонента модифицированного высвобождения для получения конечной препаративной формы. В патенте раскрыта гранула (не шарик), состоящая из покрытой сердцевины,причем покрытие представляет собой любое подходящее покрытие с использованием систем на основе органических растворителей. Однако не все антагонисты NMDA действуют одинаковым образом, и в этом патенте конкретно не описываются композиции, содержащие мемантин. В настоящее время применяется схема введения мемантина 2 раза/день с использованием таблеток немедленного высвобождения. Это может быть нежелательно, потому что соблюдение пациентом предписанной схемы лечения уменьшается по мере увеличения частоты приема препарата. Более того, введение таблетки немедленного высвобождения может привести к большей частоте побочных явлений ввиду более высокой скорости всасывания. Для лечения боли очень важно поддерживать облегчение боли без дополнительного дискомфорта. Поэтому имеется существующая и постоянная потребность в вводимой 1 раз/день препаративной форме модифицированного высвобождения, содержащей мемантин или фармацевтически приемлемую соль мемантина с надежным более медленным всасыванием в течение целевого периода времени. Краткое описание сущности изобретения В соответствии с изобретением в настоящее время было обнаружено, что мемантин и его соли,включая гидрохлорид, а также другие фармацевтически приемлемые соли мемантина, могут составляться в форму модифицированного высвобождения с ожидаемыми улучшениями переносимости. Препаративная форма по настоящему изобретению включает мемантин или его фармацевтически приемлемую соль, фармацевтически приемлемый носитель (покрытие и/или матрицу), который играет существенную роль в модификации высвобождения мемантина, и один или более эксципиентов для введения в оральной лекарственной форме, вводимой 1 раз/день. В частности, настоящее изобретение предоставляет лекарственную форму, которая медленно высвобождает активный агент при скорости высвобождения по меньшей мере от примерно 70 до примерно 80% через примерно от 4 до примерно 24 ч после вхождения лекарственной формы в среду применения. В одном варианте осуществления лекарственная форма высвобождается в этой степени в течение 6 ч от момента вхождения в среду применения, например в желудочные жидкости. Альтернативно, лекарственная форма высвобождается в этой степени в течение 12 ч от момента вхождения в среду применения. Для препаративной формы 12-часового высвобождения по меньшей мере 70%, предпочтительно по меньшей мере 80% активного ингредиента, например мемантина гидрохлорида, высвобождается примерно через 12 ч после вхождения в среду применения, но не до этого времени. В 12-часовой оральной лекарственной форме по настоящему изобретению активный ингредиент обычно присутствует в количествах от примерно 1,0 до примерно 20% (мас./мас.), предпочтительно от примерно 1,6 до примерно 20,0% (мас./мас.), наиболее предпочтительно от примерно 2,5 до примерно 20,0% (мас./мас.). Альтернативно, активный ингредиент можно измерять в виде 1 мг на таблетку в диапазоне от примерно 5 до примерно 80 мг/таблетку. Предпочтительно таблетки содержат 7, 10, 20, 28, 40 или 80 мг активного ингредиента. Альтернативно, количество активного ингредиента при применении капсул может составлять до 100 мг.-2 011446 Для препаративной формы 6-часового высвобождения по меньшей мере 70%, предпочтительно по меньшей мере 80% активного ингредиента, например мемантина гидрохлорида, высвобождается примерно через 6 ч после вхождения в среду применения, но не до этого времени. В 6-часовой оральной лекарственной форме по настоящему изобретению активный ингредиент обычно присутствует в количествах от примерно 1,0 до примерно 35% (мас./мас.), предпочтительно от примерно 1,6 до примерно 35,0% (мас./мас.), наиболее предпочтительно от примерно 5,0 до примерно 35,0% (мас./мас.). Поэтому активный ингредиент должен присутствовать в количестве от примерно 5 до примерно 80 мг на таблетку. Предпочтительно таблетки содержат 7, 10, 20, 28, 40 или 80 мг активного ингредиента. В одном варианте осуществления настоящего изобретения полимерный носитель представляет собой полимерную матрицу. Предпочтительно полимерная матрица представляет собой способную к набуханию матрицу, которая содержит гидроксипропилметилцеллюлозу. Гидроксипропилметилцеллюлоза в 12-часовых препаративных формах присутствует в количествах от примерно 50 до примерно 80% (мас./мас.), предпочтительнее в количествах от примерно 68 до примерно 77% (мас./мас.) В 6-часовых препаративных формах гидроксипропилметилцеллюлоза присутствует в количествах от примерно 20 до примерно 70% (мас./мас.), предпочтительно от примерно 54 до примерно 65% (мас./мас.). Препаративные формы по настоящему изобретению могут, кроме того, включать наполнитель. В одном варианте осуществления лекарственные формы содержат моногидрат лактозы в качестве наполнителя. В 12-часовых препаративных формах моногидрат лактозы присутствует в количествах от примерно 5 до примерно 50% (мас./мас.), предпочтительнее от примерно 5 до примерно 25% (мас./мас.), наиболее предпочтительно от примерно 6,9 до примерно 15% (мас./мас.). В 6-часовых препаративных формах моногидрат лактозы присутствует в количествах от примерно 5 до примерно 80% (мас./мас.), предпочтительнее от примерно 5 до примерно 71% (мас./мас.), наиболее предпочтительно от примерно 7 до примерно 24% (мас./мас.). В другом варианте осуществления лекарственные формы содержат микрокристаллическую целлюлозу в качестве наполнителя в количествах от примерно 5 до примерно 80% (мас./мас.), предпочтительнее от примерно 5 до примерно 71% (мас./мас.), наиболее предпочтительно от примерно 7 до примерно 40% (мас./мас.). В еще одном варианте осуществления лекарственные формы содержат дигидрофосфат кальция в качестве наполнителя в количествах от примерно 5 до примерно 80% (мас./мас.), предпочтительнее от примерно 5 до примерно 71% (мас./мас.), наиболее предпочтительно от примерно 7 до примерно 40% (мас./мас.). Препаративные формы по настоящему изобретению могут, кроме того, включать смазывающий агент, предпочтительно стеарат магния. В 12-часовых препаративных формах стеарат магния присутствует в количествах в диапазоне от примерно 0,8 до примерно 1,2% (мас./мас.), предпочтительнее от примерно 0,9 до примерно 1,1% (мас./мас.). В 6-часовых препаративных формах стеарат магния присутствует в количествах в диапазоне от примерно 0,4 до примерно 0,6% (мас./мас.), предпочтительнее в количестве примерно 0,5% (мас./мас.). Препаративные формы по настоящему изобретению могут также содержать один или более дополнительных носителей, эксципиентов, наполнителей, стабилизирующих агентов, связывающих веществ,красящих веществ, глидантов и смазывающих агентов. Краткое описание чертежей На фиг. 1 показаны величины скорости растворения наращиваемых партий 10, 20 и 40 мг таблеток мемантина HCl после 6 месяцев условий хранения при 40 С/75% относительной влажности. Растворение показано в виде процентного, растворенного в течение времени (ч). Незаштрихованный ромб представляет содержание 40 мг; незаштрихованный квадрат представляет содержание 20 мг и незаштрихованный треугольник представляет содержание 10 мг. Эти незаштрихованные формы представляют измерения через 6 месяцев. Соответствующие заштрихованные формы представляют исходные измерения. На фиг. 2 показаны величины скорости растворения наращиваемых партий 10, 20 и 40 мг таблеток мемантина HCl после 6 месяцев условий хранения при 40 С/75% относительной влажности. Растворение показано в виде процентного содержания, высвободившегося в течение времени (ч). Незаштрихованный ромб представляет содержание 40 мг; незаштрихованный квадрат представляет содержание 20 мг и незаштрихованный треугольник представляет содержание 10 мг. Эти незаштрихованные формы представляют измерения через 6 месяцев. Соответствующие заштрихованные формы представляют исходные измерения. На фиг. 3 показана стабильность профилей растворения в препаративной форме 6-часового высвобождения до 6 месяцев при 4 0 С/75% относительной влажности. Профили растворения показывают процентную долю растворенного препарата для различных партий в течение времени (ч). Прошедший срок хранения каждого образца указан на фиг. 3. На фиг. 4 показана стабильность профилей растворения в препаративной форме 12-часового высвобождения до 6 месяцев при 40 С/75% относительной влажности. Профили растворения показывают процентную долю растворенного препарата для различных партий в течение времени (ч). Прошедший срок-3 011446 хранения каждого образца указан на фиг. 4. На фиг. 5 изображены средние концентрации мемантина в плазме после введения 20 мг таблеток модифицированного высвобождения, в сравнении с двумя 10 мг таблетками немедленного высвобождения, введенными с интервалом 4 ч молодым здоровым мужчинам и женщинам в течение времени (ч). Лечение А (заштрихованные кружки) представляет препаративную форму немедленного высвобождения. Лечение В (незаштрихованный кружок) представляет препаративную форму модифицированного высвобождения. Лечение С (перевернутый треугольник) также представляет препаративную форму модифицированного высвобождения. На фиг. 6 изображены средние концентрации мемантина в плазме после введения 20 мг таблеток модифицированного высвобождения по настоящему изобретению и двух 10 мг таблеток немедленного высвобождения, введенных с интервалом 4 ч молодым здоровым мужчинам и женщинам в течение времени (ч). Лечение А (заштрихованные кружки) представляют препаративную форму немедленного высвобождения. Лечение В (незаштрихованный кружок) представляет препаративную форму модифицированного высвобождения. Лечение С (перевернутый треугольник) также представляет препаративную форму модифицированного высвобождения. На фиг. 7 изображен усеченный 24-часовой профиль средних концентраций мемантина в плазме после введения 20 мг таблеток мемантина модифицированного высвобождения по настоящему изобретению, в сравнении с двумя 10 мг таблетками препаративной формы немедленного высвобождения, введенными с интервалом 4 ч молодым здоровым мужчинам и женщинам. Лечение А (заштрихованные кружки) представляют препаративную форму немедленного высвобождения. Лечение В (незаштрихованный кружок) представляет препаративную форму модифицированного высвобождения. Лечение С(перевернутый треугольник) также представляет препаративную форму модифицированного высвобождения. На фиг. 8 показана связанная с дозой пропорциональность растворения препарата с течением времени (ч) для таблеток мемантина 10 мг (точки данных X), 20 мг (кольцевые точки данных) и 40 мг (ромбовидные точки данных) модифицированного высвобождения. Таблетка 10 мг представляет собой таблетку круглой формы, тогда как таблетки 20 и 40 мг представляют собой таблетки овальной формы. Форма таблетки имеет решающее значение для получения желательных характеристик диффузии. На фиг. 9 представлены данные растворения в виде процентной доли препарата, растворенного в течение времени (ч) для использования моногидратной и ангидратной форм лактозы в таблетках мемантина 40 мг модифицированного высвобождения. На фиг. 10 показаны профили растворения таблеток мемантина модифицированного высвобождения, полученных для доз 7 и 28 мг, с использованием трех различных наполнителей: моногидрат лактозы, фосфат кальция и микрокристаллической целлюлозы. Данные показывают, что каждая проявляет примерно одинаковое растворение. Форма точек данных для каждой композиции указана на фиг. 10. Подробное описание изобретения В соответствии с настоящим изобретением предоставляется фармацетическая композиция для введения 1 раз/день мемантина или его фармацевтически приемлемой соли, предпочтительно его гидрохлорида, или его производных человеку или животному, причем композиция включает мемантин в оральных твердых лекарственных формах, предпочтительно таблетках. В настоящем изобретении фармацетические композиции включают терапевтически эффективное количество свободного основания мемантина или его фармацевтически приемлемой соли, предпочтительно его гидрохлорида, один или более модификаторов высвобождения в форме полимерных покрытий и матриц, а также, необязательно, один или более носителей, эксципиентов, агентов, препятствующих сцеплению, наполнителей, стабилизирующих агентов, связующих агентов, красящих веществ, глидантов и смазывающих агентов (все фармацевтически приемлемые). Мемантин(1-амино-3,5-диметиладамантан),который представляет собой аналог 1-аминоциклогексана (раскрытый, например, в патентах США 4122193; 4273774; 5061703), представляет собой системно активный неконкурентный антагонист рецепторов NMDA, имеющий от аффинитет к рецептору от низкого до умеренного и сильную зависимость от напряжения и быструю кинетику блокировки/разблокировки. Эти фармакологические признаки позволяют мемантину блокировать длительную активацию рецептора в патологических условиях и быстро покидать канал NMDA во время нормальной физиологической активации канала. Мемантин и его фармацевтически приемлемые соли (например, гидрохлорид, с молекулярной массой 215,77) утвержден в США для лечения болезни Альцгеймера. Утверждение мемантина в настоящее время испрашивается по показанию нейропатической боли(при которой мемантин продемонстрировал активность на моделях in vitro), и он в настоящее время утвержден за пределами США в виде оральной препаративной формы по поводу и болезни Альцгеймера, и болезни Паркинсона. В соответствии с изобретением мемантин можно применять в форме свободного основания или фармацевтически приемлемых солей. Подходящие соли соединения включают, но не ограничиваются,такие как соли кислотно-аддитивные соли, полученные с хлористо-водородной, метилсульфоновой, бромисто-водородной, йодисто-водородной, хлорной, серной, азотной, фосфорной, уксусной, пропионовой,-4 011446 гликолевой, молочной, пировиноградной, малоновой, янтарной, малеиновой, фумаровой, винной, лимонной, бензойной, карбоновой, циннамовой, миндальной, метансульфоновой, этансульфоновой, гидроксиэтансульфоновой, бензолсульфоновой, паратолуолсульфоновой, циклогексансульфамовой, салициловой, п-аминосалициловой, 2-феноксибензойной и 2-ацетоксибензойной кислотами. В предпочтительном варианте осуществления соль представляет собой мемантин гидрохлорид (C12H21NHCl, молекулярная масса 215,77). Термин соли может также включать соли добавления свободных кислот или свободных оснований. Все эти соли (или другие аналогичные соли) можно получить обычными средствами. Все такие соли приемлемы при условии, что они нетоксичны и существенно не препятствуют желательной фармакологической активности. Кроме того, можно использовать любые соли и форму свободного основания мемантина (коллективно именуемые мемантина), включая полиморфы, гидраты и сольваты, а также аморфные формы мемантина. В предпочтительном варианте осуществления изобретения активный ингредиент представляет собой мемантин гидрохлорид. В одном варианте осуществления мемантин составлен в виде 12-часовой препаративной формы, где активный ингредиент имеет растворение по меньшей мере примерно 70-80% примерно через 12 ч. Активный ингредиент присутствует в количествах от примерно 1 до примерно 20% (мас./мас.), предпочтительно от примерно 1,6 до примерно 20% (мас./мас.), наиболее предпочтительно от примерно 2,5 до примерно 20% (мас./мас.). В предпочтительном варианте осуществления активный ингредиент присутствует в количествах от примерно 10 до примерно 80 мг на таблетку. В альтернативном варианте осуществления мемантин составлен в виде 6-часовой препаративной формы, где активный ингредиент имеет растворение по меньшей мере примерно 70-80% примерно через 6 ч. Активный ингредиент присутствует в количестве от примерно 1 до примерно 35% (мас./мас.), предпочтительно от примерно 1,6 до примерно 35% (мас./мас.), наиболее предпочтительно от примерно 5 до примерно 35% (мас./мас.). В другом предпочтительном варианте осуществления активный ингредиент присутствует в количествах от примерно 10 до примерно 80 мг на таблетку. Для достижения желательных скоростей модифицированного высвобождения лекарственную форму модифицированного высвобождения можно составить в виде полимерного покрытия или матрицы. В одном предпочтительном варианте осуществлении лекарственную форму модифицированного высвобождения составляют в виде матрицы. В зависимости от гидрофильной (эродируемой или не эродируемой) природы матрицы матрица может представлять собой материал, который набухает после контакта с желудочной жидкостью до размера, который достаточно велик для содействия удерживанию в желудке, в то время как субъект находится в состоянии переваривания пищи. В дополнение к этим основанным на диффузии матрицам матрица может также быть в эродируемой форме. Состояние переваривания пищи вызвано потреблением пищи, и оно начинается с быстрого и глубокого изменения типа моторики верхнего отдела желудочнокишечного (ЖК) тракт. Изменение состоит в снижении амплитуды сокращений, которым подвергается желудок, и снижении открытия привратника до частично закрытого состояния. В результате происходит процесс просеивания, который позволяет жидкостям и мелким частицам проходить через частично открытый привратник, в то время как не перевариваемые частицы, которые крупнее, чем привратник, проталкиваются назад и удерживаются в желудке. Другими словами, биологические жидкости мигрируют через матрицу и растворяют активный ингредиент, который высвобождается путем диффузии через матрицу, которая одновременно модулирует скорость высвобождения. Поэтому матрица контролируемого высвобождения в этих вариантах осуществления выбрана как матрица, которая может набухать до размера, достаточно большого для обратного проталкивания и, посредством этого, удерживания в желудке,вызывая продолжительное высвобождение препарата в желудке, а не в кишечнике. Раскрытия оральных лекарственных форм, которые набухают до размеров, которые продлят время нахождения в желудке,можно найти в патентах США 5007790, 5582837 и 5972389, а также в Международных (РСТ) патентных заявках WO 98/55107 и WO 96/26718. Каждый из документов, приведенных в этом абзаце, полностью включен в описание в качестве ссылки. В композициях, содержащих гидрофильную матрицу, матрица составлена из нерастворимого гидрофильного полимера. Полимер выбран из сложных эфиров целлюлозы, сложных карбоксивиниловых эфиров или сложных акриловых или метакриловых эфиров. При контакте с биологическими жидкостями матрица становится гидрированной и набухает, формируя сеть полимеров, и через эти полимеры диффундируют растворимые, активные вещества. Кроме того, могут добавляться липиды, в частности сложные глицериловые эфиры, для модулирования или для того, чтобы уменьшить набухание матрицы и скорости диффузии. Однако в настоящем изобретении липиды не требуются для модулирования диффузии матрицы. Скорее, композиции по заявляемому изобретению работают с нормальной скоростью желудочной диффузии, регулируемой частично толщиной таблетки. Кроме того, композиции с липидами могут включать многочисленные адъюванты, часто дорогостоящие адъюванты, в высоких концентрациях, что значительно увеличивает стоимость композиции. Кроме того, такие композицию получают гранулированием и-5 011446 затем прессованием смеси, образованной из полимера, активных веществ и различных адъювантов. Эти методики часто включают использование органических растворителей, которые существенно в последующем извлечь для предотвращения их диспергирования в атмосферу. Кроме того, следы токсичных растворителей могут оставаться в конечном продукте, причем эти следы необходимо количественно анализировать. В целом, набухаемые матрицы содержат связывающие вещества, которые представляют собой набухаемые в воде полимеры, а подходящие полимеры представляют собой те, которые являются нетоксичными, которые набухают неограниченным по размеру образом после пропитывания водой и затем постепенно с течением времени высвобождают препарат. Примеры полимеров, отвечающие этому описанию, включают, но не ограничиваются, следующие: полимеры целлюлозы и их производные, включая,но не ограничиваясь, гидроксиметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу,гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу и полисахариды микрокристаллической целлюлозы и их производные, полиалкиленоксиды, полиэтиленгликоли, хитосан, поли(виниловый спирт),ксантановую смолу, сополимеры малеинового ангидрида, поли(винилпирролидон), крахмал и полимеры на основе крахмала, мальтодекстрины, поли(2-этил-2-оксазолин), поли(этиленимин), полиуретановые гидрогели, поперечно сшитые полиакриловые кислоты и их производные. Дополнительные примеры представляют собой сополимеры перечисленных выше полимеров,включая блок-сополимеры и графт-сополимеры. Определенными примерами сополимеров являютсяPluronic и Tectonic, которые представляют собой блок-сополимеры полиэтиленоксидаполипропиленоксида, имеющиеся в продаже от BASF Corporation, Chemicals Div., Wyandotte, Mich.,USA. Дополнительными примерами являются графт-сополимеры гидролизованного крахмала и полиакрилонитрила, общеизвестные как "Super Slurper" и имеющиеся в продаже от Illinois Corn Growers Association, Ill, USA. В композициях, включающих гидрофобную матрицу, матрица составлена из липидного агента матрицы естественного происхождения, например пчелиные воски, которые являются вполне безвредными. Однако ее состав варьируется от одной партии к другой, и ее устойчивость с течением времени не очень удовлетворительна. Как указано выше, эти композиции в целом получены гранулированием (влажным или растворителем), а затем прессованием, включая высокие пропорции каждого из ингредиентов. В настоящем изобретении особенно предпочтительными полимерами являются поли(этиленоксид),гидроксипропилметилцеллюлоза и комбинации поли(этиленоксида), гидроксипропилметилцеллюлозы. Наиболее предпочтительной является гидроксипропилметилцеллюлоза. В 12-часовых композициях модифицированного высвобождения полимер присутствует в количествах от примерно 50 до примерно 80% (мас./мас.), предпочтительно от примерно 68 до примерно 77% (мас./мас.). В 6-часовых композициях модифицированного высвобождения полимер присутствует в количествах от примерно 20 до примерно 70% (мас./мас.), предпочтительно от примерно 54 до примерно 65% (мас./мас.). Удлинение времени максимальных величин концентрации в плазме (Tmax), по сравнению с немедленным высвобождением, связано со скоростью диссоциации препарата in vitro. Скорость диссоциации препарата in vitro зависит от композиции матрицы. Путем использования различных целлюлозных матриц можно манипулировать скоростями высвобождения in vitro (растворение препарата от более чем примерно 70 до примерно 80%) в диапазоне примерно от 4 до 24 ч, предпочтительно от примерно 6 до примерно 12 ч. Препаративные формы имеют время достижения максимальной концентрации в плазме(среднее (Tmax от примерно 4 до примерно 24 ч, предпочтительно от примерно 10 до примерно 20 ч и скорость высвобождения in vitro более чем от примерно 70 до примерно 80% примерно через 6-12 ч после вхождения в среду применения. Предпочтительно препаративные формы имеют скорость высвобождения от примерно 30 до примерно 60% примерно через 2-6 ч. Предпочтительнее препаративные формы имеют скорость высвобождения от примерно 10 до примерно 50% в пределах первого часа после вхождения в среду применения с последующим продолжительным высвобождением; предпочтительнее препаративные формы имеют скорость высвобождения от примерно 10 до примерно 35% в пределах первого часа. Весь препарат из препаративной формы модифицированного высвобождения не высвобождает мемантин немедленно, например не более чем 80% примерно через 15-30 мин в пределах первого часа после вхождения в среду применения. Это важно для предотвращения сбрасывания дозы. Таблетки в соответствии с настоящим изобретением можно получить обычными методиками смешивания, измельчения и таблетирования, которые хорошо известны в промышленности фармацевтических препаративных форм. Например, таблетку модифицированного высвобождения можно изготовить прямым прессованием штампами и головками экструдера, прилаженными к роторному таблетировочному прессу, эжекторной или пресс-формовкой, гранулирование с последующим прессованием или формированием пасты и экструзией пасты в форму или разрезанием экструдата на короткие отрезки. Предпочтительно способ, используемый для получения таблеток, представляет собой прямое прессование смеси. Этот способ также предпочтителен экономически, потому что он включает меньшее число операций установки при использовании недорогого оборудования. Обычно прямое смешивание представляет собой трудный процесс, и могут возникнуть такие проблемы, как сегрегация смеси, низкая способность к сжатию и низкая однородность содержимого. Однако препаративные формы, описанные в настоящем изо-6 011446 бретении, не проявляют ни одну из таких проблем. В настоящем изобретении можно использовать один или более наполнителей, включая, но не ограничиваясь, микрокристаллическую целлюлозу, дикальцийфосфат, лактозу, производные целлюлозы,крахмал, другие фосфаты кальция, желатин, гидрированные сахарные спирты (т.е. сорбит, манит), поливинилпирролидон и коллидон. Предпочтительно такие наполнители, как микрокристаллическая целлюлоза, дикальцийфосфат и лактоза, используются для модификации типа растворения. Когда в качестве материала матрицы используются гидроксипропилметилцеллюлоза или этилцеллюлоза, скорости растворения могут быть гораздо медленнее, чем целевая скорость модифицированного высвобождения. Медленное высвобождение происходит потому, что таблетки с гидрофобной матрицей высвобождают препарат механизмом эрозии полимера. Поскольку эрозия из гидрофобной матрицы очень медленная,скорость растворения легко растворимого активного ингредиента также медленная. Наполнители также представляют собой важные ингредиенты, используемые для улучшения потока порошка и сжимаемости для таблеток мемантина HCl. В одном варианте осуществления лекарственные формы содержат микрокристаллическую целлюлозу в качестве наполнителя в количествах от примерно 5 до примерно 80% (мас./мас.), предпочтительнее от примерно 5 до примерно 71% (мас./мас.), наиболее предпочтительно от примерно 7 до примерно 40% (мас./мас.). В другом варианте осуществления лекарственные формы содержат дикальцийфосфат в качестве одного из многих наполнителей или в качестве единственного наполнителя в количествах от примерно 5 до примерно 80% (мас./мас.), предпочтительнее от примерно 5 до примерно 71% (мас./мас.), наиболее предпочтительно от примерно 7 до примерно 40% (мас./мас.). В определенных вариантах осуществления лекарственные формы не содержат лактозу. В еще одном варианте осуществления лекарственные формы содержат моногидрат лактозы в качестве наполнителя. Для препаративных форм 12-часового высвобождения моногидрат лактозы присутствует в количествах от примерно 5 до примерно 50% (мас./мас.), предпочтительнее от примерно 5 до примерно 25% (мас./мас.), наиболее предпочтительно от примерно 6,9 до примерно 15% (мас./мас.). Для препаративных форм 6-часового высвобождения моногидрат лактозы присутствует в количествах от примерно 5 до примерно 75% (мас./мас.), предпочтительнее от примерно 5 до примерно 50% (мас./мас.),наиболее предпочтительно от примерно 7 до примерно 24% (мас./мас.). Когда таблетки изготовлены прямым прессованием,может помочь добавление смазывающих агентов, и оно иногда является важным для содействия потоку порошка и предотвращения или уменьшения скалывания (отламывания части таблетки) при снятии давления. Полезные смазывающие агенты включают стеарат магния и гидрированное растительное масло (предпочтительно гидрированные и очищенные триглицериды стеариновой и пальмитиновой кислот). В предпочтительном варианте осуществления смазывающий агент представляет собой стеарат магния. Для препаративных форм 12-часового высвобождения стеарат магния присутствует в количествах в диапазоне от примерно 0,8 до примерно 1,2% (мас./мас.), предпочтительнее от примерно 0,9 до примерно 1,1% (мас./мас.). Для препаративных форм 6-часового высвобождения стеарат магния присутствует в количествах в диапазоне от примерно 0,4 до примерно 0,6% (мас./мас.), предпочтительнее примерно 0,5% (мас./мас.). Дополнительные эксципиенты можно добавить для увеличения твердости таблеток, текучести порошка и хрупкости таблеток и для снижения сцепления со стенкой головки экструдера. В соответствии с настоящим изобретением фармацевтическая композиция модифицированного высвобождения предоставляется для однократного суточного введения мемантина или его фармацевтически приемлемой соли, предпочтительно гидрохлорида, человеку или животному. Препаративные формы мемантина по изобретению подходят для лечения заболеваний ЦНС, включая, но не ограничиваясь, лечение болезни Альцгеймера, болезни Паркинсона, деменцию, вызванную СПИД (патент США 5506231, см. также Parsons et al., Neuropharmacology 1999 Jun; 38(6): 735-67), нейропатической боли(патент США 5334618), церебральной ишемии (патент США 5061703), эпилепсии, глаукомы, печеночной энцефалопатии, рассеянного склероза, инсульта, депрессии (патент США 6479553), медленной дискинезии, малярии, инфекции вирусом Borna, гепатита С (патенты США 6034134 и 6071966). Дополнительные патологии, для лечения которых подходит мемантин, раскрыты в патентах США 5614560 и 6444702. Особый интерес представляет способность обеспечения непрерываемого облегчения боли. Соответственно, настоящее изобретение, кроме того, представляет способ терапевтического или профилактического лечения расстройств ЦНС у человека или животного, причем способ включает введение субъекту композиции в соответствии с настоящим изобретением. В целях настоящего изобретения длительное или модифицированное высвобождение означает,что высвобождение терапевтически активного средства происходит в течение продолжительного периода времени, приводя к более низкому пику концентрации в плазме (Cmax) и пролонгированному Tmax по сравнению с немедленным высвобождением. Определение соответствия указанным выше требованиям растворения и требованиям дезинтеграции проводится с использованием оборудования и тестов,определенных в XXIV Фармакопее США, и в соответствии с отдельными Официальными монографиямиp. 2051-2056, 2000), включенных сюда в качестве ссылки, для определенного терапевтически активного средства (средств), включенного в сердцевину таблетки. Терапевтически эффективное количество означает количество соединения, которое при введении млекопитающему для лечения состояния, расстройства или состояния достаточно для осуществления такого лечения. Терапевтически эффективное количество будет варьироваться в зависимости от соединения, заболевания и его тяжести и возраста, массы тела, физического состояния и реактивности подлежащего лечению млекопитающего. В соответствии с настоящим изобретением в одном варианте осуществления терапевтически эффективное количество мемантина представляет собой количество, эффективное для лечения расстройств ЦНС, включая болезнь Альцгеймера или болезнь Паркинсона. В другом варианте осуществления терапевтически эффективное количество представляет собой количество, эффективное для лечения нейропатической боли или других болезненных состояний, таких как висцеральная гиперчувствительность. Другие виды применения включают, но не ограничиваются, лечение деменции и депрессии. Эффективное количество препарата для фармакологического действия и поэтому сила действия таблетки зависят от самого заболевания, например при болезни Альцгеймера пациенту первоначально вводят дозу 5 мг и дозировка прогрессивно увеличивается до 0 мг 2 раза/день. Дополнительные дозы, оценивавшиеся в клинических испытаниях, включают 40 мг/день. Термин фармацевтически приемлемая означает биологически или фармакологически совместимая для применения in vivo у животных или людей и предпочтительно означает утвержденная регулирующим агентством Федерального правительства или правительства штата или приведен в Фармакопее США или другой общепризнанной фармакопее для применения у животных, а конкретнее у людей. Используемый термин лечить используется для обозначения снятия или облегчения по меньшей мере одного симптома заболевания у субъекта, включая, например боль, болезнь Альцгеймера, сосудистую деменцию или болезнь Паркинсона. Термин лечить может означать снятие или облегчение интенсивности и/или длительности проявления заболевания, испытываемое субъектом в ответ на данный стимул (например, давление, повреждение ткани, холодная температура и т.д.). Например, в связи с деменцией термин лечить может означать снятие или облегчение когнитивного нарушения (такого как нарушение памяти и/или ориентации), или нарушение общего функционирования (повседневной жизнедеятельности, ADL), и/или замедление или устранение прогрессирующего нарушения при ADL или когнитивного нарушения. В пределах значения настоящего изобретения термин лечить также обозначает остановку, задержку начала (т.е. период перед клиническим проявлением заболевания) и/или снижение риска развития или усугубления заболевания. Термин защищать используется здесь для обозначения предотвращения, задержки или лечения или в соответствии с целесообразностью всех этих понятий - развития, или продолжения, или усугубления заболевания у субъекта. В пределах значения настоящего изобретения деменция связана с расстройством ЦНС, включая без ограничения нейродегенеративные заболевания, такие как болезнь Альцгеймера(AD), синдром Дауна и цереброваскулярная деменция (VaD). Термин примерно или приблизительно означает в пределах приемлемого диапазона ошибки для определенной величины, определенной средним специалистом в данной области, которая частично зависит от того, как измеряется или определяется эта величина, т.е. ограничений системы измерения. Например, примерно может означать в пределах 1 или более чем 1 стандартного отклонения, в соответствии с практикой в данной области. Альтернативно, примерно в отношении композиций может означать плюс или минус диапазон до 20%, предпочтительно до 10%, предпочтительнее до 5%. Альтернативно, в частности, в отношении биологических систем или процессов термин может означать в пределах порядка величины, предпочтительно в пределах 5-кратного значения, а предпочтительнее в пределах 2-кратного значения величины. При отсутствии других указаний, когда в изобретении и формуле изобретения описываются определенные величины, термин примерно означает в пределах приемлемого диапазона ошибки для определенной величины. Например, при указании периода времени, например часов, более подходящими являются величины в процентах (20%). Так, 6 ч могут представлять собой,например, 4,8, 5,5, 6,5, 7,2, а также обычные 6 ч. Используемый здесь термин фактор подобия или фактор f2 относится к одному способу сравнения профилей растворения двух различных продуктов (см. Multisource Pharmaceutical Products: Guidelines on Registration Requirements to establish Interchangeability, Quality Assurance and Safety: Medicines,Essential Drugs and Medicines Policy, World Health Organization, 1211 Geneva 27, Switzerland, p. 11-12,2004, включенную сюда качестве ссылки). Этот независимый от модели математический подход сравнивает профиль растворения двух продуктов: тестируемого и эталонного (или двух прочностей, или продуктов от одного и того же изготовителя до и после утверждения). Рекомендуется выполнение тестов в одинаковых условиях испытания. Точки времени растворения для обоих профилей должны быть одинаковыми, например для продуктов немедленного высвобождения 10, 15, 30, 45, 60 мин и для продуктов продолжительного высвобождения 1, 2, 3, 5 и 8 ч. Только одну точку времени следует учитывать после 85% растворения эталонного продукта. Величина f2 50 или более (50-100) гарантирует тождество или эквивалентность двух кривых и, таким образом, работу двух продуктов. Фактор подобия f2 следует рассчитывать, используя уравнение: где Rt и Tt представляют собой кумулятивные процентные доли препарата, растворенные в каждую из выбранных точек времени n, соответственно, продукта сравнения эталонного и тестируемого. Для продуктов, которые растворяются очень быстро, т.е. с растворением более чем 85% через 15 мин или менее, нет необходимости в сравнении профиля. Для капсул пролонгированного высвобождения, изготовленных в виде шариков, где дозировка отличается только количеством шариков, содержащих активную часть, сравнение профиля растворения (f250) при одном рекомендуемом условии теста достаточно для отказов от биологических требований. Отказ от биологического требования представляет собой отказ уполномоченной регулирующей инстанции от требования биологической эквивалентности новой препаративной формы по сравнению с предыдущей. Тогда как для таблеток пролонгированного высвобождения, как в настоящем изобретении, когда лекарственный продукт представлен в такой же лекарственной форме, но имеет другую дозировку и является пропорционально одинаковым по его активным и неактивным ингредиентам и имеет такой же механизм высвобождения препарата, при более низкой дозировке может быть предоставлен отказ от биологического требования, если препарат проявляет аналогичные профили растворения, f250, в трех буферах с разным рН (при рН от 1,2 до 7,5) при использовании рекомендуемого способ тестирования. Используемый здесь термин стабильность растворения относится к тождеству профилей растворения (фактор тождества больше чем 50, в сравнении с исходным), полученных в различные периоды хранения при варьирующихся условиях: температуре и влажности. Термин по существу, такая же стабильность растворения означает фактор тождества f2 более чем 50 по сравнению с эталонным профилем растворения. Термин вхождение в среду применения означает контакт препаративной формы по изобретению с желудочными жидкостями пациента, которому она введена, или с жидкостью, предназначенной для имитации желудочной жидкости. Примеры Настоящее изобретение будет лучше понятно при ссылке на следующие примеры, которые предоставлены как иллюстрирующие изобретение, а не в качестве ограничения. Пример 1. Получение таблеток мемантина HCl модифицированного высвобождения. Настоящий пример описывает процесс разработки таблеток мемантина гидрохлорида модифицированного высвобождения в дозировках 7, 10, 20, 28, 40 и 80 мг. В следующих таблицах представлена иллюстративная разработка таблеток модифицированного высвобождения, включающих активные компоненты, полимерную матрицу и другие эксципиенты для определенных лекарственных форм с определенными целевыми периодами времени высвобождения. Таблица 1 Следующие таблицы иллюстрируют состав таблеток модифицированного высвобождения, включающих активные компоненты, полимерную матрицу и наполнители в виде микрокристаллической целлюлозы и/или дикальцийфосфата. Испытуемые партии каждых из таблеток получали в соответствии со способом, описанным ниже. Получение смеси для таблетирования. Мемантин HCl, НРМС (гидроксипропилметилцеллюлозу, оральный носитель-основу Synchron, типаKF), моногидрат лактозы по Национальной Фармакопее (NF) и коллоидный диоксид кремния по NF,(Cab-O-Sil) смешивают в мешалке V-Blender в течение 10 мин. К указанной выше смеси добавляют тальк (компонент против сцепления) и смешивают в течение 5 мин. Наконец, к смеси добавляют стеарат магния и смешивают в течение 5 мин. Смесь загружают в контейнер, выстланный двойными выстилками из полиэтиленовых мешков, и маркируют как Конечную смесь для прессовки. Прессовка таблеток. Смесь прессуют, используя роторный таблеточный пресс. Форма таблеток для таблеток 12-часового растворения является круглой, и целевая средняя масса таблеток составляет примерно 400 мг. Диаметр таблеток составляет 0,4375 дюйма. Форма таблеток для таблеток 6-часового растворения является круглой, и целевая средняя масса таблеток составляет примерно 200 мг. Диаметр таблеток составляет 0,3125 дюйма. Во время прессовки периодически выполняют следующие контрольные измерения: масса таблеток,твердость таблеток и толщина таблеток. Кроме того, проводили тесты растворения на таблетках 10, 20 и 40 мг для препаративных форм 6-часового высвобождения, а также на таблетках 20 мг для препаративной формы 12-часового высвобождения. Для тестов растворения таблетки различной твердости испытывали, используя устройство Apparatus II по Фармакопее США, используя 900 мл буфера с рН 1,2 (U.S. Наращивали получение композиций для таблеток мемантина HCl для дозировок 10, 20 и 40 мг. Эти партии проявили отличную стабильность после хранения при 40 С/75% относительной влажности во флаконах из HPDE (полиэтилена высокой плотности) без осушителя через 2 и 6 месяцев. Результаты растворения показаны на фиг. 1 и 2, где все таблетки проявили удовлетворительные показатели на уровне исходных величин или близко к ним. Кроме того, таблетки 20 мг испытывали на стабильность растворения для композиций 6- и 12-часового высвобождения. Профили растворения для партий (01074 Н 6 ч и 01075 Н 12 ч) до 6 месяцев при 40 С/75% относительной влажности показаны на фиг. 3 и 4. Профили растворения таблеток мемантина модифицированного высвобождения, полученных для доз 7 мг и 28 мг с использованием трех различных наполнителей: моногидрата лактозы, дикальцийфосфата и микрокристаллической целлюлозы - представлены на фиг. 10.- 10011446 Пример 2. Фармакокинетическое исследование мемантина. Настоящий пример демонстрирует биодоступность таблеток мемантина немедленного высвобождения по сравнению с таблетками мемантина модифицированного высвобождения. Материалы и методы. Структура исследования в настоящем примере представляла собой 57-дневное, одноцентровое, открытое исследование на 24 молодых здоровых субъектах в возрасте от 18 до 35 лет. Субъектов подвергали скрининговой оценке, состоящей из сбора полного медицинского анамнеза, полного физикального обследования с оценкой витальных показателей, ЭКГ в 12 отведениях, клинических лабораторных оценок, состоящих из клинического анализа крови (включая лейкоцитарную формулу), клинического биохимического исследования крови, анализа мочи, серологических тестов на сифилис RPR/VDRL (быстрый реагин плазмы/реакция Вассермана), тестов для выявления антител против ВИЧ 1 и 2, скрининга препаратов, вызывающих зависимость (включая алкоголь и никотин), анти-HCV (антител против вируса гепатита С) и HbsAg (поверхностного антигена гепатита В). У женщин проводили исследование сыворотки на -hCG (-хорионический гонадотропин) на беременность при скрининге и тест мочи на беременность в день -1. Критериями включения были информированное согласие, нормальные данные физикального обследования, здоровые взрослые люди в возрасте от 18 до 35 лет, некурящие, имеющие массу тела в пределах 15% идеальной массы тела в связи с ростом и частоту пульса не менее чем 50 ударов в минуту при пальпации и частоту сердечных сокращений не мене чем 50 сокращений в минуту, по данным регистрации ЭКГ. Критериями исключения были гиперчувствительность к мемантину или другим антагонистамNMDA, присутствие любого клинически значимого заболевания, систолическое артериальное давление в положении сидя более чем 180 мм рт.ст. или менее чем 100 мм рт.ст. либо диастолическое артериальное давление в положении сидя более чем 100 мм рт.ст. или менее чем 60 мм рт.ст. при скрининге, значимые аномалии ЭКГ, анамнез злоупотребления алкоголем или наркомании, положительные тесты на препараты, вызывающие зависимость, потребление кофеина в пределах 48 ч или алкоголя в пределах 72 ч перед тестированием, участие в другом клиническом исследовании в пределах 30 дней исследования, клинические состояния, связанные с мемантином, сопутствующая медикаментозная терапия или кормление грудью у женщин. Было 3 схемы лечения, включающих таблетку мемантина HCl 10 мг немедленного высвобождения(композиция I, растворение 6 ч, лечение В) и вторую таблетку мемантина HCl 20 мг модифицированного высвобождения (композиция II, растворение 12 ч, лечение С). Субъекты получали 3 вида лечения в 1, 22 и 43 дни исследования перекрестным образом, разделенные 21-дневным периодом очистки на основании рандомизированных последовательностей лечения. Таблетку немедленного высвобождения вводили 2 раза/день: в 08:00 и 12:00 ч в течение одного дня. Таблетку модифицированного высвобождения вводили 1 раз/день в 08:00 ч. Композиция А обсуждена в деталях в совместной заявке, одновременно поданной с заявкой на данное изобретение, Реестр поверенного 03269/100M544-US1. Субъектов доставляли в зону с запрещенным курением приблизительно в 19:00 ч в 1-, 21- и 42-й дни. Всего было 6 пребываний каждого субъекта в течение ночи (дни -1, 1, 21, 22, 42 и 43). Субъектов подвергали контролю рациона и потребления жидкостей, и они не получали сопутствующей медикаментозной терапии. В течение хода исследования регистрировали витальные признаки и побочные явления. Образцы крови для определения содержания маментина получали у каждого субъекта в ходе исследования в 1-,22- и 43-й дни исследования после введения препарата в 08:00 ч в следующие точки времени: 0.0 ч (перед введением), каждый час в течение первых 12 ч, через 14, 24, 36, 48, 72, 96, 144, 192, 240, 288 и 336 ч после введения. Ряд образцов крови подвергали фармакокинетическому анализу для определения концентрации мемантина. Приблизительно 5 мл крови брали на образец после введения на 1-, 22- и 43-й дни. Образцы крови центрифугировали и для каждого образца собирали плазму. Затем образцы подвергали флэшзамораживанию в бане с изопропиловым спиртом/сухим льдом и хранили в морозильной камере при-70 С. Биоаналитические процедуры. Биоаналитическая процедура, использованная для измерения концентрации мемантина в плазме,была утверждена для демонстрации точности, линейности, воспроизводимости и прецизионности аналитических процедур. Был разработан способ LC/MS/MS (жидкостной хроматографии/массспектрометрии/тандемной масс-спектрометрии) для определения содержания мемантина в плазме человека. После добавления 10 нг внутреннего стандарта [2H6] мемантина и буфера 0,5 М карбоната натрия к стандартам и образцам плазмы соединения экстрагировали этилацетатом. Органический слой выделяли и сушили при комнатной температуре в вакууме в концентраторе образцов (Savant). Сухой остаток анализировали после растворения в подвижной фазе. Компоненты растворенных образцов разделяли на колонке Zobax SB-C8 (1504,6 мм, 3,5 мкм) и выявляли химической ионизацией при атмосферном давле- 11011446 нии (APCI) режимом положительных ионов мониторинга выбранной реакции (SRM). В SRM использовались предшественникположительные ионы продукта m/z 180163 и m/z 186169 для мониторинга,соответственно, мемантина и его внутреннего стандарта. Протонированные молекулярные ионы мемантина и [2H6] мемантина представляют собой ионы-предшественники для режима SRM. Отношение высоты пика продукта мемантина к таковой внутреннего стандарта представляло собой реакцию, используемую для количественного определения. Стандарты плазмы утверждения способа показали точность в пределах отклонения 8,2%, и прецизионность не превышала 7,6% CV (коэффициента вариации). Точность определения мемантина при контроле качества плазмы составила в пределах отклонения 8,8% при прецизионности, не превышающей 9,8% CV. Нижний предел количественного определения способа составил 0,5 нг/мл. Фармакокинетический анализ. Фармакокинетические параметры оценивали, используя программное обеспечение WinNonlin (версия 3.3, Pharsight Corporation, Mountain View, CA). Следующие параметры определяли по данным концентрации в плазме после введения одной дозы: площадь под кривой динамики во времени концентрации в плазме (AUC0-t, AUC0-24, и AUC0-), максимальная концентрация в плазме (Cmax), время достижения максимальной концентрации в плазме (Tmax), период полувыведения (T1/2) и среднее время пребывания(MRT). Максимальную концентрацию в плазме (Cmax) и время достижения максимальной концентрации в плазме (Tmax) для мемантина определяли наблюдением. Константу скорости первого порядка, z, описывающую конечное снижение в плазме, оценивали программным обеспечением WinNonlin (версия 3.3), используя логарифмически-линейную регрессию конечной линейной фазы кривых динамики во времени средней концентрации в плазме мемантина. Показатели конечного периода полувыведения T1/2 (в часах) рассчитывали уравнением 1 Динамику во времени площади под кривой концентрации до последней измеряемой концентрации во время t (AUC0-t) или через 24 ч (AUC0-24) оценивали цифровой интеграцией с использованием линейного трапециевидного правила где Ci представляла собой концентрацию в плазме в соответствующе время взятия пробы ti. Площадь под кривой динамики во времени концентрации мемантина в плазме до бесконечности(AUC0-) рассчитывали, используя следующее уравнение 3): где Clast представляет собой последнюю измеряемую концентрацию в профиле динамики концентрации во времени.MRT рассчитывали, используя следующее уравнение 4: где AUMC представляет собой площадь под кривой первого момента. Описательные статистические данные для параметров фармакокинетики мемантина Cmax, tmax,AUC0-t, AUC0-24, AUC0-, t1/2 и MRT были предоставлены для субъектов, которые завершили исследование. Сравнения между способами лечения проводили, используя вариационный анализ ANOVA, соответствующий тройной перекрестной структуре. Результаты. Побочные явления. Не было отмечено серьезных побочных явлений. 19 (82,6%) из 23 субъектов сообщили всего о 42 побочных явлениях, возникших в связи с лечением, после проведения способов лечения А, В и С. Не было значимых различий количества побочных явлений, наблюдавшихся при любом лечении. Всего 14,12 и 16 побочных явлений наблюдалось, соответственно, после способов лечения А, В и С. Наиболее часто наблюдавшимися побочными явлениями (т.е. возникшими у 3 или более субъектов) были головная боль, головокружение, метеоризм и инфекция. Фармакокинетические результаты. Средние концентрации мемантина показаны на фиг. 5 (линейная шкала) и на фиг. 6 (полулогарифмическая шкала). На фиг. 7 представлены средние концентрации мемантина в плазме в течение первых 24 ч после введения. Максимальная концентрация мемантина была самой высокой после введения композиции немедленного высвобождения (лечение А), а самая низкая после введения композиции II модифицированного высвобождения (лечение С). Средние ( SD) фармакокинетические параметры мемантина после способов лечения А, В и С перечислены ниже. Всасывание мемантина из таблеток модифицированного высвобождения задерживался, по сравнению с таблеткой немедленного высвобождения. Скорость и степень всасывания мемантина снижались после введения композиций модифицированного высвобождения, по сравнению с композицией немедленного высвобождения. Важно, что скорость всасывания (Tmax) задерживалась с 8,2 ч для таблетки немедленного высвобождения (т.е. примерно 4 ч после введения второй таблетки) до 12,1 и 19,3 ч для двух композиций модифицированного высвобождения. Хотя умеренное высвобождение имело более медленные скорость и степень всасывания, была лучшая переносимость дозы умеренного высвобождения. Между различными видами лечения не наблюдались различия конечного периода полувыведения. 90% доверительные интервалы для сравнения логарифмически трансформированных Cmax, AUC0-24,AUC0-t и AUC0- для лечения В (композиция I модифицированного высвобождения) в сравнении с лечением А (таблетка немедленного высвобождения) показали значимое снижение средней величины Cmax композиции I модифицированного высвобождения, но не величин параметра AUC, по сравнению с таблеткой немедленного высвобождения. 90% доверительные интервалы для сравнения логарифмически трансформированных Cmax, AUC0-24, AUC0-t и AUC0- для лечения С (композиция II модифицированного высвобождения) в сравнении с лечением А (таблетка немедленного высвобождения) показали значимое снижение средней величин Сmax и AUC композиции II модифицированного высвобождения, по сравнению с таблеткой немедленного высвобождения. Обсуждение. В этом исследовании было обнаружено, что однократные суточные дозы 20 мг мемантина, введенные в виде двух доз по 10 мг таблетки немедленного высвобождения, разделенных 4-часовым интервалом, безопасны и хорошо переносимы. В этом исследовании не наблюдались тяжелые побочные явления. Скорость и степень всасывания мемантина была самой высокой после введения таблеток немедленного высвобождения. Величины Cmax составляли в среднем 24,92, 20,37 и 17,48 нг/мл соответственно для таблетки немедленного высвобождения (лечение А), таблетки композиции I модифицированного высвобождения (лечение В) и таблетки композиции II модифицированного высвобождения (лечение С).AUC0- в среднем составляла в среднем 1969, 1827 и 1730 нгч/мл соответственно для таблетки немедленного высвобождения (лечение А), таблетки композиции I модифицированного высвобождения (лечение В) и таблетки композиции II модифицированного высвобождения (лечение С). Среднее Tmax составила 8,2, 12,1 и 19,3 ч соответственно для лечений А, В и С. 90% доверительные интервалы для сравнения логарифмически трансформированных Cmax, AUC0-24,AUC0-t и AUC0- для лечения В (композиция I модифицированного высвобождения) в сравнении с лечением А (таблетка немедленного высвобождения) показали значимое снижение средней величины Cmax композиции I модифицированного высвобождения, но не величин параметра AUC, по сравнению с таблеткой немедленного высвобождения. 90% доверительные интервалы для сравнения логарифмически- 13011446 трансформированных Cmax, AUC0-24, AUC0-t и AUC0- для лечения С (композиция II модифицированного высвобождения) в сравнении с лечением А (таблетка немедленного высвобождения) показали значимое снижение средней величин Cmax и AUC композиции II модифицированного высвобождения, по сравнению с таблеткой немедленного высвобождения. Не наблюдались различия конечного периода полувыведения мемантина между различными способами лечения. Не было статистически значимых различий среднего периода полувыведения или средних корригированных по массе тела величин Cmax, AUC0-t и AUC0- между мужчинами и женщинами после введения композиций немедленного освобождения и модифицированного высвобождения. В заключение, удлиненное Tmax для двух композиций модифицированного высвобождения указывает на более медленную скорость всасывания, по сравнению с таблетками немедленного высвобождения,и демонстрирует, что были получены желательные характеристики высвобождения. Обе композиции удлиняли Tmax и поэтому являются приемлемыми. Лечение В (6-часовая композиция) имело большую биодоступность, чем лечение С (12-часовая композиция). Пример 3. Скорости растворения пропорционального по дозе мемантина модифицированного высвобождения. Настоящий пример демонстрирует различные скорости растворения для пропорциональных по дозе композиций 6-часового высвобождения 10, 20 и 40 мг мемантина гидрохлорида. В табл. 6 представлен состав таблеток модифицированного высвобождения, включающих активные компоненты, полимерную матрицу и другие эксципиенты для определенных лекарственных форм с определенными целевыми периодами времени высвобождения. Таблица 6 Растворение пропорциональной по дозе композиции. Композиции 10 мг в сравнении с 40 мг не имеют пропорциональных скоростей растворения,т.е. 40 мг медленнее, чем 10 мг. Следует отметить, что отношения площади к объему поддерживаются на постоянном уровне. В матричной системе эрозионно/диффузионного типа важно удерживать этот параметр на постоянном уровне для обеспечения одинаковой эрозии и диффузионного проникновения. Данные пропорциональности доз, показанные на фиг. 8, демонстрируют варьирующиеся скорости. На фиг. 8 таблетка 10 мг имеет круглую форму, а таблетки 20 и 40 мг представляют собой таблетки овальной формы. Форма таблетки имеет решающее значение для достижения желательных диффузионных характеристик. Пример 4. Мемантин модифицированного высвобождения. Настоящий пример демонстрирует иллюстративные композиции мемантина гидрохлорида 6- и 12-часового высвобождения. Были разработаны композиции 40 мг (6 ч) с общей массой наполнителя от 300 до 600 мг. Для 6-часовой композиции, используемой в фармакокинетическом исследовании, общая масса составляла 200 мг. Исследование оптимизировало свойства текучести и сжатия таблеточной композиции. Была получена серия партий с варьирующимся количеством моногидрата лактозы в качестве наполнителя для исследования его влияния на свойства потока и сжатия. Определенные цели этой серии партий следующие. Для исследования влияния уровня моногидрата лактозы на свойства текучести и сжатия порошка; масса таблеток 400, 500 и 600 мг.- 14011446 Для исследования влияния увеличения количества лактозы на профили растворения; масса таблеток 400, 500 и 600 мг. Для исследования влияния формы таблеток на профиль растворения: круглой и овальной. Для исследования того, являются ли композиции пропорциональными по дозе при более высоких уровнях лактозы при массе таблеток 400 и 600 мг. Для исследования влияния условий хранения на эффективность продукта. В табл. 7 показаны 6-часовые композиции. Таблица 7 Эти лоты были дополнительно подразделены. Причины подразделения представлены в табл. 8. Таблица 8 Оценивали свойства порошка конечных смесей на сжатие. Во время прессовки визуально наблюдали превосходный поток порошка через засыпную воронку. В табл. 9 представлены результаты испытания порошка. Таблица 9 Представленные выше результаты указывают на то, что когда уровень лактозы увеличивался со 112 до 394 мг (масса таблеток от 300 до 600 мг), не было значительного изменения свойств порошка. У всех изученных смесей свойств текучести и сжатия являются хорошими. Конечные таблетки для каждого из сублотов имели хорошие величины твердости и хрупкости. Также исследовали влияние различных типов лактозы и конечной массы на процессы прессовки и растворения. Настоящее исследование композиции выполняли для оптимизации процесса прессовки,свойств текучести и сжатия таблеточной композиции. Получили серию партий с варьирующимся количеством лактозы обоих сортов, безводной и моногидрата. В табл. 10 приведены детали композиций. При сравнении между смесью с моногидратом лактозы и смесями с ангидратом не наблюдалось значимых различий сжимаемости. Данные растворения показаны на фиг. 9. Данные не показывают значимого различия между профилями растворения для моногидратной и ангидратной форм лактозы. Увеличение количества лактозы не воздействует на скорость высвобождения. Сделан вывод, что скорость высвобождения для этих композиций зависит от количества Synchron KF. В отношении свойств текучести и сжатия мемантина HCl, Synchron KF и лактозы наблюдалось, что сам мемантин имеет неблагоприятные свойства потока, и показатель текучести составляет 23,5. Это связывали с частицами препарата игольчатой формы. Визуально наблюдавшееся свойство текучести лактозы (обеих форм) было превосходным. Микроскопическое исследование выявило, что частицы моногидрата лактозы крупнее и более сферические по форме. Ангидрат давал агломераты неправильной формы. На основании этих результатов предпочтительна моногидратная форма. Настоящее изобретение не должно ограничиваться в объеме описанными здесь определенными вариантами осуществления. Действительно, различные модификации изобретения, в дополнение к тем,которые описаны в заявке на изобретение, станут очевидны специалистам в данной области из предшествующего описания и сопровождающих чертежей. Такие модификации предназначены для включения в объем прилагаемой формулы изобретения. Кроме того, следует понимать, что все величины являются приблизительными и предоставлены для описания. Описания всех патентов, патентных заявок, публикаций, описаний продуктов и протоколов, приведенных во всем тексте описания, во всех целях полностью включены в него в качестве ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Твердая оральная лекарственная форма с модифицированным высвобождением, включающая:(a) по меньшей мере один терапевтически активный ингредиент, выбранный из группы, состоящей из мемантина и фармацевтически приемлемой соли мемантина, и(b) фармацевтически приемлемый полимерный носитель, оказывающий существенное воздействие на модификацию высвобождения указанного активного ингредиента, где полимерный носитель выбран из полимеров целлюлозы и их производных, включающих гидроксиметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу, полисахариды микрокристаллической целлюлозы и их производные, полиалкиленоксидов, полиэтиленгликолей, хитозана, поли(винилового спирта), ксантановой смолы, сополимеров малеинового ангидрида, поливинилпирролидона, крахмала и полимеров на основе крахмала, мальтодекстринов, поли(2-этил-2 оксазолина), полиэтиленимина, полиуретановых гидрогелей, поперечно-сшитых полиакриловых кислот,эфиров метакриловой кислоты, карбоксивиниловых эфиров и их производных, сополимеров, включающих блок-сополимеры и графт-сополимеры их полимеров и их комбинации, причем указанная лекарственная форма, замедляющая высвобождение указанного терапевтически активного агента от примерно 4 до примерно 24 ч после вхождения указанной лекарственной формы в среду применения, где указанная лекарственная форма имеет скорость растворения более чем примерно 80% после прохождения примерно от 6 до примерно 12 ч после указанного вхождения в среду применения. 2. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, где указанный активный ингредиент представляет собой мемантин гидрохлорид. 3. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, где скорость растворения более чем примерно 80% достигается примерно через 12 ч. 4. Твердая оральная лекарственная форма с модифицированным высвобождением по п.3, включающая активный ингредиент в количестве от примерно 1,0 до примерно 20% (мас./мас.). 5. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, где скорость растворения более чем примерно 80% достигается примерно через 6 ч.- 16011446 6. Твердая оральная лекарственная форма с модифицированным высвобождением по п.5, где активный ингредиент присутствует в количестве от примерно 1,0 до примерно 35% (мас./мас.). 7. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, где полимерный носитель представляет собой полимерную матрицу. 8. Твердая оральная лекарственная форма с модифицированным высвобождением по п.7, где полимерная матрица представляет собой набухаемую матрицу и включает гидроксипропилметилцеллюлозу. 9. Твердая оральная лекарственная форма с модифицированным высвобождением по п.8, где скорость растворения более чем примерно 80% достигается примерно через 12 ч и где гидроксипропилметилцеллюлоза присутствует в количествах от примерно 50 до примерно 80% (мас./мас.). 10. Твердая оральная лекарственная форма с модифицированным высвобождением по п.8, где скорость растворения более чем примерно 80% достигается примерно через 6 ч и где гидроксипропилметилцеллюлоза присутствует в количествах от примерно 20 до примерно 70% (мас./мас.). 11. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, дополнительно включающая наполнитель. 12. Твердая оральная лекарственная форма с модифицированным высвобождением по п.11, где наполнитель представляет собой моногидрат лактозы. 13. Твердая оральная лекарственная форма с модифицированным высвобождением по п.12, где скорость растворения более чем примерно 80% достигается примерно через 12 ч и где моногидрат лактозы присутствует в количестве от примерно 5 до примерно 50% (мас./мас.). 14. Твердая оральная лекарственная форма с модифицированным высвобождением по п.12, где скорость растворения более чем примерно 80% достигается примерно через 6 ч и где моногидрат лактозы присутствует в количестве от примерно 5 до примерно 75% (мас./мас.). 15. Твердая оральная лекарственная форма с модифицированным высвобождением по п.11, где наполнитель представляет собой микрокристаллическую целлюлозу. 16. Твердая оральная лекарственная форма с модифицированным высвобождением по п.15, где микрокристаллическая целлюлоза присутствует в количестве от примерно 5 до примерно 80% (мас./мас.). 17. Твердая оральная лекарственная форма с модифицированным высвобождением по п.11, где наполнитель представляет собой дикальцийфосфат. 18. Твердая оральная лекарственная форма с модифицированным высвобождением по п.17, где дикальцийфосфат присутствует в количестве от примерно 7 до примерно 40% (мас./мас.). 19. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, дополнительно включающая смазывающий агент. 20. Твердая оральная лекарственная форма с модифицированным высвобождением по п.19, где смазывающим агентом является стеарат магния. 21. Твердая оральная лекарственная форма с модифицированным высвобождением по п.20, где скорость растворения более чем примерно 80% достигается примерно через 12 ч и где стеарат магния присутствует в количестве от примерно 0,8 до примерно 1,2% (мас./мас.). 22. Твердая оральная лекарственная форма с модифицированным высвобождением по п.20, где скорость растворения более чем примерно 80% достигается примерно через 6 ч и где стеарат магния присутствует в количестве от примерно 0,4 до примерно 0,6% (мас./мас.). 23. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, дополнительно включающая один или более компонентов, выбранных из группы, состоящей из носителей, эксципиентов, агентов против сцепления, наполнителей, стабилизирующих агентов, связывающих агентов,красящих веществ и смазывающих агентов. 24. Твердая оральная лекарственная форма с модифицированным высвобождением, включающая:(f) от примерно 0,9 до примерно 1,1% (мас./мас.) стеарата магния; где скорость растворения мемантина гидрохлорида более чем примерно 80% достигается примерно через 12 ч. 25. Твердая оральная лекарственная форма с модифицированным высвобождением, включающая:(f) от примерно 0,4 до примерно 0,6% (мас./мас.) стеарата магния; где скорость растворения мемантина гидрохлорида более чем примерно 80% достигается примерно через- 17011446 6 ч. 26. Твердая оральная лекарственная форма с модифицированным высвобождением, включающая:(f) от примерно 0,4 до примерно 0,6% (мас./мас.) стеарата магния; где скорость растворения мемантина гидрохлорида более чем примерно 80% достигается примерно через 6 ч. 27. Твердая оральная лекарственная форма с модифицированным высвобождением, включающая:(f) от примерно 0,4 до примерно 0,6% (мас./мас.) стеарата магния; где скорость растворения мемантина гидрохлорида более чем примерно 80% достигается примерно через 6 ч. 28. Твердая оральная лекарственная форма с модифицированным высвобождением по любому из пп.24-27, где указанная твердая оральная лекарственная форма с модифицированным высвобождением представляет собой таблетку. 29. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, где скорость растворения, проявляемая указанной твердой оральной лекарственной формой с модифицированным высвобождением, примерно через 1 ч составляет по меньшей мере от примерно 10 до примерно 25%. 30. Твердая оральная лекарственная форма с модифицированным высвобождением по п.1, где скорость растворения, проявляемая указанной твердой оральной лекарственной формой с модифицированным высвобождением, через примерно от 2 до примерно 6 ч составляет по меньшей мере от примерно 30 до примерно 60%. 31. Применение лекарственной формы по п.1 для лечения легкой, умеренной или тяжелой деменции Альцгеймера. 32. Применение лекарственной формы по п.1 для лечения невропатической боли. 33. Способ лечения расстройства, выбранного из группы, состоящей из легкой, умеренной или тяжелой деменции Альцгеймера и невропатической боли, включающий введение твердой оральной лекарственной формы с модифицированным высвобождением по п.1. 34. Способ по п.33, где указанную лекарственную форму вводят 1 раз/день.
МПК / Метки
МПК: A61K 9/22, A61K 31/13
Метки: мемантина, формы, лекарственных, высвобождением, оральных, модифицированным, форм, препаративные
Код ссылки
<a href="https://eas.patents.su/22-11446-preparativnye-formy-oralnyh-lekarstvennyh-form-memantina-s-modificirovannym-vysvobozhdeniem.html" rel="bookmark" title="База патентов Евразийского Союза">Препаративные формы оральных лекарственных форм мемантина с модифицированным высвобождением</a>












