Конденсированные гетероциклические соединения, применимые для лечения ожирения и расстройств центральной нервной системы
Номер патента: 11581
Опубликовано: 28.04.2009
Авторы: Йоханссон Гари, Йенмальм Йенсен Анника, Бейерлейн Катарина
Формула / Реферат
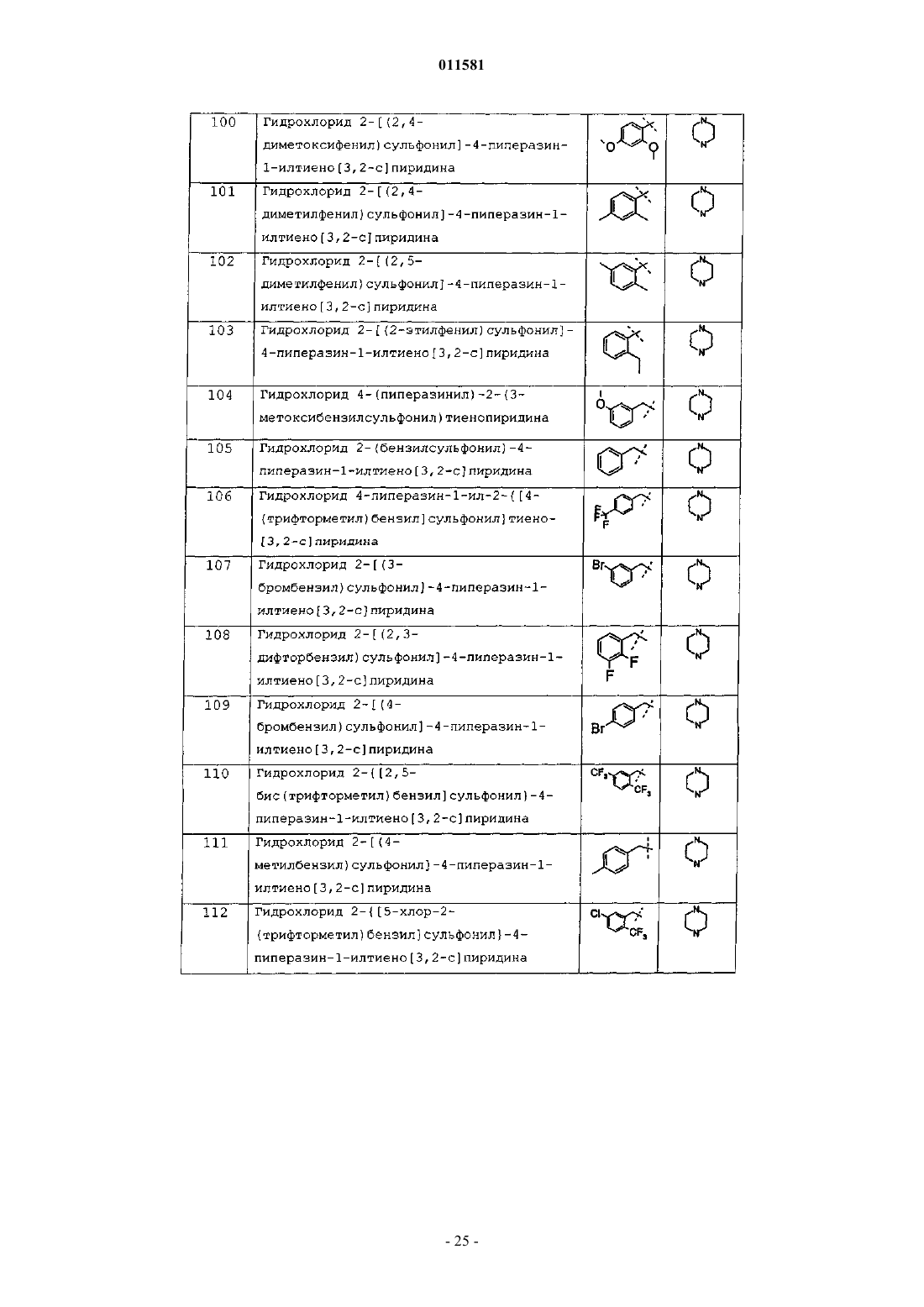
1. Соединение формулы (I)
или его фармацевтически приемлемая соль, где
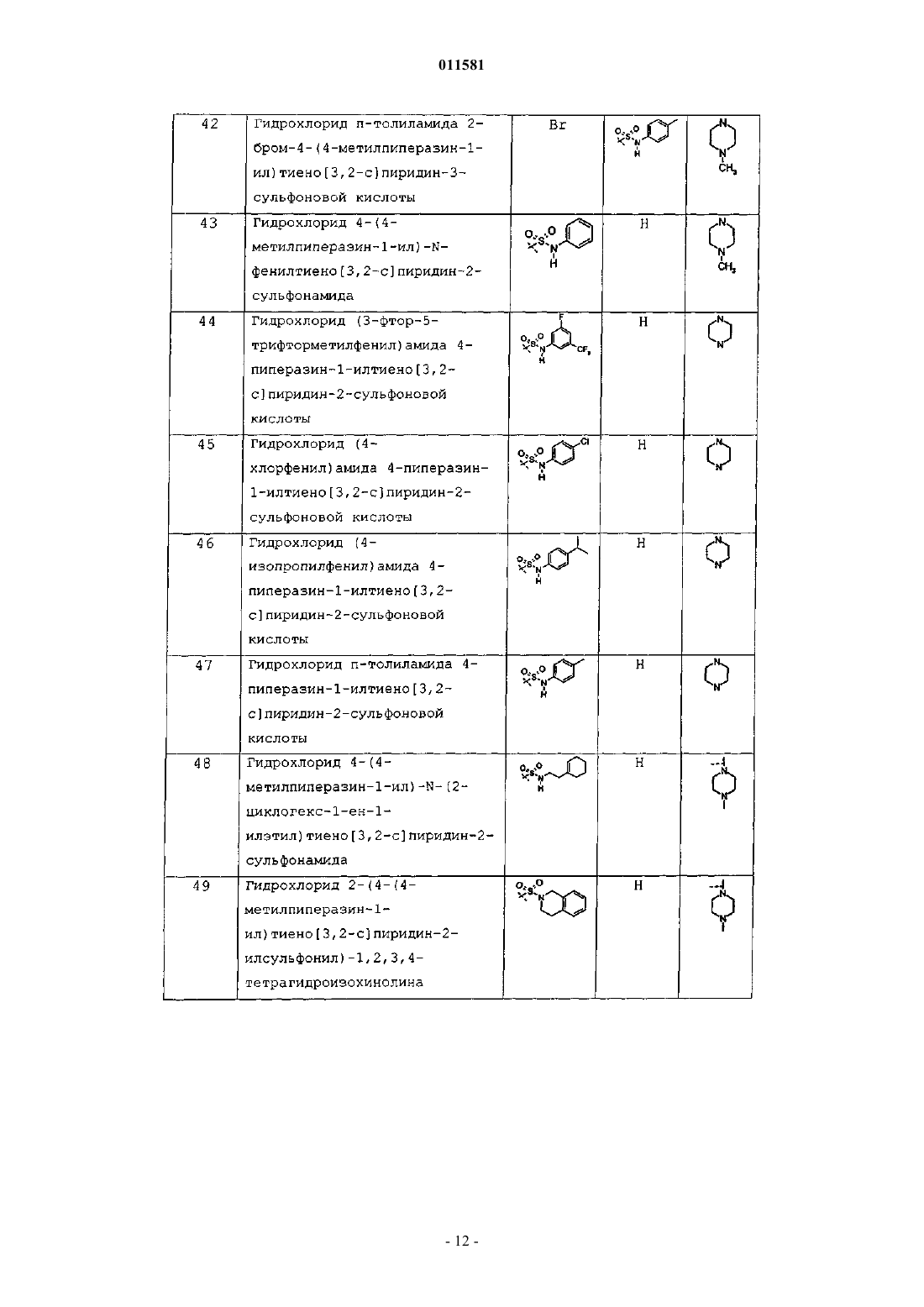
кольцо D представляет собой 5-членное гетероциклическое или гетероарильное кольцо, причем указанное кольцо включает один или два атома, выбранных из группы, включающей атомы азота, серы и кислорода, при условии, что, когда D содержит атом кислорода, D представляет собой гетероарил;
каждый W независимо представляет собой -N-, -(СН)- или -С-, при условии, что по меньшей мере одна группа W представляют собой -N-;
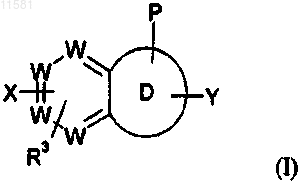
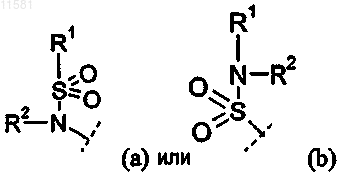
Р представляет собой группу формулы (а), (b) или (с)
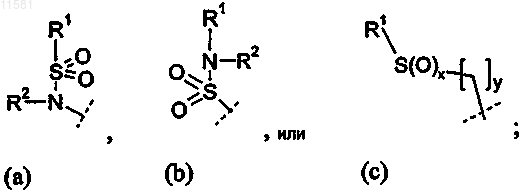
где х=0, 1 или 2 и у=0;
и Р и R3 могут быть присоединены к любому атому углерода, который допускает замещение, или когда Р представляет собой (с), тогда Р также может быть присоединен к любому атому азота в кольце D, который допускает замещение;
R1 представляет собой
(е) арилкарбонилэтил,
(g) С3-7 циклоалкил-С1-6 алкил, где циклическое кольцо является необязательно частично ненасыщенным, или
(h) группу Ar;
где Ar представляет собой
(a) фенил,
(b) 1-нафтил,
(c) 2-нафтил,
(d) арил-С1-6 алкил,
(f) 5-7-членное, необязательно ароматическое, частично насыщенное или полностью насыщенное моно- или бициклическое гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из атомов кислорода, серы и азота,
(g) бициклическая кольцевая система, включающая по меньшей мере одно гетероциклическое кольцо, соответствующее определению пункта (f), и группу Ar,
где группа Ar является замещенной в одном или нескольких положениях группами
(a) Н, X или Y или
(b) 5-7-членным, необязательно ароматическим, частично насыщенным или полностью насыщенным гетероциклическим кольцом, содержащим от 1 до 4 гетероатомов, выбранных из атомов кислорода, азота или серы;
R2 представляет собой
(a) Н или
(b) C1-6 алкил,
или R1 и R2 соединены с образованием группы -СН2СН2ОСН2СН2- или
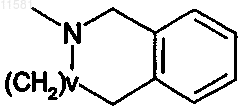
где v равно 0-2,
X и Y независимо представляют собой
(a) Н,
(b) галоген,
(c) C1-6 алкил,
(d) CF3,
(f) C1-6 алкокси,
(i) фенокси,
(m) -CN,
(о) прямые или разветвленные C1-6 алкилгалогениды,
(r) -NR4R5,
R4 и R5 независимо представляют собой
(b) C1-6 алкил;
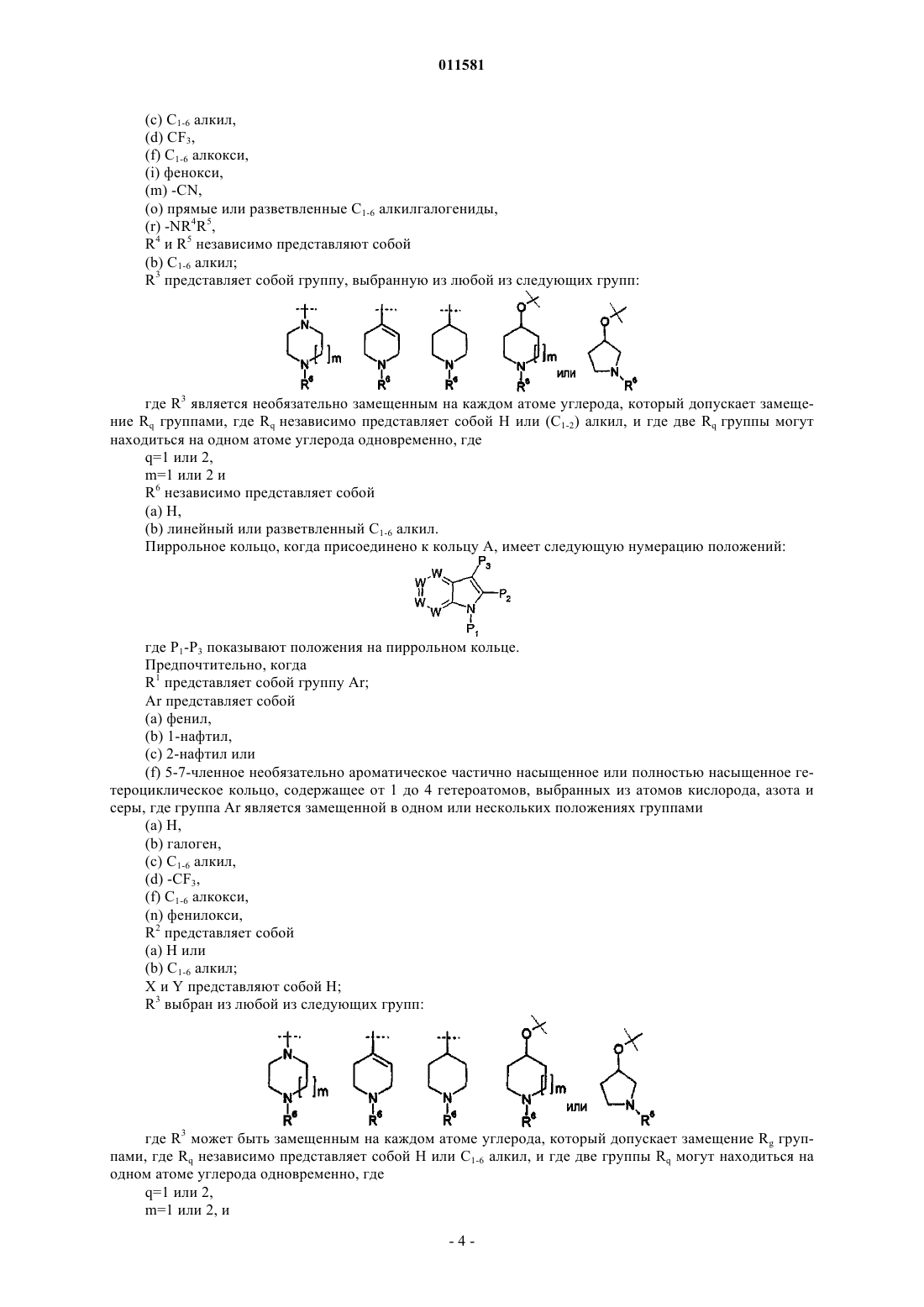
R3 представляет собой группу, выбранную из любой из следующих групп:
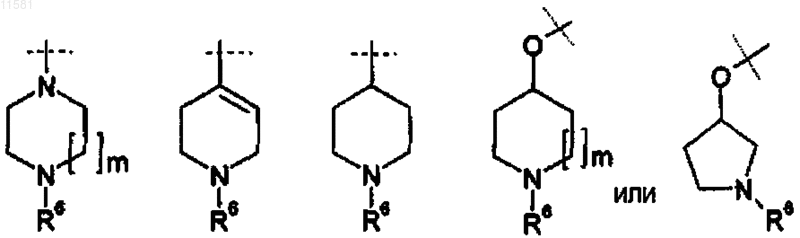
где R3 является необязательно замещенным на каждом атоме углерода, который допускает замещение Rq группами, где Rq независимо представляет собой Н или (С1-2)алкил, и где две Rq группы могут находиться на одном атоме углерода одновременно, где
q=1 или 2,
m=1 или 2 и
R6 независимо представляет собой
(a) Н,
(b) линейный или разветвленный C1-6 алкил.
2. Соединение по п.1, где
R1 представляет собой
группу Ar;
Ar представляет собой
(a) фенил,
(b) 1-нафтил,
(c) 2-нафтил или
(f) 5-7-членное, необязательно ароматическое, частично насыщенное или полностью насыщенное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из атомов кислорода, азота и серы, где группа Ar является замещенной в одном или нескольких положениях группами
(а) Н,
(b) галоген,
(c) C1-6 алкил,
(d) -CF3,
(f) C1-6 алкокси,
(n) фенилокси,
R2 представляет собой
(a) H или
(b) C1-6 алкил;
X и Y представляют собой Н;
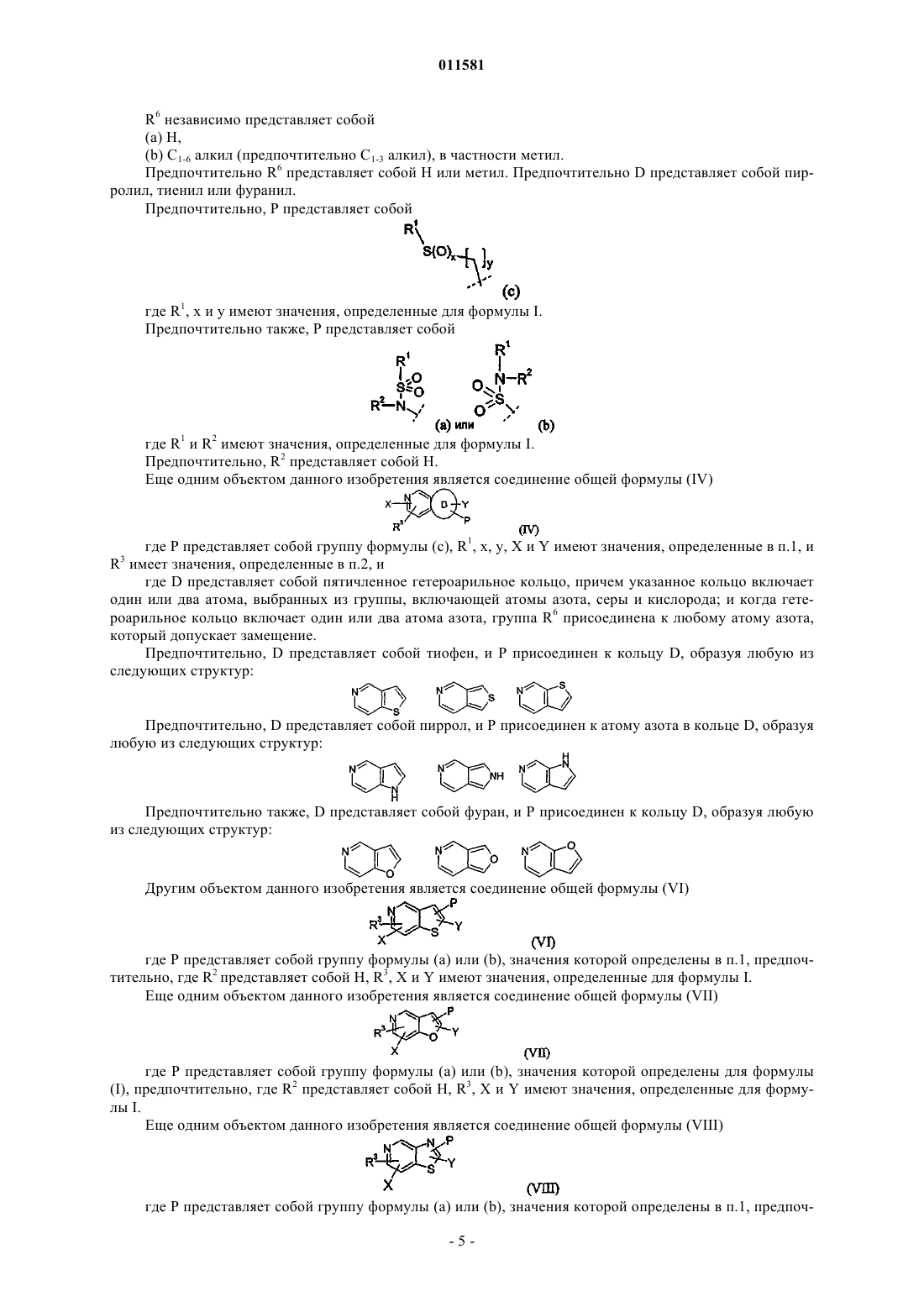
R3 выбран из любой из следующих групп:
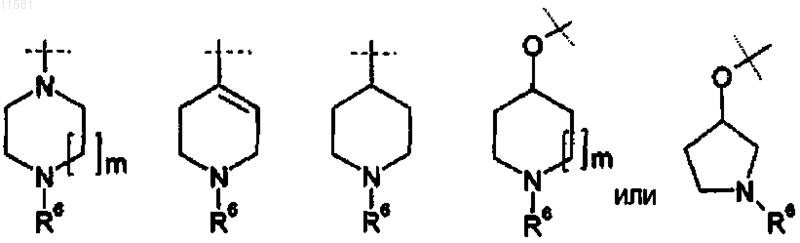
где m = 1 или 2, и
R6 независимо представляет собой
(a) Н,
(b) C1-6 алкил, в частности метил.
3. Соединение по любому из пп.1-2, где D представляет собой пирролил, тиенил или фуранил.
4. Соединение по любому из пп.1-3, где Р представляет собой
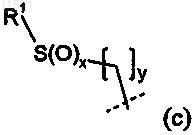
где R1, х и у имеют значения, определенные в п.1.
5. Соединение по любому из пп.1-3, где Р представляет собой
6. Соединение по п.5, где R2 представляет собой Н.
7. Соединение по п.4 общей формулы (IV)
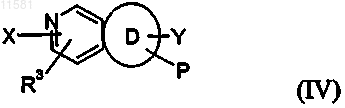
8. Соединение по любому из пп.5 или 6 общей формулы (VI)
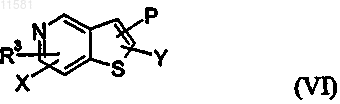
9. Соединение по любому из пп. 5 или 6 общей формулы (VII)
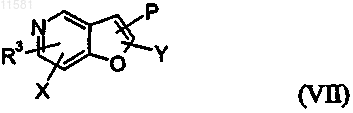
10. Соединение по п.7, которое представляет собой
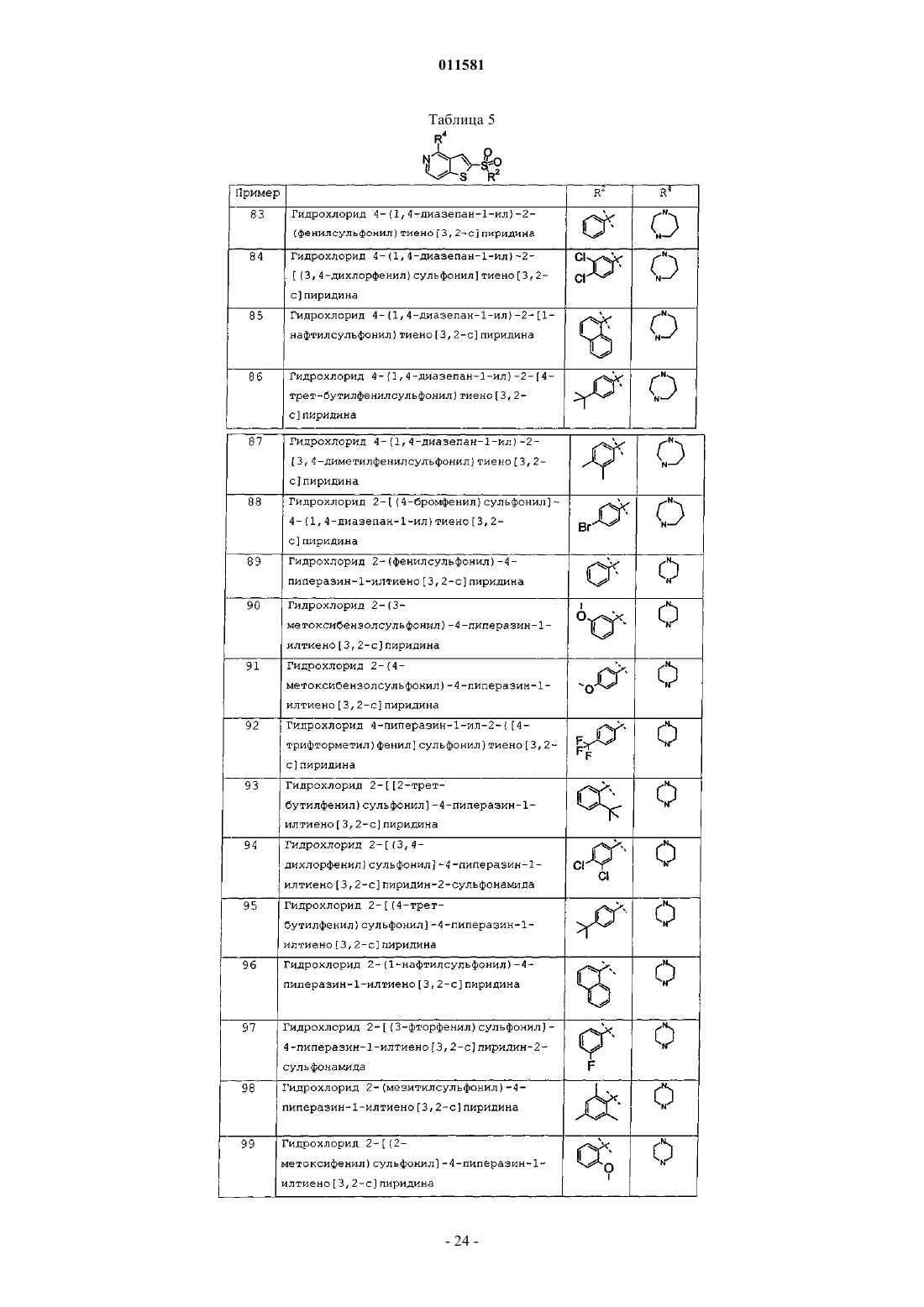
гидрохлорид 4-(1,4-диазепан-1-ил)-2-(фенилсульфонил)тиено[3,2-c]пиридина;
гидрохлорид 4-(1,4-диазепан-1-ил)-2-[(3,4-дихлорфенил)сульфонил]тиено[3,2-c]пиридина;
гидрохлорид 4-(1,4-диазепан-1-ил)-2-[4-трет-бутилфенилсульфонил]тиено[3,2-c]пиридина;
гидрохлорид 4-(1,4-диазепан-1-ил)-2-[4-трет-бутилфенилсульфонил]тиено[3,2-c]пиридина;
гидрохлорид 4-(1,4-диазепан-1-ил)-2-[3,4-диметилфенилсульфонил]тиено[3,2-c]пиридина;
гидрохлорид 2-[(4-бромфенил)сульфонил]-4-(1,4-диазепан-1-ил)тиено[3,2-c]пиридина;
гидрохлорид 2-(фенилсульфонил)-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 2-(3-метоксибензолсульфонил)-4-пиперазин-1-илтиено[3,2-с]пиридина;
гидрохлорид 2-(4-метоксибензолсульфонил)-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 4-пиперазин-1-ил-2-{[(4-трифторметил)фенил]сульфонил}тиено[3,2-c]пиридина;
гидрохлорид 2-[(2-трет-бутилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 2-[(3,4-дихлорфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид 2-[(4-трет-бутилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 2-(1-нафтилсульфонил)-4-пиперазин-1-илтиено[3,2-с]пиридина;
гидрохлорид 2-[(3-фторфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид 2-(мезитилсульфонил)-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 2-[(2-метоксифенил)сульфонил]-4-пиперазин-1-илтиено[3,2-с]пиридина;
гидрохлорид 2-[(2,4-диметоксифенил)сульфонил]-4-пиперазин-1-илтиено[3,2-с]пиридина;
гидрохлорид 2-[(2,4-диметилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 2-[(2,5-диметилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-с]пиридина;
гидрохлорид 2-[(2-этилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 4-(пиперазинил)-2-(3-метоксибензилсульфонил)тиенопиридина;
гидрохлорид 2-(бензилсульфонил)-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 4-пиперазин-1-ил-2-{[4-(трифторметил)бензил]сульфонил}тиено[3,2-c]пиридина;
гидрохлорид 2-[(3-бромбензил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 2-[(2,3-дифторбензил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 2-[(4-бромбензил)сульфонил]-4-пиперазин-1-илтиено[3,2-с]пиридина;
гидрохлорид 2-{[2,5-бис(трифторметил)бензил]сульфонил}-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 2-[(4-метилбензил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 2-{[5-хлор-2-(трифторметил)бензил]сульфонил}-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 2-[(3,5-диметоксибензил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 2-[(2-нафтилметил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина;
гидрохлорид 4-пиперазин-1-ил-2-{[4-(1,2,3-тиадиазол-4-ил)бензил]сульфонил}тиено[3,2-c]пиридина;
гидрохлорид 1-(4-пирролидин-1-илфенил)-2-[(4-пиперазин-1-илтиено[3,2-c]пиридин-2-ил)сульфонил] этанона; или
гидрохлорид 1-[4-(диэтиламино)фенил]-2-[(4-пиперазин-1-илтиено[3,2-c]пиридин-2-ил)сульфонил]этанона;
или его фармацевтически приемлемая соль.
11. Соединение по п.7, которое представляет собой
гидрохлорид 1-(4-метилфенилсульфонил)-4-пиперазин-1-ил-1Н-пирроло[3,2-c]пиридина;
гидрохлорид 1-(3-хлор-2-метилфенилсульфонил)-4-пиперазин-1-ил-1Н-пирроло[3,2-c]пиридина;
гидрохлорид 1-(3,4-диметоксифенилсульфонил)-4-пиперазин-1-ил-1Н-пирроло[3,2-c]пиридина;
гидрохлорид 4-(4-пиперазин-1-илпирроло[3,2-c]пиридин-1-сульфонил)бензонитрила;
гидрохлорид 1-(4,5-дихлортиофен-2-сульфонил)-4-пиперазин-1-ил-1Н-пирроло[3,2-c]пиридина;
гидрохлорид 1-(2-хлор-4-фторфенилсульфонил)-4-пиперазин-1-ил-1Н-пирроло[3,2-c]пиридина;
гидрохлорид 1-фенилметансульфонил-4-пиперазин-1-ил-1Н-пирроло[3,2-с]пиридина;
гидрохлорид 1-(5-хлортиофен-2-сульфонил)-4-пиперазин-1-ил-1Н-пирроло[3,2-c]пиридина;
гидрохлорид 1-(4-бутилбензолсульфонил)-4-пиперазин-1-ил-1Н-пирроло[3,2-c]пиридина;
гидрохлорид 1-(4-феноксибензолсульфонил)-4-пиперазин-1-ил-1Н-пирроло[3,2-c]пиридина;
гидрохлорид 1-(фенилсульфонил)-4-пиперазин-1-ил-1Н-пирроло[3,2-с]пиридина;
гидрохлорид 1-[(4-хлорфенил)сульфонил]-4-пиперазин-1-ил-1Н-пирроло[3,2-c]пиридина;
гидрохлорид 1-[(4-метоксифенил)сульфонил]-4-пиперазин-1-ил-1Н-пирроло[3,2-c]пиридина;
гидрохлорид 1-[(2-метокси-5-метилфенил)сульфонил]-4-пиперазин-1-ил-1Н-пирроло[3,2-c]пиридина; или
гидрохлорид 4-пиперазин-1-ил-1-{[2-(трифторметил)фенил]сульфонил}-1Н-пирроло[3,2-c]пиридина;
или его фармацевтически приемлемая соль.
12. Соединение по п.8, которое представляет собой
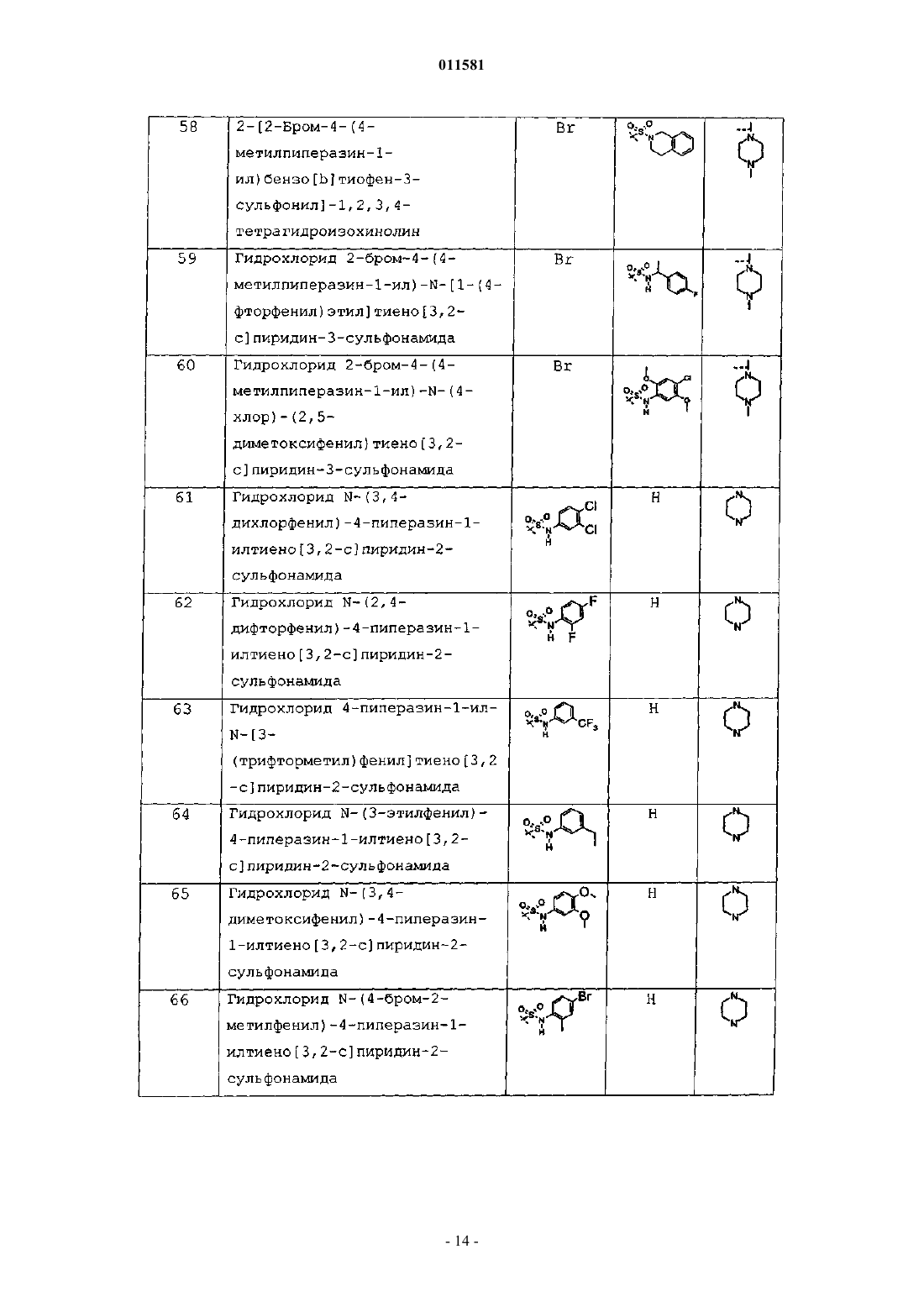
гидрохлорид N-(4-метилфенил)-4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид п-толиламида 2-бром-4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-3-сульфоновой кислоты;
гидрохлорид 4-(4-метилпиперазин-1-ил)-н-фенилтиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид (3-фтор-5-трифторметилфенил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид (4-хлорфенил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид (4-изопропилфенил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид п-толиламида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид 4-(4-метилпиперазин-1-ил)-N-(2-циклогекс-1-ен-1-илэтил)тиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид 2-(4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-2-илсульфонил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 4-(4-метилпиперазин-1-ил)-N-(2-тиен-2-илэтил)тиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид 4-(4-метилпиперазин-1-ил)-N-[1-(1-нафтил)этил]тиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид 4-(4-метилпиперазин-1-ил)-N-(4-гексилфенил)тиено[3,2-c]пиридин-2-сульфонамида;
N-(3-хлорбензил)-4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-2-сульфонамид;
гидрохлорид 4-(4-метилпиперазин-1-ил)-N-[1-(4-фторфенил)этил]тиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид N-(2,3-дифторбензил)-4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид 4-(4-метилпиперазин-1-ил)-N-(4-хлор-2,5-диметоксифенил)тиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид 2-бром-4-(4-метилпиперазин-1-ил)-N-(2-циклогекс-1-ен-1-илэтил)тиено[3,2-c]пиридин-3-сульфонамида;
гидрохлорид 2-бром-4-(4-метилпиперазин-1-ил)-N-[(1S)-1-(2-нафтил)этил]тиено[3,2-c]пиридин-3-сульфонамида;
гидрохлорид 2-бром-4-(4-метилпиперазин-1-ил)-N-[1-(4-фторфенил)этил]тиено[3,2-c]пиридин-3-сульфонамида;
2-бром-4-(4-метилпиперазин-1-ил)-N-(2,4,5-триметоксифенил)тиено[3,2-c]пиридин-3-сульфонамид;
гидрохлорид N-(3,4-дихлорфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид N-(2,4-дифторфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид 4-пиперазин-1-ил-N-[3-(трифторметил)фенил]тиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид N-(3-этилфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид N-(3,4-диметоксифенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид N-(4-бром-2-метилфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида;
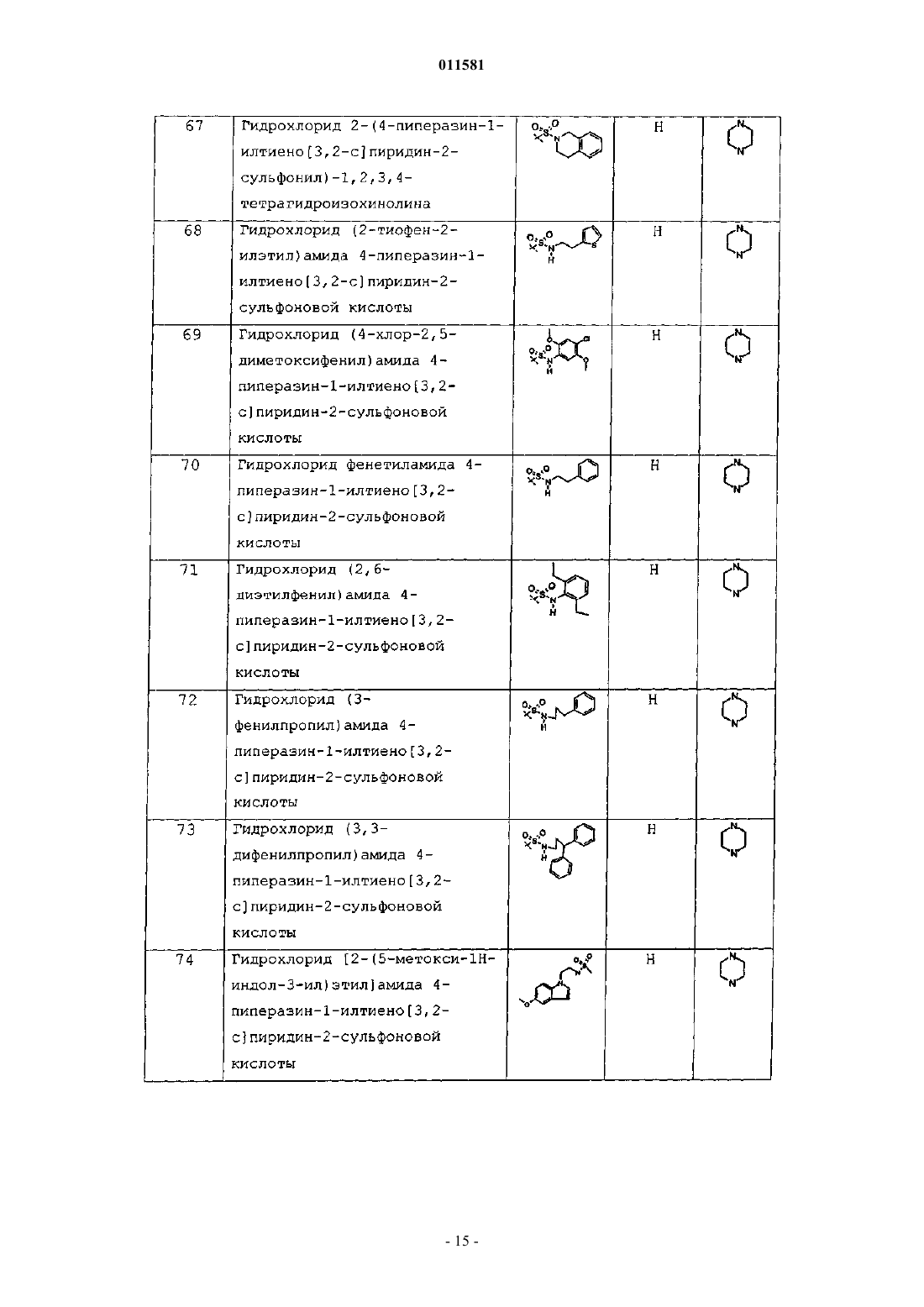
гидрохлорид 2-(4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорид (2-тиофен-2-илэтил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид (4-хлор-2,5-диметоксифенил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид фенетиламида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид (2,6-диэтилфенил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид (3-фенилпропил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид (3,3-дифенилпропил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид [2-(5-метокси-1Н-индол-3-ил)этил]амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид 4-трифторметилбензиламида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид бензилэтиламида 4-пиперазин-1-илтиено[3,2-с]пиридин-2-сульфоновой кислоты;
гидрохлорид N-(3-этилфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-3-сульфонамида;
гидрохлорид N-(4-изопропилфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-3-сульфонамида;
гидрохлорид N-(4-метилфенил)-4-(пирролидин-3-илокси)тиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид N-(4-метилфенил)-4-(пиперидин-4-илокси)тиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид N-(2,3-дифторбензил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид N-(3-хлорбензил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида;
гидрохлорид фениламида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид (4-трет-бутилфенил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид фениламида 4-(4-метилпиперазин-1-ил)тиено[3,2-с]пиридин-2-сульфоновой кислоты;
гидрохлорид (3-хлорфенил)амида 4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-2-сульфоновой кислоты;
гидрохлорид фениламида 2-бром-4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-3-сульфоновой кислоты;
гидрохлорид (4-метилфенил)амида 4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-3-сульфоновой кислоты; или
гидрохлорид N-фенил-7-пиперазин-1-илтиено[2,3-c]пиридин-2-сульфонамида;
или его фармацевтически приемлемая соль.
13. Применение соединения по любому из пп.1-12 для производства лекарственного средства для использования в лечении или профилактики расстройств центральной нервной системы.
14. Применение соединения по любому из пп.1-12 для получения лекарственного средства для применения при лечении или профилактике сахарного диабета II типа.
15. Применение соединения по любому из пп.1-12 для получения лекарственного средства для применения при лечении или профилактике ожирения, для достижения снижения массы тела и повышения массы тела.
Текст
011581 Связанные заявки По данной заявке испрашивается приоритет по заявке Швеции номер 0201925-5, поданной 20 июня 2002, заявке Швеции номер 0202908-0, поданной 1 октября 2002 года, заявке Швеции номер 0202181-4,поданной 11 июля 2002 года, заявке Швеции номер 0300357, поданной 10 февраля 2003 года, предварительной заявке США 60/406120, поданной 26 августа 2002 года, предварительной заявке США 60/434010, поданной 17 декабря 2002 года и предварительной заявке США 60/464701, поданной 23 апреля 2003 года, содержание которых включено в данное изобретение в виде ссылок. Область техники Данное изобретение относится к замещенным сульфоновым и сульфонамидным производным, к фармацевтическим композициям, включающим данные соединения, и к применению данных соединений для профилактики и лечения медицинских состояний, связанных с ожирением, сахарным диабетом 2 типа и/или расстройствами центральной нервной системы (ЦНС), для достижения снижения массы тела и повышения массы тела, а также для косметического применения. Предпосылки изобретения Ожирение - это состояние, которое характеризуется повышением содержания жира в организме, что приводит к избыточной по сравнению с общепринятыми нормами массе тела. На западе ожирение является наиболее важным расстройством пищеварения, и оно представляет собой серьезную проблему здравоохранения во всех индустриально-развитых странах. Это расстройство приводит к повышенной смертности вследствие увеличения случаев таких заболеваний, как сердечно-сосудистое заболевание, патология пищеварения, респираторное заболевание, рак и сахарный диабет 2 типа. Поиск соединений, которые снижают массу тела, проводился в течение многих десятилетий. Одним из направлений поиска стала активация серотонинергических систем либо направленной активацией серотониновых рецепторных подтипов, либо ингибированием повторного поглощения серотонина. Однако необходимый точный профиль рецепторных подтипов не известен. Серотонин (5-гидрокситриптамин или 5-НТ), ключевой трансмиттер периферийной и центральной нервной системы, модулирует широкий спектр физиологических и патологических функций, включая состояние беспокойства, регуляцию сна, агрессию, потребность в пище и депрессию. Было идентифицировано и клонировано множество подтипов рецепторов серотонина. Один из них, 5-НТ 6 рецептор, был клонирован несколькими группами в 1993 году (Ruat, M. et al. (1993) Biochem. Biophys. Res. Commun. 193: 268-276; Sebben, M. et al. (1994) NeuroReport 5: 2553-2557). Данный рецептор позитивно связан с аденилилциклазой и проявляет сродство в отношении антидепрессантов, таких как клозапин. Ранее в литературе было описано влияние 5-НТ 6 антагониста и 5-НТ 6 антисенсорных олигонуклеотидов на снижение поглощения пищи крысами (Bentley, J.C. et al. (1999) Br. J. Pharmac. Suppl. 126, P66; Bentley, J.C. etal. (1997) J. Psychopharmacol. Suppl. A64, 255; Woolley M.L. et al. (2001) Neuropharmacology). Соединения с повышенным сродством и селективностью в отношении 5-НТ 6 рецептора были идентифицированы, например, в WO 00/34242 и в публикации Isaac, M. et al. (2000) 6-Bicyclopiperazinyl-1arylsulfonylindoles and 6-Bicyclopiperidinyl-1-arylsulfonylindoles derivatives as novel, potent and selective 5HT6 receptor antagonists. BioorganicMedicinal Chemistry Letters 10: 1719-1721 (2000). Описание предшествующего уровня техники В публикации J.Med.Chem. 1970, 13(4), 592-598 описаны N-(4[2-(диэтиламино)этил]амино-1 нафтил)амиды; N-5,6,7,8-тетрагидро-4-[(3-пиперидинопропил)амино]-1-нафтиламиды и производные близких по структуре амидов и мочевин в качестве шистосомицидных средств. В WO 99/42465 описаны сульфонамидные производные, которые связываются с 5-НТ 6 рецептором и могут использоваться для лечения расстройств ЦНС, таких как состояние тревоги, депрессия, эпилепсия, обсессивно-компульсивные расстройства, расстройства познавательной способности, ADHD, анорексия и булимия, шизофрения, злоупотребление лекарственными средствами. В WO 01/32646 А 1 описаны соединения, которые связываются с 5-НТ 6 рецептором и используются для лечения расстройств ЦНС, а также, наряду с другими применениями, могут использоваться для лечения расстройств аппетита. В WO 99/37623 А 2 описаны соединения, которые связываются с 5-НТ 6 рецептором и используются для лечения расстройств ЦНС, а также, наряду с другими применениями, могут использоваться для лечения расстройств аппетита. В WO 99/42465 A3 описаны соединения, которые связываются с 5-НТ 6 рецептором и используются для лечения расстройств ЦНС, а также, наряду с другими применениями, могут использоваться для лечения расстройств аппетита. В ЕР 0815861 А 1 описаны соединения, которые связываются с 5-НТ 6 рецептором и используются для лечения расстройств ЦНС. В WO 99/02502 А 2 описаны соединения, которые связываются с 5-НТ 6 рецептором и используются для лечения расстройств ЦНС, а также, наряду с другими применениями, могут использоваться для лечения расстройств аппетита. В WO 98/27 081 А 1 описаны соединения, которые связываются с 5-НТ 6 рецептором и используются для лечения расстройств ЦНС, а также, наряду с другими применениями, могут использоваться для ле-1 011581 чения расстройств аппетита. В ЕР 0701819 описаны соединения, которые связываются с 5-НТ 1D рецептором и используются для лечения расстройств ЦНС и ожирения. В патенте США 6191141 и WO 01/12629 описаны соединения, которые связываются с 5-НТ 6 рецептором и используются для лечения расстройств ЦНС. Описание изобретения Неожиданно было установлено, что соединения формулы (I) проявляют сродство к 5-НТ 6 рецептору в качестве антагонистов в интервале низких наномольных значений. Соединения по данному изобретению и их фармацевтически приемлемые соли обладают активностью антагонистов, агонистов и частичных агонистов в отношении 5-НТ 6 рецепторов и, как полагают, могут применяться для лечения или профилактики ожирения и сахарного диабета 2 типа, для достижения снижения массы тела и повышения массы тела, а также для лечения или профилактики расстройств центральной нервной системы, таких как состояние беспокойства, депрессия, приступы панического страха, расстройства памяти, расстройства познавательной способности, расстройства сна, мигрень, анорексия, булимия, расстройства, связанные с алкоголизмом и курением, обсессивно-компульсивные расстройства, психозы, болезнь Альцгеймера,болезнь Паркинсона, болезнь Хантингтона и/или шизофрения, дефицит внимания (attention deficit hyperactivity disorders (ADHD, злоупотребление лекарственными средствами. Снижение массы тела и повышение массы тела (например, лечение расстройств, связанных с аномальной массой тела) достигается,наряду с другими средствами, снижением потребления пищевых продуктов. В данном описании термин расстройства, связанные с аномальной массой тела относится к расстройствам, вызванным нарушением баланса между поглощением энергии и расходованием энергии, что приводит к аномальной (например, избыточной) массе тела. Такие нарушения массы тела включают ожирение. Определения Если не заявлено или не указано другое значение, термин C1-6 алкил (или C2-6 алкенил) относится к группе с прямой или разветвленной углеводородной цепью, содержащей от 1 до 6 атомов углерода (или от 2 до 6 атомов углерода). Примеры указанной низшей алкильной группы включают метил,этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, а также пентил и гексил с прямой и разветвленной цепью. Алкенильные группы содержат в цепи одну или несколько двойных углеродуглеродных связей. Если не заявлено или не указано другое значение, термин C1-6 алкокси относится к алкоксигруппе с прямой или разветвленной цепью, содержащей от 1 до 6 атомов углерода. Примеры указанной низшей алкоксигруппы включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, вторбутокси, трет-бутокси, а также пентокси и гексокси с прямой и разветвленной цепью. Если не заявлено или не указано другое значение, термин C1-6 алкоксиалкил относится к алкоксиалкильной группе с прямой или разветвленной цепью, содержащей от 1 до 6 атомов углерода. Примеры указанной низшей алкоксиалкильной группы включают метоксиметил, этоксиметил, изопропоксиметил,н-бутоксиметил, трет-бутоксиэтил, а также пентоксиметил с прямой и разветвленной цепью. Термин C2-6 алкенил в данном описании относится к алкенильным группам с прямой или разветвленной цепью, содержащим от 2 до 6 атомов углерода. Типичные примеры таких групп включают винильную, аллильную, 2,3-диметилаллильную, 1-бутенильную, 1-пентенильную и 1-гексенильную группы. Термин C2-6 алкинил в данном описании относится к алкинильным группам с прямой и разветвленной цепью, содержащим от 2 до 6 атомов углерода. Типичные примеры таких групп включают этинильные, 1-пропинильные, 1-бутинильные, 1-пентинильные и 1-гексинильные группы. Если не заявлено или не указано другое значение, термин галоген будет означать фтор, хлор,бром или йод. Термин алкилгалогенид относится к алкильной группе, замещенной одной или несколькими галогеновыми группами (например, F, Cl, Br, I). Термин С 3-7 циклоалкил относится к циклической алкильной группе, содержащей кольцо от С 3 до С 7, которое может быть насыщенным или частично ненасыщенным. Примеры указанного циклоалкила включают циклопропил, циклобутил, циклопентил, циклопентенил, циклопентадиенил, циклогексил,метилциклогексил, циклогексенил, циклогексадиенил и циклогептил. Термин С 5-10 циклоалкенил относится к циклической алкенильной группе, содержащей кольцо от С 5 до С 10. Примеры указанного циклоалкенила включают 1-циклопентил, 2-циклопентенил, 1-циклогексенил, 1-циклогептенил, 1-циклооктенил, 1-циклононенил и 1-циклодеценил. Термин гетероцикл относится к углеводородной кольцевой системе, содержащей от 4 до 8 кольцевых атомов, из которых по меньшей мере один может представлять собой гетероатом (например, S, N или О) как часть кольца. Данный термин включает насыщенный, ненасыщенный, ароматический и неароматический гетероциклы. Подходящие гетероциклические группы включают тиенил, фурил, пиридил,пирролидинил, имидазолил, пиразолил, пиперидил, азепинил, морфолинил, пиранил, диоксанил, пиридазинил, пиримидинил и пиперазинил. Если не заявлено или не указано другое значение, термин арил относится к углеводородной-2 011581 кольцевой системе, содержащей по меньшей мере одно ароматическое кольцо. Примеры арильных групп включают фенил, циннамил, пенталенил, инденил, 1-нафтил, 2-нафтил, антрил и фенантрил. Термин гетероарил относится к углеводородной кольцевой системе, содержащей по меньшей мере одно ароматическое кольцо, которое содержит по меньшей мере один гетероатом, такой как О, N илиS. Примеры гетероарильных групп включают фурил, пирролил, тиенил, оксазолил, имидазолил, тиазолил, пиридинил, пиримидинил, хиназолинил и индолил. Соединения формулы (I) или его фармацевтически приемлемая соль, где кольцо D представляет собой пятичленное гетероциклическое или гетероарильное кольцо, причем указанное кольцо включает один или два атома, выбранных из группы, включающей атомы азота, серы и кислорода, при условии, что, когда D содержит атом кислорода, D представляет собой гетероарил; каждый W независимо представляет собой -N-, -(СН)- или -С-, при условии, что по меньшей мере одна группа W представляет собой -N-; Р представляет собой группу формулы (а), (b) или (с) где х=0, 1 или 2, и у=0; и Р и R3 могут быть присоединены к любому атому углерода, который допускает замещение, или когда Р представляет собой (с), тогда Р также может быть присоединен к любому атому азота в кольце D,который допускает замещение;(е) арилкарбонилметил,(g) С 3-7 циклоалкил-C1-6 алкил, где циклическое кольцо является необязательно частично ненасыщенным, или(a) фенил,(b) 1-нафтил,(c) 2-нафтил,(d) арил-С 1-6 алкил,(е) циннамил,(f) 5-7-членное, необязательно ароматическое, частично насыщенное или полностью насыщенное моно- или бициклическое гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из атомов кислорода, серы и азота,(g) бициклическая кольцевая система, включающая по меньшей мере одно гетероциклическое кольцо, соответствующее определению пункта (f), и группу Ar,где группа Ar является замещенной в одном или нескольких положениях группами(b) 5-7-членным, необязательно ароматическим, частично насыщенным или полностью насыщенным гетероциклическим кольцом, содержащим от 1 до 4 гетероатомов, выбранных из атомов кислорода,азота или серы;(c) C1-6 алкил,(d) CF3,(f) C1-6 алкокси,(i) фенокси,(m) -CN,(о) прямые или разветвленные C1-6 алкилгалогениды,(r) -NR4R5,R4 и R5 независимо представляют собойR3 представляет собой группу, выбранную из любой из следующих групп: где R3 является необязательно замещенным на каждом атоме углерода, который допускает замещение Rq группами, где Rq независимо представляет собой Н или (C1-2) алкил, и где две Rq группы могут находиться на одном атоме углерода одновременно, где(a) Н,(b) линейный или разветвленный C1-6 алкил. Пиррольное кольцо, когда присоединено к кольцу А, имеет следующую нумерацию положений: где P1-Р 3 показывают положения на пиррольном кольце. Предпочтительно, когдаR1 представляет собой группу Ar;(f) 5-7-членное необязательно ароматическое частично насыщенное или полностью насыщенное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из атомов кислорода, азота и серы, где группа Ar является замещенной в одном или нескольких положениях группамиR3 выбран из любой из следующих групп: где R3 может быть замещенным на каждом атоме углерода, который допускает замещение Rg группами, где Rq независимо представляет собой Н или C1-6 алкил, и где две группы Rq могут находиться на одном атоме углерода одновременно, где где R1, х и у имеют значения, определенные для формулы I. Предпочтительно также, Р представляет собой где R1 и R2 имеют значения, определенные для формулы I. Предпочтительно, R2 представляет собой Н. Еще одним объектом данного изобретения является соединение общей формулы (IV) где Р представляет собой группу формулы (с), R1, х, у, X и Y имеют значения, определенные в п.1, иR имеет значения, определенные в п.2, и где D представляет собой пятичленное гетероарильное кольцо, причем указанное кольцо включает один или два атома, выбранных из группы, включающей атомы азота, серы и кислорода; и когда гетероарильное кольцо включает один или два атома азота, группа R6 присоединена к любому атому азота,который допускает замещение. Предпочтительно, D представляет собой тиофен, и Р присоединен к кольцу D, образуя любую из следующих структур: 3 Предпочтительно, D представляет собой пиррол, и Р присоединен к атому азота в кольце D, образуя любую из следующих структур: Предпочтительно также, D представляет собой фуран, и Р присоединен к кольцу D, образуя любую из следующих структур: Другим объектом данного изобретения является соединение общей формулы (VI) где Р представляет собой группу формулы (а) или (b), значения которой определены в п.1, предпочтительно, где R2 представляет собой Н, R3, X и Y имеют значения, определенные для формулы I. Еще одним объектом данного изобретения является соединение общей формулы (VII) где Р представляет собой группу формулы (а) или (b), значения которой определены для формулы(I), предпочтительно, где R2 представляет собой Н, R3, X и Y имеют значения, определенные для формулы I. Еще одним объектом данного изобретения является соединение общей формулы (VIII) где Р представляет собой группу формулы (а) или (b), значения которой определены в п.1, предпоч-5 011581 тительно, где R2 представляет собой Н, R3, X и Y имеют значения, определенные для формулы I. Еще одним объектом данного изобретения является соединение общей формулы (IX)(e) -СН 2-СН 2-О-СН 3 и где Р представляет собой группу формулы (а) или (b), значения которой определены для формулы I,предпочтительно, где R2 представляет собой Н, X, Y и R3 имеют значения, определенные R3, X и Y имеют значения, определенные для формулы I. Еще одним объектом данного изобретения является соединение общей формулы (X) где Р представляет собой группу формулы (а) или (b), значения которой R3, X и Y имеют значения,определенные для формулы I, предпочтительно, где R2 представляет собой Н, X, Y и R3 имеют значения,R3, X и Y имеют значения, определенные для формулы I. Предпочтительными соединениями формулы (IV) являются гидрохлорид 4-(1,4-диазепан-1-ил)-2-(фенилсульфонил)тиено[3,2-c]пиридина; гидрохлорид 4-(1,4-диазепан-1-ил)-2-[(3,4-дихлорфенил)сульфонил]тиено[3,2-c]пиридина; гидрохлорид 4-(1,4-диазепан-1-ил)-2-(4-трет-бутилфенилсульфонил)тиено[3,2-c]пиридина; гидрохлорид 4-(1,4-диазепан-1-ил)-2-(4-трет-бутилфенилсульфонил)тиено[3,2-c]пиридина; гидрохлорид 4-(1,4-диазепан-1-ил)-2-(3,4-диметилфенилсульфонил)тиено[3,2-c]пиридина; гидрохлорид 2-[(4-бромфенил)сульфонил]-4-(1,4-диазепан-1-ил)тиено[3,2-c]пиридина; гидрохлорид 2-(фенилсульфонил)-4-пиперазин-1-илтиено[3,2-с]пиридина; гидрохлорид 2-(3-метоксибензолсульфонил)-4-пиперазин-1-илтиено[3,2-с]пиридина; гидрохлорид 2-(4-метоксибензолсульфонил)-4-пиперазин-1-илтиено[3,2-с]пиридина; гидрохлорид 4-пиперазин-1-ил-2-[4-(трифторметил)фенил]сульфонилтиено[3,2-c]пиридина; гидрохлорид 2-[(2-трет-бутилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-[(3,4-дихлорфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида; гидрохлорид 2-[(4-трет-бутилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-(1-нафтилсульфонил)-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-[(3-фторфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида; гидрохлорид 2-(мезитилсульфонил)-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-[(2-метоксифенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-[(2,4-диметоксифенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-[(2,4-диметилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-[(2,5-диметилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-[(2-этилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 4-(пиперазинил)-2-(3-метоксибензилсульфонил)тиенопиридина; гидрохлорид 2-(бензилсульфонил)-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 4-пиперазин-1-ил-2-[4-(трифторметил)бензил]сульфонилтиено[3,2-c]пиридина; гидрохлорид 2-[(3-бромбензил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-[(2,3-дифторбензил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-[(4-бромбензил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-[2,5-бис(трифторметил)бензил]сульфонил-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-[(4-метилбензил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-[5-хлор-2-(трифторметил)бензил]сульфонил-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-[(3,5-диметоксибензил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина; гидрохлорид 2-[(2-нафтилметил)сульфонил]-4-пиперазин-1-илтиено[3,2-с]пиридина; гидрохлорид 4-пиперазин-1-ил-2-[4-(1,2,3-тиадиазол-4-ил)бензил]сульфонилтиено[3,2-c]пиридина; гидрохлорид 1-(4-пирролидин-1-илфенил)-2-[(4-пиперазин-1-илтиено[3,2-c]пиридин-2-ил)сульфонил]этанона; и гидрохлорид 1-[4-(диэтиламино)фенил]-2-[(4-пиперазин-1-илтиено[3,2-c]пиридин-2-ил)сульфонил] этанона. Предпочтительными соединениями формулы (IV) являются-6 011581 гидрохлорид 1-(4-метилфенилсульфонил)-4-пиперазин-1-ил-1 Н-пирроло[3,2-c]пиридина; гидрохлорид 1-(3-хлор-2-метилфенилсульфонил)-4-пиперазин-1-ил-1 Н-пирроло[3,2-c]пиридина; гидрохлорид 1-(3,4-диметоксифенилсульфонил)-4-пиперазин-1-ил-1 Н-пирроло[3,2-c]пиридина; гидрохлорид 4-(4-пиперазин-1-илпирроло[3,2-c]пиридин-1-сульфонил)бензонитрила; гидрохлорид 1-(4,5-дихлортиофен-2-сульфонил)-4-пиперазин-1-ил-1 Н-пирроло[3,2-c]пиридина; гидрохлорид 1-(2-хлор-4-фторфенилсульфонил)-4-пиперазин-1-ил-1 Н-пирроло[3,2-c]пиридина; гидрохлорид 1-фенилметансульфонил-4-пиперазин-1-ил-1 Н-пирроло[3,2-c]пиридина; гидрохлорид 1-(5-хлортиофен-2-сульфонил)-4-пиперазин-1-ил-1 Н-пирроло[3,2-c]пиридина; гидрохлорид 1-(4-бутилбензолсульфонил)-4-пиперазин-1-ил-1 Н-пирроло[3,2-с]пиридина; гидрохлорид 1-(4-феноксибензолсульфонил)-4-пиперазин-1-ил-1 Н-пирроло[3,2-c]пиридина; гидрохлорид 1-(фенилсульфонил)-4-пиперазин-1-ил-1 Н-пирроло[3,2-c]пиридина; гидрохлорид 1-[(4-хлорфенил)сульфонил]-4-пиперазин-1-ил-1 Н-пирроло[3,2-c]пиридина; гидрохлорид 1-[(4-метоксифенил)сульфонил]-4-пиперазин-1-ил-1 Н-пирроло[3,2-c]пиридина; гидрохлорид 1-[(2-метокси-5-метилфенил)сульфонил]-4-пиперазин-1-ил-1 Н-пирроло[3,2-c]пиридина; и гидрохлорид 4-пиперазин-1-ил-1-[2-(трифторметил)фенил]сульфонил-1 Н-пирроло[3,2-c]пиридина. Предпочтительными соединениями формулы (VI) являются гидрохлорид N-(4-метилфенил)-4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-2-сульфонамида; гидрохлорид п-толиламида 2-бром-4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-3-сульфоновой кислоты; гидрохлорид 4-(4-метилпиперазин-1-ил)-н-фенилтиено[3,2-c]пиридин-2-сульфонамида; гидрохлоридN-(2,3-дифторбензил)-4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-2-сульфонамида; гидрохлорид 4-(4-метилпиперазин-1-ил)-N-(4-хлор-2,5-диметоксифенил)тиено[3,2-c]пиридин-2 сульфонамида; гидрохлорид 2-бром-4-(4-метилпиперазин-1-ил)-N-(2-циклогекс-1-ен-1-илэтил)тиено[3,2-c]пиридин-3-сульфонамида; гидрохлорид 2-бром-4-(4-метилпиперазин-1-ил)-N-[(1S)-1-(2-нафтил)этил]тиено[3,2-c]пиридин-3 сульфонамида; гидрохлорид 2-бром-4-(4-метилпиперазин-1-ил)-N-[1-(4-фторфенил)этил]тиено[3,2-c]пиридин-3 сульфонамида; 2-бром-4-(4-метилпиперазин-1-ил)-N-(2,4,5-триметоксифенил)тиено[3,2-c]пиридин-3-сульфонамид; гидрохлорид N-(3,4-дихлорфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида; гидрохлорид N-(2,4-дифторфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида; гидрохлорид 4-пиперазин-1-ил-N-[3-(трифторметил)фенил]тиено[3,2-c]пиридин-2-сульфонамида; гидрохлорид N-(3-этилфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида; гидрохлорид N-(3,4-диметоксифенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида; гидрохлорид N-(4-бром-2-метилфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида; гидрохлорид 2-(4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонил)-1,2,3,4-тетрагидроизохинолина; гидрохлорид (2-тиофен-2-илэтил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты; гидрохлорид (4-хлор-2,5-диметоксифенил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты; гидрохлорид фенетиламида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты; гидрохлорид (2,6-диэтилфенил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кисло-7 011581 ты; гидрохлорид (3-фенилпропил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты; гидрохлорид (3,3-дифенилпропил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты; гидрохлорид [2-(5-метокси-1 Н-индол-3-ил)этил]амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2 сульфоновой кислоты; гидрохлорид 4-трифторметилбензиламида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты; гидрохлорид бензилэтиламида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты; гидрохлорид N-(3-этилфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-3-сульфонамида; гидрохлорид N-(4-изопропилфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-3-сульфонамида; гидрохлорид N-(4-метилфенил)-4-(пирролидин-3-илокси)тиено[3,2-c]пиридин-2-сульфонамида; гидрохлорид N-(4-метилфенил)-4-(пиперидин-4-илокси)тиено[3,2-c]пиридин-2-сульфонамида; гидрохлорид N-(2,3-дифторбензил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида; гидрохлорид N-(3-хлорбензил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида; гидрохлорид фениламида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты; гидрохлорид (4-трет-бутилфенил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты; гидрохлорид фениламида 4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-2-сульфоновой кислоты; гидрохлорид (3-хлорфенил)амида 4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-2-сульфоновой кислоты; гидрохлорид фениламида 2-бром-4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-3-сульфоновой кислоты; гидрохлорид (4-метилфенил)амида 4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-3-сульфоновой кислоты; и гидрохлорид N-фенил-7-пиперазин-1-илтиено[2,3-c]пиридин-2-сульфонамида. Предпочтительными соединениями формулы (VII) являются гидрохлорид N-(4-метилфенил)-4-пиперазин-1-илфуро[3,2-c]пиридин-2-сульфонамида; гидрохлорид N-фенил-4-пиперазин-1-илфуро[3,2-c]пиридин-2-сульфонамида; и гидрохлорид N-фенил-7-пиперазин-1-илфуро[2,3-c]пиридин-2-сульфонамида. Предпочтительным соединением формулы (VIII) является гидрохлорид фениламида 4-пиперазин-1-илтиазоло[4,5-c]пиридин-2-сульфоновой кислоты. Предпочтительными соединениями формулы (IX) являются гидрохлорид N-(4-метилфенил)-4-пиперазин-1-ил-1 Н-пирроло[3, 2-c]пиридин-2-сульфонамида; гидрохлорид N-фенил-4-пиперазин-1-ил-1 Н-пирроло[3,2-c]пиридин-2-сульфонамида; и гидрохлорид N-фенил-7-пиперазин-1-ил-1 Н-пирроло[2,3-c]пиридин-2-сульфонамида. Другим объектом данного изобретения является способ получения соединения, описанного выше,где Р представляет собой где указанный способ включает следующие стадии: получение галогензамещенного пиридина, конденсированного с гетероароматическим 5-членным кольцом, восстановлением ароматической нитрогруппы; ароматическое нуклеофильное замещение с тиолом через промежуточное диазосоединение; окисление тиольного производного до сульфона; введение атома галогена посредством электрофильного ароматического замещения; ароматическое нуклеофильное замещение галогена диамином. Еще одним объектом данного изобретения является способ получения соединения, описанного выше, где Р представляет собой где указанный способ включает следующие стадии: получение пиридина, конденсированного с гетероароматическим 5-членным кольцом; введение карбоксильного фрагмента; преобразование карбоксильного фрагмента в аминогруппу посредством перегруппировки Курциуса; взаимодействие аминогруппы с сульфонилхлоридом. Еще одним объектом данного изобретения является способ получения соединения, описанного выше, где Р представляет собой где указанный способ включает следующие стадии: получение пиридина, конденсированного с гетероароматическим 5-членным кольцом; введение сульфонилхлоридного фрагмента нуклеофильным присоединением; взаимодействие сульфонилхлоридного фрагмента с анилином с получением сульфонамида; ароматическое нуклеофильное замещение хлора диамином. Все возможные диастереомерные формы (чистые энантиомеры, таутомеры, рацемические смеси и смеси, содержащие неравные количества двух энантиомеров) включены в объем данного изобретения. Такие соединения также могут существовать в виде цис- или транс-, Е- или Z-изомерных форм относительно двойной связи. Подразумеваются все изомерные формы. Соединения формул (I)-(XII) могут использоваться сами по себе или, когда это приемлемо, в виде их фармакологически приемлемых солей (кислотно- или основно-аддитивных солей). Фармакологически приемлемые аддитивные соли, которые упоминаются выше, как подразумевается, включают терапевтически активные нетоксичные кислотно- или основно-аддитивные солевые формы, которые способны образовывать соединения. Соединения, которые обладают основными свойствами, могут быть преобразованы в фармацевтически приемлемые кислотно-аддитивные соли обработкой основной формы подходящей кислотой. Типичные примеры кислот включают неорганические кислоты,такие как хлористо-водородная кислота, бромисто водородная кислота, йодисто водородная кислота,серная кислота, фосфорная кислота; и органические кислоты, такие как уксусная кислота, пропановая кислота, гидроксиуксусная кислота, молочная кислота, пировиноградная кислота, гликолевая кислота,малеиновая кислота, малоновая кислота, щавелевая кислота, бензолсульфоновая кислота, толуолсульфоновая кислота, метансульфоновая кислота, трифторуксусная кислота, фумаровая кислота, янтарная кислота, яблочная кислота, винная кислота, лимонная кислота, салициловая кислота, п-аминосалициловая кислота, памоевая кислота, бензойная кислота, аскорбиновая кислота и т.п. Типичными примерами основно-аддитивных солевых форм являются соли натрия, калия, кальция и соли с фармацевтически приемлемыми аминами, такими как, например, аммиак, алкиламины, бензатиин, и аминокислоты, такие как,например, аргинин и лизин. Термин аддитивная соль в данном описании включает сольваты, которые могут образовывать соединения и их соли, такие как, например, гидраты, алкоголяты и т.п. Для клинического применения соединения по данному изобретению вводятся в фармацевтические препараты для перорального, ректального, парентерального или другого способа введения. Фармацевтические препараты обычно получают смешением активного соединения или его фармацевтически приемлемой соли с общеизвестными фармацевтическими наполнителями. Кроме того, препараты могут также быть приготовлены известными методами, такими как гранулирование, компрессия, микроинкапсулирование, напыление покрытия и т.п. Препараты могут быть получены обычными методами в виде таблеток,капсул, гранул, порошков, сиропов, суспензий, суппозиториев или препаратов для инъекций, содержащих определенную дозу активного ингредиента. Жидкие препараты могут быть получены растворением или суспендированием активного соединения в воде или других подходящих носителях. Таблетки и гранулы могут содержать покрытие, нанесенное подходящим образом. Еще одним объектом данного изобретения является соединение, описанное выше, для применения в терапии. Еще одним объектом данного изобретения является соединение, описанное выше, для применения при лечении или профилактике расстройств, связанных с 5-НТ 6 рецептором, таких как ожирение, сахарный диабет II типа и/или расстройства центральной нервной системы, для достижения снижения массы тела и повышения массы тела. Еще одним объектом данного изобретения является соединение, описанное выше, для применения при лечении или профилактике расстройств центральной нервной системы. Еще одним объектом данного изобретения является соединение, описанное выше, для применения при лечении или профилактике сахарного диабета II типа. Еще одним объектом данного изобретения является соединение, описанное выше, для применения при лечении или профилактике ожирения, для достижения снижения массы тела и повышения массы тела. Еще одним объектом данного изобретения является фармацевтический препарат, включающий соединение, описанное выше, в качестве активного ингредиента в сочетании с фармацевтически приемлемым разбавителем или носителем. Еще одним объектом данного изобретения является фармацевтический препарат, включающий соединение, описанное выше, в качестве активного ингредиента для применения при лечении или профилактике расстройства, связанного с 5-НТ 6 рецептором, такого как ожирение, сахарный диабет II типа и/или расстройства центральной нервной системы, для достижения снижения массы тела и повышения массы тела. Еще одним объектом данного изобретения является соединение, описанное выше, в качестве актив-9 011581 ного ингредиента для применения при лечении или профилактике расстройств центральной нервной системы. Еще одним объектом данного изобретения является фармацевтический препарат, включающий соединение, описанное выше, в качестве активного ингредиента для применения при лечении или профилактике сахарного диабета II типа. Еще одним объектом данного изобретения является фармацевтический препарат, включающий соединение, описанное выше, в качестве активного ингредиента для применения при лечении или профилактике ожирения, для достижения снижения или повышения массы тела. Еще одним объектом данного изобретения является способ лечения или профилактики расстройства, связанного с 5-НТ 6 рецептором, такого как ожирение, сахарный диабет II типа и/или расстройства центральной нервной системы, для достижения снижения массы тела и повышения массы тела, который включает ведение субъекту (например, млекопитающему, человеку, лошади, собаке или кошке), нуждающемуся в таком лечении, эффективного количества одного или нескольких соединений, представленных любой из формул, описанных выше, их солевых форм или композиций, которые включают соединения или их солевые формы. Еще одним объектом данного изобретения является способ лечения или профилактики расстройств центральной нервной системы, который включает введение субъекту, нуждающемуся в таком лечении,эффективного количества одного или нескольких соединений, представленных любой из формул, описанных выше, их солевых форм или композиций, которые включают соединения или их солевые формы. Еще одним объектом данного изобретения является способ лечения или профилактики сахарного диабета II типа, который включает введение субъекту, нуждающемуся в таком лечении, эффективного количества одного или нескольких соединений, представленных любой из формул, описанных выше, их солевых форм или композиций, которые включают соединения или их солевые формы. Еще одним объектом данного изобретения является способ лечения или профилактики ожирения,который включает введение субъекту, нуждающемуся в таком лечении, эффективного количества одного или нескольких соединений, представленных любой из формул, описанных выше, их солевых форм или композиций, которые включают соединения или их солевые формы. Еще одним объектом данного изобретения является способ модуляции активности 5-НТ 6 рецептора,включающий введение субъекту, нуждающемуся в этом, эффективного количества одного или нескольких соединений, представленных любой из формул, описанных выше, их солевых форм или композиций,которые включают соединения или их солевые формы. Еще одним объектом данного изобретения является применение одного или нескольких соединений, представленных любой из формул, описанных выше, их солевых форм или композиций, которые включают соединения или их солевые формы, для получения лекарственного средства для применения при лечении или профилактике расстройства, связанного с 5-НТ 6 рецептором, такого как ожирение, сахарный диабет II типа и/или расстройства центральной нервной системы, для снижения массы тела и повышения массы тела. Еще одним объектом данного изобретения является применение одного или нескольких соединений, представленных любой из формул, описанных выше, их солевых форм или композиций, которые включают соединения или их солевые формы, для получения лекарственного средства для применения при лечении или профилактике расстройств центральной нервной системы. Еще одним объектом данного изобретения является применение одного или нескольких соединений, представленных любой из формул, описанных выше, их солевых форм или композиций, которые включают соединения или их солевые формы, для получения лекарственного средства для применения при лечении или профилактике сахарного диабета II типа. Еще одним объектом данного изобретения является применение одного или нескольких соединений, представленных любой из формул, описанных выше, их солевых форм или композиций, которые включают данные соединения или их солевые формы, для получения лекарственного средства для применения при лечении или профилактике ожирения, для достижения снижения массы тела и повышения массы тела. Способы, описанные в данном изобретении, включают также стадию идентификации субъекта, нуждающегося в лечении ожирения, сахарного диабета II типа или расстройств центральной нервной системы, или нуждающегося в снижении массы тела и повышении массы тела. Изобретение также относится к косметическому применению одного или нескольких соединений,представленных любой из формул, описанных выше, с целью снижения массы, а также в виде косметических композиций, содержащих указанные соединения. Кроме того, изобретение относится к нетерапевтическому способу улучшения внешнего вида тела млекопитающего, в том числе человека, который включает пероральное введение указанному млекопитающему одного или нескольких соединений, представленных любой из формул, описанных выше. Термин эффективное количество относится к количеству соединения, которое гарантирует терапевтическое воздействие на субъект, проходящий лечение. Терапевтическое воздействие может оцениваться объективно (то есть может измеряться с помощью некоторого испытания или маркера) или субъ- 10011581 ективно (то есть субъект говорит о показании или об ощущении действия). Для клинического применения соединения по данному изобретению включены в состав фармацевтических препаратов для перорального, ректального, парентерального или другого способа введения. Обычно количество активных соединений находится в интервале от 0,1 до 95% массы препарата, предпочтительно, в интервале 0,2-20% массы в препаратах для парентерального применения, и, предпочтительно, в интервале от 1 до 50% массы в препаратах для перорального введения. Обычная суточная доза активного соединения изменяется в широких пределах и будет зависеть от различных факторов, таких как, например, индивидуальная потребность каждого пациента и способ введения. Обычно дозировки для перорального и парентерального введения будут находиться в интервале от 5 до 1000 мг в день активного соединения, предпочтительно от 50 до 150 мг в день. Способы получения В дополнительном аспекте данное изобретение относится к способу получения соединений любой из представленных в данном описании формул, который включает взаимодействие любого одного или нескольких соединений представленных в описании формул, включая любые способы, описанные в данном изобретении. Соединения, представленные описанными выше формулами, могут быть получены стандартными способами или аналогичными способами, например, способами, аналогичными представленным далее. Используемые в упомянутых выше способах химические соединения могут включать, например,растворители, реагенты, катализаторы, реагенты введения или удаления защитной группы. Способы, описанные выше, могут также дополнительно включать стадии, проводимые до или после описанных стадий, для добавления или удаления подходящих защитных групп и для осуществления, в конечном счете, синтеза соединений, представленных любой из описанных выше формул, их солевых форм или композиций, которые включают соединения или их солевые формы. Кроме того, различные стадии синтеза могут проводиться в другой последовательности или в другом порядке для получения целевых соединений. Методы изменения последовательности химического синтеза и применения защитных групп (введение и удаление защиты), которые могут быть использованы для синтеза соединений,которые могут использоваться далее, известны в данной области техники и включают, например, методы, описанные в публикациях: R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989);Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и последующих редакциях этого издания. Конкретные примеры, представленные ниже, следует рассматривать только как иллюстративные, а не ограничивающие объем данного изобретения. Без дополнительного уточнения считается, что квалифицированный специалист данной области техники на основе данного описания сможет применить данное изобретение с наибольшей полнотой. Все публикации, приведенные здесь, введены в данное описание во всей полноте в виде ссылок. Способы Спектры 1 Н-ЯМР и 13 С-ЯМР регистрировались на спектрометре Bruker Advance DPX 400 при 400,1 и 100,6 МГц, соответственно. Все спектры записывались с использованием остаточного растворителя или тетраметилсилана (ТМС) в качестве внутреннего стандарта. ИК спектры записывались на спектрофотометре Perkin-Elmer Spectrum 1000 FT-IR. Спектры ион-распылительной масс-спектрометрии (МС) получены на масс-спектрометре Perkin-Elmer API 150EX. Точные определения массы проводились с использованием двойного датчика Micromass LCT. Препаративная ВЭЖХ/МС проводилась с использованием системы Waters/Micromass Platform ZQ, снабженной системой А (колонка АСЕ 5 С 8 (1950 мм) элюенты: MilliQ вода, MeCN и MilliQ вода/MeCN/O,1% ТФУК) и системой В (колонка Xterra MS С 18,05 мкм (1950 мм), элюенты: MilliQ вода, MeCN и NH4HCO3 (100 мМ. Анализ методом ВЭЖХ проводился на аппарате Agilent 1100 [колонка АСЕ 3 С 8 (система А) или колонка YMC-Pack (система В), элюенты:MilliQ/0,1% ТФУК и MeCN]. Элементный анализ проводился на аппарате Vario El. Препаративная флэшхроматография проводилась на силикагеле Merk 60 (230-400 меш). Таблица 4- 16011581 Пояснения к схеме 5: i) Малоновая кислота, пиридин, пиперидин, нагрев; ii) этилхлорформиат, ацетон, NaN3, -10 С; iii) дифениловый эфир, 220 С; iv) POCl3, нагрев; v) газообразный SO2, н-BuLi, Nхлорсукцинимид, CH2Cl2; vi) R1-NH2, пиридин; vii) HR3, K2CO3, ДМСО, нагрев. Промежуточный продукт 47. (2 Е)-3-(5-Бромтиен-2-ил)акриловая кислота. Малоновую кислоту (44,40 г, 426,7 ммоль) добавляют к смеси 5-бромтиофен-2-карбальдегида (50 г,261,7 ммоль), пиперидина (2,84 мл) и пиридина (150 мл). Смесь кипятят с обратным холодильником в течение 1 ч при 80 С и затем при 100 С в течение ночи. Летучие растворители выпаривают, остаток растворяют в воде и подкисляют соляной кислотой (рН 2). Сырой продукт кристаллизуют в этаноле. Выход: 55,24 г (90,5%). 1 Н-ЯМР (270 МГц, CH3OH-d4)м.д. 6,14 (д, J=15,83 Гц, 1H), 7,11-7,16 (м, 2 Н), 7,68 (д,J=16,36 Гц, 1H); МС 233,1 (М-Н)+; чистота (ВЭЖХ) 94%. Промежуточный продукт 48. (2 Е)-3-(5-Бромтиен-2-ил)акрилоилазид. К раствору (2 Е)-3-(5-бромтиен-2-ил)акриловой кислоты (1,04 г, 4,46 ммоль) в хлороформе (20 мл) добавляют тионилхлорид (1,04 мл), смесь кипятят с обратным холодильником в течение 2 ч при 75 С и используют на следующей стадии. Полученный раствор по каплям добавляют при перемешивании к суспензии азида натрия (0,58 г, 8,93 ммоль), диоксана (3 мл) и воды (3 мл) при охлаждении на ледяной бане. Спустя 10 мин образующийся осадок отфильтровывают и промывают водой. Остаток растворяют в дихлорметане, сушат MgSO4, фильтруют и растворитель удаляют, получая 0,96 г (83,4%) продукта. 1 Н-ЯМР(М-Н)+; чистота (ВЭЖХ) 65%. Промежуточный продукт 49. 2-Бромтиено[3,2-с]пиридин-4(5 Н)-он. Раствор (2 Е)-3-(5-бромтиен-2-ил)акрилоилазида (18,00 г, 69,7 ммоль) в дихлорметане (100 мл) добавляют по каплям к дифениловому эфиру (90 мл) при 150 С. Температуру поднимают до 220 С и выдерживают смесь при этой температуре в течение 1 ч. Смесь охлаждают до комнатной температуры и добавляют к эфиру. Образующийся твердый осадок собирают фильтрованием. Выход: 13,58 г (84,6%). 1H-ЯМР (270 МГц, ДМСО-d6)6,82 (д, J=7,13 Гц, 1 Н), 7,27 (д, J=6,86 Гц,1 Н), 7,54 (с, 1 Н), 11,55 (с, 1 Н); МС 230,1 (М-Н)+; чистота (ВЭЖХ) 92%. Промежуточный продукт 50. 2-Бром-4-хлортиено[3,2-c]пиридин. Оксихлорид фосфора (4,08 г, 26,6 ммоль) по каплям добавляют к 2-бромтиено[3,2-c]пиридин-4(5 Н)ону (2,04 г, 8,87 ммоль) при 0 С. Смесь нагревают до 135 С и выдерживают при этой температуре в течение 2,5 ч, затем осторожно выливают в смесь воды со льдом. Образующийся осадок собирают фильтрованием и сушат, получая 1,78 г (80,7%) указанного в заголовке продукта. 1H-ЯМР (270 МГц CH3OH-d4)м.д. 7,67 (д, 1 Н), 7,88 (дддд, J=6,33 Гц, 2 Н), 8,19 (д, J=5,54 Гц, 1H); МС 248,0 (М-Н)+; чистота (ВЭЖХ) 100%. Промежуточный продукт 51 и 52. 4-Хлортиено[3,2-с]пиридин-2-сульфонилхлорид и 2-бром-4-хлортиено[3,2-c]пиридин-3-сульфонилхлорид. н-Бутиллитий (1,5 мл, 2,4 ммоль) добавляют к 2-бром-4-хлортиено[3,2-c]пиридину (0,5 г, 2 ммоль),растворенному в сухом ТГФ (15 мл) при -78 С в атмосфере азота. Смесь перемешивают в течение 40 мин. Полученный выше раствор добавляют в сухой эфир, насыщенный SO2 (газ.), при -78 С. Смесь нагревают до комнатной температуры и добавляют эфир. Осадок удаляют фильтрованием. Получают два продукта, указанных в заголовке, и используют их на следующей стадии без дополнительной очистки следующим образом: N-хлорсукцинимид (2,07 г, 10,3 ммоль) добавляют к [(4-хлортиено[3,2-c]пиридин 2-ил)сульфонил]литию и [(2-бром-4-хлортиено[3,2-c]пиридин-3-ил)сульфонил]литию в дихлорметане(150 мл) при 0 С. Смесь нагревают до 60 С и выдерживают при этой температуре в течение 2 ч, экстрагируют водой (350 мл). Органическую фазу отделяют, сушат MgSO4, фильтруют и летучие растворители удаляют отгонкой в вакууме. Сырые продукты используют на следующей стадии без дополнительной очистки. Промежуточный продукт 53 и 54. п-Толиламид 4-хлор-2-тиено[3,2-с]пиридин-2-сульфоновой кислоты и п-толиламид 2-бром-4-хлортиено[3,2-с]пиридин-3-сульфоновой кислоты. п-Толуидин (30 мг, 2,87 ммоль) добавляют к раствору 4-хлортиено[3,2-c]пиридин-2-сульфонилхлорида и 2-бром-4-хлортиено[3,2-c]пиридин-3-сульфонилхлорида (0,07 г, 0,26 ммоль) в дихлорметане и пиридине (0,19 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Растворитель удаляют в вакууме и сырую смесь используют на следующей стадии без дополнительной очистки. Пример 41 и 42. Гидрохлорид п-толиламида 4-(4-метилпиперазин-1-ил)тиено[3,2-с]пиридин-2-сульфоновой кислоты и гидрохлорид п-толиламида 2-бром-4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-3 сульфоновой кислоты. Смесь п-толиламида 4-хлор-2-тиено[3,2-c]пиридин-2-сульфоновой кислоты и п-толиламида 2-бром 4-хлортиено[3,2-c]пиридин-3-сульфоновой кислоты (70 мг, 0,21 ммоль) в ДМСО (2 мл), 1-метилпиперазин (0,344 мл, 3,1 ммоль) и K2CO3 (28,5 мг, 0,21 ммоль) нагревают до 100 С и выдерживают при этой температуре в течение ночи. Реакционную смесь растворяют в воде и экстрагируют этилацетатом (310 мл). Органические слои объединяют и растворитель удаляют. Продукты очищают ВЭЖХ, получая 1,9 мг- 17011581 п-толиламида 4-(4-метилпиперазин-1-ил)тиено[3,2-c]пиридин-2-сульфоновой кислоты. Свободное основание преобразуют в гидрохлоридную соль обработкой HCl в эфире: 1H-ЯМР (270 МГц, метанол-d4)м.д. 2,26 (с, 3 Н), 2,98 (с, 3 Н), 3,40-3,55 (м, 8 Н), 7,02-7,10 (м, 6 Н), 7,55 (д, J=5,81 Гц, 1 Н), 7,69 (с, 1 Н), 8,13(д, J=5,81 Гц, 1H); ЖХ-МС 403 (М+Н)+; чистота (ЖХ-МС) 92%; и 3,8 мг п-толиламида 2-бром-4-(4 метилпиперазин-1-ил)тиено[3,2-c]пиридин-3-сульфоновой кислоты. Свободное основание преобразуют в гидрохлоридную соль обработкой HCl в эфире: 1H-ЯМР (270 МГц, метанол-d4)м.д. 2,21 (с, 1 Н), 3,00 (д,3 Н), 3,50-3,77 (м, 8 Н), 7,00-7,10 (м, 6 Н), 7,63 (д, J=5,81 Гц, 1H), 8,19 (д, J=5,81 Гц, 1H); ЖХ-МС 481(М+Н)+; чистота (ЖХ-МС) 98%. Взаимодействие сульфонилхлорида с аминами (способ Н). К раствору амина (1,3 экв.) и пиридина (8 экв.) в ДХМ добавляют сульфонилхлорид (1 экв.) и реакционную смесь перемешивают в течение ночи. После добавления Trisamine (2 экв.) смесь осторожно встряхивают в течение дополнительных 3 ч. Суспензию фильтруют через небольшой слой диоксида кремния с использованием ДХМ и этилацетата. Растворитель выпаривают, остаток растворяют в ДХМ и промывают 1 М водной HCl (2 раза). Объединенные органические фазы сушат (MgSO4), фильтруют и растворитель удаляют, получая сульфонамид. При получении продуктов недостаточной чистоты их очищают флэш-хроматографией на силикагеле. Продукты использует на следующей стадии (методика В). Связывание с ароматическими аминами (способ I). В полученные в способе Н реакционные смеси, растворенные в ДМСО (2 мл), добавляют амины (15 экв.) и K2CO3 (1 экв.). Реакционные смеси перемешивают при 100 С в течение 24 ч и затем концентрируют. Продукты очищают ЖХ-МС. Растворители удаляют в вакууме с использованием SpeedVac и очищают препаративной ЖХ/МС. Продукты, которые являются недостаточно чистыми (чистота 90%),очищают препаративной хроматографией с использованием градиентов ацетонитрил-вода, содержащих 0,1% трифторуксусной кислоты. После ВЭЖХ анализа фракции с чистотой 90% собирают и концентрируют. Удаление защиты аминогруппы в пиперазине проводят сначала растворением соединения в метаноле и добавлением небольшими порциями 1 М HCl/эфир. Реакционные смеси анализируют ТСХ. Растворители концентрируют в вакууме с использованием SpeedVac. Удаление защитной ВОС-группы (способ L). Сульфоновое или сульфонамидное производное (полученное способами Н и I) растворяют в небольшом количестве смеси МеОН/ДХМ 1:1 и обрабатывают избыточным количеством 1 М HCl в диэтиловом эфире. Перемешивание при комнатной температуре в течение ночи приводит к образованию осадка, который собирают фильтрованием, получая продукты в форме их гидрохлоридов. Пример 43. Гидрохлорид 4-(4-метилпиперазин-1-ил)-N-фенилтиено[3,2-c]пиридин-2-сульфонамида. Синтез проводят по существу в соответствии со способами Н-L. Выход: 8,1 мг (33,8%). 1 Н-ЯМР- 18011581 К раствору 4-хлортиено[3,2-c]пиридин-2-сульфонилхлорида (0,640 г, 2,39 ммоль) в ДХМ (20 мл) добавляют пиридин (1,9 мл, 23,9 ммоль) и затем п-толиламин (0,307 г, 2,86 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч. Смесь концентрируют, снова растворяют в ДМСО (10 мл) и добавляют трет-бутиловый эфир пиперазин-1-карбоновой кислоты (1,34 г, 7,17 ммоль) и K2CO3 (0,989 г, 7,17 ммоль). Смесь перемешивают при 100 С в течение 16 ч и затем концентрируют. Сырую реакционную смесь растворяют в EtOAc (100 мл) и промывают насыщенным раствором соли (250 мл). Органическую фазу сушат (Na2SO4) и концентрируют. Сырой промежуточный продукт очищают колоночной хроматографией на диоксиде кремния с использованием смеси EtOAc/н-пентан (1:1) в качестве элюента. Промежуточный продукт растворяют в EtOAc/MeOH и добавляют диэтиловый эфир, насыщенный HCl (газ.). Смесь перемешивают при комнатной температуре в течение 16 ч. Осадок собирают фильтрованием и промывают смесью диэтиловый эфир/н-пентан, получая 0,475 г сырого продукта. Очистка препаративной ВЭЖХ с обращенной фазой приводит к получению 0,133 г чистого продукта: 1H-ЯМР (ДМСО-d6, 25 С, 270,17 МГц)10,61 (шир.с, 1 Н), 9,23 (шир.с, 2 Н),8,13 (д, J=5,80 Гц, 1H), 7,91 (с, 1 Н), 7,67 (д, J=5,80 Гц, 1 Н), 7,09-7,07 (м, 4 Н), 3,68-3,59 (м, 4 Н), 3,33-3,22(м, 2 Н), 4,26-4,25 (м, 2 Н), 4,11-4,08 (м, 2 Н), 3,54-3,52 (м, 2 Н), 3,28-3-24 (м, 2 Н), 2,68 (с, 3 Н), 2,86-2,60 (2 Н закрыт сигналом растворителя); ЖХ-МС 438,10 (М-Н)+; чистота (ЖХ-МС) 93%. Пример 56. Гидрохлорид 4-(4-метилпиперазин-1-ил)-N-(4-хлор-2,5-диметоксифенил)тиено[3,2-c] пиридин-2-сульфонамида. Синтез проводят по существу в соответствии с методикой способа H-L. Выход: 14,6 мг. 1H-ЯМР(270 МГц, ДМСО-d6)м.д. 10,30-10,29 (м, 1 Н), 8,31-8,27 (м, 2 Н), 7,89-7,88 (м, 1 Н), 5,27-5,26 (м, 1 Н),3,68-3,52 (м, 4 Н), 3,05-3,04 (м, 2 Н), 2,88-2,87 (м, 3 Н), 2,04-2,03 (м, 2 Н), 2,77-1,81 (м, 2 Н), 1,54-1,15 (м,10 Н); ЖХ-МС 498,08 (М-Н)+; чистота (ЖХ-МС) 93%. Пример 58. Гидрохлорид 2-[2-бром-4-(4-метилпиперазин-1-ил)бензо[b]тиофен-3-сульфонил]1,2,3,4-тетрагидроизохинолина. Синтез проводят по существу в соответствии с методикой способа H-L. Выход: 3,7 мг. 1H-ЯМР (270 МГц, ДМСО-d6)м.д. 10,30-10,29 (м, 1 Н), 9,24-9,22 (м, 1 Н), 8,09-8,08 (м, 1 Н), 7,67-7,35 (м, 7 Н), 4,69-4,66(М-Н)+; чистота (ЖХ-МС) 92%. Пример 59. Гидрохлорид 2-бром-4-(4-метилпиперазин-1-ил)-N-[1-(4-фторфенил)эт-2-ил]тиено[3,2c]пиридин-3-сульфонамида. Синтез проводят по существу в соответствии с методикой способа H-L. Выход: 4,3 мг. 1 Н-ЯМР (270 МГц, ДMCO-d6)м.д. 10,35-10,34 (м, 1 Н), 9,16-9,14 (м, 1 Н), 8,23-8,22 (м, 1 Н), 7,80-7,79 (м, 1 Н), 7,26-7,25[3,2-c]пиридин-3-сульфонамида. Синтез проводят по существу в соответствии с методикой способа H-L. Выход: 0,7 мг, ЖХ-МС 561,91 (М-Н)+; чистота (ЖХ-МС) 95%. Пример 61. Гидрохлорид N-(3,4-дихлорфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида. 3,4-Дихлоранилин (0,49 ммоль), растворенный в ацетонитриле (1 мл) и пиридине (0,440 мл, 4,03 ммоль), добавляют к раствору 4-хлортиено[3,2-c]пиридин-2-сульфонилхлорида (0,445 ммоль) в ацетонитриле (1 мл). Реакционную смесь встряхивают в течение 1 ч, контролируя ход реакции с помощью ВЭЖХ, затем растворитель удаляют. Сырой продукт используют на следующей стадии без дополнительной очистки. В реакционную смесь, полученную на предыдущей стадии, растворенную в ДМСО (1 мл),добавляют пиперазин (15 экв.) и K2CO3 (1 экв.). Реакционную смесь перемешивают при 100 С в течение 24 ч, затем концентрируют. Продукт очищают ЖХ-МС, получая 5,8 мг (2,6%) указанного в заголовке продукта. 1 Н-ЯМР (270 МГц, СН 3 ОН-d4)м.д. 8,07-8,05 (м, 2 Н), 7,73 (д, J=6,60 Гц, 1 Н), 7,46-7,41 (м, 2 Н),7,16 (дд, J=8,71, 2,38 Гц, 1 Н), 3,94-3,90 (м, 4 Н), 3,92 (м, 4 Н), 3,53-3,50 (м, 4 Н); ЖХ-МС 443 (М-Н)+; чистота (ВЭЖХ) 95%. Пример 62. Гидрохлорид N-(2,4-дифторфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида. Синтез проводят, по существу, в соответствии с методикой способа H-L. Выход: 4,3 мг (2,1%). 1 НЯМР (270 МГц, CH3OH-d4)м.д. 8,22 (с, 1 Н), 8,07-8,01 (м, 2 Н), 7,79-7,72 (м, 1 Н), 7,55-7,47 (м, 1 Н), 7,046,94 (м, 2 Н), 4,00-3,96 (м, 4 Н), 3,53-3,43 (м, 4 Н), 2,66 (с, 1 Н); ЖХ-МС 411 (М-Н)+; чистота (ВЭЖХ) 98%. Пример 63. Гидрохлорид 4-пиперазин-1-ил-N-[3-(трифторметил)фенил]тиено[3,2-c]пиридин-2 сульфонамида. Синтез проводят, по существу, в соответствии с методикой способа H-L. Выход: 2,6 мг (1,2%). 1HЯМР (270 МГц, СН 3 ОН-d4)м.д. 8,05 (д, J=6,60 Гц, 2H), 7,81-7,60 (м, 3 Н), 7,50-7,47 (м, 2 Н), 3,94-3,90 (м,4 Н), 3,56-3,49 (м, 4 Н); ЖХ-МС 443 (М-Н)+; чистота (ВЭЖХ) 99%. Пример 64. Гидрохлорид N-(3-этилфенил)-4-пиперазин-1-илтиено[3,2-с]пиридин-2-сульфонамида. Синтез проводят по существу в соответствии с методикой способа H-L. Выход: 1,4 мг (0,7%). 1 НЯМР (270 МГц, CH3OH-d4)м.д. 8,35 (с, 1 Н), 7,58-6,92 (м, 7 Н), 3,54-3,44 (м, 2 Н), 3,01-2,95 (м, 4 Н), 2,66(с, 1 Н), 2,18-2,01 (м, 3 Н); ЖХ-МС 403 (М-Н)+; чистота (ВЭЖХ) 100%. Пример 65. Гидрохлорид N-(3,4-диметоксифенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида. Синтез проводят по существу в соответствии с методикой способа H-L. Выход: 7,7 мг (3,6%). 1H- 20011581 ЯМР (270 МГц, CH3OH-d4)8,04 (д, J=6,60 Гц, 1 Н), 7,77-7,75 (м, 2 Н), 6,85-6,83 (м, 2 Н), 6,68-6,83 (м, 1 Н),3,87-3,85 (м, 4 Н), 3,77-3,75 (м, 6 Н), 3,49-3,45 (м, 4 Н), 2,65 (с, 1 Н); ЖХ-МС 435 (М-Н)+; чистота (ВЭЖХ) 98%. Пример 66. Гидрохлорид N-(4-бром-2-метилфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонамида. Синтез проводят, по существу, в соответствии с методикой способа H-L. Выход: 12,2 мг (5,3%). 1HЯМР (270 МГц, CH3OH-d4)м.д. 8,07 (д, J=6,33 Гц, 1 Н), 7,86-7,79 (м, 2 Н), 7,40 (д, J=1,58 Гц, 1 Н), 7,307,29 (м, 1 Н), 7,08 (д, J=8,71 Гц, 1H), 3,96-3,92 (м, 4 Н), 3,53-3,51 (4 Н), 2,66 (с, 1 Н), 2,11 (с, 3 Н); ЖХ-МС 467 (М-Н)+; чистота (ВЭЖХ) 90%. Пример 67. Гидрохлорид 2-(4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфонил)-1,2,3,4-тетрагидроизохинолина. Синтез проводят, по существу, в соответствии с методикой способа H-L из трет-бутилового эфира 4-[2-(3,4-дигидро-1 Н-изохинолин-2-сульфонил)тиено[3,2-c]пиридин-4-ил]пиперазин-1-карбоновой кислоты (0,235 ммоль, 1 экв.). Выход: 4,0 мг. ЖХ/МС: tR=0,801 (система: от 30% до 60% ACN в течение 1,5 мин, Hypersil BDS), чистота: 92%. МС: 415 (М+1). 1 Н-ЯМР (270 МГц, ДМСО-d6)м.д. 2,87 (т, J=5,81 Гц,2 Н), 3,30 (с, 4 Н), 4,43 (с, 2 Н), 7,15 (м, 4 Н), 7,70 (д, J=5,54 Гц, 1 Н), 8,12 (с, 1 Н), 8,18 (д, J=5,54 Гц, 1H) 6 алифатических протонов закрыты пиком воды в спектре и поэтому не могут быть анализированы. Пример 68. Гидрохлорид (2-тиофен-2-илэтил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин-2 сульфоновой кислоты. Синтез проводят, по существу, в соответствии с методикой способа H-L из трет-бутилового эфира 4-[2-(2-тиофен-2-илэтилсульфамоил)тиено[3,2-c]пиридин-4-ил]пиперазин-1-карбоновой кислоты (0,235 ммоль, 1 экв.). Выход: 8,7 мг. ЖХ/МС: tR=0,430 (система: от 30 до 60% ACN в течение 1,5 мин, Hypersil(д, J=5,81 Гц, 1H), 8,04 (д, J=1,85 Гц, 1 Н), 8,18 (д, J=5,54 Гц, 1 Н), 8,36 (м, 1 Н), 9,05 (с, 1 Н). Пример 69. Гидрохлорид (4-хлор-2,5-диметоксифенил)амида 4-пиперазин-1-илтиено[3,2-c]пиридин 2-сульфоновой кислоты. Синтез проводят, по существу, в соответствии с методикой способа H-L из трет-бутилового эфира 4-[2-(4-хлор-2,5-диметоксифенилсульфамоил)тиено[3,2-c]пиридин-4-ил]пиперазин-1-карбоновой кислоты (0,112 ммоль, 1 экв.), который используют как тиенопиридин в способе С. Выход: 14,7 мг. ЖХ/МС:- 21011581 ммоль, 1 экв.). Выход: 14,4 мг. ЖХ/МС: tR=1,109 (система: от 30% до 60% ACN в течение 1,5 мин, YMC),чистота: 93%. МС: 493 (М+1). 1 Н-ЯМР (270 МГц, ДМСО-d6)м.д. 2,20 (м, 2 Н), 2,80 (м, 2 Н), 3,29 (с, 4 Н),3,67 (д, J=5,01 Гц, 4 Н), 4,01 (м, 1 Н), 7,14 (м, 8 Н), 7,71 (д, J=5,81 Гц, 1 Н), 7,95 (с, 1 Н), 8,18 (д, J=5,81 Гц,1H), 8,27 (м, 2 Н), 9,13 (с, 2 Н). Пример 74. Гидрохлорид [2-(5-метокси-1 Н-индол-3-ил)этил]амида 4-пиперазин-1-илтиено[3,2-c] пиридин-2-сульфоновой кислоты. Синтез проводят по существу в соответствии с методикой способа H-L из трет-бутилового эфира 42-[2-(5-метокси-1 Н-индол-3-ил)этилсульфамоил]тиено[3,2-c]пиридин-4-илпиперазин-1-карбоновой кислоты (0,112 ммоль, 1 экв.). Выход: 6,1 мг. ЖХ/МС: tR=0,364 (система: от 30% до 60% ACN в течение 1,5 мин, YMC), чистота: 91%. МС: 472 (М+1). 1 Н-ЯМР (270 МГц, CH3OH-d4)м.д. 2,85 (т, J=6,20 Гц,2 Н), 3,48 (т, J=6,20 Гц, 2 Н), 3,55 (м, 4 Н), 3,80 (с, 3 Н), 4,02 (м, 4 Н), 6,44 (дд, J=8,71, 2,37 Гц, 1 Н), 6,80 (м,2 Н), 6,97 (с, 1 Н), 7,64 (с, 1 Н), 7,67 (с, 1 Н), 7,97 (д, J=6,60 Гц, 1 Н). Пример 75. Гидрохлорид 4-трифторметилбензиламида 4-пиперазин-1-илтиено[3,2-c]пиридин-2 сульфоновой кислоты. Синтез проводят, по существу, в соответствии с методикой способа H-L из трет-бутилового эфира 4-[2-(4-трифторметилбензилсульфамоил)тиено[3,2-c]пиридин-4-ил]пиперазин-1-карбоновой кислоты(0,112 ммоль, 1 экв.), который используют как тиенопиридин в способе С. Выход: 1,9 мг. ЖХ/МС:(270 МГц, CH3OH-d4)м.д. 3,54 (м, 4 Н), 3,98 (м, 4 Н), 4,36 (с, 2 Н), 7,49 (м, 4 Н), 7,74 (д, J=6,86 Гц, 1 Н),8,02 (с, 1 Н), 8,07 (д, J=6,60 Гц, 1 Н). Пример 76. Гидрохлорид бензилэтиламида 4-пиперазин-1-илтиено[3,2-c]пиридин-2-сульфоновой кислоты. Синтез проводят по существу в соответствии с методикой способа H-L из трет-бутилового эфира 4[2-(бензилэтилсульфамоил)тиено[3,2-c]пиридин-4-ил]пиперазин-1-карбоновой кислоты (0,112 ммоль, 1 экв.). Выход: 6,4 мг. ЖХ/МС: tR=0,930 (система: от 30% до 60% ACN в течение 1,5 мин, YMC), чистота: 95%. МС: 417 (М+1). 1H-ЯМР (270 МГц, CH3OH-d4)м.д. 1,03 (т, J=7,13 Гц, 3 Н), 3,37 (м, 2 Н), 3,57 (с,2 Н), 3,75 (м, 2 Н), 4,11 (с, 2 Н), 4,50 (с, 2 Н), 5,80 (с, 1 Н), 7,32 (м, 5 Н), 7,84 (д, J=6,60 Гц, 1 Н), 8,07 (д, J=6,60 Гц, 1 Н), 8,14 (с, 1 Н). Ппромежуточный продукт 55. трет-Бутил-4-(3-[(3-этилфенил)амино]сульфонилтиено[3,2-c]пиридин-4-ил)пиперазин-1-карбоксилат. Указанное в заголовке соединение (82,7 мг, 76%) получают в виде твердого не совсем белого вещества из трет-бутил-4-[3-(хлорсульфонил)тиено[3,2-c]пиридин-4-ил]пиперазин-1-карбоксилата (90,0 мг,0,215 ммоль) и 3-этиланилина (33,9 мг, 0,28 ммоль). 1H-ЯМР (400 МГц, CDCl3)1,03 (т, J=1,5 Гц, 3 Н),1,48 (с, 9 Н), 2,47 (кв, J=7,7 Гц, 2 Н), 3,00-3,53 (м, 6 Н), 4,02-4,44 (м, 2 Н), 6,66 (д, J=8,0 Гц, 1 Н), 6,75 (с, 1 Н),6,66 (д, J=8,0 Гц, 1H), 7,02 (т, J=7,8 Гц, 1H), 7,67 (д, J=5,5 Гц, 1 Н), 8,24 (с, 1 Н), 8,39 (д, J=5,5 Гц, 1 Н), 9,80(с, 1 Н). МС (ESI+) m/z 503,2 (М+Н)+, ВЭЖХ 97%, RT: 3,93 мин. (5-99% MeCN в течение 3 мин). Пример 77. Гидрохлорид N-(3-этилфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-3-сульфонамида. Получают из трет-бутил-4-(3-[(3-этилфенил)амино]сульфонилтиено[3,2-c]пиридин-4-ил)пиперазин-1-карбоксилата (81,1 мг, 0,161 ммоль), получают 19 мг (98%) продукта в виде твердого белого вещества (38,0 мг, 54%). 1 Н-ЯМР (400 МГц, CH3OH-d4)1,09 (т, J=7,5 Гц, 3 Н), 2,51 (кв, J=7,5 Гц, 2 Н), 3,59MC (ESI+) m/z 403,2 (M+H)+. ВЭЖХ 95%, RT: 3,02 мин. (5-99% MeCN в течение 3 мин). Промежуточный продукт 56. трет-Бутил-4-(3-бромтиено [3,2-с] пиридин-4-ил)пиперазин-1 карбоксилат. Смесь 3-бром-4-хлортиено[3,2-c]пиридина (729 мг, 2,93 ммоль,), трет-бутилпиперазин-1-карбоксилата (1,64 г, 8,80 ммоль) и K2CO3 (811 мг, 5,87 ммоль) в ДМСО (45 мл) перемешивают в течение 5 дней при 100 С. После добавления Н 2 О и этилацетата слои разделяют. Водную фазу дважды экстрагируют зтилацетатом, объединенные органические фазы промывают водой и насыщенным раствором соли и сушат (MgSO4). После фильтрования и удаления растворителя остаток очищают флэш-хроматографией на силикагеле (пентан/этилацетат 8:2), получая продукт в виде белого порошка (398 мг, 34%). ВЭЖХ 99%.(М+Н)+. Промежуточный продукт 57. 4-(4-[(трет-Бутоксикарбонил)пиперазин-1-ил]тиено[3,2-с]пиридин-3 ил)сульфониллитий. К суспензии трет-бутил-4-(3-бромтиено[3,2-c]пиридин-4-ил)пиперазин-1-карбоксилата (4,055 г,10,18 ммоль) в диэтиловом эфире (30 мл) при -78 С в атмосфере N2 добавляют по каплям 1,6 М раствор н-BuLi в гексане (9,5 мл, 15,2 ммоль). Смесь перемешивают в течение 1 ч, затем в смесь с помощью пипетки вносят насыщенный раствор SO2 в ТГФ (25 мл) при -78 С. В течение ночи реакционной смеси дают возможность медленно нагреться до комнатной температуры. Затем растворитель выпаривают, остаток несколько раз промывают диэтиловым эфиром и сушат в вакууме, получая 4,094 г твердого не со- 22011581 всем белого вещества, содержащего 66% указанного в заголовке соединения и 34% (н-бутилсульфонил) лития в качестве побочного продукта. Полученную смесь используют на следующей стадии без дополнительной очистки. 1 Н-ЯМР (400 МГц, CH3OH-d4)1,48 (с, 9 Н), 3,22 (шир.с, 4 Н), 3,72 (с шир., 4 Н), 7,60(д, J=5,5 Гц, 1H), 8,06 (д, J=5,5 Гц, 1 Н), 8,14 (с, 1 Н). МС (ESI+) m/z 384,0 (М+Н)+. ВЭЖХ RT: 2,62 мин (599% MeCN в течение 3 мин). Промежуточный продукт 58. трет-Бутил-4-[3-(хлорсульфонил)тиено[3,2-с]пиридин-4-ил]пиперазин-1-карбоксилат. К суспензии (4-[4-(трет-бутоксикарбонил)пиперазин-1-ил]тиено[3,2-c]пиридин-3-илсульфонил) лития (2,751 г, 7,06 ммоль (3,126 г смеси сырого продукта в ДХМ (40 мл) при 0 С добавляют Nхлорсукцинимид (1,338 г, 10,0 ммоль). Спустя 20 мин температуру поднимают до комнатной температуры и реакционную смесь перемешивают в течение дополнительных 2,5 ч. Полученный раствор продукта промывают водой и водную фазу экстрагируют ДХМ. Объединенные органические экстракты промывают насыщенным раствором соли и сушат над MgSO4. После фильтрования и выпаривания растворителя остаток несколько раз промывают пентаном, получая продукт в виде твердого не совсем белого вещества(5-99% MeCN в течение 3 мин). Промежуточный продукт 59. трет-Бутил-4-(3-[(4-изопропилфенил)амино]сульфонилтиено[3,2-c] пиридин-4-ил)пиперазин-1-карбоксилат. Указанное в заголовке соединение (58,3 мг, 52%) получают в виде твердого не совсем белого вещества из трет-бутил-4-[3-(хлорсульфонил)тиено[3,2-c]пиридин-4-ил]пиперазин-1-карбоксилата (90,0 мг,0,215 ммоль) и 4-изопропиланилина (37,9 мг, 0,28 ммоль). 1H-ЯМР (400 МГц, CDCl3)1,12 (д, J=7,0 Гц,6 Н), 1,47 (с, 9 Н), 2,76 (септ, J=6,9 Гц, 2 Н), 3,01-3,53 (м, 6 Н), 4,04-4,41 (м, 2 Н), 6,79 (д, J=8,5 Гц, 2H), 6,66(д, J=8,5 Гц, 2 Н), 7,69 (д, J=5,5 Гц, 1 Н), 8,23 (с, 1 Н), 8,40 (д, J=5,5 Гц, 1 Н), 9,90 (с, 1 Н). MC (ESI+) m/z 517,2 (M+H)+; ВЭЖХ 97%, RT: 4,01 мин (5-99% MeCN в течение 3 мин). Пример 78. Гидрохлорид N-(4-изопропилфенил)-4-пиперазин-1-илтиено[3,2-c]пиридин-3-сульфонамида. Целевой продукт получают из трет-бутил-4-(3-[(4-изопропилфенил)амино]сульфонилтиено[3,2-c] пиридин-4-ил)пиперазин-1-карбоксилата (60,0 мг, 0,116 ммоль), который приводит к получению 19 мг(98%) продукта в виде твердого не совсем белого вещества (25,8 мг, 49%) согласно способу H-L. 1 Н-ЯМР(1 мл) и NaH (5,1 мг, 0,21 ммоль) добавляют к пирролидин-3-олу (18,5 мг, 0,21 ммоль) в атмосфере азота. Смесь выдерживают в микроволновой печи при 200 С в течение 5 мин. Продукт очищают препаративной ВЭЖХ. Выход: 29,9 мг (43,4%). 1H-ЯМР (270 МГц, CH3OH-d4)м.д. 8,09 (с, 1 Н), 7,71 (д, J=6,93 Гц, 1 Н),7,46 (д, J=6, 93 Гц, 1 Н), 7,47-7,44 (м, 4 Н), 4,67 (д, J=3,22 Гц, 1 Н), 3,97 (с, 2 Н), 2,26 (с, 3 Н). ЖХ-МС 390 (МН)+; чистота (ВЭЖХ) 99%. Пример 80. Гидрохлорид N-(4-метилфенил)-4-(пиперидин-4-илокси)тиено[3,2-c]пиридин-2-сульфонамида. Синтез проводят, по существу, в соответствии с методикой получения гидрохлорида N-(4 метилфенил)-4-(пирролидин-3-илокси)тиено[3,2-c]пиридин-2-сульфонамида. Выход: 16,2 мг (22,7%). 1 НЯМР (270 МГц, CH3OH-d4)м.д. 7,81-7,78 (м, 2 Н), 7,62 (д, J=6,93 Гц, 1 Н), 7,13-7,04 (м, 4 Н), 4,05-3,94 (м,1 Н), 3,90-3,88 (м, 2 Н), 3,63-3,58 (м, 2 Н), 2,27 (с, 3 Н), 2,06-2,03 (м, 2 Н), 2,01-1,71 (м, 2 Н); ЖХ-МС 404 (МН)+; чистота (ВЭЖХ) 99%. Пример 81. Гидрохлорид N-(2,3-дифторбензил)-4-пиперазин-1-илтиено[3,2-с]пиридин-2-сульфонамида. Выход: 74,4 мг (39,2%). 1 Н-ЯМР (270 МГц, CH3OH-d4)м.д. 8,10-8,03 (м, 2 Н), 7,81 (д, J=6,68 Гц,1 Н), 7,16-7,05 (м, 3 Н), 4,37 (с, 2 Н), 4,11-4,07 (м, 4 Н), 3,59-3,53 (м, 4 Н); ЖХ-МС 425 (М-Н)+; чистота Пояснения к схеме 6: i) амины, содержащие защитную ВОС-группу (R4), K2CO3, ДМСО; ii) тиофенолы (R1-SH), Cu2(I)O, ДМФА; iii) NaOAc, оксон, вода; iv) а.ТФУК, b.HCl, метанол. Промежуточный продукт 60. трет-Бутил-4-(2-бромтиено[3,2-c]пиридин-4-ил)пиперазин-1-карбоксилат. 2-Бром-4-хлортиено[3,2-c]пиридин (5,0 г, 20,24 ммоль) и K2CO3 (13,97 г, 101,2 ммоль) перемешивают в ДМСО (20 мл) с последующим добавлением трет-бутилпиперазин-1-карбоксилата (4,14 г, 22,26 ммоль). Реакционную смесь перемешивают при 100 С в течение 6 дней. Реакционную смесь фильтруют для удаления карбоната и добавляют воду (50 мл) и этилацетат. Фазы разделяют и водную фазу экстрагируют этилацетатом. Объединенные органические фазы сушат (MgSO4) и растворитель выпаривают. Сырой продукт очищают флэш-хроматографией, используя этилацетат/гексан (2/8) в качестве элюента, с получением 2 г целевого продукта, выход 25%, чистота 99%. 1 Н-ЯМР (270 МГц, CDCl3)1,48 (с, 9 Н),1,52-1,63 (м, 1 Н), 3,42-3,47 (м, 4 Н), 3,61-3,64 (м, 4 Н), 7,22 (дд, J=5,4, 1 Гц, 1 Н), 7,35 (д, J=1 Гц, 1 Н), 8,04 (д,J=5,4 Гц, 1H). m/z=398,91 (М+Н), бромидный образец. Промежуточный продукт 61. трет-Бутил-4-(2-бромтиено[3,2-c]пиридин-4-ил)-1,4-диазепан-1 карбоксилат. В соответствии с описанной выше методикой, исходя из 2-бром-4-хлортиено[3,2-c]пиридина (7,5 г,30,45 ммоль), K2CO3 (6,7 г, 33,5 ммоль) и трет-бутил-1,4-диазепан-1-карбоксилата (21,0 г, 152,2 ммоль) в ДМСО (30 мл) с использованием очистки флэш-хроматографией, получают 3,04 г указанного в заголовке соединения (выход 25%). ВЭЖХ чистота 92%; 1H-ЯМР (270 МГц, CDCl3)1,38 (с, 4,5 Н), 1,43 (с, 4,5 Н),1,96-2,11 (м, 2 Н), 3,36-3,41 (м, 1 Н), 3,46-3,51 (м, 1 Н), 3,65-3,87 (м, 6 Н), 7,02-7,04 (м, 1 Н), 7,40-7,42 (м,1 Н), 7,94 (д, J=5,4 Гц, 1H), m/z=411,97 (М+Н). Связывание с тиофенолами (способ М). Промежуточный продукт 62. трет-Бутил-(4-(2-фенилтио)тиено[3,2-с]пиридин-4-ил)-1,4-диазепан-1 карбоксилат. трет-Бутил-4-(2-бромтиено[3,2-с]пиридин-4-ил)-1,4-диазепан-1-карбоксилат (0,31 г, 0,752 ммоль),- 26011581 порошкообразный KOH (0,084 г, 1,5 ммоль) и Cu2(I)O (0,1 г, 0,75 ммоль) смешивают с ДМФА (1 мл) и добавляют раствор бензолтиола (0,016 г, 1,5 ммоль) в ДМФА (1 мл). Реакционную смесь нагревают до 120 С и выдерживают при этой температуре в течение 15 ч. Реакционную смесь выливают на рыхлый слой диоксида кремния и элюируют хлороформом, получая сырой продукт. Сырой продукт очищают флэш-хроматографией, используя этилацетат/гексан (2/8) в качестве элюента, с получением 0,21 г целевого продукта, выход 64%, чистота 90%. 1H-ЯМР (270 МГц,CDCl3)1,37 (с, 4,5 Н), 1,43 (с, 4,5 Н), 1,97-2,10 (м, 2 Н), 3,36-3,43 (м, 1 Н), 3,46-3,53 (м, 1 Н), 3,64-3,73 (м,2 Н), 3,78-3,96 (м, 4 Н), 7,05 (д, J=5,4 Гц, 1 Н), 7,22-7,32 (м, 5 Н), 7,59-7,63 (м, 1 Н), 7,97 (д, J=5,4 Гц, 1H). m/z= 442,15 (М+Н). Окисление тиопроизводных (способ N). Промежуточный продукт 63. трет-Бутил-(4-(2-фенилсульфонил)тиено[3,2-c]пиридин-4-ил)-1,4-диазепан-1-карбоксилат. В раствор трет-бутил-(4-(2-фенилтио)тиено[3,2-c]пиридин-4-ил)-1,4-диазепан-1-карбоксилата (0,21 г, 0,48 ммоль) и NaOAc (0,5 г) в этаноле (10 мл) (рН 5) добавляют оксон (0,64 г, 1,04 ммоль) и полученную смесь растворяют в воде (1 мл). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч. Добавляют оксон (0,32 г) в воде (1 мл). Полное преобразование SM получают спустя 8 ч. Добавляют воду (50 мл) и хлороформ (30 мл). Фазы разделяют и водную фазу экстрагируют хлороформом. Объединенные органические фазы сушат над (MgSO4) и растворитель выпаривают с получением сырого продукта, который очищают хроматографией с обращенной фазой (1090), получая 0,191 г целевого продукта в виде желтого масла (выход 86%, чистота 98%). 1 Н-ЯМР (270 МГц, CDCl3)1,28 (с,4,5 Н), 1,38 (с, 4,5 Н), 1,99-2,03 (м, 2 Н), 3,31-3,40 (м, 1 Н), 3,42-3,47 (м, 1 Н), 3,63-3,69 (м, 2 Н), 3,85-3,98 (м,4 Н), 7,02 (д, J=5,4 Гц, 1H), 7,48-7,61 (м, 3 Н), 7,76-8,01 (м, 3 Н), 8,06-8,08 (м, 1 Н). m/z = 474,01 (М+Н). Удаление трет-бутилкарбоксилатной защитной группы (способ О). Пример 83. Гидрохлорид 4-(1,4-диазепан-1-ил)-2-(фенилсульфонил)тиено[3,2-c]пиридина. трет-Бутил-(4-(2-фенилсульфонил)тиено[3,2-c]пиридин-4-ил)-1,4-диазепан-1-карбоксилат (0,165 г,0,348 ммоль) растворяют в ДХМ (2 мл) и в полученный раствор добавляют ТФУК (1 мл). Реакционную смесь перемешивают в течение 2 ч. Растворитель выпаривают. К остатку добавляют метанол и HCl в эфире ( 3), получая 0,118 г целевой HCl соли (выход 85%, чистота 98%). 1 Н-ЯМР (270 МГц, СНОН-d4)2,45-2,52 (м, 2 Н), 3,45-3,52 (м, 2 Н), 3,70-3,79 (м, 2 Н), 4,18-4,22 (м, 2 Н), 4,30-4,40 (м, 2 Н), 7,62-7,76 (м,5 Н), 7,91 (д, J=5,4 Гц, 1 Н), 8,11 (дд, J=5,4, 1 Гц, 1 Н), 8,41 (д, J=1 Гц, 1H), m/z=374,09 (M+H-HCl). Промежуточный продукт 64. трет-Бутил-4-([2-(4-трет-бутилфенил)тио]тиено[3,2-c]пиридин-4-ил)1,4-диазепан-1-карбоксилат. Продукт получают в соответствии с методикой способа М. Очистка флэш-хроматографией с использованием смеси этилацетат/гексан (2/8) в качестве элюента приводит к получению 0,035 г (чистота 99%) указанного в заголовке соединения. 1 Н-ЯМР (270 МГц, CDCl3)1,28 (с, 9 Н), 1,38 (с, 4,5 Н), 1,43 (с,4,5 Н), 1,98-2,03 (м, 2 Н), 3,35-3,41 (м, 1 Н), 3,46-3,52 (м, 1 Н), 3,62-3,72 (м, 2 Н), 3,77-3,93 (4 Н), 7,04 (д, J=5,4 Гц, 1H), 7,27-7,34 (м, 4 Н), 7,54-7,56 (м, 1 Н), 7,95 (д, J=5,4 Гц, 1H). m/z=498,0 (M+H). Промежуточный продукт 65. трет-Бутил-4-([2-(4-трет-бутилфенил)сульфонил]тиено[3,2-c]пиридин 4-ил)-1,4-диазепан-1-карбоксилат. В соответствии с методикой В из трет-бутил-4-([2-(4-трет-бутилфенил)тио]тиено[3,2-c]пиридин-4 ил)-1,4-диазепан-1-карбоксилата (0,035 г, 0,070 ммоль), оксона (0,17 г, 0,28 ммоль), NaOAc (0,5 г) в EtOH(2 мл с последующей хроматографией с обращенной фазой (4070, получают 6 мг продукта. Выход 17%, чистота 98%). 1 Н-ЯМР (270 МГц, CDCl3)1,32 (с, 9 Н), 1,35 (с, 9 Н), 2,05-2,15 (м, 2 Н), 3,45-3,62 (м,2 Н), 3,75-4,13 (м, 6 Н), 7,20-7,27 (м, 5 Н), 7,58 (д, J=10,8 Гц, 1H), 7,93 (д, J=10,8 Гц, 1H). m/z=530,0 (M+H). Промежуточный продукт 66. трет-Бутил-4-([2-(3,4-диметилфенил)тио]тиено[3,2-c]пиридин-4-ил)1,4-диазепан-1-карбоксилат. Указанное в заголовке соединение получают в соответствии со способом М. Очистка флэшхроматографией с использованием смеси этилацетат/гексан (2/8) в качестве элюента приводит к получению 0,022 г (чистота 95%) продукта. 1 Н-ЯМР (270 МГц, CDCl3)1,38 (с, 4,5 Н), 1,43 (с, 4,5 Н), 1,96-2,04- 27011581 Указанное в заголовке соединение получают в соответствии со способом М. Очистка флэшхроматографией с использованием смеси этилацетат/гексан (2/8) в качестве элюента приводит к получению 0,055 г продукта с чистотой (ВЭЖХ) 99%. 1 Н-ЯМР (270 МГц, CDCl3)1,37 (с, 4,5 Н), 1,43 (с, 4,5 Н),1,89-2,20 (м, 2 Н), 3,30-3,40 (м, 1 Н), 3,43-3,50 (м, 1 Н), 3,60, 3,90 (м, 6 Н), 6,99 (д, J=5,4 Гц, 1H), 7,39 (дд,J=8,1, 1 Гц, 1 Н), 7,50-7,61 (м, 5H), 7,79-7,88 (м, 2 Н), 7,92 (д, J=5,4 Гц, 1H), 8,40-8,44 (м, 1 Н). m/z=498,26EtOH (2 мл) с последующей хроматографией с обращенной фазой (4070), получают 15 мг продукта. Выход 26%, чистота 93%. 1H-ЯМР (270 МГц, CDCl3)1,34 (с, 9 Н), 2,06-2,10 (м, 2 Н), 3,48-3,62 (м, 2 Н),3,78-3,86 (м, 2 Н), 3,95-4,16 (м, 4 Н), 7,19-7,31 (м, 2 Н), 7,60-7,75 (м, 3 Н), 7,92-7,99 (м, 2 Н), 8,18 (м, J=8,1 Гц,1 Н), 8,50-8,53 (м, 1 Н), 8,77-8,80 (м, 1 Н). m/z=524,22 (M+H). Пример 84. Гидрохлорид 4-(1,4-диазепан-1-ил)-2-[(3,4-дихлорфенил)сульфонил]тиено[3,2-c]пиридина. трет-Бутил-4-2-[(3,4-дихлорфенил)сульфонил]тиено[3,2-с]пиридин-4-ил-1,4-диазепан-1 карбоксилат получают из 3,4-дихлортиофенола (60 мг, 15%) в виде твердого вещества бежевого цвета в соответствии с общими методиками А и В, описанными выше. 1H-ЯМР (270 МГц, CDCl3)8,27-8,14 (м,1 Н), 8,11-8,04 (м, 2 Н), 7,87-7,80 (м, 1 Н), 7,67-7,62 (м, 1 Н), 7,26-7,20 (м, 1 Н), 4,18-3,98 (м, 4 Н), 3,87-3,74(м, 2 Н), 3,61-3,44 (м, 2 Н), 2,20-2,00 (м, 2 Н), 1,33 (с, 9 Н); МС m/z 542 (М+1). Указанное в заголовке соединение (50 мг, 95%) получают в виде твердого вещества бежевого цвета в соответствии с общей методикой С, описанной выше. 1H-ЯМР (270 МГц, CH3OH-d4)8,48 (с, 1 Н), 8,30 (д, J=1,85 Гц, 1 Н), 8,05 (дд,J=8,58, 1,98 Гц, 1 Н), 7,92 (д, J=6,86 Гц, 1 Н), 7,83 (д, J=8,44 Гц, 1 Н), 7,69 (д, J=6,86 Гц, 1 Н), 4,41-4,34 (м,2 Н), 4,24-4,16 (м, 2 Н), 3,76-3,69 (м, 2 Н), 3,51-3,43 (м, 2 Н), 2,52-2,42 (м, 2 Н); МС m/z 442 (М+1). Пример 85. Гидрохлорид 4-(1,4-диазепан-1-ил)-2-(1-нафтилсульфонил)тиено[3,2-c]пиридина. Указанное в заголовке соединение получают из трет-бутил-[4-[2-(1-нафтил)сульфонил]тиено-[3,2c]пиридин-4-ил]-1,4-диазепан-1-карбоксилата (15 мг, 0,029 ммоль) в соответствии со способом О, получая 12 мг целевого продукта (выход 90%, чистота 95%). 1 Н-ЯМР (270 МГц, CH3OH-d4)2,40-2,50 (м,2 Н), 3,45-3,55 (м, 2 Н), 3,65-3,75 (м, 2 Н), 4,06-4,26 (м, 2 Н), 4,27-4,46 (м, 2 Н), 7,58-7,80 (м, 4 Н), 7,83-7,86m/z=424,06 (M+H-HCl). Пример 86. Гидрохлорид 4-(1,4-диазепан-1-ил)-2-([4-трет-бутилфенилсульфонил)тиено[3,2-c]пиридина. Указанное в заголовке соединение получают из трет-бутил-(4-[2-(4-трет-бутилфенил)сульфонил] тиено[3,2-c]пиридин-4-ил)-1,4-диазепан-1-карбоксилата (6 мг, 11,3 ммоль) в соответствии со способом О,получая 4 мг целевого продукта (выход 76%, чистота 88%). 1 Н ЯМР (270 МГц, CH3OH-d4)1,33 (с, 9 Н),2,41-2,47 (м, 2 Н), 3,41-3,49 (м, 2 Н), 3,65-3,78 (м, 2 Н), 4,15-4,25 (м, 2 Н), 4,29-4,40 (м, 2 Н), 7,65-7,70 (м,3 Н), 7,90 (д, J=5,4 Гц, 1H), 8,00-8,04 (м, 2 Н), 8,37 (с, 1 Н). m/z=430,06 (M+H-). Пример 87. Гидрохлорид 4-(1,4-диазепан-1-ил)-2-[3,4-диметилфенилсульфонил)]тиено[3,2-c]пиридина. Указанное в заголовке соединение получают из трет-бутил-(4-[2-(3,4-диметилфенил)сульфонил] тиено[3,2-c]пиридин-4-ил)-1,4-диазепан-1-карбоксилата (6 мг, 0,012 ммоль) в соответствии со способом О, получая 6 мг целевого продукта (выход 88%, чистота 89%). 1H-ЯМР (270 МГц, CH3OH-d4)2,34 (с,6 Н), 2,45-2,55 (м, 2 Н), 3,42-3,51 (м, 2 Н), 3,67-3,76 (м, 2 Н), 4,10-4,20 (м, 2 Н), 3,58-3,70 (м, 2 Н), 7,39-7,41(м, 1 Н), 7,64-7,67 (м, 1 Н), 7,79-7,84 (м, 2 Н), 7,89-7,91 (м, 1 Н), 8,36 (с, 1 Н). m/z=402,07 (M+H-HCl). Пример 88. Гидрохлорид 2-[(4-бромфенил)сульфонил]-4-(1,4-диазепан-1-ил)тиено[3,2-с]пиридина. Трифторуксусную кислоту (1 мл) медленно добавляют к раствору трет-бутил-4-2-[(4-бромфенил) тио]тиено[3,2-c]пиридин-4-ил-1,4-диазепан-1-карбоксилата (26 мг, 0,047 ммоль) в CH2Cl2 при 0 С. Реакционной смеси дают нагреться до комнатной температуры, перемешивают в течение 40 мин и затем концентрируют в вакууме. Остаток дважды растворяют в МеОН и концентрируют в вакууме. Остаток снова растворяют в МеОН и к полученному раствору медленно добавляют избыток 1 М HCl в диэтиловом эфире (4 мл). Удаление растворителей в вакууме приводит к получению указанного в заголовке соединения (21 мг, 91%) в виде твердого вещества желтого цвета. 1 Н-ЯМР (270 МГц, СН 3 ОН-d4)8,41 (с,1 Н), 8,06-7,99 (м, 2 Н), 7,92 (д, J=6,86 Гц, 1 Н), 7,87-7,80 (м, 2 Н), 7,66 (д, J=6,86 Гц, 1H), 4,38-4,31 (м, 2 Н),4,22-4,14 (м, 2 Н), 3,74-3,67 (м, 2 Н), 3,50-3,42 (м, 2 Н), 2,51-2,39 (м, 2 Н); МС m/z 452 (М+1). Пример 89. Гидрохлорид 2-(фенилсульфонил)-4-пиперазин-1-илтиено[3,2-с]пиридина. К перемешиваемому раствору трет-бутил-4-[2-(фенилтио)тиено[3,2-c]пиридин-4-ил]пиперазин-1 карбоксилата (350 мг, 0,819 ммоль) в этаноле добавляют раствор оксона в воде. Состав реакционной смеси контролируют ЖХМС. Когда все исходное вещество израсходуется, два пика на хроматограмме показывают наличие продукта и N-оксида. После очистки препаративной ВЭЖХ полученный Вос-продукт- 28011581 обрабатывают HCl в эфире. Раствор центрифугируют и супернатант удаляют. Добавляют эфир, затем центрифугируют и декантируют (повторяют три раза) для удаления избытка HCl. Оставшийся эфир окончательно удаляют выпариванием с помощью SpeedVac. Выход 18%, чистота (ВЭЖХ)=98%, m/z 360,0 (М+Н). 1H-ЯМР (270 МГц, CH3OH-d4)м.д. 3,56 (м, 4 Н), 4,08 (м, 4 Н), 7,68 (м, 4 Н), 7,77 (дд, J=6,60,0,79 Гц, 1 Н), 8,04 (д, J=6,33 Гц, 1 Н), 8,12 (м, 2 Н), 8,39 (д, J=0,79 Гц, 1H). Пример 90. Гидрохлорид 2-(3-метоксибензолсульфонил)-4-пиперазин-1-илтиено[3,2-c]пиридина. трет-Бутиловый эфир 4-[2-(3-метоксифенилсульфанил)тиено[3,2-c]пиридин-4-ил]пиперазин-1 карбоновой кислоты (120 мг, 50%) получают из 3-метокситиофенола (130 мкл, 1 ммоль) и трет-бутил-4(2-бромтиено[3,2-c]пиридин-4-ил)пиперазин-1-карбоксилата (215 мг, 0,52 ммоль) в соответствии с методикой общего способа М, описанной выше. 1 Н-ЯМР (270 МГц, CDCl3)1,48 (с, 9 Н), 3,42-3,51 (м, 4 Н),3,58-3,67 (м, 4 Н), 3,74 (с, 3 Н), 6,76 (дд, J=8,18, 2,38 Гц, 1 Н), 6,84-6,92 (м, 2 Н), 7,16-7,23 (м, 2 Н), 7,51 (с,1 Н), 8,04 (д, J=5,81 Гц, 1H); MC m/z 458 (М+1). Таким образом, указанное в заголовке соединение получают из трет-бутилового эфира 4-[2-(3-метоксифенилсульфанил)тиено[3,2-c]пиридин-4-ил]пиперазин-1 карбоновой кислоты (7 мг, 7%) после растирания в диэтиловом эфире в виде твердого вещества бежевого цвета в соответствии с общими методиками В и С, описанными выше. 1 Н-ЯМР (27 0 МГц, CD3OD)8,31(м, 4 Н), 3,79 (с, 3 Н), 6,83-6,89 (м, 2 Н), 7,15 (д, J=5,54 Гц, 1 Н), 7,35 (с, 1 Н), 7,38-7,43 (м, 2 Н), 7,99 (д,J=5,81 Гц, 1H); МС m/z 458 (М+1). трет-Бутиловый эфир 4-[2-(4-метоксифенилсульфанил)тиено[3,2-c]пиридин-4-ил]пиперазин-1 карбоновой кислоты (25 мг, 23%) получают в виде прозрачной жидкости в соответствии с общей методикой В, описанной выше. 1H-ЯМР (270 МГц, CDCl3)1,48 (с, 9 Н), 3,67-3,91 (м, 11 Н), 7,01 (д, J=8,97 Гц,2 Н), 7,27-7,37 (м, 1 Н), 7,93 (д, J=8,97 Гц, 2H), 8,01-8,19 (м, 2 Н); МС m/z 490 (М+1). Таким образом, указанное в заголовке соединение получают в соответствии с методикой С; 1 Н-ЯМР (CD3OD)8,25 (с, 1 Н),8,09-7,89 (м, 3 Н), 7,69 (д, J=6,33 Гц, 1 Н), 7,17-7,10 (м, 2 Н), 4,00-3,93 (м, 4 Н), 3,87 (с, 3 Н), 3,55-3,48 (м,4 Н); МС m/z 390 (М+1). Пример 92. Гидрохлорид 4-пиперазин-1-ил-2-[4-(трифторметил)фенил]сульфонилтиено[3,2-c]пиридина. 2-[4-(Трифторметил)фенил]тио-4-пиперазин-1-илтиено[3,2-с]пиридин (0,42 ммоль) растворяют в ТФУК (1,5 мл) при 0 С, перемешивают в течение 15 мин и добавляют Н 2 О 2 (100 мкл). Смесь перемешивают при комнатной температуре в течение ночи, добавляют NaOH (2M), экстрагируют этилацетатом(3), промывают насыщенным раствором соли, сушат над Na2SO4. Растворитель удаляют и остаток очищают препаративной ВЭЖХ, получая 154,7 мг (86,2%) продукта. 1H-ЯМР (270 МГц, ДМСО-d6)м.д. 9,79 (с, 1 Н), 8,56 (с, 1 Н), 8,35 (д, J=8,44 Гц, 2H), 8,12-8,05 (м, 3 Н), 7,79 (д, J=6,33 Гц, 1 Н), 3,98-3,96 (м, 4 Н),3,32-3,31 (м, 4 Н); ЖХ-МС 428 (М-Н)+; чистота (ВЭЖХ) 95%. Пример 93. Гидрохлорид 2-2-трет-бутилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина. Указанное в заголовке соединение получают в соответствии со способом М-О. Выход: 10,6 мг(270 МГц, ДМСО-d6)м.д. 9,57 (с, 1 Н), 8,42 (с, 1 Н), 8,26-8,22 (м, 1 Н), 8,06-8,04 (м, 1 Н), 7,68-7,55 (м, 4 Н),3,87-3,86 (м, 4 Н), 3,34-3,33 (м, 4 Н), 1,51-1,43 (м, 9 Н); ЖХ-МС 400 (М-Н)+; чистота (ВЭЖХ) 90%. Пример 94. Гидрохлорид 2-[(3,4-дихлорфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридин-2 сульфонамида. Указанное в заголовке соединение получают в соответствии со способом М-O Выход: 47,9 мг(22,9%). 1 Н-ЯМР (270 МГц, ДМСО-d6)м.д. 9,36 (с, 1 Н), 8,51 (с, 1 Н), 8,38 (д, J=2,11 Гц, 1H), 8,06-7,94 (м,3 Н), 7,70-7,68 (м, 1 Н), 3,81-3,77 (м, 4 Н), 3,31-3,29 (м, 4 Н); ЖХ-МС 427 (М-Н)+; чистота (ВЭЖХ) 95%. Пример 95. Гидрохлорид 2-[(4-трет-бутилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-с]пиридина. Раствор оксона (0,52 г, 0,84 ммоль) в воде (4 мл) превращают в буферный раствор с рН 6 добавлением ацетата оксида натрия и добавляют к раствору 2-[(4-трет-бутилфенил)тио]-4-пиперазин-1-илтиено[3,2-c]пиридина (0,42 ммоль) в этаноле (30 мл). Смесь перемешивают при комнатной температуре в течение 2 ч и добавляют дополнительное количество оксона (0,52 г, 0,84 ммоль). Реакционную смесь перемешивают в течение ночи. К смеси добавляют воду, экстрагируют дихлорметаном (220 мл) и растворитель удаляют. Остаток очищают препаративной ВЭЖХ. Выход: 41,9 мг (22,0%). 1 Н-ЯМР (500 МГц,CH3OH-d4)м.д. 8,38 (с, 1 Н), 8,05-8,01 (м, 3 Н), 7,80 (д, J=6,59 Гц, 1 Н), 7,71-7,69 (м, 2 Н), 4,15-4,13 (м,4 Н), 3,59-3,57 (4 Н), 1,37-1,33 (м, 9 Н); ЖХ-МС 416 (М-Н)+; чистота (ВЭЖХ) 95%.- 29011581 Пример 96. Гидрохлорид 2-(1-нафтилсульфонил)-4-пиперазин-1-илтиено[3,2-с]пиридина. Указанное в заголовке соединение получают в соответствии со способом М-О. Выход: 3,4 мг(0,2%). 1H-ЯМР (270 МГц, ДМСО-d6)м.д. 9,34 (с, 1 Н), 8,82 (с, 1 Н), 8,44 (с, 1 Н), 8,26-8,06 (м, 5 Н), 7,797,65 (м, 3 Н), 3,79-3,78 (м, 4 Н), 3,32-3,30 (м, 4 Н); ЖХ-МС 410 (М-Н)+, чистота (ВЭЖХ) 95%. Пример 97. Гидрохлорид 2-[(3-фторфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридин-2 сульфонамида. 2-Бром-4-хлортиено[3,2-c]пиридин (190 мг, 0,50 ммоль) в ДМФА (1 мл) добавляют к смеси 3 фторбензолтиола (9,5 мг, 1,0 ммоль), KOH (56 мг, 0,2 ммоль) и Cu2O (71 мг, 0,5 ммоль) в ДМФА (1 мл). Реакционную смесь нагревают до 120 С и выдерживают при этой температуре в течение ночи. Смесь фильтруют через слой диоксида кремния и растворитель удаляют. Остаток растворяют в ТФУК (1,5 мл) при 0 С и раствор перемешивают в течение 15 мин, добавляют Н 2 О 2 (100 мкл) и смесь перемешивают при комнатной температуре в течение ночи. Добавляют 2 М NaOH, раствор экстрагируют этилацетатом,промывают насыщенным раствором соли и растворитель удаляют. Остаток очищают препаративной ВЭЖХ. Выход: 30,1 мг (16,1%). 1H-ЯМР (270 МГц, ДМСО-d6)м.д. 9,34 (с, 1 Н), 8,45 (с, 1 Н), 8,16 (д,J=5,69 Гц, 1 Н), 7,97-7,93 (м, 2 Н), 7,76-7,62 (м, 3 Н), 3,30 (с, 4 Н) (4 Н закрыт сигналом растворителя); ЖХМС 378 (М-Н)+; чистота (ВЭЖХ) 99%. Пример 98. Гидрохлорид 2-(мезитилсульфонил)-4-пиперазин-1-илтиено[3,2-с]пиридина. Указанное в заголовке соединение получают в соответствии со способом М-О. Выход: 32,0 мг(16,1%). 1 Н-ЯМР (270 МГц, ДМСО-d6)м.д. 9,32 (с, 1 Н), 8,20-8,14 (м, 2 Н), 7,66 (д, J=5,69 Гц, 1 Н), 7,14 (с,2 Н), 3,29 (с, 4 Н), 2,65 (с, 6 Н), 2,28 (с, 3 Н) (4 Н закрыт сигналом растворителя); ЖХ-МС 402 (М-Н)+; чистота (ВЭЖХ) 95%. Пример 99. Гидрохлорид 2-[(2-метоксифенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина. Указанное в заголовке соединение получают в соответствии со способом М-О. Выход: 14,7 мг(7,6%). 1H-ЯМР (270 МГц, ДМСО-d6)м.д. 9,33 (с, 1 Н), 8,24 (с, 1 Н), 8,15 (д, J=5,94 Гц, 1H), 8,00 (дд,J=7,92, 1,48 Гц, 1 Н), 7,77-7,68 (м, 2 Н), 7,28-7,18 (м, 2 Н), 3,30 (с, 4 Н) (7 Н закрыт сигналом растворителя); ЖХ-МС 390 (М-Н)+; чистота (ВЭЖХ) 99%. Пример 100. Гидрохлорид 2-[(2,4-диметоксифенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина. Указанное в заголовке соединение получают в соответствии со способом М-O. Выход: 42,7 мг(м, 2 Н), 7,54 (д, J=2,23 Гц, 1H), 7,19 (д, J=8,66 Гц, 1 Н), 3,29 (с, 4 Н) (10 Н закрыт сигналом растворителя); ЖХ-МС 420 (М-Н)+; чистота (ВЭЖХ) 98%. Пример 101. Гидрохлорид 2-[(2,4-диметилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина. Указанное в заголовке соединение получают в соответствии со способом М-О. Выход: 17,8 мг(9,3%). 1H-ЯМР (270 МГц, ДМСО-d6)м.д. 9,32 (с, 1 Н), 8,27 (с, 1 Н), 8,15 (д, J=5,94 Гц, 1H), 8,00 (д,J=8,17 Гц, 1H), 7,67 (д, J=5,94 Гц, 1H), 7,35-7,26 (м, 2 Н), 3,29 (с, 4 Н), 2,34 (с, 3 Н) (7 Н закрыт сигналом растворителя); ЖХ-МС 388 (М-Н)+; чистота (ВЭЖХ) 98%. Пример 102. Гидрохлорид 2-[(2,5-диметилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина. Указанное в заголовке соединение получают в соответствии со способом М-О. Выход: 16,9 мг(д, J=5,69 Гц, 1 Н), 7,47 (д, J=7,67 Гц, 1 Н), 7,32 (д, J=8,16 Гц, 1 Н), 3,29 (с, 2 Н), 2,42 (с, 3 Н) (7 Н закрыт сигналом растворителя); ЖХ-МС 388 (М-Н)+; чистота (ВЭЖХ) 99%. Пример 103. Гидрохлорид 2-[(2-этилфенил)сульфонил]-4-пиперазин-1-илтиено[3,2-c]пиридина. Указанное в заголовке соединение получают в соответствии со способом М-О. Выход: 22,6 мг Пояснения к схеме 7: i) н-BuLi, диэтиловый эфир, ii) SO2 (газ.); iii) бензилбромид(ы), ДМФА, нагрев; iv) диамин(ы), K2CO3, ДМФА, нагрев; v) HCl, диэтиловый эфир. Промежуточный продукт 70. 4-Хлортиено[3,2-c]пиридин-2-сульфинат лития. 2-Бром-4-хлортиено[3,2-c]пиридин (5,00 г, 20,1 ммоль) суспендируют в сухом эфире (100 мл) и смесь охлаждают до -78 С в атмосфере N2. К смеси добавляют н-BuLi (1,6 М в гексане, 15 мл) и реакционную смесь перемешивают при -78 С в течение 2 ч. SO2 (газ.) барботируют через реакционную смесь в течение 1 ч. После прекращения барботирования реакционную смесь перемешивают в течение часа при
МПК / Метки
МПК: C07D 401/04, C07D 471/04, C07D 405/04, A61K 31/496, C07D 211/40, C07D 493/04, C07D 207/12, A61P 3/04, A61P 3/10, C07D 513/04, C07D 495/04
Метки: применимые, конденсированные, лечения, ожирения, расстройств, нервной, системы, гетероциклические, соединения, центральной
Код ссылки
<a href="https://eas.patents.su/30-11581-kondensirovannye-geterociklicheskie-soedineniya-primenimye-dlya-lecheniya-ozhireniya-i-rasstrojjstv-centralnojj-nervnojj-sistemy.html" rel="bookmark" title="База патентов Евразийского Союза">Конденсированные гетероциклические соединения, применимые для лечения ожирения и расстройств центральной нервной системы</a>
Предыдущий патент: Стабильные при хранении гербицидные смеси с метазахлором
Следующий патент: Способ получения пищевого продукта и пищевой продукт
Случайный патент: Композиция, включающая камптотецин и производное пиримидина, для лечения рака