2-алкокси-3,4,5-тригидроксиалкиламиды, их получение, композиции, их содержащие, и применение
Номер патента: 11392
Опубликовано: 27.02.2009
Авторы: Бхатнагар Неерджа, Рюксер Жан-Мари, Чжан Цзидун
Формула / Реферат
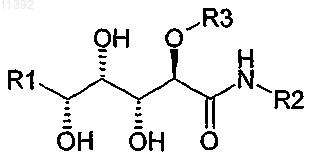
1. Соединение, содержащее полиоксилированную цепочку следующей общей формулы (I):
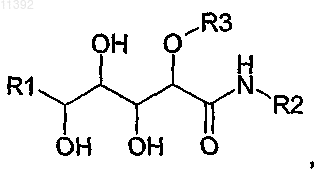
отличающееся тем что:
(i) R1 независимо выбирают из -CH=C(R11)(R12), где R11 и R12 выбраны из Н и трет-бутила;
(ii) R2 независимо выбирают из группы, состоящей из
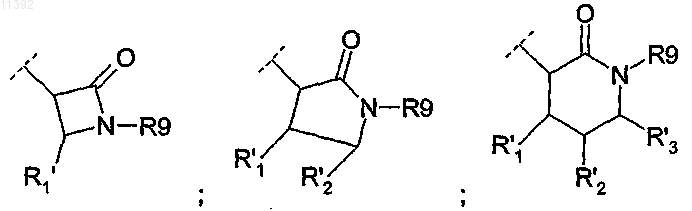
R9 выбирают из группы, состоящей из Н и R10, в которой каждый R10 независимо выбирают из
-арила,
и R'1, R'2 и R'3 независимо выбирают из Н и СООалкила или R'2 и R'3 совместно образуют фенильное кольцо;
(iii) R3 представляет собой метил.
2. Соединение, содержащее полигидроксилированную цепочку следующей общей формулы (I):
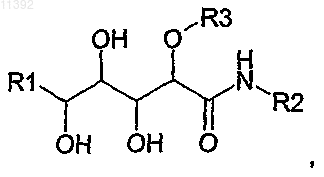
отличающееся тем, что:
(i) R1 независимо выбирают из -CH=C(R11)(R12), где R11 и R12 выбраны из Н и трет-бутила;
(ii) R2 выбирают из гетероциклов следующей общей формулы (II):
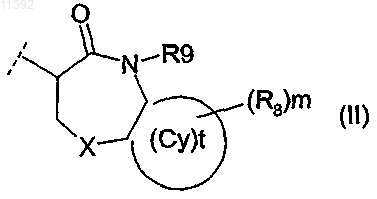
R9 выбирают из группы, состоящей из Н и R10,
X выбирают из СН2, S и N(Ry), в котором Ry независимо выбирают из группы, состоящей из COOR10;
Cy представляет собой (i) связь или (ii) фенильное кольцо;
t имеет значение 0 или 1;
каждый R8 представляет собой Н;
каждый R10 независимо выбирают из неподеленной электронной пары, Н, -алкила, -алкенила, -алкиларила, -алкилгетероарила, где каждый R10 возможно замещен по меньшей мере одним заместителем, выбранным из галогена, -О-(С1-С4)алкила, -арила, -N(СН3)2,
(iii) R3 представляет собой СН3,
при условии, что
1) если R2 обозначает
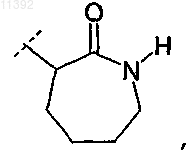
то R1 не является
(i) 3,3-диметилбутенилом;
2) если R3 обозначает метил, X обозначает -СН2-, t обозначает 0 и R1 обозначает СН=СН-С(СН3)3, то R9 не является С1-С14алкилом, -(СН2)фенилом, -(СН2)пиридином.
3. Соединение, отличающееся тем, что R1 выбирают из -CH=C(R11)(R12), где R11, R12 независимо выбирают из Н и трет-бутила, и тем, что R2 обозначает лактам следующей общей формулы (III):
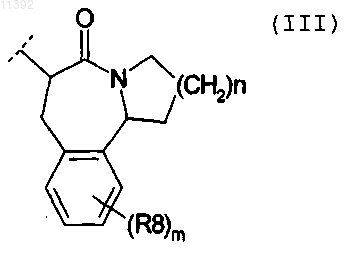
в которой
n равно 2;
R8 представляет собой Н.
4. Соединение по любому из пп.2-3, отличающееся тем, что R2 выбирают из группы, состоящей из
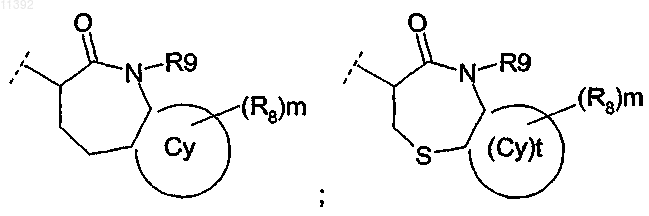
в которой R9, Су, t, R8 и m такие, как определены в п.2.
5. Соединение по п.4, отличающееся тем, что R2 выбирают из группы, состоящей из
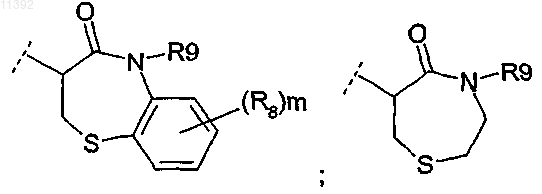
в которой R9 и R8 такие, как определены в п.2.
6. Соединение по любому из пп.2-5, отличающееся тем, что R2 выбирают из группы, состоящей из
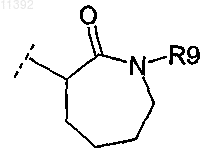
в которой R9 представляет собой алкенил или фенил, замещенный 4 или 5 заместителями, независимо выбранными из галогена.
7. Соединение по любому из пп.1-6, отличающееся тем, что R2 выбирают из группы, состоящей из
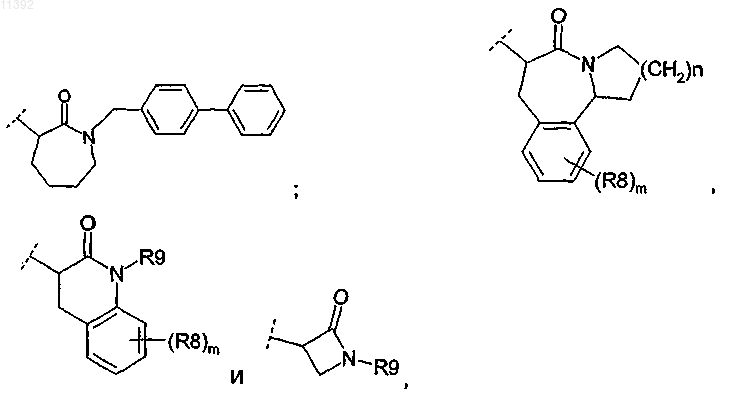
в которой
(i) m принимает значение 0;
(ii) n принимает значение 2;
(iii) каждый из R8 представляет собой Н;
(iv) R9 выбирают из группы, состоящей из Н и R10;
(v) R10 независимо выбирают из неподеленной электронной пары, -(С1-С4)алкила, -(С2-С10)алкенила, -арила, -алкиларила, -алкилгетероарила, в которой каждый R10 возможно замещен заместителем, выбранным из галогена, -О-(С1-С4)алкила, -арила, -N(CH3)2.
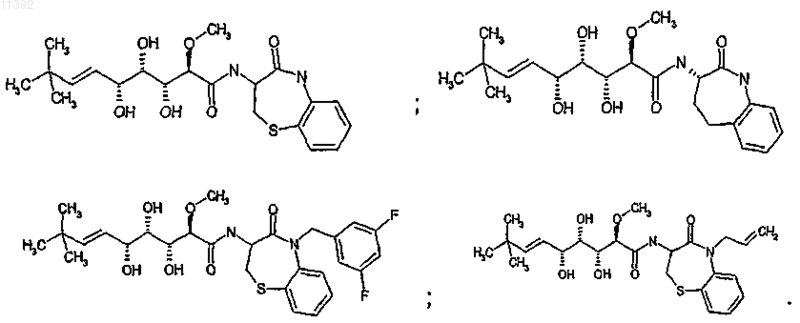
8. Соединение по любому из пп.1-7, отличающееся тем, что его выбирают из
9. Соединение по любому из пп.1-8, отличающееся тем, что абсолютная конформация полигидроксилированной цепочки представляет собой
10. Фармацевтическая композиция, содержащая соединение по любому из пп.1-9 в сочетании с фармацевтически приемлемым эксципиентом.
11. Применение соединения по любому из пп.1-9 для получения лекарственного средства для лечения патологического состояния.
12. Применение по п.11, отличающееся тем, что патологическим состоянием является рак.
Текст
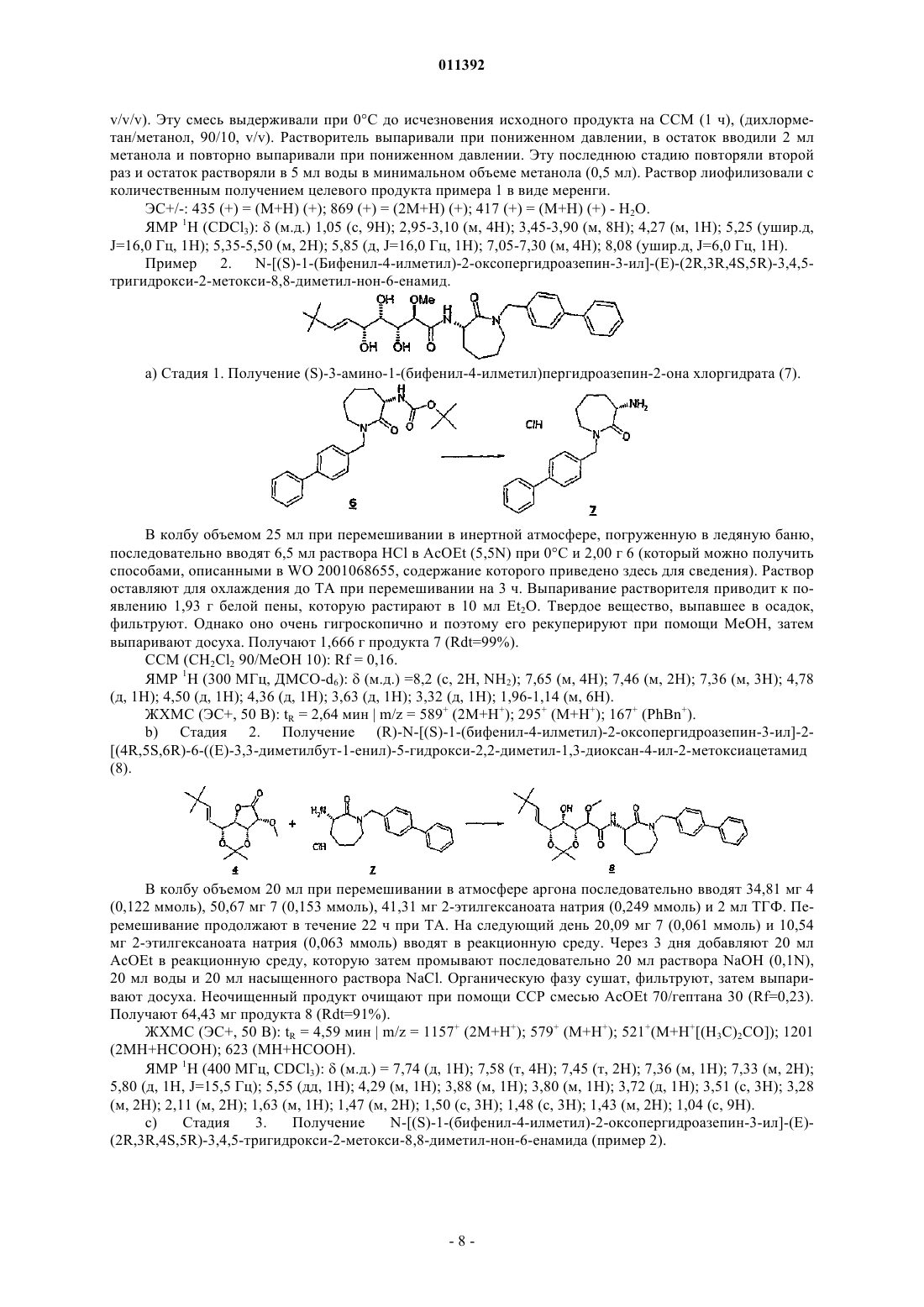
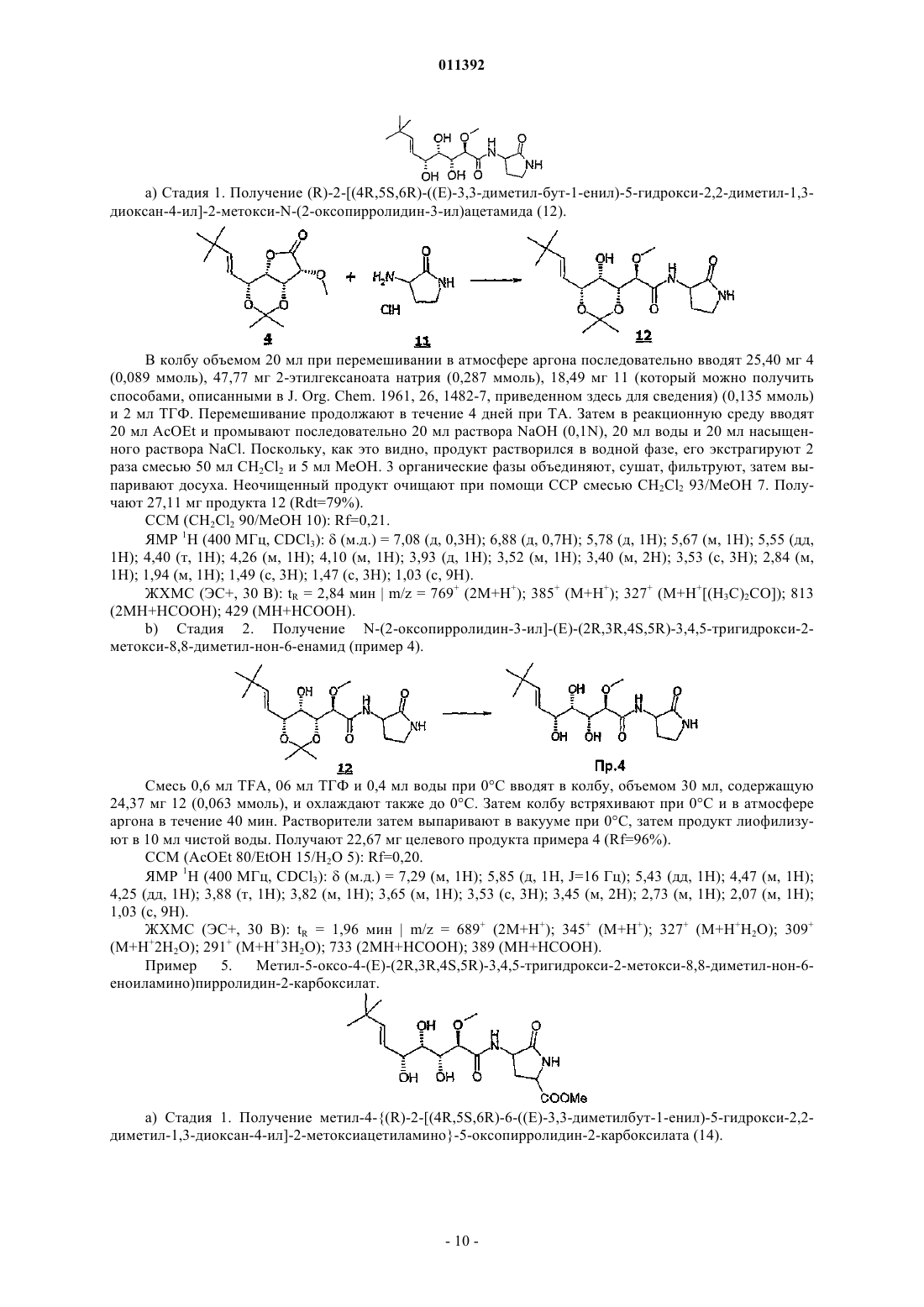
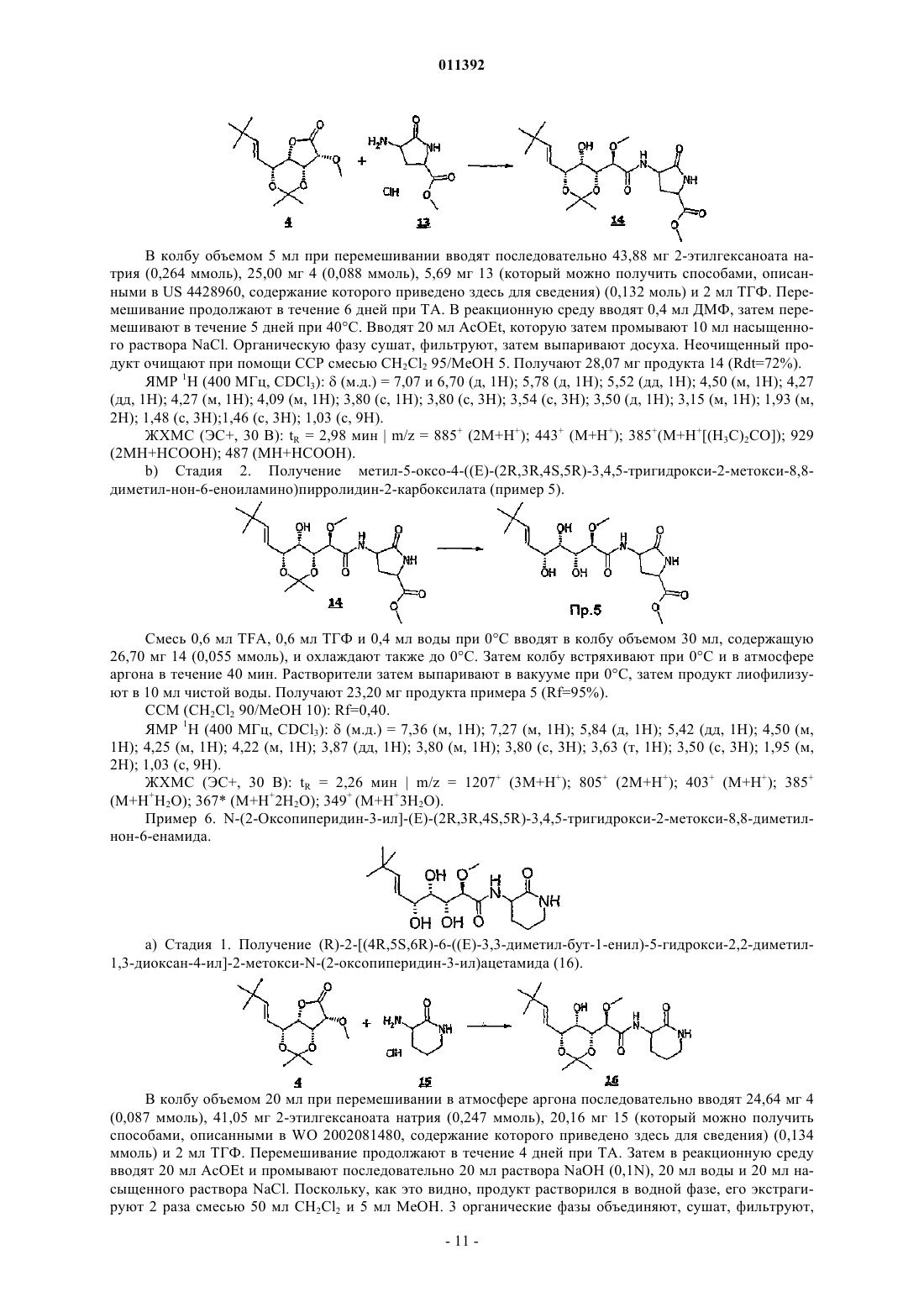
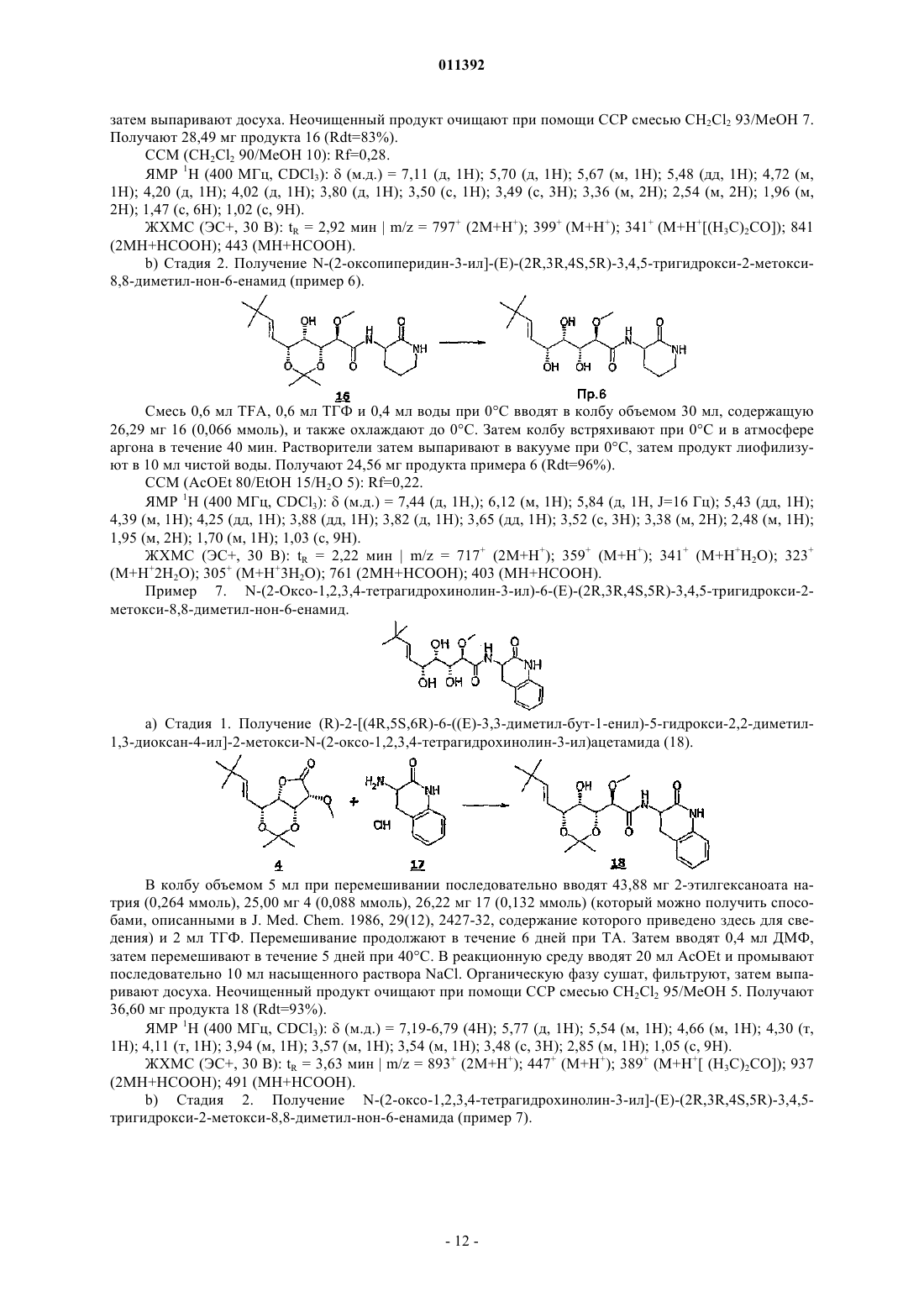
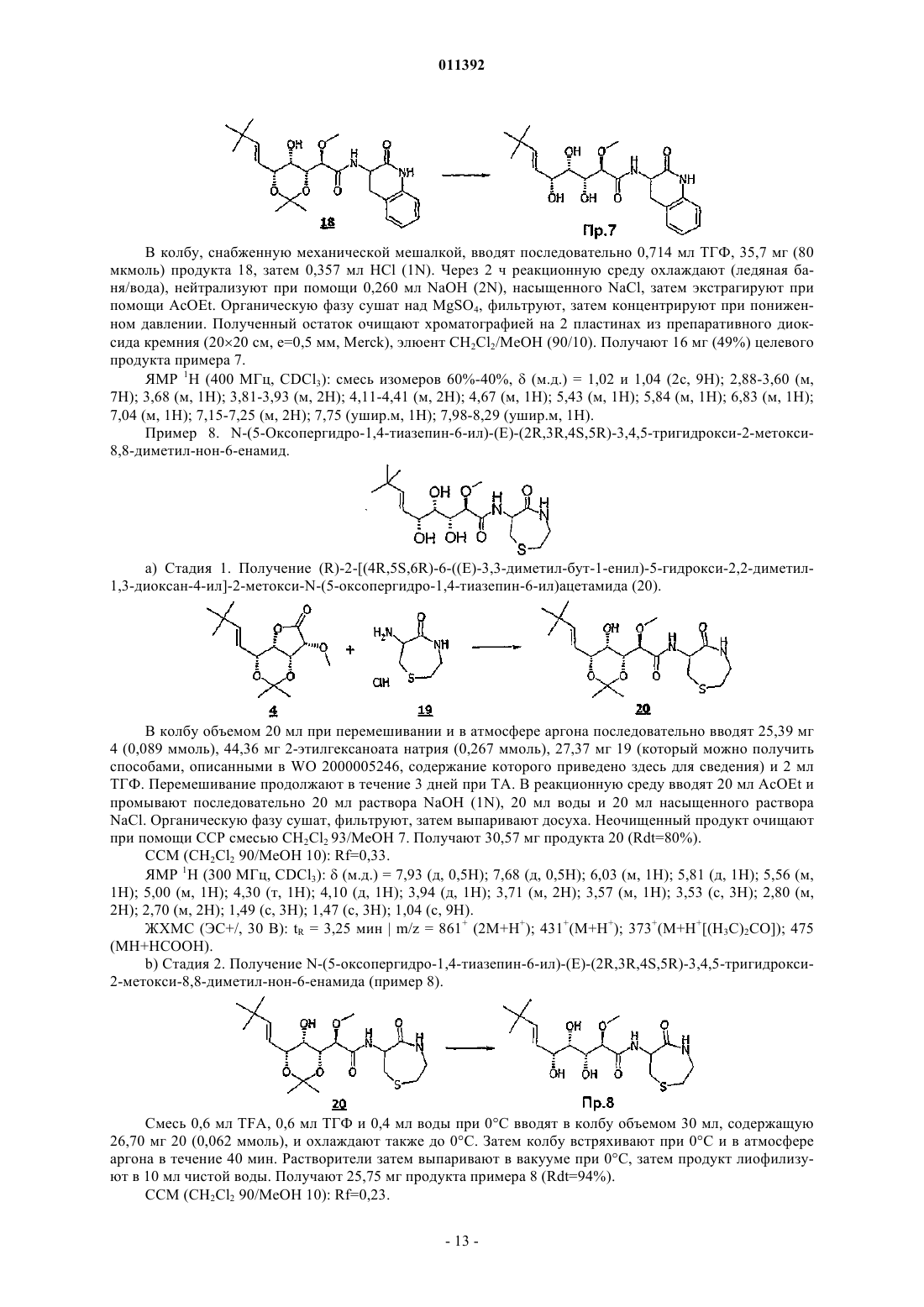
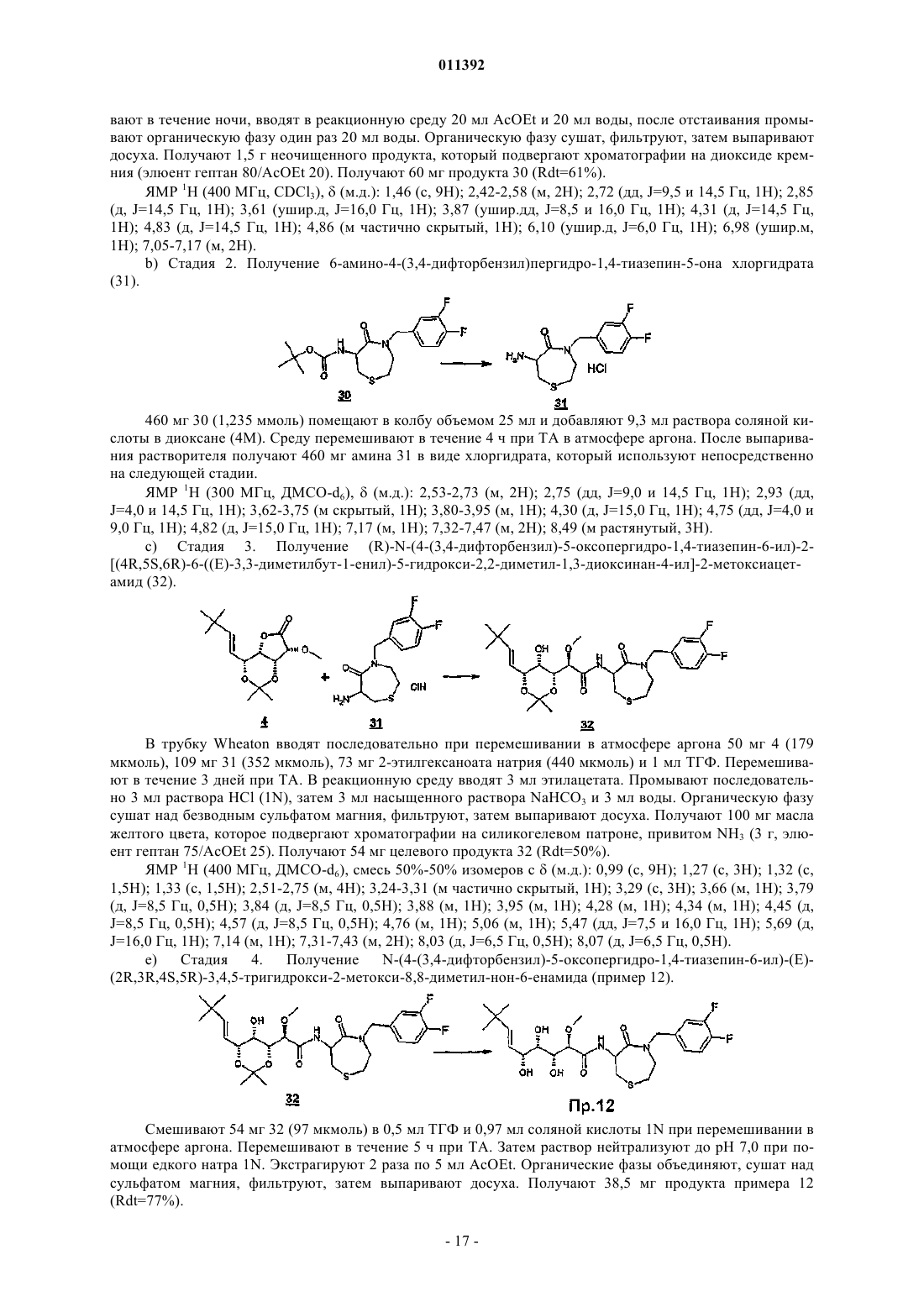
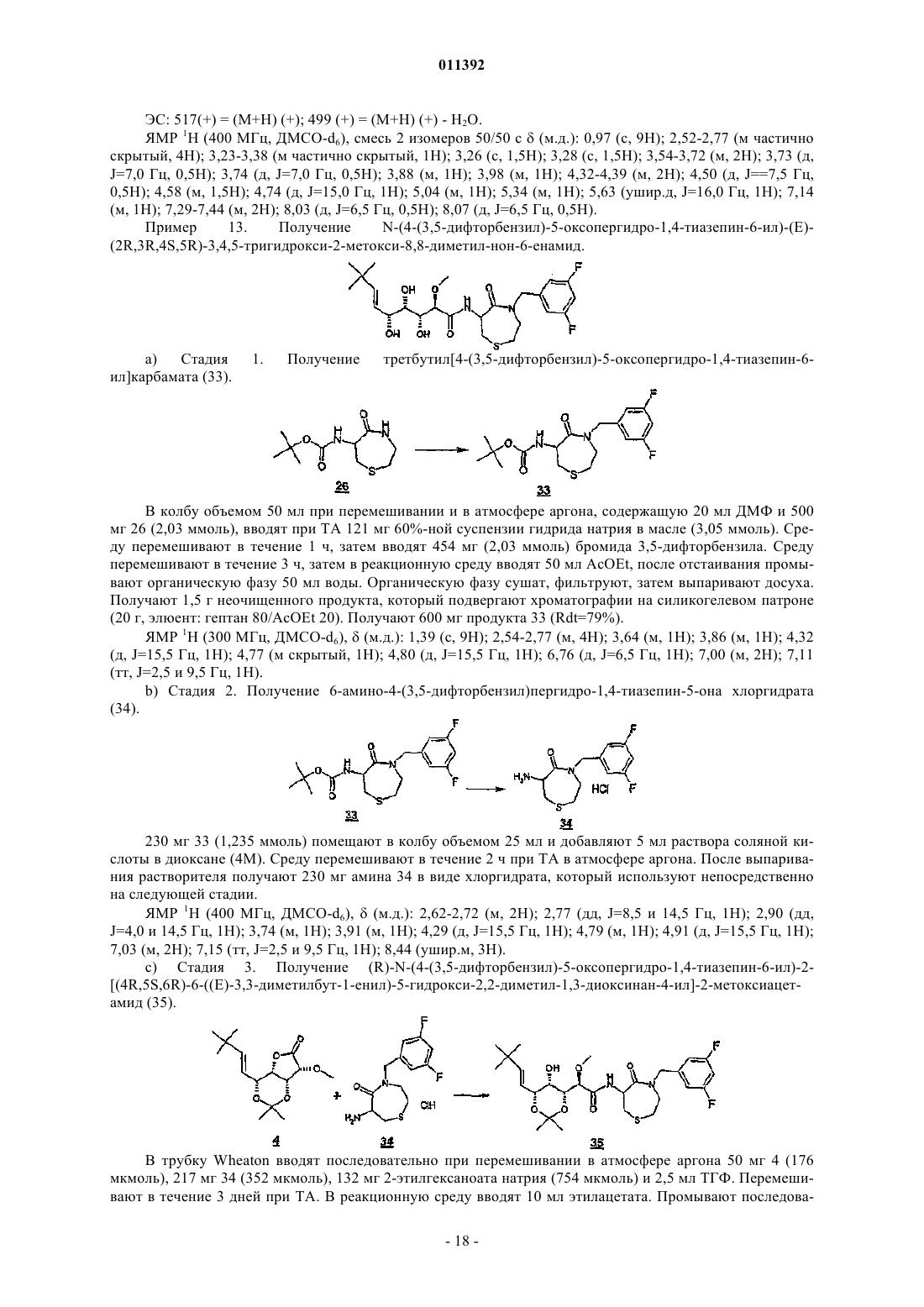
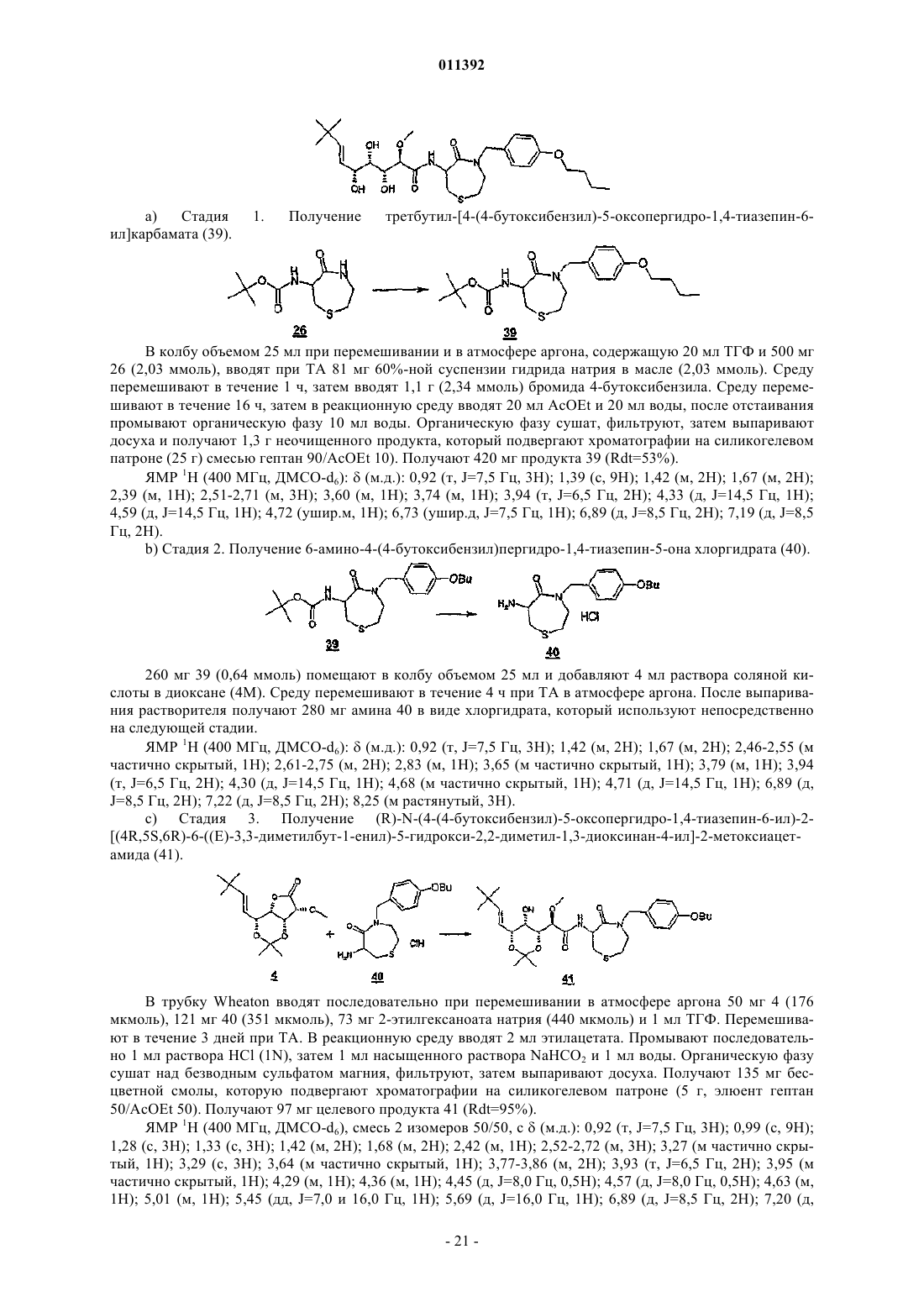
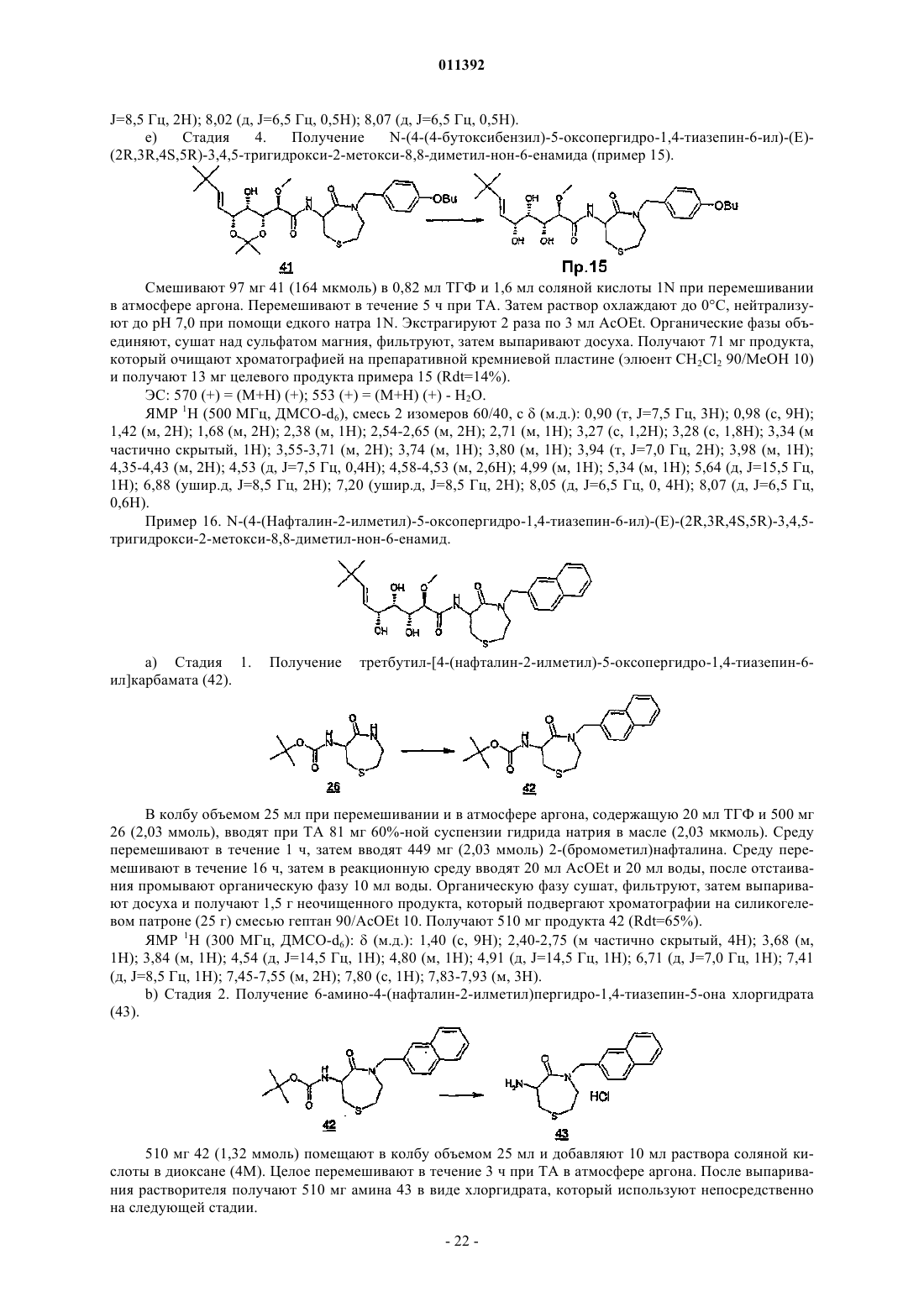
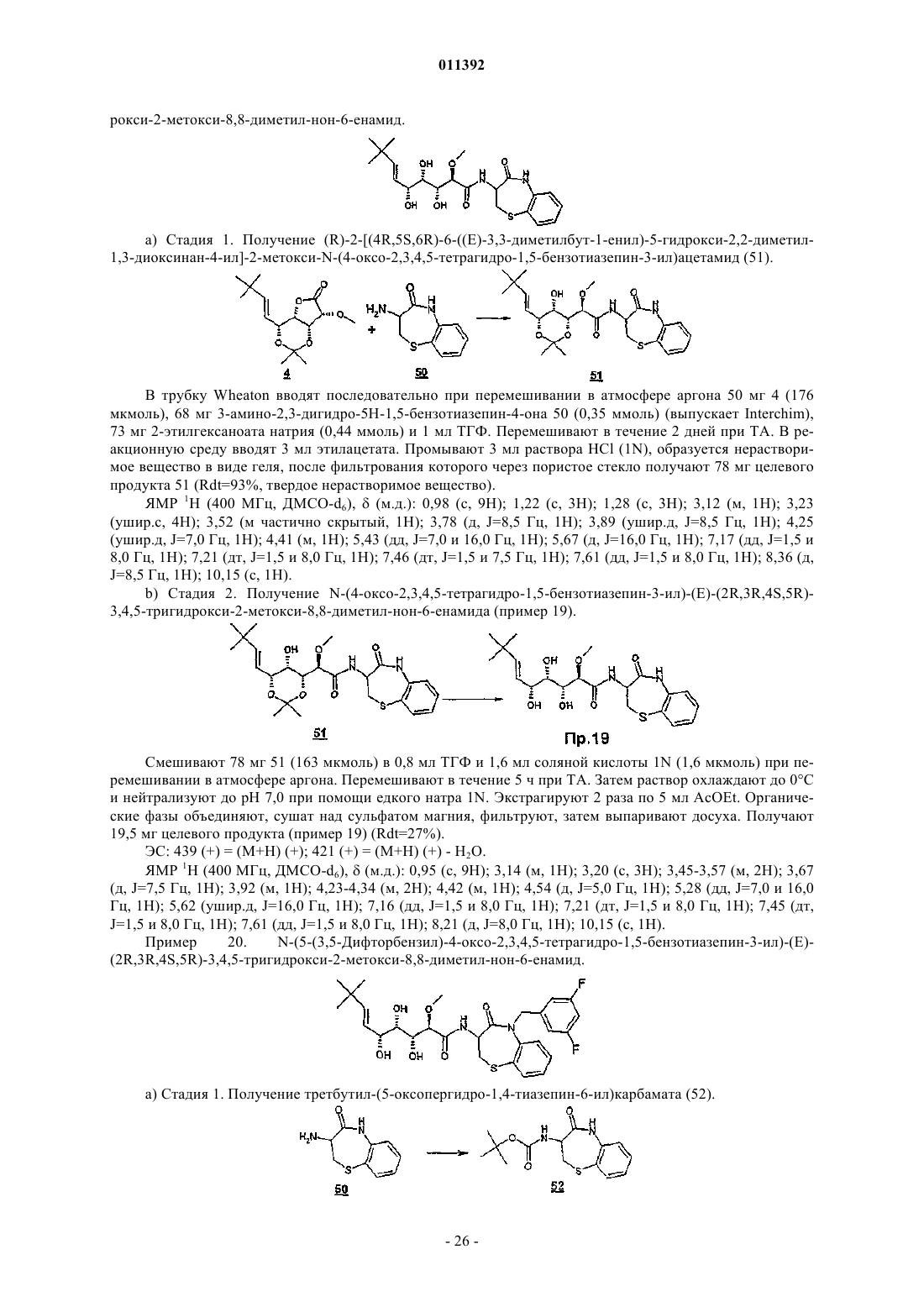
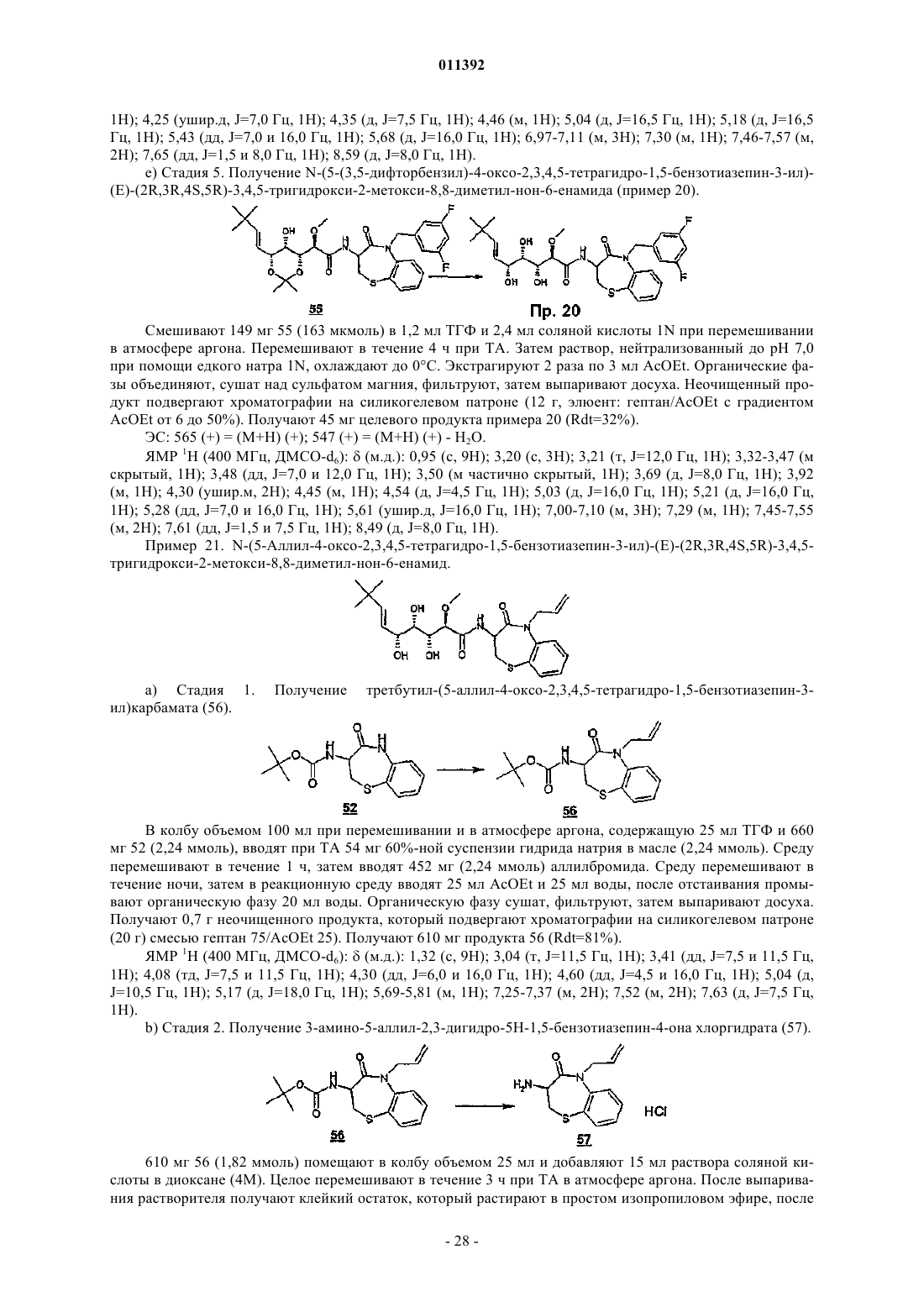
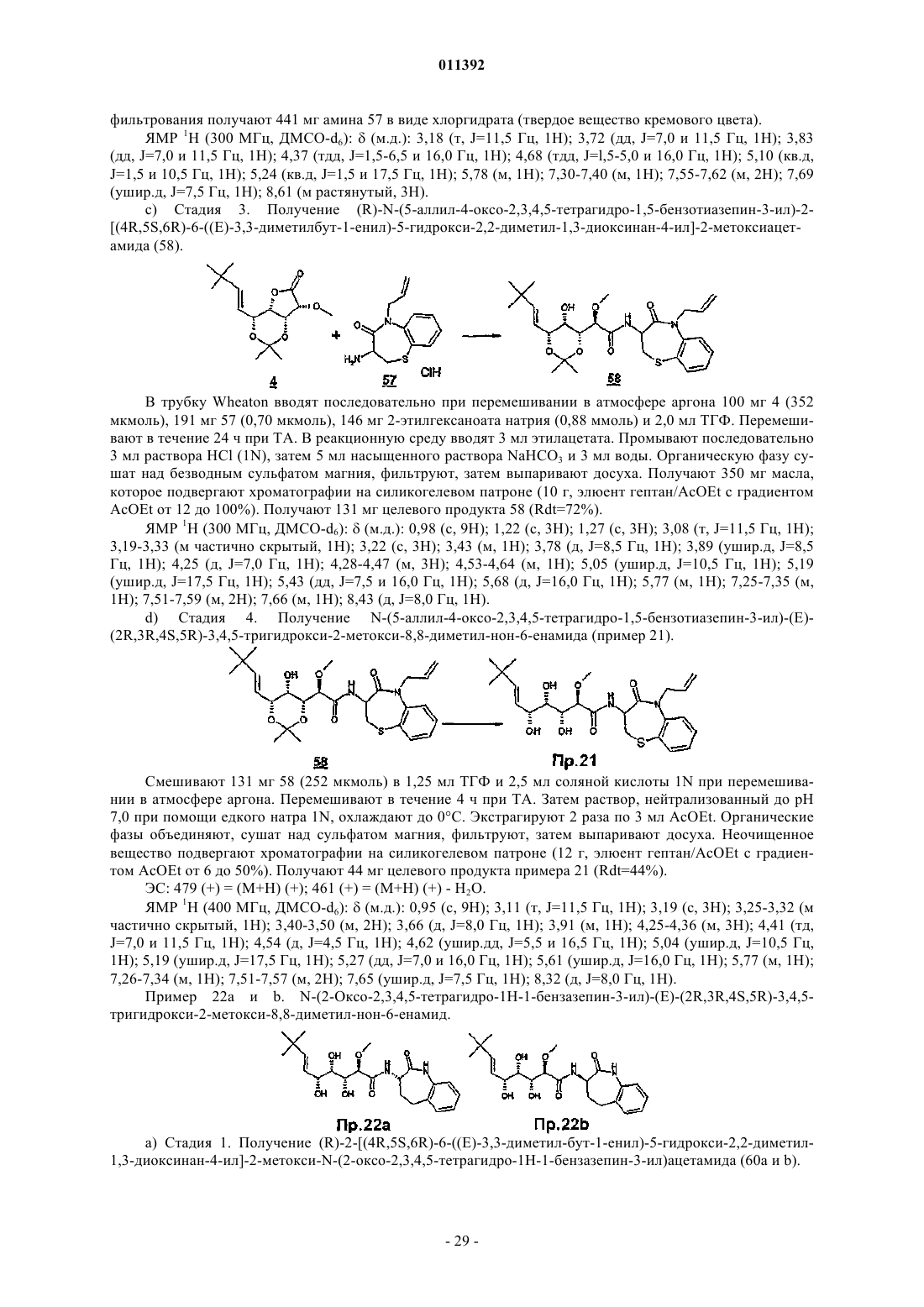
011392 Настоящее изобретение относится, в частности, к 2-алкокси-3,4,5-тригидроксиалкиламидам, их получению, композициям их содержащим и их применению в качестве лекарственного средства. Более конкретно и в соответствии с первым аспектом изобретение относится к 2-алкокси-3,4,5-тригидроксиалкиламидам, пригодным в качестве противораковых агентов. 2-Метокси-3,4,5-тригидроксиалкиламиды описаны в US 6239127, US 20010044433 A1, WO 01/85697, WO 00/29382, US 4831135, EP 687673 и US 2002128474 A1. Эти документы раскрывают главным образом аналоги и производные бенгамида, натурального продукта, выделенного из морской губкиJaspis coriacea. Эти же продукты описаны в литературе J. Org. Chem. (1986), 51(23), 4494-7; J. Org. Chem. (2001) 66(5), 1733-41; J. Med. Chem. 2001, 44, 3692-9.Kinder et al., в J. Med. Chem. 2001, 44, 3692-9 описывает активность различных бенгамидов. В этом исследовании авторы поясняют, что присутствие липофильного сложного эфира в капролактаме является основным для их противораковой активности in vitro и что N-замещение лактама метилом не влияет на указанную активность. Неожиданно было обнаружено, что можно получать продукты, обладающие значительной противораковой активностью, путем изменения заместителей, связанных с азотом капролактама. Было также обнаружено, что продукты, обладающие значительной противораковой активностью, можно получить путем изменения заместителей, связанных с атомами углерода капролактама, в частности, замещая атомы углерода циклом. Кроме того, было обнаружено, что можно получать продукты, в которых капролактам был заменен другим гетероциклом, сохраняя при этом удовлетворительную активность, к тому же с идентичными заместителями. Эти продукты соответствуют следующей формуле (I):(i) R1 независимо выбирают из группы, состоящей из алкила, циклоалкила, гетероциклоалкила, алкилена, гетероциклоалкилена, арила, гетероарила, арилалкила, гетероаралкила, арилалкилена, гетероарилалкилена, -С(R4)=N-O(R5), в котором R4 и R5 независимо выбирают из группы, состоящей из Н, -(C1C6)алкила, -(C1-С 6)алкиларила, -(C1-С 6)алкилгетероарила,(ii) R2 независимо выбирают из группы, состоящей изR9 выбирают из группы, состоящей из Н, COO(R10), CONH(R10), СО(R10), O(R10), R10, в которой каждый R10 независимо выбирают из неподеленной электоронной пары, Н, -алкила, -алкилена, -алкинила,-алкила галогенированного, -циклоалкила, в которой R10 возможно замещен по меньшей мере одним заместителем, выбранным из ОН, галогена, -(C1-C4)алкила, -О-(С 1-С 4)алкила, -(C1-C4)алкиларила, арила,-(С 1-С 4)алкилгетероарила, гетероарила, N(CH3)2, -NH2, -CONH2, и каждый из Rz независимо выбирают из группы, состоящей из Н, COO(R10), CONH(R10), CO(R10),R10, в которой каждый R10 независимо выбирают из -(C1-C4)алкила, -(С 1-С 4)алкила галогенированного,-(C1-C4)алкиларила, -(C1-C4)алкилгетероарила, в которой каждый R10 возможно замещен заместителем,выбранным из ОН, галогена, -(C1-C4)алкила, -О-(C1-C4)алкила, -(С 1-С 4)алкиларила, арила, -(С 1-С 4)алкилгетероарила, гетероарила; и R'1, R'2 и R'3 независимо выбирают из Н, R9 или они могут образовывать вместе, а также с R9 алифатический или ароматический цикл, содержащий от 5 до 7 цепочек и от 0 до 3 гетероатомов, независимо выбранных из О, S, N,(iii) R3 выбирают из группы, состоящей из -(C1-C6)алкила, -(C1-С 6)алкиларила, -(C1-C6)алкилгетероарила, -арила, -гетероарила, -арилалкилена, -гетероарилалкилена,R2 предпочтительно выбирают из гетероциклов общей формулы (II)R9 выбирают из группы, состоящей из Н, COO(R10), CONH(R10), CO(R10), O(R10), R10,X выбирают из СН 2, О, S, SO, SO2, NO, N(Ry), в котором Ry независимо выбирают из группы, состоящей из R9;Cy представляет собой (i) связь или (ii) алифатический или ароматический цикл, содержащий от 5 до 7 цепочек и от 0 до 3 гетероатомов, независимо выбранных из О, S, N;t имеет значение 0 или 1; каждый R8 независимо выбирают из группы, состоящей из Н, F, Cl, Br, N(R10)2, NO2, CN, COO(R10),CONH(R10), O(R10), R10, и m имеет значения 0, 1, 2, 3 или 4; каждый R10 независимо выбирают из неподеленной электронной пары, Н, -алкила, -алкилена, -алкинила, -алкила галогенированного, -алкиларила, -алкилгетероарила, -алкиларилгетероарила, -арила,-гетероарила, -циклоалкила, в котором каждый R10 возможно замещен по меньшей мере одним заместителем, выбранным из ОН, галогена, -(С 1-С 4)алкила, -O-(C1-C4)алкила, -(C1-C4)алкиларила, арила, -(С 1-С 4) алкилгетероарила, гетероарила, -N(CH3)2, -NH2, -CONH2, и каждый из Rz независимо выбирают из группы, состоящей из Н, COO(R10), CONH(R10), CO(R10),R10, в которой каждый R10 независимо выбирают из -(C1-C4)алкила, -(C1-C4)алкила галогенированного,-(C1-C4)алкиларила, -(С 1-С 4)алкилгетероарила, в которой каждый R10 возможно замещен заместителем,выбранным из ОН, галогена, -(C1-C4)алкила, -О-(C1-C4)алкила, -(C1-C4)алкиларила, арила, -(C1-C4)алкилгетероарила, гетероарила,при условии, что 1) если R3 обозначает метил и R1 обозначает CH=C(R4)(R5), где R4=H и R5=C1-C4 алкил, то R2 не является-СН=СН-фенил, -СН=СН-циклогексан, -СН=СН-алкил, -циклопропан-С(СН 3)3, -фенил-С(СН 3)3, -СН 2 СН 2-С(СН 3)3, С(СН 3)=СН-С(СН 3)3, -циклогексен. Предпочтительно R1 можно выбирать из -CH=C(R11)(R12), -CH=N-O(R4), -CH=N(R4); где R11 и R12 независимо выбирают из Н, (C1-С 6)алкила, и R2 может обозначать лактам. Более конкретно R1 обозначает-CH=C(R11)(R12), где R11 обозначает Н и R12 обозначает(C1-С 6)алкил. Более предпочтительно R1 выбирают из (Е)-СН=СН-СН(СН 3)(С 2 Н 5), (Е)-СН=СН-СН(СН 3)2 и (Е)-СН=СН-С(СН 3)3. Предпочтительным заместителем R3 является метил. Другие продукты согласно настоящему изобретению отличаются тем, что R1 выбирают из-СН=С(R11)(R12), CH=N-O(R4), CH=N-(R4), где R11, R12 независимо выбирают из Н, (C1-C6)алкила, и тем,что R2 обозначает лактам следующей общей формулы (III):R9 выбирают из группы, состоящей из Н, COO(R10), CONH(R10), CO(R10), R10, в которой каждый R10 независимо выбирают из -(С 1-С 4)алкила, -(С 1-С 4)алкила галогенированного, -(С 1-С 4)алкиларила, -(C1C4)алкилгетероарила, в которой каждый R10 возможно замещен одним заместителем, выбранным из ОН,галогена, -(C1-C4)алкила, -О-(C1-C4)алкила, -(C1-C4)алкиларила, арила, -(C1-C4)алкилгетероарила, -гетероарила, и каждый из Rz независимо выбирают из группы, состоящей из Н, COO(R10), CONH(R10), CO(R10), R10, в которой каждый R10 независимо выбирают из -(C1-С 4)алкила, -(C1-C4)алкила галогенированного, -(C1C4)алкиларила, -(C1-C4)алкилгетероарила, в которой каждый R10 возможно замещен заместителем, выбранным из ОН, галогена, -(C1-C4)алкила, -О-(C1-C4)алкила, -(C1-C4)алкиларила, арила, -(C1-C4)алкилгетероарила, гетероарила; каждый R90 и R91 обозначает -СН 2-; каждый q и r независимо принимает значение, выбранное из 0, 1, 2, 3 и 4;Cy представляет собой (i) связь или (ii) алифатический или ароматический цикл, содержащий от 5 до 7 цепочек и от 0 до 3 гетероатомов, независимо выбранных из О, S, N;t имеет значение 0 или 1; каждый R92 и R93 независимо выбирают из С, СН, N, NH, О и S при условии, что если один из R92 иR93 обозначает NH, О или S, то t=0. Предпочтительный заместитель R2 может быть выбран из группы, состоящей изR9, Cy, t, R8 и m такие, как определены в п.2. Наиболее предпочтительный заместитель R2 может быть выбран из группы, состоящей из в которой R9 выбирают из группы, состоящей из Н, алкена, -(C1-С 6)алкилфенила, -(C1-С 6)алкилфенила галогенированного, -(C1-С 6)алкилфенил-О-алкила, -(C1-С 6)алкилпиридина, -(C1-С 6)алкилпиридина галогенированного, -(C1-С 6)алкилнафтила, -(C1-С 6)алкил-N(СН 3)2, и R8 и m являются такими, как определены в п.2. Продукты согласно настоящему изобретению отличаются тем, что R2 выбирают из группы, состоящей из в которой R9 представляет собой алкен или фенил, замещенный 4 или 5 заместителями, независимо выбранными из R8, такого как определен в п.2. Группа других наиболее предпочтительных заместителей R2 может быть выбрана из группы, состоящей из(iii) каждый из R8 независимо выбирают из группы, состоящей из Н, F, Cl, Br, N(R10)2, NO2,COO(R10), CONH(R10), O(R10), R10, в которой каждый R10 независимо выбирают из Н, -(С 1-С 4)алкила,-(C1-C4)алкила галогенированного, -(С 1-С 4)алкиларила, -(С 1-С 4)алкилгетероарила, в которой каждый R10 возможно замещен заместителем, выбранным из галогена, -(С 1-С 4)алкила, -О-(C1-C4)алкила, -(C1-C4)алкиларила, арила, -(С 1-С 4)алкилгетероарила, гетероарила,(iv) каждый из R9, Ry независимо выбирают из группы, состоящей из Н, COO(R10), CONH(R10),CO(R10), R10, в которой каждый R10 независимо выбирают из -(C1-C4)алкила, -(C1-C4)алкила галогенированного, -(C1-C4)алкиларила, -(C1-C4)алкилгетероарила, в которой каждый R10 возможно замещен заместителем, выбранным из ОН, галогена, -(C1-C4)алкила, -О-(C1-C4)алкила, -(C1-C4)алкиларила, арила, -(C1C4)алкилгетероарила, гетероарила, и(v) каждый из Rz независимо выбирают из группы, состоящей из Н, COO(R10), CONH(R10), CO(R10),R10, в которой каждый R10 независимо выбирают из -(C1-C4)алкила, -(C1-C4)алкила галогенированного,-(C1-C4)алкиларила, -(C1-C4)алкилгетероарила, в которой каждый R10 возможно замещен заместителем,выбранным из ОН, галогена, -(C1-C4)алкила, -О-(C1-C4)алкила, -(C1-C4)алкиларила, арила, -(C1-C4)алкилгетероарила, гетероарила. Наиболее предпочтительные заместители R2 преимущественно могут быть замещены аминами, и эти амины преимущественно могут быть в форме соли. Предпочтительно изобретение относится к продуктам, представленным на табл. 1 и 2. Этими продуктами, преимущественно получаемыми в соответствии с настоящим изобретением, являются Продукты согласно настоящему изобретению могут быть в виде оснований, солей присоединения кислот, сольватов, гидратов или пролекарств. Продукты согласно настоящему изобретению предпочтительно имеют полигидроксилированную цепочку, абсолютная конформация которой представляет собой Продукты согласно изобретению могут быть в нехиральной форме, или в рацемической форме, или обогащенными стереоизомером, или обогащенными энантиомером; и возможно могут быть в форме соли. Продукт согласно изобретению можно применять для получения лекарственного средства, пригодного для лечения патологического состояния, в частности рака. Настоящее изобретение относится также к терапевтическим композициям, содержащим соединение согласно изобретению в ассоциации с эксципиентом, фармацевтически приемлемым в соответствии с выбранным способом введения. Фармацевтическая композиция может быть в твердом, жидком виде или в виде липосом. Из твердых композиций можно назвать порошки, желатиновые капсулы, таблетки. К формам для перорального введения можно также отнести твердые формы, защищенные в отношении кислой среды желудка. Вспомогательными веществами, используемыми для твердых форм, могут быть, в частности,минеральные вещества, такие как фосфаты, карбонаты, или органические вещества, такие как лактоза,целлюлоза, крахмал или полимеры. К жидким формам относятся растворы, суспензии или дисперсии. Они содержат в качестве дисперсионного вспомогательного вещества или воду, или органический растворитель (этанол, NMP или др.), или смеси поверхностно-активных веществ и растворителей или комплексообразующих агентов и растворителей. Жидкие формы предпочтительно пригодны для инъекций, и, следовательно, их состав является приемлемым для такого применения. К приемлемым способам введения посредством инъекции относятся внутривенное, интрапарентеральное, внутримышечное и подкожное введение, предпочтительным является внутривенное введение. Вводимую дозу соединений согласно изоберению подбирает врач в зависимости от способа введения пациенту и состояния последнего. Соединения согласно настоящему изобретению можно вводить отдельно или в смеси с другими противораковыми средствами. Из возможных ассоциаций можно назвать алкилирующие агенты, в частности циклофосфамид, мелфалан, ифосфамид, хлорамбуцил, бусульфан, тиотепа, преднимустин, кармустин, ломустин, семустин, стептозотоцин, декарбацин, темозоломид,прокарбацин и гексаметилмеламин,производные платины, в частности, такие как циспластин, карбоплатин или оксалиплатин,антибиотики, в частности, такие как блеомицин, митомицин, дактиномицин,агенты против микротрубочек, в частности, такие как винбластин, винкристин, виндезин, винорелбин, таксоиды (паклитаксель и доцетаксель),антрациклины, в частности, такие как доксорубицин, даунорубицин, идарубицин, эпирубицин, митоксантрон, лозоксантрон,топоизомеразы групп I и II, такие как этопозид, тенипозид, амсакрин, иринотекан, топотекан и томудекс,фторпиримидины, такие как 5-фторурацил, UFT, флоксуридин,аналоги цитидина, такие как 5-азацитидин, цитарабин, гемцитабин, 6-меркаптомурин, 6-тиогуанин,аналоги аденозина, такие как пентостатин, цитарабин или флударабина фосфат,метотрексат и фолиновая кислота,ферменты и различные соединения, такие как L-аспарагиназа, гидроксикарбамид, транс-ретиноевая кислота, сурамин, декстразоксан, амифостин, гепцептин, а также эстрогенные, андрогенные гормоны,антиваскулярные агенты, такие как производные комбрестатина или колхицина и их пролекарства. Можно также сочетать применение соединений согласно настоящему изобретению с лечением при помощи облучения. Такое лечение можно назначать одновременно, отдельно, последовательно. Врач подбирает лечение индивидуально. Определения Термин галоген относится к элементам, выбранным из F, Cl, Br и I. Термин алкил относится к насыщенному углеводородному заместителю, линейному или разветвленному, содержащему от 1 до 12 атомов углерода. Примерами алкильного заместителя являются метил,этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил, 1 метилбутил, 2-метилбутил, 3-метилбутил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил,1-этилпропил, гексил, 1-метилпентил, 2-метилпентил, 1-этилбутил, 2-этилбутил, 3,3-диметилбутил, гептил, 1-этилпентил, октил, нонил, децил, ундецил и додецил. Термин алкилен относится к углеводородному заместителю, линейному или разветвленному,имеющему одну или несколько ненасыщенных связей, содержащему один или более этиленовых фраг-5 011392 ментов, и до 12 атомов углерода. Примерами алкиленового заместителя являются 1-метилэтиленил,проп-1-енил, проп-2-енил, Z-1-метилпроп-1-енил, Е-1-метилпроп-1-енил, Z-1,2-диметилпроп-1-енил, Е 1,2-диметилпроп-1-енил, бут-1,3-диенил, 1-метилиденилпроп-2-енил, Z-2-метилбут-1,3-диенил, Е-2 метилбут-1,3-диенил, 2-метил-1-метилиденилпроп-2-енил, ундек-1-енил и ундек-10-енил. Термин алкинил относится к углеводородному заместителю, линейному или разветвленному,имеющему одну или несколько ненасыщенных связей, находящихся на паре вицинальных атомов углерода, содержащему от 1 до 12 атомов углерода. Примерами алкинильного заместителя являются заместители этинил, проп-1-инил, проп-2-инил и бут-1-инил. Термин арил относится к ароматическому моно- или полициклическому заместителю, содержащему от 6 до 14 атомов углерода. Примерами арильного заместителя являются заместители фенил, нафт 1-ил, нафт-2-ил, антрацен-9-ил, 1,2,3,4-тетрагидронафт-5-ил и 1,2,3,4-тетрагидронафт-6-ил. Термин гетероарил относится к гетероароматическому моно- или полициклическому заместителю, содержащему от 1 до 13 атомов углерода и от 1 до 4 гетероатомов. Примерами гетероарильного заместителя являются заместители пиррол-1-ил, пиррол-2-ил, пиррол-3-ил, фурил, тиенил, имидазолил,оксазолил, тиазолил, изоксазолил, изотиазолил, 1,2,4-триазолил, оксадиазолил, тиадиазолил, тетразолил,пиридил, пиримидил, пиразинил, 1,3,5-триазинил, индолил, бензо[b]фурил, бензо[b]тиенил, индазолил,бензимидазолил, азаиндолил, хинолеил, изохинолеил, карбазолил и акридил. Термин гетероатом относится здесь по меньшей мере к двухвалентному атому, не являющемуся углеродом. N, О, S и Se являются примерами гетероатомов. Термин циклоалкил относится к насыщенному или частично насыщенному циклическому углеводородному заместителю, содержащему от 3 до 12 атомов углерода. Примерами циклоалкильного заместителя являются заместители циклопропил, циклобутил, циклопентил, циклопентенил, циклопентадиенил, циклогексил, циклогексенил, циклогептил, бицикло[2.2.1]гептил, циклооктил, бицикло[2.2.2]октил, адамантил и пергидронафтил. Термин гетероциклил относится к насыщенному или частично насыщенному циклическому углеводородному заместителю, содержащему от 1 до 13 атомов углерода и от 1 до 4 гетероатомов. Предпочтительно насыщенный или частично насыщенный циклический углеводородный заместитель является моноциклическим и содержит 4 или 5 атомов углерода и от 1 до 3 гетероатомов. Преимущества изобретения иллюстрируют следующие примеры. Аббревиатуры Ас - ацетат, Bn - бензил, С - градусы Цельсия, кат. - катализатор, CCM - тонкослойная хроматография, ССР - хроматография на препаративных колонках, см - сантиметр,- химический сдвиг, d - дуплет, dd - дуплет дуплетов, ДМФ - диметилформамид, ДМСО-d6 - дейтериевый диметилсульфоксид, dt дуплет триплетов, экв. - эквивалент, ЭС+/- - электрораспыление (положительный/отрицательный режим),Et - этил, г - грамм, ч - час, Гц - герц, IC50 - константа 50%-ного ингибирования активности, iPr - изопропил, j - день, J - константа связи, ЖХМС - жидкостная хроматография в сочетании с массспектрометрией, m - мультиплет, Me - метил, мг - миллиграмм, МГц - мегагерц, мл - миллилитр, мкл микролитр, мм - миллиметр, мкм - микрометр, ммоль - миллимоль, мин - минута, N - мольл-1, ТП - точка плавления, Ph - фенил, м.д. - частей на миллион, q - квадруплет, Rdt - выход, Rf - фронтальное отношение, ЯМР 1H - протонный ядерный магнитный резонанс, s - синглет, Sl - уширенный синглет, t - триплет,ТА - комнатная температура, tBu - третбутил, TFA - трифторуксусная кислота, ТГФ - тетрагидрофуран, tr время задержки, УФ - ультрафиолетовое излучение, V - вольт. Пример 1. N-(2-Метил-3-оксо-2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-ил)(Е)-(2R,3R,4S,5R)-3,4,5 тригидрокси-2-метокси-8,8-диметил-нон-6-енамид. Раствор 176 мг (0,75 ммоль) продукта 1 метил 3-оксо-2,3,4,5-тетрагидро-1-Н-2-бензазепин-4 ил)карбамата (который можно получить в соответствии с WO 02/057257, приведенной здесь для сведения) в растворе в смеси 2 мл сухого ТГФ и 2 мл сухого ДМФ вводят по каплям при комнатной температуре в 60%-ную суспензию 36 мг (0,9 моль) NaH, диспергированного в масле, в суспензии в 2 мл безвод-6 011392 ного ТГФ в инертной атмосфере. По окончании введения добавляют 159 мг (1,5 экв.) йодида метила. Реакционную смесь затем перемешивают при комнатной температуре в течение 2 ч, затем вводят 10 мл насыщенного раствора хлорида аммония, охлаждая при этом реакционную смесь на ледяной бане. Смесь экстрагируют 310 мл этилацетата. Органические фазы объединяют, промывают 210 мл раствора, насыщенного NaCl, сушат над сульфатом магния и выпаривают досуха при пониженном давлении. Полученный маслянистый остаток подвергают хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 90/10. 82 мг (44%) целевого продукта 2 получают в виде масла. (CCM: Rf=0,7 дихлорметан/метанол 90/10). ЯМР 1 Н (CDCl3):(м.д.) 2,85-3,05 (м, 1 Н), 3,10 (с, 3 Н), 3,45-3,60 (м, 1 Н), 3,65 (с, 3 Н), 3,83 (д, 1 Н),5,15-5,25 (м, 2 Н), 6,13 (ушир.д, 1 Н), 7,05-7,25 (м, 4 Н). 0,6 мл триметилсилилйодида вводят в раствор 203 мг (0,93 ммоль) продукта 2 в 10 мл дихлорметана, затем смесь нагревают с обратным холодильником в течение 3 ч. После охлаждения до комнатной температуры и введения 50 мл этилацетата органическую фазу экстрагируют 225 мл раствора 1N соляной кислоты. Водные фазы объединяют, охлаждают, затем подщелачивают путем добавления гидроксида натрия 5N. Щелочные водные фазы затем насыщают NaCl, потом экстрагируют 325 мл этилацетата. Органические фазы объединяют, сушат над сульфатом магния и выпаривают при пониженном давлении до получения маслянистого остатка. Последний подвергают хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 90/10. 100 мг (57%) целевого продукта 3 получают в виде масла. Смесь 25 мг (0,13 ммоль) продукта 3, 22 мг (0,13 ммоль) 2-этилгексаноата натрия и 25 мг (0,088 ммоль) лактона 4 (который можно получить способами, описанными в J. Med. Chem. 2001, 44, 3692-3699,приведенного здесь для сведения, из -лактона и -глюкогептоновой кислоты) в 2 мл ТГФ, перемешивали при комнатной температуре в атмосфере азота. Реакцию продолжали до исчезновения амина 3 (примерно в течение 92 ч), присутствие которого отслеживали при помощи CCM (дихлорметан/метанол 90/10v/v). После добавления 20 мл этилацетата органическую фазу промывали 20 мл насыщенного водного раствора NaCl, сушили над сульфатом магния, фильтровали, затем растворители выпаривали при пониженном давлении. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол 97,5/2,5 v/v до получения смолы. Последнюю растворяли в 20 мл CH2Cl2, промывали 15 млNaOH 1N, 15 мл насыщенного раствора NaCl, сушили над MgSO4, фильтровали и выпаривали при пониженном давлении до получения 24 мг (59%) целевого продукта 5 в виде смолы (2 диастериоизомера). ЭС+/-: 475 (+) = (М+Н) (+); 949 (+) = (2 М+Н) (+). ЯМР 1H (CDCl3):(м.д.) 1,02 (м, 9 Н); 1,46 (м, 6 Н); 2,80-3,10 (м, 4 Н); 3,45-4,55 (м, 9 Н); 5,20-5,90 (м,4 Н); 7,05-8,10 (м, 5 Н). В колбу, снабженную магнитной мешалкой, вводили последовательно при 0 С 24 мг (50 мкмоль) продукта 5, затем 2 мл холодной смеси трифторуксусной кислоты/тетрагидрофурана/воды (1,6/1,6/1,0v/v/v). Эту смесь выдерживали при 0 С до исчезновения исходного продукта на CCM (1 ч), (дихлорметан/метанол, 90/10, v/v). Растворитель выпаривали при пониженном давлении, в остаток вводили 2 мл метанола и повторно выпаривали при пониженном давлении. Эту последнюю стадию повторяли второй раз и остаток растворяли в 5 мл воды в минимальном объеме метанола (0,5 мл). Раствор лиофилизовали с количественным получением целевого продукта примера 1 в виде меренги. ЭС+/-: 435 (+) = (М+Н) (+); 869 (+) = (2 М+Н) (+); 417 (+) = (М+Н) (+) - Н 2O. ЯМР 1H (CDCl3):(м.д.) 1,05 (с, 9 Н); 2,95-3,10 (м, 4 Н); 3,45-3,90 (м, 8 Н); 4,27 (м, 1 Н); 5,25 (ушир.д,J=16,0 Гц, 1 Н); 5,35-5,50 (м, 2 Н); 5,85 (д, J=16,0 Гц, 1 Н); 7,05-7,30 (м, 4 Н); 8,08 (ушир.д, J=6,0 Гц, 1 Н). Пример 2. N-[(S)-1-(Бифенил-4-илметил)-2-оксопергидроазепин-3-ил]-(Е)-(2R,3R,4S,5R)-3,4,5 тригидрокси-2-метокси-8,8-диметил-нон-6-енамид. В колбу объемом 25 мл при перемешивании в инертной атмосфере, погруженную в ледяную баню,последовательно вводят 6,5 мл раствора HCl в AcOEt (5,5N) при 0 С и 2,00 г 6 (который можно получить способами, описанными в WO 2001068655, содержание которого приведено здесь для сведения). Раствор оставляют для охлаждения до ТА при перемешивании на 3 ч. Выпаривание растворителя приводит к появлению 1,93 г белой пены, которую растирают в 10 мл Et2O. Твердое вещество, выпавшее в осадок,фильтруют. Однако оно очень гигроскопично и поэтому его рекуперируют при помощи МеОН, затем выпаривают досуха. Получают 1,666 г продукта 7 (Rdt=99%). В колбу объемом 20 мл при перемешивании в атмосфере аргона последовательно вводят 34,81 мг 4(0,122 ммоль), 50,67 мг 7 (0,153 ммоль), 41,31 мг 2-этилгексаноата натрия (0,249 ммоль) и 2 мл ТГФ. Перемешивание продолжают в течение 22 ч при ТА. На следующий день 20,09 мг 7 (0,061 ммоль) и 10,54 мг 2-этилгексаноата натрия (0,063 ммоль) вводят в реакционную среду. Через 3 дня добавляют 20 млAcOEt в реакционную среду, которую затем промывают последовательно 20 мл раствора NaOH (0,1N),20 мл воды и 20 мл насыщенного раствора NaCl. Органическую фазу сушат, фильтруют, затем выпаривают досуха. Неочищенный продукт очищают при помощи CCP смесью AcOEt 70/гептана 30 (Rf=0,23). Получают 64,43 мг продукта 8 (Rdt=91%). ЖХМС (ЭС+, 50 В): tR = 4,59 минm/z = 1157+ (2 М+Н+); 579+ (М+Н+); 521+(М+Н+[(Н 3 С)2 СО]); 1201 Смесь 0,6 мл TFA, 0,6 мл ТГФ и 0,4 мл воды при 0 С вводят в колбу, объемом 30 мл, содержащую 59,79 мг 8 (0,103 ммоль), и охлаждают также до 0 С. Затем колбу встряхивают при 0 С и в атмосфере аргона в течение 2 ч 30 мин. Реакционную среду фильтруют через мелкопористый фильтр, растворители затем выпаривают в вакууме при 0 С, затем продукт лиофилизуют в 10 мл чистой воды и 0,5 мл МеОН. Получают 50,75 мг продукта примера 2 (Rdt=91%). В колбу объемом 20 мл при перемешивании в атмосфере аргона последовательно вводят 25,39 мг 4(0,089 ммоль), 44,36 мг 2-этилгексаноата натрия (0,267 ммоль), 27,37 мг 9 (0,150 ммоль) (который можно получить в соответствии с US 6031094, приведенным здесь для сведения) и 2 мл ТГФ. Перемешивание продолжают в течение 3 дней при ТА. Затем в реакционную среду вводят 20 мл AcOEt и промывают 10 мл насыщенного раствора NaCl. Органическую фазу сушат, фильтруют, затем выпаривают досуха. Неочищенный продукт очищают при помощи CCP смесью CH2Cl2 93/МеОН 7 (Rf=0,21). Получают 30,57 мг продукта 10) (Rdt=80%).(86,66 мкмоль) продукта 10, затем 0,932 мл HCl (1N). Через 50 мин реакционную среду сушат. Полученный остаток очищают хроматографией на 2 пластинах препаративного диоксида кремния (2020 см,е=0,5 мм, Merck), элюент CH2Cl2/MeOH (96/4). Получают 14 мг (40%) целевого продукта примера 3. ЯМР 1 Н (400 МГц, CDCl3): смесь изомеров 50%-50%:(м.д.) 1,04 и 1,05 (2 с, 9 Н); 3,55 и 3,56 (2 с, 3 Н); 3,51-3,71 (м, 2 Н); 3,81-3,91 (м, 2 Н); 4,05 (м, 1 Н); 4,23 (м, 1 Н); 5,09 и 5,19 (2m, 1 Н); 5,44 (дд, J=7,5 и 16,5 Гц,1 Н); 5,86 (ушир.д, J=16,5 Гц, 1 Н); 7,16 (м, 1 Н); 7,37 (м, 4 Н); 7,54 (ушир.т, J=8,5 Гц, 1 Н). ЭС: m/z = 405 (M-H)-. Пример 4. N-(2-Оксопирролидин-3-ил)-(Е)-(2R,3R,4S,5R)-3,4,5-тригидрокси-2-метокси-8,8-диметил-нон-6-енамида. В колбу объемом 20 мл при перемешивании в атмосфере аргона последовательно вводят 25,40 мг 4(0,089 ммоль), 47,77 мг 2-этилгексаноата натрия (0,287 ммоль), 18,49 мг 11 (который можно получить способами, описанными в J. Org. Chem. 1961, 26, 1482-7, приведенном здесь для сведения) (0,135 ммоль) и 2 мл ТГФ. Перемешивание продолжают в течение 4 дней при ТА. Затем в реакционную среду вводят 20 мл AcOEt и промывают последовательно 20 мл раствора NaOH (0,1N), 20 мл воды и 20 мл насыщенного раствора NaCl. Поскольку, как это видно, продукт растворился в водной фазе, его экстрагируют 2 раза смесью 50 мл CH2Cl2 и 5 мл МеОН. 3 органические фазы объединяют, сушат, фильтруют, затем выпаривают досуха. Неочищенный продукт очищают при помощи CCP смесью CH2Cl2 93/МеОН 7. Получают 27,11 мг продукта 12 (Rdt=79%). Смесь 0,6 мл TFA, 06 мл ТГФ и 0,4 мл воды при 0 С вводят в колбу, объемом 30 мл, содержащую 24,37 мг 12 (0,063 ммоль), и охлаждают также до 0 С. Затем колбу встряхивают при 0 С и в атмосфере аргона в течение 40 мин. Растворители затем выпаривают в вакууме при 0 С, затем продукт лиофилизуют в 10 мл чистой воды. Получают 22,67 мг целевого продукта примера 4 (Rf=96%). В колбу объемом 5 мл при перемешивании вводят последовательно 43,88 мг 2-этилгексаноата натрия (0,264 ммоль), 25,00 мг 4 (0,088 ммоль), 5,69 мг 13 (который можно получить способами, описанными в US 4428960, содержание которого приведено здесь для сведения) (0,132 моль) и 2 мл ТГФ. Перемешивание продолжают в течение 6 дней при ТА. В реакционную среду вводят 0,4 мл ДМФ, затем перемешивают в течение 5 дней при 40 С. Вводят 20 мл AcOEt, которую затем промывают 10 мл насыщенного раствора NaCl. Органическую фазу сушат, фильтруют, затем выпаривают досуха. Неочищенный продукт очищают при помощи ССР смесью CH2Cl2 95/МеОН 5. Получают 28,07 мг продукта 14 (Rdt=72%). ЯМР 1 Н (400 МГц, CDCl3):(м.д.) = 7,07 и 6,70 (д, 1 Н); 5,78 (д, 1 Н); 5,52 (дд, 1 Н); 4,50 (м, 1 Н); 4,27 Смесь 0,6 мл TFA, 0,6 мл ТГФ и 0,4 мл воды при 0 С вводят в колбу объемом 30 мл, содержащую 26,70 мг 14 (0,055 ммоль), и охлаждают также до 0 С. Затем колбу встряхивают при 0 С и в атмосфере аргона в течение 40 мин. Растворители затем выпаривают в вакууме при 0 С, затем продукт лиофилизуют в 10 мл чистой воды. Получают 23,20 мг продукта примера 5 (Rf=95%). ССМ (CH2Cl2 90/МеОН 10): Rf=0,40. ЯМР 1 Н (400 МГц, CDCl3):(м.д.) = 7,36 (м, 1 Н); 7,27 (м, 1 Н); 5,84 (д, 1 Н); 5,42 (дд, 1 Н); 4,50 (м,1 Н); 4,25 (м, 1 Н); 4,22 (м, 1 Н); 3,87 (дд, 1 Н); 3,80 (м, 1 Н); 3,80 (с, 3 Н); 3,63 (т, 1 Н); 3,50 (с, 3 Н); 1,95 (м,2 Н); 1,03 (с, 9 Н). ЖХМС (ЭС+, 30 В): tR = 2,26 минm/z = 1207+ (3 М+Н+); 805+ (2 М+Н+); 403+ (М+Н+); 385+ В колбу объемом 20 мл при перемешивании в атмосфере аргона последовательно вводят 24,64 мг 4(0,087 ммоль), 41,05 мг 2-этилгексаноата натрия (0,247 ммоль), 20,16 мг 15 (который можно получить способами, описанными в WO 2002081480, содержание которого приведено здесь для сведения) (0,134 ммоль) и 2 мл ТГФ. Перемешивание продолжают в течение 4 дней при ТА. Затем в реакционную среду вводят 20 мл AcOEt и промывают последовательно 20 мл раствора NaOH (0,1N), 20 мл воды и 20 мл насыщенного раствора NaCl. Поскольку, как это видно, продукт растворился в водной фазе, его экстрагируют 2 раза смесью 50 мл CH2Cl2 и 5 мл МеОН. 3 органические фазы объединяют, сушат, фильтруют,- 11011392 затем выпаривают досуха. Неочищенный продукт очищают при помощи ССР смесью CH2Cl2 93/МеОН 7. Получают 28,49 мг продукта 16 (Rdt=83%). ССМ (CH2Cl2 90/МеОН 10): Rf=0,28. ЯМР 1 Н (400 МГц, CDCl3):(м.д.) = 7,11 (д, 1 Н); 5,70 (д, 1 Н); 5,67 (м, 1 Н); 5,48 (дд, 1 Н); 4,72 (м,1 Н); 4,20 (д, 1 Н); 4,02 (д, 1 Н); 3,80 (д, 1 Н); 3,50 (с, 1 Н); 3,49 (с, 3 Н); 3,36 (м, 2 Н); 2,54 (м, 2 Н); 1,96 (м,2 Н); 1,47 (с, 6 Н); 1,02 (с, 9 Н). ЖХМС (ЭС+, 30 В): tR = 2,92 минm/z = 797+ (2 М+Н+); 399+ (М+Н+); 341+ (М+Н+[(Н 3 С)2 СО]); 841 Смесь 0,6 мл TFA, 0,6 мл ТГФ и 0,4 мл воды при 0 С вводят в колбу объемом 30 мл, содержащую 26,29 мг 16 (0,066 ммоль), и также охлаждают до 0 С. Затем колбу встряхивают при 0 С и в атмосфере аргона в течение 40 мин. Растворители затем выпаривают в вакууме при 0 С, затем продукт лиофилизуют в 10 мл чистой воды. Получают 24,56 мг продукта примера 6 (Rdt=96%). ССМ (AcOEt 80/EtOH 15/H2O 5): Rf=0,22. ЯМР 1H (400 МГц, CDCl3):(м.д.) = 7,44 (д, 1 Н,); 6,12 (м, 1 Н); 5,84 (д, 1 Н, J=16 Гц); 5,43 (дд, 1 Н); 4,39 (м, 1 Н); 4,25 (дд, 1 Н); 3,88 (дд, 1 Н); 3,82 (д, 1 Н); 3,65 (дд, 1 Н); 3,52 (с, 3 Н); 3,38 (м, 2 Н); 2,48 (м, 1 Н); 1,95 (м, 2 Н); 1,70 (м, 1 Н); 1,03 (с, 9 Н). ЖХМС (ЭС+, 30 В): tR = 2,22 минm/z = 717+ (2 М+Н+); 359+ (М+Н+); 341+ (М+Н+Н 2 О); 323+ В колбу объемом 5 мл при перемешивании последовательно вводят 43,88 мг 2-этилгексаноата натрия (0,264 ммоль), 25,00 мг 4 (0,088 ммоль), 26,22 мг 17 (0,132 ммоль) (который можно получить способами, описанными в J. Med. Chem. 1986, 29(12), 2427-32, содержание которого приведено здесь для сведения) и 2 мл ТГФ. Перемешивание продолжают в течение 6 дней при ТА. Затем вводят 0,4 мл ДМФ,затем перемешивают в течение 5 дней при 40 С. В реакционную среду вводят 20 мл AcOEt и промывают последовательно 10 мл насыщенного раствора NaCl. Органическую фазу сушат, фильтруют, затем выпаривают досуха. Неочищенный продукт очищают при помощи ССР смесью CH2Cl2 95/МеОН 5. Получают 36,60 мг продукта 18 (Rdt=93%). ЯМР 1 Н (400 МГц, CDCl3):(м.д.) = 7,19-6,79 (4 Н); 5,77 (д, 1 Н); 5,54 (м, 1 Н); 4,66 (м, 1 Н); 4,30 (т,1 Н); 4,11 (т, 1 Н); 3,94 (м, 1 Н); 3,57 (м, 1 Н); 3,54 (м, 1 Н); 3,48 (с, 3 Н); 2,85 (м, 1 Н); 1,05 (с, 9 Н). ЖХМС (ЭС+, 30 В): tR = 3,63 минm/z = 893+ (2M+Н+); 447+ (М+Н+); 389+ (М+Н+[ (Н 3 С)2 СО]); 937 В колбу, снабженную механической мешалкой, вводят последовательно 0,714 мл ТГФ, 35,7 мг (80 мкмоль) продукта 18, затем 0,357 мл HCl (1N). Через 2 ч реакционную среду охлаждают (ледяная баня/вода), нейтрализуют при помощи 0,260 мл NaOH (2N), насыщенного NaCl, затем экстрагируют при помощи AcOEt. Органическую фазу сушат над MgSO4, фильтруют, затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на 2 пластинах из препаративного диоксида кремния (2020 см, е=0,5 мм, Merck), элюент CH2Cl2/МеОН (90/10). Получают 16 мг (49%) целевого продукта примера 7. ЯМР 1 Н (400 МГц, CDCl3): смесь изомеров 60%-40%,(м.д.) = 1,02 и 1,04 (2 с, 9 Н); 2,88-3,60 (м,7 Н); 3,68 (м, 1 Н); 3,81-3,93 (м, 2 Н); 4,11-4,41 (м, 2 Н); 4,67 (м, 1 Н); 5,43 (м, 1 Н); 5,84 (м, 1 Н); 6,83 (м, 1 Н); 7,04 (м, 1 Н); 7,15-7,25 (м, 2 Н); 7,75 (ушир.м, 1 Н); 7,98-8,29 (ушир.м, 1 Н). Пример 8. N-(5-Оксопергидро-1,4-тиазепин-6-ил)-(Е)-(2R,3R,4S,5R)-3,4,5-тригидрокси-2-метокси 8,8-диметил-нон-6-енамид. В колбу объемом 20 мл при перемешивании и в атмосфере аргона последовательно вводят 25,39 мг 4 (0,089 ммоль), 44,36 мг 2-этилгексаноата натрия (0,267 ммоль), 27,37 мг 19 (который можно получить способами, описанными в WO 2000005246, содержание которого приведено здесь для сведения) и 2 мл ТГФ. Перемешивание продолжают в течение 3 дней при ТА. В реакционную среду вводят 20 мл AcOEt и промывают последовательно 20 мл раствора NaOH (1N), 20 мл воды и 20 мл насыщенного раствораNaCl. Органическую фазу сушат, фильтруют, затем выпаривают досуха. Неочищенный продукт очищают при помощи ССР смесью CH2Cl2 93/МеОН 7. Получают 30,57 мг продукта 20 (Rdt=80%). ССМ (CH2Cl2 90/МеОН 10): Rf=0,33. ЯМР 1H (300 МГц, CDCl3):(м.д.) = 7,93 (д, 0,5 Н); 7,68 (д, 0,5 Н); 6,03 (м, 1 Н); 5,81 (д, 1 Н); 5,56 (м,1 Н); 5,00 (м, 1 Н); 4,30 (т, 1 Н); 4,10 (д, 1 Н); 3,94 (д, 1 Н); 3,71 (м, 2 Н); 3,57 (м, 1 Н); 3,53 (с, 3 Н); 2,80 (м,2 Н); 2,70 (м, 2 Н); 1,49 (с, 3 Н); 1,47 (с, 3 Н); 1,04 (с, 9 Н). ЖХМС (ЭС+/, 30 В): tR = 3,25 минm/z = 861+ (2 М+Н+); 431+(М+Н+); 373+(М+Н+[(Н 3 С)2 СО]); 475 Смесь 0,6 мл TFA, 0,6 мл ТГФ и 0,4 мл воды при 0 С вводят в колбу объемом 30 мл, содержащую 26,70 мг 20 (0,062 ммоль), и охлаждают также до 0 С. Затем колбу встряхивают при 0 С и в атмосфере аргона в течение 40 мин. Растворители затем выпаривают в вакууме при 0 С, затем продукт лиофилизуют в 10 мл чистой воды. Получают 25,75 мг продукта примера 8 (Rdt=94%). ССМ (CH2Cl2 90/МеОН 10): Rf=0,23. В колбу объемом 30 мл при перемешивании в инертной атмосфере (например, аргона, азота или любого другого приемлемого редкого газа) последовательно вводят 28,15 мг 4 (0,099 ммоль), 28,24 мг 21(который можно получить способами, описанными в WO 9404531, содержание которого приведено здесь для сведения) (0,123 ммоль), 18,44 мг 2-этилгексаноата натрия (0,111 ммоль) и 2 мл ТГФ. Перемешивание продолжают в течение 3 дней при ТА. В реакционную среду вводят 11,86 мг 21 (0,051 ммоль) и 9,80 мг 2-этилгексаноата натрия (0,059 ммоль). На следующий день в реакционную среду вводят 20 мл AcOEt и промывают последовательно 20 мл раствора NaOH (1N), 20 мл воды и 20 мл насыщенного раствораNaCl. Органическую фазу сушат, фильтруют, затем выпаривают досуха. Неочищенный продукт очищают при помощи ССР смесью AcOEt 70/гептан 30. Получают 43,53 мг продукта 22 (Rdt=85%). ССМ (CH2Cl2 95/МеОН 5): Rf=0,32. ЯМР 1 Н (400 МГц, CDCl3):(м.д.) = 7,60 (д, 1 Н); 7,24 (д, 1 Н); 7,11 (дт, 2 Н); 6,98 (д, 1 Н); 5,72 (д,1 Н); 5,55 (дт, 1 Н); 5,45 (дд, 1 Н); 5,25 (т, 1 Н); 4,22 (м, 1 Н); 4,04 (м, 1 Н); 3,86 (д, 1 Н); 3,60 (м, 2 Н); 3,50 (м,1 Н); 3,44 (с, 3 Н); 2,60-1,53 (м, 8 Н); 1,44 (с, 3 Н); 1,42 (с, 3 Н); 0,96 (с, 9 Н). ЖХМС (ЭС+/, 50 В): tR = 4,16 минm/z = 1051+ (2M+Na+); 1029+ (2 М+Н+); 515+ (М+Н+); 457+ Смесь 0,6 мл TFA, 0,6 мл ТГФ и 0,4 мл воды при 0 С вводят в колбу объемом 30 мл, содержащую 40,46 мг 22 (0,079 ммоль), и также охлаждают до 0 С. Затем колбу встряхивают при 0 С и в атмосфере аргона в течение 1 ч. Реакционную среду фильтруют через мелкопористый фильтр, затем растворители,затем выпаривают в вакууме при 0 С, после чего продукт лиофилизуют в 10 мл чистой воды и 0,5 мл МеОН. Получают 33,69 мг продукта примера 9 (Rdt=90%). ССМ (CH2Cl2 90/МеОН 10): Rf=0,22. ЖХМС (ЭС+/, 30 В): tR = 3,61 минm/z = 949+ (2 М+Н+); 475+ (М+Н+); 457+ (М+Н+Н 2 О); 993 (2MH+ В трехгорлую колбу объемом 100 мл при перемешивании с охлаждением и в атмосфере аргона вводят 15 г 19 (8,21 ммоль) в 20 мл хлороформа. В один прием впрыскивают 2,54 мл триэтиламина (18,07 ммоль) и целое помещают на ледяную баню. Затем по каплям впрыскивают 1,79 г дитретбутилдикарбоната (8,21 ммоль) в 25 мл хлофорома, поддерживая температуру ниже 5 С. Продолжают перемешивать в течение 2 ч 30 мин, затем вводят 45 мл CH2Cl2 и промывают три раза по 50 мл воды. Водную фазу экстрагируют 40 мл CH2Cl2, затем органические фазы объединяют, сушат над сульфатом магния, фильтруют и сушат. Получают 1,814 г твердого вещества белого цвета 26 (Rdt=64%). СОМ (AcOEt 80/циклогексан 20): Rf=0,33. ЯМР 1 Н (400 МГц, ДМСО-d6):(м.д.) = 8,03 (м, 1 Н); 6,54 (д, 1 Н); 4,48 (м, 1 Н); 3,48 (м, 2 Н); 2,6 (м,4 Н); 1,37 (с, 9 Н). ЖХМС (ЭС+/-, 30 В): m/z = 493+ (2 М+Н); 247+ (М+Н); 146+ (M+H-tBuOCO); 245- (М-Н). В колбу объемом 50 мл при перемешивании и в атмосфере аргона вводят 448 мг 26 (1,82 ммоль),67,2 мг йодида третбутиламмония (182 мкмоль), 216 мкл бензилбромида (1,82 ммоль) и 112 мг гидроксида калия (2 ммоль) в 18 мл ТГФ. Полученную белую суспензию перемешивают в течение 4 дней при ТА. В реакционную среду вводят 20 мл AcOEt, затем органическую фазу промывают три раза по 20 мл. Органическую фазу сушат, фильтруют, затем выпаривают. Получают 663 мг неочищенного продукта, который подвергают хроматографии на диоксиде кремния смесью гептан 80/AcOEt 20. Получают 417 мг продукта 27 (Rdt=68%). ССМ (гептан 80/AcOEt 20): Rf=0,25. ЯМР 1H (400 МГц, ДМСО-d6):(м.д.) = 7,3 (м, 5 Н); 6,78 (д, 1 Н); 4,77 (м, 1 Н); 4,74 и 4,38 (дд, 2 Н); 3,8 и 3,6 (м, 2 Н); 2,6 (м, 4 Н); 1,39 (с, 9 Н). ЖХМС (ЭС+/-, 30 В): m/z = 673+ (2 М+Н); 337+ (М+Н); 236+ (M+H-tBuOCO); 246+ (M+H-Bn); 335(М-Н). с) Стадия 3. Получение 6-амин-4-бензилпергидро-1,4-тиазепин-5-онхлоргидрата (28). 405 мг 28 (1,22 ммоль) помещают в 1 мл AcOEt и добавляют 28 мл раствора соляной кислоты в диоксане (4 М). Перемешивают в течение ночи при ТА в атмосфере аргона. Затем выпаривают растворители и сушат в вакууме. Получают 327 мг амина 28 в виде хлоргидрата, который используют непосредственно на следующей стадии. ЖХМС (ЭС+/-, 30 В): m/z = 473+ (2 М+Н); 237+ (М+Н); 146+ (M+H-Bn); 235- (М-Н). ЯМР 1 Н (400 МГц, ДМСО-d6):(м.д.) = 8,38 (ушир.с, 1 Н); 7,32 (м, 5 Н); 4,83 и 4,36 (дд, 2 Н); 4,72 (м,1 Н); 3,85 и 3,7 (м, 2 Н); 2,9-2,5 (м, 4 Н). В колбу объемом 50 мл при перемешивании и в атмосфере аргона последовательно вводят 116 мг 4(407 мкмоль), 140 мг 28 (513 мкмоль), 169 мг 2-этилгексаноата натрия (1,02 ммоль) и 10 мл ТГФ. Перемешивают в течение 4 дней при ТА. В реакционную среду вводят 40 мл этилацетата. Промывают последовательно 40 мл раствора едкого натра 0,1 М, затем 40 мл воды и 40 мл насыщенного раствора NaCl. Органическую фазу сушат над безводным сульфатом магния, фильтруют, затем выпаривают досуха. Получают 340 мг смолы желтоватого цвета, которую очищают хроматографией на диоксиде кремния (элюент CH2Cl2 97/MeOH 3). Получают 184 мг продукта 29 (Rdt=87%). ССМ (CH2Cl2 97/MeOH 3): Rf=0,34. ЖХМС (ЭС+/-, 50 В): m/z = 1043+ (2 М+Н); 522+ (М+Н); 464+ (М+Н-СО(СН 3)2); 1087- (2 МН+HCOOH); 566- (M-Н+НСООН); 520- (М-Н). ЯМР 1 Н (400 МГц, ДМСО-d6):(м.д.) = 8,05 (дд, 1 Н); 7,35 (м, 5 Н); 5,69 (д, 1 Н); 5,45 (дд, 1 Н); 5,05 Смешивают 340 мг 29 (653 мкмоль) в 3,8 мл ТГФ и 6,8 мл соляной кислоты 1N при перемешивании в атмосфере аргона. Перемешивают в течение 4 ч при ТА. Затем раствор охлаждают до 5 С и нейтрализуют до рН 7,0 при помощи едкого натра 2N. Вводят 2,5 г NaCl. Температуру смеси доводят до комнатной температуры. Вводят 5 мл AcOEt. Органическую фазу отделяют, сушат над сульфатом магния,фильтруют, затем выпаривают досуха. Получают 228 мг неочищенного продукта, который подвергают хроматографии на диоксиде кремния с градиентом элюирования от чистого CH2Cl2 до CH2Cl2 90/МеОН 10. Получают 153 мг продукта примера 11 (Rdt=49%). ССМ (CH2Cl2 90/МеОН 10): Rf=0,44. ЖХМС (ЭС+/-, 50 В): m/z = 969+ (2 М+Н); 482+ (М+Н); 464+ (М+Н-Н 2 О); 446+ (М+Н-2 Н 2 О); 428+ В колбу объемом 50 мл при перемешивании и в атмосфере аргона, содержащую 20 мл ТГФ и 500 мг 26 (2,03 ммоль), вводят при ТА 81 мг 60%-ной суспензии гидрида натрия в масле (2,03 ммоль). Перемешивают в течение 1 ч, затем вводят 420 мг (2,03 ммоль) бромида 3,4-дифторбензила. Среду перемеши- 16011392 вают в течение ночи, вводят в реакционную среду 20 мл AcOEt и 20 мл воды, после отстаивания промывают органическую фазу один раз 20 мл воды. Органическую фазу сушат, фильтруют, затем выпаривают досуха. Получают 1,5 г неочищенного продукта, который подвергают хроматографии на диоксиде кремния (элюент гептан 80/AcOEt 20). Получают 60 мг продукта 30 (Rdt=61%). ЯМР 1 Н (400 МГц, CDCl3),(м.д.): 1,46 (с, 9 Н); 2,42-2,58 (м, 2 Н); 2,72 (дд, J=9,5 и 14,5 Гц, 1 Н); 2,85 460 мг 30 (1,235 ммоль) помещают в колбу объемом 25 мл и добавляют 9,3 мл раствора соляной кислоты в диоксане (4 М). Среду перемешивают в течение 4 ч при ТА в атмосфере аргона. После выпаривания растворителя получают 460 мг амина 31 в виде хлоргидрата, который используют непосредственно на следующей стадии. ЯМР 1 Н (300 МГц, ДМСО-d6),(м.д.): 2,53-2,73 (м, 2 Н); 2,75 (дд, J=9,0 и 14,5 Гц, 1 Н); 2,93 (дд,J=4,0 и 14,5 Гц, 1 Н); 3,62-3,75 (м скрытый, 1 Н); 3,80-3,95 (м, 1 Н); 4,30 (д, J=15,0 Гц, 1 Н); 4,75 (дд, J=4,0 и 9,0 Гц, 1 Н); 4,82 (д, J=15,0 Гц, 1 Н); 7,17 (м, 1 Н); 7,32-7,47 (м, 2 Н); 8,49 (м растянутый, 3 Н). с) Стадия 3. Получение (R)-N-(4-(3,4-дифторбензил)-5-оксопергидро-1,4-тиазепин-6-ил)-2[(4R,5S,6R)-6-Е)-3,3-диметилбут-1-енил)-5-гидрокси-2,2-диметил-1,3-диоксинан-4-ил]-2-метоксиацетамид (32). В трубку Wheaton вводят последовательно при перемешивании в атмосфере аргона 50 мг 4 (179 мкмоль), 109 мг 31 (352 мкмоль), 73 мг 2-этилгексаноата натрия (440 мкмоль) и 1 мл ТГФ. Перемешивают в течение 3 дней при ТА. В реакционную среду вводят 3 мл этилацетата. Промывают последовательно 3 мл раствора HCl (1N), затем 3 мл насыщенного раствора NaHCO3 и 3 мл воды. Органическую фазу сушат над безводным сульфатом магния, фильтруют, затем выпаривают досуха. Получают 100 мг масла желтого цвета, которое подвергают хроматографии на силикогелевом патроне, привитом NH3 (3 г, элюент гептан 75/AcOEt 25). Получают 54 мг целевого продукта 32 (Rdt=50%). ЯМР 1H (400 МГц, ДМСО-d6), смесь 50%-50% изомеров с(м.д.): 0,99 (с, 9 Н); 1,27 (с, 3 Н); 1,32 (с,1,5 Н); 1,33 (с, 1,5 Н); 2,51-2,75 (м, 4 Н); 3,24-3,31 (м частично скрытый, 1 Н); 3,29 (с, 3 Н); 3,66 (м, 1 Н); 3,79 Смешивают 54 мг 32 (97 мкмоль) в 0,5 мл ТГФ и 0,97 мл соляной кислоты 1N при перемешивании в атмосфере аргона. Перемешивают в течение 5 ч при ТА. Затем раствор нейтрализуют до рН 7,0 при помощи едкого натра 1N. Экстрагируют 2 раза по 5 мл AcOEt. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, затем выпаривают досуха. Получают 38,5 мг продукта примера 12 третбутил[4-(3,5-дифторбензил)-5-оксопергидро-1,4-тиазепин-6 В колбу объемом 50 мл при перемешивании и в атмосфере аргона, содержащую 20 мл ДМФ и 500 мг 26 (2,03 ммоль), вводят при ТА 121 мг 60%-ной суспензии гидрида натрия в масле (3,05 ммоль). Среду перемешивают в течение 1 ч, затем вводят 454 мг (2,03 ммоль) бромида 3,5-дифторбензила. Среду перемешивают в течение 3 ч, затем в реакционную среду вводят 50 мл AcOEt, после отстаивания промывают органическую фазу 50 мл воды. Органическую фазу сушат, фильтруют, затем выпаривают досуха. Получают 1,5 г неочищенного продукта, который подвергают хроматографии на силикогелевом патроне 230 мг 33 (1,235 ммоль) помещают в колбу объемом 25 мл и добавляют 5 мл раствора соляной кислоты в диоксане (4 М). Среду перемешивают в течение 2 ч при ТА в атмосфере аргона. После выпаривания растворителя получают 230 мг амина 34 в виде хлоргидрата, который используют непосредственно на следующей стадии. ЯМР 1H (400 МГц, ДМСО-d6),(м.д.): 2,62-2,72 (м, 2 Н); 2,77 (дд, J=8,5 и 14,5 Гц, 1 Н); 2,90 (дд,J=4,0 и 14,5 Гц, 1 Н); 3,74 (м, 1 Н); 3,91 (м, 1 Н); 4,29 (д, J=15,5 Гц, 1 Н); 4,79 (м, 1 Н); 4,91 (д, J=15,5 Гц, 1 Н); 7,03 (м, 2 Н); 7,15 (тт, J=2,5 и 9,5 Гц, 1 Н); 8,44 (ушир.м, 3 Н). с) Стадия 3. Получение (R)-N-(4-(3,5-дифторбензил)-5-оксопергидро-1,4-тиазепин-6-ил)-2[(4R,5S,6R)-6-Е)-3,3-диметилбут-1-енил)-5-гидрокси-2,2-диметил-1,3-диоксинан-4-ил]-2-метоксиацетамид (35). В трубку Wheaton вводят последовательно при перемешивании в атмосфере аргона 50 мг 4 (176 мкмоль), 217 мг 34 (352 мкмоль), 132 мг 2-этилгексаноата натрия (754 мкмоль) и 2,5 мл ТГФ. Перемешивают в течение 3 дней при ТА. В реакционную среду вводят 10 мл этилацетата. Промывают последова- 18011392 тельно 10 мл раствора HCl (1N), затем 10 мл насыщенного раствора NaHCO2 и 10 мл насыщенного раствора NaCl. Органическую фазу сушат над безводным сульфатом магния, фильтруют, затем выпаривают досуха. Получают 120 мг масла желтого цвета, которое подвергают хроматографии на силикогелевом патроне, привитом NH2 (3 г, элюент CH2Cl2). Получают 48 мг целевого продукта 35 (Rdt=49%). ЯМР 1 Н (400 МГц, CDCl3), смесь 2 изомеров 50/50 с(м.д.): 1,03 (с, 4,5 Н); 1,04 (с, 4,5 Н); 1,45 (с,1,5 Н); 1,46 (с, 1,5 Н); 1,49 (с, 3 Н); 2,49-2,62 (м, 2 Н); 2,68 (дд, J=9,5 и 14,5 Гц, 0,5 Н); 2,73 (дд, J=9,5 и 14,5 Гц, J=0,5H); 2,78 (д, J=9,5 Гц, 1 Н); 2,84 (дд, J=3,0 и 14,5 Гц, 0,5 Н); 2,90 (дд, J=3,0 и 14,5 Гц, 0,5 Н); 3,44 (д,J=3,5 Гц, 0,5 Н); 3,50-3,58 (м частично скрытый, 0,5 Н); 3,51 (с, 1,5 Н); 3,55 (с, 1,5 Н); 3,60-3,68 (м, 1 Н); 3,87-3,98 (м, 2H); 4,08-4,11 (м, 1 Н); 4,29 (м, 1 Н); 4,36 (ушир.д, J=15,5 Гц, 1 Н); 4,86 (д, J=15,5 Гц, 1 Н); 5,14 Смешивают 48 мг 35 (97 мкмоль) в 0,42 мл ТГФ и 0,92 мл соляной кислоты 1N при перемешивании в атмосфере аргона. Перемешивают в течение 4 ч при ТА. Затем раствор нейтрализуют до рН 7,0 при помощи едкого натра 1N. Экстрагируют 2 раза по 2 мл AcOEt. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, затем выпаривают досуха. Получают 33,5 мг продукта примера 13 В колбу объемом 50 мл при перемешивании и в атмосфере аргона, содержащую 20 мл ДМФ и 500 мг 26 (2,03 ммоль), вводят при ТА 121 мг 60%-ной суспензии гидрида натрия в масле (3,05 ммоль). Среду перемешивают в течение 1 ч, затем вводят 489 мг (2,03 ммоль) 4-бромометил-2,6-дихлорпиридина. Среду перемешивают в течение 3 ч, затем в реакционную среду вводят 50 мл AcOEt и 50 мл воды, после отстаивания промывают органическую фазу 1 раз 50 мл воды. Органическую фазу сушат, фильтруют,затем выпаривают досуха. Получают 1,5 г неочищенного продукта, который подвергают хроматографии на силикогелевом патроне (20 г) смесью гептан 80/AcOEt 20. Получают 190 мг продукта 36 (Rdt=23%). ЯМР 1H (300 МГц, ДМСО-d6),(м.д.): 1,39 (с, 9 Н); 2,59-2.79 (м, 4 Н); 3,67 (м, 1 Н); 3,94 (м, 1 Н); 4,32 230 мг 36 (0,57 ммоль) помещают в колбу объемом 25 мл и добавляют 3 мл раствора соляной кислоты в диоксане (4 М). Среду перемешивают в течение 2 ч при ТА в атмосфере аргона. После выпаривания растворителя получают 290 мг амина 37 в виде хлоргидрата, который используют непосредственно на следующей стадии. ЯМР 1 Н (300 МГц, ДМСО-d6):(м.д.): 2,66-2,81 (т, 3 Н); 2,91 (дд, J=4,5 и 15,0 Гц, 1 Н); 3,63-3,76 (м скрытый, 1 Н); 3,96 (т, 1 Н); 4,31 (д, J=16,5 Гц, 1 Н); 4,83 (м, 1 Н); 4,95 (д, J=16,5 Гц, 1 Н); 7,48 (с, 2 Н); 8,44 В трубку Wheaton вводят последовательно при перемешивании в атмосфере аргона 50 мг 4 (176 мкмоль), 290 мг 37 (339 мкмоль), 99 мг 2-этилгексаноата натрия (595 мкмоль) и 2,5 мл ТГФ. Перемешивают в течение 3 дней при ТА. В реакционную среду вводят 10 мл этилацетата. Промывают последовательно 10 мл раствора HCl (IN), затем 10 мл насыщенного раствора NaHCO3 и 10 мл насыщенного водного раствора NaCl. Органическую фазу сушат над безводным сульфатом магния, фильтруют, затем выпаривают досуха. Получают 120 мг масла желтого цвета, которое подвергают хроматографии на силикогелевом патроне, (7 г, элюент CH2Cl2 90/AcOEt 10). Получают 78 мг целевого продукта 38 (Rdt=75%). ЯМР 1 Н (400 МГц, ДМСО-d6), смесь 2 изомеров 50/50 с(м.д.): 0,99 (с, 9 Н); 1,25 (с, 1,5 Н); 1,26 Смешивают 57 мг 38 (97 мкмоль) в 0,52 мл ТГФ и 1 мл соляной кислоты 1N при перемешивании в атмосфере аргона. Перемешивают в течение 4 ч при ТА. Затем раствор охлаждают до 0 С, нейтрализуют до рН 7,0 при помощи едкого натра 1N. Экстрагируют 2 раза по 2 мл AcOEt. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, затем выпаривают досуха. Получают 46 мг продукта примера 14 (Rdt=85%). ЭС: 550 (+) = (М+Н) (+); 532 (+) = (М+Н) (+) - Н 2 О. ЯМР 1H (400 МГц, ДМСО-d6), смесь 2 изомеров 60/40 с(м.д.): 1,03 (с, 5,4 Н); 1,04 (с, 3,6 Н); 2,572,70 (м, 2 Н); 2,75 (м, 1 Н); 2,86 (дд, J=3,0 и 14,5 Гц, 0,6 Н); 2,93 (дд, J=3,0 и 14,5 Гц, 0,4 Н); 3,58 (с, 3 Н); 3,59-3,66 (м, 2 Н); 3,81 (м, 1 Н); 3,85 (м, 1 Н); 3,99 (м, 1 Н); 4,21-4,29 (м, 2 Н); 4,91-5,00 (м, 1 Н); 5,15 (м, 1 Н); 5,44 (м, 1 Н); 5,83 (д, J=15,5 Гц, 0,6 Н); 5,84 (д, J=15,5 Гц, 0,4 Н); 7,14 (с, 1,2 Н); 7,16 (с, 0,8 Н); 8,17 (д, J=7,0 Гц, 0,6 Н); 8,20 (д, J=7,0 Гц, 0,4 Н). Пример 15. N-(4-(4-Бутоксибензил)-5-оксопергидро-1,4-тиазепин-6-ил)-(Е)-(2R,3R,4S,5R)-3,4,5 тригидрокси-2-метокси-8,8-диметил-нон-6-енамид. третбутил-[4-(4-бутоксибензил)-5-оксопергидро-1,4-тиазепин-6 В колбу объемом 25 мл при перемешивании и в атмосфере аргона, содержащую 20 мл ТГФ и 500 мг 26 (2,03 ммоль), вводят при ТА 81 мг 60%-ной суспензии гидрида натрия в масле (2,03 ммоль). Среду перемешивают в течение 1 ч, затем вводят 1,1 г (2,34 ммоль) бромида 4-бутоксибензила. Среду перемешивают в течение 16 ч, затем в реакционную среду вводят 20 мл AcOEt и 20 мл воды, после отстаивания промывают органическую фазу 10 мл воды. Органическую фазу сушат, фильтруют, затем выпаривают досуха и получают 1,3 г неочищенного продукта, который подвергают хроматографии на силикогелевом патроне (25 г) смесью гептан 90/AcOEt 10). Получают 420 мг продукта 39 (Rdt=53%). ЯМР 1 Н (400 МГц, ДМСО-d6):(м.д.): 0,92 (т, J=7,5 Гц, 3 Н); 1,39 (с, 9 Н); 1,42 (м, 2 Н); 1,67 (м, 2 Н); 2,39 (м, 1 Н); 2,51-2,71 (м, 3 Н); 3,60 (м, 1 Н); 3,74 (м, 1 Н); 3,94 (т, J=6,5 Гц, 2 Н); 4,33 (д, J=14,5 Гц, 1 Н); 4,59 (д, J=14,5 Гц, 1 Н); 4,72 (ушир.м, 1 Н); 6,73 (ушир.д, J=7,5 Гц, 1 Н); 6,89 (д, J=8,5 Гц, 2 Н); 7,19 (д, J=8,5 Гц, 2 Н). 260 мг 39 (0,64 ммоль) помещают в колбу объемом 25 мл и добавляют 4 мл раствора соляной кислоты в диоксане (4 М). Среду перемешивают в течение 4 ч при ТА в атмосфере аргона. После выпаривания растворителя получают 280 мг амина 40 в виде хлоргидрата, который используют непосредственно на следующей стадии. ЯМР 1 Н (400 МГц, ДМСО-d6):(м.д.): 0,92 (т, J=7,5 Гц, 3 Н); 1,42 (м, 2 Н); 1,67 (м, 2 Н); 2,46-2,55 (м частично скрытый, 1 Н); 2,61-2,75 (м, 2 Н); 2,83 (м, 1 Н); 3,65 (м частично скрытый, 1 Н); 3,79 (м, 1 Н); 3,94 В трубку Wheaton вводят последовательно при перемешивании в атмосфере аргона 50 мг 4 (176 мкмоль), 121 мг 40 (351 мкмоль), 73 мг 2-этилгексаноата натрия (440 мкмоль) и 1 мл ТГФ. Перемешивают в течение 3 дней при ТА. В реакционную среду вводят 2 мл этилацетата. Промывают последовательно 1 мл раствора HCl (1N), затем 1 мл насыщенного раствора NaHCO2 и 1 мл воды. Органическую фазу сушат над безводным сульфатом магния, фильтруют, затем выпаривают досуха. Получают 135 мг бесцветной смолы, которую подвергают хроматографии на силикогелевом патроне (5 г, элюент гептан 50/AcOEt 50). Получают 97 мг целевого продукта 41 (Rdt=95%). ЯМР 1H (400 МГц, ДМСО-d6), смесь 2 изомеров 50/50, с(м.д.): 0,92 (т, J=7,5 Гц, 3 Н); 0,99 (с, 9 Н); 1,28 (с, 3 Н); 1,33 (с, 3 Н); 1,42 (м, 2 Н); 1,68 (м, 2 Н); 2,42 (м, 1 Н); 2,52-2,72 (м, 3 Н); 3,27 (м частично скрытый, 1 Н); 3,29 (с, 3 Н); 3,64 (м частично скрытый, 1 Н); 3,77-3,86 (м, 2 Н); 3,93 (т, J=6,5 Гц, 2 Н); 3,95 (м частично скрытый, 1 Н); 4,29 (м, 1 Н); 4,36 (м, 1 Н); 4,45 (д, J=8,0 Гц, 0,5 Н); 4,57 (д, J=8,0 Гц, 0,5 Н); 4,63 (м,1 Н); 5,01 (м, 1 Н); 5,45 (дд, J=7,0 и 16,0 Гц, 1 Н); 5,69 (д, J=16,0 Гц, 1 Н); 6,89 (д, J=8,5 Гц, 2 Н); 7,20 (д,- 21011392 Смешивают 97 мг 41 (164 мкмоль) в 0,82 мл ТГФ и 1,6 мл соляной кислоты 1N при перемешивании в атмосфере аргона. Перемешивают в течение 5 ч при ТА. Затем раствор охлаждают до 0 С, нейтрализуют до рН 7,0 при помощи едкого натра 1N. Экстрагируют 2 раза по 3 мл AcOEt. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, затем выпаривают досуха. Получают 71 мг продукта,который очищают хроматографией на препаративной кремниевой пластине (элюент CH2Cl2 90/МеОН 10) и получают 13 мг целевого продукта примера 15 (Rdt=14%). ЭС: 570 (+) = (М+Н) (+); 553 (+) = (М+Н) (+) - Н 2 О. ЯМР 1 Н (500 МГц, ДMCO-d6), смесь 2 изомеров 60/40, с(м.д.): 0,90 (т, J=7,5 Гц, 3 Н); 0,98 (с, 9 Н); 1,42 (м, 2 Н); 1,68 (м, 2 Н); 2,38 (м, 1 Н); 2,54-2,65 (м, 2 Н); 2,71 (м, 1 Н); 3,27 (с, 1,2 Н); 3,28 (с, 1,8 Н); 3,34 (м частично скрытый, 1 Н); 3,55-3,71 (м, 2 Н); 3,74 (м, 1 Н); 3,80 (м, 1 Н); 3,94 (т, J=7,0 Гц, 2 Н); 3,98 (м, 1 Н); 4,35-4,43 (м, 2 Н); 4,53 (д, J=7,5 Гц, 0,4 Н); 4,58-4,53 (м, 2,6 Н); 4,99 (м, 1 Н); 5,34 (м, 1 Н); 5,64 (д, J=15,5 Гц,1 Н); 6,88 (ушир.д, J=8,5 Гц, 2 Н); 7,20 (ушир.д, J=8,5 Гц, 2 Н); 8,05 (д, J=6,5 Гц, 0, 4 Н); 8,07 (д, J=6,5 Гц,0,6 Н). Пример 16. N-(4-(Нафталин-2-илметил)-5-оксопергидро-1,4-тиазепин-6-ил)-(Е)-(2R,3R,4S,5R)-3,4,5 тригидрокси-2-метокси-8,8-диметил-нон-6-енамид. третбутил-[4-(нафталин-2-илметил)-5-оксопергидро-1,4-тиазепин-6 В колбу объемом 25 мл при перемешивании и в атмосфере аргона, содержащую 20 мл ТГФ и 500 мг 26 (2,03 ммоль), вводят при ТА 81 мг 60%-ной суспензии гидрида натрия в масле (2,03 мкмоль). Среду перемешивают в течение 1 ч, затем вводят 449 мг (2,03 ммоль) 2-(бромометил)нафталина. Среду перемешивают в течение 16 ч, затем в реакционную среду вводят 20 мл AcOEt и 20 мл воды, после отстаивания промывают органическую фазу 10 мл воды. Органическую фазу сушат, фильтруют, затем выпаривают досуха и получают 1,5 г неочищенного продукта, который подвергают хроматографии на силикогелевом патроне (25 г) смесью гептан 90/AcOEt 10. Получают 510 мг продукта 42 (Rdt=65%). ЯМР 1 Н (300 МГц, ДМСО-d6):(м.д.): 1,40 (с, 9 Н); 2,40-2,75 (м частично скрытый, 4 Н); 3,68 (м,1 Н); 3,84 (м, 1 Н); 4,54 (д, J=14,5 Гц, 1 Н); 4,80 (м, 1 Н); 4,91 (д, J=14,5 Гц, 1 Н); 6,71 (д, J=7,0 Гц, 1 Н); 7,41 510 мг 42 (1,32 ммоль) помещают в колбу объемом 25 мл и добавляют 10 мл раствора соляной кислоты в диоксане (4 М). Целое перемешивают в течение 3 ч при ТА в атмосфере аргона. После выпаривания растворителя получают 510 мг амина 43 в виде хлоргидрата, который используют непосредственно на следующей стадии. В трубку Wheaton вводят последовательно при перемешивании в атмосфере аргона 50 мг 4 (176 мкмоль), 114 мг 43 (352 мкмоль), 73 мг 2-этилгексаноата натрия (440 мкмоль) и 1 мл ТГФ. Перемешивают в течение 24 ч при ТА. В реакционную среду вводят 3 мл этилацетата. Промывают последовательно 3 мл раствора HCl (1N), затем 3 мл насыщенного раствора NaHCO3 и 3 мл насыщенного раствора NaCl. Органическую фазу сушат над безводным сульфатом магния, фильтруют, затем выпаривают досуха. Получают 140 мг масла, которое подвергают хроматографии на силикогелевом патроне, привитом NH2 (11 г, элюент: гептан 50/AcOEt 50). Получают 40 мг целевого продукта 44 (Rdt=44%). ЯМР 1 Н (400 МГц, CDCl3), смесь 2 изомеров 60/40, с(м.д.): 1,04 (с, 9 Н); 1,48 (с, 3 Н); 1,51 (с, 3 Н); 2,38-2,51 (м, 2 Н); 2,66-2,92 (м, 2,6 Н); 3,47-3,61 (м частично скрытый, 1,4 Н); 3,53 (с, 1,8 Н); 3,56 (с, 1,2 Н); 3,62-3,77 (м, 1 Н); 3,88-3,97 (м, 2 Н); 4,11 (ушир.д, J=6,5 Гц, 1 Н); 4,29 (м, 1 Н); 4,67 (д, J=15,5 Гц, 0,4 Н); 4,72 (д, J=15,5 Гц, 0,6 Н); 4,93 (д, J=15,5 Гц, 0,6 Н); 4,97 (д, J=15,5 Гц, 0,4 Н); 5,15 (м, 1 Н); 5,54 (дд, J=6,5 и 16,0 Гц, 0,4 Н); 5,58 (дд, J=6,5 и 16,0 Гц, 0,6 Н); 5,79 (д, J=16,0 Гц, 1 Н); 7,37 (м, 1 Н); 7,43-7,59 (м, 2 Н); 7,647,72 (м, 1 Н); 7,78-7,89 (м, 3,6 Н); 8,10 (д, J=7,0 Гц, 0,4 Н). е) Стадия 4. Получение N-(4-(нафталин-2-илметил)-5-оксопергидро-1,4-тиазепин-6-ил)-(Е)(2R,3R,4S,5R)-3,4,5-тригидрокси-2-метокси-8,8-диметил-нон-6-енамида (пример 16). Смешивают 40 мг 44 (70 мкмоль) в 0,38 мл ТГФ и 0,75 мл соляной кислоты 1N при перемешивании в атмосфере аргона. Перемешивают в течение 5 ч при ТА. Затем раствор охлаждают до 0 С, нейтрализуют до рН 7,0 при помощи едкого натра 1N. Экстрагируют 2 раза по 2 мл AcOEt. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, затем выпаривают досуха. Получают 25 мг целевого продукта примера 16 (Rdt=67%). ЭС: 531 (+) = (М+Н) (+); 513 (+) = (М+Н) (+) - Н 2 О. ЯМР 1H (400 МГц, ДМСО-d6), смесь 2 изомеров 50/50, с(м.д.): 0,98 (с, 9 Н); 2,42-2,61 (м частично скрытый, 2 Н); 2,65-2,79 (м, 2 Н); 3,29 (с, 1,5 Н); 3,30 (с, 1,5 Н); 3,30-3,40 (м частично скрытый, 1 Н); 3,61 (м,1 Н); 3,68-3,71 (м, 2 Н); 3,90 (м, 1 Н); 3,99 (м, 1 Н); 4,39 (д, J=5,5 Гц, 1 Н); 4,52 (д, J=7,5 Гц, 0,5 Н); 4,56-4,63 В колбу объемом 25 мл при перемешивании и в атмосфере аргона, содержащую 5 мл ДМФ и 123 мг 26 (0,5 ммоль), вводят при 0 С 53 мг 60%-ной суспензии гидрида натрия в масле (1,3 ммоль). Оставляют среду нагреваться до ТА в течение 1 ч, после чего вводят раствор ДМФ (2 мл), содержащий 128 мг (0,55 ммоль) 2-бромэтилдиметиламина гидробромида и 165 мг Nal (1,1 ммоль). Среду перемешивают в течение 1,5 ч, затем в реакционную среду вводят 20 мл AcOEt и 20 мл воды, после отстаивания промывают органическую фазу 3 раза по 20 мл воды, 1 раз 20 мл HCl (1N) и, наконец, 1 раз 20 мл аммиака. Органическую фазу сушат, фильтруют, затем выпаривают досуха и получают 82 мг продукта 45 (Rdt=52%). 114 мг 45 (0,359 ммоль) помещают в колбу объемом 20 мл и добавляют 4 мл раствора соляной кислоты в диоксане (4 М). Целое перемешивают в течение 3 ч при ТА в атмосфере аргона. После выпаривания растворителя получают 113 мг амина 46 в виде дихлоргидрата, который используют непосредственно на следующей стадии. с) Стадия 3. Получение (R)-N-(4-(2-диметиламиноэтил)-5-оксопергидро-1,4-тиазепин-6-ил)-2[(4R,5S,6R)-6-Е)-3,3-диметилбут-1-енил)-5-гидрокси-2,2-диметил-1,3-диоксинан-4-ил]-2-метоксиацетамида (47). В колбу объемом 20 мл вводят последовательно при перемешивании в атмосфере аргона 45 мг 4(158 мкмоль), 50 мг 46 (198 мкмоль), 66 мг 2-этилгексаноата натрия (396 мкмоль) и 2,5 мл ТГФ. Перемешивают в течение 6 дней при ТА. Добавляют 10 мл AcOEt. Органическую фазу промывают последовательно 10 мл раствора едкого натра 0,1 М, 10 мл насыщенного раствора NaCl и 10 мл насыщенного раствора NH4Cl. Органическую фазу сушат на MgSO4, фильтруют и выпаривают. Получают 31,3 мг вязкого масла желтого цвета 47 (Rdt=40%). ССМ (CH2Cl2 97/MeOH 3): Rf=0,4. ЖХМС (ЭС+/-, 50 В): m/z = 1005+ (2 М+Н); 503+ (М+Н); 445+ (М+Н-CO(СН 3)2); 1049- (2 МН+НСООН); 547- (М-Н+НСООН); 501- (М-Н). Растворяют 31 мг 47 (62 мкмоль) в 0,6 мл ТГФ в колбе объемом 50 мл и охлаждают до 0 С. Затем добавляют 0,4 мл воды при 0 С и, по меньшей мере, эквимолярное количество трифторуксусной кислоты, затем 0,6 мл ТГФ при 0 С. Колбу встряхивают в течение 2 ч при 0 С. Растворители выпаривают в глубоком вакууме при 0 С, вводят 5 мл метанола, охлажденного до 0 С, затем выпаривают досуха. Получают 35 мг твердого аморфного вещества, которое подвергают хроматографии на диоксиде кремния при помощи CH2Cl2 80/AcOEt 20. Получают 20 мг целевого продукта примера 17 (Rdt=70%). ЖХМС (ЭС+/-, 50 В): m/z = 925+ (2M+Н); 463+ (М+Н); 445+ (М+Н-Н 2 О); 427+ (М+Н-2 Н 2 О); 409+ В трубку Wheaton вводят последовательно при перемешивании в атмосфере аргона 100 мг 4 (352 мкмоль), 370 мг бензил-6-амино-5-оксо-[1,4]диазепин-1-карбоксилата 48 (1,4 ммоль) (выпускает фирмаAstraTech. Inc.), 292 мг 2-этилгексаноата натрия (1,76 ммоль) и 2,5 мл ТГФ. Перемешивают в течение 6 дней при ТА. В реакционную среду вводят 5 мл этилацетата. Промывают последовательно 5 мл раствораHCl (1N), затем 5 мл насыщенного раствора NaHCO3 и 5 мл воды. Органическую фазу сушат над безводным сульфатом магния, фильтруют, затем выпаривают досуха. Получают 190 мг масла, которое подвергают хроматографии на силикогелевом патроне, привитом NH2 (7 г, элюент гептан 40/AcOEt 60). Получают 81 мг целевого продукта 49 (Rdt=42%). ЯМР 1 Н (300 МГц, ДМСО-d6), смесь 2 изомеров 60/40, с(м.д.): 0,99 (с, 9 Н); 1,15-1,39 (м растянутый, 6 Н); 2,99 (м растянутый, 2 Н); 3,10-3,55 (м частично скрытый, 3 Н); 3,27 (с, 1,8 Н); 3,28 (с, 1,2 Н); 3,79 Смешивают 81 мг 49 (148 мкмоль) в 0,75 мл ТГФ и 1,5 мл соляной кислоты 1N (750 мкмоль) при перемешивании в атмосфере аргона. Перемешивают в течение 5 ч при ТА. Затем раствор охлаждают до 0 С и нейтрализуют до рН 7,0 при помощи едкого натра 1N. Экстрагируют 2 раза по 2 мл AcOEt. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, затем выпаривают досуха. Получают 49 мг целевого продукта. Пример 18 (Rdt=66%). ЭС: 508 (+) = (М+Н) (+); 490 (+) = (М+Н) (+) - Н 2 О. ЯМР 1 Н (400 МГц, CDCl3):(м.д.): 1,03 (с, 9 Н); 3,01 (м растянутый, 2 Н); 3,24-3,72 (ушир.м, 5 Н); 3,56 (с, 3 Н); 3,75-3,87 (м, 2 Н); 4,23 (ушир.м, 1 Н); 4,27-4,53 (м растянутый, 2 Н); 4,63 (м растянутый, 1 Н); 5,09-5,26 (м растянутый, 2 Н); 5,43 (м, 1 Н); 5,84 (д, J=16,0 Гц, 1 Н); 6,16 (м растянутый, 1 Н); 7,29-7,49 (м,5 Н); 7,93 (м растянутый, 1 Н). Пример 19. N-(4-Оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил)-(E)-(2R,3R,4S,5R)-3,4,5-тригид- 25011392 рокси-2-метокси-8,8-диметил-нон-6-енамид. В трубку Wheaton вводят последовательно при перемешивании в атмосфере аргона 50 мг 4 (176 мкмоль), 68 мг 3-амино-2,3-дигидро-5 Н-1,5-бензотиазепин-4-она 50 (0,35 ммоль) (выпускает Interchim),73 мг 2-этилгексаноата натрия (0,44 ммоль) и 1 мл ТГФ. Перемешивают в течение 2 дней при ТА. В реакционную среду вводят 3 мл этилацетата. Промывают 3 мл раствора HCl (1N), образуется нерастворимое вещество в виде геля, после фильтрования которого через пористое стекло получают 78 мг целевого продукта 51 (Rdt=93%, твердое нерастворимое вещество). ЯМР 1H (400 МГц, ДМСО-d6),(м.д.): 0,98 (с, 9 Н); 1,22 (с, 3 Н); 1,28 (с, 3 Н); 3,12 (м, 1 Н); 3,23 Смешивают 78 мг 51 (163 мкмоль) в 0,8 мл ТГФ и 1,6 мл соляной кислоты 1N (1,6 мкмоль) при перемешивании в атмосфере аргона. Перемешивают в течение 5 ч при ТА. Затем раствор охлаждают до 0 С и нейтрализуют до рН 7,0 при помощи едкого натра 1N. Экстрагируют 2 раза по 5 мл AcOEt. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, затем выпаривают досуха. Получают 19,5 мг целевого продукта (пример 19) (Rdt=27%). ЭС: 439 (+) = (М+Н) (+); 421 (+) = (М+Н) (+) - Н 2 О. ЯМР 1H (400 МГц, ДМСО-d6),(м.д.): 0,95 (с, 9 Н); 3,14 (м, 1 Н); 3,20 (с, 3 Н); 3,45-3,57 (м, 2 Н); 3,67- 26011392 В трехгорлую колбу объемом 50 мл при перемешивании и в атмосфере аргона вводят 0,4 г 50 (2,06 ммоль) в 10 мл хлороформа. В один прием впрыскивают 289 мкл триэтиламина (2,06 ммоль) и целое помещают на ледяную баню. Затем по каплям впрыскивают 449 мг дитретбутилдикарбоната (2,08 ммоль) в 10 мл хлороформа, поддерживая температуру ниже 5 С. Продолжают перемешивать в течение 3 ч, затем промывают реакционную среду 20 мл HCl (0,5N). Водную фазу сушат над сульфатом магния, фильтруют и сушат. Получают 0,43 г твердого вещества белого цвета 52 (Rdt=71%). В колбу объемом 50 мл, содержащую 20 мл ДМФ и 610 мл 52 (2,07 ммоль), вводят при ТА 112 мг 60%-ной суспензии гидрида натрия в масле (2,82 ммоль). Среду перемешивают в течение 1 ч, затем вводят 858 мг (4,14 ммоль) 3,5-дифторбензилбромида. Среду перемешивают в течение ночи, вводят в реакционную среду 20 мл AcOEt и 00 мл воды, после отстаивания органическую фазу промывают 20 мл воды. Органическую фазу сушат, фильтруют, затем выпаривают досуха. После хроматографии на силикогелевом патроне (70 г) смесью гептан/AcOEt (градиент AcOEt от 6 до 50%). Получают 410 мг продукта 53 (Rdt=54%). ЯМР 1 Н (400 МГц, ДМСО-d6),(м.д.): 1,35 (с, 9H); 3,11 (т, J=11,5 Гц, 1 Н); 3,48 (дд, J=7,0 и 11,5 Гц,1 Н); 4,15 (м, 1 Н); 5,03 (д, J=16,0 Гц, 1 Н); 5,13 (д, J=16,0 Гц, 1 Н); 6,98-7,10 (м, 3 Н); 7,28 (ушир.т, J=8,0 Гц,1 Н); 7,39 (ушир.д, J=8,0 Гц, 1 Н); 7,47-7,53 (м, 2 Н); 7,63 (ушир.д, J=7,5 Гц, 1 Н). с) Стадия 3. Получение 3-амино-5-(3,5-дифторбензил)-2,3-дигидро-5 Н-1,5-бензотиазепин-4-она гидрохлорида (54). 520 мг 53 (1,24 ммоль) помещают в колбу объемом 25 мл и добавляют 10 мл раствора соляной кислоты в диоксане (4 М). Перемешивают в течение 3 ч при ТА в атмосфере аргона. После выпаривания растворителя получают 470 мг амина 54 в виде хлоргидрата, который используют непосредственно на следующей стадии. ЯМР 1 Н (400 МГц, ДМСО-d6):(м.д.): 3,25 (т, J=11,5 Гц, 1 Н); 3,75 (дд, J=7,0 и 11,5 Гц, 1 Н); 3,94 В трубку Wheaton при перемешивании и в атмосфере аргона последовательно вводят 100 мг 4 (352 мкмоль), 251 мг 54 (0,70 ммоль), 146 мг 2-этилгексаноата натрия (0,88 ммоль) и 2,0 мл ТГФ. Перемешивают в течение 24 ч при ТА. В реакционную среду вводят 3 мл этилацетата. Промывают последовательно 3 мл раствора HCl (1N), затем 5 мл насыщенного раствора NaHCO3 и 3 мл воды. Органическую фазу сушат над безводным сульфатом магния, фильтруют, затем выпаривают досуха. Получают 350 мг масла,которое подвергают хроматографии на силикогелевом патроне (10 г, элюент гептан/AcOEt градиентAcOEt от 12 до 100%). Получают 149 мг целевого продукта 55 (Rdt=70%). ЯМР 1H (300 МГц, ДМСО-d6):(м.д.): 0,98 (с, 9 Н); 1,21 (с, 3 Н); 1,27 (с, 3 Н); 3,13-3,33 (м частично скрытый, 2 Н); 3,23 (с, 3 Н); 3,49 (дд, J=7,0 и 11,5 Гц, 1 Н); 3,79 (д, J=8,5 Гц, 1 Н); 3,91 (ушир.д, J=8,5 Гц,- 27011392 1 Н); 4,25 (ушир.д, J=7,0 Гц, 1 Н); 4,35 (д, J=7,5 Гц, 1 Н); 4,46 (м, 1 Н); 5,04 (д, J=16,5 Гц, 1 Н); 5,18 (д, J=16,5 Гц, 1 Н); 5,43 (дд, J=7,0 и 16,0 Гц, 1 Н); 5,68 (д, J=16,0 Гц, 1 Н); 6,97-7,11 (м, 3 Н); 7,30 (м, 1 Н); 7,46-7,57 (м,2 Н); 7,65 (дд, J=1,5 и 8,0 Гц, 1 Н); 8,59 (д, J=8,0 Гц, 1 Н). е) Стадия 5. Получение N-(5-(3,5-дифторбензил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил)(Е)-(2R,3R,4S,5R)-3,4,5-тригидрокси-2-метокси-8,8-диметил-нон-6-енамида (пример 20). Смешивают 149 мг 55 (163 мкмоль) в 1,2 мл ТГФ и 2,4 мл соляной кислоты 1N при перемешивании в атмосфере аргона. Перемешивают в течение 4 ч при ТА. Затем раствор, нейтрализованный до рН 7,0 при помощи едкого натра 1N, охлаждают до 0 С. Экстрагируют 2 раза по 3 мл AcOEt. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, затем выпаривают досуха. Неочищенный продукт подвергают хроматографии на силикогелевом патроне (12 г, элюент: гептан/AcOEt с градиентомAcOEt от 6 до 50%). Получают 45 мг целевого продукта примера 20 (Rdt=32%). ЭС: 565 (+) = (М+Н) (+); 547 (+) = (М+Н) (+) - Н 2 О. ЯМР 1 Н (400 МГц, ДМСО-d6):(м.д.): 0,95 (с, 9 Н); 3,20 (с, 3 Н); 3,21 (т, J=12,0 Гц, 1 Н); 3,32-3,47 (м скрытый, 1 Н); 3,48 (дд, J=7,0 и 12,0 Гц, 1 Н); 3,50 (м частично скрытый, 1 Н); 3,69 (д, J=8,0 Гц, 1 Н); 3,92 третбутил-(5-аллил-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3 В колбу объемом 100 мл при перемешивании и в атмосфере аргона, содержащую 25 мл ТГФ и 660 мг 52 (2,24 ммоль), вводят при ТА 54 мг 60%-ной суспензии гидрида натрия в масле (2,24 ммоль). Среду перемешивают в течение 1 ч, затем вводят 452 мг (2,24 ммоль) аллилбромида. Среду перемешивают в течение ночи, затем в реакционную среду вводят 25 мл AcOEt и 25 мл воды, после отстаивания промывают органическую фазу 20 мл воды. Органическую фазу сушат, фильтруют, затем выпаривают досуха. Получают 0,7 г неочищенного продукта, который подвергают хроматографии на силикогелевом патроне 610 мг 56 (1,82 ммоль) помещают в колбу объемом 25 мл и добавляют 15 мл раствора соляной кислоты в диоксане (4 М). Целое перемешивают в течение 3 ч при ТА в атмосфере аргона. После выпаривания растворителя получают клейкий остаток, который растирают в простом изопропиловом эфире, после В трубку Wheaton вводят последовательно при перемешивании в атмосфере аргона 100 мг 4 (352 мкмоль), 191 мг 57 (0,70 мкмоль), 146 мг 2-этилгексаноата натрия (0,88 ммоль) и 2,0 мл ТГФ. Перемешивают в течение 24 ч при ТА. В реакционную среду вводят 3 мл этилацетата. Промывают последовательно 3 мл раствора HCl (1N), затем 5 мл насыщенного раствора NaHCO3 и 3 мл воды. Органическую фазу сушат над безводным сульфатом магния, фильтруют, затем выпаривают досуха. Получают 350 мг масла,которое подвергают хроматографии на силикогелевом патроне (10 г, элюент гептан/AcOEt с градиентомAcOEt от 12 до 100%). Получают 131 мг целевого продукта 58 (Rdt=72%). ЯМР 1 Н (300 МГц, ДМСО-d6):(м.д.): 0,98 (с, 9 Н); 1,22 (с, 3 Н); 1,27 (с, 3 Н); 3,08 (т, J=11,5 Гц, 1 Н); 3,19-3,33 (м частично скрытый, 1 Н); 3,22 (с, 3 Н); 3,43 (м, 1 Н); 3,78 (д, J=8,5 Гц, 1 Н); 3,89 (ушир.д, J=8,5 Гц, 1 Н); 4,25 (д, J=7,0 Гц, 1 Н); 4,28-4,47 (м, 3 Н); 4,53-4,64 (м, 1 Н); 5,05 (ушир.д, J=10,5 Гц, 1 Н); 5,19 Смешивают 131 мг 58 (252 мкмоль) в 1,25 мл ТГФ и 2,5 мл соляной кислоты 1N при перемешивании в атмосфере аргона. Перемешивают в течение 4 ч при ТА. Затем раствор, нейтрализованный до рН 7,0 при помощи едкого натра 1N, охлаждают до 0 С. Экстрагируют 2 раза по 3 мл AcOEt. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, затем выпаривают досуха. Неочищенное вещество подвергают хроматографии на силикогелевом патроне (12 г, элюент гептан/AcOEt с градиентом AcOEt от 6 до 50%). Получают 44 мг целевого продукта примера 21 (Rdt=44%). ЭС: 479 (+) = (М+Н) (+); 461 (+) = (М+Н) (+) - H2O. ЯМР 1 Н (400 МГц, ДМСО-d6):(м.д.): 0,95 (с, 9 Н); 3,11 (т, J=11,5 Гц, 1 Н); 3,19 (с, 3 Н); 3,25-3,32 (м частично скрытый, 1 Н); 3,40-3,50 (м, 2 Н); 3,66 (д, J=8,0 Гц, 1 Н); 3,91 (м, 1 Н); 4,25-4,36 (м, 3 Н); 4,41 (тд,J=7,0 и 11,5 Гц, 1 Н); 4,54 (д, J=4,5 Гц, 1 Н); 4,62 (ушир.дд, J=5,5 и 16,5 Гц, 1 Н); 5,04 (ушир.д, J=10,5 Гц,1 Н); 5,19 (ушир.д, J=17,5 Гц, 1 Н); 5,27 (дд, J=7,0 и 16,0 Гц, 1 Н); 5,61 (ушир.д, J=16,0 Гц, 1 Н); 5,77 (м, 1 Н); 7,26-7,34 (м, 1 Н); 7,51-7,57 (м, 2 Н); 7,65 (ушир.д, J=7,5 Гц, 1 Н); 8,32 (д, J=8,0 Гц, 1 Н). Пример 22 а и b. N-(2-Оксо-2,3,4,5-тетрагидро-1 Н-1-бензазепин-3-ил)-(Е)-(2R,3R,4S,5R)-3,4,5 тригидрокси-2-метокси-8,8-диметил-нон-6-енамид. В трубку Wheaton вводят последовательно при перемешивании в атмосфере аргона 100 мг 4 (352 мкмоль), 150 мг 59 (0,70 мкмоль) (выпускает Interchim), 146 мг 2-этилгексаноата натрия (0,88 ммоль) и 2,5 мл ТГФ. Перемешивают в течение 2 дней при ТА. В реакционную среду вводят 3 мл этилацетата. Промывают 3 мл раствора HCl (1N), образуется нерастворимый осадок в виде геля и после фильтрования через пористое стекло получают 53 мг целевого продукта 60 а и b (соотношение 85:15) (Rdt=33% твердое белое вещество). Фильтрат отстаивают, затем органическую фазу промывают 3 мл насыщенного раствора NaHCO3, 3 мл воды, сушат над сульфатом магния, фильтруют, затем концентрируют досуха. После хроматографии на силикогелевом патроне привитом NH2 (3 г, элюент гептан 50/AcOEt 50) получают 57 мг 60 а и b (соотношение 15:85) (Rdt=35%). ЯМР 1 Н (400 МГц, ДМСО-d6):(м.д.) для 60 а: 0,98 (с, 9 Н); 1,22 (с, 3 Н); 1,27 (с, 3 Н); 2,08 (м, 1 Н); 2,26 (м, 1 Н); 2,65-2,78 (м, 2 Н); 3,21-3,33 (м скрытый, 1 Н); 3,25 (с, 3 Н); 3,78 (д, J=8,5 Гц, 1 Н); 3,90 (ушир.д,J=8,5 Гц, 1 Н); 4,20 (м, 1 Н); 4,26 (д, J=7,0 Гц, 1 Н); 4,33 (д, J=8,5 Гц, 1 Н); 5,44 (дд, J=7,0 и 16,0 Гц, 1 Н); 5,68 Смешивают 53 мг 60 а и b (соотношение 85:15) (115 мкмоль) в 0,6 мл ТГФ и 1,15 мл соляной кислоты 1N при перемешивании в атмосфере аргона. Перемешивают в течение 5 ч при ТА. Затем раствор, нейтрализованный до рН 7,0 при помощи едкого натра 1N, охлаждают до 0 С. Экстрагируют 2 раза по 5 млAcOEt. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, затем выпаривают досуха. Получают 32,5 мг целевого продукта (пример 22 а и b) (соотношение 85:15) (Rdt=67%). Смешивают 57 мг 60 а и b (соотношение 15:85) (124 мкмоль) в 0,65 мл ТГФ и 1,24 мл соляной кислоты 1N при перемешивании в атмосфере аргона. Перемешивают в течение 5 ч при ТА. Затем раствор,нейтрализованный до рН 7,0 при помощи едкого натра 1N, охлаждают до 0 С. Экстрагируют 2 раза по 5 мл AcOEt. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, затем выпаривают досуха. Получают 40,7 мг целевого продукта (пример 22 а и b) (соотношение 15:85) (Rdt=78%). ЭС: 421 (+) = (М+Н) (+); 403 (+) = (М+Н) (+) - Н 2 О. ЯМР 1H (300 МГц, ДМСО-d6):(м.д.) для пр. 22 а: 0,96 (с, 9 Н); 2,07 (м, 1 Н); 2,33 (м, 1 Н); 2,63-2,80
МПК / Метки
МПК: A61P 35/00, A61K 31/55, C07D 223/12
Метки: композиции, 2-алкокси-3,4,5-тригидроксиалкиламиды, содержащие, получение, применение
Код ссылки
<a href="https://eas.patents.su/30-11392-2-alkoksi-345-trigidroksialkilamidy-ih-poluchenie-kompozicii-ih-soderzhashhie-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">2-алкокси-3,4,5-тригидроксиалкиламиды, их получение, композиции, их содержащие, и применение</a>