Соединения с ноотропным действием, их получение, содержащие их фармацевтические композиции и их применение
Номер патента: 9558
Опубликовано: 28.02.2008
Авторы: Гальярди Стефания, Гелардини Карла, Мартинелли Мариза, Парини Карло, Фарина Карло
Формула / Реферат
1. Соединение общей формулы (I)
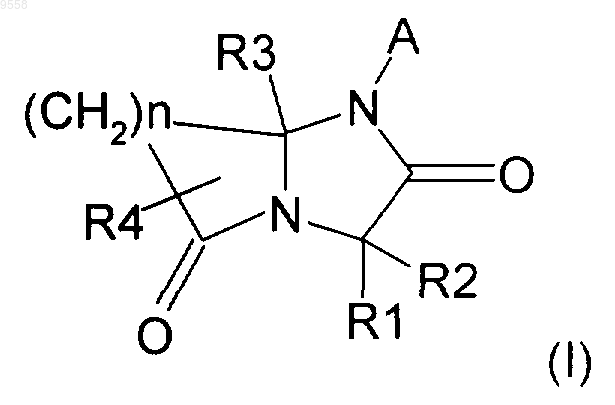
где А выбран из карбоциклических ароматических групп, гетероциклических ароматических групп и арил-С1-4-алкила;
R1 выбран из
водорода,
арил-С1-7-алкила, необязательно замещенного на арильной части одной или несколькими группами, выбранными из гидрокси, С1-4-алкокси, галогена, галоген-С1-4-алкила;
гетероциклил-С1-7-алкила, необязательно замещенного на гетероциклильной части одной или несколькими группами, выбранными из С1-4-алкила и гидрокси;
С1-7-алкила, необязательно содержащего в цепи атом кислорода или серы или необязательно замещенного в любом положении одной или несколькими группами, выбранными из гидрокси, тио, амино, карбоксила, аминокарбонила, гуанидинила,
R2 выбран из водорода, С1-4-алкила, арил-С1-4-алкила и фенила; или же R1 и R2, взятые вместе, образуют насыщенное карбоциклическое кольцо, содержащее 3-8 атомов углерода;
R3 выбран из водорода, С1-4-алкила, арил-С1-4-алкила, CONH2 и COOR5, где R5 выбран из водорода и С1-4-алкила;
R4 выбран из водорода, С1-4-алкила, арила, арил-С1-4-алкила и гетероциклила;
n равно 2, 3 или 4;
где
a) термин "карбоциклическая ароматическая группа" означает одно или слитые ароматические кольца с 6-12 членами кольца, необязательно замещенными;
b) термины "гетероциклическая ароматическая группа" и "гетероциклил" означают одно или слитые ароматические кольца, причем каждое кольцо имеет 5-12 членов и содержит до четырех гетеро-атомов, выбранных из кислорода, серы и азота, необязательно замещенных;
c) термин "арил" означает одно или слитые ненасыщенные кольца, причем каждое кольцо имеет 5-8 членов и предпочтительно 5 или 6 членов, необязательно замещенных;
в форме рацемической смеси или в форме энантиомеров, и его фармацевтически приемлемые соли или сольваты.
2. Соединения по п.1, где А представляет собой фенил, тиенил, пиридил, пиримидинильную группу, необязательно замещенную, бензил или 4-метилбензил; R1 представляет собой водород, С1-4-алкил, бензил, -СН2ОН, -CH2CH2CONH2, -CH2COOH, индол-(3-ил)метил; R2 представляет собой водород, C1-4-алкил или бензил; R3 и R4 представляют собой водород или метил, и n равно 2.
3. Соединение по п.2, где А представляет собой фенил, необязательно замещенный; R1, R2, R3 и R4 представляют собой водород, и n равно 2.
4. Соединение по любому из пп.1-3, где А замещен 1-3 заместителями, выбранными из Me, Et, изо-Pr, ОН, COOEt, СООН, СН2ОН, SO2NH2, SO2Me, OMe, Cl, F, CN и CF3.
5. Соединение по п.4, где А замещен 1-3 заместителями, выбранными из Me, Et, изо-Pr, ОН, CN, Cl и CF3
6. Соединение по п.1 или 2, где указанная C1-4-алкильная группа выбрана из Me, Et, изо-Pr, изо-Bu и циклопропилметила.
7. Соединение по п.1, выбранное из группы, состоящей из
1-фенилтетрагидро-1Н-пирроло[1,2-а]имидазол-2,5-диона,
1-о-толилтетрагидро-1Н-пирроло[1,2-а]имидазол-2,5-диона,
1-(2,6-диметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-тиофен-2-илтетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-м-толилтетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-п-толилтетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(5-фтор-2-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(3-фтор-2-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(2-трифторметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(4-хлор-2-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(3-хлорфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(3-метоксифенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(3-цианофенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(4-хлорфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(3-гидроксифенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(3-трифторметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(4-трифторметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(4-метоксифенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(3,5-диметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(3,4-диметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-нафталин-2-илтетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(3-изопропилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(4-хлор-3-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
3-бензил-1-фенилтетрагидропирроло[1,2-а]имидазол-2,5-диона,
3-метил-1-фенилтетрагидропирроло[1,2-а]имидазол-2,5-диона,
3-изобутил-1-фенилтетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(3-фтор-5-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(3-фтор-4-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
7а-метил-1-фенилтетрагидропирроло[1,2-а]имидазол-2,5-диона,
(S)-1-о-толилтетрагидропирроло[1,2-а]имидазол-2,5-диона,
(R)-1-о-толилтетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(4-этилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(4-изопропилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(4-гидроксиметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
4-(2,5-диоксогексагидропирроло[1,2-а]имидазол-1-ил)бензойной кислоты,
этилового эфира 4-(2,5-диоксогексагидропирроло[1,2-а]имидазол-1-ил)бензойной кислоты,
1-(4-метансульфонилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(4-фторфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(4-цианофенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-пиридин-2-илтетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-пиридин-3-илтетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(5-метилпиридин-2-ил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(2-цианофенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-(3-фторфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,
1-бензилтетрагидропирроло[1,2-а]имидазол-2,5-диона и
1-(4-метилбензил)тетрагидропирроло[1,2-а]имидазол-2,5-диона.
8. Способ получения соединения формулы (I) по п.1, включающий реакцию соединения формулы (II)
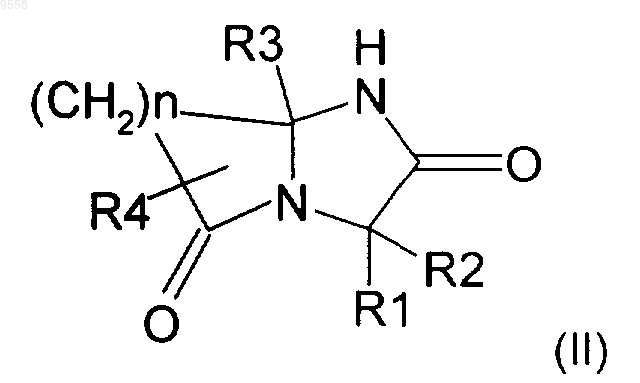
с соединением формулы (III)
А-Х (III)
где A, R1, R2, R3, R4 и n имeют значения, указанные в п.1, и X представляет собой атом галогена, с получением требуемого соединения формулы (I).
9. Способ по п.8, в котором в соединении формулы (III) X выбран из брома и иода.
10. Способ по п.8 или 9 для получения соединения формулы (I), где А представляет собой карбоциклическую ароматическую группу или гетероциклическую ароматическую группу, необязательно замещенную, в котором соединение формулы (II) растворяют в подходящем растворителе вместе с соединением формулы (III) в присутствии основания и каталитического количества соли меди при температуре между 60 и 140шС.
11. Способ по п.10, в котором указанным растворителем является N-метилпирролидон, указанным основанием является карбонат калия, указанной солью меди является иодид меди, и реакцию проводят при температуре 120шС.
12. Способ по п.8 или 9 для получения соединения формулы (I), где А представляет собой арил-С1-4-алкил, в котором соединение формулы (II) растворяют в подходящем растворителе вместе с соединением формулы (III) в присутствии подходящего основания при температуре между 60 и 140шС.
13. Способ по п. 12, в котором указанный растворитель выбран из ацетонитрила, метиленхлорида, ацетона, указанное основание выбрано из триэтиламина, карбоната калия, 2-трет-бутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфорина, N,N-диизопропилэтиламина и реакцию проводят при температуре 100шС.
14. Способ получения соединения формуыы (I) по п.1, включающий следующие стадии
i) реакцию аминокислоты формулы (IV) или одного из ее активированных производных
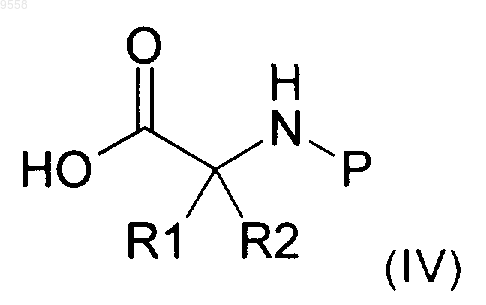
с соединением формулы (V)
A-NH2 (V)
с получением соединения формулы (VI)
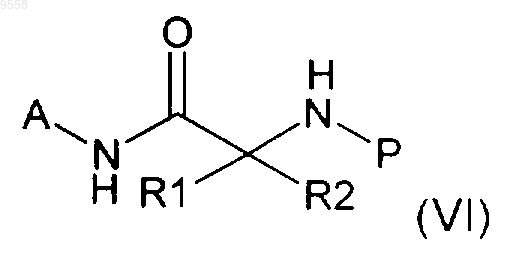
где R1, R2 и А имеют значения, указанные выше в п.1, и Р представляет собой Н или подходящую защитную группу,
ii) реакцию соединения формулы (VI), полученного на стадии i), с соединением формулы (VII)
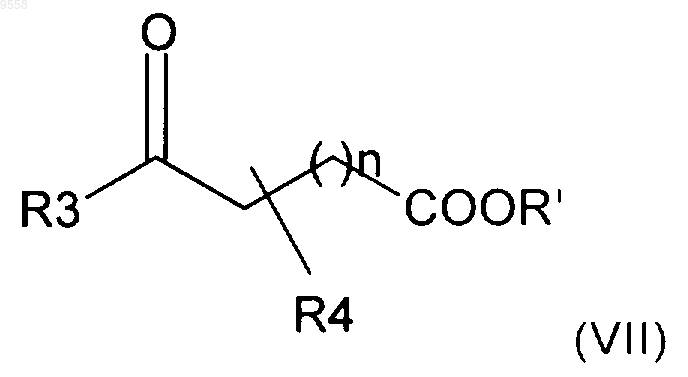
с получением соединения формулы (VIII)
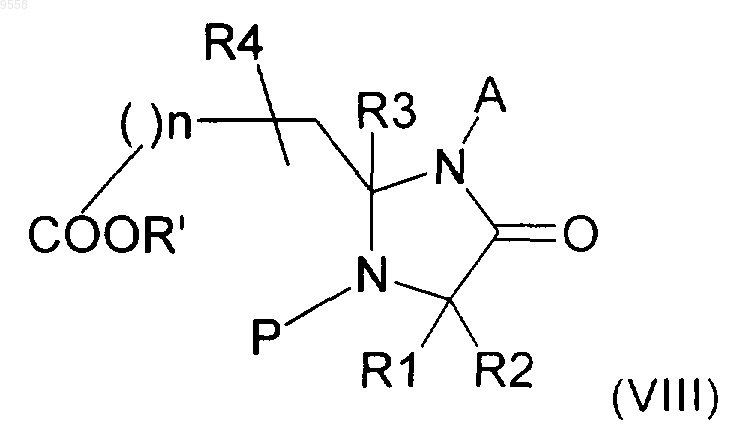
где A, R1, R2, R3, R4 и n имеют значения, указанные в п.1, Р имеет указанные выше значения, и R' представляет собой алкильную группу,
iii) возможное удаление защитной группы Р при помощи гидрогенолиза соединения формулы (VIII), полученного на стадии ii), с получением соответствующего соединения (VIII), где Р представляет собой Н, и
iv) циклизацию соединения формулы (VIII), где Р представляет собой Н, полученного на стадии ii) или на стадии iii), с получением требуемого соединения формулы (I).
15. Способ по п.14, в котором R' выбран из метила и трет-бутила, и Р выбран из Н, бензила и бензилоксикарбонила.
16. Способ по п.14, в котором на указанной стадии iv) реакцию циклизации проводят нагреванием соединения (VIII) в отсутствие растворителя при 120шС и в условиях вакуума или же кипячением с обратным холодильником при нагревании соединения (VIII) в ксилоле в течение времени, составляющего от 4 часов до 3 дней.
17. Способ по п.14, в котором указанную стадию ii) проводят кипячением с обратным холодильником при нагревании соединений формулы (VI) и (VII) в полярном растворителе в течение времени, составляющего от 2 до 24 ч, возможно в присутствии основания.
18. Способ по п.14, в котором реакцию, описанную в стадии i), проводят между хлорангидридом соединения (IV) и соединением (V) в присутствии неорганического или органического основания в подходящем апротонном растворителе при температуре между -70 и 50шС.
19. Способ по п.14, в котором реакцию стадии i) проводят реакцией вместе соединения (IV) и соединения (V) в присутствии подходящего конденсирующего агента в апротонном растворителе при температуре между -70 и 50шС.
20. Способ по пп.18 или 19, в котором указанная температура находится между -10 и 20шС.
21. Фармацевтическая композиция, содержащая в качестве активного ингредиента одно или несколько соединений формулы (I)
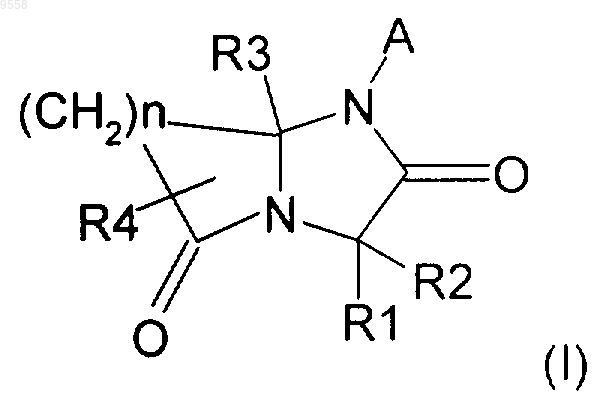
в которой А выбирается из карбоциклических ароматических групп, гетероциклических ароматических групп;
R1 это водород;
R2 это водород;
R3 это водород;
R4 это водород
в форме рацемической смеси или в форме энантиомеров или их фармацевтически приемлемые соли или сольваты, причем:
а) термин "карбоциклическая ароматическая группа" означает одно или слитые ароматические кольца с 6-12 членами кольца, необязательно замещенными;
b) термины "гетероциклическая ароматическая группа" и "гетероциклил" означают одно или слитые ароматические кольца, причем каждое кольцо имеет 5-12 членов и содержит до четырех гетеро-атомов, выбранных из кислорода, серы и азота, необязательно замещенных,
c) термин "арил" означает одно или слитые ненасыщенные кольца, причем каждое кольцо имеет 5-8 членов и предпочтительно 5 или 6 членов, необязательно замещенных.
22. Фармацевтическая композиция по п.21, дополнительно содержащая носители, разбавители и/или фармацевтически приемлемые наполнители, подходящие для форм введения, выбранных из пероральных, парентеральных, ректальных, трансдермальных форм и форм введения через слизистую оболочку.
23. Фармацевтическая композиция по п.21 или 22 в форме растворов, суспензий, растворимых порошков, гранул, микрокапсул, капсул, лепешек, таблеток, покрытых таблеток, суппозиториев, кремов, мазей, лосьонов, паст, пластырей с лекарственным средством, мембран или гелей.
24. Применение соединения формулы (I) по п.21 или одной из его фармацевтически приемлемых солей или одного из его сольватов для получения лекарственного средства, обладающего ноотропным и/или нейрозащитным, аналгезирующим и/или антигипералгезивным и противорвотным действием.
25. Применение для приготовления лечебного средства по п.24 для лечения дефицита обучаемости и памяти, болезни Альцгеймера, деменции, сенильной деменции, деменции васкулярного типа после удара, эпилепсии, церебральной ишемии, нарушений настроения, депрессии, для лечения состояний хронической боли, боли, ассоциированной с воспалением, невропатической боли, висцелярной боли и для лечения рвоты.
26. Применение для приготовления лечебного средства по п.24, в котором указанное соединение формулы (I) вводят в сочетании, одновременно или последовательно с одним или несколькими другими активными ингредиентами.
Текст
009558 Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям формулы (I), представляемой здесь ниже,способу их получения, содержащим их фармацевтическим композициям и их применению в качестве ноотропных, нейрозащитных, аналгезирующих и антигипералгезивных агентов. Уровень техники Соединения, которые обладают ноотропной активностью, уже известны в литературе. В частности производные, замещенные в положении 42-оксо-1-пирролидинацетамида, являются действительными психотропными агентами, которые восстанавливают поврежденные познавательные функции. Эти соединения описаны, например, Banfi и др. в Pharm. Res. Commun. 16, 67, 1984 и Itil и др. в Drug Development Res. 2, 447, 1982. Среди наиболее широко известных соединений, принадлежащих к классу, указанному выше, могут быть указаны 2-оксо-1-пирролидинацетамид (пирацетам), 4-гидрокси-2-оксо-1-пирролидинацетамид (оксирацетам), 2-(2-оксопирролидин-1-ил)бутирамид(леветирацетам) и N-(2,5-диметилфенил)-2-оксо-1 пирролидинацетамид (нефирацетам). Другой химический класс, который обладает ноотропной активностью, представлен имидазольными конденсированными производными, в частности, 2,5-диоксогексагидро-1 Н-пирроло[1,2-а]имидазолом(димирацетам), описанными в ЕР 335483 и в WO 9309120, и Pinza M. и др. в J. Med. Chem., 36, 4214,1993. Недавно было показано, что нефирацетам может быть хорошим терапевтическим агентом при лечении боли, связанной с невропатией. Оказалось, что антигипералгезивное действие, индуцированное нефирацетамом, является неопиоидным по природе и, вероятно, обусловлено стимуляцией никотиновой холинергической системы на спинальном и суперспинальном уровне (Rashid Harunor M.D.J. Pharmacol.Exp. Ther, 303, 226, 2002). Сущность изобретения Заявителем настоящего изобретения теперь обнаружены новые N-замещенные бициклические имидазолоны формулы (I), представляемой здесь ниже, которые продемонстрировали улучшенные психотропные свойства и более заметные аналгезирующие и антигипералгезивные действия на многих моделях боли, связанной с невропатией, относительно уже известных ноотропных агентов. Настоящие соединения формулы (I), следовательно, являются применимыми при лечении многих нарушений центральной нервной системы (ЦНС), например, при ухудшении способности к обучению,дисфункциях познавательной сферы и памяти, болезни Альцгеймера, деменциях, включая сенильную деменцию типа Альцгеймера, деменцию васкулярного типа после удара, эпилепсии, церебральной ишемии, нарушений настроения, включая депрессию, хронической, воспалительной, невропатической и висцеральной боли и рвоте. Следовательно, представителем предмета настоящего изобретения являются соединения общей формулы (I) где А выбран из карбоциклических ароматических групп, гетероциклических ароматических групп и арил-С 1-4-алкила;R1 выбран из водорода,арил-С 1-7-алкила, необязательно замещенного на арильной части одной или несколькими группами,выбранными из гидрокси, С 1-4-алкокси, галогена, галоген-С 1-4-алкила; гетероциклил-С 1-7-алкила, необязательно замещенного на гетероциклильной части одной или несколькими группами, выбранными из С 1-4-алкила и гидрокси; С 1-7-алкила, необязательно содержащего в цепи атом кислорода или серы или необязательно замещенного в любом положении одной или несколькими группами, выбранными из гидрокси, тио, амино, карбоксила, аминокарбонила, гуанидинила,R2 выбран из водорода, С 1-4-алкила, арил-С 1-4-алкила и фенила; или же R1 иR2, взятые вместе, образуют насыщенное карбоциклическое кольцо, содержащее 3-8 атомов углерода;R3 выбран из водорода, С 1-4-алкила, арил-С 1-4-алкила, CONH2 и COOR5, где R5 выбран из водорода и С 1-4-алкила;n равно 2, 3 или 4; в форме рацемической смеси или в форме энантиомеров, и их фармацевтически приемлемые соли или сольваты. Способ получения соединений формулы (I), представляемой выше, фармацевтические композиции,содержащие их, и их применение для получения лекарственных средств с ноотропным и нейрозащитным-1 009558 действием, с аналгезирующим и/или антигипералгезивным действием, и противорвотным действием составляют следующий предмет изобретения. Характеристики и преимущества настоящих соединений формулы (I) будут проиллюстрированы подробно в следующем описании. Описание фигур Фиг. 1 а, 1b: неограничивающие примеры аминокислот формулы (IV), применяемых в синтезе соединений формулы (I). Окруженная часть указывает заместитель R1. Подробное описание изобретения В рамках настоящего изобретения термин карбоциклическая ароматическая группа означает одинарные или конденсированные ароматические кольца с 6-12 членами в кольце, необязательно замещенные. Термины гетероциклическая ароматическая группа и гетероциклил означают одинарные или конденсированные ароматические кольца, причем каждое кольцо имеет 5-12 членов и содержит до четырех гетероатомов, выбранных из кислорода, серы и азота, необязательно замещенных. Всегда, когда не указывается иначе, термин арил означает одинарные или конденсированные ненасыщенные кольца, причем каждое кольцо имеет 5-8 членов, предпочтительно, 5 или 6 членов, необязательно замещенных; термин арил-С 1-4-алкил означает группу, имеющую арильную группу, как указано выше, и С 1-4-алкильную часть, соединяющую арильную группу с местом замещения. Все указанные выше С 1-4-алкильные группы, включающие группы, являющиеся частью арил-С 1-4 алкильной группы, могут быть одинаково неразветвленными или разветвленными или циклическими(т.е. циклопропил, циклопропилметил или метилциклопропил). Предпочтительными С 1-С 4-алкильными группами являются Me, Et, изо-Pr, изо-Bu и циклопропилметил. Все указанные выше С 1-7-алкильные группы, включающие группы, являющиеся частью С 1-7 алкилсодержащих групп, могут быть либо неразветвленными, разветвленными либо циклическими и могут включать в себя двойные или тройные связи. Термин С 1-7-алкильные группы, цепь которых прерывается кислородом или серой, означает, соответственно, любую простую эфирную и тиоэфирную группу,содержащую 1-7 атомов углерода. Термин гетероциклил-С 1-7-алкил означает группу, имеющую гетероциклильную группу, определенную выше, и С 1-7-алкильную часть, соединяющую гетероциклильную группу с местом замещения. Термин арил-С 1-7-алкил означает группу, имеющую арильную группу, определенную выше, и С 1-7-алкильную часть, соединяющую арильную группу с местом замещения. Галоген означает атом, выбранный из фтора, хлора, брома или иода; галоген-С 1-4-алкил означаетC1-4-алкильную группу, замещенную в любом положении одним или несколькими атомами галогена, например, трифторметил. Всегда, когда не указывается иначе, необязательно замещенные группы являются группами, необязательно замещенными 1-3 заместителями, выбранными предпочтительно из Me, Et, изо-Pr, ОН,COOEt, COOH, СН 2 ОН, SO2NH2, SO2Me, OMe, Cl, F, CN и CF3, и более предпочтительно из Me, Et, изоРr, ОН, CN, Cl и CF3; причем заместители могут быть в любом положении группы, которая является замещенной. Предпочтительными соединениями по изобретению являются соединения формулы (I), где А представляет собой необязательно замещенный фенил, необязательно замещенный бензил или же необязательно замещенную гетероциклическую ароматическую группу с 5 или 6 членами, содержащую до двух гетероатомов, выбранных из кислорода, серы и азота, R1, R2, R3 и R4 выбраны из водорода, C1-4-алкила или бензила, и n равно 2 или 3. Предпочтительно, А представляет собой фенильную, тиенильную, пиридильную, пиримидинильную группу, необязательно замещенную, бензильную или 4-метилбензильную группу; R1 представляет собой водород, C1-4-алкил (например, метил, изопропил или изобутил), бензил, -СН 2 ОН,-CH2CH2CONH2, -CH2COOH, индол-(3-ил)метил, R2 представляет собой водород, C1-4-алкил или бензил,R3 и R4 представляют собой водород или метил, и n равно 2. Более предпочтительно, А представляет собой фенил, необязательно замещенный, R1, R2, R3 и R4 представляют собой водород, и n равно 2. Когда R1 и R2, взятые вместе, образуют насыщенное карбоциклическое кольцо, содержащее 3-8 атомов углерода, образовавшееся соединение формулы (I) является спироциклическим соединением. Предпочтительные соединения формулы (I) по изобретению выбраны из группы, состоящей из 1-фенилтетрагидро-1 Н-пирроло[1,2-а]имидазол-2,5-диона,1-о-толилтетрагидро-1 Н-пирроло[1,2-а]имидазол-2,5-диона,1-(2,6-диметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-тиофен-2-илтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-м-толилтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-п-толилтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(5-фтор-2-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-фтор-2-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,-2 009558 1-(2-трифторметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-хлор-2-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-хлорфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-метоксифенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-цианофенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-хлорфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-гидроксифенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-трифторметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-трифторметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-метоксифенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3,5-диметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3,4-диметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-нафталин-2-илтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-изопропилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-хлор-3-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,3-бензил-1-фенилтетрагидропирроло[1,2-а]имидазол-2,5-диона,3-метил-1-фенилтетрагидропирроло[1,2-а]имидазол-2,5-диона,3-изобутил-1-фенилтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-фтор-5-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-фтор-4-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,7 а-метил-1-фенилтетрагидропирроло[1,2-а]имидазол-2,5-диона,(S)-1-о-толилтетрагидропирроло[1,2-а]имидазол-2,5-диона,(R)-1-о-толилтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-этилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-изопропилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-гидроксиметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,4-(2,5-диоксогексагидропирроло[1,2-а]имидазол-1-ил)бензойной кислоты,этилового эфира 4-(2,5-диоксогексагидропирроло[1,2-а]имидазол-1-ил)бензойной кислоты,1-(4-метансульфонилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-фторфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-цианофенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-пиридин-2-илтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-пиридин-3-илтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(5-метилпиридин-2-ил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(2-цианофенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-фторфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-бензилтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-метилбензил)тетрагидропирроло[1,2-а]имидазол-2,5-диона. Следует отметить, что некоторые соединения формулы (I) могут содержать один или несколько стереогенных центров. Настоящее изобретение распространяется на все оптические изомеры этих соединений в их формах, полностью или частично разделенных, и в форме рацемических смесей. Следующим предметом изобретения является способ получения соединений формулы (I) или одной из их солей, и/или одного из их сольватов, включающий реакцию соединения формулы (II) с соединением формулы (III) А-Х (III) где A, R1, R2, R3, R4 и n имеют указанные выше значения для соединений формулы (I), и X представляет собой атом галогена, выбранный из брома и иода. Когда А представляет собой ароматическую карбоциклическую группу или гетероциклическую ароматическую группу, как указано выше, взаимодействие между соединениями формулы (II) и соединением формулы (III) может быть проведено в соответствии с подходящими условиями реакции Гольдберга (Angew Chem. Int. E., 39, 4492, 2000). В частности, соединения формулы II растворяют в подходящем растворителе, таком как N-метилпирролидон, вместе с соединениями формулы (III) в присутствии каталитического количества соли меди, такой как иодид меди, и основания, такого как карбонат калия,при любой температуре, которая обеспечивает адекватный процент образования требуемого продукта, в пригодном случае при высокой температуре, такой как температура между 60 и 140 С, например, при 120 С. Реакционную смесь нагревают с применением системы общепринятого нагревания или микро-3 009558 волнового реактора адекватной мощности, например, между 25 и 250 Вт (Tetrahedron Letters, 43, 1101,2002). Когда А представляет собой арил-C1-4-алкильную группу, взаимодействие может быть проведено в подходящем растворителе, таком как ацетонитрил, метиленхлорид, ацетон, в присутствии подходящего основания, такого как триэтиламин, карбонат калия, 2-трет-бутиламино-2-диэтиламино-1,3 диметилпергидро-1,3,2-диазафосфорин (известный также как BEMP), N,N-диизопропилэтиламин (известный также как основание Хунига), при подходящей температуре, такой как температура флегмы (60140 С, предпочтительно 100 С). Указанные выше соединения формулы (II) и способы их получения описаны в заявке на Европейский патент ЕР-А-335483 и в международной заявке на патентWO-A-93/09120 и Pinza и др. в J. Med.Chem., 36, 4214, 1993. Соединения формулы (III) являются коммерчески доступными или могут быть получены из известных соединений известными способами. В альтернативном варианте соединения формулы (I) могут быть получены способом, включающим следующие стадии.i) реакцию аминокислоты формулы (IV) или одного из ее активированных производныхA-NH2 с получением соединения формулы (VI) где R1, R2 и А имеют значения, указанные выше для соединения формулы (I), и Р представляет собой Н или подходящую защитную группу. Активация аминокислот является хорошо известной синтетической процедурой; примерами активированных производных аминокислот являются смешанные ангидриды, ацилхлориды и активированные эфиры.ii) реакцию соединения формулы (VI), полученного на стадии i), с соединением формулы (VII) с получением соединения формулы (VIII) где A, R1, R2, R3, R4 и n имеют указанные выше значения для соединений формулы (I), P имеет указанные выше значения, и R' представляет собой алкильную группу.iii) Возможное удаление защитной группы Р при помощи гидрогенолиза соединения формулы(VIII), полученного на стадии ii), с получением соответствующего соединения (VIII), где Р представляет собой Н; иiv) циклизацию соединения формулы (VIII), где Р представляет собой Н, полученного на стадии ii) или на стадии iii), с получением требуемого соединения формулы (I). В соответствии с предпочтительным вариантом осуществления изобретения алкильный остаток R' выбирают из метила и трет-бутила, и Р выбирают из водорода, бензильной или бензилоксикарбонильной группы. Реакция на стадии i) между соединением формулы (IV) и соединением формулы (V) может быть проведена(a) приготовлением в первом реакторе хлорангидрида соединения формулы (IV) и смешиванием указанного хлорангидрида кислоты с соединением формулы (V) в присутствии неорганического или органического основания в адекватном апротонном растворителе, таком как диметилформамид (ДМФ), при температуре между -70 и 50 С, предпочтительно между -10 и 20 С, или же(b) реакций вместе соединения формулы (IV) с соединением формулы (V) в присутствии подходящего конденсирующего агента, такого как N,N'-карбонилдиимидазол(CDI) или карбодиимид, такой как дициклогексилкарбодиимид(DCC) или N-диметиламинопропил-N'-этилкарбодиимид, предпочтительно, в присутствии N-гидроксибензотриазола (НОВТ), чтобы максимизировать выход и предотвратить процессы рацемизации (сравни Synthesis, 453, 1972), или гексафторфосфата О-бензотриазол-1-ил-N,N,N'N'тетраметилурония (HBTU) в апротонном растворителе, таком как смесь ацетонитрила (MeCN) и тетрагидрофурана (ТГФ), например, смесь с объемным отношением между 1:9 и 7:3 (MeCN:ТГФ), при любой температуре, способной обеспечить адекватный процент образования требуемого продукта, такой как температура между -70 и 50 С, предпочтительно между -10 и 25 С На стадии ii) данного способа соединения формулы (VI) и (VII) предпочтительно кипятят с обратным холодильником при нагревании в протонном растворителе, таком как вода или метанол, и, возможно, в присутствии основания, такого как NaOH, в случае, когда соединение формулы (VI) применяют в форме одной из солей, полученных присоединением кислоты, в течение адекватного периода времени,предпочтительно составляющем от 2 до 24 ч. Удаление защитной группы Р при помощи гидролиза на стадии iii), предпочтительно, проводят с применением формиата аммония в качестве источника водорода в подходящем протонном растворителе,таком как метанол или смесь метанол-вода. Реакцию циклизации на стадии iv) проводят непосредственно с применением соединения формулы(VIII), полученного на стадии ii), если Р представляет собой Н, или же, если в указанном соединении(VIII) Р представляет собой защитную группу, сначала нужно удалить ее, как описано выше на стадииiii). Реакцию циклизации проводят в жестких условиях общепринятым образом нагреванием соединения формулы (VIII) без растворителя при 120 С и в условиях вакуума или же посредством кипячения с обратным холодильником при нагревании в ксилоле в течение подходящего периода времени, например,между 4 ч и 3 днями или облучением микроволнами. Соединения формул (IV), (V) и (VII) являются коммерчески доступными соединениями или они могут быть получены из известных соединений с применением известных способов. В частности, соединения формулы (IV) могут быть подходящим образом выбраны из любых существующих в природе аминокислот или их производных. Примеры аминокислот, применимых в настоящем изобретении, показаны на фиг. 1, где окруженная часть соответствует заместителю R1 формулы (IV): в соответствии с этим, все эти значения для R1 также являются предпочтительными для соединений формулы (I), являющихся целью настоящего изобретения. Настоящие соединения формулы (I) являются применимыми в качестве терапевтических агентов, в частности они обладают ноотропной и нейрозащитной активностью, т.е. они способствуют восстановлению функций обучения и памяти, ухудшенных в процессе старения или вследствие ишемических травм,и являются эффективными при различных патологиях ЦНС, среди которых имеются дисфункции способности к обучению, дисфункции в познавательной сфере и памяти, болезнь Альцгеймера, деменции,включающие сенильную деменцию типа болезни Альцгеймера, деменцию васкулярного типа после удара, эпилепсия, церебральная ишемия и нарушения настроения, в том числе депрессия. Настоящие соединения формулы (I), кроме того, обладают аналгезирующей и/или антигипералгезивной активностью, т.е. они способствуют борьбе с ощущениями боли, в частности, ощущениями, вызванными состояниями невропатической боли, боли, ассоциированной с хроническими воспалениями, и висцеральной боли, их эффективность доказана также при лечении рвоты. Предметом настоящего изобретения, следовательно, является также применение настоящих соединений формулы (I) или их фармацевтически приемлемых солей и/или сольватов для получения лекарственных средств для преодоления затруднений в обучении и памяти и для лечения деменции, болезни Альцгеймера, деменции васкулярного типа после удара, эпилепсии, церебральной ишемии и нарушения настроения, в том числе депрессии. Предложен также способ лечения указанных выше заболеваний и нарушений, характеризующийся введением фармацевтически активного количества соединения формулы (I) пациенту, нуждающемуся в этом. Широко известно, что нарушения познавательных функций, которые имеют место при указанных патологиях, находятся в соответствии с дефицитом церебральной холинергической системы, как выясняется из морфологических открытий (В.Е. Tomlinson in "Biochemistry of Dementias"; P.J. Roberts Ed.; JohnWileySons, New York, N.Y. pp. 15-22, 1980) и нейрохимических открытий (R.T. Bartus et al Science,217, 408, 1982). Кроме того, хорошо известно, что значительные ухудшения познавательных функций являются наиболее очевидными симптомами расстройства здоровья, наблюдаемыми у пациентов, страдающих болезнью Альцгеймера, сенильными деменциями типа Альцгеймера и деменцией вследствие многочисленных инфарктов. Активность соединений формулы (I) может быть определена на крысах в отношении действия скополамина, вызывающего амнезию (D.A. Drachman, Archs. Neurol. Chicago, 30, 113, 1974; D.A. Eckerman,Pharmacol. Biochem. Behav. 12, 595, 1980), на мнемический путь и на снижение уровней ацетилхолина в-5 009558 гиппокампе. Влияние на память и обучение может быть оценено на крысах с применением испытаний на пассивное избежание, как описано Essman, Pharmacol. Res. Commun. 5, 295, 1973. Предметом настоящего изобретение является, кроме того, применение настоящих соединений формулы (I) или их фармацевтически приемлемых солей или сольватов при лечении состояний невропатической боли, боли, ассоциированной с хроническим воспалением, или висцелярной боли. Предложен также способ лечения указанных выше заболеваний, характеризующийся введением фармацевтически эффективного количества соединения формулы (I) пациенту, нуждающемуся в этом. Выдвинута гипотеза, что процесс обучения и памяти вовлечен в механизмы боли, ассоциированной с хроническим воспалением, (Flor H., Prog. Brain. Res., 129, 313, 2000), и последние данные подтверждают гипотезу, что боль ассоциированная с хроническим воспалением, является приобретенным феноменом недостаточной адаптации (Arnstein Р.М., J. Neurosci. Nurs. 29, 179, 1997; Kumazava I., Neurosci Res.,32, 9, 1998) Познавательная дисфункция описана при различных невропатических состояниях (Kuhajda М.С., Ann. Behav. Med., 20, 31, 1998), и недавно наблюдали, что нефирацемат, ноотропный агент, ослабляет невропатическую боль благодаря его специфическому действию на невропатии (Rashid HarunorM.D., J. Pharmacol. Exp. Ther., 303, 226, 2002). Обнаружено, что аналгезирующее и/или антигипералгезивное действие нефирацетама проявляется через стимуляцию никотиновых холинергических рецепторов на спинальном и супраспинальном уровне, поскольку указанное действие ингибируется дозозависимым образом мекамиламином, известным антагонистом никотинового ацетилхолинового рецептора. Активность соединений формулы (I) может быть определена на мышах при помощи испытания на термическую гипералгезию (испытание на отдергивание лапки) и испытания на механическую гипералгезию (испытание на сжатие лапки), индуцированную частичным лигированием седалищного нерва или обработкой стрептозотоцином, по протоколам, описанным в J. Pharmacol. Exp. Ther., 303, 226, 2002, и в процитированной в них библиографии. При применении при терапевтическом лечении людей и животных соединения формулы (I) обычно изготовляют, в соответствии со стандартной фармацевтической практикой, в виде фармацевтической композиции. Отсюда следующий аспект изобретения представлен фармацевтической композицией, содержащей в качестве активного ингредиента соединение формулы (I) или одну из его фармацевтически приемлемых солей или сольватов вместе с носителями, разбавителями и фармацевтически приемлемыми наполнителями, подходящими для выбранной формы введения. Соединения формулы (I) могут быть введены стандартным путем при лечении указанных выше заболеваний, например, пероральным, парентеральным, ректальным, чрескожным путем или введением через слизистую оболочку (например, через слизистую оболочку полости рта, языка или носа). Соединения формулы (I), которые вводят перорально или посредством сублингвального пути или посредством трансбуккального введения, могут быть изготовлены в виде сиропов, таблеток, капсул и лепешек. Препарат в форме сиропа состоит, как правило, из суспензии или раствора соединения или одной из его солей в жидком носителе, например, этаноле, глицерине или воде с корригентом или красящим агентом. Когда композиция имеет форму таблеток, можно применять любой фармацевтический носитель, обычно применяемый при получении твердых препаратов. Примеры таких носителей включают стеарат магния, крахмал, лактозу и сахарозу. Когда композиция находится в форме капсул, подходящим является любой общепринятый способ инкапсулирования, например, с применением носителей, указанных выше, в капсулу из твердого желатина. Когда композиция находится в форме капсул из мягкого желатина, можно применять любой фармацевтически приемлемый носитель, обычно применяемый при получении дисперсий или суспензий, например, водные камеди, целлюлозу, силикаты или масла, для включения в оболочку изготовленную из мягкого желатина. Типичные парентеральные композиции состоят из раствора или суспензии соединения формулы (I) в водной или неводной стерильной среде, возможно содержащей масло, приемлемое для парентерального пути введения, например, полиэтиленгликоль, поливинилпирролидон, лецитин, арахисовое масло или кунжутное масло. Типичный препарат в виде суппозиториев содержит соединение формулы (I) которое является активным при введении этим путем, со связывающим и/или смазывающим агентом, например полимерными гликолями, желатином, какао-масло или другими низкоплавящимися восками или растительными жирами. Типичные препараты для чрескожного введения содержат общепринятую водную или неводную среду, например крем, мазь, лосьон или паста, или могут быть в форме содержащих лекарственное средство пластырей, повязок или мембран. Предпочтительно композиция находится в единичной дозированной форме, например, в виде таблеток или капсул, так что пациент может принимать единичную дозу. Оксирацетам является соединением, применяемым при лечении сенильной деменции и патологических состояний, связанных с ней. Соединения формулы (I) могут быть введены по схеме приема лекарственных средств, похожей на схемы приема, установленные для оксирацетама, с любым подходящим регулированием уровней дозы или частоты дозированного введения в связи с более высокой активностью и-6 009558 лучшим фармакологическим профилем соединений формулы (I). Каждая дозированная единица для перорального введения может содержать целесообразно от 0,05 до 50 мг/кг, более целесообразно от 0,1 до 25 мг/кг соединения формулы (I). Активный ингредиент может быть введен от 1 до 6 раз в день. Соединения формулы (I) могут быть введены совместно с другими фармацевтически приемлемыми соединениями, например, в сочетании, одновременно или последовательно, в частности, вместе с другими соединениями, применяемыми при лечении пожилых пациентов,такими как транквилизаторы, диуретики, гипотензивные лекарственные средства, сосудорасширяющие лекарственные средства и инотропные агенты. Далее представлены примеры настоящего изобретения исключительно для иллюстративных и неограничивающих целей. Экспериментальная часть Описание 1. 3-Изобутилтетрагидропирроло[1,2-а]имидазол-2,5-дион. К раствору гидрохлорида DL-лейцинамида (1,5 г, 9 ммоль) в воде (40 мл), рН которого отрегулирован до 9,5 10% гидроксидом натрия, добавляли этил-4-оксобутаноат (1 г, 7,5 ммоль). Смесь помещали в микроволновую печь и кипятили с обратным холодильником в течение 1 ч. Воду затем выпаривали в вакууме, и остаток хроматографировали на силикагеле (CH2Cl2/MeOH/NH4OH, 98/2/0,1), получая при этом 1,1 г указанного в заголовке соединения. 1 Н ЯМР (CDCl3)6,48 (ушир. с, 1 Н); 5,30 (т, 1 Н); 4,23 (дд, 1 Н), 2,71-2,39 (м, 3H), 2,20-1,93 (м, 1 Н); 1,86-1,73 (м, 1 Н); 1,70-1,42 (м, 2 Н), 1,05 (д, 3H); 0,96 (д, 3H). МС EI TSQ 700; источник 180 С; 70 В; 200 мкА: 196 (М+), 97. Пример 1. 1-Фенилтетрагидро-1 Н-пирроло[1,2-а]имидазол-2,5-дион. К раствору тетрагидропирроло[1,2-а]имидазол-2,5-диона (1 г, 7,14 ммоль, получен, как описано в J.CuI (0,2 г, 1,05 ммоль), K2CO3 (1 г, 7,14 ммоль) и иодбензол (5 г, 24,5 ммоль). Суспензию нагревали в микроволновой аппаратуре (250 Вт) в течение 45 мин. К суспензии добавляли этилацетат и твердую часть отделяли фильтрованием. Органическую фазу промывали водой и водную фазу снова экстрагировали CH2Cl2 Органические фазы объединяли и сушили над Na2SO4, фильтровали и концентрировали досуха. Остаток растирали с изопропиловым эфиром. Твердую часть отделяли фильтрованием, растирали с водой и фильтровали, получая при этом 0,18 г указанного в заголовке соединения, т пл = 185-188 С 1 Н ЯМР (CDCl3)7,46-7,37 (м, 4 Н); 7,28-7,21 (м, 1 Н), 5,84 (м, 1 Н), 4,48 (д, 1 Н), 3,74 (д, 1 Н), 2,78-2,60 (м,2 Н), 2,51-2,38 (м, 1 Н); 2,08-1,96 (м, 1 Н) МС EI TSQ 700; источник 180 С, 70 В; 200 мкА; 216 (М+), 160, 97. Пример 2. 1-о-Толилтетрагидро-1 Н-пирроло[1,2-а]имидазол-2,5-дион. К раствору тетрагидропирроло[1,2-а]имидазол-2,5-диона (1,3 г, 9,28 ммоль получен, как описано вJ. Med Chem 36, 4214-4220, 1994) в N-метилпирролидоне (NMP, 12 куб см) при перемешивании добавляли CuI (0,5 г, 2,62 ммоль), K2CO3 (1,3 г, 9,28 ммоль) и 2-бромтолуол (6 г, 35 ммоль). Суспензию нагревали в микроволновой аппаратуре (250 Вт) в течение 1 ч. К суспензии добавляли этилацетат и твердую часть отделяли фильтрованием. Органическую фазу промывали водой и водную фазу снова экстрагировали СН 2 Сl2. Органические фазы объединяли и сушили над Na2SO4, фильтровали и концентрировали досуха. Остаток растирали с Et2O. Твердую часть выделяли фильтрованием и кристаллизировали сначала с применением изо-РrОН и затем с применением AcOEt, получая при этом 0,33 г указанного в заголовке соединения, т пл. = 138-139 С. 1 Н ЯМР (CDCl3) : 7,35-7,23 (м, 4 Н); 7,13-7,06 (м, 1 Н), 5,69 (м ушир , 1 Н), 4,45 (д, 1 Н), 3,78 (д, 1 Н); 2,68 (ддд, 1 Н), 2,48 (ддд, 1 Н); 2,40-2,29 (м, 1 Н), 2,24 (с, 3H), 1,93 (м ушир , 1 Н). МС EI TSQ 700, источник 180 С; 70 В; 200 мкА; 230 (М+), 143, 118, 97. Примеры 3-44 (таблица 1). Общая процедура арилирования тетрагидропирроло[1,2-а]имидазол-2,5 диона арилгалогенидами. К раствору тетрагидропирроло[1,2-а]имидазол-2,5-диона (3,5 ммоль, получен, как описано в J Med.Chem. 36, 4214-4220, 1994 или в WO-9309120) в N-метилпирролидоне (NMP, 1 мл) при перемешивании добавляли CuI (0,19 г 1 ммоль), K2CO3 (0,5 г, 3,5 ммоль) и подходящий арилгалогенид (7 ммоль). Суспензию нагревали в микроволновой аппаратуре (25 Вт) в течение 20 мин. К суспензии добавляли этилацетат(50 мл) и воду (5 мл) и смесь перемешивали в течение 30' в присутствии целита. Реакционную смесь фильтровали и этилацетат промывали насыщенным раствором NaCl, сушили над Na2SO4, фильтровали и концентрировали досуха. Остаток растирали с Et2O, получая при этом требуемое соединение. Выходы варьируют от 30 до 60%. Пример 45. 1-Бензилтетрагидропирроло[1,2-а]имидазол-2,5-дион. Раствор тетрагидропирроло[1,2-а]имидазол-2,5-диона (0,5 г, 3,5 ммоль, получен, как описано в JMed. Chem 36, 4214-4220, 1994), BEMP (2 мл, 7 ммоль) и бензилбромида (0,6 мл, 5 ммоль) в CH3CN (20 мл) кипятили с обратным холодильником в течение 1 ч. Реакционную смесь концентрировали досуха,остаток затем снова растворяли в этилацетате и раствор промывали насыщенным раствором NaCl, сушили над Na2SO4, фильтровали и упаривали в вакууме. Остаток очищали флэш-хроматографией на силика-7 009558 геле (CH2Cl2/MeOH/NH4OH, 95/5/0,5), получая при этом 0,7 г указанного в заголовке соединения в виде желтого масла. Выход 87%. 1 Н ЯМР (CDCl3)7,39-7,10 (м, 5 Н); 5,03 (дд, 1 Н), 4,71 (д, 1 Н), 4,29 (д, 1 Н), 4,28 (д, 1 Н), 3,59 (д, 1 Н),2,57 (ддд, 1 Н); 2,39-2,125 (м, 2 Н), 1,92-1,77 (м, 1 Н). МС EI TSQ 700, источник 180 С, 70 В, 200 мкА 230,13 (М+), 174,09, 139,04, 91,03. Пример 46. 1-(4-Метилбензил)тетрагидропирроло[1,2-а]имидазол-2,5-дион. Раствор тетрагидропирроло[1,2-а]имидазол-2,5-диона (0,5 г, 3,5 ммоль, получен, как описано в JCH3CN (20 мл) кипятили с обратным холодильником в течение 1 ч. Реакционную смесь концентрировали досуха, остаток затем снова растворяли в этилацетате и раствор промывали насыщенным растворомNaCl, сушили над Na2SO4, фильтровали и упаривали в вакууме Остаток очищали флэш-хроматографией на силикагеле (CH2Cl2/MeOH/NH4OH, 95/5/0,5), получая при этом 0,8 г указанного в заголовке соединения в виде желтого масла. Выход 93%. 1 Н ЯМР (CDCl3)7,29-7,11 (м, 4 Н), 5,01 (м, 1 Н), 4,69 (д, 1 Н), 4,29 (д, 1 Н), 4,23 (д, 1 Н) 3,58 (д, 1 Н),2,65-2,50 (м, 1 Н), 2,40-2,24 (м, 2 Н), 2,33 (с, 3H), 1,93-1,78 (м, 1 Н). МС EI TSQ 700, источник 180 С, 70 В, 200 мкА 244,13 (М + ) 161,05, 105,02. Таблица 1. Структура, химическое название (по справочнику Бейльштейна), данные 1 Н ЯМР, МС и точки плавления для соединений, полученных по описанной выше общей процедуре Фармакологические способы Модель хронического повреждения в виде сжатия Периферическую мононевропатию вызывали у взрослых крыс наложением неплотно сжимающих лигатур вокруг общего седалищного нерва способом, описанным Bennett and Xie (Pain 1988, 33, 87-107). Крыс анестезировали хлораль гидратом. Общий седалищный нерв обнажали на уровне середины бедра тупым отделением через двухглавые бицепсы бедра. Проксимально к трифуркации седалищного нерва приблизительно 1 см нерва освобождали от прилипающей ткани и четыре лигатуры (шелк 3/0) неплотно закрепляли вокруг него с интервалами приблизительно 1 мм. Длина нерва, таким образом обработанного, была 1 см. Большое внимание уделяли наложению лигатур, так чтобы было видно, что диаметр нерва был только немного сжат при рассматривании с увеличением в 40 раз. Левую лапку не трогали. Испытание на сдавливание лапки Ноцицептивный порог у крысы определяли с помощью аналгезиметра (Ugo Basile, Varese, Italy) способом, описанным Leigiohn и др (Br. J. Pharmacol. 1988, 93, 553-560). Крыс, весящих меньше 40 г или больше 75 г во время испытания, перед введением лекарственного средства исключали из исследования(25%). Выбирали произвольную предельную величину 250 г. Эксперимент проводили на крысах, подвергаемых испытанию на сжатие лапки через 14 дней после операции, так как в это время наблюдали значительное снижение болевого порога поврежденной лапы(dx). Габапентин (30 мкг, i.с.v.), леветирацетам (300 мкг, i.с.v.), димирацетам (100 мкг, i.с.v.), соединение примера 1 (10 мкг, i.с.v.), соединение примера 2 (10 мкг i.с.v.), соединение примера 5 (3 мкг, i.с.v.), соединение примера 6 (3 мкг, i.с.v.), соединение примера 13 (30 мкг, i.с.v.) и соединение примера 22 (30 мкг, i.с.v.) настоящего изобретения показали антигипералгезивное действие по сравнению с группой,обрабатываемой солевым раствором или носителем. Все соединения не модифицировали болевой порог в контролатеральной, неоперированной лапке. Следует отметить, что все соединения проявляли свое- 21009558 антигипералгезивное действие без изменения общего поведения и самопроизвольного движения животных по сравнению с крысами, обработанными солевым раствором/носителем. Кроме того не обнаруживали у крыс модификацию согласованного движения в испытании по вращению стержня (Vaught J. и др.Neuropharmacology 1985, 24, 211-216). Влияние соединений изобретения и ссылочных соединений, определяемое (i.c.v.) на моделях мононевропатии dx крыс и оцененное в испытании на сдавливание лапки ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I) где А выбран из карбоциклических ароматических групп, гетероциклических ароматических групп и арил-С 1-4-алкила;R1 выбран из водорода,арил-С 1-7-алкила, необязательно замещенного на арильной части одной или несколькими группами,выбранными из гидрокси, С 1-4-алкокси, галогена, галоген-С 1-4-алкила; гетероциклил-С 1-7-алкила, необязательно замещенного на гетероциклильной части одной или несколькими группами, выбранными из С 1-4-алкила и гидрокси; С 1-7-алкила, необязательно содержащего в цепи атом кислорода или серы или необязательно замещенного в любом положении одной или несколькими группами, выбранными из гидрокси, тио, амино,карбоксила, аминокарбонила, гуанидинила,R2 выбран из водорода, С 1-4-алкила, арил-С 1-4-алкила и фенила; или же R1 и R2, взятые вместе, образуют насыщенное карбоциклическое кольцо, содержащее 3-8 атомов углерода;R3 выбран из водорода, С 1-4-алкила, арил-С 1-4-алкила, CONH2 и COOR5, где R5 выбран из водорода и С 1-4-алкила;a) термин карбоциклическая ароматическая группа означает одно или слитые ароматические кольца с 6-12 членами кольца, необязательно замещенными;b) термины гетероциклическая ароматическая группа и гетероциклил означают одно или слитые ароматические кольца, причем каждое кольцо имеет 5-12 членов и содержит до четырех гетероатомов, выбранных из кислорода, серы и азота, необязательно замещенных;c) термин арил означает одно или слитые ненасыщенные кольца, причем каждое кольцо имеет 58 членов и предпочтительно 5 или 6 членов, необязательно замещенных; в форме рацемической смеси или в форме энантиомеров, и его фармацевтически приемлемые соли или сольваты. 2. Соединения по п.1, где А представляет собой фенил, тиенил, пиридил, пиримидинильную группу, необязательно замещенную, бензил или 4-метилбензил; R1 представляет собой водород, С 1-4-алкил,бензил, -СН 2 ОН, -CH2CH2CONH2, -CH2COOH, индол-(3-ил)метил; R2 представляет собой водород, C1-4 алкил или бензил; R3 и R4 представляют собой водород или метил, и n равно 2. 3. Соединение по п.2, где А представляет собой фенил, необязательно замещенный; R1, R2, R3 и R4 представляют собой водород, и n равно 2. 4. Соединение по любому из пп.1-3, где А замещен 1-3 заместителями, выбранными из Me, Et, изоPr, ОН, COOEt, СООН, СН 2 ОН, SO2NH2, SO2Me, OMe, Cl, F, CN и CF3. 5. Соединение по п.4, где А замещен 1-3 заместителями, выбранными из Me, Et, изо-Pr, ОН, CN, Cl и CF3 6. Соединение по п.1 или 2, где указанная C1-4-алкильная группа выбрана из Me, Et, изо-Pr, изо-Bu и циклопропилметила. 7. Соединение по п.1, выбранное из группы, состоящей из 1-фенилтетрагидро-1 Н-пирроло[1,2-а]имидазол-2,5-диона,1-о-толилтетрагидро-1 Н-пирроло[1,2-а]имидазол-2,5-диона,1-(2,6-диметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-тиофен-2-илтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-м-толилтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-п-толилтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(5-фтор-2-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-фтор-2-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(2-трифторметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-хлор-2-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-хлорфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-метоксифенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-цианофенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-хлорфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-гидроксифенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-трифторметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-трифторметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-метоксифенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3,5-диметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3,4-диметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-нафталин-2-илтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-изопропилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-хлор-3-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,3-бензил-1-фенилтетрагидропирроло[1,2-а]имидазол-2,5-диона,3-метил-1-фенилтетрагидропирроло[1,2-а]имидазол-2,5-диона,3-изобутил-1-фенилтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-фтор-5-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-фтор-4-метилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,7 а-метил-1-фенилтетрагидропирроло[1,2-а]имидазол-2,5-диона,(S)-1-о-толилтетрагидропирроло[1,2-а]имидазол-2,5-диона,(R)-1-о-толилтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-этилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-изопропилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-гидроксиметилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,4-(2,5-диоксогексагидропирроло[1,2-а]имидазол-1-ил)бензойной кислоты,этилового эфира 4-(2,5-диоксогексагидропирроло[1,2-а]имидазол-1-ил)бензойной кислоты,1-(4-метансульфонилфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-фторфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(4-цианофенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-пиридин-2-илтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-пиридин-3-илтетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(5-метилпиридин-2-ил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,- 23009558 1-(2-цианофенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-(3-фторфенил)тетрагидропирроло[1,2-а]имидазол-2,5-диона,1-бензилтетрагидропирроло[1,2-а]имидазол-2,5-диона и 1-(4-метилбензил)тетрагидропирроло[1,2-а]имидазол-2,5-диона. 8. Способ получения соединения формулы (I) по п.1, включающий реакцию соединения формулы(III) где A, R1, R2, R3, R4 и n имeют значения, указанные в п.1, и X представляет собой атом галогена, с получением требуемого соединения формулы (I). 9. Способ по п.8, в котором в соединении формулы (III) X выбран из брома и иода. 10. Способ по п.8 или 9 для получения соединения формулы (I), где А представляет собой карбоциклическую ароматическую группу или гетероциклическую ароматическую группу, необязательно замещенную, в котором соединение формулы (II) растворяют в подходящем растворителе вместе с соединением формулы (III) в присутствии основания и каталитического количества соли меди при температуре между 60 и 140 С. 11. Способ по п.10, в котором указанным растворителем является N-метилпирролидон, указанным основанием является карбонат калия, указанной солью меди является иодид меди, и реакцию проводят при температуре 120 С. 12. Способ по п.8 или 9 для получения соединения формулы (I), где А представляет собой арил-С 1-4 алкил, в котором соединение формулы (II) растворяют в подходящем растворителе вместе с соединением формулы (III) в присутствии подходящего основания при температуре между 60 и 140 С. 13. Способ по п. 12, в котором указанный растворитель выбран из ацетонитрила, метиленхлорида,ацетона, указанное основание выбрано из триэтиламина, карбоната калия, 2-трет-бутилимино-2 диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфорина, N,N-диизопропилэтиламина и реакцию проводят при температуре 100 С. 14. Способ получения соединения формулы (I) по п.1, включающий следующие стадииi) реакцию аминокислоты формулы (IV) или одного из ее активированных производныхA-NH2 с получением соединения формулы (VI) где R1, R2 и А имеют значения, указанные выше в п.1, и Р представляет собой Н или подходящую защитную группу,ii) реакцию соединения формулы (VI), полученного на стадии i), с соединением формулы (VII) с получением соединения формулы (VIII) где A, R1, R2, R3, R4 и n имеют значения, указанные в п.1, Р имеет указанные выше значения, и R'- 24009558 представляет собой алкильную группу,iii) возможное удаление защитной группы Р при помощи гидрогенолиза соединения формулы(VIII), полученного на стадии ii), с получением соответствующего соединения (VIII), где Р представляет собой Н, иiv) циклизацию соединения формулы (VIII), где Р представляет собой Н, полученного на стадии ii) или на стадии iii), с получением требуемого соединения формулы (I). 15. Способ по п.14, в котором R' выбран из метила и трет-бутила, и Р выбран из Н, бензила и бензилоксикарбонила. 16. Способ по п.14, в котором на указанной стадии iv) реакцию циклизации проводят нагреванием соединения (VIII) в отсутствие растворителя при 120 С и в условиях вакуума или же кипячением с обратным холодильником при нагревании соединения (VIII) в ксилоле в течение времени, составляющего от 4 часов до 3 дней. 17. Способ по п.14, в котором указанную стадию ii) проводят кипячением с обратным холодильником при нагревании соединений формулы (VI) и (VII) в полярном растворителе в течение времени, составляющего от 2 до 24 ч, возможно в присутствии основания. 18. Способ по п.14, в котором реакцию, описанную в стадии i), проводят между хлорангидридом соединения (IV) и соединением (V) в присутствии неорганического или органического основания в подходящем апротонном растворителе при температуре между -70 и 50 С. 19. Способ по п.14, в котором реакцию стадии i) проводят реакцией вместе соединения (IV) и соединения (V) в присутствии подходящего конденсирующего агента в апротонном растворителе при температуре между -70 и 50 С. 20. Способ по пп.18 или 19, в котором указанная температура находится между -10 и 20 С. 21. Фармацевтическая композиция, содержащая в качестве активного ингредиента одно или несколько соединений формулы (I) в которой А выбирается из карбоциклических ароматических групп, гетероциклических ароматических групп;R4 это водород в форме рацемической смеси или в форме энантиомеров или их фармацевтически приемлемые соли или сольваты, причем: а) термин карбоциклическая ароматическая группа означает одно или слитые ароматические кольца с 6-12 членами кольца, необязательно замещенными;b) термины гетероциклическая ароматическая группа и гетероциклил означают одно или слитые ароматические кольца, причем каждое кольцо имеет 5-12 членов и содержит до четырех гетероатомов, выбранных из кислорода, серы и азота, необязательно замещенных,c) термин арил означает одно или слитые ненасыщенные кольца, причем каждое кольцо имеет 58 членов и предпочтительно 5 или 6 членов, необязательно замещенных. 22. Фармацевтическая композиция по п.21, дополнительно содержащая носители, разбавители и/или фармацевтически приемлемые наполнители, подходящие для форм введения, выбранных из пероральных, парентеральных, ректальных, трансдермальных форм и форм введения через слизистую оболочку. 23. Фармацевтическая композиция по п.21 или 22 в форме растворов, суспензий, растворимых порошков, гранул, микрокапсул, капсул, лепешек, таблеток, покрытых таблеток, суппозиториев, кремов,мазей, лосьонов, паст, пластырей с лекарственным средством, мембран или гелей. 24. Применение соединения формулы (I) по п.21 или одной из его фармацевтически приемлемых солей или одного из его сольватов для получения лекарственного средства, обладающего ноотропным и/или нейрозащитным, аналгезирующим и/или антигипералгезивным и противорвотным действием. 25. Применение для приготовления лечебного средства по п.24 для лечения дефицита обучаемости и памяти, болезни Альцгеймера, деменции, сенильной деменции, деменции васкулярного типа после удара, эпилепсии, церебральной ишемии, нарушений настроения, депрессии, для лечения состояний хронической боли, боли, ассоциированной с воспалением, невропатической боли, висцелярной боли и для лечения рвоты. 26. Применение для приготовления лечебного средства по п.24, в котором указанное соединение- 25009558 формулы (I) вводят в сочетании, одновременно или последовательно с одним или несколькими другими активными ингредиентами.
МПК / Метки
МПК: C07D 487/04, A61K 31/4188
Метки: фармацевтические, композиции, содержащие, соединения, действием, применение, ноотропным, получение
Код ссылки
<a href="https://eas.patents.su/28-9558-soedineniya-s-nootropnym-dejjstviem-ih-poluchenie-soderzhashhie-ih-farmacevticheskie-kompozicii-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения с ноотропным действием, их получение, содержащие их фармацевтические композиции и их применение</a>












