Получение арилалкилкарбаматных производных и их применение в терапии
Номер патента: 8801
Опубликовано: 31.08.2007
Авторы: Абуабделла Ахмед, Хурнер Кристан, Раве Антуан, Альмарио Гарсия Антонио
Формула / Реферат
1. Соединение формулы (I)
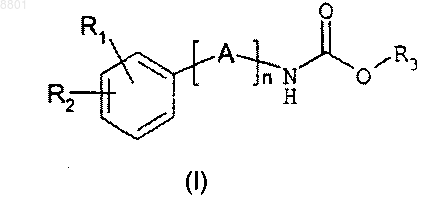
в которой n представляет собой целое число в интервале от 1 до 7;
А выбран из одной или более чем одной группы X, Y и/или Z;
X представляет собой С1-2-алкиленовую группу, возможно замещенную одной или более чем одной С1-12-алкильной, С3-7-циклоалкильной или С3-7-циклоалкил-С1-6-алкиленовой группой;
Y представляет собой либо С2-алкениленовую группу, возможно замещенную одной или более чем одной С1-12-алкильной, С3-7-циклоалкильной или С3-7-циклоалкил-С1-6-алкиленовой группой; либо С2-алкиниленовую группу;
Z представляет собой С3-7-циклоалкильную группу формулы
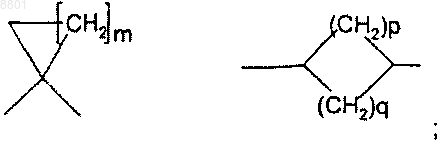
m представляет собой целое число в интервале от 1 до 5;
р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;
R1 представляет собой атом водорода или галогена либо гидрокси, циано, нитро, С1-4-алкильную, С1-4-алкокси, С1-4-тиоалкильную, С1-4-фторалкильную, С1-4-фторалкокси или С1-4-фтортиоалкильную группу;
R2 представляет собой атом водорода или галогена или циано, нитро, гидрокси, C1-4-алкильную,
C1-4-алкокси, C1-4-тиоалкильную, С1-4-фторалкильную, С1-4-фторалкокси, C1-4-фтортиоалкильную группу или группу, выбранную, в частности, из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила, пиридинила, пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила, изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила, пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила, оксадиазолила, триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси, фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более заместителями, выбранными из атома галогена или циано, нитро, С1-4-алкильной, гидрокси, С1-4-алкокси, C1-4-тиоалкильной, C1-3-фторалкильной, С1-3-фторалкокси, C1-3-фтортиоалкильной, фенилокси, бензилокси, пиперидинильной, пирролидинильной, морфолинильной, NR6R7, NHCOR6, COR6, CO2R6, SO2R6, -О-(С1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной С1-3-алкилом или бензилом;
R6 и R7 независимо друг от друга представляют собой C1-3-алкильную группу или фенил и
R3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или C1-3-алкильную группу и R5 представляет собой атом водорода или C1-3-алкильную, С3-5-циклоалкильную или С3-7-циклоалкил-С1-6-алкиленовую группу,
в форме основания, соли присоединения кислоты, гидрата или сольвата; за исключением 2-амино-2-оксоэтилбензилкарбамата.
2. Соединение формулы (I) по п.1, отличающееся тем, что
n представляет собой целое число в интервале от 1 до 7;
А выбран из одной или более чем одной группы X, Y и/или Z;
X представляет собой C1-2-алкиленовую группу, возможно замещенную одной или более чем одной С1-12-алкильной, С3-7-циклоалкильной или С3-7-циклоалкил-С1-6-алкиленовой группой;
Y представляет собой либо С2-алкениленовую группу, возможно замещенную одной или более чем одной С1-12-алкильной, С3-7-циклоалкильной или С3-7-циклоалкил-С1-6-алкиленовой группой; либо С2-алкиниленовую группу;
Z представляет собой С3-7-циклоалкильную группу формулы

m представляет собой целое число в интервале от 1 до 5;
р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;
R1 представляет собой атом водорода или галогена либо гидрокси, циано, нитро, C1-4-алкильную, С1-4-алкокси, С1-4-тиоалкильную, С1-4-фторалкильную, C1-4-фторалкокси или C1-4-фтортиоалкильную группу;
R2 представляет собой атом водорода или галогена или циано, нитро, гидрокси, С1-4-алкильную,
С1-4-алкокси, С1-4-тиоалкильную, C1-4-фторалкильную, С1-4-фторалкокси, C1-4-фтортиоалькильную группу или группу, выбранную, в частности, из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила, пиридинила, пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила, изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила, пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила, оксадиазолила, триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси, фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более заместителями, выбранными из атома галогена и циано, нитро, C1-4-алкильной, гидрокси, С1-4-алкокси, С1-4-тиоалкильной, C1-3-фторалкильной, C1-3-фторалкокси, C1-3-фтортиоалкильной, фенилокси, бензилокси, пиперидинильной, пирролидинильной, морфолинильной, NR6R7, NHCOR6, COR6, CO2R6, SO2R6, -О-(С1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной C1-3-алкилом или бензилом;
R6 и R7 независимо друг от друга представляют собой C1-3-алкильную группу или фенил, и
R3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или C1-3-алкильную группу, и
R5 представляет собой атом водорода или C1-3-алкильную, С3-5-циклоалкильную или С3-7-циклоалкил-С1-6-алкиленовую группу;
при условии, что если R1 и R2 представляют собой атом водорода и А представляет собой группу X, причем X представляет собой метилен, тогда n является отличным от 1;
в форме основания, соли присоединения кислоты, гидрата или сольвата.
3. Соединение формулы (I) по п.1 или 2, отличающееся тем, что,
когда n равно 1,
А выбран из одной или более чем одной группы X, Y и/или Z;
X представляет собой С1-2-алкиленовую группу, возможно замещенную одной шыш более чем одной С1-12-алкильной, С3-7-циклоалкильной или С3-7-циклоалкил-С1-6-алкиленовой группой;
Y представляет собой либо С2-алкениленовую группу, возможно замещенную одной или более чем одной С1-12-алкильной, С3-7-циклоалкильной или С3-7-циклоалкил-С1-6-алкиленовой группой; либо С2-алкиниленовую группу;
Z представляет собой С3-7-циклоалкильную группу формулы
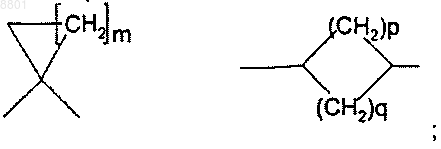
m представляет собой целое число в интервале от 1 до 5;
р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;
R1 представляет собой атом водорода или галогена либо гидрокси, циано, нитро, С1-4-алкильную, С1-4-алкокси, С1-4-тиоалкильную, С1-4-фторалкильную, С1-4-фторалкокси или С1-4-фтортиоалкильную группу;
R2 представляет собой атом галогена или циано, нитро, гидрокси, С1-4-алкильную, C1-4-алкокси, С1-4-тиоалкильную, С1-4-фторалкильную, С1-4-фторалкокси, С1-4-фтортиоалькильную группу, или группу, выбранную, в частности, из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила, пиридинила, пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила, изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила, пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила, оксадиазолила, триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси, фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более заместителями, выбранными из атома галогена и циано, нитро, С1-4-алкильной, гидрокси, С1-4-алкокси, С1-4-тиоалкильной, C1-3-фторалкильной, С1-3-фторалкокси, C1-3-фтортиоалкильной, фенилокси, бензилокси, пиперидинильной, пирролидинильной, морфолинильной, NR6R7, NHCOR6, COR6, CO2R6, SO2R6, -О-(С1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной C1-3-алкилом или бензилом;
R6 и R7 независимо друг от друга представляют собой С1-3-алкильную группу или фенил; и
R3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или C1-3-алкильную группу, и
R5 представляет собой атом водорода или C1-3-алкильную, С3-5-циклоалкильную или С3-7-циклоалкил-С1-6-алкиленовую группу;
когда n представляет собой целое число в интервале от 2 до 7,
А выбран из одной или более чем одной группы X, Y и/или Z;
X представляет собой C1-2-алкиленовую группу, возможно замещенную одной или более чем одной С1-12-алкильной, С3-7-циклоалкильной или С3-7-циклоалкил-С1-6-алкиленовой группой;
Y представляет собой либо С2-алкениленовую группу, возможно замещенную одной или более чем одной С1-12-алкильной, С3-7-циклоалкильной или С3-7-циклоалкил-С1-6-алкиленовой группой; либо С2-алкиниленовую группу;
Z представляет собой С3-7-циклоалкильную группу формулы

m представляет собой целое число в интервале от 1 до 5;
р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;
R1 представляет собой атом водорода или галогена либо гидрокси, циано, нитро, C1-4-алкильную, С1-4-алкокси, C1-4-тиоалкильную, С1-4-фторалкильную, C1-4-фторалкокси или С1-4-фтортиоалкильную группу;
R2 представляет собой атом водорода или галогена или циано, нитро, гидрокси, С1-4-алкильную,
С1-4-алкокси, C1-4-тиоалкильную, C1-4-фторалкильную, С1-4-фторалкокси, С1-4-фтортиоалькильную группу, или группу, выбранную, в частности, из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила, пиридинила, пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила, изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила, пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила, оксадиазолила, триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси, фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более заместителями, выбранными из атома галогена и циано, нитро, С1-4-алкильной, гидрокси, C1-4-алкокси, C1-4-тиоалкильной, C1-3-фторалкильной, C1-3-фторалкокси, C1-3-фтортиоалкильной, фенилокси, бензилокси, пиперидинильной, пирролидинильной, морфолинильной, NR6R7, NHCOR6, COR6, CO2R6, SO2R6, -О-(С1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной C1-3-алкилом или бензилом;
R6 и R7 независимо друг от друга представляют собой С1-3-алкильную группу или фенил и
R3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или C1-3-алкильную группу и R5 представляет собой атом водорода или С1-3-алкильную, С3-5-циклоалкильную или С3-7-циклоалкил-С1-6-алкиленовую группу;
в форме основания, соли присоединения кислоты, гидрата или сольвата.
4. Соединение формулы (I) по любому из пп.1-3, отличающееся тем, что
n представляет собой целое число от 1 до 5;
А выбран из одной или более чем одной группы X и/или Z;
X представляет собой C1-2-алкиленовую группу, возможно замещенную одной или более чем одной C1-3-алкильной группой;
Z представляет собой С3-7-циклоалкильную группу формулы

m представляет собой целое число в интервале от 1 до 5;
р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;
R1 представляет собой водород или галоген или С1-4-алкокси группу;
R2 представляет собой атом водорода или галогена или гидроксигруппу, С1-4-алкильную группу,
С1-4-алкоксигруппу, С1-4-фторалкильную группу шыш С1-4-фторалкоксигруппу или группу, выбранную из фенила, нафтила, бифенила, фенилэтиленила, пиридинила, пиримидинила, пиразинила, хинолинила, изохинолинила, тиенила, фуранила, изоксазолила, тиадиазолила, фенилимидазолила, бензотиенила, дибензофуранила, бензимидазолила, пирролопиридинила, фенилокси, фенилсульфонила, бензоила, бензилокси или фенилпропокси, возможно замещенную одним или более заместителями, выбранными из атома галогена, либо циано, нитро или С1-4-алкильной группы, С1-4-алкоксигруппы, С1-4-тиоалкильной группы, C1-3-фторалкильной группы, C1-3-фторалкоксигруппы, фенилокси, либо бензилокси, NR6R7, NHCOR6, COR6, CO2R6, SO2R6, или -О-(С1-3-алкилен)-O-;
R6 и R7 независимо друг от друга представляют собой C1-3-алкильную группу;
R3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или C1-3-алкильную группу и R5 представляет собой атом водорода или С1-3-алкильную группу, С3-5-циклоалкильную группу или С3-7-циклоалкил-С1-6-алкиленовую группу;
в форме основания, соли присоединения кислоты, гидрата или сольвата.
5. Соединение формулы (I) по п.4, отличающееся тем, что
n представляет собой целое число от 1 до 5;
А выбран из одной или более чем одной группы X и/или Z;
X представляет собой C1-2-алкиленовую группу, возможно замещенную одной или более чем одной С1-3-алкильной группой;
Z представляет собой С3-7-циклоалкильную группу формулы
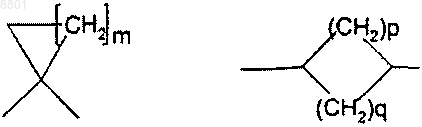
m представляет собой целое число в интервале от 1 до 5;
р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;
R1 представляет собой водород или галоген или С1-4-алкоксигруппу;
R2 представляет собой атом водорода или хлора, брома или фтора или группу гидрокси, метил, метокси, трифторметил или трифторметокси, или группу, выбранную из фенила, нафтила, бифенила, фенилэтиленила, пиридинила, пиримидинила, пиразинила, хинолинила, изохинолинила, тиенила, фуранила, изоксазолила, тиадиазолила, фенилимидазолила, бензотиенила, дибензофуранила, бензимидазолила, пирролопиридинила, фенилокси, фенилсульфонила, бензоила, бензилокси или фенилпропокси, возможно замещенную одним или более заместителями, выбранными из атома хлора или фтора, либо группы циано, нитро, метил, этил, изопропил, бутил, трет-бутил, метокси, этокси, тиометил, трифторметил, трифторметокси, фенилокси, бензилокси, NR6R7, NHCOR6, COR6, CO2R6, SO2R6 или -О-(СН2)-О-;
R6 и R7 независимо друг от друга представляют собой C1-3-алкильную группу;
R3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или С1-3-алкильную группу и R5 представляет собой атом водорода или С1-3-алкильную группу, С3-5-циклоалкильную группу, или С3-7-циклоалкил-С1-6-алкиленовую группу;
в форме основания, соли присоединения кислоты, гидрата или сольвата.
6. Соединение формулы (I) по любому из пп.1-5, отличающееся тем, что n представляет собой целое число от 1 до 5;
А представляет собой C1-2-алкиленовую группу;
R1 представляет собой водород или галоген;
R2 представляет собой группу, выбранную из фенила, нафтила, фенилокси, бензилокси, пиридинила, хинолинила, изохинолинила, фенилимидазолила или пирролопиридинила, возможно замещенную одним или более заместителями, выбранными из атома галогена, цианогруппы, C1-4-алкильной группы, С1-4-алкоксигруппы, С1-3-фторалкильной группы, C1-3-фторалкоксигруппы;
R3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой водород и R5 представляет собой атом водорода или C1-3-алкильную группу, С3-5-циклоалкильную группу или С3-7-циклоалкил-С1-6-алкиленовую группу;
в форме основания, соли присоединения кислоты, гидрата или сольвата.
7. Соединение формулы (I) по п.6, отличающееся тем, что
n представляет собой целое число от 1 до 5;
А представляет собой C1-2-алкиленовую группу;
R1 представляет собой водород или галоген;
R2 представляет собой группу, выбранную из фенила, нафтила, фенилокси, бензилокси, пиридинила, хинолинила, изохинолинила, фенилимидазолила или пирролопиридинила, возможно замещенную одним или более заместителями, выбранными из атома хлора или фтора, группы циано, метил, метокси, трифторметил, трифторметокси;
R3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой водород и R5 представляет собой атом водорода или C1-3-алкильную группу, С3-5-циклоалкильную группу или С3-7-циклоалкил-С1-6-алкиленовую группу;
в форме основания, соли присоединения кислоты, гидрата или сольвата.
8. Соединение формулы (I) по любому из пп.1-7, отличающееся тем, что
n представляет собой целое число от 5 до 7;
А представляет собой C1-2-алкиленовую группу;
R1 и R2 независимо друг от друга представляют собой атом водорода или галогена, либо циано; гидрокси, C1-4-алкильную, С1-4-алкокси, С1-4-фторалкильную или С1-4-фторалкоксигруппу;
R3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой водород и R5 представляет собой атом водорода или C1-3-алкильную группу, С3-5-циклоалкильную группу или С3-7-циклоалкил-С1-6-алкиленовую группу;
в форме основания, соли присоединения кислоты, гидрата или сольвата.
9. Способ получения соединения формулы (I) по любому из пп.1-8, включающий стадию, состоящую в превращении карбаматного эфира общей формулы (Ia)
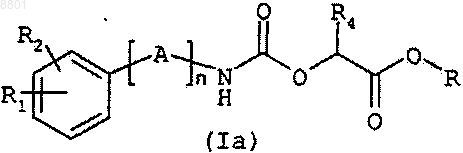
в которой A, n, R1, R2 и R4 такие, как определено для формулы (I) по п.1, и R представляет собой метильную или этильную группу, путем аминолиза с использованием амина общей формулы R5NH2, в которой R5 такой, как определено для формулы (I) по п.1.
10. Способ получения соединения формулы (I) по любому из пп.1-8, включающий стадию, состоящую в превращении производного оксазолидиндиона общей формулы (V)
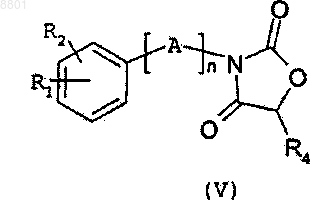
в которой A, n, R1, R2 и R4 такие, как определено для формулы (I) по п.1, путем аминолиза с использованием амина общей формулы R5NH2, в которой R5 такой, как определен для формулы (I) по п.1.
11. Соединение общей формулы (Ia)
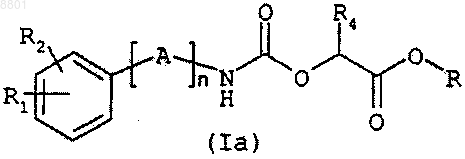
в которой n представляет собой целое число в интервале от 1 до 7;
А выбран из одной или более чем одной группы X, Y и/или Z;
X представляет собой C1-2-алкиленовую группу, возможно замещенную одной или более чем одной С1-12-алкильной, С3-7-циклоалкильной или С3-7-циклоалкил-С1-6-алкиленовой группой;
Y представляет собой либо С2-алкениленовую группу, возможно замещенную одной или более чем одэющ С1-12-алкильной, С3-7-циклоалкильной или С3-7-циклоалкил-С1-6-алкиленовой группой; либо С2-алкиниленовую группу;
Z представляет собой С3-7-циклоалкильную группу формулы
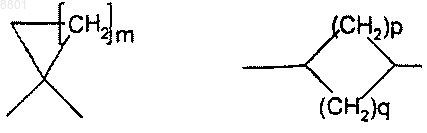
m представляет собой целое число в интервале от 1 до 5;
р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;
R1 представляет собой атом водорода или галогена, либо гидрокси, циано, нитро, С1-4-алкильную, С1-4-алкокси, С1-4-тиоалкильную, С1-4-фторалкильную, С1-4-фторалкокси или С1-4-фтортиоалкильную группу;
R2 представляет собой атом водорода или галогена или циано, нитро, гидрокси, С1-4-алкильную, C1-4-алкокси, C1-4-тиоалкильную, С1-4-фторалкильную, С1-4-фторалкокси, С1-4-фтортиоалькильную группу или группу, выбранную из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила, пиридинила, пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила, изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила, пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила, оксадиазолила, триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси, фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более заместителями, выбранными из атома галогена или циано, нитро, С1-4-алкильной, гидрокси, C1-4-алкокси, C1-4-тиоалкильной, С1-3-фторалкильной, С1-3-фторалкокси, C1-3-фтортиоалкильной, фенилокси, бензилокси, пиперидинильной, пирролидинильной, морфолинильной, NR6R7, NHCOR6, COR6, CO2R6, SO2R6, -О-(С1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной C1-3-алкилом или бензилом;
R6 и R7 независимо друг от друга представляют собой C1-3-алкильную группу или фенил; и
R4 представляет собой атом водорода или С1-3-алкильную группу; и
R представляет собой метильную или этильную группу; за исключением 2-этокси-2-оксоэтил-бензилкарбамата.
12. Соединение общей формулы (V)

в которой n представляет собой целое число в интервале от 1 до 7;
А выбран из одной или более чем одной группы X, Y и/или Z;
X представляет собой C1-2-алкиленовую группу, возможно замещенную одной или более чем одной С1-12-алкильной, С3-7-циклоалкильной или С3-7-циклоалкил-С1-6-алкиленовой группой;
Y представляет собой либо С2-алкениленовую группу, возможно замещенную одной или более чем одной С1-12-алкильной, С3-7-циклоалкильной или С3-7-циклоалкил-С1-6-алкиленовой группой; либо С2-алкиниленовую группу;
Z представляет собой С3-7-циклоалкильную группу формулы

m представляет собой целое число в интервале от 1 до 5;
р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;
R1 представляет собой атом водорода или галогена, либо гидрокси, циано, нитро, С1-4-алкильную, С1-4-алкокси, С1-4-тиоалкильную, С1-4-фторалкильную, C1-4-фторалкокси или С1-4-фтортиоалкильную группу;
R2 представляет собой атом водорода, брома, йода или фтора или циано, нитро, гидрокси, С1-4-алкильную, C1-4-алкокси, С1-4-тиоалкильную, С1-4-фторалкильную, C1-4-фторалкокси, С1-4-фтортио-
алькильную группу, или группу, выбранную из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила, пиридинила, пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила, изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила, пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила, оксадиазолила, триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси, фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более заместителями, выбранными из атома галогена или циано, нитро, C1-4-алкильной, гидрокси, С1-4-алкокси, С1-4-тиоалкильной, C1-3-фторалкильной, C1-3-фторалкокси, C1-3-фтортиоалкильной, фенилокси, бензилокси, пиперидинильной, пирролидинильной, морфолинильной, NR6R7, NHCOR6, COR6, CO2R6, SO2R6, -О-(С1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной C1-3-алкилом или бензилом;
R6 и R7 независимо друг от друга представляют собой С1-3-алкильную группу или фенил; и
R4 представляет собой атом водорода или C1-3-алкильную группу.
13. Фармацевтическая композиция, содержащая по меньшей мере одно соединение формулы (I) по любому из пп.1-8 в форме основания, соли, гидрата или фармацевтически приемлемого сольвата и возможно один или более чем один фармацевтически приемлемый эксципиент.
14. Применение соединения формулы (I) по любому из пп.1-8 в форме основания, соли, гидрата или фармацевтически приемлемого сольвата в качестве лекарства.
15. Применение соединения формулы (I) по любому из пп.1-8 в форме основания, соли, гидрата или фармацевтически приемлемого сольвата для изготовления лекарства, предназначенного для предупреждения или лечения патологии, в которую вовлечены эндогенные каннабиноиды и/или любые другие субстраты, метаболизируемые ферментом ГАЖК (гидролаза амидов жирных кислот).
16. Применение соединения формулы (I) по любому из пп.1-8 в форме основания, соли, гидрата или фармацевтически приемлемого сольвата для изготовления лекарства, предназначенного для предупреждения или лечения острой или хронической боли, головокружения, рвоты, тошноты, расстройств приема пищи, неврологических и психиатрических патологий, острых или хронических нейродегенеративных заболеваний, эпилепсии, нарушений сна, сердечно-сосудистых заболеваний, почечной ишемии, раковых заболеваний, расстройств иммунной системы, аллергических заболеваний, паразитических, вирусных или бактериальных инфекционных заболеваний, воспалительных заболеваний, остеопороза, глазных расстройств, легочных расстройств, желудочно-кишечных заболеваний или недержания мочи.
Текст
008801 Данное изобретение относится к арилалкилкарбаматным производным, к их получению и к их применению в терапии. Соединения по изобретению имеют общую формулу (I) в которой n представляет собой целое число в интервале от 1 до 7; А выбран из одной или более чем одной группы X, Y и/или Z;X представляет собой С 1-2-алкиленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой;Y представляет собой либо С 2-алкениленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой; либо С 2 алкиниленовую группу;m представляет собой целое число в интервале от 1 до 5; р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;R1 представляет собой атом водорода или галогена либо гидроксильную, циано, нитро, С 1-4 алкильную, С 1-4-алкокси, С 1-4-тиоалкильную, С 1-4-фторалкильную, С 1-4-фторалкокси или С 1-4 фтортиоалкильную группу;R2 представляет собой атом водорода или галогена или циано, нитро, гидроксильную, С 1-4 алкильную, С 1-4-алкокси, C1-4-тиоалкильную, С 1-4-фторалкильную, С 1-4-фторалкокси, C1-4-фтортиоалкильную группу или группу, выбранную, в частности, из фенила, нафтила, бифенила, фенилэтиленила,нафтилэтиленила, пиридинила, пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила, изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила,фуранила, пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила,тиадиазолила, оксадиазолила, триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси, фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси,нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более заместителями, выбранными из атома галогена или циано, нитро,С 1-4-алкильной, гидрокси, С 1-4-алкокси, C1-4-тиоалкильной, С 1-3-фторалкильной, C1-3-фторалкокси, C1-3 фтортиоалкильной, фенилокси, бензилокси, пиперидинильной, пирролидинильной, морфолинильной,NR6R7, NHCOR6, COR6, CO2R6, SO2R6, -О-(С 1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной С 1-3-алкилом или бензилом;R6 и R7 независимо друг от друга представляют собой C1-3-алкильную группу или фенил иR3 представляет собой группу общей формулы CHR4CONHR5, в которойR4 представляет собой атом водорода или C1-3-алкильную группу, иR5 представляет собой атом водорода или C1-3-алкильную, С 3-5-циклоалкильную или С 3-7 циклоалкил-С 1-6-алкиленовую группу. Во всем тексте данной заявки на патент следующее соединение не является частью данного изобретения: 2-амино-2-оксоэтилбензилкарбамат. В контексте данного изобретения соединения общей формулы (I) могут, следовательно, содержать две или более одинаковые или разные группы А. Среди соединений общей формулы (I) первый класс предпочтительных соединений состоит из соединений, гдеn представляет собой целое число в интервале от 1 до 7; А выбран из одной или более чем одной группы X, Y и/или Z;X представляет собой C1-2-алкиленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой;Y представляет собой либо С 2-алкениленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой; либо С 2 алкиниленовую группу;m представляет собой целое число в интервале от 1 до 5; р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;R1 представляет собой атом водорода или галогена либо гидрокси, циано, нитро, С 1-4-алкильную,С 1-4-алкокси, C1-4-тиоалкильную, C1-4-фторалкильную, C1-4-фторалкокси или С 1-4-фтортиоалкильную группу;R2 представляет собой атом водорода или галогена или циано, нитро, гидрокси, С 1-4-алкильную,С 1-4-алкокси, С 1-4-тиоалкильную, С 1-4-фторалкильную, C1-4-фторалкокси, С 1-4-фтортиоалькильную группу, или группу, выбранную, в частности, из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила, пиридинила, пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила, изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила,пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила,оксадиазолила, триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила,бензотиазолила, бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси,фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более чем одним заместителем, выбранным из атома галогена и циано, нитро, С 1-4-алкильной,гидрокси,C1-4-алкокси,С 1-4-тиоалкильной,C1-3-фторалкильной,C1-3-фторалкокси,C1-3 фтортиоалкильной, фенилокси, бензилокси, пиперидинильной, пирролидинильной, морфолинильной,NR6R7, NHCOR6, COR6, CO2R6, SO2R6, -О-(С 1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной С 1-3-алкилом или бензилом;R6 и R7 независимо друг от друга представляют собой C1-3-алкильную группу или фенил; иR3 представляет собой группу общей формулы CHR4CONHR5, в которойR4 представляет собой атом водорода или C1-3-алкильную группу, иR5 представляет собой атом водорода или C1-3-алкильную, С 3-5-циклоалкильную или С 3-7 циклоалкил-С 1-6-алкиленовую группу; при условии, что когда R1 и R2 представляют собой атом водорода и А представляет собой группуX, причем X представляет собой метилен, тогда n является отличным от 1. Среди соединений общей формулы (I) второй класс предпочтительных соединений состоит из соединений, в которых когда n равно 1,А выбран из одной или более чем одной группы X, Y и/или Z;X представляет собой C1-2-алкиленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой;Y представляет собой либо С 2-алкениленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой; либо С 2 алкиниленовую группу;m представляет собой целое число в интервале от 1 до 5; р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;R1 представляет собой атом водорода или галогена либо гидрокси, циано, нитро, С 1-4-алкильную,С 1-4-алкокси, С 1-4-тиоалкильную, C1-4-фторалкильную, С 1-4-фторалкокси или С 1-4-фтортиоалкильную группу;R2 представляет собой атом галогена или циано, нитро, гидрокси, С 1-4-алкильную, С 1-4-алкокси, С 1-4 тиоалкильную, С 1-4-фторалкильную, C1-4-фторалкокси, C1-4-фтортиоалькильную группу или группу, вы-2 008801 бранную, в частности, из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила, пиридинила,пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила, изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила, пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила, оксадиазолила,триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила, бензотиазолила,бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила,изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси, фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более заместителями, выбранными из атома галогена и циано, нитро, С 1-4-алкильной, гидроксильной, C1-4 алкокси, С 1-4-тиоалкильной, C1-3-фторалкильной, C1-3-фторалкокси, C1-3-фтортиоалкильной, фенилокси,бензилокси, пиперидинильной, пирролидинильной, морфолинильной, NR6R7, NHCOR6, COR6, CO2R6,SO2R6, -О-(С 1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной C1-3-алкилом или бензилом;R6 и R7 независимо друг от друга представляют собой C1-3-алкильную группу или фенил; иR3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или С 1-3-алкильную группу и R5 представляет собой атом водорода или С 1-3-алкильную,С 3-5-циклоалкильную или С 3-7-циклоалкил-С 1-6-алкиленовую группу; когда n представляет собой целое число в интервале от 2 до 7,А выбран из одной или более чем одной группы X, Y и/или Z;X представляет собой С 1-2-алкиленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой;Y представляет собой либо С 2-алкениленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой; либо С 2 алкиниленовую группу;m представляет собой целое число в интервале от 1 до 5; р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;R1 представляет собой атом водорода или галогена, либо гидрокси, циано, нитро, С 1-4-алкильную,С 1-4-алкокси, C1-4-тиоалкильную, C1-4-фторалкильную, С 1-4-фторалкокси или C1-4-фтортиоалкильную группу;R2 представляет собой атом водорода или галогена или циано, нитро, гидрокси, С 1-4-алкильную,С 1-4-алкокси, С 1-4-тиоалкильную, С 1-4-фторалкильную, С 1-4-фторалкокси, С 1-4-фтортиоалькильную группу, или группу, выбранную, в частности, из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила, пиридинила, пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила, изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила,пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила,оксадиазолила, триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила,бензотиазолила, бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси,фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси и возможно замещенную одним или более заместителями, выбранными из атома галогена и циано, нитро, С 1-4-алкильной, гидрокси,С 1-4-алкокси, С 1-4-тиоалкильной, С 1-3-фторалкильной, C1-3-фторалкокси, C1-3-фтортиоалкильной, фенилокси, бензилокси, пиперидинильной, пирролидинильной, морфолинильной, NR6R7, NHCOR6, СOR6,CO2R6, SO2R6, -О-(С 1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной C1-3-алкилом или бензилом;R6 и R7 независимо друг от друга представляют собой C1-3-алкильную группу или фенил; иR3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или С 1-3-алкильную группу и R5 представляет собой атом водорода или С 1-3-алкильную,С 3-5-циклоалкильную или С 3-7-циклоалкил-С 1-6-алкиленовую группу.-3 008801 Среди соединений общей формулы (I) третий класс особенно предпочтительных соединений состоит из соединений, в которыхn представляет собой целое число от 1 до 5 и/или А выбран из одной или более чем одной группы X и/или Z;X представляет собой C1-2-алкиленовую группу, в частности метилен, возможно замещенный одной или более C1-3-алкильными группами, в частности метилом;m представляет собой целое число в интервале от 1 до 5, в частности 1; р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5, в частности 4; и/илиR1 представляет собой водород или галоген, в частности хлор или фтор, или С 1-4-алкоксигруппу, в частности метокси; и/илиR2 представляет собой атом водорода или галогена, в частности хлор, бром или фтор, или гидроксильную группу, С 1-4-алкильную группу, в частности метил, C1-4-алкоксигруппу, в частности метокси,С 1-4-фторалкильную группу, в частности трифторметил, или С 1-4-фторалкоксигруппу, в частности трифторметокси, или группу, выбранную из фенила, нафтила, бифенила, фенилэтиленила, пиридинила, пиримидинила, пиразинила, хинолинила, изохинолинила, тиенила, фуранила, изоксазолила, тиадиазолила,фенилимидазолила, бензотиенила, дибензофуранила, бензимидазолила, пирролопиридинила, фенилокси,фенилсульфонила, бензоила, бензилокси или фенилпропокси, возможно замещенную одним или более заместителями, выбранными из атома галогена, в частности хлора или фтора, либо циано, нитро или С 1-4 алкильной группы, в частности метильной, этильной, изопропильной, бутильной или трет-бутильной,C1-6-алкоксигруппы, в частности метокси или этокси, С 1-4-тиоалкильной группы, в частности тиометильной, C1-3-фторалкильной группы, в частности трифторметильной, C1-3-фторалкоксигруппы, в частности трифторметокси, фенилокси, либо бензилокси, NR6R7, NHCOR6, COR6, CO2R6, SO2R6, или -О-(С 1-3 алкилен)-О-, в частности -О-(СН 2)-О- и/илиR6 и R7 независимо друг от друга представляют собой С 1-3-алкильную группу, в частности метил; и/илиR3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или C1-3-алкильную группу и R5 представляет собой атом водорода или С 1-3-алкильную группу, в частности метил, этил, С 3-5-циклоалкил, в частности циклопропил, или С 3-7-циклоалкил-С 1-6 алкилен, в частности циклопропилметил. Среди соединений этого третьего класса особенно предпочтительных соединений особое предпочтение отдают соединениям, в которыхn представляет собой целое число от 1 до 5; и/или А представляет собой С 1-2-алкиленовую группу, в частности метилен; и/илиR1 представляет собой водород или галоген, в частности хлор или фтор; и/илиR2 представляет собой группу, выбранную из фенила, нафтила, фенилокси, бензилокси, пиридинила, хинолинила, изохинолинила, фенилимидазола или пирролопиридинила, возможно замещенную одним или более заместителями, выбранными из атома галогена, в частности хлора или фтора, цианогруппы, С 1-4-алкильной группы, в частности метила, С 1-4-алкоксигруппы, в частности метокси, С 1-3 фторалкильной группы, в частности трифторметила, C1-3-фторалкоксигруппы, в частности трифторметокси; и/илиR3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой водород и R5 представляет собой атом водорода или C1-3-алкильную группу, в частности метил или этил,С 3-5-циклоалкильную группу, в частности циклопропил, или С 3-7-циклоалкил-С 1-6-алкиленовую группу, в частности циклопропилметил. Среди соединений общей формулы (I) четвертый класс особенно предпочтительных соединений состоит из соединений, в которыхn представляет собой целое число от 5 до 7; и/или А представляет собой C1-2-алкиленовую группу, в частности метилен; и/илиR1 и R2 независимо друг от друга представляют собой атом водорода или галогена либо циано, гидроксильную, С 1-4-алкильную, С 1-4-алкокси, С 1-4-фторалкильную или С 1-4-фторалкоксигруппу; и/илиR3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой водород и R5 представляет собой атом водорода или C1-3-алкильную группу, в частности метил или этил,С 3-5-циклоалкильную группу, в частности циклопропил, или С 3-7-циклоалкил-С 1-6-алкиленовую группу, в частности циклопропилметил.-4 008801 Среди соединений общей формулы (I) изобретение также относится к соединениям общей формулы в которой n представляет собой целое число от 1 до 6; А выбран из одной или более чем одной группы X, Y и/или Z;X представляет собой С 1-2-алкиленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой;Y представляет собой С 2-алкениленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой;m представляет собой целое число в интервале от 1 до 5; р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;R1 представляет собой атом водорода или галогена либо гидрокси, циано, нитро, C1-3-алкильную,С 1-3-алкокси, С 1-3-тиоалкильную, C1-3-фторалкильную, С 1-3-фторалкокси или С 1-3-фтортиоалкильную группу;R2 представляет собой атом водорода или галогена или циано, нитро, гидроксильную, С 1-3 алкильную, C1-3-алкокси, C1-3-тиоалкильную, C1-3-фторалкильную, С 1-3-фторалкокси, C1-3-фтортиоалькильную группу, или группу, выбранную из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила, пиридинила, пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила, изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила,пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила,оксадиазолила, триазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси, фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более заместителями, выбранными из атома галогена и циано, нитро, С 1-4-алкильной, гидрокси, С 1-4-алкокси, С 1-4 тиоалкильной, C1-3-фторалкильной, C1-3-фторалкокси, С 1-3-фтортиоалкильной, фенилокси, бензилокси,пиперидинильной, пирролидинильной, морфолинильной, NR6R7, NHCOR6, COR6, CO2R6, SO2R6, -О-(С 1-3 алкилен)-О- или 4-пиперазинильной группы, возможно замещенной C1-3-алкилом или бензилом;R6 и R7 независимо друг от друга представляют собой C1-3-алкильную группу или фенил; иR3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или C1-3-алкильную группу и R5 представляет собой атом водорода или С 1-3-алкильную,С 3-5-циклоалкильную или С 3-7-циклоалкил-С 1-6-алкиленовую группу. Соединения общей формулы (I) могут содержать один или более чем один ассиметрический атом углерода. Они могут существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры и диастереоизомеры и их смеси, включая рацемические смеси, образуют часть данного изобретения. Соединения формулы (I) могут существовать в форме оснований или солей присоединения кислот. Такие соли присоединения образуют часть данного изобретения. Такие соли преимущественно готовят с фармацевтически приемлемыми кислотами, хотя соли других кислот, которые полезны, например, для очистки или выделения соединений формулы (I), также образуют часть изобретения. Соединения общей формулы (I) могут находиться в форме гидратов или сольватов, а именно - в форме ассоциаций или комбинаций с одной или более молекулами воды или с растворителем. Такие гидраты и сольваты также образуют часть данного изобретения. В контексте данного изобретения термины понимают следующим образом:Ct-z, где t и z могут принимать значения от 1 до 12, представляет собой углеродную цепь, которая может иметь от t до z атомов углерода; например, С 1-3 представляет собой углеродную цепь, которая мо-5 008801 жет иметь от 1 до 3 атомов углерода; алкил представляет собой насыщенную, линейную или разветвленную алифатическую группу; например, C1-3-алкильная группа представляет собой линейную или разветвленную углеродную цепь, содержащую от 1 до 3 атомов углерода, в частности метил, этил, пропил или 1-метилэтил; алкилен представляет собой насыщенную, линейную или разветвленную двухвалентную алкильную группу, например, C1-3-алкиленовая группа представляет собой линейную или разветвленную двухвалентную углеродную цепь, содержащую от 1 до 3 атомов углерода, в частности метилен, этилен, 1 метилэтилен или пропилен; циклоалкил представляет собой циклическую алкильную группу, например, С 3-5-циклоалкильная группа представляет собой циклическую углеродную группу, содержащую от 3 до 5 атомов углерода, в частности циклопропил, циклобутил или циклопентил; алкенилен представляет собой двухвалентную ненасыщенную алифатическую группу из двух атомов углерода, в частности этилен; С 2-алкинилен представляет собой -CС-группу; алкокси представляет собой -О-алкильную группу с насыщенной, линейной или разветвленной алифатической цепью; тиоалкил представляет собой S-алкильную группу с насыщенной, линейной или разветвленной алифатической цепью; фторалкил представляет собой алкильную группу, в которой один или более чем один атом водорода замещен атомом фтора; фторалкокси представляет собой алкоксигруппу, в которой один или более чем один атом водорода замещен атомом фтора; фтортиоалкил представляет собой тиоалкильную группу, в которой один или более чем один атом водорода замещен атомом фтора; и атом галогена представляет собой фтор, хлор, бром или йод. Соединения по изобретению можно приготовить различными способами, которые проиллюстрированы следующими ниже схемами. Так, первый способ (схема 1) состоит во взаимодействии амина общей формулы (II), где R1, R2, n и А такие, как определено выше, с карбонатом общей формулы (III), где U представляет собой атом водорода или нитрогруппу, и R3 такой, как определено выше, в растворителе, таком как толуол или дихлорэтан, при температуре от 0 до 80 С. Схема 1 Карбонаты общей формулы (III) можно приготовить в соответствии с любым способом, описанным в литературе; например, путем взаимодействия спирта общей формулы HOR3 с фенилхлорформиатом или с 4-нитрофенилхлорформиатом в присутствии основания, такого как триэтиламин или диизопропилэтиламин. Другой способ (схема 2) получения соединений общей формулы (I) состоит во взаимодействии амина общей формулы (II), как определено выше, с карбонатом общей формулы (IIIa), где V представляет собой атом водорода или нитрогруппу, R4 такой, как определено выше, и R представляет собой метильную или этильную группу. Сложный эфир карбамата общей формулы (Iа), полученный таким образом, затем превращают в соединение общей формулы (I) путем аминолиза, используя амин общей формулы R5NH2, где R5 такой, как определено выше. Реакцию аминолиза можно проводить в растворителе,таком как метанол, или в смеси растворителей, таких как метанол и тетрагидрофуран. Карбонаты общей формулы (IIIa) можно получать аналогично карбонатам формулы (III). Вариант получения (схема 3) соединений общей формулы (I) состоит во взаимодействии производного общей формулы (IIа), где R1, R2, n и А такие, как определено выше, и W представляет собой гидрокси, мезилатную или тозилатную группу, либо атом хлора, брома или йода, с оксазолидиндионом общей структуры (IV), где R4 такой, как определено выше, с получением производного оксазолидиндиона общей структуры (V). Когда W представляет собой гидроксигруппу, эту реакцию можно провести в соответствии с условиями Мицунобу (Mitsunobu) (Synthesis 1981, 1-28), например, при воздействии диэтилового или диизопропилового азодикарбоксилата в присутствии трифенилфосфина. Когда X представляет собой атом хлора, брома или йода либо мезилатную или тозилатную группу, реакцию можно провести в присутствии основания, такого как 1,1,3,3-тетраметилгуанидин, гидрид натрия или трет-бутилат натрия, в растворителе, таком как тетрагидрофуран, ацетонитрил или диметилформамид, при температуре от 0 до 80 С. Производное оксазолидиндиона общей формулы (V), полученное таким образом, затем превращают в соединение общей формулы (I) путем аминолиза, используя амин общей формулы R5NH2, где R5 такой,как определено выше. Схема 3 Когда R2 представляет собой группу арильного или гетероарильного типа в соединении формулы(I), (Ia), (II), (IIа) или (V), R2 можно вводить в фенильное кольцо путем взаимодействия производного соединения общей формулы (I), (Ia), (II), (IIа) или (V), в котором фенильное кольцо несет атом хлора,брома или йода, либо трифлатную группу в положении, в которое нужно ввести R2, с производным арилили гетероарилбороновой кислоты в соответствии с условиями реакции Сузуки (Chem. Rev. (1995), 95,2457-2483), или с арильным или гетероарильным производным триалкилолова в соответствии с условиями реакции Стилле (Angew. Chem. (1986), 25, 508-524). Когда R2 представляет собой арилокси или имидазолильную, пирролопиридинильную или индолильную группу в соединении формулы (I), (Iа), (II), (IIа) или (V), введение R2 в фенильное кольцо можно осуществить посредством реакции О-арилирования или N-арилирования в соответствии с условиями-7 008801 реакции Бухвальда (Angew. Chem. (2003), 42, 5400-5449). Соединения общих формул (II), (IIа) и (IV), когда способ, посредством которого они получены, не описан, имеются в продаже или описаны в литературе, или могут быть получены способами, которые описаны здесь, или которые известны специалисту в данной области. Соединения общей формулы (Iа), где n, A, R1, R2 и R4 такие, как они определены для общей формулы (I), и R представляет собой метильную или этильную группу, являются новыми и также образуют часть данного изобретения. Они полезны для получения соединений общей формулы (I) в качестве промежуточных соединений в синтезе. Соединения общей формулы (V), где n, A, R1 и R4 такие, как они определены для общей формулы(I), и где R2 представляет собой атом водорода, брома, йода или фтора либо циано, нитро, гидрокси, С 1-4 алкильную, С 1-4-алкокси, С 1-4-тиоалкильную, С 1-4-фторалкильную, С 1-4-фторалкокси, C1-4-фтортиоалкильную группу или группу, выбранную из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила, пиридинила, пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила, изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила,пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила,оксадиазолила, триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила,бензотиазолила, бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси,фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более заместителями, выбранными из атома галогена и циано, нитро, С 1-4-алкильной, гидрокси,С 1-4-алкокси, С 1-4-тиоалкильной, C1-3-фторалкильной, C1-3-фторалкокси, C1-3-фтортиоалкильной, фенилокси, бензилокси, пиперидинильной, пирролидинильной, морфолинильной, NR6R7, NHCOR6, COR6,CO2R6, SO2R6, -О-(С 1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной C1-3-алкилом или бензилом; иR6 и R7 независимо друг от друга представляют собой C1-3-алкильную группу или фенил; являются новыми и также образуют часть данного изобретения. Они полезны для получения соединений общей формулы (I) в качестве промежуточных соединений в синтезе. Примеры, которые следуют далее, иллюстрируют получение некоторых соединений по изобретению. Эти примеры не ограничивают, а просто иллюстрируют изобретение. Микроанализы, ИК- и ЯМРспектры и/или ЖХ-МС (жидкостная хроматография в сочетании с масс-спектрометрией) подтверждают структуры и чистоту полученных соединений. Т.пл. (С) представляет собой точку плавления в градусах Цельсия. Номера, указанные в скобках в названиях примеров, соответствуют номерам в первой колонке таблицы, приведенной ниже в описании. Для названий соединений в следующих ниже примерах использовали номенклатуру ИЮПАК(IUPAC, International Union of Pure and Applied Chemistry). Например, для бифенильной группы соблюдали следующую нумерацию: 0,1 г (0,97 ммоль) N-метил-2-гидроксиацетамида смешивают по каплям при температуре окружающей среды с раствором 0,196 г (0,97 ммоль) 4-нитрофенилхлорформиата в 3 мл метиленхлорида и 0,166 мл (0,97 ммоль) N,N-диизопропилэтиламина. Смесь перемешивают при температуре окружающей среды в течение 45 мин и затем по каплям добавляют при температуре окружающей среды раствор 0,195 г(1,067 ммоль) 4-фенилбензиламина в 3 мл метиленхлорида и 0,166 мл (0,97 ммоль) N,Nдиизопропилэтиламина. Смесь перемешивают при температуре окружающей среды в течение 1 ч. Промывают ее насыщенным водным раствором хлорида аммония, 10%-ным водным раствором карбоната натрия и насыщенным водным раствором хлорида натрия. Фазы разделяют и органическую фазу сушат над сульфатом натрия. Систему фильтруют, фильтрат концентрируют при пониженном давлении и остаток очищают при помощи хроматографии на силикагеле, используя этилацетат. Получают 0,1 г белого твердого вещества. 2.1. 3-2-[4-(Трифторметил)фенил]этил-1,3-оксазолидин-2,4-дион. Раствор 1,4 г (7,36 ммоль) 2-[4-(трифторметил)фенил]этанола, 2,22 г (8,47 ммоль) трифенилфосфина и 0,82 г (8,1 ммоль) 1,3-оксазолидин-2,4-диона (J. Med. Chem. 1991, 34, 1542-1543) в 25 мл тетрагидрофурана, охлажденный до приблизительно -10 С, смешивают по каплям в инертной атмосфере с раствором 1,7 г (8,47 ммоль) диизопропилазидокарбоксилата (ДИАК) в 5 мл тетрагидрофурана, поддерживая температуру реакционной смеси от -10 до 0 С. Перемешивание продолжают при 0 С в течение 1 ч и затем при 25 С в течение 20 ч. Фильтрат концентрируют при пониженном давлении и остаток переносят в дихлорметан и водный 5%-ный раствор гидроксида натрия (10 мл). Водную фазу отделяют и затем дважды экстрагируют дихлорметаном. Органические фазы объединяют и последовательно промывают водным раствором соляной кислоты (1 н.) и затем насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органическую фазу сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Остаток, полученный таким образом, подвергают очистке хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана 20/80. Получают 1,5 г оксазолидиндиона в виде масла. 2.2. 2-(Метиламино)-2-оксоэтила 2-[4-(трифторметил)фенил]этилкарбамат. Раствор 0,75 г (2,74 ммоль) 3-2-[4-(трифторметил)фенил]этил-1,3-оксазолидин-2,4-диона, полученный на стадии 2.1, в 10 мл метанола смешивают с 8 мл (16,47 ммоль) раствора (2 М) метиламина в тетрагидрофуране. Перемешивание продолжают при температуре окружающей среды в течение 12 ч. После концентрирования при пониженном давлении полученный остаток очищают хроматографией на силикагеле, элюируя смесью 95/5 дихлорметана и метанола. Получают белое твердое вещество, которое перекристаллизовывают из смеси этилацетата и диизопропилового эфира. Получают 0,530 г чистого продукта. ЖХ-МС: М+Н = 305. Т.пл. (С): 140-142 С. 1 Н ЯМР (CDCl3)(м.д.): 2,85 (d, 3 Н); 2,95 (t, 2H); 3,50 (q, 2H); 4,60 (s, 2H); 4,90 (широкий s, 1H); 6,15 (широкий s, 1H); 7,35 (d, 2H); 7,60 (d, 2H). Пример 3 (соединение 150). 2-(Метиламино)-2-оксоэтила 2-(4'-хлор-1,1'-бифенил-4-ил) этилкарбамат. 3.1. 3-[2-(4-Бромфенил)этил]-1,3-оксазолидин-2,4-дион. Используют методику, описанную в примере 2 (стадия 2.1). Начиная с 4 г (19,89 ммоль) 2-(4 бромфенил)этанола, 6,3 г (23,87 ммоль) трифенилфосфина, 2,4 г (23,87 ммоль) 1,3-оксазолидин-2,4-диона и 4,8 г (23,87 ммоль) диизопропилазодикарбоксилата, получают 4,6 г чистого продукта в виде белого твердого вещества после хроматографии на силикагеле с элюированием дихлорметана. Т.пл. (С): 122-124 С. 3.2. 3-[2-(4'-Хлор-1,1'-бифенил-4-ил)этил]-1,3-оксазолидин-2,4-дион. В 250 мл трехгорлую круглодонную колбу, помещенную в инертную атмосферу, загружают 2 г(7,04 ммоль) 3-[2-(4-бромфенил)этил]-1,3-оксазолидин-2,4-диона, полученного на стадии 3.1, 2,2 г (14,08 ммоль) 4-хлорфенилбороновой кислоты и 6,5 г (28,16 ммоль) гидрата фосфата калия в суспензии в 100 мл 1,2-диметоксиэтана. Затем добавляют 0,80 г (0,70 ммоль) тетракис(трифенилфосфин)палладия. Затем реакционную смесь кипятят с обратным холодильником в течение ночи. Соли отделяют фильтрацией на селите и затем фильтрат концентрируют при пониженном давлении. Остаток переносят в этилацетат и воду. Органическую фазу отделяют и промывают насыщенным водным раствором хлорида натрия. Фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле,элюируя дихлорметаном. Получают 1,22 г чистого продукта в виде белого твердого вещества. Т.пл. (С): 182-184 С. 3.3. 2-(Метиламино)-2-оксоэтила 2-(4'-хлор-1,1'-бифенил-4-ил)этилкарбамат.-9 008801 Повторяют методику, описанную в примере 2 (стадия 2.2). Начиная с 0,40 г (1,27 ммоль) 3-[2-(4'хлор-1,1'-бифенил-4-ил)этил]-1,3-оксазолидин-2,4-диона, полученного на стадии 3.2, и 2,5 мл (5,07 ммоль) метиламина (2 М) в тетрагидрофуране, после хроматографии на силикагеле и элюирования смесью дихлорметана и метанола 98/2 получают 0,250 г чистого продукта в виде белого твердого вещества. ЖХ-МС: М+Н = 348. Т.пл. (С): 186-188 С. 1 Н ЯМР (CDCl3)(м.д.): 2,80 (d, 3 Н); 2,95 (t, 2H); 3,55 (q, 2H); 4,60 (s, 2H); 4,90 (широкий s, 1 Н); 6,15 (широкий s, 1H); 7,33 (d, 2H); 7,40-7,70 (неразрешенный мультиплет, 6 Н). Пример 4 (соединение 192). 2-(Метиламино)-2-оксоэтила 2-(3'-хлор-4'-фтор-1,1'-бифенил-4-ил) этилкарбамат. 4.1. 2-(Метиламино)-2-оксоэтила 2-(4-бромфенил)этилкарбамат. Повторяют методику, описанную в примере 2 (стадия 2.2). Начиная с 2,6 г (9,15 ммоль) 3-[2-(4 бромфенил)этил]-1,3-оксазолидин-2,4-диона, полученного в примере 3 (стадия 3.1), и 18,3 мл (36,6 ммоль) метиламина (2 М) в тетрагидрофуране, и после того, как продукт перенесли в диизопропиловый эфир, получают 2,6 г чистого продукта в виде белого твердого вещества. Т.пл. (С): 122-124 С. 4.2. 2-(Метиламино)-2-оксоэтила 2-(3'-хлор-4'-фтор-1,1'-бифенил-4-ил)этилкарбамат. Используют способ, описанный в примере 2 (стадия 2.2). Начиная с 0,820 г (2,6 ммоль) 2(метиламино)-2-оксоэтила 2-(4-бромфенил)этилкарбамата, полученного на стадии 4.1, и 0,4 г (2,86 ммоль) 3-хлор-4-фторфенилбороновой кислоты, 2,86 мл (5,72 ммоль) водного раствора карбоната натрия(2 М), 3 мл этанола и 0,15 г (0,13 ммоль) тетракис(трифенилфосфин)палладия, после хроматографии на силикагеле и элюирования смесью дихлорметана и метанола 95/5 с последующей перекристаллизацией из этилацетата получают 0,42 г чистого продукта в виде белого твердого вещества. ЖХ-МС: М+Н = 365. Т.пл. (С): 178-180 С. 1 Н ЯМР (CDCl3)(м.д.): 2,80 (d, 3 Н); 2,90 (t, 2H); 3,55 (q, 2H); 4,60 (s, 2H); 4,90 (широкий s, 1H); 6,15 (широкий s, 1H); 7,10-7,30 (неразрешенный мультиплет, 3 Н); 7,40-7,55 (неразрешенный мультиплет,3 Н); 7,65 (dd, 1H). Пример 5 (соединение 9). 2-(Метиламино)-2-оксоэтила (3-хлор-4'-фтор-1,1'-бифенил-4-ил) метилкарбамат. 5.1. 3-Хлор-4'-фтор-1,1'-бифенил-4-карбоновая кислота. В инертной атмосфере вводят 5 г (21,2 ммоль) 4-бром-2-хлорбензойной кислоты, 2,96 г (23,3 ммоль) 4-фторфенилбороновой кислоты и 31,8 мл (63,6 ммоль) водного раствора карбоната натрия (2 М) в суспензии в 40 мл толуола. Затем добавляют 0,80 г (0,70 ммоль) тетракис(трифенилфосфин)палладия. Реакционную смесь затем кипятят с обратным холодильником в течение ночи. Соли отделяют фильтрацией через селит и затем фильтрат концентрируют при пониженном давлении. Остаток переносят в этилацетат и водную соляную кислоту (4 н.). Органическую фазу отделяют и промывают насыщенным водным раствором хлорида натрия и фильтрат концентрируют при пониженном давлении. Получают 3,1 г кислоты в виде бежевого твердого вещества, которое используют как есть на следующей стадии. 5.2. (3-Хлор-4'-фтор-1,1'-бифенил-4-ил)метанол. Раствор 3,1 г (12,4 ммоль) 3-хлор-4'-фтор-1,1'-бифенил-4-карбоновой кислоты, полученной на стадии 5.1, в 50 мл тетрагидрофурана смешивают по каплям при температуре окружающей среды с 9,3 мл(18,56 ммоль) раствора (2 М) комплекса боран-диметилсульфид в тетрагидрофуране. Перемешивание продолжают при температуре окружающей среды в течение 18 ч. Смесь концентрируют при пониженном давлении и остаток переносят в этилацетат и 100 мл 0,1 н. водной соляной кислоты. Водную фазу отделяют и затем дважды экстрагируют этилацетатом. Органические фазы объединяют и последовательно промывают насыщенным водным раствором гидрокарбоната натрия и затем насыщенным водным раствором хлорида натрия. Органическую фазу сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Остаток, полученный таким образом,- 10008801 очищают хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана 20/80. Получают 1,9 г чистого продукта в виде белого твердого вещества. Т.пл. (С): 86-88 С. 5.3. 3-Хлор-4-(хлорметил)-4'-фтор-1,1'-бифенил. Раствор 1,9 г (8 ммоль) (3-хлор-4'-фтор-1,1'-бифенил-4-ил)метанола, полученный на стадии 5.2, в 20 мл хлороформа смешивают по каплям при температуре окружающей среды с 2,3 мл (32 ммоль) тионилхлорида. Смесь перемешивают при температуре окружающей среды в течение 18 ч и фильтрат концентрируют до сухости при пониженном давлении. Полученный остаток упаривают совместно с 50 мл толуола. Получают 2 г хлорида в виде масла, которое используют как есть на следующей стадии. 5.4. 3-[(3-Хлор-4'-фтор-1,1'-бифенил-4-ил)метил]-1,3-оксазолидин-2,4-дион. Раствор 0,5 г (1,96 ммоль) 3-хлор-4-(хлорметил)-4'-фтор-1,1'-бифенила, полученного на стадии 5.2,0,240 г (2,35 ммоль) 1,3-оксазолидин-2,4-диона и 0,45 г (3,92 ммоль) 1,1,3,3-тетраметилгуанидина в 10 мл тетрагидрофурана кипятят с обратным холодильником в течение 18 ч. Смесь оставляют возвращаться к температуре окружающей среды и концентрируют при пониженном давлении. Остаток переносят в дихлорметан и воду и водную фазу отделяют и дважды экстрагируют дихлорметаном. Объединенные органические фазы промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После упаривания растворителя полученный остаток очищают хроматографией на силикагеле,элюируя смесью этилацетата и циклогексана 20/80. Получают 0,33 г чистого продукта в виде белого твердого вещества. Т.пл. (С): 108-110 С. 5.5. 2-(Метиламино)-2-оксоэтила (3-хлор-4'-фтор-1,1'-бифенил-4-ил)метилкарбамат. Повторяют методику, описанную в примере 2 (стадия 2.2). Начиная с 0,33 г (0,9 ммоль) 3-[(3-хлор 4'-фтор-1,1'-бифенил-4-ил)метил]-1,3-оксазолидин-2,4-диона, полученного на стадии 5.4, и 1,35 мл (2,7 ммоль) раствора метиламина (2 М) в тетрагидрофуране, после хроматографии на силикагеле и элюирования смесью дихлорметана и метанола 95/5 с последующей перекристаллизацией из этилацетата получают 0,21 г чистого продукта в виде белого твердого вещества. ЖХ-МС: М+Н = 351. Т.пл. (С): 170-172 С. 1 Н ЯМР (CDCl3)(м.д.): 2,90 (d, 3H); 4,50 (d, 2H); 4,60 (s, 2H); 5,40 (широкий s, 1H); 6,10 (широкий 6.1. 3,4'-Дифтор-1,1'-бифенил-4-карбоксальдегид. Используют способ, описанный в примере 3 (стадия 3.2). Начиная с 5,3 г (26 ммоль) 4-бром-2 фторбензальдегида, 4 г (28,6 ммоль) 4-фторфенилбороновой кислоты, 26 мл (52 ммоль) водного раствора карбоната натрия (2 М) и 0,9 г (0,78 ммоль) тетракис(трифенилфосфин)палладия, после хроматографии на силикагеле и элюирования смесью этилацетата и циклогексана 10/90 получают 3,4 г чистого продукта в виде белого твердого вещества. Т.пл. (С): 98 С. 6.2. 3,4'-Дифтор-4-[(Z/Е)-2-нитровинил]-1,1'-бифенил. Суспензию 3,4 г (15,6 ммоль) 3,4'-дифтор-1,1'-бифенил-4-карбоксальдегида, полученного на стадии 6.1, 1,5 мл (27,3 ммоль) нитрометана и 0,9 г (11,7 ммоль) ацетата аммония нагревают при 50 С в течение ночи. Ее оставляют возвращаться к температуре окружающей среды и переносят в дихлорметан и воду. Водную фазу отделяют и дважды экстрагируют дихлорметаном и объединенные органические фазы промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана 10/90. Получают 2 г чистого продукта в виде желтого масла. 6.3. 2-(3,4'-Дифтор-1,1'-бифенил-4-ил)этанамин. Суспензию 0,90 г (23,7 ммоль) литийалюминийгидрида в 20 мл эфира, охлажденную до приблизительно 0 С, смешивают по каплям с раствором 2 г (7,7 ммоль) 3,4'-дифтор-4-[(Z/Е)-2-нитровинил]-1,1'бифенила, полученного на стадии 6.2, в 40 мл смеси тетрагидрофурана и эфира (1/1). Затем реакционную смесь нагревают при 60 С в течение 2 ч. Ее оставляют возвращаться к температуре окружающей среды и фильтруют на бумаге, и затем фильтрат обрабатывают 0,9 мл воды и 0,9 мл водного 15%-ного раствора гидроксида натрия и затем 2,7 мл воды. Перемешивают все при температуре окружающей среды в тече- 11008801 ние 1 ч. Переносят в этилацетат, водную фазу отделяют и экстрагируют три раза этилацетатом, объединенные органические фазы промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия, а фильтрат концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле, элюируя смесью дихлорметана, метанола и 28%-го водного аммиака 97/3/0,3. Получают 0,31 г продукта в виде бесцветного масла. 6.4. Этил-[(фенилоксикарбонил)окси]ацетат. Раствор 25 г (240 ммоль) этилгликолята и 55 мл (315 ммоль) диизопропилэтиламина в 500 мл толуола медленно смешивают при температуре окружающей среды с 32 мл (256 ммоль) фенилхлорформиата. Продолжают перемешивание при температуре окружающей среды в течение 2 ч. Образовавшуюся соль отделяют и фильтрат концентрируют при пониженном давлении. Получают 53,7 г маслянистого продукта, который используют как есть на следующей стадии. 6.5. Этил-2-(3,4'-дифтор-1,1'-бифенил-4-ил)этил)амино)карбонил)оксиацетат. Раствор 0,31 г (1,33 ммоль) 2-(3,4'-дифтор-1,1'-бифенил-4-ил)этанамина, полученного на стадии 6.3,и 0,33 г (1,46 ммоль) этил-[(фенилоксикарбонил)окси]ацетата, полученного на стадии 6.4, в 10 мл толуола нагревают при 60 С в течение 18 ч. Его оставляют возвращаться к температуре окружающей среды,нерастворимое вещество отделяют фильтрацией и фильтрат концентрируют при пониженном давлении. Остаток переносят в дихлорметан, объединенные органические фазы промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана 30/70. Получают 0,33 г чистого продукта в виде белого твердого вещества. Т.пл. (С): 73-75 С. 6.6. 2-(Метиламино)-2-оксоэтила 2-(3,4'-дифтор-1,1'-бифенил-4-ил)этилкарбамат. Повторяют методику примера 2 (стадия 2.2). Начиная с 0,33 г (0,9 ммоль) этил-2-(3,4'-дифтор 1,1'-бифенил-4-ил)этил)амино)карбонил)оксиацетата, полученного на стадии 6.5, и 1,35 мл (2,7 ммоль) раствора метиламина (2 М) в тетрагидрофуране, после перекристаллизации из этилацетата получают 0,210 г чистого продукта в виде белого твердого вещества. ЖХ-МС: М+Н = 349. Т.пл. (С): 164-166 С. 1 Н ЯМР (CDCl3)(м.д.): 2,90 (d, 3 Н); 3,0 (t, 2H); 3,50 (q, 2H); 4,60 (s, 2H); 5,0 (широкий s, 1H); 6,10 7.1. (4'-Фтор-1,1'-бифенил-4-ил)ацетонитрил. Используют способ, описанный в примере 3 (стадия 3.2). Начиная с 4,12 г (32,48 ммоль) (4 бромфенил)ацетонитрила, 5 г (35,73 ммоль) 4-фторфенилбороновой кислоты, 32,48 мл (64,96 ммоль) водного раствора карбоната натрия (2 М) и 1,24 г (1,07 ммоль) тетракис(трифенилфосфин)палладия, после хроматографии на силикагеле и элюирования смесью этилацетата и циклогексана 15/85 получают 3,3 г чистого продукта в виде белого твердого вещества. Т.пл. (С): 100-102 С. 7.2. 1-(4'-Фтор-1,1'-бифенил-4-ил)циклопропанкарбонитрил. Суспензию 3,1 г (14,7 ммоль) (4'-фтор-1,1'-бифенил-4-ил)ацетонитрила, полученного на стадии 7.1,2,4 мл (29,4 ммоль) 1-бром-2-хлорэтана и 0,067 г (0,294 ммоль) N-триэтилбензиламмоний хлорида, нагретую приблизительно до 50 С, смешивают по каплям с 6,7 г (102,8 ммоль) водного 60%-ного раствора гидроксида калия. Перемешивание продолжают при 50 С в течение 18 ч. Смесь оставляют возвращаться к температуре окружающей среды, нерастворимое вещество отделяют фильтрацией и фильтрат переносят в этилацетат. Водную вазу отделяют и экстрагируют три раза этилацетатом. Объединенные органические фазы промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана 10/90. Получают 2,97 г чистого продукта в виде белого твердого вещества. Т.пл. (С): 70-72 С. 7.3. 1-[1-(4'-Фтор-1,1-бифенил-4-ил)циклопропил]метанамин. Раствор 2,5 г (10 ммоль) 1-(4'-фтор-1,1'-бифенил-4-ил)циклопропилкарбонитрила, полученного на стадии 7.2, в 50 мл тетрагидрофурана, охлажденный приблизительно до 0 С, смешивают по каплям с 10 мл (10 ммоль) раствора литийалюминийгидрида (1 М) в тетрагидрофуране. Продолжают перемешивание при 0 С в течение 1 ч и затем при температуре окружающей среды в течение 18 ч. Смесь фильтруют на- 12008801 бумаге и затем фильтрат обрабатывают 0,4 мл воды и 0,4 мл водного 15%-го раствора гидроксида натрия и затем 1,2 мл воды. Смесь перемешивают при температуре окружающей среды в течение 1 ч. Переносят ее в этилацетат, водную фазу отделяют и дважды экстрагируют этилацетатом, объединенные органические фазы промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Получают 2,1 г продукта в виде белого твердого вещества, которое используют как есть на следующей стадии. Т.пл. (С): 100-102 С. 7.4. Этил-1-4'-фтор-1,1'-бифенил-4-ил)циклопропил)метил)амино)карбонил)окси)ацетат. Используют методику, описанную в примере 6 (стадия 6.4). Начиная с 2,4 г (10 ммоль) 1-[1-(4'фтор-1,1'-бифенил-4-ил)циклопропил]метанамина, полученного на стадии 7.3, и 2,7 г (12 ммоль) этил[(фенилоксикарбонил)окси]ацетата, полученного в примере 6 (стадия 6.2), после хроматографии на силикагеле и элюирования смесью 15/85 этиламина и циклогексана получают 2,7 г чистого продукта в виде белого твердого вещества. Т.пл. (С): 96 С. 7.5. 2-Амино-2-оксоэтила 1-(4'-фтор-1,1'-бифенил-4-ил)циклопропилметилкарбамат. Раствор 1,4 г (3,77 ммоль) этил-1-4'-фтор-1,1'-бифенил-4-ил)циклопропил)метил)амино) карбонил)окси)ацетата, полученного на стадии 7.4, в 10 мл смеси метанола и тетрагидрофурана 1/1 смешивают с 11 мл (75 ммоль) раствора аммиака (7 н.) в метаноле. Перемешивание продолжают при температуре окружающей среды в течение 12 ч. После концентрирования при пониженном давлении полученный остаток очищают хроматографией на силикагеле, элюируя смесью дихлорметана и метанола 97/3, с последующей перекристаллизацией из этилацетата. Получают 0,738 г чистого продукта в виде белого твердого вещества. ЖХ-МС: М+Н = 343. Т.пл. (С): 139-141 С. 1 Н ЯМР (CDCl3)(м.д.): 1,0 (s, 4H); 3,50 (d, 2H); 4,55 (s, 2H); 4,90 (широкий s, 1H); 5,50 (широкий s,1H); 5,90 (широкий s, 1H); 7,15 (t, 2H); 7,30-7,70 (неразрешенный мультиплет, 6 Н). Пример 8 (соединение 197). 2-(Метиламино)-2-оксоэтила 2-(3-фенилоксифенил)этилкарбамат. 8.1. 2-(3-Фенилоксифенил)этанамин. 1,38 г (6,59 ммоль) 3-феноксифенилацетонитрила и 1,57 г (6,59 ммоль) гексагидрата хлорида кобальта(II) растворяют в 25 мл метанола. Раствор охлаждают в бане с ледяной водой и порциями добавляют 1,74 г (46 ммоль) боргидрида натрия. Реакционную смесь перемешивают в течение ночи при температуре окружающей среды. Фильтруют ее на бумаге и промывают два раза по 25 мл метанола. Фильтрат концентрируют при пониженном давлении и остаток переносят в 50 мл водной соляной кислоты (1 н.) и 25 мл эфира. После того как фазы отчетливо отделяются, их разделяют. Водную фазу промывают три раза по 25 мл эфира. Водную фазу подщелачивают 10 мл водного 36%-ного гидроксида натрия и экстрагируют три раза по 50 мл дихлорметана. Экстракты промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Получают 0,67 г продукта в виде коричнево-оранжевого масла, которое используют как есть на следующей стадии. 8.2. Этил-2-(3-фенилоксифенил)этиламино)карбонил)окси)ацетат. Смесь 0,66 г (3,09 ммоль) 2-(3-фенилоксифенил)этанамина, полученного на стадии 8.1, и 0,96 г(4,28 ммоль) этил-[(фенилоксикарбонил)окси]ацетата, описанного в примере 6 на стадии 6.4, в 15 мл толуола нагревают при 60 С в течение ночи. Фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата 85/15, затем 70/30. Получают 0,80 г продукта в виде масла, которое используют как есть на следующей стадии. 8.3. 2-(Метиламино)-2-оксоэтила (2-(3-фенилоксифенил)этилкарбамат. 0,70 г (2,30 ммоль) этил-2-(3-фенилоксифенил)этиламино)карбонил)окси)ацетата, полученного на стадии 8.2, растворяют в смеси 4,5 мл раствора (2 М) метиламина в тетрагидрофуране и 4,5 мл метанола. Раствор оставляют на ночь при температуре окружающей среды. Фильтрат концентрируют при пониженном давлении, и остаток очищают хроматографией на силикагеле, элюируя смесью дихлорметана и метанола 98/2, затем 96/4. Продукт затем перекристаллизовывают из смеси этилацетата и диизопропилового эфира. Получают 0,51 г мелких белых кристаллов. ЖХ-МС: М+Н = 329. Т.пл. (С): 82-84 С. 9.1. 3-(4-Бромбензил)-1,3-оксазолидин-2,4-дион. Раствор 1,50 г (6 ммоль) 4-бромбензилбромида и 0,73 г (7,2 ммоль) 1,3-оксазолидин-2,4-диона в 6 мл тетрагидрофурана смешивают по каплям с раствором 1,39 г (12 ммоль) 1,1,3,3-тетраметилгуанидина в 6 мл тетрагидрофурана. Смесь перемешивают при температуре окружающей среды в течение ночи. Добавляют 50 мл ледяной водной соляной кислоты (1 н.) и 100 мл этилацетата. Органическую фазу отделяют после отстаивания и последовательно промывают 25 мл воды и 25 мл насыщенного водного раствора хлорида натрия. Ее сушат над сульфатом натрия, и фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата 80/20. Получают 1,14 г продукта в виде белых кристаллов. Т.пл. (С): 88-90 С. 9.2. 3-(4-Пиридин-2-илбензил)-1,3-оксазолидин-2,4-дион. В атмосфере аргона смесь 0,59 г (2,18 ммоль) 3-(4-бромбензил)-1,3-оксазолидин-2,4-диона, полученного на стадии 9.1, 1,60 г (4,35 ммоль) пиридин-2-ил-три-н-бутилстаннана, 0,28 г (6,6 ммоль) хлорида лития и 0,125 г (0,10 ммоль) тетракис(трифенилфосфин)палладия в 15 мл толуола кипятят с обратным холодильником в течение ночи. Охлаждают до температуры окружающей среды, фильтруют на бумаге и промывают последовательно 10 мл толуола, 10 мл этилацетата и 10 мл толуола. Фильтраты концентрируют при пониженном давлении. Остаток переносят в 50 мл ацетонитрила и промывают четыре раза по 25 мл н-гексана. Ацетонитрильную фазу концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата 70/30, затем 60/40. Получают 0,428 г продукта в виде белого порошка. Т.пл. (С): 166 С. 9.3. 2-(Метиламино)-2-оксоэтила 4-пиридин-2-илбензилкарбамат. 0,42 г (1,56 ммоль) 3-(4-пиридин-2-илбензил)-1,3-оксазолидин-2,4-диона, полученного на этапе 9.2,растворяют в смеси 3,5 мл раствора (2 М) метиламина в тетрагидрофуране и 3,5 мл метанола. Раствор оставляют на ночь при температуре окружающей среды. Добавляют 1,5 г оксида кремния и смесь концентрируют до сухости при пониженном давлении, затем очищают хроматографией на силикагеле,элюируя смесью дихлорметана и метанола 94/6, затем 93/7. Продукт перекристаллизовывают из смеси изопропанола и диизопропилового эфира. Получают 0,30 г продукта в виде белых хлопьев. ЖХ-МС: М+Н = 300. Т.пл. (С): 151-153 С. 1 Н ЯМР (ДMCO-d6)(м.д.): 8,6 (d, 1H), 8,05 (d, 2H), 7,95-7,7 (m, 4H, включая 2, заменяемый в D2O),7,35 (d, 2 Н), 7,3 (m, 1 Н), 4,35 (s, 2H), 4,25 (d, 2H, заменяемый на s в D2O), 2,6 (d, 3 Н, заменяемый на s в 10.1. (4-Изохинолин-4-илфенил)метанол. В атмосфере аргона смесь 1,09 г (7,2 ммоль) (4-гидроксиметил)фенилбороновой кислоты, 1,24 г (6 ммоль) 4-бромизохинолина и 0,28 г (0,24 ммоль) тетракис(трифенилфосфин)палладия в 50 мл толуола и 10 мл водного раствора карбоната натрия (2 М) кипятят с обратным холодильником в течение ночи. Фильтрат концентрируют при пониженном давлении и остаток переносят в 150 мл этилацетата и 40 мл воды. После отделения и разделения фаз, органическую фазу последовательно промывают 20 мл воды и 20 мл насыщенного водного раствора хлорида натрия. Сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата 60/40, затем 40/60. Получают 1,12 г белого твердого вещества. Т.пл. (С): 130 С. 10.2. 3-(4-Изохинолин-4-илбензил)-1,3-оксазолидин-2,4-дион. 1,10 г (4,67 ммоль) (4-изохинолин-4-илфенил)метанола, полученного на стадии 10.1, растворяют в 10 мл хлороформа и добавляют по каплям 1,4 мл (19 ммоль) тионилхлорида. Смесь перемешивают при- 14008801 температуре окружающей среды в течение ночи и фильтрат концентрируют до сухости при пониженном давлении. Остаток упаривают два раза совместно с 10 мл дихлорэтана. Остаток переносят в 15 мл тетрагидрофурана. Добавляют 0,56 г (5,54 ммоль) 1,3-оксазолидин-2,4-диона, с последующим добавлением по каплям раствора 1,60 г (13,9 ммоль) 1,1,3,3-тетраметилгуанидина в 5 мл тетрагидрофурана. Смесь кипятят с обратным холодильником в течение ночи. Охлаждают ее до температуры окружающей среды. Добавляют 20 мл ледяной воды и 100 мл этилацетата. После отстаивания фазы разделяют. Органическую фазу промывают три раза 10 мл воды и 20 мл насыщенного водного раствора хлорида натрия. Сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата 50/50, затем 40/60. Получают 0,84 г продукта в виде твердой желтой пены. Т.пл. (С): 65 С. 10.3. 2-Амино-2-оксоэтила 4-изохинолин-4-илбензилкарбамат. 0,34 г (1,06 ммоль) 3-(4-изохинолин-4-илбензил)-1,3-оксазолидин-2,4-диона, полученного на стадии 10.2, растворяют в смеси 6 мл раствора (7 н.) аммиака в метаноле и 6 мл тетрагидрофурана. Раствор оставляют при температуре окружающей среды в течение ночи. Добавляют 10 мл дихлорметана и 1 г оксида кремния и смесь концентрируют до сухости при пониженном давлении, затем очищают хроматографией на силикагеле, элюируя смесью дихлорметана и метанола 95/5, затем 92/8. Продукт перекристаллизовывают из смеси изопропанола и диизопропилового эфира. Получают 0,26 г продукта в виде белого хлопковидного вещества. ЖХ-МС: М+Н = 336. Т.пл. (С): 181-183 С. 1 Н ЯМР (ДМСО-d6)(м.д.): 9,3 (s, 1H), 8,4 (s, 1H), 8,2 (d, 1H), 7,9-7 (m, 4H, включая 1, заменяемый в D2O), 7,5 (s, 4H), 7,3 (s, 1H, заменяемый в D2 О), 7,2 (s, 1 Н), 4,4 (s, 2H), 4,35 (d, 2H, заменяемый на s в 11.1. 4'-(2-Гидроксиэтил)-3-бифенилкарбонитрил. Смесь 3 г (14,92 ммоль) 2-(4-бромфенил)этанола, 2,85 г (19,40 ммоль) 3-цианофенилбороновой кислоты, 5,15 г (37,30 ммоль) карбоната калия, 4,81 г (14,92 ммоль) тетра-н-бутиламмонийбромида и 0,067 г (0,30 ммоль) диацетата палладия в 15 мл воды нагревают при 100 С в атмосфере аргона в течение ночи. Охлаждают до температуры окружающей среды, разбавляют водой и экстрагируют этилацетатом. Органическую фазу сушат над сульфатом натрия и упаривают. Затем ее очищают хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата 70/30, затем 50/50, с получением 2,90 г продукта в виде масла, которое используют как есть на следующей стадии. 11.2. 4'-[2-(2,4-Диоксо-1,3-оксазолидин-3-ил)этил]-3-бифенилкарбонитрил. Раствор 2,90 г (12,99 ммоль) 4'-(2-гидроксиэтил)-3-бифенилкарбонитрила, полученного на стадии 11.1, 2,7 мл (14,29 ммоль) триэтиламина и 0,15 г (1,30 ммоль) 4-диметиламинопиридина в 30 мл дихлорметана, охлажденный на бане со льдом, смешивают с 1,1 мл (14,29 ммоль) метансульфонилхлорида. Затем смесь перемешивают при температуре окружающей среды в течение 2 ч. Добавляют 100 мл дихлорметана и 30 мл насыщенного водного раствора хлорида натрия. Органическую фазу отделяют после отстаивания, сушат над сульфатом натрия и упаривают до сухости с получением 3,5 г продукта в виде масла. Продукт снова растворяют в 60 мл тетрагидрофурана и добавляют 1,40 г (13,94 ммоль) 1,3 оксазолидин-2,4-диона и 2,87 мл (23,23 ммоль) 1,1,3,3-тетраметилгуанидина. Смесь нагревают при 70 С в течение ночи. Упаривают ее до сухости. Остаток переносят в смесь этилацетата и насыщенного водного раствора хлорида натрия. Органическую фазу отделяют после отстаивания, сушат над сульфатом натрия и упаривают до сухости. Остаток очищают хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата 60/40, затем 50/50, с получением 3,3 г продукта в виде белого твердого вещества. Т.пл. (С): 121-123. 11.3. 2-(Метиламино)-2-оксоэтила 2-(3'-циано-1,1'-бифенил-4-ил)этилкарбамат. 2,0 г (6,53 ммоль) 4'-[2-(2,4-диоксо-1,3-оксазолидин-3-ил)этил]-3-бифенилкарбонитрила, полученного на стадии 11.2, растворяют в смеси 13 мл метанола и 9,8 мл 2 н. раствора метиламина (19,6 ммоль) в тетрагидрофуране. Раствор оставляют для взаимодействия в течение ночи и затем упаривают до сухости,и остаток очищают хроматографией на силикагеле, элюируя смесью дихлорметана и метанола 96/4, затем 95/5. Продукт перекристаллизовывают из смеси этилацетата и диизопропилового эфира с получением 1,07 г продукта в виде белого порошка. Т.пл. (С): 157-159. 12.1. [4-(4-Фенил-1 Н-имидазол-1-ил)фенил]метанол. 3,04 г (20 ммоль) 4-(гидроксиметил)фенилбороновой кислоты, 1,44 г (10 ммоль) 4-фенилимидазола,2,8 мл (20 ммоль) триэтиламина и 1,64 мл (20 ммоль) пиридина растворяют в 20 мл диметилформамида. Добавляют 2,72 г (15 ммоль) диацетата меди и смесь перемешивают в течение 24 ч при температуре окружающей среды. Ее разбавляют 200 мл дихлорметана и 200 мл водного 28%-го раствора аммиака. После отделения и разделения фаз водную фазу экстрагируют 100 мл дихлорметана. Органические фазы промывают 50 мл насыщенного водного раствора хлорида натрия, сушат над сульфатом натрия и упаривают до сухости. Продукт очищают хроматографией на силикагеле, элюируя смесью дихлорметана и метанола 97/3, затем 95/5. Продукт перекристаллизовывают из смеси толуола и диизопропилового эфира с получением 1,82 г продукта в виде белых кристаллов. Т.пл. (С): 137-139. 12.2. 2-Амино-2-оксоэтила [4-(4-фенил-1 Н-имидазол-1-ил)фенил]метилкарбамат. Раствор 1,0 г (4 ммоль) [4-(4-фенил-1 Н-имидазол-1-ил)фенил]метанола, полученного на стадии 12.1, 0,485 г (4,80 ммоль) 1,3-оксазолидин-2,4-диона и 1,15 г (4,38 ммоль) трифенилфосфина в 16 мл тетрагидрофурана, охлажденный в бане с ацетоном и льдом, смешивают по каплям с 0,80 г (4 ммоль) диизопропилазодикарбоксилата в растворе в 2 мл тетрагидрофурана. Смесь затем снова нагревают до температуры окружающей среды и перемешивают в течение ночи. Берут 9 мл раствора, к которым добавляют 12 мл 7 н. раствора аммиака (84 ммоль) в метаноле. Смесь оставляют для взаимодействия в течение ночи,смешивают с 4 г оксида кремния и упаривают до сухости. Продукт очищают хроматографией на силикагеле, элюируя смесью дихлорметана и метанола 95/5, затем 93/7 и 90/10. Продукт перекристаллизовывают из смеси метанола и диизопропилового эфира с получением 0,429 г продукта в виде белых кристаллов. Т.пл. (С): 200-203. ЖХ-МС: М+Н = 351. 1 Н ЯМР (ДМСО)(м.д.): 8,30 (s, 1H), 8,20 (s, 1H), 7,80 (d+m, 3H), 7,65 (d, 2 Н), 7,45-7,20 (m, 7H),4,35 (s, 2H), 4,25 (d, 2H). Пример 13 (соединение 224). 2-Амино-2-оксоэтила 2-[4-(1 Н-пирроло[2,3-b]пиридин-1-ил)фенил] этилкарбамат. 13.1. 2-[4-(1H-Пирроло[2,3-b]пиридин-1-ил)фенил]этанол. Смесь 1,24 г (5 ммоль) 2-(4-йодфенил)этанола, 0,62 г (5,25 ммоль) 7-азаиндола, 2,33 г (11,0 ммоль) фосфата калия, 0,082 г (1,0 ммоль) N,N'-диметилэтилендиамина и 0,095 г (0,50 ммоль) йодида одновалентной меди в 4 мл толуола нагревают при 80 С в течение ночи при тщательном перемешивании в атмосфере аргона. Смесь охлаждают до температуры окружающей среды и разбавляют 150 мл этилацетата и 50 мл воды. После отстаивания и разделения фаз, органическую фазу промывают 25 мл воды и 25 мл насыщенного водного раствора хлорида натрия. Ее сушат над сульфатом натрия и упаривают до сухости. Остаток очищают хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата 70/30,затем 60/40 и 50/50, с получением 1,05 г продукта в виде масла. 13.2. 3-2-[4-(1 Н-Пирроло[2,3-b]пиридин-1-ил)фенил]этил-1,3-оксазолидин-2,4-дион. Раствор 1,0 г (4,20 ммоль) 2-[4-(1 Н-пирроло[2,3-b]пиридин-1-ил)фенил]этанола, полученного на стадии 13.1, 0,51 г (5,04 ммоль) 1,3-оксазолидин-2,4-диона и 1,21 г (4,62 ммоль) трифенилфосфина в 16 мл тетрагидрофурана, охлажденный на бане с ацетоном и льдом, по каплям смешивают с 0,84 г (4,2 ммоль) диизопропилазодикарбоксилата в растворе в 2 мл тетрагидрофурана. Смесь затем снова нагревают до температуры окружающей среды и перемешивают в течение ночи. Добавляют 4 г оксида кремния,и смесь упаривают до сухости. Остаток очищают хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата 70/30, затем 60/40, затем 50/50 и 40/60 с получением 1,52 г продукта в виде клейкого твердого вещества, которое используют как есть на следующей стадии.- 16008801 13.3. 2-Амино-2-оксоэтила 2-[4-(1 Н-пирроло[2,3-b]пиридин-1-ил)фенил]этилкарбамат. 0,80 г (2,49 ммоль) 3-2-[4-(1 Н-пирроло[2,3-b]пиридин-1-ил)фенил]этил-1,3-оксазолидин-2,4 диона, полученного на стадии 13.2, растворяют в 6 мл тетрагидрофурана и добавляют 12 мл 7 н. раствора аммиака (84 ммоль) в метаноле. Смесь оставляют реагировать в течение ночи при температуре окружающей среды. Добавляют 2,5 г оксида кремния и смесь упаривают до сухости. Остаток очищают хроматографией на силикагеле, элюируя смесью дихлорметана и метанола 98/2, затем 96/4 и 94/6. Продукт перекристаллизовывают из смеси этилацетата и диизопропилового эфира с получением 0,478 г продукта в виде белых хлопьев. Т.пл. (С): 110-112. ЖХ-МС: М+Н = 339. 1 Н ЯМР (ДМСО)(м.д.): 8,30 (dd, 1H), 8,05 (d, 1H), 7,90 (d, 1H), 7,80 (d, 2 Н), 7,30 (d+m, 3H), 7,257,10 (m, 3H), 6,70 (d, 1H), 4,30 (s, 2H), 3,25 (широкий t, 2 Н), 2,80 (t, 2H). Пример 14 (соединение 196). 2-(Метиламино)-2-оксоэтил 2-4-[(4-хлорфенил)окси]фенил этилкарбамат. 14.1. 2-(4-[(4-Хлорфенил)окси]фенил)этанол. Смесь 1,14 г (4,60 ммоль) 2-(4-йодфенил)этанола, 0,88 г (6,89 ммоль) 4-хлорфенола, 2,99 г (9,20 ммоль) карбоната цезия, 0,14 г (1,38 ммоль) N,N-диметилглицина и 0,087 г (0,46 ммоль) йодида одновалентной меди в 4 мл диоксана нагревают при 90 С в течение 24 ч при тщательном перемешивании в атмосфере аргона. Ее охлаждают до температуры окружающей среды и переносят в 150 мл этилацетата и 50 мл воды. После отстаивания и разделения фаз органическую фазу промывают 25 мл воды и 25 мл насыщенного водного раствора хлорида натрия, сушат над сульфатом магния и упаривают до сухости. Остаток очищают хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата 85/15, затем 75/25, с получением 0,68 г продукта в виде масла. 14.2. 3-(2-(4-[(4-Хлорфенил)окси]фенил)этил)-1,3-оксазолидин-2,4-дион. Раствор 1,0 г (4,02 ммоль) 2-(4-[(4-хлорфенил)окси]фенил)этанола, полученного согласно примеру 14.1, и 1,1 мл (7,89 ммоль) триэтиламина в 12 мл дихлорметана, охлажденный на бане со льдом, смешивают с раствором 0,60 г (5,24 ммоль) метансульфонилхлорида в 2 мл дихлорметана. Объединенные растворы затем перемешивают при температуре окружающей среды в течение 2 ч. Разбавляют их 25 мл воды и 75 мл дихлорметана. После отстаивания и разделения фаз органическую фазу промывают 25 мл воды и 25 мл насыщенного водного раствора хлорида натрия, сушат над сульфатом натрия и упаривают до сухости с получением 1,32 г продукта в виде масла. Этот продукт снова растворяют в 12 мл тетрагидрофурана. Добавляют 0,50 г (5 ммоль) 1,3 оксазолидин-2,4-диона и раствор 0,92 г (8,0 ммоль) 1,1,3,3-тетраметилгуанидина в 4 мл тетрагидрофурана. Смесь затем кипятят с обратным холодильником в течение ночи. Охлаждают на бане со льдом и добавляют 25 мл водного 0,1 н. раствора соляной кислоты и 100 мл этилацетата. После того как фазы отстоялись, органическую фазу отделяют и промывают два раза 25 мл воды, затем 25 мл насыщенного водного раствора хлорида натрия, сушат над сульфатом натрия и упаривают до сухости. Остаток очищают хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата 85/15, затем 75/25 и 65/35, с получением 1,20 г продукта в виде белого твердого вещества. Т.пл. (С): 105-107. 14.3. 2-(Метиламино)-2-оксоэтила 2-4-[(4-хлорфенил)окси]фенилэтилкарбамат. 0,46 г (1,39 ммоль) 3-(2-(4-[(4-хлорфенил)окси]фенил)этил)-1,3-оксазолидин-2,4-диона, полученного на стадии 14.2, повторно растворяют в смеси 3 мл тетрагидрофурана и 6 мл метанола. Добавляют 3 мл 2 М раствора метиламина (6 ммоль) в тетрагидрофуране. Смесь оставляют для взаимодействия при температуре окружающей среды в течение ночи, затем добавляют 2 г оксида кремния и смесь упаривают до сухости. Остаток очищают хроматографией на силикагеле, элюируя смесью дихлорметана и метанола 98/2, затем 96/4 и 94/6. Продукт перекристаллизовывают из смеси этилацетата и диизопропилового эфира с получением 0,40 г продукта в виде белого порошка. Т.пл. (С): 133-135. ЖХ-МС: М+Н = 363. 1 Н ЯМР (ДМСО)(м.д.): 7,70 (m, 1H), 7,40 (d, 2H), 7,25 (d+m, 3 Н), 6,95 (m, 4 Н), 4,30 (s, 2 Н), 3,25(m, 2 Н), 2,70 (t, 2H), 2,55 (d, 3 Н). В следующей ниже табл. 1 приведены примеры химических структур и физических свойств некоторых соединений по изобретению. В этой таблице все соединения находятся в форме свободного основания; изопропил, н-бутил и трет-бутил представляют собой изопропильную, линейную бутильную и третичную бутильную группы соответственно. Соединения по изобретению подвергали фармакологическим испытаниям, позволяющим определить их ингибиторный эффект в отношении фермента ГАЖК (гидролаза амидов жирных кислот). Ингибиторную активность демонстрировали в радиоферментном анализе, основанном на измерении количества продукта (этаноламина[1-3 Н]) гидролиза анандамид[этаноламин 1-3 Н] посредством ГАЖК (Life Sciences (1995), 56, 1999-2005 и Journal of Pharmacology and Experimental Therapeutics (1997),283, 729-734). Соответственно, мозг мышей (без мозжечка) удаляют и хранят при -80 С. Гомогенаты мембран готовят к моменту использования путем гомогенизации тканей в Polytron в 10 мМ трис-HCl буфере (рН 8,0), содержащем 150 мМ NaCl и 1 мМ ЭДТА (этилендиаминтетрауксусной кислоты). Затем проводят ферментативную реакцию в 70 мкл буфера, содержащего бычий сывороточный альбумин без жирных кислот (1 мг/мл). Друг за другом добавляют исследуемые вещества в различных концентрациях,- 24008801 анандамид[этаноламин 1-3 Н] (удельная активность: 15-20 Ки/ммоль), разведенный до 10 мкМ холодным анандамидом, и мембранный препарат (400 мкг замороженной ткани на анализ). Через 15 мин при 25 С ферментативную реакцию завершают добавлением 140 мкл смеси хлороформ/метанол (2:1). Полученную смесь перемешивают в течение 10 мин, затем центрифугируют в течение 15 мин при 3500g. В аликвоте(30 мкл) водной фазы, содержащей этаноламин [1-3 Н], осуществляют подсчет импульсов в жидкой фазе. В данных условиях большинство активных соединений по изобретению имеют значения ИК 50 (концентрации, ингибирующей на 50% контрольную ферментативную активность ГАЖК) от 0,001 до 1 мкМ. В табл. 2 ниже представлены значения ИК 50 для некоторых соединений по изобретению. Таблица 2 Очевидным образом следует, что соединения по изобретению оказывают ингибиторный эффект в отношении фермента ГАЖК.In vivo активность соединений по изобретению оценивали в тесте на аналгезию. Соответственно интраперитонеальное (и.п.) введение ФБХ (фенилбензохинона, 2 мг/кг в 0,9%-м растворе хлорида натрия, содержащем 5% этанола) самцам мышей линии OF1, имеющим массу от 25 до 30 г, вызывает абдоминальные растяжения, в среднем 30 скручиваний или сокращения в течение периода времени от 5 до 15 мин после инъекции. Исследуемые соединения вводят перорально в суспензии в твин-80 в концентрации 0,5% за 60 или 120 мин до введения ФБХ. В этих условиях большинство сильнодействующих соединений по изобретению снижают число растяжений, индуцированных ФБХ, на 35-70% в интервале доз от 1 до 30 мг/кг. В табл. 3 ниже представлены результаты теста на аналгезию для некоторых соединений по изобретению. Таблица 3(б) 3 мг/кг п.о. за 1 ч Фермент ГАЖК (Chemistry and Physics of Lipids, (2000), 108, 107-121) катализирует гидролиз эндогенных производных амидов и сложных эфиров различных жирных кислот, таких как Nарахидоноилэтаноламин (анандамид), N-пальмитоилэтаноламин, N-олеоилэтаноламин, олеамид или 2 арахидоноилглицерин. Эти производные оказывают различное фармакологическое действие посредством взаимодействия, среди прочего, с каннабиноидными и ваниллоидными рецепторами. Соединения по изобретению блокируют такой путь расщепления и увеличивают уровень в тканях этих эндогенных веществ. В связи с этим их можно использовать в предупреждении и лечении патологий, в которых участвуют эндогенные каннабиноиды и/или любые другие субстраты, метаболизируемые ферментом ГАЖК. Можно упомянуть, например, следующие заболевания и расстройства: боль, особенно острую или хроническую боль нейрогенного типа: мигрень, нейропатическую боль,включая формы, связанные с вирусом герпеса и с диабетом; острую или хроническую боль, связанную с воспалительными заболеваниями: артритом, ревматоидным артритом, остеоартритом, спондилитом, подагрой, васкулитом, болезнью Крона, синдромом раздраженного кишечника; острую или хроническую периферическую боль; головокружение, рвоту, тошноту, особенно следующие после химиотерапии; расстройства приема пищи, особенно анорексию и кахексию различных видов; неврологические и психиатрические патологии: дрожание, дискинезию, дистонию, спастичность,- 25008801 обсессивно-компульсивное поведение, синдром Туретта, все формы депрессии и тревоги любого вида и причины, расстройства настроения, психозы; острые и хронические нейродегенеративные заболевания: болезнь Паркинсона, болезнь Альцгеймера, старческое слабоумие, хорею Хантингтона, поражения,связанные с ишемией мозга, с краниальной и медуллярной травмой; эпилепсию; расстройства сна, включая апное во сне; сердечно-сосудистые заболевания, особенно гипертензию, сердечные аритмии, артериосклероз,сердечные приступы, ишемии сердца; ишемию почек; раковые заболевания: доброкачественные опухоли кожи, папилломы и опухоли мозга, опухоли простаты, опухоли мозга (глиобластомы, медуллоэпителиомы, медуллобластомы, нейробластомы, опухоли эмбрионального происхождения, астроцитомы, астробластомы, эпендиомы, олигодендроглиомы, опухоль сплетения, нейроэпителиомы, эпифизарная опухоль, эпендимобластомы, злокачественные менингиомы, саркоматозы, злокачественные меланомы, шванномы); расстройства иммунной системы, особенно аутоиммунные заболевания; псориаз, красную волчанку, заболевания соединительной ткани или коллагеновые заболевания, синдром Шегрена, анкилозирующий спондилоартрит, недифференцированный спондилоартрит, болезнь Бехчета, гемолитические аутоиммунные анемии, множественный склероз, амиотрофический латеральный склероз, амилозы, отторжение трансплантатов, заболевания, поражающие плазмоцитарные линии; аллергические заболевания: аллергическую реакцию немедленного или замедленного типа, аллергические риниты или конъюктивиты, контактные дерматиты; паразитические, вирусные или бактериальные инфекционные заболевания: ВИЧ, менингит; воспалительные заболевания, особенно заболевания суставов: артрит, ревматоидный артрит, остеоартрит,спондилит, подагру, васкулит, болезнь Крона, синдром раздраженного кишечника, остеопороз; глазные расстройства; глазную гипертензию, глаукому; легочные расстройства: заболевания дыхательных путей, бронхоспазмы, кашель, астму, хронический бронхит, хроническую непроходимость дыхательных путей, эмфизему; желудочно-кишечные заболевания: синдром раздраженного кишечника, кишечные воспалительные расстройства, язвы, диареи; недержание мочи и воспаление мочевого пузыря. Применение соединения формулы (I) в форме основания, соли, гидрата или фармацевтически приемлемого сольвата для изготовления лекарства, предназначенного для лечения вышеуказанных патологий, образует неотъемлемую часть данного изобретения. Изобретение, кроме того, относится к лекарствам, которые содержат соединение формулы (I), или соль, или гидрат, или фармацевтически приемлемый сольват соединения формулы (I). Эти лекарства используют в терапии, особенно при лечении вышеуказанных патологий. В соответствии с другим аспектом настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве действующего начала по меньшей мере одно соединение по изобретению. Такие фармацевтические композиции содержат эффективную дозу соединения по изобретению, или соли, или гидрата, или фармацевтически приемлемого сольвата указанного соединения и возможно один или более чем один фармацевтически приемлемый эксципиент. Указанные эксципиенты выбирают в соответствии с фармацевтической формой и желательным способом введения из обычных эксципиентов, которые известны специалисту в данной области. В фармацевтических композициях по настоящему изобретению для перорального, подъязычного, подкожного,внутримышечного, внутривенного, местного, локального, интратекального, интраназального, трансдермального, легочного, глазного или ректального введения действующее начало формулы (I), приведенной выше, или его соль, сольват или гидрат, когда это приемлемо, можно вводить в виде одиночной дозы для введения, в виде смеси с традиционными фармацевтическими эксципиентами, животным и человеку с целью профилактики или лечения вышеуказанных расстройств или заболеваний. Подходящие формы введения стандартной дозы включают пероральные формы, такие как таблетки,мягкие и твердые желатиновые капсулы, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, формы для подъязычного, трансбуккального, интратрахеального, внутриглазного и интраназального введения и для введения посредством ингаляции, формы для подкожного, внутримышечного или внутривенного введения, и формы для ректального или вагинального введения. Для местного введения соединения по изобретению можно использовать в кремах, мазях или лосьонах. В качестве примера форма введения единичной дозы соединения по изобретению в виде таблетки может содержать следующие компоненты:- 26008801 Соединения по изобретению 50,0 мг Маннит 223,75 мг Кроскармеллоза натрия 6,0 мг Кукурузный крахмал 15,0 мг Гидроксипропилметилцеллюлоза 2,25 мг Стеарат магния 3,0 мг Указанные формы единичной дозы содержат дозу, позволяющую ежесуточно вводить от 0,01 до 20 мг действующего начала на кг массы тела, в зависимости от фармацевтической формы. В отдельных случаях могут быть приемлемы более высокие или более низкие дозы; такие дозы также являются частью данного изобретения. Согласно традиционной практике, подходящую для каждого пациента дозу определяет врач в соответствии со способом введения, массой и реакцией упомянутого пациента. В соответствии с другим аспектом данное изобретение также относится к способу лечения указанных выше патологий, включающему введение эффективной дозы соединения по изобретению, одной из его фармацевтически приемлемых солей, или сольвата, или гидрата указанного соединения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) в которой n представляет собой целое число в интервале от 1 до 7; А выбран из одной или более чем одной группы X, Y и/или Z;X представляет собой С 1-2-алкиленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой;Y представляет собой либо С 2-алкениленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой; либо С 2 алкиниленовую группу;m представляет собой целое число в интервале от 1 до 5; р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;R1 представляет собой атом водорода или галогена либо гидрокси, циано, нитро, С 1-4-алкильную,С 1-4-алкокси, С 1-4-тиоалкильную, С 1-4-фторалкильную, С 1-4-фторалкокси или С 1-4-фтортиоалкильную группу;R2 представляет собой атом водорода или галогена или циано, нитро, гидрокси, C1-4-алкильную,C1-4-алкокси, C1-4-тиоалкильную, С 1-4-фторалкильную, С 1-4-фторалкокси, C1-4-фтортиоалкильную группу или группу, выбранную, в частности, из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила,пиридинила, пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила,изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила, пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила, оксадиазолила, триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси, фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более заместителями, выбранными из атома галогена или циано, нитро, С 1-4-алкильной, гидрокси, С 1-4 алкокси, C1-4-тиоалкильной, C1-3-фторалкильной, С 1-3-фторалкокси, C1-3-фтортиоалкильной, фенилокси,бензилокси, пиперидинильной, пирролидинильной, морфолинильной, NR6R7, NHCOR6, COR6, CO2R6,SO2R6, -О-(С 1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной С 1-3-алкилом илиR6 и R7 независимо друг от друга представляют собой C1-3-алкильную группу или фенил иR3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или C1-3-алкильную группу и R5 представляет собой атом водорода или C1-3-алкильную,С 3-5-циклоалкильную или С 3-7-циклоалкил-С 1-6-алкиленовую группу,в форме основания, соли присоединения кислоты, гидрата или сольвата; за исключением 2-амино-2 оксоэтилбензилкарбамата. 2. Соединение формулы (I) по п.1, отличающееся тем, чтоn представляет собой целое число в интервале от 1 до 7; А выбран из одной или более чем одной группы X, Y и/или Z;X представляет собой C1-2-алкиленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой;Y представляет собой либо С 2-алкениленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой; либо С 2 алкиниленовую группу;m представляет собой целое число в интервале от 1 до 5; р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;R1 представляет собой атом водорода или галогена либо гидрокси, циано, нитро, C1-4-алкильную,С 1-4-алкокси, С 1-4-тиоалкильную, С 1-4-фторалкильную, C1-4-фторалкокси или C1-4-фтортиоалкильную группу;R2 представляет собой атом водорода или галогена или циано, нитро, гидрокси, С 1-4-алкильную,С 1-4-алкокси, С 1-4-тиоалкильную, C1-4-фторалкильную, С 1-4-фторалкокси, C1-4-фтортиоалькильную группу или группу, выбранную, в частности, из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила,пиридинила, пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила,изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила, пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила, оксадиазолила, триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси, фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более заместителями, выбранными из атома галогена и циано, нитро, C1-4-алкильной, гидрокси, С 1-4 алкокси, С 1-4-тиоалкильной, C1-3-фторалкильной, C1-3-фторалкокси, C1-3-фтортиоалкильной, фенилокси,бензилокси, пиперидинильной, пирролидинильной, морфолинильной, NR6R7, NHCOR6, COR6, CO2R6,SO2R6, -О-(С 1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной C1-3-алкилом или бензилом;R6 и R7 независимо друг от друга представляют собой C1-3-алкильную группу или фенил, иR3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или C1-3-алкильную группу, иR5 представляет собой атом водорода или C1-3-алкильную, С 3-5-циклоалкильную или С 3-7 циклоалкил-С 1-6-алкиленовую группу; при условии, что если R1 и R2 представляют собой атом водорода и А представляет собой группу X,причем X представляет собой метилен, тогда n является отличным от 1; в форме основания, соли присоединения кислоты, гидрата или сольвата. 3. Соединение формулы (I) по п.1 или 2, отличающееся тем, что,когда n равно 1,А выбран из одной или более чем одной группы X, Y и/или Z;X представляет собой С 1-2-алкиленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой;Y представляет собой либо С 2-алкениленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой; либо С 2 алкиниленовую группу;m представляет собой целое число в интервале от 1 до 5; р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;R1 представляет собой атом водорода или галогена либо гидрокси, циано, нитро, С 1-4-алкильную,С 1-4-алкокси, С 1-4-тиоалкильную, С 1-4-фторалкильную, С 1-4-фторалкокси или С 1-4-фтортиоалкильную группу;R2 представляет собой атом галогена или циано, нитро, гидрокси, С 1-4-алкильную, C1-4-алкокси, С 1-4 тиоалкильную, С 1-4-фторалкильную, С 1-4-фторалкокси, С 1-4-фтортиоалькильную группу, или группу, выбранную, в частности, из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила, пиридинила,пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила, изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила, пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила, оксадиазолила,триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила, бензотиазолила,бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила,изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси, фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более заместителями, выбранными из атома галогена и циано, нитро, С 1-4-алкильной, гидрокси, С 1-4-алкокси,С 1-4-тиоалкильной, C1-3-фторалкильной, С 1-3-фторалкокси, C1-3-фтортиоалкильной, фенилокси, бензилокси, пиперидинильной, пирролидинильной, морфолинильной, NR6R7, NHCOR6, COR6, CO2R6, SO2R6, -О(С 1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной C1-3-алкилом или бензилом;R6 и R7 независимо друг от друга представляют собой С 1-3-алкильную группу или фенил; иR3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или C1-3-алкильную группу, иR5 представляет собой атом водорода или C1-3-алкильную, С 3-5-циклоалкильную или С 3-7 циклоалкил-С 1-6-алкиленовую группу; когда n представляет собой целое число в интервале от 2 до 7,А выбран из одной или более чем одной группы X, Y и/или Z;X представляет собой C1-2-алкиленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой;Y представляет собой либо С 2-алкениленовую группу, возможно замещенную одной или более чем одной С 1-12-алкильной, С 3-7-циклоалкильной или С 3-7-циклоалкил-С 1-6-алкиленовой группой; либо С 2 алкиниленовую группу;m представляет собой целое число в интервале от 1 до 5; р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;R1 представляет собой атом водорода или галогена либо гидрокси, циано, нитро, C1-4-алкильную,С 1-4-алкокси, C1-4-тиоалкильную, С 1-4-фторалкильную, C1-4-фторалкокси или С 1-4-фтортиоалкильную группу;R2 представляет собой атом водорода или галогена или циано, нитро, гидрокси, С 1-4-алкильную,С 1-4-алкокси, C1-4-тиоалкильную, C1-4-фторалкильную, С 1-4-фторалкокси, С 1-4-фтортиоалькильную группу, или группу, выбранную, в частности, из фенила, нафтила, бифенила, фенилэтиленила, нафтилэтиленила, пиридинила, пиримидинила, пиразинила, пиридазинила, триазинила, инданила, инденила, хинолинила, изохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, тиенила, фуранила,пирролила, имидазолила, пиразолила, оксазолила, тиазолила, изоксазолила, изотиазолила, тиадиазолила,оксадиазолила, триазолила, фенилимидазолила, бензотиенила, бензофуранила, дибензофуранила, бензимидазолила, бензотриазолила, индолила, изоиндолила, индазолила, бензоксазолила, бензизоксазолила,бензотиазолила, бензизотиазолила, дигидроиндолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила, тетрагидрохинолинила, тетрагидроизохинолинила, фенилокси,- 29008801 фенилтио, фенилсульфонила, бензоила, бензилокси, фенилэтокси, фенилпропокси, нафтилокси, нафтилметокси, нафтилэтокси, нафтилпропокси, хинолинокси и изохинолинокси, и возможно замещенную одним или более заместителями, выбранными из атома галогена и циано, нитро, С 1-4-алкильной, гидрокси,C1-4-алкокси, C1-4-тиоалкильной, C1-3-фторалкильной, C1-3-фторалкокси, C1-3-фтортиоалкильной, фенилокси, бензилокси, пиперидинильной, пирролидинильной, морфолинильной, NR6R7, NHCOR6, COR6,CO2R6, SO2R6, -О-(С 1-3-алкилен)-О- или 4-пиперазинильной группы, возможно замещенной C1-3-алкилом или бензилом;R6 и R7 независимо друг от друга представляют собой С 1-3-алкильную группу или фенил иR3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или C1-3-алкильную группу и R5 представляет собой атом водорода или С 1-3-алкильную,С 3-5-циклоалкильную или С 3-7-циклоалкил-С 1-6-алкиленовую группу; в форме основания, соли присоединения кислоты, гидрата или сольвата. 4. Соединение формулы (I) по любому из пп.1-3, отличающееся тем, чтоn представляет собой целое число от 1 до 5; А выбран из одной или более чем одной группы X и/или Z;X представляет собой C1-2-алкиленовую группу, возможно замещенную одной или более чем однойm представляет собой целое число в интервале от 1 до 5; р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;R1 представляет собой водород или галоген или С 1-4-алкокси группу;R2 представляет собой атом водорода или галогена или гидроксигруппу, С 1-4-алкильную группу,С 1-4-алкоксигруппу, С 1-4-фторалкильную группу или С 1-4-фторалкоксигруппу или группу, выбранную из фенила, нафтила, бифенила, фенилэтиленила, пиридинила, пиримидинила, пиразинила, хинолинила, изохинолинила, тиенила, фуранила, изоксазолила, тиадиазолила, фенилимидазолила, бензотиенила, дибензофуранила, бензимидазолила, пирролопиридинила, фенилокси, фенилсульфонила, бензоила, бензилокси или фенилпропокси, возможно замещенную одним или более заместителями, выбранными из атома галогена, либо циано, нитро или С 1-4-алкильной группы, С 1-4-алкоксигруппы, С 1-4-тиоалкильной группы,C1-3-фторалкильной группы, C1-3-фторалкоксигруппы, фенилокси, либо бензилокси, NR6R7, NHCOR6,COR6, CO2R6, SO2R6, или -О-(С 1-3-алкилен)-O-;R6 и R7 независимо друг от друга представляют собой C1-3-алкильную группу;R3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или C1-3-алкильную группу и R5 представляет собой атом водорода или С 1-3-алкильную группу, С 3-5-циклоалкильную группу или С 3-7-циклоалкил-С 1-6-алкиленовую группу; в форме основания, соли присоединения кислоты, гидрата или сольвата. 5. Соединение формулы (I) по п.4, отличающееся тем, чтоn представляет собой целое число от 1 до 5; А выбран из одной или более чем одной группы X и/или Z;X представляет собой C1-2-алкиленовую группу, возможно замещенную одной или более чем одной С 1-3-алкильной группой;m представляет собой целое число в интервале от 1 до 5; р и q представляют собой целые числа и определены таким образом, что p+q представляет собой число в интервале от 1 до 5;R1 представляет собой водород или галоген или С 1-4-алкоксигруппу;R2 представляет собой атом водорода или хлора, брома или фтора или группу гидрокси, метил, метокси, трифторметил или трифторметокси, или группу, выбранную из фенила, нафтила, бифенила, фенилэтиленила, пиридинила, пиримидинила, пиразинила, хинолинила, изохинолинила, тиенила, фуранила,изоксазолила, тиадиазолила, фенилимидазолила, бензотиенила, дибензофуранила, бензимидазолила,пирролопиридинила, фенилокси, фенилсульфонила, бензоила, бензилокси или фенилпропокси, возможно замещенную одним или более заместителями, выбранными из атома хлора или фтора, либо группы циано, нитро, метил, этил, изопропил, бутил, трет-бутил, метокси, этокси, тиометил, трифторметил, трифторметокси, фенилокси, бензилокси, NR6R7, NHCOR6, COR6, CO2R6, SO2R6 или -О-(СН 2)-О-;
МПК / Метки
МПК: C07C 269/06, A61K 31/27, A61K 31/33, C07C 269/00, C07C 271/10, C07D 263/44
Метки: производных, получение, применение, арилалкилкарбаматных, терапии
Код ссылки
<a href="https://eas.patents.su/30-8801-poluchenie-arilalkilkarbamatnyh-proizvodnyh-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Получение арилалкилкарбаматных производных и их применение в терапии</a>
Предыдущий патент: Противокоррозионный пигмент
Следующий патент: Композиции и способы чернения и придания коррозионно-стойких свойств цинку или другим активным металлам
Случайный патент: Способ изготовления армированного прокладочного материала












