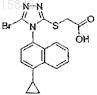
Полиморфные формы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4h-1,2,4-триазол-3-илтио)уксусной кислоты и их применение
Номер патента: 22301
Опубликовано: 30.12.2015
Авторы: Галвин Габриэль, Жирарде Жан-Люк, Замански Ирина, Трейбер Лацло Р.
Формула / Реферат
1. Кристаллический полиморф 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты
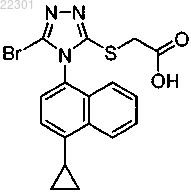
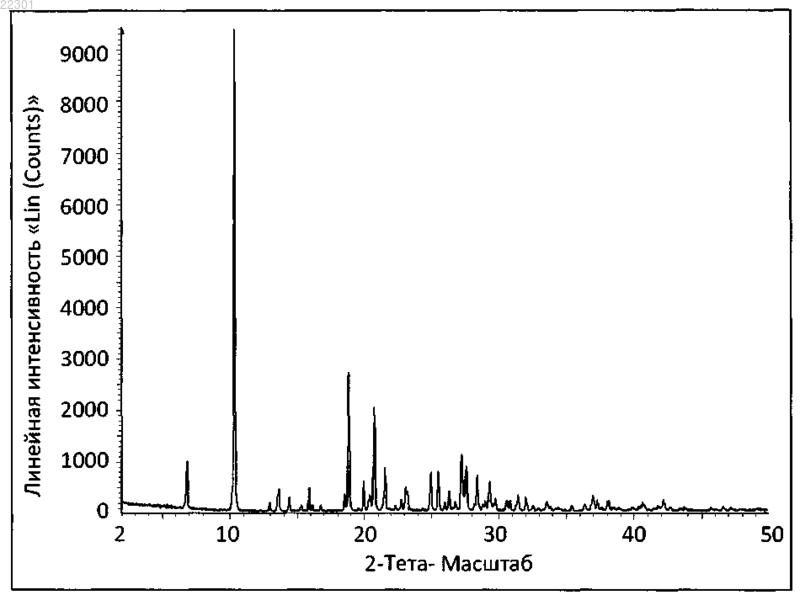
характеризующийся пиками при 10,46, 18,76 и 19,83±0,1° 2θ.
2. Кристаллический полиморф по п.1, дополнительно характеризующийся по меньшей мере одним добавочным пиком при 18,21 или 23,08±0,1° 2θ.
3. Кристаллический полиморф по п.1, изготовленный способом, включающим стадию кристаллизации 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты из смеси воды и этилацетата.
4. Твердая фармацевтическая композиция для лечения или предупреждения гиперурикемии или заболевания, вызванного повышенными уровнями мочевой кислоты, содержащая эффективное количество 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты, включающей кристаллический полиморф по п.1 или 3 в качестве активного ингредиента; и по меньшей мере одно вспомогательное вещество или носитель.
5. Твердая фармацевтическая композиция для лечения или предупреждения подагры, содержащая эффективное количество 2-(5-бром-4-(4-циклопропилнафталина-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты, включающей кристаллический полиморф по п.1 или 3 в качестве активного ингредиента; и по меньшей мере одно вспомогательное вещество или носитель.
6. Способ лечения или предупреждения гиперурикемии или заболевания, вызванного повышенными уровнями мочевой кислоты, включающий введение эффективного количества кристаллического полиморфа по п.1 или 3.
7. Способ лечения или предупреждения подагры, включающий введение эффективного количества кристаллического полиморфа по п.1 или 3.
8. Кристаллический полиморф 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты
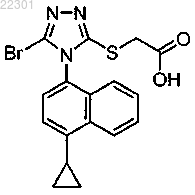
характеризующийся пиками при 10,32, 18,84 и 20,75±0,1° 2θ.
9. Кристаллический полиморф по п.8, дополнительно характеризующийся по меньшей мере двумя добавочными пиками при 6,80, 21,54, 24,97, 25,53, 27,28 и 27,60±0,1° 2θ.
10. Кристаллический полиморф по п.8, изготовленный способом, включающим стадию кристаллизации 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты из смеси воды и уксусной кислоты.
11. Твердая фармацевтическая композиция для лечения или предупреждения гиперурикемии или заболевания, вызванного повышенными уровнями мочевой кислоты, содержащая эффективное количество 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты, включающей кристаллический полиморф по п.8 или 10 в качестве активного ингредиента и по меньшей мере одно вспомогательное вещество или носитель.
12. Твердая фармацевтическая композиция для лечения или предупреждения подагры, содержащая
эффективное количество 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты, включающей кристаллический полиморф по п.8 или 10 в качестве активного ингредиента; и по меньшей мере одно вспомогательное вещество или носитель.
13. Способ лечения или предупреждения гиперурикемии или заболевания, вызванного повышенными уровнями мочевой кислоты, включающий введение эффективного количества кристаллического полиморфа по п.8 или 10.
14. Способ лечения или предупреждения подагры, включающий введение эффективного количества кристаллического полиморфа по п.8 или 10.
15. Твердая фармацевтическая композиция для лечения или предупреждения гиперурикемии или заболевания, вызванного повышенными уровнями мочевой кислоты, содержащая
форму 1 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты по п.8 в качестве активного ингредиента,
форму 2 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты по п.1 в качестве активного ингредиента и
по меньшей мере одно вспомогательное вещество или носитель.
16. Твердая фармацевтическая композиция для лечения или предупреждения подагры, содержащая
форму 1 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты по п.8 в качестве активного ингредиента;
форму 2 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты по п.1 в качестве активного ингредиента и
по меньшей мере одно вспомогательное вещество или носитель.
17. Способ получения кристаллического полиморфа 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты, который включает
растворение 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)ацетата натрия в воде с образованием раствора;
добавление минеральной кислоты;
добавление этилацетата;
отделение органического слоя;
осаждение кристаллического полиморфа из органического слоя;
при этом кристаллический полиморф характеризуется пиками при 10,46, 18,76 и 19,83±0,1° 2θ.
18. Способ по п.17, который характеризуется одним или несколькими из следующего:
минеральная кислота представляет собой бромисто-водородную кислоту;
минеральную кислоту добавляют в количестве 1,05 экв.;
объем органического слоя уменьшают для осаждения кристаллического полиморфа;
органический слой охлаждают для осаждения кристаллического полиморфа;
кристаллический полиморф фильтруют и промывают и/или
кристаллический полиморф дополнительно характеризуется по меньшей мере одним добавочным пиком при 18,21 или 23,08±0,1° 2θ.
19. Способ получения кристаллического полиморфа 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты, включающий:
(a) приведение в контакт 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)ацетата натрия с водным раствором бромистого водорода и органического растворителя с образованием водной фазы и органической фазы;
(b) изолирование органической фазы из смеси стадии (а) и
(c) кристаллизация 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты из органической фазы.
20. Способ получения кристаллического полиморфа 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты, включающий кристаллизацию 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4Н-1,2,4-триазол-3-илтио)уксусной кислоты из смеси воды и этилацетата.
Текст
Описаны кристаллические полиморфные формы 2-(5-бром-4-(4-циклопропилнафталин-1 ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты. Кроме того, представлены фармацевтические композиции и применения таких соединений, форм соединений и композиций для лечения различных заболеваний и патологических состояний. По настоящей заявке испрашивается приоритет предварительной заявки на патент США с серийным номером 61/383659, поданной 30 декабря 2010 г., полное содержание которой включено в настоящее описание посредством отсылки. Область техники, к которой относится изобретение В настоящем документе описаны полиморфные формы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)4H-1,2,4-триазол-3-илтио)уксусной кислоты, которая, как известно, снижает уровни мочевой кислоты. Сведения о предшествующем уровне техники Подагра связана с повышенными уровнями мочевой кислоты, которая кристаллизуется и образует отложения в суставах, сухожилиях и окружающих тканях. Подагра характеризуется повторными приступами, сопровождающимися покраснением, болезненностью, жаром и/или опухшими суставами. Сущность изобретения В настоящем изобретении описаны кристаллические полиморфы 2-(5-бром-4-(4 циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты Согласно одному аспекту в настоящем документе описаны кристаллические полиморфы 2-(5-бром 4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты, характеризующиеся пиками при 10,32, 18,84 и 20,750,1 2. В других вариантах осуществления такой кристаллический полиморф дополнительно характеризуется по меньшей мере двумя добавочными пиками при 6,80, 21,54,24,97, 25,53, 27,28 и 27,600,1 2. В еще других вариантах осуществления кристаллический полиморф характеризуется картиной порошковой рентгеновской дифракции, по существу, аналогичной картине порошковой рентгеновской дифракции, представленной на фиг. 1. В других вариантах осуществления кристаллический полиморф дает картину порошковой рентгеновской дифракции, по существу, аналогичную картине порошковой рентгеновской дифракции, представленной на фиг. 2. В соответствующем аспекте настоящего изобретения описаны кристаллические полиморфы 2-(5-бром-4-(4 циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты, характеризующиеся температурой начала эндотермического эффекта примерно 151 С, определенной методом дифференциальной сканирующей калориметрии. В другом варианте осуществления кристаллический полиморф характеризуется картиной дифференциальной сканирующей калориметрии, по существу, аналогичной картине дифференциальной сканирующей калориметрии, представленной на фиг. 3. В другом схожем аспекте,описанном в настоящем документе, представлена кристаллическая полиморфная форма 1 2-(5-бром-4-(4 циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты. Также в настоящем документе описаны кристаллические полиморфные формы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4 триазол-3-илтио)уксусной кислоты, полученные способом, включающим стадию кристаллизации аморфной 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты из смеси воды и уксусной кислоты. В соответствующем аспекте настоящего изобретения описаны твердые фармацевтические композиции, которые содержат эффективное количество кристаллического полиморфа,характеризующегося вышеупомянутыми дифракционными картинами, эффективное количество кристаллического полиморфа, характеризующегося вышеупомянутыми картинами дифференциальной сканирующей калориметрии, или эффективное количество кристаллической полиморфной формы 1 в качестве активного ингредиента и по меньшей мере одно вспомогательное вещество или носитель. Также в настоящем документе описаны способы лечения или предупреждения гиперурикемии или заболевания,вызванного повышенными уровнями мочевой кислоты, которые включают введение эффективного количества кристаллического полиморфа, характеризующегося вышеупомянутыми диффракционными картинами, эффективного количества кристаллического полиморфа, характеризующегося вышеупомянутыми картинами дифференциальной сканирующей калориметрии, или эффективного количества кристаллической полиморфной формы 1. Также в настоящем документе описаны способы лечения или предупреждения подагры, которые включают введение эффективного количества кристаллического полиморфа, характеризующегося вышеупомянутыми диффракционными картинами, эффективного количества кристаллического полиморфа, характеризующегося вышеупомянутыми картинами дифференциальной сканирующей калориметрии, или эффективного количества кристаллической полиморфной формы 1. В другом аспекте в настоящем документе описаны кристаллические полиморфы 2-(5-бром-4-(4 циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты, характеризующиеся пиками при 10,46, 18,76 и 19,830,1 2. В других вариантах осуществления такой кристаллический полиморф дополнительно характеризуется по меньшей мере одним добавочным пиком при 18,21 или 23,080,1 2. В еще других вариантах осуществления кристаллический полиморф дает картину порошковой рентге-1 022301 новской дифракции, по существу, аналогичную картине порошковой рентгеновской дифракции, представленной на фиг. 5. В еще других вариантах осуществления кристаллический полиморф дает картину порошковой рентгеновской дифракции, по существу, аналогичную картине порошковой рентгеновской дифракции, представленной на фиг. 6. В соответствующем аспекте настоящего изобретения описаны кристаллические полиморфы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3 илтио)уксусной кислоты, характеризующиеся температурой начала эндометрической реакции примерно 175 С, определенной методом дифференциальной сканирующей калориметрии. В другом варианте осуществления кристаллический полиморф характеризуется картиной дифференциальной сканирующей калориметрии, по существу, аналогичной картине дифференциальной сканирующей калориметрии,представленной на фиг. 8. В другом соответствующем аспекте настоящего документа описана кристаллическая полиморфная форма 2 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3 илтио)уксусной кислоты. Также в настоящем документе описаны кристаллические полиморфные формы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты, полученные способом, который включает стадию кристаллизации аморфной 2-(5-бром-4-(4-циклопропилнафталин-1 ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты из смеси воды и этилацетата. В соответствующем аспекте настоящего изобретения описаны твердые фармацевтические композиции, которые содержат эффективное количество кристаллического полиморфа, характеризующегося вышеупомянутыми дифракционными картинами, эффективное количество кристаллического полиморфа, характеризующегося вышеупомянутыми картинами дифференциальной сканирующей калориметрии, или эффективное количество кристаллической полиморфной формы 2 в качестве активного ингредиента и по меньшей мере одно вспомогательное вещество или носитель. Также в настоящем документе описаны способы лечения или предупреждения гиперурикемии или заболевания, вызванного повышенными уровнями мочевой кислоты, которые включают введение эффективного количества кристаллического полиморфа, характеризующегося вышеупомянутыми дифракционными картинами, эффективного количества кристаллического полиморфа, характеризующегося вышеупомянутыми картинами дифференциальной сканирующей калориметрии, или эффективного количества кристаллической полиморфной формы 2. Также в настоящем документе описаны способы лечения или предупреждения подагры, которые включают введение эффективного количества кристаллического полиморфа, характеризующегося вышеупомянутыми дифракционными картинами, эффективного количества кристаллического полиморфа, характеризующегося вышеупомянутыми картинами дифференциальной сканирующей калориметрии, или эффективного количества кристаллической полиморфной формы 2. В другом аспекте предложены твердые фармацевтические композиции, содержащие эффективное количество по меньшей мере двух из упомянутых выше кристаллических полиморфных форм 2-(5-бром 4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты и по меньшей мере одно вспомогательное вещество или носитель. В другом аспекте предложены способы лечения или предупреждения гиперурикемии или заболевания, вызванного повышенными уровнями мочевой кислоты, которые включают введение эффективного количества по меньшей мере двух из упомянутых выше кристаллических полиморфных форм 2-(5-бром 4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты и по меньшей мере одного вспомогательного вещества или носителя. В еще другом аспекте предложены способы лечения или предупреждения подагры, включающие введение эффективного количества по меньшей мере двух из упомянутых выше кристаллических полиморфных форм 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты и по меньшей мере одного вспомогательного вещества или носителя. Включение путем отсылки Все публикации и патентные заявки, упомянутые в настоящем описании, включены в него путем отсылки в том же объеме, как если бы каждая отдельная публикация или патентная заявка были конкретно и индивидуально указана как включенные путем отсылки. Краткое описание чертежей Новые признаки, содержащиеся в изобретении, подробно изложены в прилагаемой формуле изобретения. Лучшее понимание признаков и преимуществ настоящего изобретения можно получить исходя из следующего подробного описания, содержащего иллюстративные варианты осуществления настоящего изобретения, в которых использованы принципы, лежащие в основе изобретения, и сопровождающих чертежей, среди которых фиг. 1 представляет собой иллюстративную картину порошковой рентгеновской дифракции полиморфной формы 1 (исходные данные); фиг. 2 - иллюстративную картину порошковой рентгеновской дифракции полиморфной формы 1 (с вычитанием фоновых значений и удалением K2); фиг. 3 - иллюстративную картину дифференциальной сканирующей калориметрии полиморфной формы 1; фиг. 4 - иллюстративные кривые термогравиметрических анализов: (а) термограмма 1 и (b) термограмма 2 полиморфной формы 1; фиг. 5 - иллюстративную картину порошковой рентгеновской дифракции полиморфной формы 2(исходные данные); фиг. 6 - иллюстративную картину порошковой рентгеновской дифракции полиморфной формы 2 (с вычитанием фоновых значений и удалением K2); фиг. 7 - иллюстративное наложение картин порошковой рентгеновской дифракции полиморфной формы 1 (нижняя) и формы 2 (верхняя); фиг. 8 - иллюстративную картину дифференциальной сканирующей калориметрии полиморфной формы 2; фиг. 9 - иллюстративный 1 Н ЯМР-спектр (DMSO-d6) полиморфной формы 2; фиг. 10 - иллюстративную кривую HPLC полиморфной формы 2; фиг. 11 - иллюстративную кривую термогравиметрического анализа полиморфной формы 2; фиг. 12 - иллюстративное исследование полиморфных форм 1 и 2 методом гравиметрической сорбции паров. Подробное описание изобретения Хотя в настоящем документе показаны и описаны некоторые варианты осуществления настоящего изобретения, компетентному в данной области специалисту будет очевидно, что такие варианты осуществления настоящего изобретения приведены только в качестве примеров. Компетентный специалист сможет представить себе многочисленные вариации, изменения и замены, которые не выходят за рамки сущности данного изобретения. Следует понимать, что в практической реализации настоящего изобретения можно использовать в некоторых ситуациях различные альтернативы описанным здесь вариантам его осуществления. Предполагается, что представленные ниже пункты формулы изобретения определяют его объем, причем этой формулой изобретения охвачены не только способы и структуры, но и их эквиваленты. Использованные в настоящем документе заголовки разделов служат только организационным целям, их не следует воспринимать как ограничения описанного здесь предмета обсуждения. Все документы или части документов, указанные в описании, включая, без ограничения, патенты, патентные заявки,статьи, книги, руководства и монографии, являются включенными посредством отсылки во всей их полноте для любой цели. Настоящее изобретение относится к полиморфным формам 2-(5-бром-4-(4-циклопропилнафталин 1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты, которая, как известно, понижает уровни мочевой кислоты. Термин "полиморная форма 1" относится к кристаллической форме 2-(5-бром-4-(4 циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты, которая дает картину порошковой рентгеновской дифракции, по существу, аналогичную картине, представленной на фиг. 1 и/или 2,и/или профиль дифференциальной сканирующей калориметрии, по существу, аналогичный профилю,представленному на фиг. 3. Термин "полиморфная форма 2" относится к кристаллической форме 2-(5-бром-4-(4 циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты, которая дает картину порошковой рентгеновской дифракции, по существу, аналогичную картине, представленной на фиг. 5 и/или 6,и/или профиль дифференциальной сканирующей калориметрии, по существу, аналогичный профилю,представленному на фиг. 8. Кроме того, настоящее изобретение относится к твердым фармацевтическим композициям, содержащим в качестве активного ингредиента эффективное количество 2-(5-бром-4-(4 циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты в виде кристаллической полиморфной формы 1, кристаллической полиморфной формы 2 или их комбинации. Настоящее изобретение также относится к способам лечения или предупреждения заболеваний,включающим введение эффективного количества 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4 триазол-3-илтио)уксусной кислоты в виде кристаллической полиморфной формы 1, кристаллической полиморфной формы 2 или их комбинации. Также описаны способы приготовления кристаллических полиморфных форм 1 и 2. 2-(5-Бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусная кислота. В настоящем документе описаны полиморфные формы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)4H-1,2,4-триазол-3-илтио)уксусной кислоты, которая, как известно, понижает уровни мочевой кислоты. 2-(5-Бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусная кислота и родственные соединения описаны в публикациях заявок на патент США 2008-0176850, US 2009-0197825, US 2010-0056464, US 2010-0056465, US 2010-0069645 и US 2010-0081827. Полиморфная форма 1. В одном варианте осуществления полиморфная форма 1 2-(5-бром-4-(4-циклопропилнафталин-1 ил)-4H-1,2,4-триазол-3-илтио)ацетата дает картину порошковой рентгеновской дифракции, которая характеризуется дифракционной картиной, представленной в табл. 1 А или 1 В. В некоторых вариантах осуществления в настоящем документе предложен полиморф 2-(5-бром-4-(4-циклопропилнафталин-1-3 022301 ил)-4H-1,2,4-триазол-3-илтио)ацетата, содержащий по меньше мере 3 пика (0,1 2) из табл. 1 А или 1 В. В определенных вариантах осуществления в настоящем документе предложен полиморф 2-(5-бром-4-(4 циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетата, содержащий по меньше мере 4 пика(0,1 2) из табл. 1 А или 1 В, по меньшей мере 5 пиков (0,1 2) из табл. 1 А или 1 В, по меньшей мере 6 пиков (0,1 2) из табл. 1 А или 1 В, по меньшей мере 8 пиков (0,1 2) из табл. 1 А или 1 В, по меньшей мере 10 пиков (0,1 2) из табл. 1 А, по меньшей мере 15 пиков (0,1 2) из табл. 1 А, по меньшей мере 20 пиков (0,1 2) из табл. 1 А, по меньшей мере 25 пиков (0,1 2) из табл. 1 А, по меньшей мере 30 пиков (0,1 2) из табл. 1 А. Таблица 1 А Таблица 1 В В одном варианте осуществления в настоящем документе предложена полиморфная форма 1 2-(5 бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)ацетата, которая характеризуется пиками на картине порошковой рентгеновской дифракции при 10,32, 18,84 и 20,750,1 2. В других вариантах осуществления полиморфная форма 1 дополнительно характеризуется по меньшей мере одним пиком, возникающим при 6,80, 21,54, 24,97, 25,53, 27,28 и 27,600,1 2. В другом варианте осуществления полиморфная форма 1 дополнительно характеризуется по меньшей мере двумя пиками, возникающими при 6,80, 21,54, 24,97, 25,53, 27,28 и 27,600,1 2. В еще других вариантах осуществления полиморф дает картину порошковой рентгеновской дифракции, по существу, аналогичную картине порошковой рентгеновской дифракции, представленной на фиг. 1. Полиморфная форма 2. В одном варианте осуществления полиморфная форма 2 2-(5-бром-4-(4-циклопропилнафталин-1 ил)-4 Н-1,2,4-триазол-3-илтио)ацетата дает картину порошковой рентгеновской дифракции, характеризующуюся дифракционной картиной, представленной в табл. 2 А или 2 В. В некоторых вариантах осуществления в настоящем документе предложен полиморф 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н 1,2,4-триазол-3-илтио)ацетата, содержащий по меньше мере 3 пика (0,1 2) из табл. 2 А или 2 В. В некоторых вариантах осуществления в настоящем документе предложен полиморф 2-(5-бром-4-(4 циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетата, содержащий по меньше мере 4 пика(0,1 2) из табл. 2 А или 2 В, по меньшей мере 5 пиков (0,1 2) из табл. 2 А или 2 В, по меньшей мере 6 пиков из (0,1 2) из табл. 2 А или 2 В, по меньшей мере 8 пиков (0,1 2) из табл. 2 А или 2 В, по меньшей мере 10 пиков (0,1 2) из табл. 2 А, по меньшей мере 15 пиков (0,1 2) из табл. 2 А, по меньшей мере 20 пиков (0,1 2) из табл. 2 А, по меньшей мере 25 пиков (0,1 2) из табл. 2 А, по меньшей мере 30 пиков (0,1 2) из табл. 2 А. В одном варианте осуществления в настоящем документе предложена полиморфная форма 2 2-(5 бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)ацетата, которая характеризуется пиками порошковой рентгеновской дифракции при 10,46, 18,76 и 19,830,1 2. В других вариантах осуществления полиморфная форма 2 дополнительно характеризуется по меньшей мере одним пиком, возникающим при 18,21 или 23,080,1 2. В других вариантах осуществления полиморфная форма 2 дополнительно характеризуется двумя пиками, возникающими при 18,21 или 23,080,1 2. В еще других вариантах осуществления полиморфная форма 2 дает картину порошковой рентгеновской дифракции, по существу, аналогичную картине порошковой рентгеновской дифракции, представленной на фиг. 5. Было обнаружено, что в некоторых случаях кристаллические полиморфы 2-(5-бром-4-(4 циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетата проявляют повышенную стабильность по сравнению с аморфными твердыми формами карбоновой кислоты. В ряде случаев улучшенная стабильность кристаллических полиморфов 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-5 022301 илтио)ацетата обеспечивает получение фармацевтических лекарственных форм, проявляющих уменьшенную вариабельность дозы, присутствующей в данной лекарственной форме, уменьшение присутствия примесей в конечном фармацевтическом продукте и улучшение длительности хранения готовых лекарственных форм по сравнению с фармацевтическими лекарственными формами, приготовленными с аморфными твердыми формами карбоновой кислоты. В некоторых вариантах осуществления описанный в настоящем документе полиморф (например, форма 1 или форма 2) демонстрирует отсутствие разложения (например, меньше чем 0,01, меньше чем 0,1, меньше чем 0,5 мас.%) в течение по меньшей мере 3 месяцев в условиях ускоренной деградации (например, 40 С-75% RH), в течение по меньшей мере 4 месяцев в условиях ускоренной деградации (например, 40 С-75% RH), в течение по меньшей мере 5 месяцев в условиях ускоренной деградации (например, 40 С-75% RH), в течение по меньшей мере 6 месяцев в условиях ускоренной деградации (например, 40 С-75% RH), в течение по меньшей мере 9 месяцев в условиях ускоренной деградации (например, 40 С-75% RH), в течение по меньшей мере 12 месяцев в условиях ускоренной деградации (например, 40 С-75% RH), и/или (ii) в течение по меньшей мере 12 месяцев в условиях длительного хранения (например, 25 С-60% RH), в течение по меньшей мере 18 месяцев в условиях длительного хранения (например, 25 С-60% RH), в течение по меньшей мере 24 месяцев в условиях длительного хранения (например, 25 С-60% RH). К тому же в некоторых случаях было обнаружено, что кристаллические полиморфы 2-(5-бром-4-(4 циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетата проявляют пониженную гигроскопичность по сравнению с другими формами, находящимися в твердом состоянии, определенную методом гравиметрической сорбции пара (GVS). Фиг. 12 иллюстрирует исследование методом GVS формы 1 и формы 2. Было обнаружено, что форма 1 адсорбирует 0,2% мас./мас. при высокой влажности, и было обнаружено, что форма 2 адсорбирует 0,1% мас./мас. при высокой влажности. Это свойство пониженной гигроскопичности способствует в значительной степени приготовлению твердых фармацевтических лекарственных форм. Смешивание с аморфными твердыми формами. В определенных вариантах осуществления любой из описанных в настоящем документе полиморфов (например, форма 1) необязательно содержит (или смешан, или в комбинации) определенное количество аморфного 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)ацетата. В некоторых вариантах осуществления содержание аморфного компонента в полиморфе (например, формы 1) или комбинации полиморфов составляет менее 50 мас.% полиморфа или комбинации полиморфов, менее 25 мас.% полиморфа или комбинации полиморфов, менее 15 мас.% полиморфа или комбинации полиморфов, менее 10 мас.% полиморфа или комбинации полиморфов или менее 5 мас.% полиморфа или комбинации полиморфов. Размер частиц. В определенных вариантах осуществления в настоящем документе предложены полиморфные частицы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)ацетата (например, кристаллические или содержащие кристаллический компонент). В некоторых вариантах осуществления в настоящем документе предложен полиморф 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол 3-илтио)ацетата (например, кристаллический или содержащий кристаллический компонент) с размером частиц примерно 5-50 мкм. В некоторых вариантах осуществления средний размер частиц составляет по меньшей мере 10, 15-50, 15-35, 35-45, 35-40 мкм, примерно 40 мкм или т.п. В некоторых вариантах осуществления частицы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)ацетата (например, кристаллические или содержащие кристаллический компонент, например полиморф формы 1) со средним диаметром больше чем 5 или 10 мкм обладают улучшенными параметрами стабильности по сравнению с частицами меньшего диаметра. Мочевая кислота является результатом окисления ксантина. Заболевания, связанные с нарушением метаболизма мочевой кислоты, включают, но без ограничения, полицитемию, миелоидную метаплазию,подагру, рецидивы подагры, подагрический артрит, гиперурикемию, гипертензию, сердечно-сосудистое заболевание, коронарную болезнь сердца, синдром Леша-Найяна, синдром Келли-Сигмиллера, болезнь почек, камни в почках, почечную недостаточность, воспаление суставов, артрит, уролитиаз, свинцовое отравление, гиперпаратиреоз, псориаз или саркоидоз. Определения. Термин "субъект" используется в настоящем документе в отношении индивидов, страдающих нарушением и т.п., при этом термин охватывает как млекопитающих, так и не млекопитающих. В одном варианте осуществления предложенных здесь способов и композиций млекопитающим является человек. Термины "эффективное количество", "терапевтически эффективное количество" или "фармацевтически эффективное количество", используемые в настоящем документе, относятся к количеству по меньшей мере одного вводимого агента или соединения, которое является достаточным для лечения или предупреждения конкретного заболевания или патологического состояния. Результатом является уменьшение и/или ослабление признаков, симптомов или причин заболевания или любое другое желательное изменение биологической системы. Например, "эффективное количество" для терапевтических целей представляет собой такое количество композиции, содержащей раскрытое в настоящем документе со-6 022301 единение, которое необходимо для обеспечения клинически значимого уменьшения проявлений заболевания. Адекватное "эффективное" количество в любом конкретном случае определяется с использованием таких методик, как исследование с увеличением дозы. Термин "по существу, аналогичная", используемый здесь, относится к картине порошковой рентгеновской дифракции или картине дифференциальной сканирующей калориметрии, которая не идентична представленным здесь картинам, но находится в пределах экспериментальной ошибки при рассмотрении средним специалистом в данной области. Модулирование активности URAT-1. Также в настоящем документе описаны способы модулирования активности URAT-1 путем приведения в контакт URAT-1 с количеством полиморфной формы 2-(5-бром-4-(4-циклопропилнафталин-1 ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты, как описано в настоящем документе, достаточным для модулирования активности URAT-1. Термин "модулировать" относится к ингибированию или активированию активности URAT-1. В некоторых вариантах осуществления предложены способы ингибирования активности URAT-1 путем приведения в контакт URAT-1 с количеством полиморфной формы 2-(5-бром 4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты, как описано в настоящем документе, достаточным для ингибирования активности URAT-1. В некоторых вариантах осуществления предложены способы ингибирования активности URAT-1 в растворе путем приведения в контакт указанного раствора с количеством полиморфной формы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H1,2,4-триазол-3-илтио)уксусной кислоты, как описано в настоящем документе, достаточным для ингибирования активности URAT-1 в указанном растворе. В некоторых вариантах осуществления предложены способы ингибирования активности URAT-1 в клетке путем приведения в контакт указанной клетки с количеством полиморфной формы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3 илтио)уксусной кислоты, как описано в настоящем документе, достаточным для ингибирования активности URAT-1 в указанной клетке. В некоторых вариантах осуществления предложены способы ингибирования активности URAT-1 в ткани путем приведения в контакт указанной ткани с количеством полиморфной формы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты, как описано в настоящем документе, достаточным для ингибирования активности URAT-1 в указанной ткани. В некоторых вариантах осуществления предложены способы ингибирования активностиURAT-1 в крови путем приведения в контакт указанной крови с количеством полиморфной формы 2-(5 бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты, как описано в настоящем документе, достаточным для ингибирования активности URAT-1 в крови. В некоторых вариантах осуществления предложены способы ингибирования активности URAT-1 в плазме путем приведения в контакт плазмы с количеством полиморфной формы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H1,2,4-триазол-3-илтио)уксусной кислоты, как описано в настоящем документе, достаточным для ингибирования активности URAT-1 в плазме. В некоторых вариантах осуществления предложены способы ингибирования активности URAT-1 у животного путем приведения в контакт указанного животного с количеством полиморфной формы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3 илтио)уксусной кислоты, как описано в настоящем документе, достаточным для ингибирования активности URAT-1 у указанного животного. В некоторых вариантах осуществления предложены способы ингибирования активности URAT-1 у млекопитающего путем приведения в контакт указанного млекопитающего с количеством полиморфной формы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол 3-илтио)уксусной кислоты, как описано в настоящем документе, достаточным для ингибирования активности URAT-1 у указанного млекопитающего. В некоторых вариантах осуществления предложены способы ингибирования активности URAT-1 у человека путем приведения в контакт указанного человека с количеством полиморфной формы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3 илтио)уксусной кислоты, как описано в настоящем документе, достаточным для ингибирования активности URAT-1 у указанного человека. Фармацевтические композиции. В настоящем документе описаны фармацевтические композиции, содержащие эффективное количество полиморфной формы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты, как описано в настоящем документе. В некоторых вариантах осуществления фармацевтические композиции содержат эффективное количество полиморфной формы 2-(5-бром-4-(4 циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты, как описано в настоящем документе, и по меньшей мере один фармацевтически приемлемый носитель. В некоторых вариантах осуществления фармацевтические композиции содержат эффективное количество полиморфной формы 1,как описано в настоящем документе, и по меньшей мере один фармацевтически приемлемый носитель. В некоторых вариантах осуществления фармацевтические композиции содержат эффективное количество полиморфной формы 2, как описано в настоящем документе, и по меньшей мере один фармацевтически приемлемый носитель. В некоторых вариантах осуществления фармацевтические композиции содержат эффективное количество комбинации полиморфной формы 1 и формы 2, как описано в настоящем документе, и по меньшей мере один фармацевтически приемлемый носитель. В некоторых вариантах осуществления фармацевтические композиции предназначены для лечения нарушений. В некоторых вариантах осуществления фармацевтические композиции предназначены для лечения нарушений у млекопитающего. В некоторых вариантах осуществления фармацевтические композиции предназначены для лечения нарушений у человека. В некоторых вариантах осуществления фармацевтические композиции предназначены для лечения или профилактики нарушений метаболизма мочевой кислоты. В некоторых вариантах осуществления фармацевтические композиции предназначены для лечения или профилактики гиперурикемии. В некоторых вариантах осуществления фармацевтические композиции предназначены для лечения или профилактики подагры. Способы введения, композиции и лекарственные формы. В настоящем документе описаны фармацевтические композиции, содержащие полиморфную форму 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4-триазол-3-илтио)уксусной кислоты, как описано в настоящем документе. Соединение, формы соединения и композиции, описанные в настоящем документе, вводят отдельно или в комбинации с фармацевтически приемлемыми носителями, вспомогательными веществами или разбавителями в виде фармацевтической композиции согласно стандартной фармацевтической практике. Введение можно осуществлять любым способом, который обеспечивает доставку соединения к месту действия. Эти способы включают, хотя и не ограничиваясь этим, доставку в кишечник (включая пероральную, через желудочный или дуоденальный зонд, ректальный суппозиторий или ректальную клизму), парентеральные способы (инъекции или вливания, включая внутриартериальные,внутрисердечные, внутрикожные, интрадуоденальные, интрамедуллярные, внутримышечные, внутрикостные, внутрибрюшинные, внутриоболочечные, внутрисосудистые, внутривенные, в стекловидное тело,эпидуральные и подкожные), ингаляционные, чрескожные, чресслизистые, сублингвальные, буккальные и местные (включая накожный, дермальный, клизму, глазные капли, ушные капли, интраназальный, вагинальный) способы введения, хотя наиболее подходящий способ может зависеть, например, от патологического состояния и заболевания реципиента. Опытные специалисты в данной области будут знакомы с методами введения, которые могут применяться для описанных здесь соединений, форм соединений,композиций и способов. Только в качестве примера описанные в настоящем документе соединения,формы соединений и композиции в некоторых вариантах вводят местно в ту область организма, которая нуждается в лечении, например локальное вливание во время хирургической операции, местное наложение кремов или мазей, инъекция, катетер или имплантат, причем указанный имплантат может быть изготовлен, например, из пористого, непористого или желатинообразного материала, включая мембраны, в частности силиконовые мембраны или волокна. В некоторых вариантах введение может осуществляться посредством прямой инъекции в участок больной ткани или органа. Описанные в настоящем документе фармацевтические композиции представлены, например, в форме, пригодной для перорального применения, такой как таблетка, капсула, пилюля, порошок, лекарственный состав с замедленным высвобождением, раствор, суспензия, в форме, пригодной для парентерального введения, такой как стерильный раствор, суспензия или эмульсия, в форме, пригодной для местного введения, такой как мазь или крем, или в форме, пригодной для ректального введения, такой как суппозиторий. В некоторых вариантах осуществления фармацевтическая композиция представлена в виде стандартных лекарственных форм, удобных для однократного введения точных доз. Фармацевтические композиции включают соединение или форму соединения, как описано в настоящем документе, в качестве активного ингредиента и общепринятый фармацевтический носитель или вспомогательное вещество. В некоторых вариантах осуществления эти композиции включают другие или дополнительные лекарственные или фармацевтические агенты, носители, вспомогательные вещества и т.д. Фармацевтические композиции удобным образом представлены в виде стандартной лекарственной формы. В некоторых вариантах осуществления они приготовлены с определенным количеством активного соединения любым из способов, хорошо известных или очевидных для опытных специалистов в области фармацевтики. Дозы. Количество вводимых фармацевтических композиций, прежде всего, будет зависеть от млекопитающего, подлежащего лечению. В случаях, когда фармацевтические композиции вводят субъектучеловеку, ежедневную дозировку обычно определяет лечащий врач, при этом доза, как правило, варьируется в зависимости от возраста, пола, диеты, веса, общего состояния здоровья отдельного пациента и его реакции на лечение, от тяжести симптомов у пациента, от точных показаний к лечению или патологического состояния, подлежащего лечению, от тяжести показаний или патологического состояния, подлежащего лечению, от времени введения, способа введения, размещения композиции, скорости экскреции, комбинации лекарственных средств, а также в зависимости от заключения лечащего врача. К тому же, в зависимости от патологического состояния и его тяжести может варьироваться способ введения. В некоторых вариантах осуществления фармацевтическая композиция представлена в виде стандартной лекарственной формы. В такой форме препарат подразделен на стандартные дозы, каждая из которых содержит соответствующее количество активного компонента, например эффективное количество для достижения нужного результата. Определение нужной дозы для конкретной ситуации находится в компетенции опытного специалиста. В некоторых вариантах осуществления для удобства общую суточную дозу разделяют и, если это желательно, вводят по частям в течение дня. Количество и частота введения регулируются в зависимости от заключения лечащего врача с учетом тех факторов, которые описаны выше. Таким образом, количество вводимой фармацевтической композиции варьируется в зависимости от обстоятельств. Введение может осуществляться в приблизительном количестве от 0,001 до 100 мг/кг весатела в день (введение в одной дозе или дробных дозах) или как минимум приблизительно 0,1 мг/кг веса тела в день. В некоторых вариантах конкретная терапевтическая доза включает приблизительно от 0,01 до 7000 мг соединения или приблизительно от 0,05 до 2500 мг. Количество активного соединения в стандартной дозе препарата в некоторых вариантах осуществления может варьироваться или регулироваться приблизительно от 0,1 до 1000 мг, приблизительно от 1 до 300 мг или от 10 до 200 мг в соответствии с конкретным назначением. В некоторых случаях конкретная терапевтическая доза составляет примерно 200 мг, примерно 300 мг, примерно 400 мг, примерно 500 мг, примерно 600 мг, примерно 700 мг или примерно 800 мг. В некоторых случаях доза, выходящая за нижнюю границу вышеуказанного диапазона, может оказаться более чем достаточной, тогда как в других случаях можно без каких-либо вредных побочных эффектов применять гораздо большие дозы, например, подразделяя их на несколько меньших доз для введения в течение всего дня. При комбинированных применениях, когда соединение является не единственным средством лечения, возможно введение меньшего количества соединения при сохранении терапевтического или профилактического эффекта. Комбинированные терапии. Описанные в настоящем документе соединения и формы соединений вводят в качестве единственной терапии или в комбинации с другой терапией или терапиями. Только в качестве примера, в случае, если одним из побочных эффектов, испытываемых пациентом при введении соединения или формы соединения, как описано в настоящем документе, является гипертензия, возможно введение антигипертензивного агента в комбинации с соединением. Или только в качестве примера терапевтическая эффективность соединения или формы соединения, как описано в настоящем документе, можно повысить посредством введения адъюванта (т.е. адъювант сам по себе может обладать лишь минимальным терапевтическим эффектом, но в комбинации с другим терапевтическим агентом общая терапевтическая польза для пациента возрастает). Либо только в качестве примера благоприятный эффект, испытываемый пациентом, можно увеличить посредством введения соединения или формы соединения, как описано в настоящем документе, в сочетании с другим терапевтическим агентом(также по определенной схеме), который также обладает терапевтическим эффектом. Независимо от заболевания, нарушения или патологического состояния, подлежащего лечению, общий полезный эффект для пациента может представлять собой аддитивный эффект двух терапевтических агентов либо пациент может испытывать синергический полезный эффект. В случаях, когда соединения или формы соединений, как описано в настоящем документе, вводят в комбинации с другими терапевтическими агентами, их не обязательно вводить в одной фармацевтической композиции с другими терапевтическими агентами, и возможно, что в связи с разными физическими и химическими характеристиками их следует вводить разными способами. Например, соединение или форму соединения, как описано в настоящем документе, можно вводить перорально для создания и поддержания их хорошего уровня в крови, тогда как другие терапевтические агенты можно вводить внутривенно. Определение способа введения и целесообразности введения, где это возможно, в одной и той же фармацевтической композиции находится в компетенции опытного клициниста. Начальное введение можно осуществлять в соответствии с утвержденными протоколами, известными в данной области, а затем, основываясь на наблюдаемых эффектах, опытный клиницист может изменять дозы, способы введения и время введения лекарственных средств. Описанные в настоящем документе соединения, формы соединений и композиции (и там, где это необходимо, другой химиотерапевтический агент) можно вводить одновременно (например, одновременно, по существу, одновременно или в рамках единого протокола лечения), последовательно или раздельно в зависимости от природы заболевания, патологического состояния пациента и фактического выбора другого химиотерапевтического агента, подлежащего введению. Для комбинированных нанесений и применений описанные в настоящем документе соединения, формы соединений и композиции и химиотерапевтический агент необходимо вводить одновременно или, по существу, одновременно. Таким образом, сначала можно вводить соединения, формы соединений и композиции, как описано в настоящем документе, с последующим введением химиотерапевтического агента; или сначала можно вводить химиотерапевтический агент с последующим введением соединений, форм соединений и композиций,как описано в настоящем документе. Это альтернативное введение можно повторять в течение одного протокола лечения. Определение порядка введения и числа повторов введения каждого терапевтического агента в течение протокола лечения находится в компетенции опытного терапевта после оценки подлежащего лечению заболевания и патологического состояния пациента. Например, химиотерапевтический агент можно вводить первым, в особенности, если это цитотоксический агент, и затем лечение можно продолжить введением соединений, форм соединений и композиций, как описано в настоящем документе, с последующим введением, где определено желательным, химиотерапевтического агента и так далее до завершения протокола лечения. Таким образом, согласно опыту и знаниям практикующий врач может изменять каждый протокол введения для лечения в соответствии с потребностями отдельного пациента в процессе проведения лечения. Лечащий врач при вынесении решения об эффективности лечения при вводимых дозах будет рассматривать общее состояние здоровья пациента, а также более явные признаки,такие как ослабление связанных с заболеванием симптомов. Ослабление связанных с заболеванием симптомов, таких как боль, и улучшение общего состояния могут быть использованы для того, чтобы способствовать оценке эффективности лечения. Конкретные неограничивающие примеры возможных комбинированных терапий включают использование соединений, форм соединений и композиций, описанных в настоящем документе, с фебуксостатом, аллопуринолом, пробенецидом, сульфинпиразоном, лозартаном, фенофибратом, бензбромароном или ингибиторами PNP (такими как, но без ограничения, фородезин, ВСХ-1777 или ВСХ-4208). Этот перечень не может трактоваться как закрытый, а напротив должен служить в качестве иллюстративного примера, общего для соответствующей терапевтической области в настоящий момент. Более того, комбинированные схемы лечения могут включать различные способы введения, включая, но без ограничения, пероральное, внутривенное, внутриглазное, подкожное, кожное и местное ингаляционное. Заболевания. В настоящем документе описаны способы лечения заболевания или нарушения у индивида, страдающего заболеванием или нарушением, при этом указанные способы включают введение указанному индивиду эффективного количества полиморфной формы, как описано в настоящем документе, 2-(5 бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты. В настоящем документе также описаны способы предупреждения заболевания или нарушения у индивида, которые включают введение указанному индивиду эффективного количества полиморфной формы, как описано в настоящем документе, 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4H-1,2,4 триазол-3-илтио)уксусной кислоты. Изобретение распространяется на применение соединений, форм соединений и композиций, описанных в настоящем документе, в производстве лекарственных средств, предназначенных для лечения или предупреждения заболевания или нарушения. В некоторых вариантах заболеванием или нарушением является гиперурикемия. В некоторых случаях гиперурикемия характеризуется превышением нормальных уровней мочевой кислоты в крови, стабильно сохраняющихся на протяжении длительного периода времени. В некоторых случаях повышенные уровни уратов в крови могут представлять собой результат усиленной выработки мочевой кислоты (1020%) и/или ее пониженной экскреции почками (80-90%). В некоторых случаях причины гиперурикемии включают ожирение/избыточный вес, чрезмерное употребление алкоголя, избыточное потребление пуринов с пищей (такие продукты, как моллюски, икра, гребешки, чечевица, бобы и красное мясо, особенно ливер - мозги, почки, рубец, печень), некоторые лекарственные препараты, включая аспирин в малых дозах, диуретики, ниацин, циклоспорин, пиразинамид, этамбутол, некоторые лекарственные средства,снижающие высокое артериальное давление, и некоторые химиотерапевтические средства против рака,иммунодепрессанты и цитотоксические агенты, специфические болезненные состояния, особенно связанные с высокой скоростью обновления клеточной популяции (такие как злокачественные опухоли,лейкозы, лимфома или псориаз), а также болезни с повышенным артериальным давлением, расстройства гемоглобина, гемолитическую анемию, серповидно-клеточную анемию, различные нефропатии, миелопролиферативные и лимфопролиферативные заболевания, гиперпаратиреоз, почечное заболевание, состояния, связанные с инсулинорезистентностью, сахарный диабет, реципиентов при трансплантации и,возможно, заболевание сердца, наследственные дефекты ферментов, нарушенную почечную функцию(например, усиленный кругооборот АТР, пониженная гломерулярная фильтрация урата) и контакт со свинцом (сатурнизм или "свинцовая подагра"). В некоторых случаях гиперурикемия может быть бессимптомной, несмотря на ее связь со следующими состояниями: подагра, подагрический артрит, мочекислые камни в мочевом тракте (уролитиаз),отложения мочевой кислоты в мягких тканях (тофус), отложения мочевой кислоты в почках (мочекислая нефропатия) и нарушенная почечная функция, возможно, ведущая к хронической и острой почечной недостаточности. В дальнейших или дополнительных вариантах заболеванием или нарушением является подагра, которая представляет собой состояние, возникающее в результате отложения кристаллов мочевой кислоты в тканях организма. Подагра часто относится к наследственному нарушению способности организма обрабатывать мочевую кислоту, но может также ухудшаться диетой, обогащенной пурином. Недостаточная обработка мочевой кислоты может привести к повышенным уровням мочевой кислоты в крови, вызывая повторные приступы воспаления суставов (артрит), отложения кристаллов мочевой кислоты в суставах и вокруг них, узелковую подагру, образование тофуса, снижение функции почек и камни в почках. Приблизительно 3-5 млн людей в США страдают от приступов подагры, которыми чаще страдают мужчины,чем женщины. В некоторых случаях подагра является одной из самых распространенных форм артрита,и на ее долю приходится приблизительно 5% всех случаев артрита. В некоторых случаях у 10-18% индивидов, страдающих подагрой, наблюдается почечная недостаточность и уролитиаз, которые являются частыми причинами заболеваемости и смертности, связанными с этим заболеванием. Подагра связана с гиперурикемией. В некоторых случаях у индивидов, страдающих подагрой, из организма выводится приблизительно на 40% меньше мочевой кислоты, чем у индивидов без подагры при любой заданной концентрации мочевой кислоты в плазме. В некоторых случаях уровни уратов увеличиваются до тех пор, пока не будет достигнута точка насыщения. В некоторых случаях при достижении точки насыщения происходит выпадение кристаллического осадка уратов. В некоторых случаях кристаллы затвердевают, образуя в суставах и коже кристаллические отложения (тофус), которые вызывают воспаление суставов (артрит). В некоторых случаях отложения образуются в суставной жидкости(синовиальной жидкости) и/или выстилке суставов (синовиальной выстилке). Наиболее частыми областями таких отложений являются большой палец ноги, стопа, лодыжки и кисти рук (относительно редкие области отложений включают уши и глаза). В некоторых случаях кожа вокруг пораженного сустава становится красной и блестящей, при этом пораженный участок становится более чувствительным и болезненным при прикосновении. В некоторых случаях частота приступов подагры увеличивается. В некоторых случаях при отсутствии лечения острые приступы подагры приводят к стойкому повреждению сустава и последующей нетрудоспособности. В некоторых случаях тканевые отложения уратов приводят к острому воспалительному артриту, хроническому артриту, отложениям кристаллов уратов в почечной паренхиме и уролитиазу. В некоторых случаях частота подагрического артрита возрастает в пять раз у индивидов с уровнем уратов в сыворотке от 7 до 8,9 мг/дл и до 50 раз у индивидов с уровнем 9 мг/дл(530 мкмоль/л). В некоторых случаях у индивидов с подагрой развивается почечная недостаточность и конечная стадия почечного заболевания (то есть "подагрическая нефропатия"). В некоторых случаях подагрическая нефропатия характеризуется хронической интерстициальной нефропатией, которой способствует медуллярное отложение мононатрия урата. В некоторых случаях подагра включает болезненные приступы острого, монартикулярного, воспалительного артрита, отложение кристаллов уратов в суставах, отложение кристаллов уратов в почечной паренхиме, уролитиаз (образование камней в мочевом тракте) и нефролитиаз (образование камней в почках). В некоторых случаях наблюдается вторичная подагра у индивидов, страдающих раком, особенно лейкозом,и у индивидов с заболеваниями крови (например, полицитемией, миелоидной метаплазией и т.д.). В некоторых случаях приступы подагры развиваются очень быстро, причем первый приступ часто возникает в ночное время. В некоторых случаях симптомы включают неожиданную тяжелую боль в суставе и крайне выраженную болезненную чувствительность в области пораженного сустава, опухание сустава и блестящую красную или пурпурную кожу вокруг сустава. В некоторых случаях приступы возникают нечасто, продолжаются по 5-10 дней, причем в промежутках между приступами никаких симптомов заболевания не наблюдается. В некоторых случаях приступы становятся более частыми и могут продолжаться дольше, особенно, если никаких мер по поводу заболевания не принимается. В некоторых случаях приступы повреждают пораженный сустав(ы), что приводит к их ригидности, опуханию, ограничению движений и/или от постоянной легкой до умеренной боли. Свинцовое отравление или "свинцовая подагра" представляет собой гиперурикемию, индуцированную свинцом вследствие подавления свинцом тубулярного транспорта уратов, приводящего к снижению почечной экскреции мочевой кислоты. В некоторых случаях подагра развивается более чем у 50% индивидов со свинцовой нефропатией. В некоторых случаях острые приступы свинцовой подагры чаще затрагивают коленный сустав, чем большой палец ноги. В некоторых случаях заболевание почек наблюдается чаще и протекает тяжелее при свинцовой подагре, чем при первичной подагре. В некоторых случаях лечение состоит в исключении дальнейшего контакта индивида со свинцом в применении хелатообразующих агентов для выведения свинца, а также подавлении острого подагрического артрита и гиперурикемии. В некоторых случаях свинцовая подагра характеризуется менее частыми приступами, чем первичная подагра. В определенных случаях подагра, ассоциированная со свинцом, поражает женщин предклимактерического возраста, то есть редкий случай подагры, не связанной со свинцом. В некоторых случаях синдром Леша-Найяна (LNS или синдром Найяна) поражает приблизительно одного из 100000 новорожденных детей. В некоторых случаях причиной LNS является генетически обусловленная недостаточность фермента гипоксантингуанин-фосфорибозилтрансферазы (HGPRT). В некоторых случаях LNS представляет собой Х-сцепленное рецессивное заболевание. В некоторых случаяхLNS присутствует при рождении младенцев мужского пола. В некоторых случаях заболевание приводит к тяжелой подагре, слабому мышечному контролю и умственной отсталости средней степени, которые появляются на первом году жизни. В некоторых случаях заболевание также приводит к аутоагрессивному поведению (например, прикусыванию губ и кончиков пальцев, частым ударам головой), начинающееся на втором году жизни. В некоторых случаях заболевание также приводит к опуханию суставов подагрического типа и тяжелым осложнениям в почках. В некоторых случаях заболевание сопровождается невролгическими симптомами, включая гримассы лица, непроизвольное движение и повторяющиеся движения рук и ног, также наблюдаемые при болезни Гентингтона. Прогноз для индивидов с LNS является слабым. В некоторых случаях ожидаемая продолжительность жизни индивидов с LNS при отсутствии лечения составляет примерно менее 5 лет. В некоторых случаях ожидаемая продолжительность жизни индивидов с LNS, проходящих лечение, составляет примерно более 40 лет. В некоторых случаях гиперурикемия наблюдается у индивидов с сердечно-сосудистым заболеванием (CVD) и/или болезнью почек. В некоторых случаях гиперурикемия наблюдается у индивидов с пред- 11022301 расположенностью к гипертонии, гипертензией, повышенной проксимальной реабсорбцией натрия, микроальбуминурией, протеинурией, болезнью почек, ожирением, гипертриглицеридемией, низким уровнем холестериновой фракции липопротеинов высокой плотности, гиперинсулинемией, гиперлептинемией,гипоадипонектинемией, болезнью периферических, сонных и коронарных артерий, атеросклерозом, застойной сердечной недостаточностью, инсультом, синдромом опухолевого лизиса, эндотелиальной дисфункцией, окислительным стрессом, повышенным уровнем ренина, повышенным уровнем эндотелина и/или повышенным уровнем С-реактивного белка. В некоторых случаях гиперурикемия наблюдается у индивидов с ожирением (например, центральным типом ожирения), высоким артериальным давлением,гиперлипидемией и/или нарушением уровня глюкозы крови натощак. В некоторых случаях гиперурикемия наблюдается у индивидов с метаболическим синдромом. В некоторых случаях подагрический артрит указывает на повышенный риск острого инфаркта миокарда. В некоторых вариантах осуществления введение описанного в настоящем документе соединения индивиду является полезным для снижения вероятности клинических проявлений заболевания или патологического состояния, связанного с гиперурикемией, включая, но без ограничения, предрасположенность к гипертонии, гипертензию, повышенную проксимальную реабсорбцию натрия, микроальбуминурию, протеинурию, болезнь почек, ожирение, гипертриглицеридемию, низкий уровень холестериновой фракции липопротеинов высокой плотности, гиперинсулинемию, гиперлептинемию, гипоадипонектинемию, болезнь периферических, сонных и коронарных артерий, атеросклероз, застойную сердечную недостаточность, инсульт, синдром опухолевого лизиса, эндотелиальную дисфункцию, окислительный стресс, повышенный уровень ренина, повышенный уровень эндотелина и/или повышенный уровень С-реактивного белка. В некоторых вариантах осуществления соединение или форму соединения, как описано в настоящем документе, вводят индивиду, страдающему заболеванием или патологическим состоянием, требующим лечения диуретиком. В некоторых вариантах осуществления соединение или форму соединения, как описано здесь, вводят индивиду, страдающему заболеванием или патологическим состоянием,требующим лечения диуретиком, при этом диуретик вызывает задержку уратов в почках. В некоторых вариантах заболевание или патологическое состояние представляет собой застойную сердечную недостаточность или эссенциальную гипертензию. В некоторых вариантах осуществления введение соединения или формы соединения, как описано в настоящем документе, индивиду полезно для повышения подвижности или улучшения качества жизни. В некоторых вариантах осуществления введение соединения или формы соединения, как описано в настоящем документе, индивиду полезно для лечения или ослабления побочных эффектов противораковой терапии. В некоторых вариантах осуществления введение соединения или формы соединения, как описано в настоящем документе, индивиду полезно для снижения почечной токсичности цисплатина. В некоторых случаях лечение подагры проводят путем понижения выработки мочевой кислоты. В некоторых случаях лечение подагры проводят путем увеличения экскреции мочевой кислоты. В некоторых случаях для лечения подагры применяют ингибиторы URAT-1, ксантиноксидазы, ксантиндегидрогеназы, ксантиноксидоредуктазы, ингибитор пурин-нуклеозидфосфорилазы (PNP), ингибитор транспортера мочевой кислоты (URAT), ингибитор транспортера глюкозы (GLUT), ингибитор GLUT-9, растворенный носитель семейства 2 (облегченный транспортер глюкозы), ингибитор звена 9 (SLC2A9), ингибитор транспортера органического аниона (ОАТ), ингибитор ОАТ-4 или их комбинации. В общем, целями лечения подагры являются: i) уменьшение боли, опухания суставов и продолжительности острого приступа, а также ii) предупреждение дальнейших приступов и повреждения суставов. В некоторых случаях приступы подагры успешно лечат, применяя комбинации терапий. В некоторых случаях подагра представляет собой одну из наиболее поддающихся лечению форм артрита.i) Лечение приступа подагры. В некоторых случаях боль и опухание, связанные с острым приступом подагры, можно подавлять такими лекарственными средствами, как ацетаминофен, стероиды, нестероидные противовоспалительные лекарственные средства (NSAID), адренокортикостероидный гормон (АСТН) или колхицин. В некоторых случаях правильное медикаментозное лечение подавляет подагру в течение от 12 до 24 ч, и через несколько дней после этого лечение можно прекратить. В некоторых случаях медикаментозное лечение применяют в сочетании с покоем, обильным потреблением жидкости, ледяными обертываниями, поднятием и/или защитой пораженной области(ей). В некоторых случаях вышеупомянутые терапии не предупреждают последующих приступов и не влияют на причины заболевания, связанного с нарушением метаболизма мочевой кислоты.ii) Предупреждение дальнейших приступов. В некоторых случаях с целью предупреждения дальнейших приступов подагры стараются снизить уровень мочевой кислоты в сыворотке до таких значений, которые меньше уровней насыщения. В некоторых случаях это достигается посредством снижения выработки мочевой кислоты (например, аллопуринол) или посредством увеличения экскреции мочевой кислоты с помощью урикозурических средств(например, пробенецид, сульфинпиразон, бензбромарон). В некоторых случаях аллопуринол подавляет образование мочевой кислоты, приводя к снижению ее уровня как в сыворотке, так и в моче, причем такое лечение становится полностью эффективным через 2-3 месяца. В некоторых случаях аллопуринол является структурным аналогом гипоксантина (отличаясь только перемещением атомов углерода и азота в положения 7 и 8), подавляющим действие ксантиноксидазы,фермента, ответственного за превращение гипоксантина в ксантин, а ксантина в мочевую кислоту. В некоторых случаях он метабилизируется, превращаясь в соответствующий аналог ксантина, аллоксантин(оксипуринол), который также является ингибитором ксантиноксидазы. В некоторых случаях аллоксантин, хотя и является более мощным ингибитором ксантиноксидазы, менее приемлем фармацевтически по причине низкой пероральной биодоступности. Сообщалось о том, что в некоторых случаях применение аллопуринола сопровождалось летальными реакциями вследствие гиперчувствительности, подавления костного мозга, гепатита и васкулита. В некоторых случаях частота возникновения побочных эффектов может достигать в общей сложности 20% от общего числа лиц, получающих лечение этим лекарственным средством. За последние два десятка лет, прошедших после появления аллопуринола, в лечении нарушений метаболизма мочевой кислоты существенного прогресса достигнуто не было. В некоторых случаях экскрецию мочевой кислоты усиливают урикозурические агенты (например,пробенецид, сульфинпиразон и бензбромарон). В некоторых случаях пробенецид вызывает увеличение секреции мочевой кислоты почечными канальцами и при длительном применении мобилизует запасы уратов в организме. В некоторых случаях у 25-50% индивидов, получавших лечение пробенецидом, не удавалось достичь снижения уровня мочевой кислоты в сыворотке до величин 6 мг/дл. В некоторых случаях отсутствие чувствительности к пробенециду обусловлено непереносимостью лекарства, сопутствующим приемом салицилатов и почечной недостаточностью. В некоторых случаях непереносимость к пробенециду развивается у трети индивидов. В некоторых случаях введение урикозурических средств также приводит к развитию камней в мочевом тракте, желудочно-кишечной непроходимости, желтухи и анемии. Успешное лечение направлено на уменьшение боли, ассоциированной с обострением подагры и длительным повреждением пораженных суставов. Терапевтическими целями являются обеспечение быстрого и безопасного ослабления боли, предотвращение дальнейших приступов, предупреждение образования тофула и последующего артрита и избежание ухудшения других медицинских состояний. Начало лечения зависит от первопричин гиперурикемии, таких как функция почек, диета и прием лекарственных средств. Несмотря на то что подагра является заболеванием, поддающимся лечению, существуют ограниченные терапии, подходящие для управления острой и хронической подагрой, и ряд побочных эффектов, ассоциированых с текущими терапиями. Лекарственное лечение подагры включает управление болью, предупреждение или уменьшение воспаления суставов во время острого приступа подагры и хроническую длительную терапию для поддержания пониженных уровней мочевой кислоты в сыворотке. Нестероидные противовоспалительные лекарственные средства (NSAID) являются эффективными противовоспалительными лекарственными средствами для лечения острой подагры, но часто ассоциированы с раздражением желудочно-кишечной (GI) системы, язвой желудка и кишечника и периодическим кишечным кровотечением. Колхицин для острой подагры является самым распространенным, вводимым перорально в виде таблеток (каждые 1-2 ч до наступления значительного ослабления боли или развития пациентом GI побочных эффектов, таких как тяжелая диарея, тошнота и рвота) или внутривенно. Кортикостероиды, принимаемые короткими курсами, можно вводить перорально или инъецировать непосредственно в пораженный сустав. Лекарственные средства применяются для снижения уровней мочевой кислоты в крови, что увеличивает выведение почками мочевой кислоты путем ингибирования повторного поглощения или уменьшения выработки мочевой кислоты путем блокады ксантиоксидазы. Введение этих лекарственных средств, как правило, не инициируют до тех пор, пока воспаление в результате острого подагрического артрита не уменьшится по интенсивности, так как они могут усилить приступ. Если они уже принимались до приступа, их прием продолжают, но только регулируют после разрешения приступа. Так как много субъектов с повышенными уровнями в крови мочевой кислоты могут не развивать приступы подагры или камни в почках, решение о пролонгированном лечении лекарственными средствами, понижающими уровни мочевой кислоты, является индивидуальным. Наборы. Соединения, формы соединения, композиции и способы, описанные в настоящем документе, позволяют создавать наборы для лечения заболеваний и нарушений, например таких, которые описаны в настоящем документе. Такие наборы содержат соединение, форму соединения, соединения, формы соединений или композиции, описанные в настоящем документе, которые находятся в контейнере, а также, в необязательном порядке, инструкции, разъясняющие применение набора в соответствии с различными способами и подходами, описанными в настоящем документе. В некоторых вариантах такие наборы также включают дополнительную информацию, например ссылки из научной литературы, материалы упаковочного вкладыша, результаты клинических испытаний, и/или сводные данные по всем сведениям подобного рода, которые представляют или доказывают активность и/или преимущества композиции,и/или которые описывают дозирование, введение, побочные эффекты, лекарственные взаимодействия, а также другую информацию, полезную для лиц, предоставляющих медицинскую помощь. Такая информация может быть основана на результатах различных исследований, например исследований на экспериментальных животных с использованием модели in vivo, а также клинических испытаний на человеке. Описанные в настоящем документе наборы могут предоставляться медицинским работникам, включая врачей, медицинских сестер, фармацевтов, руководителей здравоохранения и т.д., а также продаваться в рыночном варианте и/или распространяться в качестве рекламы. В некоторых вариантах наборы также могут продаваться в рыночном варианте непосредственно потребителям. В определенных вариантах осуществления предложены композиции или наборы, содержащие 2-(5 бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетат (например, его полиморф, такой как форма 1), двойной пластиковый мешочек из полиэтилена низкой плотности и HDPE контейнер. В других вариантах осуществления композиция или набор, кроме того, содержит мешочек из фольги (например, безводный мешочек из фольги, такой как безводный мешочек из фольги с запаянными швами). В некоторых вариантах осуществления композиция или набор, кроме того, содержит десиккант; в еще других вариантах осуществления десиккант является необязательным и/или присутствует. В некоторых случаях такая упаковка улучшает стабильность 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4 триазол-3-илтио)ацетата (например, формы 1). В некоторых вариантах осуществления соединения формы соединений и фармацевтические композиции, описанные в настоящем документе, используются для диагностики и в качестве реактивов для научных исследований. Например, в некоторых вариантах осуществления соединения, формы соединений и фармацевтические композиции, взятые отдельно или в комбинации с другими соединениями, используются в качестве инструментов при дифференциальных и/или комбинаторных анализах для выяснения картин экспрессии генов, экспрессируемых в клетках и тканях. В качестве одного неограничивающего примера, характер экспрессии в клетках или тканях, подвергавшихся воздействию одного или более соединений, сравнивают с контрольными клетками или тканями, не подвергавшимися такому воздействию, а полученный характер экспрессии анализируют на дифференциальном уровне экспрессии генов с учетом принадлежности, например, к ассоциации с заболеванием, сигнальному пути, клеточной локализации, уровню экспрессии, размеру, структуре или функции исследуемых генов. Такие анализы можно проводить на стимулированных или не стимулированных клетках, а также в присутствии или отсутствие других соединений, которые могут повлиять на характер экспрессии. Помимо пользы для лечения человека соединения, формы соединений и фармацевтические композиции, описанные в настоящем документе, также полезны в ветеринарии для лечения животных. Примеры и лекарственные средства, представленные ниже, дополнительно иллюстрируют и наглядно поясняют соединения, предлагаемые настоящим изобретением, а также способы получения таких соединений. Следует понимать, что объем настоящего изобретения не ограничивается каким-либо образом объемом приведенных далее примеров и лекарственных средств. ПримерыI. Приготовление 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты. Пример 1 А. Приготовление 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3 илтио)уксусной кислоты посредством промежуточного соединения метил 2-(5-амино-4-(4 циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетата. 2-(5-Бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусную кислоту готовили согласно ранее описанным методикам (см. публикацию заявки на патент США 2009/0197825), как показано на схеме ниже. Пример 1 В. Приготовление 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3 илтио)уксусной кислоты посредством промежуточного соединения 2-(4-(4-циклопропилнафталин-1-ил)5-гидрокси-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты. Приготовление 1-циклопропил-4-изотиоцианатонафталина было описано ранее (см. публикацию заявки на патент США 2009/0197825). Вкратце, 1-бромнафталин связывали с циклопропилмагния бромидом с образованием 1-циклопропилнафталина. Взаимодействие с нитритом натрия обеспечило получение нитропроизводного, которое восстанавливали путем обработки водородом над Pd/C с образованием 1-амино-4-циклопропилнафталина. В заключение, взаимодействие с тиофосгеном обеспечило получение 1-циклопропил-4-изотиоцианатонафталина. 1-Циклопропил-4-изотиоцианатонафталин вступал в реакцию с гидразином и затем циклизировался в присутствии диметилкарбоната с получением 4-(4-циклопропилнафталин-1-ил)-5-меркапто-4 Н-1,2,4 триазол-3-ола. Связывание 4-(4-циклопропилнафталин-1-ил)-5-меркапто-4 Н-1,2,4-триазол-3-ола с 2-хлоруксусной кислотой обеспечило получение 2-(4-(4-циклопропилнафталин-1-ил)-5-гидрокси-4 Н-1,2,4-триазол-3 илтио)уксусной кислоты. Бромирование 2-(4-(4-циклопропилнафталин-1-ил)-5-гидрокси-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты с использованием защитных групп по мере необходимости (например, защиты кислоты как изопропилового эфира) обеспечило получение 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4 триазол-3-илтио)уксусной кислоты. Пример 1 С. Приготовление 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3 илтио)ацетата натрия из метил 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3 илтио)ацетата. Водный раствор гидроксида натрия (1N, 3,0 л, 3,0 моль, 1,25 экв.) добавляли в охлажденную (1518 С) смесь метил 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетата - форма 2 (1,0 кг, 2,39 моль, 1 экв.) и этанола (9 л) при скорости, при которой поддерживается внутренняя температура 25 С. Затем смесь перемешивали при 20-25 С (поддерживая рН 12), производя контроль HPLC и считая реакцию завершенной при суммарном количестве метилового и этилового эфиров 0,5% (3 ч). Затем смесь фильтровали через среднюю воронку со стеклянным фильтром (10-16 мкм) и фильтрат концентрировали в вакууме (40 С) до конечного объема 5,2 л. Добавляли воду (0,6 л) и раствор охлаждали до 0-5 С при перемешивании. Полученную суспензию нагревали (17-18 С) в течение 1 ч, затем охлаждали (0-5 С) в течение 2-3 ч и выдерживали при 0-5 С еще в течение 6-9 ч. Суспензию фильтровали через воронку с фильтром и рубашкой (0-5 С), выстеленную фильтровальной бумагой (3 мкм) или фильтровальной тканью. Полученный кек промывали предварительно охлажденной (3-5 С) водой (31,25 л), оставляли для стекания отработанной жидкости (по меньшей мере 3 ч) и затем сушили в вакуумной печи(18-25 С, в атмосфере азота) до тех пор, пока содержание воды не составило 13% мас./мас. (8 дней). 2(5-Амино-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетат натрия выделяли в виде светло-желтого твердого вещества (696,4 г; KF = 13%).II. Приготовление кристаллических полиморфных форм 2-(5-бром-4-(4-циклопропилнафталин-1 ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты. Пример 2. Приготовление 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3 илтио)уксусной кислоты - форма 1. 2-(5-Бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусную кислоту - форму 1 готовили из сырого 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетата натрия, как описано ниже Стадия 1. 2-(5-Бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетат натрия (60 г) и воду (300 мл) перемешивали и быстро нагревали (40-50 С) до растворения всех твердых веществ. Раствор охлаждали и перемешивали в ледяной ванне в течение 1-2 ч, после чего начиналось образование кристаллов (или, если кристаллизация не начиналась, в раствор добавляли затравку незначительного количества кристаллов 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетата натрия). Перемешивание в ледяной ванне продолжали до завершения кристаллизации и затем твердую фазу изолировали путем фильтрации через вакуумную воронку-фильтр (средней пористости) в вакууме. Фильтрационный кек промывали ледяной водой (в количестве, достаточном для покрытия фильтрационного кека) и жидкость оставляли для полного стекания под вакуумом для получения влажного фильтрационного кека (126,5 г). Стадия 2. Фильтрационный кек растворяли в воде (70 г присутствует в фильтрационном кеке плюс 130 мл; концентрация 200-250 мг/мл) при 60-70 С и медленно добавляли в уксусную кислоту (200 мл). Раствор уксусной кислоты/воды (1:1 об/об) охлаждали до комнатной температуры при непрерывном перемешивании и затем охлаждали до 0 С, что вызывало образование кристаллов, которые изолировали путем вакуумной фильтрации при помощи вакуумной воронки-фильтра средней пористости. Твердую фазу промывали ледяной кислотой/водой (1:1 об/об) и сушили в вакуумной печи с получением 2-(5 бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты (39,5 г, 78%). Пример 3. Приготовление 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3 илтио)уксусной кислоты - форма 2. 2-(5-Бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусную кислоту - форма 2 готовили из 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетата натрия, как описано ниже(217 мл) нагревали (30-35 С) при энергичном перемешивании в течение 10-15 мин, во время которого суспензия растворялась, оставляя только следовое количество твердых веществ. Смесь фильтровали через среднюю воронку со стеклянным пористым фильтром и прозрачный фильтрат охлаждали до 10 С. Приблизительно половину смеси водного раствора бромистого водорода (48 мас.%, 18 г, 106,8 ммоль,1,05 экв.) и деионизированной воды (13 мл) добавляли в фильтрат в течение 10 мин при 10-15 С, во время которого происходило образование твердых веществ. Добавляли этилацетат (347 мл) при энергичном перемешивании в растворенную твердую фазу. Оставшийся раствор бромистого водорода добавляли в течение 10 мин при 10 С и перемешивание продолжали в течение 5-10 мин, во время которого происходило образование мутной суспензии. Перемешивание останавливали, фазам позволяли разделиться и водный слой удаляли. Органический слой промывали деионизированной водой (110 мл) при энергичном перемешивании в течение 5-10 мин и после разделения фаз водный слой удаляли. Органический слой нагревали до 45-50 С и растворитель удаляли с использованием слабого вакуума, что приводило к образованию суспензии (конечный объем 200 мл), которую нагревали (45-50 С) при умеренном перемешивании в течение 1 ч, постепенно (3-4 ч) охлаждали до 20-25 С и выдерживали при 20-25 С еще в течение 12 ч и в заключение охлаждали до 5-10 С и выдерживали в течение 20-30 мин. Суспензию затем фильтровали под вакуумом через воронку Бюхнера, выстеленную фильтровальной бумагой ватман 3. Происходила быстрая фильтрация твердой фазы, и маточную жидкость циклически пропускали через сосуд для выделения остаточных твердых веществ, которые объединяли с начальной партией. Твердые вещества промывали холодным (5 С) этилацетатом (26 мл) и оставляли сушиться на воронке в течение не менее 10 мин, затем смачивали в н-гептане (30 мл) в течение не менее 10 мин и снова применяли вакуум в течение 6 ч. Твердую фазу переносили в сушильную чашку и сушили в вакуумной печи (25 мм рт.ст.) в течение не менее 16 ч при 35-40 С в атмосфере азота. 2-(5-Бром-4-(4-циклопропилнафталин-1-ил)-4 Н 1,2,4-триазол-3-илтио)уксусную кислоту - форма 2 получали в виде свободнотекучего грязно-белого твердого вещества (28,39 г, 69%), содержащего следовые количества воды (0,16 мас.%) и этилацетата Этилацетат (200 мл) добавляли в раствор 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4 триазол-3-илтио)уксусной кислоты - полиморфной формы 1 (30 г) в ацетоне (200 мл) при 60 С. Часть растворителя (200 мл) удаляли под низким вакуумом и добавляли свежий этилацетат (200 мл) с последующим другим циклом дистилляции, во время которого начинался процесс кристаллизации. Температуру водяной ванны медленно повышали до 70 С, во время которого проводили четыре дополнительных цикла добавления этилацетата/дистилляции до получения конечного объема 200 мл. Смесь оставляли охлаждаться до комнатной температуры и затем помещали в холодильник на ночь. Твердую фазу изолировали путем фильтрации, промывали ледяным этилацетатом и сушили в вакуумной печи с получением 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты - формы 2. Способ 2. Раствор 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты формы 1 в одном из растворителей, перечисленных ниже, медленно выпаривали при комнатной температуре до кристаллизации, замораживали и кристаллы твердого вещества изолировали и промывали растворителем с получением твердой полиморфной формы 2, содержащей следовые количества растворителя и воды, как указано. Способ 3. Твердую полиморфную форму 1 уравновешивали его насыщенным раствором ацетонитрила, этилацетата или толуола при 60 С в течение 6 дней с получением твердой полиморфной формы 2. Твердую полиморфную форму 1 уравновешивали его насыщенным раствором ацетона при 60 С в течение 6 дней, что приводило к разложению. Способ 4. Твердую полиморфную форму 1 и растворитель (20 мкл) нагревали при 60 С в течение 13 дней с получением твердой полиморфной формы 2.III. Анализ кристаллических полиморфных форм 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н 1,2,4-триазол-3-илтио)уксусной кислоты. Пример 5 А. Анализ кристаллической полиморфной формы 1. Порошковая рентгеновская дифракция. Картина порошковой рентгеновской дифракции полиморфной формы 1 представлена на фиг. 1 (исходные данные) и 2 (с вычитанием фоновых значений и удалением K2); наблюдаемые и репрезентативные пики на картине XRPD представлены в таблицах ниже (получены с коррекцией на фоновое значение и удалением K2). Дифференциальная сканирующая калориметрия (DSC). Кривые дифференциальной сканирующей калориметрии для формы 1 представлены на фиг. 3; записана температура перехода 150,7 С. Сканирующая электронная микроскопия (SEM). Анализ SEM показал, что первичные кристаллы формы 1 состоят из агломератов (типичный размер 25 мкм) кристаллов пластинчатого типа (размер 5 мкм). Термогравиметрический анализ (TGA). Термограммы TGA для формы 1 представлены на фиг. 4(а) и (b), которые указывают, что материал не содержит значительных уровней летучих веществ. Растворимость. Форму 1 (25 мг) и ацетатный буфер (25 мМ, рН 5, 4 мл), приготовленный с хлоридом натрия и без него (ионная сила доведена до 0,1 М), помещали в стеклянную колбу, которую герметично закрывали и помещали на лабораторный встряхиватель в инкубатор при 25 С. Через 1, 5 и 7 дней образцы фильтровали и анализировали методом HPLC. Растворимость формы 1 (мг/мл) в разные моменты времени с хлоридом натрия и без него показана в таблице ниже Пример 5 В. Анализ кристаллической полиморфной формы 2. Порошковая рентгеновская дифракция. Картина порошковой рентгеновской дифракции полиморфной формы 2 представлена на фиг. 5 (исходные данные) и 6 (с вычитанием фона и удалением K2); наблюдаемые и репрезентативные пики на картине XRPD представлены в таблицах ниже (полученны с коррекцией на фоновое значение и удалением K2). На фиг. 7 представлено наложение картин XRPD (смещение по оси Y) формы 1 (нижняя) и формы 2(верхняя). Дифференциальная сканирующая калориметрия (DSC). Кривые дифференциальной сканирующей калориметрии для формы 2 представлены на фиг. 8, записывали точку плавления при 174,7 С. 1 Н NMR спектроскопия. Спектр 1 Н NMR, снятый в DMSO-d6, полиморфной формы 2 представлен на фиг. 9, главные пики перечислены в таблице нижеHPLC. Кривые HPLC полиморфной формы 2 представлены на фиг. 10. Перечень пиков для следов представлен в таблице ниже Сканирующая электронная микроскопия (SEM). Анализ SEM показал, что первичные кристаллы формы 2 состоят из агломератов (типичный размер 25 мкм) колонновидных кристаллов (размер 10 мкм). Термогравиметрический анализ (TGA). Наложение термограмм TGA для формы 2 представлено на фиг. 11, которые указывают на то, что материал не содержит значительных уровней летучих веществ. Растворимость. Форму 2 (25 мг) и ацетатный буфер (25 мМ, рН 5, 4 мл), приготовленные с хлоридом натрия и без него (ионная сила доведена до 0,1 М), помещали в стеклянную колбу, которую герметично закрывали и помещали на лабораторный встряхиватель в инкубатор при 25 С. Через 1, 5 и 7 дней образцы фильтровали и анализировали методом HPLC. Растворимость формы 2 (мг/мл) в разные моменты времени, с хлоридом натрия и без него, показана в таблице ниже Форму 2 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетата тестировали в различных условиях для определения стабильности лекарственного средства. Деградации упакованной формы 2 не наблюдали в течение 1 месяца в условиях ускоренной деградации (40 С-75% RH, или 25 С 60% RH). Упаковка представляла собой двойные мешочки из полиэтилена низкой плотности внутри Стабильность кристаллического полиморфного 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н 1,2,4-триазол-3-илтио)ацетата. Было обнаружено, что кристаллические полиморфы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)4 Н-1,2,4-триазол-3-илтио)ацетата проявляют повышенную стабильность по сравнению с аморфными твердыми формами карбоновой кислоты. Улучшенная стабильность кристаллических полиморфов 2-(5 бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетата обеспечивает получение фармацевтических лекарственных форм, проявляющих пониженную изменчивость дозы, присутствующей в заданной лекарственной форме, уменьшение присутствия примесей в конечном фармацевтическом продукте и улучшенную длительность хранения готовых лекарственных форм по сравнению с фармацевтической лекарственной формой, приготовленной с аморфной твердой формой карбоновой кислоты.IV. Аналитические методы. Пример 6 А. Порошковая рентгеновская дифракция (XRPD). Картины XRPD снимали на дифрактометре D8 Advance фирмы Bruker методом Брэгга-Брентано с конфигурацией тета/тета. Падающий пучок рентгеновских лучей получали с использованием излучения медного анода CuK (=1,5418 ) (напряжение на трубке = 40 кВ, сила тока на трубке = 40 мА), параллельно с 1,00 мм первичной щелью Соллера со стороны источника и 1,0 мм вторичной щелью Соллера со стороны детектора. CuK-излучение удаляли с помощью 1,0 мм щели графитового монохроматора со стороны детектора. Сцинтилляционный счетчик (NaI) использовали с щелью 0,1 мм. Использовали непрерывное сканирование в диапазоне 2-50 2 с размером шага 0,02 2 и шаговым периодом 5 с. Приблизительно 25 мг материала осторожно прессовали на Si пластинку с нулевым фоном для обеспечения плоского приготовления. Данные собирали с использованием программного обеспечения BrukerDiffracplus XRD Commander версия 2.3. Перечень пиков получали с использованием программного обеспечения Bruker Diffracplus EVA версия 9.0 с вычитанием фоновых значений и удалением K2. Прибор калибровали при помощи порошка кремния согласно NIST alumina standard SRM1976. Параметры прибора XRPD (Bruker D8 Advance) приведены в таблице ниже Пример 6 В. Дифференциальная сканирующая калориметрия (DSC). Анализ методом дифференциальной сканирующей калориметрии проводили с использованием дифференциального сканирующего калориметра Q2000 фирмы ТА Instruments. Калибровку температуры проводили с использованием контролепригодного металлического индия согласно NIST. Образцы в дубликате готовили путем плотного закрытия приблизительно 2-5 мг (точно записанных) материала в негерметичном тигле ТА Tzero. Негерметичный тигль/крышку ТА Tzero взвешивали и использовали в качестве образца сравнения. Образцы нагревали со скоростью 10 С/мин от 25 до 200 С при продувке газообразным азотом со скоростью 50 мл/мин. Измеряли температуру плавления (Tm) и теплоту плавления(Hm) с использованием программного обеспечения ТА Universal Analysis software версия 4.4. Пример 6 С. Сканирующая электронная микроскопия (SEM). Изображения SEM собирали на сканирующем электронном микроскопе фирмы JEOL SEM модельJSM-6100. Образец впрыскивали на держатель SEM, содержащий двустороннюю углеродную пленку, и покрывали золотом методом напыления в течение 60 с с использованием Denton Desk II unit. SEM функ- 21022301 ционировал при ускоряющем напряжении 15 кВ. Изображения собирали с использованием программного обеспечения DIPS версия 2.5 (Digital Imaging Processing System) с медленным сканированием, установленным на 800640 пикселей и интеграторе при 50 мкс без усреднения. Изображения собирали в диапазоне от 50 Х до 5000 Х. Пример 6D. Термогравиметрический анализ (TGA). Термогравиметрический анализ (TGA) проводили с использованием термогравиметрического анализатора Q5000 фирмы ТА Instrument. Калибровку по массе проверяли с использованием сертифицированной массы 50 мг. Образцы в дубликате готовили путем взвешивания 5-10 мг материала в Pt тигле ТА. Образцы нагревали со скоростью 10 С/мин до 200 С при продувке газообразным азотом со скоростью 25 мл/мин. Потери массы измеряли с использованием программного обеспечения ТА Universal 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3 характеризующийся пиками при 10,46, 18,76 и 19,830,1 2. 2. Кристаллический полиморф по п.1, дополнительно характеризующийся по меньшей мере одним добавочным пиком при 18,21 или 23,080,1 2. 3. Кристаллический полиморф по п.1, изготовленный способом, включающим стадию кристаллизации 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты из смеси воды и этилацетата. 4. Твердая фармацевтическая композиция для лечения или предупреждения гиперурикемии или заболевания, вызванного повышенными уровнями мочевой кислоты, содержащая эффективное количество 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты, включающей кристаллический полиморф по п.1 или 3 в качестве активного ингредиента; и по меньшей мере одно вспомогательное вещество или носитель. 5. Твердая фармацевтическая композиция для лечения или предупреждения подагры, содержащая эффективное количество 2-(5-бром-4-(4-циклопропилнафталина-1-ил)-4 Н-1,2,4-триазол-3 илтио)уксусной кислоты, включающей кристаллический полиморф по п.1 или 3 в качестве активного ингредиента; и по меньшей мере одно вспомогательное вещество или носитель. 6. Способ лечения или предупреждения гиперурикемии или заболевания, вызванного повышенными уровнями мочевой кислоты, включающий введение эффективного количества кристаллического полиморфа по п.1 или 3. 7. Способ лечения или предупреждения подагры, включающий введение эффективного количества кристаллического полиморфа по п.1 или 3. 8. Кристаллический полиморф 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3 илтио)уксусной кислоты характеризующийся пиками при 10,32, 18,84 и 20,750,1 2. 9. Кристаллический полиморф по п.8, дополнительно характеризующийся по меньшей мере двумя добавочными пиками при 6,80, 21,54, 24,97, 25,53, 27,28 и 27,600,1 2. 10. Кристаллический полиморф по п.8, изготовленный способом, включающим стадию кристаллизации 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты из смеси воды и уксусной кислоты. 11. Твердая фармацевтическая композиция для лечения или предупреждения гиперурикемии или заболевания, вызванного повышенными уровнями мочевой кислоты, содержащая эффективное количество 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты, включаю- 22022301 щей кристаллический полиморф по п.8 или 10 в качестве активного ингредиента и по меньшей мере одно вспомогательное вещество или носитель. 12. Твердая фармацевтическая композиция для лечения или предупреждения подагры, содержащая эффективное количество 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3 илтио)уксусной кислоты, включающей кристаллический полиморф по п.8 или 10 в качестве активного ингредиента; и по меньшей мере одно вспомогательное вещество или носитель. 13. Способ лечения или предупреждения гиперурикемии или заболевания, вызванного повышенными уровнями мочевой кислоты, включающий введение эффективного количества кристаллического полиморфа по п.8 или 10. 14. Способ лечения или предупреждения подагры, включающий введение эффективного количества кристаллического полиморфа по п.8 или 10. 15. Твердая фармацевтическая композиция для лечения или предупреждения гиперурикемии или заболевания, вызванного повышенными уровнями мочевой кислоты, содержащая форму 1 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты по п.8 в качестве активного ингредиента,форму 2 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты по п.1 в качестве активного ингредиента и по меньшей мере одно вспомогательное вещество или носитель. 16. Твердая фармацевтическая композиция для лечения или предупреждения подагры, содержащая форму 1 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты по п.8 в качестве активного ингредиента; форму 2 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты по п.1 в качестве активного ингредиента и по меньшей мере одно вспомогательное вещество или носитель. 17. Способ получения кристаллического полиморфа 2-(5-бром-4-(4-циклопропилнафталин-1-ил)4 Н-1,2,4-триазол-3-илтио)уксусной кислоты, который включает растворение 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)ацетата натрия в воде с образованием раствора; добавление минеральной кислоты; добавление этилацетата; отделение органического слоя; осаждение кристаллического полиморфа из органического слоя; при этом кристаллический полиморф характеризуется пиками при 10,46, 18,76 и 19,830,1 2. 18. Способ по п.17, который характеризуется одним или несколькими из следующего: минеральная кислота представляет собой бромисто-водородную кислоту; минеральную кислоту добавляют в количестве 1,05 экв.; объем органического слоя уменьшают для осаждения кристаллического полиморфа; органический слой охлаждают для осаждения кристаллического полиморфа; кристаллический полиморф фильтруют и промывают и/или кристаллический полиморф дополнительно характеризуется по меньшей мере одним добавочным пиком при 18,21 или 23,080,1 2. 19. Способ получения кристаллического полиморфа 2-(5-бром-4-(4-циклопропилнафталин-1-ил)4 Н-1,2,4-триазол-3-илтио)уксусной кислоты, включающий:(a) приведение в контакт 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3 илтио)ацетата натрия с водным раствором бромистого водорода и органического растворителя с образованием водной фазы и органической фазы;(b) изолирование органической фазы из смеси стадии (а) и(c) кристаллизация 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты из органической фазы. 20. Способ получения кристаллического полиморфа 2-(5-бром-4-(4-циклопропилнафталин-1-ил)4 Н-1,2,4-триазол-3-илтио)уксусной кислоты,включающий кристаллизацию 2-(5-бром-4-(4 циклопропилнафталин-1-ил)-4 Н-1,2,4-триазол-3-илтио)уксусной кислоты из смеси воды и этилацетата.
МПК / Метки
МПК: C07D 249/12, A61K 31/4196, A61P 9/00
Метки: 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4h-1,2,4-триазол-3-илтио)уксусной, полиморфные, формы, применение, кислоты
Код ссылки
<a href="https://eas.patents.su/29-22301-polimorfnye-formy-2-5-brom-4-4-ciklopropilnaftalin-1-il-4h-124-triazol-3-iltiouksusnojj-kisloty-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Полиморфные формы 2-(5-бром-4-(4-циклопропилнафталин-1-ил)-4h-1,2,4-триазол-3-илтио)уксусной кислоты и их применение</a>
Предыдущий патент: Разделение энантиомеров 2-амино-3,6-дигидро-4-диметиламино-6-метил-1,3,5-триазина с использованием винной кислоты
Следующий патент: Водосодержащая пестицидная суспензия
Случайный патент: Коллоидно-жидкокристаллический композит для электрооптических устройств