Ингибиторы вируса гепатита с
Номер патента: 21194
Опубликовано: 30.04.2015
Авторы: Пак Шон К., Кеннет Дж., Пател Бхарат П., Тимонко Стивен, Белема Маконен, Натали Джр.
Формула / Реферат
1. Способ получения соединения формулы (III)
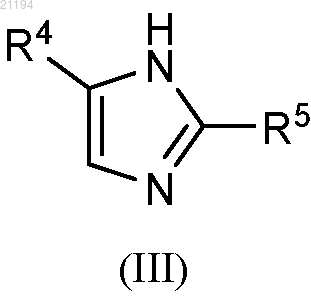
или его фармацевтически приемлемой соли,
где R4 и R5 независимо выбраны из атома водорода, (С1-С6)алкила, (C6-C10)арила, (С6-С10)арил(С1-С6)алкила, гетероциклила и гетероциклил(С1-С2)алкила, где гетероциклил представляет собой 5-6-членный гетероциклил, включающий 1-2 гетероатома, выбранных из N, S и О,
включающий обработку соединения формулы (IV)
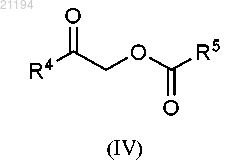
ацетатом аммония в присутствии основания.
2. Способ по п.1, отличающийся тем, что основание выбрано из третичного амина, ароматического амина, анилина и замещенного имидазола, выбранного из 1-метилимидазола, 2-метилимидазола, 4-метилимидазола, 4-хлоримидазола, 2-хлоримидазола, 4-цианоимидазола и бензимидазола.
3. Способ по п.1, отличающийся тем, что основание выбрано из 1,4-диметилпиперазина, 3-хинуклидинола, 3-метилпиридина, диметилбутиламина, N,N-диметиланилина, димерпранола, хиноксазолина, креатинина, имидазола, морфолина, N-метилморфолина, 1,8-диазабициклоундец-7-ена, 1,4-диазабицикло[2.2.2]октана, коллидина, диизопропилэтиламина и 2,6-лутидина.
4. Способ по п.1, отличающийся тем, что основание представляет собой имидазол.
Текст
ИНГИБИТОРЫ ВИРУСА ГЕПАТИТА С Изобретение относится к способу получения соединения формулы (III) которое можно использовать в лечении инфекции, вызываемой вирусом гепатита С (ВГС). Перекрестная ссылка на родственные заявки Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США 61/260115, поданной 11 ноября 2009, и предварительной заявке на патент США 61/378806, поданной 31 августа 2010, которые включены в настоящую заявку посредством ссылки во всей своей полноте. Настоящее изобретение относится к способам получения соединений, которые могут быть использованы в лечении инфекции, вызываемой вирусом гепатита С (ВГС). ВГС является самым распространенным патогеном человека, которым инфицировано приблизительно 170 млн человек во всем мире, что примерно в пять раз превышает количество инфицированных вирусом иммунодефицита человека типа 1. У существенной части ВГС-инфицированных индивидуумов в дальнейшем развивается тяжелое прогрессирующее заболевание печени, включая цирроз печени и печеночно-клеточный рак. В настоящее время стандартное лечение ВГС, которое включает использование комбинации пегилированного интерферона и рибавирина, имеет неоптимальную частоту достижения стойкого вирусологического ответа и вызывает многочисленные побочные эффекты. Очевидно, что назрела необходимость в разработке эффективной терапии, предназначенной для решения данной медицинской проблемы. ВГС относится к вирусам, содержащим одноцепочечную (+)РНК. На основании сравнения предсказанной аминокислотной последовательности и обширного сходства в нетранслируемой 5'-области РНК ВГС относят к отдельному роду семейства флавивирусов (Flaviviridae). Вирусные частицы всех членов семейства флавивирусов представляют собой покрытые оболочкой вирионы, геном которых состоит из одноцепочечной (+)РНК, кодирующей все известные специфичные вирусные белки, которая транслируется как одна непрерывная открытая рамка считывания. Значительная гетерогенность нуклеотидной и кодируемой аминокислотной последовательности,найденная в различных областях генома ВГС, обусловлена высокой частотой ошибок, возникающих при репликации, выполняемой кодируемой вирусом РНК-зависимой РНК-полимеразой, которая лишена корректирующей активности. Охарактеризовано по меньшей мере шесть основных генотипов и описано более 50 подтипов, имеющих широкое распространение. Клиническое значение генетической гетерогенности ВГС проявляется в тенденции возникновения мутаций при использовании монотерапии, поэтому желательно использовать дополнительные схемы лечения. Возможность модулирующего воздействия генотипов на патогенез и терапию остается невыясненной. Геном ВГС, представляющий собой одноцепочечную РНК, содержит приблизительно 9500 нуклеотидов и имеет единственную открытую рамку считывания (ORF), кодирующую один большой полипротеин, состоящий из приблизительно 3000 аминокислот. В инфицированных клетках данный полипротеин расщепляется в нескольких сайтах клеточными и вирусными протеазами, что приводит к образованию структурных и неструктурных (NS) белков. У ВГС образование зрелых неструктурных белков (NS2, NS3,NS4A, NS4B, NS5A и NS5B) зависит от двух вирусных протеаз. Первая протеаза предположительно является металлопротеазой и расцепляет связь NS2-NS3; вторая протеаза (N-концевая область NS3, в данном описании также именуемая NS3-протеазой) является сериновой протеазой и расщепляет полипротеин во всех сайтах, следующих за NS3, как в цис-положении, а именно по сайту NS3-NS4A, так и в трансположении, по остальным сайтам NS4A-NS4B, NS4B-NS5A, NS5A-NS5B. Белок NS4A, по-видимому,является многофункциональным белком, играет роль кофактора NS3-протеазы и участвует в мембраной локализации NS3 и других компонентов репликации вируса. Образование NS3-NS4A комплекса необходимо для формирования специфической протеазной активности и приводит к увеличению эффективности протеолитического расщепления. Белок NS3 также обладает активностью нуклеозидтрифосфатазы и РНК-хеликазы. NS5B (в данном описании также именуемый ВГС-полимеразой) представляет собой РНК-зависимую РНК-полимеразу и вместе с другими ВГС-белками, включая NS5A, в составе репликазного комплекса участвует в репликации ВГС. В качестве соединений, пригодных для лечения ВГС-инфицированных пациентов, желательно использовать соединения, которые селективно ингибируют репликацию ВГС. В частности, желательно использовать соединения, которые являются эффективными ингибиторами функции белка NS5A. Белокet al., J. Virol, 83:4395 (2009); Appel, N. et al., J. Biol. Chem., 281:9833 (2006); Huang, L., J. Biol. Chem.,280:36417 (2005); Rice, С. et al., заявка на патент WO 2006/093867. Согласно первому аспекту настоящего изобретения предложен способ получения соединения формулы (III) или его фармацевтически приемлемой соли,где R4 и R5 независимо выбраны из атома водорода, (С 1-С 6)алкила, (C6-C10)арила, (C6-C10)арил(С 1-1 021194 С 6)алкила, гетероциклила и гетероциклил(С 1-С 2)алкила, где гетероциклил представляет собой 5-6 членный гетероциклил, включающий 1-2 гетероатома, выбранных из N, S и О,включающий обработку соединения формулы (IV) ацетатом аммония в присутствии основания. Во втором варианте изобретения основание выбрано из третичного амина, ароматического амина,анилина и замещенного имидазола, выбранного из 1-метилимидазола, 2-метилимидазола, 4 метилимидазола, 4-хлоримидазола, 2-хлоримидазола, 4-цианоимидазола и бензимидазола. При этом основание может быть выбрано из 1,4-диметилпиперазина, 3-хинуклидинола, 3 метилпиридина, диметилбутиламина, N,N-диметиланилина, димерпранола, хиноксазолина, креатинина,имидазола,морфолина,N-метилморфолина,1,8-диазабициклоундец-7-ена,1,4 диазабицикло[2.2.2]октана, коллидина, диизопропилэтиламина и 2,6-лутидина. Другие аспекты настоящего изобретения могут включать подходящие комбинации вариантов осуществления изобретения, раскрытых в данном описании. В данном описании также раскрыты другие аспекты и варианты осуществления изобретения. Описание настоящего изобретения следует истолковывать в соответствии с законами и принципами образования химических связей. В некоторых случаях необходимо удалить атом водорода, чтобы поместить в данное положение заместитель. Необходимо понимать, что соединения согласно настоящему изобретению представляют собой соединения, которые являются достаточно стабильными для их использования в качестве фармацевтического агента. Подразумевается, что определение любого заместителя или переменной в конкретном положении в молекуле не зависит от его определений в любых других положениях в данной молекуле. Например, когда R1 и R2, оба, содержат группу R4, данные две группы R4 могут быть одинаковыми или разными. Все патенты, заявки на патенты и литературные публикации, цитированные в описании изобретения, включены в данное описание посредством ссылки во всей своей полноте. В случае несоответствия настоящее описание, включая определения, имеет преимущественную силу. В настоящем описании приведенные ниже термины имеют значения, указанные в определениях этих терминов. В контексте данного описания формы единственного числа существительных включают соответствующие формы множественного числа, если из контекста ясно не следует иное. Если не указано иное, все арильные, циклоалкильные и гетероциклические группы согласно настоящему изобретению могут иметь заместители, описанные в каждом из соответствующих определений. Например, арильная часть арилалкильной группы может иметь заместители, описанные в определении термина "арил". Термин "алкенил" в контексте данного описания относится к группе с нормальной или разветвленной цепью, содержащей от двух до шести атомов углерода и по меньшей мере одну двойную углеродуглеродную связь. Термин "алкенилокси" в контексте данного описания относится к алкенильной группе, соединенной с основной молекулярной группировкой через атом кислорода. Термин "алкенилоксикарбонил" в контексте данного описания относится к группе алкенилокси, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "алкокси" в контексте данного описания относится к алкильной группе, соединенной с основной молекулярной группировкой через атом кислорода. Термин "алкоксиалкил" в контексте данного описания относится к алкильной группе, содержащей в качестве заместителей одну, две или три группы алкокси. Термин "алкоксиалкилкарбонил" в контексте данного описания относится к алкоксиалкильной группе, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "алкоксикарбонил" в контексте данного описания относится к группе алкокси, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "алкилкарбонилокси" в контексте данного описания относится к алкилкарбонильной группе, соединенной с основной молекулярной группировкой через атом кислорода. Термин "алкил" в контексте данного описания относится к группе, происходящей от насыщенного углеводорода с нормальной или разветвленной цепью, содержащего от одного до шести атомов углерода. В соединениях согласно настоящему изобретению, у которых R4 представляет собой алкил, данный алкил может необязательно формировать конденсированное 3-членное кольцо с соседним атомом углерода с образованием следующей структуры: где n выбран из 1 и 2. Термин "алкилкарбонил" в контексте данного описания относится к алкильной группе, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "алкилсульфанил" в контексте данного описания относится к алкильной группе, соединенной с основной молекулярной группировкой через атом серы. Термин "алкилсульфонил" в контексте данного описания относится к алкильной группе, соединенной с основной молекулярной группировкой через сульфонильную группу. Термин "амино" в контексте данного описания относится к -NRqRs, где Rq и Rs независимо выбраны из атома водорода, алкила и арилалкила. Термин "арил" в контексте данного описания относится к фенильной группе или бициклической конденсированной кольцевой системе, у которой одно из колец или оба кольца представляют собой фенильную группу. Бициклические конденсированные кольцевые системы состоят из фенильной группы,конденсированной с 4-6-членным ароматическим или неароматическим карбоциклическим кольцом. Арильные группы согласно настоящему изобретению могут быть соединены с основной молекулярной группировкой через любой атом углерода группы, который способен иметь заместители. Типичные примеры арильных групп включают инданил, инденил, нафтил, фенил и тетрагидронафтил, но не ограничены ими. Арильные группы согласно настоящему изобретению необязательно содержат один, два, три,четыре или пять заместителей, независимо выбранных из алкенила, алкокси, алкоксиалкила, алкоксикарбонила, алкила, алкилкарбонила, второй арильной группы, арилалкокси, арилалкила, арилкарбонила,циано, атома галогена, галогеналкокси, галогеналкила, гетероциклила, гетероциклилалкила, гетероциклилкарбонила, гидрокси, гидроксиалкила, нитро, -NRxRy, (NRxRy)алкила, оксо и -P(O)OR2, где каждый R независимо выбран из атома водорода и алкила, и где алкильная часть арилалкила и гетероциклилалкила не содержит заместители, и где вторая арильная группа, арильная часть арилалкила, арильная часть арилкарбонила, гетероциклил и гетероциклильная часть гетероциклилалкила и гетероциклилкарбонила необязательно содержат один, два или три заместителя, независимо выбранные из алкокси, алкила, циано, атома галогена, галогеналкокси, галогеналкил и нитро. Термин "арилалкокси" в контексте данного описания относится к арильной группе, соединенной с основной молекулярной группировкой через группу алкокси. Термин "арилалкоксикарбонил" в контексте данного описания относится к группе арилалкокси, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "арилалкил" в контексте данного описания относится к алкильной группе, содержащей в качестве заместителей одну, две или три арильные группы. Кроме того, алкильная часть арилалкила необязательно содержит в качестве заместителей одну или две дополнительные группы, независимо выбранные из алкокси, алкилкарбонилокси, атома галогена, галогеналкокси, галогеналкила, гетероциклила,гидрокси и -NRcRd, где гетероциклил дополнительно необязательно содержит один или два заместителя,независимо выбранные из алкокси, алкила, незамещенного арила, незамещенного арилалкокси, незамещенного арилалкоксикарбонила, атома галогена, галогеналкокси, галогеналкил, гидрокси, -NRxRy и оксо. Термин "арилкарбонил" в контексте данного описания относится к арильной группе, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "основание" в контексте данного описания относится к соединению, которое является акцептором протонов. Термин "непрерывный процесс" в контексте данного описания относится к многостадийной методике, которая не предполагает выделение получаемых промежуточных соединений. Термин "циано" в контексте данного описания относится к -CN. Термин "циклоалкил" в контексте данного описания относится к насыщенной моноциклической или бициклической углеводородной кольцевой системе, содержащей от трех до четырнадцати атомов углерода и не содержащей гетероатомы. Типичные примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил, бицикло[3.1.1]гептил и адамантил, но не ограничены ими. Циклоалкильные группы согласно настоящему изобретению необязательно имеют один, два, три,четыре или пять заместителей, независимо выбранных из алкокси, алкила, арила, циано, атома галогена,галогеналкокси, галогеналкила, гетероциклила, гидрокси, гидроксиалкила, нитро и -NRxRy, где арил и гетероциклил дополнительно необязательно содержат один, два или три заместителя, независимо выбранные из алкокси, алкила, циано, атома галогена, галогеналкокси, галогеналкила, гидрокси, нитро и оксо. Термин "циклоалкилокси" в контексте данного описания относится к циклоалкильной группе, соединенной с основной молекулярной группировкой через атом кислорода. Термин "циклоалкилоксикарбонил" в контексте данного описания относится к группе циклоалки-3 021194 локси, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "циклоалкилсульфонил" в контексте данного описания относится к циклоалкильной группе,соединенной с основной молекулярной группировкой через сульфонильную группу. Термин "этилен" в контексте данного описания относится к СН 2. Термин "формил" в контексте данного описания относится к -СНО. Термины "атом галогена" и "галоген" в контексте данного описания относится к Cl, Br, F или I. Термин "галогеналкокси" в контексте данного описания относится к галогеналкильной группе, соединенной с основной молекулярной группировкой через атом кислорода. Термин "галогеналкоксикарбонил" в контексте данного описания относится к группе галогеналкокси, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "галогеналкил" в контексте данного описания относится к алкильной группе, содержащей в качестве заместителей один, два, три или четыре атома галогена. Термин "гетероциклил" в контексте данного описания относится к 4-, 5-, 6- или 7-членному кольцу,содержащему один, два, три или четыре гетероатома, независимо выбранные из атома азота, кислорода и серы. 4-членное кольцо не содержит двойных связей, 5-членное кольцо содержит 0-2 двойные связи и 6 и 7-членное кольцо содержит 0-3 двойные связи. Термин "гетероциклил" также включает бициклические группы, у которых гетероциклическое кольцо конденсировано с другой моноциклической гетероциклической группой или 3-7-членным ароматическим или неароматическим карбоциклическим кольцом, бициклические группы, у которых гетероциклическое кольцо содержит в качестве заместителя 3-7-членное спироциклическое кольцо, а также мостиковые бициклические группы, такие как 7 азабицикло[2.2.1]гепт-7-ил, 2-азабицикло[2.2.2]окт-2-ил и 2-азабицикло[2.2.2]окт-3-ил. Гетероциклические группы согласно настоящему изобретению могут быть соединены с основной молекулярной группировкой через любой атом углерода или атом азота группы. Примеры гетероциклических групп включают бензотиенил, фурил, имидазолил, индолинил, индолил, изохинолинил, изотиазолил, изоксазолил,морфолинил, оксазолил, пиперазинил, пиперидинил, пиразолил, пиридинил, пирролидинил, пирролопиридинил, пирролил, хинолинил, тетрагидропиранил, тиазолил, тиенил и тиоморфолинил, но не ограничены ими. Гетероциклические группы согласно настоящему изобретению необязательно имеют один,два, три, четыре или пять заместителей, независимо выбранных из алкенила, алкокси, алкоксиалкила,алкоксикарбонила, алкила, алкилкарбонила, арила, арилалкоксикарбонила, арилалкила, арилкарбонила,циано, атома галогена, галогеналкокси, галогеналкила, второй гетероциклической группы, гетероциклилалкила, гетероциклилкарбонила, гидрокси, гидроксиалкила, нитро, -NRxRy, (NRxRy)алкил и оксо, где алкильная часть арилалкила и гетероциклилалкила не содержит заместители, и где арил, арильная часть арилалкила, арильная часть арилкарбонила, вторая гетероциклическая группа и гетероциклильная часть гетероциклилалкила и гетероциклилкарбонила необязательно содержат один, два или три заместителя,независимо выбранные из алкокси, алкила, циано, атома галогена, галогеналкокси, галогеналкила и нитро. Термин "гетероциклилалкокси" в контексте данного описания относится к гетероциклильной группе, соединенной с основной молекулярной группировкой через группу алкокси. Термин "гетероциклилалкоксикарбонил" в контексте данного описания относится к группе гетероциклилалкокси, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "гетероциклилалкил" в контексте данного описания относится к алкильной группе, содержащей в качестве заместителей одну, две или три гетероциклильные группы. Кроме того, алкильная часть гетероциклилалкила необязательно содержит в качестве заместителей одну или две дополнительные группы, независимо выбранные из алкокси, алкилкарбонилокси, арила, атома галогена, галогеналкокси, галогеналкила, гидрокси и -NRcRd, где дополнительно арил необязательно содержит один или два заместителя, независимо выбранные из алкокси, алкила, незамещенного арила, незамещенного арилалкокси, незамещенного арилалкоксикарбонила, атома галогена, галогеналкокси, галогеналкила, гидрокси и -NRxRy. Термин "гетероциклилалкилкарбонил" в контексте данного описания относится к гетероциклилалкильной группе, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "гетероциклилкарбонил" в контексте данного описания относится к гетероциклильной группе, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "гетероциклилокси" в контексте данного описания относится к гетероциклильной группе,соединенной с основной молекулярной группировкой через атом кислорода. Термин "гетероциклилоксикарбонил" в контексте данного описания относится к группе гетероциклилокси, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "гидрокси" в контексте данного описания относится к -ОН. Термин "гидроксиалкил" в контексте данного описания относится к алкильной группе, содержащей в качестве заместителей одну, две или три гидроксигруппы. Термин "гидроксиалкилкарбонил" в контексте данного описания относится к гидроксиалкильной группе, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "алкоксид металла" в контексте данного описания относится к M-OR, где М представляет собой металл, выбранный из натрия, лития и калия, и R представляет собой алкильную группу. Термин "гидроксид металла" в контексте данного описания относится к М-ОН, где М представляет собой металл, выбранный из натрия, лития и калия. Термин "нитро" в контексте данного описания относится к -NO2. Термин "защитная группа атома азота" в контексте данного описания относится к группе, предназначенной для защиты аминогруппы от нежелательных реакций в процессе синтеза. Типичные Nзащитные группы включают ацильные группы, такие как ацетил, бензоил, 2-бромацетил, 4-бромбензоил,трет-бутилацетил, карбоксальдегид, 2-хлорацетил, 4-хлорбензоил, -хлорбутирил, 4-нитробензоил, третнитрофеноксиацетил, фталил, пивалоил, пропионил, трихлорацетил и трифторацетил, сульфонильные группы, такие как бензолсульфонил и пара-толуолсульфонил, карбамат-образующие группы, такие как бензилоксикарбонил,бензилоксикарбонил(Boc),парахлорбензилоксикарбонил и пара-метоксибензилоксикарбонил, но не ограничены ими. Термин "реагент для введения защитной группы у атома азота" в контексте данного описания относится к соединению, которое в условиях реакции вводит защитную группу у атома азота, который необходимо защитить. Термин "-NRcRd" в контексте данного описания относится к двум группам, Rc и Rd, которые соединены с основной молекулярной группировкой через атом азота. Rc и Rd независимо выбраны из атома водорода, алкенилоксикарбонила, алкоксиалкилкарбонила, алкоксикарбонила, алкила, алкилкарбонила,циклоалкилокси, алкилсульфонила, арила, арилалкоксикарбонила, арилалкила, арилалкилкарбонила,арилкарбонила, арилоксикарбонила, арилсульфонила, циклоалкила, циклоалкилоксикарбонила, циклоалкилсульфонила, формила, галогеналкоксикарбонила, гетероциклила, гетероциклилалкоксикарбонила,гетероциклилалкила, гетероциклилалкилкарбонила, гетероциклилкарбонила, гетероциклилоксикарбони(NReRf)алкилкарбонила,(NReRf)карбонила,ла,гидроксиалкилкарбонила,(NReRf)алкила,e f(NR R )сульфонила,-C(NCN)OR' и-C(NCN)NR R , где R' выбран из алкила и незамещенного фенила, и где дополнительно алкильная часть арилалкила, арилалкилкарбонила, гетероциклилалкила и гетероциклилалкилкарбонила необязательно содержит в качестве заместителя одну группу-NReRf; и где дополнительно арил, арильная часть арилалкоксикарбонила, арилалкила, арилалкилкарбонила, арилкарбонила,арилоксикарбонила и арилсульфонила, гетероциклил и гетероциклильная часть гетероциклилалкоксикарбонила, гетероциклилалкила, гетероциклилалкилкарбонила, гетероциклилкарбонила и гетероциклилоксикарбонила необязательно содержат один, два или три заместителя, независимо выбранные из алкокси, алкила, циано, атома галогена, галогеналкокси, галогеналкил и нитро. Термин "(NRcRd)алкенил" в контексте данного описания относится к где Rc и Rd являются такими, как определено в данном описании, и каждый Rq независимо представляет собой атом водорода или C1-3-алкил. Термин "(NRcRd)алкил" в контексте данного описания относится к алкильной группе, содержащей в качестве заместителей одну, две или три группы -NRcRd. Кроме того, алкильная часть (NRcRd)алкила необязательно содержит в качестве заместителей одну или две дополнительные группы, выбранные из алкокси, алкоксиалкилкарбонила, алкоксикарбонила, алкилсульфанила, C2-алкинила, арилалкоксикарбонила, карбокси, циано, циклоалкила, атома галогена, гетероциклила, гетероциклилкарбонила, гидрокси и(NReRf)карбонила, где дополнительно гетероциклил необязательно содержит один, два, три, четыре или пять заместителей, независимо выбранных из алкокси, алкила, циано, атома галогена, галогеналкокси,галогеналкила и нитро. Термин "-NReRf" в контексте данного описания относится к двум группам, Re и Rf, которые соединены с основной молекулярной группировкой через атом азота. Re и Rf независимо выбраны из атома водорода, алкила, незамещенного арила, незамещенного арилалкила, незамещенного циклоалкила, незамещенного (циклоалкил)алкила, незамещенного гетероциклила, незамещенного гетероциклилалкила,(NRxRy)алкила и (NRxRy)карбонила. Термин "(NReRf)алкил" в контексте данного описания относится к алкильной группе, содержащей в качестве заместителей одну, две или три группы -NReRf. Термин "(NReRf)алкилкарбонил" в контексте данного описания относится к (NReRf)алкильной группе, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "(NReRf)карбонил" в контексте данного описания относится к группе-NReRf, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "(NReRf)сульфонил" в контексте данного описания относится к группе-NReRf, соединенной с основной молекулярной группировкой через сульфонильную группу. Термин "-NRxRy" в контексте данного описания относится к двум группам, Rx и Ry, которые соеди-5 021194 нены с основной молекулярной группировкой через атом азота. Rx и Ry независимо выбраны из атома водорода, алкоксикарбонила, алкила, алкилкарбонила, незамещенного арила, незамещенного арилалкоксикарбонила, незамещенного арилалкила, незамещенного циклоалкила, незамещенного гетероциклила и(NRx'Ry')карбонила, где Rx' и Ry' независимо выбраны из атома водорода и алкила. Термин "(NRxRy)алкил" в контексте данного описания относится к алкильной группе, содержащей в качестве заместителей одну, две или три группы -NRxRy. Термин "(NRxRy)карбонил" в контексте данного описания относится к группе -NRxRy, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "-NRxRy" в контексте данного описания относится к двум группам, Rx и Ry, которые соединены с основной молекулярной группировкой через атом азота. Rx и Ry независимо выбраны из атома водорода и алкила. Термин "(NRx'Ry')карбонил" в контексте данного описания относится к группе -NRx'Ry', соединенной с основной молекулярной группировкой через карбонильную группу. Термин "оксо" в контексте данного описания относится к 0. Термин "сульфонил" в контексте данного описания относится к -SO2-. Соединения согласно настоящему изобретению имеют асимметрические центры. Данные центры обозначены символами "R" или "S" в зависимости от конфигурации заместителей у хирального атома углерода. Необходимо понимать, что данное изобретение включает все стереохимические изомерные формы или их смеси, которые обладают способностью ингибировать NS5A. Индивидуальные стереоизомеры соединений могут быть получены путем синтеза из имеющихся в продаже исходных веществ, которые содержат хиральные центры, или путем расщепления полученной смеси стереоизомерных продуктов, например путем ее превращения в смесь диастереоизомеров и последующего разделения с использованием перекристаллизации или хроматографических методик или путем прямого разделения стереоизомеров на хиральных хроматографических колонках. Исходные соединения с известной стереохимической конфигурацией либо имеются в продаже, либо могут быть получены с использованием методик разделения, известных в данной области техники. Некоторые соединения согласно настоящему изобретению могут существовать в различных стабильных конформационных формах, которые могут быть разделены. Торсионная асимметрия, обусловленная ограниченным вращением вокруг асимметричной простой связи, например, вследствие стерического препятствия или напряжения кольца, может быть использована для разделения разных конформеров. Настоящее изобретение включает каждый конформационный изомер указанных соединений и их смеси. Соединения согласно настоящему изобретению также существуют в виде таутомеров; поэтому настоящее изобретение также включает все таутомерные формы. Подразумевается, что настоящее изобретение включает все изотопы атомов, которые присутствуют в соединениях согласно настоящему изобретению. Изотопы представляют собой атомы, имеющие одно и то же атомное число, но разные массовые числа. В качестве неограничивающего примера часто встречающихся изотопов можно привести изотопы водорода, включающие дейтерий и тритий. Изотопы углерода включают 13 С и 14 С. Соединения согласно изобретению, меченные изотопами, обычно могут быть получены с помощью стандартных методик, известных специалистам в данной области техники, или с помощью методик, аналогичных методикам, приведенным в данном описании, с использованием подходящих реагентов, меченных изотопами, вместо немеченых реагентов, используемых в других случаях. Такие соединения могут иметь целый ряд возможных применений, например, могут быть использованы в качестве стандартов и реагентов при определении биологической активности. Стабильные изотопы обладают потенциальной способностью благоприятно модифицировать биологические, фармакологические или фармакокинетические свойства содержащих их соединений. Соединения согласно настоящему изобретению могут существовать в виде фармацевтически приемлемых солей. Термин "фармацевтически приемлемая соль" в контексте данного описания означает соли или цвиттер-ионные формы соединений согласно настоящему изобретению, которые являются растворимыми или диспергируемыми в воде или масле, являются, по результатам медицинской оценки,пригодными для использования в контакте с тканями пациентов, не обладают чрезмерной токсичностью,не вызывают чрезмерного раздражения, аллергической реакции или других проблем или осложнений,соизмеримых с разумным соотношением пользы и риска, и являются эффективными, если используются по назначению. Данные соли могут быть получены в результате взаимодействия подходящего атома азота с подходящей кислотой на заключительных стадиях выделения и очистки соединения или отдельно,после синтеза соединения. Типичные соли присоединения кислот включают ацетат, адипат, альгинат,цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат; диглюконат, глицерофосфат, полусульфат, гептаноат, гексаноат, формиат, фумарат, гидрохлорид, гидробромид,гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, мезитиленсульфонат, метансульфонат, нафтиленсульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмоат, пектинат, персульфат, 3 фенилпроприонат, пикрат, пивалат, пропионат, сукцинат, тартрат, трихлорацетат, трифторацетат, фосфат, глутамат, бикарбонат, пара-толуолсульфонат и ундеканоат. Примеры кислот, которые могут быть использованы для получения фармацевтически приемлемых солей присоединения, включают неорганические кислоты, такие как соляная, бромисто-водородная, серная и фосфорная, и органические кислоты,такие как щавелевая, малеиновая, янтарная и лимонная. Соли присоединения оснований могут быть получены на заключительных стадиях выделения и очистки соединений в результате взаимодействия карбоксильной группы с подходящим основанием,таким как гидроксид, карбонат или бикарбонат катиона металла, или с аммиаком или органическим первичным, вторичным или третичным амином. Катионы фармацевтически приемлемых солей включают катионы лития, натрия, калия, кальция, магния и алюминия, а также катионы нетоксичных аминов, такие как аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, диэтиламин, этиламин, трибутиламин, пиридин, N,N-диметиланилин, N-метилпиперидин, Nметилморфолин, дициклогексиламин, прокаин, дибензиламин, N,N-дибензилфенетиламин и N,Nдибензилзтилендиамин. Другие типичные органические амины, которые могут быть использованы для получения солей присоединения оснований, включают этилендиамин, этаноламин, диэтаноламин, пиперидин и пиперазин. Аббревиатуры, использованные в настоящей заявке, включая, в частности, аббревиатуры, использованные в иллюстративных примерах, приведенных ниже, хорошо известны специалистам в данной области техники. Некоторые из использованных аббревиатур перечислены ниже.RT или Rt=комнатная температура или время удержания (в зависимости от контекста); EDCI=1-(3 диметиламинопропил)-3-этилкарбодиимида гидрохлорид; Boc, boc или ВОС=трет-бутоксикарбонил;DCE=1,2-дихлорэтан; d=сутки и DEA=диэтиламин. Далее настоящее изобретение будет описано со ссылкой на некоторые варианты осуществления изобретения, не ограничивающие его объем. Напротив, настоящее изобретение включает все альтернативы, модификации и эквиваленты, как если бы они были включены в объем прилагаемой формулы изобретения. Соответственно каждый из приведенных примеров, которые включают конкретные варианты осуществления изобретения, иллюстрирует только одно практическое использование изобретения, при этом следует понимать, что данные примеры иллюстрируют только некоторые варианты осуществления изобретения и приведены для того, чтобы показать, что именно является наиболее полезным, и облегчить понимание описанных методик и концептуальных аспектов изобретения. Исходные вещества имеются в продаже или могут быть получены с использованием традиционных описанных в литературе методик, известных средним специалистам в данной области техники. Синтез. Условия анализа соединений. Анализ чистоты и масс-спектрометрический анализ с использованием масс-спектрометрии низкого разрешения выполняли на системе для ЖХ (жидкостной хроматографии) Shimadzu LC system, соединенной с системой для МС (масс-спектрометрии) Waters MICROMASS ZQ MS system. Следует отметить,что время удержания может слегка варьировать при измерении на разных системах. Дополнительные условия проведения ЖХ (хроматографические условия), использованные, если не указано иное, для анализа соединений, описанных в данном разделе, приведены ниже. Хроматографические условия MS-W1 Промежуточные соединения Схема 5 Промежуточное соединение 19. (S)-5-трет-Бутилдифенилсилилокси)метил)пирролидин-2-он. К раствору (S)-5-(гидроксиметил)пирролидин-2-она (10 г, 87 ммоль) в CH2Cl2 (50 мл) добавляли трет-бутилхлордифенилсилан (25,6 г, 93 ммоль), Et3N (12,1 мл, 87 ммоль) и DMAP (1,06 г, 8,7 ммоль). Данную смесь перемешивали при комнатной температуре, пока исходный пирролидинон не был полностью израсходован, затем разбавляли CH2Cl2 (50 мл) и промывали водой (50 мл). Органический слой сушили (Na2SO4), фильтровали, упаривали под вакуумом и полученное неочищенное вещество очищали путем флэш-хроматографии (силикагель; 30-100% EtOH/гексаны) с выходом (S)-5-третбутилдифенилсилилокси)метил)пирролидин-2-она (22,7 г, выход: 74%) в виде бесцветного масла. ЖХМС: (М+Н)+=354,58. 1H ЯМР (400 МГц, ДМСО-d6)м.д: 7.69 (br s, 1H), 7.64-7.61 (m, 4 Н), 7.50-7.42 (m,6 Н), 3.67-3.62 (m, 1H), 3.58-3.51 (m, 2 Н), 2.24-2.04 (m, 3H), 1.87-1.81 (m, 1H), 1.00 (s, 9H).(8,93 г, 88 ммоль) и DMAP (1,08 г, 8,83 ммоль) в CH2Cl2 (200 мл) добавляли порциями в течение 10 мин ди-трет-бутилдикарбонат (38,5 г, 177 ммоль) в виде твердого вещества и данную реакционную смесь перемешивали в течение 18 ч при 24C. Большую часть летучего компонента удаляли под вакуумом и оставшееся неочищенное вещество очищали путем хроматографии на силикагеле (20% EtOAc/гексаны 50%(S)-трет-бутил 2-трет-бутилдифенилсилилокси)метил)-5 оксопирролидин-1-карбоксилата (32,65 г, выход: 82%) в виде белого твердого вещества. ЖХ-МС: (МВос+Н)+=354,58. 1H ЯМР (400 МГц, ДМСО-d6)м.д: 7.61-7.59 (m, 2 Н), 7.56-7.54 (m, 2 Н), 7.50-7.38 (m,6 Н), 4.18 (m, 1H), 3.90 (dd, J=10.4, 3.6, 1H), 3.68 (dd, J=10.4, 2.1, 1H), 2.68-2.58 (m, 1H), 2.40-2.33 (m, 1H),2.22-2.12 (m, 1H), 2.01-1.96 (m, 1H), 1.35 (s, 9H), 0.97 (s, 9H). Промежуточное соединение 21. (S)-трет-Бутил 2-трет-бутилдифенилсилилокси)метил)-2,3 дигидро-1H-пиррол-1-карбоксилат. В 3-горлую колбу, оснащенную термометром и отводом для подачи азота, вносили (S)-трет-бутил 2-трет-бутилдифенилсилилокси)метил)-5-оксопирролидин-1-карбоксилат (10,05 г, 22,16 ммоль) и толуол (36 мл) и колбу помещали в охлаждающую баню (-55C). Когда внутренняя температура смеси достигала -50C, добавляли по каплям в течение 30 мин триэтилборгидрид лития (23 мл, 1,0 М/ТГФ, 23 ммоль) и данную смесь перемешивали в течение 35 мин, поддерживая внутреннюю температуру в диапазоне от 50 до -45C. Добавляли по каплям в течение 10 мин основание Хюнига (16,5 мл, 94 ммоль). Затем за один прием добавляли DMAP (34 мг, 0,278 ммоль) и затем в течение 15 мин добавляли трифторуксусный ангидрид (3,6 мл, 25,5 ммоль), поддерживая внутреннюю температуру в диапазоне от -50 до -45C. Через 10 мин баню удаляли и реакционную смесь перемешивали в течение 14 ч, пока температура смеси не достигала температуры окружающей среды. Затем реакционную смесь разбавляли толуолом (15 мл), охлаждали в бане с ледяной водой и медленно, в течение 5 мин, обрабатывали водой (55 мл). Фазы разделяли, органический слой промывали водой (250 мл) и концентрировали под вакуумом. Данное неочищенное вещество очищали путем флэш-хроматографии (силикагель; 5% EtOH/гексаны) с получением(S)-трет-бутил 2-трет-бутилдифенилсилилокси)метил)-2,3-дигидро-1H-пиррол-1-карбоксилата (7,947 г,выход: 82%) в виде бесцветного вязкого масла. ЖХ-МС: [M+Na]+=460,19. Rt=2,41 мин, согласно данным анализа с использованием следующих условий ЖХВД: градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В (растворитель А=0,1% ТФУ в смеси МеОН/вода (1:9); растворитель В=0,1% ТФУ в смеси МеОН/вода (9:1, продолжительность градиента: 2 мин, конечную концентрацию градиента поддерживали в течение 1 мин; регистрация: при 220 нм; колонка: PHENOMENEX Luna, 3,050 мм, S10. 1H ЯМР (400 МГц, ДМСО-d6)м.д: 7.62-7.58 (m, 4 Н), 7.49-7.40 (m, 6 Н),6.47 (br s, 1H), 5.07-5.01 (перекрывающиеся br d, 1H), 4.18 (br s, 1H), 3.89 (br s, 0.5H), 3.69 (br s, 1.5H),2.90-2.58 (br m, 2H), 1.40-1.26 (перекрывающиеся br s, 9H), 0.98 (s, 9H). Промежуточное соединение 22. (3S)-трет-Бутил 3-трет-бутилдифенилсилилокси)метил)-2 азабицикло[3.1.0]гексан-2-карбоксилат. К охлажденному (-30C) раствору (S)-трет-бутил 2-трет-бутилдифенилсилилокси)метил)-2,3 дигидро-1H-пиррол-1-карбоксилата (3,94 г, 9,0 ммоль) в толуоле (27 мл) добавляли по каплям в течение 15 мин диэтилцинк (1,1 М раствор в толуоле, 19 мл, 21 ммоль). Добавляли по каплям в течение 10 мин хлориодметан (стабилизированный медью; 3,0 мл, 41 ммоль) и данную смесь перемешивали, поддерживая температуру бани в течение 1 ч при -25C и в течение 18,5 ч в диапазоне от -25 до -21C. Открывали доступ воздуха к реакционной смеси, смесь гасили, медленно добавляя полунасыщенный раствор NaHCO3 (40 мл), затем охлаждающую баню удаляли и перемешивали в течение 20 мин при температуре окружающей среды. Затем реакционную смесь фильтровали через фильтровальную бумагу и полученный белый фильтрационный осадок промывали толуолом (50 мл). Органическую фазу фильтрата отделяли, промывали водой (240 мл), сушили (MgSO4) и концентрировали под вакуумом. Данное неочищенное вещество очищали путем хроматографии на силикагеле (силикагель: 350 г; растворитель для нанесения пробы: 7% EtOAc/гексаны; элюент: 7-20% EtOH/гексаны) с получением (3S)-трет-бутил 3-третбутилдифенилсилилокси)метил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (3,69 г, 90,7%) в виде смеси цис/транс-изомеров [примечание: точное соотношение цис/транс-изомеров на данном этапе не определяли]. ЖХ-МС: [M+Na]+=474,14. Rt=2,39 мин, согласно данным анализа с использованием следующих условий ЖХВД: градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% раствори- 10021194 тель В (растворитель А=0,1% ТФУ в смеси МеОН/вода (1:9); растворитель В=0,1% ТФУ в смеси МеОН/вода (9:1, продолжительность градиента: 2 мин, конечную концентрацию градиента поддерживали в течение 1 мин; регистрация: при 220 нм; колонка: PHENOMENEX Luna, 3,050 мм, S10. 1H ЯМР (400 МГц, ДМСО-d6)м.д: 7.62-7.60 (m, 4 Н), 7.49-7.40 (m, 6 Н), 3.77-3.67 (перекрывающиеся br s, 3H), 3.113.07 (m, 1 Н), 2.23 (арр br s, 1 Н), 2.05-2.00 (m, 1H), 1.56-1.50 (m, 1H), 1.33 (очень широкий s, 9 Н), 1.00 (s,9 Н), 0.80 (m, 1H), 0.30 (m, 1H). Промежуточное соединение 23. (3S)-трет-Бутил 3-(гидроксиметил)-2-азабицикло[3.1.0]гексан-2 карбоксилат. К раствору (3S)-трет-бутил 3-трет-бутилдифенилсилилокси)метил)-2-азабицикло[3.1.0]гексан-2 карбоксилата (смесь цис/транс-изомеров) (3,13 г, 6,93 ммоль) в ТГФ (30 мл) добавляли по каплям в течение 5 мин TBAF (1,0 М раствор в ТГФ, 7,27 мл, 7,27 ммоль) и данную смесь перемешивали в течение 4,75 ч при температуре окружающей среды. После добавления насыщенного раствора NH4Cl (5 мл) большую часть летучего компонента удаляли под вакуумом и остаток распределяли между CH2Cl2 (70 мл) и полунасыщенным раствором NH4Cl (30 мл). Водную фазу экстрагировали CH2Cl2 (30 мл) и объединенную органическую фазу сушили (MgSO4), фильтровали, концентрировали под вакуумом и затем выдерживали в глубоком вакууме в течение ночи. Оставшееся неочищенное вещество очищали путем флэш-хроматографии (силикагель; 40-50% EtOH/гексаны) с получением смеси цис/транс-изомеров (3S)трет-бутил 3-(гидроксиметил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (1,39 г, выход: 94%) в виде бесцветного масла [примечание: точное соотношение цис/транс-изомеров на данном этапе не определяли] ЖХ-МС: (M+Na)+=236,20. 1H ЯМР (400 МГц, ДМСО-d6, =2.5 м.д.)м.д: 4.70 (t, J=5.7, 1H), 3.62-3.56 (m,1H), 3.49-3.44 (m, 1H), 3.33-3.27 (m, 1H), 3.08-3.04 (m, 1H), 2.07 (br m, 1H), 1.93-1.87 (m, 1H), 1.51-1.44 (m,1H), 1.40 (s, 9 Н), 0.76-0.71 (m, 1H), 0.26 (m, 1H). Промежуточное соединение 24. (1R,3S,5R)-2-(трет-Бутоксикарбонил)-2-азабицикло[3.1.0]гексан-3 карбоновая кислота. К раствору (3S)-трет-бутил 3-(гидроксиметил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (смесь цис/транс-изомеров) (2,15 г, 10,08 ммоль) в смеси CH3CN (20 мл) и CCl4 (20 мл) добавляли полурастворенный в воде (31 мл) NaIO4 (6,46 г, 30,2 ммоль). Затем сразу добавляли RuCl3 (0,044 г, 0,212 ммоль) и полученную гетерогенную реакционную смесь интенсивно перемешивали в течение 75 мин. Затем реакционную смесь разбавляли водой (60 мл) и экстрагировали CH2Cl2 (350 мл). Объединенные органические фазы обрабатывали МеОН (метанолом) (1 мл), выдерживали в течение приблизительно 5 мин и затем фильтровали через подушку диатомовой земли (CELITE). Подушку промывали CH2Cl2 (50 мл) и фильтрат концентрировали под вакуумом с получением светло-серого твердого вещества. Данное неочищенное вещество растворяли при нагревании в EtOH (10 мл), вносили затравку и раствор оставляли при температуре окружающей среды. Примерно через 15 мин после переноса в охлаждающую среду начиналось интенсивное образование кристаллов. Через 1 ч добавляли гексаны (6 мл) и данную смесь охлаждали в течение ночи (было не очевидно, что выпадет в осадок дополнительное количество вещества). Затем смесь фильтровали, промывали смесью гексаны/EtOH (соотношение 2:1; 20 мл), охлажденной в ледяной воде, и сушили в условиях глубокого вакуума с получением первой партии (1R,3S,5R)-2-(третбутоксикарбонил)-2-азабицикло[3.1.0]гексан-3-карбоновой кислоты (желтоватые кристаллы, 1,222 г). Маточный раствор концентрировали под вакуумом, остаток растворяли при нагревании в EtOH(3 мл) и выдерживали в течение 1 ч при температуре окружающей среды, затем добавляли гексаны(3 мл) и выдерживали в холодильной камере в течение 15 ч. Вторую партию (1R,3S,5R)-2-(третбутоксикарбонил)-2-азабицикло[3.1.0]гексан-3-карбоновой кислоты выделяли аналогичным образом (серые кристаллы, 0,133 г), суммарный выход: 59%. ЖХ-МС: [M+Na]+=250,22. Rt=1,48 мин, согласно данным анализа с использованием следующих условий ЖХВД: градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В (растворитель А=0,1% ТФУ в смеси метанол/вода(1:9); растворитель В=0,1% ТФУ в смеси метанол/вода (9:1, продолжительность градиента: 3 мин; регистрация: при 220 нм; колонка: PHENOMENEX Luna, 3,050 мм, S10. Т.пл. (разл.) первой партии=147,5149,5C. 1H ЯМР (400 МГц, ДМСО-d6)м.д: 12.46 (s, 1H), 3.88 (арр br s, 1H), 3.27 (арр br s, 1H; перекрывающийся с сигналом от воды), 2.28 (br m, 1H), 2.07 (арр br s, 1H), 1.56 (арр s, 1H), 1.40/1.34 (два перекрывающихся s, 9H), 0.71 (m, 1H), 0.45 (m, 1H). 13 С ЯМР (100.6 МГц, ДМСО-d6) 172.96, 172.60, 154.45,153.68, 78.74, 59.88, 59.58, 36.91, 31.97, 31.17, 27.77, 27.52, 14.86, 14.53, 13.69. Вычислено для C11H17NO4: С, 58,13; Н, 7,54; N, 6,16. Найдено (первая партия): С, 58,24; Н, 7,84; N, 6,07. Вращение плоскости поляризации света (10 мг/мл в CHCl3): []D=-216 и -212, для первой и второй партии соответственно. Альтернативный синтез промежуточного соединения 24(1R,3R,5R)-2-Азабицикло[3.1.0]гексан-3-карбоксамид (.CH3SO3H) получали в соответствии с методикой синтеза стереоизомеров данного соединения, описанной в патенте WO 2004/052850. Промежуточное соединение 24. (1R,3S,5R)-2-(трет-Бутоксикарбонил)-2-азабицикло[3.1.0]гексан-3 карбоновая кислота. В круглодонную колбу объемом 1 л, оснащенную отводом для подачи азота, подвесной мешалкой,термопарой и колбонагревателем, вносили (1R,3R,5R)-2-азабицикло[3.1.0]гексан-3-карбоксамид(.CH3SO3H) (50 г, 225 ммоль) и изопропанол (250 мл). Затем к полученной суспензии добавляли NaOEt(252 мл, 23 мас.% в EtOH (2,68 М, 675 ммоль, 3,0 экв. и перемешивали в течение приблизительно 1 ч при 50C. Затем к смеси добавляли воду (12,2 мл, 675 ммоль, 3 экв.) и нагревали до 60C. Полученную суспензию оставляли перемешиваться при 60C в течение приблизительно 18 ч. Затем суспензию охлаждали до комнатной температуры и добавляли воду (250 мл) и ди-трет-бутилдикарбонат (98,2 г, 450 ммоль, 2,0 экв.). Этанол и изопропанол удаляли путем перегонки под вакуумом и водную смесь охлаждали до 0C. Затем смесь нейтрализовали путем добавления 6 М водного раствора HCl (76 мл, 456 ммоль), поддерживая внутреннюю температуру ниже 5C. Полученный продукт экстрагировали МТВЕ(500 мл) и обогащенный органический слой промывали водой (100 мл). Полученный прозрачный раствор концентрировали до объема 150 мл путем перегонки под вакуумом и к полученной суспензии добавляли гептан (600 мл), поддерживая внутреннюю температуру выше 45C. Суспензию охлаждали до комнатной температуры в течение приблизительно 30 мин и оставляли перемешиваться при комнатной температуре в течение приблизительно 2 ч. Полученный продукт фильтровали, промывали смесью гептан:МТВЕ (4:1,250 мл) и сушили под вакуумом при 70C с выходом (1R,3S,5R)-2-(трет-бутоксикарбонил)-2 азабицикло[3.1.0]гексан-3-карбоновой кислоты (40,5 г, 178 ммоль, выход: 79%; чистота согласно АР нитриле (25 мл) добавляли DIPEA (2,79 мл, 16,0 ммоль) (раствор становился желтым и прозрачным) и данную реакционную смесь перемешивали в течение ночи. Затем реакционную смесь концентрировали и очищали на BIOTAGE (80 г SiO2, 10-25% EtOH/гексаны) с получением (1R,3S,5R)-3-(2-(3-бромфенил)2-оксоэтил) 2-трет-бутил 2-азабицикло[3,1,0]гексан-2,3-дикарбоксилата (3,37 г, 7,94 ммоль) в виде вязкого светло-желтого масла ЖХ-МС время удержания 1,853 мин, m/z 423 и 425,98 (1:1) (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Waters XTERRA MS (7 мкм, С 18, 3,050 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 4 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 2 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 3 мин; растворитель А: 5% МеОН/95% Н 2 О/10 мМ ацетат аммония; растворитель В: 5% Н 2 О/95% МеОН/10 мМ ацетат аммония. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. 1H ЯМР (400 МГц, CDCl3)м.д: 8.04 (d, J=1.8 Гц, 1H), 7.83 (d, J=7.8 Гц, 1H), 7.75 (d, J=8.0 Гц, 1 Н), 7.38 (dd, J=8.0, 7.8 Гц, 1H), 5.58-5.10 (m, 2H), 4.23 (br Промежуточное соединение 94. (1R,3S,5R)-трет-Бутил 3-(4-(3-бромфенил)-1H-имидазол-2-ил)-2 азабицикло[3.1.0]гексан-2-карбоксилат. В сосуд высокого давления объемом 350 мл, содержащий раствор (1R,3S,5R)-3-(2-(3-бромфенил)-2 оксоэтил) 2-трет-бутил 2-азабицикло[3.1.0]гексан-2,3-дикарбоксилата (3,33 г, 7,85 ммоль) в ксилоле (75 мл), добавляли ацетат аммония (5,94 г, 77 ммоль) и данную смесь перемешивали в атмосфере азота в течение 5 мин. Сосуд герметично закрывали и затем помещали в масляную баню, предварительно нагретую до 140C (реакционная смесь становилась темно-коричневой), реакционную смесь выдерживали при 140C в течение 11 ч. Добавляли еще одну порцию ацетата аммония (3,0 г), реакционную смесь перемешивали в течение 8 ч при 145C, затем охлаждали до комнатной температуры и перемешивали (согласно данным ЖХ-МС-анализа превращение составляло 90%). Затем реакционную смесь концентрировали в условиях глубокого вакуума с получением коричневого масла, которое распределяли между ДХМ(200 мл) и полунасыщенным раствором бикарбоната натрия (200 мл). Органический слой сушили(MgSO4), фильтровали и концентрировали. Неочищенную оранжевую отвердевшую пену очищали наBIOTAGE Horizon (20-50% EtOH/гексаны, 160 г SiO2) с получением (1R,3S,5R)-трет-бутил 3-(4-(3 бромфенил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (2,03 г, 5,02 ммоль) в виде желтой отвердевшей пены. ЖХ-МС: время удержания: 2,450 мин; m/z 404 и 406,06 (1:1) (МН+). ЖХданные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEX Luna (10 мкм, С 18, 3,050 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 4 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 3 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 4 мин; растворитель А: 5% МеОН/95% Н 2 О/10 мМ ацетат аммония; растворитель В: 5% Н 2 О/95% МеОН/10 мМ ацетат аммония. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. 1H ЯМР (400 МГц, CDCl3)м.д: 7.89 (s, 1H), 7.65 (d, J=6.5 Гц, 1H), 7.42-7.32 (m, 2 Н), 7.26 (t, J=7.8 Гц, 1H), 4.72-4.61 (m, 1H), 3.62-3.53 (m,1H), 2.51 (dd, J=13.0, 7.8 Гц, 1H), 2.36-2.26 (m, 1H), 1.75-1.66 (m, 1H), 1.29 (br s, 9H), 0.84 (dt, J=8.0, 5.7 Гц,1H), 0.63-0.57 (m, 1H).(1R,3S,5R)-3-(4-(3-(6-(2-1S,3R,5S)-2-(третбутоксикарбонил)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)-2-нафтил)фенил)-1H-имидазол-2 ил)-2-азабицикло[3.1.0]гексан-2-карбоксилат. Раствор (1R,3S,5R)-трет-бутил 3-(5-(6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)нафталин-2 ил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (220 мг, 0,395 ммоль) (полученного в соответствии с методикой синтеза промежуточного соединения 51 из промежуточного соединения 55),(1R,3S,5R)-трет-бутил 3-(4-(3-бромфенил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата ровали под вакуумом в течение 5 мин и затем насыщали азотом в сосуде высокого давления объемом 100 мл. Добавляли ацетат палладия(II) (8,9 мг, 0,039 ммоль) и данную смесь нагревали в течение 4 ч при 120C. Затем реакционную смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировали EtOH (этилацетатом) и ДХМ. Объединенные органические слои промывали солевым раствором,сушили (Na2SO4), фильтровали и концентрировали. Неочищенный остаток очищали на системе BIOTAGE на силикагелевом картридже (90 г), используя для элюирования градиент 0-100% EtOH в гексанах,с получением трет-бутил(1R,3S,5R)-3-(4-(3-(6-(2-1S,3R,5S)-2-(трет-бутоксикарбонил)-2 азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)-2-нафтил)фенил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан 2-карбоксилата (142 мг, 0,203 ммоль) в виде желтого твердого вещества. ЖХ-МС: время удержания: 1,585 мин; m/z 699,57 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS,оснащенном колонкой Waters Sunfire (C18, 4,630 мм, 5 мкм), с использованием детектора SPD-10AVUV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 4 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 2 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 3 мин; растворитель А: 10% метанола/90% воды/0,1% ТФУ; растворитель В: 10% воды/90% метанола/0,1% ТФУ. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. 1H ЯМР (500 МГц, MeOD)м.д: 8.33 (d, J=1.2 Гц, 1 Н), 8.31 (s, 1H), 8.20-8.24 (m, 1H), 8.14-8.20 (m, 1H), 8.10-8.14 (m, 1H), 7.97-8.07 (m,3H), 7.94 (d, J=7.9 Гц, 1H), 7.87-7.92 (m, 1H), 7.77-7.82 (m, 1H), 7.67-7.74 (m, 1H), 4.84-4.96 (m, 2 Н), 3.67(1R,3S,5R)-3-(4-(3-(6-(2-1S,3R,5S)-2-(трет-бутоксикарбонил)-2 азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)-2-нафтил)фенил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан 2-карбоксилата (130 мг, 0,20 ммоль) в ДХМ (2 мл) добавляли ТФУ (2 мл, 26,0 ммоль) и данную смесь перемешивали в течение 2 ч при комнатной температуре. Летучие компоненты удаляли под вакуумом и оставшийся неочищенный продукт очищали путем препаративной ЖХВД (метанол/вода, 0,1% ТФУ) с получением ТФУ-соли(1R,3S,5R)-3-(4-(3-(6-(2-1S,3R,5S)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)-2 нафтил)фенил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексана (103 мг) в виде желтовато-коричневого твердого вещества. ЖХ-МС: время удержания: 1,303 мин; m/z 499,13 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Waters Sunfire (С 18, 4,630 мм,5 мкм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 4 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 2 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 3 мин; растворитель А: 10% метанола/90% воды/0,1% ТФУ; растворитель В: 10% воды/90% метанола/0,1% ТФУ. Массспектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением: 1 Н ЯМР (500 МГц, MeOD)м.д: 8.33 (s, 1 Н), 8.22 (d, J=12.5 Гц, 2 Н), 8.02 (dd, J=8.6, 5.8 Гц, 2 Н),7.90-7.97 (m, 2H), 7.75-7.82 (m, 4 Н), 7.58 (t, J=7.8 Гц, 1 Н), 4.74-4.78 (m, 2H), 3.46-3.53 (m, 2H), 2.64-2.74(107 мг, 0,296 ммоль) в диоксане (1,5 мл) добавляли дихлор-бис-(трифенилфосфин)палладий (II) (17,30 мг, 0,025 ммоль) и данную смесь перемешивали в течение 2 ч при 110C. Затем реакционную смесь разбавляли МеОН (метанолом) и очищали путем препаративной ЖХВД (Н 2 О-МеОН с 10 мМ NH4OAcбуфером) с получением 6-бром-2-(1-этоксивинил)хиноксалина (36 мг, 0,129 ммоль, выход: 52,3%) в виде белого твердого вещества. ЖХ-МС: время удержания: 2,76 мин; m/z 279 [М+Н]+ (колонка: PHENOMENEX Luna (3,050 мм, S10. Растворитель А=90% воды/10% метанола/0,1% ТФУ. Растворитель В=10% воды/90% метанола/0,1% ТФУ. Скорость потока=4 мл/мин. Начальная концентрация растворителя В(%)=0. Конечная концентрация растворителя В (%)=100. Продолжительность градиента=3 мин. Длина волны=220).(0,500 мл) добавляли NBS (55,1 мг, 0,310 ммоль) и данную смесь перемешивали в течение 2 ч при комнатной температуре. Затем реакционную смесь разбавляли МеОН (метанолом) и очищали путем препаративной ЖХВД (Н 2 О-МеОН с 10 мМ NH4OAc-буфером) с получением 2-бром-1-(6-бромхиноксалин-2 ил)этанона (50 мг, 0,15 ммоль, выход: 59%) в виде белого твердого вещества. ЖХ-МС: время удержания: 2,40 мин; m/z 329 [М+Н]+ (колонка: PHENOMENEX Luna (3,050 мм, S10. Растворитель А=90% воды/10% метанола/0,1% ТФУ. Растворитель В=10% воды/90% метанола/0,1% ТФУ. Скорость потока=4 мл/мин. Начальная концентрация растворителя В (%)=0. Конечная концентрация растворителя В Промежуточное соединение 110. (1S,3S,5S)-3-(2-(6-Бромхиноксалин-2-ил)-2-оксоэтил) 2-трет-бутил 2-азабицикло[3.1.0]гексан-2,3-дикарбоксилат. К раствору 2-бром-1-(6-бромхиноксалин-2-ил)этанона (50 мг, 0,152 ммоль) и (1R,3S,5R)-2-(третбутоксикарбонил)-2-азабицикло[3.1.0]гексан-3-карбоновой кислоты (37,9 мг, 0,167 ммоль) в ацетонитриле (1,5 мл) добавляли DIPEA (0,040 мл, 0,227 ммоль) и данную смесь перемешивали в течение 16 ч при комнатной температуре. Растворитель выпаривали и остаток распределяли между EtOH (20 мл) и насыщенным водным раствором NaHCO3 (5 мл). Органический слой сушили (MgSO4), фильтровали и концентрировали с получением неочищенного (1R,3S,5R)-3-(2-(6-бромхиноксалин-2-ил)-2-оксоэтил) 2-третбутил 2-азабицикло[3.1.0]гексан-2,3-дикарбоксилата (63 мг) в виде оранжевого твердого вещества. ЖХМС: время удержания: 2,74 мин; m/z 476 [М+Н]+ (колонка: PHENOMENEX Luna (3,050 мм, S10. Растворитель А=90% воды/10% метанола/0,1% ТФУ. Растворитель В=10% воды/90% метанола/0,1% ТФУ. Скорость потока=4 мл/мин. Начальная концентрация растворителя В (%)=0. Конечная концентрация растворителя В (%)=100. Продолжительность градиента=3 мин. Длина волны=220).(1R,3S,5R)-3-(2-(6-бромхиноксалин-2-ил)-2-оксоэтил) 2-трет-бутил 2 азабицикло[3.1.0]гексан-2,3-дикарбоксилата (63 мг, 0,13 ммоль) в толуоле (3 мл) добавляли NH4OAc (102 мг, 1,323 ммоль) и данную смесь перемешивали в течение 4 ч при 120C. Добавляли еще одну порциюNH4OAc (102 мг, 1,323 ммоль) и реакционную смесь дополнительно нагревали в течение 4 ч при 120C. Затем реакционную смесь разбавляли EtOH (этилацетатом) (20 мл) и насыщенным водным растворомNaHCO3 (5 мл). Органический слой сушили (MgSO4), фильтровали, концентрировали и затем очищали путем флэш-хроматографии на силикагеле, используя для элюирования смесь EtOH/гексан (1:2), с получением (1R,3S,5R)-трет-бутил 3-(4-(6-бромхиноксалин-2-ил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (25 мг, 0,055 ммоль) в виде красно-оранжевого твердого вещества. ЖХ-МС: время удержания: 2,07 мин; m/z 456 [М+Н]+ (колонка: PHENOMENEX Luna (3,050 мм, S10. Растворитель А=90% воды/10% метанола/0,1% ТФУ. Растворитель В=10% воды/90% метанола/0,1% ТФУ. Скорость потока=4 мл/мин. Начальная концентрация растворителя В (%)=0. Конечная концентрация растворителя В (%)=100. Продолжительность градиента=3 мин. Длина волны=220). Промежуточное соединение 112. (1R,3S,5R)-3-(4-(6-(2-1R,3S,5R)-2-(трет-Бутоксикарбонил)-2 азабицикло[3.1.0]гекс-3-ил)-1H-бензимидазол-5-ил)-2-хиноксалинил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилат. К дегазированной суспензии (1R,3S,5R)-трет-бутил 3-(4-(6-бромхиноксалин-2-ил)-1H-имидазол-2 ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (25 мг, 0,055 ммоль), K2CO3 (22,71 мг, 0,164 ммоль), дициклогексил(2',6'-диметоксибифенил-2-ил)фосфина (4,50 мг, 10,96 мкмоль) и (1R,3S,5R)-трет-бутил 3-(6(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2 карбоксилата (30,3 мг, 0,071 ммоль) в смеси ТГФ (1 мл) и воды (0,250 мл) добавляли Pd(OAc)2 (1,230 мг,5,48 мкмоль) и данную смесь перемешивали в течение 2 ч при 110C. Затем реакционную смесь разбавляли МеОН (метанолом), фильтровали и очищали путем препаративной ЖХВД (Н 2 О-МеОН с 10 мМ МН 4 ОАс-буфером) с получением (1R,3S,5R)-трет-бутил 3-(5-(6-(2-1R,3S,5R)-2-(трет-бутоксикарбонил)2-азабицикло[3.1.0]гексан-3-ил)-1H-бензо[d]имидазол-6-ил)хиноксалин-2-ил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (12 мг, 0,018 ммоль, выход: 33%) в виде желтого твердого вещества. ЖХ-МС: время удержания: 1,90 мин; m/z 675 [М+Н]+ (колонка: PHENOMENEX Luna (3,050 мм,S10). Растворитель А=95% воды/5% метанола/10 мМ ацетат аммония. Растворитель В=5% воды/95% метанола/10 мМ ацетат аммония. Скорость потока=4 мл/мин. Начальная концентрация растворителя В(%)=0. Конечная концентрация растворителя В (%)=100. Продолжительность градиента=2 мин. Длина волны=220). 1H ЯМР (400 МГц, MeOD)м.д: 9.38 (s, 1H), 8.28 (d, J=2.0 Гц, 1H), 8.16-8.22 (m, 1H), 8.108.15 (m, 1H), 7.95 (s, 2 Н), 7.66-7.76 (m, 2 Н), 3.54-3.73 (m, 2 Н), 2.52-2.69 (m, 2 Н), 2.33-2.47 (m, 2 Н), 1.711.84 (m, 2 Н), 1.08-1.57 (m, 20 Н), 0.83-0.95 (m, 2 Н), 0.60-0.74 (m, 2 Н).(1R,3S,5R)-трет-бутил 3-(5-(6-(2-1R,3S,5R)-2-(трет-бутоксикарбонил)-2 азабицикло[3.1.0]гексан-3-ил)-1H-бензо[d]имидазол-6-ил)хиноксалин-2-ил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (10 мг, 0,015 ммоль) в ДХМ (0,5 мл) добавляли ТФУ (0,25 мл, 3,24 ммоль) и данную смесь перемешивали в течение 16 ч при комнатной температуре. Летучие компоненты удаляли под вакуумом и остаток растирали с Et2O. Полученное твердое вещество промывали Et2O (диэтиловым эфиром) с выходом ТФУ-соли 6-(2-1R,3S,5R)-2-азабицикло[3.1.0]гексан-3-ил)-1Hбензо[d]имидазол-6-ил)-2-(2-1R,3S,5R)-2-азабицикло[3.1.0]гексан-3-ил)-1H-имидазол-5-ил)хиноксалина(10,5 мг) в виде желтого твердого вещества. ЖХ-МС: время удержания: 1,32 мин; m/z 475 [М+Н]+ (колонка: PHENOMENEX Luna (3,050 мм, S10). Растворитель А=90% воды/10% метанола/0,1% ТФУ. Растворитель В=10% воды/90% метанола/0,1% ТФУ. Скорость потока=4 мл/мин. Начальная концентрация растворителя В (%)=0. Конечная концентрация растворителя В (%)=100. Продолжительность градиента=3 мин. Длина волны=220). Промежуточное соединение 114. Бензил (2S)-2-(6-(6-(2-2S)-1-бензилокси)карбонил)-2 пирролидинил)-1H-имидазо[4,5-b]пиридин-6-ил)-2-нафтил)-3H-имидазо[4,5-b]пиридин-2-ил)-1-пирролидинкарбоксилат. Получали аналогично промежуточному соединению 39 с использованием в качестве исходного вещества(S)-1-(третбутоксикарбонил)пирролидин-2-карбоновой кислоты; данное промежуточное соединение не содержит(20,8 мг) получали в виде белого твердого вещества. ЖХ-МС: время удержания: 1,742 мин; m/z 769,41(МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEX Luna (10 мкм, С 18, 3,050 мм), с использованием детектора SPD-10AV UV-Vis,на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 5 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 3 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 4 мин; растворитель А: 5% ацетонитрила/95% Н 2 О/10 мМ ацетат ам- 16021194(3 мл) добавляли HATU (47,8 мг, 0,126 ммоль) и полученную смесь перемешивали в течение 2 ч при температуре окружающей среды. Затем реакционную смесь разбавляли метанолом (2 мл) и водой (2 мл) и удаляли под вакуумом летучий компонент. Остаток частично очищали путем обратно-фазовой ЖХВД(вода/метанол, 0,1% ТФУ) и затем дополнительно очищали путем обратно-фазовой ЖХВД (вода/ацетонитрил, 0,1% ТФУ) с получением ТФУ-соли метил 1S)-1-1S,3R,5S)-3-(4-(6-(3-(2-1R,3S,5R)2-2S)-2-метоксикарбонил)амино)-3-метилбутаноил)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4 ил)фенил)-2-нафтил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гекс-2-ил)карбонил)-2-метилпропил)карбамата (45 мг) в виде белого твердого вещества. Данные ЖХ-МС-анализа: время удержания: 1,458 мин; m/z 813,30 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой Waters Sunfire (C18, 4,630 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 4 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 2 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 3 мин; растворитель А: 10% метанола/90% воды/10 мМ ацетат аммония; растворитель В: 10% воды/90% метанола/10 мМ ацетат аммония. Масс-спектр получали с использованием Промежуточное соединение 118. 2-Бром-1-(6-бромнафталин-2-ил)этанон. К раствору 1-(6-бромнафталин-2-ил)этанона (3,30 г, 13,3 ммоль) (чистота 90%) в ДХМ (60 мл) добавляли раствор брома (0,682 мл, 13,3 ммоль) в ДХМ (20 мл) и данную реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь концентрировали с получением 2-бром-1-(6-бромнафталин-2-ил)этанона (4,35 г) в виде желтоватого твердого вещества, которое использовали без дополнительной очистки. Данные ЖХ-МС-анализа: время удержания: 2,177 мин; m/z 342,92(MNa+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEX Luna (10 мкм, С 18, 2,030 мм), с использованием детектора SPD-10AV UV-Vis,на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 1 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 2 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 3 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. 1 Н ЯМР Промежуточное соединение 119. (1R,3S,5R)-3-(2-(6-Бромнафталин-2-ил)-2-оксоэтил) 2-трет-бутил 2-азабицикло[3.1.0]гексан-2,3-дикарбоксилат. К перемешиваемой суспензии неочищенного 2-бром-1-(6-бромнафталин-2-ил)этанона (4,35 г, 13,3 ммоль) и (1R,3S,5R)-2-(трет-бутоксикарбонил)-2-азабицикло[3.1.0]гексан-3-карбоновой кислоты (3,01 г,13,25 ммоль) в ацетонитриле (80 мл) добавляли DIPEA (3,47 мл, 19,88 ммоль) и данную реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь концентрировали досуха и очищали на BIOTAGE Horizon (160 г SiO2, 10-20% EtOAc/гексаны). Фракции, содержащие желаемый продукт, выдерживали в течение 3 суток. В некоторых фракциях образовались большие кристаллы (собрали 240 мг чистого желаемого продукта согласно 1 Н ЯМР). Все фракции, содержащие желаемый продукт, собирали и концентрировали до получения желтой отвердевшей пены, которую суспендировали в Et2O (40 мл). Образовавшееся белое твердое вещество собирали путем фильтрования и промывали Et2O с получением (1R,3S,5R)-3-(2-(6-бромнафталин-2-ил)-2-оксоэтил) 2-трет-бутил 2 азабицикло[3.1.0]гексан-2,3-дикарбоксилата (3.24 г). Данные ЖХ-МС-анализа: время удержания: 2.760 мин; m/z 472; 474,02 (1:1) (МН-). ЖХ-данные регистрировали на жидкостном хроматографе ShimadzuLC-10AS, оснащенном колонкой PHENOMENEX Luna (10 мкм, С 18, 3.050 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 4 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 3 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 4 мин; растворитель А: 5% МеОН/95% Н 2 О/10 мМ ацетат аммония; растворитель В: 5% Н 2 О/95% МеОН/10 мМ ацетат аммония. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. 1(1R,3S,5R)-3-(2-(6-Бромнафталин-2-ил)-2-оксоэтил) 2-трет-бутил 2-азабицикло[3.1.0]гексан-2,3 дикарбоксилат (3,46 г, 7,28 ммоль) и ацетат аммония (11,2 г, 146 ммоль) растворяли в толуоле (100 мл) и перемешивали. Затем данную реакционную смесь помещали в масляную баню, которую предварительно нагревали до 100C, и перемешивали при этой же температуре в течение 12 ч. Затем реакционную смесь оставляли охлаждаться до комнатной температуры, концентрировали и распределяли между ДХМ (200 мл) и полунасыщенным водным раствором NaHCO3 (150 мл). Органический слой промывали солевым раствором (100 мл), сушили (MgSO4), фильтровали и концентрировали до получения отвердевшей смолистой пены. Данное вещество очищали на BIOTAGE Horizon (160 г SiO2; растворитель для нанесения пробы: ДХМ; 30-50% EtOH/гексаны) с получением (1R,3S,5R)-трет-бутил 3-(5-(6-бромнафталин-2-ил)1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (3,05 г) в виде желтой отвердевшей пены. Данные ЖХ-МС-анализа: время удержания: 2,238 мин; m/z 452,07; 454,02 (1:1) (MET). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEXLuna (3 мкм, С 18, 2,030 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 1 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 2 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 3 мин; растворитель А: 5% ацетонитрила/95% Н 2 О/10 мМ ацетат аммония; растворитель В: 5% Н 2 О/95% ацетонитрила/10 мМ ацетат аммония. Масс-спектр получали с использованием MICROMASS Промежуточное соединение 134. 6-Бром-2-(1-этоксивинил)хинолин. К раствору 6-бром-2-хлорхинолина (1,0 г, 4,1 ммоль) и трибутил(1-этоксивинил)станнана (1,79 г,4,95 ммоль) в диоксане (8 мл) добавляли дихлор-бис-(трифенилфосфин)палладий(II) (0,289 г, 0,412 ммоль) и данную смесь перемешивали в течение 5 ч при 100C, желаемый продукт идентифицировали с использованием ЖХ-МС. Неочищенную реакционную смесь концентрировали и очищали путем флэшхроматографии на силикагеле, используя для элюирования смесь гексаны/ДХМ (1:1), с получением продукта, 6-бром-2-(1-этоксивинил)хинолина, (720 мг) в виде белого твердого вещества. Данные ЖХ-МСанализа: время удержания: 4,091 мин; m/z 279,84 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEXLuna (3 мкм, С 18, 2,050 мм),с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 0,8 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 4 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 5 мин; растворитель А: 5% МеОН/95% Н 2 О/10 мМ ацетат аммония; растворитель В: 5% Н 2 О/95% МеОН/10 мМ ацетат аммония. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. Промежуточное соединение 135. 2-Бром-1-(6-бромхинолин-2-ил)этанон. К раствору 6-бром-2-(1-этоксивинил)хинолина (530 мг, 1,91 ммоль) в смеси ТГФ (10 мл) и воды (2,5 мл) добавляли NBS (407 мг, 2,287 ммоль) и данную смесь перемешивали в течение 2 ч при комнатной температуре. Затем реакционную смесь распределяли между EtOAc и солевым раствором и органический слой концентрировали. Данное неочищенное вещество очищали путем флэш-хроматографии на силикагеле, используя для элюирования Et2O/гексаны (градиент: 0-5% Et2O), с получением 2-бром-1-(6 бромхинолин-2-ил)этанона (380 мг) в виде белого твердого вещества. Данные ЖХ-МС-анализа: время удержания: 3,988 мин; m/z 329,84 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEX Luna (3 мкм, С 18, 2,050 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 0,8 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 4 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 5 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. Промежуточное соединение 136. (1R,3S,5R)-3-(2-(6-Бромхинолин-2-ил)-2-оксоэтил) 2-трет-бутил 2 азабицикло[3.1.0]гексан-2,3-дикарбоксилат. К раствору 2-бром-1-(6-бромхинолин-2-ил)этанона (268 мг, 0,815 ммоль) и (1R,3S,5R)-2-(третбутоксикарбонил)-2-азабицикло[3.1.0]гексан-3-карбоновой кислоты (204 мг, 0,896 ммоль) в ацетонитриле (8 мл) добавляли DIPEA (0,21 мл, 1,2 ммоль) и данную реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Затем реакционную смесь разбавляли насыщенным водным растворомNaHCO3 (5 мл) и экстрагировали EtOH (этилацетатом) (220 мл). Объединенные органические слои промывали солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Данный неочищенный продукт очищали путем флэш-хроматографии на силикагеле (растворитель для нанесения пробы: ДХМ),используя для элюирования Et2O/гексаны (градиент: 10-30% Et2O), с получением (1R,3S,5R)-3-(2-(6 бромхинолин-2-ил)-2-оксоэтил) 2-трет-бутил 2-азабицикло[3.1.0]гексан-2,3-дикарбоксилата (332 мг) в виде белого твердого вещества. Данные ЖХ-МС-анализа: время удержания: 4,283 мин; m/z 476,88 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкойPHENOMENEX Luna (3 мкм, С 18, 2,050 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 0,8 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 4 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 5 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением.(1R,3S,5R)-3-(2-(6-бромхинолин-2-ил)-2-оксоэтил) 2-трет-бутил 2 азабицикло[3.1.0]гексан-2,3-дикарбоксилата (407 мг, 0,856 ммоль) в толуоле (10 мл) добавляли ацетат аммония (990 мг, 12,8 ммоль) и данную смесь перемешивали в течение 3 ч при 120C. Затем реакционную смесь разбавляли насыщенным водным раствором NaHCO3 (10 мл) и экстрагировали EtOH (этилацетатом) (50 мл). Органический слой промывали солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Данное неочищенное вещество очищали путем флэш-хроматографии на силикагеле,используя для элюирования смесь EtOH/гексаны (1:1), с получением трет-бутил (1R,3S,5R)-3-(4-(6-бром 2-хинолинил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (272 мг) в виде светложелтого твердого вещества. Данные ЖХ-МС-анализа: время удержания: 3,306 мин; m/z 456,99 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкойPHENOMENEX Luna (3 мкм, С 18, 2,050 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 0,8 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 4 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 5 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением: 1 Н ЯМР(1R,3S,5R)-3-(4-(6-бром-2-хинолинил)-1H-имидазол-2-ил)-2 азабицикло[3.1.0]гексан-2-карбоксилата (150 мг, 0,329 ммоль), (1R,3S,5R)-трет-бутил 3-(5-(4-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (149 мг, 0,329 ммоль), дициклогексил(2',6'-диметоксибифенил-2-ил)фосфина (27,0 мг, 0,066 ммоль) и K2CO3 (137 мг, 0,988 ммоль) в смеси ТГФ (2 мл) и воды (0,50 мл) добавляли Pd(OAc)2 (7,40 мг, 0,033 ммоль) и данную реакционную смесь перемешивали в течение 2 ч при 110C. Затем реакционную смесь разбавляли МеОН (метанолом), фильтровали и очищали путем препаративной ЖХВД (Н 2 О-МеОН с 10 мМ NH4OAc в качестве буфера) с получением трет-бутил (1R,3S,5R)-3-(4-(6-(4-(2-1R,3S,5R)-2-(третбутоксикарбонил)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)фенил)-2-хинолинил)-1H-имидазол 2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (140 мг) в виде ярко-желтого твердого вещества. Данные ЖХ-МС-анализа: время удержания: 3,150 мин; m/z 700,36 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEX Luna (3 мкм, С 18,- 20021194 2,050 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 0,8 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 4 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 5 мин; растворитель А: 5% МеОН/95% Н 2 О/10 мМ ацетат аммония; растворитель В: 5% Н 2 О/95% МеОН/10 мМ ацетат аммония. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением.(1R,3S,5R)-3-(4-(6-(4-(2-1R,3S,5R)-2-(трет-бутоксикарбонил)-2 азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)фенил)-2-хинолинил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (130 мг, 0,186 ммоль) в смеси диоксана (3 мл), МеОН (0,5 мл) и ДХМ (3 мл) добавляли 4 М раствор HCl (1 мл, 4,00 ммоль) в диоксане и данную смесь перемешивали в течение 2 ч при комнатной температуре. Затем реакционную смесь концентрировали с получением HCl соли 2-(21R,3S,5R)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)-6-(4-(2-1R,3S,5R)-2-азабицикло[3.1.0]гекс-3-ил)1H-имидазол-4-ил)фенил)хинолина (140 мг) в виде желтого твердого вещества. Данные ЖХ-МС-анализа: время удержания: 2,063 мин; m/z 500,37 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEXLuna (3 мкм, С 18, 2,050 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 0,8 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 4 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 5 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. 1H ЯМР (400 МГц, MeOD)м.д: 9.09 (d, J=9.0 Гц, 1 Н), 8.66 (s, 1 Н), 8.56-8.62(0,720 г, 3,14 ммоль) в ацетонитриле (50 мл) добавляли DIPEA (0,823 мл, 4,71 ммоль) и данную реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь концентрировали досуха и очищали на BIOTAGE Horizon (40 г SiO2, 10-20% EtOAc/гексаны) с получением(1,09 г) в виде желтой отвердевшей пены. Данные ЖХ-МС-анализа: время удержания: 4,413 мин; m/z 476; 478,20 (1:1) (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS,оснащенном колонкой PHENOMENEX Luna (3 мкм, С 18, 2,050 мм), с использованием детектора SPD10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 1 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 4 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 5 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. 1 Н ЯМР (400 МГц, MeOD)м.д: 8.57 (br. s., 1 Н), 8.14(d, J=1.5 Гц, 1 Н), 8.01 (d,J=8.5 Гц, 1 Н), 7.96 (d, J=8.8 Промежуточное соединение 152. (2S,5S)-трет-Бутил 2-(5-(6-бромнафталин-2-ил)-1H-имидазол-2 ил)-5-метилпирролидин-1-карбоксилат. К раствору (2S,5S)-2-(2-(6-бромнафталин-2-ил)-2-оксоэтил) 1-трет-бутил 5-метилпирролидин-1,2 дикарбоксилата (1,17 г, 2,47 ммоль) в толуоле (30 мл) добавляли ацетат аммония (3,79 г, 49,1 ммоль),данную реакционную смесь помещали в масляную баню, которую предварительно нагревали до 100C, и перемешивали при этой же температуре в течение ночи. Затем реакционную смесь оставляли охлаждаться до комнатной температуры, концентрировали и распределяли между ДХМ (100 мл) и полунасыщенным водным раствором NaHCO3 (75 мл). Органический слой промывали солевым раствором (50 мл),сушили (MgSO4), фильтровали и концентрировали до получения отвердевшей смолистой пены. Данное вещество очищали на BIOTAGE Horizon (160 г SiO2; растворитель для нанесения пробы: ДХМ; 20-35%EtOAc/гексаны) с получением (2S,5S)-трет-бутил 2-(5-(6-бромнафталин-2-ил)-1H-имидазол-2-ил)-5 метилпирролидин-1-карбоксилата (893 мг) в виде желтовато-коричневой отвердевшей пены. Данные ЖХ-МС-анализа: время удержания: 3,410 мин; m/z 456; 458,22 (1:1) (MH+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEX Luna (3 мкм,С 18, 2,050 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 0,8 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 3 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 4 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением: 1 Н ЯМР (400 МГц, MeOD)м.д: 8.19 (br. s., 1 Н),8.01 (s, 1 Н), 7.83-7.93 (m, 1 Н), 7.76-7.83 (m, 2 Н), 7.55 (dd, J=8.7, 1.6 Гц, 1H), 7.47 (br. s., 1H), 4.94 (br. s.,1H), 3.99-4.09 (m, 1H), 2.22-2.36 (m, 2H), 2.09-2.21 (m, 1H), 1.72 (br. s., 1H), 1.42 (d, J=6.0 Гц, 3H), 1.34 (br.(1R,3S,5R)-трет-Бутил-3-(4-6-(2-2S,5S)-1-(третбутоксикарбонил)-5-метилпирролидин-2-ил)-1H-имидазол-4-ил)нафталин-2-ил)этинил)-1H-имидазол-2 ил)-2-азабицикло[3.1.0]гексан-2-карбоксилат. Раствор (2S,5S)-трет-бутил 2-(5-(6-бромнафталин-2-ил)-1H-имидазол-2-ил)-5-метилпирролидин-1 карбоксилата (127 мг, 0,277 ммоль), (1R,3S,5R)-трет-бутил 3-(5-этинил-1H-имидазол-2-ил)-2 азабицикло[3.1.0]гексан-2-карбоксилата (91 мг, 0,33 ммоль) и CuI (2,6 мг, 0,014 ммоль) в смеси ДМФА (3 мл) и TEA (0,12 мл, 0,83 ммоль) барботировали азотом в течение 15 мин. Затем добавляли Pd(PPh3)4 (16 мг, 0,014 ммоль), сосуд с реакционной смесью продували азотом, герметично закрывали и нагревали при 50C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, затем реакционную смесь барботировали азотом в течение 20 мин и затем добавляли еще одну порцию CuI (4 мг) иPd(PPh3)4 (15 мг). Данную реакционную смесь продували азотом в течение 5 мин, сосуд с реакционной смесью герметично закрывали и смесь нагревали при 60C в течение 1 суток. Затем реакционную смесь охлаждали до комнатной температуры, разбавляли метанолом, фильтровали и очищали путем препаративной ЖХВД (МеОН/вода с ТФУ-буфером) с получением ТФУ-соли (1R,3S,5R)-трет-бутил 3-(5-6-(22S,5S)-1-(трет-бутоксикарбонил)-5-метилпирролидин-2-ил)-1H-имидазол-5-ил)нафталин-2-ил)этинил)1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (56,7 мг) в виде желтого твердого вещества. Данные ЖХ-МС-анализа: время удержания: 3,161 мин; m/z 649,62 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEX Luna (3 мкм,С 18, 2,050 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 0,8 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 4 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 5 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. 1 Н ЯМР (400 МГц, MeOD)м.д: 8.31 (s, 1 Н),8.21 (s, 1 Н), 8.07 (d, J=8.8 Гц, 1 Н), 7.99-8.04 (m, 2 Н), 7.91 (dd, J=8.8, 1.8 Гц, 1 Н), 7.77-7.87 (m, 1 Н), 7.69(53,6 мг, 0,061 ммоль) в диоксане (1,5 мл) добавляли 4 М раствор HCl (0,611 мл, 2,445 ммоль) в диоксане и данную реакционную смесь интенсивно перемешивали в течение 2 ч. Затем реакционную смесь в течение ночи концентрировали в потоке азота с получением HCl соли (1R,3S,5R)-3-(4-6-(2-2S,5S)-5-метилпирролидин-2 ил)-1H-имидазол-4-ил)нафталин-2-ил)этинил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексана (37 мг), который использовали без дополнительной очистки. Данные ЖХ-МС-анализа: время удержания: 2,302 мин; m/z 449,40 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEX Luna (3 мкм, С 18, 2,050 мм), с использованием детектора SPD-10AVUV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 0,8 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 4 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 5 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. Пример 80. Метил 1S)-1-1R,3S,5R)-3-(4-(6-(4-(2-1R,3S,5R)-2-2S)-2 метоксикарбонил)амино)-3-метилбутаноил)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)фенил)-2 хинолинил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гекс-2-ил)карбонил)-2-метилпропил)карбамат. К раствору HCl соли 2-(2-1R,3S,5R)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)-6-(4-(21R,3S,5R)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)фенил)хинолина (промежуточное соединение 139) (50 мг, 0,073 ммоль) и (S)-2-(метоксикарбониламино)-3-метилбутановой кислоты (29,5 мг, 0,169 ммоль) в смеси ДМФА (1 мл) и DIPEA (0,115 мл, 0,660 ммоль) добавляли HATU (64,1 мг, 0,169 ммоль) и данную реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Затем реакционную смесь разбавляли МеОН (метанолом), фильтровали и очищали путем препаративной ЖХВД (Н 2 ОМеОН с 0,1% ТФУ-буфером) с получением ТФУ-соли метил 1S)-1-1R,3S,5R)-3-(4-(6-(4-(21R,3S,5R)-2-2S)-2-метоксикарбонил)амино)-3-метилбутаноил)-2-азабицикло[3.1.0]гекс-3-ил)-1Hимидазол-4-ил)фенил)-2-хинолинил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гекс-2-ил)карбонил)-2 метилпропил)карбамата (55,3 мг) в виде желтого твердого вещества. Данные ЖХ-МС-анализа: время удержания: 2,883 мин; m/z 814,65 (МН+). ЖХ-данные регистрировали на жидкостном хроматографеShimadzu LC-10AS, оснащенном колонкой PHENOMENEX Luna (3 мкм, С 18, 2,030 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 1 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 2 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 3 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением.(64,1 мг, 0,169 ммоль) и данную реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Затем реакционную смесь разбавляли МеОН (метанолом), фильтровали и очищали путем препаративной ЖХВД (Н 2 О-МеОН с 0,1% ТФУ-буфером) с получением ТФУ-соли метил 1S)-2-1R,3S,5R)3-(4-(6-(4-(2-1R,3S,5R)-2-2S)-2-метоксикарбонил)амино)-2-(тетрагидро-2H-пиран-4-ил)ацетил)-2 азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)фенил)-2-хинолинил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гекс-2-ил)-2-оксо-1-(тетрагидро-2H-пиран-4-ил)этил)карбамата (64,8 мг) в виде желтого твердого вещества. Данные ЖХ-МС-анализа: время удержания: 2,553 мин; m/z 898,70 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEXLuna (3 мкм, С 18, 2,030 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 1 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 2 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 3 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. Пример 96. Метил 1S)-2-1R,3S,5S)-3-(4-6-(2-1R,3S,5R)-2-2S)-2-метоксикарбонил)амино)-3 метилбутаноил)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)-2-нафтил)этинил)-1H-имидазол-2-ил)2-азабицикло[3.1.0]гекс-2-ил)-2-оксо-1-(тетрагидро-2H-пиран-4-ил)этил)карбамат. К раствору (1R,3S,5R)-трет-бутил 3-(5-6-(2-1R,3S,5R)-2-S)-2-(метоксикарбониламино)-3 метилбутаноил)-2-азабицикло[3.1.0]гексан-3-ил)-1H-имидазол-5-ил)нафталин-2-ил)этинил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (промежуточное соединение 150) (69 мг, 0,074 ммоль) в диоксане (2 мл) добавляли 4 М раствор HCl (0,370 мл, 1,48 ммоль) в диоксане и данную суспензию перемешивали в течение 1,5 ч. Затем реакционную смесь концентрировали в потоке азота и полученный промежуточный продукт обрабатывали (S)-2-(метоксикарбониламино)-2-(тетрагидро-2H-пиран 4-ил)уксусной кислотой (20,9 мг, 0,096 ммоль), ДМФА (1,5 мл), DIPEA (0,078 мл, 0,44 ммоль) и в заключение HATU (36,6 мг, 0,096 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре, разбавляли МеОН (метанолом), фильтровали и очищали путем препаративной ЖХВД (МеОН/вода с 0,1% ТФУ) с получением ТФУ-соли метил 1S)-2-1R,3S,5R)-3-(4-6-(2-1R,3S,5R)-2-2S)2-метоксикарбонил)амино)-3-метилбутаноил)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)-2-нафтил)этинил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гекс-2-ил)-2-оксо-1-(тетрагидро-2H-пиран-4-ил)этил)карбамата (35,3 мг) в виде желтого твердого вещества. Данные ЖХ-МС-анализа: время удержания: 2,726 мин;m/z 803,74 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEX Luna (3 мкм, С 18, 2,050 мм), с использованием детектора SPD10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 0,8 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 4 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 5 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. 1 Пример 97. Метил 1S)-1-1R,3S,5R)-3-(4-(6-2-1R,3S,5R)-2-2S)-2-2R,4R,6S-2,6 диметилтетрагидро-2H-пиран-4-ил)-2-метоксикарбонил)амино)ацетил)-2-азабицикло[3.1.0]гекс-3-ил)1H-имидазол-4-ил)этинил)-2-нафтил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гекс-2-ил)карбонил)-2 метилпропил)карбамат. К раствору (1R,3S,5R)-трет-бутил 3-(5-6-(2-1R,3S,5R)-2-S)-2-(метоксикарбониламино)-3 метилбутаноил)-2-азабицикло[3.1.0]гексан-3-ил)-1H-имидазол-5-ил)нафталин-2-ил)этинил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (промежуточное соединение 150) (62,7 мг, 0,067 ммоль) в диоксане (2 мл) добавляли 4 М раствор HCl (0,34 мл, 1,3 ммоль) в диоксане и данную суспензию перемешивали в течение 1,5 ч. Затем реакционную смесь концентрировали досуха в потоке азота и затем обрабатывали 2-2R,4R,6S)-2,6-диметилтетрагидро-2H-пиран-4-ил)-2-(метоксикарбониламино)уксусной кислотой (Сар-179, стереоизомер 2) (21,45 мг, 0,087 ммоль), ДМФА (1,5 мл), DIPEA(0,071 мл, 0,40 ммоль) и в заключение HATU (33,3 мг, 0,087 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре, разбавляли МеОН (метанолом), фильтровали и очищали путем препаративной ЖХВД (МеОН/вода с 0,1% ТФУ) с получением ТФУ-соли метил 1S)-1-1R,3S,5R)3-(4-(6-2-1R,3S,5R)-2-2S)-2-2R,4R,6S)-2,6-диметилтетрагидро-2H-пиран-4-ил)-2-метоксикарбонил)амино)ацетил)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)этинил)-2-нафтил)-1H-имидазол-2 ил)-2-азабицикло[3.1.0]гекс-2-ил)карбонил)-2-метилпропил)карбамата (28 мг) в виде желтого твердого вещества. Данные ЖХ-МС-анализа: время удержания: 2,898 мин; m/z 831,80 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEX Luna (3 мкм, С 18, 2,050 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 0,8 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 4 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 5 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. 1H ЯМР (400 МГц, MeOD)м.д: 8.27 (s, 1H), 8.17 (s, 1 Н), 8.05 (d, J=8.8 Гц, 1 Н), 7.98-8.02 (m, 2 Н), 7.88 (dd, J=8.5, 1.8 Гц, 1 Н), 7.74 (s, 1H),7.66 (dd,J=8.5, 1.5 Гц, 1 Н), 5.15 (dd, J=9.2, 6.9 Гц, 1 Н), 5.10 (dd, J=9.0, 6.3 Гц, 1 Н), 4.56 (t, J=6.0 Гц, 2 Н),3.73-3.85 (m, 2 Н), 3.67 (s, 6 Н), 3.43-3.54 (m, 2 Н), 2.70 (dd, J=13.7, 9.4 Гц, 1 Н), 2.61 (dd, J=13.6, 9.0 Гц, 1 Н),2.40-2.54 (m, 2 Н), 2.01-2.23 (m, 4 Н), 1.55-1.64 (m, 1 Н), 1.46 (d, J=12.0 Гц, 1 Н), 1.17 (dd, J=6.0, 4.3 Гц, 6 Н),1.04-1.13 (m, 3 Н), 1.01 (d, J=6.8 Гц, 3 Н), 0.96-1.03 (m, 1 Н), 0.92 (d, J=6.8 Гц, 3 Н), 0.88-0.93 (m, 1 Н), 0.820.87 (m, 1 Н). Пример 98. Метил 1S)-2-2S,5S)-2-(4-(6-2-1R,3S,5R)-2-2S)-2-метоксикарбонил)амино)-2(тетрагидро-2H-пиран-4-ил)ацетил)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)этинил)-2-нафтил)1H-имидазол-2-ил)-5-метил-1-пирролидинил)-2-оксо-1-(тетрагидро-2H-пиран-4-ил)этил)карбамат. К HCl соли (1R,3S,5R)-3-(4-6-(2-2S,5S)-5-метилпирролидин-2-ил)-1H-имидазол-4-ил)нафталин 2-ил)этинил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гексана (промежуточное соединение 154) (27 мг,0,045 ммоль) и (S)-2-(метоксикарбониламино)-2-(тетрагидро-2H-пиран-4-ил)уксусной кислоте (24,7 мг,0,114 ммоль) в смеси ДМФА (1 мл) и DIPEA (0,056 мл, 0,32 ммоль) добавляли HATU (43,2 мг, 0,114 ммоль) и данную реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Затем реакционную смесь концентрировали в потоке азота, растворяли в МеОН, фильтровали и очищали путем препаративной ЖХВД (МеОН/вода с 0,1% ТФУ-буфером) с получением ТФУ-соли метил 1S)-22S,5S)-2-(4-(6-2-1R,3S,5R)-2-2S)-2-метоксикарбонил)амино)-2-(тетрагидро-2H-пиран-4-ил)ацетил)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)этинил)-2-нафтил)-1H-имидазол-2-ил)-5-метил-1 пирролидинил)-2-оксо-1-(тетрагидро-2H-пиран-4-ил)этил)карбамата (31,4 мг) в виде желтого твердого вещества. Данные ЖХ-МС-анализа: время удержания: 2,658 мин; m/z 847,80 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEXLuna (3 мкм, С 18, 2,050 мм), с использованием детектора SPD-10AV UV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 0,8 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 4 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 5 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованиемMICROMASS Platform для ЖХ в режиме ионизации электрораспылением. Согласно: 1 Н ЯМР полученный продукт представляет собой смесь (1:3.5) ротамеров. Далее приведен спектр 1H ЯМР основного ротамера. 1H ЯМР (400 МГц, MeOD)м.д: 8.29 (s, 1H), 8.18 (s, 1 Н), 8.06 (d, J=8.5 Гц, 1 Н), 8.01 (d, J=8.8 Гц, 1 Н), 7.99 (s, 1H), 7.89 (dd, J=8.7, 1.6 Гц, 1 Н), 7.74 (s, 1 Н), 7.67 (dd, J=8.4, 1.4 Гц, 1 Н), 5.19 (dd, J=10.5,7.0 Гц, 1 Н), 5.09 (dd, J=8.9, 6.4 Гц, 1 Н), 4.59 (d, J=7.5 Гц, 1 Н), 4.22 (d, J=9.3 Гц, 1 Н), 3.86-4.00 (m, 4 Н),3.72-3.82 (m, 2 Н), 3.67 (s, 6 Н), 3.23-3.45 (m, 4 Н), 2.50-2.70 (m, 2 Н), 2.24-2.50 (m, 3 Н), 1.90-2.13 (m, 4 Н),1.70-1.85 (m, 1 Н), 1.57 (d, J=6.5 Гц, 3 Н), 1.30-1.64 (m, 6 Н), 1.23 (d, J=11.5 Гц, 1 Н), 1.04-1.12 (m, 1 Н), 0.85(50,7 мг, 0,133 ммоль) и данную реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Затем реакционную смесь разбавляли МеОН (метанолом), фильтровали и очищали путем препаративной ЖХВД (Н 2 О-МеОН с 0,1% ТФУ-буфером) с получением ТФУ-соли метил 1S)-1-1R,3S,5R)-3-(4-(6-(4-(21R,3S,5R)-2-2S)-2-метоксикарбонил)амино)-3-метилбутаноил)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол 4-ил)фенил)-2-хиноксалинил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гекс-2-ил)карбонил)-2-метилпропил)карбамата (22,3 мг) в виде желтого твердого вещества. Данные ЖХ-МС-анализа: время удержания: 3,451 мин; m/z 815,72 (МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEX Luna (3 мкм, С 18, 2,050 мм), с использованием детектора SPD-10AVUV-Vis, на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 0,8 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 4 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 5 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением. 1HCl соли метил 1S)-1-2S,4S)-2-(4-(6-(4-(2-2S,4S)-1-2S)-2 метоксикарбонил)амино)-3-метилбутаноил)-4-метил-2-пирролидинил)-1H-имидазол-4-ил)фенил)-2-хинолинил)-1H-имидазол-2-ил)-4-метил-1-пирролидинил)карбонил)-2-метилпропил)карбамата (промежуточное соединение 173) (10,1 мг, 0,014 ммоль) и (S)-2-(метоксикарбониламино)-2-(тетрагидро-2H-пиран 4-ил)уксусной кислоты (7,0 мг, 0,032 ммоль) в смеси ДМФА (0,5 мл) и DIPEA (0,022 мл, 0,13 ммоль) добавляли HATU (12,24 мг, 0,032 ммоль) и данную реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Затем реакционную смесь разбавляли МеОН (метанолом), фильтровали и очищали путем препаративной ЖХВД (Н 2 О-МеОН с 0,1% ТФУ-буфером) с получением ТФУ-соли метил 1S)-2-1R,3S,5R)-3-(4-(6-(4-(2-1R,3S,5R)-2-2S)-2-метоксикарбонил)амино)-2-(тетрагидро-2H-пиран-4-ил)ацетил)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-4-ил)фенил)-2-хиноксалинил)-1H-имидазол-2-ил)-2-азабицикло[3.1.0]гекс-2-ил)-2-оксо-1-(тетрагидро-2H-пиран-4-ил)этил)карбамата (7,3 мг) в виде желтого твердого вещества. Данные ЖХ-МС-анализа: время удержания: 3,251 мин; m/z 899,79(МН+). ЖХ-данные регистрировали на жидкостном хроматографе Shimadzu LC-10AS, оснащенном колонкой PHENOMENEX Luna (3 мкм, С 18, 2,050 мм), с использованием детектора SPD-10AV UV-Vis,на длине волны детектора 220 нм. Использовали следующие условия элюирования: скорость потока: 0,8 мл/мин; градиент: 100% растворитель А/0% растворитель В - 0% растворитель А/100% растворитель В; продолжительность градиента: 4 мин; конечную концентрацию градиента поддерживали в течение 1 мин; продолжительность анализа: 5 мин; растворитель А: 10% МеОН/90% Н 2 О/0,1% трифторуксусной кислоты; растворитель В: 10% Н 2 О/90% МеОН/0,1% трифторуксусной кислоты. Масс-спектр получали с использованием MICROMASS Platform для ЖХ в режиме ионизации электрораспылением: 1 Н ЯМР(m, 8H), 1.02-1.16 (m, 2H), 0.79-0.96 (m, 2H). Биологическая активность В настоящем изобретении использован анализ репликона ВГС, который подготавливали, проводили и подтверждали в соответствии с тем, как описано в PCT/US2006/022197, заявке того же заявителя, что и данная заявка, и в O'Boyle et al., Antimicrob. Agents Chemother., 49(4): 1346-1353 (Apr. 2005). Также использованы методики анализа, включающие люциферазные репортеры (описание см. Apath.com). Для исследования соединений, описанных в настоящем изобретении, использовали клетки с репликоном HCV-neo и клетки с репликоном, содержащим замену фрагмента вирусного генома в NSSAобласти на ген устойчивости (к антибиотику). Установлено, что ингибирующая активность соединений в отношении клеток, содержащих мутации, уменьшена в разной степени по сравнению с соответствующей ингибирующей активностью в отношении клеток дикого типа. Соответственно соединения согласно настоящему изобретению могут являться эффективными ингибиторами функции белка NS5A ВГС, и предполагается, что данные соединения являются эффективными в комбинациях, описанных ранее в заявкеPCT/US2006/022197 и в заявке того же заявителя WO 04/014852. Необходимо понимать, что соединения согласно настоящему изобретению могут ингибировать несколько генотипов ВГС. В табл. 2 приведены значения ЕС 50 (концентрации, требуемой для достижения 50%-ного ингибирования) типичных соединений согласно настоящему изобретению в отношении генотипа ВГС 1b. Согласно одному из вариантов осуществления изобретения соединения согласно настоящему изобретению обладают ингибирующей активностью в отношении генотипов 1 а, 1b, 2 а, 2b, 3 а, 4 а и 5 а. Значения ЕС 50 в отношении ВГС 1b находятся в следующих диапазонах: А=0,4-10 пМ; В=10,1 пМ-1,00 нМ и С=1,01 нМ-1 мкМ. Соединения согласно настоящему изобретению наряду с ингибированием функции NS5A также могут использовать другие механизмы ингибирования ВГС, одновременно с ингибированием NS5A или независимо от него. Согласно одному из вариантов осуществления изобретения соединения согласно настоящему изобретению ингибируют репликон ВГС и согласно другому варианту осуществления изобретения соединения согласно настоящему изобретению ингибируют NS5A. Таблица 2 Специалисту в данной области очевидно, что настоящее изобретение не ограничено приведенными выше иллюстративными примерами и что возможны другие варианты осуществления изобретения в пределах сущности изобретения. Поэтому желательно, чтобы примеры рассматривались исключительно как иллюстративные и не ограничивающие изобретение, при этом изобретение следует рассматривать со ссылкой на прилагаемую формулу изобретения, а не на вышеописанные примеры, и поэтому предпола- 27021194 гается, что изобретение включает все варианты в пределах сущности и объема формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (III) или его фармацевтически приемлемой соли,где R4 и R5 независимо выбраны из атома водорода, (С 1-С 6)алкила, (C6-C10)арила, (С 6-С 10)арил(С 1 С 6)алкила, гетероциклила и гетероциклил(С 1-С 2)алкила, где гетероциклил представляет собой 5-6 членный гетероциклил, включающий 1-2 гетероатома, выбранных из N, S и О,включающий обработку соединения формулы (IV) ацетатом аммония в присутствии основания. 2. Способ по п.1, отличающийся тем, что основание выбрано из третичного амина, ароматического амина, анилина и замещенного имидазола, выбранного из 1-метилимидазола, 2-метилимидазола, 4 метилимидазола, 4-хлоримидазола, 2-хлоримидазола, 4-цианоимидазола и бензимидазола. 3. Способ по п.1, отличающийся тем, что основание выбрано из 1,4-диметилпиперазина, 3 хинуклидинола, 3-метилпиридина, диметилбутиламина, N,N-диметиланилина, димерпранола, хиноксазолина, креатинина, имидазола, морфолина, N-метилморфолина, 1,8-диазабициклоундец-7-ена, 1,4 диазабицикло[2.2.2]октана, коллидина, диизопропилэтиламина и 2,6-лутидина. 4. Способ по п.1, отличающийся тем, что основание представляет собой имидазол.
МПК / Метки
МПК: C07D 209/54
Метки: вируса, ингибиторы, гепатита
Код ссылки
<a href="https://eas.patents.su/29-21194-ingibitory-virusa-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы вируса гепатита с</a>
Предыдущий патент: Автоматизированная система управления командного пункта военно-воздушных сил и войск противовоздушной обороны
Следующий патент: Способ получения геополимеров
Случайный патент: Человеческие моноклональные антитела против лиганда-1 запрограммированной гибели клеток (pd-l1) и их применения


































