Ингибиторы трипсинподобной серинпротеазы, их получение и применение
Номер патента: 18998
Опубликовано: 30.12.2013
Авторы: Лудвиг Фридрих-Александер, Швайнитц Андреа, Зеффинг Анетт, Никлиш Зилке, Ван Де Лохт Андреас, Шульце Александер, Райхельт Клаудиа, Хайникке Йохен, Штайнметцер Петер, Штайнметцер Торстен, Штюрцебехер Йорг, Дагиш Мохаммед
Формула / Реферат
1. Соединение общей формулы (I)

где R1 присутствует однократно или отсутствует и, если присутствует, означает остаток COOR5, где R5 означает атом водорода или полиэтиленгликолевый остаток формулы (II) или (III):
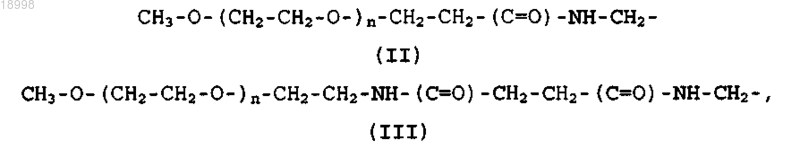
где n имеет такое значение, что полиэтиленгликолевые остатки обладают средней молекулярной массой 10000, 5000, 3400, 2000, 1000 или 750 Да;
R2 означает необязательно замещенный, ароматический или неароматический цикл или бицикл с 6-10 атомами углерода или ароматический гетероцикл с 4-5 атомами углерода и одним атомом азота или оксидом азота, где замещение в случае R2 представляет собой галоген, необязательно замещенную фтором, разветвленную или линейную алкильную группу с 1-6 атомами углерода, необязательно замещенную фтором, разветвленную или линейную алкоксигруппу с 1-6 атомами углерода, гидроксильную группу или цианогруппу;
R3 означает необязательно замещенный ароматический цикл с 6 атомами углерода или ароматический гетероцикл с 3-5 атомами углерода и 1-2 атомами азота, где замещение в случае R3 представляет собой алкиламиногруппу с 1-3 атомами углерода или амидиногруппу;
R4 означает галоген, присутствующий от одного до четырех раз;
o=1 или 2;
p=0, 1, 2 или 3;
i=0 или 1,
а также его рацемические смеси и соли с органическими или неорганическими кислотами.
2. Соединение по п.1, отличающееся тем, что
n означает целое число между 25 до 250, в частности 18, 25, 50, 85, 125 или 250;
R4 означает фтор;
o=1;
p=3;
i=0.
3. Соединение по п.1 или 2, отличающееся тем, что R1 имеется однократно и находится в мета- или пара-положении, предпочтительно R1 означает группу COOH, в особенности R1 имеется однократно и его выбирают из группы 4-COOH или в особенности группы 3-COOH.
4. Соединение по любому из пп.1-3, отличающееся тем, что R2 означает ароматический цикл или бицикл с 6-10 атомами углерода или гетероцикл с 5 атомами углерода и одним атомом азота.
5. Соединение по любому из пп.1-4, отличающееся тем, что замещение в случае R2 представляет собой хлор или фтор, в особенности хлор или необязательно замещенную фтором метильную или трет-бутильную группу, необязательно замещенную фтором, разветвленную или линейную метоксигруппу, гидроксильную группу или цианогруппу.
6. Соединение по любому из пп.1-3, отличающееся тем, что R2 означает неароматический цикл с 6 атомами углерода.
7. Соединение по любому из пп.1-6, отличающееся тем, что замещение в случае R3 представляет собой алкиламинную группу, имеющую 1 атом углерода, или амидиногруппу.
8. Соединение по любому из пп.1-7, отличающееся тем, что замещение в случае R3 представляет собой алкиламиногруппу с 1 атомом углерода.
9. Соединение по любому из пп.1-8, отличающееся тем, что соединение представляет собой соль соляной кислоты, HBr, уксусной кислоты, трифторуксусной кислоты или толуолсульфокислоты.
10. Соединение по любому из пп.1-9, отличающееся тем, что R2 выбирают из следующих остатков:
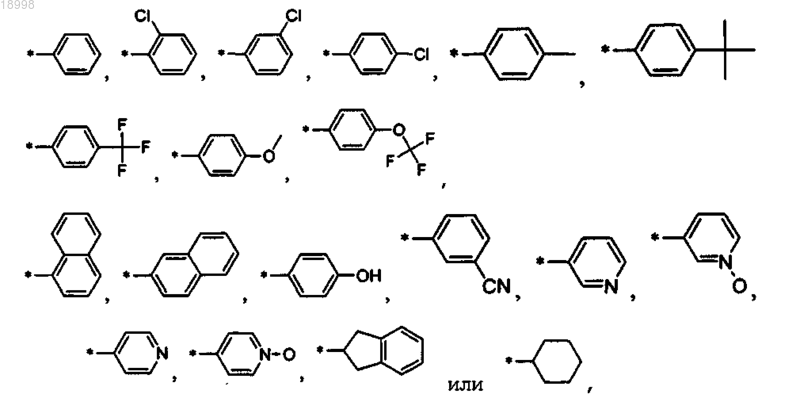
в особенности
 .
.11. Соединение по любому из пп.1-10, отличающееся тем, что R3 выбирают из:
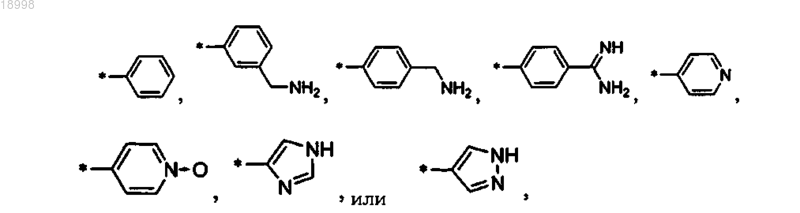
в особенности
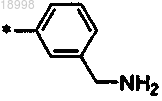 .
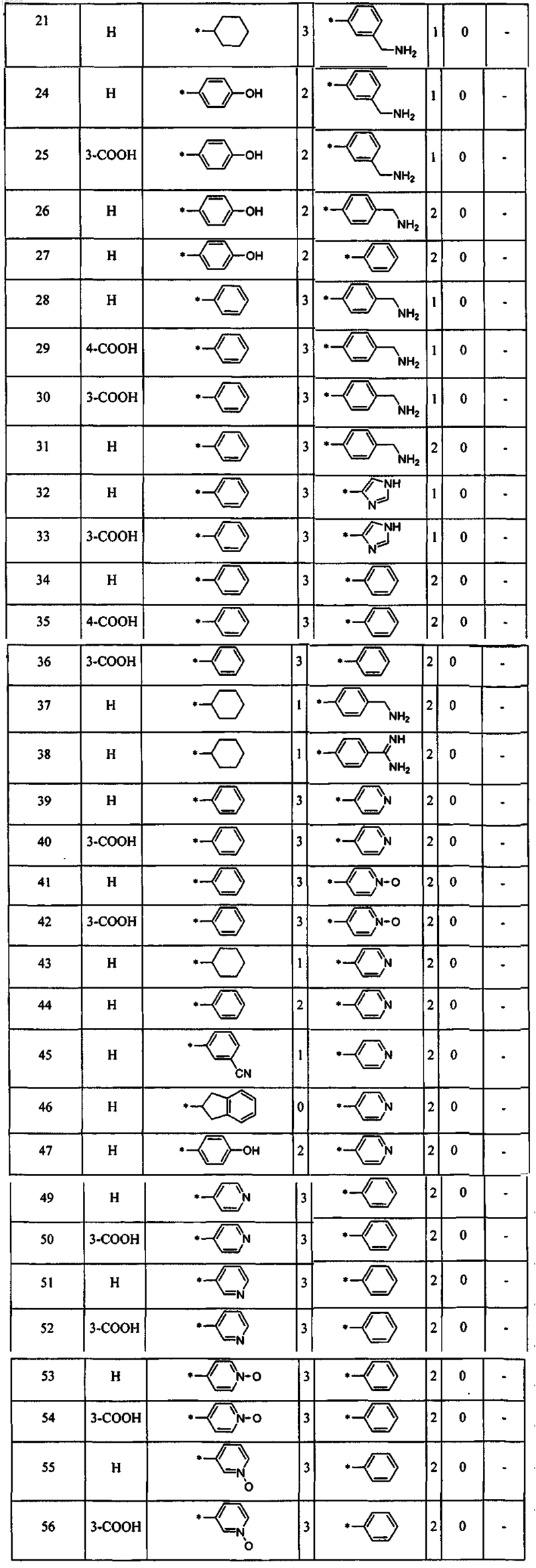
.12. Соединение по любому из пп.1-11, отличающееся тем, что соединение выбирают из следующих:

13. Соединение общей формулы (IV)
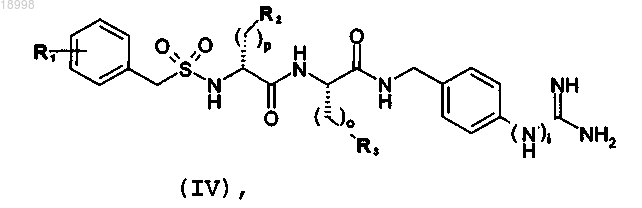
где R1 присутствует однократно или отсутствует и, если присутствует, означает остаток COOR5, где R5 означает атом водорода или разветвленную или линейную низшую алкильную группу с 1-6 атомами углерода или полиэтиленгликолевый остаток формулы (V) или (VI):
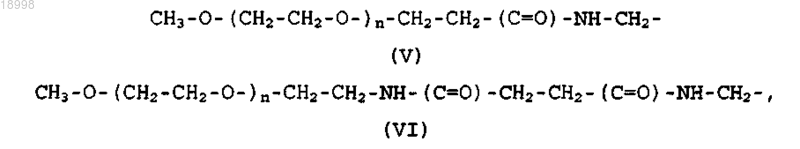
где n имеет такое значение, что полиэтиленгликолевая цепь имеет среднюю молекулярную массу 10000, 5000, 3400, 2000, 1000 или 750 Да;
R2 означает разветвленную или линейную алкилоксигруппу с 1-6 атомами углерода, гидроксильную группу, аминогруппу или разветвленную или линейную алкилоксикарбониламидогруппу с 1-6 атомами углерода или полиэтиленгликолевый остаток формулы (V) или (VI), где n имеет вышеуказанное значение;
R3 выбирают из следующих остатков:
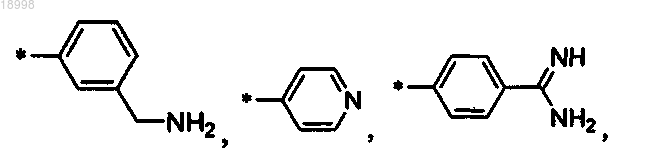
o=1 или 2;
p=1, 2, 3 или 4;
i=0;
а также его рацемические смеси и соли с органическими или неорганическими кислотами.
14. Соединение по п.13, отличающееся тем, что
R5 означает метил или этил, в особенности метил;
n означает целое число между 25 до 250, в частности 18, 25, 50, 85, 125 или 250;
R2 означает радикал трет-бутилокси или радикал трет-бутилоксикарбониламидо;
R3 означает ;
;p=1 или 4;
i=0.
15. Соединение по любому из пп.13 или 14, отличающееся тем, что R1 имеется однократно и находится в мета- или пара-положении, предпочтительно R1 означает группу COOH, в особенности R1 имеется однократно и его выбирают из группы 4-COOH или группы 3-COOH.
16. Соединение по любому из пп.13-15, отличающееся тем, что соединение представляет собой соль соляной кислоты, HBr, уксусной кислоты, трифторуксусной кислоты или толуолсульфокислоты.
17. Соединение по любому из пп.13-16, отличающееся тем, что соединение выбирают из следующих:
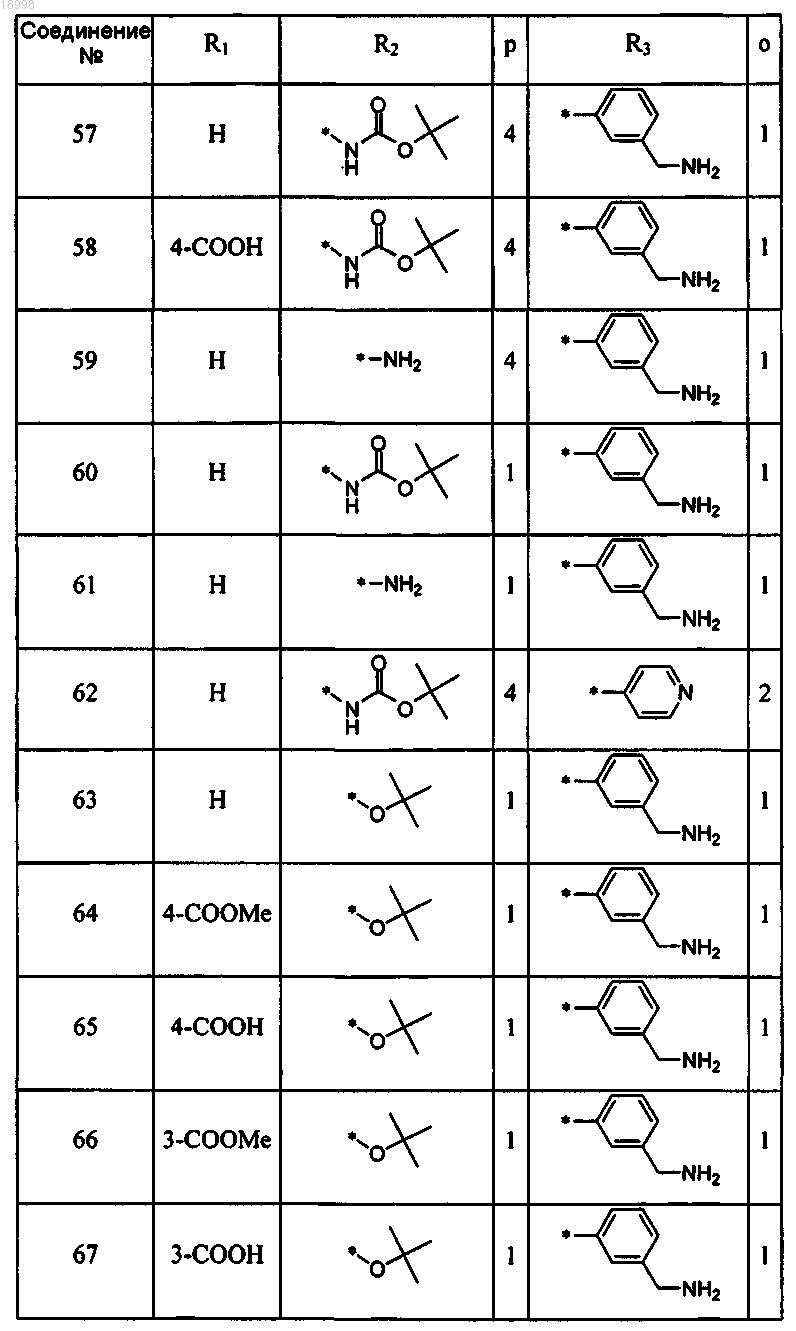
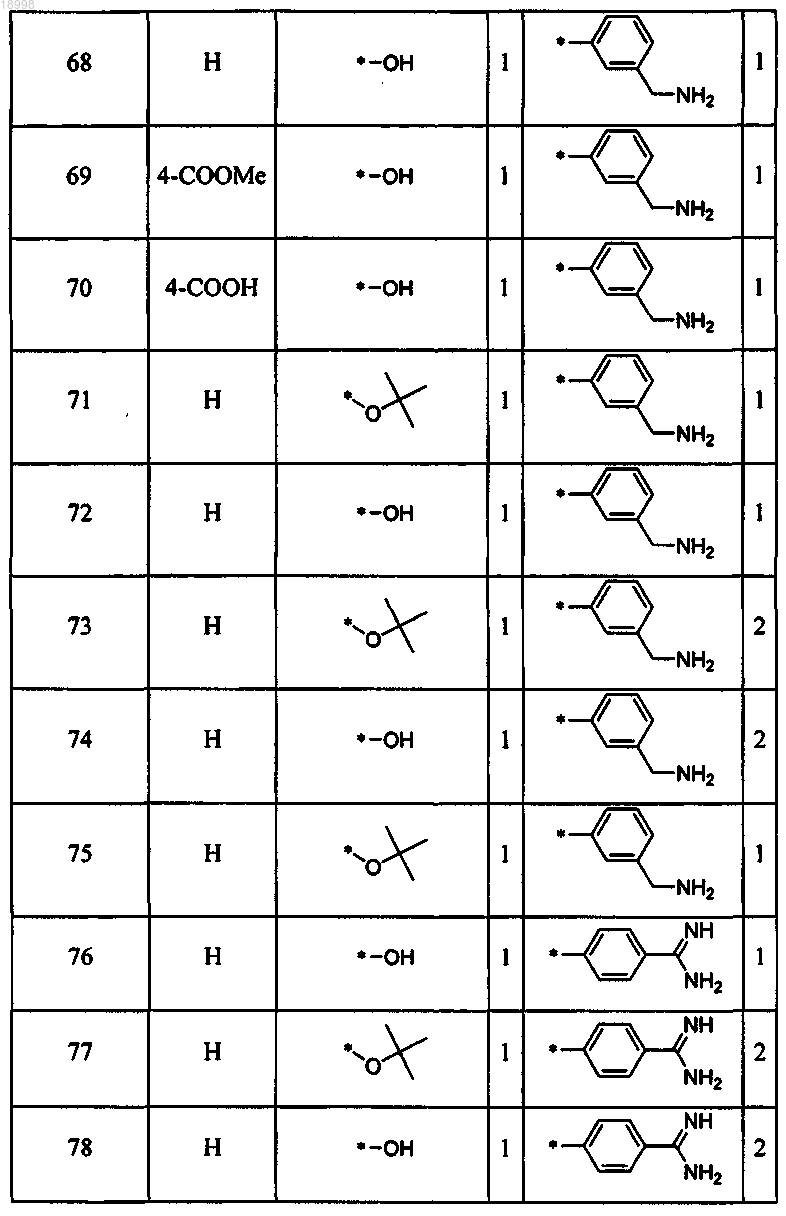
18. Соединение формулы
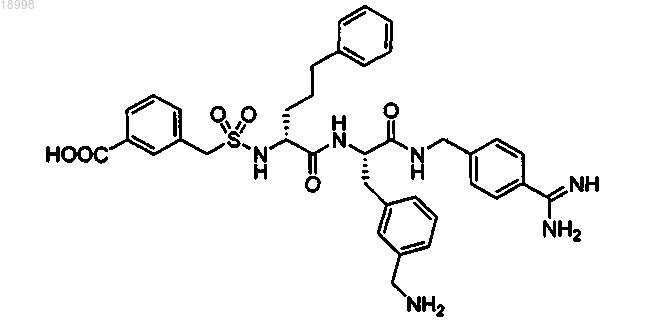
и его рацемические смеси и соли с органическими или неорганическими кислотами, в частности соли соляной кислоты, HBr, уксусной кислоты, трифторуксусной кислоты или толуолсульфокислоты.
19. Способ получения соединения по любому из пп.1-18, отличающийся тем, что соответствующие аминокислоты последовательно присоединяют к защищенному по амидиногруппе амидинобензиламину, причем N-терминальная аминокислота либо уже содержит P4-остаток, либо его затем связывают с ней, и затем полученные соединения в случае необходимости очищают и в случае необходимости пэгилируют.
20. Способ получения соединения по любому из пп.1-18, включающий следующие стадии:
(a) амидирование соответствующей Nα-защищенной аминокислоты с остатком R3 с помощью соответствующего защищенного аминометилбензамидина;
(b) отщепление Nα-защитной группы от аминокислоты с остатком R3 и введение во взаимодействие полученного продукта с соответствующей бензилсульфониламинокислотой с остатками R1 и R2 и отщепление остаточных защитных групп для получения соединения формулы (I) и после возможной очистки;
(c) в случае необходимости пэгилирование полученного соединения.
21. Лекарственное средство для лечения кровопотери, содержащее по меньшей мере одно соединение по любому из пп.1-18.
22. Лекарственное средство по п.21 для лечения кровопотери, возникающей в результате гиперфибринолитических состояний, в случае трансплантаций органов или хирургических вмешательств на сердце, прежде всего с экстракорпоральным кровообращением.
23. Фибриновый клей, содержащий одно соединение по любому из пп.1-18 в качестве первого компонента и тромбин в качестве второго компонента и хлорид кальция для активации фактора XIII, а также подходящие эксципиенты или добавки.
24. Применение по меньшей мере одного соединения по любому из пп.1-18 для получения лекарственного средства по п.21 или 22.
25. Применение по меньшей мере одного соединения по любому из пп.1-18 для получения фибринового клея по п.23.
Текст
Изобретение относится к ингибиторам трипсинобразной серинпротеазы общей формулы (I),которые наряду с плазмином также ингибируют калликреин плазмы, а также к их получению и применению в качестве лекарственного средства, предпочтительно для лечения кровопотери, в особенности в случае гиперфибринолитических состояний, в случае трансплантаций органов или хирургических вмешательств на сердце, прежде всего с экстракорпоральным кровообращением,или в качестве компонента фибринового клея. Изобретение относится к ингибиторам трипсинподобной серинпротеазы общей формулы которые наряду с плазмином также ингибируют калликреин плазмы, а также к их получению и применению в качестве лекарственного средства, предпочтительно для лечения кровопотери, в особенности в случае гиперфибринолитических состояний, в случае трансплантаций органов или хирургических вмешательств на сердце, прежде всего с экстракорпоральным кровообращением, или в качестве компонента фибринового клея. Ингибиторы плазмина и калликреина плазмы (PK) уже известны. Плазмин представляет собой трипсинподобную серинпротеазу и расщепляет многочисленные C-концевые субстраты основных аминокислот аргинина или лизина. Плазмин образуется из плазминогена зимогена путем каталитического воздействия плазминогенного активатора урокиназы или тканевого плазминогенного активатора (tPA). К субстратам плазмина относятся различные белки внеклеточного матрикса и базальной мембраны, например, фибронектин, ламинин, коллаген типа IV или фибрин, однако также многочисленные зимогены,как проформы матриксных металлопротеаз или плазминогенного активатора урокиназы. В крови плазмин является ответственным прежде всего за фибринолиз тем, что он расщепляет фибрин с образованием растворимых продуктов. К эндогенным ингибиторам плазмина относятся 2-макроглобулин и серпин, 2-антиплазмин. При определенных патологических условиях можно приходить к спонтанной активации фибринолиза. В случае такого рода гиперплазминемии разрушается не только закрывающий рану фибрин, но и также образуются ингибирующие свертывание продукты разрушения фибриногена. Благодаря этому могут возникать тяжелые нарушения остановки кровотечения. В качестве антифибринолитических средств в клинике используют синтетические аминокарбоновые кислоты,как-аминокапроновая кислота,п-аминометилбензойная кислота или транексаминокислота (транс-4-аминометилциклогексанкарбоновая кислота). Эти соединения блокируют связывание плазминогена зимогена с фибрином и благодаря этому подавляют его активацию до плазмина. Поэтому эти соединения не являются никакими прямыми ингибиторами плазмина и не могут ингибировать уже образовавшийся плазмин. В качестве другого антифибринолитического средства используют апротинин (Trasylol, Bayer A.G., Leverkusen), полипептид из 58 аминокислот, который получают из легкого крупного рогатого скота. Апротинин ингибирует плазмин с константой ингибирования 1 нМ, однако является относительно неспецифическим и ингибирует также активный трипсин (Ki=0,1 нМ) и калликреин плазмы (Ki=30 нМ). Апротинин ингибирует еще другие ферменты, однако с пониженной эффективностью. Основное применение апротинина служит уменьшению кровопотери, в особенности в случае хирургических вмешательств на сердце с экстракорпоральным кровообращением (СРВ), благодаря чему отчетливо снижается потребность в периоперативных переливаниях крови (Sodha et al., 2006). Дополнительно апротинин также используют в случае других операций, например в случае трансплантаций органов, для ингибирования кровопотери, или применяют в качестве добавки в фибриновый клей. Применение апротинина имеет некоторые недостатки. Так как его выделяют из органов крупного рогатого скота, в принципе, существует опасность патогенных бактериальных загрязнений и аллергических реакций. Риск анафилактического шока в случае первого введения апротинина является относительно незначительным (0,1%), однако при неоднократном введении в течение 200 суток повышается до 4-5%. Вкратце, сообщалось, что введение апротинина, при непосредственном сравнении с-аминокапроновой кислотой или транексаминокислотой, индуцирует повышенное количество побочных действий (Mangano et al., 2006). За счет введения апротинина приходят к удвоению количества повреждений почек, благодаря чему требуется диализ. За счет введения апротинина также повышается риск инфаркта сердца и инсульта по сравнению с контрольными группами. До сих пор известны лишь немногие синтетические ингибиторы плазмина. Авторами Sanders и Seto(1999) описываются относительно слабоэффективные производные 4-гетероциклогексанона с константами ингибирования 50 мкМ в отношении плазмина. Авторы Xue и Seto (2005) сообщают о пептидных циклогексаноновых производных со значениями IC502 мкМ, дальнейшая разработка в отношении получения которых, однако, неизвестна. Авторами Okada и Tsuda описываются различные производные с 4-аминометилциклогексаноильным остатком, которые ингибируют плазмин со значениями IC500,l мкМ,причем клиническое применение этих ингибиторов неизвестно (Okada et al., 2000; Tsuda et al., 2001). В многочисленных публикациях в отношении получения ингибиторов протеаз свертывания в качестве антитромботических средств сообщаются константы ингибирования для плазмина, причем в этих случаях целью являлось по возможности слабое ингибирование плазмина. Ни в одной из этих работ не указано возможное применение этих соединений для уменьшения кровопотери в случае хирургических вмешательств на сердце. Так, например, тромбиновый ингибитор мелагатран ингибирует плазмин со значением Ki, составляющим 0,7 мкМ, в то время как структурно близкородственные соединения Н 317/86 обладают константой ингибирования 0,22 мкМ в отношении плазмина (Gustafsson et al., 1998). Оба соединения, однако, ингибируют тромбин протеазы отчетливо сильнее со значениями Ki, составляющими 2 нМ, благодаря чему за счет введения мелагатрана приходят к сильному ингибированию свертывания. Как описывается в начале контекста, апротинин наряду с плазмином дополнительно ингибирует калликреин плазмы (PK). PK представляет собой многофункциональную трипсинобразную серинпротеазу, для которой известны различные физиологические субстраты. Так, PK путем протеолитического расщепления может высвобождать вазоактивный пептид брадикинин из высокомолекулярного кининогена и активировать зимогеновый фактор свертывания XII, про-урокиназу, плазминоген и про-MMP 3. Поэтому предполагают, что система PK/кинин играет важную роль в различных видах заболеваний, так, например, в случае тромбоэмболических ситуаций, диссеминированного внутрисосудистого свертывания, септического шока, аллергий, синдрома после гастрэктомии, артрита или респираторного дистресссиндрома у взрослых (ARDS) (Tada P.K., 2001). Вследствие этого апротинин за счет своего ингибирующего воздействия на PK ингибирует высвобождение пептидного гормона брадикинина. Брадикинин за счет активации брадикинин-В 2-рецептора вызывает различные эффекты. За счет индуцируемого брадикинином высвобождения tPA, NO и простациклина из эндотелиальных клеток (см. обзорную работу Schmaier, 2002) оказывается влияние на фибринолиз, кровяное давление и воспалительные явления. Обсуждается, что за счет ингибирования высвобождения брадикинина уменьшаются системные воспалительные процессы, которые могут возникать как побочное действие при операциях. В качестве ингибиторов PK описываются различные бисбензамидины, как пентамидин и родственные соединения, а также эфиры -амино- и -гуанидиноалкилкарбоновых кислот с микромолярными значениями Ki (Asghar et al., 1976; Muramatu и Fuji, 1971; Muramatu и Fuji, 1972; Ohno et al., 1980;Muramatu et al., 1982; Satoh et al., 1985; Teno et al., 1991). Первые селективные конкурентные ингибиторы, которые производятся от аргинина, соответственно фенилаланина, получены Okamoto et al. (1988) и ингибируют PK со значениями Ki, составляющими около 1 мкМ. Авторами Okada et al. опубликовано несколько работ в отношении получения конкурентных ингибиторов PK, причем самые эффективные соединения, которые производятся от транс-4 аминометилциклогексанкарбонил-Phe-4-карбоксиметиланилида, обладают константами ингибирования около 0,5 мкМ (Okada et al., 1999; Okada et al., 2000; Tsuda et al., 2001). Все вместе указанные ингибиторыPK имеют присущее им относительно высокое значение Ki. В патенте США 6472393 описываются сильные ингибиторы PK с константами ингибирования около 1 нМ, которые обладают 4-амидиноанилином в качестве остатка P1. Ингибиторы PK также описываются в патенте США 5602253. В патенте США 2006/0148901 описываются ингибиторы PK, ингибирующее воздействие которых на плазмин, однако,является относительно незначительным, благодаря чему эти ингибиторы отличаются от ингибиторов,которые описываются в настоящем патенте. Поэтому в основу изобретения положена задача получения пригодных для терапевтических применений низкомолекулярных биологически активных веществ, которые обратимо и конкурентно с высокой активностью и специфичностью ингибируют, в особенности плазмин и калликреин плазмы и поэтому пригодны для остановки кровотечения при различных применениях, например в случае хирургических вмешательств на сердце с СРВ, в случае трансплантаций органов или других операций. Дальнейшее преимущество этих соединений состоит в том, что благодаря их воздействию в качестве ингибитора калликреина плазмы дополнительно уменьшается высвобождение кинина и благодаря этому могут подавляться опосредуемые кинином воспалительные реакции. За счет ингибированного высвобождения кинина, с другой стороны, подавляется индуцируемое кинином высвобождение tPA из эндотелиальных клеток,благодаря чему через этот механизм можно регулировать в сторону уменьшения фибринолиз. Следующим преимуществом этих соединений является, несмотря на селективность, известное ингибирующее воздействие этих соединений на FXa и/или тромбин, благодаря чему дополнительно должны уменьшаться тромботические осложнения при использовании этих соединений. В настоящее время неожиданно найдено, что за счет комбинации двух стерически претенциозных и/или гидрофобных остатков R2 и R3 согласно формуле (I), предпочтительно замещенных или незамещенных ароматических соединений, можно получать ингибиторы с высокими константами ингибирования в отношении плазмина и калликреина плазмы. Сравнимо хороших эффектов можно достигать также при использовании веществ, которые содержат в случае R2 неароматические и в случае R3 основно замещенные фенильные остатки. Объектом настоящего изобретения поэтому являются соединения общей формулы (I) где R1 при необходимости может присутствовать однократно или многократно и, независимо друг от друга, означать остаток COOR5, где R5 означает атом водорода или разветвленную или линейную низшую алкильную группу с 1-6 атомами углерода, предпочтительно метил или этил, в особенности метил,разветвленный или линейный аминоалкильный остаток с 1-6 атомами углерода, предпочтительно метил,галоген или псевдогалогеновый остаток, предпочтительно хлор или цианогруппу, или полиэтиленгликолевый остаток формулы (II) или (III): причем n, как правило, имеет такое значение, что указанные полиэтиленгликолевые остатки обладают средней молекулярной массой 10000, 5000, 3400, 2000, 1000 или 750 Да; обычно n означает целое число от 18 до 250, в особенности 18, 25, 50, 85, 125 или 250;R2 означает необязательно замещенный, ароматический или неароматический цикл или бицикл с 5-13 атомами углерода или ароматический гетероцикл с 4-5 атомами углерода и одним атомом азота,оксидом азота, атомом кислорода или атомом серы, прежде всего с одним атомом азота или оксидом азота; или остаток структуры:R3 означает необязательно замещенный ароматический цикл с 5-6 атомами углерода или ароматический гетероцикл с 3-5 атомами углерода и 1-2 атомами азота, одним оксидом азота, атомом кислорода или атомом серы, прежде всего с одним атомом азота или оксидом азота;R4 означает однократно или многократно имеющийся галоген, предпочтительно фтор;i=0 или 1, в особенности 0; а также их рацемические смеси и соли с органическими или неорганическими кислотами. Экспериментальные результаты показали, что ингибирование плазмина и калликреина плазмы является особенно хорошим в случае соединений с циклическими структурами в случае R2 и R3 и, в особенности, с ароматическим углеродным циклом в случае R2 и R3. Далее, показано, что путем пригодного выбора заместителей в случае соединений с ароматическим углеродным циклом в случае R2 и R3 можно дополнительно достигать хорошего ингибирования фактора Xa и/или тромбина. Экспериментальные результаты также показали, что отчетливое уменьшение ингибирования тромбина достигается тогда, когда R1 представляет собой группу 3-COOH. Согласно предпочтительному варианту осуществления, поэтому R1 имеется однократно и находится в мета- или пара-положении, предпочтительно R1 означает остаток COOH, в особенности R1 имеется однократно и его выбирают из атома водорода, группы 4-ингибирования тромбина можно достигать благодаря тому, что R4 представляет собой атом фтора, в особенности в орто-положении. Дальнейший предпочтительный вариант осуществления настоящего изобретения относится к соединениям, в случае которых R2 означает замещенный или незамещенный ароматический цикл или бицикл с 6-10 атомами углерода или гетероцикл с 5 атомами углерода и одним атомом азота. Замещение в случае R2 может представлять собой, в общем, галоген, предпочтительно хлор или фтор, в особенности хлор, необязательно замещенную фтором, разветвленную или линейную алкильную группу с 1-6 атомами углерода, предпочтительно метил или третичный бутил, возможно замещенную фтором, разветвленную или линейную алкилоксигруппу с 1-6 атомами углерода, предпочтительно метил,гидроксильную группу или цианогруппу. Согласно альтернативному варианту осуществления также R2 может представлять собой неароматический цикл с 6 атомами углерода. В качестве особенно пригодных соединений оказываются соединения формулы (I), в которых замещение в случае R3 представляет собой ароматический углеводород с основным остатком, в особенности алкиламиногруппу с 1-3 атомами углерода, предпочтительно с 1 атомом углерода или амидиногруппу. Прежде всего, в качестве особенно пригодного оказывается соединение формулы (I), где i=0 и отсутствует R4, со следующими остатками: Соли предлагаемых согласно изобретению соединений получают, в общем, при использовании соляной кислоты, HBr, уксусной кислоты, трифторуксусной кислоты, толуолсульфокислоты или других пригодных кислот. В частности, пригодны соединения, в случае которых R2 выбирают из следующих остатков:. в особенности Примерами такого рода соединений являются соединения формулы (I), которые определяются следующим образом: Также оказывается, что соединения общей формулы (IV) которая соответствует общей формуле (I),где R1 при необходимости может присутствовать однократно или многократно и, независимо друг от друга, означать остаток COOR5, где R5 означает атом водорода или разветвленную или линейную низшую алкильную группу с 1-6 атомами углерода, предпочтительно метил или этил, в особенности метил, разветвленный или линейный аминоалкильный остаток с 1-6 атомами углерода, предпочтительно метил, галоген или псевдогалогеновый остаток, предпочтительно хлор или цианогруппу, или полиэтиленгликолевый остаток формулы (V) или (VI): причем n имеет такое значение, что полиэтиленгликолевая цепь имеет среднюю молекулярную массу 10000, 5000, 3400, 2000, 1000 или 750 Да; предпочтительно n означает целое число от 18 до 250, в особенности 18, приблизительно 25, 50, 85, 125 или 250;R2 означает разветвленную или линейную алкилоксигруппу с 1-6 атомами углерода, предпочтительно третичный бутил, гидроксильную группу, аминогруппу или разветвленную или линейную алкилоксикарбониламидогруппу с 1-6 атомами углерода, предпочтительно третичный бутил, или полиэтиленгликолевый остаток формулы (V) или (VI), где n имеет вышеуказанное значение;R3 выбирают из следующих остатков:R4 означает однократно или многократно имеющийся галоген, предпочтительно фтор;i=0 или 1, в особенности 0; а также их рацемические смеси и соли с органическими или неорганическими кислотами также пригодны согласно настоящему изобретению. Также в этом случае предпочтительны соединения, в которых R1 имеется однократно и находится в мета- или пара-положении, предпочтительно R1 означает атом водорода или группу COOH, в особенности R1 имеется однократно и его выбирают из атома водорода, группы 4-COOH или группы 3-COOH. Соли этих соединений получают, в общем, снова при использовании соляной кислоты, HBr, уксусной кислоты, трифторуксусной кислоты, толуолсульфокислоты или других пригодных кислот. Примерами такого рода соединений являются соединения формулы (IV), где i=0 и отсутствует остаток R4, которые определяются следующим образом: Соединения общей формулы (I), в принципе, можно получать известным образом, например, как описывается ниже, причем, в общем, последовательно соответствующие аминокислоты присоединяют к защищенному по амидиногруппе амидинобензиламину. При этом N-терминальная аминокислота либо уже содержит P4-остаток, либо его затем связывают с ней. Номенклатура отдельных составных частей P1, P2, P3 и P4 предлагаемых согласно изобретению соединений приводится ниже (см. также Schechter и Berger, 1967). Например, из коммерчески доступного 4-цианобензиламина (Showa Denko K.K., Япония) по известным специалисту способам получают защищенный, предпочтительно Boc-защищенный, и защищенный по амидиногруппе амидинобензиламин, в особенности 4-ацетилоксамидинобензиламин. После отщепления защитной группы осуществляют присоединение других аминокислот и P4-остатка посредством стандартных способов присоединения и при использовании защитных групп, предпочтительно при использовании Boc в качестве N-концевой защитной группы. P3-Аминокислоту также можно присоединять непосредственно в виде защищенной, предпочтительно бензилсульфонилзащищенной, аминокислоты, которая уже содержит остаток R1. Пептидные аналоги синтезируют последовательно, начиная с ацетилоксамидинобензиламина. В большинстве случаев промежуточные продукты хорошо кристаллизуются и тем самым их можно просто очищать. Конечную очистку ингибиторов осуществляют на последней стадии, предпочтительно путем препаративной высокоэффективной жидкостной хроматографии(ВЭЖХ) с обращенными фазами. Другим объектом изобретения поэтому является способ получения предлагаемого согласно изобретению соединения, причем соответствующие аминокислоты последовательно присоединяют к защищенному по амидиногруппе амидинобензиламину, например к 4-ацетилоксамидинобензиламину или к 4-(бензилоксикарбониламидино)бензиламину, причем N-концевая аминокислота либо уже содержитP4-остаток, либо его затем связывают с ней. После возможной очистки полученные соединения, в случае необходимости, можно подвергать пэгилированию. Примерный способ получения предлагаемых согласно изобретению соединений включает следующие стадии:(a) амидирование соответствующей N-защищенной аминокислоты с остатком R3 с помощью соответствующего защищенного аминометилбензамидина;(b) после отщепления N-защитной группы от аминокислоты с остатком R3 введение во взаимодействие полученного продукта с соответствующей бензилсульфониламинокислотой с остатками R1 и R2 и отщепление остаточных защитных групп для получения предлагаемого согласно изобретению соединения и после возможной очистки;(с) в случае необходимости полученное соединение пэгилируют. Дальнейшие, общеизвестные специалисту подробности в отношении способа, например в отношении выбираемых защитных групп или пэгилирования, можно узнать из примеров. Предпочтительной защитной группой амидного азота является, например, трет-бутилоксикарбонил (Boc). Исходными соединениями являются, например, аминокислотные производные, соответственно ПЭГ-производные. Химикалии, в общем, являются коммерчески доступными. Пэгилирование, т.е. дериватизацию с помощью полиэтиленгликоля, осуществляют, в общем, либо через P3-аминокислоту, либо черезP4-бензилсульфонильный остаток при использовании активированных ПЭГ-производных, например с помощью активированного в виде N-гидроксисукцинимидного сложного эфира ПЭГ. Полезным свойством связанных с ПЭГ соединений является удлинение периода полураспада ингибиторов в системе кровообращения. Следующая структура представляет собой пример, в случае которого ПЭГ-цепь связана через P3-аминокислоту (D-Lys): При использовании сукцинильного связывающего агента получают следующее соединение: Дополнительно ПЭГ-цепь присоединяют через пригодный P4-бензилсульфонильный остаток соответственно нижепредставленной общей формуле, причем P4-остаток модифицирован с помощью аминометильной группы в пара- или орто-положении. При использовании сукцинильного связывающего агента получают следующее соединение: Специалисту, однако, также известны другие способы получения, которые можно осуществлять равным образом. Пэгилированные соединения, в общем, представляют собой смеси соединений с различной степенью пэгилирования, причем молекулярная масса ПЭГ-остатков обычно находится в области 750, 1000, 2000, 3400, 5000 или 10000 Да. Однако коммерчески доступны также дискретные полиэтиленгликоли с определенной молекулярной массой. Настоящее изобретение также относится к лекарственному средству, содержащему по меньшей мере одно из предлагаемых согласно изобретению соединений, предпочтительно для лечения кровопотери,в особенности, в случае гиперфибринолитических состояний, в случае трансплантаций органов или хирургических вмешательств на сердце, прежде всего, с экстракорпоральным кровообращением. Настоящее изобретение относится также к фибриновому клею, который содержит по меньшей мере одно из предлагаемых согласно изобретению соединений, в случае которого апротинин заменяется пригодным ингибитором согласно настоящему изобретению. Под фибриновым клеем понимают, в общем, физиологический двухкомпонентный клей, который содержит в качестве первого компонента фибриноген, фактор XIII и апротинин соответственно, по меньшей мере одно из предлагаемых согласно изобретению соединений и в качестве второго компонента тромбин и хлорид кальция для активации фактора XIII. Настоящее изобретение относится также к применению по меньшей мере одного, предлагаемого согласно изобретению соединения для получения лекарственного средства согласно изобретению или фибринового клея согласно изобретению по общеизвестным специалисту способам, например путем смешения с пригодными вспомогательными веществами или добавками. Настоящее изобретение относится также к следующим объектам: соединения общей формулыA выбирают из следующих структур: причем A предпочтительно означает фенильный остаток;R1 означает H, COOH, COOR5 (где R5 = метил или этил), аминометил, галоген, псевдогалоген, предпочтительно, однако, H и COOH и особенно предпочтительно COOH, так как карбоксильная группа уд- 10018998 линяет время полураспада ингибиторов в системе кровообращения;R2 означает разветвленный или неразветвленный алкил с 3-12 атомами углерода, также циклоалкилзамещенный, арил или аралкил с 6-14 атомами углерода, гетероарил или находится в виде гетероарилалкила с 6-12 атомами углерода и 1-3 гетероатомами, далее,R6 означает галоген или псевдогалоген с p=0, 1, 2, а также их рацематы, кристаллические формы и гидраты и соли с органическими и неорганическими кислотами; соединения нижеприводимой формулы, в которой отдельные позиции обозначены как P4-P1: где обозначения R1, R2, R3, R4, A и i соответствуют вышеуказанным определениям; В соответствует ПЭГ-цепи, которая на конце находится в виде простого метилового эфира;Y означает пригодный связывающий агент для присоединения ПЭГ к P3-аминокислоте, например пропионильный остаток; иX означает либо NH-группу, либо NH-алкильную группу, либо NH-арильную группу. Присоединение осуществляется само по себе известным образом. Предлагаемые согласно изобретению соединения обладают, например, ПЭГ-цепью, которая имеет среднюю молекулярную массу 750, 1000, 2000, 5000, 10000, 20000 Да или представляет собой дискретную ПЭГ-цепь. Применение предлагаемых согласно изобретению соединений для получения лекарственного средства, которое пригодно для уменьшения кровопотери в случае гиперфибринолитических состояний, и применению предлагаемых согласно изобретению соединений в качестве средств для получения фибри- 11018998 нового клея. Нижеприводимые примеры должны подробнее пояснить изобретение, не ограничивая его объема охраны. Примеры 1. Способы анализа. 1.1. Аналитическая высокоэффективная жидкостная хроматография (ВЭЖХ). Для аналитической ВЭЖХ с обращенными фазами использовали ВЭЖХ-установку LC-10A фирмыShimadzu, состоящую из отдельных систем: термостата колонок CTO-10AS, насосов LC-10AD (два), дегазатора DGU-14A, устройства для автоматического ввода проб SIL-10AD, системного контроллераSCL-10A, детектора SPD-10A UV-Vis и колонки Luna 5 мкм C18 (2) 100, 2504,6 мм фирмы Phenomenex, при использовании относящегося к этому программного обеспечения Shimadzu CLASS-VP, версия 5.3. Детектирование осуществляли при длине волны 220 нм. В качестве элюирующих средств служили вода с 0,1% ТФУК (А) и ацетонитрил с 0,1% ТФУК (В) при объемной скорости потока 1 мл/мин и при использовании линейного градиента (1% В/мин). В зависимости от соединения использовали различные начальные условия для аналитической ВЭЖХ, которые указаны в случае соответствующих соединений. Для анализа всех модифицированных полиэтиленгликолем биологически активных веществ использовали колонку Jupiter 5 мкм C18 (2) 300, 2504,6 мм фирмы Phenomenex. 1.2. Препаративная ВЭЖХ. Для препаративной ВЭЖХ с обращенными фазами использовали ВЭЖХ-установку фирмыShimadzu, состоящую из отдельных систем: препаративных насосов LC-8A (два), дегазатора DGU-14A,коллектора фракций FRC-10A, системного контроллера SCL-10A, детектора SPD-10A UV-Vis и колонкиLuna 5 мкм С 8 (2) 100, 25030,0 мм фирмы Phenomenex, при использовании относящегося к этому программного обеспечения Shimadzu CLASS-VP, версия 5.3. Детектирование осуществляли при длине волны 220 нм. В качестве элюирующих средств также служили вода с 0,1% трифторуксусной кислоты(ТФУК) (А) и ацетонитрил с 0,1% ТФУК (В) при объемной скорости потока 10 и 20 мл/мин и при использовании пригодного градиента. 1.3. Масс-спектрометрия. Масс-спектры снимали обычным образом при использовании ESI-MS (масс-спектрометр с ионизацией электронным распылением) LCQ фирмы Finnigan (Бремен, Германия). Все связанные с полиэтиленгликолем соединения анализировали на приборе Maldi Ultraflex Tof/Tof фирмы Bruker. Используемые сокращения.HPLC - высокоэффективная жидкостная хроматография (ВЭЖХ); 5 г (17,2 ммоль) Boc-Phe(3-CN)-ОН (Acros Organics) растворяют в 700 мл 90%-ной уксусной кислоты и гидрируют при температуре 40C в течение 3 ч при нормальном давлении с помощью водорода и при использовании 800 мг 10% Pd/C в качестве катализатора. Растворитель удаляют в вакууме, остаток растворяют в небольшом количестве метанола и осаждают путем добавления диэтилового эфира. Выход: 4,1 г (ВЭЖХ: 16,7 мин, начало при 10% В).(29,9 ммоль) DIEA и 2 мл (16,78 ммоль) этилового эфира трифторуксусной кислоты при комнатной температуре. Смесь перемешивают, спустя приблизительно 15 мин первоначальная суспензия полностью превращается в раствор. Спустя 1 ч растворитель удаляют в вакууме и остаток растворяют в этилацетате и воде. Этилацетатную фазу промывают 2 раза с помощью 5%-ного раствора KHSO4 и 3 раза с помощью насыщенного раствора NaCl и органическую фазу сушат над Na2SO4. Растворитель удаляют в вакууме. Выход: 4,9 г аморфного твердого вещества (ВЭЖХ: 28,13 мин, начало при 20% В). с) Boc-Phe(3-Tfa-Ame)-4-(ацетилгидроксиамидино)бензиламид. 5,43 г (13,9 ммоль) Boc-Phe(3-Tfa-Ame)-ОН и 4,28 г (15,3 ммоль) 4-(ацетилгидроксиамидино)бензиламина (синтез описывается в дополнение к Schweinitz et al., 2004) растворяют в 50 мл ДМФА и при температуре 0C смешивают с 5,2 мл (30 ммоль) DIEA и 5,81 г (15,3 ммоль) HBTU. Смесь перемешивают в течение 15 мин при температуре 0C и в течение следующих 3 ч при комнатной температуре. Растворитель удаляют в вакууме и остаток растворяют в этилацетате. Этилацетатную фазу промывают 3 раза с помощью 5%-ного раствора KHSO4, 1 раз с помощью насыщенного раствора NaCl, 3 раза с помощью насыщенного раствора NaHCO3 и 2 раза с помощью насыщенного раствора NaCl. Осадившийся между фазами продукт отфильтровывают под вакуумом и высушивают в вакууме. Выход: 4,17 г кристаллов белого цвета (ВЭЖХ: 28,08 мин, начало при 20% В). 4,1 г Boc-Phe(3-Tfa-Ame)-4-(ацетилгидроксиамидино)бензиламида суспендируют в 60 мл безводного диоксана и смешивают с 11 мл 4 н. раствора HCl в диоксане. После кратковременной обработки ультразвуком смесь встряхивают в течение 1 ч при комнатной температуре. Спустя 1 ч продукт осаждают путем добавления диэтилового эфира, отфильтровывают под вакуумом и высушивают в вакууме. Выход: 3,8 г твердого вещества белого цвета (ВЭЖХ: 9,47 мин, начало при 20% В). е) 3-MeOOC-Bzl-SO3-Na+. 5 г (21,8 ммоль) метилового эфира 3-бромметилбензойной кислоты (Acros Organics) суспендируют в 25 мл воды и смешивают с 2,94 г (23,8 ммоль) Na2SO3. Смесь кипятят с обратным холодильником в течение 5 ч и после этого растворитель частично удаляют в вакууме вплоть до начинающейся кристаллизации. Смесь выдерживают в течение ночи при температуре 4C и продукт отфильтровывают. Выход: 3,7 г кристаллов белого цвета (ВЭЖХ: 12,02, начало при 10% В). 2,5 г (9,91 ммоль) 3-MeOOC-Bzl-SO3-Na+ смачивают с помощью фосфорилхлорида и смешивают с 2,27 г (10,9 ммоль) PCl5. Смесь приблизительно в течение 5 мин охлаждают при температуре 0C и после этого нагревают на масляной бане в течение 4 ч (температура бани 80C). Затем смесь выливают на лед и интенсивно перемешивают. После перемешивания в течение приблизительно 30 мин начинает осаждаться хлорангидрид кислоты, его отфильтровывают под вакуумом и высушивают в вакууме. Выход: 1,4 г твердого вещества белого цвета. 1,3 г (6,72 ммоль) H-d-Ppg-OH (Peptech, Burlington, MA) суспендируют в 90 мл безводного дихлорметана и смешивают с 2 мл (15,7 ммоль) TMS-Cl и 2,6 мл (15 ммоль) DIEA. Смесь кипятят с обратным холодильником в течение 1 ч, прозрачный раствор охлаждают до температуры 0C и смешивают с 2 г(8 ммоль) 3-MeOOC-Bzls-Cl и 2,6 мл DIEA. Смесь перемешивают в течение 15 мин при температуре 0C и в течение 1,5 ч при комнатной температуре. Растворитель удаляют в вакууме и остаток растворяют в 700 мл полунасыщенного раствора NaHCO3. Смесь экстрагируют 2 раза небольшим количеством этилацетата и затем водную фазу подкисляют с помощью HCl (значение рН составляет приблизительно 2-3). Смесь экстрагируют 3 раза с помощью 150 мл этилацетата и объединенные этилацетатные фазы промывают 2 раза с помощью 5%-ного раствора KHSO4 и 1 раз с помощью насыщенного раствора NaCl. Органическую фазу сушат над Na2SO4 и растворитель удаляют в вакууме. Выход: 2,4 г масла (ВЭЖХ: 33,53 мин, начало при 20% В). 0,605 г (1,5 ммоль) 3-МеООС-Bzls-d-Ppg-OH и 0,85 г (1,65 ммоль) H-Phe(3-Tfa-Ame)-4(ацетилгидроксиамидино)бензиламидаHCl растворяют в 40 мл безводного ДМФА и при температуре 0C смешивают с 0,63 г (1,65 ммоль) HBTU и 0,6 мл (0,34 ммоль) DIEA. Смесь перемешивают в течение 15 мин при температуре 0C и в течение следующих 3 ч при комнатной температуре. Растворитель удаляют в вакууме и остаток растворяют в этилацетате. Этилацетатную фазу промывают 3 раза с помощью 5%-ного раствора KHSO4, 1 раз с помощью насыщенного раствора NaCl, 3 раза с помощью насыщенного раствора NaHCO3 и 2 раза с помощью насыщенного раствора NaCl. Растворитель удаляют в вакууме. Выход: 1,36 г масла (ВЭЖХ: 38,40 мин, начало при 20% В). 1,3 г 3-МеООС-Bzls-d-Ppg-Phe(3-Tfa-Ame)-4-(ацетилгидроксиамидино)бензиламида растворяют в 100 мл 90%-ной уксусной кислоты и гидрируют в течение ночи при нормальном давлении с помощью водорода и при использовании 150 мл 10% Pd/C в качестве катализатора. Катализатор отфильтровывают и фильтрат концентрируют в вакууме. Выход: 1,2 г масла (ВЭЖХ: 29,45 мин, начало при 20% В). 2.2. 3-HOOC-Bzls-d-Ppg-Phe(3-Ame)-4-амидинобензиламид 2 ацетат (3). 1,2 г 3-MeOOC-Bzls-d-Ppg-Phe(3-Tfa-Ame)-4-амидинобензиламидацетата перемешивают в течение 1,5 ч в смеси из 10 мл диоксана и 10 мл 1 н. раствора LiOH. Затем смесь нейтрализуют путем добавления ТФУК и продукт очищают препаративной ВЭЖХ с обращенными фазами. Содержащие продукт фракции объединяют и лиофилизируют. Выход: 0,4 г в виде ТФУК-соли (ВЭЖХ: 24,16 мин, начало при 10% В).MS: рассчитано: 698,29; найдено: 699,3 (М+Н)+. Продукт переводят в ацетат путем препаративной ВЭЖХ за счет элюирования с помощью возрастающих градиентов ацетонитрила, содержащего 0,1% уксусной кислоты. Выход: 0,32 г. Соответственно вышеприведенному описанию синтеза получают дальнейшие ингибиторы, причем вводят различным образом замещенные или незамещенные бензилсульфонильные остатки и различныеd-фенилпропилглицина синтезируют путем связывания по Heck и вводят в P3-позицию ингибиторов. Синтез можно осуществлять, например, следующим образом: 2.3. Bzls-d-Gly(3-Cl-Phpr)-Phe(3-Ame)-4-Amba2 ТФУК (6). 1,0 г (8,68 ммоль) D-аллилглицина (Peptech, Burlingtom, MA) суспендируют в 50 мл безводного дихлорметана и смешивают с 2,4 мл (19 ммоль) TMS-Cl и 3,3 мл (19 ммоль) DIEA. Смесь кипятят с обратным холодильником в течение 1 ч, прозрачный раствор охлаждают до температуры 0C и смешивают с 2,35 г (9,55 ммоль) Bzls-Cl и 1,8 мл DIEA. Смесь перемешивают в течение 15 мин при температуре 0C и в течение 1,5 ч при комнатной температуре. Растворитель удаляют в вакууме и остаток растворяют в 700 мл полунасыщенного раствора NaHCO3. Смесь экстрагируют 2 раза этилацетатом и после этого водную фазу подкисляют с помощью HCl (значение pH составляет приблизительно 2-3). Смесь экстрагируют 3 раза с помощью 150 мл этилацетата и объединенную этилацетатную фазу промывают 2 раза с помощью 5%-ного раствора KHSO4 и 1 раз с помощью насыщенного раствора NaCl. Органическую фазу сушат над Na2SO4 и растворитель удаляют в вакууме. Выход: 2,2 г масла (ВЭЖХ: 21,1 мин, начало при 20% В).(1,34 ммоль) 1-Cl-3-йодбензола и 9 мг (0,04 ммоль) ацетата палладия(II) в смеси из 2,5 мл ДМФА и 2,5 мл воды перемешивают в течение 10 мин при комнатной температуре. К этой суспензии добавляют раствор 0,4 г (1,48 ммоль) Bzls-d-Gly(аллил)-ОН в 2,5 мл ДМФА и 2,5 мл воды и смесь нагревают в течение 4-6 дней при температуре 45-50C, в случае необходимости неоднократно добавляют незначительные количества катализатора. Катализатор отфильтровывают, растворитель удаляют в вакууме и остаток суспендируют в 50 мл 5%-ного раствора KHSO4. Смесь экстрагируют 3 раза с помощью, каждый раз,15-20 мл этилацетата и объединенную этилацетатную фазу промывают 2 раза с помощью 5%-ного раствора KHSO4 и 1 раз с помощью насыщенного раствора NaCl. Органическую фазу сушат над Na2SO4 и растворитель удаляют в вакууме. Остаток (0,55 г, темное масло) очищают флэш-хроматографией на силикагеле 60 (40-63 мкМ) (градиент 0-20% метанола в дихлорметане). Выход: 0,23 г (ВЭЖХ: 39,7 мин, начало при 20% В). Дальнейший синтез ингибитора осуществляют аналогично описанному синтезу ингибитора 1. Промежуточный продукт 2.2.b связывают с промежуточным продуктом 2d (H-Phe(3-Tfa-Ame)-4(ацетилгидроксиамидино)бензиламидHCl) аналогично методике 2h. Гидрирование полученного промежуточного продукта осуществляют аналогично методике 2i, при этом не наблюдают никакого отщепления атома хлора от P3-аминокислоты. На последней стадии осуществляют отщепление трифторацетильной защитной группы с помощью LiOH в диоксане аналогично последней стадии синтеза в случае получения соединения 3. ВЭЖХ: 29,04 мин, начало при 10% В. Аналогично вышеприведенному описанию синтеза 2.2a-i также получают соединение 4, причем вместо 4-(ацетилгидроксиамидино)бензиламида на стадии с) используют п-нитробензиламин. Восстановление нитробензиламиногруппы до п-аминобензиламина осуществляют аналогично стадии 2.2i при использовании смеси метанол/ТГФ (1:1) в качестве растворителя. Гуанилирование паминобензиламиногруппы осуществляют при использовании коммерчески доступного 1,3-ди-Вос-2(трифторметилсульфонил)гуанидина (Fluka) в качестве реагента для гуанилирования. При этом промежуточный продукт, получаемый путем реакции восстановления, растворяют в диоксане и вместе с реагентом для гуанилирования и ТФУК перемешивают в течение одного дня при температуре 50C. После удаления растворителя известным образом с помощью ТФУК отщепляют защитные группы. После удаления растворителя на последней стадии осуществляют отщепление трифторацетильной защитной группы и сложного метилового эфира с помощью LiOH в диоксане, аналогично последней стадии синтеза при получении соединения 3. ВЭЖХ: 25,1 мин, начало при 10% В. 2.5. Пэгилированные соединения. Согласно стандартным способам синтезируют дальнейшие ингибиторы, с которыми ковалентно связываются полиэтиленгликолевые (ПЭГ) цепи различной длины. В случае всех синтезов используют коммерчески доступные ПЭГ-производные фирм Fluka, Nektar Therapeutics или Rapp Polymere с различными средними молекулярными массами (1000, 2000, 5000, 10000 Да). Используемые ПЭГ-производные на одном конце защищены в виде простого метилового эфира и на другом конце модифицированы с помощью активированного в виде N-гидроксисукцинимидного сложного эфира остатка пропионовой кислоты или янтарной кислоты. Благодаря этому эти активированные ПЭГ-производные могут вступать во взаимодействие со свободной аминогруппой ингибитора (см. схемы синтеза 1-5). На последней стадии путем смешения с 1 н. раствором NaOH отщепляют ТФУК-защитную группу и продукты очищают путем ионообменной хроматографии на Fractogel CE (Merk KgaA, Дармштадт) при использовании градиента ацетата аммония и 3 раза лиофилизируют из воды. Согласно нижеприводимым примерам получают ингибиторы с ПЭГ-цепью средней молекулярной массы приблизительно 1000, 2000, 5000 или 10000 Да. Схема 1 Синтезированные согласно примерам соединения, включая их константы ингибирования, представлены в нижеприводимой таблице. 3. Определение констант ингибирования в случае плазмина и PK (значения Ki в нМ) Определение ингибирующего воздействия на отдельные ферменты осуществляли аналогично уже известным способам (Strzbecher et al., 1997). Реакции для определения ингибирования человеческого плазмина и человеческого калликреина плазмы осуществляли при использовании следующей исходной смеси при температуре 25C: 200 мкл TBS (0,05 М трис-гидроксиметиламинометан; 0,154 М NaCl, 2% этанол, pH 8,0; содержит ингибитор); 25 мкл субстрата (2 мМ, 1 мМ и 0,67 мМ тозил-Gly-Pro-Lys-pNA = хромозим PL, фирма LOXO, для плазмина, и 2 мМ, 1 мМ и 0,5 мМ H-D-Pro-Phe-Arg-pNA = S2302, фирма Chromogenix, для PK; растворено в воде); 50 мкл раствора фермента (плазмин, фирма Calbiochem: 2-5 мЕд/мл в 0,154 М NaCl + 0,1% BSA,мас./об., + 25%, об./об., глицерина; калликреин плазмы, фирма Enzyme Research Lab.: 20-60 нг/мл в 0,154 М NaCl + 0,1% BSA, мас./об.). Для кинетики нулевого порядка спустя 20 мин реакцию прекращали путем добавления 25 мкл уксусной кислоты (50% об./об.) и определяли поглощение при длине волны 405 нм при использовании спектрофотометра для прочтения микропланшетов (Multiscan Ascent, фирма Thermo). В случае кинетики псевдопервого порядка регистрировали скорости реакций в состоянии равновесия путем снятия кинетики реакции. Значения Ki определяли или по Dixon (1953) путем линейной регрессии при использовании компьютерной программы, или путем адаптации параметров соответственно уравнению скорости для конкурентного ингибирования. Значения Ki представляют собой среднее по меньшей мере из двух определений. Значения Ki: А означает 10 нМ; В означает 100 нМ; С означает 1000 нМ и D означает 1000 нМ. Результаты. 1. Значение Ki в отношении ингибирования плазмина составляет, в общем, 100 нМ. В особенности,в случае соединений с циклическими структурами у R2 и R3 значение Ki является отчетливо менее чем 100 нМ, и в случае соединений с ароматическим углеродным циклом у R2 и R3 составляет ниже приблизительно 10 нМ. Неожиданно имеется особенно много предлагаемых согласно изобретению соединений со значением Ki ниже 5 нМ, например соединения 1-11, 13, 14, 16-18, 20-33, 35, 38, 39, 46 и 48-56. 2. Значение Ki в отношении ингибирования калликреина плазмы составляет, в общем, 100 нМ. В особенности, в случае соединений с ароматическим углеродным циклом у R2 и R3 значение Ki является отчетливо менее чем 100 нМ. Неожиданно имеется особенно много предлагаемых согласно изобретению соединений со значением Ki ниже 1 нМ, например соединения 1-3, 5, 6, 8-25, 27, 29, 34-36, 39, 40, 4957, 59-61, 64, 65 и 68-70. 3. За счет введения гомотирозина или пиридина и соответствующих N-оксидов в качестве гетероциклов в P3 можно отчетливо снижать селективность в отношении FXa. 4. В общем, отчетливого уменьшения ингибирования тромбина можно достигать, когда R1 представляет собой группу 3-COOH. Дальнейшего уменьшения ингибирования тромбина можно достигать благодаря тому, что R4 представляет собой атом фтора, в особенности в орто-положении. 5. В качестве особенно пригодного соединения оказывается соединение формулы (I), где i означает 0 и отсутствует R4, со следующими остатками: ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I) где R1 присутствует однократно или отсутствует и, если присутствует, означает остаток COOR5, гдеR5 означает атом водорода или полиэтиленгликолевый остаток формулы (II) или (III): где n имеет такое значение, что полиэтиленгликолевые остатки обладают средней молекулярной массой 10000, 5000, 3400, 2000, 1000 или 750 Да;R2 означает необязательно замещенный, ароматический или неароматический цикл или бицикл с 6-10 атомами углерода или ароматический гетероцикл с 4-5 атомами углерода и одним атомом азота или оксидом азота, где замещение в случае R2 представляет собой галоген, необязательно замещенную фтором, разветвленную или линейную алкильную группу с 1-6 атомами углерода, необязательно замещенную фтором, разветвленную или линейную алкоксигруппу с 1-6 атомами углерода, гидроксильную группу или цианогруппу;R3 означает необязательно замещенный ароматический цикл с 6 атомами углерода или ароматический гетероцикл с 3-5 атомами углерода и 1-2 атомами азота, где замещение в случае R3 представляет собой алкиламиногруппу с 1-3 атомами углерода или амидиногруппу;R4 означает галоген, присутствующий от одного до четырех раз;i=0 или 1,а также его рацемические смеси и соли с органическими или неорганическими кислотами. 2. Соединение по п.1, отличающееся тем, чтоn означает целое число между 25 до 250, в частности 18, 25, 50, 85, 125 или 250;i=0. 3. Соединение по п.1 или 2, отличающееся тем, что R1 имеется однократно и находится в мета- или пара-положении, предпочтительно R1 означает группу COOH, в особенности R1 имеется однократно и его выбирают из группы 4-COOH или в особенности группы 3-COOH. 4. Соединение по любому из пп.1-3, отличающееся тем, что R2 означает ароматический цикл или бицикл с 6-10 атомами углерода или гетероцикл с 5 атомами углерода и одним атомом азота. 5. Соединение по любому из пп.1-4, отличающееся тем, что замещение в случае R2 представляет собой хлор или фтор, в особенности хлор или необязательно замещенную фтором метильную или третбутильную группу, необязательно замещенную фтором, разветвленную или линейную метоксигруппу,гидроксильную группу или цианогруппу. 6. Соединение по любому из пп.1-3, отличающееся тем, что R2 означает неароматический цикл с 6 атомами углерода. 7. Соединение по любому из пп.1-6, отличающееся тем, что замещение в случае R3 представляет собой алкиламинную группу, имеющую 1 атом углерода, или амидиногруппу. 8. Соединение по любому из пп.1-7, отличающееся тем, что замещение в случае R3 представляет собой алкиламиногруппу с 1 атомом углерода. 9. Соединение по любому из пп.1-8, отличающееся тем, что соединение представляет собой соль соляной кислоты, HBr, уксусной кислоты, трифторуксусной кислоты или толуолсульфокислоты. 10. Соединение по любому из пп.1-9, отличающееся тем, что R2 выбирают из следующих остатков:. 11. Соединение по любому из пп.1-10, отличающееся тем, что R3 выбирают из:. в особенности 12. Соединение по любому из пп.1-11, отличающееся тем, что соединение выбирают из следующих: 13. Соединение общей формулы (IV) где R1 присутствует однократно или отсутствует и, если присутствует, означает остаток COOR5, гдеR5 означает атом водорода или разветвленную или линейную низшую алкильную группу с 1-6 атомами углерода или полиэтиленгликолевый остаток формулы (V) или (VI): где n имеет такое значение, что полиэтиленгликолевая цепь имеет среднюю молекулярную массу 10000, 5000, 3400, 2000, 1000 или 750 Да;R2 означает разветвленную или линейную алкилоксигруппу с 1-6 атомами углерода, гидроксильную группу, аминогруппу или разветвленную или линейную алкилоксикарбониламидогруппу с 1-6 атомами углерода или полиэтиленгликолевый остаток формулы (V) или (VI), где n имеет вышеуказанное значение;R3 выбирают из следующих остатков:i=0; а также его рацемические смеси и соли с органическими или неорганическими кислотами. 14. Соединение по п.13, отличающееся тем, чтоR5 означает метил или этил, в особенности метил;n означает целое число между 25 до 250, в частности 18, 25, 50, 85, 125 или 250;i=0. 15. Соединение по любому из пп.13 или 14, отличающееся тем, что R1 имеется однократно и находится в мета- или пара-положении, предпочтительно R1 означает группу COOH, в особенности R1 имеется однократно и его выбирают из группы 4-COOH или группы 3-COOH. 16. Соединение по любому из пп.13-15, отличающееся тем, что соединение представляет собой соль соляной кислоты, HBr, уксусной кислоты, трифторуксусной кислоты или толуолсульфокислоты. 17. Соединение по любому из пп.13-16, отличающееся тем, что соединение выбирают из следующих: и его рацемические смеси и соли с органическими или неорганическими кислотами, в частности соли соляной кислоты, HBr, уксусной кислоты, трифторуксусной кислоты или толуолсульфокислоты. 19. Способ получения соединения по любому из пп.1-18, отличающийся тем, что соответствующие аминокислоты последовательно присоединяют к защищенному по амидиногруппе амидинобензиламину,причем N-терминальная аминокислота либо уже содержит P4-остаток, либо его затем связывают с ней, и затем полученные соединения в случае необходимости очищают и в случае необходимости пэгилируют. 20. Способ получения соединения по любому из пп.1-18, включающий следующие стадии:(a) амидирование соответствующей N-защищенной аминокислоты с остатком R3 с помощью соответствующего защищенного аминометилбензамидина;(b) отщепление N-защитной группы от аминокислоты с остатком R3 и введение во взаимодействие полученного продукта с соответствующей бензилсульфониламинокислотой с остатками R1 и R2 и отщепление остаточных защитных групп для получения соединения формулы (I) и после возможной очистки;(c) в случае необходимости пэгилирование полученного соединения. 21. Лекарственное средство для лечения кровопотери, содержащее по меньшей мере одно соединение по любому из пп.1-18. 22. Лекарственное средство по п.21 для лечения кровопотери, возникающей в результате гиперфибринолитических состояний, в случае трансплантаций органов или хирургических вмешательств на сердце, прежде всего с экстракорпоральным кровообращением. 23. Фибриновый клей, содержащий одно соединение по любому из пп.1-18 в качестве первого компонента и тромбин в качестве второго компонента и хлорид кальция для активации фактора XIII, а также подходящие эксципиенты или добавки. 24. Применение по меньшей мере одного соединения по любому из пп.1-18 для получения лекарственного средства по п.21 или 22. 25. Применение по меньшей мере одного соединения по любому из пп.1-18 для получения фибринового клея по п.23.
МПК / Метки
МПК: C07D 213/56, A61K 31/18, C07C 311/33, C07D 213/89, C07D 233/64, A61P 7/02, A61K 31/44
Метки: применение, получение, серинпротеазы, ингибиторы, трипсинподобной
Код ссылки
<a href="https://eas.patents.su/29-18998-ingibitory-tripsinpodobnojj-serinproteazy-ih-poluchenie-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы трипсинподобной серинпротеазы, их получение и применение</a>
Предыдущий патент: Антагонисты ccr2 группы 4-азетидинил-1-гетероарилциклогексанола
Следующий патент: Соединения тропана
Случайный патент: Устройство и способ регулируемого распределения текучей среды и способ производства такого устройства












