Соединения имидазолидинониламинопиримидина
Номер патента: 16178
Опубликовано: 28.02.2012
Авторы: Генри Джеймс Роберт, Ванг Ян, Сойер Джейсон Скотт, Брукс Харольд Бернс, Ли Хун-Юй, Крич Джойс З.
Формула / Реферат
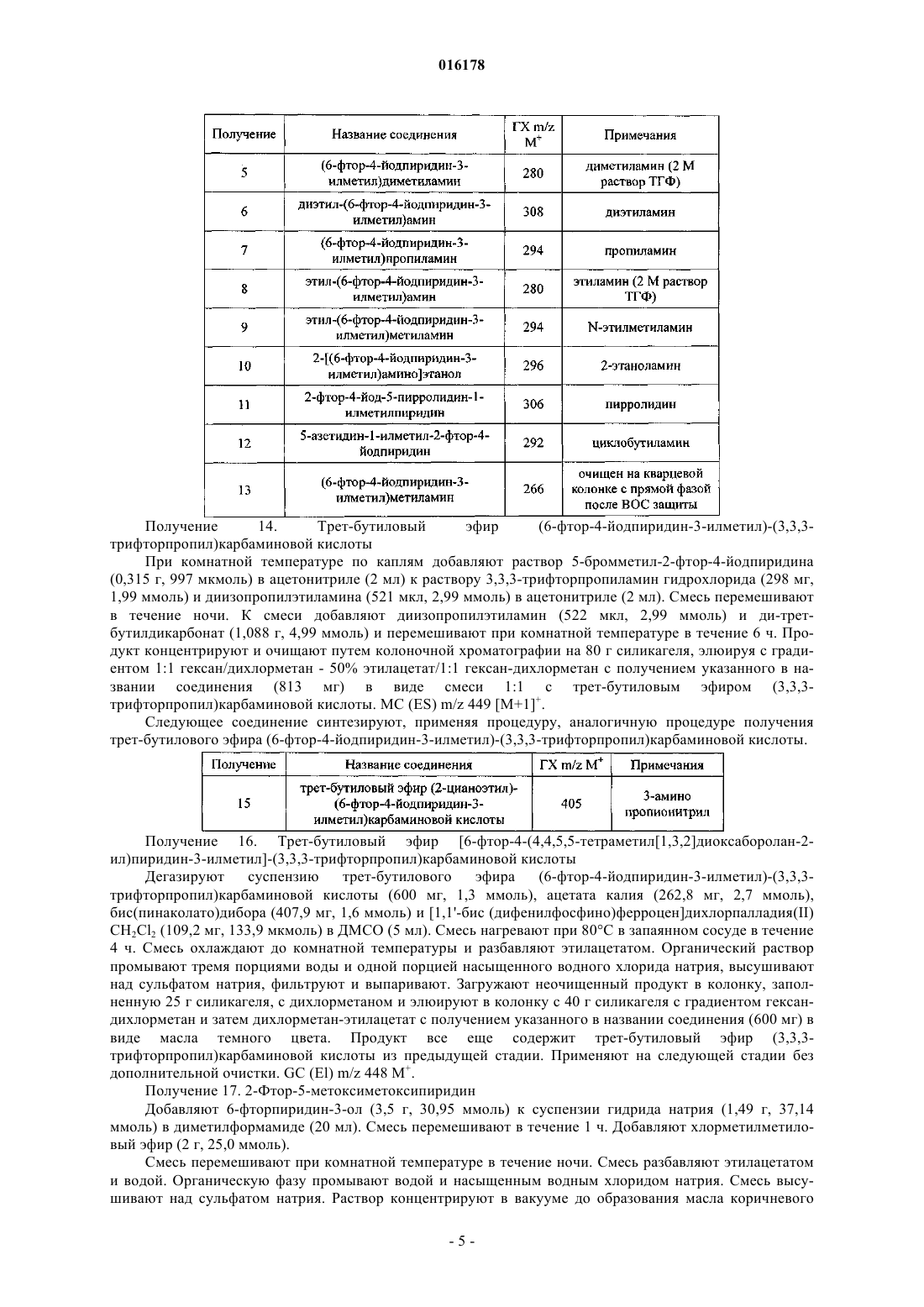
1. Соединение формулы
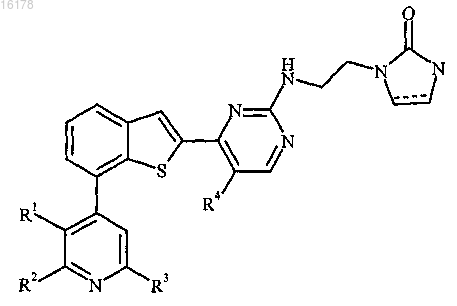
где
R1 представляет собой аминометил, (C1-С3алкил)аминометил, ди(С1-С2алкил)аминометил, N-этил-N-метиламинометил, 1-аминоэтил, 1-((C1-С2алкил)амино)этил, 3,3,3-трифторпропиламинометил, этинил, 2-гидроксиэтокси, 2-гидроксиэтиламинометил, 2-цианоэтиламинометил, морфолин-4-илметил, метоксиметоксиметил, циклопропил, 1-азетидинилметил, 1-пирролидинилметил или 1,3-диоксолан-2-ил;
R2 представляет собой водород или галоген;
R3 представляет собой водород или галоген;
при условии, что по меньшей мере один из R2 и R3 представляет собой водород;
R4 представляет собой водород, метил или галоген; и
представляет собой одинарную связь, которая может присутствовать или отсутствовать,
или фармацевтически приемлемая соль указанного соединения.
2. Соединение по п.1, отличающееся тем, что
R1 представляет собой аминометил, (C1-С3алкил)аминометил, ди(С1-С2алкил)аминометил, N-этил-N-метиламинометил, 1-аминоэтил, 1-((C1-С2алкил)амино)этил, 3,3,3-трифторпропиламинометил, этинил, 2-гидроксиэтокси, 2-гидроксиэтиламинометил, 2-цианоэтиламинометил, морфолин-4-илметил, метоксиметоксиметил, циклопропил, 1-азетидинилметил, 1-пирролидинилметил или 1,3-диоксолан-2-ил;
R2 представляет собой водород или фтор;
R3 представляет собой водород, хлор или фтор;
при условии, что по меньшей мере один из R2 и R3 представляет собой водород;
R4 представляет собой водород, метил, хлор или фтор и
представляет собой одинарную связь, которая может присутствовать или отсутствовать,
или фармацевтически приемлемая соль указанного соединения.
3. Соединение по п.1, отличающееся тем, что
R1 представляет собой диметиламинометил, метиламинометил или аминометил;
R2 представляет собой водород или фтор;
R3 представляет собой водород, хлор или фтор;
при условии, что по меньшей мере один из R2 и R3 представляет собой водород;
R4 представляет собой водород, метил, хлор или фтор и
представляет собой одинарную связь, которая может присутствовать или отсутствовать,
или фармацевтически приемлемая соль указанного соединения.
4. Соединение по п.1, отличающееся тем, что R1 представляет собой диметиламинометил, R2 представляет собой водород, R3 представляет собой фтор и R4 представляет собой фтор, или фармацевтически приемлемая соль указанного соединения.
5. Соединение по п.1, отличающееся тем, что R1 представляет собой метиламинометил, R2 представляет собой водород, R3 представляет собой фтор и R4 представляет собой фтор, или фармацевтически приемлемая соль указанного соединения.
6. Соединение по п.1, отличающееся тем, что R1 представляет собой аминометил, R2 представляет собой водород, R3 представляет собой галоген и R4 представляет собой галоген, или фармацевтически приемлемая соль указанного соединения.
7. Соединение, выбранное из группы, включающей
1-(2-{4-[7-(5-((диметиламино)метил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-{4-[7-(2-фтор-5-(морфолинометил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-{5-фтор-4-[7-(2-фтор-5-(морфолинометил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-{4-[7-(5-((диметиламино)метил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2-иламино}этил)имидазолидин-2-он,
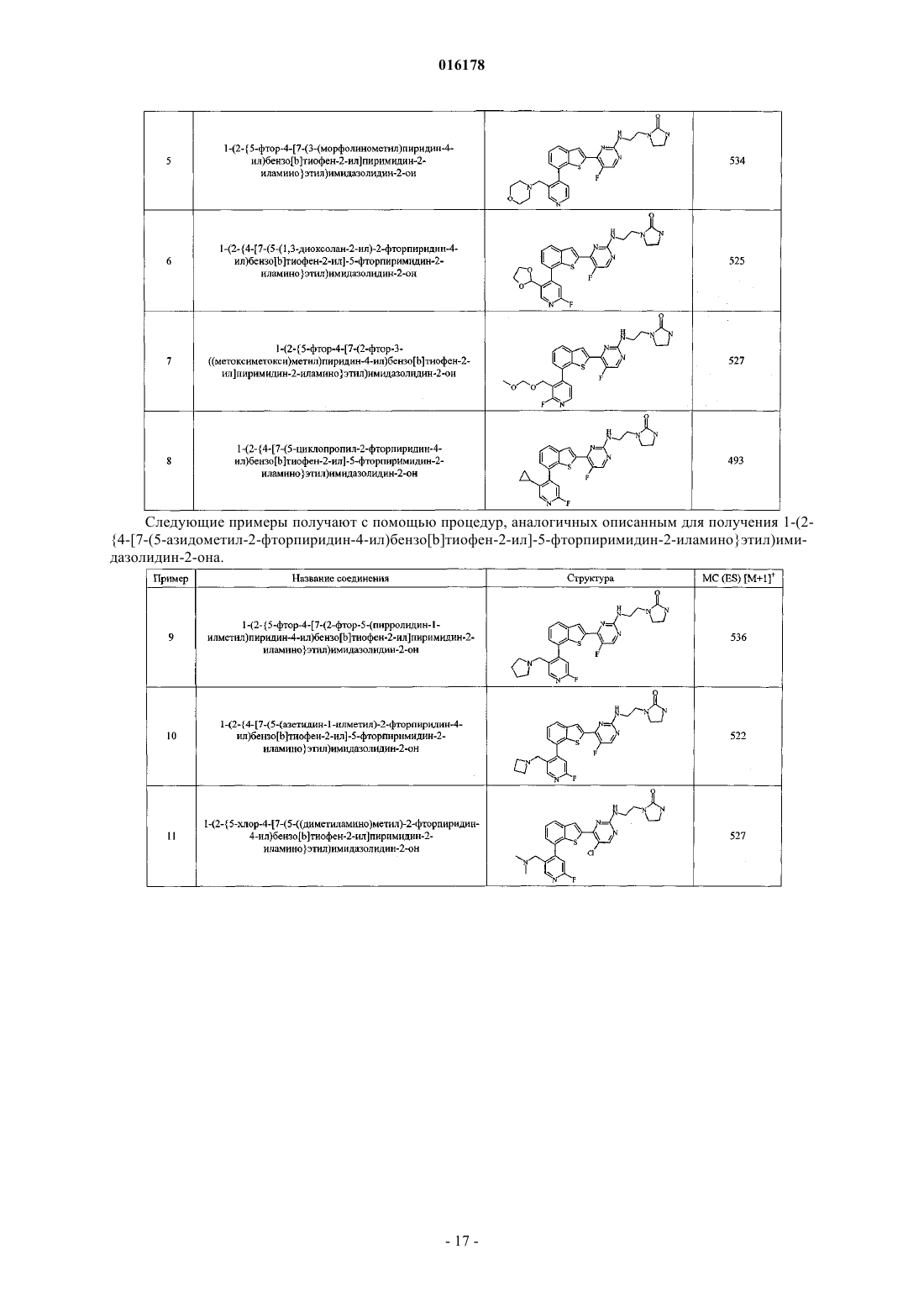
1-(2-{5-фтор-4-[7-(3-(морфолинометил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-{4-[7-(5-(1,3-диоксолан-2-ил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-{5-фтор-4-[7-(2-фтор-3-((метоксиметокси)метил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-{4-[7-(5-циклопропил-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-{5-фтор-4-[7-(2-фтор-5-(пирролидин-1-илметил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-{4-[7-(5-(азетидин-1-илметил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-{5-хлор-4-[7-(5-((диметиламино)метил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2-иламино}этил)имидазолидин-2-он,
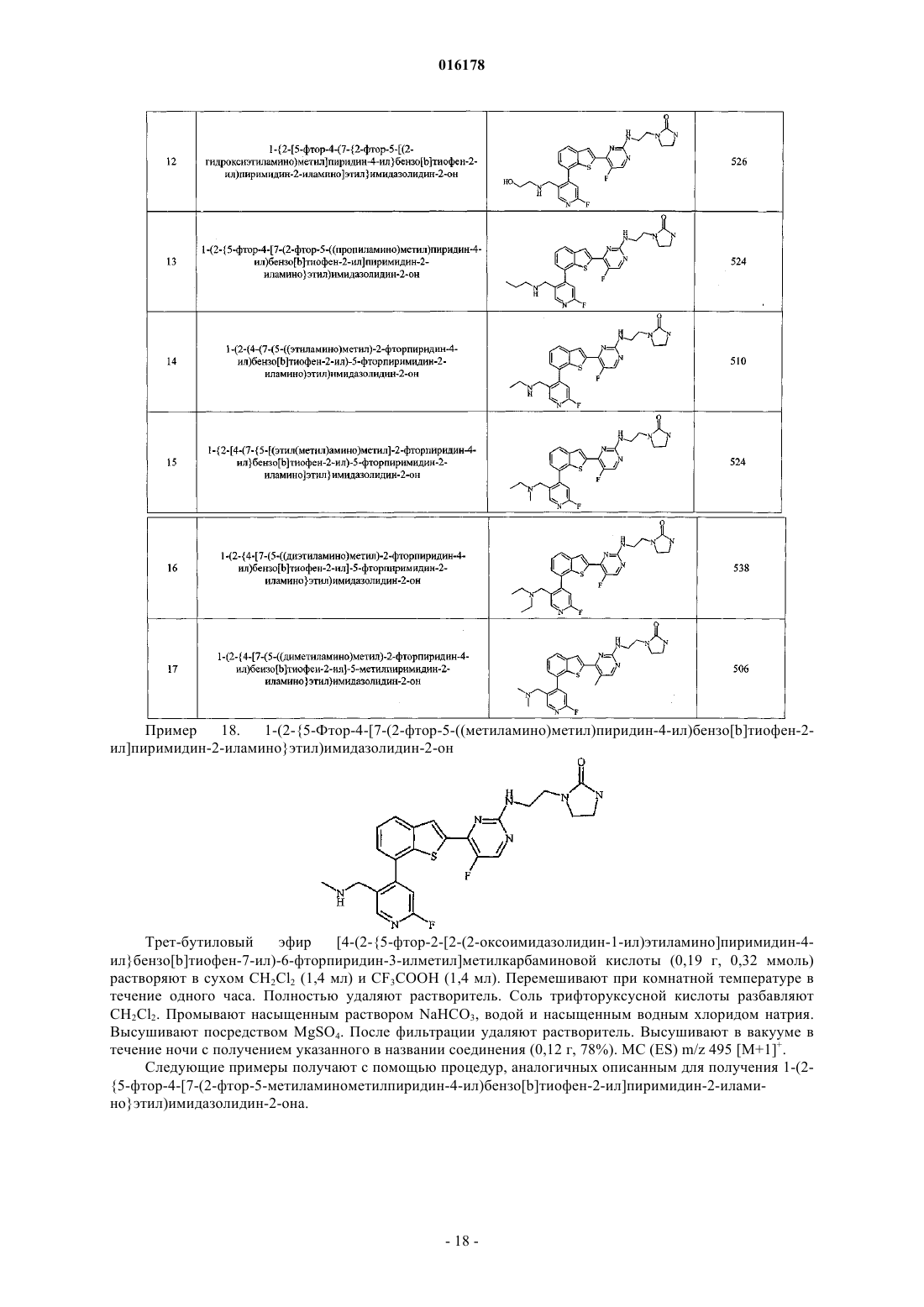
1-{2-[5-фтор-4-(7-{2-фтор-5-[(2-гидроксиэтиламино)метил]пиридин-4-ил}бензо[b]тиофен-2-ил)пиримидин-2-иламино]этил}имидазолидин-2-он,
1-(2-{5-фтор-4-[7-(2-фтор-5-((пропиламино)метил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-(4-(7-(5-((этиламино)метил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил)-5-фторпиримидин-2-иламино)этил)имидазолидин-2-он,
1-{2-[4-(7-{5-[(этил(метил)амино)метил]-2-фторпиридин-4-ил}бензо[b]тиофен-2-ил)-5-фторпиримидин-2-иламино]этил}имидазолидин-2-он,
1-(2-{4-[7-(5-((диэтиламино)метил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-{4-[7-(5-((диметиламино)метил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-метилпиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-{5-фтор-4-[7-(2-фтор-5-((метиламино)метил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-{4-[7-(2-фтор-5-((метиламино)метил)пиридин-4-ил)бензо[b]тиофен-2-ил]-5-метилпиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-{5-хлор-4-[7-(2-фтор-5-((метиламино)метил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2-иламино}этил)имидазолидин-2-он,
1-(2-{4-[7-(2-фтор-5-((метиламино)метил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2-иламино}этил)имидазолидин-2-он,
1-[2-(4-{7-[5-(1-аминоэтил)-2-фторпиридин-4-ил]бензо[b]тиофен-2-ил}-5-фторпиримидин-2-иламино)этил]имидазолидин-2-он,
1-(2-{5-фтор-4-[7-(2-фтор-5-((метиламино)метил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2-иламино}этил)-1Н-имидазол-2(3Н)-он,
1-{2-[5-фтор-4-(7-{2-фтор-5-[(3,3,3-трифторпропиламино)метил]пиридин-4-ил}бензо[b]тиофен-2-ил)пиримидин-2-иламино]этил}имидазолидин-2-он,
3-{[6-фтор-4-(2-{5-фтор-2-[2-(2-оксоимидазолидин-1-ил)этиламино]пиримидин-4-ил}бензо[b]тиофен-7-ил)пиридин-3-ил]метиламино}пропаннитрил,
1-(2-{4-[7-(5-(аминометил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2-иламино}этил)имидазолидин-2-он,
R-1-[2-(4-{7-[5-(1-аминоэтил)-2-фторпиридин-4-ил]бензо[b]тиофен-2-ил}-5-фторпиримидин-2-иламино)этил]имидазолидин-2-он,
S-1-[2-(4-{7-[5-(1-аминоэтил)-2-фторпиридин-4-ил]бензо[b]тиофен-2-ил}-5-фторпиримидин-2-иламино)этил]имидазолидин-2-он,
1-[2-(5-фтор-4-{7-[2-фтор-5-(2-гидроксиэтокси)пиридин-4-ил]бензо[b]тиофен-2-ил}пиримидин-2-иламино)этил]имидазолидин-2-он,
1-(2-(4-(7-(3-этинилпиридин-4-ил)бензо[b]тиофен-2-ил)пиримидин-2-иламино)этил)имидазолидин-2-он,
1-(2-(4-(7-(3-этинилпиридин-4-ил)бензо[b]тиофен-2-ил)-5-фторпиримидин-2-иламино)этил)имидазолидин-2-он,
1-(2-(4-(7-(5-(1-аминоэтил)-2-хлорпиридин-4-ил)бензо[b]тиофен-2-ил)-5-фторпиримидин-2-иламино)этил)имидазолидин-2-он,
S-1-(2-(4-(7-(5-(1-(этиламино)этил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил)-5-фторпиримидин-2-иламино)этил)имидазолидин-2-он,
R-1-(2-(4-(7-(5-(1-(этиламино)этил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил)-5-фторпиримидин-2-иламино)этил)имидазолидин-2-он,
S-1-(2-(5-фтор-4-(7-(2-фтор-5-(1-(метиламино)этил)пиридин-4-ил)бензо[b]тиофен-2-ил)пиримидин-2-иламино)этил)имидазолидин-2-он и
R-1-(2-(5-фтор-4-(7-(2-фтор-5-(1-(метиламино)этил)пиридин-4-ил)бензо[b]тиофен-2-ил)пиримидин-2-иламино)этил)имидазолидин-2-он,
или фармацевтически приемлемая соль указанного соединения.
8. Фармацевтическая композиция, содержащая соединение по пп.1-7 или фармацевтически приемлемую соль указанного соединения в комбинации с фармацевтически приемлемым носителем, разбавителем или наполнителем.
9. Применение соединения по любому из пп.1-7 или фармацевтически приемлемая соль указанного соединения при получении лекарственного средства.
Текст
(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Настоящее изобретение относится к новым соединениям имидазолидинониламинопиримидина,которые могут иметь клиническое применение при лечении рака путем ингибирования Plk1.Plk1 относится к небольшому семейству протеинкиназ, которое характеризуется наличием фосфосерин/треонин-связывающего домена, известного как поло бокс домен. Plk1 играет центральную роль в регуляции клеточного цикла. Полагают, что Plkl, наряду с другими функциями, участвует в регуляции процессов инициирования, развития и выхода из митоза, т.е. стадии, на которой происходит деление раковых клеток. Следовательно, блокирование Plkl в раковых клетках препятствует делению или митозу этих клеток. Получены эффективные противоопухолевые средства, которые препятствуют митозу, такие как алкалоиды барвинка (NAVELBINE), таксоиды (TAXOTERE) и ингибиторы топоизомеразы II (ADRIAMYCIN). VELCADE представляет собой антибластомное средство, которое ингибирует 26S протеосому. Однако эти лекарственные средства вызывают значительные побочные эффекты у нормальных,неделящихся клеток. Plk ингибиторы специфически нацелены на делящиеся клетки и позволяют избежать нежелательной токсичности. Ингибиторы Plk1 известны в данной области. Смотрите, например, международную заявку WO 06/066172. Кроме того, некоторые аналоги дигидроптеридинона (например, BI-2536) описаны в качестве ингибиторов Plkl в международной заявке WO 06/021548. В настоящее время BI-2536 находится в фазе II клинических испытаний, но имеет высокий клиренс (CL1000 мл/мин), и дозирование средства ограничено миелосупрессией человека. Все еще существует потребность в дополнительных соединениях, ингибирующих Plk1, которые обладают более высокой эффективностью или улучшенными фармакокинетическими свойствами. Также был бы полезен Plk1 ингибитор, принимаемый перорально. Настоящее изобретение относится к новым соединениям имидазолидинонил-аминопиримидина, которые могут иметь клиническое применение при лечении рака посредством ингибирования Plk1. Некоторые из этих соединений также обладают большей эффективностью по сравнению с соединениями, описанными в международной заявке WO 06/066172. Кроме того, предположительно некоторые из этих соединений обладают улучшенными фармакокинетическими свойствами по сравнению с BI-2536. Более того, благодаря тому, что предлагаемые в настоящем изобретении соединения, прошедшие испытания,показали биодоступность при пероральном применении, некоторые из этих соединений предположительно можно принимать перорально. Краткое описание изобретения Настоящее изобретение относится к соединениям формулы IR2 представляет собой водород или галоген;R3 представляет собой водород или галоген; при условии, что по меньшей мере один из R2 и R3 представляет собой водород;R4 представляет собой водород, метил или галоген; и представляет собой простую связь, которая присутствует или отсутствует; или их фармацевтически приемлемой соли. Настоящее изобретение относится к способу лечения у млекопитающего рака, выбранного из группы, включающей немелкоклеточный рак легких, опухоль носоглотки, пищевода, желудка, меланому,эпидермальную карциному кожи, рак молочной железы, яичника, эндометрия, прямой кишки, нейроглиому, глиобластому, тироидную карциному, рак шейки матки, поджелудочной железы, предстательной железы, гепатобластому и неходжкинскую лимфому, включающему введение млекопитающему при необходимости такого лечения эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединение формулы I или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым наполнителем, носителем или разбавителем. Настоящее изобретение также относится к соединению формулы I или его фармацевтически приемлемой соли для применения при получении лекарственного средства. Кроме того, настоящее изобретение-1 016178 относится к соединению формулы I или его фармацевтически приемлемой соли для применения при получении лекарственного средства для лечения рака у млекопитающих, выбранного из группы, включающей немелкоклеточный рак легких, опухоль носоглотки, пищевода, желудка, меланому, эпидермальную карциному кожи, рак молочной железы, яичника, эндометрия, прямой кишки, нейроглиому, глиобластому, тироидную карциному, рак шейки матки, рак поджелудочной железы, рак предстательной железы,гепатобластому и неходжкинскую лимфому. Кроме того, настоящее изобретение относится к фармацевтической композиции, адаптированной для лечения рака, выбранного из группы, включающей немелкоклеточный рак легких, опухоль носоглотки, пищевода, желудка, меланому, эпидермальную карциному кожи, рак молочной железы, яичника, эндометрия, прямой кишки, нейроглиому, глиобластому, тироидную карциному, рак шейки матки, рак поджелудочной железы, рак предстательной железы, гепатобластому и неходжкинскую лимфому, содержащей соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или более фармацевтически приемлемыми наполнителями, носителями или разбавителями. Настоящее изобретение также относится к соединениям формулыR2 представляет собой водород или галоген;R3 представляет собой водород или галоген; при условии, что по меньшей мере один из R2 и R3 представляет собой водород;R4 представляет собой водород или галоген; или их фармацевтически приемлемой соли. Подробное описание изобретения Общие химические термины, применяемые в вышеуказанных формулах, имеют общепринятые значения. Например, термин "C1-С 3 алкил" означает алкилы с прямой или разветвленной цепью, такие как метил, этил, пропил и изопропил. "C1-С 2 алкил" включен в значение "C1-С 3 алкил" и означает метил и этил. Термин "галоген" означает фтор, хлор, бром и йод. Специалисту в данной области понятно, что большинство или все соединения согласно настоящему изобретению способны образовывать соли. Соединения, предлагаемые в настоящем изобретении, представляют собой амины и, соответственно, взаимодействуют с любой из множества неорганических и органических кислот с образованием фармацевтически приемлемых солей присоединения кислоты. Такие фармацевтически приемлемые соли присоединения кислоты и общепринятая методология их получения хорошо известны в данной области. См., например, P. Stahl, et al., HANDBOOK OF PHARMACEUTICALSALTS: PROPERTIES, SELECTION AND USE, (VCHA/Wiley-VCH, 2002); S.M. Berge, et al., "Pharmaceutical Salts, "Journal of Pharmaceutical Sciences, vol. 66,1, январь 1977 г. Предпочтительными являются соединения формулы I, в которых:i) R1 представляет собой диметиламинометил, R2 представляет собой водород, R3 представляет собой фтор и R4 представляет собой фтор;j) R1 представляет собой метиламинометил, R2 представляет собой водород, R3 представляет собой фтор и R4 представляет собой фтор; иk) R1 представляет собой аминометил, R2 представляет собой водород, R3 представляет собой фтор,4 и R представляет собой фтор. Схемы Специалисту очевидно, что не все заместители в соединениях согласно настоящему изобретению-2 016178 выдержат некоторые реакционные условия, применяемые при синтезе указанных соединений. Эти группировки могут быть введены в подходящий момент во время синтеза, или они могут быть защищены, а затем, при необходимости или желании, защита может быть снята. Опытному специалисту в данной области техники очевидно, что защитные группы можно удалить в любой подходящий момент во время синтеза соединений согласно настоящему изобретению. Способы введения и удаления азот- и кислородсодержащих защитных групп хорошо известны в данной области; смотрите, например, Greene и Wuts,Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons, New York, Chapter 7 (1999). Более того,специалисту в данной области очевидно, что во многих обстоятельствах последовательность, в которой вводят эти группировки, не является решающей. Конкретная последовательность стадий, необходимых для получения соединений согласно настоящему изобретению, может зависеть от конкретного синтезируемого соединения, исходного соединения и относительной лабильности замещенных группировок. На схемах, представленных ниже, все заместители, если не указано иначе, такие как определено выше, а реагенты хорошо известны и успешно применяются в данной области или проиллюстрированы при описании получения лекарственных средств и в примерах. Соединение 2-галопиримидин (1) вступает в реакцию нуклеофильного замещения с 1-(2 аминоэтил)-2-имидазолидиноном (2) или 1-(2-аминоэтил)-1,3-дигидро-2 Н-имидазол-2-оном (3) с получением соединения (4). Такие реакции проводят в подходящем растворителе, таком как н-бутанол, диоксан и тому подобное. В целом, эти реакции проводят при температурах от примерно 120 до 150 С на масляной бане или в микроволновом реакторе. Типичное стехиометрическое соотношение для такой реакции составляет примерно 2 эквивалента аминов (2) или (3) или 1 эквивалент (2) или (3) в присутствии избытка соединений, нейтрализующих кислоты, таких как триэтиламин или диизопропилэтиламин. На дополнительной стадии образуется фармацевтически приемлемая соль соединения (4). Образование таких солей хорошо известно и успешно применяется в данной области. Очевидно, что соединения (1) можно легко получить способами, аналогичными способам, описанным в настоящем документе, с применением процедур, которые хорошо известны и признанны в данной области. Например, соединение (1) получают связыванием необязательно замещенного пиридинильного соединения с необязательно замещенным бензотиофенильным соединением способами сочетания Сузуки. Образовавшийся аддукт Сузуки борируют способами, хорошо известными в данной области, и затем соединяют с необязательно замещенным пиримидингалогенидом, применяя способы сочетания Сузуки. Кроме того, известно, что стадии, необходимые для получения соединения (1), можно осуществить в любой последовательности, включая реакцию промежуточного соединения с соединением (2) или (3) с образованием соединения (1), таким образом, что последующее образование связи углерод-углерод, реакция сочетания и т.п. обеспечивают соединение (4). Далее настоящее изобретение проиллюстрировано следующими примерами и получениями. Указанные примеры и получения являются только иллюстративными и не предполагают каким-либо образом ограничить изобретение. Термины, применяемые в примерах и получениях, имеют общепринятые значения, если не указано иначе. Соединения, представленные ниже в качестве примеров, были названы с применением ChemDraw, Version 10. Получения Получение 1. 2-бензо[b]тиофен-7-ил-4,4,5,5-тетраметил[1,3,2]диоксаборолан В колбе смешивают 7-бромбензо[b]тиофен (426 мг, 2 ммоль), бис(пинаколато)дибор (756 мг, 3 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), комплекс с дихлорметаном (1:1) (81 мг, 0,1 ммоль), ацетат калия (294 мг, 3 ммоль) в диметилсульфоксиде (ДМСО) (10 мл). Барботируют азот через смесь в течение 5 мин. Запаивают колбу и помещают ее в масляную баню и нагревают при 100 С в течение 4 ч. Смесь разбавляют хлороформом/изопропанолом (3/1). Раствор промывают насыщенным водным хлоридом натрия. Органический раствор высушивают над сульфатом натрия. Раствор концентрируют в вакууме до образования темного остатка. Очищают путем колоночной хроматографии (гексан- 20% этилацетат в гексане) с получением указанного в названии соединения (342 мг, 66%) в виде бесцветного твердого вещества. MС (ES) m/z 261 [M+1]+.-3 016178 Получение 2. Бензо[b]тиофен-7-бороновая кислота Смешивают 7-бромбензо[b]тиофен (300 г, 1,41 ммоль) и триизопропилборат (403,6 г, 2,15 ммоль) в безводном тетрагидрофуране (ТГФ) (4000 мл) в 12-л колбе Мортона, оборудованной механической мешалкой, и охлаждают в атмосфере азота в бане с сухим льдом/ацетоном до -70 С. По каплям добавляют н-бутиллитий (1,6 М в гексане, 714 г, 1,68 ммоль) с такой скоростью, чтобы поддерживать внутреннюю температуру менее -67,5 С. После того как добавление завершено, реакционную смесь оставляют перемешиваться при этой температуре в течение одного часа. Удаляют охлаждающую баню и медленно добавляют 4 л воды. Далее, добавляют концентрированную HСl (75 мл) до тех пор, пока рН раствора не станет равным примерно 2. Оставляют суспензию перемешиваться в течение одного часа. Добавляют достаточное количество 5 н. водного NaOH для установления рН смеси, равного примерно 12. Фазы разделяют и сохраняют водную фазу. Разбавляют органическую фазу 4 л метил-трет-бутилового эфира и экстрагируют посредством 1 л 5 н. водного NaOH. Фазы разделяют. Объединяют водную фазу с ранее полученным водным экстрактом. Промывают водную фазу дополнительным количеством метил-третбутилового эфира (4 л). Фазы разделяют, и водные фазы переносят в 12-л 3-горлую круглодонную колбу,оборудованную механической мешалкой. Охлаждают раствор до +5 С с помощью бани с ледяной водой. Медленно добавляют концентрированную HCl, пока рН раствора не станет равным примерно 2. Смесь перемешивают в течение 30 мин и отфильтровывают образовавшееся твердое вещество. Твердое вещество промывают в воронке 2 л воды два раза и оставляют высушиваться на воздухе в течение 30 мин. Твердое вещество помещают в вакуумную печь при 50 С и высушивают в вакууме в течение ночи. Желтый цвет удаляют путем суспендирования высушенного твердого вещества с 2 л н-гептана в течение 30 мин. Твердое вещество отфильтровывают еще раз, высушивают на воздухе в течение 30 мин и высушивают в вакууме при 40 С в течение ночи с получением указанного в названии соединения (188,8 г, 75%) в виде твердого вещества белого цвета. 1 Н-ЯМР (400 МГц, CD3OD)7,86 (д, J = 8 Гц, 1 Н), 7,49-7,57 (м, 2 Н), 7,30-7,39 (м, 2 Н). Получение 3. 5-Бромметил-2-фтор-4-йодпиридин В колбе смешивают 2-фтор-4-йодпиколин (10,0 г, 42,19 ммоль), N-бромсукцинимид (9,76 г, 54,85 ммоль), 2,2'-азобисизобутиронитрил (3,46 г, 21,10 ммоль) и сухой CCl4 (100 мл). Нагревают при 70 С в атмосфере азота в течение 16 ч. Охлаждают до комнатной температуры. Разбавляют дихлорметаном и промывают водой и насыщенным водным хлоридом натрия. Фазы разделяют и высушивают органическую фазу над сульфатом магния. Концентрируют в вакууме с получением неочищенного продукта. Очищают путем колоночной хроматографии (1-15% этилацетат в гексане) с получением указанного в названии соединения (8,27 г, 62%). МС (EI) m/z 315 М+. Получение 4. 4-(6-Фтор-4-йодпиридин-3-илметил)морфолин В колбе в атмосфере азота смешивают 5-бромметил-2-фтор-4-йодпиридин (6,13 г, 19,40 ммоль),морфолин (3,38 г, 38,80 ммоль) и сухой CH3CN (100 мл). Добавляют N,N-диизопропилэтиламин (6,76 мл,38,80 ммоль, 2 М раствор ТГФ). Нагревают при 81 С в течение 2 ч и охлаждают до комнатной температуры. Разбавляют дихлорметаном и промывают водой и насыщенным водным хлоридом натрия. Отделяют органическую фазу от водной фазы и высушивают над сульфатом магния. После фильтрации концентрируют в вакууме с получением неочищенного указанного в названии соединения 6,23 г (99,7%). МС (ES) m/z 323 [М+1]+. Следующие соединения синтезируют с применением подходящего амина, посредством процедуры,аналогичной процедуре получения 4-(6-фтор-4-йодпиридин-3-илметил)морфолина.(6-фтор-4-йодпиридин-3-илметил)-(3,3,3 трифторпропил)карбаминовой кислоты При комнатной температуре по каплям добавляют раствор 5-бромметил-2-фтор-4-йодпиридина(0,315 г, 997 мкмоль) в ацетонитриле (2 мл) к раствору 3,3,3-трифторпропиламин гидрохлорида (298 мг,1,99 ммоль) и диизопропилэтиламина (521 мкл, 2,99 ммоль) в ацетонитриле (2 мл). Смесь перемешивают в течение ночи. К смеси добавляют диизопропилэтиламин (522 мкл, 2,99 ммоль) и ди-третбутилдикарбонат (1,088 г, 4,99 ммоль) и перемешивают при комнатной температуре в течение 6 ч. Продукт концентрируют и очищают путем колоночной хроматографии на 80 г силикагеля, элюируя с градиентом 1:1 гексан/дихлорметан - 50% этилацетат/1:1 гексан-дихлорметан с получением указанного в названии соединения (813 мг) в виде смеси 1:1 с трет-бутиловым эфиром (3,3,3 трифторпропил)карбаминовой кислоты. МС (ES) m/z 449 [М+1]+. Следующее соединение синтезируют, применяя процедуру, аналогичную процедуре получения трет-бутилового эфира (6-фтор-4-йодпиридин-3-илметил)-(3,3,3-трифторпропил)карбаминовой кислоты. Получение 16. Трет-бутиловый эфир [6-фтор-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2 ил)пиридин-3-илметил]-(3,3,3-трифторпропил)карбаминовой кислоты Дегазируют суспензию трет-бутилового эфира(6-фтор-4-йодпиридин-3-илметил)-(3,3,3 трифторпропил)карбаминовой кислоты (600 мг, 1,3 ммоль), ацетата калия (262,8 мг, 2,7 ммоль),бис(пинаколато)дибора (407,9 мг, 1,6 ммоль) и [1,1'-бис (дифенилфосфино)ферроцен]дихлорпалладия(II) СН 2 Сl2 (109,2 мг, 133,9 мкмоль) в ДМСО (5 мл). Смесь нагревают при 80 С в запаянном сосуде в течение 4 ч. Смесь охлаждают до комнатной температуры и разбавляют этилацетатом. Органический раствор промывают тремя порциями воды и одной порцией насыщенного водного хлорида натрия, высушивают над сульфатом натрия, фильтруют и выпаривают. Загружают неочищенный продукт в колонку, заполненную 25 г силикагеля, с дихлорметаном и элюируют в колонку с 40 г силикагеля с градиентом гександихлорметан и затем дихлорметан-этилацетат с получением указанного в названии соединения (600 мг) в виде масла темного цвета. Продукт все еще содержит трет-бутиловый эфир (3,3,3 трифторпропил)карбаминовой кислоты из предыдущей стадии. Применяют на следующей стадии без дополнительной очистки. GC (El) m/z 448 М+. Получение 17. 2-Фтор-5-метоксиметоксипиридин Добавляют 6-фторпиридин-3-ол (3,5 г, 30,95 ммоль) к суспензии гидрида натрия (1,49 г, 37,14 ммоль) в диметилформамиде (20 мл). Смесь перемешивают в течение 1 ч. Добавляют хлорметилметиловый эфир (2 г, 25,0 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. Смесь разбавляют этилацетатом и водой. Органическую фазу промывают водой и насыщенным водным хлоридом натрия. Смесь высушивают над сульфатом натрия. Раствор концентрируют в вакууме до образования масла коричневого-5 016178 цвета. Очищают путем колоночной хроматографии, (10% этилацетат в гексане) с получением указанного в названии соединения (4,30 г, 88,4%) в виде масла желтого цвета. 1 Н-ЯМР (400 МГц, CDCl3)3,48 (с, 3 Н), 5,15 (с, 2 Н), 6,85 (дд, J = 3,6 Гц, J = 8,8 Гц, 1 Н), 7,47 (м,1 Н), 7, 96 (м, 1 Н). Получение 18. 2-Фтор-4-йод-5-метоксиметоксипиридин Охлаждают раствор 2-фтор-5-метоксиметоксипиридина (4,1 г, 2 6,1 ммоль) в ТГФ (60 мл) до -75 С. Добавляют трет-бутиллитий (1,7 М в пентане, 30,4 мл, 51,66 ммоль) в течение 30 мин. Смесь дополнительно перемешивают в течение получаса. Добавляют йод (9,8 г, 38,61 ммоль, растворенный в 60 мл тетрагидрофурана). После того как добавление завершено, перемешивают в течение 1 ч. Дают температуре подняться до комнатной температуры в течение 1 ч при перемешивании. Обрабатывают смесь водой. Раствор экстрагируют три раза этилацетатом. Органическую фазу промывают насыщенным водным хлоридом натрия. Смесь высушивают над сульфатом натрия. Раствор концентрируют в вакууме до образования твердого вещества коричневого цвета. Твердое вещество коричневого цвета растирают в порошок с гексаном. Фильтруют с получением указанного в названии соединения (3,9 г, 52,8%) в виде твердого вещества коричневого цвета. 1H-ЯМР (400 МГц, CDCl3)3,53 (с, 3 Н), 5,23 (с, 2 Н), 7,39 (д, J = 4,0 Гц, 1 Н), 7,96 (д, J = 1,6 Гц, 1 Н). Получение 19. 6-Фтор-4-йодпиридин-3-ол К раствору 2-фтор-4-йод-5-метоксиметоксипиридина (3,9 г, 13,78 ммоль) в ТГФ (20 мл) добавляют НСl (3 М в воде, 31 мл, 93,01 ммоль). Смесь перемешивают при 60 С в течение 3 ч. Смесь охлаждают. Доводят рН до 7 путем медленного добавления насыщенного водного раствора бикарбоната натрия. Раствор экстрагируют этилацетатом три раза. Органическую фазу промывают насыщенным водным хлоридом натрия. Смесь высушивают над сульфатом натрия. Раствор концентрируют в вакууме с получением указанного в названии соединения (3,2 г, 97,18%) в виде твердого вещества желтого цвета. MС (EI) m/z 240 [M+1]+. Получение 20. 2-Фтор-4-йод-5-[2-(тетрагидропиран-2-илокси)этокси]пиридин 6-Фтор-4-йодпиридин-3-ол (0,5 г, 2,09 ммоль) добавляют к суспензии гидрида натрия (60% дисперсия в минеральном масле, 0,1 г, 2,51 ммоль) в диметилформамиде (6 мл). Смесь перемешивают в течение одного часа. Добавляют 2-(2-бромэтокси)тетрагидропиран (0,51 г, 2,34 ммоль). Раствор перемешивают при комнатной температуре в течение ночи. Смесь разбавляют этилацетатом и водой. Органическую фазу промывают насыщенным водным хлоридом натрия и водой. Смесь высушивают над сульфатом натрия. Раствор концентрируют в вакууме с получением масла желтого цвета. Масло очищают путем колоночной хроматографии (10% этилацетат в гексане) с получением указанного в названии соединения (0,58 г, 75,5%) в виде масла желтого цвета. МС (EI) m/z 368 [М+1]+. Получение 21. 4-Хлор-3-триметилсилилэтинилпиридин К раствору 4-хлор-3-йодпиридина (2,0 г, 8,3 ммоль) в толуоле (20 мл) добавляют трифенилфосфин(0,219 г, 0,83 ммоль), йодид меди (0,07 9 г, 0,41 ммоль) и ацетат палладия (II) (0,0 93 г, 0,41 ммоль), при комнатной температуре по каплям добавляют триэтиламин (3,49 мл, 25 ммоль), с последующим добавлением триметилсилилацетилена (1,65 мл, 11,69 ммоль) при комнатной температуре и непрерывном перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь концентрируют путем испарения толуола в вакууме. Соединение (почти чистое) экстрагируют, растирая в порошок с гексаном и затем отфильтровывая слой гексана 4-5 раз. Гексан выпаривают в вакууме и высушивают остаток с получением чистого соединения (1,68 г, 96%). 1(ES) m/z 210 [М+1]+. Получение 22. Трет-бутиловый эфир (6-фтор-4-йодпиридин-3-илметил)метилкарбаминовой кислоты Смешивают неочищенную смесь (6-фтор-4-йодпиридин-3-илметил)метиламина (8 г, 30,07 ммоль) с диизопропилэтиламином (10,49 мл, 60,14 ммоль) в сухом ацетонитриле (50 мл) в атмосфере азота. Добавляют ди-трет-бутилдикарбонат (13,13 г, 60,14 ммоль) и перемешивают в течение ночи. Промывают смесь насыщенным бикарбонатом, водой и насыщенным водным хлоридом натрия. Отделяют органическую фазу от водной фазы и высушивают над MgSO4. После фильтрации удаляют органический растворитель до сухости с получением неочищенного продукта. Неочищенный продукт очищают путем колоночной хроматографии с применением 5-25% этилацетата в гексане с получением указанного в названии соединения (8,24 г, 75%). МС (ES) m/z 367 [М+1]+. Получение 23. 1-(6-Фторпиридин-3-ил)этанол При 0 С в атмосфере азота к раствору 6-фторпиридин-3-карбальдегида (3 г, 24 ммоль) в ТГФ (20 мл) добавляют метилбромид магния (3 М в эфире, 12 мл, 36 ммоль). Смесь продолжают перемешивать в течение ночи при комнатной температуре. Смесь гидролизуют посредством 1 н. HСl и проводят базификацию разбавленным гидроксидом аммония до рН, равного примерно 9. Продукт извлекают хлороформом/изопропиловым спиртом (3/1). Высушивают над сульфатом натрия. Раствор концентрируют в вакууме до образования масла желтого цвета. Очищают путем колоночной хроматографии (10% метанол в-6 016178 дихлорметане) с получением продукта в виде бесцветного масла (2,3 г, 68%). МС (ES) m/z 142 [М+1]+. Получение 24. 2-Фтор-5-(1-метоксиметоксиэтил)пиридинN,N'-диизопропилэтиламин и хлорметоксиметан добавляют к раствору 1-(6-фторпиридин-3 ил)этанола (3,0 г, 21,3 ммоль) в дихлорметане при 0 С. Смесь продолжают перемешивать в течение 30 мин при 0 С, а затем в течение ночи при комнатной температуре. Смесь разбавляют хлороформом/изопропиловым спиртом (3/1). Раствор промывают насыщенным водным хлоридом натрия. Высушивают раствор над сульфатом натрия. Раствор концентрируют в вакууме до образования темного остатка. Очищают путем колоночной хроматографии (гексан - 20% этилацетат в гексане) с получением продукта в виде бесцветного твердого вещества (3 г, 66%). МС (ES) m/z 186 [М+1]+. Получение 25. 5-Азидометил-2-фтор-4-йодпиридин В круглодонной колбе смешивают 5-бромметил-2-фтор-4-йодпиридин (0,45 г, 1,4 ммоль), азид натрия (370 мг, 5,7 ммоль) и эфир 18-краун (45 мг, 0,17 ммоль) в диметилформамиде (10 мл). Смесь перемешивают в течение 4 ч при комнатной температуре. Реакционную смесь разбавляют хлороформом и промывают водой и насыщенным водным хлоридом натрия. Отделяют органическую фазу от водной фазы и высушивают над MgSO4. После фильтрации выпаривают органический растворитель в вакууме с получением неочищенного продукта. Неочищенный продукт очищают путем колоночной флэшхроматографии (элюируют 20% метилацетатом в гексане) с получением указанного в названии соединения (бесцветное масло, 0,032 г, 82%). МС (ES) m/z 279 [М+1]+ Получение 26. (4-Хлорпиридин-3-ил)морфолин-4-илметанон Смешивают 4-хлорникотиновую кислоту (0,10 г, 6,0 ммоль) и 1,1'-карбонилдиимидазол (0,97 г, 6,0 ммоль) в сухом ТГФ (15 мл). Перемешивают при комнатной температуре в атмосфере азота в течение 90 мин. Добавляют морфолин (1,58 мл, 18,0 ммоль) и перемешивают при комнатной температуре в атмосфере азота в течение 15 ч. Разбавляют дихлорметаном, промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным хлоридом натрия. Фазы разделяют и высушивают органическую фазу над сульфатом магния. Концентрируют в вакууме. Неочищенный остаток очищают путем колоночной хроматографии [5-25% (10% 2 М раствор аммиака/метанола в дихлорметане)/дихлорметане] с получением указанного в названии соединения (1,17 г, 86%). МС (ES) m/z 227 [М+1]+. Получение 27. 4-(4-Хлорпиридин-3-илметил)морфолин Растворяют (4-хлорпиридин-3-ил)морфолин-4-илметанон (1,17 г, 5,17 ммоль) в сухом ТГФ (10 мл). В атмосфере азота при комнатной температуре по каплям добавляют раствор 2 М ВН 3-Ме 2S/ТГФ (15 мл,31,0 ммоль). Перемешивают при комнатной температуре в течение 15 ч в атмосфере азота. Очень медленно по каплям добавляют метанол (11,0 мл). Нагревают при 60 С в течение 3 ч и охлаждают в вакууме до комнатной температуры с получением указанного в названии соединения (1,1 г, 100%). МС (ES) m/z 213 [М+1]+. Получение 28. 5-[1,3]диоксолан-2-ил-2-фторпиридин В сосуде высокого давления смешивают 6-фторпиридин-3-карбальдегид (4 г, 32 ммоль), этиленгликоль (3 г, 48 ммоль), дигидрат хлорида меди(II) (0,56 г, 3,2 ммоль) и ТГФ (10 мл). Смесь нагревают при 100 С в течение одного часа. Смесь разбавляют хлороформом-изопропанолом (3:1, 100 мл). Органическую фазу промывают насыщенным водным хлоридом натрия и водой. Высушивают органическую фазу над сульфатом натрия. Раствор концентрируют в вакууме до образования масла коричневого цвета. Очищают путем колоночной хроматографии (20% этилацетат в гексане) с получением указанного в названии соединения (2,1 г, 39%) в виде масла бледно-желтого цвета. МС (ES) m/z 170 [М+1]+. Получение 29. 5-[1,3]диоксолан-2-ил-2-фтор-3-йодпиридин Раствор 5-[1,3]диоксолан-2-ил-2-фторпиридина (2,0 г, 11,8 ммоль) в ТГФ (20 мл) охлаждают до-75 С. В течение 30 мин добавляют литийдиизопропиламид (2 М в ТГФ, 6 мл, 12 ммоль). Смесь дополнительно перемешивают в течение 3 ч. Добавляют йод (3,0 г, 11,8 ммоль, растворенный в 100 мл ТГФ). После этого перемешивают в течение 2 ч. К смеси добавляют воду (100 мл) и при перемешивании дают температуре подниматься до комнатной температуры в течение 1 ч. Обрабатывают смесь насыщенным водным раствором тиосульфата натрия (50 мл). Раствор экстрагируют эфиром. Раствор концентрируют в вакууме до получения масла коричневого цвета. Очищают путем колоночной хроматографии (гексан 20% этилацетат в гексане) с получением указанного в названии соединения (2,1 г, 60%) в виде масла желтого цвета. МС (ES) m/z 296 [М+1]+. Следующие соединения синтезируют, применяя процедуру, аналогичную процедуре получения 5[1,3]диоксолан-2-ил-2-фтор-3-йодпиридина. Получение 31. 5-[1,3]диоксолан-2-ил-2-фтор-4-йодпиридин Раствор 5-[1,3]диоксолан-2-ил-2-фтор-3-йодпиридина (2,0 г, 6,8 ммоль) в ТГФ (20 мл) охлаждают до -75 С. Добавляют литий диизопропиламид (2M в ТГФ, 3,4 мл, 6,8 ммоль) в течение 30 мин. Смесь дополнительно перемешивают в течение 3 ч. Добавляют воду (100 мл) и при перемешивании позволяют температуре подняться до комнатной температуры в течение 1 ч. Раствор экстрагируют эфиром. Раствор-7 016178 концентрируют в вакууме до получения масла коричневого цвета. Очищают путем колоночной хроматографии (гексан - 15% этилацетат в гексане) с получением указанного в названии соединения (1,03 г, 51%) в виде масла желтого цвета. МС (ES) m/z 296 [М+1]+. Следующие соединения синтезируют, применяя процедуру, аналогичную процедуре получения 5[1,3]диоксолан-2-ил-2-фтор-4-йодпиридина. Получение 33. 1-(6-фтор-4-йодпиридин-3-ил)этанол К раствору 2-фтор-4-йод-5-(1-метоксиметоксиэтил)пиридина (1 г, 3,2 ммоль) в метаноле (10 мл) добавляют 1 н. НСl (5 мл). Смесь перемешивают в течение ночи. Реакционную смесь разбавляют 2 н. карбонатом натрия. Продукт извлекают в хлороформ. Высушивают органическую фазу над сульфатом натрия. Раствор концентрируют в вакууме с получением неочищенного продукта. Неочищенный продукт очищают путем колоночной хроматографии(10% метанол в дихлорметане) с получением продукта в виде твердого вещества белого цвета (0,75 г,87%). MС (ES) m/z 268 [M+1]+. Получение 34. 5-(1-азидоэтил)-2-фтор-4-йодпиридин Азид тетра-N-бутиламмония добавляют к раствору трифенилфина (11 г, 42 ммоль) и 1,4 циклогексадиен-2,2-дикарбонитрил,4,5-дихлор-3,6-диоксо- (9 г, 40 ммоль) в дихлорметане (150 мл) при охлаждении в ледяной бане. Затем к вышеуказанному раствору добавляют 1-(6-фтор-4-йодпиридин-3 ил)этанол (6,7 г, 25,1 ммоль). Смесь перемешивают при комнатной температуре в течение одного часа. Смесь концентрируют в вакууме до примерно 50 мл. Остаток очищают путем колоночной флэшхроматографии (гексан - 20% этилацетат в гексане в качестве градиента) и получают заданный продукт в виде бесцветного масла (5,7 г, 78%). МС (ES) m/z 293 [М+1]+. Получение 35. R-5-(1-азидоэтил)-2-фтор-4-йодпиридин Разделяют 5-(1-азидоэтил)-2-фтор-4-йодпиридин (11,7 г) способом хиральной хроматографии(Chiralpak AS-H колонка, 15:85:изопропиловый спирт/С 7 при 270 нм) с получением R-1-(1-азидоэтил)4-фтор-2-йодбензола (3,82 г, 33%). Получение 36. 1- (6-хлорпиридин-3-ил)этиламин Перемешивают смесь 1-(6-хлорпиридин-3-ил)этанона (5 г, 32,14 ммоль) в титантетра(изопропоксиде) (18,27 г, 64,27 ммоль) и аммиаке (160,7 ммоль, 2M в МеОН) в атмосфере N2 в течение 6 ч при комнатной температуре. К этой смеси добавляют тетрагидроборат натрия (1,82 г, 4 8,21 ммоль) и перемешивают в течение ночи. Реакционную смесь гасят гидроксидом аммония и смесь фильтруют. Из фильтрата удаляют растворитель и остаток экстрагируют дихлорметаном, промывают насыщенным водным хлоридом натрия и высушивают над Na2SO4, фильтруют и удаляют растворитель с получением масла темно-желтого цвета (4,2 г). МС (ES) m/z 157 [Ь+l]+. Получение 37. Трет-бутиловый эфир [1-(6-хлорпиридин-3-ил)этил]карбаминовой кислоты К раствору 1-(6-хлорпиридин-3-ил)этиламина (4,2 г, 26,82 ммоль) в ацетонитриле (50 мл) добавляют диизопропилэтиламин (5,2 г, 40,23 ммоль) и ди-трет-бутилдикарбонат (7,02 г, 32,18 ммоль), и перемешивают смесь в течение ночи. Смесь промывают насыщенным NaHCO3 (200 мл) и экстрагируют в дихлорметане, промывают насыщенным водным хлоридом натрия и высушивают над Na2SO4. Очищают путем колоночной хроматографии с применением 5-20% этилацетата в гексане и получают твердое вещество белого цвета (5,1 г). МС (ES) m/z 257 [М+1]+. Получение 38. Трет-бутиловый эфир [1-(6-хлор-4-йодпиридин-3-ил)этил]карбаминовой кислоты В атмосфере N2 при -78 С добавляют трет-бутиллитий (35 мл, 59,6 ммоль) к раствору третбутилового эфира [1-(6-хлорпиридин-3-ил)этил]карбаминовой кислоты (5,1 г, 19,87 ммоль) в ТГФ (60 мл). Через 30 мин при -78 С в течение 30 мин добавляют йод (7,6 г, 29,8 ммоль) в ТГФ (20 мл). Перемешивают в течение одного часа и затем нагревают до комнатной температуры. Гасят водой, экстрагируют в этилацетате насыщенным водным хлоридом натрия, высушивают над Na2SO4. Очищают путем колоночной хроматографии с применением 5-20% этилацетата в гексане и получают продукт (1 г). МС (ES)m/z 383 [М+1]+. Получение 39. 5-(1-азидоэтил)-2-фторпиридин В 1-л колбу, охлаждаемую в ледяной бане, добавляют трифенилфосфин (27,9 г, 106,3 ммоль), 1,4 циклогексадиен-1,2-дикарбонитрил, 4,5-дихлор-3,6-диоксо (24,12 г, 106,3 ммоль). При перемешивании медленно добавляют дихлорметан (150 мл). К темному раствору медленно добавляют азид тетра-Nбутиламмония (30,23 г, 106,3 ммоль), а затем 1-(6-фторпиридин-3-ил)этанол (10 г, 70,85 ммоль), растворенный в дихлорметане (10 мл). Вынимают колбу из ледяной бани и перемешивают при комнатной температуре в течение одного часа. На роторном испарителе удаляют растворитель и очищают путем нормально-фазовой хроматографии с применением 5-20% этилацетата в гексане с получением продукта в виде бесцветного масла (7,75 г). ГХМС (EI) m/z 166 М+.(4,2 кг/см 2) в этаноле (200 мл) в присутствии PtO2 (6 вес.%). Через 4 ч смесь фильтруют, удаляют растворитель на роторном испарителе и образовавшееся масло высушивают в вакууме с получением продукта(3,149 г). ГХМС (EI) m/z 140 М+. Получение 41. Трет-бутиловый эфир [1-(6-фторпиридин-3-ил)этил]карбаминовой кислоты К раствору 1-(6-фторпиридин-3-ил)этиламина (14,86 г, 10 6,01 ммоль) в ацетонитриле (100 мл) добавляют диизопропилэтиламин (37 мл, 212 ммоль) и ди-трет-бутилдикарбонат (46,27 г, 212 ммоль). Смесь перемешивают в течение ночи. Промывают насыщенным NaHCO3, экстрагируют в дихлорметане,промывают насыщенным водным хлоридом натрия, высушивают над Na2SO4. Очищают путем колоночной хроматографии с применением 10-70% этилацетата в гексане и получают продукт в виде твердого вещества белого цвета (20 г). МС (ES) m/z 241 [М+1]+. Получение 42. Трет-бутиловый эфир [1-(6-фтор-4-йодпиридин-3-ил)этил]карбаминовой кислоты Добавляют раствор трет-бутилового эфира [1-(6-фторпиридин-3-ил) этил] карбаминовой кислоты(9,3 г, 38,8 ммоль) в сухом ТГФ (90 мл) в трет-бутиллитий (68,4 мл, 116,3 ммоль, 1,7 М раствор в пентане) в сухом ТГФ (70 мл) в течение 15 мин в атмосфере N2 при -78 С. Перемешивают при -78 С в течение одного часа. Добавляют раствор йода (14,8 г, 58,2 ммоль) в сухом ТГФ (90 мл) в течение 15 мин. Перемешивают при -78 С в течение 2 ч. Нагревают до 0 С. Добавляют воду. Нагревают до комнатной температуры. Экстрагируют этилацетатом. Органическую фазу промывают раствором Na2CO3, водой и насыщенным водным хлоридом натрия и высушивают над MgSO4. После фильтрации неочищенный продукт концентрируют и очищают путем флэш-хроматографии (5-20% этилацетат/гексан). Получают требуемый продукт, трет-бутиловый зфир [1-(6-фтор-4-йодпиридин-3-ил)этил]карбаминовой кислоты (2,8 г, 20%),МС (ES) m/z 367 [М+1]+. Получение 43. Трет-бутиловый эфир этил-[1-(6-фтор-4-йодпиридин-3-ил)этил]карбаминовой кислоты Гидрид натрия (84,0 мг, 2,1 ммоль, 60% дисперсия в минеральном масле) добавляют к раствору трет-бутилового эфира(10 мл). Перемешивают при комнатной температуре в течение 30 мин. Добавляют йодэтан (0,2 мл, 2,1 ммоль). Перемешивают в течение одного часа. Реакцию гасят водой. Экстрагируют СН 2 Сl2. Органическую фазу промывают водой и насыщенным водным хлоридом натрия. Высушивают над MgSO4. После фильтрации получают неочищенный продукт, трет-бутиловый эфир этил-[1-(6-фтор-4-йодпиридин-3 ил)этил]карбаминовой кислоты (0,4 г, 97%) с 90% чистотой согласно ВЭЖХ, МС (ES) m/z 395 [М+1]+. Следующие соединения получают с помощью процедур, аналогичных процедурам получения третбутилового эфира этил-[1-(6-фтор-4-йодпиридин-3-ил)этил]карбаминовой кислоты. Получение 45. 2-Фтор-4-йод-3-метоксиметоксиметилпиридин Хлорметилметиловый эфир (2 г, 25,0 ммоль) постепенно добавляют к раствору 2-фтор-4 йодпиридин-3-ил)метанола (1,0 г, 3,95 ммоль) и N,N-диизопропилэтиламина (5 г, 39 ммоль) в дихлорметане (5 мл). Смесь перемешивают при комнатной температуре в течение ночи. Смесь разбавляют хлороформом. Органическую фазу промывают насыщенным водным хлоридом натрия и водой. Смесь высушивают над сульфатом натрия. Раствор концентрируют в вакууме до получения масла коричневого цвета. Очищают путем колоночной хроматографии (10% метанол в дихлорметане) с получением указанного в названии соединения (0,90 г, 77%) в виде масла желтого цвета. MС (ES) m/z 298 [M+1]+. Получение 46. 5-Циклопропил-2-фторпиридин В колбе смешивают 2-фтор-5-йодпиридин (1,12 г, 5 ммоль), циклопропилбороновую кислоту (645 мг, 7,5 ммоль), палладий ацетат (56 мг, 0,25 ммоль), фосфат калия (3,2 г, 15 ммоль) и смесь толуол-вода(20:1, 21 мл). Смесь нагревают при 100 С в течение 4 ч. Смесь разбавляют хлороформом-изопропанолом(3:1, 100 мл). Органическую фазу промывают насыщенным водным хлоридом натрия и водой. Смесь высушивают над сульфатом натрия. Раствор концентрируют в вакууме до получения масла коричневого цвета. Очищают путем колоночной хроматографии (20% зтилацетат в гексане) с получением указанного в названии соединения (430 мг, 63%) в виде масла бледно-желтого цвета. 1 Н-ЯМР (400 МГц, CDCl3)7,99 (д, J = 3 Гц, 1 Н), 7,39 (тд, J = 3, 5 Гц, 1 Н) , 6,79 (дд, J = 3, 8 Гц, 1 Н),0,96-1,02 (м, 2 Н), 0,63-0,69 (м, 2 Н). Получение 47. 5-Циклопропил-2-фтор-3-йодпиридин Раствор 5-циклопропил-2-фторпиридина (1,3 г, 9,5 ммоль) в ТГФ (20 мл) охлаждают до -75 С в бане с сухим льдом-ацетоном в атмосфере азота. Добавляют диизопропиламид лития (2M В ТГФ, 6 мл, 12-9 016178 ммоль) в течение 30 мин. Смесь дополнительно перемешивают в течение 3 ч. Добавляют йод (2,9 г, 11,4 ммоль, растворенный в 50 мл ТГФ) и смесь перемешивают в течение 2 ч. Добавляют воду (100 мл) и при перемешивании дают температуре подняться до комнатной температуры в течение 1 ч. Обрабатывают смесь насыщенным водным раствором тиосульфата натрия (50 мл). Раствор экстрагируют эфиром. Раствор концентрируют в вакууме до образования масла коричневого цвета. Очищают путем колоночной хроматографии (гексан - 20% этилацетат в гексане) с получением указанного в названии соединения (1,7 г, 68%) в виде масла желтого цвета. 1 Н-ЯМР (400 МГц, CDCl3)8,03 (дд, J = 3, 8 Гц, 1 Н), 7,99 (с, 1 Н), 0,91-1,00 (м, 2 Н), 0,71-0,78 (м,2 Н). Получение 48. 5-Циклопропил-2-фтор-4-йодпиридин Раствор 5-циклопропил-2-фтор-3-йодпиридина (1,7 г, 6,5 ммоль) в ТГФ (20 мл) охлаждают до -75 С в бане с сухим льдом-ацетоном в атмосфере азота. Добавляют диизопропиламид лития (2 М в ТГФ, 3,9 мл, 7,8 ммоль) в течение 30 мин. Перед добавлением воды (100 мл) смесь перемешивают в течение еще 3 ч. Затем позволяют температуре подняться до комнатной температуры в течение 1 ч при перемешивании. Раствор экстрагируют эфиром. Раствор концентрируют в вакууме до образования масла коричневого цвета. Масло очищают путем колоночной хроматографии (гексан - 15% этилацетат в гексане) с получением продукта в виде масла желтого цвета (1,1 г, 65%). Получение 49. 4-(4-бензо[b]тиофен-7-ил-6-фторпиридин-3-илметил)морфолин Смешивают 4-(6-фтор-4-йодпиридин-3-илметил)морфолин (0,48 г, 1,5 ммоль), 2-бензо[b]тиофен-7 ил-4,4,5,5-тетраметил[1,3,2]диоксаборолан (0,47 г, 1,8 ммоль) и карбонат натрия (0,39 г, 3,75 ммоль) вCH3CN (8 мл) и воде (4 мл). Смесь продувают азотом в течение 5 мин. Добавляют [1,1'бис(дифенилфосфино)ферроцен]дихлорпалладий(II), комплекс с дихлорметаном (1:1) (5,0 мг, 0,6 ммоль) и дополнительно продувают азотом в течение 5 мин. Смесь нагревают при 120 С в течение 10 мин в микроволновом реакторе и охлаждают до комнатной температуры. Реакционную смесь разбавляют этилацетатом, промывают водой и насыщенным водным хлоридом натрия. Органическую фазу отделяют и высушивают над сульфатом магния. Фильтруют и концентрируют в вакууме с получением неочищенной смеси. Очищают путем колоночной хроматографии (0,1-1% 2 М аммиак в метаноле/дихлорметане) с получением указанного в названии соединения (0,43 г, 87%). МС (ES) m/z 329 [М+1]+. Следующие соединения получают, применяя процедуру, аналогичную процедуре получения 4-(4 бензо[b]тиофен-7-ил-6-фторпиридин-3-илметил)морфолина и используя подходящий исходный материал.(10 мл) в круглодонной колбе добавляют гидразиновую соль муравьиной кислоты (1:1) и 0,5 г никеля Ренея. Смесь перемешивают в течение 3 ч при комнатной температуре. Выливают реакционную смесь,разбавленную раствором карбоната натрия. Продукт извлекают в хлороформ и промывают водой и насыщенным водным хлоридом натрия. Отделяют органическую фазу от водной фазы и высушивают надNa2SO4. После фильтрации органический растворитель выпаривают в вакууме с получением требуемого продукта в виде твердого вещества желтого цвета (530 мг, 100%). МС (ES) m/z 273 [М+1]+.[1-(4-бензо[b]тиофен-7-ил-6-фторпиридин-3 ил)этил]карбаминовой кислоты К раствору 1- (4-бензо[b]тиофен-7-ил-6-фторпиридин-3-ил)этиламина (530 мг, 1,9 ммоль) в диоксане (30 мл) и воде (10 мл) в круглодонной колбе добавляют ди-трет-бутилдикарбонат (647 мг, 2,9 ммоль). Смесь перемешивают в течение 2 ч при комнатной температуре. Реакционную смесь выливают в хлороформ и промывают водой и насыщенным водным хлоридом натрия. Отделяют органическую фазу от водной фазы и высушивают над Na2SO4. После фильтрации выпаривают органический растворитель в вакууме и получают неочищенный продукт. Неочищенный продукт очищают путем флэшхроматографии (гексан - 20% этилацетата в гексане) с получением требуемого продукта в виде твердого вещества белого цвета (550 мг, 76%). МС (ES) m/z 373 [М+1]+. Получение 59. 4-Бензо[b]тиофен-7-триметилсилилэтинил-1-пиридин 4-хлор-3-триметилсилилэтинилпиридин (1,0 г, 4,78 ммоль) добавляют к раствору ТГФ:Н 2 О, добавляют карбонат калия(1,97 г,14,3 ммоль) и 2-бензо[b]тиофен-7-ил-4,4,5,5 тетраметил[1,3,2]диоксаборолан (1,49 г, 5,72 ммоль). Реакционную смесь дегазируют в течение 30 мин. Добавляют Pd катализатор (0,218 г, 0,2 ммоль) и три(трет-бутилфосфино)тетрафторборат (0,120 г, 0,4 ммоль) в атмосфере N2. Реакционную смесь нагревают при 80 С в течение 2 ч. Весь ТГФ выпаривают в вакууме, разбавляют реакционную смесь этилацетатом и промывают насыщенным водным хлоридом натрия, экстрагируют органическую фазу и высушивают над Na2SO4. Фильтруют и концентрируют в вакууме, пропускают неочищенный продукт через колонку с силикагелем (60-120 меш) и получают чистое соединение. Выход (0,7 г, 48%), МС (ES) m/z 308[М+1]+. Получение 60. 4-4-[2-(2-Хлорпиримидин-4-ил)бензо[b]тиофен-7-ил]-6-фторпиридин-3-илметилморфолин Раствор А. В атмосфере азота при -78 С смешивают 4-(4-бензо[b]тиофен-7-ил-6-фторпиридин-3 илметил)морфолин (0,43 г, 1,31 ммоль) и триизопропилборат (0,43 г, 2,63 ммоль) в сухом ТГФ (5 мл). Добавляют 1,5 М литий диизопропиламид моно(ТГФ) в циклогексане (2,2 мл, 3,28 ммоль) в атмосфере азота. Перемешивают в атмосфере азота при -78 С в течение одного часа и нагревают реакцию до комнатной температуры. Раствор В. Смешивают 2,4-дихлорпиримидин (0,29 г, 1,97 ммоль), 2-(ди-трет-бутилфосфо)бифенил (0,01 г,0,04 ммоль) и карбонат натрия (0,42 г, 3,94 ммоль) в ТГФ (7 мл) и воде (3 мл). Продувают азотом в течение 5 мин. Добавляют [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий (II), комплекс с дихлорметаном (1:1) (0,05 г, 0,07 ммоль). Смесь нагревают при 60 С в атмосфере азота. Добавляют по каплям через шприц раствор А к раствору В в течение 20 мин. Нагревают реакционную смесь в течение одного часа при 60 С в атмосфере азота и охлаждают до комнатной температуры. Реакционную смесь разбавляют этилацетатом, промывают водой и насыщенным водным хлоридом натрия. Органическую фазу отделяют и высушивают над сульфатом магния. Фильтруют и концентрируют в вакууме с получением неочищенного продукта. Очищают путем колоночной хроматографии [0,1-1% 2M аммиак в метаноле/дихлорметане] с получением указанного в названии соединения (0,42 г, 73%). MС(ES) m/z 441 [М+1]+. Следующие соединения получают по существу согласно способу получения 4-4-[2-(2 хлорпиримидин-4-ил)бензо[b]тиофен-7-ил]-6-фторпиридин-3-илметилморфолина, применяя подходящий исходный материал. Получение 75. Трет-бутиловый эфир (2-азидокарбонилэтил)карбаминовой кислоты По каплям добавляют этилхлорформиат (2,52 г, 23,25 ммоль) к раствору 3-третбутоксикарбониламинопропионовой кислоты (4 г, 21,14 ммоль) и 4-метилморфолина (2,35 г, 23,25 ммоль) в ТГФ (60 мл) при -20 С. Через 40 мин суспензию нагревают до -5 С и добавляют по каплям раствор азида натрия (3,44 г, 52,85 ммоль) в воде (10 мл). Через 10 мин смесь разбавляют этилацетатом (60 мл) и промывают водой, насыщенным водным хлоридом натрия, и высушивают над MgSO4. После фильтрации органический растворитель удаляют и получают продукт в виде прозрачного масла (4,3 г,95%). 1H-ЯМР (ДМСО-d6)6,91 (шир.с, 1 Н), 3,18 (кв., J = 6,4 Гц, 2 Н), 2,51-2,48 (м, 2 Н), 1,37 (с, 9 Н). Получение 76. Трет-бутиловый эфир (2-изоцианатоэтил)карбаминовой кислоты Перемешивают раствор трет-бутилового эфира (2-азидокарбонилэтил)карбаминовой кислоты (4,3 г,20,07 ммоль) в толуоле (50 мл) при 65 С в течение 25 мин, пока не прекратится выделение газа N2. Раствор охлаждают. 1 Н-ЯМР (ДМСО-d6)7,06 (шир.с, 1 Н), 3,33-3,29 (м, 2 Н), 3,12 (кв., J = 5,8 Гц, 2 Н), 1,39 (с, 9 Н). Получение 77. Трет-бутиловый эфир 2-[3-(2,2-диэтоксиэтил)уреидо]этилкарбаминовой кислоты 2,2-диэтоксиэтанамин (3,33 г, 25,04 ммоль) добавляют к раствору трет-бутилового эфира (2 изоцианатоэтил)карбаминовой кислоты (3,73 г, 20,03 ммоль) в толуоле (50 мл). Через 1 ч смесь концентрируют с получением твердого вещества белого цвета (6,39 г). 1H-ЯMР (ДМСО-d6)6,74 (т, J = 5 Гц, 1 Н), 6,03 (т, J = 5,6 Гц, 1 Н), 5,85 (т, J = 5,8 Гц, 1 Н), 4,39 (т, J = 5,4 Гц, 1 Н), 3,61-3,55 (м, 2 Н), 3,48-3,42 (м, 2 Н), 3,06 (т, J = 5,7 Гц, 2 Н), 3,01 (кв., J = 6,2 Гц, 2 Н), 2,92 (кв.,J = 6,2 Гц, 2 Н), 1,37 (с, 9 Н), 1,11 (т, J = 6,4 Гц, 6 Н). Получение 78. Трет-бутиловый эфир [2-(2-оксо-2,3-дигидроимидазол-1-ил)этил]карбаминовой кислоты Трет-бутиловый эфир 2-[3-(2,2-диэтоксиэтил)уреидо]этилкарбаминовой кислоты (6,5 г, 20,35 ммоль) растворяют в метаноле (75 мл) и воде (40 мл). К реакционной смеси по каплям добавляют НСl(0,4 М, 50 мл), и концентрируют в вакууме. Остаток экстрагируют в хлороформе и промывают насыщенным водным хлоридом натрия, высушивают над MgSO4, фильтруют и удаляют растворитель на роторном испарителе с получением неочищенного твердого вещества белого цвета. Очищают путем колоночной хроматографии с применением 1-10% МеОН в дихлорметане и получают чистый продукт в виде твердого вещества белого цвета (2,53 г, 11,13 ммоль). ГХМС (EI) m/z 227 М+. Получение 79. 1-(2-Аминоэтил)-1,3-дигидроимидазол-2-он; соединение с трифторуксусной кислотой Трифторуксусную кислоту (10 мл) добавляют к раствору трет-бутилового эфира [2-(2-оксо-2,3 дигидроимидазол-1-ил)этил]карбаминовой кислоты (2,5 г, 11 ммоль) в дихлорметане (10 мл). Смесь перемешивают в течение 3 ч. Удаляют большую часть растворителя и трифторуксусной кислоты на роторном испарителе и желтоватое густое масло высушивают в вакууме с получением продукта. ГХМС (EI)m/z 127 М+. Получение 80. Трет-бутиловый эфир 1-[6-фтор-4-(2-5-фтор-2-[2-(2-оксо-2,3-дигидроимидазол-1 ил)этиламино]пиримидин-4-илбензо[b]тиофен-7-ил)пиридин-3-ил]этилкарбаминовой кислоты В трубке высокого давления смешивают трет-бутиловый эфир (1-4-[2-(2-хлор-5-фторпиримидин 4-ил)бензо[b]тиофен-7-ил]-6-фторпиридин-3-илэтил)карбаминовой кислоты (150 мг, 0,3 ммоль), 1-(2 аминоэтил)-1,3-дигидроимидазол-2-он (70 мг, 0,55 ммоль) и триэтиламин (80 мг, 0,8 ммоль) в Nметилпирролидоне (1,0 мл). Реакционную смесь нагревают при 130 С в течение одного часа в микроволновом реакторе и затем охлаждают до комнатной температуры. Реакционную смесь разбавляют этилацетатом и промывают водой и насыщенным водным хлоридом натрия. Отделяют органическую фазу от водной фазы и высушивают над MgSO4. После фильтрации выпаривают органический растворитель и получают неочищенный продукт. Неочищенный продукт очищают путем колоночной хроматографии(10% метанол в дихлорметане) и получают требуемый продукт (80 мг, 74%). МС (ES) m/z 538 [M+t-Bu]+,494 [М-Вос]-, 616 [M+Na]+. Получение 81. 2-Хлор-4-[7-(3-триметилсиланилэтинилпиридин-4-ил)бензо[b]тиофен-2 ил]пиримидин 2,4-дихлорпиримидин (0,29 г, 1 ммоль) и карбонат натрия (2,0 М, 0,273 г, 2,6 ммоль) добавляют к раствору ТГФ в круглодонной колбе. Реакционную смесь дегазируют в течение 30 мин и добавляют Pd катализатор (0,053 г, 0,06 ммоль) и затем нагревают реакционную смесь с обратным холодильником в течение 1,5 ч. Одновременно в другую круглодонную колбу в атмосфере N2 добавляют 4 бензо[b]тиофен-7-триметилсилилэтинил-1-пиридин (0,40 г, 1,3 ммоль), добавляют трис-изопропилборат(0,59 мл, 2,5 ммоль) при комнатной температуре. Добавляют по каплям литий диизопропиламид (1,9 мл,3,8 ммоль) при -78 С. Перемешивают раствор в течение 1,5 ч при -78 С. Через 1,5 ч добавляют вышеупомянутый раствор к первой орошаемой реакционной смеси. Вновь нагревают с обратным холодильником реакционную смесь в течение еще 2 ч. Весь ТГФ выпаривают в вакууме и экстрагируют реакционную смесь, помещая ее в этилацетат и промывая насыщенным водным хлоридом натрия. Высушивают органическую фазу над Na2SO4, фильтруют и концентрируют в вакууме с получением неочищенного соединения. Пропускают неочищенный продукт через колонку с силикагелем (60-120 меш) и элюируют чистое соединение. Выход (0,180 г, 33%). 1H-ЯMР (400 МГц, CDCl3)8,863 (с, 1 Н), 8,663 (д, J=4,8 Гц, 1 Н), 8,621 (д, J=5,6 Гц, 1 Н), 8,207 (с,1 Н), 7,832 (д, J=7,6 Гц, 1 Н), 7,595 (т, J=5,6 Гц, 3 Н), 7,508 (т, J=7,6 Гц, 1 Н), 0,286 (с, 9 Н); МС (ES) m/z 420,17 [M+1]+. Следующее промежуточное соединение получают с помощью процедур, аналогичных применяемым для получения 2-хлор-4-[7-(3-триметилсиланилэтинилпиридин-4-ил)бензо[b]тиофен-2 ил]пиримидина. Следующие промежуточные соединения получают по существу согласно способу получения 1-(24-[7-(5-диметиламинометил-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2-иламиноэтил)имидазолидин-2-она, применяя подходящий исходный материал. Получение 91. 1-(2-[4-[7-(3-триметилсиланилэтинилпиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин 2-иламино)этилимидазолидин-2-он 2-хлор-4-[7-(3-триметилсиланилэтинилпиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин (0,180 г, 0,4 ммоль) помещают в запаянную трубку и добавляют к нему н-бутанол (2 мл). Добавляют N-2 аминоэтилимидазолидин-2-он (0,103 г, 0,8 ммоль). Трубку запаивают и нагревают в масляной бане в течение 4-5 ч при 120 С. Реакционную смесь концентрируют при пониженном давлении, и неочищенный продукт очищают путем колоночной хроматографии. Выход (0,1 г, 49%); 1H-ЯМР (400 МГц, ДMCО-d6)8,832 (с, 1 Н), 8,725 (д, J=5,2 Гц, 1 Н), 8,394 (с, 1 Н), 8,369 (с, 1 Н),8,015 (д, J=8,8 Гц, 1 Н), 7,711 (д, J=5,2 Гц, 1 Н), 7,552 (м, 2 Н), 7,356 (с, 1 Н), 7,272 (д, J=4,8 Гц, 1 Н), 6,288 (с,1 Н), 3,185 (м, 4 Н), 0,286 (с, 9 Н) ; MС (ES) m/z 513 [М+1]+. Следующее промежуточное соединение получают с помощью процедур, аналогичных применяемым для получения 1-(2-[4-[7-(3-триметилсиланилэтинилпиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин 2-иламино)этилимидазолидин-2-она. Получение 93 1-(2-5-фтор-4-[7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензо[b]тиофен-2-ил]пиримидин-2 иламиноэтил)имидазолидин-2-он В колбе смешивают 7-1-2-[4-(7-бромбензо[b]тиофен-2-ил)-5-фторпиримидин-2 иламино]этилимидазолидин-2-он (5,5 г, 12,6 ммоль), бис(пинаколато)дибор (3,84 г, 15,3 ммоль), (1,1'бис(дифенилфосфино)ферроцен)дихлорпалладий(II) (1,0 г, 1,3 ммоль), ацетат калия (2,5 г, 25 ммоль) в ДМСО (80 мл). Через смесь барботируют азот в течение 10 мин. Колбу запаивают, помещают в масляную баню и нагревают при 85 С в течение ночи. Смесь разбавляют хлороформом/изопропиловым спиртом (3/1). Раствор промывают насыщенным водным хлоридом натрия. Раствор высушивают над сульфатом натрия. Раствор концентрируют в вакууме до образования темного остатка. Остаток очищают путем колоночной хроматографии (гексан - 20% этилацетат в гексане -10% метанол в дихлорметане) с получением продукта в виде твердого вещества коричневого цвета (5 г, 82%). МС (ES) m/z 484 [М+1]+. Следующие соединения получают с помощью процедур, аналогичных описанным для получения 1(2-5-фтор-4-[7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензо[b]тиофен-2-ил]пиримидин-2 иламиноэтил)имидазолидин-2-она.NaHCO3 (35 мг, 0,41 ммоль) в ДMСО (87 мл) и воде (3 мл). Смесь два раза продувают азотом в течение 5 мин. Смесь нагревают в масляной бане при 85 С в течение 1 ч. Охлаждают до комнатной температуры. Реакционную смесь разбавляют хлороформом/изопропиловым спиртом (93/1) и промывают водой и насыщенным водным хлоридом натрия. Отделяют органическую фазу от водной фазы и высушивают над сульфатом натрия. После фильтрации удаляют органический растворитель и получают неочищенную смесь. Неочищенный продукт очищают путем колоночной хроматографии (10% метанол в дихлорметане) с получением указанного в названии соединения (105 мг, 100%). МС ES) m/z 508 [M+1]+. Следующие промежуточные соединения получают с помощью процедур, аналогичных описанным для получения 1-(2-4-[7-(5-азидометил-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2 иламиноэтил)имидазолидин-2-она. Получение 102. Трет-бутил-1-6-хлор-4-(2-(5-фтор-2-(2-(2-оксоимидазолидин-1 ил)этиламино)пиримидин-4-ил)бензо[b]тиофен-7-ил)пиридин-3-ил)этилкарбамат В микроволновом сосуде смешивают трет-бутиловый эфир [1-(6-хлор-4-йодпиридин-Зил)этил]карбаминовой кислотыNaHCO3 (110 мг, 1,31 ммоль) в ацетонитриле (7 мл) и воде (3 мл). Смесь продувают азотом в течение 5 мин. Смесь нагревают при 100 С в течение 15 мин в микроволновой печи. Удаляют растворитель на роторном испарителе. Очищают путем нормально-фазовой колоночной хроматографии, применяя 0,5-5% МеОН в дихлорметане, и выделяют продукт в виде твердого вещества белого цвета (220 мг). МС (ES)- 15016178 Получение 103. Трет-бутил-(6-фтор-4-(2-(5-фтор-2-(2-(2-оксо-2,3-дигидро-1 Н-имидазол-1 ил)этиламино)пиримидин-4-ил)бензо[b]тиофен-7-ил)пиридин-3-ил)метил(метил)карбамат Смешивают трет-бутиловый эфир 4-[2-(2-хлор-5-фторпиримидин-4-ил)бензо[b]тиофен-7-ил]-6 фторпиридин-3-илметилметилкарбаминовой кислоты (0,52 г, 1,04 ммоль) и триэтиламин (0,87 мл, 6,24 ммоль) в н-бутаноле (10,0 мл). Добавляют 1-(2-аминоэтил)-1,3-дигидроимидазол-2-он; соединение с трифторуксусной кислотой (0,75 г, 3,12 ммоль). Реакционную смесь нагревают при 120 С в течение 54 ч для завершения реакции, затем охлаждают до комнатной температуры. Удаляют растворитель на роторном испарителе с получением неочищенного продукта. Неочищенный продукт очищают путем колоночной хроматографии (0,5-6% 2 М NH3 в метанольном растворе в дихлорметане) и получают требуемый продукт (0,28 г). МС (ES) m/z 594 [М+1]+. Примеры Пример 1. 1-(2-4-[7-(5-диметиламино)метил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5 фторпиримидин-2-иламиноэтил)имидазолидин-2-он Смешивают 4-[2-(2-хлор-5-фторпиримидин-4-ил)бензо[b]тиофен-7-ил]-6-фторпиридин-3 илметилдиметиламин (0,25 г, 0,59 ммоль) и триэтиламин (0,25 мл, 1,78 ммоль) в н-бутаноле (8,0 мл). Добавляют 1-(2-аминоэтил)имидазолидин-2-он (0,23 г, 1,78 ммоль). Реакционную смесь нагревают при 120 С в течение ночи (15 ч), затем охлаждают до комнатной температуры. Реакционную смесь разбавляют этилацетатом и промывают водой и насыщенным водным хлоридом натрия. Органическую фазу отделяют от водной фазы и высушивают над MgSO4. После фильтрации удаляют органический растворитель и получают неочищенный продукт. Неочищенный продукт очищают путем колоночной хроматографии (0,5-10% 2 н. NH3 в метанольном растворе/дихлорметане) с получением указанного в названии соединения (0,19 г, 63%). МС (ES) m/z 510 [М+1]+. Следующие соединения получают по существу согласно способу получения 1-(2-4-[7-(5 диметиламино)метил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2-иламиноэтил)имидазолидин-2-она, применяя подходящий исходный материал. Следующие примеры получают с помощью процедур, аналогичных описанным для получения 1-(24-[7-(5-азидометил-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2-иламиноэтил)имидазолидин-2-она.[4-(2-5-фтор-2-[2-(2-оксоимидазолидин-1-ил)этиламино]пиримидин-4 илбензо[b]тиофен-7-ил)-6-фторпиридин-3-илметил]метилкарбаминовой кислоты (0,19 г, 0,32 ммоль) растворяют в сухом СН 2 Сl2 (1,4 мл) и CF3COOH (1,4 мл). Перемешивают при комнатной температуре в течение одного часа. Полностью удаляют растворитель. Соль трифторуксусной кислоты разбавляют СН 2 Сl2. Промывают насыщенным раствором NaHCO3, водой и насыщенным водным хлоридом натрия. Высушивают посредством MgSO4. После фильтрации удаляют растворитель. Высушивают в вакууме в течение ночи с получением указанного в названии соединения (0,12 г, 78%). МС (ES) m/z 495 [M+1]+. Следующие примеры получают с помощью процедур, аналогичных описанным для получения 1-(25-фтор-4-[7-(2-фтор-5-метиламинометилпиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2-иламиноэтил)имидазолидин-2-она. Трифторуксусную кислоту (1 мл) добавляют к раствору трет-бутилового эфира [6-фтор-4-(2-5 фтор-2-[2-(2-оксо-2,3-дигидроимидазол-1-ил)этиламино]пиримидин-4-илбензо[b]тиофен-7-ил)пиридин 3-илметил]метилкарбаминовой кислоты (280 мг, 0,47 ммоль) в дихлорметане (1 мл). Перемешивают в течение одного часа и удаляют растворитель на роторном испарителе. Промывают насыщенным NaHCO3 и экстрагируют в дихлорметане, промывают насыщенным водным хлоридом натрия, высушивают надNa2SO4, и фильтруют. Удаляют растворитель на роторном испарителе с получением твердого вещества и высушивают в вакууме с получением продукта (196 мг). МС (ES) m/z 494 [М+1]+. Пример 24. 1-2-[5-фтор-4-(7-2-фтор-5-[(3,3,3-трифторпропиламино)метил]пиридин-4-илбензо[b]тиофен-2-ил)пиримидин-2-иламино]этилимидазолидин-2-он[6-фтор-4-(2-5-фтор-2-[2-(2-оксоимидазолидин-1-ил)этиламино]пиримидин-4-илбензо[и]тиофен-7 ил)пиридин-3-илметил]-(3,3,3-трифторпропил)карбаминовой кислоты (0,136 г, 200,68 мкмоль) в дихлорметане (3 мл). Смесь перемешивают в течение ночи при комнатной температуре. Выпаривают растворитель и суспендируют образовавшееся твердое вещество в дихлорметане и обрабатывают 30% водным карбонатом калия. Органическую фазу промывают насыщенным водным хлоридом натрия и загружают органический раствор в колонку, заполненную 25 г силикагеля, с дихлорметаном и элюируют в колонку с 40 г силикагеля при градиенте дихлорметан-этилацетат и затем этилацетат - 10% метанол в этилацетате с получением указанного в названии соединения. Далее вещество очищают путем ВЭЖХ (условия- 19016178 ВЭЖХ: 38-42% CH3CN/10 мМ NH4HCO3, pH 10 при 20 мл/мин на XBride MS C18 19100 мм). Собирают соответствующие фракции и концентрируют полученный раствор. Остаток выпаривают совместно с двумя порциями абсолютного этанола, одной порцией толуола, и переносят в 10-мл круглодонную колбу с дихлорметаном. Переводят вещество в твердое агрегатное состояние, применяя совместное испарение дихлорметана-гексана с получением 45 мг указанного в названии соединения (39%) в виде твердого вещества желтого цвета. МС (ES) m/z 578 [М+1]+. Следующий пример получают с помощью процедур, аналогичных описанным для получения 1-2[5-фтор-4-(7-2-фтор-5-[(3,3,3-трифторпропиламино)метил]пиридин-4-илбензо[b]тиофен-2 ил)пиримидин-2-иламино]этилимидазолидин-2-она. К раствору 1-(2-4-[7-(5-азидометил-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин 2-иламиноэтил)имидазолидин-2-она (105 мг, 0,3 ммоль) в этаноле (10 мл) в круглодонной колбе добавляют 2 г гидразиновой соли муравьиной кислоты (1:1) и 0,5 г никеля Ренея. Смесь перемешивают в течение 3 ч при комнатной температуре. Выливают реакционную смесь, разбавленную раствором карбоната натрия. Продукт извлекают в хлороформ и промывают водой и насыщенным водным хлоридом натрия. Отделяют органическую фазу от водной фазы и высушивают над Na2SO4. После фильтрации органический растворитель выпаривают в вакууме с получением неочищенного продукта. Неочищенный продукт очищают путем колоночной флэш-хроматографии (хлороформ/метанол/гидроксид аммония, 7/3/0,05) с получением указанного в названии соединения в виде твердого вещества желтого цвета (0,50 мг, 53%). Разделяют 1-[2-(4-7-[5-(1-аминоэтил)-2-фторпиридин-4-ил]бензо[b]тиофен-2-ил-5-фторпиримидин-2-иламино)этил]имидазолидин-2-он (180 мг, 0,36 ммоль) способом хиральной ВЭЖХ (Chiralpak Пиридиний-п-толуолсульфонат (4,3 мг, 0,02 ммоль) добавляют к раствору 1-2-[5-фтор-4-(7-2 фтор-5-[2-(тетрагидропиран-2-илокси)этокси]пиридин-4-илбензо[b]тиофен-2-ил)пиримидин-2 иламино]этилимидазолидин-2-она (100 мг, 0,17 ммоль) в этаноле (4 мл). Смесь перемешивают при 55 С в течение ночи. Раствор охлаждают. Концентрируют раствор в вакууме до образования масла желтого цвета. Масло очищают путем колоночной хроматографии (метиленхлорид - 10% метанол в метиленхлориде) с получением указанного в названии соединения (75 мг, 87%) в виде твердого вещества светложелтого цвета. МС (ES) m/z 513 [М+1]+. Пример 30. 1-(2-(4-(7-(3-этинилпиридин-4-ил)бензо[b]тиофен-2-ил)пиримидин-2-иламино)этил)имидазолидин-2-он 1-(2-[4-[7-(3-триметилсиланилэтинилпиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2-иламино)этилимидазолидин-2-он (0,1 г, 0,19 ммоль) в метаноле помещают в круглоонную колбу. Добавляют карбонат калия (0,053 г, 0,38 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 20 мин. Выпаривают весь растворитель в вакууме. Экстрагируют соединение путем разбавления дихлорметаном и промывания водой. Высушивают соединение в вакууме (0,083 г, 40%). МС (ES) m/z 441,26 [М+1]+. Следующий пример получают с помощью процедур, аналогичных применяемым для получения 1(2-(4-(7-(3-этинилпиридин-4-ил)бензо[b]тиофен-2-ил)пиримидин-2-иламино)этил)имидазолидин-2-она.(220 мг, 0,36 ммоль) в дихлорметане (1 мл). Перемешивают в течение одного часа и удаляют раствори- 21016178 тель на роторном испарителе. Промывают насыщенным NаНСО 3 и экстрагируют в дихлорметане, промывают насыщенным водным хлоридом натрия, высушивают над Na2SO4 и фильтруют. Удаляют растворитель на роторном испарителе с получением твердого вещества и высушивают в вакууме с получением продукта (158 мг). MС (ES) m/z 512 [М+1]+. Разделяют продукт (90 мг, 0,18 ммоль) способом хиральной ВЭЖХ (Chiralpak AS-H, 100% МеОН/0,02% диметилэтаноламин/СO2, 5 мл/мин, 225 нм) и получают первый элюированный изомер (39 мг). МС (ES) m/z 512 [М+1]+. Примеры 33 и 34. S-1-(2-(4-(7-(5-(1-(этиламино)этил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил)-5 фторпиримидин-2-иламино) этил) имидазолидин-2-он и R-1-(2-(4-(7-(5-(1-(этиламино)этил)-2 фторпиридин-4-ил)бензо[b]тиофен-2-ил)-5-фторпиримидин-2-иламино)этил)имидазолидин-2-он(Chiralpak AD-H, 30% МеОН/0,2% изопропиламин/СO2, 5 мл/мин, 225 нм) и получают первую фракцию в виде S-энантиомера (58,4 мг, 38%) и вторую фракцию в виде R-энантиомера (58,4 мг, 38%). МС 1-(2-(5-фтор-4-(7-(2-фтор-5-(1-(метиламино)этил)пиридин-4-ил)бензо[b]тиофен-2-ил)пиримидин-2 иламино)этил)имидазолидин-2-он получают с помощью процедур, аналогичных описанным для получения 1-(2-5-фтор-4-[7-(2-фтор-5-метиламинометилпиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2 иламиноэтил)имидазолидин-2-она. Разделяют 1-(2-(5-фтор-4-(7-(2-фтор-5-(1-(метиламино)этил)пиридин-4-ил)бензо[b]тиофен-2-ил)пиримидин-2-иламино)этил)имидазолидин-2-он (196 мг, 0,38 ммоль) способом хиральной ВЭЖХ (Chiralpak AD-H, 40% EtOH (0,2% изопропиламин)/СО 2, 5 мл/мин, 225 нм) и получают первую фракцию в виде S-энантиомера (60,2 мг, 31%) и вторую фракцию в виде Rэнантиомера (58,9 мг, 30%). МС (ES) m/z 510 [М+1]+. Исследования Было показано, что Plk1 характеризуется чрезмерной экспрессией во многих человеческих опухолях, таких как немелкоклеточный рак легких, опухоль носоглотки, пищевода, желудка, меланома, эпидермальная карцинома кожи, рак молочной железы, яичника, эндометрия, прямой кишки, нейроглиома,глиобластома, тириоидная карцинома, рак шейки матки, поджелудочной железы, предстательной желе- 22016178 зы, гепатобластома и неходжкинская лимфома. Кроме того, Plk1 экспрессия имеет прогностическое значение при немелкоклеточном раке легкого, опухоли носоглотки, раке пищевода, меланоме, колоректальном раке, гептобластоме и не-ходжкинской лимфоме (Strebhardt, К. и A. Ullrich. Nature Reviews Cancer 6(4): 321-30 (2006. Plkl фосфорилированные субстраты регулируют ход митоза путем координирования созревания центросомы, вступления в митоз, разделения сестринских хроматид и цитокинеза (Eckerdtand Strebhardt 2006; Strebhardt and Ullrich 2006; van de Weerdt, B. C. and R. H. Medema. Cell Cycle 5(8): 853-64 (2006. При подавлении Plkl функции при использовании введения антитела, экспрессии доминантной негативной Plk1 и подавление с помощью несенсорной мРНК приводят к возникновению однополярных веретен деления и задержке анафазы, что приводит к гибели митотических клеток в опухолевых клеточных линиях, но обратимой задержке G2 в нормальных неизмененных первичных клеточных линиях. Кроме того, сообщается, что Plk можно применять при лечении рабдоидных опухолей (Morozov A.,et al., Clinical Cancer Research. 13 (16) : 4721-30, (15 августа 2007 г.). Соединение ВI-2536 демонстрировало активность в доклинических моделях, использующих ксенографтные опухоли мыши НСТ 116, А 549 и NCIH460 (Baum, A., P. Garin-Chesa, et al. (2006). С 191 In vivoAACR-NCI-EORTC International Conference on "Molecular Targets and Cancer Therapeutics", Philadelphia,PA). Результаты следующих исследований подтверждают, что указанные соединения согласно настоящему изобретению можно применять в качестве противораковых агентов. Экспрессия и очистка Plk1 кДНК гена Plk1 человека, которую можно получить из многих источников, таких как Incyte (инвентарный номер: NM005030), может быть непосредственно связана на одном из своих концов с полинуклеотидной последовательностью, экспрессирующей маркер His6, например, С-концевой маркер FLAGHis6, и встроена в подходящий экспрессионный вектор, такой как вектор pFastBac (Invitrogen), и трансфецирована в подходящую систему, такую как бакуловирус, подобно тому, как было описано в Yue-WeiQian, et al., Science, 282, 1701 (1998) для xPlkkl. В случае применения системы вирусной экспрессии, вирус (например, бакуловирус, несущий маркерную полинуклеотидную конструкцию Plkl-Flag-His6) вводили в культуру подходящей клетки хозяина, такой как клетки Sf9. Когда экспрессировалось достаточное количество белка слияния Plkl-Flag-His6, например, примерно через 46 ч после инфецирования,культуру обрабатывали окадиковой кислотой (0,1 мкМ) в течение достаточного периода времени (например, 3 ч). Белки слияния Plkl-Flag-His6 очищали от остатков клеток, применяя металоаффинную смолу, такую как TALON (Clontech, каталог 635503), способами, хорошо известными в данной области. Очищенные белки слияния Plkl-Flag-His6 хранили до применения в маленьких аликвотах в подходящей среде, такой как 10 мМ HEPES, 150 мМ NaCl, 0,01% TRITON X-100, 1 мМ дитиотреитол (DTT), 10% глицерин, рН 7,5, при -80 С. Идентичность очищенного маркерного белка слияния Plk1-Flag-His6 подтверждали с помощью MALDI (лазерная десорбция/ионизация из матрицы). Экспрессия и очистка GST-Cdc25C(1-206) Для кДНК гена Cdc25C человека, которую можно получить из множества источников, таких какIncyte (инвентарный номер: AY497474), можно провести экспрессию в любой подходящей системе экспрессии, после чего произвести очистку хорошо известными способами, аналогичными тем, которые описаны Bin Ouyang et al, Oncogene, 18, 6029-6036 (1999). Одна подходящая система включает рост в течение ночи при 18 С Е. coli BL21, трансформированной посредством вектора pGEX-2T (Amersham) , в который была встроена кДНК гена Cdc25C человека для индукции экспрессии посредством 1 мМ изопропил-бета-D-тиогалактопиранозид. Экспрессируемый белок GST-Cdc25C (1-206), субстрат для Plk1,можно очистить с помощью GLUTATHIONE SEPHAROSE 4B и хранить в маленьких аликвотах в подходящем растворе, таком как 10 мМ HEPES, 100 мМ NaCl, рН 7,5 при -80 С. Исследование ингибирования Plkl Киназная реакция Plkl содержит маркерный фермент слияния Plkl-Flag-His6 (0,2 нг/мкл) в буфере,содержащем 50 мМ HEPES, рН 7,3, 1,0 мМ дитиотреитол, 5,0 мкМ АТР, 10 мМ МgСl2, 0,01% TRITON Х-100, 0,4 Ci 33P-ATP, и 0,06 мкг/мкл пептид GST-Cdc25c (1-206). Соединения брали в виде 10 мМ исходных растворов в ДМСО. Соединения серийно разбавляли 1:3 в 20% ДМСО с целью построения кривой концентрационного ответа на основе 10 точек и затем разбавляли 1:5 (от 20 мкМ до конечной концентрации 0,001 мкМ при 4% конечной концентрации ДМСО) в реакционной смеси для определения активности соединения. Реакцию проводили при комнатной температуре в течение 60 минут и затем прекращали путем добавления 60 мкл 10,0% Н 3 РО 4. Реакционную смесь (85 мкл) переносят в 96 луночный планшет с фосфоцеллюлозным фильтром, предварительно смоченный 30 мкл 10,0% Н 3 РО 4,инкубируют при комнатной температуре в течение 20-30 минут и затем промывают 3 раза 0,5% Н 3 РО 4. Перед добавлением 40 мкл MicroScintTM20 (Packard) лунки высушивали и затем считывали на WallacMICROBETA Jet. Затем значения процента ингибирования для 10 точек данных концентрационного ответа анализировали, например, с помощью программного обеспечения ACTIVITY BASE (IDBS),- 23016178 используя логистическое уравнение с 4 параметрами. Абсолютные значения IC50 вычисляли на основе формы полученной кривой. Все приведенные соединения имеют IC50 менее 100 нМ с минимальным значимым отношением (MSR) 3,6. Например, соединение примера 4 имеет IC50 примерно 25 нМ. Анализ содержания pHH3(S10), митотических клеток и ДНК Клетки HeLa из American Type Culture Collection (ATCC) высевали при концентрации 200 клеток/лунка в 9 б-луночные планшеты Beckman Dickinson BIOCOAT и инкубировали в МДС (минимальной достаточной среде, например, GIBCO, каталог 11095) с 10% FBS (фетальная бычья сыворотка) при 37 С, 5% СО 2 в течение 24 ч. Клетки обрабатывали путем добавления соединения (в 0,25% ДМСО) в среду, вводя его в 10 точках в диапазоне от 0,5 до 0,0098 мкМ. После 23 ч экспозиции в соединения, клетки фиксировали, например, с помощью фиксатора PREFER [Anatech LTD., каталог 414] в течение 30 минут, затем разрушали с помощью 0,1% TRITON X100 в фосфатно-солевом буферном растворе (PBS) в течение 15 мин. Клетки промывали 3 раза PBS, затем разрезали РНКазой 50 мкг/мл. Первичное антитело на фосфорилированный гистон Н 3 (Upstate каталог 06-570), добавляли к клеткам при соотношении 1:500 в PBS с 1% бычьим сывороточным альбумином (BSA) и оставляли на сутки при 4 С. После 3 промываний PBS клетки инкубировали А 1 еха 488, метили вторичным антителом (Invitrogen каталогА 11008) в течение одного часа при комнатной температуре. Клетки снова промывали 3 раза PBS, и затем добавляли 15 мкМ йодистый пропидий (Molecular Probes каталогР 3566) в течение 30 мин для окрашивания ядер. Флюоресценцию планшетов сканировали с помощью ACUMEN EXPLORER [лазерный сканирующий флюоресценцию цитометр для микропланшетов (состоит из 488 нм ионного аргонового возбуждающего лазера и фотоумножающей трубки детекции), производится ТТР LABTECH LTD] с целью измерения содержания фосфорилированного гистона Н 3, ДНК и доли митотических клеток, путем измерения конденсации ДНК. Анализ изображений основан на сигналах флюоресценции от определяемых клеток в различных субпопуляциях. рНН 3(S10)-положительные клетки идентифицировали по средней интенсивности на 500-530 нм выше пороговой величины. Для идентификации индивидуальных клеток (клетки с содержанием ДНК от 2 н. до 4 н.) и субпопуляций клеточного цикла (клетки 2 н., клетки 4 н.) использовали общую интенсивность от йодистого пропидия/ДНК на 655-705 нм. Максимальную интенсивность при 575-64 0 нм использовали для установления конденсации ДНК, которую используют в качестве маркера для идентификации митотических клеток из числа 4 н. клеток. Результатом анализа является процент каждой идентифицированной субпопуляции, % рНН 3, % 2 н., % 4 н., % митотических клеток и общее количество клеток. Значение ЕС 50 определяли на основании формы кривой, по 4 логистическим параметрам для каждого результата, с использованием ACTIVITY BASE. Полученные значения EC50s для рНН 3(s10), ДНК и митотических клеток имеют MSR 2,6, 2,4 и 2,5, соответственно. Например, соединение примера 4 имеет pHH3(s10) ЕС 50=24 нм (n=1), ДНК ЕС 50=35 нм (n=2) и митотических клеток ЕС 50=22 нм (n=1). Антипролиферативное исследование Воздействие соединений на клеточную пролиферацию можно определить, применяя клетки и способы клеточной пролиферации, хорошо известные в данной области (Robert С. Squatrito et al., Gynecological Oncology, 58, 101-105, (1995. Например, клетки HCT116, которые можно получить из AmericanType Culture Collection, высевали примерно 2000 клеток/лунка в 96-луночные планшеты и оставляли в течение ночи во влажном СO2-инкубаторе при 37 С. После 20-24-часовой инкубации добавляли серийно полулогарифмически разбавленные соединения (в 3,16 раз), и планшеты возвращали в инкубатор. После подходящей продолжительности экспозиции (например, 72 ч), определяли пролиферацию клеток хорошо известными способами. Согласно одному способу, 10 мкл соли тетразолия, такой как Alamar Blue, добавляют на планшеты с клетками. После соответствующей экспозиции в красителе, измеряли флуоресценцию (возбуждение 530 нм, эмиссия на 580 нм). Полученное значение IС 50 имеет MSR 3,1. Например,соединение примера 4 имеет IC50 44 нМ (n=3). Предпочтительно соединения согласно настоящему изобретению получают в виде фармацевтических композиций, вводимых различными путями. Наиболее предпочтительны такие композиции для перорального введения. Такие фармацевтические композиции и процессы их получения хорошо известны в данной области. См., например, REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY (A.Gennaro, et al., eds., 19th ed. , Mack Publishing Co., 1995). В целом, соединения формулы I являются эффективными в широком диапазоне дозирования. Например, дозировки на день обычно находятся в диапазоне от примерно 0,01 до примерно 20 мг/кг массы тела, предпочтительно от 0,1 до 20 мг/кг массы тела. В некоторых случаях уровни дозирования, лежащие ниже нижнего предела вышеуказанного диапазона, могут быть более соответствующими, тогда как в других случаях могут применять еще более высокие дозы, не вызывая какого-либо вредного побочного эффекта, и, следовательно, вышеуказанный диапазон дозирования не предполагает каким-либо образом ограничить объем изобретения. Понятно, что количество фактически введенного соединения будет определяться врачом с учетом соответствующих обстоятельств, в том числе, состояния, которое необходимо лечить, выбранного пути введения, фактического вводимого соединения или соединений, возраста, массы и реакции конкретного пациента и остроты симптомов, наблюдаемых у пациента.R2 представляет собой водород или галоген;R3 представляет собой водород или галоген; при условии, что по меньшей мере один из R2 и R3 представляет собой водород;R4 представляет собой водород, метил или галоген и представляет собой одинарную связь, которая может присутствовать или отсутствовать,или фармацевтически приемлемая соль указанного соединения. 2. Соединение по п.1, отличающееся тем, чтоR2 представляет собой водород или фтор;R3 представляет собой водород, хлор или фтор; при условии, что по меньшей мере один из R2 и R3 представляет собой водород;R4 представляет собой водород, метил, хлор или фтор и представляет собой одинарную связь, которая может присутствовать или отсутствовать,или фармацевтически приемлемая соль указанного соединения. 3. Соединение по п.1, отличающееся тем, чтоR2 представляет собой водород или фтор;R3 представляет собой водород, хлор или фтор; при условии, что по меньшей мере один из R2 и R3 представляет собой водород;R4 представляет собой водород, метил, хлор или фтор и представляет собой одинарную связь, которая может присутствовать или отсутствовать,или фармацевтически приемлемая соль указанного соединения. 4. Соединение по п.1, отличающееся тем, что R1 представляет собой диметиламинометил, R2 представляет собой водород, R3 представляет собой фтор и R4 представляет собой фтор, или фармацевтически приемлемая соль указанного соединения. 5. Соединение по п.1, отличающееся тем, что R1 представляет собой метиламинометил, R2 представляет собой водород, R3 представляет собой фтор и R4 представляет собой фтор, или фармацевтически приемлемая соль указанного соединения. 6. Соединение по п.1, отличающееся тем, что R1 представляет собой аминометил, R2 представляет собой водород, R3 представляет собой галоген и R4 представляет собой галоген, или фармацевтически приемлемая соль указанного соединения. 7. Соединение, выбранное из группы, включающей 1-(2-4-[7-(5-диметиламино)метил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин 2-иламиноэтил)имидазолидин-2-он,1-(2-4-[7-(2-фтор-5-(морфолинометил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2 иламиноэтил)имидазолидин-2-он,1-(2-5-фтор-4-[7-(2-фтор-5-(морфолинометил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2 иламиноэтил)имидазолидин-2-он,1-(2-4-[7-(5-диметиламино)метил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2 иламиноэтил)имидазолидин-2-он,1-(2-5-фтор-4-[7-(3-(морфолинометил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2 иламиноэтил)имидазолидин-2-он,- 25016178 1-(2-4-[7-(5-(1,3-диоксолан-2-ил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2 иламиноэтил)имидазолидин-2-он,1-(2-5-фтор-4-[7-(2-фтор-3-метоксиметокси)метил)пиридин-4-ил)бензо[b]тиофен-2 ил]пиримидин-2-иламиноэтил)имидазолидин-2-он,1-(2-4-[7-(5-циклопропил-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2 иламиноэтил)имидазолидин-2-он,1-(2-5-фтор-4-[7-(2-фтор-5-(пирролидин-1-илметил)пиридин-4-ил)бензо[b]тиофен-2 ил]пиримидин-2-иламиноэтил)имидазолидин-2-он,1-(2-4-[7-(5-(азетидин-1-илметил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2 иламиноэтил)имидазолидин-2-он,1-(2-5-хлор-4-[7-(5-диметиламино)метил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин 2-иламиноэтил)имидазолидин-2-он,1-2-[5-фтор-4-(7-2-фтор-5-[(2-гидроксиэтиламино)метил]пиридин-4-илбензо[b]тиофен-2 ил)пиримидин-2-иламино]этилимидазолидин-2-он,1-(2-5-фтор-4-[7-(2-фтор-5-пропиламино)метил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин 2-иламиноэтил)имидазолидин-2-он,1-(2-(4-(7-(5-этиламино)метил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил)-5-фторпиримидин-2 иламино)этил)имидазолидин-2-он,1-2-[4-(7-5-[(этил(метил)амино)метил]-2-фторпиридин-4-илбензо[b]тиофен-2-ил)-5 фторпиримидин-2-иламино]этилимидазолидин-2-он,1-(2-4-[7-(5-диэтиламино)метил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2 иламиноэтил)имидазолидин-2-он,1-(2-4-[7-(5-диметиламино)метил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5 метилпиримидин-2-иламиноэтил)имидазолидин-2-он,1-(2-5-фтор-4-[7-(2-фтор-5-метиламино)метил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2 иламиноэтил)имидазолидин-2-он,1-(2-4-[7-(2-фтор-5-метиламино)метил)пиридин-4-ил)бензо[b]тиофен-2-ил]-5-метилпиримидин 2-иламиноэтил)имидазолидин-2-он,1-(2-5-хлор-4-[7-(2-фтор-5-метиламино)метил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2 иламиноэтил)имидазолидин-2-он,1-(2-4-[7-(2-фтор-5-метиламино)метил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2 иламиноэтил)имидазолидин-2-он,1-[2-(4-7-[5-(1-аминоэтил)-2-фторпиридин-4-ил]бензо[b]тиофен-2-ил-5-фторпиримидин-2 иламино)этил]имидазолидин-2-он,1-(2-5-фтор-4-[7-(2-фтор-5-метиламино)метил)пиридин-4-ил)бензо[b]тиофен-2-ил]пиримидин-2 иламиноэтил)-1 Н-имидазол-2(3 Н)-он,1-2-[5-фтор-4-(7-2-фтор-5-[(3,3,3-трифторпропиламино)метил]пиридин-4-илбензо[b]тиофен-2 ил)пиримидин-2-иламино]этилимидазолидин-2-он,3-[6-фтор-4-(2-5-фтор-2-[2-(2-оксоимидазолидин-1-ил)этиламино]пиримидин-4 илбензо[b]тиофен-7-ил)пиридин-3-ил]метиламинопропаннитрил,1-(2-4-[7-(5-(аминометил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил]-5-фторпиримидин-2 иламиноэтил)имидазолидин-2-он,R-1-[2-(4-7-[5-(1-аминоэтил)-2-фторпиридин-4-ил]бензо[b]тиофен-2-ил-5-фторпиримидин-2 иламино)этил]имидазолидин-2-он,S-1-[2-(4-7-[5-(1-аминоэтил)-2-фторпиридин-4-ил]бензо[b]тиофен-2-ил-5-фторпиримидин-2 иламино)этил]имидазолидин-2-он,1-[2-(5-фтор-4-7-[2-фтор-5-(2-гидроксиэтокси)пиридин-4-ил]бензо[b]тиофен-2-илпиримидин-2 иламино)этил]имидазолидин-2-он,1-(2-(4-(7-(3-этинилпиридин-4-ил)бензо[b]тиофен-2-ил)пиримидин-2-иламино)этил)имидазолидин 2-он,1-(2-(4-(7-(3-этинилпиридин-4-ил)бензо[b]тиофен-2-ил)-5-фторпиримидин-2 иламино)этил)имидазолидин-2-он,1-(2-(4-(7-(5-(1-аминоэтил)-2-хлорпиридин-4-ил)бензо[b]тиофен-2-ил)-5-фторпиримидин-2 иламино)этил)имидазолидин-2-он,S-1-(2-(4-(7-(5-(1-(этиламино)этил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил)-5-фторпиримидин-2 иламино)этил)имидазолидин-2-он,R-1-(2-(4-(7-(5-(1-(этиламино)этил)-2-фторпиридин-4-ил)бензо[b]тиофен-2-ил)-5-фторпиримидин-2 иламино)этил)имидазолидин-2-он,S-1-(2-(5-фтор-4-(7-(2-фтор-5-(1-(метиламино)этил)пиридин-4-ил)бензо[b]тиофен-2-ил)пиримидин 2-иламино)этил)имидазолидин-2-он иR-1-(2-(5-фтор-4-(7-(2-фтор-5-(1-(метиламино)этил)пиридин-4-ил)бензо[b]тиофен-2-ил)пиримидин 2-иламино)этил)имидазолидин-2-он,- 26016178 или фармацевтически приемлемая соль указанного соединения. 8. Фармацевтическая композиция, содержащая соединение по пп.1-7 или фармацевтически приемлемую соль указанного соединения в комбинации с фармацевтически приемлемым носителем, разбавителем или наполнителем. 9. Применение соединения по любому из пп.1-7 или фармацевтически приемлемая соль указанного соединения при получении лекарственного средства.
МПК / Метки
МПК: A61K 31/4436, A61K 31/381, A61K 31/496, A61K 31/4178, C07D 409/14, A61K 31/444, A61P 35/00, A61K 31/4439
Метки: соединения, имидазолидинониламинопиримидина
Код ссылки
<a href="https://eas.patents.su/28-16178-soedineniya-imidazolidinonilaminopirimidina.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения имидазолидинониламинопиримидина</a>