Производные тиазола и их применение
Номер патента: 17166
Опубликовано: 30.10.2012
Авторы: Рюкле Томас, Ковини Давид, Помель Венсан, Кваттропани Анна, Дорбэ Жером
Формула / Реферат
1. Производное тиазола формулы (I)
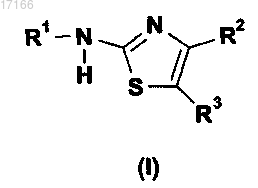
где R1 представляет собой ацил формулы C(O)R, где R представляет собой Н или С1-12алкил;
R2 выбран из Н, галогена, C1-С6-алкила, С2-С6-алкенила и С2-С6-алкинила;
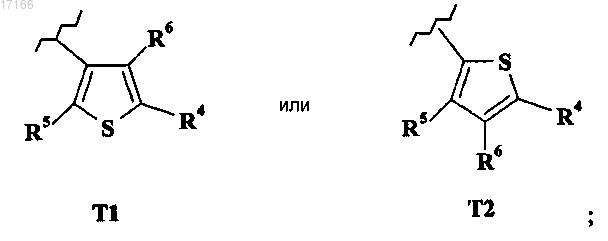
R3 выбран из следующих тиенильных групп:
R4 выбран из Н, необязательно замещенного С1-С6-алкила; необязательно замещенного С2-С6-алкенила, необязательно замещенного С2-С6-алкинила, необязательно замещенного алкоксикарбонила и необязательно замещенного ацила формулы C(O)R, где R представляет собой Н или С1-12алкил, а также необязательно замещенного морфолинкарбонила и необязательно замещенного пиперидинкарбонила;
R5 и R6 независимо выбраны из Н и галогена; а также его геометрические изомеры, его оптически активные формы, такие как энантиомеры, диастереомеры и ее рацематные формы, а также их фармацевтически приемлемым соли, причем замещенные группы могут быть замещены 1-5 заместителями, выбранными из группы, состоящей из С1-С6-алкила; С2-С6-алкенила; С2-С6-алкинила; С3-С8циклоалкила; гетероциклоалкила, где гетероциклоалкил относится к С3-С8-циклоалкильной группе, в которой вплоть до 3 атомов углерода заменены гетероатомами, выбранными из группы, состоящей из О, S, NR, где R определяется как водород или метил; C1-C6-алкиларила, где арил относится к ненасыщенной ароматической карбоциклической группе, состоящей из от 6 до 14 атомов углерода; С1-С6-алкилгетероарила, С1-С6-алкилциклоалкила, C1-C6-алкилгетероциклоалкила, амино, аммония, ацила, ациламино, аминокарбонила, алкоксикарбонила, где алкоксикарбонил относится к группе -С(О)OR, где R включает Н, С1-С6-алкил; арила, где арил относится к ненасыщенной ароматической карбоциклической группе, состоящей из от 6 до 14 атомов углерода; карбамата, гетероарила, где гетероарил относится к моноциклической гетероароматической группе или к бициклической или трициклической гетероароматической группе с конденсированными кольцами, включающими N, О, S в качестве гетероатомов; сульфинила, сульфонила, С1-С6алкокси, сульфанила, галогена, тригалогенметила, циано, гидрокси, меркапто, нитро.
2. Производное тиазола по п.1, в котором R2 представляет собой метил.
3. Производное тиазола по любому из предшествующих пунктов, в котором R3 представляет собой тиенил Т1.
4. Производное тиазола по любому из предшествующих пунктов, в котором R3 представляет собой тиенил Т2.
5. Производное тиазола по любому из предшествующих пунктов, в котором R4 выбран из Н, необязательно замещенного C1-С6-алкила, необязательно замещенного С2-С6-алкенила и необязательно замещенного С2-С6-алкинила.
6. Производное тиазола по любому из предшествующих пп.1-4, в котором R4 выбран из алкоксикарбонила и ацила.
7. Производное тиазола по любому из предшествующих пунктов, в котором R5 и R6 представляют собой Н.
8. Производное тиазола по любому из предшествующих пунктов, выбранное из следующей группы:
N-[5-(5-формил-2-тиенил)-4-метил-1,3-тиазол-2-ил]ацетамид;
N-(5-{5-[(аллиламино)метил]-2-тиенил}-4-метил-1,3-тиазол-2-ил)ацетамид;
N-{5-[5-(гидроксиметил)-2-тиенил]-4-метил-1,3-тиазол-2-ил}ацетамид;
5-[2-(ацетиламино)-4-метил-1,3-тиазол-5-ил]тиофен-2-карбоновая кислота;
N-{4-метил-5-[5-(морфолин-4-илкарбонил)-2-тиенил]-1,3-тиазол-2-ил}ацетамид;
N-[4-метил-5-(2-тиенил)-1,3-тиазол-2-ил]ацетамид;
N-(5-{5-[(4-гидроксипиперидин-1-ил)карбонил]-2-тиенил}-4-метил-1,3-тиазол-2-ил)ацетамид;
N-(5-{5-[(3-гидроксипиперидин-1-ил)карбонил]-2-тиенил}-4-метил-1,3-тиазол-2-ил)ацетамид;
N-(5-{5-[(Е)-(гидроксиимино)метил]-2-тиенил}-4-метил-1,3-тиазол-2-ил)ацетамид;
N-[5-(5-циано-2-тиенил)-4-метил-1,3-тиазол-2-ил]ацетамид;
метил-5-[2-(ацетиламино)-4-метил-1,3-тиазол-5-ил]тиофен-2-карбоксилат;
N-[4-метил-5-(3-тиенил)-1,3-тиазол-2-ил]ацетамид.
9. Применение производного тиазола по любому из пп.1-8, а также его изомеров и их смесей в качестве лекарственного средства для профилактики и/или лечения заболеваний посредством модулирования активности PI3-киназы, где заболевание выбрано из группы, состоящей из аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, аллергии, астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, злокачественной опухоли, трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата или повреждений легких.
10. Применение производного тиазола по любому из пп.1-8, а также его изомеров и их смесей для получения лекарственного средства для профилактики и/или лечения заболеваний посредством модулирования активности PI3-киназы, где заболевание выбрано из группы, состоящей из аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, аллергии, астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, злокачественной опухоли, трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата или повреждений легких.
11. Применение по пп.9, 10, где указанные заболевания выбраны из группы, включающей рассеянный склероз, псориаз, ревматоидный артрит, системную красную волчанку, воспалительное заболевание кишечника, повреждение легкого, тромбоз или инфекцию/воспаление головного мозга, такое как менингит или энцефалит.
12. Применение по пп.9, 10, где указанные заболевания выбраны из группы, включающей болезнь Альцгеймера, болезнь Гентингтона, травму ЦНС, инсульт или ишемические состояния.
13. Применение по пп.9, 10, где указанные заболевания выбраны из группы, включающей атеросклероз, гипертрофию сердца, дисфункцию кардиомиоцитов, повышенное кровяное давление или ангиоспазм.
14. Применение по пп.9, 10, где указанные заболевания выбраны из группы, включающей хроническое обструктивное заболевание легких, связанный с анафилактическим шоком фиброз, псориаз, аллергические заболевания, астму, инсульт или ишемические состояния, ишемию-реперфузию, агрегацию/активацию тромбоцитов, атрофию/гипертрофию скелетных мышц, рекрутинг лейкоцитов в ткани злокачественной опухоли, ангиогенез, инвазивный метастаз, меланому, саркому Капоши, острые и хронические бактериальные и вирусные инфекции, сепсис, отторжение трансплантата, гломерулосклероз, гломерулонефрит, прогрессивный фиброз почек, повреждения эндотелия и эпителия легкого или, в общем, воспаление дыхательных путей легкого.
15. Применение по пп.9-14 для ингибирования PI3-киназной активности.
16. Применение по пп.9-15, где указанная PI3-киназа представляет собой PI3-киназу γ.
17. Фармацевтическая композиция, содержащая по меньшей мере одно производное тиазола по любому из пп.1-8 и его фармацевтически приемлемый носитель, разбавитель или эксципиент.
18. Способ получения производного тиазола по любому из пп.1-8, включающий стадию взаимодействия соединения формулы (Р1) с производным формулы (Р2) в присутствии комплексов палладия и основания
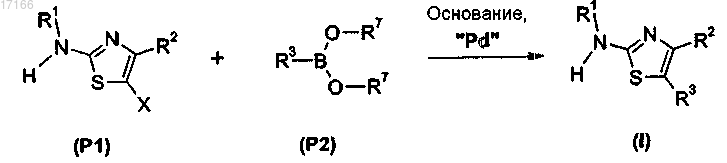
где X представляет собой Br или I, R7 выбран из Н и С1-С6-алкила и где группы -B(OR7)2 могут образовывать гетероцикл.
19. Соединение формулы (Р2), представляющее собой метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)тиофен-2-карбоксилат.
Текст
Изобретение относится к производным тиазола формулы (I), в частности, для лечения и/или профилактики аутоиммунных нарушений и/или воспалительных заболеваний, сердечнососудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, заболеваний почек, агрегации тромбоцитов, злокачественной опухоли, трансплантации,отторжения трансплантата или повреждений легких. 017166 Область изобретения Изобретение относится к применению производных тиазола формулы (I) для лечения и/или профилактики аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, аллергии, астмы, панкреатита, полиорганной недостаточности, заболеваний почек, заболеваний и расстройств, связанных с агрегацией тромбоцитов, злокачественной опухолью, трансплантацией, подвижностью сперматозоидов,дефицитом эритроцитов, подвижностью сперматозоидов, отторжением трансплантата или повреждением легких. Конкретно, настоящее изобретение относится к производным тиазола для модулирования, особенно ингибирования, активности или функции фосфоинозитид-3-киназ, PI3K. Предпосылки изобретения Фосфоинозитид-3-киназы (PI3K) играют центральную сигнальную роль в клеточной пролиферации,выживаемости клеток, васкуляризации, мембранном транспорте, транспорте глюкозы, росте нейритов,мембранном раффлинге, продукции супероксида, реорганизации актина и хемотаксисе (Cantley, 2000,Science, 296, 1655-1657 и Vanhaesebroeck et al., 2001, Annu. Rev. Biochem., 70, 535-602). Термином "PI3K" называют семейство киназ липидов, которое у млекопитающих состоит из восьми идентифицированных PI3K, которые подразделяют на три подсемейства в соответствии с их структурой и их специфичностью в отношении субстрата. Группа PI3K класса I состоит из двух подгрупп, класса IA и класса IB. Класс IA состоит из регуляторного элемента массой 85 кДа (ответственного за белок-белковые взаимодействия посредством взаимодействия Src-гомологичного домена 2 (SH2) с остатками фосфотирозина других белков) и каталитической субъединицы массой 110 кДа. Для этого класса существует три каталитические формы (p100, p110 и p110) и пять регуляторных изоформ (р 85, р 85, р 55, р 55 и р 50). Класс IB стимулируется G-белковыми -субъединицами гетеродимерных G-белков. Единственным охарактеризованным членом класса IB является PI3K (каталитическая субъединица p110 в комплексе с регуляторным белком массой 101 кДа, р 101). Класс II PI3K включает изоформы ,и , которые обладают массой приблизительно 170 кДа и характеризуются наличием С-концевого С 2-домена. Класс III PI3K включает фосфатидилинозитол-специфичные 3-киназы. Эволюционно консервативные изоформы p110 иэкспрессируются повсеместно, в то время какиболее специфично экспрессируются в системе гемопоэтических клеток, в гладкомышечных клетках,миоцитах и эндотелиальных клетках (Vanhaesebroeck et al., 1997, Trends Biochem. Sci., 22(7), 267-72). Их экспрессия также может регулироваться путем индуцирования в зависимости от типа клетки и ткани и стимулов, а также от заболевания.PI3K представляют собой ферменты, вовлеченные в передачу сигналов фосфолипидов, и они активируются в ответ на различные внеклеточные сигналы, такие как факторы роста, митогены, интегрины(межклеточные взаимодействия), гормоны, цитокины, вирусы и нейротрансмиттеры, а также посредством внутриклеточной перекрестной регуляции другими сигнальными молекулами (перекрестное влияние сигналов, где первоначальный сигнал может активировать некоторые параллельные каскады, которые на втором этапе передают сигналы на PI3K посредством внутриклеточных процессов передачи сигнала),например, такими как малые ГТФ-азы, киназы или фосфатазы. Фосфатидилинозитол (Ptdlns) представляет собой основной структурный элемент внутриклеточных инозитольных липидов в эукариотических клетках, состоящий из D-мио-инозитол-1-фосфата (Ins1P),связанного через его фосфатную группу с диацилглицерином. Инозитольная концевая группа в PtdIns имеет пять свободных гидроксигрупп, и выявлено, что в клетках три из них являются фосфорилированными в различных сочетаниях. PtdIns и его фосфорилированные производные совместно называют инозитолфосфолипидами или фосфоинозитидами (PI). Для эукариотических клеток описано восемь видов PI(Vanhaesebroeck et al., 2001, выше). Все PI располагаются в мембранах и являются субстратами для киназ, фосфатаз и липаз.In vitro, PI3K фосфорилирует 3-гидроксильную группу инозитольного кольца трех различных субстратов: фосфатидилинозитола (PtdIns), фосфатидилинозитол-4-фосфата (PI(4)P) и фосфатидилинозитол 4,5-бифосфата (PI(4,5)P2), соответственно, с образованием трех липидных продуктов, а именно фосфатидилинозитол-3-монофосфата (PI(3)P), фосфатидилинозитол-3,4-бисфосфата (PI(3,4)P2) и фосфатидилинозитол-3,4,5-трисфосфата (PI(3,4,5)P3 (см. схему А, ниже). Предпочтительным субстратом для PI3K класса I является PI(4,5)P2. PIK II класса имеют строгое предпочтение в отношении PtdIns в качестве субстрата по сравнению с PI(4)P и PI(4,5)P2. PI3K III класса в качестве субстрата in vivo могут использовать только PtdIns, и, вероятно, они являются ответственными за образование большей части PI(3)P в клетках (Vanhaesebroeck et al., 2001, выше). Внутриклеточный каскад передачи сигнала фосфоинозитидов начинается со связывания сигнальной молекулы (внеклеточные лиганды, стимулы, димеризация рецепторов, трансактивация гетерологичным рецептором (например, рецепторной тирозинкиназой со связанным с G-белком трансмембранным рецептором, встроенным в плазматическую мембрану, что приводит к активации PI3K. После активации PI3K превращают мембранный фосфолипид PI(4,5)P2 в PI(3,4,5)P3, который, в свою очередь, может далее превращаться в другую 3'-фосфорилированную форму фосфоинозитидов посредством 5'-специфичных фосфоинозитидфосфатаз, таким образом, ферментативная активность PI3K либо прямо, либо косвенно приводит к образованию двух подтипов 3'-фосфоинозитидов, которые выполняют функцию вторичных посредников при внутриклеточной передаче сигнала (Toker et al., 2002,Cell Mol. Life Sci. 59(5) 761-79). Роль действия фосфорилированных продуктов PtdIns в качестве вторичных посредников состоит в том, что они вовлечены во множество каскадов передачи сигнала, включая каскады, необходимые для клеточной пролиферации, клеточной дифференциации, роста клеток, установления размера клеток, выживаемости клеток, апоптоза, адгезии, подвижности клеток, миграции клеток, хемотаксиса, инвазии,перестройки цитоскелета, изменения формы клеток, транспорта везикул и метаболического каскада(Stein, 2000, Mol. Med. Today 6(9) 347-57). Хемотаксис направленное движение клеток по градиенту концентрации химических аттрактантов, также называемых хемокинами, вовлечен во множество имеющих значение заболеваний, таких как воспаление/аутоиммунитет, нейродегенерация, ангиогенез, инвазия/метастаз и заживление ран (Wyman et al., 2000, Immunol Today 21(6) 260-4; Hirsch et al., 2000, Science 287(5455) 1049-53; Hirsch et al. , 2001, FASEB J. 15(11) 2019-21 и Gerard et al., 2001, Nat. Immunol. 2(2) 108-15). Таким образом, полагают, что активация PI3-киназы вовлечена в ряд клеточных ответов, включая рост клеток, дифференциацию и апоптоз (Parker et al., 1995, Current Biology, 5, 577-99, Yao et al., 1995,Science, 267, 2003-05). Недавние биохимические исследования показали, что PI3K класса I (например, изоформа PI3K класса IB) представляют собой киназные ферменты с двойной специфичностью, т.е. они проявляют как киназную активность в отношении липидов (фосфорилирование фосфоинозитидов), так и киназную активность в отношении белков, поскольку они способны индуцировать фосфорилирование другого белка в качестве субстрата, включая аутофосфорилирование как внутримолекулярный регуляторный механизм. Оказалось, что PI3K вовлечены в ряд аспектов активации лейкоцитов. Было показано, что ассоциированная с р 85 активность PI3-киназы физически ассоциирована с цитоплазматическим доменом CD28,который представляет собой важную костимуляторную молекулу для активации Т-клеток в ответ на антиген. Эти эффекты связаны с повышением транскрипции ряда генов, включая ген интерлейкина-2 (IL2), важного фактора роста Т-клеток (Fraser et al., 1991, Science, 251, 313-16). Мутация CD28, связанная с его способностью более длительно взаимодействовать с PI3-киназой, приводит к отсутствию запуска продукции IL-2, что подтверждает критическую роль PI3-киназы в активации Т-клеток. Клеточные процессы, в которых PI3K играют существенную роль, включают подавление апоптоза,реорганизацию актинового скелета, рост кардиомиоцитов, стимуляцию инсулином гликогенсинтазы,TNF-опосредуемое примирование нейтрофилов и образование супероксида, и миграцию и адгезию лей-2 017166 коцитов к эндотелиальным клеткам.PI3K была идентифицирована в качестве медиатора G-бета-гамма-зависимой регуляции активности JNK, где G-бета-гамма представляют собой субчастицы гетеротримерных G-белков. Недавно было описано, что PI3K переключает воспалительные сигналы посредством различных сопряженных с G(i) рецепторов (Laffargue et al., 2002, Immunity 16(3) 441-51) и ее центральная для функционирования тучных клеток, с точки зрения стимулов для лейкоцитов, иммунология включает, например, цитокины, хемокины, аденозины, антитела, интегрины, факторы агрегации, факторы роста, вирусы или гормоны (Lawlor et al. , 2001, J. Cell. Sci., 114 (Pt 16) 2903-1). Специфичные ингибиторы определенных членов семейства ферментов являются ценными инструментами для расшифровки функций каждого фермента. В качестве ингибиторов PI3-киназы широко применяли два соединения, LY294002 и вортманнин(ср. далее в настоящем описании). Эти соединения представляют собой неспецифичные ингибиторыPI3K, поскольку они не отличают четыре члена PI3-киназ I класса. Значения IC50 для вортманнина в отношении каждой из различных PI3-киназ I класса находятся в диапазоне 1-10 нМ и значения IC50 для LY294002 в отношении каждой из этих PI3-киназ составляют приблизительно 15-20 мкМ (Fruman et al., 1998, Ann. Rev. Biochem., 67, 481-507), а также 5-10 мМ в отношении протеинкиназы СК 2, и существует некоторая ингибиторная активность в отношении фосфолипаз. Вортманнин представляет собой продукт метаболизма грибов, который необратимо ингибирует активность PI3K посредством ковалентного связывания каталитического домена этого фермента. Ингибирование активности PI3 К вортманнином приводит к подавлению последующего клеточного ответа на внеклеточный фактор (Thelen et al., 1994, Proc. Natl. Acad. Sci. USA, 91, 4960-64). Эксперименты с вортманнином показывают, что активность PI3K в клетках гемопоэтического ростка, в частности, нейтрофилов, моноцитов и других типов лейкоцитов, вовлечена во множество не связанных с памятью иммунных ответов, обусловленных острым и хроническим воспалением. Исходя из исследований с применением вортманнина, существуют доказательства того, что функционирование PI3-киназы также необходимо для некоторых аспектов передачи сигнала в лейкоцитах посредством сопряженных с G-белком рецепторов (Thelen et al., 1994). Более того, было показано, что вортманнин и LY294002 блокируют миграцию нейтрофилов и высвобождение супероксида. Однако, поскольку эти соединения не отличают различные изоформы PI3K, остается неясным, какая конкретно изоформа или изоформы PI3K вовлечена в эти эффекты. Некоторые результаты указывают на то, что ингибиторы PI3K, например, LY294002, могут повышать противоопухолевую активность определенных цитотоксических средств (например, паклитаксела)in vivo (Grant, 2003, Current Drugs, 6(10), 946-948). Недавно в качестве ингибиторов PI3K были предложены производные тиазола (WO 2005/021519;WO 04/078754 и WO 04096797). В WO 2005/021519 описаны производнье тиазола следующей структуры: В WO 04/078754 описаны производные тиазола следующей структуры: В WO 04096797 описаны производные тиазола следующей структуры:-3 017166 Высокое значение каскада PI3K при некоторых широко распространенных заболеваниях подчеркивает необходимость в разработке ингибиторов, в том числе селективных ингибиторов, PIK. Сущность изобретения Один вариант осуществления настоящего изобретения относится к веществам, которые пригодны для лечения и/или профилактики нарушений, связанных с фосфоинозитид-3-киназами, PI3K. Другой вариант осуществления настоящего изобретения относится к веществам, которые являются пригодными для лечения и/или профилактики аутоиммунных и/или воспалительных нарушений. Другой вариант осуществления настоящего изобретения относится к веществам, которые являются пригодными для лечения и/или профилактики сердечно-сосудистых заболеваний. Другой вариант осуществления настоящего изобретения относится к веществам, которые являются пригодными для лечения и/или профилактики нейродегенеративных нарушений. Другой вариант осуществления настоящего изобретения относится к веществам, которые являются пригодными для лечения и/или профилактики нарушения, выбранного из бактериальных и вирусных инфекций, аллергии, астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, злокачественной опухоли, трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата, повреждений легких, респираторных заболеваний и ишемических состояний. Другой вариант осуществления настоящего изобретения относится к химическим соединениям, которые способны модулировать, особенно ингибировать, активность или функцию фосфоинозитид-3 киназ, PI3K, при болезненных состояниях у млекопитающих, особенно у человека. Другой вариант осуществления настоящего изобретения относится к новой категории фармацевтических композиций для лечения и/или профилактики заболеваний, выбранных из аутоиммунных, воспалительных нарушений, сердечно-сосудистых заболеваний, нейродегенеративных нарушений, бактериальных и вирусных инфекций, аллергии, астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, злокачественной опухоли, трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата, повреждений легких, респираторных заболеваний и ишемических состояний. Другой вариант осуществления настоящего изобретения относится к применению соединений по изобретению для лечения и/или профилактики нарушений, выбранных из аутоиммунных, воспалительных нарушений, сердечно-сосудистых заболеваний, нейродегенеративных нарушений, бактериальных и вирусных инфекций, аллергии, астмы, панкреатита, полиорганной недостаточности, заболеваний почек,агрегации тромбоцитов, злокачественной опухоли, трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата, повреждений легких, респираторных заболеваний и ишемических состояний. В одном варианте осуществления изобретение относится к производным тиазола формулы (I): где R1, R2 и R3 определены в подробном описании ниже. В другом варианте осуществления изобретение относится к применению соединения формулы (I) в качестве лекарственного средства. В другом варианте осуществления изобретение относится к применению соединения формулы (I) для приготовления фармацевтической композиции для лечения нарушения, выбранного из аутоиммунных, воспалительных нарушений, сердечно-сосудистых заболеваний, нейродегенеративных нарушений,бактериальных и вирусных инфекций, аллергии, астмы, панкреатита, полиорганной недостаточности,заболеваний почек, агрегации тромбоцитов, злокачественной опухоли, трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата, повреждения легких, респираторных заболеваний и ишемических состояний, и других заболеваний и нарушений, обусловленных фосфоинозитид-3-киназами, PI3K, включающими PI3Kи . В другом варианте осуществления изобретение относится к фармацевтической композиции, содержащей, по меньшей мере, одно соединение формулы (I) и его фармацевтически приемлемый носитель,разбавитель или эксципиент. В другом варианте осуществления изобретение относится к применению соединения формулы (I) для лечения пациента, страдающего нарушением, выбранным из аутоиммунных, воспалительных нарушений, сердечно-сосудистых заболеваний, нейродегенеративных нарушений, бактериальных и вирусных инфекций, аллергии, астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, злокачественной опухоли, трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата, повреждения легких, респираторных заболеваний и ишемических состояний, и других заболеваний и нарушений, обусловленных фосфоинозитид-3-киназами, PI3K. Спо-4 017166 соб включает введение пациенту соединения формулы (I). В другом варианте осуществления изобретение относится к способу получения соединения формулы (I). В другом варианте осуществления изобретение относится к соединению формулы (Р 2). Подробное описание изобретения Ниже представлены определения различных химических групп, которые образуют структуру соединений в соответствии с этим изобретением, и подразумевается их единообразное применение на протяжении описания и формулы изобретения, если нет иных явных определений, дающих более широкое определение."C1-С 6-алкил" относится к одновалентным алкильным группам, имеющим от 1 до 6 атомов углерода. Этот термин иллюстрируется такими группами, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-гексил и т.п. Аналогично "С 1-С 12-алкил" относится к одновалентным алкильным группам, имеющим от 1 до 12 атомов углерода, включая группы "С 1-С 6-алкилов" и гептильную, октильную, нонильную, деканоильную, ундеканоильную и додеканоильную группы, и "C1-С 10-алкил" относится к одновалентным алкильным группам, имеющим от 1 до 10 атомов углерода, "C1-C8-алкил" относится к одновалентным алкильным группам, имеющим от 1 до 8 атомов углерода и "C1-C5-алкил" относится к одновалентным алкильным группам имеющим от 1 до 5 атомов углерода."Гетероалкил" относится к С 1-С 12-алкилу, предпочтительно С 1-С 6-алкилу, где по меньшей мере один атом углерода заменен гетероатомом, выбранным из О, N или S, включая 2-метоксиэтил."Арил" относится к ненасыщенной ароматической карбоциклической группе, состоящей из от 6 до 14 атомов углерода, имеющей одно кольцо (например, фенил) или несколько конденсированных колец"Гетероарил" относится к моноциклической гетероароматической группе или к бициклической или трициклической гетероароматической группе с конденсированными кольцами. Конкретные примеры гетероароматических групп включают необязательно замещенные пиридил, пирролил, пиримидинил,фурил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил,1,2,4-триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4 триазинил, 1,2,3-триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил, изобензотиенил, индолил, изоиндолил, 3 Н-индолил, бензимидазолил, имидазо[1,2-а]пиридил,бензотиазолил, бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил,нафтиридинил, пиридо[3,4-и]пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил, хинолил, изохинолил, тетразолил, 5,6,7,8-тетрагидрохинолил, 5,6,7,8-тетрагидроизохинолил, пуринил, птеридинил, карбазолил, ксантенил или бензохинолил."С 2-С 6-алкенил" относится к алкенильным группам, предпочтительно имеющим от 2 до 6 атомов углерода и имеющим по меньшей мере 1 или 2 участка алкенильной ненасыщенности. Предпочтительные алкенильные группы включают этенил (-СН=СН 2), н-2-пропенил (аллил, -СН 2 СН=СН 2) и т.п."С 2-С 6-алкинил" относится к алкинильным группам, предпочтительно имеющим от 2 до 6 атомов углерода и имеющим по меньшей мере 1-2 участка алкинильной ненасыщенности, предпочтительные алкинильные группы включают этинил (-ССН), пропаргил (-СН 2 ССН) и т.п."С 3-С 8-циклоалкил" относится к насыщенной карбоциклической группе из от 3 до 8 атомов углерода, имеющей одно кольцо (например, циклогексил) или несколько конденсированных колец (например,норборнил). С 3-С 8-циклоалкил включает циклопентил, циклогексил, норборнил и т.п."Гетероциклоалкил" относится к С 3-С 8-циклоалкильной группе в соответствии с приведенным выше определенлем, в которой вплоть до 3 атомов углерода заменены гетероатомами, выбранными из группы, состоящей из О, S, NR, где R определяется как водород или метил. Гетероциклоалкил включает пирролидин, пиперидин, пиперазин, морфолин, тетрагидрофуран и т.п."Ацилокси-С 1-С 6-алкил" относится к С 1-С 6-алкильным группам, имеющим заместитель ацилокси,включая этиловый эфир пропионовой кислоты и т.п."Алкокси" относится к группе -O-R, где R включает "С 1-C6-алкил", или "арил", или "гетероарил",или "арил-С 1-С 6-алкил", или "гетероарил-С 1-С 6-алкил". Предпочтительные группы алкокси включают,например, метокси, этокси, фенокси и т.п."Аминокарбонил" относится к группе -C(O)NRR', где каждый из R, R' независимо включает водород, или C1-С 6-алкил, или арил, или гетероарил, или "арил-С 1-С 6-алкил", или "гетероарил-С 1-С 6-алкил",включая N-фенилформамид."Ациламино" относится к группе -NRC(O)R', где каждый из R, R' независимо представляет собой водород, "C1-С 6-алкил", "С 2-С 6-алкенил", "С 2-С 6-алкинил", "С 3-С 8-циклоалкил", "гетероциклоалкил","арил", "гетероарил", "арил-С 1-С 6-алкил" или "гетероарил-С 1-С 6-алкил", "арил-С 2-С 6-алкенил", "гетероарил-С 2-С 6-алкенил", "арил-С 2-С 6-алкинил", "гетероарил-С 2-С 6-алкинил", "циклоалкил-С 1-С 6-алкил", "гетероциклоалкил-С 1-С 6-алкил"."Уреидо" относится к группе -NRC(О)NR'R", где каждый из R, R', R" независимо представляет собой водород, "С 1-С 6-алкил", "С 2-С 6-алкенил", "С 2-С 6-алкинил", "С 3-С 8-циклоалкил", "гетероциклоалкил","арил", "гетероарил", "арил-С 1-С 6-алкил" или "гетероарил-С 1-С 6-алкил", "арил-С 2-С 6-алкенил", "гетероарил-С 2-С 6-алкенил", "арил-С 2-С 6-алкинил", "гетероарил-С 2-С 6-алкинил", "циклоалкил-С 1-С 6-алкил", "гетероциклоалкил-С 1-С 6-алкил", и где R' и R" вместе с атомом азота, к которому они присоединены, необязательно могут образовывать 3-8-членное гетероциклоалкильное кольцо."Карбамат" относится к группе -NRC(O)OR', где каждый из R, R' независимо представляет собой водород, "C1-С 6-алкил", "С 2-С 6-алкенил", "С 2-С 6-алкинил", "С 3-С 8-циклоалкил", "гетероциклоалкил","арил", "гетероарил", "C1-С 6-алкиларил" или "гетероарил-С 1-С 6-алкил", "арил-С 2-С 6-алкенил", "гетероарил-С 2-С 6-алкенил", "арил-С 2-С 6-алкинил", "гетероарил-С 2-С 6-алкинил", "циклоалкил-С 1-С 6-алкил", "гетероциклоалкил-С 1-С 6-алкил"."Амино" относится к группе -NRR', где каждый из R, R' независимо представляет собой водород,или "С 1-С 6-алкил", или "арил", или "гетероарил", или "С 1-С 6-алкиларил", или "C1-C6-алкилгетероарил",или "циклоалкил", или "гетероциклоалкил", и где R и R' вместе с атомом азота, к которому они присоединены, необязательно могут образовывать 3-8-членное гетероциклоалкильное кольцо."Аммоний" относится к положительно заряженной группе N+RR'R", где каждый из R, R', R" независимо представляет собой "C1-С 6-алкил", или "С 1-С 6-алкиларил", или "С 1-С 6-алкилгетероарил", или "циклоалкил", или "гетероциклоалкил", и где R и R' вместе с атомом азота, к которому они присоединены,необязательно могут образовывать 3-8-членное гетероциклоалкильное кольцо."Сульфанил" относится к группам -S-R, где R включает Н, "C1-С 6-алкил", "C1-С 6-алкил", замещенный галогенами, например, группу -SO-CF3, "С 2-С 6-алкенил", "С 2-С 6-алкинил", "С 3-С 8-циклоалкил", "гетероциклоалкил", "арил", "гетероарил", "арил-С 1-С 6-алкил" или "гетероарил-С 1-С 6-алкил", "арил-С 2-С 6 алкенил", "гетероарил-С 2-С 6-алкенил", "арил-С 2-С 6-алкинил", "алкинилгетероарил-С 2-С 6", "циклоалкилС 1-С 6-алкил", "гетероциклоалкил-С 1-С 6-алкил". Предпочтительные сульфанильные группы включают метилсульфанил, этилсульфанил и т.п."Сульфониламино" относится к группе -NRSO2-R', где каждый из R, R' независимо включает водород, "C1-С 6-алкил", "С 2-С 6-алкенил", "С 2-С 6-алкинил", "С 3-С 8-циклоалкил", "гетероциклоалкил", "арил","гетероарил", "арил-С 1-С 6-алкил" или "гетероарил-С 1-С 6-алкил", "арил-С 2-С 6-алкенил", "гетероарил-С 2 С 6-алкенил ", "арил-С 2-С 6-алкинил", "гетероарил-С 2-С 5-алкинил", "циклоалкил-С 1-С 6-алкил", "гетероциклоалкил-С 1-С 6-алкил"."Аминосульфонил" относится к группе -SO2-NRR', где каждый из R, R' независимо включает водород, "С 1-С 6-алкил", "С 2-С 6-алкенил", "С 2-С 6-алкинил", "С 3-С 8-циклоалкил", "гетероциклоалкил", "арил","гетероарил", "арил-С 1-С 6-алкил" или "гетероарил-С 1-С 6-алкил", "арил.-С 2-С 6-алкенил", "гетероарил-С 2 С 6-алкенил", "арил-С 2-С 6-алкинил", "гетероарил-С 2-С 6-алкинил", "циклоалкил-С 1-С 6-алкил", "гетероциклоалкил-С 1-С 6-алкил"."Замещенный или незамещенный": если нет иных ограничений определением отдельных заместителей, указанные выше группы, такие как группы "алкенил", "алкинил", "арил", "гетероарил", "циклоалкил", "гетероциклоалкил" и т.д. необязательно могут быть замещены от 1 до 5 заместителями, выбранными из группы, состоящей из "C1-С 6-алкила", "С 2-С 6-алкенила" , "С 2-С 6-алкинила", "циклоалкила", "гетероциклоалкила", "С 1-С 6-алкиларила", "C1-C6-алкилгетероарила", "С 1-С 6-алкилциклоалкила", "C1-C6 алкилгетероциклоалкила", "амино", "аммония", "ацила", "ацилокси", "ациламино", "аминокарбонила","алкоксикарбонила", "уреидо", "арила", "карбамата", "гетероарила", "сульфинила", "сульфонила", "алкокси", "сульфанила", "галогена", "карбокси", тригалогенметила, циано, гидрокси, меркапто, нитро и т.п."Фармацевтически приемлемые соли или комплексы" относятся к солям или комплексам определенных ниже соединений формулы (I), которые сохраняют требуемую биологическую активность. Примеры таких солей включают, но не ограничиваются ими, кислотно-аддитивные соли, образованные неорганическими кислотами (например, хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и т.п.), и соли, образованные органическими кислотами, такими как уксусная кислота, щавелевая кислота, виннокаменная кислота, янтарная кислота,яблочная кислота, фумаровая кислота, малеиновая кислота, аскорбиновая кислота, бензойная кислота,дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота, нафталиндисульфоновая кислота и полигалактуроновая кислота. Указанные соединения также можно вводить в качестве фармацевтически приемлемых четвертичных солей, известных специалистам в данной области, которые, в частности, включают четвертичную соль аммония формулы-NR,R',R"+Z-, где R, R', R" независимо представляют собой водород, алкил или бензил, C1-C6-алкил, С 2 С 6-алкенил, С 2-С 6-алкинил, C1-С 6-алкиларил, C1-C6-алкилгетероарил, циклоалкил, гетероциклоалкил, и Z представляет собой противоион, включая, хлорид, бромид, йодид, -О-алкил, толуолсульфонат, метилсульфонат, сульфонат, фосфат или карбоксилат (такой как бензоат, сукцинат, ацетат, гликолят, малеат,малат, фумарат, цитрат, тартрат, аскорбат, циннамоат, манделоат и дифенилацетат)."Фармацевтически активное производное" относится к любому соединению, которое при введении реципиенту способно обеспечивать, прямо или косвенно, активность, описанную в настоящем описании. Термин "косвенно" также охватывает пролекарства, которые могут превращаться в активную форму лекарственного средства с помощью эндогенных ферментов или посредством метаболизма. В настоящее время выявлено, что соединения по настоящему изобретению представляют собой модуляторы фосфатоинозитид-3-киназ (PI3K), включающих PI3Kи . При ингибировании фермента фосфатоинозитид-3-киназы (PI3K) соединениями по настоящему изобретению PI3K становится неспособной проявлять свои ферментативные, биологические и/или фармакологические эффекты. Соединения по настоящему изобретению, таким образом, пригодны для лечения и профилактики аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, аллергии, астмы, панкреатита,полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, злокачественной опухоли,трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата или повреждений легких. Общая формула (I) в соответствии с настоящим изобретением также включает в себя ее таутомеры,ее геометрические изомеры, ее оптически активные формы, такие как энантиомеры, диастереомеры, и ее рацематные формы, а также их фармацевтически приемлемые соли. Предпочтительные фармацевтически приемлемые соли формулы (I) представляют собой кислотно-аддитивные соли, образованные фармацевтически приемлемыми кислотами, такие как гидрохлорид, гидробромид, сульфат или бисульфат, фосфат или гидрофосфат (кислый фосфат), ацетат, бензоат, сукцинат, фумарат, малеат, лактат, цитрат, тартрат,глюконат, метансульфонат, бензолсульфонат и паратолуолсульфонат. Соединения формулы (I) пригодны для модулирования, особенно ингибирования, активности фосфатоинозитид-3-киназ (PI3K). Таким образом, полагают, что соединения по настоящему изобретению также особенно пригодны для лечения и/или профилактики нарушений, опосредуемых PI3K, в частностиPI3K а и/или PI3K . Указанное лечение включает модулирование - особенно ингибирование или отрицательную регуляцию - фосфатоинозитид-3-киназ. Соединения формулы (I) пригодны для применения в качестве лекарственного средства. Один вариант осуществления настоящего изобретения относится к производным тиазола формулы где R1 представляет собой ацил формулы С(О)R, где R представляет собой Н или С 1-12 алкил;R3 выбран из следующих тиенильных групп:R4 выбран из Н, необязательно замещенного C1-С 6-алкила; необязательно замещенного С 2-С 6 алкенила, необязательно замещенного С 2-С 6-алкинила, необязательно замещенного алкоксикарбонила и необязательно замещенного ацила формулы C(O)R, где R представляет собой Н или С 1-12 алкил, а также необязательно замещенного морфолинкарбонила и необязательно замещенного пиперидинкарбонила;R5 и R6 независимо выбраны из Н и галогена; а также его геометрическим изомерам, его оптически активным формам, таким как энантиомеры, диастереомеры и ее рацематным формам, а также их фармацевтически приемлемым солям. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R2 представляет собой метил. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R3 представляет собой тиенил Т 1. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R3 представляет собой тиенил Т 2. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R4 выбран из Н, необязательно замещенного С 1-С 6-алкила, необязательно замещенного С 2-С 6 алкенила и необязательно замещенного С 2-С 6-алкинила. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R4 представляет собой необязательно замещенный ацил формулы C(O)R, где R представляет собой Н или С 1-12-алкил, и необязательно замещенный алкоксикарбонил. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R5 и R6 представляют собой Н. Соединения по настоящему изобретению включают, в частности, соединения группы:-9 017166 Соединения по настоящему изобретению пригодны в качестве лекарственных средств. Их можно использовать для приготовления лекарственного средства для профилактики и/или лечения аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, заболеваний почек, агрегации тромбоцитов, злокачественной опухоли, трансплантации, дефицита эритроцитов, отторжения трансплантата или повреждений легких. В одном варианте осуществления соединения формулы (I) пригодны для лечения и/или профилактики аутоиммунных заболеваний или воспалительных заболеваний, таких как рассеянный склероз, псориаз, ревматоидный артрит, системная красная волчанка, воспалительное заболевание кишечника, воспаление легкого, тромбоз или инфекция/воспаление головного мозга, такое как менингит или энцефалит. В другом варианте осуществления соединения формулы (I) пригодны для лечения и/или профилактики нейродегенеративных заболеваний, включающих болезнь Альцгеймера, болезнь Гентингтона, травму ЦНС, инсульт или ишемические состояния. В следующем варианте осуществления в соответствии с этим изобретением соединения формулы(I) пригодны для лечения и/или профилактики сердечно-сосудистых заболеваний, таких как атеросклероз, гипертрофия сердца, дисфункция кардиомиоцитов, повышенное кровяное давление или ангиоспазм. В следующем варианте осуществления в соответствии с этим изобретением соединения формулы(I) пригодны для лечения и/или профилактики дефицита эритроцитов, такого как анемия, включая гемолитическую анемию, апластическую и изолированную эритроцитарную анемию. В другом варианте осуществления в соответствии с этим изобретением соединения формулы (I) пригодны для лечения и/или профилактики хронического обструктивного заболевания легких, связанного с анафилактическим шоком фиброза, псориаза, аллергических заболеваний, астмы, инсульта или ишемических состояний, ишемии-реперфузии, агрегации/активации тромбоцитов, атрофии/гипертрофии скелетных мышц, рекрутинга лейкоцитов в ткани злокачественной опухоли, ангиогенеза, инвазивных метастазов, в частности меланомы, саркомы Капоши, острых и хронических бактериальных и вирусных инфекций, сепсиса, трансплантации, отторжения трансплантата, гломерулосклероза, гломерулонефрита,прогрессивного почечного фиброза, эндотелиальных и эпителиальных повреждений в легком или, в целом, воспаления дыхательных путей легких. В другом варианте осуществления в соответствии с этим изобретением предусмотрен способ получения производных тиазола формулы (I), включающий стадию взаимодействия амина формулы (Р 1) с производным формулы (Р 2) в присутствии комплексов палладия, таких как Pd(PPh3)4, хлорид [1,1'-бис где X может представлять собой Br или I, R7 может представлять собой Н в случае производных бороновой кислоты, или любую C1-С 6-алкильную или замещенную С 1-С 6-алкильную группы в случае производных боронового эфира, и где группа -B(OR7)2 может необязательно образовывать гетероцикл, такой как пинаколовый эфир бороновой кислоты. В еще одном варианте осуществления в соответствии с этим изобретением предусмотрено соединение формулы (Р 2), которое представляет собой метил 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)тиофен-2-карбоксилат. В другом варианте осуществления в соответствии с этим изобретением предусмотрен способ получения производного тиазола формулы (I), включающий стадию взаимодействия соединения формулы где X может представлять собой Br или I и R8 представляет собой метил или н-бутил. Производные тиазола, иллюстрирующие изобретение, можно получать из доступных исходных материалов с использованием следующих основных способов и процессов. Следует понимать, что когда приведены типичные или предпочтительные экспериментальные условия (т.е. температуры реакции,время, количество моль реагентов, растворители и т.д.), также можно использовать другие экспериментальные условия, если нет иных указаний. Оптимальные условия реакции могут различаться в зависимости от конкретных используемых участвующих в реакции веществ или растворителей, однако такие ус- 10017166 ловия может определить специалист в данной области с использованием общепринятых способов оптимизации. При применении в качестве фармацевтических средств соединения по настоящему изобретению,как правило, вводят в форме фармацевтической композиции. Таким образом, фармацевтические композиции, содержащие соединение формулы (I) и фармацевтически приемлемый носитель, разбавитель или эксципиент, таким образом, также находятся в объеме настоящего изобретения. Специалист в данной области знает множество таких соединений носителей, разбавителей или эксципиентов, пригодных для составления фармацевтической композиции. Соединениям по этому изобретению, совместно с общепринятым используемым адъювантом, носителем, разбавителем или эксципиентом, можно придавать форму фармацевтических композиций и их стандартных доз, и в такой форме их можно использовать в виде твердых форм, таких как таблетки или заполненные капсулы, или жидкостей, таких как растворы, суспензии, эмульсии, эликсиры, или капсулы,наполненные ими, для перорального применения, или в форме стерильных инъецируемых растворов для парентерального (в том числе подкожного) применения. Такие фармацевтические композиции и их стандартные дозированные формы могут содержать ингредиенты в общепринятых соотношениях с дополнительными активными соединениями или компонентами, или без них, и такие стандартные дозированные формы могут содержать любое пригодное эффективное количество активного ингредиента, соответствующее предполагаемому диапазону суточной дозировки, подлежащему применению. Фармацевтические композиции, содержащие производные тиазола по изобретению, можно получать способами, хорошо известными в фармацевтической области, и они содержат по меньшей мере одно активное соединение. Как правило, соединения по изобретению вводят в фармацевтически эффективном количестве. Количество фактически вводимого соединения, как правило, будет определять врач с учетом соответствующих обстоятельств, включая подлежащее лечению состояние, выбранный способ введения,конкретное вводимое соединение, возраст, массу тела и ответ конкретного пациента, тяжесть симптомов пациента и т.п. Фармацевтические композиции по настоящему изобретению можно вводить множеством способов,включая пероральный, ректальный, чрескожный, подкожный, внутривенный, внутримышечный и интраназальный. Композиции для перорального введения могут находиться в форме жидких растворов или суспензий в резервуаре, или нерасфасованных порошков. Более часто, однако, композиции представлены в виде стандартных дозированных форм для упрощения точного дозирования. Термин "стандартные дозированные формы" относится к физически дискретным единицам, пригодным для однократных дозировок для человека и других млекопитающих, и каждая единица содержит установленное количество активного вещества, вычисленное для достижения требуемого терапевтического эффекта, совместно с пригодным фармацевтическим эксципиентом. Типичные стандартные дозированные формы включают предварительно заполненные дозированные ампулы или шприцы в случае жидких композиций, или пилюли,таблетки, капсулы или сходные с ними в случае твердых композиций. В таких композициях производное тиазола, как правило, представляет собой неосновной компонент (от приблизительно 0,1 до приблизительно 50 мас.% или предпочтительно от приблизительно 1 до приблизительно 40 мас.%), где оставшаяся часть представляет собой вещества для доставки или носители и технологические добавки, способствующие формированию требуемой дозированной формы. Жидкие формы, пригодные для перорального введения, могут включать пригодный водный или неводный носитель с буферами, суспендирующими и размельчающими средствами, красителями, вкусовыми добавками и т.п. Твердые формы могут включать, например, любой из следующих ингредиентов,или сходные соединения: связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза, дезинтегрирующее вещество, такое как альгиновая кислота, примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния; вещество, способствующее скольжению, такое как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или вкусовая добавка, такая как мята перечная, метилсалицилат,или добавка со вкусом апельсина. В основе инъецируемых композиций, как правило, лежит инъецируемый стерильный физиологический раствор или фосфатно-солевой буфер или другие инъецируемые носители, известные в данной области. Как упомянуто выше, производные тиазола формулы (I) в таких композициях, как правило, представляют собой неосновной компонент, часто находящийся в диапазоне между 0,05 и 10 мас.%, а остальную часть составляет инъецируемый носитель и т.п. Описанные выше компоненты для перорально вводимых или инъецируемых композиций являются только репрезентативными. Дополнительные материалы, а также способы обработки и т.п. представлены в 5 разделе Remington's Pharmaceutical Sciences, 20 издание, 2000, Marck Publishing Company, Истон, Пенсильвания, который включен в настоящее описание в качестве ссылки. Соединения по изобретению также можно вводить в форме систем для доставки лекарственного средства с замедленным высвобождением. Описание репрезентативных материалов для замедленного высвобождения также можно найти в материалах, включенных в Remington's Pharmaceutical Sciences.- 11017166 Синтез соединений формулы (I) Новые производные тиазола формулы (I) можно получать из широко доступных исходных материалов с помощью нескольких подходов синтеза с использованием как жидкофазных, так и твердофазных методов синтеза (Brummond et al. , 1999, J.O.C., 64, 1723-1726). Методы синтеза описаны далее. Следующие сокращения относятся соответственно к представленным ниже определениям:(ангстрем), см (сантиметр), экв (эквивалент), ч (час), г (грамм), М (молярный), МГц (мегагерц), мкл (микролитр), мин (минута), мг (миллиграмм), мл (миллилитр), мм (миллиметр), ммоль (миллимоль), мМ (миллимолярный), нм (нанометр), rt (комнатная температура), БСА (бычий сывороточный альбумин), CDI(фосфоинозитиды), PI3K (фосфоинозитид-3-киназы), PI(3)P (фосфатидилинозитол-3-монофосфат),PI(3,4)P2 (фосфатидилинозитол-3,4-бисфосфат), PI(3,4,5)P3 (фосфатидилинозитол-3,4,5-трисфосфат),PI(4)P (фосфатидилинозитол-4-фосфат), PI(4,5)P2 (фосфатидилинозитол-4,5-бифосфат), PtdIns (фосфатидилинозитол), РуВОР (гексафторфосфат бензотриазол-1-илокси)трипирролидинофосфония), SPA (сцинтилляционный анализ сближения) TEA (триэтиламин), TFA (трифторуксусная кислота), THF (тетрагидрофуран), TLC (тонкослойная хроматография), УФ (ультрафиолет). Производные тиазола, иллюстрирующие изобретение, можно получать из доступных исходных материалов с использованием следующих основных способов и процессов. Следует понимать, что когда приведены типичные или предпочтительные экспериментальные условия (т.е. температуры реакции,время, количество моль реагентов, растворители и т.д.), также можно использовать другие экспериментальные условия, если нет иных указаний. Оптимальные условия реакции могут различаться в зависимости от конкретных используемых участвующих в реакции веществ или растворителей, однако такие условия может определить специалист в данной области с использованием общепринятых способов оптимизации. В процессе, проиллюстрированном в следующих схемах, R1, R2, R3, R4, R5 и R6 являются такими,как определено выше в описании. Главным образом, производные тиазола общей формулы (I) можно получать с помощью нескольких подходов синтеза с использованием как жидкофазных, так и твердофазных протоколов химии (Kodomariet al., 2002; Tetrahedron Lett., 43, 1717-1720) либо посредством общепринятых способов, либо посредством микроволновых способов. Фармацевтически приемлемые катионные соли соединений по настоящему изобретению легко получают проведением реакции кислых форм с соответствующим основанием, как правило одноэквивалентным, в сорастворителе. Типичные основания представляют собой гидроксид натрия, метоксид натрия, этоксид натрия, гидрид натрия, гидроксид калия, метоксид калия, гидроксид магния, гидроксид кальция, бензатин, холин, диэтаноламин, этилендиамин, меглумин, бенэтамин, диэтиламин, пиперазин и трометамин. Соль выделяют концентрированием досуха или добавлением осадителя. В некоторых случаях соли можно получать смешиванием раствора кислоты с раствором катиона (этилгексаноат натрия,олеат магния) с использованием растворителя, в котором требуемая катионная соль осаждается, или в ином случае ее можно выделять концентрированием и добавлением осадителя. Способы получения промежуточных соединений для соединений формулы (I) В зависимости от структуры X, R1, R2, R3, R4, R5 и R6 для синтеза соединений формулы (I) можно выбирать различные стратегии синтеза. Соединения формулы (I) можно получать катализируемой металлом реакцией перекрестной конденсации. Например, их можно получать реакцией конденсации Сузуки между арилгалогенидом (Р 1), гдеX может представлять собой Br или I, и бороновой кислотой или сложным эфиром (P2), где R7 может представлять собой Н в случае производных бороновой кислоты, или любую алкильную или замещенную алкильную группы в случае производных боронового эфира, где необязательно -ВOR7)2 образует цикл, такой как пинаколовый эфир бороновой кислоты (схема 1, ниже) (Bellina et al., 2004, Synthesis,2419). Можно использовать различные комплексы палладия, такие как Pd(PPh3)4, хлорид [1,1'бис(дифенилфосфино)ферроцен]палладия(II) (Pd(dppf)Cl2), PdCl2(PPh3)2, Pd(OAc)2, при возможном добавлении фосфиновых лигандов, таких как PPh3. Можно использовать различные органические или неорганические основания, такие как TEA, DIEA, алкоголят натрия, такой как NaOMe или NaOEt, KF, или любые карбонатные соли, такие как K2CO3, Na2CO3, Cs2CO3. Растворитель или смеси растворителей можно выбирать из THF, толуола, диоксана, МеОН, MeCN, DMF, воды и т.д. Выбор растворителя или смеси растворителей может зависеть от структуры основания (Р 1) и (Р 2). Полученную реакционную смесь можно нагревать в инертной атмосфере при различных температурах, при возможном применении- 12017166 микроволнового излучения. Можно использовать все различные сочетания, описанные выше. Схема 1 Для получения соединений формулы (I) можно использовать реакцию конденсации Стилла, включающую реакцию между арилгалогенидом (Р 1), где X может представлять собой Br или I, и содержащим олово реагентом (Р 3), где R8 представляет собой метил или н-бутил (схема 2, ниже). Эта реакция может катализироваться различными комплексами палладия, такими как Pd(PPh3)4, хлорид [1,1'-бис(дифенилфосфино)ферроцен]палладия(II) (Pd(dppf )Cl2), PdCl2(PPh3)2, Pd(OAc)2, при возможном добавлении фосфиновых лигандов, таких как PPh3, и солей хлора, таких как LiCl или ZnCl2. Схема 2 Если указанные выше условия катализируемой металлом реакции перекрестной конденсации не применимы для получения соединений формулы (I), то следует использовать пригодные способы получения, известные специалисту в данной области. Соединения формулы (I) можно превращать в альтернативные соединения формулы (I) с использованием пригодных способов взаимопревращения, хорошо известных специалисту в данной области. Когда R4 представляет собой Н, соединения формулы (Ia), где R3 может представлять собой Т 1 или Т 2,можно далее функционализировать посредством реакций электрофильного замещения (схема 3, ниже). Например, хлорсульфонирование хлорсульфоновой кислотой с последующей реакцией с PCl5/POCl3 может привести к соответствующему сульфонилхлориду (Р 4). Далее можно проводить реакцию промежуточного соединения (Р 4) с амином, HNR9R10, где R9 и R10 выбраны из Н, необязательно замещенного С 1-С 6-алкила (например, аллила, 2-гидроксиэтила), где необязательно -NR9R10 может образовывать кольцо, и может быть выбран из замещенного гетероциклоалкила,такого как необязательно замещенный пиперидин (например, 3-гидроксипиперидин-1-ил, 4-гидроксипиперидин-1-ил), необязательно замещенный морфолин (например, морфолин-4-ил) и необязательно замещенный 8-(1,4-диокса-8-азаспиро[4.5]декан), в присутствии основания, например TEA, DIEA, пиридина и т.д., с получением соединений формулы (Ib) (соединений формулы (I), где R4=SO2NR9R10), аминосульфонила, как определено выше, и где R3 может представлять собой Т 1 или Т 2. Для соединение формулы (Ia) можно проводить другие реакции электрофильного замещения, такие как бромирование, нитрирование, формилирование, ацилирование и т.д. с использованием условий, известных специалисту в данной области (например, см. Beaton et al., 1976, J. Chem. Soc., Perkin I, 2355-2363). Соединения формулы (Ia) можно депротонировать с помощью пригодного основания, такого как алкиллитий, с получением промежуточного соединения (P5), которое далее можно подвергать реакции с электрофилом. Например,реакция промежуточного соединения (Р 5) с СО 2 может приводить к соединениям формулы (Ic), где- 13017166 Соединения формулы (Ic) также можно получать омылением сложного эфира (Id) (соединений формулы (I), где R4 = CO2Alk, где Alk может представлять собой любую С 1-С 6-алкильную группу, необязательно замещенный алкил) (схема 3). Соединения (Id) можно получать реакцией перекрестной конденсации между (Р 1) и пригодным замещенным тиофеном (Р 2) или (Р 3). Соединения формулы (Ic) далее можно превращать в соответствующий амид (Ie) (соединения формулы (I), где R4=CO2NR11R12 представляет собой аминокарбонил, как определено выше, и где R3 может представлять собой Т 1 или Т 2) (схема 4, ниже). Амид (Ie) можно получать конденсацией соответствующей карбоновой кислоты (Ic) с амином HNR11R12, где R11 и R12 выбраны из Н, необязательно замещенного C1-С 6-алкила, необязательно -NR11R12 может образовывать кольцо, и может быть выбран из замещенного гетероциклоалкила, такого как необязательно замещенный морфолин (например, морфолин-4-ил),необязательно замещенный пиперидин (например 4-гидроксипиперидин-1-ил, 3-гидроксипиперидин-1 ил), в присутствии активирующего вещества, такого как DCC, EDC, HOBt, PyBOP, и т.д. В зависимости от структуры вещества для проведения конденсации может быть необходимым добавление основания,такого как TEA или DIEA. Растворители могут быть выбраны из DCM, DMF, MeCN или любых других растворителей, пригодных для такого превращения. Схема 4 Карбоновую кислоту (Ic) сначала можно превращать в соответствующий хлорангидрид (Р 6) с использованием пригодного реагента, такого как оксалилхлорид или тионилхлорид. Реакция полученного хлорангидрида с амином HNR11R12, как определено выше, в присутствии основания, например пиридина, DIEA, TEA и т.д., может привести к соединениям формулы (Ie) (соединениям формулы (I), где R4=CO2NR11R12). В случае аминов с низкими температурами кипения соединения формулы (Ie) можно получать нагреванием сложного эфира (Id) в амине HNR11R12, используемом в качестве растворителя под действием микроволнового излучения, где R11 и R12 определены выше. Спирты формулы (If) (соединения формулы (I), где R3=T1 или Т 2 и R4=CH2OH) можно получать восстановлением промежуточного соединения (Р 6) при добавлении гидрида, такого как три-третбутоксиалюминогидрид лития (tBuO)3 AlHLi). Соответствующий альдегид формулы (Ig) (соединения формулы (I), где R3=T1 или Т 2 и R4=C(O)H), можно получать окислением спирта (If) в условиях, известных специалисту в данной области, таких как окисление Сверна и Десс-Мартина. Спирты формулы (If) (соединения формулы (I), где R3=T1 или Т 2 и R4=CH2OH) можно далее превращать в соответствующий тиенилацетонитрил (Ih) (соединение формулы (I), где R3=T1 или Т 3 и R4=CH2CN) посредством двухстадийного процесса, превращения первичного спирта в пригодную уходящую группу,такую как трифлат или хлор, с последующей реакцией SN2 с NaCN в качестве нуклеофила. Альдегид (Ih) можно далее превращать восстановительным аминированием с получением соединения формулы (Ii) (соединения формулы (I), где R3=T1 или Т 2, R4 = -CH2NR13R14, и R13 и R14 выбраны из Н, необязательно замещенного С 1-С 6-алкила, такого как аллил. Схема 5- 14017166 Восстановительное аминирование альдегида (Ih) можно проводить посредством одной или двух стадий. Амин R13R14NH, где R13 и R14 выбраны из Н, необязательно замещенного С 1-С 6-алкила, такого как аллил, и альдегид (Ih) можно смешивать в присутствии восстановителя, такого как NaHB(OAc)3 илиNaBH3CN с получением одностадийным методом соединения формулы (Ii). Соответствующее промежуточное соединение, представляющее собой имин, можно сначала выделять, а затем проводить восстановление пригодным реагентом, таким как NaBH4 или любой другой реагент, известный специалисту в данной области. Тиофенкарбальдегид (Ih) можно превращать в соответствующий тиофенкарбонитрил (Ik) (соединение формулы (I), где R3=T1 или Т 2 и R4=CN, как описано выше). Нагревание альдегида (Ih) с 10 экв. гидрохлорида гидроксиламина и 10 экв. пиридина в смеси 1:1 EtOH/THF при 70 С может привести к получению оксима карбальдегида (Ij) (соединение формулы (I), где R4=CHNOH). Его далее можно превращать в соответствующий карбонитрил (Ik) проведением реакции с ацетатом меди в ацетонитриле при 70 С. Карбонитрил (Ik) также можно получать в однореакторном процессе проведением реакции тиофенкарбальдегида (Ih) с гидрохлоридом гидроксиламина и мезилхлоридом в DMF под действием микроволнового излучения. Схема 6 Соединения формулы (Ia)-(Ik) можно получать непосредственно катализируемой металлом реакцией перекрестной конденсации, проводя реакцию между (Р 1) и пригодным замещенным тиофеном (Р 2) или (Р 3). Бороновая кислота или сложный эфир (Р 2) могут быть коммерчески доступными из различных источников, или их можно синтезировать, как подробно описано ниже в примерах, с использованием условий, известных специалисту в данной области. Бороновую кислоту (Р 2 а) можно превращать в соответствующий бороновый эфир (Р 2b) нагреванием (Р 2 а) в присутствии спирта или диола (схема 7, ниже). Бороновый эфир (Р 2b) можно превращать в альтернативный бороновый эфир с использованием условий,известных специалисту в данной области. Схема 7 Пинаколовый бороновый эфир (Р 2 с) можно получать реакцией конденсации с металлом между соответствующим тиофенгалогенидом, (Р 4), где X=Br, I и т.д., и бис (пинаколато) дибороном (Р 5) или пинаколбораном (Р 6) (схема 8, ниже). Эту реакцию можно катализировать с использованием различных комплексов палладия, таких как Pd(PPh3)4, хлорид [1,1'-бис(дифенилфосфино) ферроцен]палладия(II)(Pd(dppf)Cl2), PdCl2(PPh3)2, Pd(OAc)2, при возможном добавлении фосфиновых лигандов, таких как PPh3. Можно использовать различные органические или неорганические основания, такие как TEA,DIEA, KF, КОН, или любую карбонатную соль, такую как K2CO3, Na2CO3, Cs2CO3. Растворитель или смесь растворителей можно выбирать из THF, толуола, диоксана, МеОН, MeCN, DMF, воды и т.д. Полученную реакционную смесь можно нагревать в инертной атмосфере при различных температурах, при возможном применении микроволонового излучения. Можно использовать все различные сочетания,описанные выше. Тиофенгалогенид (Р 4) сначала можно превращать в соответствующий тиофеновый реагент Гриньяра (Р 7), который можно подвергать реакции с триалкилборатом, например B(OMe)3, а затем можно либо обрабатывать кислотой с получением соответствующей бороновой кислоты (Р 2 а), либо обрабатывать пригодным спиртом или диолом R7OH с получением соответствующего боронового эфира (Р 2b). Прямое 2-борилирование можно проводить катализируемой иридием реакцией из 2-незамещенных производных тиофена (Р 8) (схема 9, ниже). Комплекс с иридием (I), образованный 1/2 [Ir (OMe) (COD)]2 и 4,4'-ди-трет-бутил-2,2'-бипиридином, катализирует прямое борилирование производных тиофенов в стехиометрических количествах относительно бис(пинаколато)диборона, что приводит к получению тиофен-2-боронового эфира (Р 2 с'). Схема 9 Если указанное выше сочетание условий не применимо для получения, боронового эфира или кислоты (Р 2), тогда следует использовать пригодные способы получения, известные специалисту в данной области. Оловоорганические реагенты (Р 3) могут быть коммерчески доступными или их можно синтезировать с использованием условий, известных специалисту в данной области. Соединения формулы (Р 1), где X=Br или I, можно получать галогенированием соответствующего тиазола (Р 9) такими реагентами, как Br2, I2 или NBS, NTS (схема 10, ниже) . В зависимости от структурыR1 перед галогенированием может быть необходима защита вторичного амина, например, с помощью Тиазол (Р 9) может быть коммерчески доступным из различных источников, или его можно синтезировать с использованием условий, известных специалисту в данной области, с применением как жидкофазных, так и твердофазных методов синтеза (Kodomari et al., 2002, выше). Например, его можно получать двухстадийным методом (схема 11, ниже), исходя из -галогенирования кетона (Р 10) с использованием, например, Br2 в случае бромирования или тионилхлорида в случае хлорирования, с получением- 16017166 промежуточного соединения (Р 11). "Hal" в промежуточном соединении (Р 11) также может представлять собой группу тозилокси, которую можно вносить с помощью пригодных реагентов, таких как гидрокси(тозилокси)йодбензол. Затем промежуточное соединение (Р 11) можно добавлять к раствору замещенной тиомочевины R1NHC(S)NH2 (P12) в пригодном растворителе, предпочтительно полярном растворителе, например EtOH, с получением промежуточного соединения (Р 9). Полученное промежуточное соединение (Р 11) можно подвергать реакции с тиомочевиной, с получением тиазола (Р 13), который может быть далее замещен посредством R1, как определено выше, с использованием условий, известных специалисту в данной области. Схема 11 Соединения тиомочевины (Р 12), используемые в схеме синтеза 11, выше либо коммерчески доступны из различных источников, либо их синтезируют с использованием условий, известных специалисту в данной области. Например, соединения тиомочевины (Р 12) можно получать конденсацией соли амина R1HI2, предпочтительно соли HCl, с тиоцианатом калия, используемого в эквимолярных количествах, в THF, при кипячении с обратным холодильником, как показано на схеме 12, ниже, каскад А. Схема 12 Амин R NH2 сначала можно активировать этоксикарбонилизотиоцианатом с получением промежуточного соединения, этоксикарбонилтиомочевины, как представлено выше на схеме 12, каскад В. При удалении защитной группы в кислых условиях, например, в присутствии концентрированной HCl, происходит высвобождение требуемого соединения тиомочевины (Р 12). Амин R1NH2 также можно активировать бензоилизотиоцианатом, который получают добавлением бензоилхлорида к тиоцианату аммония,- 17017166 с получением промежуточного соединения, бензоилтиомочевины, как показано выше на схеме 12, каскад С. При удалении защитной группы в щелочных условиях, например, в присутствии NaOH, происходит высвобождение требуемого соединения тиомочевины (Р 12). Альтернативно амин R1NH2 можно подвергать реакции с тиофосгеном, а затем добавлять аммиак, как представлено выше на схеме 12, каскад D. Если указанные выше способы синтеза не применимы для получения N-замещенной тиомочевины (Р 12),тогда следует использовать пригодные способы получения, известные специалисту в данной области. Способы получения промежуточных соединений для соединений формулы (I) В соответствии с дальнейшим общим процессом соединения формулы (I) можно превращать в альтернативные соединения формулы (I) с использованием пригодных способов взаимопревращения, хорошо известных специалисту в данной области. Если представленный выше ряд общих способов синтеза не применим для получения соединений формулы (I) и/или промежуточных соединений, необходимых для синтеза соединений формулы (I), следует использовать пригодные способы получения, известные специалисту в данной области. Как правило, синтез любого конкретного соединения формулы (I) зависит от конкретных заместителей каждой молекулы и от доступности необходимых промежуточных соединений; такие факторы также учитывают специалисты в данной области. Для всех способов внесения и удаления защитной группы, см. Philip J.Peter G.M. Wuts в "Protective Groups in Organic Synthesis", Wiley Interscience, 3 издание, 1999. Соединения по этому изобретению можно выделять вместе с молекулами растворителя посредством кристаллизации при выпаривании соответствующего растворителя. Фармацевтически приемлемые кислотно-аддитивные соли соединений формулы (I), которые содержат основный центр, можно получать общепринятыми способами. Например, раствор свободного основания можно обрабатывать пригодной кислотой, либо в чистом виде, либо в пригодном растворе, и полученную соль выделять либо фильтрацией, либо выпариванием в вакууме растворителя реакционной смеси. Фармацевтически приемлемые основно-аддитивные соли можно получать аналогичным образом посредством обработки раствора соединения формулы (I) пригодным основанием. Оба типа солей можно получать или взаимопревращать,используя методики, которые используют ионообменную смолу. Представленное ниже настоящее изобретение можно проиллюстрировать посредством некоторых примеров, которые не следует рассматривать как ограничивающие объем этого изобретения. Примеры Использовали следующие коммерчески доступные исходные материалы: РуВОР (Novabiochem), 2-(трибутилстаннил)тиофен (Aldrich), 5-(дигидроксиборил)-2-тиофенкарбоновая кислота (Acros), 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)тиофен (Boron-Mol), 5-формил-2 тиофенбороновая кислота (Aldrich), 2-ацетамидо-4-метилтиазол (Aldrich), пинакол (Aldrich), 2 н. растворWaters ZMD (ES) ; 1 Н-ЯМР: Bruker DPX-300 МГц. Очистку посредством препаративной ВЭЖХ проводят с помощью системы для ВЭЖХ Waters PrepLC 4000 System, оборудованной колонками Prep Nova-PakHR С 186 мкМ 60 , 4030 мм (вплоть до 100 мг) или XTerra Prep MS C8, 10 мкМ, 50300 мм (вплоть до 1 г). Все процессы очистки проводят с помощью градиента MeCN/H2O 0,09% TFA. Полупрепаративную ВЭЖХ с обращенной фазой проводят с помощью системы Biotage Parallex Flex System, оборудованной колонками Supelcosil ABZ+Plus (25 см 21,2 мм, 12 мкМ) ; УФ-детекция при 254 нм и 220 нм; скорость потока 20 мл/мин (вплоть до 50 мг). Анализ TLC проводят на планшетах Merck Precoated 60 F254. Очистку флэш-хроматографией проводят с подложкой на основе SiO2 с использованием смесей циклогексан/EtOAc или DCM/MeOH в качестве элюентов. Химические реакции с помощью микроволнового излучения проводят на однорежимном микроволновом реакторе Emrys Optitniser от Personal Chemistry. Промежуточное соединение 1: Получение N-(5-йод-4-метил-1,3-тиазол-2-ил)ацетамида (промежуточное соединение (Р 1), где R1 представляет собой С(О)СН 3, R2 представляет собой СН 3 и X представляет собой I).- 18017166 К раствору 2-ацетамидо-4-метилтиазола (5 г; 32,01 ммоль; 1 экв.) в MeCN (100 мл) добавляют Nйодсукцинимид (8,642 г; 38,41 ммоль; 1,2 экв.). Полученный гомогенный раствор перемешивают при комнатной температуре. Через 5 мин образуется осадок. Его фильтруют и промывают холодным MeCN. Первую партию промежуточного соединения 1 выделяют в виде не совсем белого твердого вещества(5,072 г; 57%). Маточные растворы выпаривают и растворяют в EtOAc. Их промывают двумя частями 1 н. раствора Na2S2O3 и сушат над MgSO4. После фильтрации и выпаривания растворителей полученное твердое вещество суспендируют в MeCN, фильтруют и сушат в вакууме с получением второй партии промежуточного соединения 1 в виде не совсем белого твердого вещества (1,813 г; 20%). Общий выход этой реакции составляет 77%. 1 Н-ЯМР (DMSO-d6, 300 МГц)1,88 (с, 3 Н), 2,02 (с, 3 Н), 12,02 (с, 1 Н). M-(ESI): 281,02; M+(ESI): 283,09. ВЭЖХ, Rt: 2,55 мин (чистота: 100%). Промежуточное соединение 2. Получение метил 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил) тиофен-2-карбоксилата (промежуточное соединение Р 2 с, где R5=R2=H и R4=C(O)CH3)Et2O (100 мл) и МеОН (5 мл). Добавляют пинакол (687,2 мг; 5,82 ммоль; 1 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Для завершения реакции добавляют небольшое количество пинакола (200 мг; 1,7 ммоль; 0,3 экв.) и смесь перемешивают в течение 12 дополнительных часов. Добавляют воду (50 мл) и две фазы разделяют. Водную фазу экстрагируют простым эфиром (50 мл). Объединенные органические фазы сушат над MgSO4, фильтруют и выпаривают с получением 5(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)тиофен-2-карбоновой кислоты в виде не совсем белого твердого вещества (1,33 г; 90%). 1 Н-ЯМР (DMSO-d6, 300 МГц)1,13 (с, 12 Н), 7,37 (д, J=3,8 Гц, 1 Н), 7,58 (д, J=3,8 Гц, 1 Н), 13,12 (с,1 Н) . M-(ESI): 253. ВЭЖХ, Rt: 0,98 мин (чистота: 100%). Стадия 2. Метил 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)тиофен-2-карбоксилат. 5-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)тиофен-2-карбоновую кислоту (1,33 г; 5,23 ммоль; 1 экв.) растворяют в МеОН (60 мл) и толуоле (14 мл). По каплям добавляют раствор (триметилсилил)диазометана (7,85 мл; 2 М; 15,70 ммоль; 3 экв.). Полученную смесь перемешивают в течение 5 ч при комнатной температуре. Для завершения реакции добавляют раствор (триметилсилил)диазометана (7,85 мл; 2 М; 15,70 ммоль; 3 экв.). Через 3 ч превращение прекращается. Растворители выпаривают и полученное твердое вещество перекристаллизовывают в МеОН с получением промежуточного соединения 2 в виде не совсем белого твердого вещества (1087 мг; 77,5%). 1N-(5-йод-4-метил-1,3-тиазол-2-ил)ацетамид, промежуточное соединение 1 (3,300 г; 11,70 ммоль; 1 экв.), 5-формил-2-тиофенбороновую кислоту (2,737 г; 17,55 ммоль; 1,50 экв.), триэтиламин (4,86 мл; 35,09 ммоль; 3 экв.) растворяют в DMF (70 мл). Смесь дегазируют аргоном, добавляют Pd(dppf)Cl2 (428 мг; 0,58 ммоль; 0,05 экв.) и смесь нагревают при 95 С в течение 2 ч. Растворители выпаривают и неочищенную смесь суспендируют в THF. Ее фильтруют с получением соединения (1) в виде коричневого твердого вещества (864 мг; 28%). 1- 19017166 Стадия 1. N-(5-5-[(Е)-(Аллилимино)метил]-2-тиенил-4-метил-1,3-тиазол-2-ил)ацетамид. К раствору аллиламина (17 мкл; 0,23 ммоль; 1,20 экв.) и уксусной кислоты (16 мкл; 0,28 ммоль;. 1,50 экв.) в сухом THF (5 мл) добавляют безводный сульфат магния (94 мг; 0,78 ммоль; 4,15 экв.) и N- [5(5-формил-2-тиенил)-4-метил-1,3-тиазол-2-ил]ацетамид, соединение (1), (50 мг; 0,19 ммоль; 1 экв.). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Смесь фильтруют и промывают безводным THF и DCM с получением N-(5-5-[(E)-(аллилимино)метил]-2-тиенил-4-метил-1,3 тиазол-2-ил)ацетамида, который используют на следующей стадии без дальнейшей очистки (57,3 мг, количественный выход). Стадия 2. N-(5-5-[(Аллиламино)метил]-2-тиенил-4-метил-1,3-тиазол-2-ил)ацетамид (2).N-(5-5-[(Е)-(аллилимино)метил]-2-тиенил-4-метил-1,3-тиазол-2-ил)ацетамид, полученный на стадии 1, как описано выше (57,3 мг; 0,19 ммоль; 1 экв.), растворяют в 4 мл МеОН. Добавляют NaBH4 (7,1 мг; 0,19 ммоль; 1 экв.). После одной ночи для завершения реакции добавляют вторую часть NaBH4 (7,1 мг; 0,19 ммоль; 1 экв.). Реакционную смесь гасят добавлением воды (2 мл) и растворители концентрируют. Водную фазу подкисляют 1 н. HCl и промывают AcOEt. Затем ее подщелачивают посредствомNaHCO3 и требуемый продукт экстрагируют посредством AcOEt. Объединенные органические слои сушат над сульфатом магния, фильтруют и концентрируют с получением соединения (2) в виде оранжевого твердого вещества (24,1 мг; 42%). 1N-[5-(5-формил-2-тиенил)-4-метил-1,3-тиазол-2-ил]ацетамид, соединение (1), полученный как описано выше (25 мг; 0,09 ммоль; 1 экв.), растворяют в МеОН (2 мл) и добавляют борогидрид натрия (3,6 мг; 0,0 9 ммоль; 1 экв.). После одной ночи для завершения реакции добавляют вторую часть NaBH4 (7,1 мг; 0,19 ммоль; 1 экв.). Реакционную смесь гасят добавлением воды (1 мл) и растворители концентрируют. Водную фазу нейтрализуют посредством 1 н. HCl и требуемый продукт экстрагируют посредствомAcOEt. Объединенные органические слои сушат над сульфат магния, фильтруют и концентрируют с получением соединения (3) в виде оранжевого твердого вещества (19,4 мг; 77%). 1 Н-ЯМР (DMSO-d6)2,12 (с, 3 Н), 2,38 (с, 3 Н), 4,61 (д, J=6 Гц, 2 Н), 5,51 (т, J=6 Гц, 1 Н), 6,93 (д, J=3,8 Гц, 1 Н), 6,99 (д, J=3,8 Гц, 1 Н), 12,15 (ушир.с, 1 Н). M-(ESI): 267,15; M+(ESI): 269,20. ВЭЖХ, Rt: 2,26 мин(1397,5 мг; 4,29 ммоль; 2,20 экв.), Pd(dppf)Cl2 (57,1 мг; 0,08 ммоль; 0,04 экв.) помешают в микроволновый реактор, а затем добавляют DMF (8 мл) и воду (4 мл). Реакционную смесь продувают аргоном и нагревают под действием микроволнового излучения в течение 10 мин при 150 С. Ее фильтруют через бумажный фильтр, разбавляют 1 н. раствором НС 1 (10 мл) и требуемый продукт экстрагируют посредствомEtOAc. Объединенный органический слой сушат над MgSO4, фильтруют и выпаривают. Неочищенный продукт очищают препаративной ВЭЖХ с получением соединения (4) в виде не совсем белого твердого вещества (125 мг; 22,7%). 1 5-[2-(Ацетиламино)-4-метил-1,3-тиазол-5-ил]тиофен-2-карбоновую кислоту, соединение (4), полученную как описано выше (24 мг; 0,09 ммоль; 1 экв.), растворяют в THF (4 мл). Последовательно добавляют РуВОР (66,4 мг; 0,13 ммоль; 1,50 экв.), DIEA (0,03 мл; 0,17 ммоль; 2 экв.) и морфолин (0,02 мл; 0,2 6 ммоль; 3 экв.). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Растворители выпаривают и добавляют CH3CN. Полученный осадок фильтруют с получением соединения (5) в виде желтого твердого вещества (5 мг; 33%). 1 Н-ЯМР (DMSO-d6)2,14 (с, 3 Н), 2,43 (с, 3 Н), 3,55-3,78 (м, 8 Н), 7,15 (д, J=3,8 Гц, 1 Н), 7,41 (д, J=3,8 Гц, 1 Н), 12,15 (ушир.с, 1 Н). M- (ESI): 350,06; M+(ESI): 352,06. ВЭЖХ, Rt: 2,61 мин (чистота: 97,2%). Пример 6. N-[4-метил-5-(2-тиенил)-1,3-тиазол-2-ил]ацетамид (6).Pd(dppf)Cl2 (0,52 г; 0,71 ммоль; 0,10 экв.) растворяют в DMF (35 мл). Добавляют 2-(трибутилстаннил) тиофен (2,68 мл; 8,44 ммоль; 1,19 экв.). Реакционную смесь продувают аргоном и нагревают при 100 С в течение 1 ч 30 мин. Растворители выпаривают, неочищенную смесь растворяют в EtOAc (100 мл) и промывают водой (3x100 мл). Водную фазу объединяют и экстрагируют посредством EtOAc (250 мл). Объединенные органические фазы промывают солевым раствором и сушат над MgSO4. Растворители выпаривают, и неочищенный продукт очищают препаративной ВЭЖХ с получением соединения (6) в виде не совсем белого порошка (1,24 г; 73,5%). 1 5-[2-(Ацетиламино)-4-метил-1,3-тиазол-5-ил]тиофен-2-карбоновую кислоту, соединение (4) (50 мг; 0,18 ммоль; 1 экв.), растворяют в THF (8 мл). Последовательно добавляют РуВОР (138,2 мг; 0,27 ммоль; 1,50 экв.), 4-гидроксипиперидин (53,7 мг; 0,53 ммоль; 3 экв.) и DIEA (0,06 мл; 0,35 ммоль; 2 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Растворители выпаривают и неочищенный продукт суспендируют в MeCN, фильтруют и промывают несколько раз посредствомMeCN с получением соединения (7) в виде коричневого твердого вещества (15,2 мг; 23%). 1- 21017166 5-[2-(Ацетиламино)-4-метил-1,3-тиазол-5-ил]тиофен-2-карбоновую кислоту, соединение (4), полученную как описано выше (40 мг; 0,14 ммоль; 1 экв.), растворяют в THF (8 мл). Последовательно добавляют РуВОР (110,6 мг; 0,21 ммоль; 1,50 экв.), 3-гидроксипиперидин (43,0 мг; 0,43 ммоль; 3 экв.) и DIEA(0,05 мл; 0,28 ммоль; 2 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Растворители выпаривают и неочищенный продукт суспендируют в MeCN, фильтруют и промывают несколько раз посредством MeCN с получением соединения (8) в виде не совсем белого вещества (35,6 мг; 65%). 1N-[2-(5-формилтиофен-2-ил)-4-метилтиазол-5-ил]ацетамид, соединение (1) (104 мг; 0,39 ммоль; 1 экв.), растворяют в смеси THF/этанол 1:1 (10 мл) при комнатной температуре. Добавляют гидрохлорид гидроксиламина (275 мг; 3,9 ммоль; 10 экв.) и пиридин (310 мкл; 3,9 ммоль; 10,0 экв.) и реакционную смесь нагревают при 70 С в течение 30 минут. Реакционную смесь охлаждают до комнатной температуры и растворители выпаривают. Неочищенный материал растворяют в дихлорметане и фильтруют через небольшой фильтрующий элемент из диоксида кремния с получением соединения (9) в качестве смеси изомеров оксида в виде желтого твердого вещества (55 мг; 55%). 1 Н-ЯМР (MeOH-d4, 300 МГц)2,25 (с, 3 Н), 2,50 (с, 3 Н), 6,65 (с, 1 Н), 7,12 (д, J=6 Гц, 1 Н), 7,40 (д,J=6 Гц, 1 Н), 7,72 (с, 1 Н). M-(ESI): 280,36; M+(ESI): 282,40. ВЭЖХ, Rt: 2,64 мин (чистота: 87,8%). Пример 10. N-[5-(5-Циано-2-тиенил)-4-метил-1,3-тиазол-2-ил]ацетамид (10).N-(5-5-[(гидроксиимино)метил]-2-тиенил-4-метил-1,3-тиазол-2-ил)ацетамид, соединение (9) (100 мг; 0,36 ммоль; 1 экв.), нагревают с ацетатом меди (3,3 мг; 0,018 ммоль; 0,05 экв.) в чистом пиридине (5 мл) при 75 С в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и растворители выпаривают до высушивания. Неочищенный материал растворяют в дихлорметане, промывают водой (10 мл) и сушат надMgSO4. Растворители выпаривают и неочищенный продукт очищают флэш-хроматографией с использованием смеси циклогексан/этилацетат (90/10) в качестве элюента. Соединение (10) получают в виде желтого порошка (42 мг; 44%). 1 Н-ЯМР (CDCl3, 300 МГц)2,22 (с, 3 Н), 2,43 (с, 3 Н), 7,01 (д, J=6 Гц, 1 Н), 7,50 (д, J=6 Гц, 1 Н) . M(ESI): 262,3; M+(ESI): 264,3. ВЭЖХ, Rt: 3,03 мин (чистота: 91%). Пример 11. Метил-5-[2-(ацетиламино)-4-метил-1,3-тиазол-5-ил 1 тиофен-2-карбоксилат (11). В пробирке для обработки микроволновым излучением N-(5-йод-4-метил-1,3-тиазол-2-ил)ацетамид,промежуточное соединение 1 (150 мг; 0,53 ммоль; 1 экв.) и Pd(dppf)Cl2 (19,5 мг; 0,03 ммоль; 0,05 экв.) суспендируют в толуоле (3 мл). Фторид калия (123,6 мг; 2,13 ммоль; 4 экв.) растворяют в МеОН (3 мл) и добавляют к первому раствору. В конце добавляют метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)тиофен-2-карбоксилат, промежуточное соединение 2 (213,8 мг; 0,80 ммоль; 1,50 экв.). Полученный раствор продувают аргоном, пробирку закрывают и нагревают с помощью микроволнового излучения при 120 С в течение 10 минут. Требуемый продукт образуется совместно с диметиловым эфиром [2,2']битиофенил-5,5'-дикарбоновой кислоты, продуктом гомоконденсации метил-5-(4,4,5,5-тетраметил-1,3,2 диоксаборолан-2-ил)тиофен-2-карбоксилата. Растворители выпаривают и неочищенный продукт очищают препаративной ВЭЖХ с получением соединения (16) в виде не совсем белого твердого вещества (180 мг; 57%). 1 В пробирке для обработки микроволновым излучением N-(5-йод-4-метил-1,3-тиазол-2-ил)ацетамид,промежуточное соединение 1 (564,2 мг; 2 ммоль; 1 экв.) и Pd(dppf)Cl2 (73,2 мг; 0,10 ммоль; 0,05 экв.) суспендируют в толуоле (7 мл). Добавляют раствор фторида калия (464,8 мг; 8 ммоль; 4 экв.) в МеОН (7 мл). В конце добавляют 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)тиофен (630,3 мг; 3 ммоль; 1,50 экв.) в виде твердого вещества. Полученный раствор продувают аргоном, пробирку закрывают и нагревают с помощью микроволнового излучения при 120 С в течение 15 мин. Реакционную смесь фильтруют через целит и растворители выпаривают. Полученный неочищенный продукт растворяют в EtOAc, промывают водой и солевым раствором и сушат над MgSO4. Затем его очищают препаративной ВЭЖХ с получением соединения (12) в виде не совсем белого твердого вещества (316,7 мг; выход 66%). 1H-ЯМР (DMSO-d6)2,12 (с, 3 Н), 2,35 (с, 3 Н), 7,28 (дд, J=l,5, 4,9 Гц, 1 Н), 7,58 (дд, J=l,5, 3,0 Гц, 1 Н),7,67 (дд, J=3,0, 4,9 Гц, 1H), 12,09 (с, 1 Н). M-(ESI): 237,03; M+(ESI): 239,03. ВЭЖХ, Rt: 2,92 мин (чистота: 99,6%). Пример 13. Способы биологического анализа. Соединения по настоящему изобретению можно подвергать следующим анализам. а) Высокопроизводительный анализ PI3K-киназы липидов (анализ связывания). Эффективность соединений по изобретению в отношении ингибирования индуцируемого посредством PI3K фосфорилирования липидов можно тестировать посредством следующего анализа связывания. Анализ сочетает технологию сцинтилляционного анализа сближения (SPA, Amersham) и способность неомицина (поликатионного антибиотика) связывать фосфолипиды с высокой аффинностью и специфичностью. Сцинтилляционный анализ сближения основан на свойствах изотопов со слабой эмиссией(таких как 3 Н, 125I, 33 Р). Покрытие гранул SPA неомицином дает возможность определения фосфорилированных липидных субстратов после инкубации с рекомбинантной PI3K и радиоактивным АТФ в одной лунке, посредством иммобилизации радиоактивных фосфолипидов на гранулах SPA вследствие их специфичного связывания с неомицином. В 384-луночный МТР, содержащий 5 мкл тестируемого соединения формулы (I) (растворенного в 6% DMSO; с получением концентрации тестируемого соединения 100, 30, 10, 3, 1, 0,3, 0,1, 0,03, 0,01, 01 мкМ), добавляют следующие компоненты для анализа. 1) 5 мкл (58 нг) рекомбинантной GST-PI3K человека (в 40 мМ Hepes, pH 7,4, 1 мМ DTT и 5% этиленгликоле), 2) 10 мкл липидных мицелл и 3) 10 мкл киназного буфера ([33 Р] АТФ 45 мкМ/60 нКи, 30 мМ MgCl2, 1 мМ DTT, 1 мМ 6-глицерофосфат, 100 мкМ Na3VO4, холат Na 0,3%, в 40 мМ Hepes, pH 7,4). После инкубации при комнатной температуре в течение 180 мин при осторожном встряхивании реакцию останавливают добавлением 60 мкл раствора,содержащего 100 мкг покрытых неомицином гранул PVT SPA в PBS, содержащем 10 мМ АТФ и 5 мМ ЭДТА. Далее анализируемую смесь инкубируют при комнатной температуре в течение 60 мин при осторожном встряхивании, обеспечивая связывание фосфолипидов с гранулами неомицин-SPA. После осаждения покрытых неомицином гранул PVT SPA в течение 5 мин при 1500g, радиоактивный PtdIns(3)P количественно определяют посредством сцинтилляционного подсчета в устройстве для счета в планшетах Wallac MicroBeta. Значения, указанные в табл. I, ниже, относятся к IC50 (нМ) в отношении PI3K, т.е. к количеству,необходимому для достижения 50% ингибирования указанной мишени. Указанные значения показывают значительную ингибиторную эффективность соединений тиазола в отношении PI3K. Примеры ингибиторной активности соединений по этому изобретению указаны в табл. I, ниже. Таблица I. Значения IC50 производных тиазола против PI3Kb) Клеточный ELISA для мониторинга ингибирования PI3K. Эффективность соединений по этому изобретению в отношении ингибирования индуцируемого посредством PI3K фосфорилирования Akt/PKB можно тестировать в следующем клеточном анализе. Измерение фосфорилирования Akt/PKB в макрофагах после стимуляции компонентом комплемента 5 а: 264 Raw: макрофаги 264-7 Raw (культивируемые в среде DMEM-F12, содержащей 10% эмбриональную телячью сыворотку и антибиотики) высевают в количестве 20000 клеток/лунка в 96 МТР за 24 ч до- 23017166 стимуляции клеток. Перед стимуляцией 50 нМ компонентом комплемента 5 а в течение 5 мин клетки не подпитывают сывороткой в течение 2 ч и предварительно обрабатывают ингибиторами в течение 20 мин. После стимуляции клетки фиксируют в 4% формальдегиде в течение 20 мин и промывают 3 раза в PBS,содержащем 1% Triton X-100 (PBS/Triton). Эндогенную пероксидазу блокируют посредством инкубации в течение 20 мин в 0,6% Н 2 О 2 и 0,1% азиде натрия в PBS/Triton и промывают 3 раза в PBS/Triton. Затем клетки блокируют посредством инкубации в течение 60 мин с 10% эмбриональной телячьей сывороткой в PBS/Triton. Затем проводят детекцию фосфорилированного Akt/PKB посредством инкубации в течение ночи при 4 С с первичным антителом (против фосфосерина 473 Akt IHC, Cell Signaling), разбавленным в 800 раз в PBS/Triton, содержащем 5% бычий сывороточный альбумин (BSA). После 3 промываний вPBS/Triton клетки инкубируют в течение 60 мин с конъюгированным с пероксидазой вторичным антителом козы против антител кролика (разведение 1/400 в PBS/Triton, содержащем 5% BSA), промывают 3 раза в PBS/Triton и 2 раза в PBS и далее инкубируют в 100 мкл люминесцентного раствора субстратного реагента (Pierce) в течение 2 мин, а затем проводят считывание (1 с/лунка). Значения, указанные в табл. II, ниже, показывают процентное ингибирование фосфорилирования АКТ по сравнению с исходным уровнем. Указанные значения показывают очевидный эффект соединений тиазола на активацию фосфорилирования АКТ в макрофагах. Примеры ингибиторной активности соединений по этому изобретению указаны в табл. II, ниже. Таблица II. Значения IC50 производных тиазола в клеточном анализе Пример 14. Модель индуцируемого тиогликолятом рекрутинга клеток в перитонеальной полости. Эффективность in vivo соединений по этому изобретению в отношении ингибирования миграции лейкоцитов при внутрибрюшинной иммунизации тиогликолятом можно тестировать с помощью следующего анализа. Экспериментальный протокол. Самок мышей С 3 Н в возрасте 8-10 недель подвергают голоданию в течение 18 ч. За 15 мин до внутрибрюшинной инъекции тиогликолята (1,5%, 40 мл/кг) самкам перорально вводят тиазолы формулы (I). Контрольным мышам вводят CMC/Tween в качестве носителя (10 мл/кг). Затем мышей умерщвляют посредством ингаляции СО 2 и перитонеальную полость промывают два раза 5 мл ледяного PBS/1 мМ ЭДТА. Лаважи делают через 4 ч или 48 ч после иммунизации тиогликолятом для оценки рекрутинга нейтрофилов или макрофагов, соответственно. Лейкоциты (нейтрофилы, лимфоциты или макрофаги) подсчитывают с использованием Beckman Coulter ACT 5diff. В качестве контрольного лекарственного средства используют дексаметазон. Примеры ингибиторной активности соединений по этому изобретению представлены в табл. III,ниже. Таблица III. % Ингибирование рекрутинга нейтрофилов при дозе 10 мг/кг через 4 ч Пример 15. Получение фармацевтического состава. Состав 1. Таблетки. Соединение формулы (I) смешивают в виде сухого порошка со связующим веществом на основе сухого желатина приблизительно в массовом соотношении 1:2. В качестве смазывающего вещества добавляют небольшое количество стеарата магния. Смесь формуют в таблетки весом 240-270 мг (80-90 мг активного соединения тиазола на таблетку) в таблеточном прессе. Состав 2. Капсулы. Соединение формулы (I) смешивают в виде сухого порошка с разбавителем на основе крахмала в массовом соотношении приблизительно 1:1. Смесью наполняют 250-мг капсулы (125 мг активного соединения тиазола на капсулу). Состав 3. Жидкость. Соединение формулы (I) (1250 мг), сахарозу (1,75 г) и ксантановую смолу (4 мг) измельчают, пропускают через сито 10 меш. U.С, а затем смешивают с изготовленным ранее раствором микрокристаллической целлюлозы и карбоксиметилцеллюлозы натрия (11:89, 50 мг) в воде. В воде разбавляют бензоат натрия (10 мг), вкусовую добавку и краситель и добавляют при перемешивании. Затем добавляют достаточное количество воды для получения общего объема 5 мл. Состав 4. Таблетки. Соединение формулы (I) смешивают в виде сухого порошка со связующим веществом в виде сухого желатина в массовом соотношении приблизительно 1:2. В качестве смазывающего вещества добавляют небольшое количество стеарата магния. Смесь формуют в 450-900-мг таблетки (150-300 мг активного- 24017166 соединения тиазола) в таблеточном прессе. Состав 5. Инъекция. Соединение формулы (I) растворяют в инъецируемой водной среде на основе буферного стерильного физиологического раствора до концентрации приблизительно 5 мг/мл. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное тиазола формулы (I) где R1 представляет собой ацил формулы C(O)R, где R представляет собой Н или С 1-12 алкил;R3 выбран из следующих тиенильных групп:R4 выбран из Н, необязательно замещенного С 1-С 6-алкила; необязательно замещенного С 2-С 6 алкенила, необязательно замещенного С 2-С 6-алкинила, необязательно замещенного алкоксикарбонила и необязательно замещенного ацила формулы C(O)R, где R представляет собой Н или С 1-12 алкил, а также необязательно замещенного морфолинкарбонила и необязательно замещенного пиперидинкарбонила;R5 и R6 независимо выбраны из Н и галогена; а также его геометрические изомеры, его оптически активные формы, такие как энантиомеры, диастереомеры и ее рацематные формы, а также их фармацевтически приемлемым соли, причем замещенные группы могут быть замещены 1-5 заместителями, выбранными из группы, состоящей из С 1-С 6-алкила; С 2-С 6-алкенила; С 2-С 6-алкинила; С 3-С 8 циклоалкила; гетероциклоалкила, где гетероциклоалкил относится к С 3-С 8-циклоалкильной группе, в которой вплоть до 3 атомов углерода заменены гетероатомами, выбранными из группы, состоящей из О, S, NR, где R определяется как водород или метил; C1-C6-алкиларила, где арил относится к ненасыщенной ароматической карбоциклической группе, состоящей из от 6 до 14 атомов углерода; С 1-С 6-алкилгетероарила, С 1-С 6 алкилциклоалкила, C1-C6-алкилгетероциклоалкила, амино, аммония, ацила, ациламино, аминокарбонила,алкоксикарбонила, где алкоксикарбонил относится к группе -С(О)OR, где R включает Н, С 1-С 6-алкил; арила, где арил относится к ненасыщенной ароматической карбоциклической группе, состоящей из от 6 до 14 атомов углерода; карбамата, гетероарила, где гетероарил относится к моноциклической гетероароматической группе или к бициклической или трициклической гетероароматической группе с конденсированными кольцами, включающими N, О, S в качестве гетероатомов; сульфинила, сульфонила, С 1-С 6 алкокси, сульфанила, галогена, тригалогенметила, циано, гидрокси, меркапто, нитро. 2. Производное тиазола по п.1, в котором R2 представляет собой метил. 3. Производное тиазола по любому из предшествующих пунктов, в котором R3 представляет собой тиенил Т 1. 4. Производное тиазола по любому из предшествующих пунктов, в котором R3 представляет собой тиенил Т 2. 5. Производное тиазола по любому из предшествующих пунктов, в котором R4 выбран из Н, необязательно замещенного C1-С 6-алкила, необязательно замещенного С 2-С 6-алкенила и необязательно замещенного С 2-С 6-алкинила. 6. Производное тиазола по любому из предшествующих пп.1-4, в котором R4 выбран из алкоксикарбонила и ацила. 7. Производное тиазола по любому из предшествующих пунктов, в котором R5 и R6 представляют собой Н. 8. Производное тиазола по любому из предшествующих пунктов, выбранное из следующей группы:N-[4-метил-5-(3-тиенил)-1,3-тиазол-2-ил]ацетамид. 9. Применение производного тиазола по любому из пп.1-8, а также его изомеров и их смесей в качестве лекарственного средства для профилактики и/или лечения заболеваний посредством модулирования активности PI3-киназы, где заболевание выбрано из группы, состоящей из аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, аллергии, астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, злокачественной опухоли, трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата или повреждений легких. 10. Применение производного тиазола по любому из пп.1-8, а также его изомеров и их смесей для получения лекарственного средства для профилактики и/или лечения заболеваний посредством модулирования активности PI3-киназы, где заболевание выбрано из группы, состоящей из аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, аллергии, астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, злокачественной опухоли, трансплантации,подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата или повреждений легких. 11. Применение по пп.9, 10, где указанные заболевания выбраны из группы, включающей рассеянный склероз, псориаз, ревматоидный артрит, системную красную волчанку, воспалительное заболевание кишечника, повреждение легкого, тромбоз или инфекцию/воспаление головного мозга, такое как менингит или энцефалит. 12. Применение по пп.9, 10, где указанные заболевания выбраны из группы, включающей болезнь Альцгеймера, болезнь Гентингтона, травму ЦНС, инсульт или ишемические состояния. 13. Применение по пп.9, 10, где указанные заболевания выбраны из группы, включающей атеросклероз, гипертрофию сердца, дисфункцию кардиомиоцитов, повышенное кровяное давление или ангиоспазм. 14. Применение по пп.9, 10, где указанные заболевания выбраны из группы, включающей хроническое обструктивное заболевание легких, связанный с анафилактическим шоком фиброз, псориаз, аллергические заболевания, астму, инсульт или ишемические состояния, ишемию-реперфузию, агрегацию/активацию тромбоцитов, атрофию/гипертрофию скелетных мышц, рекрутинг лейкоцитов в ткани злокачественной опухоли, ангиогенез, инвазивный метастаз, меланому, саркому Капоши, острые и хронические бактериальные и вирусные инфекции, сепсис, отторжение трансплантата, гломерулосклероз,гломерулонефрит, прогрессивный фиброз почек, повреждения эндотелия и эпителия легкого или, в общем, воспаление дыхательных путей легкого. 15. Применение по пп.9-14 для ингибирования PI3-киназной активности. 16. Применение по пп.9-15, где указанная PI3-киназа представляет собой PI3-киназу . 17. Фармацевтическая композиция, содержащая по меньшей мере одно производное тиазола по любому из пп.1-8 и его фармацевтически приемлемый носитель, разбавитель или эксципиент. 18. Способ получения производного тиазола по любому из пп.1-8, включающий стадию взаимодействия соединения формулы (Р 1) с производным формулы (Р 2) в присутствии комплексов палладия и основания
МПК / Метки
МПК: A61P 31/00, A61P 25/00, C07D 417/04, A61P 37/00, A61K 31/427
Метки: применение, производные, тиазола
Код ссылки
<a href="https://eas.patents.su/27-17166-proizvodnye-tiazola-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные тиазола и их применение</a>