Производные 4-(метиламинофенокси)пиридин-3-илбензамида для лечения рака
Номер патента: 21627
Опубликовано: 30.07.2015
Авторы: Тераути Юки, Накагава Такаси, Сумида Такуми, Ямагути Казуя, Сакамото Макото, Харада Ясуо, Кодзима Ютака, Сиракура Масамити
Формула / Реферат
1. Соединение формулы (1) или его фармацевтически приемлемая соль
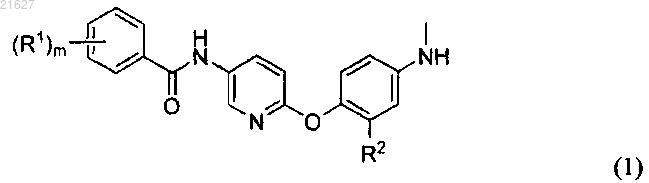
где R1 представляет собой атом галогена, С6-С10арильную группу, С6-С10арилоксигруппу или линейную или разветвленную алкильную группу, содержащую 1-6 атомов углерода и необязательно замещенную одним или более атомами галогена;
R2 представляет собой атом водорода, атом галогена, линейную или разветвленную алкильную группу, содержащую 1-6 атомов углерода или линейную или разветвленную алкоксигруппу, содержащую 1-6 атомов углерода; и
m равно целому числу от 1 до 3;
при условии, что, если m равно 2 или 3, R1 являются одинаковыми или различными.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой атом водорода.
3. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой атом галогена.
4. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой линейную или разветвленную алкильную группу, содержащую 1-6 атомов углерода.
5. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой линейную или разветвленную алкоксигруппу, содержащую 1-6 атомов углерода.
6. Соединение по п.1 или его фармацевтически приемлемая соль, которое выбрано из группы, состоящей из
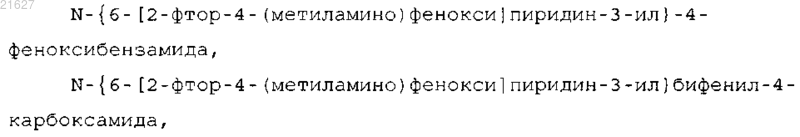

7. Соединение по п.1, которое выбрано из группы, состоящей из


8. Фармацевтическая композиция для предупреждения и/или лечения рака, содержащая соединение формулы (1) или его фармацевтически приемлемую соль по п.1 и фармацевтически приемлемый носитель.
9. Лекарственное средство для предупреждения и/или лечения рака, содержащее соединение формулы (1) или его фармацевтически приемлемую соль по п.1.
10. Применение соединения формулы (1) или его фармацевтически приемлемой соли по п.1 для получения фармацевтической композиции для предупреждения и/или лечения рака.
11. Способ предупреждения и/или лечения рака, включающий введение нуждающемуся в этом пациенту соединения формулы (1) или его фармацевтически приемлемой соли по п.1.
Текст
Настоящее изобретение относится к новому соединению, обладающему противоопухолевым действием, стабильностью и метаболической стабильностью. Соединение по настоящему изобретению представлено следующей общей формулой (1): где R1 представляет собой атом галогена, арильную группу, арилоксигруппу или низшую алкильную группу, необязательно замещенную одним или более атомами галогена; R2 представляет собой атом водорода, атом галогена, низшую алкильную группу или низшую алкоксигруппу; m равно целому числу от 1 до 3; при условии, что если m равно 2 или 3, R1 являются одинаковыми или различными. Область техники, к которой относится изобретение Настоящее изобретение относится к гетероциклическому соединению. Предпосылки создания изобретения Со времени клинического использования впервые в мире в 1940-х гг. азотистого иприта в качестве противоракового средства разработано множество противораковых лекарственных средств. Фактически предметом клинического использования являются, например, антиметаболиты, такие как 5-фторурацил,противоопухолевые антибиотики, такие как адриамицин, комплекс платины, такой как цисплатин, и получаемые из растений канцеростатики, такие как виндезин. Однако большинство из этих канцеростатиков имеют существенные побочные эффекты, например нарушения пищеварения, миелосупрессию и алопецию, так как они являются цитотоксичными также относительно нормальных клеток. Из-за побочных эффектов диапазон их применения ограничен, и, кроме того, их собственные терапевтические эффекты в большинстве случаев являются частными и кратковременными. Кроме терапевтических эффектов и побочных эффектов одним из важных требований к лекарственному средству является метаболическая стабильность, так как на фармакокинетику лекарственного средства в организме человека сильно влияет подверженность метаболизму. Кроме того, стабильность при хранении фармацевтически активного ингредиента, содержащегося в лекарственном средстве, является важной для его коммерческого применения. Следовательно, важно оценить метаболическую стабильность и стабильность при хранении лекарственного средства-кандидата. Осуществляются разработки новых канцеростатиков; однако удовлетворительные результаты пока не получены. В патентных документах 1, 2 и 3 раскрыты некоторые типы соединений, обладающих ингибирующей активностью по отношению фиброза, противоопухолевой активностью и ингибирующей активностью в отношении активации STAT3/5 соответственно. Однако конкретные соединения, раскрытые в настоящем изобретении, отличаются от конкретных соединений, раскрытых в этих патентных документах, и неизвестно, оказывают ли соединения по настоящему изобретению противоопухолевую активность. Список цитируемых документов Патентная литература Патентный документ 1 WO 2006/014012. Патентный документ 2 WO 2007/066784. Патентный документ 3 WO 2008/044667. Патентный документ 4 JP 2001-89412. Сущность изобретения Техническая проблема Следовательно, задачей настоящего изобретения является получение соединения, которое не только оказывает противоопухолевое действие при меньших побочных эффектах, но также имеет подходящую для лекарственного средства метаболическую стабильность и стабильность при хранении. Решение проблемы Авторы настоящего изобретения проводили интенсивные исследования с точки зрения достижения указанной выше цели. В результате они обнаружили, что соединение, представленное приведенной ниже общей формулой (1), и его соль оказывают превосходное противоопухолевое действие при меньших побочных эффектах и имеют подходящую для лекарственного средства метаболическую стабильность и стабильность при хранении. Следовательно, они пригодны в качестве лекарственных средств для лечения или предупреждения раковых заболеваний различных типов. Примеры раковых заболеваний включают рак, связанный с половым стероидным гормоном (например, рак простаты, рак молочной железы, рак яичников, рак матки,тестикулярный рак), солидный рак (например, рак легких, колоректальный рак, рак мочевого пузыря, рак щитовидной железы, рак пищевода, рак печени, рак головного мозга, рак поджелудочной железы, рак желудка, меланому) и рак крови (например, острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз, множественную миелому,лимфому). Термин "рак" в данном описании включает "опухоль". Настоящее изобретение выполнено на основании данного открытия. Более конкретно, настоящее изобретение относится к лекарственным средствам, представленным в п.1. Пункт 1: соединение, представленное следующей общей формулой (1), или его соль: где R1 представляет собой атом галогена, арильную группу, арилоксигруппу или низшую алкильную группу, необязательно замещенную одним или более атомами галогена;R2 представляет собой атом водорода, атом галогена, низшую алкильную группу или низшую алкоксигруппу иm равно целому числу от 1 до 3; при условии, что, если m равно 2 или 3, R1 являются одинаковыми или различными. Пункт 2: соединение по п.1 или его соль, где R2 представляет собой атом водорода. Пункт 3: соединение по п.1 или его соль, где R2 представляет собой атом галогена. Пункт 4: соединение по п.1 или его соль, где R2 представляет собой низшую алкильную группу. Пункт 5: соединение по п.1 или его соль, где R2 представляет собой низшую алкоксигруппу. Пункт 6: соединение по п.1 или его соль, которое выбрано из группы, состоящей из Пункт 7: соединение по п.1, которое выбрано из группы, состоящей из(1), или его соль по любому из пп.1-7 и фармакологически приемлемый носитель. Пункт 9: фармацевтическая композиция по п.8 для предупреждения и/или лечения рака. Пункт 10: соединение, представленное общей формулой (1), или его соль по любому из пп.1-7 для применения в фармацевтической композиции. Пункт 11: применение соединения, представленного общей формулой (1), или его соли по любому из пп.1-7 в качестве фармацевтической композиции. Пункт 12: применение соединения, представленного общей формулой (1), или его соли по любому из пп.1-7 для получения фармацевтической композиции. Пункт 13: способ предупреждения и/или лечения рака, включающий введение нуждающемуся в этом пациенту соединения, представленного общей формулой (1), или его соли по любому из пп.1-7. Описание вариантов осуществления Конкретными примерами групп, показанных в общей формуле (1), являются следующие группы. Примеры низших алкоксигрупп включают линейные или разветвленные алкоксигруппы, имеющие от 1 до 6 атомов углерода, такие как метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси,пентилокси и гексилоксигруппы. Примеры низших алкильных групп включают линейные или разветвленные алкильные группы,имеющие от 1 до 6 атомов углерода, такие как метильная, этильная, пропильная, изопропильная, 2,2 диметилпропильная, 1-этилпропильная, бутильная, изобутильная, трет-бутильная, изопентильная, пентильная и гексильная группы. Примеры низших алкильных групп, необязательно замещенных одним или более атомами галогена,включают, кроме описанных выше низших алкильных групп, линейные или разветвленные алкильные группы, имеющие от 1 до 6 атомов углерода, которые могут быть замещены 1-3 атомами галогена, такие как трифторметильная, трихлорметильная, хлорметильная, бромметильная, фторметильная, йодметильная, дифторметильная, дибромметильная, дихлорметильная, 2-хлорэтильная, 2,2,2-трифторэтильная, 2,2,2 трихлорэтильная, 3-хлорпропильная, 2,3-дихлорпропильная, 4,4,4-трихлорбутильная, 4-фторбутильная, 5 хлорпентильная, 3-хлор-2-метилпропильная, 5-бромгексильная и 5,6-дибромгексильная группы. Примеры атома галогена включают атом фтора, атом хлора, атом брома и атом йода. Примеры арильной группы включают С 6-С 10 ароматические группы, такие как фенил, 1-нафтил, 2 нафтил, о-толил, м-толил и п-толил. Примеры арилоксигруппы включают С 6-С 10 арилоксигруппы, такие как фенокси, 1-нафтилокси и 2 нафтилокси. Одним предпочтительным примером является соединение, представленное общей формулой (1),или его соль, гдеR1 представляет собой арильную группу, арилоксигруппу или низшую алкильную группу, необязательно замещенную одним или более атомами галогена;R2 представляет собой атом водорода, атом галогена, низшую алкильную группу или низшую алкоксигруппу иm равно целому числу 1. Другим предпочтительным примером является соединение, представленное общей формулой (1),или его соль, гдеR1 представляет собой атом галогена;R2 представляет собой атом водорода, атом галогена, низшую алкильную группу или низшую алкоксигруппу иm равно целому числу от 1 до 3; при условии, что, если m равно 2 или 3, R1 являются одинаковыми или различными. Еще одним предпочтительным примером является соединение, представленное общей формулойR1 представляет собой атом галогена или низшую алкильную группу, необязательно замещенную одним или более атомами галогена;R2 представляет собой атом водорода, атом галогена, низшую алкильную группу или низшую алкоксигруппу иm равно целому числу 2; при условии, что R1 являются одинаковыми или различными. В табл. 1 представлен список использованных в данном описании сокращений. Способы получения соединений по настоящему изобретению описаны ниже. Применяя технические знания, специалисты в данной области могут легко получить гетероциклическое соединение по настоящему изобретению, представленное общей формулой (1), или его соль на основании примеров и сравнительных примеров настоящего описания. Например, гетероциклическое соединение или его соль можно получить способами, представленными на следующих реакционных схемах. Реакционная схема 1 где R1, R2 и m являются такими, как указано выше, и Р обозначает аминозащитную группу. Соединение (1) может быть получено, подвергая соединение (2) депротонированию. При том что условия депротонирования варьируются в зависимости от типа аминозащитной группы Р, они не имеют особых ограничений, пока происходит депротонирование. Например, можно проводить депротонирование согласно способу, описанному в T.W. Green, Protective Groups in Organic Synthesis, 4th edition, JohnWileySons, Inc., p. 696-926. Если Р представляет собой трет-бутоксикарбонил, то депротонирование можно проводить в инертном растворителе в присутствии 1,0-100,0 моль кислоты на 1 моль соединения (2). Примеры кислот включают неорганические кислоты, такие как хлористо-водородная кислота и серная кислота; и органические кислоты, такие как TFA и метансульфоновая кислота. Используемый растворитель не имеет особых ограничений до тех пор, пока он не ингибирует взаимодействие и допускает растворение в нем исходного вещества до некоторой степени. Предпочтительные примеры растворителя включают AcOEt, MeOH, EtOH, 1,4-диоксан, метиленхлорид, хлороформ,изопропанол, ДМФА и NMP. Взаимодействие обычно осуществляют при температуре от -10 до 100C, предпочтительно при 050C, и обычно оно завершается за 0,5-50 ч, предпочтительно за 1-20 ч. Реакционные схемы А-С далее подробно объясняют получение исходного соединения (2). Реакционная схема А-7 021627 где R2 и Р являются такими, как указано выше, и X1 обозначает уходящую группу. Соединение (5) также может быть получено взаимодействием соединения (3) с соединением (4). Взаимодействие можно осуществлять в присутствии или отсутствие основания, в инертном растворителе или без растворителя. Примеры уходящей группы, представленной X1, включают атом галогена (например, атом фтора,хлора, брома, йода), необязательно галогенированный С 1-С 6 алкилсульфонилокси (например, метансульфонилокси, этансульфонилокси, трихлорметансульфонилокси, трифторметансульфонилокси и т.д.),арилсульфонилокси (например, С 6-С 10 арилсульфонилокси (например, фенилсульфонилокси, нафтилсульфонилокси), необязательно замещенный 1-3 заместителями, выбранными из группы, включающей С 1-С 6 алкильную группу (например, метил, этил и т.д.), С 1-6 алкокси (например, метокси, этокси и т.д.) и нитрогруппу), галогенацилокси (например, трихлорацетокси, трифторацетокси и подобные) и подобные. Конкретные примеры включают фенилсульфонилокси,м-нитрофенилсульфонилокси,птолуолсульфонилокси, трихлорацетокси, трифторацетокси и подобные. Примеры инертного растворителя включают воду; простые эфиры, такие как диоксан, ТГФ, Et2O,диметиловый эфир диэтиленгликоля и диметиловый эфир этиленгликоля; ароматические углеводороды,такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как дихлорметан, дихлорэтан,хлороформ и четыреххлористый углерод; низшие (С 1-6) спирты, такие как МеОН, EtOH и изопропанол; кетоны, такие как ацетон и метилэтилкетон; полярные растворители, такие как ДМФА, ДМСО, гексаметилфосфортриамид и ацетонитрил; и их смеси. В качестве основания можно использовать различные известные основания в широких пределах. Примеры основания включают неорганические основания, например гидроксиды щелочных металлов,такие как гидроксид натрия, гидроксид калия, гидроксид цезия и гидроксид лития; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия, карбонат лития, гидрокарбонат лития, гидрокарбонат натрия и гидрокарбонат калия; щелочные металлы, такие как натрий и калий; амиды металлов, такие как амид натрия; гидриды металлов, такие как гидрид натрия и гидрид калия; алкоголяты щелочных металлов, такие как метилат натрия, этилат натрия, метилат калия и этилат калия; и органические основания, например Et3N; DIPEA; трипропиламин; пиридин; хинолин; DBN; DBU иDABCO. Эти основания можно использовать по отдельности или в виде комбинации двух или более. Указанное выше взаимодействие можно проводить, добавляя к реакционной системе, когда требуется, йодид щелочного металла, служащий ускорителем взаимодействия, например йодид калия или йодид натрия. Соединение (4) обычно используют в количестве по меньшей мере 0,5 моль, предпочтительно 1-5 моль на 1 моль соединения (3). Основание обычно используют в количестве 0,5-10 моль, предпочтительно 1-6 моль на 1 моль соединения (3). Взаимодействие обычно осуществляют при температуре от 0 до 250C, предпочтительно при 0200C, и обычно оно завершается за 1-80 ч. Реакционная схема В где R2 и Р являются такими, как указано выше. Стадия 1. Соединение (6) может быть получено взаимодействием соединения (5) с метилирующим реагентом. Взаимодействие можно осуществлять в присутствии или отсутствие основания, в инертном растворителе или без растворителя. Примеры метилирующего реагента включают йодметан, диметилсульфат, диметилкарбонат, метилтрифторметансульфонат, метилфторсульфонат и подобные. Примеры инертного растворителя включают воду; простые эфиры, такие как диоксан, ТГФ, Et2O,диметиловый эфир диэтиленгликоля и диметиловый эфир этиленгликоля; ароматические углеводороды,такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как дихлорметан, дихлорэтан,хлороформ и четыреххлористый углерод; низшие (С 1-6) спирты, такие как МеОН, EtOH и изопропанол; кетоны, такие как ацетон и метилэтилкетон; полярные растворители, такие как ДМФА, ДМСО, гексаметилфосфортриамид и ацетонитрил; и их смеси. В качестве основания можно использовать различные известные основания в широких пределах. Примеры оснований включают неорганические основания, например гидроксиды щелочных металлов,такие как гидроксид натрия, гидроксид калия, гидроксид цезия и гидроксид лития; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия, карбонат лития, гидрокарбонат лития, гидрокарбонат натрия и гидрокарбонат калия; щелочные металлы, такие как натрий и калий; амиды металлов, такие как амид натрия; гидриды металлов, такие как гидрид натрия и гидрид калия; алкоголяты щелочных металлов, такие как метилат натрия, этилат натрия, метилат калия и этилат калия; и органические основания, например Et3N; DIPEA; трипропиламин; пиридин; хинолин; DBN; DBU иDABCO. Эти основания можно использовать по отдельности или в виде комбинации двух или более. Метилирующий реагент обычно используют в количестве 0,9-10 моль, предпочтительно 1-5 моль на 1 моль соединения (5). Основание обычно используют в количестве 0,5-10 моль, предпочтительно 1-5 моль на 1 моль соединения (5). Взаимодействие обычно осуществляют при температуре от -10 до 100C, предпочтительно при 080C, и обычно оно завершается за 0,5-48 ч, предпочтительно за 1-24 ч. Стадия 2. Соединение (7) может быть получено восстановлением соединения (6). Восстановление можно осуществлять в присутствии каталитического агента восстановительного гидрирования в инертном растворителе. Примеры каталитического агента восстановительного гидрирования включают палладиевую чернь,палладий на углероде, оксид платины, платиновую чернь и никель Ренея. Примеры инертного растворителя включают карбоновые кислоты, такие как муравьиная кислота и уксусная кислота; простые эфиры, такие как диоксан, ТГФ, Et2O, диметиловый эфир диэтиленгликоля и диметиловый эфир этиленгликоля; сложные эфиры, такие как метилацетат, AcOEt и изопропилацетат; и низшие (например, (C1-6) спирты, такие как МеОН, EtOH и изопропанол. Взаимодействие обычно можно осуществлять в атмосфере водорода при атмосферном давлении примерно до 20 атм и предпочтительно при атмосферном давлении до 10 атм или в присутствии донора водорода, такого как муравьиная кислота, формиат аммония, циклогексен или гидразингидрат. Каталитический агент восстановительного гидрирования обычно используют в количестве 0,1-40 мас.% и предпочтительно 1-20 мас.% от массы соединения (6). Взаимодействие обычно осуществляют при температуре от -30 до 100C и предпочтительно при 060C. Реакционная схема С где R1, R2, m и Р являются такими, как указано выше, и X2 обозначает уходящую группу, такую как атом галогена (фтора, хлора, брома и йода) и гидроксигруппу. Соединение (2) может быть получено взаимодействием соединения (7) с соединением (8). Если X2 обозначает атом галогена, то взаимодействие можно осуществлять в присутствии или отсутствие основания в инертном растворителе. Примеры инертного растворителя включают воду; простые эфиры, такие как диоксан, ТГФ, Et2O,диметиловый эфир диэтиленгликоля и диметиловый эфир этиленгликоля; сложные эфиры, такие как метилацетат, AcOEt и изопропилацетат; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как дихлорметан, дихлорэтан, хлороформ и четыреххлористый углерод; низшие (С 1-6) спирты, такие как МеОН, EtOH и изопропанол; кетоны, такие как ацетон и метилэтилкетон; полярные растворители, такие как ДМФА, ДМСО, гексаметилфосфортриамид и ацетонитрил; и их смеси. В качестве основания можно использовать различные известные основания в широких пределах. Примеры основания включают неорганические основания, например гидроксиды щелочных металлов,такие как гидроксид натрия, гидроксид калия, гидроксид цезия и гидроксид лития; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия, карбонат лития, гидрокарбонат лития, гидрокарбонат натрия и гидрокарбонат калия; щелочные металлы, такие как натрий и калий; амиды металлов, такие как амид натрия; гидриды металлов, такие как гидрид натрия и гидрид калия; алкоголяты щелочных металлов, такие как метилат натрия, этилат натрия, метилат калия и этилат калия; и органические основания, например Et3N; DIPEA; трипропиламин; пиридин; хинолин; DBN; DBU иDABCO. Эти основания можно использовать по отдельности или в виде комбинации двух или более. При данном взаимодействии соединение (8) обычно используют в количестве по меньшей мере 0,5 моль, предпочтительно 1-5 моль на 1 моль соединения (7). Основание обычно используют в количестве 0,5-10 моль, предпочтительно 1-5 моль на 1 моль соединения (5). Взаимодействие обычно осуществляют при температуре от 10 до 100C, предпочтительно при 080C, и обычно оно завершается за период от 5 мин до 48 ч, предпочтительно за 0,5-24 ч. Если X2 обозначает гидрокси, то соединение (2) может быть получено взаимодействием соединения(7) с соединением (8) по известной реакции образования амидной связи. В данной реакции получения амида можно легко применять условия известных реакций образования амидной связи. Например, можно применять следующие реакционные способы: (i) способ с получением смешанного ангидрида кислот, в котором осуществляют взаимодействие соединения (8) с алкилгалогенформиатом, с получением смешанного ангидрида кислот, и затем осуществляют взаимодействие смешанного ангидрида кислот с соединением (7); (ii) способ с активным сложным эфиром, в котором соединение (8) преобразуют в активированный сложный эфир, например сложный фениловый эфир, сложный п-нитрофениловый эфир, сложный N-гидроксисукцинимидный эфир или сложный 1-гидроксибензотриазольный эфир, или в активированный амид посредством бензоксазолин-2-тиона, и затем осуществляют взаимодействие активированного сложного эфира или амида с соединением (7); (iii) использование активирующего агента, при котором соединение (7) подвергают реакции конденсации с соединением (8) в присутствии активирующего агента; и (iv) другие способы, например способ, в котором соединение (8) преобразуют в ангидрид карбоновой кислоты, используя дегидратирующий агент, такой как уксусный ангидрид, и затем осуществляют взаимодействие ангидрида карбоновой кислоты с соединением (7); способ, в котором осуществляют взаимодействие сложного эфира соединения (8) и С 1-6 спирта с соединением (7) при высоком давлении и высокой температуре; и способ, в котором осуществляют взаимодействие галогенангидрида соединения (8), т.е. галогенангидрида карбоновой кислоты, с соединением (7). Обычно способ (i) с получением смешанного ангидрида кислот можно осуществлять в присутствии или отсутствие основания, в инертном растворителе. Примеры инертного растворителя включают галогенированные углеводороды, такие как хлороформ, дихлорметан, дихлорэтан и четыреххлористый углерод; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как Et2O, диизопропиловый эфир, ТГФ и диметоксиэтан; сложные эфиры, такие как метилацетат, AcOEt и изопропилацетат; апротонные полярные растворители,такие как ДМФА, диметилсульфоксид и гексаметилфосфортриамид, и их смеси. Примеры основания включают органические основания, такие как Et3N, триметиламин, пиридин,диметиланилин, DIPEA, диметиламинопиридин, N-метилморфолин, DBN, DBU и DABCO; неорганические основания, например карбонаты, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия и гидрокарбонат калия; гидроксиды металлов, такие как гидроксид натрия, гидроксид калия и гидроксид кальция; гидриды металлов, такие как гидрид калия и гидрид натрия; металлы, такие как калий и натрий; амиды металлов, такие как амид натрия; и алкоголяты металлов, такие как метилат натрия и этилат натрия. Примеры алкилгалогенформиатов, используемых в способе со смешанными ангидридами кислот,включают метилхлорформиат, метилбромформиат, этилхлорформиат, этилбромформиат и изобутилхлорформиат. В данном способе соединение (7), алкилгалогенформиат и соединение (8) предпочтительно используют в эквимолярных количествах, а также каждое соединение из алкилгалогенформиата и соединения (8) можно использовать в количестве 0,5-2 моль на 1 моль соединения (7). Взаимодействие обычно осуществляют при температуре от -20 до 150C, предпочтительно при 1050C, и обычно оно завершается за период от 5 мин до 30 ч, предпочтительно от 10 мин до 25 ч. Способ (iii), в котором реакцию конденсации осуществляют в присутствии активирующего агента,можно проводить в инертном растворителе в присутствии или отсутствие основания. Примеры инертного растворителя включают галогенированные углеводороды, такие как хлороформ, дихлорметан, дихлорэтан и четыреххлористый углерод; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как Et2O, диизопропиловый эфир, ТГФ и диметоксиэтан; сложные эфиры, такие как метилацетат, AcOEt и изопропилацетат; апротонные полярные растворители,такие как ДМФА, диметилсульфоксид и гексаметилфосфортриамид; и их смеси. Примеры основания включают органические основания, такие как Et3N, DIPEA, триметиламин, пиридин, диметиланилин, N-этилдиизопропиламин, диметиламинопиридин, N-метилморфолин, DBN, DBU и DABCO; неорганические основания, например карбонаты, такие как карбонат натрия, карбонат калия,гидрокарбонат натрия и гидрокарбонат калия; гидроксиды металлов, такие как гидроксид натрия, гидроксид калия и гидроксид кальция; гидриды металлов, такие как гидрид калия и гидрид натрия; металлы,такие как калий и натрий; амиды металлов, такие как амид натрия; и алкоголяты металлов, такие как метилат натрия и этилат натрия. Примеры активирующего агента включают дициклогексилкарбодиимид, WSC, DEPC, DMT-MM,трифенилфосфин, дифенилфосфинилхлорид, фенил-N-фенилфосфорамидхлоридат, диэтилхлорфосфат,диэтилцианофосфат,азид дифенилфосфорной кислоты и хлорангидрид бис-(2-оксо-3- 10021627 оксазолидинил)фосфиновой кислоты и карбонилдиимидазол. Подходящим количеством активирующего агента обычно является по меньшей мере 0,9 моль, предпочтительно 1-5 моль на 1 моль соединения (8). Вместе с активирующим агентом можно использовать добавку. Примеры добавок включают НОАТ, НОВТ и подобные. Взаимодействие обычно осуществляют при температуре от -20 до 180C, предпочтительно при 0150C, и обычно оно завершается за период от 5 мин до 90 ч. Если в качестве одного из других способов (iv) применяют способ, в котором осуществляют взаимодействие галогенангидрида кислоты соединения (7) с соединением (8), указанным выше, то взаимодействие можно осуществлять в присутствии основания в инертном растворителе. Примеры основания включают различные известные основания в широких пределах, такие как соединения, аналогичные основаниям, используемым для способа с получением смешанного ангидрида кислот (i). Кроме указанных выше растворителей, примеры инертного растворителя включают спирты, такие как метанол, этанол,изопропанол, пропанол, бутанол, 3-метокси-1-бутанол, этилцеллозольв и метилцеллозольв; ацетонитрил; пиридин; ацетон и воду. Соотношение соединения (7) к галогенангидриду кислоты соединения (8) не имеет ограничений и может быть выбрано подходящим образом из широкого диапазона значений. Обычно подходящим для использования является, например, по меньшей мере 0,9 моль, предпочтительно 1-5 моль соединения (7) на 1 моль галогенангидрида кислоты соединения (8). Взаимодействие обычно осуществляют при температуре от -20 до 180C, предпочтительно при 0150C, и обычно взаимодействие завершается за период от 5 мин до 30 ч. Если необходимо, перед использованием для взаимодействий исходных и промежуточных соединений, показанных на каждой из указанных выше реакционных схем, можно провести защиту функциональной группы подходящей группой известным способом и по завершении взаимодействия провести депротонирование защитной группы известным способом. Кроме того, каждая из формул, показанных на каждой из реакционных схем, включает соединения,добавляемые к исходным соединениям, и целевые соединения в виде сольватов (например, гидратов,этилатов и т.д.). Соединение (1) по настоящему изобретению включает стереоизомеры и оптические изомеры. Исходные соединения и целевые соединения, представленные на каждой из реакционных схем,можно использовать в виде подходящих солей. Целевые соединения, полученные на каждой стадии,можно использовать на следующей стадии без выделения. Каждое из целевых соединений, полученное согласно приведенным выше реакционным схемам,можно выделить из реакционной смеси и очистить, например, после охлаждения реакционной смеси,применяя методику выделения, например фильтрование, концентрирование, экстракцию и т.д., отделяя неочищенный реакционный продукт и затем подвергая сырой реакционный продукт общей методике очистки, например колоночной хроматографии, перекристаллизации и т.д. Среди соединений по настоящему изобретению соединения, имеющие основную группу, могут легко образовывать соли с общеизвестными фармацевтически приемлемыми кислотами. Примеры таких кислот включают хлористо-водородную кислоту, бромисто-водородную кислоту, азотную кислоту, серную кислоту, фосфорную кислоту и другие неорганические кислоты, метансульфоновую кислоту, птолуолсульфоновую кислоту, уксусную кислоту, лимонную кислоту, винную кислоту, малеиновую кислоту, фумаровую кислоту, яблочную кислоту, молочную кислоту, другие органические кислоты и т.д. Среди соединений по настоящему изобретению соединения, имеющие кислотную группу, могут легко образовывать соли при взаимодействии с фармацевтически приемлемыми основными соединениями. Примеры таких основных соединений включают гидроксид натрия, гидроксид калия, гидроксид кальция, карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия и т.д. В соединении по настоящему изобретению один или более атомов могут быть замещены одним или более изотопными атомами. Примеры изотопных атомов включают дейтерий (2 Н), тритий (3 Н), 13 С, 14N,18O и т.д. Далее дано описание фармацевтических препаратов, включающих соединение по настоящему изобретению в качестве активного ингредиента. Такие фармацевтические препараты получают, формулируя соединение по настоящему изобретению в виде обычных фармацевтических препаратов, используя обычно используемые разбавители или эксципиенты, такие как наполнители, добавки, связующие, смачивающие агенты, дезинтегранты, поверхностно-активные вещества, лубриканты и т.д. Форму таких фармацевтических препаратов можно выбрать из различных форм в соответствии с целью терапии. Конкретные примеры включают таблетки, пилюли, порошки, растворы, суспензии,эмульсии, гранулы, капсулы, суппозитории, инъекции (растворы, суспензии и т.д.) и подобные. Для получения таблеток можно использовать любой из различных известных носителей, включающих, например, лактозу, белый сахар, хлорид натрия, глюкозу, карбамид, крахмал, карбонат кальция,каолин, кристаллическую целлюлозу и другие эксципиенты; воду, этанол, пропанол, простой сироп, растворы глюкозы, растворы крахмала, растворы желатина, карбоксиметилцеллюлозу, шеллак, метилцеллюлозу, фосфат калия, поливинилпирролидон и другие связующие; сухой крахмал, альгинат натрия, по- 11021627 рошок агара, порошок ламинарана, гидрокарбонат натрия, карбонат кальция, сложные эфиры алифатических кислот и полиоксиэтиленсорбитана, лаурилсульфат натрия, моноглицерид стеариновой кислоты,крахмал, лактозу и другие дезинтегранты; белый сахар, стеарин, масло какао, гидрированные масла и другие ингибиторы дезинтегрирования; четвертичное аммониевое основание, лаурилсульфат натрия и другие промоторы абсорбции; глицерин, крахмал и другие смачивающие агенты; крахмал, лактозу, каолин, бентонит, коллоидную кремниевую кислоту и другие адсорбенты; очищенный тальк, стеараты, порошок борной кислоты, полиэтиленгликоль и другие лубриканты; и т.д. Если требуется, на такие таблетки можно наносить покрытия из обычных материалов покрытий, получая, например, таблетки, покрытые сахаром, таблетки, покрытые желатином, таблетки с энтеросолюбильным покрытием, таблетки с пленочным покрытием, двуслойные или многослойные таблетки и т.д. Для получения пилюль можно использовать любой из различных известных носителей, включающих, например, глюкозу, лактозу, крахмал, масло какао, гидрированные растительные масла, каолин,тальк и другие эксципиенты; порошок гуммиарабика, порошок трагаканта, желатин, этанол и другие связующие; ламинаран, агар, другие дезинтегранты и т.д. Для получения суппозиториев можно использовать любой из различных известных носителей,включающих, например, полиэтиленгликоль, масло какао, высшие спирты, сложные эфиры высших спиртов, желатин, полусинтетические глицериды и т.д. Для получения препарата для инъекций раствор, эмульсию или суспензию стерилизуют и предпочтительно готовят изотоничным крови. Можно использовать любой из различных известных широкоиспользуемых разбавителей для получения раствора, эмульсии или суспензии. Примеры таких разбавителей включают воду, этанол, пропиленгликоль, этилированный изостеариловый спирт, полиоксилированный изостеариловый спирт, сложные эфиры алифатических кислот и полиоксиэтиленсорбитан и т.д. В этом случае, фармацевтический препарат может содержать хлорид натрия, глюкозу или глицерин в количестве, достаточном для получения изотонического раствора, и может содержать обычные агенты,способствующие растворению, буферы, анальгетики и т.д., а также, если необходимо, красители, стабилизаторы, вкусовые агенты, подслащающие и другие агенты и/или другие лекарственные средства. Доля соединения по настоящему изобретению в фармацевтическом препарате не имеет ограничений и может быть выбрана подходящим образом из широкого диапазона значений. Обычно предпочтительно, чтобы фармацевтический препарат содержал соединение по настоящему изобретению в пропорции от 1 до 70 мас.%. Способ введения фармацевтического препарата по настоящему изобретению не имеет ограничений,и препарат можно вводить способом, подходящим для формы препарата, возраста и пола пациента, состояния заболевания и других условий. Например, таблетки, пилюли, растворы, суспензии, эмульсии,гранулы и капсулы принимают перорально. Инъекции вводят внутривенно отдельно или в виде смеси с обычными препаратами для инъекций, такими как растворы глюкозы, растворы аминокислот или подобные, или вводят отдельно внутримышечно, внутрикожно, подкожно или внутрибрюшинно, как требуется. Суппозитории вводят ректально. Дозировку фармацевтического препарата выбирают подходящим образом в соответствии со способом введения, возрастом и полом пациента, тяжестью заболевания и другими условиями, и обычно она составляет от 0,001 до 100 мг/кг массы тела/день и предпочтительно от 0,001 до 50 мг/кг массы тела/день, одной дозой или разделенными дозами. Так как дозировку варьируют в зависимости от различных условий, доза меньше указанного выше диапазона может быть достаточной или может потребоваться доза больше указанного выше диапазона. Примеры Ниже приведены примеры получения соединений, используемых в данном изобретении, с последующими результатами фармакологических тестов этих соединений. Сравнительный пример 1. Получение трет-бутил-3-метокси-4-[(5-нитропиридин-2-ил)окси]фенил карбамата. Смесь 2-метокси-4-нитрофенола (3,22 г), ди-трет-бутилдикарбоната (4,16 г) и палладия на углероде(5 мас.%, 2,03 г) в EtOH (100 мл) перемешивают при 40C в течение 5 ч в атмосфере водорода. Смесь фильтруют через рыхлый слой целита и концентрируют фильтрат при пониженном давлении с получением коричневого масла. Масло растворяют в ДМФА (80 мл). Добавляют к раствору 2-хлор-5 нитропиридин (3,02 г) и карбонат калия (3,95 г). После перемешивания при комнатной температуре в течение 1 ч и при 50C в течение 3 ч смесь фильтруют через рыхлый слой целита и концентрируют фильтрат при пониженном давлении. Остаток разбавляют AcOEt и водой и экстрагируют AcOEt. Органический слой промывают водой, насыщенным водным NaCl, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. К остатку добавляют смесь Et2O/ацетон и полученную смесь перемешивают при комнатной температуре в течение ночи. Образовавшийся осадок собирают фильтрованием и очищают фильтрат колоночной хроматографией на силикагеле (H-гексан/AcOEt=9/1-3/1). Фракции объединяют с получением указанного в заголовке соединения (5,44 г) в виде светло-желтого твердого вещества. 1 м), 7,43 (1 Н, с), 8,44 (1 Н, дд, J=9,0, 2,7 Гц), 9,00-9,02 (1 Н, м). Сравнительный пример 2. Получение трет-бутил-3-метил-4-[(5-нитропиридин-2-ил)окси]фенил карбамата. К ДМФА-раствору (50 мл) трет-бутил-(4-гидрокси-3-метилфенил)карбамата (5,00 г) добавляют 2 хлор-5-нитропиридин (3,91 г) и карбонат калия (4,64 г). После перемешивания при 80C в течение 4 ч смесь концентрируют при пониженном давлении. Остаток разбавляют AcOEt и водой и экстрагируютAcOEt. Органический слой промывают водой, насыщенным водным NaCl, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. К остатку добавляют Et2O, и смесь перемешивают при комнатной температуре в течение 2 ч. Образовавшийся осадок собирают фильтрованием, с получением указанного в заголовке соединения (6,04 г) в виде коричневого порошка. 1(4,42 г) добавляют NaH (60% в масле, 0,51 г) при 0C. После перемешивания при 0C в течение 10 мин добавляют йодметан (1,91 г) и смесь перемешивают при комнатной температуре в течение 1 ч. Смесь выливают в воду со льдом и экстрагируют AcOEt. Органический слой промывают водой, насыщенным водным NaCl и сушат над безводным Na2SO4. Удаляют растворитель при пониженном давлении с получением указанного в заголовке соединения (4,80 г) в виде коричневого масла. 1H-ЯМР (CDCl3) : 1,49 (9 Н, с), 3,30 (3H, с), 3,74 (3H, с), 6,87 (1 Н, дд, J=8,5, 2,4 Гц), 6,96-7,05 (2 Н,м), 7,09 (1 Н, д, J=8,5 Гц), 8,45 (1 Н, дд, J=9,0, 2,7 Гц), 9,02 (1 Н, д, J=2,4 Гц). Следующее соединение получают, по существу, таким же способом, как в сравнительном примере 3, используя подходящие исходные вещества. Сравнительный пример 4. трет-Бутил-3-фтор-4-[(5-нитропиридин-2-ил)окси]фенилметилкарбамат. 1H-ЯМР (CDCl3) : 1,49 (9 Н, с), 3,30 (3H, с), 7,07-7,24 (4 Н, м), 8,51 (1 Н, дд, J=9,0, 2,7 Гц), 9,01 (1 Н,д, J=2,7 Гц). Сравнительный пример 5. Получение трет-бутилметил-3-метил-4-[(5-нитропиридин-2 ил)окси]фенилкарбамата. К ДМФА-суспензии (50 мл) NaH (60% в масле, 640 мг) добавляют трет-бутил-3-метил-4-[(5 нитропиридин-2-ил)окси]фенилкарбамат (5,00 г) при 0C. После перемешивания при 0C в течение 10 мин добавляют йодметан (3,08 г) и смесь перемешивают в течение 3 ч. Смесь выливают в воду со льдом и экстрагируют AcOEt. Органический слой промывают водой, насыщенным водным NaCl и сушат над безводным Na2SO4. Удаляют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (H-гептан/AcOEt=6/1-1/1) с получением указанного в заголовке соединения (4,35 г) в виде белого твердого вещества. 1H-ЯМР (CDCl3) : 1,48 (9 Н, с), 2,14 (3H, с), 3,28 (3H, с), 7,01 (1 Н, дд, J=9,2, 0,6 Гц), 7,02 (1 Н, д,J=8,5 Гц), 7,15 (1 Н, дд, J=8,5, 2,4 Гц), 7,18-7,23 (1 Н, ушир.м), 8,47 (1 Н, дд, J=9,2, 2,8 Гц), 9,04 (1 Н, дд,J=2,7, 0,5 Гц). Сравнительный пример 6. Получение трет-бутилметил-4-[(5-нитропиридин-2-ил)окси]фенилкарбамата. К ТГФ-суспензии (30 мл) NaH (60% в масле, 1,22 г) добавляют трет-бутил-4-[(5-нитропиридин-2 ил)окси]фенилкарбамат (7,77 г) при 0C. После перемешивания при 0C в течение 10 мин добавляют йодметан (4,33 г) и смесь перемешивают при комнатной температуре в течение 3 ч. Смесь выливают в воду со льдом и экстрагируют AcOEt. Органический слой промывают водой, насыщенным водным NaCl и сушат над безводным Na2SO4. Удаляют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (н-гексан/AcOEt=2/1) с получением указанного в заголовке соединения (6,30 г) в виде светло-желтого твердого вещества. 1(2 Н, м), 8,48 (1 Н, дд, J=9,0, 2,7 Гц), 9,05 (1 Н, д, J=2,7 Гц). Сравнительный пример 7. Получение трет-бутил-4-[(5-аминопиридин-2-ил)окси]-3-метоксифенил метилкарбамата. Смесь трет-бутил-3-метокси-4-[(5-нитропиридин-2-ил)окси]фенилметилкарбамата (4,80 г) и палладия на углероде (5 мас.%, 1,36 г) в EtOH (100 мл) перемешивают при 40C в течение 2 ч в атмосфере водорода. Смесь фильтруют через рыхлый слой целита и концентрируют фильтрат при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (H-гексан/AcOEt=3/2-3/7) с получением указанного в заголовке соединения (3,58 г) в виде желтого масла. 1 Смесь трет-бутилметил-3-метил-4-[(5-нитропиридин-2-ил)окси]фенилкарбамата (4,35 г) и палладия на углероде (10 мас.%, 620 мг) в AcOEt (80 мл) перемешивают при 45C в течение 3 ч в атмосфере водорода. Смесь фильтруют через рыхлый слой целита и концентрируют фильтрат при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (н-гептан/AcOEt=1/1-3/7) с получением указанного в заголовке соединения (3,55 г) в виде белого твердого вещества. 1(1 Н, д, J=2,9 Гц). Сравнительный пример 9. Получение трет-бутил-4-[(5-аминопиридин-2-ил)окси]фенилметилкарбамата. Смесь трет-бутилметил-4-[(5-нитропиридин-2-ил)окси]фенилкарбамата (3,28 г) и палладия на углероде (10 мас.%, 328 мг) в EtOH (30 мл) перемешивают при 50C в течение 4 ч в атмосфере водорода. Смесь фильтруют через рыхлый слой целита и концентрируют фильтрат при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (н-гексан/AcOEt=2/1) с получением указанного в заголовке соединения (2,79 г) в виде светло-желтого твердого вещества. 1EtOH (57 мл) продувают аргон, затем обрабатывают платиной на углероде (5 мас.%, подложка из активированного угля, влажный, Дегусса тип F101 ra/w) (0,6 г). Затем реакционную смесь помещают в атмосферу Н 2 и энергично перемешивают при 40C в течение 2 ч. Реакционную смесь фильтруют через рыхлый слой целита, концентрируют фильтрат при пониженном давлении с получением указанного в заголовке соединения в виде белого порошка (2,59 г). 1(390 мг) при 0C, затем полученную смесь перемешивают при 0C в течение 10 мин. Образовавшийся осадок отделяют и промывают Н 2 О и Et2O с получением указанного в заголовке соединения в виде белого порошка (0,53 г). 1H-ЯМР (CDCl3) : 1,48 (9 Н, с), 3,27 (3H, с), 7,01 (1 Н, д, J=8,8 Гц), 7,03-7,23 (6 Н, м), 7,05 (2 Н, д,J=8,8 Гц), 7,36-7,43 (2 Н, м), 7,77 (1 Н, с), 7,84 (2 Н, д, J=8,8 Гц), 8,19 (1 Н, д, J=2,2 Гц), 8,22 (1 Н, дд, J=8,7,2,8 Гц). Следующие соединения получают, по существу, таким же способом, как в сравнительном примере 11, используя подходящие исходные вещества. Сравнительный пример 12. трет-Бутил-[4-(5-[(бифенил-4-илкарбонил)амино]пиридин-2-илокси)3-фторфенил]метилкарбамат. 1H-ЯМР (CDCl3) : 1,47 (9 Н, с), 2,17 (3H, с), 3,26 (3H, с), 6,89 (1 Н, д, J=9,0 Гц), 6,99 (1 Н, д, J=8,5 Гц),7,08 (1 Н, дд, J=8,5, 2,4 Гц), 7,12-7,17 (1 Н, ушир.м), 7,40-7,42 (1 Н, м), 7,46-7,50 (2 Н, м), 7,62-7,64 (2 Н, м),7,70-7,72 (2 Н, м), 7,94-7,97 (2 Н, м), 7,97-8,00 (1 Н, ушир.м), 8,22-8,26 (2 Н, м). Сравнительный пример 18. Получение трет-бутилметил-3-метил-4-[(5-[4-(трифторметил)бензоил] аминопиридин-2-ил)окси]фенилкарбамата. К AcOEt-раствору (15 мл) трет-бутил-4-[(5-аминопиридин-2-ил)окси]-3-метилфенилметилкарбамата (0,5 г) и Et3N (0,32 мл) медленно добавляют 4-(трифторметил)бензоилхлорид (237 мл) при 0C,затем полученную смесь перемешивают при комнатной температуре в течение 30 мин. К полученному раствору добавляют AcOEt (10 мл) и воду (10 мл), смесь экстрагируют AcOEt. Органический слой промывают насыщенным водным NaHCO3 и насыщенным водным NaCl, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. После добавления гексана (20 мл) раствор энергично перемешивают. Образовавшийся осадок собирают с получением указанного в заголовке соединения (700 мг) в виде белого твердого вещества. 1(1 Н, д, J=8,8 Гц), 8,26 (1 Н, д, J=2,7 Гц). Следующие соединения получают, по существу, таким же способом, как в сравнительном примере 18, используя подходящие исходные материалы. Сравнительный пример 19. трет-Бутил-4-[(5-[2-фтор-4-(трифторметил)бензоил]аминопиридин 2-ил)окси]-3-метилфенилметилкарбамат. 1(0,53 г) растворяют в TFA (4 мл) и перемешивают при комнатной температуре в течение 5 мин. Смесь выпаривают при пониженном давлении и растворяют остаток в AcOEt. Добавляют охлажденный на льду 5 М NaOH, доводя рН до 12, и экстрагируют смесь AcOEt. Органический слой промывают водой и насыщенным водным NaCl, сушат над безводным MgSO4 и концентрируют при пониженном давлении. Остаток растворяют в Et2O и перемешивают раствор в течение 1 дня. Образовавшийся осадок собирают и промывают Et2O с получением указанного в заголовке соединения в виде белого порошка (0,29 г). 1(5 Н, м), 7,17-7,22 (1 Н, м), 7,36-7,43 (2 Н, м), 7,68 (1 Н, с), 7,84 (2 Н, д, J=8,9 Гц), 8,16-8,23 (2 Н, м). Следующие соединения получают, по существу, таким же способом, как в примере 1, используя подходящие исходные вещества. Пример 2. N-6-[2-Фтор-4-(метиламино)фенокси]пиридин-3-илбифенил-4-карбоксамид. Т.пл.: 190,0-190,5C (разл.). Пример 3. N-6-[2-Фтор-4-(метиламино)фенокси]пиридин-3-ил-4-(трифторметил)бензамид. 1(2 Н, м), 7,69-7,71 (2 Н, м), 7,91 (1 Н, ушир.с), 7,92-7,95 (2 Н, м), 8,19 (1 Н, дд, J=8,8, 2,8 Гц), 8,22 (1 Н, д,J=2,4 Гц). Пример 8. N-6-[2-метил-4-(метиламино)фенокси]пиридин-3-ил-4-(трифторметил)бензамид. Получение N-6-[2-метил-4-(метиламино)фенокси]пиридин-3-ил-4-(трифторметил)бензамида. К раствору трет-бутилметил-3-метил-4-[(5-[4-(трифторметил)бензоил]аминопиридин-2 ил)окси]фенилкарбамата (0,60 г) в CH2Cl2 (1 мл) добавляют TFA (3,32 мл) тремя порциями при 0C. После перемешивания при 0C в течение 30 мин смесь выпаривают при пониженном давлении и остаток растворяют в AcOEt. Добавляют охлажденный на льду 2 М NaOH (10 мл), смесь экстрагируют AcOEt. Органический слой промывают водой и насыщенным водным NaCl, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. После добавления Et2O (20 мл) раствор энергично перемешивают. Образовавшийся осадок собирают и перекристаллизовывают осадок из смеси Et2O/AcOEt/гексан с получением указанного в заголовке соединения (0,44 г) в виде белого порошка. 1H-ЯМР (CDCl3) : 2,09 (3H, с), 2,83 (3H, с), 3,64 (1 Н, с), 6,46 (1 Н, дд, J=8,5, 2,9 Гц), 6,49 (1 Н, д,J=2,9 Гц), 6,83 (1 Н, д, J=9,0 Гц), 6,88 (1 Н, д, J=8,5 Гц), 7,74 (2 Н, д, J=8,1 Гц), 7,92-8,01 (3H, м), 8,14 (1 Н,дд, J=8,9, 2,8 Гц), 8,21 (1 Н, д, J=2,7 Гц). Следующие соединения получают. по существу, таким же способом, как в примере 8, используя подходящие исходные вещества. Пример 9. 2-Фтор-N-6-[2-метил-4-(метиламино)фенокси]пиридин-3-ил-4-(трифторметил)бензамид. 1(1 Н, дд, J=8,8, 2,6 Гц), 8,24 (1 Н, д, J=2,6 Гц). Пример 12. Получение N-6-[2-метокси-4-(метиламино)фенокси]пиридин-3-ил-4-(трифторметил) бензамида. К AcOEt-раствору (10 мл) трет-бутил-4-[(5-аминопиридин-2-ил)окси]-3-метоксифенилметилкарбамата (0,60 г) и триэтиламина (0,26 г) добавляют 4-(трифторметил)бензоилхлорид (0,38 г) при 0C. Смесь перемешивают при комнатной температуре в течение 1 ч. Смесь выливают в воду и экстрагируютAcOEt. Органический слой промывают водой, насыщенным водным NaCl, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией (нгексан/AcOEt=9/1-7/3) с получением желтого аморфного порошка. Полученный порошок растворяют вCH2Cl2 (10 мл), затем добавляют TFA (1 мл). Смесь перемешивают при комнатной температуре в течение 2 ч. После удаления растворителя при пониженном давлении выливают остаток в насыщенный водныйNaHCO3 и экстрагируют AcOEt. Органический слой промывают водой, насыщенным водным NaCl, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (н-гексан/AcOEt=7/3-3/7) с получением указанного в заголовке соединения (0,42 г) в виде бесцветного масла. 1(1 Н, д, J=8,8 Гц), 6,95 (1 Н, д, J=8,3 Гц), 7,74 (2 Н, д, J=8,3 Гц), 7,94-8,02 (3H, м), 8,11-8,22 (2 Н, м). Следующие соединения получают, по существу, таким же способом, как в примере 12, используя подходящие исходные вещества. Пример 13. N-6-[2-Метокси-4-(метиламино)фенокси]пиридин-3-ил-4-феноксибензамид. 1(2 Н, м), 7,49 (1 Н, д, J=12,0 Гц), 7,60 (1 Н, дд, J=8,3, 1,0 Гц), 8,14 (1 Н, дд, J=8,8, 2,8 Гц), 8,28-8,34 (3H, м). Пример 20 2,3,4-Трифтор-N-6-[4-(метиламино)фенокси]пиридин-3-илбензамид. Получение 2,3,4-трифтор-N-6-[4-(метиламино)фенокси]пиридин-3-илбензамида. К AcOEt-раствору (10 мл) трет-бутил-4-[(5-аминопиридин-2-ил)окси]фенилметилкарбамата (0,50 г) и триэтиламина (0,32 г) добавляют 2,3,4-трифторбензоилхлорид (0,37 г) при 0C. Смесь перемешивают при комнатной температуре в течение 1 ч. Смесь выливают в воду и экстрагируют AcOEt. Органический слой промывают водой, насыщенным водным NaCl, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток растворяют в CH2Cl2 (10 мл), затем добавляют TFA (3 мл). После перемешивания при комнатной температуре в течение 2 ч смесь выливают в насыщенный водный NaHCO3 и экстрагируют AcOEt. Органический слой промывают водой, насыщенным водным NaCl, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (н-гексан/AcOEt=2/1) с получением указанного в заголовке соединения (0,55 г) в виде белого твердого вещества. 1(0,34 г) добавляют 6 М HCl (0,14 мл) при 0C. Полученную смесь перемешивают при 0C. Образовавшийся осадок перекристаллизовывают из EtOH/H2O с получением указанного в заголовке соединения в виде белого порошка (0,28 г). 1(1 Н, д, J=2,2 Гц), 10,35 (1 Н, с). Следующие соединения получают, по существу, таким же способом, как в примере 21, используя подходящие исходные вещества. Пример 22. Гидрохлорид 2-фтор-N-6-[2-фтор-4-(метиламино)фенокси]пиридин-3-ил-4(трифторметил)бензамида. 1(1 Н, т, J=8,8 Гц), 7,44-7,54 (1 Н, м), 7,56-7,65 (1 Н, м), 8,16 (1 Н, дд, J=8,8, 2,7 Гц), 8,37 (1 Н, д, J=2,4 Гц),10,70 (1 Н, с). Пример 24. Получение гидрохлорида N-6-[2-метил-4-(метиламино)фенокси]пиридин-3-ил-4(трифторметил)бензамида. К EtOH-раствору (3 мл) N-6-[2-метил-4-(метиламино)фенокси]пиридин-3-ил-4-(трифторметил) бензамида (0,30 г) добавляют 6 М водный HCl (0,13 мл) при 0C. Полученную смесь перемешивают при 0C. Образовавшийся осадок перекристаллизовывают из EtOH/H2O с получением указанного в заголовке соединения в виде белого порошка (0,20 г). 1 Н-ЯМР (ДМСО-d6) : 2,14 (3H, с), 2,91 (3H, с), 7,11 (1 Н, д, J=9,0 Гц), 7,17 (1 Н, д, J=8,5 Гц), 7,32 2,8 Гц), 8,48 (1 Н, д, J=2,4 Гц), 10,71 (1 Н, с). Следующие соединения получают, по существу, таким же способом, как в примере 24, используя подходящие исходные вещества. Пример 25. Гидрохлорид 2,3,4-трифтор-N-6-[2-метил-4-(метиламино)фенокси]пиридин-3 илбензамида. Т.пл.: 222,9-225,4C (разл.). Пример 26. Гидрохлорид N-6-[2-метокси-4-(метиламино)фенокси]пиридин-3-ил-4-феноксибензамида. Т.пл.: 202,2-202,3C. Пример 27. Гидрохлорид N-6-[2-метокси-4-(метиламино)фенокси]пиридин-3-ил-4-(трифторметил)бензамида. Т.пл.: 217,6-218,2C. Пример 28. Гидрохлорид 2-фтор-N-6-[2-метокси-4-(метиламино)фенокси]пиридин-3-ил-4(трифторметил)бензамида. Т.пл.: 197,0-198,1C. Пример 29. Гидрохлорид 2,3,4-трифтор-N-6-[2-метокси-4-(метиламино)фенокси]пиридин-3 илбензамида. Т.пл.: 207,1-209,8C. Пример 30. Гидрохлорид N-6-[4-(метиламино)фенокси]пиридин-3-ил-4-(трифторметил)бензамида. 1(0,55 г) добавляют 6 М HCl (0,27 мл) при комнатной температуре. Полученную смесь перемешивают при комнатной температуре. Образовавшийся осадок собирают фильтрованием с получением указанного в заголовке соединения в виде белого порошка (0,35 г). 1H-ЯМР (ДМСО-d6) : 2,89 (3H, с), 7,11 (1 Н, д, J=8,8 Гц), 7,20-7,23 (2 Н, м), 7,38-7,40 (2 Н, м), 7,477,52 (1 Н, м), 7,58-7,64 (1 Н, м), 8,18 (1 Н, дд, J=8,8, 2,7 Гц), 8,45 (1 Н, д, J=2,7 Гц), 10,75 (1 Н, с). Следующие соединения можно получить, по существу, таким же способом, как в примере 21, используя подходящие исходные вещества. Пример 33. ГидрохлоридN-6-[2-фтор-4-(метиламино)фенокси]пиридин-3-илбифенил-4 карбоксамида. Пример 34. Гидрохлорид N-6-[2-фтор-4-(метиламино)фенокси]пиридин 3-ил-4-(трифторметил) бензамида. Пример 35. Гидрохлорид N-6-[2-метил-4-(метиламино)фенокси]пиридин-3-ил-4-феноксибензамида. Пример 36. Гидрохлорид N-6-[2-метил-4-(метиламино)фенокси]пиридин-3-илбифенил-4-карбоксамида. Пример 37. Гидрохлорид 2-фтор-N-6-[2-метил-4-(метиламино)фенокси]пиридин-3-ил-4-(трифторметил)бензамида. Пример 38. Гидрохлорид N-6-[4-(метиламино)фенокси]пиридин-3-ил-4-феноксибензамида. Пример 39. Гидрохлорид N-6-[4-(метиламино)фенокси]пиридин-3-илбифенил-4-карбоксамида. Пример 40. Гидрохлорид N-6-[2-метокси-4-(метиламино)фенокси]пиридин-3-илбифенил-4 карбоксамида. Фармакологический тест. Антипролиферативное действие на раковые клетки (in vitro). Ингибирование роста раковых клеток печени человека (HuH-7) определяют способом с применением сульфородамина В на базе способа Skehan P. et al. (J Natl Cancer Inst. 1990 Jul 4; 82(13): 1107-12). В данном исследовании клетки HuH-7 высевают на среду DMEM, содержащую 10% фетальную бычью сыворотку, на 96-луночный микропланшет. После 24-часовой инкубации при 37C в присутствии 5% диоксида углерода, добавляют тестируемое соединение и клетки инкубируют еще 5 дней. После инкубации добавляют раствор трихлоруксусной кислоты с получением конечной концентрации 10% и клетки оставляют стоять при 4C в течение 1 ч для фиксации. Затем клетки промывают водой для удаления среды и трихлоруксусной кислоты и сушат на воздухе. Высушенные клетки хранят при 4C, пока они не окрасятся сульфородамином В. В каждую лунку добавляют 1% раствор уксусной кислоты, содержащий 0,4% сульфородамин В, и оставляют стоять в течение периода 20-30 мин при комнатной температуре. После удаления супернатанта каждую лунку промывают 1% раствором уксусной кислоты и добавляют при пе- 18021627 ремешивании 10 мМ раствор Tris (трис-(гидроксиметил)аминометан) для элюирования красителя, захваченного клетками. Затем определяют оптическую плотность при экспериментальной длине волны 492 нм и длине волны сравнения 690 нм и рассчитывают разницу. Активность роста клеток в каждой лунке определяют как значение, определяемое вычитанием OD в контрольной лунке, не содержащей клеток (разница поглощения при 492 и 690 нм), из OD в экспериментальной лунке. Определяют концентрацию 50% ингибирования (IC50 (нМ тестируемого соединения, сравнивая активность роста клеток в лунке, содержащей тестируемое соединение, с контролем, не содержащим тестируемое соединение. Результаты показаны в табл. 2. Таблица 2 Тест на метаболическую стабильность в микросомах печени. В данном исследовании распределяют в каждую пробирку по 222,5 мкл микросом печени (0,22 мг/мл) и добавляют туда 2,5 мкл тестируемого соединения (100 мкМ). Затем 22,5 мкл этой смеси вводят в 500 мкл ацетонитрила с добавлением IS в качестве 0 мин образца и остаток предварительно инкубируют при 37C в течение 5 мин. Взаимодействие начинают, добавляя 22,5 мкл NADH/NADPH (10 мМ), и через 10 и 20 мин 25 мкл реакционной смеси вводят в 500 мкл ацетонитрила с добавлением IS. Образцы центрифугируют (5700 об/мин, 4C, 10 мин) и анализируют супернатанты ЖХ/МС/МС. Рассчитывают наклон линии линейной регрессии из соотношений log остаточного процента относительно времени инкубации (-ke) и рассчитывают собственный клиренс (CLint), используя следующее уравнение: Тест на стабильность. Для определения стабильности соединений без проведения длительного теста на стабильность оценивают стабильность растворенных соединений в условиях теплового и кислотного стресса. Примерно 0,005 г тестируемого соединения растворяют в 50 мл подвижной фазы и используют по- 19021627 лученный раствор в качестве образца раствора. Растворы помещают во флаконы из коричневого стекла и хранят при 70C в течение периода тестирования. Проводят исследование на 20 мкл каждого образца раствора в указанных далее точках отбора проб под контролем жидкостной хроматографии в соответствии со следующими условиями. Определяют остаточное относительное содержание площади пика тестируемого соединения (%) в общей площади пиков, детектируемой в растворе способом автоматического интегрирования. Рабочие условия указаны ниже. Детектор: ультрафиолетовый абсорбционный фотометр(длина волны: 254 нм); колонка: колонка из нержавеющей стали с внутренним диаметром примерно 4 мм и длиной примерно 15 см, набивка из октадецилсиланизированного силикагеля для жидкостной хроматографии (диаметр частиц 5 мкм); температура колонки: постоянная температура около 40C; подвижная фаза: смесь воды, ацетонитрила и трифторуксусной кислоты (500:500:1); скорость потока: 1 мл/мин; время измерения: 25 мин; точки отбора образцов: день 0, день 1 и день 3. Остаточное относительное содержание площади пика тестируемого соединения (%) рассчитывают следующим образом: площадь пика тестируемого соединения/общая площадь пиков, детектируемая в растворе 100. Описанным выше способом подтверждено, что некоторые конкретные соединения, такие как соединение примера 30, имеют превосходную стабильность при хранении. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (1) или его фармацевтически приемлемая соль где R1 представляет собой атом галогена, С 6-С 10 арильную группу, С 6-С 10 арилоксигруппу или линейную или разветвленную алкильную группу, содержащую 1-6 атомов углерода и необязательно замещенную одним или более атомами галогена;R2 представляет собой атом водорода, атом галогена, линейную или разветвленную алкильную группу, содержащую 1-6 атомов углерода или линейную или разветвленную алкоксигруппу, содержащую 1-6 атомов углерода; иm равно целому числу от 1 до 3; при условии, что, если m равно 2 или 3, R1 являются одинаковыми или различными. 2. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой атом водорода. 3. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой атом галогена. 4. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой линейную или разветвленную алкильную группу, содержащую 1-6 атомов углерода. 5. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой линейную или разветвленную алкоксигруппу, содержащую 1-6 атомов углерода. 6. Соединение по п.1 или его фармацевтически приемлемая соль, которое выбрано из группы, состоящей из 7. Соединение по п.1, которое выбрано из группы, состоящей из 8. Фармацевтическая композиция для предупреждения и/или лечения рака, содержащая соединение формулы (1) или его фармацевтически приемлемую соль по п.1 и фармацевтически приемлемый носитель. 9. Лекарственное средство для предупреждения и/или лечения рака, содержащее соединение формулы (1) или его фармацевтически приемлемую соль по п.1. 10. Применение соединения формулы (1) или его фармацевтически приемлемой соли по п.1 для получения фармацевтической композиции для предупреждения и/или лечения рака. 11. Способ предупреждения и/или лечения рака, включающий введение нуждающемуся в этом пациенту соединения формулы (1) или его фармацевтически приемлемой соли по п.1.
МПК / Метки
МПК: A61K 31/44, C07D 213/75, A61P 35/00
Метки: лечения, 4-(метиламинофенокси)пиридин-3-илбензамида, производные, рака
Код ссылки
<a href="https://eas.patents.su/24-21627-proizvodnye-4-metilaminofenoksipiridin-3-ilbenzamida-dlya-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 4-(метиламинофенокси)пиридин-3-илбензамида для лечения рака</a>
Предыдущий патент: Бытовой прибор со съемной предохранительной панелью
Следующий патент: Соединения актагардина и их применение для лечения или профилактики инфекции clostridium difficile
Случайный патент: Зубная щетка с эксцентриковым приводом