Производные триазоло[4,3-b]пиридазина и их применение для лечения рака предстательной железы
Номер патента: 19647
Опубликовано: 30.05.2014
Авторы: Рейбоу Алфред Артур, Рао-Коруподжу Сриниваза, Брэдбери Роберт Хью, Тумма Харикришна, Карр Грегори Ричард
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
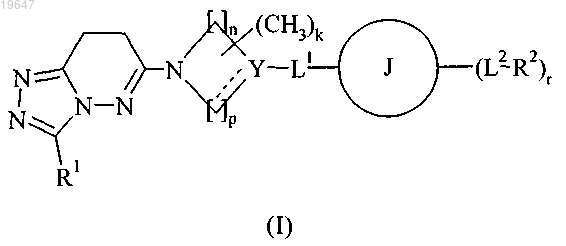
где R1 представляет собой галоС1-4алкил;
k представляет собой 0, 1 или 2;
n и p независимо представляют собой 1 или 2;
Y представляет собой N, С, СН или СОН;
![]() представляет собой простую связь, когда Y представляет собой N, СН или СОН;
представляет собой простую связь, когда Y представляет собой N, СН или СОН;
![]() представляет собой двойную связь, когда Y представляет собой С, L1 представляет собой простую связь и J представляет собой индолил или пирролопиридинил;
представляет собой двойную связь, когда Y представляет собой С, L1 представляет собой простую связь и J представляет собой индолил или пирролопиридинил;
L1 представляет собой простую связь, -(CR3R4)r, -(CR3R4)v-O-(CR3R4)v-, -N(R5)-(CH2)q-, -S-, -S(O)- или -S(O)2-;
R3 и R4, идентично или различно в каждом случае, представляют собой водород или метил;
R5 представляет собой водород или метил;
q, идентично или различно в каждом случае, представляет собой 0, 1, 2, 3 или 4;
t представляет собой 1, 2 или 3;
v, идентично или различно в каждом случае, представляет собой 0, 1 или 2;
J представляет собой фенил или нафтил; С3-6циклоалкил; моноциклическое 4-, 5-, 6- или 7-членное гетероциклическое кольцо, которое содержит 1, 2 или 3 гетероатома, независимо выбранных из О, N или S; 5- или 6-членное моноциклическое гетероарильное кольцо, которое содержит 1, 2, 3 или 4 гетероатома, независимо выбранных из О, N или S; или
9- или 10-членную бициклическую гетероарильную кольцевую систему, которая содержит 1, 2, 3, 4 или 5 гетероатомов, независимо выбранных из О, N или S;
L2 представляет собой простую связь, -(CR3R4)t-, -C(O)N(R5)-(CH2)q-, -C(O)N(R5)-(CH2)q-S(O)2-, -NR5C(O)-(CH2)q-, -C(O)-(CH2)q-, -O-(CR9R10)q-, -O-(CR3R4)q-NR5-(CH2)q-, -O-(CR3R4)q-C(O)NR5-(CH2)q-, -S-, -S(O)- или -S(O)2-;
R9 и R10, идентично или различно в каждом случае, представляют собой водород, метил, этил, изопропил, циклопропил или метоксиметил;
R2 представляет собой
гало, C1-6алкил, С2-6алкенил, С2-6алкинил, карбокси, C1-6алкокси, циано, оксо, фторС1-6алкил, гидрокси, амино, N-С1-4алкиламино или N,N-ди-С1-4алкиламино;
фенил или нафтил, где фенильное или нафтильное кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6;
моноциклическое 4-, 5-, 6- или 7-членное гетероциклическое кольцо, которое содержит 1, 2 или 3 гетероатома, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6;
моноциклическое 5- или 6-членное гетероарильное кольцо, которое содержит 1, 2, 3 или 4 гетероатома, независимо выбранных из О, N или S, и где гетероарильное кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6; или
9- или 10-членную бициклическую гетероарильную кольцевую систему, которая содержит 1, 2, 3, 4 или 5 гетероатомов, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6;
R6 представляет собой амино, гало, С1-6алкил, С3-6циклоалкил, С2-6алкенил, С2-6алкинил, C1-6алкокси, С2-6алканоил, С1-6алкоксиС1-6алкил, карбокси, циано, оксо, фторС1-6алкил, гидрокси, гидроксиС1-6алкил, C1-6алкилсульфанил, C1-6алкилсульфинил, C1-6алкилсульфонил, оксетан-3-илкарбонил, N-С1-4алкиламино, N,N-ди-C1-4алкиламино или -C(O)NR7R8, где R7 и R8 независимо представляют собой водород или метил; и
r представляет собой 0, 1, 2 или 3.
2. Соединение в соответствии с п.1 или его фармацевтически приемлемая соль, где R1 представляет собой трифторметил.
3. Соединение в соответствии с п.1 или 2 или его фармацевтически приемлемая соль, где Y представляет собой N, СН или СОН.
4. Соединение в соответствии с любым из пп.1-3 или его фармацевтически приемлемая соль, где L1 представляет собой простую связь или -(CR3R4)t-.
5. Соединение в соответствии с любым из пп.1-4 или его фармацевтически приемлемая соль, где J представляет собой фенил, пиридинил, индолил или пирролопиридинил.
6. Соединение в соответствии с любым из пп.1-5 или его фармацевтически приемлемая соль, где L2 представляет собой простую связь, -O-(CR9R10)q- или -O-(CR3R4)q-C(O)NR5-(CH2)q-.
7. Соединение в соответствии с любым из пп.1-6 или его фармацевтически приемлемая соль, где J представляет собой фенил и L2 связан в пара-положении фенильного кольца относительно связывания L1.
8. Соединение в соответствии с любым из пп.1-7 или его фармацевтически приемлемая соль, где R2 представляет собой
гало, С1-6алкил, С2-6алкенил, С2-6алкинил, карбокси, C1-6алкокси, циано, оксо, фторС1-6алкил, гидрокси, амино, N-С1-4алкиламино или N,N-ди-С1-4алкиламино;
моноциклическое 4-, 5-, 6- или 7-членное гетероциклическое кольцо, которое содержит 1, 2 или 3 гетероатома, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6; или
моноциклическое 5- или 6-членное гетероарильное кольцо, которое содержит 1, 2, 3 или 4 гетероатома, независимо выбранных из О, N или S, и где гетероарильное кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6.
9. Соединение в соответствии с любым из пп.1-7 или его фармацевтически приемлемая соль, где R2 представляет собой
гало, С1-6алкил, C1-6алкокси, циано, фторС1-6алкил или гидрокси;
моноциклическое 6-членное гетероциклическое кольцо, которое содержит 1 или 2 гетероатома, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6; или
моноциклическое 5-членное гетероарильное кольцо, которое содержит 1 или 2 гетероатома, независимо выбранных из О, N или S, и где гетероарильное кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6.
10. Соединение в соответствии с любым из пп.1-7 или его фармацевтически приемлемая соль, где R2 представляет собой
фтор, хлор, метил, метокси, дифторметил, трифторметил, циано или гидрокси;
пиперидинил или пиперазинил, где пиперидинильное или пиперазинильное кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6; или
пиразолил или имидазолил, где пиразолильное или имидазолильное кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6.
11. Соединение в соответствии с любым из пп.1-10 или его фармацевтически приемлемая соль, где n и р оба представляют собой 2.
12. Соединение в соответствии с любым из пп.1-11 или его фармацевтически приемлемая соль, где k представляет собой 0.
13. Соединение в соответствии с любым из пп.1-12 или его фармацевтически приемлемая соль, где r представляет собой 0 или 1.
14. Соединение в соответствии с любым из пп.1-13 или его фармацевтически приемлемая соль, где R6 представляет собой C1-6алкил, С2-6алканоил, фторС1-6алкил, C1-6алкилсульфонил или оксо.
15. Соединение в соответствии с любым из пп.1-13 или его фармацевтически приемлемая соль, где R6 представляет собой метил, этил, ацетил, пентаноил, метилсульфонил или трифторметил.
16. Соединение в соответствии с п.1, выбранное из
6-[4-(4-фторбензил)пиперазин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-[4-(1Н-индол-3-ил)-3,6-дигидропиридин-1(2Н)-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-[4-(1Н-индол-3-ил)пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-(4-{4-[3-(4-ацетилпиперазин-1-ил)пропокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-(4-{4-[2-(4-ацетилпиперазин-1-ил)этокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-[4-(3-фторбензил)пиперазин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-[4-(3-хлорбензил)пиперазин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
3-(трифторметил)-6-{4-[3-(трифторметил)бензил]пиперазин-1-ил}-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-[4-(2,3-дифторбензил)пиперазин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-{4-[2-(дифторметил)-5-фторбензил]пиперазин-1-ил}-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-[4-(1Н-индол-3-илметил)пиперазин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-{4-[(5-фтор-1Н-индол-3-ил)метил]пиперазин-1-ил}-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
3-({4-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперазин-1-ил}метил)-1Н-индол-5-карбонитрил;
4-(4-фторфенил)-1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ол;
6-(4-{4-[2-(1-метил-1Н-пиразол-5-ил)этокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-(4-{4-[2-(1-метил-1Н-пиразол-5-ил)этокси]фенил}пиперазин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-[4-(1Н-пирроло[2,3-b]пиридин-3-ил)-3,6-дигидропиридин-1(2Н)-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-[4-(1Н-пирроло[2,3-b]пиридин-3-ил)пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
N-(2-метоксиэтил)-N-метил-2-(4-{1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ил}фенокси)ацетамид;
N,N-диметил-2-(4-{1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ил}фенокси)ацетамид;
N-(2-гидроксиэтил)-N-метил-2-(4-{1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ил}фенокси)ацетамид;
N-бутил-N-метил-2-(4-{1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ил}фенокси)ацетамид;
N-(2-метоксиэтил)-N-метил-4-(4-{1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ил}фенокси)бутанамид;
N-(2-гидроксиэтил)-N-метил-4-(4-{1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ил}фенокси)бутанамид;
6-(4-{4-[2-(4-пентаноилпиперазин-1-ил)этокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-[4-(4-{2-[4-(метилсульфонил)пиперазин-1-ил]этокси}фенил)пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-(4-{4-[3-(4-пентаноилпиперазин-1-ил)пропокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-[4-(4-{3-[4-(метилсульфонил)пиперазин-1-ил]пропокси}фенил)пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-(4-{4-[3-(4-ацетилпиперазин-1-ил)пропокси]фенил}пиперазин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-(4-{4-[3-(4-пентаноилпиперазин-1-ил)пропокси]фенил}пиперазин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-[4-(4-{3-[4-(метилсульфонил)пиперазин-1-ил]пропокси}фенил)пиперазин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-(4-{4-[2-(4-ацетилпиперазин-1-ил)этокси]фенил}пиперазин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-(4-{4-[2-(4-пентаноилпиперазин-1-ил)этокси]фенил}пиперазин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-[4-(4-{2-[4-(метилсульфонил)пиперазин-1-ил]этокси}фенил)пиперазин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-{4-[4-(4,4,4-трифторбутокси)фенил]пиперидин-1-ил}-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
4-{4-[2-(1-метил-1Н-пиразол-5-ил)этокси]фенил}-1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ол;
1-метил-4-[2-(4-{1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ил}фенокси)этил]пиперазин-2-она;
6-(4-{4-[2-(1H-имидазол-1-ил)этокси]фенил}пиперазин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-(4-{4-[2-(2-этил-1H-имидазол-1-ил)этокси]фенил}пиперазин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
3-(трифторметил)-6-[4-(4-{2-[3-(трифторметил)-1Н-пиразол-1-ил]этокси}фенил)пиперазин-1-ил]-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-(4-{4-[2-(1Н-имидазол-1-ил)этокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-(4-{4-[2-(2-этил-1H-имидазол-1-ил)этокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-(4-{4-[2-(3,5-диметил-1Н-пиразол-1-ил)этокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
3-(трифторметил)-6-[4-(4-{2-[3-(трифторметил)-1Н-пиразол-1-ил]этокси}фенил)пиперидин-1-ил]-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
4-{4-[2-(4-ацетилпиперазин-1-ил)этокси]фенил}-1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ол;
1-этил-4-[2-(4-{1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ил}фенокси)этил]пиперазин-2-она;
1-циклопропил-4-[2-(4-{1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ил}фенокси)этил]пиперазин-2-она;
6-(4-{4-[2-(4-ацетил-1,4-диазепан-1-ил)этокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
(3R)-1,3-диметил-4-[2-(4-{1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ил}фенокси)этил]пиперазин-2-она;
(3S)-1,3-диметил-4-[2-(4-{1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ил}фенокси)этил]пиперазин-2-она;
6-[4-(4-{2-[(3R)-4-ацетил-3-метилпиперазин-1-ил]этокси}фенил)пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
6-[4-(4-{2-[(3S)-4-ацетил-3-метилпиперазин-1-ил]этокси}фенил)пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
(R)-6-(4-{4-[2-(4-ацетилпиперазин-1-ил)пропокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
(S)-6-(4-{4-[2-(4-ацетилпиперазин-1-ил)пропокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина;
(S)-1-метил-4-[1-метил-2-(4-{1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ил}фенокси)этил]пиперазин-2-она;
(R)-1-метил-4-[1-метил-2-(4-{1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6-ил]пиперидин-4-ил}фенокси)этил]пиперазин-2-она;
и их фармацевтически приемлемых солей.
17. Соединение в соответствии с п.16, которое представляет собой 6-(4-{4-[2-(4-ацетилпиперазин-1-ил)этокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин или его фармацевтически приемлемую соль в кристаллической форме.
18. Соединение в соответствии с п.16 или 17, выбранное из
6-(4-{4-[2-(4-ацетилпиперазин-1-ил)этокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин нападизилата;
6-(4-{4-[2-(4-ацетилпиперазин-1-ил)этокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин дитозилата;
6-(4-{4-[2-(4-ацетилпиперазин-1-ил)этокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин малеата и
6-(4-{4-[2-(4-ацетилпиперазин-1-ил)этокси]фенил}пиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин фумарата.
19. Фармацевтическая композиция, которая содержит соединение в соответствии с любым из пп.1-18 или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым разбавителем или носителем.
20. Соединение в соответствии с любым из пп.1-18 или его фармацевтически приемлемая соль для применения в качестве лекарственного средства.
21. Соединение в соответствии с любым из пп.1-18 или его фармацевтически приемлемая соль для применения для лечения рака предстательной железы.
22. Применение соединения в соответствии с любым из пп.1-18 или его фармацевтически приемлемой соли для приготовления лекарственного средства для применения для лечения рака предстательной железы.
23. Способ получения соединения формулы (I), как определено выше, или его фармацевтически приемлемой соли, где Y в формуле (I) представляет собой N, СН или СОН, который включает восстановление соединения формулы (II)
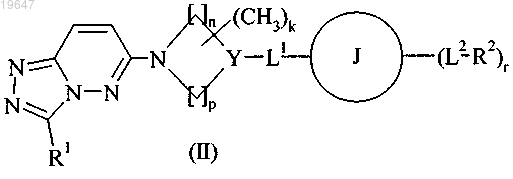
и затем, при необходимости:
(i) превращение соединения формулы (I) в другое соединение формулы (I);
(ii) удаление любых защитных групп;
(iii) разделение рацемической смеси на отдельные энантиомеры;
(iv) приготовление его фармацевтически приемлемой соли.
Текст
ПРОИЗВОДНЫЕ ТРИАЗОЛО[4,3-b]ПИРИДАЗИНА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ Изобретение охватывает бициклические соединения формулы I Брэдбери Роберт Хью, Карр Грегори Ричард, Рейбоу Алфред Артур (GB),Рао-Коруподжу Сриниваза, Тумма Харикришна (IN), R1, R2, L1, L2, J, Y, k, n, p и r имеют значения, указанные в описании. Настоящее изобретение также относится к способам получения таких соединений, фармацевтическим композициям,которые их содержат, и к их применению для лечения состояний, связанных с андрогеновым рецептором, в особенности рака предстательной железы. Изобретение относится к новым бициклическим производным и более предпочтительно к бициклическим производным, которые действуют в качестве лигандов андрогенового рецептора (AR). Настоящее изобретение также относится к способам получения таких бициклических производных, и новым промежуточным соединениям для их получения, к фармацевтическим композициям, которые содержат такие бициклические производные, к применению таких бициклических производных для приготовления лекарственных средств, и к применению таких бициклических производных для лечения состояний, связанных с андрогеновым рецептором, таких как рак предстательной железы. Рак предстательной железы является второй наиболее распространенной причиной смерти от злокачественного новообразования среди мужчин в развитых странах и он составляет около 25% всех диагностированных случаев и 9% смертей от злокачественного новообразования, составляя свыше 27 тыс. смертных случаев в США в 2009 (A. Jemal и др., СА Cancer J Clin, опубликованный онлайн, май 2009 г.). На ранних стадиях рост раковой опухоли предстательной железы зависит от андрогена и, как таковой, хорошо реагирует на гормональные терапии, которые направлены на вызывание истощения уровней андрогена путем хирургической (орхидэктомия) или медицинской кастрации (например, LHRH-агонисты(Zoladex, бусерелин), LHRH антагонисты (цетрореликс), или ингибиторы 5-редуктазы (финастерид. В настоящее время эти лечения часто используют в комбинации с антагонистами андрогена (например,Casodex, ципротерон ацетат, флутамид) для достижения полной блокады андрогена. Индукция антиандрогенной терапии представляет собой основной прогресс в лечении рака предстательной железы, тем не менее, чрезвычайно эффективно поддаваясь лечению на начальных стадиях, у большинства пациентов злокачественное новообразование рецидивирует в течение 2-3 лет. Этот рецидив свидетельствует о переходе злокачественного новообразования в так называемое состояние, резистентное к кастрации, при котором опухоль продолжает расти в присутствии низких концентраций циркулирующего тестостерона. На этой стадии классический антагонист андрогена может быть изначально эффективным, но в конечном итоге злокачественное новообразование продолжает расти, несмотря на полную блокаду андрогена. Резистентный к кастрации рак предстательной железы представляет собой в значительной степени нереализованную потребность в медицине с коэффициентом выживания в течение 5 лет менее чем 15%. В настоящее время единственным лечением является доцетаксал, который проявляет улучшенное выживание, предоставляя преимущество на 2 месяца (О. Smaletz и H.I. Scher, Semin. Urol. Oncol., 2002, 20:155163; D.A. Loblaw и др., J.Clin. Oncol., 2007, 25: 1596-1605). Собранная в настоящее время совокупность доказательств проведенных как клинических, так и доклинических исследований, подтверждают точку зрения, что передача сигналов посредством андрогенового рецептора является важной для большинства резистентных к кастрации раков предстательной железы. Андрогеновый рецептор относится к семейству рецепторов стероидных гормонов, которые функционируют в качестве транскрипционных факторов. Связывание андрогена с андрогеновым рецептором приводит к стабилизации рецептора и защищает его от быстрого протеолитического расщепления. Комплекс андрогена и андрогенового рецептора транспортируется в ядро, где он регулирует экспрессию андроген-реагирующих генов путем связывания с их ДНК элементами андрогенного ответа в промоторном участке таких андроген-реагирующих генов (D.J. Lamb и др. Vitam. Horm. 2001, 62, 199-230). В настоящее время установлено, что большинство резистентных к кастрации опухолей обладают функциональным андрогеновым рецептором, который часто мутирован или амплифицирован. Мутации рецептора возникают приблизительно у 25-30% пациентов, которые получали лечение антагонистами, и могут приводить к промискуитетному рецептору, который распознает антагонисты андрогена в качестве агонистов или он стимулируется другими стероидами, такими как глюкокортикоиды. Амплификация генов и сверхэкспрессия андрогенового рецептора обычно обнаруживатся в резистентных к кастрации злокачественных новообразованиях и приводит к гиперчувствительности к низким уровням андрогенов. Доклинически рецептор часто сверхэкспрессирован на моделях in vitro и in vivo резистентного к кастрации рака предстательной железы. Сверхэкспрессия рецептора может превращать линии, отвечающие на действие гормонов, в линии, нечувствительные к гормонам, и удаление андрогенового рецептора, используя миРНК, предотвращает рост андроген-независимой ксенотрансплантированной модели, данные,которые подтверждают клиническую роль, которую этот рецептор осуществляет в прогрессировании от андроген-зависимого в андроген-резистентное заболевание (B.J. Feldman; D. Feldman., Nat Rev Cancer,2001, 1, 34-45; Chen и др., Curr Opin Pharmacol., 2008, 8, 440-8). Идентификация антиандрогенов, которые должны ингибировать не только природную форму андрогенового рецептора, но также и мутированные формы и таким образом изменять рецепторную молекулу так, чтобы она становилась нестабильной, должно быть чрезвычайно пригодным для лечения опухолей предстательной железы на различных стадиях роста. Такие соединения будут ингибировать рецидив роста опухолей или по меньшей мере удлинять интервал без заболевания. В случае андрогеновых рецепторов были идентифицирован такие лиганды, которые дестабилизируют рецептор и приводят к уменьшению содержания рецептора как в условиях in vitro, так и in vivo (S. Dauvois и др., Proc Natl. Acad. Sci.USA, 1992, 89, 4037-41; R.A. McClelland и др. Eur. J. Cancer, 1996, 32A, 413-416). В случае андрогенового рецептора серии бициклических производных, способных индуцировать клеточную понижающую регуляцию андрогенового рецептора в условиях in vitro, были описаны в WO 2009/081197. Другие серии бициклических производных, способных индуцировать клеточную понижающую регуляцию андрогенового рецептора, описаны в настоящей заявке. В соответствии с первым аспектом настоящего изобретения предложены соединения формулы (I) или их фармацевтически приемлемая соль: где R1 представляет собой галоС 1-4 алкил;n и р независимо представляют собой 1 или 2;Y представляет собой N, С, СН или СОН; представляет собой простую связь, когда Y представляет собой N, СН или СОН; представляет собой двойную связь, когда Y представляет собой С, L1 представляет собой простую связь и J представляет собой индолил или пирролопиридинил;L1 представляет собой простую связь, -(CR3R4)t, -(CR3R4)v-O-(CR3R4)v-, -N(R5)-(CH2)q-, -S-, -S(O)или -S(O)2-;R3 и R4, идентично или различно в каждом случае, представляют собой водород или метил;R5 представляет собой водород или метил;q, идентично или различно в каждом случае, представляет собой 0, 1, 2, 3 или 4;v, идентично или различно в каждом случае, представляет собой 0, 1 или 2;J представляет собой фенил или нафтил; С 3-6 циклоалкил; моноциклическое 4-, 5-, 6- или 7-членное гетероциклическое кольцо, которое содержит 1, 2 или 3 гетероатома, независимо выбранных из О, N или S; 5- или 6-членное моноциклическое гетероарильное кольцо, которое содержит 1, 2, 3 или 4 гетероатома, независимо выбранных из О, N или S; или 9 или 10-членную бициклическую гетероарильную кольцевую систему,которая содержит 1, 2, 3, 4 или 5 гетероатомов, независимо выбранных из О, N или S;L2 представляет собой простую связь, -(CR3R4)t, -C(O)N(R5)-(CH2)q-, -C(O)N(R5)-(CH2)q-S(O)2-,5R9 и R10, идентично или различно в каждом случае, представляют собой водород, метил, этил, изопропил, циклопропил или метоксиметил;R2 представляет собой гало, C1-6 алкил, С 2-6 алкенил, С 2-6 алкинил, карбокси, C1-6 алкокси, циано, оксо,фторС 1-6 алкил, гидрокси, амино, N-С 1-4 алкиламино или N,N-ди-C1-4 алкиламино; фенил или нафтил, где фенильное или нафтильное кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6; моноциклическое 4-, 5-, 6- или 7-членное гетероциклическое кольцо, которое содержит 1, 2 или 3 гетероатома, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6; моноциклическое 5 или 6-членное гетероарильное кольцо, которое содержит 1, 2, 3 или 4 гетероатома, независимо выбранных из О, N или S, и где гетероарильное кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6; или 9- или 10-членную бициклическую гетероарильную кольцевую систему, которая содержит 1, 2, 3, 4 или 5 гетероатомов, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6;R6 представляет собой амино, гало, C1-6 алкил, С 3-6 циклоалкил, С 2-6 алкенил, С 2-6 алкинил, C1-6 алкокси, С 2-6 алканоил, С 1-6 алкоксиС 1-6 алкил, карбокси, циано, оксо, фторС 1-6 алкил, гидрокси, гидроксиС 1-6 алкил, С 1-6 алкилсульфанил, С 1-6 алкилсульфинил, C1-6 алкилсульфонил, оксетан-3-илкарбонил, N-С 1-4 алкиламино, N,N-ди-С 1-4 алкиламино или -C(O)NR7R8, где R7 и R8 независимо представляют собой водород или метил; и r представляет собой 0, 1, 2 или 3. Предпочтительными являются соединения в соответствии с изобретением или их фармацевтически приемлемая соль, где R представляет собой трифторметил. Также предпочтительными являются соединения в соответствии с изобретением или их фармацевтически приемлемая соль, где Y представляет собой N, СН или СОН. Еще одну группу предпочтительных соединений составляют соединения в соответствии с изобретением или их фармацевтически приемлемая соль, где L1 представляет собой простую связь или Предпочтительными являются соединения в соответствии с изобретением или их фармацевтически приемлемая соль, как они определены выше, где J представляет собой фенил, пиридинил, индолил или пирролопиридинил. Предпочтительными являются соединения в соответствии с изобретением или их фармацевтически приемлемая соль, как они определены выше, где L2 представляет собой простую связь, -O-(CR9R10)q- или-O-(CR3R4)q-C(O)NR5-(CH2)q-. Еще более предпочтительными являются соединения в соответствии с изобретением или их фармацевтически приемлемая соль, где J представляет собой фенил, и L2 связан в пара-положении фенильного кольца относительно связывания L1. Еще одну группу предпочтительных соединений составляют соединения в соответствии с изобретением или их фармацевтически приемлемая соль, где R2 представляет собой гало, C1-6 алкил, С 2-6 алкенил, С 2-6 элкинил, карбокси, С 1-6 алкокси, циано, оксо, фторС 1-6 алкил, гидрокси, амино, N-С 1-4 алкиламино или N,N-ди-C1-4 алкиламино; моноциклическое 4-, 5-, 6- или 7-членное гетероциклическое кольцо, которое содержит 1, 2 или 3 гетероатома, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6; или моноциклическое 5- или 6-членное гетероарильное кольцо, которое содержит 1, 2, 3 или 4 гетероатома, независимо выбранных из О, N или S, и где гетероарильное кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6. Еще более предпочтительно, когда в указанных соединениях R2 представляет собой гало, С 1-6 алкил,C1-6 алкокси, циано, фторС 1-6 алкил или гидрокси; моноциклическое 6-членное гетероциклическое кольцо,которое содержит 1 или 2 гетероатома, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6; или моноциклическое 5-членное гетероарильное кольцо, которое содержит 1 или 2 гетероатома, независимо выбранных из О, N или S, и где гетероарильное кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6. Наиболее предпочтительно R2 представляет собой фтор, хлор, метил, метокси, дифторметил, трифторметил, циано или гидрокси; пиперидинил или пиперазинил, где пиперидинильное или пиперазинильное кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6; или пиразолил или имидазолил, где пиразолильное или имидазолильное кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6. Предпочтительными являются соединения в соответствии с изобретением или их фармацевтически приемлемая соль, как они определены выше, где n и р оба представляют собой 2. Также предпочтительными являются соединения в соответствии с изобретением или их фармацевтически приемлемая соль, как они определены выше, где k представляет собой 0. Также предпочтительными являются соединения в соответствии с изобретением или их фармацевтически приемлемая соль, как они определены выше, где r представляет собой 0 или 1. Предпочтительными также являются соединения в соответствии с изобретением или их фармацевтически приемлемая соль, как они определены выше, где R6 представляет собой С 1-6 алкил, С 2-6 алканоил,фторС 1-6 алкил, C1-6 алкилсульфонил или оксо, более предпочтительно где R6 представляет собой метил,этил, ацетил, пентаноил, метилсульфонил или трифторметил. Наиболее предпочтительную группу составляют соединения в соответствии с изобретением, выбранные из 6-[4-(4-фторбензил)пиперазин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина; 6-[4-(1 Н-индол-3-ил)-3,6-дигидропиридин-1(2 Н)-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло(R)-1-метил-4-[1-метил-2-(4-1-[3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин-6 ил]пиперидин-4-илфенокси)этил]пиперазин-2-она; и их фармацевтически приемлемых солей. Наиболее предпочтительным является соединение в соответствии с настоящим изобретением, которое предоставляет собой 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин или его фармацевтически приемлемую соль в кристаллической форме. Особенно предпочтительным является соединение из числа вышеперечисленных, выбранное из 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8 дигидро[1,2,4]триазоло[4,3-b]пиридазин нападизилата; 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8 дигидро[1,2,4]триазоло[4,3-b]пиридазин дитозилата; 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8 дигидро[1,2,4]триазоло[4,3-b]пиридазин малеата и 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8 дигидро[1,2,4]триазоло[4,3-b]пиридазин фумарата. В соответствии с изобретением также предложена фармацевтическая композиция, которая содержит соединение по изобретению, как оно определено выше, или его фармацевтически приемлемую соль,в сочетании с фармацевтически приемлемым разбавителем или носителем. Еще один аспект изобретения составляет соединение по изобретению, как оно определено выше,или его фармацевтически приемлемая соль, для применения в качестве лекарственного средства. Еще один аспект изобретения составляет соединение по изобретению, как оно определено выше,или его фармацевтически приемлемая соль, для применения для лечения рака предстательной железы. Еще один аспект изобретения составляет соединение по изобретению, как оно определено выше,или его фармацевтически приемлемой соли, для приготовления лекарственного средства для применения для лечения рака предстательной железы. Кроме того, согласно изобретению предложен также способ получения соединения формулы (I),как оно определено выше, или его фармацевтически приемлемой соли, где Y в формуле (I) представляет собой N, СН или СОН, который включает восстановление соединения формулы (II)(i) превращение соединения формулы (I) в другое соединение формулы (I);(ii) удаление любых защитных групп;(iii) разделение рацемической смеси на отдельные энантиомеры;(iv) приготовление его фармацевтически приемлемой соли. Подразумевается, что любая подходящая -L2-R2 группа формулы (I) может быть связаны с любым подходящим атомом группы J и что R2 может быть связан с группой J посредством любого подходящего линкера, выбранного из L2. Подразумевается, что поскольку определенные соединения формулы (I), описанные выше, могут существовать в оптически активных или рацемических формах вследствие наличия одного или нескольких асимметрических атомов углерода, то изобретение охватывает любую такую оптическую активную или рацемическую форму, которая обладает вышеуказанной активностью. Синтез оптически активных форм можно осуществлять с помощью стандартных методик органической химии, известных в данной области техники, например, путем синтеза из оптически активных исходных веществ или путем разделения рацемической формы. Аналогичным образом вышеуказанную активность можно оценивать при помощи стандартных лабораторных методик, которые указаны в заявке ниже. Подразумевается, что определенные соединения формулы (I), описанные выше, могут проявлять явление таутомерии. В частности, таутомерия может затрагивать любые гетероциклические группы, которые несут 1 или 2 оксо заместителя. Подразумевается, что настоящее изобретение охватывает любую такую таутомерную форму, или их смесь, которая обладает активностью лиганда андрогенового рецептора и не ограничивается только любой из таутомерных форм, используемых в приведенных структурных формулах или указанных в названиях соединений в примерах. Подразумевается, что определенные соединения формулы (I), описанные выше, могут существовать в несольватированных формах, а также в сольватированных формах, таких как, например, гидратированные формы. Подразумевается, что настоящее изобретение охватывает все такие сольватированные формы, которые обладают активностью лиганда андрогенового рецептора. В одном варианте осуществления изобретения, таким образом, обеспечивается соединение формулы (I) в сольватированной форме. В другом варианте осуществления изобретения, таким образом, обеспечивается соединение формулы (I) в гидратированной форме. Также подразумевается, что определенные соединения формулы (I) могут существовать в кристаллической форме и проявлять полиморфизм. Настоящее изобретение охватывает все такие полиморфные формы, которые обладают активностью лиганда андрогенового рецептора. В одном варианте осуществления изобретения, таким образом, обеспечивается соединение формулы (I), или его фармацевтически приемлемая соль или сольват, в кристаллической форме. Термин "гало" в настоящей заявке используется для обозначения фтора, хлора, брома и йода. Оксогруппа, если связана с атомом углерода, заменяет два атома водорода на атоме углерода исходной системы. Таким образом, если СН 2 группа замещена оксогруппой, то есть с помощью связанного двойной связью атома кислорода, то она превращается в СО группу. Термин "C1-6 алкил" обозначает насыщенную углеродную цепь длиной от 1 до 6 атомов углерода,которая может быть неразветвленной или разветвленной. Тем не менее, ссылка на индивидуальные алкильные группы, такие как "пропил", являются специфическими только для версий с неразветвленной цепью, и ссылки на индивидуальные разветвленные алкильные группы, такие как трет-бутил, являются специфическими только для версий с разветвленной цепью. Например, "С 1-6 алкил" включает, но не ограничиваясь только ими, метил, этил, пропил, изопропил, бутил, трет-бутил, пентил, трет-пентил, гексил и изогексил. Термин "С 1-4 алкил" может толковаться соответствующим образом. Термин "С 2-4 алкенил" обозначает ненасыщенную углеродную цепь длиной от 2 до 4 атомов углерода, которая может быть неразветвленной или разветвленной, которая содержит по меньшей мере одну углерод-углеродную двойную связь. Тем не менее, ссылка на индивидуальные алкенильные группы, такие как "пропенил", являются специфическими только для версий с неразветвленной цепью, и ссылки на индивидуальные разветвленные алкильные группы, такие как изопропенил, являются специфическими только для версий с разветвленной цепью. Например, "С 2-4 алкенил" включает, но не ограничиваясь только ими, этенил, пропенил, изопропенил и бутенил. Термин "С 2-4 алкинил" обозначает ненасыщенную углеродную цепь длиной от 2 до 4 атомов углерода, которая может быть неразветвленной или разветвленной, которая содержит по меньшей мере одну углерод-углеродную тройную связь. Например, "С 2-4 алкинил" включает, но не ограничиваясь только ими, этинил, пропинил и бутинил. Термин "С 3-6 циклоалкил" обозначает насыщенное 3-6-членное моноциклическое углеродное кольцо. Например, "С 3-6 циклоалкил" включает циклопропил, циклобутил, циклопентил и циклогексил. Термин "фторС 1-6 алкил" обозначает насыщенную углеродную цепь длиной от 1 до 6 атомов углерода, которая может быть неразветвленной или разветвленной, где по меньшей мере один из атомов водорода заменен фтором. Например, "фторС 1-6 алкил" включает, но не ограничиваясь только ими, фторметил,фторэтил, фторпропил, фторизопропил, фторбутил, фторизобутил, фтор-трет-бутил, фторпентил, фторизопентил, фторгексил, фторизогексил, трифторметил, пентафторэтил, гептафторпропил, нонафторбутил,-6 019647 ундекафторпентил и тридекафторгексил. Термин "фторС 1-4 алкил" должен толковаться соответствующим образом. Термин "С 1-6 алкокси" обозначает насыщенную углеродную цепь длиной от 1 до 6 атомов углерода,которая может быть неразветвленной или разветвленной, связанную с кислородом. Например, "C1-6 алкокси" включает, но не ограничиваясь только ими, метокси, этокси, пропокси, бутокси, пентокси и гексокси. Термин "С 2-6 алканоил" обозначает насыщенную углеродную цепь длиной от 1 до 5 атомов углерода, которая может быть неразветвленной, разветвленной или циклической, связанную с карбонилом. Например, "С 2-6 алканоил" включает, но не ограничиваясь только ими, ацетил, пропаноил, бутаноил, пентаноил, гексаноил, циклопропилкарбонил и циклобутилкарбонил. Термин "С 1-6 алкоксиС 1-6 алкил" обозначает насыщенную углеродную цепь длиной от 1 до 6 атомов углерода, которая может быть неразветвленной или разветвленной, связанную посредством атома кислорода с другой насыщенной углеродной цепью длиной от 1 до 6 атомов углерода, которая может быть неразветвленной или разветвленной. Например, "С 1-6 алкоксиС 1-6 алкил" включает, но не ограничиваясь только ими, метоксиэтил, метоксипропил, этоксипропил, пропоксиэтил и бутоксипропил. Термин "гидроксиС 1-6 алкил" обозначает насыщенную углеродную цепь длиной от 1 до 6 атомов углерода, которая может быть неразветвленной или разветвленной, где один из атомов водорода заменен гидрокси группой. Например, "гидроксиС 1-6 алкил" включает, но не ограничиваясь только ими, гидроксиметил, гидроксиэтил, 2-гидроксипропил , 3-гидроксипропил, 1-гидроксиизопропил, 4-гидроксибутил,гидроксипентил, гидроксигексил и гидроксиизогексил. Термин "C1-6 алкилсульфанил" обозначает насыщенную углеродную цепь длиной от 1 до 6 атомов углерода, которая может быть неразветвленной или разветвленной, связанную с серой. Например, "C1-6 алкилсульфанил" включает, но не ограничиваясь только ими, метилсульфанил, этилсульфанил, пропилсульфанил, изопропилсульфанил, бутилсульфанил, изобутилсульфанил, трет-бутилсульфанил, пентилсульфанил и гексилсульфанил. Термин "C1-6 алкилсульфинил" обозначает насыщенную углеродную цепь длиной от 1 до 6 атомов углерода, которая может быть неразветвленной или разветвленной, связанную с сульфоксидом. Например, "C1-6 алкилсульфинил" включает, но не ограничиваясь только ими, метилсульфинил, этилсульфинил, пропилсульфинил, изопропилсульфинил, бутилсульфинил, изобутилсульфинил, трет-бутилсульфинил, рэтилсульфинил и гексилсульфинил. Термин "C1-6 алкилсульфонил" обозначает насыщенную углеродную цепь длиной от 1 до 6 атомов углерода, которая может быть неразветвленной или разветвленной, связанную с диоксидом серы. Например, "C1-6 алкилсульфонил" включает, но не ограничиваясь только ими, метилсульфонил, этилсульфонил,пропилсульфонил,изопропилсульфонил,бутилсульфонил,изобутилсульфонил,третбутилсульфонил, пентилсульфонил и гексилсульфонил. Термин "N-С 1-4 алкиламино" обозначает насыщенную углеродную цепь длиной от 1 до 4 атомов углерода, которая может быть неразветвленной или разветвленной, связанную с вторичной амино группой. Например, "N-С 1-4 алкиламино" включает, но не ограничиваясь только ими, метиламино, этиламино, пропиламино и бутиламино. Термин "N,N-ди-С 1-4 алкиламино" обозначает насыщенную углеродную цепь длиной от 1 до 4 атомов углерода, которая может быть неразветвленной или разветвленной, связанную с третичной аминогруппой, которая, в свою очередь, связана с дополнительной насыщенной углеродной цепью аналогичной длины. Например, "N,N-ди-С 1-4 алкиламино" включает, но не ограничиваясь только ими, N,Nдиметиламино, N,N-диэтиламино, N,N-дипропиламино и N,N-дибутиламино. Термин "галоС 1-4 алкил" обозначает насыщенную углеродную цепь длиной от 1 до 4 атомов углерода которая может быть неразветвленной или разветвленной, где по меньшей мере один изатомов водорода заменен атомом галогена. Например, "галоС 1-4 алкил" включает, но не ограничиваясь только ими,дифторметил, трифторметил, хлор(дифтор)метил, дифторэтил и дифторпропил. Если специально не указано иначе, термин "моноциклическое гетероарильное кольцо" обозначает 5- или 6-членное, полностью ненасыщенное и/или ароматическое моноциклическое кольцо, которое содержит 1, 2, 3 или 4 гетероатома, независимо выбранных из азота, кислорода или серы, связанное посредством кольцевых атомов углерода или кольцевых атомов азота, где связь из азота возможна, например, невозможна связь с азотом пиридинового кольца, но возможна связь посредством 1-азота пиразольного кольца. Примеры 5- или 6-членных гетероарильных колец включают, но не ограничиваясь только ими, фуранил, имидазолил, триазолил, тетразолил, пиразинил, пиразолил, пиримидинил, пиридазинил,пиридинил, пирролил, изоксазолил, оксазолил, 1,2,4-оксадиазолил, изотиазолил, тиазолил, тиадиазолил,1,2,4-триазолил и тиофенил. Если специально не указано иначе, термин "бициклическая гетероарильная кольцевая система" обозначает 9- или 10-членную, полностью ненасыщенную и/или ароматическую сопряженную бициклическую кольцевую систему, которая содержит 1, 2, 3, 4 или 5 гетероатомов, независимо выбранных из азота, кислорода или серы, связанную посредством кольцевых атомов углерода или кольцевых атомов азота,где возможна связь из азота, или 9- или 10-членную сопряженную бициклическую кольцевую систему,-7 019647 где только одно из колец полностью насыщенное и/или ароматическое и которая содержит 1, 2, 3, 4 или 5 гетероатомов, независимо выбранных из азота, кислорода или серы. Примеры 5/6 и 6/6 бициклических гетероарильных кольцевых систем включают бензофуранил, бензимидазолил, бензтиофенил, бензтиазолил, бензизотиазолил, бензоксазолил, бензизоксазолил, 1,3-бензодиоксолил, индолил, пиридоимидазолил, пиримидоимидазолил, пирролопиридинил, хинолинил, изохинолинил, хиноксалинил, хиназолинил,фталазинил, циннолинил и нафтиридинил. Это определение дополнительно включает серо-содержащие кольца, где атом серы окислен до S(O) или S(O2) группы. Если специально не указано иначе, термин "гетероциклическое кольцо" обозначает 4-, 5-, 6- или 7-членное полностью насыщенное или частично насыщенное моноциклическое кольцо, которое содержит 1, 2 или 3 гетероатома, выбранных из азота, кислорода или серы, связанное посредством кольцевых атомов углерода или кольцевых атомов азота. Примеры 4-, 5-, 6- или 7-членных гетероциклических колец включают, но не ограничиваясь только ими, азетидинил, тетрагидрофуранил, дигидропиранил, тетрагидропиранил, пирролинил, пирролидинил, тиазолидинил, морфолинил, оксетанил, пиперидинил, пиперазинил, дигидропиридинил, дигидропиримидинил и азепанил. Это определение дополнительно включает серосодержащие кольца, где атом серы окислен доS(O) или S(O2) группы. В дальнейших вариантах осуществления первого аспекта настоящего изобретения, каждое из следующих определений J, Y, L1, L2, R1, R2, R3, R4, R5, R6, R9, R10, n, р, k и r в абзацах (1)-(73) далее в настоящем изобретении может использоваться индивидуально или в комбинации с одним или несколькими другими следующими определениями в пределах наиболее широкого определения формулы (I). Например, для специалиста в данной области техники будет понятным, что абзацы (4), (11), (21), (24) и (35) могут быть объединены для обеспечения соединения формулы (I), или его фармацевтически приемлемой соли, где R1 представляет собой трифторметил, Y представляет собой СН, L1 представляет собой простую связь, J представляет собой фенил и L2 представляет собой -О-(CR9R10)q-. Аналогично, абзацы (4),(11), (21) (31), (35) и (55) могут быть объединены для обеспечения соединения формулы (I), или его фармацевтически приемлемой соли, где R1 представляет собой трифторметил, Y представляет собой СН, L1 представляет собой простую связь, J представляет собой фенил и L2 связан в пара-положении фенильного кольца относительно связывания L1, L2 представляет собой -O-(CR9R10)q- и R2 представляет собой пиперидинил или пиперазинил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из R6.(8) Y представляет собой СН или СОН;(16) n и р оба представляют собой 2;(18) n и р оба представляют собой 1;(19) L1 представляет собой простую связь или -(CR3R4)t;(20) L1 представляет собой простую связь, -СН 2-, -СН(СН 3)-;(21) L1 представляет собой простую связь;(31) J представляет собой фенил, и L связан в пара-положении фенильного кольца относительно связывания L1;(32) L2 представляет собой простую связь;(33) L2 представляет собой простую связь, -O-(CR9R10)q- или -O-(CR3R4)q-C(O)NR5-(CH2)q-;(34) L2 представляет собой простую связь;(45) R3 и R4 оба представляют собой водород;(53) R2 представляет собой моноциклическое 4-, 5-, 6- или 7-членное гетероциклическое кольцо, которое содержит 1, 2 или 3 гетероатома, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6;(54) R2 представляет собой моноциклическое 6-членное гетероциклическое кольцо, которое содержит 1 или 2 гетероатома, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6;(55) R2 представляет собой пиперидинил или пиперазинил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из R6;(58) R2 представляет собой моноциклическое 5- или 6-членное гетероарильное кольцо, которое содержит 1, 2, 3 или 4 гетероатома, независимо выбранных из О, N или S, и где гетероарильное кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6;(59) R2 представляет собой моноциклическое 5-членное гетероарильное кольцо, которое содержит 1 или 2 гетероатома, независимо выбранных из О, N или S, и где гетероарильное кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6;(60) R2 представляет собой пиразолил или имидазолил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из R6;(72) R9 и R10, идентично или различно в каждом случае, представляют собой водород или метил;(73) R9 и R10 оба представляют собой водород. Подходящая фармацевтически приемлемая соль соединения формулы (I) представляет собой, например, соль присоединения кислоты соединения формулы I, например соль присоединения кислоты с неорганической или органической кислотой, такой как соляная, бромистоводородная, серная, трифторуксусная, лимонная, малеиновая, нафталин-1,5-дисульфоновая, толуол-4-сульфоновая или фумаровая кислота; или, например, соль соединения формулы I, которое является достаточно кислотным, например соль щелочного или щелочноземельного металла, такая как соль кальция или магния, или соль аммония,или соль с органическим основанием, таким как метиламин, диметиламин, триметиламин, пиперидин,морфолин или трис-(2-ги дроксиэтил)амин. В одном варианте осуществления изобретения обеспечивается фармацевтически приемлемая соль соединения формулы (I), где соль представляет собой соль присоединения кислоты с органической кислотой, выбранной из малеиновой, нафталин-1,5-дисульфоновой, толуол-4-сульфоновой и фумаровой кислоты. Соединения в соответствии с изобретением могут вводиться в виде пролекарства, представляющего собой соединение, которое распадается в организме человека или животного с высвобождением соединения по изобретению. Пролекарство может применяться для изменения физических свойств и/или фармакокинетических свойств соединения по изобретению. Пролекарство может образовываться, если соединение по изобретению содержит подходящую группу или заместитель, к которой (которому) может присоединяться группа, модифицирующая свойство. Примерами пролекарств являются производные сложных эфиров, способные к расщеплению в условиях in vivo, которые могут образовываться на карбокси группе или гидроксигруппе в соединении формулы I, и производные амидов, способные к расщеплению в условиях in vivo, которые могут образовываться на карбоксигруппе или аминогруппе в соединении формулы I. Таким образом, настоящее изобретение охватывает те соединения формулы I, как определено в настоящем изобретении выше, которые становятся доступными путем органического синтеза или становятся доступными в организме человека или животного при расщеплении их пролекарства. Следовательно, настоящее изобретение охватывает те соединения формулы I, которые образуются с помощью способов органического синтеза, а также те соединения, которые образуются в организме человека или животного при осуществлении метаболизма предшественника соединения, таким образом, соединение формулы I может являться синтетически полученным соединением или метаболически полученным соединением. Подходящим фармацевтически приемлемым пролекарством соединения формулы I является пролекарство, которое, согласно приемлемому медицинскому усмотрению, считается пригодным для введения в организм человека или животного без нежелательных фармакологических активностей и без чрезмерной токсичности. Различные формы пролекарств описаны, например, в следующих документах:h) E. Roche (ред.), "Bioreversible Carriers in Drug Design", Pergamon Press, 1987. Подходящим фармацевтически приемлемым пролекарством соединения формулы (I), содержащим карбоксигруппу, является, например, его сложный эфир, способный к расщеплению в условиях in vivo. Сложный эфир соединения формулы (I), способный к расщеплению в условиях in vivo, содержащий карбоксигруппу, представляет собой, например, фармацевтически приемлемый сложный эфир, который расщепляется в организме человека или животного с образованием исходной кислоты. Подходящие фармацевтически приемлемые сложные эфиры для карбокси включают C1-6 алкиловые сложные эфиры, такие как метил, этил и трет-бутил, С 1-6 алкоксиметиловые сложные эфиры, такие как метоксиметиловые сложные эфиры, C1-6 алканоилоксиметиловые сложные эфиры, такие как пивалоилоксиметиловые сложные эфиры, 3-фталидиловые сложные эфиры, С 3-8 циклоалкилкарбонилокси C1-6 алкиловые сложные эфиры,такие как циклопентилкарбонилоксиметиловый и 1-циклогексилкарбонилоксиэтиловый сложные эфиры,2-оксо-1,3-диоксоленилметиловые сложные эфиры, такие как 5-метил-2-оксо-1,3-диоксолен-4-илметиловые сложные эфиры и C1-6 алкоксикарбонилокси-C1-6 алкиловые сложные эфиры, такие как метоксикарбонилоксиметиловый и 1-метоксикарбонилоксиэтиловый сложные эфиры. Подходящим фармацевтически приемлемым пролекарством соединения формулы (I), содержащим гидрокси группу, является, например, его сложный или простой эфир, способный к расщеплению в условиях in vivo. Сложный или простой эфир соединения формулы (I), способный к расщеплению в условияхin vivo, содержащий гидроксигруппу, представляет собой, например, фармацевтически приемлемый сложный или простой эфир, который расщепляется в организме человека или животного с образованием исходного гидроксисоединения. Подходящими фармацевтически приемлемыми группами, образующими сложный эфир, для гидроксигруппы являются неорганические сложные эфиры, такие как фосфатные сложные эфиры (включая фосфорамидные циклические сложные эфиры). Дальнейшими подходящими фармацевтически приемлемыми группами, образующими сложный эфир, для гидроксигруппы являются С 1-10 алканоильные группы, такие как ацетильная, бензоильная, фенилацетильная и замещенные бензоильная и фенилацетильная группы, С 1-10 алкоксикарбонильные группы, такие как этоксикарбонил, N,N- 10019647[диС 1-4 алкил]карбамоильная, 2-диалкиламиноацетильная и 2-карбоксиацетильная группы. Примерами кольцевых заместителей на фенилацетильной и бензоильной группах являются аминометил, Nалкиламинометил, N,N-диалкиламинометил, морфолинометил, пиперазин-1-илметил и 4-С 1-4 алкилпиперазин-1-илметил. Подходящими фармацевтически приемлемыми группами, образующими простой эфир,для гидроксигруппы являются -ацилоксиалкильные группы, такие как ацетоксиметильная и пивалоилоксиметильная группы. Подходящим фармацевтически приемлемым пролекарством соединения формулы (I), содержащим карбоксигруппу, является, например, его амид, способный к расщеплению в условиях in vivo, например,амид, образованный с амином, такой как аммиак, С 1-4 алкиламин, такой как метиламин, ди-С 1-4 алкиламин,такой как диметиламин, N-этил-N-метиламин или диэтиламин, С 1-4 алкокси-С 2-4 алкиламин, такой как 2 метоксиэтиламин, фенил-С 1-4 алкиламин, такой как бензиламин, и аминокислоты, такие как глицин или их сложный эфир. Подходящим фармацевтически приемлемым пролекарством соединения формулы (I), содержащим аминогруппу, является, например, его производное амида, способное к расщеплению в условиях in vivo. Подходящие фармацевтически приемлемые амиды из аминогруппы включают, например, амид, образованный с С 1-10 алканоильными группами, такими как ацетил, бензоильная, фенилацетильная и замещенные бензоильная и фенилацетильная группы. Примерами кольцевых заместителей на фенилацетильной и бензоильной группах являются аминометил, N-алкиламинометил, N,N-диалкиламинометил, морфолинометил, пиперазин-1-илметил и 4-С 1-4 алкилпиперазин-1-илметил. На действия соединения формулы (I) в условиях in vivo могут оказывать частичные влияния один или несколько метаболитов, которые образуются в организме человека или животного после введения соединения формулы (I). Как указывалось в настоящем изобретении ранее, также на действия соединения формулы (I) в условиях in vivo могут оказывать влияние метаболизм предшественника соединения(пролекарства). В одном варианте осуществления изобретения обеспечивается аморфная форма 6-(4-4-[2-(4 ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3b]пиридазина. Как указано в настоящей заявке выше, определенные соединения формулы (I) могут существовать в кристаллической форме и проявлять полиморфизм. Таким образом, в соответствии с настоящим изобретением обеспечивается кристаллическая форма 6-[4-[4-[3-(4-ацетилпиперазин-1-ил)пропокси]фенил]пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина или его фармацевтически приемлемой соли. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-[4-[4-[3-(4-ацетилпиперазин-1-ил)пропокси]фенил]пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина, форма А, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 4,9, при измерении с использованием CuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-[4-[4-[3-(4-ацетилпиперазин-1-ил)пропокси]фенил]пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина, форма А, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 18,4, при измерении с использованием CuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-[4-[4-[3-(4-ацетилпиперазин-1-ил)пропокси]фенил]пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина, форма А, которая имеет порошковую рентгенограмму по меньшей мере с двумя специфическими пиками при 2 значениях приблизительно 4,9 и 18,4, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-[4-[4-[3-(4-ацетилпиперазин-1-ил)пропокси]фенил]пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина, форма А, которая имеет порошковую рентгенограмму со специфическими пиками при 2 значениях приблизительно 4,9, 6,1, 7,5, 12,2, 13,5, 16,6, 18,4, 19,8, 20,0 и 24,6, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-[4-[4-[3-(4-ацетилпиперазин-1-ил)пропокси]фенил]пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина, форма А, которая имеет порошковую рентгенограмму, по существу,такую же, что и порошковая рентгенограмма, представленная на фиг. А, при измерении с использованием CuKa излучения. Как указано в настоящей заявке выше, определенные соединения формулы (I) могут существовать в сольватированной форме. Таким образом, в соответствии с настоящим изобретением обеспечивается сольватированная форма 6-[4-[4-[3-(4-ацетилпиперазин-1-ил)пропокси]фенил]пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-[4-[4-[3-(4-ацетилпиперазин-1-ил)пропокси]фенил]пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина, форма А этилацетат сольват, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 4,1, при измерении с использованием CuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,52. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-[4-[4-[3-(4-ацетилпиперазин-1-ил)пропокси]фенил]пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина, форма А этилацетат сольват, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 20,5, при измерении с использованием CuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-[4-[4-[3-(4-ацетилпиперазин-1-ил)пропокси]фенил]пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина, форма А этилацетат сольват, которая имеет порошковую рентгенограмму по меньшей мере с двумя специфическими пиками при 2 значениях приблизительно 4,1 и 20,5, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-[4-[4-[3-(4-ацетилпиперазин-1-ил)пропокси]фенил]пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина, форма А этилацетат сольват, которая имеет порошковую рентгенограмму со специфическими пиками при 2 значениях приблизительно 4,1, 8,2, 12,1, 16,7, 17,8, 18,2, 18,7,19,0, 20,5 и 24,6, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-[4-[4-[3-(4-ацетилпиперазин-1-ил)пропокси]фенил]пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина, форма А этилацетат сольват, которая имеет порошковую рентгенограмму, по существу такую же, что и порошковая рентгенограмма, представленная на фиг. В, при измерении с использованием CuKa излучения. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина, форма А, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 4,7, при измерении с использованиемCuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина, форма А, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 9,5, при измерении с использованиемCuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина, форма А, которая имеет порошковую рентгенограмму по меньшей мере с двумя специфическими пиками при 2 значениях приблизительно 4,7 и 9,5, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина, форма А, которая имеет порошковую рентгенограмму со специфическими пиками при 2 значениях приблизительно 4,7, 9,5, 12,0, 14,3, 17,4, 18,8, 19,0, 21,7, 22,5 и 22,7, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина, форма А, которая имеет порошковую рентгенограмму, по существу такую же, что и порошковая рентгенограмма, представленная на фиг. С, при измерении с использованием CuKa излучения. Как указано в настоящей заявке выше, определенные соединения формулы (I) могут существовать в сольватированной форме, например гидратированной форме. Таким образом, в соответствии с настоящим изобретением обеспечивается гидратированная форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси] фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина, форма А гидрат, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 17,8, при измерении с использованием CuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина, форма А гидрат, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 8,9, при измерении с использованием CuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина, форма А гидрат, которая имеет порошковую рентгенограмму по меньшей мере с двумя специфическими пиками при 2 значениях приблизительно 17,8 и 8,9, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина, форма А гидрат, которая имеет порошковую рентгенограмму со специфическими пиками при 2 значениях приблизительно 4,8, 8,9, 15,5, 17,8, 19,0, 19,7, 21,6, 22,0, 22,3 и 23,9, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина, форма А гидрат, которая имеет порошковую рентгенограмму, по существу такую же, что и порошковая рентгенограмма, представленная на фиг. D, при измерении с использованием CuKa излучения. Как указано в настоящей заявке выше, определенные соединения формулы (I) может образовывать соли присоединения кислот. В одном варианте осуществления настоящего изобретения, обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина нападизилат, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 19,8, при измерении с использованием CuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина нападизилат, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 19,4, при измерении с использованиемCuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина нападизилат, которая имеет порошковую рентгенограмму по меньшей мере с двумя специфическими пиками при 2 значениях приблизительно 19,8 и 19,4, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения, обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазинанападизилат, которая имеет порошковую рентгенограмму со специфическими пиками при 2 значениях приблизительно 8,7, 9,4, 11,9, 13,8, 18,9, 19,4, 19,8, 20,3, 21,3 и 22,4, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина нападизилат, которая имеет порошковую рентгенограмму, по существу такую же, что и порошковая рентгенограмма, представленная на фиг. К, при измерении с использованием CuKa излучения. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазинадитозилат, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 23,1, при измерении с использованиемCuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина дитозилат, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 17,5, при измерении с использованиемCuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина дитозилат, которая имеет порошковую рентгенограмму по меньшей мере с двумя специфическими пиками при 2 значениях приблизительно 23,1 и 17,5, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина дитозилат, которая имеет порошковую рентгенограмму со специфическими пиками при 2 значениях приблизительно 6,5, 12,8, 13,6, 14,9,17,5, 20,1, 21,9, 22,1, 23,1 и 23,5, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина дитозилат, которая имеет порошковую рентгенограмму, по существу, такую же, что и порошковая рентгенограмма, представленная на фиг. М, при измерении с использованиемCuKa излучения. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазинамалеат, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 20,3, при измерении с использованием CuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина малеат, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 22,0, при измерении с использованиемCuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина малеат, которая имеет порошковую рентгенограмму по меньшей мере с двумя специфическими пиками при 2 значениях приблизительно 20,3 и 22,0, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазинамалеат, которая имеет порошковую рентгенограмму со специфическими пиками при 2 значениях приблизительно 11,9, 13,5, 16,8, 19,4, 19,6, 20,3, 22, 24,9, 26,5 и 27,2, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазинамалеат, которая имеет порошковую рентгенограмму, по существу такую же,что и порошковая рентгенограмма, представленная на фиг. О, при измерении с использованием CuKa излучения. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазинафумарат, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 20,4, при измерении с использованиемCuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина фумарат, которая имеет порошковую рентгенограмму по меньшей мере с одним специфическим пиком при 2 значении приблизительно 21,1, при измерении с использованиемCuKa излучения, более предпочтительно, где указанное значение может быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина фумарат, которая имеет порошковую рентгенограмму по меньшей мере с двумя специфическими пиками при 2 значениях приблизительно 20,4 и 21,1, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина фумарат, которая имеет порошковую рентгенограмму со специфическими пиками при 2 значениях приблизительно 9,4, 15,2, 17,9, 18,5, 19,9, 20,4, 21,1, 21,9, 23,7 и 24,3, при измерении с использованием CuKa излучения, более предпочтительно, где указанные значения могут быть плюс или минус 0,5 2. В одном варианте осуществления настоящего изобретения обеспечивается кристаллическая форма 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазина фумарат, которая имеет порошковую рентгенограмму, по существу такую же,что и порошковая рентгенограмма, представленная на фиг. Q, при измерении с использованием CuKa излучения. Если указано, что настоящее изобретение относится к кристаллической форме, степень кристалличности обычно составляет больше, чем приблизительно 60%, более подходяще, больше чем приблизительно 80%, предпочтительно больше чем приблизительно 90% и более предпочтительно больше чем приблизительно 95%. Наиболее предпочтительно степень кристалличности составляет больше, чем приблизительно 98%. Следует принять во внимание, что значения 2 порошковой рентгенограммы могут незначительно отличаться при измерении на разных приборах и при анализе разных образцов, таким образом, значения,указанные в скобках, не должны рассматриваться как абсолютные. В данной области техники известно, что может быть получена порошковая рентгенограмма, которая содержит одно или несколько погрешностей измерений, которые зависят от условий измерения (таких как используемое оборудование, приготовление образца или прибор). В частности, хорошо известно,что напряжение при порошковой рентгенограмме может отличаться в зависимости от условий измерения и приготовления образцов. Например, специалисты в области порошковой рентгенограммы могут подтвердить, что относительные интенсивности пиков могут отличаться в соответствии с ориентацией тестируемого образца и в зависимости от типа и настроек используемого прибора. Специалист в данной области также будет учитывать тот факт, что на положение отражений может влиять точная высота, на которую устанавливается образец в дифрактометре и калибровка нуля дифрактометра. Плоскостность поверхности образца также может иметь незначительное влияние. Следовательно, специалист в данной области техники примет во внимание, что данные порошковой рентгенограммы, приведенные в настоящем изобретении, не должны толковаться как абсолютные и любая кристаллическая форма, которая обеспечивает порошковую рентгенограмму, идентичную представленным в настоящем изобретении, охватывается объемом настоящего изобретения (для дополнительной информации см. Jenkins, RSnyder,R.L. 'Introduction to X-Ray Powder Diffractometry' John WileySons, 1996). В целом погрешность измерения угла дифракции на порошковой рентгенограмме для угла 2-тета составляет приблизительно плюс или минус 0,5 2-тета, и такой порядок погрешности измерения следует учитывать при анализе порошковых рентгенограмм на фиг. А, В, С, D, I, K, М, О и Q и при анализе таблиц А, В, С, D, Е, F, G, Н и I. Кроме того, следует принять во внимание, что интенсивности могут колебаться в зависимости от экспериментальных условий и приготовления образца (предпочтительная ориентация). Предпочтительная ориентация происходит, если имеет место тенденция для морфологии кристалла (форма) проявлять предпочтительную ориентацию, такую как игольчатая (иглообразная), что приводит к неслучайной ориентации кристаллов при установке образцов для анализа XRPD (порошковой рентгеновской дифракции). Это может приводить к различиям в относительной интенсивности пиков. Получение соединений формулы (I) Соединения формулы (I) или их фармацевтически приемлемая соль могут быть получены различными способами, включая следующие способы (а), (b), (с), (d), (e) или (f) где, если специально не указано иначе, переменные величины имеют значения, как определено выше для соединений формулы (I):(b) когда Y в формуле (I) представляет собой СН и L1 представляет собой простую связь, восстановление соединения формулы (III)(с) когда Y в формуле (I) представляет собой N и L1 представляет собой -(СН 2)t-, взаимодействие соединения формулы (IV) с соединением формулы (V) или(d) когда Y в формуле (I) представляет собой С,представляет собой двойную связь,L1 представляет собой простую связь и J представляет собой индолил или пирролопиридинил, взаимодействие соединения формулы (VI) с соединением формулы (VII), где X представляет собой СН или(е) когда R2 представляет собой моноциклическое 4-, 5-, 6- или 7-членное гетероциклическое кольцо, которое содержит 1 атом N и необязательно содержит 1 или 2 дополнительных гетероатома, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6, L2 представляет собой простую связь, -(CR3R4)t-, -C(O)N(R5)-(CH2)q-,-NR5C(O)-(CH2)q-, -C(O)-(CH2)q-, -O-(CR9R10)q-, -O-(CR3R4)q-NR5-(CH2)q- или -O-(CR3R4)q-C(O)NR5(CH2)q-, иq представляет собой 2, 3 или 4, взаимодействие соединения формулы (XVIII) с моноциклическим 4-, 5-, 6- или 7-членным гетероциклическим кольцом, которое содержит 1 атом N и необязательно содержит 1 или 2 дополнительных гетероатома, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6:(f) когда R2 представляет собой моноциклическое 4-, 5-, 6- или 7-членное гетероциклическое кольцо, которое содержит 1 атом N и необязательно содержит 1 или 2 дополнительных гетероатома, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6;q представляет собой 2, 3, или 4; где в конечном случае -CR9R10- представляет собой -CHR9a-; и где R9a представляет собой метил, этил, изопропил, циклопропил или метоксиметил; взаимодействие соединения соединения формулы (XIX) с моноциклическим 4-, 5-, 6- или 7 членным гетероциклическим кольцом, которое содержит 1 атом N и необязательно содержит 1 или 2 дополнительных гетероатома, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6:(i) превращение соединения формулы (I) в другое соединение формулы (I);(ii) удаление любых защитных групп;(iii) разделение рацемической смеси на отдельные энантиомеры;(iv) приготовление его фармацевтически приемлемой соли; и/или(v) приготовление его кристаллической формы. Специфическими условиями реакций для способов (а)-(f), описанных выше, являются следующие условия.Cпособы (а) и (b) - соединения формулы (II) и (III) можно восстанавливать в присутствии подходящего катализатора на основе металла, например палладия на угле, формиат аммония и подходящего растворителя, например этанола, путем нагревания до подходящей температуры, например от 50 до 100 С,более подходяще приблизительно 78 С. Способ (с) - соединения формулы (IV) можно подвергать реакции с соединениями формулы (V) в присутствии подходящего восстановителя, например цианоборогидрида (полистирилметил)триметиламмония, подходящего растворителя, например дихлорметана, подходящей кислоты, например, уксусной кислоты, и при подходящей температуре, например от 0 до 50 С, более подходяще приблизительно при комнатной температуре. Способ (d) - соединения формулы (VI) можно подвергать реакции с соединениями формулы (VII) в присутствии основания, например, гидроксида калия, подходящего растворителя, например метанола, и при подходящей температуре, например 5, от 0 до 100 С, более подходяще приблизительно 65 С. Способ (е) - соединения формулы (XVIII) можно подвергать реакции с моноциклическим 4-, 5-, 6 или 7-членным гетероциклическим кольцом, которое содержит 1 атом N и необязательно содержит 1 или 2 дополнительных гетероатома, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6 в присутствии основания, например DIPEA, подходящего растворителя, например ДМФА, и при подходящей температуре, например от 0 до 100 С, более подходяще приблизительно 20 С. Способ (f) - соединения формулы (XIX) можно подвергать реакции с моноциклическим 4-, 5-, 6 или 7-членным гетероциклическим кольцом, которое содержит 1 атом N и необязательно содержит 1 или 2 дополнительных гетероатома, независимо выбранных из О, N или S, и где гетероциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, выбранными из R6 в присутствии подходящей кислоты, например уксусной кислоты, подходящего восстановителя, например триацетоксиборогидрида натрия, подходящего катализатора, например MgSO4, подходящего растворителя, например ТГФ, и при подходящей температуре, например от 0 до 50 С, более подходяще приблизительно при комнатной температуре. Способ получения соединений формулы (I) может включать превращение соединения формулы (I) в другое соединение формулы (I), используя стандартные химические реакции, хорошо известные специалистам в данной области техники, для получения другого соединения в соответствии с изобретением. Аналогичным образом способ получения предшественника соединений формулы (II) может включать превращение соединения формулы (II) в другое соединение формулы (II). Химические превращения этого типа хорошо известны специалистам в данной области техники и могут включать взаимные превращения функциональных групп, такие гидролиз, гидрирование, гидрогенолиз, окисление или восстановление, и/или дальнейшую функционализацию путем стандартных реакций, таких как катализируемое амидом или металлом, или реакций нуклеофильного вытеснения. Примеры таких превращений описаны,например, в Comprehensive Organic Chemistry, том 2, с. 3, D. Barton и D. Ollis ред., Pergamon, 1979, Comprehensive Functional Group Transformations, A.R. Katritzky, O. Meth-Cohn, и C.W. Rees ред, Pergamon,1995, и различными авторами в Houben-Weyl, Methods of Organic Chemistry, Verlag Chemie, разные годы,и ссылки, представленные в этих источниках. Способ приготовления соединений формулы (I) в форме отдельного энантиомера может включать разделение рацемического соединения в соответствии с изобретением на отдельные энантиомеры. Примеры подходящих методов разделения энантиомеров рацемического соединения хорошо известны специалистам в данной области техники и включают хроматографию, используя хиральную неподвижную фазу; или превращение рацемической смеси в диастереомерные производные, разделение смеси диастереомерных производных на два отдельных диастереомера, и регенерацию разделенного отдельного энантиомера из каждого разделенного отдельного диастереомера; или селективную химическую реакцию одного из энантиомеров рацемического соединения (кинетическое разделение), используя диастереоселективную реакцию, катализируемую микробиологическим средством или ферментом. Альтернативно соединения в соответствии с изобретением в форме отдельного энантиомера могут быть приготовлены, используя хиральные исходные вещества, для использования в одном из процессов,описанных в предыдущих разделах. Для специалиста в данной области техники будет понятным, что может быть необходимым/желательным защищать любые чувствительные группы в соединениях в некоторых процессах/реакциях, описанных в настоящей заявке. Примеры, когда такая защита является необходимой или желательной, и подходящие методы для осуществления такой защиты известны специалистам в данной области техники. Можно использовать общепринятые защитные группы в соответствии со стандартной практикой (дляSons, 2002). Таким образом, если реагирующие вещества включают такие группы, как амино, карбокси или гидрокси, то может являться желательным защитить эту группу в некоторых реакциях, описанных в настоящей заявке. Любые защитные группы, используемые в способах, описанных в настоящей заявке, можно в целом выбирать из любых групп, описанных в литературе или известных специалисту в области химии как подходящие для защиты данной группы, и они могут быть введены с помощью общепринятых методов. Защитные группы могут быть удалены с помощью любого пригодного способа, как описано в литературе, или известного специалисту в области химии как подходящий для удаления данной защитной группы, такие методы выбирают таким образом, чтобы осуществить удаление защитной группы с минимальным повреждением групп где-нибудь в другом месте молекулы. Защитные группы могут быть удалены на любой подходящей стадии при синтезе, используя общепринятые техники, хорошо известные в области химии. Предшественники соединений формулы (II) могут быть приготовлены путем взаимодействия соединения формулы (VIII), где G представляет собой подходящую уходящую группу, такую как галоген,например, хлор, с соединением формулы (IX), где все другие переменные имеют значения, как указано в настоящей заявке выше, для соединений формулы (I), если специально не указано иначе:(i) превращение соединения формулы (II) в другое соединение формулы (II);(ii) удаление любых защитных групп и/или(iii) разделение рацемической смеси на отдельные энантиомеры. Вышеописанную реакцию можно осуществлять путем объединения соединений формул (VIII) и(IX) в подходящем растворителе, например диметилформамиде или диметилацетамиде, при подходящей температуре, например, в интервале от 25 до 250 С, более предпочтительно в интервале от 50 до 150 С, в присутствии подходящего основания, например диизопропилэтиламина. Предшественники соединения формулы (III) и (VI) могут быть приготовлены в соответствии со схемой 1 ниже, где G представляет собой подходящую уходящую группу, такую как галоген, например хлор, и все другие переменные имеют значения, как указано в настоящей заявке выше, для соединений формулы (I). Схема 1 Предшественники соединений формулы (IV) могут быть приготовлены в соответствии со схемой 2 ниже, где G представляет собой подходящую уходящую группу, такую как галоген, например, хлор, Р 1 представляет собой подходящую защитную группу, например, N-трет-бутоксикарбонил, и все другие переменные имеют значения, как указано в настоящей заявке выше, для соединений формулы (I). Схема 2 Соединения формулы (XVIII), где L2 представляет собой простую связь, -(CR3R4)t, -C(O)N(R5)(CH2)q-, -NR5C(O)-(CH2)q-, -C(O)-(CH2)q-, -O-(CR9R10)q-, -O-(CR3R4)q-NR5-(CH2)q-, или -O-(CR3R4)qC(O)NR5-(CH2)q- и q представляет собой 2, 3 или 4, могут быть получения путем взаимодействия соединения формулы (XX) с раствором метансульфонил хлорида в подходящем растворителе, например ДХМ, в присутствии подходящего основания, например триэтиламина, и при подходящей температуре, например 0 С в атмосфере азота. Соединения формулы (XIX), где L2 представляет собой -O-(CR9R10)q-, q представляет собой 2, 3,или 4, в конечном случае -CR9R10- представляет собой -CHR9a-и R9a представляет собой метил, этил, изопропил, циклопропил или метоксиметил, могут быть приготовлены путем взаимодействия соединения формулы (XX) с соединением формулы Cl-(CR9R10)q-1-C(=O)R9a в подходящем растворителе, напримерDMA, в присутствии подходящего основания, например карбоната калия, и при подходящей температуре, например от 50 до 150 С, более предпочтительно приблизительно 100 С. Соединения формулы (VIII) могут быть получены с помощью методов, хорошо известных специалисту в данной области, включая методы в соответствии с или аналогичные методам, описанным в химической литературе, например, как описано в W.L. Mosby, Heterocyclic Compounds, том 15 часть 1 и часть 2, Systems with Bridgehead Humpogen, Interscience, 1961; R.N. Castle, Heterocyclic Compounds, том 27, Condensed Pyridazines, Wiley, 1973; и Heterocyclic Chemistry, том 35, Condensed Pyrazines, G.W.H.Cheeseman и R.F. Cookson, Wiley, 1979 и ссылках, приведенных в этих источниках. В частности соединения формулы (VIII), где G представляет собой хлор и R1 представляет собой трифторметил, могут быть получены, как описано в Monatsh. Chem. (1972) 103(6), 1591-603. Соединения формул (V), (IX), (XIV) и (XX) могут быть получены с помощью методов, хорошо известных специалисту в данной области, включая методы в соответствии с или аналогичные методам,описанным в химической литературе, например, J.R. Malpass, Aliphatic and Cyclic Amines в Comprehensive Organic Chemistry, том 2, с. 3, D. Barton и D. Ollis ред., Pergamon, 1979, J. M. J.Gladych и D. Hartley,Poly functional Amines в Comprehensive Organic Chemistry, том 2, с. 61, D. Barton и D. Ollis ред., Pergamon,1979; Houben-Weyl Methods of Organic Chemistry, том Е 23 и Cyclic Compounds I (1999) том Е 23 и CyclicCompounds VI(2000) и ссылках, приведенных в этих источниках и модифицированы, в случае необходимости, путем трансформации функциональных групп, хорошо известных специалистам в данной области техники, включая методы в соответствии с или аналогичные методам, описанным в химической литературе, например, Comprehensive Functional Group Transformations, A.R. Katritzky, O. Meth-Cohn, и C.W.Rees ред., Pergamon, 1995, и ссылках, приведенных в этих источниках. Соединения формул (V) и (IX) также могут быть получены с помощью методов в соответствии с или аналогичных методам, описанным в настоящей заявке для приготовления примеров, представленных в настоящем изобретении. Соединения формул (VII), (X) и (XV) доступны из коммерческих источников или могут быть получены с помощью методов, хорошо известных специалисту в данной области, включая методы в соответствии с или аналогичные методам, описанным в химической литературе. 1.1.1. Биологические исследования. Способность соединений уменьшать количество андрогеновых рецепторов (AR) оценивали в кле- 19019647 точном иммунофлуоресцентном исследовании, используя клеточную линию эпителия предстательной железы LNCaP. а) Клеточное исследование понижающей регуляции LNCaP андрогенового рецептора. В этом иммунофлуоресцентом исследовании конечной точки оценивали способность тестируемого соединения понижающе регулировать и уменьшать измеряемые уровни AR в клеточной линии карциномы предстательной железы LNCaP (LNCaP клон FGC (CRL-1740), полученной из Американской коллекции типовых культур (АТСС.(FBS в 5% СО 2 воздушном инкубаторе при 37 С. Клетки для анализа собирали из Т 175 маточных колб путем однократного промывания в PBS (фосфатно-солевом буферном растворе, рН 7,4)кода Invitrogen 14190-094) и собирали, используя 5 мл 1 трипсина/этиламиндиаминтетрауксусной кислоты (EDTA)(10 трипсина-EDTA, 5,0 г/л трипсина, 2,0 г/л EDTA4Na и 8,5 г/л NaCl, без фенолового красного, ( кода Invitrogen 15400-054), разведенный в PBS растворе. В каждую колбу добавляли 5 мл объема ростовой среды (как описано выше, за исключением того, что 5% (об./об.) очищенного на активированном угле FBS ( кода HyClone SH30068.03) включали вместо 10% (об./об.) FBS). Клетки вводили посредством шприца по меньшей мере дважды, используя стерильную 18G1,5" (1,240 мм) иглу с указанным наружным диаметром и плотность клеток измеряли, используя счетную камеру. Клетки дополнительно разводили с помощью ростовой среды плюс 5% (об./об.) очищенного на активированном угле FBS и высевали при плотности 6,510 клеток на лунку (в 90 мкл) в прозрачные, черные обработанные планшеты для культивирования тканей на 96 лунок (Packard,6005182). Тестируемые данные, представленные в настоящей заявке, получали с помощью двух различных приготовлений соединений и способов дозирования. В способе (1)10 мМ маточного раствора соединения в 100% (об./об.) ДМСО серийно разводили в 4-кратных стадиях в 100% (об./об.) ДМСО, используя Thermo Scientific Matrix SerialMate. После этого разведенные соединения дополнительно разводили 1 к 30 в среде для исследования, используя Thermo Scientific Matrix PlateMate, и аликвоту 10 мкл этого разведения дозировали в клетки вручную, используя многоканальную пипетку. В способе (2), используя в качестве исходного 10 мМ маточный раствор соединения, Labcyte Echo 550 использовали для получения набора концентраций соединения, установленных на определенный ответ, в 30 мкл среды для исследования. Echo 550 представляет собой жидкостное манипулирующее устройство, в котором используют акустическую технологию для осуществления прямых переносов с микропланшета на микропланшет ДМСО-растворов соединений. Систему можно запрограммировать для переноса настолько малых объемов, чтобы обеспечить кратность увеличения 2,5 нл между микропланшетами и тем самым получить серийные разведения соединений, которые затем обратно заполняли для нормализации ДМСОконцентрации в диапазоне разведения. После этого объем 10 мкл разведенного соединения дозировали в клетки, используя Thermo Scientific Matrix PlateMate. Планшеты инкубировали в течение ночи при 37 С, 5% СО 2. Затем лунки дозировали с соединением,приготовленным в соответствии с одним из 2 способов, описанных выше, и дополнительно инкубировали в течение 20-22 ч при 37 С, 5% СО 2. Планшеты фиксировали путем добавления 20 мл 10% (об./об.) раствора формальдегида (в PBS) в каждую лунку (конечная концентрация формальдегида = 1,67%(об./об. и оставляли при комнатной температуре в течение 10 мин. Этот фиксирующий раствор удаляли и клетки промывали с помощью 250 мкл PBS/0,05% (об./об.) Твин 20 (PBST), используя автоматизированный промыватель планшет. Затем этот процесс повторяли еще два раза. Иммуноокрашивание осуществляли при комнатной температуре. Клетки пермеализировали путем добавления 35 мл PBS, содержащего 0,5% Твин 20 и инкубировали в течение 1 ч при комнатной температуре. Пермеализирующий раствор удаляли и клетки промывали с помощью 250 мкл PBST, используя автоматизированный промыватель планшет. Затем этот процесс повторяли еще два раза. В каждую лунку добавляли 35 мл блокирующего раствора (PBSTK), содержащего 3% (мас./об.) сухого обезжиренного молока Marvel (Nestle и планшеты инкубировали при комнатной температуре минимально в течение 1 ч. После удаления блокирующего раствора с помощью промывателя планшет, в каждую лунку добавляли 35 мкл мышиного античеловеческого AR моноклонального антитела (клон AR441) (иммуноген - синтетический пептид, соответствующий аминокислотам 229-315 AR человека, связанный с гемоцианином лимфы улитки, DAKO,кода М 3562), разведенном 1:500 в блокирующем растворе, и инкубировали в течение 1 ч. Затем этот раствор первичного антитела удаляли из лунок после этого промывали с помощью 3100 мкл PBST, используя промыватель планшет. Затем в каждую лунку добавляли 35 мкл AlexaFluor 488 козьего антимышиного IgG вторичного антитела (Invitrogen,кода А-11001), разведенного 1:500 в блокирующем растворе. В последующем, при любых возможных обстоятельствах, планшеты защищали от воздействия света. Планшеты инкубировали в течение 1 ч и затем раствор вторичного анти- 20019647 тела удаляли из лунок, после этого промывая с помощью 3100 мкл PBST, используя промыватель планшет. Затем в каждую лунку добавляли 50 мкл PBST и планшеты покрывали с помощью черной герметизирующей прокладки и хранили при 4 С перед анализом. Планшеты анализировали в течение шести часов после завершения иммуноокрашивания. Зеленый флуоресцентный AR-ассоциированный сигнал в каждой лунке измеряли, используя Acumen Explorer HTS Reader (TTP Labtech Ltd., Cambridge). Эмиссия AR-ассоциированной флуоресценции может быть определена при 530 нм после возбуждения при 488 нм. Прибор представляет собой флуоресцентный цитометр для анализа микропланшет с лазерным сканированием, который отбирает пробы из лунок через регулярные интервалы и использует пороговые алгоритмы для идентификации всех интенсивностей флуоресценции выше фона раствора без необходимости генерации и анализа изображения. Эти флуоресцирующие объекты могут быть определены количественно и обеспечивать характеристику уровня AR в клетках. Данные значений флуоресценции в зависимости от дозы, полученные для каждого соединения, обрабатывали с помощью подходящего программного обеспечения (такого как Origin) для осуществления анализа подгонки кривых. Понижающие регуляцию уровни AR выражали в виде IC50 значения. Его определяли путем расчета концентрации соединения, которая необходима для получения 50% уменьшения AR сигнала. В нижеприведенной таблице представлены биологические данные для соединений согласно настоящему изобретению, используя вышеописанный анализ понижающей регуляции.b) Исследование конкурентного связывания андрогеновый рецептор-лигандсвязывающий домен. Способность соединений связываться с выделенным лигандсвязывающим доменом андрогенового рецептора (AR-LBD) оценивали в конкурентных анализах, используя обнаружение конечной точки путем флуоресцентной поляризации (FP). Для FP тест, тестовый набор для анализа получали от Invitrogen и использовали для измерения связывания соединения с выделенным крысиным AR-LBD, который имеет последовательность, идентичную на 100% к последовательности AR-LBD человека. Invitrogen PolarScreen Androgen Receptor CompetitorAssay Red ( кода продукта PV4293) представляет собой конкурентный анализ на основе флуоресцентной поляризации (FP), который измеряет, может ли тестируемое соединение вытеснять флуоресцентно меченный индикатор. Если тестируемое соединение связывается с AR-LBD, то это предотвращает образование комплекса рецептор/меченный индикатор, что будет приводить к более низкому значению поляризации. Если тестируемое соединение не связывается с рецептором, то это не будет оказывать влияния на образование комплекса рецептор/меченный индикатор, и измеренное значение поляризации меченного индикатора будет оставаться высоким. Исследование осуществляли, как описано ниже, и все реагенты добавляли с помощью Thermo Scientific Matrix PlateMate. 1. Акустически дозировали 120 нл тестируемого соединения в черные низкообъемные планшеты для анализа на 384 лунки. 2. Добавляли реагенты в объемах, необходимых для получения следующих конечных концентраций исследуемых компонентов : - 0,5 мМ DTT, 2 нМ флуормон, 12 нМ AR-LBD в буфере для исследованияInvitrogen. 3. Дозировали 15 мл смеси для анализа в каждую лунку планшета для анализа. 4. Анализируемый планшет покрывали для защиты реагентов от воздействия света и испарения, и инкубировали при комнатной температуре в течение 4-6 ч. 5. Возбуждали при 530 нМ и измеряли сигнал эмиссии флуоресценции каждой лунки при 590 нм вFP режиме, используя BMG PheraSTAR или другой подходящий планшет-ридер. Соединения дозировали непосредственно из микропланшета с исходным соединением, содержащим серийные разведения соединения (4 лунки, содержащие 10 мМ, 0,1 мМ, 1 мкМ и 10 нМ конечного соеди- 22019647 нения соответственно) в микропланшет для анализа, используя Labcyte Echo 550. Echo 550 представляет собой жидкостное манипулирующее устройство, в котором используют акустическую технологию для осуществления прямых переносов с микропланшета на микропланшет ДМСО-растворов соединений и систему можно запрограммировать для переноса множественных небольших нл объемов соединений из различных лунок первоначальных планшет, чтобы получить желательные серийные разведения соединений при исследовании, которые затем обратно заполняли для нормализации ДМСО-концентрации в диапазоне разведения. В целом в каждую лунку добавляли 120 нл соединения плюс ДМСО и соединения тестировали в 12-точечном формате ответа в зависимости от концентрации в конечном интервале концентрации соединения 100, 30, 10, 3, 1, 0,3, 0,1, 0,03, 0,01, 0,003, 0,001, 0,0001 мкМ соответственно. Данные FP дозозависимого ответа, полученные для каждого соединения, обрабатывали с помощью подходящего программного обеспечения (такого как Origin) для осуществления анализа подгонки кривых. Конкурентное AR связывание может быть выражено в виде IC50 значения. Его определяли путем расчета концентрации соединения, которая необходима для получения уменьшения на 50% связывания меченного индикатора с AR-LBD. В нижеприведенной таблице представлены биологические данные для определенных соединений согласно настоящему изобретению, используя вышеописанный анализ конкурентного связывания лиганд-связывающего домена андрогенового рецептора. Фармацевтические композиции и способы лечения, включающие соединения формулы (I) В соответствии с дальнейшим аспектом изобретения обеспечивается фармацевтическая композиция, которая содержит соединение формулы (I), или его фармацевтически приемлемую соль, как описано в настоящей заявке выше, в сочетании с фармацевтически приемлемым разбавителем или носителем. Композиция может находиться в форме, подходящей для перорального введения, например, в виде таблетки или капсулы; для парентеральной инъекции (включая внутривенное, подкожное, внутримышечное,внутрисосудистое или инфузию) в виде стерильного раствора, суспензии или эмульсии; для местного введения в виде мази или крема; или для ректального введения в виде суппозитория. Например, композиция, пригодная для доклинического in vivo внутривенного введения, включает 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин, приготовленный в виде раствора в 20/20/60 DMA/PEG400/HPCD (диметил/ацетамид/полиэтилен гликоль 400/гидроксипропилциклодекстрин) (20% мас./об.) в очищенной воде при концентрации вплоть до 50 мг/мл, соответствующей 96,23 мкмоль/мл. Альтернативно, композиция, пригодная для перорального введения, содержит 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин, приготовленный в виде раствора в 20% мас./об. SBECD (сульфобутиловый простой эфир - Р-циклодекстрина) в очищенной воде, доведенный до рН 4 при концентрации в диапазоне от 0,1 до 28 мг/мл исходного соединения, соответствующей от 0,19 до 53,89 мкмоль/мл. Для перорального введения в клинической практике соединение в соответствии с изобретением предпочтительно будет вводиться в таблетированной форме. Например, соединение в соответствии с изобретением может смешиваться с адъювантом или носителем, например, лактозой, сахарозой, сорбитом, маннитом; крахмалом, например картофельным крахмалом, кукурузным крахмалом или амилопектином; производным целлюлозы; связующим, например, желатином или поливинилпирролидоном; и/или смазывающим веществом, например стеаратом магния, стеаратом кальция, полиэтиленгликолем, воском,парафином и другими, и затем спрессовываться в таблетки. Если требуется оболочка таблетки, то ядра,приготовленные, как описано выше, могут быть покрыты с помощью концентрированного сахарного раствора, который может содержать, например, гуммиарабик, желатин, тальк и диоксид титана. Альтернативно, таблетка может быть покрыта оболочкой из подходящего полимера, растворенного в быстро испаряющемся органическом растворителе. Для приготовления мягких желатиновых капсул соединение в соответствии с изобретением может смешиваться с, например, растительным маслом или полиэтиленгликолем. Твердые желатиновые капсулы могут содержать гранулы соединения, используя любой из вышеуказанных наполнителей для таблеток. Также жидкие или полутвердые препараты соединений в соответствии с изобретением можно заполнять в твердые желатиновые капсулы. Жидкие препараты для перорального введения могут находиться в форме сиропов или суспензий,например растворов, содержащих соединение в соответствии с изобретением, сбалансированных путем добавления сахара, и смеси этанола, воды, глицерина и пропиленгликоля. Необязательно такие жидкие препараты могут содержать красители, ароматизаторы, сахарин и/или карбоксиметилцеллюлозу в качестве загустителя, или другие наполнители, известные специалисту в данной области техники. Соединение формулы (I) обычно будет вводиться теплокровному животному в стандартной дозе в диапазоне 5-5000 мг/м 2 площади тела животного, то есть приблизительно 0,1-100 мг/кг, и это обычно обеспечивает терапевтически эффективную дозу. Стандартная дозированная форма, такая как таблетка или капсула, обычно содержит, например, 1-250 мг активного компонента. Предпочтительно суточная доза используется в диапазоне 1-50 мг/кг. Тем не менее, суточная доза обязательно будет изменяться в зависимости от хозяина, подвергаемого лечению, конкретного пути введения, и тяжести заболевания,подвергаемого лечению. Следовательно, оптимальная дозировка может быть определена лечащим врачом, который лечит любого конкретного пациента. Например, 6-[4-[4-[3-(4-ацетилпиперазин-1 ил)пропокси]фенил]пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин может вводиться пациенту человеку в дозе от 75 до 3000 мг BID (два раза в сутки), более предпочтительно приблизительно 280 мг BID, и 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин может вводиться пациенту человеку в дозе от 30 до 240 мг BID, более предпочтительно приблизительно 60 мг BID, или от 65 до 730 мг UID (один раз в сутки), более предпочтительно приблизительно 145 мг UID. Предполагаемые дозы 6-[4-[4-[3-(4 ацетилпиперазин-1-ил)пропокси]фенил]пиперидин-1-ил]-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина и 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина для человека рассчитываются для стандартного человека весом 70 кг и BID дозы представлены на дозу (то есть, половина общей суточной дозы). Дальнейшую информацию относительно путей введения и схем дозирования можно найти в разделе 25.3 в томе 5 Comprehensive Medicinal Chemistry (Corwin Hansch; председатель редакционной коллегии), Pergamon Press 1990. Нами было обнаружено, что соединения, определенные в настоящем изобретении, являются эффективными модуляторами андрогенового рецептора. Таким образом, полагают, что соединения в соответствии с настоящим изобретением являются потенциально полезными средствами для лечения заболеваний или медицинских состояний, опосредованных только или частично андрогеновым рецептором. Соединения в соответствии с изобретением индуцируют понижающую регуляцию андрогенового рецептора и/или могут быть селективными агонистами, частичными агонистами, антагонистами или частичными антагонистами андрогенового рецептора. Соединения в соответствии с изобретением могут быть полезными для лечения состояний, связанных с андрогеновым рецептором. "Состояние, связанное с андрогеновым рецептором," как используется в настоящей заявке, обозначает состояние или нарушение, которое можно лечить путем модуляции функции или активности андрогенового рецептора у субъекта, где лечение включает предотвращение,частичное облегчение или лечение состояния или нарушения. Модуляция может происходить местно,например, в пределах определенной ткани субъекта, или более экстенсивно во всем организме субъекта,подвергаемого лечению для такого состояния или нарушения. Таким образом, обеспечивается соединение формулы (I), или его фармацевтически приемлемая соль, для применения в качестве лекарственного средства. В одном варианте осуществления соединения в соответствии с настоящим изобретением могут вводиться животным, например людям, для лечения различных состояний и нарушений, включая, но не ограничиваясь только ими, лечение заболеваний, чувствительных к андрогену, или нарушений, прогрессирование или начало которых опосредуется путем активации андрогенового рецептора или модуляторов андрогенового рецептора. Примеры конкретных заболеваний или нарушений, чувствительных к андрогену, включают, но не ограничиваясь только ими, андроген-чувствительные злокачественные новообразования, такие как рак предстательной железы и другие злокачественные новообразования, состоящие из злокачественных опухолевых клеток, содержащих андрогеновый рецептор, такие как злокачественные новообразования молочной железы, головного мозга, кожи, яичников, мочевого пузыря, лимфатической системы, печени и почек; злокачественные новообразования кожи, поджелудочной железы, эндометрия,легких и ободочной кишки; остеосаркома; злокачественная гиперкальциемия; метастатическое заболевание костей; и нарушения, чувствительные к андрогенам, такие как доброкачественная гиперплазия предстательной железы и гипертрофия предстательной железы, акне (юношеские угри), себорея, гирсутизм(гипертрихоз), андрогенная аллопеция и мужское облысение, преждевременное половое созревание, эндометриоз, синдром поликистозных яичников, лечение сперматогенеза, контрактующей преэклампсии,эклампсии беременных и преждевременных родов, лечение предменструального синдрома, лечение сухости влагалища, полового извращения, маскулинизации, и других. Соединения в соответствии с изобретением также можно использовать для улучшения овуляции у домашних животных. В другом варианте осуществления соединения в соответствии с настоящим изобретением могут вводиться животным, например людям, для лечения различных состояний и нарушений, включая, но не ограничиваясь только ими, поддержание мышечной силы и функционирования (например, у пожилых людей); реверсия или предотвращение слабости или возрастного функционального ухудшения здоровья("ARFD") у пожилых людей (например, саркопения); лечение катаболических побочных эффектов глюкокортикоидов; предотвращение и/или лечение снижения массы, плотности или роста костей (например,остеопороз и остеопения); лечение синдрома хронической усталости (CFS); хронической миалгии; лечение синдрома острой усталости и мышечной потери с последующей элективной хирургией (например,послехирургическая реабилитация); усиление заживления ран; усиление восстановление переломов костей (таких как усиление восстановления пациентов с переломом шейки бедра); усиление заживления осложненных переломов, например, дистракционного остеогенеза; при замене суставов; предотвращение послехирургических адгезионных образований; усиление восстановления или роста зубов; поддержание сенсорной функции (например, слуха, зрения, обоняния и вкуса); лечение парадонтоза; лечение атрофии после переломов и атрофии, связанной с хроническим обструктивным заболеванием легких (COPD),хронического заболевания печени, СПИДа, невесомости, кахексии при злокачественном новообразовании, восстановления после ожога и травмы, хронического катаболического состояния (например, комы),нарушений питания (например, анорексии) и химиотерапии; лечение кардиомиопатии; лечение тромбоцитопении; лечение замедление роста, связанного с болезнью Крона; лечение синдрома укороченной тонкой кишки; лечение синдрома раздраженной толстой кишки; лечение воспалительного заболевания кишечника; лечение болезни Крона и язвенного колита; лечение осложнений, связанных с трансплантацией; лечение физиологической низкорослости, включая недостаточность соматотропного гормона у детей и низкорослости, связанной с хроническим заболеванием; лечение ожирения и замедление роста,связанного с ожирением; лечение анорексии (например, связанной с кахексией или старением); лечение повышенного уровня кортизона и синдрома Кушинга; болезни Педжета; лечение остеоартрита; индукция пульсирующего высвобождения гормона роста; лечение остеохондродисплазии; лечение депрессии, повышенной возбудимости, раздражительности и стресса; лечение уменьшенной психической энергии и заниженной самооценки (например, мотивации/чрезмерной настойчивости); улучшение когнитивной функции (например, лечение деменции, включая болезнь Альцгеймера и потерю кратковременной памяти); лечение катаболизма в связи с легочной дисфункцией и вентиляционной зависимостью; лечение дисфункции сердца (например, связанной с заболеванием клапанов, инфаркта миокарда, кардиальной гипертрофии или застойной сердечной недостаточности); снижения кровяного давления; защиты относительно дисфункции желудочка-24 или предотвращение реперфузионных явлений; лечение взрослых при хроническом диализе; реверсия или замедление катаболического состояния старения; истощения или реверсии протеиновой катаболической ответной реакции после травмы (например, реверсии катаболического состояния, связанного с хирургией, застойной сердечной недостаточности, сердечной миопатии,ожогов, злокачественного новообразования, COPD и др.); уменьшение кахексии и потери белка вследствие хронических заболеваний, таких как злокачественное новообразование или СПИД; лечение гиперинсулинемии, включая гиперплазию панкреатических островков; лечение пациентов с иммуносупрессией; лечение атрофии, связанной с рассеянным склерозом или другими нейродегенеративными заболеваниями; стимуляция репарации миелина; поддержание толщины кожи; лечение метаболического гомеостаза и почечного гомеостаза (например, у ослабленных пожилых лиц); стимуляция остеобластов, ремоделирования костей и роста хрящей; регуляция потребления пищи; лечение резистентности к инсулину, включая NIDDM, у млекопитающих (например, у людей; лечение резистентности к инсулину в сердце; улучшение качества и коррекции относительного гипосоматотрофизма в старческом возрасте вследствие значительного повышения REM фазы сна и снижения латентного периода REM фазы сна; лечение гипотермии; лечение застойной сердечной недостаточности; лечение липодистрофии (например, у пациентов,принимающих лечение при ВИЧ или СПИДе, такое как ингибиторы протеазы); лечение мышечной атрофии (например, вследствие физической неактивности, постельного режима или уменьшенных состояний весовой нагрузки); лечение скелетно-мышечных поражений (например, у пожилых людей); улучшение суммарной легочной функции; лечение нарушений сна; и лечение катаболического состояния пролонгированного критического заболевания;возрастные снижения уровней тестостерона у мужчин, менопаузы у мужчин, гипогонадизма, гормональной заместительной терапии у мужчин, расстройств половой функции у мужчин и женщин (например, эректильной дисфункции, снижения полового влечения, полового хорошего самочувствия, снижения либидо), недержания мочи, контрацепции у мужчин и женщин, выпадения волос, и улучшение функционирования/силы костей и мышц. Термин лечение также охватывает профилактическое лечение. Дополнительно, состояния, заболевания и расстройства обобщенно собраны под названием "Синдром X" или Метаболический синдром, как подробно описано в Johannsson J. Clin. Endocrinol. Metab., 82,727-34 (1997), можно лечить путем применения соединений в соответствии с изобретением. В одном варианте осуществления состояния, связанные с рецептором андрогена, включают рак предстательной железы, доброкачественную гиперплазию предстательной железы и гипертрофию предстательной железы, акне (юношеские угри), себорею, гирсутизм (гипертрихоз), андрогенную аллопецию и мужское облысение, преждевременное половое созревание, синдром поликистозных яичников, половое извращение, маскулинизацию и другие. Соединения в соответствии с изобретением также могут использоваться для улучшения овуляции у домашних животных. Таким образом, в настоящем изобретении раскрыт способ лечения любого из вышеуказанных со- 25019647 стояний, связанных с андрогеновым рецептором, у теплокровного животного, такого как человек, нуждающегося в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, как описано в настоящей заявке выше. В настоящем изобретении раскрыто также применение соединения формулы (I), или его фармацевтически приемлемой соли, как определено в настоящей заявке выше, для приготовления лекарственного средства для лечения любого из вышеуказанных состояний, связанных с андрогеновым рецептором. В настоящем изобретении ракрыто соединение формулы (I) или его фармацевтически приемлемая соль или пролекарство, как описано в настоящей заявке выше, для применения для лечения любого из вышеуказанных состояний, связанных с андрогеновым рецептором. В настоящем изобретении раскрыто соединение формулы (I) или его фармацевтически приемлемая соль, как описано в настоящей заявке выше, для применения в способе лечения животного организма,такого как человеческий организм, путем терапии. В изобретении также раскрыто применение соединения формулы (I) или его фармацевтически приемлемой соли или пролекарства, как описано в настоящей заявке выше, для приготовления лекарственного средства для применения для получения антиандрогенного эффекта у теплокровного животного,такого как человек. В изобретении раскрыт способ получения антиандрогенного эффекта у теплокровного животного,такого как человек, нуждающегося в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано в настоящей заявке выше. Термин "антиандрогенный эффект" используется в настоящем изобретении для обозначения ингибирования и/или понижающей регуляции андрогеновых рецепторов. В изобретении раскрыто соединение формулы (I) или его фармацевтически приемлемая соль, как описано в настоящей заявке выше, для приготовления лекарственного средства для применения для получения антипролиферативного клеточного эффекта у теплокровного животного, такого как человек. В изобретении раскрыт способ получения антипролиферативного клеточного эффекта у теплокровного животного, такого как человек, нуждающегося в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано в настоящей заявке выше. Раскрыт также способ лечения андроген-чувствительных злокачественных новообразований у теплокровного животного, такого как человек, нуждающегося в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано в настоящей заявке выше. Далее раскрыто соединение формулы (I) или его фармацевтически приемлемая соль, как описано в настоящей заявке выше, для применения для лечения андроген-чувствительных злокачественных новообразований. В настоящем изобретении соответственно также раскрыто применение соединения формулы (I) или его фармацевтически приемлемой соли, как описано в настоящей заявке выше, для приготовления лекарственного средства для применения для лечения андроген-чувствительных злокачественных новообразований. В частности, в изобретении раскрыт способ лечения рака предстательной железы у теплокровного животного, такого как человек, нуждающегося в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано в настоящей заявке выше. В одном варианте осуществления этого способа рак предстательной железы является гормоно-резистентным. В изобретении предложено соединение формулы (I) или его фармацевтически приемлемая соль, как описано в настоящей заявке выше, для применения для лечения рака предстательной железы, более предпочтительно гормонорезистетного рака предстательной железы. В соответствии с еще одним аспектом изобретения предложено применение соединения формулы(I) или его фармацевтически приемлемой соли, как описано в настоящей заявке выше, для приготовления лекарственного средства для применения для лечения рака предстательной железы, более предпочтительно гормонорезистетного рака предстательной железы. Гормонорезистетный рак предстательной железы (HRPC) развивается, когда рак предстательной железы прогрессирует в гормоно-независимую и резистентную к кастрации стадию заболевания. В изобретении также раскрыт способ лечения любого из следующих состояний: доброкачественная гиперплазия предстательной железы, гипертрофия предстательной железы, акне (юношеские угри), себорея, гирсутизм (гипертрихоз), андрогенная аллопеция и мужское облысение, преждевременное половое созревания, синдром поликистозных яичников, половое извращение, или маскулинизация; у теплокровного животного, такого как человек, нуждающегося в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано в настоящей заявке выше. В изобретении также раскрыто соединение формулы (I) или его фармацевтически приемлемая соль,как описано в настоящей заявке выше, для применения для лечения любого из следующих состояний: доброкачественная гиперплазия предстательной железы, гипертрофия предстательной железы, акне(юношеские угри), себорея, гирсутизм (гипертрихоз), андрогенная аллопеция и мужское облысение,преждевременное половое созревания синдром поликистозных яичников, половое извращение, или маскулинизация. В настоящем изобретении дополнительно раскрыто применение соединения формулы (I), или его фармацевтически приемлемой соли, как описано в настоящей заявке выше, для приготовления лекарственного средства для применения для лечения любого из следующих состояний: доброкачественная гиперплазия предстательной железы, гипертрофия предстательной железы, акне (юношеские угри), себорея, гирсутизм (гипертрихоз), андрогенная аллопеция и мужское облысение, преждевременное половое созревания, синдром поликистозных яичников, половое извращение или маскулинизация. Как было указано выше, размер дозы, необходимый для терапевтического или профилактического лечения конкретного заболевания, связанного с пролиферацией клеток, обязательно будет изменяться в зависимости от хозяина, подвергаемого лечению, пути введения и тяжести заболевания, подвергаемого лечению. Применяется единичная доза в интервале, например, 1-100 мг/кг, предпочтительно 1-50 мг/кг. Соединения формулы (I), определенные в настоящей заявке выше, могут применяться в виде одиночной терапии или можно применять, дополнительно к соединению в соответствии с изобретением,общепринятую хирургию или лучевую терапию или химиотерапию. Такая химиотерапия может включать одну или несколько следующих категорий противоопухолевых средств:(i) антипролиферативные/противоопухолевые лекарственные средства и их сочетания, которые применяются в онкологии, такие как алкилирующие средства (например, цис-платин, оксалиплатин, карбоплатин, циклофосфамид, азотный иприт, мельфалан, хлорамбуцил, бусульфан, темозоламид и нитрозомочевины); антиметаболиты (например, гемцитабин и антифолаты, такие как фторпиримидины, такие как 5-фторурацил и тегафур, ралтитрексед, метотрексат, арабинозид цитозина, и гидроксимочевина); противоопухолевые антибиотики (например, антрациклины, такие как адриамицин, блеомицин, доксорубицин, дауномицин, эпирубицин, идарубицин, митомицин-С, дактиномицин и митрамицин); антимитотические средства (например, алкалоиды барвинка, такие как винкристин, винбластин, виндезин и винорелбин и таксоиды, такие как таксол и таксотер, и ингибиторы polo-киназы); и ингибиторы топоизомеразы (например, эпиподофиллотоксины, такие этопозид и тенипозид, амсакрин, топотекан и камфотецин);(ii) цитостатические средства, такие как антиэстрогены (например, тамоксифен, фульвестрант, торемифен, ралоксифен, дролоксифен и йодоксифен), LHRH антагонисты или LHRH агонисты (например,гозерелин, лейпрорелин и бусерелин), прогестогены (например, мегестролацетат), ингибиторы ароматазы (например, такие как анастрозол, летрозол, воразол и эксеместан), ингибиторы 5-редуктазы, такие как финастерид, и ингибиторы синтеза андрогена, такие как те, которые ингибируют фермент 17-гидроксилаза (например, абиратерон);(AZD0530; международная патентная заявка WO 01/94341), N-(2-хлор-6-метилфенил)-2-6-[4-(2 гидроксиэтил)пиперазин-1-ил]-2-метилпиримидин-4-иламинотиазол-5-карбоксамид (дазатиниб, BMS354825; J. Med. Chem., 2004, 47, 6658-6661), ботузиниб (SKI-606), и ингибиторы металлопротеиназы, такие как маримастат, ингибиторы функции рецептора урокиназного активатора плазминогена или антитела к гепараназе];(iv) ингибиторы действия фактора роста: например, такие ингибиторы включают антитела к фактору роста и антитела к рецептору фактора роста (например, анти erbB2 антитело трастузумаб[Herceptin], анти-EGFR антитело панитумумаб, анти erbBl антитело цетуксимаб [Erbitux, C225] и любые антитела к фактору роста или антитела к рецептору фактора роста, описанные Stern и др. Critical reviews in oncology/haematology, 2005, том 54, cc. 11-29); такие ингибиторы также включают ингибиторы тирозинкиназы, например, ингибиторы семейства фактора роста эпидермиса (например, ингибиторы тирозинкиназы семейства EGFR, такие как N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолинопропокси) хиназолин-4-амин (гефетиниб, ZD1839), N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амин(эрлотиниб, OSI774) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3-морфолинопропокси)хиназолин-4 амин (CI1033), ингибиторы erbB2 тирозинкиназы, такие как лапатиниб), ингибиторы семейства фактора роста гепатоцитов; ингибиторы семейства инсулинового фактора роста; ингибиторы семейства фактора роста производных тромбоцитов, такие как иматиниб и/или нилотиниб (AMN107); ингибиторы серин/ треонин киназ (например, ингибиторы Ras/Raf пути передачи сигналов, такие как ингибиторы фарнезилтрансферазы, например, сорафениб (BAY 43-9006), типифарниб (Rl 15777) и лонафарниб (SCH66336,ингибиторы клеточной передачи сигналов посредством МЕК и/или АКТ киназ, ингибиторы c-kit, ингибиторы abl киназы, ингибиторы PI3 киназы, ингибиторы Plt3 киназы, ингибиторы CSF-1R киназы, ингибиторы киназы IGF рецептора (инсулин-подобного фактора роста); ингибиторы аурора киназы (например, AZD1152, РН 739358, VX-680, MLN8054, R763, МР 235, МР 529, VX-528 и AX39459) и ингибиторы циклин-зависимых киназ, такие как ингибиторы CDK2 и/или CDK4;(v) антиангиогенные средства, такие как те, которые ингибируют действие фактора роста эндотелия сосудов, [например, антитело к фактору роста клеток эндотелия сосудов бевацизумаб (Avastin) и например, ингибитор тирозинкиназы рецептора VEGF, такой как вандетаниб (ZD6474), ваталаниб(РТК 787), сунитиниб (SU11248), акситиниб (AG-013736), пазопаниб (GW 786034) и 4-(4-фтор-2 метилиндол-5-илокси)-6-метокси-7-(3-пирролидин-1-илпропокси)хиназолин (AZD2171; пример 240 в заявке WO 00/47212), соединения, такие как описаны в международных патентных заявках WO9 7/22596,WO 97/30035, WO 97/32856 и WO 98/13354, и соединения, которые действуют по другому механизму(например, линомид, ингибиторы действия интегрина v3 и ангиостатина)];(vi) вещества, которые повреждают сосуды, такие как комбрестатин А 4, и соединения, описанные в международных патентных заявках WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и WO 02/08213; (vii) антагонист рецептора эндотелина, например, зиботентан (ZD4054) или атрасентан;(viii) антисмысловая терапия, например, такая, которая направлена на мишени, перечисленные выше, такие как ISIS 2503, антисмысловая терапия на основе гена ras;(ix) способы генной терапии, включая, например, способы замены аберрантных генов, такие как способы аберрации р 53 или аберрации BRCA1 или BRCA2, GDEPT (пролекарственная терапия, направленная на ген фермента), способы с использованием деаминазы цитозина, тимидинкиназы или бактериальной нитроредуктазы и способы повышения устойчивости пациента к химиотерапии или радиотерапии, такие как генная терапия резистентности ко многим лекарственным средствам; и(х) способы иммунотерапии, включая, например, способы повышения иммуногенности опухолевых клеток пациента в условиях ex vivo и in vivo, такие как трансфекция цитокинами, такими как интерлейкин 2, интерлейкин 4 или фактор стимуляции колоний гранулоцитов-макрофагов, способы снижения активности Т-клеток, способы с использованием трансфектированных иммунных клеток, таких как цитокин-трансфектированные дендритные клетки,способы с использованием цитокинтрансфектированных линий опухолевых клеток и способы с использованием антиидиотипичных антител. Соответственно, в настоящем изобретении раскрыта комбинация, пригодная для применения для лечения рака предстательной железы, в частности HRPC, содержащая соединение формулы I, как описано в настоящей заявке выше, например, 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1 ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин или его фармацевтически приемлемую соль, и ингибитор синтеза андрогена (например, абиратерон); антагонист рецептора эндотелина (например, зиботентан (ZD4054) или атрасентан); илиLHRH агонист (например, гозерелин, лейпрорелин или бусерелин). Таким образом, в изобретении дополнительно раскрыто соединение формулы I, как описано в настоящей заявке выше, например, 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин или его фармацевтически приемлемая соль,в комбинации с ингибитором синтеза андрогена (например, абиратерон); антагонистом рецептора эндотелина (например, зиботентан (ZD4054) или атрасентан); илиLHRH агонистом (например, гозерелин, лейпрорелин или бусерелин). В частности, раскрыто соединение формулы I, как описано в настоящей заявке выше, например 6(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазин или его фармацевтически приемлемая соль, в комбинации с ингибитором синтеза андрогена. Подходящим ингибитором синтеза андрогена является, например, абиратерон. В частности, раскрыто соединение формулы I, как описано в настоящей заявке выше, например, 6(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазин или его фармацевтически приемлемая соль, в комбинации с антагонистом рецептора эндотелина. Подходящим антагонистом рецептора эндотелина является, например, зиботентан(ZD4054) или атрасентан. Кроме того, раскрыто соединение формулы I, как описано в настоящей заявке выше, например, 6(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4] триазоло[4,3-b]пиридазин или его фармацевтически приемлемая соль, в комбинации с LHRH агонистом. Подходящим LHRH агонистом является, например, гозерелин, лейпрорелин или бусерелин. В настоящей заявке, где используется термин "комбинация", то подразумевается, что он относится к одновременному, раздельному или последовательному введению. В одном аспекте изобретения, "комбинация" относится к одновременному введению. В другом аспекте изобретения, "комбинация" относится к раздельному введению. В дальнейшем аспекте изобретения, "комбинация" относится к последовательному введению. Если введение является последовательным или раздельным, то задержка при введении второго компонента должна быть такой, чтобы не потерять благоприятного эффекта комбинации. В настоящем изобретении дополнительно раскрыта фармацевтическая композиция, которая содержит соединение формулы I, как описано в настоящей заявке выше, например, 6-(4-4-[2-(4-ацетилпи- 28019647 перазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин или его фармацевтически приемлемая соль, в комбинации с ингибитором синтеза андрогена (например, абиратерон); антагонистом рецептора эндотелина (например, зиботентан (ZD4054) или атрасентан); илиLHRH агонистом (например, гозерелин, лейпрорелин или бусерелин), и в сочетании с фармацевтически приемлемым разбавителем или носителем. В настоящем изобретении дополнительно раскрывается фармацевтическая композиция, которая содержит соединение формулы I, как описано в настоящей заявке выше, например, 6-(4-4-[2-(4 ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3b]пиридазин или его фармацевтически приемлемая соль, в комбинации с ингибитором синтеза андрогена(например, абиратерон); антагонистом рецептора эндотелина (например, зиботентан (ZD4054) или атрасентан); илиLHRH агонистом (например, гозерелин, лейпрорелин или бусерелин); и в сочетании с фармацевтически приемлемым разбавителем или носителем для применения для лечения рака предстательной железы, в частности HRPC. В настоящем изобретении также раскрыто применение соединения формулы I, как описано в настоящей заявке выше, например, 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина или его фармацевтически приемлемой соли, в комбинации с ингибитором синтеза андрогена (например, абиратерон); антагонистом рецептора эндотелина (например, зиботентан (ZD4054) или атрасентан); илиLHRH агонистом (например, гозерелин, лейпрорелин или бусерелин); для приготовления лекарственного средства для применения для лечения рака предстательной железы, в частности HRPC, у теплокровного животного, такого как человек. В настоящем изобретении далее раскрыто соединение формулы I, как описано в настоящей заявке выше, например, 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин или его фармацевтически приемлемая соль, в комбинации с ингибитором синтеза андрогена (например, абиратерон); антагонистом рецептора эндотелина (например,зиботентан (ZD4054) или атрасентан); илиLHRH агонистом (например, гозерелин, лейпрорелин или бусерелин); для применения для лечения рака предстательной железы, в частности HRPC, у теплокровного животного, такого как человек. Таким образом, в изобретении также раскрыт способ лечения рака предстательной железы, в частности HRPC, у теплокровного животного, такого как человек, нуждающегося в таком лечении, который включает введение указанному животному эффективного количества соединения формулы I, как описано в настоящей заявке выше, например, 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1 ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазина или его фармацевтически приемлемой соли, в комбинации с ингибитором синтеза андрогена (например, абиратерон); антагонистом рецептора эндотелина (например, зиботентан (ZD4054) или атрасентан); илиLHRH агонистом (например, гозерелин, лейпрорелин или бусерелин). В настоящем изобретении дополнительно раскрыт также набор, содержащий соединение формулыI, как описано в настоящей заявке выше, например, 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси] фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин или его фармацевтически приемлемую соль, в комбинации с ингибитором синтеза андрогена (например, абиратерон); антагонистом рецептора эндотелина (например, зиботентан (ZD4054) или атрасентан); илиa) соединение формулы I, как описано в настоящей заявке выше, например, 6-(4-4-[2-(4-ацетилпиперазин-1-ил)этокси]фенилпиперидин-1-ил)-3-(трифторметил)-7,8-дигидро[1,2,4]триазоло[4,3-b]пиридазин или его фармацевтически приемлемую соль, в первой единичной дозированной форме;b) ингибитор синтеза андрогена (например, абиратерон), антагонист рецептора эндотелина (например, зиботентан (ZD4054) или атрасентан) или LHRH агонист (например, гозерелин, лейпрорелин или бусерелин); во второй единичной дозированной форме; иc) контейнер, предназначенный для содержания указанных первой и второй дозированных форм. Примеры Далее изобретение иллюстрируется со ссылкой на последующие примеры, в которых, в целом:(i) температуры представлены в градусах Цельсия (С); если специально не указано иначе, операции осуществляли при комнатной температуре или температуре окружающей среды, то есть при температуре в диапазоне от 18 до 25 С;(ii) органические растворы высушивали над безводным сульфатом магния или безводным сульфатом натрия; упаривание растворителя осуществляли, используя роторный испарители при пониженном давлении (от 600 до 4000 Па; от 4,5 до 30 мм рт. ст.) при температуре бани вплоть до 60 С;
МПК / Метки
МПК: C07D 487/04, A61K 31/519, A61P 35/00
Метки: лечения, производные, железы, предстательной, рака, применение, триазоло[4,3-b]пиридазина
Код ссылки
<a href="https://eas.patents.su/30-19647-proizvodnye-triazolo43-bpiridazina-i-ih-primenenie-dlya-lecheniya-raka-predstatelnojj-zhelezy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные триазоло[4,3-b]пиридазина и их применение для лечения рака предстательной железы</a>
Предыдущий патент: Способ производства бумаги
Следующий патент: Устройство для бестраншейной замены трубопроводов
Случайный патент: Способ и устройство для высокоскоростного осушения гидросмесей












