Соединения актагардина и их применение для лечения или профилактики инфекции clostridium difficile
Номер патента: 21628
Опубликовано: 30.07.2015
Авторы: Вадман Сьёрд Николаас, Доусон Майкл Джон, Кортес Баргалло Хесус
Формула / Реферат
1. Способ лечения или профилактики инфекции Clostridium difficile у субъекта, включающий введение лантибиотика типа В, выбранного из группы, состоящей из актагардина и его вариантов, содержащих 1, 2, 3 или 4 аминокислоты, замененные другой аминокислотой по положению, выбранному из положений 2, 3, 4, 5, 8, 10, 11, 13, 15, 16 или 18; их производных и солей.
2. Способ по п.1, отличающийся тем, что лантабиотик типа В вводят для лечения инфекции Clostridium difficile в нижнем отделе кишечника или толстой кишки у субъекта, при этом способ включает пероральное введение субъекту от 100 до 2000 мг в сутки указанного лантибиотика типа В.
3. Способ по любому из пп.1, 2, отличающийся тем, что лантибиотик типа В представляет собой соединение актагардина формулы (I)
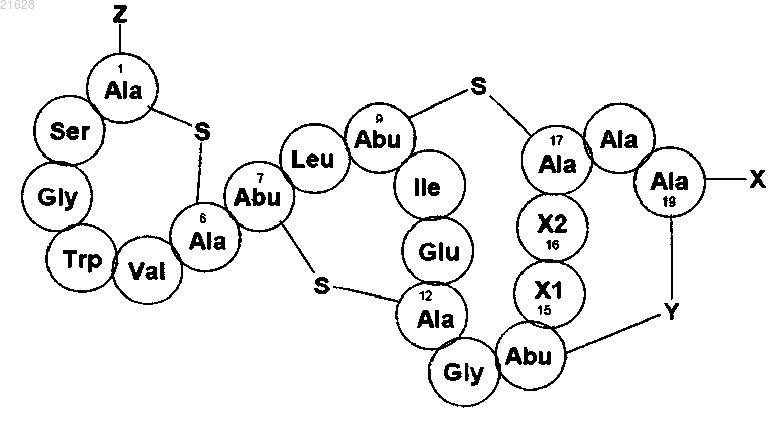
где Х1 обозначает остаток, который представляет собой Leu, Val или Ile;
Х2 обозначает остаток, который представляет собой Leu, Val или Ile;
X представляет собой группу -ОН, которая содержится в аминокислоте, находящейся в положении 19, содержащей свободный терминальный карбоксильный остаток, или группу -NR1R2, являющуюся модификацией С-конца аминокислоты в положении 19, где R1 представляет собой водород, или алкил, или гетероалкильную группу, замещенную по меньшей мере одним гидроксильным заместителем, a R2 представляет собой водород, или алкил, или гетероалкильную группу, замещенную по меньшей мере одним гидроксильным заместителем, или R1 и R2 совместно с атомом азота образуют гетероциклическую группу, которая содержит по меньшей мере один гидроксильный заместитель, причем гетероциклическая группа может дополнительно содержать один или более гетероатомов, или R1 и R2 независимо представляют собой:
(1) водород;
(2) группу формулы -(CH2)n-NR11R12, в которой n представляет собой целое число от 2 до 8, a R11 и R12 независимо представляют собой водород или (C1-C4)алкил: или R11 и R12 совместно представляют собой группу -(СН2)3-, -(СН2)4-, -(СН2)2-О-(СН2)2-, -(CH2)2-S-(CH2)2- или -(СН2)5-; или R1 и R2 совместно с соседним атомом азота образуют пиперазиновый фрагмент, который может быть замещен в положении 4 заместителем, выбранным из:
(a) (C1-C4)алкила,
(b) (C5-C7)циклоалкила,
(c) пиридила,
(d) -(CH2)p-NR13R14, где р представляет собой целое число от 1 до 8, a R13 и R14 независимо представляют собой водород или (C1-C4)алкил;
(е) пиперидинила,
(f) замещенного пиперидинила, причем указанный замещенный пиперидинил содержит заместитель у атома азота, представляющий собой (C1-C4)алкил,
(g) бензилп и
(h) замещенного бензила, в котором фенильный фрагмент содержит 1 или 2 заместителя, выбранных из хлора, брома, нитро, (C1-C4)алкила и (C1-C4)алкокси;
Z представляет собой аминокислотный остаток, NR3R4, -NR5COR6, -NR5C(O)OR6, -NR5SOR6, -NR5SO2R6, -NR5C(S)NR6R7, -NR5C(NR8)NR6R7 или -N=R9, и каждая из указанных групп представляет собой модификации N-конца аминокислоты в положении 1, где R3, R4, R5, R6, R7, R8 и R9 представляют собой независимо водород или возможно замещенную группу, выбранную из алкила, гетероалкила, арила, гетероарила, аралкила и гетероаралкила, при условии что R9 не является водородом;
Y представляет собой -S- или -S(O)-,
или фармацевтически приемлемую соль указанного соединения.
4. Способ по п.3, отличающийся тем, что Х1 представляет собой Leu или Val.
5. Способ по любому из пп.3, 4, отличающийся тем, что Х2 представляет собой Val или Ile.
6. Способ по любому из пп.3-5, отличающийся тем, что R1 или R2 представляет собой независимо один из нижеприведенных заместителей:
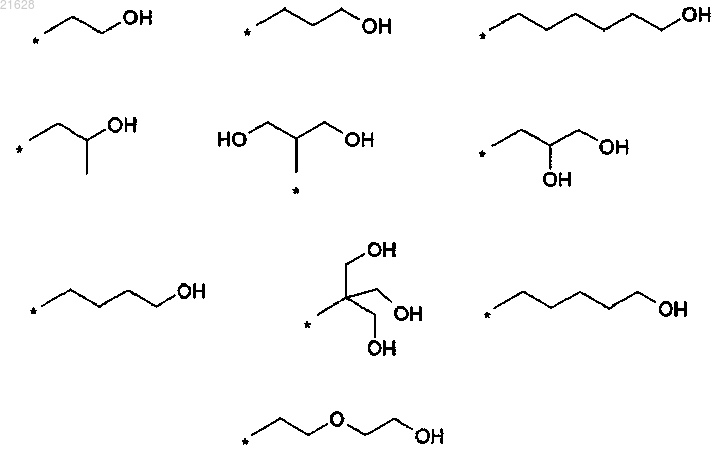
где * указывает на место присоединения к азоту.
7. Способ по любому из пп.3-5, отличающийся тем, что R1 представляет собой алкил, a R2 представляет собой водород.
8. Способ по любому из пп.3-5, отличающийся тем, что R1 или R2 представляет собой независимо один из нижеприведенных заместителей:
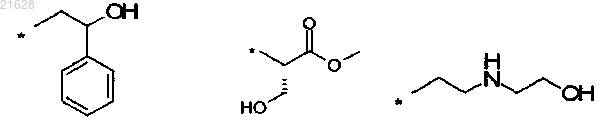
где * указывает на место присоединения к азоту.
9. Способ по любому из пп.3-5, отличающийся тем, что R1 и R2 совместно с атомом азота образуют заместитель, который выбран из:
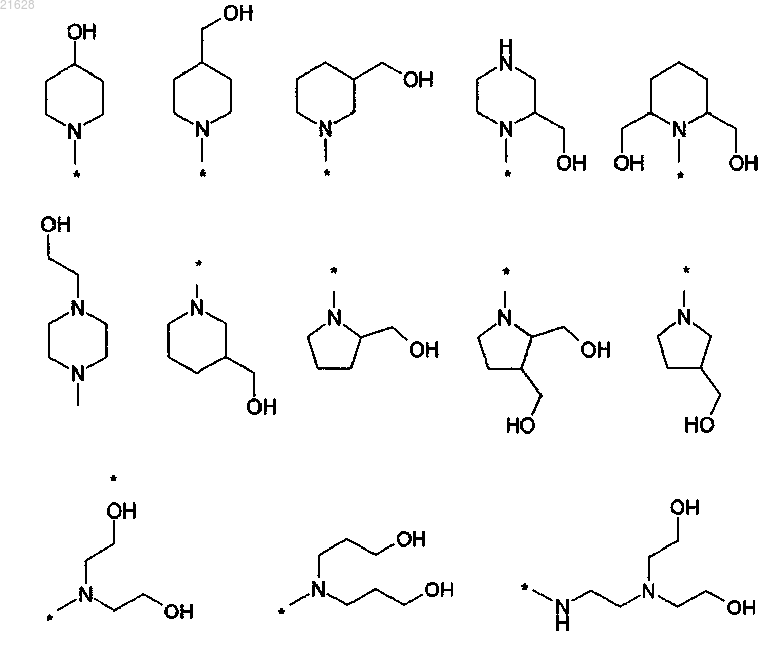
где * указывает на место присоединения к карбонильному углероду С-конца.
10. Способ по любому из пп.3-9, отличающийся тем, что лантибиотик типа В представляет собой вариант соединения актагардина формулы (I), в котором 1, 2, 3 или 4 аминокислоты заменены другими аминокислотами по положению, выбранному из положений 2, 3, 4, 5, 8, 10, 11, 13, 15, 16 или 18.
11. Способ по любому из пп.1-10, отличающийся тем, что субъекту вводят указанный лантибиотик типа В и второй активный агент, который представляет собой противомикробный агент.
12. Способ по п.11, отличающийся тем, что указанный лантибиотик типа В и указанный второй активный агент, который представляет собой противомикробный агент, вводят одновременно, раздельно или последовательно.
13. Способ по п.11 или 12, отличающийся тем, что второй активный агент представляет собой соединение или композицию, связанную с восстановлением одного или более компонентов анаэробной микрофлоры кишечника.
14. Способ по любому из пп.1-13, отличающийся тем, что лантибиотик типа В, выбранный из группы, состоящей из актагардина и его вариантов, содержащих 1, 2, 3 или 4 аминокислоты, замененные другой аминокислотой по положению, выбранному из положений 2, 3, 4, 5, 8, 10, 11, 13, 15, 16 или 18, малоактивен против организмов Bifidobacterium spp и Bacteroides spp.
15. Применение лантибиотика типа В, выбранного из группы, состоящей из актагардина и его вариантов, содержащих 1, 2, 3 или 4 аминокислоты, замененные другой аминокислотой по положению, выбранному из положений 2, 3, 4, 5, 8, 10, 11,13,15, 16 или 18; и их производных и солей, для получения лекарственного средства для лечения или профилактики у субъекта бактериальной инфекции нижнего отдела кишечника или толстой кишки.
16. Соединение актагардина формулы (I)
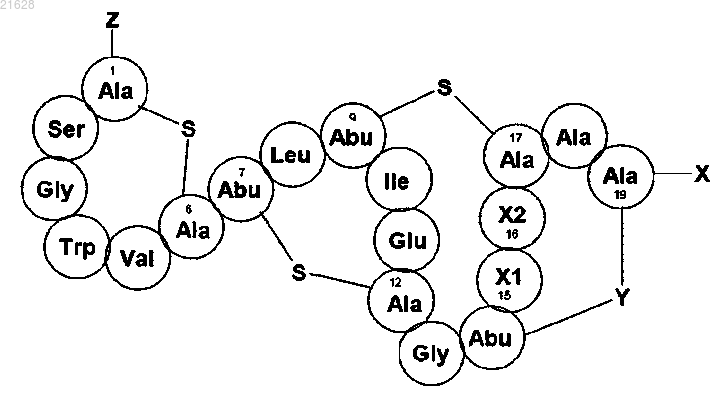
обладающее противомикробной активностью,
где Х1 обозначает остаток Leu, Val или Ile;
Х2 обозначает остаток Leu, Val или Ile;
X представляет собой группу -NR1R2, являющуюся модификацией С-конца аминокислоты в положении 19, где R1 и R2 независимо представляют собой:
(1) водород;
(2) группу формулы -(CH2)n-NR11R12, где n представляет собой целое число от 2 до 8, a R11 и R12 независимо представляют собой водород или (C1-C4)алкил, или R11 и R12 совместно представляют собой группу -(СН2)3-, -(СН2)4-, -(СН2)2-О-(СН2)2-, -(CH2)2-S-(CH2)2- или -(СН2)5-, или R1 и R2 совместно с соседним атомом азота образуют пиперазиновый фрагмент, который может содержать заместитель в положении 4, выбранный из:
(a) (C1-C4)алкила,
(b) (C5-C7)циклоалкила,
(c) пиридила,
(d) -(CH2)p-NR13R14, где р представляет собой целое число от 1 до 8, a R13 и R14 независимо представляют собой водород или (C1-C4)алкил,
(e) пиперидинила,
(f) замещенного пиперидинила, причем указанный замещенный пиперидинил содержит заместитель у атома азота, представляющий собой (C1-C4)алкил,
(g) бензила и
(h) замещенного бензила, в котором фенильный фрагмент содержит 1 или 2 заместителя, выбранных из хлора, брома, нитро, (C1-C4)алкила и (C1-C4)алкокси;
Z представляет собой либо аминокислотный остаток, либо -NH2, где последний представляет собой N-конец остатка аланина в положении 1;
Y представляет собой -S- или -S(O)-,
или фармацевтически приемлемую соль указанного соединения, или вариант указанного соединения, где 1, 2, 3 или 4 аминокислоты замещены другой аминокислотой и указанные 1, 2, 3 или 4 аминокислоты находятся в положении, выбранном из положений 2, 3, 4, 5, 8, 10, 11, 13, 15, 16 или 18 в соединении формулы (I).
17. Соединение по п.16, отличающееся тем, что Х1-Х2 выбраны из группы, состоящей из Leu-Leu, Leu-Val, Leu-Ile, Val-Leu, Val-Ile, Ile-Leu, Ile-Val и Ile-Ile.
18. Соединение по п.16 или 17, отличающееся тем, что Z представляет собой аминокислоту.
19. Соединение по п.17, отличающееся тем, что указанная аминокислота выбрана из группы Ala-, Ile-, Lys-, Phe-, Val-, Glu-, Asp-, His-, Leu-, Arg-, Ser- и Trp- и указанные аминокислоты находятся в D- или L- конфигурации.
20. Соединение по любому из пп.16-19, отличающееся тем, что R2 представляет собой водород и R1 представляет собой группу формулы -(CH2)n-NR11R12, в которой n обозначает целое число от 2 до 8, a R11 и R12 независимо представляют собой водород или (C1-C4)алкил или R11 и R12 совместно представляют собой группу -(CH2)3-, -(CH2)4-, -(CH2)2-O-(CH2)2-, -(CH2)2-S-(CH2)2- или -(CH2)5-.
21. Применение соединения по пп.16-20 для лечения или профилактики инфекции Clostridium difficile у субъекта.
Текст
СОЕДИНЕНИЯ АКТАГАРДИНА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ИНФЕКЦИИ Clostridium difficile Настоящее изобретение предлагает способы лечения или профилактики у субъекта микробной инфекции нижнего отдела кишечника или толстой кишки, включающие введение субъекту лантибиотика типа В. В частности, изобретение предлагает способы лечения или профилактики инфекции Clostridium difficile путем введения лантибиотиков типа В, включающих соединения актагардина и его варианты, содержащие 1, 2, 3 или 4 аминокислоты, замененные другой аминокислотой по положению, выбранному из положений 2, 3, 4, 5, 8, 10, 11, 13, 15, 16 или 18; его производных и солей.(71)(73) Заявитель и патентовладелец: НОВАКТА БИОСИСТЕМС ЛИМИТЕД (GB) Родственная заявка Настоящая заявка связана с заявкой на Патент Великобритании 071403.0, зарегистрированной 18 июля 2007 г.; содержание которой полностью включено в настоящую заявку посредством ссылки. Область техники Настоящее изобретение относится к применению лантибиотиков типа В, их производных и вариантов для лечения и профилактики микробной инфекции у субъекта. Уровень техники Инфекция Clostridium difficile является наиболее распространнной причиной диареи, приобретнной в больнице. С. difficile представляет собой споробразующую анаэробную бактерию, обычно присутствующую в кишечнике у примерно до 3% здоровых взрослых и 66% детей. Данные бактерии редко доставляют проблемы здоровым субъектам, поскольку они находятся под контролем популяции бактерий,присутствующих в норме в кишечнике. Однако терапевтическое или профилактическое применение широкого спектра анибиотиков нарушает баланс бактерий в кишечнике, позволяя резистентным С. difficile,присутствующим в виде спор, быстро размножаться и продуцировать токсины, вызывающие диарею,ассоциируемую с Clostridium difficile (CDAD - также известную под названием диареи, ассоциируемой с примом антибиотиков), инфекцию просвета толстой кишки и псевдомембранозный колит, а в исключительных случаях смерть. В настоящее время существует два общепринятых способа лекарственной терапии для леченияCDAD, а именно лечение ванкомицином и метронидазолом. Оба агента связывают с высоким уровнем рекуррентности симптомов (15-20%), возможно, потому что они не позволяют возрождение флоры кишечника до нормального состояния, поэтому существует высокая потребность в агентах с улучшенным профилем. Кроме того, клиницисты неохотно прописывают ванкомицин для продолжительного приема из опасений возрастания общей резистентности к антибиотикам, оставляя его как "последнее средство" в лечении других полихимиорезистентных патогенов. Лантибиотики представляют собой пептиды, обладающие активностью антибиотиков и другими видами активности, выделяемые грамположительными бактериями. Они содержат, кроме других модифицированных остатков, тиоэфиры аминокислот лантионин и метиллантионин, образующие путм поперечных сшивок полициклическую структуру. Их подразделяют на два класса, лантибиотики типа А и типа В. Лантибиотики типа А в целом представляют собой амфифильные соединения с вытянутой цепочкой, способные образовывать поры в бактериальных и других плазменных мембранах. Примерами являются низин и субтилин. Лантибиотики типа В, наоборот, являются глобулярными пептидами, структура которых конформационнозависима. Примерами являются мерсацидин и актагардин. Дополнительные примеры приведены ниже в табл. 1 Лантибиотики представляют собой класс пептидных антибиотиков, продуцируемых бактериями, с узким спектром активности, который включает Clostridium difficile. Структурно для лантибиотиков характерна интенсивная посттрансляционная модификация, включающая в основном дегидратацию гидроксилсодержащих остатков серина и треонина при необходимости с образованием циклов по цистеину с образованием тиоэфирных мостиков. Таблица 1. Классификация лантибиотиков Дополнительно к лантибиотикам типа В можно отнести лихеницидин. Классификация согласно HG Sahl et al, Ann. Rev. Microbiology 1998, 52, 41 (содержание которой полностью включено в настоящую заявку посредством ссылки). Также существуют различные промежуточные формы лантибиотиков, они включают ряд соединений, биологическое действие которых зависит от синергии с другими пептидами. Примеры последней группы включают цитолизины и стафилококцины. Низин является наиболее хорошо изученным лантибиотиком типа А, он был утверждн в некоторых странах в качестве пищевой добавки (Turtell and Delves-Broughton, International acceptance of nisin asa food preservative. Bull. Int. Dairy Fed. 1988, 329, 20-23). Низин селективен к грамположительным бактериям, включая Clostridium spp. Узкий спектр антибактериальной активности, казалось бы мог сделать его идеальным вариантом терапевтического агента для лечения CDAD. К сожалению низин легко метаболизируется кишечными ферментами, что затрудняет его доставку к месту инфекции. Был предпринят ряд попыток создать такие рецептуры низина, в которых он доставлялся бы в толстую кишку неповрежднным, как описано в (Патенте США 5985823, 1999; Т. Ugurlu et al. Eur. J. Pharm.Biopharm. 2007, 67, 202), однако характерная уязвимость низина к ферментативному расщеплению остатся проблемой. Это привело к предположению о том, что низин и другие лантибиотики, для доставки в конкретные целевые участки кишечника при оральном введении должны быть инкапсулированы (Rea et al. J. Med.Microbiol. 2002, 56, 940). Соответственно, было предложено вводить бактериоцин с помощью клизмы через задний проход. Ранее авторы настоящего изобретения для применения в качестве антибиотиков идентифицировали и синтезировали мерсацидин (WO 2007/036706). Авторы настоящего изобретения также для применения в качестве антибиотиков идентифицировали и синтезировали аналоги актагардина (PCT/GB2007/000138 WO/2007/083112). Сообщалось об обнаружении генных кластеров, ответственных за продуцирование циннамицина и дурамицина, а также об усовершенствовании способов их получения (см. WO 02/088367 и WO 2004/033706, соответственно). Для того чтобы преодолеть проблемы, такие как резистентность, биосовместимость, токсичность и тому подобное, в области антибиотиков постоянно существует потребность в обеспечении новых соединений, обладающих свойствами антибиотиков. Аналогично желательно создание способов получения лантибиотиков, а также вариантных форм лантибиотиков (которые при необходимости имели бы иной профиль активности по сравнению с нативными формами. Считается, что для лечения инфекции, вызванной Clostridium difficile, желательно, чтобы антибактериальный агент среди прочих обладал одним или более из следующих свойств: хорошей активностьюin vivo против Clostridium difficile; относительно плохой активностью против большинства других организмов в норме составляющих флору кишечника; был системно или в кишечнике малотоксичен или нетоксичен и относительно плохо абсорбировался при оральном введении (тем самым минимизируя симптомы общего отравления). Однако, до сих пор не было достаточного количества экспериментальных данных, чтобы определить пригодность соединений лантибиотиков, обладающих антибактериальной активностью in vitro для применения в способе лечения или профилактики бактериальной инфекции у субъекта. В частности недостаточно данных относительно активности соединений лантибиотиков и их применения in vivo для лечения бактериальных инфекций толстой кишки. Авторы настоящего изобретения обнаружили активность in vivo ряда производных лантибиотиков типа В, ранее не предлагавшихся для применения для лечениия или профилактики. Сущность изобретения Настоящее изобретение обеспечивает применение лантибиотика типа В, выбранного из группы, состоящей из актагардина и его вариантов, содержащих 1, 2, 3 или 4 аминокислоты, замененные другой аминокислотой по положению, выбранному из положений 2, 3, 4, 5, 8, 10,11, 13,15,16 или 18; их производных и солей, для лечения или профилактики микробной инфекции у субъекта. Инфекция может являться инфекцией желудочно-кишечного тракта, предпочтительно кишечника, и наиболее предпочтительно толстой кишки. В частности в одном аспекте настоящего изобретения предложен способ лечения бактериальной инфекции. Предпочтительно инфекция представляет собой инфекцию Clostridium, предпочтительно инфекцию Clostridium perfringens, Clostridium difficile, Clostridium tetani или Clostridium botulinum, наиболее предпочтительно инфекцию С. difficile. Эти способы обеспечивают новые и эффективные альтернативы способу лечения лантибиотиками типа А, ванкомицином или метронидазолом. В изобретении также предлагается способ лечения заболевания, вызванного бактериальной инфекцией кишечника, в особенности толстой кишки. Способ может применяться для лечения псевдомембранозного колита или CDAD. Предпочтительно инфекция представляет собой инфекцию Clostridium, предпочтительно Clostridium perfringens, Clostridium difficile, Clostridium tetani или Clostridium botulinum,наиболее предпочтительно инфекцию С. difficile. В настоящем изобретении также предлагается способ лечения или профилактики субъекта, включающий стадию введения субъекту лантибиотика типа В. Предпочтительно лантибиотик типа В вводится орально. Лантибиотики типа В, описанные в настоящей заявке, их производные и варианты, могут являться избирательно действующими по отношению к С. difficile. Данные соединения могут обладать, по сравнению с ванкомицином или метронидазолом, пониженной активностью против других сапрофитов и паразитов флоры кишечника, в особенности Bifidobacterium spp и Bacteroides spp. Соединения, описанные в настоящей заявке, аналогично ванкомицину активны против С. difficile и обеспечивают в способе лечения или профилактики микробной инфекции у субъекта новые и эффектив-2 021628 ные альтернативы ванкомицину. Лантибиотики типа В, описанные в настоящей заявке, могут обладать по сравнению с низином повышенной устойчивостью к ферментативнму расщеплению. В частности, соединения могут обладать по сравнению с низином повышенной устойчивостью к действию кишечного сока. Структуры лантибиотиков типа В являются более компактными по сравнению с соединениями типа А, и они не обладают протяженной линейной конфигурацией, характерной для А-форм. Следовательно они менее восприимчивы к протеолизу и поэтому они с большей вероятностью достигают места инфекции, такой как бактериальная инфекция нижней части кишечного тракта. Краткое описание фигур Фиг. 1(а) показывает устойчивость лантибиотиков низина и мерсадицина в имитированном желудочном соке (ИЖС). Фиг. 1 (b) показывает устойчивость соединений VI и VII в имитированном желудочном соке (ИЖС). Фиг. 2(а) показывает устойчивость лантибиотиков низина и мерсадицина в имитированном кишечном соке (ИКС). Фиг. 2(b) показывает устойчивость соединения VI в имитированном кишечном соке (ИКС). Фиг. 3 показывает эффективность in vivo ванкомицина, соединения IV и соединения VI на модели тифлита хомяков, ассоциируемой с С. difficile. Фиг. 4 показывает эффективность in vivo соединения VII на модели тифлита хомяков, ассоциируемой с С. difficile. Подробное описание изобретения Настоящее изобретение относится к применению лантибиотиков типа В и их производных и вариантов при лечении или профилактике микробной инфекции у субъекта. Конкретно изобретение предлагает применение этих соединений для лечения инфекций, ассоциируемых с Clostridium, наиболее предпочтительно, инфекции Clostridium difficile. При упоминании о применении лантибиотика типа В такое применение также включает применение поизводного или варианта, если из контекста не следует обратное. Считается, что развитие или рецидив инфекций С. difficile в значительной степени связаны с дисбалансом нормальной флоры кишечника. Идеальный терапевтический агент для лечения CDAD (диареи,ассоциируемой с С. difficile) поэтому должен быть высокоселективным в уничтожении С. difficile, имея низкую активность против организмов, доминирующих в условиях кишечника нормального здорового организма, а именно в основном Bifidobacterium spp и Bacteroides spp. Такой агент должен позволить кишечной флоре во время терапии возвратиться к нормальному равновесному состоянию, и тем самым уменьшить риск рецидива CDAD. Оба терапевтических агента, в настоящее время применямых при CDAD, ванкомицин и метронидазол, обычно вводят в высоких дозах, они обладают значительной активностью против организмов, присущих в норме кишечной флоре. Широко распостранено мнение, что частая рекуррентность CDAD у субъектов, ранее переживавших эпизоды инфекции С. difficile, происходит потому, что флора кишечника в течение курса терапии не смогла вернуться к норме. Соединения, описанные в настоящей заявке, могут обладать улучшенной селективностью по отношению к патогенной флоре в присутствии флоры кишечника. Соединения, описанные в настоящей заявке, при применении против Clostridium difficile обладают действием, сравнимым с эффектом ванкомицина и метронидазола. Лантибиотики типа В, описанные в настоящей заявке, и их производные и варианты также могут обладать повышенной устойчивостью по отношению к разрушающим ферментам по сравнению с лантибиотиками типа А, такими как низин, при их попадании в желудочно-кишечный тракт. Поскольку соединения не разрушаются пищеварительными ферментами, повышается их локальная биодоступность в месте инфекции. Увеличение концентрации соединения в кишечнике особенно важно при лечении субъектов, страдающих диареей, поскольку в этом случае время пребывания соединения в кишечнике может быть коротким. Предпочтительным способом введения лекарственной формы при лечении инфекций С. difficile является оральное введение. В виду отсутствия значительной абсорбции или метаболизма в желудочнокишечном тракте обеспечивается доставка к месту инфекции, особенно в кишечнике, максимально достижимой концентрации. Поскольку при оральном введении абсорбция пептидов и родственных соединений с молекулярной массой свыше 1000 Да в целом низкая, весьма важным этапом переваривания пищи в норме является быстрый метаболизм при посредстве ферментов пептидаз. Восприимчивость пептидов по отношению к ферментативному перевариванию в желудке и кишечнике легко может быть установлена in vitro путм измерения их устойчивости в имитированном желудочном соке по Фармакопее США(ИКС, пепсин в физиологическом растворе, рН 1,2) и имитированном кишечном соке по Фармакопее США (ИКС, панкреатин в водном растворе дигидрофосфата калия, рН 6,8). Лантибиотики типа В структурно являются гораздо более компактными по сравнению с лантибиотиками типа А и, что весьма важно, обладают глобулярной третичной структурой, стабилизированной тиоэфирными и другими химическими сшивками. Как таковые, лантибиотики типа В являются менее удобной мишенью для метаболизирующих ферментов и даже вне защитных композиций имеют больше шансов достичь нижней части кишечника. Лантибиотики типа В, особенно Мерсацидин и Актагардин, также обладают активностью против грам-положительных орагнизмов, включая важные резистентные патогены, такие как С. difficile, MRSA(Staphylococcus aureus резистентный к метициллину) и VRE (Энтерококк, резистентный к ванкомицину). Полагают, что антибактериальная активность Мерсацидина и Актагардина в основном проявляется, благодаря их способности связывать липид II, важный биосинтетический промежуточный продукт в синтезе стенки клетки бактерии. Связывание липида II является клинически значимым антибактериальным механизмом, выказываемым другими выдающимися антибиотиками, такими как ванкомицин. К группе лантибиотиков типа В относятся такие пептиды, как циннамицин, дурамицин и анковерин. Было замечено, что эти соединения обладают более слабой антибактериальной активностью по сравнению с актагардином и мерсацидином, и считается, что их основным биологическим действием возможно является ингибирование ферментов. Настоящее изобретение предлагает способ селективного ингибирования роста С. difficile в присутствии других сапрофитов и паразитов, присущих флоре кишечника. Соединения для применения по настоящему изобретению предпочтительно обладают низкой активностью против непатогенных компонентов флоры кишечника. Флора кишечника может содержать Bifidobacterium spp и/или Bacteroides spp. Флора кишечника может содержать один или более организм, которые выбраны из группы, состоящей изBifidobacterium adolescentis NCTC 11814, Bifidobacterium longum NCTC 11818, Bacteroides fragilis NCTC 9343 и Bacteroides thetaiotaomicron NCTC 10582. В отличие от ванкомицина соединения для применения согласно изобретению в присутствии флоры кишечника могут селективно ингибировать рост С. difficile. Предпочтительно соединения для применения согласно изобретению обладают ингибирующей активностью против конкретного организма флоры кишечника, уступающей ингибирующей активности ванкомицина против данного организма. При оценке ингибирующей активности соединения против организма флоры кишечника значениями минимальной ингибирующей концентрации (MIC), соединения для применения согласно изобретению могут иметьMIC, в 2 или более раз превышающую, в 4 или более раз превышающую, в 8 или более раз превышающую, в 16 или более раз превышающую или в 32 или более раз превышающую значение MIC ванкомицина против данного организма. Предпочтительно соединения для применения согласно изобретению обладают более низкой активностью против двух, трх, четырх, пяти или более непатогенных организмов флоры кишечника по сравнению с активностью ванкомицина. Предпочтительно соединения для применения согласно изобретению обладают активностью против С. difficile, сравнимой или превосходящей активность ванкомицина. При измерении ингибирующей активности соединения против С. difficile значениями минимальной ингибирующей концентрации (MIC),соединения для применения согласно изобретению могут иметь значения MIC, в 16 или более раз уступающие, в 8 или более раз уступающие, в 4 или более раз уступающие, в 2 или более раз уступающие значению MIC ванкомицина против С. difficile. Соединения могут обладать активностью, равной или превышающей активность ванкомицина. Настоящее изобретение также относится к лечению инфекции, недоступной для лечения другим активным соединением, предпочтительно соединением, применение которого не описано в настоящей заявке. Другие активные соединения могут представлять собой ванкомицин или метронидазол. Настоящее изобретение также предлагает способ лечения микробной инфекции, включающий введение субъекту, нуждающемуся в лечении эффективного количества лантибиотика типа В в комбинации со вторым активным агентом. Второй активный агент может являться другим лантибиотиком типа В. Альтернативно второй активный агент может являться другим антимикробным агентом или другим агентом, предназначенным для лечения второго симптома или причины излечиваемого состояния. Второй активный агент может являться соединением или композицией, которое ассоциируется с восстановлением поврежднных компонентов анаэробной кишечной микрофлоры, в особенности во время лечения диареи, ассоциируемой с С. difficile. Второй активный агент может представлять собой толевамер (GT160-246). В дополнительном аспекте способа предлагается лантибиотик типа В и второй активный агент в виде объединнного препарата для одновременного, раздельного или последовательного применения в терапии. В дополнительном аспекте способа предлагается лантибиотик типа В и второй активный агент в виде объединнного препарата для одновременного, раздельного или последовательного применения в терапии для лечения или профилактики микробной инфекции у субъекта. Соединения, описанные в настоящей заявке, можно применять в виде фармацевтической композиции. Так лантибиотик типа В можно вводить в композиции, также содержащей фармацевтически приемлемый носитель. Композиция может представлять собой композицию с отложенным или замедленным высвобождением. В изобретении также предлагается способ ограничения роста спор С. difficile, включающий стадию контакта взвеси спор С. difficile с лантибиотиком типа В. Споры могут находиться в суспензии. Способ также может представлять собой способ in vitro. В изобретении также предлагается способ ограничения прорастания спор С. difficile, включающий стадию контакта взвеси спор С. difficile с лантибиотиком типа В. Споры могут находиться в суспензии. Способ также може представлять собой способ in vitro. Изобретение предлагает способ ингибирования роста бактерий, предпочтительно роста С. difficile, в среде, содержащей протеазы, в частности в среде, содержащей панкреатин, способ, включающий стадию контакта с бактерией в среде, с соединением или композицией, описанной в настоящей заявке. Предпочтительно средой является среда кишечного сока. Предпочтительно способ представляет собой способ invitro. В этом случае среда может являться имитацией среды в кишечнике. Могут применяться также экстракты из кишечника. С. difficile может являться клинически изолируемым штаммом. Лантибиотики типа В Настоящее изобретение предлагает применение лантибиотика типа В или его производного, или его варианта в лечении или профилактике микробной инфекции у субъекта. Соединение лантибиотика типа В, пригодное для применения по настоящему изобретению, связывает липид II. Природные лантибиотики типа В для применения согласно изобретению включают члены семейства актагардина. Ниже описываются предпочтительные соединения для применения в способах согласно изобретению. Производные и варианты лантибиотиков типа В, а также модифицированные формы этих соединений также могут найти применение в способах, описанных в настоящей заявке. Эти соединения могут быть получены синтетически, полусинтетически (например химической модификацией ферментативных продуктов) или генетическими изменениями в организмах-продуцентах. Потенциально лантибиотик типа В можно видоизменить всеми тремя способами, из которых особенный интерес представляют последние два. Например, модификация аминокислот могла бы применяться для производства вариантов с изменнным профилем активности, а также с изменнными свойствами, такими как бидоступность, биораспределение или способность преодолевать различные механизмы резистентности к самим материнским лантибиотикам типа В. Изменнные аминокислоты также могут оказаться пригодными для введения реакционноспособных боковых цепей, что открывает путь к модификации химическими способами. В одном варианте реализации лантибиотик типа В представляет собой актагардин или его варианты, или его производные. Актагардин Для применения в настоящем изобретении предлагается аналог Актагардина формулы (I) в котором А представляет собой Leu, Val или боковую цепь аминокислоты IIe; В представляет собой Leu, Val или боковую цепь аминокислоты IIe;X представляет собой -NR1R2 или его фармацевтически приемлемую соль, или -ОН, a Y, Z, R1 и R2 являются такими, как определено ниже. Альтернативно структуру соединения формулы (I) удобно представить следующим образом: где Х 1 обозначает, что остаток представляет собой Leu; Val или IIe; Х 2 обозначает, что остаток представляет собой Leu; Val или IIe;X представляет собой -ОН или -NR1R2, где R1 представляет собой водород или алкильную, или гетероалкильную группу, замещнную по меньшей мере одним гидроксильным заместителем, a R2 представляет собой водород или алкильную, или гетероалкильную группу, замещнную по меньшей мере одним гидроксильным заместителем, или R1 и R2 совместно с атомом азота представляют собой гетероциклическую группу, содержащую по меньшей мере один гидроксильный заместитель, где гетероциклическая группа при необходимости дополнительно содержит один или более гетероатомов, или R1 и R2 независимо представляют собой(2) группу формулы -(CH2)n-NR11R12, в которой п представляет собой целое число от 2 до 8, a R11 и 12R независимо представляют собой водород или (C1-C4)алкил или R3 и R4 совместно представляют собой группу -(СН 2)3-, -(СН 2)4-, -(СН 2)2-О-(СН 2)2-, -(CH2)2-S-(CH2)2- или -(СН 2)5-; или R1 и R2 совместно с прилежащим атомом азота образуют пиперазиновую группировку, которая в может быть в положении 4 замещена заместителем, выбранным из(b) (C5-C7)циклоалкила,(c) пиридила,(d) -(CH2)p-NR13R14 в котором р представляет собой целое число от 1 до 8, a R5 и R6 независимо представляют собой водород или (C1-C4)алкил;(f) замещнного пиперидинила, в котором замещнный пиперидинил содержит заместитель у атома азота, представляющий собой (С 1-4)алкил;(h) замещнного бензила, в котором фенильная группировка содержит 1 или 2 заместителя, которые выбраны из хлора, брома, нитрогруппы, (C1-C4)алкила и (C1-C4)алкоксигруппы;Z представляет собой остаток аминокислоты, -NR3R4, -NR5COR6, -NR5C(O)OR6; -NR5SOR6,5-NR SO2R6; -NR5C(S)NR6R7, -NR5C(NR8)NR6R7 или -N=R9, в котором R3 R4, R5, R6, R7, R8 и R9 представляют собой независимо водород или возможно замещенную группу, выбранную из алкила, гетероалкила,арила, гетероарила, аралкила и гетероаралкила, при условии, что R9 не является водородом;Y представляет собой -S- или -S(O)-; или их фармацевтически приемлемую соль. Варианты и биологически активные соединения также применимы в способах по настоящему изобретению. В случае, когда Z является группой -NH2, будет понятно, что данная группировка представляет собой N-конец остатка аланина в положении 1 вышеуказанного соединения. В случае, когда группа Z представляет собой остаток аминокислоты, будет понятно, что данная группировка представляет собой аминокислоту, обычно в данной области техники, определяемую как Хаа(0), связаннную с аминокислотой амидной связью в положении 1. В случае, когда группа Z представляет собой -NR3R4, -NR5COR6,-NR5C(O)OR6; -NR5SOR6, -NR5SO2R6; -NR5C(S)NR6R7, -NR5C(NR8)NR6R7 или -N=R9, будет понятно, что эти группы представляют собой модификацию N-конца аминокислоты в положении 1. Необходимо учитывать, что в отображении вышеприведнного соединения (I) остатки аминокислот обозначаются трхбуквенным кодом. Как следует из структурной формулы, Abu относится к остатку аминокислоты, производному 4-аминомасляной кислоты. В случае, когда группа X представляет собой -NR1R2, будет понятно, что данная группировка представляет собой заместитель, присоединнный амидной связью к аланину в положении 19. В случае, когда группа X представляет собой -ОН, будет понятно, что она отображает аланин в положении 19, содержащий свободный карбоксильный конец (-СООН). Следует также принять во внимание, что упоминание Z как остатка аминокислоты относится к группе -NR5COR6, в которой R6 представляет собой амин и функции боковой цепи остатка аминокислоты. Например, для остатка аминокислоты глицина R6 представляет собой -CH2NH2. Типично в остатке-6 021628 аминокислоты, R6 является C1-7 алкильной группой, содержащей в качестве заместителя аминогруппу и возможно дополнительно замещнной соответствующим образом. Соединения формулы (I), в которых Х 1 и Х 2 представляют собой VaI и IIe соответственно, a Y представляет собой -S(O)-, можно считать производными актагардина. Если Х 1 и Х 2 представляют собойLeu и Val соответственно, a Y представляет собой -S-, соединения можно считать производными дезоксиактагардина В. Если Х 1 и Х 2 представляют собой Leu и Val соответственно, a Y представляет собой S-, Z представляет собой -NH2, X представляет собой -ОН, соединение представляет собой дезоксиактагардин. Если Х 1 и Х 2 представляют собой Leu и Val, соответственно, a Y представляет собой -S-, Z представляет собой -NH2, X представляет собой -NHCH2CH2OH, соединение можно назвать N-[2 этаноламин]дезоксиактагардином монокарбоксамидом. Препочтительные соединения Ниже описаны предпочтительные соединения актагардина формулы (I) для применения согласно изобретению. Предпочтения для Х 1 и Х 2 Предпочтительно Х 1 представляет собой Leu, a X2 представляет собой Val или IIe; или Х 1 представляет собой Val и Х 2 представляет собой Val или IIe. Наиболее предпочтительно Х 1 представляет собой Leu, а Х 2 представляет собой VaI или Х 1 представляет собой VaI, a X2 представляет собой IIe. Предпочтения для RR1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13 или R14 могут быть соответствующим образом возможно замещены или возможно дополнительно замещены. Однако в некоторых вариантах реализации эти группы соответствующим образом не замещены или дополнительно не замещены. Предпочтения для X Как R1, так и R2 обе могут представлять собой водород, то есть X может представлять собой -NH2. Если R1 или R2 является алкильной группой, алкильная группа может представлять собой C1-7 алкильную группу, наиболее предпочтительно C1-4 алкильную группу. Алкильная группа R1 или R2 предпочтительно является полностью насыщенной.R1 или R2 могут иметь один, два, три, четыре, пять, шесть или семь атомов углерода. Если R1 и R2, совместно с атомом азота амидной группы составляют гетероциклическую группу, и если группа дополнительно содержит один или более гетероатомов, предпочтительно гетероатомы не находятся в соседних положениях гетероциклического кольца. Как R1, так и R2 могут содержать один или более гидроксильных заместителей. Между собой R1 и 2R могут содержать два или более гидроксильных заместителя. Предпочтительно R1 содержит один, два или три гидроксильных заместителя.R1 и R2 могут являться одинаковыми. Предпочтительно R1 является алкильной группой. Предпочтительно R2 представляет собой водород. Если R1 или R2 является гетероалкильной группой, содержащей гидроксильный заместитель, гидроксильный заместитель является заместителем на атоме углерода гетероалкильной группы. Если R1 или R2 представляет собой алкильную или гетероалкильную группу, содержащую два или более гидроксильных заместителей, каждый гидроксильный заместитель представляет собой заместитель на различных атомах углерода алкильной или гетероалкильной группы. В одном варианте реализации R1 или R2 алкильной группы является ациклическим. В одном варианте реализации R1 или R2 алкильной группы является линейным. В одном варианте реализации R1 или R2 замещн или соответствующим образом дополнительно замещн. Заместитель может представлять собой одну или более из групп, которые выбраны из карбоксильной группы, сложноэфирной группы, ацилоксигруппы, амидогруппы, ациламидогруппы, арила и гетероарила. Предпочтительно, заместитель представляет собой одну или более группу, которые выбраны из группы, состоящей из карбоксильной, сложноэфирных, ацилокси-, арильных и гетероарильных групп. Предпочтительно R1 или R2 независимо представляет собой один из заместителей, приведнных ниже, где показывает положение присоединения к атому азота: Дополнительно или альтернативно R1 или R2 могут быть независимо выбраны из одного из приведнных ниже заместителей, где показывает положение присоединения к атому азота В одном варианте реализации группа R1 независимо выбрана из одного из заместителей из вышеприведнного набора заместителей. В этом варианте реализации R2 представляет собой предпочтительно водород. Альтернативно R1 и R2 совместно с атомом азота, то есть X, могут являться заместителем, который выбран из нижеприведнной группы, где показывает положение присоединения к углероду карбонила С-конца Дополнительно или альтернативно R1 или R2 могут независимо являться нижеприведнным заместителем, где показывает положение присоединения к атому азота предпочтительно R1 представляет собой -СН 2 СН 2 ОН. Пиперидинильная (е) и замещнная пиперидинильная группы (f) предпочтительно содержат атом азота в положении 4. Заместитель у N может быть выбран из групп:(d) -(CH2)P-NR13R14, в которой р представляет собой целое число от 1 до 8, a R13 и R14 независимо представляют собой водород или (C1-C4)алкил и(f) замещнного пиперидинила, где замещнный пиперидинил содержит заместитель у атома азота,который представляет собой (C1-C4)алкил. Если заместитель у азота представляет собой -(CH2)P-NR13R14, тогда R13 и R14 предпочтительно может являться (C1-C4)алкилом, более предпочтительно (C1-C2)алкилом, например метилом. Целое число р предпочтительно составляет от 1 до 4, например 3. Если заместителем у атома азота является замещнный пиперидинил, тогда второй заместитель у атома азота предпочтительно представляет собой (C1-C2)алкил, например метил. Как упоминалось выше,-8 021628 атом азота находится предпочтительно в положении 4. Особенно предпочтительными для применения согласно изобретению являются соединения, в которых R1 представляет собой алкильную или гетероалкильную группу, замещнную по меньшей мере одним гидроксильным заместителем, a R2 представляет собой водород или алкильную, или гетероалкильную группу, замещнную по меньшей мере одним гидроксильным заместителем, или R1 и R2 совместно с атомом азота представляют собой гетероциклическую группу, содержащую по меньшей мере один гидроксильный заместитель, в которой гетероциклическая группа при необходимости дополнительно содержит один или более гетероатом. Предпочтения для Z В одном варианте реализации, Z представляет собой -NH2, аминокислоту или -NR5COR6. Предпочтительно Z представляет собой -NH2 или аминокислоту. В одном варианте реализации Z представляет собой -NR5COR6, a R5 представляет собой водород.Z может представлять собой -NH2. Если Z представляет собой остаток аминокислоты, остаток аминокислоты представляет собой предпочтительно остаток стандартной аминокислоты, кодируемый генетическим кодом или остаток егоD- изоформы, более предпочтительно остаток аминокислоты, выбранный из группы Ile-, Lys-, Phe-, Val-,Glu-, Asp-, His-, Leu, Arg-, Ser- и Trp-. Согласно одному из аспектов остаток аминокислоты может быть выбран из группы Ile-, Lys-, Phe-, Val-, Glu-, Asp-, His-, Leu-, Arg- и Ser-. Такие варианты могут быть обеспечены химическим присоединением остатка к соединениям, в которых Z представляет собой -NH2,по описанию к патенту США 6022851, который включен в настоящую заявку посредством ссылки. Следует принимать во внимание, что при химическом присоединении кислоты допускается нахождение аминокислоты в L- или D-конфигурации. Это относится к D-Ala, и дополнительно к D-формам других аминокислот, таких как были упомянуты выше. Остаток аминокислоты может являться модифицированным остатком стандартной аминокислоты,таким как остатки, сформированные при посттрансляционной модификации остатков, например, остатков серина, цистеина и треонина. Остаток в пределах набора соединений по настоящему изобретению может быть выбран из дегидрированных аминокислот, из группы, показанной ниже Вторую из этих структур можно назвать остатком дегидроаминомасляной кислоты. Дополнительно остаток аминокислоты может быть выбран из циклических остатков, показанных в нижеприведнной группе Принимается во внимание, что синтез этих циклических структур типично включает циклизацию остатков боковой цепи серина, треонина или цистеина с амидным карбонилом, типично, но не обязательно, соседнего остатка аминокислоты. Таким образом, вышеизображнные структуры включают часть соседних групп, таких как соседних аминокислот. Альтернативно, соседняя группа может быть стать производной из группы, совместно с остатками серина, треонина или цистеина, образующими амидную связь у остатка N-конца. Это доказывается ретросинтезом в нижеприведнном примере для оксазолинового остатка аминокислоты, производного из остатка серина, который связывается амидной связью с соседней группой остатка N-конца серина Звздочкауказывает на положение атома углерода в оксазолине, полученном из углерода карбонила в соседней группе. Ретросинтез представлен только в иллюстративных целях, и, обсуждавшиеся выше, посттрансляционно модифицированные остатки аминокислот можно приготовить из альтернативных предшественников. Остаток аминокислоты может являться остатком аминокислоты нестандартного происхождения или редкой стандартной аминокислоты. Аминокислота может быть выбрана из группы, состоящей из селеносерина, аминомасляной кислоты, аминоизмасляной кислоты, бутилглицина, цитруллина, циклогексилаланина, диаминопропионовой кислоты, гомосерина, гидроксипролина, норлейцина, норвалина,орнитина, пеницилламинопироглутаминовой кислоты, саркозина, стати на, тетрагидроизохинолин-3 карбоновой кислоты и тиенилаланина. Могут быть выбраны L- или D-формы. Аминокислота может являться -, - или -аминокислотой. Аминогруппа аминокислоты может быть моно- или диалкилированной. Если Z представляет собой остаток аминокислоты, аминогруппу аминокислоты можно модифицировать. Так, N-конец может являться группой, выбранной из -NR3R4,-NR5COR6, -NR5C(O)OR6; -NR5SOR6, -NR5SO2R6; -NR5C(S)NR6R7 и -NR5C(NR8)NR6R7, где R3 R4, R5, R6,R7 и R8 определены выше. Если Z представляет собой остаток аминокислоты, остаток аминокислоты может также представлять собой защищенный остаток аминокислоты. Защитные группы для аминогрупп могут быть выбраны из группы, состоящей из Fmoc, Boc, Ас, Bn и Z (или Cbz). Боковая цепь также может быть защищена соответствующим образом. Защитные группы для боковых цепей могут быть выбраны из группы, состоящей из Pmc, Pbf, OtBu, Trt, Acm, mMt, tBu, Boc, ivDde,2-CITrt, tButhio, Npys, Mts, NO2, Tos, OBzI, OcHx, Acm, pMeBzI, pMeOBz, OcHx, Bom, Dnp, 2-CI-Z, BzI,For и 2-Br-Z по выбору для данной боковой цепи. Стандартные и нестандартные аминокислоты и их защищенные версии, также как и способы снятия защитных групп хорошо известны. Многие из них подытожены в каталоге Merck Novabiochem 'Reagents for Peptide and High-Throughput Synthesis' (2006/7) (содержание которого полностью включено в настоящую заявку в виде ссылки). Одна из R3 и R4 групп может являться взможно замещенной группой выбранной из алкила, гетероалкила, арила, гетероарила, аралкила и гетероаралкила. Группы R3 и R4 обе могут представлять собой водород. Если Z представляет собой -NH2, то есть R3 и R4 обе представляют собой водород, эта группа может находиться в защищенной форме. Защитная группа может быть выбрана из группы, состоящей из Fmoc,Boc, Ас, Bn и Z (или Cbz). Могут применяться другие защитные группы, такие как те, которые описаны ниже касательно защищннных форм. Предпочтительно, R5 представляет собой водород. Предпочтительно, Z представляет собой -NH2, аминокислоту или -NR5COR6. Если Z представляет собой -NR5COR6, предпочтительно R5 представляет собой водород и R6 представляет собой аралкильную группу, замещнную гидроксилом, наиболее предпочтительно аралкильную группу, замещнную в алкильной части группы. R6 может являться -CH(OH)Ph (то есть Z модифицирована миндальнокислой группой). Предпочтительные структуры Предпочтительно соединения лантибиотика типа В представляют собой соединения типа актагардина, выбранные из нижеприведнной группы: Соединение II: Актагардин Соединение III: Дезоксиактагардин В Соединение V: Phe(0)Дезоксиактагардин В Соединение VI: N-[2-Этаноламино]актагардин монокарбоксамид Соединение VII: N-[2-Этаноламин]дезоксиактагардин монокарбоксамид Соединение VIII: N-[4-Бутаноламино]дезоксиакгагардин В монокарбоксамид Соединение IX: (3-Амино-1,2-пропандиол)дезоксиактагардин В монокарбоксамид Соединение X: (2-Амино-1,3-пропанол)дезоксиактагардин В монокарбоксамид Соединение XI: [Трис(гидроксиметил)метиламиновая соль ]дезоксиактагардина В Соединение XII: (1-Амино-2-пропанол)дезоксиактагардин В монокарбоксамид Соединение XIII: (1-Амино-3-пропанол)дезоксиактагардин В монокарбоксамид Соединение XIV: (Этаноламино)-(L)-фенилаланил-(0)-дезоксиактагардин В монокарбоксамид Соединение XV: (Этаноламино)-(L)-триптофанил-(0)-дезоксиактагардин Вмонокарбоксамид Соединение XVI: (Этаноламино)-(L)-аланил-(0)-дезоксиактагардин В монокарбоксамид Соединение XVII: (Этаноламино)-(D)-аланил-(0)-дезоксиактагардин В монокарбоксамид Соединение XVIII: (Этаноламино)-(L)-изолейцинил-(0)-дезоксиактагардин В монокарбоксамид Соединение XIX: (Этаноламино)-(L)-лейцинил-(0)-дезоксиактагардин В монокарбоксамид Соединение XX: (Этаноламино)-N-фенилацетилдезоксиактагардин В монокарбоксамид Соединение XXI: (Этаноламино)-N-ацетилдезоксиактагардин В монокарбоксамид Соединение XXII: (Этаноламино)-N-манделилдезоксиактагардин В монокарбоксамид Соединение XXIII: (N,N-бис(2-гидроксиэтил)этилендиамин)дезоксиактагардин В монокарбоксамид Дополнительно или альтернативно предпочтительные соединения согласно первому аспекту настоящего изобретения могут быть выбраны из соединений по прилагаемому ниже списку: Соединение L: Дезоксиактагардин В N-[ 2-гидрокси-2-фенилфенилэтиламин]монокарбоксамид Соединение LI: Метиловый эфир L-серинилдезоксиактагардина В монокарбоксамида Соединение LII: (N-(2-гидроксиэтил)этилендиамино)дезоксиактагардин В монокарбоксамид Соединение LIII: (2-Гидроксипиперазино)дезоксиактагардин В монокарбоксамид Дополнительно или альтернативно предпочтительные соединения согласно первому аспекту настоящего изобретения могут быть выбраны из соединений по прилагаемому ниже списку: Соединение LX: (Этаноламино)-(L)-аланил-(0)-дезоксиактагардин В монокарбоксамид Соединение LXI: (Этаноламино) (D)-аланил-(0)-дезоксиактагардин В монокарбоксамид Соединение LXII: (Этаноламино) (L)-изолейцинил-(0)-дезоксиактагардин В монокарбоксамид Соединение LXIII: (Этаноламино) (L)-лейцинил-(0)-дезоксиактагардин В монокарбоксамид Соединение LXIV: (Этаноламино)N-Фенилацетилдезоксиактагардин В монокарбоксамид Соединение LXV: (Этаноламино)N-ацетилдезоксиактагардин В монокарбоксамид Соединение LXVI: (Этаноламино)N-манделилдезоксиактагардин В монокарбоксамид Наиболее предпочтительными соединениями являются: Соединение I:N-[2-Этаноламино]дезоксиактагардин монокарбоксамид Соединение III: N-[2-Этаноламино]актагардин монокарбоксамид Варианты Соединения для применения по настоящему изобретению включают варианты соединений формулы (I). Вариант соединения формулы (I), описанный в настоящей заявке, включает соединение, в котором один или более, например от 1 до 5, например 1, 2, 3 или 4 аминокислот замещены другой аминокислотой. Предпочтительно аминокислота находится в положении, выбранном из позиций 2, 3, 4, 5, 8, 10, 11,13, 15, 16 или 18 соединения формулы (I). Замены могут представлять собой замену одной аминокислоты на другую аминокислоту, встречающуюся в природе, и могут являться консервативными или неконсервативными заменами. Консервативные замены включают те замены, размещенные в следующей таблице, когда аминокислоты одного и того же блока во второй колонке и предпочтительно на той же строке третьей колонки могут замещаться одно на другое: Для соединений формулы (I) аминокислота находится предпочтительно в положении, выбранном из положений 2, 3, 4, 5, 8, 10, 11, 13, 15, 16 или 18 соединения формулы (I). Альтернативно, аминокислота может быть заменена на одну из вышеописанных модифицированных нестандартных или редких стандартных аминокислот. Вариант соединения формулы (I) может включать соединения, в которых остаток, производный из треонина, принимающий участие в тиониновом мостике (обозначен Abu) замещается на остаток, производный из серина (Ala), например остаток в положении 7. Аналогично, остаток производный из серина,принимающий участок в тиониновом мостике (обозначен Ala) замещается остатком, производным из треонина (Abu), например остаток в положении 1. Таким образом в вариантах для применения согласно изобретению, включающих соединения с бета-метиллантиониновой поперечной сшивкой бетаметиллантиониновая поперечная сшивка заменяется лантиониновой поперечной сшивкой и наоборот. Таким образом могут изменяться одна, две или три поперечных сшивки. Вариант соединения согласно изобретению может включать соединение, альтернативно или дополнительно включающее поперечную сшивку, отличную от тионинового мостика. Альтернативные мостики включают, если это приемлемо, дисульфидные мостики и амидные и сложноэфирные мостики (так называемые макролактамные и макролактонные варианты, соответственно). Производные Производные соединений для применения согласно изобретению (включая варианты) представляют собой такие производные, в которых изменена одна или более аминокислот путем, например, этерификации амидирования или окисления. Производные соединений согласно изобретению могут являться моноамидными производными по одной из карбоксильных функций актагардина формулы (I). Производное соединение может включать соединение, в которой карбоксильная функция боковой цепи внутреннего остатка, например таковая ос- 11021628 татка Glu11, изменена из -СООН на группу -COOR9, в которой R9 представляет собой водород, (C1C4)алкил или (C1-C4)алкокси(C2-C4)алкил. Альтернативно карбоксильная функция боковой цепи внутреннего остатка, например таковая остатка Glu11 актагардина может быть изменена из -СООН на группу- CONR1R2, в которой R1 и R2 определены, как выше для заместителей у С-конца амида. Согласно изобретению производными соединений по N-концу могут являться таковые, в которых аминогруппа -NH2 заменена на -NHR10, где R10 представляет собой С 1-4 алкил. Соединение (I) представлено со следующими поперечными сшивками: поперечная сшивка по 1-6,через лантионин (Ser-Cys); поперечная сшивка по 7-12, через бета-метиллантионин (Thr-Cys) и поперечная сшивка по 9-17, через бета-метиллантионин (Thr-Cys). Одна, две или три поперечных сшивки могут представлять собой тиониновые поперечные сшивки. Также представлено соединение (I) с поперечной сшивкой по 14-19, через бетаметиллантионинсульфоксид (Thr-Cys). В производном соединении формулы (I) одна, две, три или четыре поперечные сшики могут остутствовать. Предпочтительно, чтобы присутствовали по меньшей мере одна или более поперечных сшивок через тионин или тионинсульфоксид. Синтез соединений актагардина Авторы изобретения ранее описали способы приготовления соединений актагардина, а также их производных и вариантов. Имеется более ранняя родственная заявка изобретателей, находящаяся на рассмотрении PCT/GB 2007/000138 (WO/2007/083112), содержание которой настоящим полностью включено в настоящую заявку посредством ссылки. Соединения, указанные в данном документе, могут применяться как исходные материалы для соединений, описанных в настоящем изобретении. Соединения, описанные в настоящей заявке, могут применяться к качестве исходных материалов для синтеза других соединений для применения согласно изобретению. Соединения актагардина для применения согласно изобретению могут быть приготовлены из известных соединений актагардина. Предпочтительно, соединения актагардина согласно изобретению изготавливают из актагардина, актагардина В и дезоксиактагардина В. Данные лантибиотики можно рассматривать как "Исходные лантибиотики" или "исходный материал для изготовления лантибиотиков". Соединение актагардина может быть приготовлено экспрессией нуклеиновой кислоты, например строительного элемента экспрессии кодирующего предшественника полипептида, транспортируемого в рекомбинантном векторе экспрессии, в клетку хозяина, который содержит соответствующий ген лантибиотика, такой как ген LanA, если это необходимо, вместе со ассоциируемыми генами кластера, требующимися для конверсии предшественника полипептида в аналог актагардина. Варианты соединения актагардина могут быть получены соответствующей модификацией гена LanA с применением способов,по своей сути известных специалистам в данной области. Ген LanO, который, как было показано, является частью актагардинового генного кластера, кодирует белок, ответственный за окисление дезоксиформы аналогов актагардина в актагардин, в котором Y представляет собой -S(O)-. Модификация этого гена может позволить образование производных соединений с альтернативной структурой поперечной сшивки. Модификация гена LanO также позволяет менять соотношения относительных уровней окисленной (Y=-S(O и восстановленных форм (Y = -S-),продуцируемых в клетке хозяина. Считается, что ген LanM, который, как было показано, является частью актагардинового генного кластера, кодирует белок, требующийся для конверсии предшественника полипептида в аналог лантибиотика. Модулирование этого гена, и других генов, кодирующих модифицикацию белков, может позволить продуцирование производных соединений с альтернативными структурами поперечных сшивок. Модулирование этих генов может также позволить продуцирование соединений, обладающих или сохраняющих последовательность аминокислот, присоединнных к N-концу аналога актагардина, такую как лидерная последовательность. Типично, соединения, продуцированные клеточной культурой, будут содержать свободный амин вN-конце (то есть z представляет собой -NH2) и свободную карбоксильную группу в С-конце (то есть X представляет собой -ОН). Эти концы можно дериватизировать, как в подробностях будет описано ниже. Если аналог актагардина должен содержать модифицированный N-конец, типично, в исходном материале N-конец будет представлять собой свободный амин. Следует принимать во внимание, что соединения,продуцируемые клеточной культурой, могут содержать также модифицированный N-конец. Таким образом, допускается, что соединение для применения в качестве исходного материала является соединением, где Z представляет собой -NHR3, где R3 определено как для аналогов по формуле (I). Если настоящее изобретение относится к применению соединений производных исходного материала аналога актагардина, в которых Х 1 и Х 2 представляют собой Leu и VaI, соответственно, в качестве клетки хозяина может выступать A. liguriae NCIMB 41362 без какой-либо дополнительной модификации. Если клетки хозяина продуцируют смесь аналогов исходного материала, например такие, в которыхY представляет собой -S- или -S(O)-, продукты можно выделить, применяя стандартную технологию разделения, например при посредстве ВЭЖХ (высокоэффективная жидкостная хроматография), например как описано в Патенте США 6022851 для получения актагардина и Ala-Актагардина. В зависимости от культуры клетки исходный материал для лантибиотика может выделяться из клетки хозяина немодифицированным. Изолированные и модифицированные соединения могут быть введены в рецептуру в форме фармацевтической композиции, при необходимости в форме фармацевтически приемлемой соли. Актагардин можно извлекать из культуральной среды при помощи стандартных технологий, известных специалистам в данной области, например отделением от остальных компонентов культуральной среды хроматографическими средствами. Такие средства включают применение гидрофобных смол,обращеннофазной хроматографии, ионобменной хроматографии и ВЭЖХ. Альтернативно, исходный материал для производства лантибиотиков или их вариантов и производных может быть получен посредством химического пептидного синтеза, например, твердофазного пептидного синтеза (ТФПС). Эти технологии хорошо известны специалистам в данной области. Однако,предпочтительно, исходный материал для изготовления лантибиотиков получают из клеточной культуры. Соединения для применения согласно изобретению могут в значительной степени находиться в изолированной форме. Изолированными соединениями будут считаться такие изолированные соединения, определнные выше, которые, как было определено выше, свободны или в практически свободны от ассоциируемого с ними материала, такого как полипептиды, из которых были получены данные соединения. Естественно, соединения могут вводиться в композицию с разбавителями и вспомогательными веществами и быть изолируемыми только в практических целях. Соединение согласно изобретению также может находиться в основном в очищенной форме, в этом случае соединение в препарате может содержать в процентном отношении более 90%, например 95%,98% или 99% соединения в препарате, представляющего собой соединение согласно изобретению. Соединения согласно изобретению изготавливают путм взаимодействия исходного материала для производства лантибиотиков, содержащих карбоксильный С-конец, с соединением, содержащим 2-6 кратный молярный избыток соответствующих аминогрупп, в приемлемом органическом растворителе,таком как диметилформамид при температуре, типично, между 0C и комнатной температурой и в присутствии подходящего конденсирующего агента. Репрезентативными примерами конденсирующих агентов являются производные карбодиимида, такие как дициклогексилкарбодиимид, фосфоазидаты, такие как DPPA (дифенилфосфорилазид) или сочетающие агенты на основе бензотриазола, такие как РуВор,HATU (гексафторфосфат 2-(1 Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония) или TBTU (тетрафторборат О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония). Соединения согласно изобретению, в которых Z представляет собой аминокислоту или -NR5COR6 можно приготовить путм взаимодействия исходного материала для производства лантибиотиков, содержащих аминогруппу в N-конце посредством реакции сочетания с соответствующей карбоновой кислотой в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид, фосфоазидаты,такие как DPPA или сочетающие агенты на основе бензотриазола, такие как РуВор, HATU или TBTU. Для запуска реакции в основном применяют органические аминооснования, такие как триэтиламин или диизопропилэтиламин. Альтернативно, в качестве реагентов для взаимодействия с N-концом лантабиотика можно применять предварительно полученные активированные производные соответствующей кислоты, такие как пентафторфениловые эфиры. Для запуска реакции добавляют катализатор, такой как HOBt. Типичным растворителем является диметилформамид. Если карбоновая кислота, сочетающаяся с лантибиотиком, дополнительно содержит функциональные группы, способные помешать реакции сочетания, могут применяться подходящие защитные группы,известные специалистам в данной области. Например, защитные группы Fmoc или tBoc могут применяться для производных аминокислот, предназначенных для сочетания с N-концом лантибиотика. Соединения по настоящему изобретению, где Z представляет собой NR3R4, можно приготовить из лантибиотика, содержащего в N-конце аминогруппу, посредством реакции сочетания с альдегидом или кетоном в органическом растворителе, таком как дихлорметан, диметилсульфоксид или уксусная кислота в присутствии подходящего восстанавливающего агента, такого как боргидрид натрия или триацетоксиборгидрид натрия. Эти восстанавливающие агенты можно применять в растворе или связывать с подходящей смолой, такой как полистирол. В зависимости от условий реакции возможен выбор альдегида или кетона и соотношения реагентов, применяемых в реакции моно- или диалкилирования N-конца. Альтернативно реакцию можно проводить в отсутствии восстанавливающего агента. В этом случае можно получать соединения по настоящему изобретению, где Z представляет собой -N=R9. Соединения согласно изобретению, где Z представляет собой -NR5C(O)OR6; -NR5SOR6, -NR5SO2R6; 5-NR C(S)NR6R7 или -NR5C(NR8)NR6R7, можно приготовить из исходного материала для производства лантибиотиков, содержащего аминогруппу на N-конце, посредством реакций сочетания, с соответствующим образом активированной группой замещаемого реагента. Так, соединения, в которых Z представляет собой -NR5C(O)OR6, можно приготовить, применяя ClC(O)OR6 и тому подобное. Соединения, в которых Z представляет собой NR5SO2R6, могут дополнительно содержать функциональную группу, ко- 13021628 торую надо защищать защитной группой. Защитную группу можно удалить соответствующим образом после проведения реакции сочетания. Соединения актагардина для применения согласно изобретению могут быть модифицированы, как по N-, так и по С-концу. Эти соединения могут быть приготовлены из исходных материалов, модифицированных либо по С-, либо по N-концу. Другой конец может быть затем модифицировано, чтобы создать соединения для применения по настоящему изобретению. Так, последовательность замещений может,либо отвечать особенностям модификации N-конца с последующей модификацией С-конца или наоборот. Если возникают проблемы, связанные с региоселективностью, например, если заместитель на Сконце обладает свойствами характерными для аминогруппы, может применяться подходящая стратегия защиты. Так, исходный материал лантибиотика, в котором N-конец соединения представляет собой остаток аминокислоты, -NR3R4, -NR5COR6, -NR5C(O)OR6; -NR5SOR6, -NR5SO2R6, -NR5C(S)NR6R7,-NR5C(NR8)NR6R7 или -N=R9 (как ранее определялось в настоящей заявке по отношению к соединениям согласно изобретению), может эквивалентно сочетаться с аминоспиртами у С-конца. Авторы изобретения обнаружили, что в условиях реакции сочетания, применяемых для сочетания аминоспирта с карбоксилом С-конца исходноголантибиотика, может модифицироваться также карбоксильная группа в боковой цепи остатка аминокислоты, например глутаминовой кислоты. Соединения такого рода, в которых в аминокислоте модифицируются и С-конец, и боковая цепь, также нашли применение в настоящем изобретении. Если была модифицирована боковая цепь аминокислоты, для того чтобы изменить количество полученного продукта, может применяться соответствующее изменение реакционных условий. Альтернативно, для того чтобы обеспечить целостность боковой цепи может применяться стратегия защиты и снятия защиты. Подходящие защитные группы для остатков аминокислот боковой цепи хорошо известны и включают в себя вышеупомянутые защитные группы. Варианты актагардина, у которых остаток треонина заменн на остаток дегидробутиринаминокислоты, могут быть приготовлены химическим дегидратированием треонинового остатка. Например, остаток треонина может быть обработан EDC (хлористым 3-[циано(этил)амино]пропилдиметилазанием) в присутствии CuCl. Аналогичную реакцию ранее описали для дегидратации треонинового остатка низина(смотри Fukase, K et al Bull. Chem. Soc. Jpn. 1992, 65, 2227-2240). Способ может адаптирован для приготовления дегидроостатка аланина из серинового остатка. Производные с изменнными поперечными сшивками можно приготовить циклизацией соответствующего остатка аминокислоты, например, боковые цепи цистеиновых остатков пригодны для образования дисульфидных мостиков. Технологии макролактамизации, макролактонизации и образования дисульфидных мостиков хорошо известны специалистам в области пептидного синтеза. Идентификацию продуктов реакции можно проводить, применяя ЖХ-МС (жидкостную хроматографию с масс-спектрометрическим детектором). Ход реакции можно прослеживать посредством ВЭЖХ. ВЭЖХ может применяться для отслеживания расхода исходного материала, появления продукта, а также побочных продуктов или продуктов разложения (если они появятся). Продукты и исходный материал можно анализировать при помощи спектроскопии ЯМР. Соостветствующие технологии были ранее описаны авторами настоящего изобретения по отношению к приготовлению соединений, вариантов и производных актагардина. Структуру соединения на основе лантибиотика можно подтвердить, применяя стандартные технологии, такие как COSY (двумерная корреляционная ЯМР), НМВС (гетероядерная корреляция многих связей), TOCSY (спектроскопия полной корреляции), HSQC (гетероядерная одноквантовая когерентность) и NOESY ядерная спектроскопия с применением эффекта Оверхаузера), а также NOE. Включает другие формы Вышеупомянутые соединения и полипептидные предшественники включают свои хорошо известные ионные, солевые, сольватные и защищенные формы. Например, ссылки на карбоновую кислоту (СООН) также включают анионную (карбоксилатную) форму (-СОО), е соль или сольват, а также традиционные защищенные формы. Аналогично ссылка на аминогруппу включает е протонированную форму(-N+HR1R2), соль или сольват аминогруппы, например хлористо-водородную соль, равно как и традиционные защитные формы аминогруппы. Аналогично, ссылка на гидроксильную группу также включает е анионную форму (-0), соль или сольват, равно как и традиционные защитные формы гидроксильной группы. Например, ссылка на карбоксилсодержащую боковую цепь глутаминовой кислоты (Glu), свойства которой как остатка соединения согласно изобретению, включает остаток соединения для применения согласно изобретению. Также ссылка на X-ОН включает ссылку на карбоксилатную форму остатка аминокислоты аланина в положении 19 актагардина. Изомеры, соли, сольваты, защищенные формы и пролекарства Изомеры Некоторые соединения могут существовать в одной или более конкретных геометрических, оптических, энантиомерных, диастереомерных, эпимерных, стереоизомерных, таутомерных, конформационных или аномерных форм, включая, но не органичиваясь перечисляемыми, цис- и транс-формы; Е- и Z- 14021628"конверта" и формы "полукресла" и их комбинации, в дальнейшем собирательно именуемые "изомерами" (или "изомерными формами"). Например, описанные в настоящей заявке остатки аминокислот могут существовать в одной из конкретных стереоизомных форм. Аналогично группы R1 и R2 могут существовать в одной из конкретных стереоизомерных форм, если такие формы существуют. Подобным образом группы R3, R4, R5, R6, R7, R8,R9, R10, R11, R12, R13 и R14 могут существовать в любой конкретной стереоизомерной форме, если такие формы существуют. Если соединение для применения согласно изобретению включает остаток дигидроаминомасляной кислоты, остаток может существовать либо в цис-, либо в транс-форме. Если соединение находится в кристаллической форме, оно может существовать в разнообразных полиморфных формах. Авторы отмечают, что кроме обсуждаемых ниже таутомерных форм из понятия "изомеры", применяемого в настоящей заявке, исключены структурные (или конституционные) изомеры (то есть изомеры,которые различаются связями между атомами, а не просто расположением атомов в пространстве). Например, упоминание метоксигруппы, -ОСН 3, не следует толковать как упоминание его структурного изомера, гидроксиметильной группы, -СН 2 ОН. Аналогично, упоминание орто-хлорфенила не должно толковаться, как упоминание его структурного изомера, мета-хлорфенила. Однако ссылка на класс структур может по праву включать структурные изомерные формы, подпадающие под этот класс (например, C1-7 алкил включает н-пропил и изо-пропил; бутил включает н-, изо-, втор- и трет-бутил; метоксифенил включает орто-, мета- и пара-метоксифенил). Вышеупомянутое исключение не относится к таутомерным формам, например, кето-, енольным- и енолятным-формам, как, например, в следующих таутомерных парах: кетон/енол, имин/енамин,амид/иминоспирт, амидин/амидин, нитрозо/оксим, тиокетон/ентиол, N-нитрозо/гидроксиазо и нитро/ацинитро. Авторы отмечают, что в понятие "изомер" включаются соединения с одним или более изотопными заменами. Например, Н может находиться в любой изотопной форме, включая 1 Н, 2 Н (D) и 3 Н (Т); С может находиться в любой изотопной форме, включая 12 С, 13 С и 14 С; О может быть в любой изотопной форме, включая 16 О и 18 О и тому подобное. Если специально не оговорено, ссылка на конкретное соединение включает все такие изомерные формы, включая (полностью или частично) рацематы и другие их смеси. Способы приготовления (например, асимметрический синтез) и разделения (например, дробная кристаллизация и хроматографические средства) таких изомерных форм, либо хорошо известны специалистам в данной области или легко создаются адаптированием способов, изложенных в настоящей заявке, или известных способов, в известном исполнении. Соль Если специально не оговорено, ссылка на конкретное соединение также включает его ионные, солевые, сольватные и защищенные формы, например, обсуждаемые ниже, а также его различные полиморфные формы. Может оказаться подходящим или желательным приготовить, очистить и/или применить соответствующую соль активного соединения, например, фармацевтически приемлемую соль. Примеры фармацевтически приемлемых солей приводятся в Berge et al.,"Pharmaceutically Acceptable Salts", J. Pharm. Sci.,66, 1-19 (1977). Например, если соединение имеет анионную природу или содержит функциональную группу, которая может стать анионной (например, -СООН может стать -СОО-), тогда соль может образоваться с соответствующим катионом. Примеры приемлемых неорганических катионов включают, не ограничиваясь перечисляемыми, ионы щелочных металлов такие как Na+ и K+, катионы щелочно-земельных металлов,такие как Са 2+ и Mg2+ и другие катионы, такие как Al3+. Примеры приемлемых органических катионов включают, не ограничиваясь перечисляемыми, ион аммония (то есть, NH4+) и замещнные ионы аммония(например, NH3R+, NH2R2+, NHR3+, NR4+). Примерами приемлемых замещнных ионов аммония являются ионы производные из: этиламина, диэтиламина, дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина, меглумина и трометамина, а также аминокислоты, такие как лизин и аргингин. Примером общераспространнной четвертичной соли аммония является N(CH3)4+. Если соединение имеет катионную природу или содержит функциональную группу, которая может стать катионной (например, -NH2 может стать -NH3+), тогда с приемлемым анионом образуется соль. Примеры приемлемых неорганических анионов включают, не ограничиваясь перечисляемыми, производные следующих неорганических кислот: хлористо-водородной, бромисто-водородной, йодистоводородной, серной, сернистой, азотной, азотистой, фосфорной и фосфористой. Примеры приемлемых органических анионов включают, не ограничиваясь перечисляемыми, производные следующих органи- 15021628 ческих кислот: уксусной, пропионовой, янтарной, гликолевой, стеариновой, пальмитиновой, молочной,малоновой, памоевой, винной, лимонной, глюконовой, аскорбиновой, малеиновой, гидроксималеиновой,фенилуксусной, глутаминовой, аспарагиновой, бензойной, коричной, пировиноградной, салициловой,сульфаниловой, 2-ацетоксибензойной, фумаровой, толуолсульфоновой, метансульфоновой, этансульфоновой, этандисульфоновой, щавелевой, изетионовой, валериановой и глюконовой. Примеры приемлемых полимерных анионов включают, не ограничиваясь перечисляемыми, производные следующих полимерных кислот: дубильной кислоты, карбоксиметилцеллюлозы. Сольват Может оказаться подходящим или желательным приготовить, очистить и/или применить соответствующий сольват активного соединения. Термин "сольват", применяемый в настоящей заявке в свом традиционном смысле, относится к комплексу растворнного вещества (например, соли активного соединения) и растворителя. Если растворителем является вода, сольват традиционно называют гидратом,например, моногидратом, дигидратом, тригидратом, и так далее. Защищенные формы Может оказаться подходящим или желательным приготовить, очистить и/или применять активное соединение в химически защищенной форме. Понятие "химически защищенная форма" в настоящем описании имеет традиционный химический смысл, и относится к соединению, в котором одна или более из реакционноспособных функциональных групп защищены от нежелательных химических реакций, то есть, эти группы существуют в виде защищенной или защитной группы (также известной под названием замаскированной или маскирующей группы или блокированной или блокирующей группы). Посредством защиты реакционноспособной функциональной группы можно проводить реакции, вовлекающие незащищнные реакционноспособные функциональные группы, не затрагивая защищенную группу, защитная группа может удаляться, обычно на более поздней стадии, практически не затрагивая остаток молекулы. Смотри, например, Protective Groups in Organic Synthesis (Т. Green и Р. Wuts; 3rd Edition; JohnWiley and Sons, 1999). Например, аминогруппу можно защищать, как ранее описано при Z, представляющем собой -NH2. Дополнительно аминогруппу можно защитить в виде амида или уретана, например, в виде: метиламида(-NH-Alloc), в виде 2(-фенилсульфонил)этилоксиамида (-NH-Psec); или, если это приемлемо в виде нитроксида (N-O). Например, карбоксильную группу карбоновых кислот можно защищать, как ранее описано для остатка аминокислоты. Например, карбоксильную группу карбоновой кислоты можно защитить образованием сложного эфира например: С 1-7 алкилового эфира (например, метилового эфира; трет-бутилового эфира); C1-7 галогеналкилового эфира (например, C1-7 тригалогеналкилового эфира); три-C1-7 алкилсилилС 1-7 алкилового эфира или С 5-20 арил-C1-7 алкилового эфира (например, бензилового эфира; нитробензилового эфира) или амида, например метиламида. Например, гидроксильную группу можно защищать эфирной (-OR) или сложноэфирной (-OC(=O)R) группами, например эфирными трет-бутилэфирной; бензильной, бензгидрильной (дифенилметильной) или тритильной (трифенилметильной); триметилсилильной или трет-бутилдиметилметилсилильной или сложноэфирной ацетилированной (-ОС(=О)СН 3, -ОАс) группой. Например, альдегидную или кетонную группу можно защищать, переводя в ацеталь или кеталь, соответственно, в которых карбонильная группа (С=О) превращается в диэфир (C(OR)2), посредством реакции, например, с первичным спиртом. Альдегидную или кетонную группу легко регенерировать гидролизом в большом избытке воды в присутствии кислоты. Пролекарства Может оказаться подходящим или желательным приготовить, очистить и/или применить соединение в форме пролекарства. Термин "пролекарство", применяемый в настоящей заявке, относится к соединению, которое при метаболизме (например, in vivo), образует желаемое активное соединение. Типично, пролекарство является неактивным, или менее активным, чем желаемое активное соединение, но может обеспечить преимущества в обращении, введении или метаболических свойствах. Например, некоторые пролекарства представляют собой сложные эфиры активного соединения (например,физиологически приемлемого метаболически лабильного сложного эфира). В результате метаболизма сложноэфирная группа (-C(=O)OR) расщепляется с образованием активного лекарственного средства. Некоторые сложные эфиры могут образоваться посредством этерификации, например, карбоксильных групп (-СООН) исходного соединения, включая, если это необходимо, предварительную защиту любых других реакционноспособных групп, присутствующих в исходном соединении, с последующим снятием защиты, если это необходимо. Примеры таких метаболически лабильных сложных эфиров включают, не ограничиваясь перечисляемыми, такие эфиры, в которых R представляет собой С 1-20 алкил (например -Me, -Et); С 1-7 аминоалкил (например ами- 16021628 ноэтил; 2-(N,N-диэтиламино)этил; 2-(4-морфолино)этил) и ацилокси-С 1-7 алкил (например, ацилоксиметил; ацилоксиэтил; например пивалоилоксиметил; ацетоксиметил; 1-ацетоксиэтил; 1-(1-метокси-1 метил)этилкарбонилоксиэтил; 1-(бензоилокси)этил; изопропоксикарбонилоксиметил; 1-изопропоксикарбонилоксиэтил; циклогексилкарбонилоксиметил; 1-циклогексилкарбонилоксиэтил; циклогексилоксикарбонилоксиметил; 1-циклогексилоксикарбонилоксиэтил; (4-тетрагидропиранилокси)карбонилоксиметил; 1-(4-тетрагидропиранилокси)карбонилоксиэтил; (4-тетрагидропиранил)карбонилоксиметил и 1-(4-тетрагидропиранил)карбонилоксиэтил). Дополнительные приемлемые формы пролекарств включают фосфоновые и гликолевые соли. В частности, гидроксильные группы (-ОН), можно "встраивать" в фосфонатные пролекарства реакцией с хлордибензилфосфитом, с последующим гидрированием, с образованием фосфонатной группы -ОР(=О)(ОН)2. Эта группа при метаболизме ферментативно отщепляется фосфатазами с образованием активного лекарственного средства с гидроксилом. Также некоторые пролекарства активируются ферментативно с образованием активного соединения или соединения, которое после дополнительной химической реакции приводят к активному соединению. Например, пролекарство может быть углеводным производным или другим гликозидным конъюгатом,или может быть производным сложного эфира аминокислоты. Фармацевтически приемлемые соли"Фармацевтически приемлемая соль", может являться кислой солью присоединения, в которой основание сохраняет биологическую эффективность и свойства фармацевтически приемлемого соединения. Такие соли включают соли, образованные хлористоводородной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой, фосфорной кислотой и тому подобное, и органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота,миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, пара-толуолсульфокислота,салициловая кислота и тому подобное. Соли также включают основные соли, такие как соли щелочных или щелочно-земельных металлов. Дополнительно или альтернативно соли могут быть образованы с любым из соединений, такими как N-метил-D-глюкамин, L-аргинин, L-тирозин, холин и трис (гидроксиметил)аминометан. Определения Алкил: Термин "алкил", применяемый в настоящей заявке, относится к одновалентной группировке, полученной удалением атома водорода от углерода в углеводороде, содержащем от 1 до 20 атомов углерода(если специально не оговорено) и которая может быть насыщенной или ненасыщенной (например, частично ненасыщенной, полностью ненасыщенной). Гетероалкил: Термин "Гетероалкил", применяемый в настоящей заявке, относится к алкильной группе, в которой один или более атомов углерода замещены гетероатомами N, S или О.I В контексте алкильных групп префиксы (например C1-4, C1-7, C1-20, С 2-7, С 3-7 и так далее.) указывают на количество атомов углерода или диапазон количеств атомов углерода. Например, термин "C1-4 алкил", применяемый в настоящей заявке, относится к алкильной группе, содерждащей от 1 до 4 атомов углерода. Примеры групп алкилов включают C1-4 алкил ("низший алкил "), C1-7 алкил и C1-20 алкил. Авторы отмечают, что первый префикс может варьирваться согласно некоторым ограничениям, вытекающим из других условий; например, для ненасыщенных алкильных групп, первый префикс должен быть по меньшей мере 2; для циклических алкильных групп первый префикс должен быть по меньшей мере 3 и так далее. Примеры (незамещнных) насыщенных алкильных групп включают, не ограничиваясь перечисляемыми, метил (C1), этил (С 2), пропил (С 3), бутил (С 4), пентил (С 5), гексил (С 6), гептил (С 7), октил (С 8), нонил (С 9), децил (С 10), ундецил (С 11), додецил (C12), тридецил (C13), тетрадецил (С 14), пентадецил (C15) и эйкодецил (С 20). Примеры (незамещнных) насыщенных линейных алкильных групп включают, не ограничиваясь перечисляемыми, метил (C1), этил (С 2), н-пропил (С 3), н-бутил (С 4), n-пентил (амил) (С 5), н-гексил (С 6) и н-гептил (С 7). Примеры (незамещнных) насыщенных разветвлнных алкильных групп включают, не ограничиваясь перечисляемыми, изопропил (С 3), изобутил (С 4), втор-бутил (С 4), трет-бутил (С 4), изопентил (С 5) и неопентил (С 5). Циклоалкил: Термин "циклоалкил", применяемый в настоящей заявке, относится к алкильной группе, в то же время, являющейся циклической группой; то есть одновалентной группировке, полученной удалением атома водорода от алициклического кольцевого атома карбоциклического кольца карбоциклического соединения, которое (карбоциклическое кольцо) может быть насыщенным или ненасыщенным (например, частично не насыщенным полностью не насыщенным), которая (группировка) содержит от 3 до 20 атомов углерода (если специально не оговорено), включая от 3 до 20 атомов кольца. Предпочтительно каждое кольцо содержит от 3 до 7 кольцевых атомов. Примеры циклоалкильных групп включают С 3-20 циклоалкил, C3-15 циклоалкил, С 3-10 циклоалкил, С 3-7 циклоалкил. Гетероциклил: Термин "гетероциклил", применяемый в настоящей заявке, относится к одновалентной группировке, полученной удалением атома водорода от кольцевого атома гетероциклического соединения, которая(группировка) содержит от 3 до 20 кольцевых атомов (если специально не оговорено), из которых от 1 до 10 являются кольцевыми гетероатомами. Предпочтительно каждое кольцо содержит от 3 до 7 кольцевых атомов, из которых от 1 до 4 являются кольцевыми гетероатомами. В этом контексте префиксы (например, С 3-20, С 3-7, C5-6, и так далее) указывают на количество кольцевых атомов или на диапазон количеств кольцевых атомов, будь то атомы углерода или гетероатомы. Например, термин "С 5-6 гетероциклил", применяемый в настоящей заявке, относится к гетероциклильной группе, содержащей 5 или 6 кольцевых атомов. Примеры гетероциклильных групп включают С 3-20 гетероциклил, С 5-20 гетероциклил, С 3-15 гетероциклил, С 5-15 гетероциклил, C3-12 гетероциклил, С 5-12 гетероциклил, С 3-10 гетероциклил, С 5-10 гетероциклил, С 3-7 гетероциклил, С 5-7 гетероциклил и С 5-6 гетероциклил. Примеры моноциклических гетероциклильных групп включают, не ограничиваясь перечисляемыми, группы производные:O1S1: оксатиола (С 5) и оксатиана (тиоксана) (С 6) и, N1O1S1: оксатиазина (С 6). Примеры замещнных (неароматических) моноциклических гетероциклильных групп включают группы производные сахаридов в циклической форме, например, фураноз (С 5), таких как арабинофураноза, ликсофураноза, рибофураноза и ксилофураноза и пираноз (С 6), таких как аллопираноза, альтропираноза, глюкопираноза, маннопираноза, гулопираноза, идопираноза, галактопираноза и талопираноза.R1 и R2 совместно с атомом азота амидной связи могут создать гетероциклильную группу, содержащую по меньшей мере один гидроксильный заместитель. Гетероциклильная группа, может являться группой, которая выбрана из N1. Примеры приведены выше. Гетероциклильная группа может содержать один или более дополнительный гетероатом. Тогда гетероциклильная группа может являться группой,которая выбрана из N2, N1O1, N1S1, N2O1 и N1O1S1 Примеры приведены выше. Арил: термин "арил", применяемый в настоящей заявке, относится к одновалентной группировке,полученной удалением атома водорода из ароматического кольца ароматического соединения, причм указанное соединение может содержать одно кольцо или два или более колец (например, конденсированных). Гетероарил: термин "Гетероарил", применяемый в настоящей заявке относится к арильной группе,содержащей один или более атомов углерода, замещнными, не ограничиваясь перечисляемыми, N, S, О гетероатомами. В этом случае удобно обозначать группу в виде "С 5-20 гетероарильной" группой, в которой "С 5-20" указывает на кольцевые атомы, будь то атомы углерода или гетероатомы. Предпочтительно каждое кольцо содержит от 5 до 7 кольцевых атомов, из которых от 0 до 4 являются кольцевыми гетероатомами. Аралкил: термин аралкил, применяемый в настоящей заявке, относится к алкильной группе, определнной выше, замещнной одной или более, предпочтительно одной, арильной группой, определнной выше. Гетероаралкил: термин "гетероаралкил", применяемый в настоящей заявке, относится к алкильной группе, определнной выше, замещнной одной или более предпочтительно одной арильной группой,определнной выше, в которой один или более атомов углерода в алкильной и/или арильной группе замещн, не ограничиваясь перечисляемыми, N, S, О гетероатомами. С 5-20 арил: термин "С 5-20 арил" применяемый в настоящей заявке, относится к одновалентной группировке, полученной удалением атома водорода от атома ароматического кольца С 5-20 ароматического соединения, и содержащего в кольце от 5 до 20 атомов, и в которой по меньшей мере одно из указанных колец представляет собой ароматическое кольцо. Предпочтительно каждое кольцо содержит в кольце от 5 до 7 атомов. Примеры C5-20 арильных групп, в которых кольцевые гетероатомы отсутствуют (то есть С 5-20 карбоарильная группы), включают, не ограничиваясь перечисляемыми, производные из бензола (то есть фенил) (С 6), нафталина (С 10), антрацена (С 14), фенантрена (C14) и пирена (С 16). Примеры С 5-20 гетероарильных групп, содержащих конденсированные кольца, включают, не ограничиваясь перечисляемыми, С 9 гетероарильные группы, производные бензофурана, изобензофурана,бензотиофена, индола, изоиндола; С 10 гетероарильных групп, производных хинолина, изохинолина, бензодиазина, пиридопиридина; C14 гетероарильные группы, производные акридина и ксантена. Вышеназванные группы, или сами по себе или являясь частью другого заместителя, при необходимости могут замещаться одной или более группами, которые выбраны из них самих и дополнительных пречисленных ниже заместителей. Галоген: -F,-Cl, -Br и -I. Гидроксил: -ОН. Эфир: -OR, где R представляет собой заместитель в эфире, например, C1-7 алкильную группу (также называемую С 1-7 алкоксигруппой), С 3-20 гетероциклильную группу (также называемую С 3-20 гетероциклилоксигруппой), либо С 5-20 арильную группе (также называемую С 5-20 арилоксигруппой), предпочтительноC1-7 алкильную группу. Нитрогруппа: -NO2. Цианогруппа (нитрил, карбонитрил): -CN. Ацил (кетогруппа): -C(=O)R, где R представляет собой ацильный заместитель, например, Н, С 1-7 алкильную группу (также называемую C1-7 алкилацильной группой или C1-7 алканоильной группой), C3-20 гетероциклильную группу (также называемую С 3-20 гетероциклилацильной группой) или С 5-20 арильную группу (также называемую С 5-20 арилацильной группой), предпочтительно, С 1-7 алкильную группу. Примеры ацильных групп включают, не ограничиваясь перечисляемыми, -С(=О)СН 3 (ацетил), -С(=О)СН 2 СН 3(пропионил), -С(=О)С(СН 3)3 (бутирил) и -C(=O)Ph (бензоил, фенон). Карбоксильная группа (карбоновая кислота): -СООН. Сложный эфир (карбоксилат, эфир карбоновой кислоты, оксикарбонил): -C(=O)OR, где R представляет собой сложноэфирный заместитель, например, C1-7 алкильную группу, C3-20 гетероциклильную группу или C5-20 арильную группу, предпочтительно а C1-7 алкильную группу. Примеры сложноэфирных групп включают, не ограничиваясь перечисляемыми, -С(=О)ОСН 3, -С(=О)ОСН 2 СН 3, -С(=О)ОС(СН 3)3 иR представляют собой независимо заместители у амина, определнные для аминогрупп. Примеры амидогрупп включают, не ограничиваясь перечисляемыми, -C(=O)NH2, -C(=O)NHCH3, -C(=O)N(CH3)2,-C(=O)NHCH2CH3, и -C(=O)N(CH2CH3)2, а также амидогруппы, в которых R1 и R2, совместно с атомом азота, к которому они присоединены, образующие гетероциклическую структуру как, например, пиперидинокарбонил, морфолинокарбонил, тиоморфолинокарбонил и пиперазинилкарбонил. Аминогруппа: -NR1R2, в которой R1 и R2 представляют собой независимо заместители, например,водород, C1-7 алкильную группу (также называемую C1-7 алкиламиногруппой или ди-C1-7 алкиламиногруппой) С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно Н или C1-7 алкильную группу, или, в случае "циклической" аминогруппы, R1 и R2, совместно с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, содержащее от 4 до 8 атомов кольца. Примеры аминогрупп включают, не ограничиваясь перечисляемыми, -NH2, -NHCH3, -NHCH(CH3)2, -N(CH3)2,-N(CH2CH3)2 и -NHPh. Примеры циклических аминогрупп включают, не ограничиваясь перечисляемыми,азиридинил, азетидинил, пирролидинил, пиперидиновую группу, пиперазинил, пергидродиазепинил,морфолиногруппу и тиоморфолиногруппу. В частности, циклические аминогруппы могут замещаться в свом кольце любыми заместителями, определнными в настоящей заявке, например карбоксилом, карбоксилатом и амидогруппой. Ациламидогруппа (ациламиногруппа): -NR1C(=O)R2, в которых R1 представляет собой заместитель у амида, например, водород, C1-7 алкильную группу, С 3-20 гетероциклильную группу или C5-20 арильную группу, предпочтительно Н или C1-7 алкильную группу, наиболее предпочтительно Н, и R2 представляет собой заместитель у ацильной группы, например, C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно, C1-7 алкильную группу. Примеры ациламидных групп включают, не ограничиваясь перечисляемыми, -NHC(=O)CH3, -NHC(=O)CH2CH3 и -NHC(=O)Ph. R1 и R2 могут совместно образовать циклическую структуру, как, например, сукцинимидил, малеимидил и фталимидил- 19021628 Уреидогруппа: -N(R1)CONR2R3, в которой R2 и R3 представляют собой независимо заместители у аминогрупп, определнные для аминогрупп, и R1 представляет собой заместитель у уреидогруппы, например, водород, С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу,предпочтительно водород или C1-7 алкильную группу. Примеры уреидогрупп включают, не ограничиваясь перечисляемыми, -NHCONH2, -NHCONHMe, -NHCONHEt, -NHCONMe2, -NHCONEt2, -NMeCONH2,-NMeCONHMe, -NMeCONHEt, -NMeCONMe2, -NMeCONEt2 и -NHCONHPh. Ацилоксигруппа (обращенный эфир): -OC(=O)R, в которой R представляет собой заместитель у ацилоксигруппы, например, C1-7 алкильную группу, С 3-20 гетероциклильную группу или C5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры ацилоксигрупп включают, не ограничиваясь перечисляемыми, -ОС(=О)СН 3 (ацетокси), -ОС(=О)СН 2 СН 3, -ОС(=О)С(СН 3)3, -OC(=O)Ph, -OC(=O)C6H4F и -OC(=O)CH2Ph. Тиол: -SH. Тиоэфир (сульфид): -SR, в котором R представляет собой заместитель у тиоэфирной группы, например, С 1-7 алкильную группу (также называемую C1-7 алкилтио группой), С 3-20 гетероциклильную группу или C5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры С 1-7 алкилтио групп включают, не ограничиваясь перечисляемыми, -SCH3 и -SCH2CH3. Сульфоксид (сульфинил): -S(=O)R, в котором R представляет собой заместитель у сульфоксида, например C1-7 алкильную группу, С 3-20 гетероциклильную группу, или C5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры сульфоксидных групп включают, не ограничиваясь перечисляемыми, -S(=O)CH3 и -S(=O)CH2CH3. Сульфонил (сульфон): -S(=O)2R, в котором R представляет собой заместитель у сульфона, например, C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно С 1-7 алкильную группу. Примеры сульфоновых групп включают, не ограничиваясь перечисляемыми,-S(=O)2CH3 (метансульфонил, мезил), -S(=O)2CF3, -S(=O)2CH2CH3 и 4-метилфенилсульфонил (тозил). Тиоамидогруппа (тиокарбамил): -C(=S)NR1R2, в которой R1 и R2 представляют собой независимо заместители у аминогруппы, уже определнные для аминогрупп. Примеры амидогрупп включают, не ограничиваясь перечисляемыми, -C(=S)NH2, -C(=S)NHCH3, -C(=S)N(CH3)2 и -C(=S)NHCH2CH3. Сульфонаминогруппа: -NR1S(=O)2R, в которой R1 представляет собой заместитель у аминогруппы,уже определнный для аминогрупп, и R представляет собой заместитель у сульфонаминогруппы, например, С 1-7 алкильную группу, С 3-20 гетероциклильную группу или C5-20 арильную группу, предпочтительно С 1-7 алкильную группу. Примеры сульфонаминогрупп включают, не ограничиваясь перечисляемыми,-NHS(=O)2CH3, -NHS(=O)2Ph и -N(CH3)S(=O)2C6H5. Как упоминалось выше, группы, составляющие список перечисленных групп, например, алкил, гетероциклил и арил, сами могут замещаться. Таким образом, вышеприведнные определения покрывают группы замещнных заместителей. Применение соединений лантибиотика типа В Настоящее изобретение предлагает применение лантибиотика типа В для лечения или профилактики у субъекта микробной инфекции, также предлагается применение лантибиотика типа В в производстве лекарственного средства для применения у субъекта в способе лечения или профилактики. Настоящее изобретение предлагает антибиотики типа В для лечения или профилактики у субъекта микробной инфекции нижнего отдела кишечника или толстой кишки. Настоящее изобретение также предлагает применение лантибиотика типа В в приготовлении лекарственного средства для лечения или профилактики у субъекта бактериальной инфекции нижнего отдела кишечника или толстой кишки. Лантибиотик типа В предпочтительно вводят орально. Для применения в способах согласно изобретению наиболее предпочтительными лантибиотиками типа В являются соединения актагардина формулы (I) и соединения мерсацидина формулы (II). Инфекция и заболевание Настоящее изобретение относится к применению соединения на основе лантибиотика типа В и его композиций по настоящему изобретению, вводимых субъекту для лечения или профилактики микробной инфекции. Соединения лантибиотика типа В можно вводить человеку или животному. Животное может быть млекопитающим или другим позвоночным. Термин "микробная инфекция " относится к инвазии патогенных микробов в организм хозяина животного происхождения. Он (термин) включает интенсивный рост количества микробов, по сравнению с обычно присутствующим их количеством в организме животного. В более общем плане микробной инфекцией может являться ситуация, при которой присутствие популяции(ий) микробов наносит вред хозяину животного происхождения. Таким образом, животное "страдает" от микробной инфекции, если избыточные количества популяции микробов присутствуют в теле или на теле животного, или если присутствие микробной популяции(ий) наносит вред клеткам или другим ткани животного. Настоящее изобретение также относится к лечению или профилактике инфекции Clostridium difficile, Helicobacter pylori или инфекции энтерококков резистентных к ванкомицину (VRE). Предпочтительно изобретение относится к инфекции Clostridium difficile. Настоящее изобретение также относится к лечению инфекции, неизлеченной другим активным соединением, предпочтительно соединением, не являющимся лантибиотиком типа В. Другое активное соединение может представлять собой ванкомицин. Если соединение лантибиотика типа В для применения в настоящем изобретении вводится инфицированному субъекту, не излеченному с применением другого активного соединения, лантибиотика типа В может вводиться через сутки, через неделю или один месяц, два месяца или три месяца после последнего введения другого активного соединения. Предпочтительно другое активное соединение представляет собой ванкомицин. Соединения и композиции также можно применять для системного лечения бактериемии (включая бактериемию, относящуюся к постановке катетера), пневмонии, инфекции кожи и кожных структур(включая инфекцию в месте хирургии), эндокардита и остеомиелита. Эти и другие способы лечения могут быть направлены против болезнетворных агентов, таких как стафилококки, стрептококки, энтерококки. Соединения или их композиции согласно изобретению также могут применяться для местного лечения кожных инфекций, то есть Propionibacterium acnes, включая угри. Соединения и их композиции также можно применять для лечения глазных инфекций, таких как конъюнктивит. Соединения также можно применять для лечения или предотвращения кожных инфекций в местах ран или ожогов. Кроме того, соединения и композиции, описанные в настоящей заявке на изобретение,можно применять в профилактических целях. Их можно применять у субъектов с риском инфекции (например у пациентов, поступающих в клинику) или у здоровых профессионалов или другого персонала по уходу при риске стать носителями таких инфекций. Наиболее предпочтительно соединения и композиции можно применять для лечения суперинфекции кишечника, такой как инфекция, вызываемая Clostridium difficile, включая полирезистентные С. difficile (псевдомембранозный колит). Соединение или композицию можно вводить орально. Также можно лечить инфекции кишечника, ассоциируемые с Helicobacter pylori. Настоящее изобретение также предлагает способ лечения CDAD. За полное излечение симптомовCDAD к концу лечения можно принять освобождение кишечника менее чем три раза в день (неважно сформировавшимся или несформировавшимся калом) при отсутствии ассоцируемой лихорадки, отсутствии повышенной концентрации лейкоцитов или боли в области живота. Фармацевтические композиции Соединения согласно настоящему изобретению, основанные на лантибиотиках, можно вводить в композиции с одним или более фармацевтически приемлемых ингредиентов, хорошо известных специалистам в данной области, включая, но не органичиваясь перечисляемыми, фармацевтически приемлемые носители, адъюванты, эксципиенты, разбавители, наполнители, буферные системы, консерванты, антиоксиданты, лубриканты, стабилизаторы, солюбилизаторы, сурфактанты (например, смачивающие агенты), маскирующие агенты, красители, ароматизаторы и подсластители. Композиция может дополнительно содержать другие активные агенты, например, другие терапевтические или профилактические агенты. Так, настоящее соединение дополнительно предлагает фармацевтические композиции, определнные выше и способы изготовления фармацевтической композиции путм смешивания по меньшей мере одного активного соединения, определнного выше, с одним или более других фармацевтически приемлемых ингредиентов, хорошо известных специалистам в данной области, например, носителей, адъювантов,эксципиентов, и так далее. При введении в рецептуру в виде дискретных единиц (например, таблеток, и так далее) каждая единица содержит заранее определнное количество (дозу) активного соединения. Термин "фармацевтически приемлемый", применяемый в настоящей заявке, относится к соединениям, ингредиентам, материалам, композициям, лекарственнным формам, и так далее, которые находятся в пределах компетенции медицинской сферы, пригодным к применению в контакте с тканями рассматриваемого субъекта (например, человека) не обладающим чрезмерной токсичностью, раздражающим действием, аллергической реакцией или другой проблемой или осложнением, сопоставимым с разумным отношением польза/риск. Каждый носитель, адъювант, эксципиент, и так далее, также должен быть "приемлемым" в смысле совместимости с другими ингредиентами композиции. Рецептура композиций может быть пригодной для любого приемлемого способа и средства введения. Фармацевтически приемлемые носители или разбавители включают применяющиеся в композициях, пригодных для орального; ректального, назального локального (включая буккальное и подъязычное),вагинального, парентерального (включая подкожное, внутримышечное, внутивенное, интрадермальное интратекальное, эпидуральное) введения. Композиции могут быть удобно представлены в единичной лекарственной форме и могут быть приготовлены любым способом, известным специалистам в фармацевтике. Такие способы включают стадию приведения в контакт активного ингредиента с носителем,который содержит один или более вспомогательных ингредиентов. В целом композиции приготавливают равномерным и тесным приведением в контакт активного ингредиента с жидкими носителями или тонкоизмельчнными тврдыми носителями или теми и другими, и затем, при необходимости формования продукта. В тврдых композициях можно применять традиционные нетоксичные тврдые носители, например, маннитол, лактозу, целлюлозу, производные целлюлозы, крахмал, стеарат магния, сахаринат натрия,- 21021628 тальк, глюкозу, сахарозу, карбонат магния, и тому подобное, все они - фармацевтического качества. Вышеуказанное активное соединение может быть введено в композицию в виде суппозиториев, применяя в качестве носителя, например, полиалкиленгликоли, ацетилированные триглицериды и тому подобное. Жидкие фармацевтические композиции, пригодные для введения могут быть, например, изготовлены растворением, диспергированием, и так далее, определнного выше активного соединения и при необходимости фармацевтических адъювантов в носителе, таких, например, как вода, водный физиологический раствор декстрозы, глицерин, этанол, и тому подобное, формируя таким образом раствор или суспензию. При необходимости, фармацевтическая композиция, предназначенная к введению, может также содержать незначительные количества нетоксичных вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, буферные агенты для доведения рН, и тому подобное, например, ацетат натрия,монолаурат сорбита, натриевая соль триэтаноламиноацетата, триэтаноламиноолеат, и так далее. Существующие способы приготовления таких лекарственных форм известны, или станут очевидными специалистам в данной области; например, смотри "Remington: The Science and Practice of Pharmacy, 20th Edition,2000, pub. Lippincott, WilliamsWilkins. Композиция или рецептура, предназначенные к введению, будут, в любом случае, содержать количество активного соединения(ий) в количестве эффективном для смягчения симптомов субъекта, которого лечат. Могут быть приготовлены лекарственные формы или композиции, содержащие активный ингредиент в диапазоне от 0,25 до 95%, добавляя для баланса нетоксичный носитель. Для орального введения, предпочтительного способа введения, формируют фармацевтически приемлемую нетоксичную композицию посредством добавления нормально употребляемых эксципиентов,таких например как, маннитол, лактоза, целлюлоза, производные целлюлозы, кросскармелллоза натрия,крахмал, стеарат магния, сахаринат натрия, тальк, глюкоза, сахароза, карбонат магния, и тому подобное все компоненты фармацевтическго качества. Такие композиции принимают форму растворов, суспензий,таблеток, пилюль, капсул, порошков, рецептур замедленного высвобождения и тому подобное. Такие композиции могут содержать 1-95% активного ингредиента, более предпочтительно 2-50%, наиболее предпочтительно 5-8%. При парентеральном введении обычно проводят инъекцию, либо подкожную, либо внутремышечную, или внутривенную. Инъекционные формы могут быть приготовлены в традиционном виде, либо жидких растворов, либо суспензий, тврдых форм, пригодных для растворения или суспендирования в жидкости перед инъекцией или в виде эмульсий. Дополнительно, если желательно вводимые фармацевтические композиции могут также содержать незначительные количества нетоксичных вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, агенты для доведения рН и тому подобное, таких как например, ацетат натрия, монолаурат сорбита, триэтаноламиноолеат, натриевая соль триэтаноламиноацетата и так далее. Для местного применения рецептура фармацевтически приемлемых композиций может быть создана в виде подходящей мази или геля, содержащих активный компонент, суспендированный или растворнный в одном или более носителей. Носители для местного введения соединений по данному изобретению включают, не ограничиваясь перечисляемыми, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропиленовое соединение, эмульгирующий парафин и воду. Альтернативно, рецептура фармацевтически приемлемой композиции может быть создана в виде подходящего лосьона или крема, содржащего активные компоненты, суспендированные или растворнные в одном или более фармацевтически приемлемом носителе. Подходящие носители включают, не ограничиваясь перечисляемыми, минеральное масло, моностеарат сорбита, полисорбат 60, цетиловые эфиры парафина, цетеариловый спирт, 2-октилдодеканол, бензиновый спирт и воду. Процентное содержание активного соединения, содержащегося в такой парентеральной или локальной композиции сильно зависит от его конкретной природы, а также от активности соединения и потребностей субъекта. Однако, процентные содержания активного ингредиента от 0,1 до 10% мас./мас. употребимы, и будут выше, если композиция является тврдой и будет впоследствии разбавлена до вышеупомянутых процентных содержаний. Предпочтительно в растворе будет содержаться от 0,2-2% мас./мас. активного агента в растворе. Другие композиции для применения согласно изобретению включают рецептуры для отложенного высвобождения, в которых лантибиотик типа В вводят в композицию, так чтобы позволить специфическую доставку в тонкий и толстый кишечник и более предпочтительно в толстый кишечник. Это может достигаться применением рецептур с отложенным высвобождением. В данной области техники известно много примов для создания композиций соединений с отложенным высвобождением, из которых активный ингредиент первоначально высвобождается в толстой кишке. В целом, такие примы заключаются в защите активного ингредиента от среды желудка и кишечника посредством одного или более покрытий. Например, в Европейском Патенте ЕР-0572942, содержание которого вводится в настоящую заявку посредством ссылки, описывается композиция с отложенным высвобождением, содержащая ядро, содержащее активный ингредиент при необходимости в сочетании с одним или более эксципиентом, покрытое промежуточным слоем, который тормозит высвобождение ингредиента независимо от рН и внешним слоем, растворяющимся со скоростью, зависимой от рН. Внешний слой представляет собой полимер, такой как ацетофталат целлюлозы ацетаттерефталат целлюлозы, тримеллитатацетат целлюлозы, фталат гидроксипропилметилцеллюлозы, поливинилфталат,полиакрилат или полиметакрилат. Покрытие малорастворимо или нерастворимо при значениях рН менее 5, но растворимо при более нейтральных или щелочных значениях рН, например рН 7,5 или выше. Это покрытие предохраняет активный ингедиент при его прохождении через желудок и кишечник. Промежуточным слоем будет являться материал, такой как гидрофобный гельобразующий полимер, типа метилцеллюлозы, карбоксиметилцеллюлозыа, гидроксипропилметилцеллюлозы, поливиниловых спиртов, полисахаридов и тому подобное. Альтернативный подход описан в WO 91/07949, в котором также применяется два защитных слоя. Согласно этому источнику промежуточным слоем является аморфная амилоза, такая как стеклообразная или каучукоподобная амилоза. Этот слой разрушается действием ферментов микрофлоры толстой кишки. Для защиты амилозного слоя добавляется внешний слой из плнки, формируемой целлюлозным материалом или акриловым полимерным материалом. Этот внешний слой растворяется независимо от значения рН. Амилоза предпочтительно представляет собой стеклообразную амилозу с температурой стеклования, Tg, не менее 17 С, предпочтительно не менее 30 С и молекулярной массой по меньшей мере 20000, например, по меньшей мере 100000 Да. Плнкообразующая целлюлоза может являться, например, натриевой солью карбоксиметилцеллюлозы, карбоксиметилнатриевыми солями 1-гидроксиэтилцеллюлозы, 2-гидроксицеллюлозы, 2 гидроксипропилцеллюлозы, метилцеллюлозы и тому подобное, предпочтительно с молекулярной массой в диапазоне от 420000 до 280000 Да. Акриловые полимерные материалы включают их акрилатные и метакрилатные полимеры и сополимеры, предпочтительно в диапазоне молекулярных масс от 15000 до 250000 Да. Согласно WO 91/07949, содержание которой полностью включено в настоящую заявку посредством ссылки, покрытие амилозой может иметь толщину от 5 до 50 мкм вокруг ядра, например, в виде сферы 1 мм с активным ингредиентом, внешнее покрытие также может иметь размер в том же диапазоне. Также описываются покрытия, содержащие смесь амилозы и плнкообразующего материала. Композиции с отложенным высвобождением согласно изобретению, включая вышеописанные, дадут при необходимость высвобождения в толстой кишке значительного количества активного ингредиента (например по меньшей мере 50% от общего количества высвобождающегося в организме из каждой лекарственной формы). Например, композиция с отложенным высвобождением после 3 ч инкубации с 0,1 н HCl при 20 С должна показывать менее 20%, предпочтительно менее 10% высвобождения активного ингредиента, но более 50%, предпочтительно более 75% высвобождения активного ингредиента в течение 24 ч при значениях рН 7,0 или выше (например, 7,5) и/или при экспозиции к анаэробной микробной биологической переработке фекальной микрофлорой (например, применяя условия биологической переработки, описанные в Примере 4(d) WO 91/07949). Следует принять во внимание, что состав фармацевтической композиции меняется при проходе через желудочно-кишечный тракт. Например, согласно планируемому механизму доставки может понижаться содержание ароматизаторов. Дополнительные руководящие материалы, касающиеся приемлемых носителей, адъювантов, эксципиентов и так далее можно найти в стандартных руководствах по фармакологии, например, "Remington: The Science and Practice of Pharmacy, 20th Edition, 2000, pub. Lippincott, WilliamsWilkins; и Handbook of Pharmaceutical Excipients, 2nd edition, 1994. Введение и доставка к месту действия Соединения, описанные в настоящей заявке, могут вводиться внутрь (орально), парентерально(внутримышечно или внутривенно), ректально, в нос, вагинально или локально (местно). Их можно вводить в виде растворов, порошков (таблеток, капсул, включая микрокапсулы), мазей (кремов или гелей) или суппозиториев. Допустимыми вспомогательными веществами для таких композиций являются общепринятые в фармации жидкие или тврдые наполнители и модифицирующие агенты, растворители,эмульгаторы, лубрикаторы, вкусовые добавки, красители и/или буферные вещества. Соединения и композиции, описанные в настоящей заявке, предпочтительно вводят орально. Без упоминания деталей соединения или фармацевтические композиции, вводимые орально, из ротовой полости могут поступать в пищевод и затем в желудок. Из желудка соединения или фармацевтические композиции могут переводиться в тонкий кишечник и затем в толстый кишечник, который включает в себя толстую кишку. Лантибиотики типа В для применения в способах по настоящему изобретению могут являться устойчивыми в каждом из этих отделов желудочно-кишечного тракта. Допускается применение лантибиотиков типа В согласно изобретению для лечения инфекции толстой кишки, в особенности инфекции С. difficile. Толстая кишка представляет собой отдел большого кишечника, простирающийся от слепой кишки до заднего прохода. Лантибиотики типа В, описанные в настоящей заявке, их производные и варианты, при необходимости более устойчивы к разрушающим ферментам, таким ка те, которые находятся в желудочнокишечном тракте, по сравнению с антибиотиками, такими как низин. Соединения, описанные в настоя- 23021628 щей заявке, могут обладать повышенной устойчивостью к панкреатину. Упоминание панкреатина является упоминанием смеси одного или более пищеварительных ферментов, продуцируемых клетками поджелудочной железы. Панкреатин обычно содержит одну или более протеаз, липазу и амилазу. Панкреатин может содержать один или более фермент из групп трипсина (образующегося в поджелудочной железе в виде трипсиногена) и химотрипсина (образующегося в поджелудочной железе в виде химотрипсиногена). Если способы согласно изобретению относятся к применению панкреатина in vitro, допускается применение в качестве его источника панкреатина человека или животного, например свиньи (панкреатин свиньи). Поэтому изобретение предлагает способ лечения или профилактики у субъекта микробной инфекции, включающий введение субъекту лантибиотика типа В, при котором лантибиотик типа В впоследствие экспонируется к среде, содержащей панкреатин, такой как среда кишечного сока. В дополнение к ферментам панкреатина в среде кишечного сока могут содежаться другие разрушающие ферменты. Лантибиотики типа В для применения согласно изобретению могут являться устойчивыми в желудочном соке. Устойчивость может быть определена по отношению к доле от общего количества лантибиотика типа В, извлекаемого из имитации желудочного сока после экспозиции к нему в течение по меньшей мере 15 мин, по меньшей мере 30 мин, по меньшей мере 60 мин, по меньшей мере 120 мин или по меньшей мере 180 мин. При необходимости извлечение устойчивого лантибиотика типа В, обработанного имитацией желудочного сока, в доле от общего количества от экспонированного количества по меньшей мере 80 мол.%, по меньшей мере 90 мол.%, по меньшей мере 95 мол.% или по меньшей мере 99 мол.%. Дополнительно или альтернативно устойчивость можно определить по отношению к активности лантибиотика типа В против стандартного микроорганизма до и после экспонирования к желудочному соку. Допусается применение в качестве микрорганизма М. Leutus. Устойчивые лантибиотики типа В,извлечнные из жидкой среды могут сохранять по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99% активности, сравнительно с лантибиотиком типа В до экспонирования. Допускается применение в качестве модели желудочного сока имитации желудочного сока или экстракта из желудочно-кишечного тракта. Соединения для применения согласно изобретению могут оказаться устойчивыми по отношению к среде кишечного сока. Устойчивость может быть определена по отношению к доле от общего количества лантибиотика типа В, извлекаемого из имитации кишечного сока после экспозиции к нему в течение по меньшей мере 15 мин, по меньшей мере 30 мин, по меньшей мере 60 мин, по меньшей мере 120 мин или по меньшей мере 180 мин. При необходимости извлечение устойчивого лантибиотика типа В, обработанного имитацией кишечного сока, в доле от общего количества от экспонированного количества по меньшей мере 80 мол.%, по меньшей мере 90 мол.%, по меньшей мере 95 мол.% или по меньшей мере 99 мол.%. Дополнительно или альтернативно устойчивость можно определить по отношению к активности лантибиотика типа В против стандартного микроорганизма до и после экспонирования к кишечному соку. Допусается применение в качестве микорорганизма М. Leutus. Устойчивые лантибиотики типа В могут извлекаться из текучей среды, сохраняя по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, или по меньшей мере 99% активности по сравнению с лантибиотиком типа В до экспозиции. Допускается применение в качестве модели кишечного сока имитации кишечного сока или экстракта из желудочно-кишечного тракта. При оральном введении соединения лантибиотиков типа В для применения согласно изобретению предпочтительно незначительно абсорбируются или метаболизируют в желудочно-кишечном тракте субъекта. В частности соединения не должны абсорбироваться или метаболизировать в желудке и тонком кишечнике субъекта. Устойчивость лантибиотиков типа В, описанных в настоящей заявке, к ферментативному разсщеплению кишечным соком весьма высокая. Как обсуждалось выше, соединения, такие как низин, неустойчивы в кишечном соке, требуют тщательного подбора композиции, чтобы обеспечить отсутствие расщепления во время доставки к месту действия и в месте действия. Выбор времени Оптимальное время, необходимое для лечения инфекции, колеблется от одних суток до одного года, лечение может проводиться несколько недель или месяцев, или даже, если необходимо, в течение продолжительности жизни индивидуального пациента. Например, продолжительность лечения может составлять по меньшей мере 5 суток, по меньшей мере 10 суток, по меньшей мере 30 суток, по меньшей мере 45 суток, по меньшей мере 90 суток или по меньшей мере 180 суток. В конечном счете, наиболее желательно продолжать лечение столько времени, сколько требуется для прекращения обнаружения неразмножающихся форм бактерий. Если необходимо введение соединения или композиции можно повторять. Соединения или композиции можно вводить один, два, три, четыре или пять раз в сутки. Альтернативно введение может повторяться один раз в сутки, на вторые или на третьи сутки или один раз в неделю. При необходимости в те- 24021628 чение курса лечения режим лечения, выбор времени или частота введения могут меняться. При внутривенном введении дозы соединения или его композиции, его можно вводить с интервалом от 4 до 24 ч, от 8 до 24 ч или от 15 до 24 ч. Доза может вводиться внутривенной инфузией за 2, 4, 5,6, 7, 8, 9, 10, 12, 14, 20, 24, 48 или 72-часовой период. Критерием при выборе адекватной дозы и графика введения, как было определено выше, является полученный результат. Например, для лечения бактериальной инфекции первоначально могут потребоваться относительно более высокие дозы. Последующая доза может быть выше предыдущей. Для получения оптимальных результатов соединения обычно вводят как можно скорее после появления первых признаков, постановки диагноза, внешних признаков или возникновения инфекции или во время ремиссии инфекции. Дозировка При лечении или профилактике субъекта этому субъекту вводится эффективное количество соединения или композиции. Под "эффективным" количеством авторы изобретения подразумевают количество активного ингредиента, требуемое для лечения или предотвращения инфекции или заболевания, связываемого с инфекцией. Эффективное количество соединения, применяемого согласно изобретению для терпапевтического или профилактического лечения состояний, обусловленных или привносимых микробной инфекцией,изменяется в зависимости от способа введения, возраста, массы тела и общего состояния здоровья субъекта. В конце концов лечащий врач установит адекватное количество и режим введения. Именно такое количество считают "эффективным" количеством. Эффективное количество вводимого соединения в конце концов будет на усмотрении врача, принимая во внимание тяжесть заболевания конкретного субъекта (например, пациента человека или экспериментального животного) и общее состояние субъекта. Типично адекватные диапазоны доз будут составлять 0,1-1000 мг/кг, например, от 0,2 до 100 мг/кг или от 1 до 50 мг/кг или от 5 до 25 мг/кг, причм типично вводимые дозы будут такими, какие сочтт уместными врач. Целесообразно вводить их в единичных дозах, которые содержат по меньшей мере эффективное ежедневное количество соединений согласно изобретению, например, 30-3000, предпочтительно 50-1000 мг. Предпочтительно эффективное количество вводимого соединения составляет от около 100 до около 2000 мг на пациента в сутки. Токсичность и терапевтическую эффективность таких соединений можно определять при биологических испытаниях или у экспериментальных животных с помощью стандартных фармацевтических процедур, например, определяя LD50 (дозу, летальную для 50% контингента популяции) и ED50 (дозу терапевтически эффективную у 50% контингента популяции). Соотношение доз между токсичным и терапевтическими эффектами представляет собой терапевтический индекс, выражаемый как отношениеLD50/ED50. ДЛЯ применения согласно изобретению предпочтительны соединения с большими терапевтическеими индексами. Хотя допускается применение соединений, выказывающих токсичные побочные эффекты, при разработке системы доставки, направляющей такие соединения к месту действия на ткань,следует проявлять осторожность, чтобы минимизировать потенциальный вред неинфицированным клеткам и тем самым уменьшить побочные эффекты. Для выяснения диапазона доз у человека могут применяться данные полученные при испытаниях или в исследованиях у животных. Дозировка таких соединений предпочтительно находится в диапазоне концентраций в кровотоке, обеспечивающих ED50 при малой токсичности или е отсутствии. Дозы могут варьироваться в этом диапазоне в зависимости от применяемой лекарственной формы и способа введения. Для любого соединения, применяемого в способе согласно изобретению, первоначально терапевтически эффективная доза может быть установлена из биологических испытаний и исследований у животных. Такую информацию можно применять для более точного определения полезных доз у человека. Следует принять во внимание, что доза может приспосабливаться в зависимости от типа композиции, применяемой для доставки соединения к месту действия, степени инфекции, тяжести заболевания, а также времени прохода продукта через кишечник, на которое будет оказывать влияние степень диареи у субъекта, если она имеет место. Контингент пациентов Настоящее изобретение также предлагает способ лечения или профилактики микробной инфекции нижнего отдела кишечника или толстой кишки у субъекта, причм данный способ включает введению субъекту лантибиотика типа В, при том что субъект входит в состав выбранного контингента пациентов. Допускается введение в контингент субъекта с микробной инфекцией, резистентной к конкретному активному агенту. Предпочтительно микробная инфекция резистентна к лечению ванкомицином. Субъект может быть инфицирован микробной инфекцией резистентной к лечению активным агентом, не являющимся лантибиотиком типа В. Предпочтительно субъект является субъектом, получавшим активный агент по меньшей мере за 1,2, 24 ч, 2, 3 суток, 1 неделю, 2 недели, 1, 2 или 3 месяца до начала лечения лантибиотиком типа В. Предпочтительно, чтобы субъект получал активный агент за по меньшей мере 1 или 2 месяца до начала лечения лантибиотиком типа В. Совместное введение Композиции для применения согласно изобретению также могут содержать второй активный агент,включающий соединение, отличное от соединения лантибиотика типа В, другой антимикробный агент или другой агент, направленный на лечение вторичного симптома или причины излечиваемого состояния. Введение второго активного агента может позволить более эффективное применение лантибиотика типа В, если второй активный агент вводят совместно с лантибиотиком типа В. Предпочтительно в композицию не включают дополнительный активный агент, проявляющий активность против организмов, доминирующих во флоре кишечника в условиях нормального здорового организма, особенно Bifidobacterium spp и Bacteroides spp. В одном варианте реализации второй активный агент представляет собой толевамар (GT160-246). Толевамар связывает цитотоксины А/В, выделяемые С. difficile, также его ассоциируют с восстановлением компонентов анаэробной микрофлоры кишечника, поврежднной лечением диареи, обусловленной С.Diseases, Prague Congress Centre, Prague, Czech Republic, May 1-4, 2004). В сочетании с соединениями для применения в настоящем изобретении могут применяться различные антибактериальные агенты. Последние включают хинолоны, тетрациклины, гликопептиды, аминоглюкозиды, -лактамы, рифамицины, коумермицины, макролиды, кетолиды, азалиды и хлоамфеникол. В конкретных вариантах реализации представителем антибиотиков вышеназванных классов могут, например, быть один из следующих:DV-7751a. Тетрациклины: хлортетрациклин, демеклоциклин, доксициклин, лимециклин, метациклин, миноциклин, окситетрациклин и тетрациклин. Гликопептиды: ванкомицин и его производные. Аминогликозиды: амикацин, арбекацин, бутирозин, дибекацин, фортимицины, гентамицин, канамицин, меомицин, нетилмицин, рибостамицин, сизомицин, спектомицин, стрептомицин, тобрамицин,клиндамицин и линкомицин. Рифамицины: рифамицин SV, рифамицин О, рифабутин, рифампицин, рифампин и рифализил. Вместо второго антибактериального агента композиция может содержать второй агент, предназначенный для лечения дополнительного симптома или причины состояния, излечиваемого вариантом мерсацидина. Например, композиция может содержать анальгетик, например, нестероидное противовоспалительное соединение. В частности, если композиция является композицией для лечения кожных инфекций композиция может содержать дерматологический агент, такой как стероид для лечения воспаления кожи. Другие агенты, которые могли бы быть полезными включают ретиноиды, бактерицидные агенты,такие как пероксид бензоила и противогрибковые препараты. Согласно этим аспектам изобретения соединения, намеченные в комбинацию со вторым активным агентом, могут представлять собой любое из соединений, показанных выше для применения согласно изобретению, включая актагардин, N-[2-этаноламино]дезоксиактагардин В, мерсацидин и мерсацидинF3W. Допускается одновременное, раздельное или последовательное введение второго активного агента. Принимают, что при "одновременном" введении лантибиотик типа В и второй активный агент вводятся субъекту одним примом и одинаковым способом введения. Принимают, что при "раздельном" введении лантибиотик типа В и второй активный агент одновременно вводятся субъекту двумя различными способами введения. Это может осуществляться, например,если один агент вводят инфузией, а другой во время инфузии применяют орально. Принимают, что при "последовательном" введении два агента вводят в различные моменты времени, при условии, что первый введнный агент присутствует в субъекте и проявляет в нм активность в момент введения второго агента. Например, первым можно вводить лантибиотик типа В, таким образом,чтобы он уменьшил у субъекта микробную инфекцию к моменту введения второго активного агента. Альтернативно сначала можно вводить второй активный агент. В целом, при последовательном введении второй из двух агентов вводят в пределах 48 ч, предпочтительно в пределах 24 ч, например в пределах 12, 6, 4, 2 или 1 ч после введения первого агента. Агенты вводят в композицию в соответствии с желаемым способом их введения. Агент или фармацевтическая композиция, содержащая агент, может вводиться субъекту любым подходящим способом введения, будь то системно, периферически или местно (то есть в месте желаемого действия). Способы приготовления соединений согласно изобретению Эксперимент по синтезу соединений лантибиотиков типа В Приготовление серии соединений лантибиотиков типа В в деталях описано ниже. Исходные лантибиотики, такие как актагардин, были получены в соответствии с методиками описанными выше для этих соединений. Актагардин Были приготовлены следующие соединения актагардина, в которых группы Х 1, Х 2, Z и X представляли собой следующие группы: Были также приготовлены следующие соединения, в которых материнский лантибиотик и группы Х 1, Х 2, Z и X представляли собой следующие группы: Звздочка указывает на положение присоединения атома азота к остатку аланина амидной связью в положении 19. В случае, когда группа Z представляет собой остаток аминокислоты, будет понятно что эта группировка представляет собой аминокислоту, которую в данной области техники принято изображать как Хаа(0), связанную амидной связью с аминокислотой в положении 1. Приготовление соединений VI-XIII, XXIII и от L до LIII Общая методика 1. К раствору лантиобиотика (например, актагардина, актагардина В, или дезоксиактагардина В) (200 мг, 108 нмоль), подходящего аминоспирта (330 нмоль) и диизопропилэтиламина (410 нмоль) в сухом диметилформамиде (2 мл) порциями добавляли раствор гексафторфосфата бензотриазол-1-ил-окси-триспирролидинофосфония (РуВор) (125 мг, 258 нмоль) в сухом диметилформамиде (1,5 мл). Для отслеживания хода реакции смесь анализировали посредством ВЭЖХ, добавляя дополнительные аликвоты раствора РуВор до полного расходования исходного материала. Анализ посредством ВЭЖХ на этой стадии также показал присутствие различных количеств (5-20%) диамида. После завершения реакции смесь разбавляли 30% ацетонитрилом в 20 мМ Kpi (фосфат калия) водного фосфатного буфера, рН 7 (10 мл) и моноамид очищали посредством препаративной ВЭЖХ в условиях, представленных в таблице 1 Нужные фракции концентрировали до 25% их первоначального объма и удаляли соли нанесением на предварительно кондиционированную колонку С 18 Bond Elut (500 мг), которую затем промывали последовательно элюируя двумя свободными объмами колонки 30, 40, 70 и 90% водного метанола. После упаривания соответствующих фракций целевые продукты были получены в виде белых тврдых веществ. Образцы анализировали посредством ЖХ-МС в условиях, описанных ниже. Соединение VI: актагардин N-[2-этаноламино]монокарбоксамид Было получено сочетанием дезоксиактагардина В и этаноламина по общей методике 1. Выход 11 мг, 53%. [М+2 Н 2+] рассчитано 966,5, обнаружено 966,1. Соединение VII: дезоксиактагардин N-[2-этаноламин]монокарбоксамид Было получено сочетанием дезоксиактагардина В и этаноламина по общей методике 1. Выход 18 мг, 85% Выход. [М+2 Н 2+] рассчитано 979,0, обнаружено 980,2. Соединение VIII: дезоксиактагардин В N-[4-бутаноламин]монокарбоксамид Было получено сочетанием дезоксиактагардина В и бутаноламина по общей методике 1. Выход 9 мг, 43%. [М+2 Н 2+] рассчитано 972,50, обнаружено 979,9.2. Соединение IX: дезоксиактагардин В (3-амино-1,2-пропандиол)монокарбоксамид Было получено сочетанием дезоксиактагардина В и 3-амино-1,2-пропандиола по общей методике 1. Выход 18 мг, 87%. [М+2 Н 2+] рассчитано 973,5.0, обнаружено 973,9. Соединение X: дезоксиактагардин В (2-амино-1,3-пропанол)монокарбоксамид Было получено сочетанием дезоксиактагардина В и 2-амино-1,3-пропанола по общей методике 1. Выход 20 мг, 96%. [М+2 Н 2+] рассчитано 973.5, обнаружено 973.9. Соединение XI: дезоксиактагардин В [трис (гидроксиметил)метиламино] монокарбоксамид Было получено сочетанием дезоксиактагардина В и трис (гидроксиметил)метиламина по общей методике 1. Выход 13 мг, 69%. [М+2 Н 2+] рассчитано 988,5, обнаружено 988,6. Соединение XII: дезоксиактагардин В (1-амино-2-пропанол)монокарбоксамид Было получено сочетанием дезоксиактагардина В и 1-амино-2-пропанола по общей методике 1. Выход 16 мг, 78%. [М+2 Н 2+] рассчитано 965,5, обнаружено 965,6. Соединение XIII: дезоксиактагардин В (1-амино-3-пропанол)монокарбоксамид Было получено сочетанием дезоксиактагардина В и 1-амино-3-пропанола по общей методике 1. Выход 19 мг, 87%. [М+2 Н 2+] рассчитано 965,5, обнаружено 965,3. Соединение XX: дезоксиактагардин В N-[2-гидрокси-2-фенилэтиламино]монокарбоксамид Было получено сочетанием дезоксиактагардина В и N-[2-гидрокси-2-фенилэтиламина] по общей методике 1. [М+2 Н 2+] рассчитано 995,5, обнаружено 995,8. Соединение XXI: дезоксиактагардина В (метиловый эфир L-серин)монокарбоксамид Было получено сочетанием дезоксиактагардина В и метилового эфира L-серина по общей методике 1. [М+2 Н 2+] рассчитано 987,5, обнаружено 986,9. Соединение XXII: дезоксиактагардин В (N-(2-гидроксиэтил)этилендиамино)монокарбоксамид Было получено сочетанием дезоксиактагардина В и N-(2-гидроксиэтил)этилендиамина по общей методике 1. [М+2H 2+] рассчитано 980, обнаружено 979,8. Соединение XXIII: дезоксиактагардин В (2-Гидоксипиперазино)монокарбоксамид Было получено сочетанием дезоксиактагардина В и 2-гидроксипиперазина по общей методике 1.[М+2 Н 2+] рассчитано 978,5, обнаружено 977,7. Приготовление соединений XIV-XXI и LX-LXVI Общая методика 2 на примере дезоксиактагардина В (L)-триптофанип-(0) N-(9 флуоренилметоксикарбонил)триптофан-О-пентафторфениловый эфир (80 мг, 135 нмоль) добавляли к раствору 1-гидроксибензотриазола гидрата (18 мг, 135 нмоль) в сухом диметилформамиде (1 мл). Затем смесь добавляли к раствору дезоксиактагардина В (50 мг, 27 нмоль) в сухом диметилформамиде (0,5 мл). Смесь оставляли на 15 мин при комнатной температуре, по истечении этого времени весь исходный материал был израсходован. Добавляли воду (0,05 мл) и пиперидин (0,1 мл) и смесь оставляли на один час при комнатной температуре. Реакционную смесь разбавляли в 30% водном метаноле и полученную суспензию белого цвета наносили на микроколонку для твердофазной экстракции, содержащую 1 г тврдой фазы С 18. Материал элюировали фракциями 40, 50, 60 и 70% водного метанола. 60%-ную фракцию упаривали досуха с образованием тврдого вещества кремового цвета. Выход равен 35 мг (63%). [М+2 Н 2+] рассчитано 1030,0, обнаружено 1030,1. Соединение XV: (L)-триптофанил-(0)-дезоксиактагардин В (этаноламино)монокарбоксамид Было получено сочетанием (L)-триптофанил-(0)-дезоксиактагардина В (50 мг) и этаноламина по общей методике 1. Выход 23 мг, 45%. [М+2H 2+] рассчитано 1051,5, обнаружено 1051,8.(L)-Фенилаланил-(0)-дезоксиактагардин В Было получено сочетанием дезоксиактагардина В и N-(9-флуоренилметоксикарбонил)фенилаланинО-пентафторфенилового эфира по общей методике 2 2. Выход 65%. [М+2 Н 2+] рассчитано 1010,5, обнаружено 1011,0. Соединение XIV: (L)-Фенилаланил-(0)-дезоксиактагардин В (этаноламино) монокарбоксамид Было получено сочетанием (L)-фенилаланил-(0)-дезоксиактагардин В (50 мг) и этаноламина по общей методике 1. Выход 23 мг, 45%. [М+2 Н 2+] рассчитано 1032,0, обнаружено 1032,2. Приготовление соединений XXIV-XXX Синтез данных соединений проводился по ранее описанной авторами методике. Так к раствору дезоксиактагардина В) (20 мг, 11 нмоль), соответствующего амина (11 нмоль) и диизопропилэтиламина (7,2 мкл, 70 нмоль) в сухом диметилформамиде (0,8 мл) порциями добавляли 200 мкл раствора гексафторфосфата бензотриазол-1-ил-окси-трис-пирролидинофосфония (РуВор) (70 мг,134 нмоль) в сухом диметилформамиде (1,0 мл). Для отслеживания хода реакции смесь анализировали посредством ВЭЖХ, добавляя дополнительные аликвоты раствора РуВор до полного расходования исходного материала. Анализ посредством ВЭЖХ на этой стадии также показал присутствие различных количеств (5-20%) диамида. После завершения реакции смесь разбавляли 30% ацетонитрилом в 20 мМKpi (фосфат калия) водного фосфатного буфера, рН 7 (10 мл) и моноамид очищали посредством препаративной ВЭЖХ в условиях, представленных в табл. 4. Нужные фракции концентрировали до 25% их первоначального объма и удаляли соли нанесением на предварительно кондиционированную колонку С 18 Bond Elut (500 мг) которую затем промывали последовательно элюируя двумя свободными объма- 29
МПК / Метки
МПК: A61P 31/04, A61P 1/12, A61K 38/16
Метки: актагардина, применение, лечения, инфекции, clostridium, профилактики, соединения, диффициле
Код ссылки
<a href="https://eas.patents.su/30-21628-soedineniya-aktagardina-i-ih-primenenie-dlya-lecheniya-ili-profilaktiki-infekcii-clostridium-difficile.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения актагардина и их применение для лечения или профилактики инфекции clostridium difficile</a>
Предыдущий патент: Производные 4-(метиламинофенокси)пиридин-3-илбензамида для лечения рака
Следующий патент: Микроэлементная добавка в кормовые смеси для животных и птицы в биодоступной форме
Случайный патент: Мускульные движители пловца












