Производные пиразинона как стимуляторы секреции инсулина, способы их получения и их применение для лечения диабетов
Номер патента: 21325
Опубликовано: 29.05.2015
Авторы: Боттон Жерар, Кегоат Мишлине, Шарон Кристине, Эльбаваб Самер
Формула / Реферат
1. Соединение общей формулы (I)

где n=2;
R1 выбран из (С1-С6)алкила, (С2-С5)алкенила или (С2-С5)алкинила;
R2 представляет собой водород;
R3 выбран из водорода, галогена или (С6-С14)арила, где арил, возможно, замещен одним или более заместителями Y;
R4 выбран из (С6-С14)арил(С1-С6)алкила, который, возможно, замещен одним или более заместителями Y;
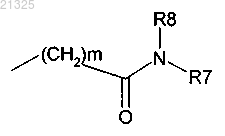
где m=1-6;
R7 и R8 вместе с атомом азота, к которому они присоединены, образуют гетероцикл; гетероцикл может включать один гетероатом, выбранный из N, О и S;
Y выбран из гидроксигруппы, тиогруппы, галогена, цианогруппы, трифторметоксигруппы, трифторметила, карбоксигруппы, карбоксиметила, карбоксиэтила, (С1-С6)алкила, (С1-С6)алкоксигруппы, (С1-С6)алкиламиногруппы, (С6-С14)арила, (С6-С14)арилсульфинил(С1-С6)алкила, (С6-С14)арилоксигруппы, (С6-С14)арил(С1-С6)алкоксигруппы, аминогруппы, азидогруппы, нитрогруппы, гуанидиногруппы, амидиногруппы, фосфоногруппы, оксогруппы, карбамоила, (С1-С6)алкилсульфонила, (С1-С6)алкилсульфинила или (С1-С6)алкилтиогруппы или две Y группы могут образовывать метилендиоксигруппу;
где термин "гетероарил" относится к 5-14-членному гетероарилу, содержащему от 1 до 4 гетероатомов, выбранных из N, О и S;
термин "гетероцикл" относится к пиперидину, морфолину, пиперазину, пирролидину, тиазолидину, оксазолидину, пиразолидину, изоксазолидину или имидазолидину;
и его рацемические формы, энантиомеры, диастереомеры и их смеси, и его фармацевтически приемлемые соли.
2. Соединение по п.1,
где n=2;
R1 представляет собой (С1-С6)алкил;
R2 представляет собой водород;
R3 выбран из водорода, галогена или (С6-С14)арила, где (С6-С14)арил, возможно, замещен одним или более заместителями Y;
R4 выбран из (С6-С14)арил(С1-С6)алкила, который, возможно, замещен одним или более заместителями Y;
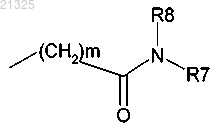
где m=1-6;
R7 и R8 вместе с атомом азота, к которому они присоединены, образуют гетероцикл; гетероцикл может включать один гетероатом, выбранный из N, О и S;
Y выбран из гидроксигруппы, тиогруппы, галогена, цианогруппы, трифторметоксигруппы, трифторметила, карбоксигруппы, карбоксиметила, карбоксиэтила, (С1-С6)алкила, (С1-С6)алкоксигруппы, (С1-С6)алкиламиногруппы, (С6-С14)арила, (С6-С14)арилсульфинил(С1-С6)алкила, (С6-С14)арилоксигруппы, (С6-С14)арил(С1-С6)алкоксигруппы, аминогруппы, азидогруппы, нитрогруппы, гуанидиногруппы, амидиногруппы, фосфоногруппы, оксогруппы, карбамоила, (С1-С6)алкилсульфонила, (С1-С6)алкилсульфинила или (С1-С6)алкилтиогруппы или две Y группы могут образовывать метилендиоксигруппу;
и его рацемические формы, энантиомеры, диастереомеры и их смеси, и его фармацевтически приемлемые соли.
3. Соединение по любому из пп.1 или 2, где R1 означает метил, этил, пропил или бутил.
4. Соединение по любому из пп.1-3, где R3 означает Cl, Br или фенил, необязательно замещенный одной или более группами Y.
5. Соединение по любому из пп.1-4, где R4 означает бензил, фенилэтил или 2-оксо-2-пиперидин-1-илэтил, где каждая из этих групп необязательно замещена одной или более группами Y.
6. Соединение по любому из пп.1-5, где Y означает галоген, трифторметил, (С1-С6)алкил или (С1-С6)алкоксигруппу.
7. Соединение, выбранное из следующих соединений:


так же, как их рацемические формы, энантиомеры, диастереомеры и их смеси, и их фармацевтически приемлемые соли.
8. Способ получения соединения общей формулы (I) по любому из пп.1-7, включающий:
а) взаимодействие соединения формулы (1)
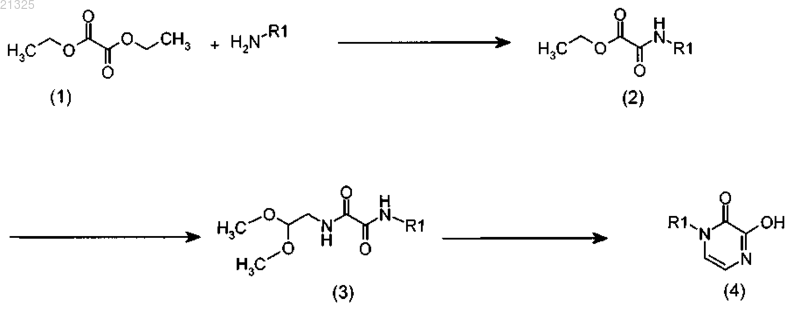
с амином R1-NH2, где R1 является таким, как определено в п.1, в присутствии четвертичной аммониевой соли в инертном растворителе с получением соединения формулы (2);
взаимодействие соединения формулы (2) с защищенным диалкилацетатом аминоацетальдегида в растворителе с получением соединения формулы (3);
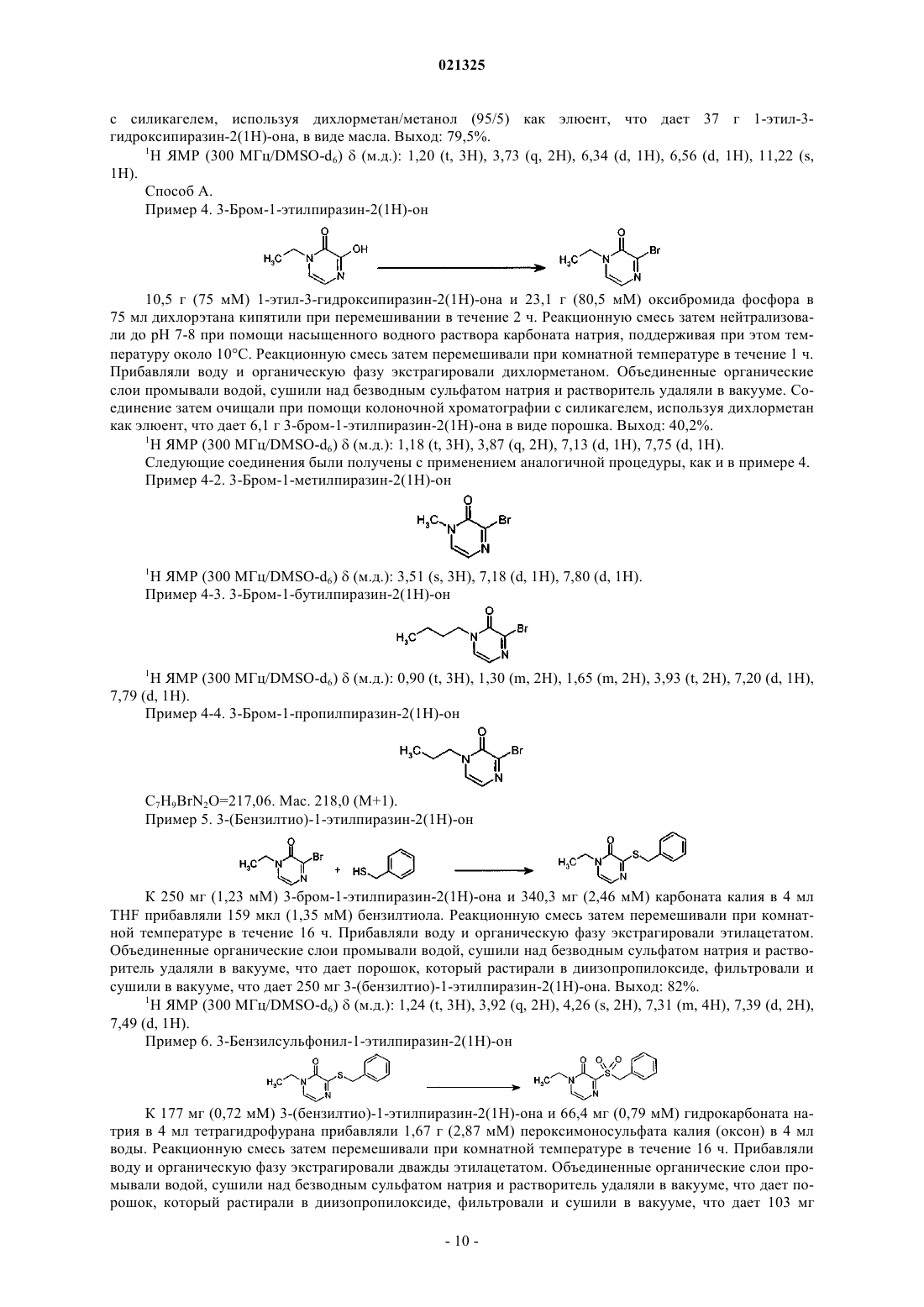
циклизацию соединения формулы (3) в кислотных условиях в растворителе с каталитическим количеством концентрированной хлористо-водородной кислоты с получением соединения формулы (4);
b) бромирование соединения формулы (4), где R1 является таким, как определено в п.1, с применением бромирующего агента в инертном растворителе с получением соединения формулы (5)

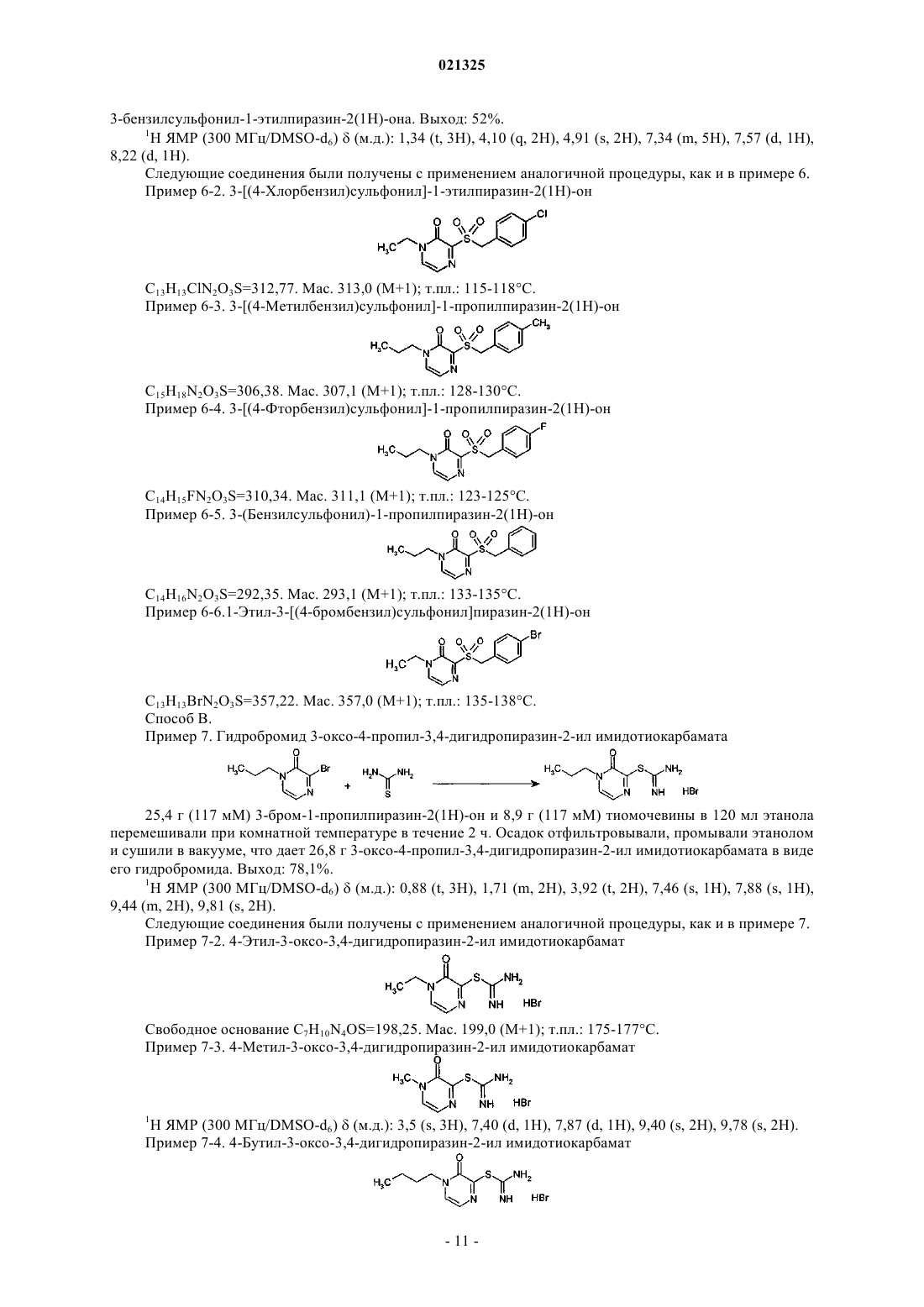
взаимодействие соединения формулы (5) с подходящим тиолом R4-SH, где R4 является таким, как определено в п.1, в присутствии по крайней мере одного эквивалента основания в растворителе с получением соединения формулы (I), где n=0;
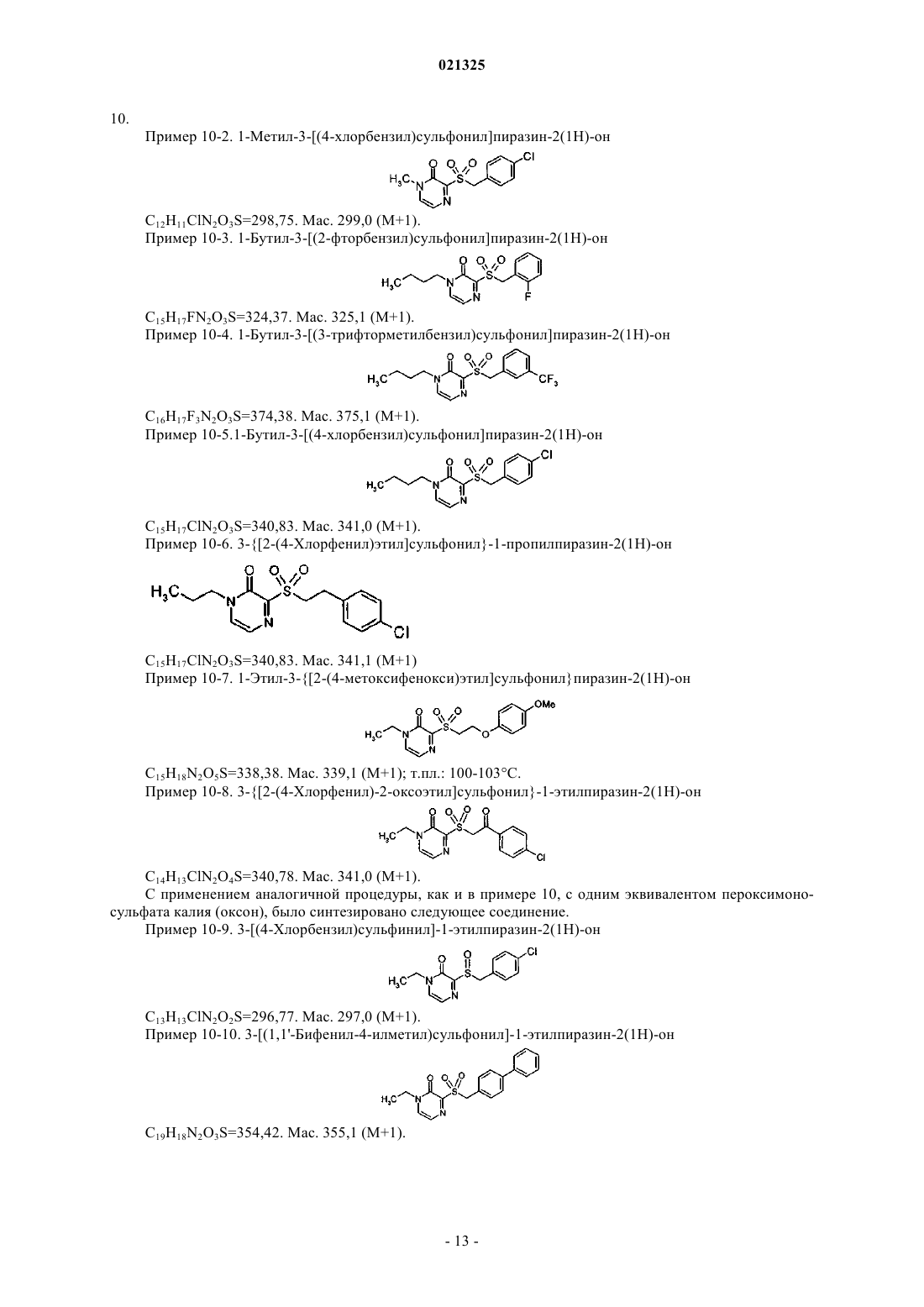
взаимодействие соединения формулы (I), где n=0, с окисляющими агентами в присутствии основания в растворителе с получением производного сульфона (I), где n=2.
9. Способ получения соединения общей формулы (I) по любому из пп.1-7, включающий:
а) взаимодействие соединения формулы (1)

с амином R1-NH2, где R1 является таким, как определено в п.1, в присутствии четвертичной аммониевой соли в инертном растворителе с получением соединения формулы (2);
взаимодействие соединения формулы (2) с защищенным диалкилацетатом аминоацетальдегида в растворителе с получением соединения формулы (3);
циклизацию соединения формулы (3) в кислотных условиях в растворителе с каталитическим количеством концентрированной хлористо-водородной кислоты с получением соединения формулы (4);
b) бромирование соединения формулы (4), где R1 является таким, как определено в п.1, с применением бромирующего агента в инертном растворителе с получением соединения формулы (5)

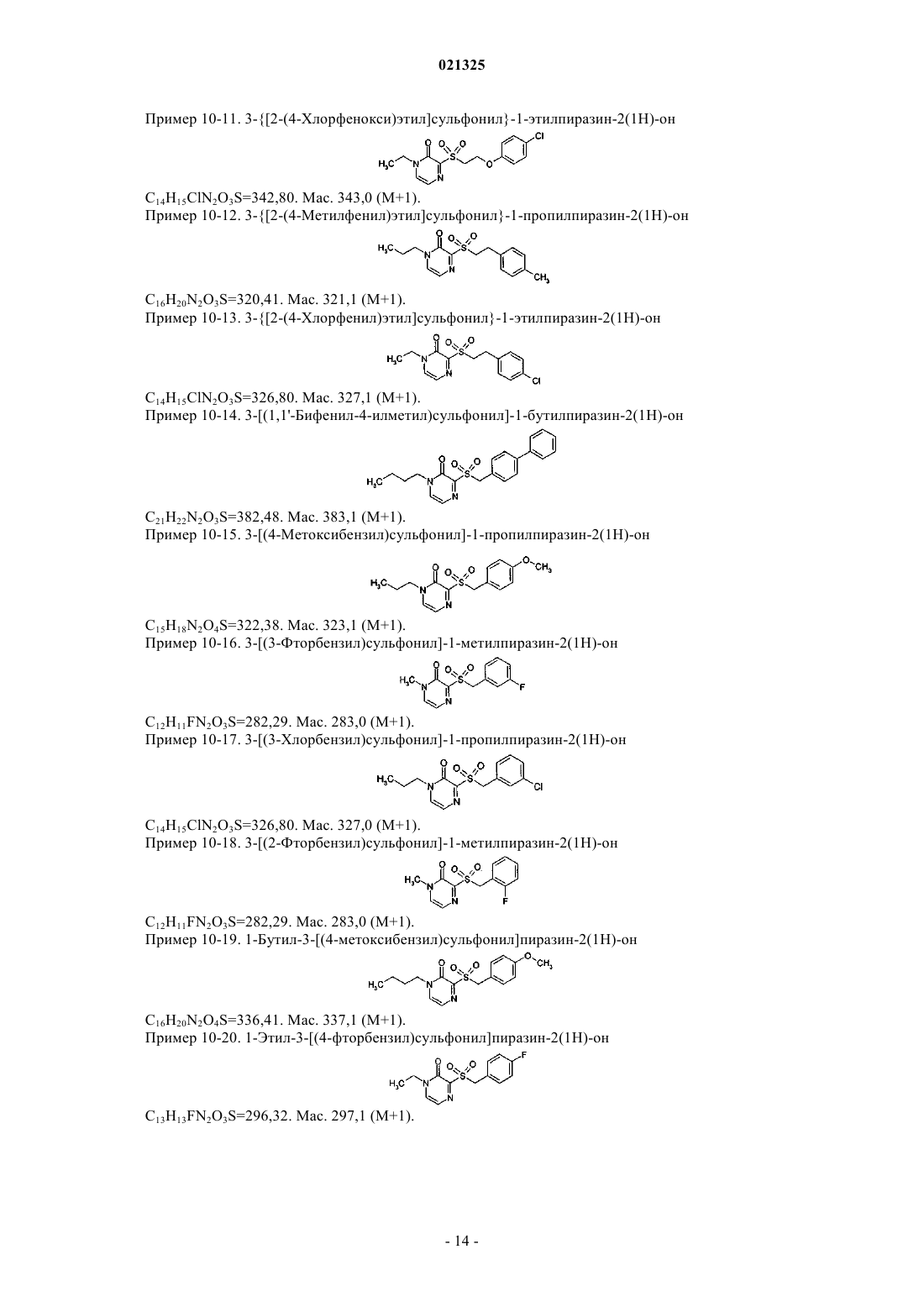
взаимодействие соединения формулы (5) с тиомочевиной в растворителе с получением имидотиокарбамата (8);
гидролиз (8) в присутствии основания с получением соответствующего 3-меркаптопиразинона (9);
взаимодействие 3-меркаптопиразинонов (9) с галогено-R4, где R4 является таким, как определено в п.1, в присутствии по крайней мере одного эквивалента основания в растворителе с получением соединения формулы (I), где n=0;
взаимодействие соединения формулы (I), где n=0, с окисляющими агентами в присутствии основания в растворителе с получением производного сульфона (I), где n=2.
10. Фармацевтическая композиция для стимуляции секреции инсулина, содержащая по крайней мере одно соединение общей формулы (I) и/или его фармацевтически приемлемую соль по любому из пп.1-7 в комбинации с одним или несколькими фармацевтически приемлемыми носителем, адъювантом, разбавителем или эксципиентом.
11. Применение по крайней мере одного соединения общей формулы (I) по любому из пп.1-7, а также его рацемических форм, энантиомеров, диастереомеров, их смесей и их фармацевтически приемлемых солей, для приготовления лекарственного средства для предупреждения и/или лечения патологий, связанных с гипергликемией; для приготовления лекарственного средства, стимулирующего секрецию инсулина в ответ на концентрацию глюкозы, для лечения диабета, для предупреждения и/или лечения диабета II типа и патологий, связанных с расстройствами метаболизма, гиперхолестеринемией, гиперлипидемией, которые увеличиваются гиперинсулинемией и гипергликемией; для лечения болезней, выбранных из диабетов, связанных с микрососудистыми и макрососудистыми осложнениями, артериальной гипертензии, воспалительных процессов, микроангиопатии, макроангиопатии, ретинопатии и невропатии; для уменьшения гипергликемии, для лечения дислипидемии и ожирения или сердечно-сосудистых болезней, включая атеросклероз и ишемию миокарда.
Текст
ПРОИЗВОДНЫЕ ПИРАЗИНОНА КАК СТИМУЛЯТОРЫ СЕКРЕЦИИ ИНСУЛИНА,СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ДИАБЕТОВ Изобретение относится к производным пиразинона формулы (I) где n, R1, R2, R3 и R4 являются такими, как определено в п.1, как стимуляторам секреции инсулина. Изобретение также относится к получению и применению этих производных пиразинона для профилактики и/или лечения диабетов и связанных патологий.(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) Область техники Настоящее изобретение относится к производным пиразинона формулы (I) как стимуляторам секреции инсулина. Изобретение также относится к получению и применению этих производных пиразинона для профилактики и/или лечения диабетов и связанных патологий. Уровень техники изобретения Сахарный диабет 2 типа является одной из наиболее распространенных мировых болезней. В 2007 г. ее распространение исчислялось в 5,9% (246 млн людей) взрослого населения и находится в непрерывном росте. Эта болезнь является еще более серьезной, так как она может привести к тяжелым микро- и макроосложнениям, которые могут стать калечащими или летальными, поскольку диабет является главным фактором риска при сердечно-сосудистом заболевании и инсульте. Диабет 2 типа характеризуется голодной и постобеденной гипергликемией, последствием двух главных дефектов: резистентности к инсулину на уровне тканей-мишеней и видоизмененной секреции инсулина из поджелудочных бета-клеток. Эта последняя аномалия, кажется, возникает сама по себе, поскольку она присутствует при стадии нарушении толерантности к глюкозе (IGT) (Mitrakou et al., N. Engl.J. Med. 326: 22-29, 1992). Наблюдалось в UK Prospective Diabetes Study (UKPDS), что 50% функции бетаклетки уже потеряны, когда диагностируют диабет, предполагается, что истощение функции бета-клетки может начаться за 10-12 лет до диагностирования диабета (Holman, Diabetes Res. Clin. Pract. 40: S21, 1998or UKPDS Group, Diabetes 44:1249-58, 1995). Неполноценная секреция инсулина происходит через количественный и качественный дефект бетаклетки, т.е. уменьшение массы бета-клетки и специфический дефект секреции инсулина в ответ на глюкозу, особенно первую фазу секреции, пока сохраняется реакция на неглюкозный стимулятор секреции(Pfeifer et al., Am. J. Med. 70: 579-88, 1981). Важность восстановления нормального профиля секреции инсулина в ответ на глюкозу, чтобы поддерживать гликемический контроль внутри нормального диапазона, опиралась на исследования у волонтеров недиабетиков, показывая, что запаздывание первой фазы секреции инсулина в ответ на глюкозу приводит к нарушению толерантности к глюкозе (Calles-Escandonet al., Diabetes 36: 1167-72, 1987). Оральные антидиабетические средства, пригодные для лечения пациентов с диабетом 2 типа, такие как сульфонилмочевина или glinides, известны тем, что стимулируют секрецию инсулина связыванием сульфонилмочевиной рецептора на K-АТР каналах бета-клетки, приводя к увеличению внутриклеточного кальция и экзоцитоза инсулина. Эта секреция инсулина является, таким образом, полностью независимой от уровня глюкозы в плазме и лечение этими молекулами обычно стимулирует пролонгированную гиперинсулинемию, которая может привести к некоторым побочным эффектам, таким как тяжелая гипогликемия, увеличение массы тела и заострение сердечно-сосудистого риска. В дополнение, другой смертельный побочный эффект этих соединений, пролонгированная гиперинсулинемия, наблюдаемая при лечении сульфонилмочевиной, без эффекта защиты массы бета-клетки, должна привести к вторичному повреждению через истощение бета-клетки. Новое лечение диабета 2 типа может восстанавливать нормальный профиль секреции инсулина,особенно в ответ на глюкозу, пока сохраняется или увеличивается масса бета-клетки. Это наблюдается с аналогами GLP-1, такими как эксенатид или лираглутид, но эти молекулы являются пептидами и должны вводиться парентеральным путем. Такие характеристики для новой оральной маленькой молекулы были бы большим преимуществом перед другими антидиабетическими лекарственными средствами. Соответственно настоящему изобретению соединения формулы (I) являются стимуляторами секреции инсулина, применимые для лечения диабета и сопутствующих патологий. Они понижают уровни глюкозы в крови восстановлением дефектной глюкозозависимой секреции инсулина при диабете 2 типа. Заявка на патент WO 2007071646 описывает арил- и гетероарилзамещенные производные пиразинона, имеющие активность антагонистичекую меланинконцентрируюшему гормону, применимые для предупреждения и/или лечения нарушений психики. ЕР 927171 описывает пиразиноны антагонисты рилизинг-фактора кортикотропина для применения в лечении психиатрических и неврологических заболеваний, включая большую депрессию, расстройства,вызванные тревожностью, посттравматические стрессовые расстройства и расстройства пищевого поведения. Краткое описание изобретения Настоящее изобретение направлено на производные пиразинона формулы (I). Указанные производные являются важными для лечения диабетов и вместе с этим связанных патологий. Производные пиразинона согласно изобретению имеют следующую формулу (I):R3 выбран из водорода, галогена или (С 6-С 14)арила, где арил, возможно, замещен одним или более заместителями Y;R4 выбран из (С 6-С 14)арил(С 1-С 6)алкила, который, возможно, замещен одним или более заместителями Y;R7 и R8 вместе с атомом азота, к которому они присоединены, образуют гетероцикл; гетероцикл может включать один гетероатом, выбранный из N, О и S;Y выбран из гидроксигруппы, тиогруппы, галогена, цианогруппы, трифторметоксигруппы, трифторметила, карбоксигруппы, карбоксиметила, карбоксиэтила, (С 1-С 6)алкила, (С 1-С 6)алкоксигруппы, (С 1 С 6)алкиламиногруппы, (С 6-С 14)арила, (С 6-С 14)арилсульфинил(С 1-С 6)алкила, (С 6-С 14)арилоксигруппы, (С 6 С 14)арил(С 1-С 6)алкоксигруппы, аминогруппы, азидогруппы, нитрогруппы, гуанидиногруппы, амидиногруппы, фосфоногруппы, оксогруппы, карбамоила, (С 1-С 6)алкилсульфонила, (С 1-С 6)алкилсульфинила или (С 1-С 6)алкилтиогруппы или две Y группы могут образовывать метилендиоксигруппу; а также их рацемические формы, энантиомеры, диастереомеры и их смеси, и их фармацевтически приемлемые соли. В другом предпочтительном варианте изобретение обеспечивает производные пиразинона формулыR3 выбран из: водорода, галогена или (С 6-С 14)арила, где (С 6-С 14)арил, возможно, замещен одним или более заместителями Y;R4 выбран из (С 6-С 14)арил(С 1-С 6)алкила, который, возможно, замещен одним или более заместителями Y;R7 и R8 вместе с атомом азота, к которому они присоединены, образуют гетероцикл, гетероцикл может включать один гетероатом, выбранный из N, О и S;Y выбран из гидроксигруппы, тиогруппы, галогена, цианогруппы, трифторметоксигруппы, трифторметила, карбоксигруппы, карбоксиметила, карбоксиэтила, (С 1-С 6)алкила, (С 1-С 6)алкоксигруппы, (С 1 С 6)алкиламиногруппы, (С 6-С 14)арила, (С 6-С 14)арилсульфинил(С 1-С 6)алкила, (С 6-С 14)арилоксигруппы, (C6C14)арил(C1-С 6)алкоксигруппы, аминогруппы, азидогруппы, нитрогруппы, гуанидиногруппы, амидиногруппы, фосфоногруппы, оксогруппы, карбамоила, (С 1-С 6)алкилсульфонила, (С 1-С 6)алкилсульфинила или (С 1-С 6)алкилтиогруппы или две Y группы могут образовывать метилендиоксигруппу; а также их рацемические формы, энантиомеры, диастереомеры и их смеси, и их фармацевтически приемлемые соли. Соединения формулы (I) могут быть выбраны из следующих соединений: так же, как их рацемические формы, энантиомеры, диастереомеры и их смеси, и их фармацевтически приемлемые соли. Изобретение также относится к рацемическим формам, таутомерным формам, энантиомерам, диастереоизомерам, эпимерам и органическим или минеральным солям соединений общей формулы (I), так же, как к их кристаллическим формам, включая их полиморфные формы и полиморфные формы соединений формулы (I). Настоящее изобретение направлено не только на рацемические смеси этих соединений, но также на их индивидуальные стереоизомеры и/или диастереоизомеры, так же, как и на их смеси во всех соотношениях. Соединения изобретения формулы (I), как определено выше, содержащие достаточно кислую функцию или достаточно основную функцию, или их обе, могут включать соответствующие фармацевтически приемлемые соли органических или минеральных кислот или органических или минеральных оснований. Выражение "фармацевтически приемлемые соли" относится к относительно нетоксическим минеральным и органическим солям присоединения кислот и солям присоединения оснований соединений настоящего изобретения. Эти соли могут быть получены in situ во время окончательного выделения и очистки соединений. В частности, соли присоединения кислот могут быть получены путем раздельного взаимодействия очищенного соединения в его очищенной форме с органической или минеральной кислотой и выделения полученной таким образом соли. Конечными солями являются, например, гидрохлориды, гидробромиды,сульфаты, гидросульфаты, дигидрофосфаты, цитраты, малеаты, фумараты, трифторацетаты, 2-нафталинсульфонаты, пара-толуолсульфонаты. Изобретение также относится к фармацевтически приемлемым солям с органическими или неорганическими основаниями. В частности, соли присоединения оснований могут быть получены путем раздельного взаимодействия очищенного соединения в его очищенной форме с органическим или неорганическим основанием и выделения полученной таким образом соли. Конечными солями являются, например, соли металлов, в особенности соли щелочных металлов, соли щелочно-земельных металлов и соли переходных металлов (таких как натрий, калий, кальций, магний, алюминий), или соли, полученные с основаниями, такими как аммиак или вторичные или третичные амины (такие как диэтиламин, триэтиламин, пиперидин, пиперазин, морфолин), или с основными аминокислотами, или с осаминами (такими как меглюмин), или с аминоспиртами (такими как 3-аминобутанол и 2-аминоэтанол). Изобретение также относится к солям, которые применяются для хирального разделения рацематов. Как примеры, могут применяться следующие хиральные кислоты: (+)-D-ди-О-бензоилвинная кислота, (-)-L-ди-О-бензоилвинная кислота, (-)-L-ди-О,О'-п-толуил-L-винная кислота, (+)-D-ди-О,О'-птолуил-L-винная кислота, (R)-(+)-яблочная кислота, (S)-(-)-яблочная кислота, (+)-камфорная кислота,(-)-камфорная кислота, R-(-)-1,1'-бинафталин-2,2'-диилгидрофосфиновая, (+)-камфановая кислота,(-)-камфановая кислота, (S)-(+)-2-фенилпропионовая кислота, (R)-(+)-2-фенилпропионовая кислота,D-(-)-миндальная кислота, L-(+)-миндальная кислота, D-винная кислота, L-винная кислота или любые их смеси. Как примеры, могут применяться следующие хиральные амины: хинин, бруцин, (S)-1-(бензилоксиметил)пропиламин (III), (-)-эфедрин, (4S,5R)-(+)-1,2,2,3,4-тетраметил-5-фенил-1,3-оксазолидин,(R)-1-фенил-2-п-толилэтиламин, (S)-фенилглицинол, (-)-N-метилэфедрин, (+)-(2S,3R)-4-диметиламино-3 метил-1,2-дифенил-2-бутанол, (S)-фенилглицинол, (S)метилбензиламин или любые их смеси. Также в объем настоящего изобретения включены пролекарства соединений формулы (I). Термин "пролекарство", как использован здесь, относится к любому соединению, которое, когда применяется к биологической системе, оно генерирует "лекарство" (биологически активное соединение) как результат самопроизвольной химической реакции(й), катализируемой ферментом химической реакции(й), и/или метаболической химической реакции(й). В соответствии с настоящим изобретением и как использованы здесь, следующие термины определены со следующими значениями, если не обозначено четко иначе. Термин "арил" относится к ароматической группе, которая имеет 5-14 кольцевых атомов и по крайней мере одно кольцо имеет конъюгированную пиэлектронную систему и включает биарильные группы, все из которых могут быть необязательно замещены. Подходящие арильные группы включают фенил, нафтил, бифенил, антрил, фенантрил, инденил и т.п. Термин "гетероарил" относится к ароматическим гетероциклам с 5-14 кольцевыми атомами, содержащими от 1 до 4 гетероатомов, как кольцевые атомы в ароматическом кольце и остальные кольцевые атомы дополнены атомами углерода. Подходящие гетероатомы включают О, S, N. Подходящие гетероарильные группы включают фуранил, бензофуранил, тиенил, пиридил, пиридил-N-оксид, пиримидинил,пиразинил, оксазолил, тиазолил, изоксазолил, хинолинил, тиазолил, пиридазинил, пирролил, имидазолил, индазолил, изотиазолил, индолил, оксадиазолил и т.п. Термин "циклоалкил" означает насыщенные карбоциклические кольца, необязательно замещенные,и включает моно-, би- и трициклические соединения от 3 до 10 атомов углерода. Подходящими циклоалкильными группами являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, адамантил и т.п. Термин "гетероциклоалкил" относится к необязательно замещенным моноциклическим, бициклическим или трициклическим радикалам, содержащим один или более гетероатомов, предпочтительно выбранных из О, S и N, необязательно в окисленном состоянии (для S и N), и необязательно одну или более двойную связь. По крайней мере одно из колец предпочтительно содержит от 1 до 4 эндоциклических гетероатомов, более предпочтительно от 1 до 3 гетероатомов. Более предпочтительно гетероциклоалкил (или просто "гетероциклический") радикал включает одно или более колец, каждое имеет от 5 до 8 узлов. Примерами гетероциклических радикалов являются морфолинил, пиперидинил, пиперазинил, тиазолидинил, оксазолидинил, тетрагидротиенил, дигидрофуранил, тетрагидрофуранил, пиразолидинил,1,3-диоксанил, пирролидинил, пиранил, дигидропиранил, изоксазолидинил, имидазолил, имидазолидинил и т.п. Термин "гетероцикл" относится к необязательно замещенным моноциклическим, бициклическим или трициклическим радикалам, содержащим один или более гетероатомов, предпочтительно выбранных из О, S и N, необязательно в окисленном состоянии (для S и N), и необязательно одну или более двойную связь. По крайней мере одно из колец предпочтительно содержит от 1 до 4 эндоциклических гетероатомов, более предпочтительно от 1 до 3 гетероатомов. Примерами гетероциклов являются пиперидин, морфолин, пиперазин, пирролидин, тиазолидин, оксазолидин, пиразолидин, изоксазолидин, имидазолидин. Термин "алкил" относится к насыщенным алифатическим группам, включающим основную цепь и боковую цепь. Подходящие алкильные группы, имеющие от 1 до 20 атомов углерода, включают метил,этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, пентил, гексил, октил, деканоил, додеканоил,гексадецил, оксадецил и т.п. Термин "алкенил" относится к ненасыщенным группам, содержащим по крайней мере одну углерод-углеродную двойную связь и включающим основную цепь, боковую цепь и циклические группы. Подходящие алкенильные группы, имеющие от 2 до 20 атомов углерода, включают этенил, 2-пропенил,2-бутенил, 3-бутенил, 2-пентенил, 3-пентенил, 4-пентенил и т.п. Термин "алкинил" относится к ненасыщенным группам, содержащим по крайней мере одну углерод-углеродную тройную связь, и включающим основную цепь, боковую цепь и циклические группы; и необязательно включающим по крайней мере одну углерод-углеродную двойную связь. Подходящие алкинильные группы, имеющие от 2 до 20 атомов углерода, включают этинил, 2-пропинил, 2-бутинил,3-бутинил, 2-пентинил, 3-пентинил, 4-пентинил и т.п. Термин "арилалкил" относится к алкильной группе, предпочтительно алкильной группе, имеющей от 1 до 20 атомов углерода, замещенной арильной группой. Подходящие арилалкильные группы включают бензил, пиколил и т.п. Термин "арилалкенил" относится к алкенильной группе, предпочтительно алкенильной группе,имеющей от 1 до 20 атомов углерода, замещенной арильной группой. Термин "арилалкинил" относится к алкинильной группе, предпочтительно алкинильной группе,имеющей от 1 до 20 атомов углерода, замещенной арильной группой. Термин "алкоксигруппа" относится к группе alk-O-, где "alk" означает алкильную группу. Термин "арилоксигруппа" относится к группе арил-О-. Термин "арилоксиалкил" относится к алкильной группе, замещенной арилоксигруппой. Термин "арилалкоксиалкил" относится к алкильной группе, замещенной арилалкоксигруппой. Термин "арилалкоксигруппа" относится к группе арил-Alk-O-, где "Alk" означает алкильную группу. Термин "арилтиоалкил" относится к алкильной группе, замещенной арилтиогруппой. Термин "алкилсульфинил" относится к алкил-SO-группе. Термин "алкилсульфонил" относится к алкил-SO2-группе. Термин "арилсульфонилалкил" относится к алкильной группе, замещенной арилсульфонил (арилSO2-) группой. Термин "арилалкилтиоалкил" относится к алкильной группе, замещенной арилалкилтиогруппой. Термин "гетероарилалкил" относится к алкильной группе, замещенной гетероарильной группой. Термин "гетероарилоксиалкил" относится к алкильной группе, замещенной гетероарилоксигруппой. Термин "гетероарилалкоксиалкил" относится к алкильной группе, замещенной гетероарилалкоксигруппой. Термин "гетероарилтиоалкил" относится к алкильной группе, замещенной гетероарилтиогруппой. Термин "гетероарилалкилтиоалкил" относится к алкильной группе, замещенной гетероарилалкилтиогруппой. Термин "гетероциклоалкилалкил" относится к алкильной группе, замещенной гетероциклоалкильной группой. Термин "гетероциклоалкилоксиалкил" относится к алкильной группе, замещенной гетероциклоалкилоксигруппой. Термин "гетероциклоалкилалкоксиалкил" относится к алкильной группе, замещенной гетероциклоалкилалкоксигруппой. Термин "гетероциклоалкилтиоалкил" относится к алкильной группе, замещенной гетероциклоалкилтиогруппой. Термин "гетероциклоалкилалкилтиоалкил" относится к алкильной группе, замещенной гетероциклоалкилалкилтиогруппой. Термин "циклоалкилалкил" относится к алкильной группе, замещенной циклоалкильной группой. Термин "циклоалкилоксиалкил" относится к алкильной группе, замещенной циклоалкилоксигруппой. Термин "циклоалкилалкоксиалкил" относится к алкильной группе, замещенной циклоалкилалкоксигруппой. Термин "низший", упоминаемый здесь по отношению к органическим радикалам или соединениям,соответственно определяет такие, как вплоть до и включая 10, предпочтительно вплоть до и включая 6 и преимущественно от 1 до 4 атомов углерода. Такие группы могут быть линейными, разветвленными или циклическими. Термины "алкилтиогруппа" относятся к группе алкил-S-. Термин "циклоалкилтиогруппа" относится к группе циклоалкил-S-. Термин "циклоалкилтиоалкил" относится к алкильной группе, замещенной циклоалкилтиогруппой. Термин "циклоалкилалкилтиоалкил" относится к алкильной группе, замещенной циклоалкилалкилтиогруппой. Термин "галоген" относится к атому фтора, брома или хлора. Термин "амидиногруппа" относится к -C(NR5)-NR5R6, где R5R6 означает, как определено выше,что все, кроме водорода, необязательно замещены. Термин "карбамоил" относится к незамещенной аминокарбонильной группе. Соединения изобретения соответственно формуле (I) демонстрируют гипогликемическую активность и являются применимыми в лечении сопутствующих патологий с синдромом резистентности к инсулину. Резистентность к инсулину характеризуется понижением действия инсулина (см. "Presse Medicale",(1997), 26(14), 671-677) и участвует во многих патологических состояниях, таких как диабет и, в частности, инсулиннезависимый диабет (диабет II типа или NIDDM), дислипидемия, ожирение, артериальная гипертензия, и также центрально-сердечные, микроваскулярные и макроваскулярные осложнения, например атеросклероз, ретинопатия и невропатия. В связи с этим ссылка может быть сделана, например,Diabetes, 37, (1988), 1595-1607; Journal of Diabetes and its complications, 12, (1998), 110-119; Horm. Res.,38, (1992), 28-32. Изобретение также относится к фармацевтической композиции, содержащей как активный ингредиент по крайней мере одно соединение формулы (I), как описано выше, и/или его фармацевтически приемлемую соль, в комбинации с одним или несколькими фармацевтически приемлемыми носителем,адъювантом, разбавителем или эксципиентом. Специалист в данной области техники осведомлен обо всем разнообразии таких носителей, адъювантов, разбавителей или эксципиентов, подходящих для составления фармацевтической композиции. Фармацевтические композиции настоящего изобретения могут быть введены различными путями,включая оральный, парентеральный, внутривенный, внутримышечный, ректальный, подслизистый или подкожный. Таким образом, они будут представлены в форме растворов для инъекции либо суспензий или мультидозированных ампул, в форме таблеток без добавок или с покрытием, таблеток с сахарным покрытием, облаточных капсул, желатиновых капсул, пилюль, саше, порошка, суппозиториев или ректальных капсул, растворов или суспензий, для подкожного применения в полярном растворителе или для подслизистого применения. Эксципиенты, которые являются подходящими для таких введений, являются фармацевтически приемлемыми эксципиентами, такими как производные целлюлозы или микрокристаллической целлюлозы, карбонаты щелочно-земельных металлов, фосфат магния, крахмал, модифицированный крахмал, лактоза и подобное для твердых форм. Для ректального применения предпочтительными эксципиентами являются масло какао или полиэтиленгликольстеараты. Для парентерального применения средами, наиболее соответственно используемыми, являются вода, водные растворы, физиологический солевой раствор и изотонические растворы. Например, в случае орального введения, например в форме гранул, таблеток или таблеток с оболочкой, пилюль, капсул, желатиновых капсул, гелей, облаток или порошков, подходящая дозировка соединений является между около 0,1 и около 100 мг/кг массы тела на 1 день и предпочтительно между около 0,5 и около 50 мг/кг массы тела на 1 день, более предпочтительно между около 1 и около 10 мг/кг массы тела на 1 день и наиболее предпочтительно между около 2 и около 5 мг/кг массы тела на 1 день. Если рассматривается типичное тело весом 10 и 100 кг, для того чтобы проиллюстрировать диапазон дневной оральной дозировки, которая может быть применена, как описано выше, подходящие дозировки соединений формулы (I) могут быть между около 1-10 и 1000-10000 мг/на 1 день, предпочтительно между около 5-50 и 500-5000 мг/на 1 день, более предпочтительно между 10-100 и 100-1000 мг/на 1 день и наиболее предпочтительно между 20-200 и 50-500 мг/на день. Понятно, однако, что уровень удельной дозы для каждого отдельного пациента будет зависеть от различных факторов, включая активность используемого особого соединения; возраст, массу тела, общее состояние здоровья, пол и питание индивида, которого лечат; время и пути введения; скорость выведения; другие лекарственные средства, которые были введены раньше; тяжесть отдельной болезни, подвер-6 021325 гающейся лечению, как хорошо известно специалистам в данной области техники. Как описано выше, составы настоящего изобретения, подходящие для орального введения, могут быть представлены как отдельные единицы, такие как капсулы, саше или таблетки, каждая содержащая определенное количество активного ингредиента, в виде порошка или гранул, в виде раствора или суспензии в водном или неводном растворе или в виде жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. Активный ингредиент может также быть введен в виде болюса, электуария или пасты. При инсулиннезависимом диабете для человека гипергликемия является результатами двух главных дефектов: изменения секреции инсулина и понижения эффективности инсулина на уровне трех мест, означающих печень, мышцы и жировую ткань. Настоящее изобретение также относится к соединению общей формулы (I) так же, как и его рацемическим формам, таутомерам, энантиомерам, диастереомерам, эпимерам и полиморфам, их смесям и их фармацевтически приемлемым солям, для приготовления лекарственного средства для предупреждения и/или лечения патологий, связанных с гипергликемией; для приготовления лекарственного средства,стимулирующего секрецию инсулина в ответ на концентрацию глюкозы, предпочтительно для лечения диабета, более предпочтительно для предупреждения и/или лечения диабета II типа и патологий, связанных с расстройствами метаболизма, гиперхолестеринемией, гиперлипидемией, которые увеличиваются гиперинсулинемией и гипергликемией; для лечения болезней, выбранных из диабетов, связанных с микрососудистыми и макрососудистыми осложнениями, таких как артериальная гипертензия, воспалительные процессы, микроангиопатия, макроангеопатия, ретинопатия и невропатия; для уменьшения гипергликемии, для лечения дислипидемии и ожирения или болезней, таких как сердечно-сосудистые болезни,включая атеросклероз, ишемию миокарда. Настоящее изобретение также относится к применению, по крайней мере, соединения общей формулы (I) так же, как и его рацемических форм, таутомеров, энантиомеров, диастереомеров, эпимеров и полиморфов, и их смесей, и их фармацевтически приемлемых солей, и их неактивных лекарственных форм, для предупреждения и/или лечения патологий, связанных с гипергликемией, предпочтительно для лечения диабета, более предпочтительно для предупреждения и/или лечения диабета II типа и патологий,связанных с расстройствами метаболизма, гиперхолестеринемией, гиперлипидемией, которые увеличиваются гиперинсулинемией и гипергликемией; для лечения болезней, выбранных из диабетов, связанных с микрососудистыми и макрососудистыми осложнениями, таких как артериальная гипертензия, воспалительные процессы, микроангиопатия, макроангиопатия, ретинопатия и невропатия; для уменьшения гипергликемии, для лечения дислипидемии и ожирения или болезней, таких как сердечно-сосудистые болезни, включая атеросклероз, ишемию миокарда. Настоящее изобретение также относится к процессу производства соединений формулы (I), как описано выше, соответственно следующим представленным способам, показанным на схеме 1 (Приготовление промежуточных производных пиразинона); на схеме 2 (Приготовление производных пиразинона, способ А) или на схеме 3 (Приготовление производных пиразинона, способ В), в которых n, R1, R2,R3 и R4 являются, как описано выше в формуле (I). Следующие схемы даны для представительных целей и только для цели облегчения представления. Разумеется, зависимость природы соединений формулы (I),которые будут получать, представленные методики могут быть адаптированны специалистами в данной области техники выбором соответствующих начальных материалов, в которых природа заместителей R1,R4 может быть модифицирована, тем более, как функция природы или длины желаемой цепи. Соединения, применимые согласно изобретению, могут быть получены, не считая отдельно отмеченные, путем применения или адаптации известных методик, для которых используются методики,применимые ранее или описанные в литературе, патентах или заявках на патент, Chemical Abstracts и в Интернете. Соединения, применимые согласно изобретению, могут быть получены, не считая отдельно отмеченные, путем применения или адаптации известных методик, для которых используются методики,применимые ранее или описанные в литературе, патентах или патентных заявках, the Chemical Abstracts и в Интернете. Получение промежуточных производных пиразинона. Схема 1 в которой R1 означает, как определено выше для формулы (I). Соединения (2) получены взаимодействием диэтилоксалата (1) с амином в присутствии четвертичной аммониевой соли, такой как аликват 336, в инертном растворителе, таком как хлороформ, толуол или дихлорметан, при температуре между 20 С и кипением, в течение от 24 до 100 ч. Интермедиаты (3) с боковой цепью, содержащей защищенный альдегид в виде ацеталя, получены взаимодействием соединения формулы (2) с защищенным диалкилацетатом аминоацетальдегидом, таким как (2,2-диметоксиэтил)амин. Реакцию проводят в растворителе, таком как спирт, например 2-пропанол,при температуре между 20 С и кипением, в течение от 1 до 24 ч. Пиразиноны (4) могут быть получены циклизацией соединения (3) в кислотных условиях, например в растворителе, таком как уксусная кислота, с каталитическим количеством концентрированной хлористо-водородной кислоты, при температуре между 20 С и кипением, в течение от 1 до 24 ч. Получение производных пиразинона. Способ А. Схема 2 в которой n, R1 и R4 означают, как определено выше для формулы (I). 3-Бромпиразиноны (5) получены бромированием соответствующих 3-гидроксипиразинонов (4) с применением бромирующего агента, такого как POBr3, в инертном растворителе, таком как 1,2-дихлорэтан, при температуре между 20 С и кипением, более предпочтительно при кипении, в течение от 1 до 24 ч. Тиопроизводные (I), где n=0, получены в реакции 3-бромпиразинонов (5) с подходящими тиолами,такими как, без ограничения, бензилтиолы, производные алкилтиолов, необязательно замещенные, в присутствии по крайней мере одного эквивалента неорганического основания, такого как карбонат натрия или калия, карбонат цезия, или органического основания, такого как триэтиламин или диизопропилэтиламин в растворителе, таком как ацетонитрил, тетрагидрофуран или толуол при температуре между 20 С и кипением, в течение от 1 до 24 ч. Производные сульфона (I), где n=2, получены из соединения (I), где n=0 с применением окисляющих агентов, таких как метахлорнадбензойная кислота (МХНБК). Другой предпочтительный способ использует по крайней мере один эквивалент пероксимоносульфата калия (оксон) в присутствии основания, такого как гидрокарбонат натрия, в растворителе, таком как тетрагидрофуран и вода, при температуре между -20 С и кипением, предпочтительно при комнатной температуре в течение от 1 до 24 ч. Сульфинильное производное (I), где n=1 получено из соединения (I), где n=0, применяя один эквивалент оксона, в присутствии основания, такого как гидрокарбонат натрия, в растворителе, таком как тетрагидрофуран и вода, при температуре между -20 С и кипением, предпочтительно при комнатной температуре в течение от 1 до 4 ч. Получение производных пиразинона. Способ В. Схема 3 в которой n, R1 и R4 означают, как определено выше для формулы (I). 3-Бромпиразиноны (5) получены бромированием соответствующих 3-гидроксипиразинонов (4) с применением бромирующего агента, такого как POBr3, в инертном растворителе, таком как 1,2-дихлор-8 021325 этан, при температуре между 20 С и кипением, более предпочтительно при кипении, в течение от 1 до 24 ч. Имидотиокарбаматы (8) получены в реакции 3-бромпиразинонов (5) с тиомочевиной в растворителе,таком как ацетонитрил, метанол или этанол, при температуре между 20 С и кипением, предпочтительно при комнатной температуре, в течение от 1 до 24 ч. Имидотиокарбаматы (8) затем гидролизовали в присутствии основания, такого как гидроксид натрия или калия, что дает соответствующие 3-меркаптопиразиноны (9). Соединения (I), где n=0, получены в реакции 3-меркаптопиразинонов (9) с галогено-R4, таким как,без ограничения, необязательно замещенные бензилбромиды, в присутствии по крайней мере одного эквивалента неорганического основания, такого как карбонат натрия или калия, карбонат цезия, или органического основания, такого как триэтиламин или диизопропилэтиламин, в растворителе, таком как дихлорметан, ацетонитрил, диметилформамид, тетрагидрофуран, диоксан или толуол, при температуре между 20 С и кипением, в течение от 1 до 24 ч. Производные сульфона (I), где n=2, получены из соединения (I), где n=0, с применением окисляющих агентов, таких как МХНБК. Другой предпочтительный способ использует по крайней мере один эквивалент оксона в присутствии основания, такого как гидрокарбонат натрия, в растворителе, таком как тетрагидрофуран и вода, при температуре между -20 С и кипением, предпочтительно при комнатной температуре, в течение от 1 до 24 ч. Сульфинильное производное (I), где n=1, получены из соединения (I), где n=0, применяя один эквивалент оксона, в присутствии основания, такого как гидрокарбонат натрия, в растворителе, таком как тетрагидрофуран и вода, при температуре между -20 С и кипением, предпочтительно при комнатной температуре, в течение от 1 до 4 ч. Примеры далее иллюстрируют изобретение, однако не ограничивая его. Использованные исходные материалы являются известными продуктами или продуктами, полученными согласно известным способам. Процентное содержание выражается в весовом отношении, если не указано иначе. Соединения охарактеризованы главным образом с помощью следующих аналитических методов. ЯМР спектры получены используя ЯМР спектрометр Bruker Avance DPX 300 МГц. Массы определены при помощи ВЭЖХ соединенной с масс-детектором Agilent Series 1100. Температуры плавления (т.пл.) измерены на Stuart Scientific. Примеры Пример 1. Этил(этиламино)(оксо)ацетат К 135,8 мл (1000 мМ) диэтилоксалата и 1 г аликвата 336 в 1000 мл дихлорметана прибавляли 64,4 мл (1000 мМ) этиламина (70% в воде). Реакционную смесь перемешивали при комнатной температуре в течение 72 ч. Реакционная смесь сушили над безводным сульфатом натрия и растворитель удаляли в вакууме, что дает масло, которое затем очищали при помощи колоночной хроматографии с силикагелем,используя дихлорметан/диметилкетон 59,9 г (412,6 мМ) этил(этиламино)(оксо)ацетата и 45 мл (412,6 мМ) (2,2-диметоксиэтил)амина в 480 мл 2-пропанола перемешивали при комнатной температуре в течение 16 ч. Белый осадок отфильтровывали, промывали 2-пропанолом и сушили в вакууме, что дает 67,8 г N-(2,2-диметоксиэтил)-N'этилэтандиамида. Выход: 80,5%. 1 Н ЯМР (300 МГц/DMSO-d6)(м.д.): 1,07 (t, 3 Н), 3,15 (m, 2 Н), 3,27 (m, 8 Н), 4,51 (m, 1 Н), 8,62 (m,1 Н), 8,81 (m, 1 Н). Пример 3. 1-Этил-3-гидроксипиразин-2(1 Н)-он 67,5 г (330 мМ) N-(2,2-диметоксиэтил)-N'-этилэтандиамида и 2 мл концентрированной хлористоводородной кислоты в 390 мл уксусной кислоты кипятили при перемешивании в течение 1 ч. Растворитель удаляли в вакууме, что дает масло, которое затем очищали при помощи колоночной хроматографии 10,5 г (75 мМ) 1-этил-3-гидроксипиразин-2(1H)-она и 23,1 г (80,5 мМ) оксибромида фосфора в 75 мл дихлорэтана кипятили при перемешивании в течение 2 ч. Реакционную смесь затем нейтрализовали до рН 7-8 при помощи насыщенного водного раствора карбоната натрия, поддерживая при этом температуру около 10 С. Реакционную смесь затем перемешивали при комнатной температуре в течение 1 ч. Прибавляли воду и органическую фазу экстрагировали дихлорметаном. Объединенные органические слои промывали водой, сушили над безводным сульфатом натрия и растворитель удаляли в вакууме. Соединение затем очищали при помощи колоночной хроматографии с силикагелем, используя дихлорметан как элюент, что дает 6,1 г 3-бром-1-этилпиразин-2(1 Н)-она в виде порошка. Выход: 40,2%. 1 Н ЯМР (300 МГц/DMSO-d6)(м.д.): 1,18 (t, 3H), 3,87 (q, 2H), 7,13 (d, 1H), 7,75 (d, 1H). Следующие соединения были получены с применением аналогичной процедуры, как и в примере 4. Пример 4-2. 3-Бром-1-метилпиразин-2(1 Н)-онTHF прибавляли 159 мкл (1,35 мМ) бензилтиола. Реакционную смесь затем перемешивали при комнатной температуре в течение 16 ч. Прибавляли воду и органическую фазу экстрагировали этилацетатом. Объединенные органические слои промывали водой, сушили над безводным сульфатом натрия и растворитель удаляли в вакууме, что дает порошок, который растирали в диизопропилоксиде, фильтровали и сушили в вакууме, что дает 250 мг 3-(бензилтио)-1-этилпиразин-2(1 Н)-она. Выход: 82%. 1 Н ЯМР (300 МГц/DMSO-d6)(м.д.): 1,24 (t, 3H), 3,92 (q, 2H), 4,26 (s, 2H), 7,31 (m, 4H), 7,39 (d, 2H),7,49 (d, 1H). Пример 6. 3-Бензилсульфонил-1-этилпиразин-2(1 Н)-он К 177 мг (0,72 мМ) 3-(бензилтио)-1-этилпиразин-2(1 Н)-она и 66,4 мг (0,79 мМ) гидрокарбоната натрия в 4 мл тетрагидрофурана прибавляли 1,67 г (2,87 мМ) пероксимоносульфата калия (оксон) в 4 мл воды. Реакционную смесь затем перемешивали при комнатной температуре в течение 16 ч. Прибавляли воду и органическую фазу экстрагировали дважды этилацетатом. Объединенные органические слои промывали водой, сушили над безводным сульфатом натрия и растворитель удаляли в вакууме, что дает порошок, который растирали в диизопропилоксиде, фильтровали и сушили в вакууме, что дает 103 мг 3-бензилсульфонил-1-этилпиразин-2(1H)-она. Выход: 52%. 1 Н ЯМР (300 МГц/DMSO-d6)(м.д.): 1,34 (t, 3H), 4,10 (q, 2H), 4,91 (s, 2H), 7,34 (m, 5H), 7,57 (d, 1H),8,22 (d, 1H). Следующие соединения были получены с применением аналогичной процедуры, как и в примере 6. Пример 6-2. 3-[(4-Хлорбензил)сульфонил]-1-этилпиразин-2(1 Н)-он 25,4 г (117 мМ) 3-бром-1-пропилпиразин-2(1 Н)-он и 8,9 г (117 мМ) тиомочевины в 120 мл этанола перемешивали при комнатной температуре в течение 2 ч. Осадок отфильтровывали, промывали этанолом и сушили в вакууме, что дает 26,8 г 3-оксо-4-пропил-3,4-дигидропиразин-2-ил имидотиокарбамата в виде его гидробромида. Выход: 78,1%. 1 Н ЯМР (300 МГц/DMSO-d6)(м.д.): 0,88 (t, 3H), 1,71 (m, 2H), 3,92 (t, 2H), 7,46 (s, 1 Н), 7,88 (s, 1 Н),9,44 (m, 2 Н), 9,81 (s, 2H). Следующие соединения были получены с применением аналогичной процедуры, как и в примере 7. Пример 7-2. 4-Этил-3-оксо-3,4-дигидропиразин-2-ил имидотиокарбамат 26,7 г (91,3 мМ) гидробромида 3-оксо-4-пропил-3,4-дигидропиразин-2-ил имидотиокарбамата в 25 мл 3 N водного раствора гидроксида натрия перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь нейтрализовали при помощи HCl 3 N и осадок отфильтровывали, промывали водой и сушили в вакууме, что дает 9,7 г 3-меркапто-1-пропилпиразин-2(1 Н)-она в виде желтого порошка. Выход: 62,3%. 1 Н ЯМР (300 МГц/DMSO-d6)(м.д.): 0,86 (t, 3H), 1,62 (m, 2H), 3,72 (t, 2H), 6,5 (d, 1H), 7,07 (d, 1H),13,46 (s, 1H). Следующие соединения были получены с применением аналогичной процедуры, как и в примере 8. Пример 8-2. 3-Меркапто-1-бутилпиразин-2(1 Н)-он 500 мг (2,30 мМ) 3-меркапто-1-пропилпиразин-2(1 Н)-она, 319,2 мкл (1,21 мМ) 4-хлорбензилбромида и 637 мг (4,6 мМ) карбоната калия в 4 мл тетрагидрофурана перемешивали всю ночь при комнатной температуре. Прибавляли воду и водный слой экстрагировали этилацетатом. Органический слой отделяли и промывали водой, сушили над безводным сульфатом натрия и выпаривали в вакууме, что дает масло, которое очищали при помощи колоночной хроматографии с силикагелем, используя дихлорметан/диметилкетон (98/2) как элюент, что дает 600 мг 3-[(4-хлорбензил)-тио]-1-пропилпиразин-2(1H)она. Выход: 88%. 1 Н ЯМР (300 МГц/DMSO-d6)(м.д.): 0,83 (t, 3H), 1,63 (m, 2H), 3,80 (t, 2H), 4,23 (s, 2 Н), 7,27 (d, 1 Н),7,36 (m, 4 Н), 7,43 (d, 1H). Пример 10. 3-[(4-Хлорбензил)сульфонил]-1-пропилпиразин-2(1 Н)-он К 360 мг (1,17 мМ) 3-[(4-хлорбензил)-тио]-1-пропилпиразин-2(1 Н)-она и 107,7 мг (1,28 мМ) гидрокарбоната натрия в 2 мл тетрагидрофурана прибавляли 2,9 г (4,7 мМ) оксона в 2 мл воды. Реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Прибавляли воду и водный слой экстрагировали этилацетатом. Органический слой отделяли и промывали водой, сушили над безводным сульфатом натрия и выпаривали в вакууме. Остаток помещали в диизопропилоксид, отфильтровывали и промывали диизопропилоксидомом, что дает 90 мг 3-[(4-хлорбензил)сульфонил]-1-пропилпиразин-2(1 Н)она. Выход: 23%. 1 Н ЯМР (300 МГц/DMSO-d6)(м.д.): 0,90 (t, 3H), 1,75 (m, 2H), 4,02 (t, 2H), 4,93 (s, 2H), 7,34 (d, 2H),7,41 (d, 2H), 7,58 (d, 1H), 8,24 (d, 1H).C14H15ClN2O3S=326,8. Мас. 327,0 (М+1); т.пл.: 125-128 С. Следующие соединения были получены с применением аналогичной процедуры, как и в примереC14H13ClN2O4S=340,78. Мас. 341,0 (М+1). С применением аналогичной процедуры, как и в примере 10, с одним эквивалентом пероксимоносульфата калия (оксон), было синтезировано следующее соединение. Пример 10-9. 3-[(4-Хлорбензил)сульфинил]-1-этилпиразин-2(1 Н)-он К 35 г (290 мМ) гидрохлорида этиламинаоацетонитрила в 500 мл дихлорметана прибавляли 40,9 мл(435 мМ) оксалилбромида. Реакционную смесь кипятили в течение 20 ч при перемешивании. Растворитель удаляли в вакууме и затем остаток очищали при помощи колоночной хроматографии с силикагелем,используя дихлорметан как элюент, что дает 10 г 3,5-дибром-1-этилпиразин-2(1 Н)-она в виде белого порошка. Выход: 12,2%. 1 Н ЯМР (300 МГц/DMSO-d6)(м.д.): 1,26 (t, 3H), 3,92 (q, 2H), 8,20 (s, 1H). Следующие соединения были получены с применением аналогичной процедуры, как и в примере 11. Пример 11-2. 3,5-Дихлор-1-этилпиразин-2(1 Н)-он(35,5 мМ) карбоната калия в 40 мл тетрагидрофурана перемешивали в течение 4 ч при комнатной температуре. Прибавляли 100 мл воды и полученный таким образом осадок отфильтровывали, промывали водой и сушили, что дает 4,8 г 5-бром-3-[(4-хлорбензил)-тио]-1-этилпиразин-2(1 Н)-она в виде порошка. Выход: 75,4%. 4,6 г (12,7 мМ) 5-бром-3-[(4-хлорбензил)-тио]-1-этилпиразин-2(1 Н)-она и 9,9 г (40 мМ) метахлорнадбензойной кислоты (70%) в 75 мл дихлорметана перемешивали в течение 10 мин при комнатной температуре. Прибавляли 2 М водный раствор метабисульфита натрия, органический слой отделяли и промывали водным раствором гидрокарбоната натрия, затем водой и выпаривали в вакууме. Остаток помещали в диизопропилоксид. Порошок отфильтровывали и промывали диизопропилоксидом, что дает 4,3 г 5-бром-3-[(4-хлорбензил)сульфонил]-1-этилпиразин-2(1 Н)-она. Выход: 87%. 1 Н ЯМР (300 МГц/DMSO-d6)(м.д.): 1,31 (t, 3H), 4,01 (q, 2H), 4,89 (s, 2H), 7,35 (d, 2H), 7,42 (d,2H),8,61 (s, 1H).Pd(PPh3) в 4 мл толуола перемешивали в течение 10 мин при комнатной температуре в атмосфере азота. Прибавляли 93,4 мг (0,77 мМ) фенилборной кислоты и 1,5 мл 2 М водного раствора карбоната цезия и реакционную смесь кипятили при перемешивании в течение 1 ч. Прибавляли 10 мл воды и 10 мл толуола, органический слой отделяли. Водный слой экстрагировали толуолом и объединенные органические слои отделяли и промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток затем очищали при помощи колоночной хроматографии с силикагелем, используя дихлорметан/диметилкетон (95/5) как элюент, что дает 52 мг 3-[(4-хлорбензил)сульфонил]-1-этил-5 фенилпиразин-2(1 Н)-она в виде порошка. Выход: 26%. 1 Н ЯМР (300 МГц/DMSO-d6)(м.д.): 1,38 (t, 3H), 4,13 (q, 2H), 5,00 (s, 2H), 7,41 (m, 7H), 7,83 (d, 2H),8,84 (s, 1H). 5 г (25,9 мМ) 3,5-дихлор-1-этилпиразин-2(1H)-она и 2 г (26 мМ) тиомочевины в 50 мл этанола перемешивали в течение 4 ч при комнатной температуре. Растворитель удаляли в вакууме и остаток помещали в ацетонитрил, что дает 4,7 г гидрохлорида 6-хлор-4-этил-3-оксо-3,4-дигидропиразин-2-илимидотиокарбамата в виде порошка. Выход: 67,4%. Свободное основание C7H9ClN4OS=234,7. Мас. 233,0 (М-1). Пример 16. 5-Хлор-1-этил-3-меркаптопиразин-2(1 Н)-он 4,6 г (17,5 мМ) гидрохлорида 6-хлор-4-этил-3-оксо-3,4-дигидропиразин-2-ил-имидотиокарбамата в 25 мл 3 N водного раствора гидроксида натрия перемешивали при 65 С в течение 1 ч. Реакционную смесь нейтрализовали при помощи 3 N водной хлористо-водородной кислоты и полученный таким образом осадок отфильтровывали, что дает 2,7 г 5-хлор-1-этил-3-меркаптопиразин-2(1H)-она в виде желтого порошка. Выход: 81%. 200 мг (1,05 мМ) 5-хлор-1-этил-3-меркаптопиразин-2(1 Н)-она, 178 мг (1 мМ) 2-хлор-Nфенилацетамида и 135,6 мг (1,05 мМ) диизопропилэтиламина в 5 мл тетрагидрофурана перемешивали всю ночь при комнатной температуре. Прибавляли воду и осадок отфильтровывали и промывали водой,что дает 170 мг 2-[(6-хлор-4-этил-3-оксо-3,4-дигидропиразин-2-ил)-тио]-N-фенилацетамида. Выход: 50%. К 100 мг (0,31 мМ) 2-[(6-хлор-4-этил-3-оксо-3,4-дигидропиразин-2-ил)-тио]-N-фенилацетамида и 26 мг (0,31 мМ) гидрокарбоната натрия в 2 мл тетрагидрофурана прибавляли 760 мг (1 мМ) оксона в 2 мл воды. Реакционную смесь перемешивали всю ночь при комнатной температуре. Прибавляли воду, осадок отфильтровывали и промывали водой, что дает 55 мг 2-[(6-хлор-4-этил-3-оксо-3,4-дигидропиразин-2 ил)сульфонил]-N-фенилацетамида в виде порошка. Выход: 50%. 1 Н ЯМР (300 МГц/DMSO-d6)(м.д.): 1,30 (t, 3H), 4,05 (q, 2H), 4,71 (s, 2H), 7,11 (m, 1H), 7,30 (t, 2H),7,46 (d, 2H), 8,60 (s, 1H), 10,49 (s, 1H); т.пл.: 178-180 С. Пример 18-2. 5-Хлор-1-этил-3-[(2-оксо-2-пиперидин-1-илэтил)сульфонил]пиразин-2(1 Н)-онINS-1 клетки были выделены, чтобы оценить соединения настоящего изобретения, их превосходящую реакцию на глюкозу и другие физиологические и фармакологические стимуляторы секреции инсулина. Культура поджелудочных INS-1 клеток.INS-1 клетки были выращены в полной среде RPMI1640, содержащей 1 мМ пирувата натрия,50 мкМ 2-меркаптоэтанола, 2 мМ глутамина, 10 мМ HEPES, 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина (СМ), дополненного 10 мМ глюкозой, и 10% (об./об.) инактивированной нагреванием фетальной телячьей сыворотки (ФТС), как описано Asfari et al. (Endocrinology 130: 167-178,1992). Испытания секреции инсулина.INS-1 клетки были высеяны и выращены в 48-ячеечных планшетах. После 2 дней выращивания среда была удалена и клетки были выращены на протяжении 24 ч со средой, замененной на 5 мМ глюкозы, 1% ФТС. Клетки потом были промыты бикарбонатным HEPES буфером Кребса-Ринге (KRBH; 135 мМ NaCl; 3.6 мМ KCl; 5 мМ NaHCO3; 0,5 мМ NaH2PO4; 0,5 мМ MgCl2; 1,5 мМ CaCl2 и 10 мМ HEPES; pH 7,4) 0,1% АБС, содержащим 2,8 мМ глюкозы и преинкубированным на протяжении 30 мин при 37 С в том же буфере. Клетки потом были промыты дважды и инкубированы на протяжении 1 ч в KRBH 0,1% АБС, содержащим 4,2 мМ глюкозы и разные концентрации тестируемых молекул. Концентрация инсулина в собранных супернатантах была измерена твердофазным иммуноферментным анализом, используя антиинсулиновые антитела крысы (Insulin Rat Elit PLUS, cat. ref 10-1145-01). Результаты секреции инсулина выражены в % относительно контрольного образца (глюкоза 4,2 мМ). Секреция инсулина в INS-1 клетках (глюкоза при 4,2 мМ) Секреция инсулина в островках N0STZ крысы, больной диабетом. Материалы и способы. Изоляция островков и обработки. 14+3-недельные неголодные N0STZ (PORTHA et al., 1974) крысы мужского пола (Charles RiversDomaine des Oncins, I'Arbresle, France) были усыплены фенобарбиталом натрия (Nembutal: 45 мг/кг в 5 мл/кг, введенным внутрибрюшинно) и температура тела поддерживалась лампой для обогрева. Островки Лангеганса поджелудочной железы крысы были отделены от поджелудочной железы 8 крыс ферментацией с коллагеназой Р (Boehringer, Meylan, France). Островки были очищены осаждением в сбалансированном солевом растворе Хенкса [NaCl (137 мМ); KCl (5,36 мМ); MgSO4, 7 Н 2 О (0,81 мМ);Na2HPO4, 12 Н 2 О (0,34 мМ); KH2PO4 (0,44 мМ); CaCl2, 2 Н 2 О (1,26 мМ); NaHCO3 (4,17 мМ)] с последующим градиентным разделением Фиколла. Островки потом были отсортированы вручную под стереоскопическим микроскопом и экспериментальные серии 3 островков были инкубированы на протяжении 90 мин при 37 С с непрерывным встряхиванием в режиме увлажнения (95% О 2, 5% СО 2) в 1 мл раствора Кребс/Hepes рН 7 [NaCl (115 мМ),NaHCO3 (24 мМ), KCl (5 мМ), MgCl2 (1 мМ), CaCl2, 2 Н 2 О (1 мМ), 0,2% альбумина бычьей сыворотки(Fraction V, fatty acid free, Boehringer, Mannheim), 10 мМ Hepes], содержащим необходимую концентрацию глюкозы или соединения. Соединения были растворены в ДМСО до 2,10-2 М матричных растворов. Они потом были разбавлены до необходимой концентрации в буфере Кребса/Hepes, содержащем необходимую концентрацию глюкозы. В конце инкубации среда была собрана и уровни инсулина были измерены, используя твердофазный иммуноферментный анализ (EUROBIO, Courtaboeuf, France). Дозозависимый эффект соединений на секрецию инсулина в островках Островки были отсортированы вручную и инкубированы в присутствии увеличивающихся концентраций соединений в присутствии глюкозы при 2,8 или 8 мМ. В конце инкубации среда была собрана и уровни инсулина были измерены, используя способ твердофазного иммуноферментативного анализа. Результаты выражены в виде % контрольного образца глюкозы (2,8 или 8 мМ) и представлено значениеСОС (стандартная ошибка среднего). В островках, выделенных из N0STZ крыс больных диабетом, соединения не показывают никакого эффекта в присутствии низкой, не стимулирующей, концентрации глюкозы (2,8 мМ), даже при высокой концентрации (10-4 М), в то время как они усиливали секрецию инсулина в ответ на 8 мМ глюкозы, стимулирующую концентрацию глюкозы. Эти результаты показывают, что эффект соединений на секрецию инсулина зависит от уровня глюкозы и означает, что лечением этими соединениями можно избежать гипогликемического риска. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I)R3 выбран из водорода, галогена или (С 6-С 14)арила, где арил, возможно, замещен одним или более заместителями Y;R4 выбран из (С 6-С 14)арил(С 1-С 6)алкила, который, возможно, замещен одним или более заместителями Y;R7 и R8 вместе с атомом азота, к которому они присоединены, образуют гетероцикл; гетероцикл может включать один гетероатом, выбранный из N, О и S;Y выбран из гидроксигруппы, тиогруппы, галогена, цианогруппы, трифторметоксигруппы, трифторметила, карбоксигруппы, карбоксиметила, карбоксиэтила, (С 1-С 6)алкила, (С 1-С 6)алкоксигруппы, (С 1 С 6)алкиламиногруппы, (С 6-С 14)арила, (С 6-С 14)арилсульфинил(С 1-С 6)алкила, (С 6-С 14)арилоксигруппы, (С 6 С 14)арил(С 1-С 6)алкоксигруппы, аминогруппы, азидогруппы, нитрогруппы, гуанидиногруппы, амидиногруппы, фосфоногруппы, оксогруппы, карбамоила, (С 1-С 6)алкилсульфонила, (С 1-С 6)алкилсульфинила или (С 1-С 6)алкилтиогруппы или две Y группы могут образовывать метилендиоксигруппу; где термин "гетероарил" относится к 5-14-членному гетероарилу, содержащему от 1 до 4 гетероатомов, выбранных из N, О и S; термин "гетероцикл" относится к пиперидину, морфолину, пиперазину, пирролидину, тиазолидину,оксазолидину, пиразолидину, изоксазолидину или имидазолидину; и его рацемические формы, энантиомеры, диастереомеры и их смеси, и его фармацевтически приемлемые соли. 2. Соединение по п.1,где n=2;R4 выбран из (С 6-С 14)арил(С 1-С 6)алкила, который, возможно, замещен одним или более заместителями Y;R7 и R8 вместе с атомом азота, к которому они присоединены, образуют гетероцикл; гетероцикл может включать один гетероатом, выбранный из N, О и S;Y выбран из гидроксигруппы, тиогруппы, галогена, цианогруппы, трифторметоксигруппы, трифторметила, карбоксигруппы, карбоксиметила, карбоксиэтила, (С 1-С 6)алкила, (С 1-С 6)алкоксигруппы, (С 1 С 6)алкиламиногруппы, (С 6-С 14)арила, (С 6-С 14)арилсульфинил(С 1-С 6)алкила, (С 6-С 14)арилоксигруппы, (С 6 С 14)арил(С 1-С 6)алкоксигруппы, аминогруппы, азидогруппы, нитрогруппы, гуанидиногруппы, амидиногруппы, фосфоногруппы, оксогруппы, карбамоила, (С 1-С 6)алкилсульфонила, (С 1-С 6)алкилсульфинила или (С 1-С 6)алкилтиогруппы или две Y группы могут образовывать метилендиоксигруппу; и его рацемические формы, энантиомеры, диастереомеры и их смеси, и его фармацевтически приемлемые соли. 3. Соединение по любому из пп.1 или 2, где R1 означает метил, этил, пропил или бутил. 4. Соединение по любому из пп.1-3, где R3 означает Cl, Br или фенил, необязательно замещенный одной или более группами Y. 5. Соединение по любому из пп.1-4, где R4 означает бензил, фенилэтил или 2-оксо-2-пиперидин-1 илэтил, где каждая из этих групп необязательно замещена одной или более группами Y. 6. Соединение по любому из пп.1-5, где Y означает галоген, трифторметил, (С 1-С 6)алкил или(С 1-С 6)алкоксигруппу. 7. Соединение, выбранное из следующих соединений: так же, как их рацемические формы, энантиомеры, диастереомеры и их смеси, и их фармацевтически приемлемые соли. 8. Способ получения соединения общей формулы (I) по любому из пп.1-7, включающий: а) взаимодействие соединения формулы (1) с амином R1-NH2, где R1 является таким, как определено в п.1, в присутствии четвертичной аммониевой соли в инертном растворителе с получением соединения формулы (2); взаимодействие соединения формулы (2) с защищенным диалкилацетатом аминоацетальдегида в растворителе с получением соединения формулы (3); циклизацию соединения формулы (3) в кислотных условиях в растворителе с каталитическим количеством концентрированной хлористо-водородной кислоты с получением соединения формулы (4);b) бромирование соединения формулы (4), где R1 является таким, как определено в п.1, с применением бромирующего агента в инертном растворителе с получением соединения формулы (5) взаимодействие соединения формулы (5) с подходящим тиолом R4-SH, где R4 является таким, как определено в п.1, в присутствии по крайней мере одного эквивалента основания в растворителе с получением соединения формулы (I), где n=0; взаимодействие соединения формулы (I), где n=0, с окисляющими агентами в присутствии основания в растворителе с получением производного сульфона (I), где n=2. 9. Способ получения соединения общей формулы (I) по любому из пп.1-7, включающий: а) взаимодействие соединения формулы (1) с амином R1-NH2, где R1 является таким, как определено в п.1, в присутствии четвертичной аммониевой соли в инертном растворителе с получением соединения формулы (2); взаимодействие соединения формулы (2) с защищенным диалкилацетатом аминоацетальдегида в растворителе с получением соединения формулы (3); циклизацию соединения формулы (3) в кислотных условиях в растворителе с каталитическим количеством концентрированной хлористо-водородной кислоты с получением соединения формулы (4);b) бромирование соединения формулы (4), где R1 является таким, как определено в п.1, с применением бромирующего агента в инертном растворителе с получением соединения формулы (5) взаимодействие соединения формулы (5) с тиомочевиной в растворителе с получением имидотиокарбамата (8); гидролиз (8) в присутствии основания с получением соответствующего 3-меркаптопиразинона (9); взаимодействие 3-меркаптопиразинонов (9) с галогено-R4, где R4 является таким, как определено в п.1, в присутствии по крайней мере одного эквивалента основания в растворителе с получением соединения формулы (I), где n=0; взаимодействие соединения формулы (I), где n=0, с окисляющими агентами в присутствии основания в растворителе с получением производного сульфона (I), где n=2. 10. Фармацевтическая композиция для стимуляции секреции инсулина, содержащая по крайней мере одно соединение общей формулы (I) и/или его фармацевтически приемлемую соль по любому из пп.17 в комбинации с одним или несколькими фармацевтически приемлемыми носителем, адъювантом, разбавителем или эксципиентом. 11. Применение по крайней мере одного соединения общей формулы (I) по любому из пп.1-7, а также его рацемических форм, энантиомеров, диастереомеров, их смесей и их фармацевтически приемлемых солей, для приготовления лекарственного средства для предупреждения и/или лечения патологий,связанных с гипергликемией; для приготовления лекарственного средства, стимулирующего секрецию инсулина в ответ на концентрацию глюкозы, для лечения диабета, для предупреждения и/или лечения диабета II типа и патологий, связанных с расстройствами метаболизма, гиперхолестеринемией, гиперлипидемией, которые увеличиваются гиперинсулинемией и гипергликемией; для лечения болезней, выбранных из диабетов, связанных с микрососудистыми и макрососудистыми осложнениями, артериальной гипертензии, воспалительных процессов, микроангиопатии, макроангиопатии, ретинопатии и невропатии; для уменьшения гипергликемии, для лечения дислипидемии и ожирения или сердечно-сосудистых болезней, включая атеросклероз и ишемию миокарда.
МПК / Метки
МПК: A61K 31/4965, A61P 3/10, C07D 241/18
Метки: секреции, лечения, применение, производные, инсулина, способы, диабетов, пиразинона, стимуляторы, получения
Код ссылки
<a href="https://eas.patents.su/24-21325-proizvodnye-pirazinona-kak-stimulyatory-sekrecii-insulina-sposoby-ih-polucheniya-i-ih-primenenie-dlya-lecheniya-diabetov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиразинона как стимуляторы секреции инсулина, способы их получения и их применение для лечения диабетов</a>
Предыдущий патент: Ключ и дисковый переключатель цилиндрического замка
Следующий патент: Способ получения охлаждающего элемента и охлаждающий элемент
Случайный патент: Способ получения синтетического бензинового топлива и бензиновое топливо, полученное таким способом