Пуриновые соединения
Номер патента: 20529
Опубликовано: 28.11.2014
Авторы: Сандерсон Адам Ян, Астлс Питер Чарльз, Гвидетти Росселла, Холлиншед Шон Патрик
Формула / Реферат
1. Соединение формулы
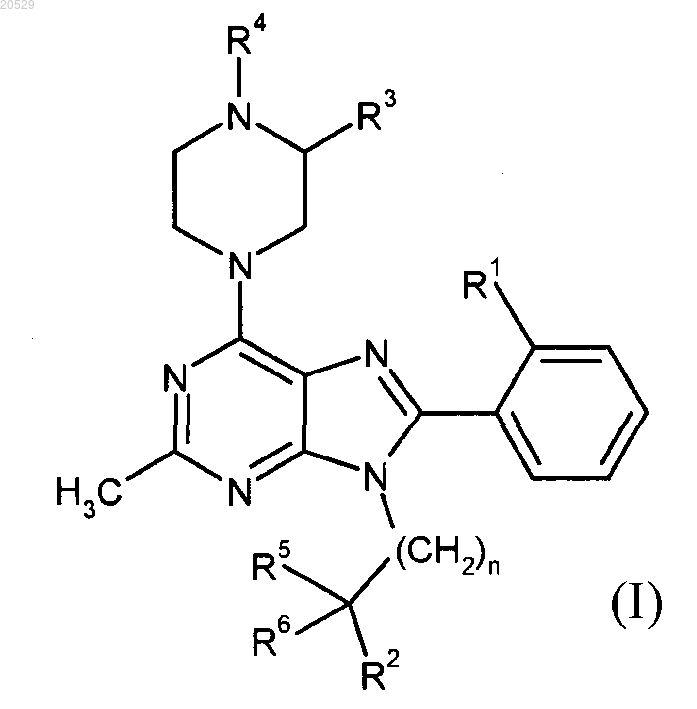
где R1 представляет собой Cl или СН3;
R2 представляет собой ОН, ОСН3, СН2ОН или СН2ОСН3;
R3 представляет собой Н или совместно с R4 образует конденсированный пирролидин-2-он;
R4 представляет собой C1-C2 алкил, C1-C2 фторалкил, С(O)СН3 или CO2CH3;
R5 представляет собой Н, СН3 или СН2ОСН3;
R6 представляет собой Н, СН3 или совместно с R5 образует циклопропановое кольцо;
n равно 0 или 1,
или фармацевтически приемлемая соль указанного соединения.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где R1 представляет собой Cl.
3. Соединение по любому из пп.1 или 2 или его фармацевтически приемлемая соль, где R2 представляет собой ОН или СН2ОН.
4. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль, где R2 представляет собой СН2ОН.
5. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, где R3 представляет собой Н и R4 представляет собой метил, этил, 2-фторэтил или С(O)СН3.
6. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль, где R3 представляет собой Н и R4 представляет собой метил.
7. Соединение по любому из пп.1-6 или его фармацевтически приемлемая соль, где R5 и R6 независимо выбраны из Н и СН3.
8. Соединение по любому из пп.1-7 или его фармацевтически приемлемая соль, где R5 представляет собой Н и R6 представляет собой СН3.
9. Соединение по любому из пп.1-8 или его фармацевтически приемлемая соль, где n равно 0.
10. Соединение по п.1, представляющее собой 2-[8-(2-хлорфенил)-2-метил-6-(4-метилпиперазин-1-ил)пурин-9-ил]пропан-1-ол, или его фармацевтически приемлемая соль.
11. Соединение по п.1, представляющее собой (2R)-2-[8-(2-хлорфенил)-2-метил-6-(4-метилпиперазин-1-ил)пурин-9-ил]пропан-1-ол, или его фармацевтически приемлемая соль.
12. Фармацевтическая композиция для лечения боли, содержащая соединение по любому из пп.1-11 или его фармацевтически приемлемую соль и фармацевтически приемлемый разбавитель или носитель.
13. Применение соединения по любому из пп.1-11 или его фармацевтически приемлемой соли для лечения или предотвращения боли.
14. Применение по п.13 для лечения боли.
15. Применение по п.14 для лечения остеоартритной боли.
16. Применение по п.13 для лечения или предотвращения боли, вызванной химиотерапией.
17. Способ для лечения или предотвращения боли, включающий введение эффективного количества соединения по любому из пп.1-11 или его фармацевтически приемлемой соли нуждающемуся в этом человеку или животному.
18. Способ по п.17 для лечения боли.
19. Способ по п.17 для лечения остеоартритной боли.
20. Способ по п.17 для лечения или предотвращения боли, вызванной химиотерапией.
Текст
(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) и фармацевтические композиции для лечения или предотвращения боли.(GPCR). Рецепторы CB1 экспрессируются как в центральной, так и в периферической системе, тогда как рецепторы СВ 2 экспрессируются преимущественно в периферической системе, в основном в клетках и тканях иммунной системы. В недавнем обзоре, посвященном фармакологическому и терапевтическому потенциалу рецептора СВ 2 (Br. J. Pharmacol. (2008) 153, 319-334), СВ 2 идентифицирован в качестве терапевтической мишени для лечения боли, в частности воспалительной и невропатической боли. Агонисты СВ 2, в частности селективные в отношении СВ 2 агонисты, представляют собой мишень для лечения боли с ограничением побочных эффектов, опосредованных центральной нервной системой.WO 2004/037823 относится к пуриновым соединениям и их применению в качестве лигандов каннабиоидных рецепторов, в частности в качестве антагонистов рецептора СВ 1. В связи с побочными эффектами, связанными с существующими пероральными фармакологическими агентами, по-прежнему существует необходимость в разработке альтернативных способов терапии для лечения боли. Согласно настоящему изобретению предложено соединение формулыR2 представляет собой ОН, ОСН 3, СН 2 ОН или СН 2 ОСН 3;R6 представляет собой Н, СН 3 или совместно с R5 образует циклопропановое кольцо иn равно 0 или 1,или фармацевтически приемлемая соль указанного соединения. Было обнаружено, что соединения согласно настоящему изобретению являются агонистами рецептора CB2 in vitro. Некоторые соединения согласно настоящему изобретению обладают большей активностью по сравнению с существующими агонистами CB2. Некоторые соединения согласно настоящему изобретению представляют собой селективные агонисты CB2. Некоторые соединения согласно настоящему изобретению обладают большей селективностью в отношении CB2 по сравнению с существующими агонистами СВ 2. Некоторые соединения согласно настоящему изобретению обладают потенциалом для приемлемого профиля побочного действия у людей. Согласно настоящему изобретению предложена фармацевтическая композиция, содержащая соединение согласно настоящему изобретению или его фармацевтически приемлемую соль и фармацевтически приемлемый разбавитель или носитель. Кроме того, согласно настоящему изобретению предложена фармацевтическая композиция, содержащая соединение согласно настоящему изобретению или его фармацевтически приемлемую соль совместно с фармацевтически приемлемым разбавителем или носителем и, необязательно, одним или более другими терапевтическими ингредиентами. Согласно настоящему изобретению предложено соединение или его фармацевтически приемлемая соль для применения в терапии. Согласно настоящему изобретению предложено соединение или его фармацевтически приемлемая соль для применения для лечения боли, в частности остеоартритной боли. Согласно другому аспекту настоящего изобретения предложено применение соединения или его фармацевтически приемлемой соли для получения лекарственного средства для лечения боли, в частности остеоартритной боли. Согласно другому аспекту настоящего изобретения предложено применение соединения или его фармацевтически приемлемой соли для получения медикамента для лечения или предотвращения боли, в частности боли, вызванной химиотерапией. Согласно настоящему изобретению предложен способ лечения боли, включающий введение эффективного количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли человеку или животному, нуждающемуся в этом. Согласно настоящему изобретению предложен способ лечения или предотвращения боли, включающий введение эффективного количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли человеку или животному, нуждающемуся в этом. Согласно настоящему изобретению также предложен способ лечения остеоартритной боли, включающий введение эффективного количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли человеку или животному, нуждающемуся в этом. Согласно настоящему изобретению также предложен способ лечения или предотвращения боли,вызванной химиотерапией, включающий введение эффективного количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли человеку или животному, нуждающемуся в этом. Соединения согласно настоящему изобретению предпочтительно применять для лечения боли, в частности воспалительной боли, более конкретно боли в суставах, наиболее конкретно остеоартритной боли. Соединения согласно настоящему изобретению предпочтительно применять для лечения или предотвращения боли, в частности боли, вызванной химиотерапией. Также было установлено, что агонисты рецептора СВ 2 обладают терапевтическим потенциалом для лечения рассеянного склероза (Br. J. Pharmacol. (2008) 153, 216-225 и J. Biol. Chem. (2008) 283, 1332013329). Также было установлено, что агонисты рецептора СВ 2 обладают потенциалом для лечения боли в костях, вызванной раком (Life Sciences 86 (2010) 646-653). Предпочтительные варианты реализации настоящего изобретения представляют собой соединения формулы или их фармацевтически приемлемые соли, где R2, R4, R5, R6 и n являются такими, как определено выше. Предпочтительные варианты реализации настоящего изобретения представляют собой соединения формулы или их фармацевтически приемлемые соли, где R2, R4, R5 и R6 являются такими, как определено в настоящем патенте. Некоторые классы соединений формул (I), (II) или (III) являются предпочтительными. В следующих пронумерованных группах описаны указанные предпочтительные классы: 1) R1 представляет собой Cl; 2) R2 представляет собой ОН или СН 2 ОН; 3) R2 представляет собой СН 2 ОН; 4) R3 представляет собой Н; 5) R4 представляет собой C1-C2 алкил, C1-C2 фторалкил или С(O)СН 3; 6) R4 представляет собой метил, этил, 2-фторэтил или С(O)СН 3;7) R4 представляет собой метил или этил; 8) R5 представляет собой Н или CH3; 9) R5 представляет собой Н; 10) R6 представляет собой Н или СН 3; 11) R6 представляет собой СН 3; 12) n представляет собой 0; 13) R5 представляет собой Н и R6 представляет собой СН 3; 14) R2 представляет собой ОН или СН 2 ОН и R4 представляет собой метил, этил, 2-фторэтил или С(O)СН 3; 15) R2 представляет собой ОН или СН 2 ОН и R4 представляет собой метил или этил; 16) R2 представляет собой ОН или СН 2 ОН и R4 представляет собой метил; 17) R2 представляет собой СН 2 ОН; R4 представляет собой метил, этил, 2-фторэтил или С(O)СН 3; R5 представляет собой Н и R6 представляет собой СН 3. Фармацевтически приемлемые соли каждого соединения согласно настоящему изобретению включены в объем настоящего изобретения. Следует понимать, что если в настоящей заявке какая-либо группа охарактеризована как "определенная в настоящей заявке" или "как определено в настоящей заявке", то указанная группа включает первое из приведенных и самое широкое определение наряду со всеми без исключения конкретными определениями указанной группы. Выше и далее в описании изобретения следующие термины, если иное не указано, имеют следующие значения. В настоящей заявке термин С 1-С 2 алкил относится к метилу или этилу. В настоящей заявке термин С 1-С 2 фторалкил относится к С 1-С 2 алкильной группе, определенной в настоящей заявке, где один или более атомов водорода заменены на фтор, и включает трифторметил, 2 фторэтил, 2,2-дифторэтил и 2,2,2 трифторэтил. Предпочтительно С 1-С 2 фторалкильная группа представляет собой 2-фторэтил. В настоящей заявке термины "изомер 1" и "изомер 2" относятся к конкретным энантиомерам конечных соединений или промежуточных соединений, при этом "изомер 1" относится к первому из соединений, вымываемых в ходе описанного хроматографического процесса, а "изомер 2" относится ко второму из вымываемых соединений. Когда термин "изомер 1" или "изомер 2" сначала приведен в отношении промежуточного соединения, указанный термин также относится к конечному соединению. В настоящей заявке термин "фармацевтически приемлемая соль" относится к солям соединений согласно настоящему изобретению, которые, по существу, являются нетоксичными для живых организмов. Указанные соли и общая методика их получения хорошо известны в данной области техники; см., например, P. Stahl, et al., Handbook of Pharmaceutical Salts: Properties Selection and Use, (VCHA/Wiley-VCH,2002) и J. Pharm. Sci. 66, 2-19 (1977). Предпочтительно фармацевтически приемлемые соли представляют собой гидрохлорид и оксалат. Варианты реализации изобретения включают примеры, предложенные в настоящей заявке, и несмотря на то, что пример или его соль может быть представлен в одной хиральной или конформационной форме, дополнительные варианты реализации изобретения включают все другие стереоизомерные и/или конформационные формы описанных примеров, а также их фармацевтически приемлемых солей. В настоящей заявке термин "селективные в отношении СВ 2 агонисты" или "селективность в отношении СВ 2" относится к соединениям, имеющим более высокую активность в отношении СВ 2 по сравнению с СВ 2. Предпочтительно соединения согласно настоящему изобретению обладают 100-кратной селективностью в отношении СВ 2. Более предпочтительно соединения согласно настоящему изобретению обладают 500-кратной селективностью в отношении СВ 2. Наиболее предпочтительно соединения согласно настоящему изобретению обладают 1000-кратной селективностью в отношении СВ 2. Соединения согласно настоящему изобретению предпочтительно представлены в виде фармацевтических композиций, которые вводят различными путями. Предпочтительно указанные композиции представляют собой композиции для перорального введения. Указанные фармацевтические композиции и способы их получения хорошо известны в данной области техники; см., например, Remington: The Science и Practice of Pharmacy (A. Gennaro, et al., eds., 19th ed., Mack Publishing Co., 1995). Дифракционные рентгенограммы соединений согласно изобретению можно получать на порошковом рентгеновском дифрактометре Bruker D4 Endeavor, снабженном источником CuK (=1,54060 ) и детектором Vantec, работающим при 35 кВ и 50 мА. Образец сканируют между 4 и 40 при 2, с шагом 0,009 при 2 и скоростью сканирования 0,5 с/шаг, с отклонением 0,6 мм, фиксированным при 5,28 антирассеивателем и щелью детектора 9,5 мм. Погрешность измерения положения пика 0,2 при 2 включает его возможные отклонения и не мешает однозначной идентификации указанной кристаллической формы. Предпочтительное соединение согласно настоящему изобретению представляет собой 2-[8-(2 хлорфенил)-2-метил-6-(4-метилпиперазин-1-ил)пурин-9-ил]пропан-1-ол; более предпочтительное соединение представляет собой(2R)-2-[8-(2-хлорфенил)-2-метил-6-(4-метилпиперазин-1-ил)пурин-9 ил]пропан-1-ол. Предпочтительная форма (2R)-2-[8-(2-хлорфенил)-2-метил-6-(4-метилпиперазин-1-ил)пурин-9 ил]пропан-1-ола характеризуется дифракционным пиком (2-тета значения) на 8,26 на рентгенограмме в комбинации с одним или более пиками, выбранными из 19,68, 14,81 и 13,20;0,2; предпочтительно характеризуется дифракционными пиками на 8,26 и 19,68 в комбинации с одним или более пиками, выбранными из 14,81 и 13,20;0,2. Следующие схемы, примеры получения и примеры приведены для лучшего описания практического осуществления настоящего изобретения. Подходящие условия реакций для этапов указанных схем,примеров получения и примеров известны в данной области техники и соответствующие модификации условий реакций, включая замену растворителей и сопутствующих реагентов, находятся в пределах возможностей специалистов в данной области техники. Более того, специалистам в данной области техники ясно, что в некоторых обстоятельствах порядок введения фрагментов не имеет определяющего значения. Конкретный порядок этапов, необходимых для получения соединений формулы (I), зависит от конкретного синтезируемого соединения, исходного соединения и относительной подвижности замещаемых фрагментов, что очевидно специалисту в области химии. Специалисту в данной области техники ясно, что не все заместители совместимы с любыми условиями проведения реакций. Для таких соединений можно применять введение защитных групп или модифицирование на подходящем этапе синтеза с помощью методов, хорошо известных в данной области техники. Подходящие защитные группы включают защитные группы, описанные в источнике T.W. Greene,"Protective Groups in Organic Synthesis", John Wiley and Sons, New York, N.Y., 1991, далее называемом"Greene". Согласно указанному источнику описаны соответствующие условия "введения" и "удаления" подходящих защитных групп для использования специалистами в данной области техники. Промежуточные вещества и конечные продукты согласно настоящему изобретению при желании могут быть дополнительно очищены с помощью общих методик, таких как перекристаллизация или хроматография на твердых носителях, таких как силикагель или оксид алюминия. Названия соединений согласно настоящему изобретению получали с использованием программыSymyx Version 3,1.NET с названиями функциональных групп согласно IUPAC. Используемые в настоящей заявке аббревиатуры имеют следующие определения: "солевой раствор" означает насыщенный водный раствор хлорида натрия; "БСА" означает бычий сывороточный альбумин;"ДХМ" означает дихлорметан; "DDQ" означает 2,3-дихлор-5,6-дициано-1,4-бензохинон; "DMAC" означает N,N-диметилацетамид; "ДМФА" означает N,N-диметилформамид; "ЭДТА" означает этилендиаминтетрауксусную кислоту; "EtOAc" означает этилацетат, "ГДФ" означает гуанозиндифосфат; "HEPES" означает 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту; "IPA" означает 2-пропанол; "IPAm" означает 2-пропиламин; "МеОН" означает метанол; "SCX" означает колонку, одноразовый картридж или эквивалент, заполненный сильной катионообменной смолой на основе силикагеля; "СФХ" означает сверхкритическую флюидную хроматографию; "ТГФ" означает тетрагидрофуран; "tBOC" означает третбутоксикарбонил. Схема 1 Соединение формулы (I) может быть получено в соответствии с реакциями, показанными на схеме 1. На 1 этапе 4,6-дихлор-2-метилпиримидин-5-иламин подвергали реакции с амином (1) в реакции замещения с получением диаминопиримидина (2). Реакция может протекать в присутствии подходящего основания, такого как триэтиламин или диизопропилэтиламин, в подходящем растворителе, таком как изопропанол, при повышенной температуре, такой как примерно от 100 до 160 С, предпочтительно в герметично закрытой пробирке. Альтернативно, реакцию можно проводить с использованием микроволнового излучения. На 2 этапе из диаминопиримидина (2) и бензальдегида (3) в присутствии кислотного катализатора,такого как хлорид железа на диоксиде кремния или п-толуолсульфоновая кислота, образовывался имин. Реакция проходит в подходящем растворителе, таком как 1,4-диоксан или толуол, при повышенной температуре, такой как примерно от 70 до 110 С. При отсутствии диоксида кремния можно добавлять молекулярные сита для удаления воды из реакционной смеси. После фильтрования для удаления твердого вещества и концентрирования можно проводить окислительную циклизацию имина в подходящем растворителе, таком как дихлорметан, в присутствии окислителя, такого как DDQ (2,3-дихлор-5,6 дицианобензохинон), при подходящей температуре, такой как примерно от -30 до 40 С, с получением 6 хлорпурина формулы (4). На 3 этапе проводили реакцию замещения между 6-хлорпурином (4) и пиперазином (5) с получением пиперазинилпурина формулы (I). Реакция может протекать в присутствии подходящего основания,такого как триэтиламин или диизопропилэтиламин, в растворителе, таком как метанол, этанол или изопропанол, при повышенной температуре, такой как примерно от 50 до 100 С. Альтернативно, реакцию можно проводить с использованием микроволнового излучения. Специалистам в данной области техники ясно, что можно вводить подходящую защитную группу,такую как tBOC, для аминной функциональной группы, присутствующей на пиперазинильном фрагменте. После замещения на 3 этапе можно удалить защитную группу и ацилировать или алкилировать амин для получения дополнительных соединений формулы (I). Схема 2 На схеме 2 показан альтернативный способ получения соединения формулы (I). Диаминопиримидин (2) объединяли с бензальдегидом (3) и пиперазином (5) в присутствии подходящего окислителя, такого как нитробензол или уксусная кислота. Реакцию проводили в подходящем растворителе, таком как метоксибензол, при повышенной температуре, такой как примерно от 120 до 150 С, при сообщении с атмосферой с получением соединения формулы (I). Схема 3 На схеме 3 показан другой альтернативный пример получения соединения формулы (I). На этапе 1 6-хлор-2-метил-4,5-пиримидиндиамин подвергали реакции с бензальдегидом (3) с получением 6-хлорпурина (6), по существу, как описано на схеме 1, этапе 2, выше. На этапе 26-хлорпурин (6) подвергали реакции с пиперазином (5) с получением пиперазинилпурина (7), по существу, как описано на схеме 1, этапе 3, выше. На этапе 3 указанный пиперазинилпурин (7) алкилировали галогеналканом (8) (где X=Br или I) с получением соединения формулы (I). Специалистам в данной области техники очевидно, что существуют различные способы осуществления указанного алкилирования. Например, пиперазинилпурин (7) можно обрабатывать подходящим основанием, таким как гидрид натрия, гидрид калия, карбонат цезия или калия или бис-(триметилсилил)амид натрия или калия. Подходящие растворители включают инертные растворители, такие как ТГФ, диоксан, ДМФА, DMAC или N-метил-2-пирролидинон. Предпочтительно условия включают использование гидрида натрия в ТГФ при подходящей температуре, такой как примерно от -70 до 50 С, с получением соединения формулы (I). Специалистам в данной области техники очевидно, что для соединений формулы (I), где R2 содержит спиртовую группу на конце, можно вводить подходящую защитную группу во время этапа алкилирования с последующим удалением указанной защитной группы. Схема 4 На схеме 4 показан еще один альтернативный способ получения соединения формулы (I). На этапе 1 5-амино-4,6-дихлор-2-метилпиримидин ацилировали бензоилхлоридом (9) с последующим замещением амином (1) с получением аминоамидопиримидина (10). Реакцию проводили в инертном растворителе, таком как диметилацетамид или N-метил-2-пирролидон, при повышенной температуре, такой как от 60 до 100 С, в присутствии бензоилхлорида (9). Добавляли воду и продолжали нагревать до добавления подходящего органического основания, такого как диизопропилэтиламин или триэтиламин, с последующим добавлением амина (1) при продолжении нагревания. На этапе 2 аминоамидопиримидин (10) объединяли с пиперазином (5) в герметизированной колбе с получением соединения формулы (I). Реакцию проводили в подходящем растворителе, таком как изопропанол, при повышенной температуре, такой как от 140 до 180 С, в присутствии подходящего органического основания, такого как диизопропилэтиламин. Пример получения 1. 6-Хлор-N4-(2-метоксиэтил)-2-метилпиримидин-4,5-диамин Раствор 4,6-дихлор-2-метилпиримидин-5-иламина (5,0 г, 0,02 моль), 2-метоксиэтиламина (2,32 г,0,03 моль) и диизопропилэтиламина (3,9 г, 0,03 моль) в изопропаноле (70 мл) при 150 С в герметично закрытой пробирке нагревали в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и удаляли изопропанол при пониженном давлении с получением осадка. Указанный осадок растворяли в дихлорметане и промывали водой и солевым раствором. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением осадка. Указанный осадок очищали на колонке с силикагелем при использовании в качестве элюента смеси метанол:дихлорметан (4:96) с получением указанного в заголовке соединения (5,0 г). ИЭР/МС m/z 217(М+1). Диаминопиримидины в приведенной ниже таблице получали, по существу, в соответствии со способом, описанным в примере получения 1, с использованием соответствующего амина и 4,6-дихлор-2 метилпиримидин-5-иламина. Соединения примеров получения 3, 4 и 7 очищали с помощью хроматографии на силикагеле при использовании в качестве элюента смеси этилацетат/гексан. Соединение примера получения 9 получали с помощью хроматографии на силикагеле при использовании в качестве элюента смеси ацетон/гексан. Соединение примера получения 10 очищали с использованием катионообменника Раствор 6-хлор-N4-(2-метоксиэтил)-2-метилпиримидин-4,5-диамина (5,0 г, 0,023 моль), 2 хлорбензальдегида (4,8 г, 0,03 моль), 15% FeCl3 на SiO2 (20 г) в 1,4-диоксане (150 мл) нагревали до 100 С в течение 16 ч. Диоксид кремния удаляли посредством фильтрования через диатомовую землю и фильтрат концентрировали при пониженном давлении с получением осадка. Указанный осадок растворяли в безводном дихлорметане (150 мл) и добавляли DDQ (5,2 г, 0,022 моль) при 0 С и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли дихлорметаном, промывали 1 н. раствором гидроксида натрия, водой и солевым раствором. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением осадка. Указанный осадок очищали на колонке с силикагелем при использовании в качестве элюента смеси этилацетат:н-гексан (40:60) с получением указанного в заголовке соединения (2,9 г). ИЭР/МС m/z 337 (М+1). Фенилпурины в приведенной ниже таблице получали, по существу, в соответствии со способом,-7 020529 описанным в примере получения 11, с использованием соответствующего диаминопиримидина и 2 хлорбензальдегида или 2-метилбензальдегида. Соединение способа получения 17 очищали с помощью хроматографии на силикагеле с использованием в качестве элюента смеси ацетон/гексан. Смесь 1-(5-амино-6-хлор-2-метилпиримидин-4-иламино)-2-метилпропан-2-ола (0,5 г, 0,002 моль), 2 хлорбензальдегида (0,6 г, 0,004 моль), п-толуолсульфоновой кислоты (0,1 г) и молекулярных сит (1,0 г) в толуоле (25 мл) нагревали до 130 С в течение 16 ч. Молекулярные сита удаляли посредством фильтрования через диатомовую землю и фильтрат концентрировали при пониженном давлении с получением осадка. Осадок растворяли в безводном дихлорметане (5 мл) и добавляли DDQ (0,47 г, 0,002 моль) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Указанную реакционную смесь разбавляли дихлорметаном, промывали 1 н. раствором гидроксида натрия, водой и солевым раствором. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением осадка. Указанный осадок очищали на колонке с силикагелем при использовании в качестве элюента смеси метанол:дихлорметан (2:98) с получением указанного в заголовке соединения(0,4 г). ИЭР/МС m/z 351 (М+1). Фенилпурин в приведенной ниже таблице получали, по существу, в соответствии со способом, описанным в примере получения 18, с использованием 3-[(5-амино-6-хлор-2-метилпиримидин-4-ил)амино]2,2-диметилпропан-1-ола и 2-хлорбензальдегида. В реакционную колбу помещали N-трет-бутоксикарбонилпиперазин (1,600 г, 8,590 ммоль), карбонат калия (3,56 г, 25,77 ммоль), йодид натрия (катализатор) (10 мг, 66,7 мкмоль), 1,4-диоксан (20 мл) и 1 бром-2-фторэтан (704,0 мкл, 9,45 ммоль). Смесь нагревали с обратным холодильником при перемешивании в течение ночи. После завершения реакции полученную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Полученный осадок распределяли между этилацетатом и водой. Органический слой отделяли и сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением чистого сложного трет-бутилового эфира 4-(2 фторэтил)пиперазин-1-карбоновой кислоты. ГХ-МС m/z 232 (М). К перемешанному раствору сложного трет-бутилового эфира 4-(2-фторэтил)пиперазин-1 карбоновой кислоты (2,00 г, 8,61 ммоль) в безводном дихлорметане (60 мл) добавляли 4 н. раствор HCl в 1,4-диоксане (21,52 мл, 86,1 ммоль) при комнатной температуре в атмосфере азота. Перемешивали в течение ночи в атмосфере азота. Реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,78 г). ИЭР/МС m/z 133 (М+1). Пример получения 21. Гидрохлорид 8-(2-хлорфенил)-6-(4-этилпиперазин-1-ил)-2-метил-9 Н-пурина Раствор 6-хлор-8-(2-хлорфенил)-2-метил-9 Н-пурина (0,5 г, 0,0017 моль), N-этилпиперазина (0,22 г,0,0019 моль) и триэтиламина (0,22 г, 0,0022 моль) в этаноле (10 мл) нагревали при 90 С в течение 8 ч. Альтернативно, реакционную смесь нагревали с помощью микроволнового излучения. После завершения реакции реакционную смесь концентрировали при пониженном давлении. Осадок растворяли в безводном дихлорметане и промывали насыщенным раствором бикарбоната натрия, водой и солевым раствором. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением осадка. Указанный осадок очищали на колонке с силикагелем с использованием в качестве элюента смеси МеОН:ДХМ (2:98) с получением 8-(2-хлорфенил)-6-(4 этилпиперазин-1-ил)-2-метил-9 Н-пурина (0,25 г). В смесь 8-(2-хлорфенил)-6-(4-этилпиперазин-1-ил)-2 метил-9 Н-пурина (0,25 г, 0,0007 моль) в безводном эфире (2,5 мл) добавляли HCl (2 М раствор в этаноле)(1,0 экв.) при 0 С и перемешивали в течение 1 ч при комнатной температуре. Осадок фильтровали, промывали эфиром и ДХМ. Сушили в вакууме с получением указанного в заголовке соединения (0,275 г) в виде твердого вещества белого цвета. ИЭР/МС m/z 357 (М+1). Альтернативно, соль HCl получали путем растворения свободного основания в ацетоне, смеси ацетонитрил:вода (1:1) или другом подходящем органическом растворителе, затем добавляли водный или эфирный раствор HCl при перемешивании. Затем лиофилизировали с получением гидрохлорида. Фенилпиперазинилпурины в приведенной ниже таблице получали, по существу, в соответствии со способом, описанным в примере получения 21, с использованием содержащих соответствующие заместители пиперазина и 6-хлорпурина. Если иное не указано, продукты, представляющие собой свободные основания, очищали с помощью нормальнофазовой хроматографии на силикагеле с использованием в качестве элюента смеси ацетон/гексан или МеОН/ДХМ.b Очищали посредством хирального разделения: СФХ, Diacel OJ-H, элюент: 12% МеОН (0,2% IPAm)/CO2. Изомер 1 (100% э.и.) и изомер 2 (91,1% э.и.). с Очищали посредством хирального разделения: СФХ, Diacel AD-H, элюент: 10% IPA (0,2% диэталметиламин)/CO2. Изомер 1 (100% э.и.) и изомер 2 (100% э.и.). 4,6-Дихлор-2-метилпиримидин-5-иламин (307 г, 1,72 моль) помещали в колбу на 10 л с рубашкой,снабженную верхнеприводной мешалкой, конденсатором змеевикого типа, термометром и капельной воронкой. Затем в колбу добавляли изопропиловый спирт (3,45 л) и перемешивали с получением прозрачного бледно-желтого раствора. В колбу добавляли триэтиламин (456,7 мл, 3,28 моль) одной порцией при перемешивании и нагревали до 50 С. Медленно добавляли (R)-(-)-2-амино-1-пропанол (194,30 г,202,10 мл, 2,59 моль) через капельную воронку в течение 30 мин. После завершения добавления реакционную смесь нагревали с обратным холодильником в течение 36 ч. Реакционной смеси позволяли охлаждаться. К реакционной смеси добавляли дополнительную порцию (R)-(-)-2-амино-1-пропанола (64,77 г,67,37 мл, 862,26 ммоль, 0,5 экв.) и триэтиламина (174,51 г, 240,37 мл, 1,72 моль, 1,0 экв.) и нагревали с обратным холодильником в течение 18 ч. Реакционной смеси позволяли охлаждаться. К реакционной смеси добавляли дополнительную порцию (R)-(-)-2-амино-1-пропанола (32,38 г, 33,68 мл, 431,13 ммоль,0,25 экв.) и триэтиламина (87,25 г, 120,18 мл, 862,26 ммоль, 0,5 экв.) и нагревали с обратным холодильником в течение 6 ч. Позволяли охлаждаться при перемешивании при комнатной температуре в течение 48 ч. Растворитель удаляли посредством роторного выпаривания с получением полутвердого вещества не совсем белого цвета. Добавляли воду (500 мл) и из полученной белой суспензии удаляли остаточный изопропанол посредством ротационного выпаривания. Твердое вещество белого цвета собирали посред- 13020529 ством фильтрования и промывали водой (1200 мл, 1130 мл). Указанное твердое вещество белого цвета сушили в вакуумной печи над твердым гидроксидом калия при 50 С с получением указанного в заголовке соединения (222,6 г). ИЭР/МС m/z 217 (М+1). Пример 20. (2R)-2-[8-(2-Хлорфенил)-2-метил-6-(4-метилпиперазин-1-ил)пурин-9-ил]пропан-1-ол; соль щавелевой кислоты(2R)-2-[(5-Амино-6-хлор-2-метилпиримидин-4-ил)амино]пропан-1-ол (228 г, 1,05 моль) и 1 метилпиперазин (210,80 г, 233,9 мл, 2,1) растворяли в диметилсульфоксиде (3,16 л) в реакторе с рубашкой на 10 л, сообщающимся с атмосферой. В колбу добавляли 2-хлорбензальдегид (221,88 г, 1,58 моль) с последующим добавлением триэтиламина (127,78 г, 176 мл, 1,26 моль) и нитробензола (129,55 г, 1,05 моль). Смесь нагревали до 140 С в течение 3,5 ч и затем позволяли охлаждаться. Перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь выливали в колбу на 20 л, содержащую воду (7,5 л), при перемешивании. Через 30 мин темно-коричневое масло экстрагировали дихлорметаном (17,5 л, 15 л) и отделяли органический слой. Объединенные органические слои сушили над сульфатом натрия, фильтровали и выпаривали с получением масла. Указанное масло растворяли в тетрагидрофуране (3,2 л) и обрабатывали раствором щавелевой кислоты (94,74 г, 1,05 моль, 1 экв.) в тетрагидрофуране (2,1 л) при быстром перемешивании. Реакционную смесь нагревали до 45 С в течение 15 мин и затем горячую смесь фильтровали посредством гравитационного фильтрования. Отфильтрованный осадок промывали несколько раз смесью этилацетат-тетрагидрофуран (1:1) и в конечном итоге промывали эфиром при перемешивании твердого вещества вручную. Указанное твердое вещество сушили в вакуумной печи с получением указанного в заголовке соединения в виде твердого вещества светло-коричневого цвета (329,4 г). []20D -6, концентрация=0,101 г/100 мл (МеОН). Пример 20 а. (2R)-2-[8-(2-Хлорфенил)-2-метил-6-(4-метилпиперазин-1-ил)пурин-9-ил]пропан-1-ол К 2 М раствору гидроксида натрия (1,01 л, 2,02 моль) при быстром перемешивании добавляли оксалатную соль (2R)-2-[8-(2-хлорфенил)-2-метил-6-(4-метилпиперазин-1-ил)пурин-9-ил]пропан-1-ола (330,3 г, 674,17 ммоль). Перемешивали в течение 20 мин и затем экстрагировали дихлорметаном (5 л, затем 2,5 л), промывали водой (2,5 л) и затем солевым раствором (1,5 л). К раствору дихлорметана добавляли дополнительную порцию материала в виде свободного основания (15,3 г) (полученного в ходе предварительной реакции, по существу, как описано выше). Раствор дихлорметана сушили над сульфатом натрия,фильтровали и выпаривали с получением кристаллического твердого вещества золотистого цвета. Указанное твердое вещество сушили в вакууме с получением указанного в заголовке соединения (264,5 г). ИЭР/МС m/z 401,2 (М+1). []20D -4,1 (с 1, МеОН). Пример 20b. Гидрохлорид (2R)-2-[8-(2-хлорфенил)-2-метил-6-(4-метилпиперазин-1-ил)пурин-9 ил]пропан-1-ола(2R)-2-[8-(2-Хлорфенил)-2-метил-6-(4-метилпиперазин-1-ил)пурин-9-ил]пропан-1-ол (15,29 г, 38,14 ммоль) растворяли в диэтиловом эфире (114 мл) в круглодонной колбе на 250 мл, снабженной впускным отверстием для азота, и обрабатывали 4 н. раствором соляной кислоты в диоксане (9,53 мл, 38,14 ммоль). Перемешивали при комнатной температуре в течение 2,5 ч и затем собирали твердое вещество посредством вакуумной фильтрации. Промывали диэтиловым эфиром (300 мл) и затем сушили в вакууме с получением указанного в заголовке соединения (12,1 г). ИЭР/МС m/z 401,2 (М+1 - HCl).(202,1 г,504,10 ммоль) обрабатывали ацетонитрилом (1,26 л) в колбе на 2 л и перемешивали при комнатной температуре в течение 30 мин. Твердое вещество собирали посредством фильтрования, промывали ацетонитрилом (250 мл), сушили на воздухе и затем сушили в вакууме при 40 С с получением чистого указанного в заголовке соединения (134,1 г). Оптическую чистоту определяли с помощью хиральной СФХ для идентификации одного энантиомера. ИЭР/МС m/z 401,2 (М+1). Условия хиральной ВЭЖХ: Diacel AD-H,10% IPA, 0,2% изопропиламин 89,8% сверхкритический диоксид углерода, УФ (220 нм), TR=4,22 мин,100% э.и. Альтернативный способ получения (2R)-2-[8-(2-хлорфенил)-2-метил-6-(4-метилпиперазин-1 ил)пурин-9-ил]пропан-1-ола. Пример получения 23 а. 2-Хлор-N-[4-хлор-6-(1R)-2-гидрокси-1-метилэтил]амино]-2 метилпиримидин-5-ил]бензамид В трехгорлой круглодонной колбе на 250 мл, снабженной конденсатором флегмы, магнитной мешалкой и впускным/выпускным отверстием для азота, объединяли 2-хлорбензоилхлорид (10,44 г, 57,86 ммоль), 5-амино-4,6-дихлор-2-метилпиримидин (10 г, 56,17 ммоль) и N-метилпирролидон (44 мл) и нагревали до 80 С в течение 5 ч. Добавляли воду (506 мкл) и продолжали перемешивать при нагревании в течение 20 мин до добавления диизопропилэтиламина (29,4 мл, 168,52 ммоль). Затем добавляли (R)-(-)-2 амино-1-пропанол (6,23 мл, 79,77 ммоль) одной порцией с последующей промывкой Nметилпирролидоном (10 мл). Продолжали нагревать при 80 С в течение 17 ч. Реакционному раствору позволяли охлаждаться до комнатной температуры и затем добавляли по каплям воду (112 мл) через капельную воронку в течение 10 мин. Продолжали перемешивать при комнатной температуре в течение 35 мин и затем выливали в этилацетат (300 мл). Фазы разделяли и водную фазу экстрагировали этилацетатом (2200 мл). Объединенные органические порции промывали водой (200 мл) и затем солевым раствором (200 мл), сушили над сульфатом магния, фильтровали и выпаривали с получением оранжевого масла. Указанное масло растирали с трет-бутилметиловым эфиром с получением после сбора посредством фильтрования твердого вещества белого цвета. Указанное твердое вещество сушили на фильтре в течение 0,5 ч и затем в вакуумной печи при 50 С с получением указанного в заголовке соединения (15,1 г). ИЭР/МС m/z 355,0/357,0 (М+1). Пример 20d. (2R)-2-[8-(2-Хлорфенил)-2-метил-6-(4-метилпиперазин-1-ил)пурин-9-ил]пропан-1-ол В автоклаве Парра на 300 мл с магнитной мешалкой объединяли 2-хлор-N-[4-хлор-6-(1R)-2 гидрокси-1-метилэтил]амино]-2-метилпиримидин-5-ил]бензамид (13,0 г), IPA (11 мл), N-метилпиперизин(7,1 мл) и диизопропилэтиламин (7,0 мл). Реакционный сосуд герметизировали и нагревали до 160 С в течение 24 ч. Выпаривали весь летучий материал, растворяли в дихлорметане (100 мл) с получением темного раствора. Промывали водой (250 мл), сушили с помощью гидрофобной фритты и выпаривали весь растворитель при пониженном давлении. Отбирали полученное твердое вещество, растворяли в ацетонитриле (85 мл) и перемешивали. Через 1,5 ч собирали твердое вещество посредством фильтрования и сушили на воздухе, затем сушили в вакууме с получением указанного в заголовке соединения (10,73 г). Оптическую чистоту определяли с помощью хиральной СФХ для идентификации одного энантиомера. ИЭР/МС m/z 401,2 (М+1). Условия хиральной ВЭЖХ: Diacel AD-H, 10% IPA, 0,2% изопропиламин,- 15020529(2R)-2-[8-(2-Хлорфенил)-2-метил-6-(4-метилпиперазин-1-ил)пурин-9-ил]пропан-1-ол (800 мг, пример 20 а) смешивали с ацетонитрилом (5 мл). Полученный прозрачный темно-коричневый раствор перемешивали при 500 об/мин при комнатной температуре, через 1 мин после начала перемешивания начинало осаждаться твердое вещество белого цвета. Образец перемешивали в течение 10 мин для того, чтобы позволить максимально возможному количеству материала осадиться из раствора. Твердое вещество белого цвета выделяли посредством вакуумной фильтрации и промывали 1 мл ацетонитрила. Материал сушили в вакуумной печи при 85 С в течение 1 ч для восстановления 505 мг. Дифракционные пики, полученные в результате рентгеноструктурного анализа с использованием в качестве источника излучения 1-[8-(2-хлорфенил)-2-метил-6-(4-метилпиперазин-1-ил)пурин-9 Раствор 1-(5-амино-6-хлор-2-метилпиримидин-4-иламино)циклопропил]метанола (1,165 г, 5,09 ммоль) и N-метилпиперизина (622,70 мкл, 5,60 ммоль) в метоксибензоле (15,28 мл) перемешивали при сообщении колбы с атмосферой. Добавляли 2-хлорбензальдегид (860,03 мкл, 7,64 ммоль) одной порцией с последующим добавлением нитробензола (522,22 мкл, 5,09 ммоль) и повышали температуру до 140 С. Реакционную смесь перемешивали при 140 С в течение 10 ч. Переносили реакционную смесь на ротационный испаритель для удаления летучих веществ. Разбавляли 2 н. раствором соляной кислоты (500 мл) и промывали дихлорметаном (500 мл). Удаляли органический слой и кислые фракции обрабатывали водным концентрированным раствором гидроксида натрия до достижения рН 14. Продукт экстрагировали дихлорметаном, сушили над MgSO4 и выпаривали с получением коричневого масла. Неочищенный материал очищали с помощью нормально-фазовой СФХ (колонка с динитрофенилом, 20%МеОН (0,2% диэтилметиламин), 80% СО 2). Соль HCl получали путем растворения свободного основания в смеси вода:ацетонитрил 2:1 или другом подходящем органическом растворителе, затем добавляли при перемешивании водный или эфирный раствор HCl. Лиофилизировали с получением гидрохлорида указанного в заголовке соединения (390 мг) в виде твердого вещества. ИЭР/МС m/z 413 (М+1). Фенилпиперазинилпурины в приведенной ниже таблице получали, по существу, в соответствии со способом, описанным в примере 21, с использованием содержащего подходящие заместители диаминопиримидина, 2-хлорбензальдегида и N-метила или N-этилпиперазина. К раствору трет-бутил-4-[8-(2-хлорфенил)-9-(2-гидрокси-2-метилпропил)-2-метилпурин-6 ил]пиперазин-1-карбоксилата (1,9 г, 0,0038 моль) в дихлорметане (10 мл) добавляли трифторуксусную кислоту (10 мл) при 0 С и перемешивали в течение 2 ч при комнатной температуре. Реакцию гасили насыщенным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением указанного в заголовке соединения (1,5 г). ИЭР/МС m/z 401 (М+1). Пример 24. Гидрохлорид метил-4-[8-(2-хлорфенил)-9-(2-гидрокси-2-метилпропил)-2-метилпурин-6 ил]пиперазин-1-карбоксилата К раствору 1-[8-(2-хлорфенил)-2-метил-6-пиперазин-1-илпурин-9-ил]-2-метилпропан-2-ола (0,001 моль, 0,5 г) и пиридина (2,0 мл) в безводном дихлорметане (3 мл) добавляли метилхлорформиат (0,29 г,0,0031 моль) при 0 С и перемешивали в течение 2 ч при комнатной температуре. Реакцию гасили насыщенным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением осадка. Указанный осадок очищали на колонке с силикагелем с использованием в качестве элюента смеси метанол:дихлорметан (3:97) с получением метил 4-[8-(2-хлорфенил)-9-(2-гидрокси-2-метилпропил)-2 метилпурин-6-ил]пиперазин-1-карбоксилата (0,3 г). ИЭР/МС m/z 459 (М+1). К раствору метил-4-[8-(2-хлорфенил)-9-(2-гидрокси-2-метилпропил)-2-метилпурин-6-ил]пиперазин 1-карбоксилата (0,3 г, 0,0006 моль) в эфире (4 мл) добавляли HCl (2,0 М раствор в эфире) (0,023 г, 0,0006 моль) при 0 С и перемешивали в течение 2 ч при комнатной температуре. Осадок фильтровали, промывали эфиром и сушили в вакууме с получением указанного в заголовке соединения (0,24 г) в виде твердого вещества белого цвета. ИЭР/МС m/z 459 (М+1). К раствору 8-(2-хлорфенил)-6-(4-этилпиперазин-1-ил)-2-метил-9 Н-пурина (0,233 г, 0,00065 моль) в безводном тетрагидрофуране (20 мл) добавляли гидрид натрия (0,031 г, 0,0013 моль) при 0 С. Реакционную смесь перемешивали в течение 15 мин, затем охлаждали до -30 С и добавляли бромметилметиловый эфир (0,081 г, 0,00065 моль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Реакцию гасили водой, удаляли тетрагидрофуран посредством выпаривания и затем реакционную смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением осадка. Указанный осадок очищали с помощью препаративной обращено-фазовой ВЭЖХ (колонка X-Bridge, 5 мМ NH4OAc/ацетонитрил) с получением указанного в заголовке соединения (0,029 г). ИЭР/МС m/z 401 (М+1). Пример получения 25. 2-[(5-Амино-6-хлор-2-метилпиримидин-4-ил)амино]этанол Автоклав на 1 л заполняли 5-амино-4,6-дихлор-2-метилпиримидином (50,0 г, 0,281 моль), 2 аминоэтанолом (18,8 г, 0,309 моль), диизопропилэтиламином (54,5 г, 0,421 моль) и IPA (500 мл). Смесь нагревали до 145-155 С при перемешивании в течение от 24 до 30 ч. Реакционную смесь охлаждали до 25-30 С. Указанную реакционную смесь концентрировали, удаляя растворитель в вакууме при температуре ниже 50 С. В указанную смесь добавляли ДХМ (500 мл) и перемешивали при 10-25 С в течение 2 ч. Смесь фильтровали и отфильтрованный осадок сушили в печи при 45-50 С с получением продукта в виде твердого вещества бледно-желтого цвета (35,0 г). 1 Н ЯМР (ДМСО-d6):6,76 (s, 1 Н); 4,79 (s, 3H); 3,533,37 (m, 4H); 2,09 (s, 3 Н). Пример получения 26. 2-[6-Хлор-8-(2-хлорфенил)-2-метилпурин-9-ил]этанол В трехгорлую круглодонную колбу на 500 мл загружали 2-[(5-амино-6-хлор-2-метилпиримидин-4 ил)амино]этанол (13,0 г, 0,064 моль) и 1,4-диоксан (300 мл). Добавляли 2-хлорбензальдегид (13,5 г, 0,096 моль) с последующим добавлением одной порции хлорида железа(III), 5 мас.%, на силикагеле (37,5 г). Смесь нагревали до 100-105 С в течение 48 ч. Охлаждали до 20-35 С, фильтровали и промывали отфильтрованный осадок 1,4-диоксаном (40 мл). Фильтраты объединяли и концентрировали в вакууме. Осадок растворяли в дихлорметане (260 мл, 20 мл/г) и охлаждали до 0-5 С. Добавляли 2,3-дихлор-5,6 дициано-1,4-бензохинон (14,5 г, 0,064 моль) при 0 С, смесь нагревали до 10-25 С и перемешивали в течение 2 ч. Фильтровали и промывали отфильтрованный осадок этанолом (100 мл) и объединяли фильтраты. Указанные фильтраты концентрировали в вакууме с получением темного осадка. Заново растворяли осадок в дихлорметане (300 мл), промывали указанный раствор 1 н. водным раствором гидроксида натрия до достижения рН 10-11 с последующей промывкой водой (260 мл). Органический слой концентрировали с получением неочищенного материала. Указанный неочищенный материал очищали на силикагеле (400 г) при использовании в качестве элюента смеси дихлорметан/метанол (50:1) с получением твердого вещества желтого цвета (6,5 г). 1 Н ЯМР (ДМСО-d6):7,73-7,56 (m, 4H); 4,83 (t, J=6Hz, 1H); 4,12 В трехгорлую круглодонную колбу на 500 мл загружали 2-[6-хлор-8-(2-хлорфенил)-2-метилпурин 9-ил]этанол (13,3 г, 0,0412 ммоль) и этанол (200 мл) с последующим добавлением 2,3,4,7,8,8 агексагидро-1 Н-пирроло[1,2-а]пиразин-6-она (6,365 г, 0,0453 моль) и триэтиламина (14,8 мл, 3,5 экв.). Смесь нагревали до 80-85 С в течение 24 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме с получением твердого вещества желтого цвета в качестве неочищенного продукта. Неочищенный материал очищали с помощью колоночной хроматографии с использованием 400 г силикагеля и при использовании в качестве элюента смеси дихлорметан/метанол (50:1) с получением продукта в виде твердого вещества желтого цвета (13,3 г). 1 Н ЯМР (ДМСО-d6):7,55-7,41 (m, 4 Н); 5,72 (bs, 2 Н); 4,16-3,92 (m, 3 Н); 3,71 (s, 2 Н); 3,71-3,68 (m, 1 Н); 3,02-2,93 (m, 2 Н); 2,74 (m, 1 Н); 2,70 (s, 3 Н); 2,44 (m, 2 Н); 2,32-2,29 (m, 1H); 1,76-1,69 (m, 1 Н). Пример 26. 2-[8-(2-Хлорфенил)-9-(2-гидроксиэтил)-2-метилпурин-6-ил]-1,3,4,7,8,8 агексагидропирроло[1,2-а]пиразин-6-он, изомер 2-2-[8-(2-Хлорфенил)-9-(2-гидроксиэтил)-2-метилпурин-6-ил]-1,3,4,7,8,8 а-гексагидропирроло[1,2 а]пиразин-6-он (19,0 г) растворяли в метаноле (400 мл). Разделяли энантиомеры с помощью сверхкритической жидкостной хроматографии (колонка AD-H, 25030 мм, 5 мкм); подвижная фаза: А: сверхкритический CO2; В: МеОН 0,05% диэтиламин, А: В=75:25 при 85 мл/мин. Длина волны детектора составляла 254 нм. Растворители выпаривали с получением твердого вещества желтого цвета, соответствующего пику 2. Растворяли в дихлорметане (100 мл), промывали водой (230 мл), декантировали и концентрировали органический раствор в вакууме при температуре ниже 50 С с получением 7,2 г (99,8% э.и.) изомера 2 в виде твердого вещества белого цвета. Пример 27. Гидрохлорид 2-[8-(2-хлорфенил)-9-(2-метоксиэтил)-2-метилпурин-6-ил]-1,3,4,7,8,8 агексагидропирроло[1,2-а]пиразин-6-она, изомер 2(35 мл) с последующим добавлением метилйодида (1,24 г, 8,50 ммоль). Порциями добавляли 60% NaH(0,59 г, 13,9 ммоль) при 10-25 С и перемешивали в течение 2 ч. Полученную смесь порциями выливали в воду (100 мл) при перемешивании и экстрагировали раствор этилацетатом (350 мл). Органические слои объединяли, промывали водой (250 мл) и концентрировали в вакууме с получением масла. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле (100 г) при использовании в качестве элюента смеси дихлорметан/метанол (50:1) с получением твердого вещества желтого цвета. Указанное твердое вещество заново растворяли в этилацетате (40 мл) и медленно добавляли раствор 1 н.HCl в этилацетате до образования твердого осадка. Перемешивали при комнатной температуре в течение 2 ч, фильтровали отфильтрованный осадок и промывали этилацетатом (10 мл). Указанный отфильтрованный осадок сушили в вакууме с получением 2,8 г указанного в заголовке соединения в виде твердого вещества не совсем белого цвета (98,0% э.и.); ИЭР/МС m/z 441,3 (М+1). Исследование функциональной активности в отношении CB1 и СВ 2 in vitro. Приведенные в примерах соединения исследовали по принципу агонизма с использованием основанного на сцинтилляционном анализе сближения (SPA) анализа связывания GTP-35S. Все компоненты для анализа готовили в аналитическом буфере, содержащем 20 мМ HEPES, 100 мМ NaCl, 5 мМ MgCl2(pH 7,4, при комнатной температуре). Полулогарифмические разведения соединения готовили на аналитическом буфере, содержащем БСА (конечная концентрация 0,125%). Связывание GTP-35S определяли в 96-луночных планшетах с использованием метода полного захвата мембран для анализа CB1 и модифицированного метода "захвата" антител, описанного ранее (DeLapp et al. J. Pharmacol. Exp. Ther. 289:946955, 1999), для анализа СВ 2. Все инкубации проводили при комнатной температуре. мкг/мл) добавляли в аналитический буфер и гомогенизировали. Разведенные соединения, ГТФ-35S (конечная концентрация 500 нМ) и мембраны добавляли в аналитический планшет и инкубировали в течение 30 мин. Затем добавляли 1 мг/лунку SPA-микрогранул с агглютинином из проростков пшеницы и планшеты герметизировали, содержимое перемешивали на вортексе и инкубировали в течение дополнительного часа. Затем планшеты центрифугировали при 700g в течение 10 мин и анализировали каждую лунку по 1 мин с помощью сцинтилляционного счетчика.CB2-Sf9. Мембраны hCB2-Sf9 и ГДФ (конечная концентрация 1 мкМ) добавляли в аналитический буфер и гомогенизировали. Разведенные соединения и мембраны добавляли в аналитический планшет и предварительно инкубировали в течение 15 мин. Затем добавляли ГТФ-35S (конечная концентрация 500 нМ) и инкубировали еще 35 мин. Затем добавляли смесь, содержащую детергент нонидет Р 40 (конечная концентрация 0,2%), антитела против Gi (конечное разведение 1:362) и добавляли 1,25 мг микрогранул для сцинтилляционного анализа сближения с антикроличьими антителами. Планшеты герметизировали и их содержимое перемешивали на вортексе и затем инкубировали еще в течение 2 ч, затем центрифугировали и анализировали, как в случае СВ 1. Для анализа данных сначала вычитали фон из значений для всех лунок. Относительную эффективность агониста определяли путем приведения показателей зависимости доза-эффект для агониста/обратного агониста к показателям, полученным для эффекта полного агониста (метанандамида). Данные анализировали с использованием 4-параметрической логистической сокращенной модели с помощью программы Activity Base и XLFit3. Все приведенные в примерах соединения анализировали по существу, как описано выше, и было обнаружено, что относительное значение ЕС 50 каждого из указанных соединений для СВ 2 составляло 100 нМ. Относительное значение ЕС 50 примера 6 для СВ 2 составляло 2,7 нМ и относительное значение ЕС 50 для CB1 составляло 100000 нМ. Относительное значение ЕС 50 примера 19 для СВ 2 составляло 22,4 нМ и относительное значение ЕС 50 для CB1 составляло 100000 нМ. Таким образом, была показана активность соединений согласно настоящему изобретению в отношении СВ 2 in vitro. Более того, была показана селективность соединений согласно настоящему изобретению в отношении СВ 2 по сравнению с CB1, что обеспечивает ограничение вероятности возникновения побочных эффектов, опосредованных центральной нервной системой. Замещение 3 Н-СР 55940 в человеческих и крысиных рецепторах СВ 2. Использовали методы, описанные Фелдером (Felder et al., Mol. Pharmaocol. 48:443-450, 1995), с незначительными модификациями. В частности, гомогенаты мембран из клеток, которые постоянно или временно экспрессируют человеческий или крысиный рецептор СВ 2, промывали посредством центрифугирования и разводили в буфере, содержащем 50 мМ трис-HCl (рН 7,4), 5 мМ MgCl2, 2,5 мМ ЭДТА и 0,1% БСА. Определяли специфическое связывание 3 Н-СР 55940 с 1 мкМ СР 55940. Способность соединений замещать 3 Н-СР 55940 в специфическом связывании анализировали в диапазоне концентраций при разведении в буфере, содержащем трис, MgCl2, ЭДТА, БСА, в присутствии 1% диметилсульфоксида,путем инкубирования при комнатной температуре в течение 90 мин в объеме 300 мкл. 96-луночный микропланшет с фильтрами, предварительно обработанный 0,5% поливинилпирролидоном, 0,1% полисорбатом 20 в воде, промывали три раза холодным трис-буфером. Реакционную смесь затем переносили в планшет с фильтром непосредственно перед завершением инкубации посредством быстрого фильтрования и трех промывок 200 мкл холодным трис-буфером. После высушивания планшета с фильтрами в каждую лунку добавляли сцинтилляционную жидкость Microscint 20, планшет герметизировали и анализировали для определения распада за 1 мин. Кривые замещения наносили на график и результирующие значения Ki определяли с использованием программы Graphpad Prism. Значение Ki в отношении примера 8 для человеческого рецептора составляет 142 нМ и для крысиного рецептора значение Ki составляет 37,5 нМ. Значение Ki примера 13 для человеческого рецептора составляло 65,2 нМ и значение Ki для крысиного рецептора составляло 215 нМ. Таким образом, было показано, что соединения согласно настоящему изобретению связываются как с человеческими, так и с крысиными рецепторами СВ 2 in vitro. Модель с использованием монойодацетата (MIA). Во всех исследованиях для измерения боли в модели MIA использовали самцов крыс породы Lewis,возраст которых составлял примерно 8 недель на момент проведения инъекции MIA. Крыс содержали в группах по 2 или 3 животных на клетку и поддерживали при постоянной температуре со световым циклом 12 ч света/12 ч темноты. Животные имели свободный доступ к пище и воде в течение всего времени,за исключением периода сбора данных. В стандартной модели MIA в правое колено каждой крысы инъецировали 0,3 мг MIA в 50 мкл солевого раствора, а в левые колени инъецировали 50 мкл солевого раствора. Боль измеряли в различное время после инъекции MIA (в норме не ранее чем через 10 дней после инъекции MIA) с помощью теста недееспособности. С помощью указанного теста измеряли различие между весовой нагрузкой на задние лапы, в колени которых вводили MIA и солевой раствор, и каждое измерение представляло собой сред- 20020529 нее 3 отдельных измерений, каждое из которых проводили в течение 1 с. Для исследований агонистов СВ 2 крыс распределяли случайным образом по группам дозирования(n=5 или 6) и затем однократно вводили дозу исследуемого соединения. Дозирование проводили с интервалом в 15 мин между крысами и измеряли боль в заранее определенное время после введения дозы(обычно через 2 ч) с помощью теста недееспособности. Исследования обычно проводили на 4 группах группе плацебо (1% карбоксиметилцеллюлоза в воде плюс 0,25% полисорбат 80) и 3 группах, включающих соединения, которые могут представлять собой группы, включающие разные соединения в одной дозе, или группы, включающие одно и то же соединение в 3 дозах. Результаты представляли в виде различия весовой нагрузки между коленями, в которые вводили солевой раствор, и коленями, в которые вводили MIA, и проводили статистическое сравнение животных, получавших плацебо, и животных, получавших соединение, для оценки влияния соединений на боль в колене в указанной модели. Соединение примера 19 исследовали по существу, как описано выше, и было обнаружено, что указанное соединение в дозах 0,3 и 1 мг/кг приводило к уменьшению боли по сравнению с носителем. Пример 18 анализировали по существу, как описано выше, и было обнаружено, что указанное соединение в дозе 0,3 мг/кг приводит к уменьшению боли по сравнению с носителем. Таким образом, было показано, что соединения согласно настоящему изобретению подходят для лечения боли, в частности боли в суставах. Исследование боли, вызванной химиотерапией. Самцов крыс Harlan Sprague Dawley весом 150-200 г акклиматизировали в виварии в течение 7 дней. Животных содержали при постоянной температуре со световым циклом 12 ч света/12 ч темноты в группах по 3-4 животных со свободным доступом к пище и воде. Дозирование соединения два раза в день в дозе 10 мг/кг (перорально), морфином в дозе 5 мг/кг и носителем начинали на 1 День исследования и продолжали на протяжении исследования (18 День). Паклитаксел в дозе 1 мг/кг (внутрибрюшинно) вводили на 2, 4, 6 и 8 Дни с достижением суммарной дозы 4 мг/кг для индукции периферической нейропатии, вызванной химиотерапией. Крыс помещали в отдельные камеры из оргстекла с плоским дном, представляющим собой металлическую сетку, для обеспечения доступа к задним лапам. После периода акклиматизации в течение от 15 мин до 1 ч исследовали среднюю часть подошвы задних лап в зоне локализации седалищного нерва. Набор из 8 нитей фон Фрея с логарифмически возрастающей жесткостью (0,41, 0,70, 1,20, 2,00, 3,63, 5,50,8,50 и 15,10 г) подводили к задним лапам. Нити фон Фрея подводили перпендикулярно к подошвенной поверхности с усилием, достаточным для возникновения небольшого изгиба. Стимул предоставляли с интервалами в несколько секунд. Положительный ответ отмечали в случае наблюдения резкого отдергивания лапы или вздрагивания сразу после удаления нити. В дни исследования конечные оценки поведения проводили через 1 ч после дозирования. Полученные данные оценивали с использованием метода"вверх и вниз" Диксона и переводили в значение порога ответа (1980, Ann. Rev. Pharmacol. Toxicol. 20:441-462). Максимальное прилагаемое усилие составляло 15,10 г. Начальную оценку поведения проводили на 10 День исследования и следующие измерения проводили на 12, 15 и 18 Дни исследования. Результаты выражали в виде средних значений со стандартными ошибками среднего (среднее + среднеквадратическая ошибка (СКО для n, равного 12 на группу. Все статистические оценки проводили с использованием однонаправленного анализа ANOVA с последующим сравнением с контрольной группой с помощью критерия Даннетта. Значения считали статистически достоверными при р 0,05. Статистические анализы проводили с использованием программы для статистического анализа JMP (SAS Research Institute, версии 6.0.2). Средние запаздывания отдергивания лапы со стандартными ошибками показаны для соединения примера 19, морфина и носителя в таблице выше. По сравнению с животными, получавшими носитель или морфин, у животных, получавших соединение примера 19, наблюдалась менее выраженная аллодиния на протяжении всего исследования. Таким образом, было показано, что соединение примера 19 согласно настоящему изобретению является применимым для предотвращения боли, в частности боли, вызванной химиотерапией, такой как периферическая нейропатия, вызванная химиотерапией. Токсикологическое исследование для определения оптимальной дозы на собаках породы бигль. Для оценки острой токсичности после введения одной пероральной дозы агониста CB2 путем принудительного кормления использовали одну мужскую и одну женскую особь собак породы бигль. Собак содержали отдельно при постоянной температуре с циклом 12 ч света/12 ч темноты циклом. Агонист СВ 2 готовили в носителе (1% гидроксиэтилцеллюлоза, 0,25% полисорбат 80 и 0,05% противовспениватель 1510-US, Dow Corning, в очищенной воде) и вводили перорально путем принудительного кормления в дозе 2 мл/кг. Проводили оценку заболеваемости и клинические наблюдения у собак (до дозирования,через 2 ч после дозирования, вечером и затем ежедневно). Потребление пищи оценивали с помощью ежедневной визуальной оценки оставшейся пищи. Для оценки эффекта на гематологические показатели и клинические биохимические показатели кровь собирали до введения дозы и через 48 ч после дозирования. Для оценки токсикокинетических концентраций лекарственного средства в плазме кровь собирали через 0,5, 1, 2, 4, 8 и 24 ч после введения дозы. Соединение примера 19 исследовали по существу, как описано выше, в однократной пероральной дозе 30 мг/кг. Клинические наблюдения после введения дозы ограничивались рвотой и расширенными зрачками. Рвоту отмечали только у женских особей собак через 19, 39 мин и 2 ч после введения дозы. Расширенные зрачки наблюдали у мужских и женских особей собак через 2-4 ч после введения дозы. Также отмечали снижение дефекации и минимальное снижение потребления пищи у женских особей собак. Эффекты на гематологические показатели ограничивались небольшим снижением содержания ретикулоцитов у женских особей собак (изменение на 39% по сравнению с содержанием до введения дозы). Средняя площадь под кривой зависимости для периода 0-24 ч (AUC0-24 ч) при дозе 30 мг/кг составляла 44451 нгч/мл. Средняя максимальная концентрация (Cmax) при дозе 30 мг/кг составляла 7537 нг/мл. Таким образом, было показано, что конкретные соединения согласно настоящему изобретению обладали ограниченной токсичностью у собак в концентрации 30 мг/кг и, таким образом, потенциалом для приемлемого профиля побочного действия у людей. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулыR2 представляет собой ОН, ОСН 3, СН 2 ОН или СН 2 ОСН 3;n равно 0 или 1,или фармацевтически приемлемая соль указанного соединения. 2. Соединение по п.1 или его фармацевтически приемлемая соль, где R1 представляет собой Cl. 3. Соединение по любому из пп.1 или 2 или его фармацевтически приемлемая соль, где R2 представляет собой ОН или СН 2 ОН. 4. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль, где R2 представляет собой СН 2 ОН. 5. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, где R3 представляет собой Н и R4 представляет собой метил, этил, 2-фторэтил или С(O)СН 3. 6. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль, где R3 представляет собой Н и R4 представляет собой метил. 7. Соединение по любому из пп.1-6 или его фармацевтически приемлемая соль, где R5 и R6 независимо выбраны из Н и СН 3. 8. Соединение по любому из пп.1-7 или его фармацевтически приемлемая соль, где R5 представляет собой Н и R6 представляет собой СН 3. 9. Соединение по любому из пп.1-8 или его фармацевтически приемлемая соль, где n равно 0. 10. Соединение по п.1, представляющее собой 2-[8-(2-хлорфенил)-2-метил-6-(4-метилпиперазин-1 ил)пурин-9-ил]пропан-1-ол, или его фармацевтически приемлемая соль. 11. Соединение по п.1, представляющее собой (2R)-2-[8-(2-хлорфенил)-2-метил-6-(4 метилпиперазин-1-ил)пурин-9-ил]пропан-1-ол, или его фармацевтически приемлемая соль. 12. Фармацевтическая композиция для лечения боли, содержащая соединение по любому из пп.1-11 или его фармацевтически приемлемую соль и фармацевтически приемлемый разбавитель или носитель. 13. Применение соединения по любому из пп.1-11 или его фармацевтически приемлемой соли для лечения или предотвращения боли. 14. Применение по п.13 для лечения боли. 15. Применение по п.14 для лечения остеоартритной боли. 16. Применение по п.13 для лечения или предотвращения боли, вызванной химиотерапией. 17. Способ для лечения или предотвращения боли, включающий введение эффективного количества соединения по любому из пп.1-11 или его фармацевтически приемлемой соли нуждающемуся в этом человеку или животному. 18. Способ по п.17 для лечения боли. 19. Способ по п.17 для лечения остеоартритной боли. 20. Способ по п.17 для лечения или предотвращения боли, вызванной химиотерапией.
МПК / Метки
МПК: A61K 31/52, A61P 25/02, C07D 487/04
Метки: пуриновые, соединения
Код ссылки
<a href="https://eas.patents.su/24-20529-purinovye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Пуриновые соединения</a>
Предыдущий патент: Макроциклы в качестве ингибиторов фактора xia
Следующий патент: Борсодержащие молекулы небольшого размера
Случайный патент: Способ подводной разведки и глубоководной добычи самородков золота и платины и устройство его осуществления












