Лактоновые производные 17.бета.-карбокси, карботио и амид андростанов
Номер патента: 1401
Опубликовано: 26.02.2001
Формула / Реферат
1. Соединение формулы (I)
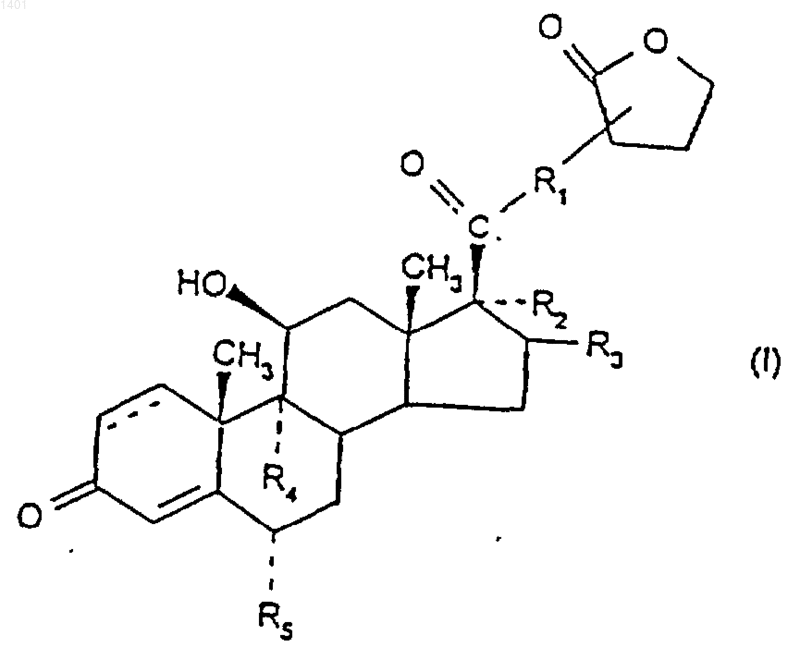
и его сольваты, в котором
R1 представляет собой О, S или NH;
R2 представляет собой ОС(=O)С1-6алкил;
R3 представляет собой водород, метил (который может быть либо в конфигурации a , либо в конфигурации b ) или метилен; или
R2 и R3 вместе представляют собой
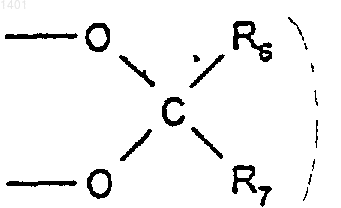
где R6 и R7 являются одинаковыми или различными и каждый представляет собой водород или C1-6алкил;
R4 и R5 являются одинаковыми или различными и каждый представляет собой водород или галоген.
2. Соединение по п.1, в котором R1 представляет собой О или S.
3. Соединение по п.2, в котором R1 представляет собой S.
4. Соединение по любому из пп.1-3, в котором R1 связан с альфа-углеродным атомом лактоновой группировки.
5. Соединение по любому из пп.1-4, в котором R2 представляет собой ОС(=O)С1-3алкил.
6. Соединение по п.5, в котором R2 представляет собой ОС(=O)этил.
7. Соединение по п.5 или 6, в котором R3 является метилом.
8. Соединение по любому из пп.1-4, в котором R2 и R3 вместе представляют собой
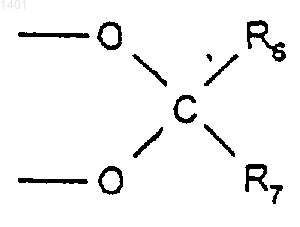
где R6 и R7 являются одинаковыми или различными и каждый представляет собой водород или C1-6алкил.
9. Соединение по п.8, в котором R6 и R7 являются одинаковыми или различными и каждый представляет собой водород или C1-3алкил.
10. Соединение по п.8 или 9, в котором R6 и R7 являются одинаковыми или различными и каждый представляет собой водород, метил или н-пропил.
11. Соединение по любому из пп.8-10, в котором R6 и R7 оба являются метилом.
12. Соединение по любому из пп.8-10, в котором R6 и R7 являются различными и каждый представляет собой водород или н-пропил.
13. Соединение по любому из пп.1-12, в котором R4 и R5 являются одинаковыми или различными и каждый представляет собой водород, фтор или хлор.
14. Соединение по любому из пп.1-13, в котором R4 и R5 оба являются фтором.
15. Соединение по п.1, в котором R1 является S; R2 является ОС(=O)С1-6алкилом; R3 является метилом; R4 и R5 являются одинаковыми или различными и каждый представляет собой водород или фтор.
16. Соединение по п.15, в котором R2 является ОС(=O)этилом, а R4 и R5 каждый является фтором.
17. Соединение по п.1, в котором R1 является S; R2 и R3 вместе представляют собой
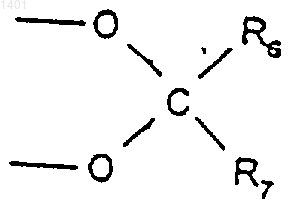
где R6 и R7 являются одинаковыми или различными и каждый представляет собой водород или C1-6алкил; R4 и R5, которые могут быть одинаковыми или различными, каждый представляет собой водород или фтор.
18. Соединение по п.17, в котором R6 и R7 являются одинаковыми или различными и каждый представляет собой водород, метил или н-пропил, а R4 и R5 каждый является фтором.
19. S-(2-Оксо-тетрагидрофуран-3-ил)эфир 17a -бутирилокси-6a ,9a -дифтор-11b -гидрокси-16a -метил-3-оксо-андроста-1,4-диен-17b -карботиокислоты;
S-(2-оксо-тетрагидрофуран-3-ил)эфир 17a -ацетилокси-6a ,9a -дифтор-11b -гидрокси-16a -метил-3-оксо-андроста-1,4-диен-17b -карботиокислоты;
S-(2-оксо-тетрагидрофуран-3-ил)эфир 9a -фтор-11b -гидрокси-16b -метил-3-оксо-17a -пропионилокси-андроста-1,4-диен-17b -карботиокислоты;
S-(5-оксо-тетрагидрофуран-2-ил)эфир 6a ,9a -дифтор-11b -гидрокси-16a -метил-3-оксо-17a -пропионилокси-андроста-1,4-диен-17b -карботиокислоты;
S-(2-оксо-тетрагидрофуран-4-ил)эфир 6a ,9a -дифтор-11b -гидрокси-16a -метил-3-оксо-17a -пропионилокси-андроста-1,4-диен-17b -карботиокислоты;
(2-оксо-тетрагидрофуран-3-ил)эфир 6a ,9a -дифтор-11b -гидрокси-16a -метил-3-оксо-17a -пропионилокси-андроста-1,4-диен-17b -карбоновой кислоты;
(2-оксо-тетрагидрофуран-5-ил)эфир 6a ,9a -дифтор-11b -гидрокси-16a -метил-3-оксо-17a -пропионилокси-андроста-1,4-диен-17b -карбоновой кислоты;
S-(2-оксо-тетрагидрофуран-5-ил)эфир 6a ,9a -дифтор-11b -гидрокси-16a ,17a -изопропилидендиокси-3-оксо-андроста-1,4-диен-17b -карботиокислоты;
S-(2-оксо-тетрагидрофуран-3-ил)эфир 6a ,9a -дифтор-11b -гидрокси-16a ,17a -изопропилидендиокси-3-оксо-андрост-4-ен-17b -карботиокислоты;
N-(2-оксо-тетрагидрофуран-3-ил)амид 6a ,9a -дифтор-11b -гидрокси-16a ,17a -изопропилидендиокси-3-оксо-андроста-1,4-диен-17b -карбоновой кислоты;
(2-оксо-тетрагидрофуран-3-ил)эфир 6a ,9a -дифтор-11b -гидрокси-16a ,17a -изопропилидендиокси-3-оксо-андроста-1,4-диен-17b -карбоновой кислоты;
S-(2-оксо-тетрагидрофуран-3-ил)эфир 16a ,17a -бутилидендиокси-11b -гидрокси-3-оксо-андроста-1,4-диен-17b -карботиокислоты;
S-(2-оксо-тетрагидрофуран-3-ил)эфир 16a ,17a -(R-бутилидендиокси)-6a ,9a -дифтор-11b -гидрокси-3-оксо-андроста-1,4-диен-17b -карботиокислоты;
(2-оксо-тетрагидрофуран-3-ил)эфир 16a ,17a -бутилидендиокси-11b -гидрокси-3-оксо-андроста-1,4-диен-17b -карбоновой кислоты;
N-(2-оксо-тетрагидрофуран-3-ил)амид 16a ,17a -(R-бутилидендиокси)-6a ,9a -дифтор-11b -гидрокси-3-оксо-андрост-4-ен-17b -карбонотющ кислоты;
N-(2-оксо-тетрагидрофуран-4-ил)амид 6a ,9a -дифтор-11b -гидрокси-16a ,17a -изопропилидендиокси-3-оксо-андроста-1,4-диен-17b -карбоновой кислоты;
S-(2-оксо-тетрагидрофуран-3-ил)эфир 6a ,9a -дифтор-11b -гидрокси-16a -метил-3-оксо-17a -пропионилокси-андрост-4-ен-17b -карботиокислоты;
(5-оксо-тетрагидрофуран-2-ил)эфир 16a ,17a -(R-бутилидендиокси)-6a ,9a -дифтор-11b -гидрокси-3-оксо-андрост-4-ен-17b -карботиокислоты;
и их сольваты.
20. S-(2-Оксо-тетрагидрофуран-3-ил)эфир 6a ,9a -дифтор-11b -гидрокси-16a -метил-3-оксо-17a -пропионилокси-андроста-1,4-диен-17b -карботиокислоты; и его сольваты.
21. S-(2-Оксо-тетрагидрофуран-3-ил)эфир 6a ,9a -дифтор-11b -гидрокси-16a , 17a -изопропилидендиокси-3-оксо-андроста-1,4-диен-17b -карботиокислоты и его сольваты.
22. S-(2-Оксо-тетрагидрофуран-3-ил)эфир 16a ,17a -(R-бутилидендиокси)-6a ,9a -дифтор-11b -гидрокси-3-оксо-андрост-4-ен-17b -карботиокислоты и его сольваты.
23. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.1-22, или его физиологически приемлемый сольват возможно в смеси с одним или более чем одним физиологически приемлемым разбавителем или носителем.
24. Фармацевтический аэрозольный препарат, содержащий соединение формулы (I) по любому из пп.1-22, или его физиологически приемлемый сольват и фторуглерод или водородсодержащий хлорфторуглерод в качестве пропеллента, возможно в комбинации с поверхностно-активным веществом и/или сорастворителем.
25. Комбинация, содержащая соединение формулы (I) по любому из пп.1-22, или его физиологически приемлемый сольват и другой терапевтически активный агент.
26. Комбинация по п.25, в которой другой терапевтически активный агент является агонистом b 2-адренорецепторов.
27. Способ лечения человека или животного с противовоспалительным и/или аллергическим состоянием, при котором указанному человеку или животному вводят эффективное количество соединения формулы (I) по любому из пп.1-22, или его физиологически приемлемого сольвата.
28. Способ получения соединения формулы (I) по п.1, при котором соединение формулы (II)
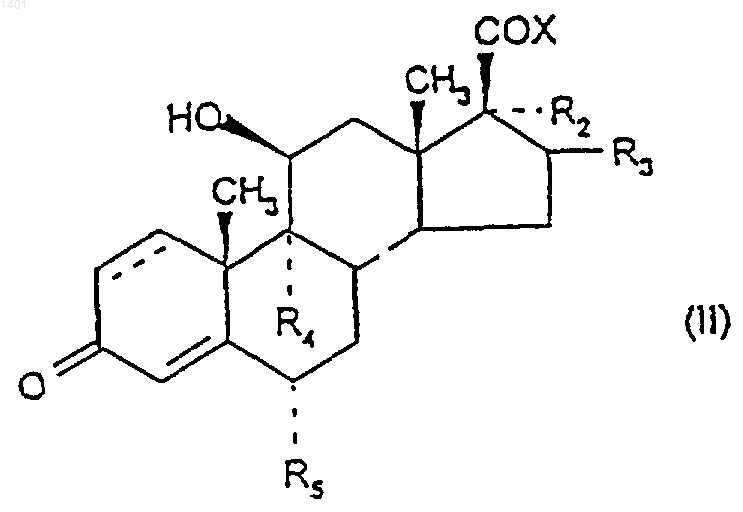
в котором R2, R3, R4, R5 и ---- являются такими, как определено ранее для соединений формулы (I), a X представляет собой ОН, или его активированное производное обрабатывают соединением формулы (III)
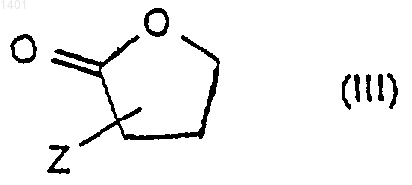
и его солями,
в которой Z представляет собой ОН, NH2 или SH;
и далее, при необходимости или желании, (1) образуют сольват или (2) получают индивидуальный изомер соединения формулы (I).
29. Способ получения соединения формулы (I) по п.1, при котором для соединений формулы (I), в которых R1 представляет собой О или S, соединение формулы (II), в котором R2, R3, R4 и R5 являются такими, как определено в п.1, а Х представляет собой ОН или SH, или его соответствующие соли обрабатывают соединением формулы (VI) или формулы (VII)

где Q представляет собой подходящую уходящую группу (такую как Cl, Br, OSO2A, где А является, например, СН3, CF3, п-СН3С6Н4);
и далее, при необходимости или желании, (1) образуют сольват или (2) получают индивидуальный изомер соединения формулы (I).
30. Способ получения соединения формулы (I) по пп.28 и 29, при котором соединение формулы (I) превращают в другое соединение формулы (I), и далее, при необходимости, (1) образуют сольват или (2) получают индивидуальный изомер соединения формулы (I).
31. Способ получения соединения формулы (I) по пп.28 и 29, при котором получают защищенные производные формулы (1), снимают с них защиту и далее, при необходимости, (1) образуют сольват или (2) получают индивидуальный изомер соединения формулы (I).
Текст
1 Настоящее изобретение относится к новым противовоспалительным и противоаллергическим соединениям андростановой серии и к способам их получения. Настоящее изобретение относится также к фармацевтическим препаратам, содержащим данные соединения и их терапевтическому применению, особенно для лечения воспалительных и аллергических состояний. Глюкокортикостероиды, которые обладают противовоспалительными свойствами, известны и широко используются для лечения воспалительных расстройств или заболеваний,таких как астма и ринит. Однако глюкокортикостероиды, в общем, могут иметь недостаток,который заключается в том, что они вызывают нежелательные системные действия. Международные заявки WО 94/13690, WО 94/14834, WО 92/13873 и WО 92/13872 раскрывают глюкокортикостероиды, которые, как утверждают, обладают противовоспалительным действием в сочетании с пониженной системной активностью. Настоящее изобретение предусматривает новую группу соединений, которые обладают полезной противовоспалительной активностью,в то же время имея небольшую или совсем не имея системную активность. Таким образом,соединения по настоящему изобретению представляют собой более безопасную альтернативу тем известным глюкокортикостероидам, которые имеют нежелательные побочные действия. Так, в соответствии с одним аспектом изобретения, предложено соединение формулы (I)R2 отдельно представляет собой ОС(=O)С 1-6 алкил;R3 отдельно представляет собой водород,метил (который может быть либо в конфигурации , либо в конфигурации ) или метилен; либо R2 и R3 вместе представляет собой где R6 и R7 являются одинаковыми или различными, и каждый представляет собой водород или C1-6 алкил;R4 и R5 являются одинаковыми или различными и каждый представляет собой водород или галоген; ипредставляет собой простую или двойную связь. В вышеупомянутых определениях термин"алкил" как группа или часть группы означает 2 нормальную или, где подходит, разветвленную алкильную группировку. Например, он может представлять собой функциональную группуC1-6 алкил, представленную метилом, этилом, нпропилом, изопропилом, н-бутилом и третбутилом. Сольваты могут быть, например, гидратами. Дальнейшие ссылки на соединение по изобретению включают в себя как соединения формулы (I), так и их сольваты, особенно фармацевтически приемлемые сольваты. Специалистам очевидно, что изобретение включает в своем объеме все стереоизомеры соединений формулы (I) и их смеси. В частности, соединения формулы (I) содержат асимметрический центр в точке присоединения лактоновой группировки. Таким образом, изобретение включает в своем объеме диастереоизомеры по этому асимметрическому центру и их смеси. Диастереоизомеры и их смеси по асимметрическому центру, образованному, когда R2 и R3 вместе представляет собойR1 может быть связанным с альфа, бета или гамма углеродным атомом лактоновой группы, однако обычно предпочтительными являются соединения формулы (I), в которых R1 связан с альфа атомом. Предпочтительной группой соединений по изобретению являются соединения формулы (I),в которых R1 представляет собой О или S, в особенности S. Другой предпочтительной группой соединений по изобретению являются соединения формулы (I), в которых R2 отдельно представляет собой ОС(=O)С 1-6 алкил, более предпочтительно ОС(=O)С 1-3 алкил, главным образом ОС(=O)этил. Обычно предпочтительными являются соединения в пределах этой группы, в которых R3 является метилом. Другой предпочтительной группой соединений являются соединения формулы (I), в которых R2 и R3 вместе представляет собой где R6 и R7 являются одинаковыми или различными и каждый представляет собой водород или С 1-6 алкил, в особенности водород или С 1-3 алкил, главным образом, водород, метил или н-пропил. 3 Предпочтительными являются соединения формулы (I), в которых R4 и R5 могут быть одинаковыми или различными и каждый представляет собой водород, фтор или хлор, в особенности водород или фтор. Особенно предпочтительными являются соединения, в которых обаR4 и R5 являются фтором. Особенно группой соединений по изобретению являются соединения формулы (I), в которых R1 является S; R2 является ОС(=O)С 1-6 алкилом, в особенности ОС(=O)С 1-3 алкилом,главным образом ОС(=O)этилом; R3 является метилом; R4 и R5, которые могут быть одинаковыми или различными, и каждый представляет собой водород или фтор, наиболее предпочтительно фтор, ипредставляет собой простую или двойную связь. Другой особенно группой соединений по изобретению являются соединения формулы (I),в которых R1 является S; R2 и R3 вместе представляют собой где R6 и R7 являются одинаковыми или различными и каждый представляет собой водород или C1-6 алкил, в особенности водород или С 1-3 алкил, главным образом, водород, метил или нпропил; R4 и R5, которые могут быть одинаковыми или различными, каждый представляет собой водород или фтор, главным образом,фтор, ипредставляет собой простую или двойную связь. Предпочтительными являютсяR-изомеры соединений в пределах этой группы,в которых R6 и R7 являются различными. Должно быть понятно, что данное изобретение охватывает все комбинации особенно предпочтительных и предпочтительных групп,упомянутых выше. Соединения формулы (I) включают в себя:S-(2-оксо-тетрагидро-фуран-3-ил)эфир 16,17-(R-бутилидендиокси)-6,9-дифтор 11-гидрокси-3-оксо-андрост-4-ен-17 карботиокислоты; Очевидно, что каждое из вышеуказанных соединений формулы (I) включает в себя индивидуальные R и S диастереоизомеры по асимметрическому центру в точке присоединения лактоновой группировки, а также их смеси. Специалистам очевидно также, что соединения формулы (I) могут включать в себя индивидуальные R и S диастереоизомеры по асимметрическому центру, образованному, когда R2 и R3 вместе представляет собой где R6 и R7 являются различными, также как и их смеси. Так, индивидуальные R и S диастереоизомеры, выделенные таким образом, что они являются практически свободными от другого диастереоизомера, то есть чистыми, и их смеси включены в объем данного изобретения. Индивидуальный R или S диастереоизомер, выделенный таким образом, что он является практически свободным от другого диастереоизомера, то есть чистым, предпочтительно выделяют таким образом, чтобы присутствовало менее чем 10%,предпочтительно менее чем 1%, особенно предпочтительно менее чем 0,1% другого диастереоизомера. Соединения формулы (I) обладают потенциально благотворным противовоспалительным и противоаллергическим воздействием, особенно при местном введении, продемонстрированным, например, их способностью связываться с рецептором глюкокортикоида и противодействовать ответу посредством этого рецептора. Следовательно, соединения формулы (I) полезны при лечении воспалительных и/или аллергических расстройств. Кроме того, соединения формулы (I) обладают преимуществом, так как имеют небольшую или совсем не имеют системную активность. Поэтому соединения по изобретению могут представлять собой более безопасную альтернативу тем известным противовоспалительным глюкокортикоидам, которые имеют нежелательные побочные действия. Примеры болезненных состояний, при которых соединения по изобретению могут быть полезными, включают в себя кожные болезни,такие как экзема, псориаз, аллергический дерматит, нейродермит, зуд и аллергические реакции; воспалительные состояния носа, горла,легких, такие как астма (включая аллерген зависимые астматические реакции), ринит (включая сенную лихорадку), назальные полипы, хроническая обструктивная легочная болезнь, интер 001401 6 стициональное лгочное заболевание и фиброз; воспалительные состояния пищеварительного тракта, такие как неспецифический язвенный колит и болезнь Крона; аутоиммунные болезни,такие как ревматоидный артрит. Соединения по изобретению могут также иметь применение при лечении конъюнктивы и конъюнктивита. Очевидно, что приведенные здесь ссылки на заболевания распространяются на профилактику, так же как на лечение установленных состояний. Как упомянуто выше, соединения формулы (I) полезны в медицине или ветеринарии, в частности в качестве противовоспалительных и противоаллергических агентов. Поэтому здесь в еще одном аспекте изобретения, предложено соединение формулы (I) или его физиологически приемлемый сольват для использования в медицине или ветеринарии,особенно при лечении пациентов с воспалительными и/или аллергическими состояниями. Согласно другому аспекту изобретения,предложено применение соединения формулы(I) или его физиологически приемлемого сольвата для производства лекарственного средства для лечения пациентов с воспалительными и/или аллергическими состояниями. В другом или альтернативном аспекте предложен способ лечения человека или животного с воспалительным и/или аллергическим состоянием, при котором указанному человеку или животному вводят эффективное количество соединения формулы (I) или его физиологически приемлемого сольвата. Соединения по изобретению могут быть получены для введения любым подходящим способом, поэтому изобретение включает в своем объеме также фармацевтические композиции, содержащие соединение формулы (I) или его физиологически приемлемый сольват совместно, при желании, в смеси с одним или более чем одним физиологически приемлемым разбавителем или носителем. Кроме того, предложен способ получения таких фармацевтических композиций, при котором ингредиенты смешивают. Соединения по изобретению могут, например, быть получены для перорального,трансбуккального, подъязычного, парентерального, местного или ректального введения, главным образом, для местного введения. Местное введение здесь включает в себя введение инсуффляцией и ингаляцией. Примеры различных типов препарата для местного введения включают в себя мази, лосьоны, кремы, гели, пены, препараты для трансдермальной доставки посредством пластырей, порошки,спреи, аэрозоли, капсулы или картриджи для использования в ингаляторе или инсуффляторе,или капли (например, капли для глаз или носа),растворы/суспензии для распыления, суппози 7 тории, вагинальные суппозитории, очистительные клизмы и жевательные либо сосательные таблетки или пилюли (например, для лечения афтозных язв),или липосомные либо микрокапсулированные препараты. Мази, кремы и гели могут быть, например,приготовлены на водной или масляной основе с добавлением подходящего загущающего и/или желирующего агента и/или растворителей. Так,такие основы могут, например, включать в себя воду и/или масло, такое как жидкий парафин или растительное масло, например арахисовое масло или касторовое масло, или растворитель,такой как полиэтиленгликоль. Загущающие агенты и желирующие агенты, которые можно использовать в соответствии с природой основы, включают в себя мягкий парафин, стеарат алюминия, цетостеариловый спирт, полиэтиленгликоль, ланолин, пчелиный воск, производные карбоксиполиметилена и целлюлозы и/или моностеарат глицерина и/или неионные эмульгаторы. Лосьоны могут быть приготовлены на водной или масляной основе и будут, в общем,также содержать один или более чем один эмульгатор, стабилизирующий агент, диспергирующий агент, суспендирующий агент или загущающий агент. Порошки для наружного применения могут быть приготовлены при помощи любой подходящей порошковой основы, например талька,лактозы или крахмала. Капли могут быть приготовлены на водной или неводной основе, содержащей также один или более чем один диспергирующий агент, солюбилизирующий агент,суспендирующий агент или консервант. Распыляемые композиции могут, например, быть приготовлены в виде водных растворов или суспензий, либо аэрозолей в баллонах под давлением, таких как ингалятор с дозатором, с использованием подходящего жидкого пропеллента. Аэрозольные композиции, подходящие для ингаляции, могут быть либо суспензией, либо раствором, и обычно они содержат соединение формулы (I) и подходящий пропеллент, такой как фторуглерод либо водородсодержащий хлорфторуглерод или их смеси,предпочтительно гидрофторалканы, главным образом, 1,1,1,2-тетрафторэтан, 1,1,1,2,3,3,3 гептафтор-н-пропан или их смесь. Аэрозольная композиция может, возможно, содержать дополнительные эксципиенты для препаратов,хорошо известные из уровня техники, такие как поверхностно-активные вещества, например олеиновая кислота или лецитин, и сорастворители, например, этанол. Преимущественно, препараты по изобретению могут быть забуферены путем добавления подходящих буферных агентов. Капсулы и картриджи, например, из желатина, для использования в ингаляторе или инсуффляторе могут быть приготовлены содер 001401 8 жащими порошковую смесь для ингаляции из соединения по изобретению и подходящей порошковой основы, такой как лактоза или крахмал. Каждая капсула или картридж обычно могут содержать от 20 мкг до 10 мг соединения формулы (I). Альтернативно, соединение по изобретению может быть представлено без эксципиентов, таких как лактоза. Пропорция активного соединения формулы (I) в композициях для местного применения согласно изобретению зависит от конкретного типа препарата, который надо приготовить, но обычно будет в пределах от 0,001 до 10 мас.% Однако обычно для большинства типов препаратов используемая пропорция преимущественно будет в пределах от 0,005 до 1% и предпочтительно от 0,01 до 0,5%. Однако в порошках для ингаляции или инсуффляции используемая пропорция будет в пределах от 0,1 до 5%. Аэрозольные препараты предпочтительно готовят таким образом, чтобы каждая мерная доза или "пафф" аэрозоля содержала 20 - 2000 мкг, предпочтительно 20 - 500 мкг соединения формулы (I). Вводить можно один раз в день или несколько раз в день, например, 2, 3, 4 или 8 раз, например по 1, 2 или 3 дозы каждый раз. Общая суточная доза аэрозоля будет в пределах от 100 мкг до 10 мг, предпочтительно 200 - 2000 мкг. Общая суточная доза и мерная доза в капсулах и картриджах ингалятора или инсуффлятора обычно будет составлять двойную дозу аэрозольного препарата. Препараты для местного применения можно вводить один или более чем один раз в день посредством нанесения на пораженный участок; можно использовать герметические повязки. Постоянное или пролонгированное поступление может быть достигнуто при помощи системы скоч-резервуар. Для внутреннего введения соединения по изобретению могут быть, например, приготовлены, как это принято для перорального, парентерального или ректального введения. Препараты для перорального введения включают в себя сиропы, эликсиры, порошки, гранулы, таблетки и капсулы, которые обычно содержат традиционные эксципиенты, такие как связывающие агенты, наполнители, смазывающие вещества,разрыхлители, увлажняющие агенты, суспендирующие агенты, эмульгаторы, консерванты,буферные соли, отдушки, подкрашивающие и/или подслащивающие агенты, где как подходит. Предпочтительными, однако, являются формы стандартной дозы, как описано ниже. Предпочтительными формами препарата для внутреннего введения являются формы стандартной дозы, то есть таблетки или капсулы. Такие формы стандартной дозы содержат от 0,1 до 20 мг, предпочтительно от 2,5 до 10 мг соединений по изобретению. Соединения по изобретению обычно можно назначать для внутреннего введения в случа 9 ях, когда показана системная адренокортикальная терапия. В общих терминах, препараты для внутреннего введения могут содержать от 0,05 до 10% активного ингредиента в зависимости от типа препарата. Суточная доза может варьироваться от 0,1 мг до 60 мг, например 5-30 мг, в зависимости от состояния, которое надо лечить,и продолжительности желаемого лечения. Препараты медленного высвобождения или препараты, покрытые энтеросолюбильной оболочкой, могут иметь преимущество, особенно для лечения воспалительных расстройств пищеварительного тракта. Фармацевтические композиции согласно изобретению можно также использовать в комбинации с другим терапевтически активным агентом, например, с агонистом 2-адренорецепторов, антигистаминным или противоаллергическим. Таким образом, данное изобретение предусматривает в следующем аспекте, комбинацию, содержащую соединение формулы (I) или его физиологически приемлемый сольват вместе с другим терапевтически активным агентом,например с агонистом 2-адренорецепторов,антигистаминным или противоаллергическим. Комбинация, упомянутая выше, может быть подходящим образом представлена для использования в форме фармацевтического препарата и, таким образом, фармацевтические препараты, содержащие комбинацию, как она определена выше, вместе с фармацевтически приемлемым разбавителем или носителем представляют собой еще один аспект данного изобретения. Индивидуальные соединения таких комбинаций можно вводить либо последовательно,либо одновременно в отдельных или комбинированных фармацевтических препаратах. Соответствующие дозы известных терапевтических агентов легко могут быть определены специалистами. Соединения формулы (I) и их сольваты могут быть получены по методике, описанной ниже, составляющей следующий аспект данного изобретения. Таким образом, согласно первому способу(А), соединение формулы (I) может быть получено обработкой соединения формулы (II) в котором R2, R3, R4, R5 иявляются такими,как определено ранее для соединений формулы(I), а Х представляет собой ОН, или его активированного производного, такого как триазол или и его солями, в котором Z представляет собой ОН, NH2 или SH. Так, соединение формулы (II), где Х представляет собой ОН, может быть активировано активирующим агентом, таким как триазол, например 1-гидрокси-бензотриазол, и карбодиимид, например 1-(3-диметиламино-пропил)-3 этил-карбодиимид гидрохлорид, в полярном растворителе, таком как диметилформамид,лучше при повышенной температуре, например,около 100 С, и в инертной атмосфере, такой как азот или подобной, с образованием активированного производного соединения формулы (II),такого как производное триазола, например производное бензотриазола формулы (IV) в котором R2, Rз, R4, R5 иявляются такими,как определено ранее. Активированное производное, которое может быть выделено, если требуется, подвергают взаимодействию с соединением формулы(III), где Z представляет собой NH2, SH или ОН,с образованием целевого соединения формулы(I). Специалистам будет понятно, что реакция сочетания может происходить в одну стадию без выделения активированного производного,если соединение формулы (III) присутствует во время или добавлено после активации. Альтернативно, активированное производное может быть выделено, а затем обработано соединением формулы (III) с образованием целевого соединения формулы (I). Оба метода включены в объм настоящего изобретения. Соединения формулы (I) могут также быть получены в соответствии с вышеупомянутым способом (А) сочетанием соединения формулы (II), где Х представляет собой ОН,с соединением формулы (III), где Z представляет собой SH, ОН или NH2, через промежуточный смешанный ангидрид, например смешанный фосфорный ангидрид, такой как соединение формулы (V), как описано Kertesz и Маrх вJournal of Organic Chemistry, 1986, 51, 23152328. Так, соединение формулы (II), где Х представляет собой ОН, может быть активировано активирующим агентом, таким как диэтилхлорфосфат в присутствии основания, такого как третичный амин, например триэтиламин, и в 11 подходящем растворителе, таком как хлорированный растворитель, например дихлорметан, с образованием активированного производного соединения формулы (II), например, диэтилфосфатного производного смешанного ангидрида формулы (V) в котором R2, R3, R4, R5 иявляются такими,как определено ранее. Активированное производное, которое, если требуется, может быть выделено, подвергают взаимодействию с соединением формулы (III),где Z представляет собой SH, ОН или NH2, с образованием целевого соединения формулы (I). Очевидно, что реакция сочетания может происходить без выделения активированного производного, если соединение формулы (III) присутствует во время или добавлено после активации. Альтернативно, активированное производное может быть выделено, а затем последовательно обработано соединением формулы(III) с образованием целевого соединения формулы (I). Оба способа включены в объм настоящего изобретения. Соединения формулы (I), где R1 представляет собой О или S, могут быть также получены в соответствии со вторым способом (Б), при котором соединение формулы (II), в котором R2,R3, R4, R5 иявляются такими, как определено ранее, а Х представляет собой ОН или SH, или его соответствующие соли, обрабатывают соединением формулы (VI), или формулы (VII), в котором Q представляет собой подходящую уходящую группу (такую как Cl, Вr, OSO2A, где А является например СН 3, CF3, п-СН 3 С 6 Н 4), в соответствии со стандартными способами. Вышеуказанный общий способ (Б), использующий соединения формулы (VI), может быть применен для получения соединений формулы (I), в которых R1 связан с альфа, бета или гамма углеродным атомом лактоновой группы. Соединения формулы (I), где R1 представляет собой О или S, могут быть получены в соответствии с вышеуказанным способом (Б) алкилированием соединения формулы (II), где Х представляет собой соответственно ОН или SH,соединением формулы (VI), где Q представляет собой подходящую уходящую группу, с использованием методов, известных из уровня техники, или адаптацией этих методов. 12 Так, например, соединение формулы (I),где R1 представляет собой О, может быть получено алкилированием соединения формулы (II),где Х представляет собой ОН, лучше в форме подходящей соли (такой как соль щелочного металла, например, натрия, или четвертичная аммониевая соль), соединением формулы (VI),где Q представляет собой подходящую уходящую группу, предпочтительно хлор, бром или мезилат. Реакцию алкилирования предпочтительно проводят в присутствии растворителя,лучше полярного растворителя, в инертных условиях, например, в азоте, или подобных, лучше при температуре примерно от 0 до 100 С. Подходящие полярные растворители могут включать в себя ацетон, диметилформамид, диметилацетамид, диметилсульфоксид, дихлорметан или хлороформ. Подобным образом, соединения формулы(I), где R1 представляет собой S, могут быть получены в соответствии с вышеуказанным способом (Б) алкилированием соединения формулы(II), где Х представляет собой SH, соединением формулы (VI), где Q представляет собой подходящую уходящую группу, адаптацией методов,описанных Phillips et al в Journal of MedicinalChemistry, 1994, 37, 3717-3729. Так, соединение формулы (I), где R1 представляет собой S, может быть получено алкилированием соответствующего соединения формулы (II), где Х представляет собой SH, лучше в форме подходящей соли (такой как соль щелочного металла, например, натрия, или четвертичная аммониевая соль), соединением формулы (VI), где Z представляет собой подходящую уходящую группу,как описано выше для подобных реакций алкилирования. Альтернативно, соединения формулы (I),где R1 представляет собой О или S, могут быть получены в соответствии с вышеуказанным способом (Б) алкилированием соединения формулы (II), где Х представляет собой ОН или SH,соединением формулы (VI), где Q представляет собой ОН, в условиях Mitsunobu с использованием трифенилфосфина и диалкилазокарбондиксилата или с использованием методикиJournal of the Chemical Society, Chemical Communications, 1995, 1403-1404. Соединение формулы (I), где R1 представляет собой S и он связан с бета углеродным атомом лактоновой группы, может быть также получено взаимодействием соответствующего соединения формулы (II), где Х представляет собой SH, с соединением формулы (VII). Например, присоединением по Michael соединения формулы (II) к соединению формулы (VII) в присутствии основания, такого как карбонат калия, и подходящего растворителя, такого как диметилформамид. Соединения формулы (I) могут также быть получены из других соединений формулы (I) с 13 использованием традиционных способов взаимного превращения, таких как переацетализация,эпимеризация или этерификация. Таким образом, способ получения соединения формулы (I) взаимным превращением другого соединения формулы (I) (способ В) составляет другой аспект данного изобретения. Соединения формулы (I), имеющие простую связь 1,2, могут быть получены частичным восстановлением соответствующего соединения с двойной связью 1,2 традиционными способами. Например, гидрогенизацией соответствующего соединения формулы (I) или промежуточного соединения, использованного для получения соединения формулы (I), с использованием палладиевого катализатора, лучше в подходящем растворителе, например, этилацетате, или предпочтительно с использованием трис(трифенилфосфин)родий(I) хлорида (известного как катализатор Wilkinson), лучше в подходящем растворителе, таком как толуол, этилацетат или этанол. Очевидно, что может быть желательным использовать защищенные производные промежуточных соединений, используемых в получении соединений формулы (I). Так, вышеуказанные способы могут требовать снятия защиты как на промежуточной, так и на конечной стадии, чтобы получить целевое соединение. Таким образом, в соответствии с другим способом(Г), соединение формулы (I) может быть получено проведением реакции с защищенным производным соединения формулы (I) с целью удаления присутствующей защитной группы или групп, что составляет еще один аспект данного изобретения. Защита и снятие защиты функциональных групп могут быть осуществлены с использованием традиционных способов. Так, гидроксильные группы могут быть защищены с использованием любых обычных групп, защищающих гидроксил, например как описано в ProtectiveWiley and Sons, 1991). Примеры подходящих групп, защищающих гидроксил, включают в себя группы, выбранные из алкила (например, трет-бутила или метоксиметила), аралкила (например, бензила,дифенилметила или трифенилметила), гетероциклических групп, таких как тетрагидропиранил, ацил (например, ацетил или бензоил) и силильные группы, такие как триалкилсилил (например, трет-бутилдиметилсилил). Группы, защищающие гидроксил, могут быть удалены традиционными способами. Так, например, алкил, силил, ацил и гетероциклические группы могут быть удалены сольволизом, например,гидролизом, в кислотных или щелочных условиях. Аракильные группы, такие как трифенилметил, могут быть аналогичным образом удале 001401 14 ны сольволизом, например, гидролизом, в кислотных условиях. Аракильные группы, такие как бензил, могут быть расщеплены гидрогенолизом в присутствии катализатора из благородного металла, такого как палладий на древесном угле. Соединения формул (II), (III), (IV), (V),(VI) и (VII) являются либо общеизвестными соединениями, либо могут быть получены способами, аналогичными тем, которые описаны в технике для получения известных соединений формулы (II), (III), (IV), (V), (VI) и (VII), или могут быть получены способами, описанными здесь. Например, соединения формулы (II), где Х представляет собой ОН, могут быть получены окислением соответствующего 21-гидрокси-20 кето-прегнана формулы (VIII)Journal of Organic Chemistry, 1986, 51, 23152328. Соединения формулы (VIII) коммерчески доступны, например, фторцинолонацетонид,будезонид и триамцинолон ацетонид доступны от Sigma-Aldrich или могут быть получены из коммерчески доступных соединений формулы(VIII), например, способами переацетализации,описанными в ЕР 0262108, и частичным восстановлением соединений с двойной связью 1,2 способами, описанными здесь. Альтернативно,соединения формулы (VIII) могут быть получены из коммерчески доступных 17 гидроксилпроизводных соединений формулы(VIII) представляют собой ещ один следующий аспект настоящего изобретения. Соединения формулы (II), где Х представляет собой SH, могут быть получены путем применения или адаптации известных способов,например, используя способы, описанные Phillips et al в Journal of Medicinal Chemistry, 1994,37,3717-3729. Соединения формулы (III), (VI) и (VII) коммерчески доступны от Sigma-Aldrich или могут быть легко получены путем применения или адаптации известных способов. Например, 15 соединения формулы (III), где Z является SH,могут быть получены способами, описаннымиFush в Ark-Kemi, 1966, 26, 111 и 1968, 29, 379; соединения формулы (III), где Z является амино, могут быть получены способами, описанными G.J. McGarvey et al в Tetrahedron Letters, 1983, 24, 2733; хиральные -ОН соединения формулы (III) могут быть получены способами, описанными Кеnnе et al в J. Chem. Soc.et al в J. Org. Chem. 1981,46,4439. Индивидуальные изомеры формулы (I) при точке присоединения лактоновой группировки могут быть получены либо из исходных материалов, имеющих желаемую стереохимию, либо посредством эпимеризации, разделения фракционной кристаллизацией или хроматографией(например, HPLC разделением) на соответствующей стадии синтеза требуемого соединения формулы (I) с использованием традиционных способов. Так, например, специалистам ясно, что синтез, использующий рацемическую смесь соединений формулы (III) или (IV), приводит к образованию соединений формулы (I) в виде смеси диастереоизомеров, которые затем могут быть разделены. Альтернативно, индивидуальные диастереоизомеры могут быть получены с использованием соединений формулы (III) или где R6 и R7 являются различными, также могут существовать в R и S диастереоизомерных формах. Синтез таких соединений может быть стереоспецифическим с получением индивидуальных диастереоизомеров. Так, например, Rдиастереоизомер соединения формулы (I), в котором R6 представляет собой Н, a R7 представляет собой н-пропил, может быть легко получен трансацетализацией соответствующего 16,17-изопропилидендиокси производного масляным альдегидом в присутствии кислотного катализатора, такого как перхлорная кислота,как описано в ЕР 0262108. Реакция трансацетализации может быть осуществлена на промежуточной стадии или после введения лактоновой группы. Сольваты (например, гидраты) соединения формулы (I) могут образовываться во время выполнения одной из вышеупомянутых стадий способа. Так, соединения формулы (I) могут быть выделены вместе с молекулами растворителя кристаллизацией или выпариванием в подходящем растворителе с получением соответствующих сольватов. 16 Следующие примеры иллюстрируют изобретение, но не ограничивают его ни в коем образе. Примеры Общее: точки плавления определены наKofler блоке, и они не являются точными. 1HЯМР спектр записывали при 250 или 400 МГц и,химические сдвиги выражены в ррm по отношению к тетраметилсилану. Для описания множества сигналов использованы следующие сокращения: s (синглет), d (дублет), t (триплет), qMS(TSP+ve) и MS(ES+ve) относятся к массспектру, проходящему в положительной моде с использованием соответственно техники термовпрыска и электровпрыска. HRMS (ES+ve) относится масс-спектру высокого разрешения с электровпрыском, проходящему в положительной моде. TLC (тонкослойную хроматографию) проводили на пластинах Merck Kieselgel 60 F254,а колоночную хроматографию проводили наMerck Kieselgel (Art. 7734 или 9385). PLC (препаративную тонкослойную хроматографию) проводили на Whatman пластинах из двуокиси кремния. Препаративную HPLC (жидкостную хроматографию высокого разрешения) проводили на системе Gilson Medical Electronics с использованием стационарной фазы, указанной в примере. ДМФ используют как сокращение для безводного N,N-диметилформамида. Органические растворители были высушены над безводным сульфатом магния. Там, где были получены смеси изомеров при асимметрическом центре в лактоновой группе, эти изомеры могли быть разделены традиционной хроматографией на двуокиси кремния и они обозначены как изомеры А и Б, соответственно, в порядке элюации из колонки. Промежуточное соединение 1. 6,9 Дифтор-11-гидрокси-16-метил-3-оксо-17 пропионилокси-андрост-4-ен-17-карбоновая кислота. 6,9-Дифтор-11-гидрокси-16-метил-3 оксо-17-пропионилокси-андрост-4-ен-17 карбоновую кислоту (1,36 г, 3 ммоля) добавляли к раствору Wilkinson катализатора (150 мг) в этилацетате (100 мл), и полученный раствор перемешивали в атмосфере водорода до завершения гидрогенизации. Протекание реакции контролировали HPLC. Затем раствор экстрагировали насыщеным водным бикарбонатом натрия (4 х 50 мл), и объединенные водные слои промывали этилацетатом (75 мл), затем водный слой подкисляли до рН 1 концентрированной соляной кислотой. Затем полученное экстрагировали этилацетатом (75 мл) и экстракт сушили и выпаривали с получением соединения, указанного в заголовке, в виде тврдого вещества(3 Н, s), 1.00 (6 Н, s и t, J 8 Гц), 0.85 (3 Н, d, J 9 Гц). Промежуточное соединение 2. 6,9 Дифтор-11-гидрокси-16-метил-3-оксо-17 пропионилокси-андрост-4-ен-17-карботиокислоты S-(N,N-диметилкарбаминовой кислоты ангидрид). Триэтиламин (378 мкл, 2,72 ммоля) добавляли к суспензии 6,9-дифтор-11-гидрокси 16-метил-3-оксо-17-пропионилокси-андрост 4-ен-17-карбоновой кислоты (промежуточное соединение 1,825 мг, 1,81 ммоля) в сухом дихлорметане (12 мл) под азотом. Получали чистый раствор и затем добавляли одной порциейN,N-диметилтиокарбамоил хлорид (659 мг, 5,43 ммоля), раствор перемешивали при комнатной температуре и протекание реакции контролировали HPLC. По завершении реакционную смесь разбавляли этилацетатом (50 мл) и хорошо промывали 1 М соляной кислотой (30 мл), 5% раствором бикарбоната натрия (30 мл) и рассолом(30 мл), затем сушили и выпаривали с получением неочищенного продукта в виде пены. Его очищали препаративной тонкослойной хроматографией на силикагеле, элюируя смесью дихлорметан-диэтиловый эфир (5:2), с получением соединения, указанного в заголовке, в виде кристаллического тврдого вещества (507 мг, 58%): т. пл. 189-191 С; ИK max (KBr) 3363, 1750,1722, 1669, 1651 см-1; ЯМР(CDCl3) включает 6.13 (1 Н, s), 5.20 и 5.35 (1 Н, 2m), 4.37 (1 Н, m),3.33 (1 Н, m), 3.08 и 3.16 (6 Н, 2s), 2.42 (2 Н, q, J 7 Гц), 1.51 (3 Н, s), 1.14-1.20 (6 Н, s и t, J 7 Гц), 0.98(5 мл) нагревали с обратным холодильником в атмосфере азота. Протекание реакции контролировали анализом TLC и по окончании реакционную смесь вливали в охлажденную на льду смесь 3,5 М соляной кислоты (60 мл) и этилацетата (40 мл). Отделяли органическую фазу, промывали водой (30 мл) и экстрагировали 5% раствором карбоната натрия (3 х 20 мл). Объединенные основные экстракты затем расслаивали этилацетатом (40 мл) и доводили до рН 1 6 М соляной кислотой. Органическую фазу отделяли, сушили и выпаривали с получением соединения, указанного в заголовке, в виде твердого вещества (190 мг, 45%): т. пл. 147-151 С;(3H, s), 1.17 (3 Н, t, J 7 Гц) 1.13 (3 Н,: s), 0.99 (3 Н,d, J 7 Гц). Промежуточное соединение 4. 2-Оксотетрагидро-фуран-3R-иловый эфир метансульфоновой кислоты. К перемешиваемому раствору (R)-3 гидрокси-2-оксо-тетрагидро-фурана (400 мг,3,92 ммоля) и триэтиламина (601 мкл, 4,31 ммоля) в безводном дихлорметане (15 мл) при 0 С в атмосфере азота добавляли метансульфонилхлорид (334 мкл, 4,31 ммоля). Полученную смесь перемешивали при 0 С в течение 0,25 часа. Добавляли дополнительное количество триэтиламина (109 мкл, 0,78 ммоля) и метансульфонилхлорида (61 мкл, 0,78 ммоля), и смесь перемешивали 1,5 ч. Реакционную смесь вливали в воду (20 мл), и отделившийся водный слой экстрагировали дихлорметаном (20 мл). Объединенные органические слои промывали насыщенным раствором бикарбоната натрия (20 мл) и насыщеным рассолом (20 мл), затем сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и получали жлтый остаток, который очищали колоночной флэш-хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат: циклогексан (3:2). Удаление растворителя из соответствующих фракций при пониженном давлении привело к получению соединения,указанного в заголовке, в виде белого кристаллического твердого вещества (214 мг, 30%): т. пл. 69-72 С; MS (TSP+ve) m/z 198 (M+NH4)+; ИК max (KBr) 1774, 1363 см-1; ЯМР (CDCl3) 5.33 (1H, t, J 9 Гц), 4.53 (1 Н, dt, J 9 и 3.5 Гц),4.43-4.28 (1 Н, m), 3.30 (3 Н, s), 2.88-2.72 (1 Н, m),2.66-2.47 (1 Н, m). Обнаружено: С, 33.53; H, 4.16;(S)-3-гидрокси-2-оксо-тетрагидрофурана (2 г,19,6 ммоля), 4-N,N-диметиламинопиридина (240 мг, 1,96 ммоля) и диизопропилэтиламина (3,76 мл, 21,56 ммоля) в сухом дихлорметане (20 мл) под азотом при -40 С. Смесь перемешивали 30 минут и давали ей возможность нагреться до комнатной температуры, затем е промывали 2 М раствором соляной кислоты (50 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали флэш-хроматографией на силикагеле, элюируя смесью этилацетатциклогексан (1:1). Растирание с диэтиловым эфиром и высушивание в вакууме приводило к образованию соединения, указанного в заголовке, в виде белого кристаллического твердогоS(N,N-диметилкарбаминовой кислоты ангидрид). Триэтиламин (550 мкл, 3,94 ммоля) добавляли к суспензии 16,17-(R-бутилидендиокси)-6,9-дифтор-11-гидрокси-3-оксоандрост-4-ен-17-карбоновой кислоты (1,345 г,2,96 ммоля) в сухом дихлорметане (20 мл) под азотом. Получали чистый раствор и затем одной порцией добавлялиN,N-диметилтиокарбамоилхлорид (1,11 г, 9 ммоля), раствор перемешивали при комнатной температуре и протекание реакции контролировали анализом HPLC. По завершении реакционную смесь концентрировали при пониженном давлении, и остаток растворяли в этилацетате (50 мл) и хорошо промывали 2 М соляной кислотой (30 мл), 5% раствором бикарбоната натрия (30 мл) и рассолом(30 мл), затем сушили и выпаривали с получением неочищенного продукта в виде пены. Его очищали колоночной хроматографией на силикагеле, элюируя смесью ацетон-дихлорметанS-(N,N-карбаминовой кислоты ангидрида) (промежуточное соединение 6; 830 мг, 1,53 ммоля) в диэтиламине (8 мл) нагревали с обратным холодильником в атмосфере азота. Протекание реакции контролировали TLC анализом и по завершении реакционную смесь концентрировали при пониженном давлении и остаток растворяли в этилацетате(50 мл) и подкисляли 2 М соляной кислотой (40 мл). Органическую фазу отделяли, промывали водой (30 мл) и экстрагировали 5% раствором карбоната калия (5 х 20 мл). Объединенные основные экстракты затем расслаивали этилацетатом (40 мл) и доводили до рН 1 6 М соляной кислотой. Органическую фазу отделяли, сушили и выпаривали с получением соединения, указанного в заголовке, в виде пены (103 мг, 14%): MS 20 Пример 1. S-(2-Оксо-тетрагидро-фуран-3 ил)эфир 6,9-дифтор-11-гидрокси-16 метил-3-оксо-17-пропионилокси-андроста-1,4 диен-17-карботиокислоты. Порошкообразный безводный карбонат калия (76 мг, 0,55 ммоля) добавляли к перемешиваемому раствору 6,9-дифтор-11 гидрокси-16-метил-3-оксо-17-пропионилокси-андроста-1,4-диен-17-карботиокислоты(258 мг, 0,55 ммоля) в сухом ДМФ (4 мл). Смесь перемешивали под азотом и затем охлаждали на льду. Затем добавляли -бромбутиролактон(56 мкл, 0,68 ммоля) и смесь перемешивали до завершения реакции, что показывала TLC. Раствор парционировали между водой (25 мл) и этилацетатом (25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали колоночной флэшхроматографией на силикагеле, используя в качестве элюента сначала эфир, а в конце этилацетат, выделяя изомер А соединения, указанного в заголовке, в виде кристаллического твердого вещества (120 мг, 19,5%): т. пл. 237-238 С;(3 Н, d, J 6.25 Гц). (Обнаружено: С, 60.72; Н,6.39; S, 5.58. C28H34F2O7S требует С, 60.85; Н,6.30; S, 5.80%), и изомер Б соединения, указанного в заголовке, в виде кристаллического твердого вещества (116 мг, 38,2%): т. пл. 220-222 С;(3 мл), перемешиваемом при 0 С под азотом. После образования желтого осадка добавляли раствор 6,9-дифтор-11-гидрокси-16-метил 3-оксо-17-пропионилокси-андроста-1,4-диен 17-карботиокислоты (200 мг, 0,43 ммоля) и(R)гидроксибутиролактона (65 мг, 0,64 ммоля) в тетрагидрофуране (3 мл) и протекание реакции контролировали TLC анализом. По завершении удаляли растворитель, и остаток аб 21 сорбировали прямо на силикагель и очищали колоночной флэш-хроматографией, элюируя диэтилэфиром. Соединение, указанное в заголовке, выделяли в виде белого кристаллического твердого вещества (149 мг, 63%): т. пл. 236238 С; аналитические и спектроскопические данные идентичны данным, полученным ранее для изомера А из примера 1. Способ 2. 2-Оксо-тетрагидро-фуран-3R-иловый эфир метансульфоновой кислоты (промежуточное соединение 4, 93 мг, 0,52 ммоля) обрабатывали раствором натриевой соли 6,9-дифтор-11 гидрокси-16-метил-3-оксо-17-пропионилокси-андроста-1,4-диен-17-карботиокислоты(253 мг, 0.52 ммоля) в ДМФ (3 мл) и смесь перемешивали при 20 С под азотом 2,5 ч. Протекание реакции контролировали TLC анализом. По завершении реакционную смесь разбавляли этилацетатом и вливали в воду. Органический раствор промывали бикарбонатом натрия, 2 М соляной кислотой, рассолом, сушили и выпаривали до сухости с получением соединения, указанного в заголовке (246 мг, 86%): т. пл. 237238 С; аналитические и спектроскопические данные идентичны данным, полученным ранее для изомера А из примера 1. Пример 3. S-(2-Оксо-тетрагидро-фуран 3R-ил)эфир 6,9-дифтор-11-гидрокси-16 метил-3-оксо-17-пропионилокси-андроста-1,4 диен-17-карботиокислоты. Трифенилфосфин (168 мг, 0,64 ммоля) добавляли к раствору диизопропилазодикарбоксилата (0,126 мл, 0,64 ммоля) в тетрагидрофуране(3 мл), перемешиваемом при 0 С под азотом. После получения желтого осадка добавляли раствор 6,9-дифтор-11-гидрокси-16-метил 3-оксо-17-пропионилокси-андроста-1,4-диен 17-карботиокислоты (200 мг, 0,43 ммоля) и(S)гидроксибутиролактона (65 мг, 0,64 ммоля) в тетрагидрофуране (3 мл) и протекание реакции контролировали TLC анализом. По завершении удаляли растворитель, и остаток абсорбировали прямо на силикагель и очищали колоночной флэш-хроматографией, элюируя диэтилэфиром. Соединение, указанное в заголовке, выделяли в виде белого кристаллического твердого вещества (143 мг, 61%): т. пл. 219222 С; аналитические и спектроскопические данные идентичны данным, полученным ранее для изомера Б из примера 1. Пример 4. S-(2-Oксо-тетрагидро-фуран-3 ил)эфир 6,9-дифтор-11-гидрокси-16 метил-3-оксо-17-пропионилокси-андрост-4-ен 17-карботиокислоты. Порошкообразный безводный карбонат калия (102 мг, 0,735 ммоля) добавляли к перемешиваемому раствору 6,9-дифтор-11 гидрокси-16-метил-3-оксо-17-пропионилокси-андрост-4-ен-17-карботиокислоты (промежуточное соединение 3, 346 мг, 0,735 ммоля) 22 в сухом ДМФ (5 мл). Смесь перемешивали под азотом, а затем охлаждали на льду. Затем добавляли -бромбутиролактон (70 мкл, 0,85 ммоля) и смесь перемешивали до завершения реакции, что показывала TLC. Раствор парционировали между водой (25 мл) и этилацетатом(25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали колоночной флэш-хроматографией на силикагеле, используя в качестве элюента сначала эфир, а в конце этилацетат, выделяя изомер А соединения, указанного в заголовке, в виде кристаллического твердого вещества (85 мг,20%): т. пл. 244-246 С; MS (TSP+ve) m/z 572(3 Н, s), 1.13 (3 Н, t, J 7 Гц), 1.12 (3 Н, s), 1.01 (3 Н,d, J 7 Гц) (Обнаружено: С, 60.33; Н. 6.74; S, 5.70,С 28 Н 36F2 О 7S требует С, 60.63; Н, 6.54; S, 5.78%),и изомер Б соединения, указанного в заголовке,в виде кристаллического твердого вещества (80 мг, 20%): т. пл. 195-197 С; MS (TSP+ve) m/z 572(CDCl3) включает 6.07 (1 Н, s), 5.30 и 5.11 (1 Н,2m), 4.49 (1 Н, m), 4.37-4.24 (2 Н, m), 3.96 (1 Н,m), 3.36 (1 Н, m), 2.64 (1 Н, m), 2.34 (2 Н, q, J 7 Гц), 1.44 (3 Н, s). 1.08 (3 Н, t, J 7 Гц), 1.04 (3 Н, s),0.93 (3 Н, d, J 7 Гц) (Обнаружено: С, 60.34; Н,6.60; S, 5.63. С 28 Н 36F2O7S требует С, 60.63; Н,6.54; S, 5.78%). Пример 5. S-(2-Oкco-тетрагидро-фуран-3 ил)эфир 17-бутирилокси-6,9-дифтор-11 гидрокси-16-метил-3-оксо-андроста-1,4-диен 17-карботиокислоты. Порошкообразный безводный карбонат калия (59 мг, 0.43 ммоля) добавляли к перемешиваемому раствору 17-бутирилокси-6,9 дифтор-11-гидрокси-16-метил-3-оксо-андроста-1,4-диен-17-карботиокислоты (206 мг, 0,43 ммоля) в сухом ДМФ (3 мл). Смесь перемешивали под азотом, а затем охлаждали на льду. Затем добавляли -бромбутиролактон (46 мкл, 0,53 ммоля) и смесь перемешивали до завершения реакции, что показывала TLC. Раствор парционировали между водой (25 мл) и этилацетатом (25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали препаративной тонкослойной хроматогафией на силикагеле, элюируя смесью хлороформ-этилацетат (2:1), с получением изомера А соединения, указанного в заголовке, в виде кристаллического твердого вещества: (30,7 мг, 13%) т. пл. 143-145 С; MS(1H, m), 1.54 (3 Н, s), 1.16 (3 Н, s), 1.00 (3 Н, d. J 6.25 Гц), 0.95 (3 Н, t, J 7.25 Гц);(Обнаружено: С,60.87; Н, 6.40: S, 5.42. С 29 Н 36FO7S требует С,60.70; Н, 6.46; S, 5.59%), и изомер Б соединения,указанного в заголовке, в виде кристаллического твердого вещества (46 мг, 19%): т. пл. 164166 С; MS (TSP+ve) m/z 567 [МН]+; ИК max(1 Н, m), 4.39 (2 Н, m), 4.09 (1 Н, m), 3.31 (1 Н, m),2.70 (1 Н, m), 1.53 (3 Н, s), 1.14 (3 Н, s), 0.95 (6 Н,d, J 6.25 Гц b t, J 7.25 Гц): HRMS (ES+ve) обнаружено 567.2200, [МН]+. C29H37F2O7S требует 567.2205. Пример 6. S-(2-Oксо-тетрагидро-фуран-3 ил)эфир 17-ацетилокси-6,9-дифтор-11 гидрокси-16-метил-3-оксо-андроста-1,4-диен 17-карботиокислоты. Порошкообразный безводный карбонат калия (55 мг, 0.40 ммоля) добавляли к перемешиваемому раствору 17-ацетилокси-6,9 дифтор-11-гидрокси-16-метил-3-оксо-андроста-1,4-диен-17-карботиокислоты (181 мг, 0.40 ммоля) в сухом ДМФ (3 мл). Смесь перемешивали под азотом, а затем охлаждали на льду. Затем добавляли -бромбутиролактон (43 мкл, 0,50 ммоля) и смесь перемешивали до завершения реакции, что показывала TLC. Раствор парционировали между водой (25 мл) и этилацетатом (25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали препаративной тонкослойной хроматогафией на силикагеле, элюируя смесью хлороформ : циклогексан : этанол(10:10:1), с получением изомера А соединения,указанного в заголовке, в виде кристаллического твердого вещества: (74 мг, 34%): т. пл. 253255 С; MS (TSP+ve) m/z 539 [MH]+; ИК max(1 Н, m), 4.37 (2 Н, m), 4.13 (1 Н, m), 3.30 (1 Н, m),2.74 (1 Н, m), 2.06 (3 Н, s), 1.54 (3 Н, s), 1.18 (3 Н,s), 1.00 (3 Н, d, J 7 Гц). (Обнаружено: С, 58.81; Н,5.88; S, 5.78. C27H32F2O7S.0.7 Н 2 О требует С,58.83; Н, 6.11; S, 5.82%), и изомер Б соединения,указанного в заголовке, в виде кристаллического твердого вещества (74 мг, 34%): т. пл. 258260 С; MS (TSP+ve) m/z 539 [MH]+; ИК max 24 Пример 7. S-(2-Oксо-тетрагидро-фуран-3 ил)эфир 9-фтор-11-гидрокси-16-метил-3 оксо-17-пропионилокси-андроста-1,4-диен 17-карботиокислоты. Порошкообразный безводный карбонат калия (76 мг, 0,55 ммоля) добавляли к перемешиваемому раствору 9-фтор-11-гидрокси 16-метил-3-оксо-17-пропионилокси-андроста-1,4-диен-17-карботиокислоты (352 мг, 0,75 ммоля) в сухом ДМФ (7 мл). Смесь перемешивали под азотом, а затем охлаждали на льду. Затем добавляли -бромбутиролактон (78 мкл, 0,94 ммоля) и смесь перемешивали до завершения реакции, что показывала TLC. Раствор парционировали между водой (25 мл) и этилацетатом (25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали колоночной флэшхроматогафией на силикагеле, используя в качестве элюента сначала эфир, а в конце этилацетат, выделяя изомер А соединения, указанного в заголовке, в виде кристаллического твердого вещества (124 мг, 30%): MS (TSP+ve) m/z 535S, 5.83. С 28 Н 35FO7S0,45 Н 2O требует С, 61.97; Н,6.67; S, 5.91%), и изомер Б соединения, указанного в заголовке, в виде кристаллического твердого вещества (156 мг, 37%): MS (TSP+ve) m/z 535 [МН]+; HRMS (ES+ve) обнаружено: 535.2165 [MH]+. C29H36FO7S требует 535.2164; ИК max (nujol) 3461, 1771, 1743, 1707, 1658,1614 см-1; ЯМР(CDCl3) включает 7.22 (1 H, d,J 10 Гц), 6.35 (1H, d, J 10 Гц), 6.13 (1 Н, bs), 4.61C28H35FO7S.0.6 H2O требует С, 61.34; Н, 6.71; S,5.85%). Пример 8. S-(5-Оксо-тетрагидро-фуран-2 ил)эфир 6-9-дифтор-11-гидрокси-16 метил-3-оксо-17-пропионилокси-андроста-1,4 диен-17-карботиокислоты. Порошкообразный безводный карбонат калия (76 мг, 0,55 ммоля) добавляли к перемешиваемому раствору 6-9-дифтор-11-гидрокси-16-метил-3-оксо-17-пропионилоксиандроста-1,4-диен-17-карботиокислоты(258 мг, 0,55 ммоля) в сухом ДМФ (5 мл). Смесь перемешивали под азотом, а затем охлаждали на льду. Затем добавляли -хлорбутиролактон 25 завершения реакции, что показывала TLC. Раствор парционировали между водой (25 мл) и этилацетатом (25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали препаративной тонкослойной хроматогафией на силикагеле, элюируя смесью хлороформ - циклогексан - этанол(20:20:1), с получением изомера А соединения,указанного в заголовке, в виде кристаллического твердого вещества (50 мг, 16%): т. пл. 152 С;(2 Н, q, J 7 Гц), 1.52 (3 Н, s), 1.14 (3 Н, t, J 7 Гц),1.14 (3 Н, s), 1.01 (3 Н, d, J 7 Гц); HRMS (ES+ve) обнаружено: 553.6446 [MH]+; C28H35FO7S требует 553.6445, и изомер Б соединения, указанного в заголовке, в виде кристаллического твердого вещества (34 мг, 10%): т. пл. 210-213 С; МС[MH]+, C28H35F2O7S требует 553.6445. Пример 9. S-(2-Oксо-тетрагидро-фуран-4 ил)эфир 6-9-дифтор-11-гидрокси-16 метил-3-оксо-17-пропионилокси-андроста-1,4 диен-17-карботиокислоты. Порошкообразный безводный карбонат калия (69 мг, 0,5 ммоля) добавляли к перемешиваемому раствору 6-9-дифтор-11-гидрокси 16-метил-3-оксо-17-пропионилокси-андроста-1,4-диен-17-карботиокислоты (234 мг, 0,5 ммоля) в сухом ДМФ (5 мл). Смесь перемешивали под азотом, а затем охлаждали на льду. Затем добавляли 2(5 Н)-фуранон (400 мкл, 5,63 ммоля) и смесь перемешивали до завершения реакции, что показывала TLC. Раствор парционировали между водой (25 мл) и этилацетатом(25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали препаративной тонкослойной хроматогафией на силикагеле, используя в качестве элюента этилацетат и выделяя соединение, указанное в заголовке, в виде кристаллического твердого вещества (9 мг, 3%): МС (FAB+ve) m/z 553 539 [МН]+; ИК max (KBr) 3474, 1784, 1745,1667, 1633 см-1; ЯМР(CDCl3) включает 7.13(3 Н, 2d, J 8 Гц); HRMS (ES+ve) обнаружено: 553.2083 [MH]+, С 28 Н 35F2O7S требует 553.2072; Пример 10. (2-Oксо-тетрагидро-фуран-3 ил)эфир 6-9-дифтор-11-гидрокси-16 метил-3-оксо-17-пропионилокси-андроста-1,4 диен-17-карбоновой кислоты. Порошкообразный безводный карбонат калия (103 мг, 0,75 ммоля) добавляли к перемешиваемому раствору 6-9-дифтор-11 гидрокси-16-метил-3-оксо-17-пропионилокси-андроста-1,4-диен-17-карбоновой кислоты(340 мг, 0,75 ммоля) в сухом ДМФ (7 мл). Смесь перемешивали под азотом, а затем охлаждали на льду. Затем добавляли -бромбутиролактон(78 мкл, 0,94 ммоля) и смесь перемешивали до завершения реакции, что показывала TLC. Раствор парционировали между водой (25 мл) и этилацетатом (25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали препаративной тонкослойной хроматогафией на силикагеле, элюируя смесью хлороформ-циклогексан-этанол(20:20:1), с получением изомера А соединения,указанного в заголовке, в виде кристаллического твердого вещества (43 мг, 11%): т. пл. 205206 С; MS (TSF+ve) m/z 537 [MH]+; ИК max[MH]+, С 28 Н 35F2O8 требует 537.2294, и изомер Б соединения, указанного в заголовке, в виде кристаллического тврдого вещества (43 мг, 11%): т. пл. 231-233 С; MS (TSP+ve) m/z 537 [MH]+; ИК max (KBr) 3482, 1789, 1747, 1668, 1630 см-1; ЯМР(CDCl3) включает 7.13 (1 Н, d, J 10 Гц),6.41 (1 Н, s), 6.39 (1 Н, d, J 10 Гц), 5.51 и 5.20 (1 Н,2m), 5.10 (1 Н, m), 4.58 (1 Н, m), 4.46-4.32 (2 Н,m), 3.30 (1 Н, m), 2.40 (2 Н, q, J 7 Гц), 1.72 (3 Н, s),1.55 (3 Н, s), 1.00 (3 Н, t, J 7 Гц), 0.96 (3 Н, d, J 7 Гц); HRMS (ES+ve) обнаружено: 537.2299[MH]+, С 28 Н 35F2O8 537.2297. Пример 11. (2-Оксо-тетрагидро-фуран-5 ил)эфир 6-9-дифтор-11-гидрокси-16 метил-3-оксо-17-пропионилокси-андроста-1,4 диен-17-карбоновой кислоты. Порошкообразный безводный карбонат калия (76 мг, 0,55 ммоля) добавляли к перемешиваемому раствору 6-9-дифтор-11-гидрокси-16-метил-3-оксо-17-пропионилоксиандроста-1,4-диен-17-карбоновой кислоты (249 мг, 0,55 ммоля) в сухом ДМФ (5 мл). Смесь перемешивали под азотом, а затем охлаждали на льду. Затем добавляли -хлорбутиролактон(83 мкл, 0,69 ммоля) и смесь перемешивали до завершения реакции, что показывала TLC. Рас 27 твор парционировали между водой (25 мл) и этилацетатом (25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали препаративной тонкослойной хроматогафией на силикагеле, элюируя смесью хлороформ-циклогексан-этанол(20:20:1), с получением изомера А соединения,указанного в заголовке, в виде кристаллического твердого вещества (62 мг, 21%): т. пл. 263266 С; MS (TSF+ve) m/z 537 [MH]+; HRMS(3 Н, s), 1.13 (3 Н, t, J 7 Гц), 1.08 (3 Н, s), 0.93 (3 Н,d, J 7 Гц). (Обнаружено: С. 61.77; Н, 6.15. С 28 Н 35F2O8 0.3 Н 2O требует С, 62.05; Н, 6.43%),и изомер Б соединения, указанного в заголовке,в виде кристаллического тврдого вещества (48 мг, 16%): т.пл. 241-243 С; MS (TSP+ve) m/z 537(2 Н, q, J 7 Гц), 1.53 (3 Н, s), 1.11 (3 Н, t, J 7 Гц),1.10 (3 Н, s), 0.95 (3 Н, d, J 7 Гц). (Обнаружено: С,61.69: H, 6.05. С 28 Н 34F2O8 требует С, 61.85; H,6.45%). Пример 12. S-(2-Oксо-тетрагидро-фуран-3 ил)эфир 6-9-дифтор-11-гидрокси-16,17 изопропилидендиокси-3-оксо-андроста-1,4 диен-17-карботиокислоты. Порошкообразный безводный карбонат калия (44 мг, 0,32 ммоля) добавляли к перемешиваемому раствору 6-9-дифтор-11-гидрокси-16,17-изопропилидендиокси-3-оксоандроста-1,4-диен-17-карботиокислоты(130 мг, 0,286 ммоля) в сухом ДМФ (1,4 мл). Смесь перемешивали под азотом, а затем охлаждали на льду. Затем добавляли -бромбутиролактон(30 мкл, 0,36 ммоля) и смесь перемешивали до завершения реакции, что показывала TLC. Раствор парционировали между водой (25 мл) и этилацетатом (25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали препаративной HPLC с нормальной фазой Dynamax 60A С 18, 25 см х 41 мм i.d.), элюируя смесью 70-90% этилацетата/гептан при 45 мл/мин с детектированием при 270 нм с получением изомера А в виде кристаллического тврдого вещества (29 мг, 20%): т. пл. 308-312 С; MS (TSP+ve) m/z 539 [MH]+; ИК max 28 5.58 (1 H, bs), 4.88 (1 Н, m), 4.47-4.15 (4 Н, m),1.49 (3 Н, s), 1.37 (3H, s),1.20 (3H, s),0.90 (3 Н, s). Обнаружено: С, 59.77; H, 6.01. С 27 Н 32F2O7S. 0.3 Н 2O требует С, 59.61; H, 6.04%), и изомер Б соединения указанного в заголовке, в виде кристаллического тврдого вещества (43 мг, 29%): т. пл. 275-278 С; MS (TSP+ve) m/z 539 [MH]+; ИК max (KBr) 3415, 2928, 1779, 1669, 1633 см-1; ЯМР (ДМСО) включает 7.25 (1 H, d, J 10 Гц),6.30 (1 H, d, J 10 Гц), 6.11 (1 Н, s), 5.73 и 5.54C27H32F2O7S0.4 Н 2O требует С, 59.42; H, 6.06%). Пример 13. S-(2-Oксо-тетрагидро-фуран-5 ил)эфир 6-9-дифтор-11-гидрокси-16,17 изопропилидендиокси-3-оксо-андроста-1,4 диен-17-карботиокислоты. Порошкообразный безводный карбонат калия (61 мг, 0,44 ммоля) добавляли к перемешиваемому раствору 6-9-дифтор-11-гидрокси-16,17-изопропилидендиокси-3-оксоандроста-1,4-диен-17-карботиокислоты(200 мг, 0,44 ммоля) в сухом ДМФ (5 мл). Смесь перемешивали под азотом, а затем охлаждали на льду. Затем добавляли -хлорбутиролактон(64 мг, 0,53 ммоля) в сухом ДМФ (1 мл) и смесь перемешивали до завершения реакции, что показывала TLC. Раствор парционировали между водой (25 мл) и этилацетатом (25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали колоночной флэш-хроматогафией на силикагеле, элюируя смесью циклогексан-этилацетат (1:1), с получением изомера А соединения, указанного в заголовке, в виде кристаллического твердого вещества (67 мг, 28%): т. пл. 304-307 С; MS (TSF+ve)(1 Н, m), 1.65 (3 Н, s), 1.49 (3 Н, s), 1.37 (3 Н, s),1.00 (3 Н, s). (Обнаружено: С, 159.76: Н, 6.13: S,5.80. С 27 Н 32F2O7S0.2 Н 2O требует С, 59.81; Н,6.02; S, 15.91%) %), и изомер Б соединения, указанного в заголовке, в виде кристаллического тврдого вещества (67 мг, 28%): т. пл. 270273 С; MS (TSP+ve) m/z 539 [МН]+; ИК max 29 К перемешиваемой суспензии 6-9 дифтор-11-гидрокси-16,17-изопропилидендиокси-3-оксо-андрост-4-ен-17-карботиокислоты (448 мг, 1,02 ммоля) в дихлорметане (8 мл) добавляли триэтиламин (160 мкл, 1,15 ммоля),затем диэтилхлорфосфат (160 мкл, 1,11 ммоля) и смесь перемешивали до образования промежуточного смешанного ангидрида. Добавляли раствор натриевой соли-меркапто-бутиролактона [полученной добавлением гидрида натрия (70 мл 60% дисперсии в масле, 1,75 ммоля) к раствору -меркаптобутиролактона(170 мг, 1,44 ммоля) в ДМФ (4 мл)] и реакцию контролировали TLC анализом. По завершении реакционную смесь разбавляли этилацетатом(50 мл), насыщенным раствором бикарбоната натрия (2 х 50 мл), водой (50 мл) и насыщенным рассолом (50 мл). Затем органический слой сушили и концентрировали с получением неочищенного материала в виде смолы. Его очищали колоночной флэш-хроматографией на силикагеле, элюируя смесью этилацетат-циклогексан(1:1). Выделяли изомер А соединения, указанного в заголовке, в виде кристаллического тврдого вещества (60 мг, 11%): т. пл. 169-173 С;(5 мл) перемешивали и нагревали при 100 С в атмосфере азота до завершения реакции, что показывал TLC анализ. После охлаждения до комнатной температуры добавляли этилацетат(20 мл). Объединенные органические слои промывали водой (15 мл) и насыщенным рассолом(15 мл), сушили над безводным MgSO4 и концентрировали с получением неочищенного продукта в виде смолы. Его очищали колоночной флэш-хроматографией на силикагеле, элюируя этилацетатом с получением соединения, указанного в заголовке, в виде кристаллического тврдого вещества (60 мг, 57%): т. пл. 181184 С: MS (TSP+ve) 522 [MH]+; ИК max (KBr) 3320, 1774, 1669, 1633 см-1; ЯМР (СDСl3) включает 7.18 (1H, d, J 10 Гц), 6.93 (1 Н, bs), 6.42(2 Н, m), 2.72 (1 Н, m), 1.79 (3 Н, s), 1.35 (3 Н, s),1.22 (3 Н, s), 1.04 (3 Н, s). (Обнаружено: С, 60.63; Н, 6.59; N, 2.44. С 27 Н 33F2NO7.0.7 H2O требует С,60.71; Н, 6.49; N, 2.62%). Пример 16. N-(2-Oксо-тетрагидро-фуран 3-ил)амид 6-9-дифтор-11-гидрокси-16,17-изопропилидендиокси-3-оксо-андроста-1,4 диен-17-карбоновой кислоты. Смесь 6-9-дифтор-11-гидрокси-16,17-изопропилидендиокси-3-оксо-андроста-1,4 диен-17-карбоновой кислоты (259 мг, 0,591 ммоля), аминобутиролактона гидрохлорида (108 мг, 0,591 ммоля), 1-гидроксибензотриазола (80 мг, 0,591 ммоля), 1-(3 диметиламино-пропил)-3-этил-карбодиимида гидрохлорида (113 мг, 0,591 ммоля) и диизопропилэтиламина (0,11 мл, 0,650 ммоля) в диметилформамиде (20 мл) перемешивали и нагревали при 100 С в атмосфере азота до завершения реакции, как показывал TLC анализ. После охлаждения до комнатной температуры добавляли этилацетат (20 мл) и соляную кислоту(2 М, 5 мл). Водный слой отделяли и экстрагировали этилацетатом (20 мл). Объединенные органические слои промывали водой (15 мл) и насыщенным рассолом (15 мл), сушили над безводным MgSO4 и концентрировали с получением неочищенного продукта в виде смолы. Его очищали препаративной тонкослойной хроматографией на силикагеле, элюируя смесью 5:2 этилацетат: циклогексан с получением Sизомера соединения, указанного в заголовке,изомера А, в виде кристаллического тврдого вещества, как получено выше, и R-изoмера соединения, указанного в заголовке, изомера Б, в виде кристаллического тврдого вещества (40 мг, 13%). Т. пл. 333-336 С; MS (TSP+ve) 522 31 Пример 17. (2-Oксо-тетрагидро-фуран-3 ил)эфир 6-9-дифтор-11-гидрокси-16,17 изопропилидендиокси-3-оксо-андроста-1,4 диен-17-карбоновой кислоты. Порошкообразный безводный карбонат калия (65 мг, 0,47 ммоля) добавляли к перемешиваемому раствору 6-9-дифтор-11 гидрокси-16,17-изопропилидендиокси-3 оксо-андроста-1,4-диен-17-карбоновой кислоты (205 мг, 0,47 ммоля) в сухом ДМФ (4 мл). Смесь перемешивали под азотом, а затем охлаждали на льду. Затем добавляли -бром-бутиролактон (50 мг, 0,58 ммоля) в сухом ДМФ(1 мл) и смесь перемешивали до завершения реакции, что показывала TLC. Раствор парционировали между водой (25 мл) и этилацетатом(25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали препаративной тонкослойной хроматогафией на силикагеле, элюируя смесью хлороформ-циклогексан-этанол (10:10:1), с получением изомера А соединения, указанного в заголовке, в виде кристаллического твердого вещества (65 мг, 27%): т. пл. 253-255 С; MS (TSP+ve)(1 Н, m), 4.37 (2 Н, m), 2.71 (1 Н, m), 1.52 (3 Н, s),1.42 (3 Н, s), 1.21 (3 Н, s), 1.08 (3 Н, s). (Обнаружено: С, 61.43; Н, 6.07. С 27 Н 32F2O80.3 Н 2O требует С, 61.43; Н, 6,22%), и изомер Б соединения,указанного в заголовке, в виде кристаллического твердого вещества (53,2 мг, 22%): т. пл. 300304 С; MS (TSP+ve) m/z 523 [MH]+; ИК max(1 Н, m), 5.15 (1 Н, m), 4.46 (1 Н, m), 4.39 (2 Н, m),2.70 (1 Н, m), 1.52 (3 Н, s), 1.42 (3 Н, s), 1.25 (3 Н,s), 1.06 (3 Н, s). (Обнаружено: С, 61.76; Н, 6.11. С 27 Н 32F2O8 требует С, 62.06; Н, 6,17%). Пример 18. S-(2-Oксо-тетрагидро-фуран-3 ил)эфир 16,17-бутилидендиокси-11-гидрокси-3-оксо-андроста-1,4-диен-17-карботиокислоты. Порошкообразный безводный карбонат калия (24 мг, 0,175 ммоля) добавляли к перемешиваемому раствору 16,17-бутилидендиокси-11-гидрокси-3-оксо-андроста-1,4-диен 17-карботиокислоты (69 мг, 0,16 ммоля) в сухом ДМФ (1,5 мл). Смесь перемешивали под азотом, а затем охлаждали на льду. Затем добавляли -бромбутиролактон (16,5 мкл, 0,20 ммоля) и смесь перемешивали до завершения реакции, что показывала TLC. Раствор парционировали между водой (25 мл) и этилацетатом(25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт 32 очищали препаративной HPLC хроматогафией с нормальной фазой (Dynamax 60A С 18, 25 см х 31 мм i.d.), элюируя смесью 70-90% этилацетата/гептан при 45 мл/мин с детектированием при 270 нм и с получением диастереоизомерной смеси А соединения, указанного в заголовке,выделенного в виде кристаллического твердого вещества (23 мг, 18%): т. пл. 129-132 С; MS(4 Н, 1m), 1.38 (3 Н, s), 0.97 (6 Н, m). (Обнаружено: С, 64.34; Н, 7.24; S, 5.39. С 28 Н 36O7S0.5 H2O требует С, 64.26; H, 7.19; S, 5.72%), и диастереоизомерной смеси Б соединения, указанного в заголовке, в виде кристаллического твердого вещества (29 мг, 35%): т. пл. 149-154 С; MS(4 Н, m), 1.37 (3 Н, s), 0.90 (6 Н, m). (Обнаружено: С, 64.43; H, 7.12; S, 5.78. C28H36O7S0.3 Н 2 О требует С, 64.42; H, 7.07; S, 6.14%). Пример 19. S-(2-Oкco-тeтparидpo-фvpaн-3 ил)эфиp 16,17-(R-бутилидендиокси)-6,9 дифтор-11-гидрокси-3-оксо-андрост-4-ен-17 карботиокислота. К перемешиваемой суспензии 16,17-(Rбутилидендиокси)-6,9-дифтор-11-гидрокси 3-оксо-андрост-4-ен-17-карботиокислоты (200 мг, 0,44 ммоля) в дихлорметане (3 мл) добавляли триэтиламин (61 мкл, 0,44 ммоля), затем диэтилхлорфосфат (64 мкл, 0,44 ммоля) и смесь перемешивали до образования промежуточного смешанного ангидрида. Добавляли раствор натриевой соли -меркаптобутиролактона [полученный добавлением гидрида натрия (24 мг 60% дисперсии в масле, 0,6 ммоля) к растворуTLC анализом. По завершении реакционную смесь разбавляли этилацетатом (50 мл) и промывали 1 М HCl (2 х 50 мл), водой (50 мл), насыщенным раствором бикарбоната натрия (2 х 50 мл), водой (50 мл) и насыщенным рассолом (50 мл). Затем органический слой сушили и концентрировали с получением неочищенного материала в виде смолы. Его очищали препаративной тонкослойной хроматографией на силикагеле, элюируя смесью этилацетат-40-60 петролейный эфир (1:1). После растирания с диэтиловым эфиром выделяли изомер А соединения,указанного в заголовке, в виде пены (84,5 мг,35%): MS (TSP+ve) m/z 555 [MH]+; ИК max(KBr) 3466, 1771 см-1; ЯМР(СDСl3) включает 6.14 (1 Н, s), 5.36 и 5.18 (1 Н, 2m), 4.82 (1 Н, d, J 5 Гц), 4.77 (1 Н, t, J 4.5 Гц), 4.35 (4 Н, m), 1.52 (3 Н,s), 0.96 (6 Н, t, s, J 7.5 Гц). (Обнаружено: С,61.22; Н 7.06; S, 5.39. C28H36O7S 0.2 С 5 Н 12 требует С, 61.37; Н, 6.88; S, 5.59%). Пример 20. S-(2-Oкco-тeтparидpo-фуpaн-3 ил)эфиp 16,17-(R-бутилидендиокси)-6,9 дифтор-11-гидрокси-3-оксо-андроста-1,4-диен 17-карботиокислоты. К суспензии песка (10 г) в гептане (12,5 мл) при комнатной температуре добавляли S-(2oкco-тeтpaгидpo-фypaн-3-ил)эфиp 6-9-дифтор-11-гидрокси-16,17-изопропилидендиокси-3-оксо-андроста-1,4-диен-17-карбоновой кислоты (Пример 12, 0,5 г, 0,93 ммоля) при энергичном перемешивании. К этой суспензии добавляли бутанал (0,123 мл, 1,39 ммоля), затем перхлорную кислоту (0, 320 мл, 3,71 ммоля) и суспензию перемешивали при комнатной температуре до завершения реакции, что подтверждалось TLC анализом. Реакцию охлаждали на льду, затем добавляли 10% водный раствор К 2 СО 3 (8 мл), убеждаясь, что внутренняя температура не поднялась выше 25 С. Песок собирали фильтрацией и промывали гептаном (4 х 20 мл), водой (6 х 20 мл), затем этилацетатом (4 х 40 мл) и объединенные этилацетатные слои промывали рассолом (20 мл) и сушили до концентрирования с получением неочищенного продукта в виде твердого вещества. Этот материал очищали колоночной флэшхроматографией на силикагеле, элюируя смесью этилацетат-циклогексан (3:2). Выделяли изомер А соединения, указанного в заголовке, в виде кристаллического твердого вещества (74 мг,15%): т. пл. 260-264 С; MS (TSP+ve) m/z 553(3 Н, t, J 7 Гц). (Обнаружено: С, 60.72; H, 6.01; S,5.51. С 28 Н 34F2O7S требует С, 60.86; H, 6.20; S,5.80%), и изомер Б соединения, указанного в заголовке, также в виде кристаллического твердого вещества (53 мг, 10%): т. пл. 254-257 С; 34 кcи-3-оксо-андроста-4-диен-17-карбоновая кислоты. Порошкообразный безводный карбонат калия (37 мг, 0,264 ммоля) добавляли к перемешиваемому раствору 16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты (100 мг, 0,24 ммоля) в сухом ДМФ (1,3 мл). Смесь перемешивали под азотом, а затем охлаждали на льду. Затем добавляли -бромбутиролактон(25 мкл, 0,30 ммоля) и смесь перемешивали до завершения реакции, что показывала TLC. Раствор парционировали между водой (25 мл) и этилацетатом (25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали препаративной HPLC хроматогафией с обращенной фазой (Dynamax 60A С 18, 25 см х 41 мм i.d.), элюируя смесью 7090% MeCN/H2O при 45 мл/мин с детектированием при 230 нм, и с получением диастереоизомерной смеси А соединения, указанного в заголовке, выделенного в виде кристаллического твердого вещества (41 мг, 34%): т. пл. 177180 С; MS SP+ve) m/z 501 [МН]+; ИК max (КВr) 3515, 1789, 1738, 1653, 1616 см-1; ЯМР (ДМСОd6) включает 7.30 (1H, d, J 10 Гц), 6.18 (1H, d, J 10 Гц), 5.91 (1 Н, s), 5.65 (1 Н, m), 5.18 (1 Н, m),4.86 (2 Н, m), 4.38 (3 Н, m), 1.38 (3 Н, s), 0.93 (3 Н,s), 0.85 (3 Н, t, J 7 Гц). (Обнаружено: С, 66.31; H,7.30. С 28 Н 36O8 0.4 Н 2O требует С, 66.23; H,7.30%), и диастереоизомерной смеси Б соединения, указанного в заголовке, выделенного в виде кристаллического твердого вещества (38 мг,31%): т. пл. 128-133 С; MS (TSP+ve) m/z 501(0,13 мл, 0,648 ммоля) в ДМФ (25 мл) перемешивали и нагревали при 100 С в атмосфере азота до завершения реакции, что показывал TLC анализ. После охлаждения до комнатной температуры добавляли этилацетат (100 мл) и 2 М соляную кислоту (100 мл). Органический слой отделяли и экстрагировали последовательно 35 водой (100 мл), 1 М водным раствором гидроксида натрия (100 мл), водой (100 мл) и насыщенным рассолом (100 мл). Органический слой сушили над безводным MgSO4 и концентрировали с получением неочищенного продукта в виде смолы. Его очищали колоночной флэшхроматографией на силикагеле, элюируя смесью этилацетат: циклогексан (1:1), затем этилацетатом с получением двух фракций. Их затем очищали препаративной HPLC хроматогpафией с обращенной фазой (Dynamax 60A C18, 25 см х 41 мм i.d.), элюируя смесью 47% MeCN/H2O при 45 мл/мин с детектированием при 230 нм в обоих случаях. Менее полярная фракция давала изомер А соединения, указанного в заголовке, в виде белого твердого вещества (30 мг, 3%): т. пл. 165 С; MS (TSP+ve) 538 [МН]+; ИК max(KBr) 3468, 3407, 3351, 1778, 1663, 1520 см-1; ЯМР(CDCl3) включает 6.72 (1 Н, d, J 8 Гц),6.14 (1 Н, s), 5.38 и 5.18 (1 Н, 2m), 4.98 (1 Н, d, J 5 Гц), 4.82 (1 Н, m), 4.67 (1 Н, t, J 4 Гц), 4.50 (1 Н, t,J 9 Гц), 4.37 (2 Н, m), 1.05 (3 Н, s), 0.95 (3 Н, t, J 7 Гц). (Обнаружено: С, 63.00: Н, 6.75; N, 2.13. С 28 Н 37F2NO7 требует С, 62.51; Н, 6.88; N,2.60%). Более полярную фракцию далее очищали препаративной TLC, элюируя несколько раз смесью этилацетат:циклогексан (3:1) с получением изомера В соединения, указанного в заголовке, в виде белого твердого вещества (25 мг,2%): т, пл. 155-160 С; MS (TSP+ve) 538 [МН]+; ИК max (KBr) 3382, 1779, 1668, 1516 см-1; ЯМР(15 мл) перемешивали и нагревали при 100 С в атмосфере азота до завершения реакции, как показывал анализ TLC. После охлаждения до комнатной температуры добавляли этилацетат(100 мл) и 2 М соляную кислоту (100 мл). Органический слой отделяли и экстрагировали 1 М водным раствором гидроксида натрия (100 мл),водой (100 мл) и насыщенным рассолом (100 мл). Органический слой сушили над безводнымMgSО 4 и концентрировали с получением неочищенного продукта в виде смолы. Его очища 001401 36 ли препаративной HPLC хроматографией с обращенной фазой (Dynamax 60A С 18, 25 см х 41 мм i.d.) элюируя смесью 40% MeCN/H2O при 45 мл/мин с детектированием при 230 нм, с получением соединения, указанного в заголовке, в виде белого твердого вещества (129 мг, 22%): т. пл. 204-206 С; MS (TSP+ve) 522 [MH]+; ИК max(0,6 мл, 3,44 ммоля) в ДМФ (15 мл) перемешивали и нагревали при 100 С в атмосфере азота до завершения реакции, что показывал TLC анализ. После охлаждения до комнатной температуры добавляли этилацетат (100 мл) и 2 М соляную кислоту (100 мл). Органический слой отделяли и экстрагировали водой (100 мл), 1 М водным раствором гидроксида натрия (100 мл),водой (100 мл) и насыщенным рассолом (100 мл). Органический слой сушили над безводнымMgSO4 и концентрировали с получением неочищенного продукта в виде смолы. Его очищали колоночной флэш-хроматографией на силикагеле, элюируя смесью этилацетат: циклогексан (4:1), затем очищали препаративной HPLC хроматогафией с обращенной фазой (Dynamax 60A С 18, 25 см х 41 мм i.d.), элюируя смесью 40% МеСN/Н 2 О при 45 мл/мин с детектированием при 230 нм, получая соединение, указанное в заголовке, в виде белого твердого вещества (99 мг, 17%): т. пл. 322 С; MS (TSP+ve) 522 37 Пример 25. S-(2-Оксо-тетрагидро-фуран 3S-ил)эфир 6,9-дифтор-11-гидрокси-16,17-изопропилидендиокси-3-оксо-андроста-1,4 диен-17-карботиокислоты. Порошкообразный безводный карбонат калия (34 мг, 0,32 ммоля) добавляли к перемешиваемому раствору 6-9-дифтор-11 гидрокси-16,17-изопропилидендиокси-3 оксо-андроста-1,4-диен-17-карботиокислоты(250 мг, 0,55 ммоля) в сухом ДМФ (10 мл). Смесь перемешивали под азотом в течение 15 мин. Затем добавляли 2-оксо-тетрагидро-фуран 3R-иловый эфир метансульфоновой кислоты(промежуточное соединение 4, 99 мг, 0,55 ммоля) и смесь перемешивали в течение 10 минут. Раствор парционировали между насыщенным раствором бикарбоната натрия (50 мл) и этилацетатом (50 мл), промывали 2 М раствором соляной кислоты (50 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали флэш-хроматогафией на силикагеле,элюируя смесью этилацетат-циклогексан (1:1),затем смесью этилацетат-циклогексан (3:1), с получением соединения, указанного в заголовке, в виде белого твердого вещества (148 мг,50%): т. пл. 310-314 С; MS (TSP+ve) m/z 539(3H,s), 1.02 (3 Н, s). Это соединение идентично изомеру А из примера 12. Пример 26. S-(2-Оксо-тетрагидро-фуран 3R-ил)эфир 6,9-дифтор-11-гидрокси-16,17-изопропилидендиокси-3-оксо-андроста-1,4 диен-17-карботиокислоты. Порошкообразный безводный карбонат калия (34 мг, 0,32 ммоля) добавляли к перемешиваемому раствору 6-9-дифтор-11 гидрокси-16,17-изопропилидендиокси-3 оксо-андроста-1,4-диен-17-карботиокислоты(250 мг, 0,55 ммоля) в сухом ДМФ (10 мл). Смесь перемешивали под азотом в течение 30 мин. Затем добавляли 2-оксо-тетрагидро-фуран 3S-иловый эфир метансульфоновой кислоты(промежуточное соединение 5, 99 мг, 0,55 ммоля) и смесь перемешивали в течение 15 мин. Раствор парционировали между насыщенным раствором бикарбоната натрия (50 мл) и этилацетатом (50 мл), промывали 2 М раствором соляной кислоты (50 мл), сушили и выпаривали до твердого вещества. Неочищенный продукт очищали флэш-хроматогафией на силикагеле,элюируя смесью этилацетат-циклогексан (1:1),затем смесью этилацетат-циклогексан (3:1), с получением соединения, указанного в заголовке, в виде белого твердого вещества (120 мг,41%): т. пл. 284-287 С; MS (TSP+ve) m/z 539(3H,s), 0.96 (3 Н, s). Это соединение идентично изомеру Б из примера 12. Пример 27. (5-Oксо-тетрагидро-фуран-2 ил)эфир 16,17-(R-бутилидендиокси)-6,9 дифтор-11-гидрокси-3-оксо-андрост-4-ен-17 карботиокислоты. Порошкообразный безводный карбонат калия (29 мг, 0,21 ммоля) добавляли к перемешиваемому раствору 16,17-(R-бутилидендиокси)-6,9-дифтор-11-гидрокси-3-оксоандрост-4-ен-17-карботиокислоты (промежуточное соединение 7, 100 мг, 0,21 ммоля) в сухом ДМФ (2 мл). Смесь перемешивали под азотом, добавляли -хлорбутиролактон (42 мг,0,35 ммоля) и смесь перемешивали до завершения реакции, что показывала TLC. Раствор парционировали между водой (25 мл) и этилацетатом (25 мл). Органическую фазу отделяли, промывали водой (2 х 25 мл), сушили и выпаривали до смолы. Неочищенный продукт очищали препаративной тонкослойной хроматографией на силикагеле, элюируя диэтиловым эфиром с получением соединения, указанного в заголовке, в виде пены (24 мг, 21%): MS (ES+ve) m/z 555[MH]+; ИК max (KBr) 3484, 1790, 1700, 1665 см-1; ЯМР(CDCl3) включает 6.24 (0.5 Н, dd, J 8 и 6 Гц), 6.15 и 6.14 (1 Н, 2s), 5.86 (0.5 Н, dd, J 5 и 1 Гц), 5.33 и 5.21 (1 Н, 2m), 4.84 (0.5 Н, d, J 5.5 Гц),4.80 (0.5 Н, t, J 4.5 Гц), 4.78 (0.5 Н, d, J 5.5 Гц),4.71 (0.5 Н, t, J 4.5 Гц), 4.44 и 4.38 (1 Н, 2m), 1.53 и 1.52 (3 Н, 2s), 1.00-0.92 (6 Н, m). Индивидуальные диастереоизомеры выделяли дальнейшей препаративной тонкослойной хроматографией на силикагеле, элюируя диэтиловым эфиромIn vitro Фармакологическую активность исследовали функциональным in vitro анализом для выявления глюкокортикоидной активности, которая обычно является предопределяющей для противовоспалительной и противоаллергической активности in vivo. Использованный функциональный анализ являлся модификацией способа, описанного T.S.Receptor". Так, клетки Hela стабильно трансфецировали с использованием детектируемого репортерного гена (выделенная плацентарная щелочная фосфатаза, sPAP) под контролем промотора глюкокортикоидного ответа (LTR вируса опухоли молочной железы мыши, MMTV). Различные концентрации стандарта (дексаметазона) или соединений по изобретению культивировали с трансфецированными клетками Hela в течение 72 ч. В конце культивирования добавляли субстрат(п-нитрофенолацетат) для sPAP, и этот продукт измеряли спектрофотометрическим методом. Повышенное поглощение отражало повышенную sPAP транскрипцию, и линии концентрация-ответ были построены так, чтобы можно было оценить значения EC50. В этом тесте изомеры из примеров 1, 4, 5,6, 7, 8, 12, 15, 16, 19, 22, 23 и 24 и соединение из примера 9 имели значения ЕС 50 менее 400 нМ. Гидролиз в крови Все изомеры/соединения из примеров были нестабильны в человеческой плазме, что указывает на возможность обладания благоприятным in vivo профилем побочных действий. Соединения из примеров 15, 16, 22 и 23 показали период полураспада менее 3-х ч, в то время как все изомеры из остальных примеров показали период полураспада менее 60 мин.(1) Противовоспалительная активность ингибирование отека уха крысы. Тестируемые соединения растворяли в ацетоне и 40 мкл, содержащих 5% кротонового масла, наносили на внутреннюю поверхность каждого уха самцов крыс массой 60-80 г. Животных умерщвляли спустя 6 часов и отделяли уши. Перфорировали диски стандартного размера (0,5 см в диаметре) и взвешивали их. Вычисляли среднюю массу ушных дисков и из нее вычисляли процент ингибирования воспаления уха по отношению к ушам, обработанным одним кротоновым маслом. Соединение Пример 2 Пример 19, изомер А Пример 19, изомер Б Пример 19, изомер Б(2) Системные действия - супрессия АСТН у крыс с резекцией надпочечников. Самцам крыс CD (90-120 г) проводили резекцию надпочечников под анестезией с Изофлураном, и в воду для питья добавляли 0,9% физиологический раствор. Через четыре дня животные получали разовую внутритрахеальную дозу (под анестезией с Изофлураном) соединения, суспендированного в физиологическом растворе (содержащем 0,2% Tween-80, 0,2 мл) в 10 ч утра. Через 4 ч животных умерщвля 40 ли введением Эутерала и брали образцы крови посредством внутрисердечной пункции и собирали в пробирки, обработанные гепарином. Образцы центрифугировали (20 мин при 1000 об/мин при 4 С), плазму собирали и проводили радиоиммунологический анализ (RIA) на адренокортикотропный гормон (АСТН) с использованием двойного RIA комлекта антител DPC. В каждый эксперимент включали интактные и обработанные носителем контрольные группы для учета дневных колебаний в АСТН и влияния носителя. Результаты вычисляли по отношению к стандартной кривой RIA и выражали как пг АСТН/мл плазмы, вычисляя процент редукции в АСТН. Соединение Флуосинолон ацетонид Флуосинолон ацетонид Пример 2 Этот результат иллюстрирует минимальную системную активность, ассоциированную с этими лабильными производными плазмы. Фармацевтические препараты Далее приведены примеры подходящих препаратов соединений по изобретению. Термин "активный ингредиент" использован здесь для обозначения соединения по изобретению и может быть, например, изомерами (или их смесью) из примеров 1,12 или 19. 1. Ингаляционные картриджи Микронизированный активный ингредиент Лактоза ВР Активный ингредиент микронизируют традиционным способом до такой тонины, чтобы при введении имелась возможность ингаляции практически всего лекарственного средства в легкие, затем смешивают с лактозой стандартной для таблетирования фракции в высоко мощном миксере. Порошковой смесью заполняют желатиновые капсулы на соответствующем инкапсулирующем аппарате. Содержимое картриджей вводят с использованием порошкового ингалятора, такого как ингалятор ROTAHALER. Альтернативно, порошковой смесью можно заполнить блистеры блистерной упаковки или пластинки. Содержимое блистерной упаковки или пластинки вводят с использованием порошкового ингалятора, такого как ингалятор DISKHALER или DISKUS. [ROTAHALER, DISKHALER и DISKUS - товарные знаки группы компаний Glaxo Wellcome]. 2. Аэрозольный препарат.(1) Суспензия. мг/пуск Микронизированный активный ингредиент 1,1,1,2-Тетрафторэтан Активный ингредиент отвешивают прямо в открытый алюминиевый баллон и устанавливают дозатор. Затем в баллон под давлением через этот дозатор добавляют 1,1,1,2 тетрафторэтан, и баллон встряхивают, чтобы диспергировать лекарственное средство. Окончательно ингалятор содержит 0,33 мас.%/мас. активного ингредиента.(2) Раствор. мг/пуск Микронизированный активный ингредиент Этанол (безводный) 1,1,1,2-Тетрафторэтан Активный ингредиент растворяют в этаноле. Полученный этанольный раствор активного ингредиента дозируют в открытый алюминиевый баллон и устанавливают дозатор. Затем в баллон под давлением через этот дозатор добавляют 1,1,1,2-тетрафторэтан. Окончательно ингалятор содержит 0,33 мас.%/мас. активного ингредиента и 10 мас.%/мас. этанола. 3. Крем. Микронизированный активный ингредиент Жидкий парафин Цетостеариловый спирт Цетомакроголь 1000 Изопропилмиристат Пропиленгликоль Бензойная кислота Фосфат натрия Лимонная кислота/моногидрат Очищенная вода Микронизированный активный ингредиент диспергируют в порции воды, содержащей порцию цетомакроголя 1000. Жидкий парафин, цетостеариловый спирт и изопропилмиристат расплавляют вместе, охлаждают до температуры от 50 до 60 С и добавляют к остальной воде, содержащей пропиленгликоль, бензойную кислоту (консерванты), и фосфат натрия и лимонную кислоту (буферные агенты). Полученную масляную фазу добавляют к суспензии активного ингредиента при перемешивании до остывания. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I)R3 представляет собой водород, метил (который может быть либо в конфигурации , либо в конфигурации ) или метилен; или 42 где R6 и R7 являются одинаковыми или различными и каждый представляет собой водород или C1-6 алкил;R4 и R5 являются одинаковыми или различными и каждый представляет собой водород или галоген. 2. Соединение по п.1, в котором R1 представляет собой О или S. 3. Соединение по п.2, в котором R1 представляет собой S. 4. Соединение по любому из пп.1-3, в котором R1 связан с альфа-углеродным атомом лактоновой группировки. 5. Соединение по любому из пп.1-4, в котором R2 представляет собой ОС(=O)С 1-3 алкил. 6. Соединение по п.5, в котором R2 представляет собой ОС(=O)этил. 7. Соединение по п.5 или 6, в котором R3 является метилом. 8. Соединение по любому из пп.1-4, в котором R2 и R3 вместе представляют собой где R6 и R7 являются одинаковыми или различными и каждый представляет собой водород или C1-6 алкил. 9. Соединение по п.8, в котором R6 и R7 являются одинаковыми или различными и каждый представляет собой водород или C1-3 алкил. 10. Соединение по п.8 или 9, в котором R6 и R7 являются одинаковыми или различными и каждый представляет собой водород, метил или н-пропил. 11. Соединение по любому из пп.8-10, в котором R6 и R7 оба являются метилом. 12. Соединение по любому из пп.8-10, в котором R6 и R7 являются различными и каждый представляет собой водород или н-пропил. 13. Соединение по любому из пп.1-12, в котором R4 и R5 являются одинаковыми или различными и каждый представляет собой водород, фтор или хлор. 14. Соединение по любому из пп.1-13, в котором R4 и R5 оба являются фтором. 15. Соединение по п.1, в котором R1 является S; R2 является ОС(=O)С 1-6 алкилом; R3 является метилом; R4 и R5 являются одинаковыми или различными и каждый представляет собой водород или фтор. 16. Соединение по п.15, в котором R2 является ОС(=O)этилом, а R4 и R5 каждый является фтором. 17. Соединение по п.1, в котором R1 является S; R2 и R3 вместе представляют собой где R6 и R7 являются одинаковыми или различными и каждый представляет собой водород 43 или C1-6 алкил; R4 и R5, которые могут быть одинаковыми или различными, каждый представляет собой водород или фтор. 18. Соединение по п.17, в котором R6 и R7 являются одинаковыми или различными и каждый представляет собой водород, метил или нпропил, а R4 и R5 каждый является фтором. 19. S-(2-Оксо-тетрагидро-фуран-3-ил)эфир 17-бутирилокси-6,9-дифтор-11-гидрокси 16-метил-3-оксо-андроста-1,4-диен-17 карботиокислоты;(5-оксо-тетрагидро-фуран-2-ил)эфир 16,17-(R-бутилидендиокси)-6,9-дифтор 11-гидрокси-3-оксо-андрост-4-ен-17 карботиокислоты; и их сольваты. 20. S-(2-Оксо-тетрагидро-фуран-3-ил)эфир 6,9-дифтор-11-гидрокси-16-метил-3-оксо 17-пропионилокси-андроста-1,4-диен-17 карботиокислоты и его сольваты. 21. S-(2-Оксо-тетрагидро-фуран-3-ил)эфир 6,9-дифтор-11-гидрокси-16,17-изопропилидендиокси-3-оксо-андроста-1,4-диен-17 карботиокислоты и его сольваты. 22. S-(2-Оксо-тетрагидро-фуран-3-ил)эфир 16,17-(R-бутилидендиокси)-6,9-дифтор 11-гидрокси-3-оксо-андрост-4-ен-17 карботиокислоты и его сольваты. 23. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.1-22, или его физиологически приемлемый сольват возможно в смеси с одним или более чем одним физиологически приемлемым разбавителем или носителем. 24. Фармацевтический аэрозольный препарат, содержащий соединение формулы (I) по любому из пп.1-22, или его физиологически приемлемый сольват и фторуглерод или водородсодержащий хлорфторуглерод в качестве пропеллента, возможно в комбинации с поверхностно-активным веществом и/или сорастворителем. 25. Комбинация, содержащая соединение формулы (I) по любому из пп.1-22, или его физиологически приемлемый сольват и другой терапевтически активный агент. 26. Комбинация по п.25, в которой другой терапевтически активный агент является агонистом 2-адренорецепторов. 27. Способ лечения человека или животного с противовоспалительным и/или аллергическим состоянием, при котором указанному человеку или животному вводят эффективное количество соединения формулы (I) по любому из пп.1-22, или его физиологически приемлемого сольвата. 28. Способ получения соединения формулы (I) по п.1, при котором соединение формулы в котором R2, R3, R4, R5 иявляются такими,как определено ранее для соединений формулы(I), a X представляет собой ОН, или его активированное производное обрабатывают соединением формулы (III) и его солями, в которой Z представляет собой ОН, NH2 или SH; и далее, при необходимости или желании, (1) образуют сольват или (2) получают индивидуальный изомер соединения формулы (I). 29. Способ получения соединения формулы (I) по п.1, при котором для соединений формулы (I), в которых R1 представляет собой О или S, соединение формулы (II), в котором R2, 46R3, R4 и R5 являются такими, как определено в п.1, а Х представляет собой ОН или SH, или его соответствующие соли обрабатывают соединением формулы (VI) или формулы (VII) где Q представляет собой подходящую уходящую группу (такую как Cl, Br, OSO2A, где А является, например, СН 3, CF3, п-СН 3 С 6 Н 4); и далее, при необходимости или желании,(1) образуют сольват или (2) получают индивидуальный изомер соединения формулы (I). 30. Способ получения соединения формулы (I) по пп.28 и 29, при котором соединение формулы (I) превращают в другое соединение формулы (I), и далее, при необходимости, (1) образуют сольват или (2) получают индивидуальный изомер соединения формулы (I). 31. Способ получения соединения формулы (I) по пп.28 и 29, при котором получают защищенные производные формулы (1), снимают с них защиту и далее, при необходимости, (1) образуют сольват или (2) получают индивидуальный изомер соединения формулы (I).
МПК / Метки
МПК: A61P 29/00, A61K 31/56, C07J 3/00
Метки: амид, лактоновые, производные, карботио, 17.бета.-карбокси, андростанов
Код ссылки
<a href="https://eas.patents.su/24-1401-laktonovye-proizvodnye-17beta-karboksi-karbotio-i-amid-androstanov.html" rel="bookmark" title="База патентов Евразийского Союза">Лактоновые производные 17.бета.-карбокси, карботио и амид андростанов</a>
Предыдущий патент: Способ получения производных камптотецина.
Следующий патент: Тетракарбон
Случайный патент: Способ получения аннелированных производных пиперазин-2-она и соответствующие промежуточные продукты












