Пиримидин-2, 4, 6-трионовые ингибиторы металлопротеиназ
Формула / Реферат
1. Соединение формулы
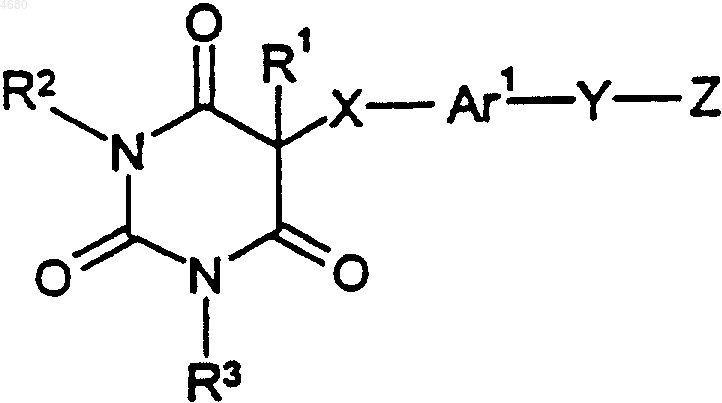
где R1 представляет собой (C1-C8)алкил или (C3-C8)циклоалкил;
R2 и R3 представляют собой водород;
X выбран из группы, состоящей из кислорода и серы;
Y выбран из группы, состоящей из связи, кислорода и серы;
Ar1 представляет собой (C6-C10)арил и
Z представляет собой бензил или (C6-C10)арил, возможно замещенный по любому кольцевому атому углерода, способному образовывать дополнительную связь, одним заместителем, выбранными из F, Cl и Br;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R2 и R3, каждый, представляют собой водород.
3. Соединение по п.2, где X представляет собой кислород.
4. Соединение по п.2, где X представляет собой серу.
5. Соединение по п.2, где Y представляет собой связь, кислород или серу.
6. Соединение по п.3, где Y представляет собой связь, кислород или серу.
7. Соединение по п.4, где Y представляет собой связь, кислород или серу.
8. Соединение по п.2, где Y представляет собой кислород.
9. Соединение по п.3, где Y представляет собой кислород.
10. Соединение по п.2, где X и Y, каждый, представляют собой кислород.
11. Соединение по п.2, где Ar1 представляет собой фенил.
12. Соединение по п.8, где Ar1 представляет собой фенил.
13. Соединение по п.9, где Ar1 представляет собой фенил.
14. Соединение по п.10, где Ar1 представляет собой фенил.
15. Соединение по п.2, где Z представляет собой (C6-C10)арил.
16. Соединение по п.3, где Z представляет собой (C6-C10)арил.
17. Соединение по п.8, где Z представляет собой (C6-C10)арил.
18. Соединение по п.9, где Z представляет собой (C6-C10)арил.
19. Соединение по п.13, где Z представляет собой (C6-C10)арил.
20. Соединение по п.2, где Z замещен по любому кольцевому атому углерода, способному образовывать дополнительную связь, одним заместителем, выбранным из F, Cl и Br.
21. Соединение по п.1, где X представляет собой кислород, Y представляет собой связь, кислород или серу, R1 представляет собой (C1-C4алкил) и R2 и R3 представляют собой водород.
22. Соединение по п.1, где R2 и R3, каждый, представляют собой водород; X представляет собой кислород; Y представляет собой кислород.
23. Соединение по п.1, где R1 представляет собой метил; R2 и R3, каждый, представляют собой водород; X представляет собой кислород; Y представляет собой кислород и Z представляет собой (C6-C10)арил.
24. Соединение по п.1, где R1 представляет собой н-бутил; R2 и R3, каждый, представляют собой водород; X представляет собой кислород; Y представляет собой кислород и Z представляет собой (C6-C10)арил.
25. Соединение по п.1, где R1 представляет собой метил; R2 и R3, каждый, представляют собой водород; X представляет собой кислород; Y представляет собой связь и Z представляет собой (C6-C10)арил.
26. Соединение по п.1, где R1 представляет собой н-бутил; R2 и R3, каждый, представляют собой водород; X представляет собой кислород; Y представляет собой связь и Z представляет собой (C6-C10)арил.
27. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из
5-метил-5-(4-феноксифенокси)пиримидин-2,4,6-триона;
5-метил-5-(4-(4'-фторфенокси)фенокси)пиримидин-2,4,6-триона;
5-н-бутил-5-(4-феноксифенокси)пиримидин-2,4,6-триона;
5-н-бутил-5-(4-(4'-фторфенокси)фенокси)пиримидин-2,4,6-триона;
5-метил-5-(4-фенилфенокси)пиримидин-2,4,6-триона;
5-метил-5-(3-фенилфенокси)пиримидин-2,4,6-триона и
5-метил-5-(4-бензилоксифенокси)пиримидин-2,4,6-триона;
или их фармацевтически приемлемых солей.
28. Фармацевтическая композиция для лечения состояния, выбранного из группы, состоящей из артрита, воспалительного кишечного заболевания, болезни Крона, эмфиземы, острого респираторного дистресс-синдрома, астмы, хронического обструктивного заболевания легких, болезни Альцгеймера, токсичности органного трансплантата, кахексии, аллергических реакций, аллергической контактной гиперчувствительности, рака, изъязвления тканей, рестеноза, периодонтального заболевания, врожденного буллезного эпидермолиза, остеопороза, разбалтывания искусственных суставных имплантатов, атеросклероза, аневризмы аорты, застойной сердечной недостаточности, инфаркта миокарда, удара, церебральной ишемии, травмы головы, повреждения спинного мозга, нейродегенеративных расстройств, аутоиммунных расстройств, болезни Хантингтона, болезни Паркинсона, мигрени, депрессии, периферической невропатии, боли, церебральной амилоидной ангиопатии, ноотропного или когнитивного усиления, бокового амиотрофического склероза, множественного склероза, глазного ангиогенеза, повреждения роговицы, дегенерации желтого пятна, аномального заживления ран, ожогов, диабета, рубцевания роговицы, склерита, СПИДа, сепсиса и септического шока у млекопитающего, включая человека, содержащая количество соединения по п.1, эффективное при таком лечении, и фармацевтически приемлемый носитель.
29. Способ лечения состояния, выбранного из группы, состоящей из артрита, воспалительного кишечного заболевания, болезни Крона, эмфиземы, острого респираторного дистресс-синдрома, астмы, хронического обструктивного заболевания легких, болезни Альцгеймера, токсичности органного трансплантата, кахексии, аллергических реакций, аллергической контактной гиперчувствительности, рака, изъязвления тканей, рестеноза, периодонтального заболевания, врожденного буллезного эпидермолиза, остеопороза, разбалтывания искусственных суставных имплантатов, атеросклероза, аневризмы аорты, застойной сердечной недостаточности, инфаркта миокарда, удара, церебральной ишемии, травмы головы, повреждения спинного мозга, нейродегенеративных расстройств, аутоиммунных расстройств, болезни Хантингтона, болезни Паркинсона, мигрени, депрессии, периферической невропатии, боли, церебральной амилоидной ангиопатии, ноотропного или когнитивного усиления, бокового амиотрофического склероза, множественного склероза, глазного ангиогенеза, повреждения роговицы, дегенерации желтого пятна, аномального заживления ран, ожогов, диабета, рубцевания роговицы, склерита, СПИДа, сепсиса и септического шока у млекопитающего, включая человека, при котором указанному млекопитающему вводят количество соединения по п.1, эффективное при лечении такого состояния.
30. Фармацевтическая композиция для лечения состояния, которое можно лечить посредством ингибирования матриксных металлопротеиназ, у млекопитающего, включая человека, содержащая количество соединения по п.1, эффективное при таком лечении, и фармацевтически приемлемый носитель.
31. Фармацевтическая композиция для лечения состояния, которое можно лечить посредством ингибирования репролизина млекопитающих, у млекопитающего, включая человека, содержащая количество соединения по п.1, эффективное при таком лечении, и фармацевтически приемлемый носитель.
Текст
1 Предпосылки изобретения Настоящее изобретение относится к пиримидин-2,4,6-трионовым ингибиторам металлопротеиназ и к фармацевтическим композициям и способам лечения воспаления, рака и других расстройств. Соединения по настоящему изобретению являются ингибиторами цинковых металлоэндопептидаз, в частности тех, которые относятся к матриксному металлопротеиназному (также называемому ММР или матриксиновое) и репролизиновому (также известному как адамилзиновое) подсемействам метцинкинов (Rawlings, et al., Methods in Enzymology, 248, 183-228(1995. ММР подсемейство ферментов в настоящее время включает в себя семнадцать членов(ММР-1, ММР-2, ММР-3, ММР-7, ММР-8,ММР-9, ММР-10, ММР-11, ММР-12, ММР-13,ММР-14, ММР-15, ММР-16, ММР-17, ММР-18,ММР-19, ММР-20). Эти ММР наиболее широко известны благодаря их роли в регулировании оборота белков внеклеточного матрикса и как таковые играют важную роль в нормальных физиологических процессах, таких как репродукция, развитие и дифференциация. Кроме того, ММР экспрессируются при многих патологических ситуациях, при которых происходит аномальный оборот соединительной ткани. Например, было показано, что ММР-13, фермент с сильной активностью в отношении деградации коллагена типа II (основной коллаген в хряще),сверхэкспрессируется в остеоартритном хряще(Mitchell, et al., J. Clin. Invest., 97, 761 (1996. Другие ММР (ММР-2, ММР-3, ММР-8, ММР-9,ММР-12) также сверхэкспрессируются в остеоартритном хряще, и предполагается, что ингибирование некоторых или всех этих ММР замедляет или блокирует ускоренную потерю хряща, типичную для заболеваний суставов,таких как остеоартрит или ревматоидный артрит. Репролизины млекопитающих известны как ADAM (A Disintegrin And Metalloprteinase дезинтегрин и металлопротеиназа) (Wolfberg, etal., J. Cell Biol., 131, 275-278 (1995 и содержат дезинтегриновый домен в дополнение к металлопротеиназоподобному домену. К настоящему времени идентифицированы двадцать три индивидуальных ADAM.ADAM-17, также известный как фактор некроза опухоли альфа превращающий фермент(ТАСЕ), является наиболее широко известнымADAM. ADAM-17 (ТАСЕ) ответственен за расщепление клеточно-связанного фактора некроза опухоли альфа (TNF-, также известный как кахектин). Признано, что TNF- вовлечен во многие инфекционные и аутоиммунные заболевания (W. Friers, FEBS Letters, 285, 199 (1991. Кроме того, показано, что TNF- является пер 004680 2 вичным медиатором воспалительного ответа,наблюдаемого при сепсисе и септическом шоке(Spooner, et аl., Clinical Immunology and Immunopathology, 62 S11 (1992. Существует две формы TNF- - мембранный белок типа II с относительной молекулярной массой 26000 (26 кДа) и растворимая форма с молекулярной массой 17 кДа, образуемая из клеточно-связанного белка путем специфического протеолитического расщепления. Растворимая форма TNF- с молекулярной массой 17 кДа высвобождается клеткой и ассоциируется с вредными воздействиями TNF-. Эта форма TNF- также способна действовать в сайтах, отдаленных от места синтеза. Таким образом, ингибиторы ТАСЕ предотвращают образование растворимого TNF- и предупреждают вредные воздействия растворимого фактора. Выбранные соединения по изобретению являются сильными ингибиторами аггреканазы- фермента, важного в процессе деградации хрящевого аггрекана. Также полагают, что аггреканаза представляет собой ADAM (Tortorellaet al., Science, 284, 1664 (1999. Потеря аггрекана из хрящевого матрикса является важным фактором в развитии заболеваний суставов, таких как остеоартрит и ревматоидный артрит, и предполагается, что ингибирование аггреканазы замедляет или блокирует потерю хряща при этих заболеваниях. Другие ADAM, которые проявили экспрессию при патологических состояниях, включают ADAM TS-1 (Kuno, et al., J. Biol. Chem.,272, 556-562 (1997 и ADAM 10, ADAM 12 иComm., 235, 437-442, (1997. По мере накопления знаний об экспрессии, физиологических субстратах и связи ADAM с заболеваниями становится понятной вся важность роли ингибирования этого класса ферментов. Признано, что разные комбинации ММР иADAM экспрессируются при разных патологических состояниях. Как таковые, ингибиторы с конкретной селективностью в отношении индивидуальных ADAM и/или ММР могут быть предпочтительны для отдельных заболеваний. Например, ревматоидный артрит представляет собой воспалительное заболевание суставов,характеризующееся избыточными уровнямиTNF и потерей составляющих суставного матрикса. В этом случае, соединение, которое ингибирует ТАСЕ и аггреканазу, а также ММР,например ММР-13, может быть предпочтительным терапевтическим средством. Наоборот, при менее воспалительном заболевании суставов,таком как остеоартрит, могут быть предпочтительными соединения, которые ингибируют ММР, расщепляющие матрикс, а не ТАСЕ, такие как ММР-13. Авторы настоящего изобретения также обнаружили, что можно идентифицировать инги 3 биторы формулы I с дифференцированной металлопротеазной и репролизиновой активностью (предпочтительно ММР-13 ингибирующей активностью). Одна группа предпочтительных ингибиторов формулы I, которую авторы данного изобретения смогли идентифицировать,включает в себя ингибиторы, которые селективно ингибируют ММР-13 в предпочтение ММР 1. Ингибиторы матриксных металлопротеиназ и репролизина общеизвестны в литературе. Конкретно, WO 98/58925, опубликованная 30 декабря 1998 г., относится к некоторым пиримидин-2,4,6-трионовым ингибиторам ММР. Европейский патент 606046, опубликованный 13 июля 1994 г., относится к некоторым гетероциклическим ингибиторам ММР. Патент США 5861510, опубликованный 19 января 1999 г.,относится к циклическим арилсульфониламиногидроксамовым кислотам, которые полезны в качестве ингибиторов ММР. WO 98/34918,опубликованная 13 августа 1998 г., относится к гетероциклическим гидроксамовым кислотам, в том числе к некоторым диалкилзамещенным соединениям, которые полезны в качестве ингибиторов ММР. WO 96/27583 и WO 98/07697,опубликованные 7 марта 1996 г. и 26 февраля 1998 г. соответственно, относятся к арилсульфонилгидроксамовым кислотам. WO 98/03516,опубликованная 29 января 1998 г., относится к фосфинатам с ММР активностью. WO 98/33768,опубликованная 6 августа 1998 г., относится кN-незамещенным арилсульфониламиногидроксамовым кислотам. WO 98/08825 и WO 98/08815, обе опубликованные 5 марта 1998 г.,относятся к некоторым гетероциклическим ингибиторам ММР. Заявки на патент США 60/096232 и 60/096256, обе поданные 12 августа 1998 г., также относятся к ингибиторам ММР и ТАСЕ на основе гетероциклических гидроксамовых кислот. Содержание каждой из вышеупомянутых публикаций и заявок во всей своей полноте включено в данное описание изобретения ссылкой. Краткое изложение сущности изобретения Настоящее изобретение относится к соединениям формулы(С 3-С 8)циклоалкил возможно может содержать от одного до трех гетероатомов, независимо выбранных из кислорода, NR5 и серы; где указанный (С 1-С 8)алкил или (С 3-С 8)циклоалкил возможно может быть также замещен заместителями в количестве от одного до двух, независимо выбранными из (С 1-С 4)алкила, (С 6 004680 4 С 10)арила, (С 2-С 10)гетероарила, ОН, NH2, (С 1 С 4)алкиламино, ди[(С 1-С 4)алкил]амино, (С 3(С 3-С 8)циклоалкил(С 1 С 8)циклоалкиламино,С 4)алкиламино,(С 1-С 4)алкокси,-CONH2,-CONHR4, -CON(R4)2 и (С 3-С 8)циклоалкила, где указанный (С 3-С 8)циклоалкил возможно может содержать один или два гетероатома, независимо выбранные из NR5, кислорода и серы;R2 и R3 независимо выбраны из водорода или (С 1-С 4)алкила, где указанный (С 1-С 4)алкил возможно может содержать один гетероатом,выбранный из кислорода, NR5 или серы; где указанный (С 1-С 4)алкил возможно может быть также замещен (С 6-С 10)арилом, (С 2-С 10)гетероарилом, ОН, NH2, (С 1-С 4)алкиламино, ди[(С 1 С 4)алкил]амино, (С 3-С 8)циклоалкиламино, (С 3 С 8)циклоалкил(С 1-С 4)алкиламино, (С 1-С 4)алкокси, -CON(R4)2 или (С 3-С 8)циклоалкилом; где указанный (С 3-С 8)циклоалкил может содержать один или два гетероатома, независимо выбранные из NR5, кислорода и серы; Х выбран из группы, состоящей из кислорода, серы, SO2, S=O, NR4, -CH2O-, -OCH2-,-CH2S-, -CH2(S=O)-, -CH2SO2-, -SCH2-, -SOCH2-,-SO2CH2-, -N(R4)CH2-, -CH2N(R4)-, -N(R4)SO2- иR4 в любом месте, где он встречается, независимо выбран из водорода и (С 1-С 4)алкила;R5 в любом месте, где он встречается, независимо выбран из водорода, (С 1-С 4)алкила,(С 6-С 10)арила, (С 2-С 10)гетероарила, ОН, -CONH2,-CONHR4, -CON(R4)2 и (С 3-С 8)циклоалкила;Z представляет собой (С 6-С 10)арил, (С 3 С 8)циклоалкил, (С 3-С 8)циклоалкил(С 1-С 4)алкил или (С 2-С 10)гетероарил; где один или два кольцевых атома углерода указанного (С 3-С 8)циклоалкила или (С 3-С 8)циклоалкил(С 1-С 4)алкила возможно могут быть заменены гетероатомами,независимо выбранными из кислорода, серы иNR5; Аr1 и Z возможно могут быть замещены по любому кольцевому атому углерода, способному образовывать дополнительную связь, заместителями в количестве от одного до трех, независимо выбранными из F, Cl, Br, CN, ОН, (С 1 С 4)алкила, (С 1-С 4)перфторалкила, (С 1-С 4)перфторалкилокси, (С 1-С 4)алкокси и (С 3-С 8)циклоалкилокси; или его фармацевтически приемлемым солям. Настоящее изобретение также относится к фармацевтически приемлемым солям соединений формулы I, образованным присоединением кислот. Кислотами, пригодными для получения фармацевтически приемлемых, образованных присоединением кислот солей вышеупомянутых 5 основных соединений по данному изобретению,являются кислоты, которые образуют нетоксичные соли присоединения кислот, т.е. соли, содержащие фармацевтически приемлемые анионы, такие как гидрохлоридные, гидробромидные, гидройодидные, нитратные, сульфатные,бисульфатные, фосфатные, кислые фосфатные,ацетатные, лактатные, цитратные, кислые цитратные, тартратные, битартратные, сукцинатные, малеатные, фумаратные, глюконатные,сахаратные, бензоатные, метансульфонатные,этансульфонатные, бензолсульфонатные, паратолуолсульфонатные и памоатные [т.е. 1,1'метилен-бис-(2-гидрокси-3-нафтоат)ные] соли. Данное изобретение также относится к солям соединений формулы I, образованным присоединением оснований. Химическими основаниями, пригодными для использования в качестве реагентов для получения фармацевтически приемлемых, образованных присоединением оснований солей соединений формулы I, которые имеют кислотную природу, являются основания, которые образуют нетоксичные основные соли с такими соединениями. Такие нетоксичные основные соли включают, без ограничений, соли, образованные такими фармакологически приемлемыми катионами, как катионы щелочных металлов (например калия и натрия) и катионы щелочно-земельных металлов (например кальция и магния), аммониевые соли или водорастворимые соли присоединения аминов, такие как N-метилглюкаминовые (меглюминовые), и низшие алканоламмониевые и другие основные соли фармацевтически приемлемых органических аминов. Термин "связь", используемый здесь в определении группы Y, означает, что группы Аr1 иZ непосредственно связаны через углеродуглеродную связь с образованием боковой цепи арильных колец, такой как дифенил. Используемый здесь термин "алкил" включает в себя, если не указано иное, насыщенные одновалентные углеводородные радикалы, имеющие прямые, разветвленные или циклические группировки или их комбинации. Алкильные группы, там где они встречаются,возможно могут быть замещены подходящим заместителем. Используемый здесь термин "алкенил" включает в себя, если не указано иное, углеводородные радикалы, содержащие по меньшей мере одну олефиновую связь и имеющие прямые, разветвленные или циклические группировки или их комбинации. Используемый здесь термин "алкинил" включает в себя, если не указано иное, углеводородные радикалы, содержащие по меньшей мере одну углерод-углеродную тройную связь и имеющие прямые, разветвленные или циклические группировки или их комбинации. Используемый здесь термин "алкокси" включает в себя O-алкильные группы, в кото 004680 6 рых "алкил" является таким, как определено выше. Используемый здесь термин "галогено" включает в себя, если не указано иное, фтор,хлор, бром или йод, предпочтительно фтор или хлор. Используемый здесь термин "арил" включает в себя, если не указано иное, органический радикал, получаемый из ароматического углеводорода удалением одного или более чем одного водорода, такой как фенил или нафтил,возможно замещенный подходящими заместителями в количестве от 1 до 3, такими как фторо, хлоро, циано, нитро, трифторметил, (С 1 С 6)алкокси, (С 6-С 10)арилокси, (С 3-С 8)циклоалкилокси, трифторметокси, дифторметокси или(С 1-С 6)алкил. Используемый здесь термин "гетероарил" включает в себя, если не указано иное, органический радикал, получаемый из ароматического гетероциклического соединения удалением одного или более чем одного водорода, такой как пиридил, фурил, пирроил, тиенил, изотиазолил,имидазолил, бензимидазолил, тетразолил, пиразинил, пиримидил, хинолил, изохинолил, бензофурил, изобензофурил, бензотиенил, пиразолил, индолил, изоиндолил, пуринил, карбазолил,изоксазолил, тиазолил, оксазолил, бензтиазолил или бензоксазолил, возможно замещенный подходящими заместителями в количестве от 1 до 3, как определено ниже, такими как фторо, хлоро, трифторметил, (С 1-С 6)алкокси, (С 6-С 10)арилокси, (С 3-С 8)циклоалкилокси, трифторметокси,дифторметокси или (С 1-С 6)алкил. Термин "соответствующий заместитель" предназначен для обозначения химически и фармацевтически приемлемой функциональной группы, т.е. группировки, которая не сводит к нулю ингибиторную активность соединений по изобретению. Такие соответствующие заместители могут быть рутинно подобраны специалистами в данной области техники. Показательные примеры соответствующих заместителей включают, без ограничений, галогеногруппы, перфторалкильные группы, перфторалкоксигруппы, алкильные группы, гидроксигруппы, оксогруппы, меркаптогруппы, алкилтиогруппы, алкоксигруппы, арильные или гетероарильные группы, арилокси- или гетероарилоксигруппы,аралкильные или гетероаралкильные группы,аралкокси- или гетероаралкоксигруппы, карбоксигруппы, аминогруппы, алкил- и диалкиламиногруппы, карбамоильные группы, алкилкарбонильные группы, алкоксикарбонильные группы,алкиламинокарбонильные группы, диалкиламинокарбонильные группы, арилкарбонильные группы, арилоксикарбонильные группы, алкилсульфонильные группы, арилсульфонильные группы и тому подобное. Некоторые соединения формулы I содержат хиральные центры и, следовательно, существуют в разных энантиомерных формах. Дан 7 ное изобретение относится ко всем оптическим изомерам, энантиомерам, диастереомерам и стереоизомерам соединений формулы I и их смесям. Соединения по изобретению также существуют в разных таутомерных формах. Данное изобретение относится ко всем таутомерам формулы I. Предпочтительными соединениями по изобретению являются соединения, в которыхR2 и R3, каждый, представляют собой водород. Другие предпочтительные соединения по изобретению включают соединения, в которых Х представляет собой кислород, -ОСН 2-, -СН 2O-; где более предпочтительно Х представляет собой кислород; где более предпочтительно Y представляет собой связь, кислород, серу, -CH2-,SO2, -OCH2- или -СН 2 О-; где более предпочтительно Y представляет собой кислород, -ОСН 2 или -CH2O-; где наиболее предпочтительно Y представляет собой кислород. Другие воплощения данного изобретения включают в себя соединения формулы I, где Х представляет собой серу, SO2, -SCH2-, -CH2S-,-CH2SO2- или -SO2CH2-; где более предпочтительно Y представляет собой связь, кислород,серу, -СН 2-, SO2, -OCH2- или -CH2O-; где более предпочтительно Y представляет собой кислород, -OCH2- или -CH2O-; где наиболее предпочтительно Y представляет собой кислород. Другие воплощения данного изобретения включают в себя соединения формулы I, где Х представляет собой NR4, -CH2NR4- или-NR4CH2-; где более предпочтительно Y представляет собой связь, кислород, серу, -CH2-,SO2, -OCH2- или -CH2O-; где более предпочтительно Y представляет собой кислород, -OCH2 или -CH2O-; где наиболее предпочтительно Y представляет собой кислород. Другие воплощения данного изобретения включают в себя соединения формулы I, где Х представляет собой -N(R4)SO2- или -SO2N(R4)-; где более предпочтительно Y представляет собой связь, кислород, серу, -CH2-, SO2, -OCH2 или -CH2O-; где более предпочтительно Y представляет собой кислород, -OCH2-; где наиболее предпочтительно Y представляет собой кислород. Другими предпочтительными соединениями являются соединения, в которых Аr1 представляет собой возможно замещенный фенил. Другие воплощения данного изобретения включают в себя те соединения формулы I, гдеZ представляет собой (С 6-С 10)арил, предпочтительно фенил, возможно замещенный одним или более чем одним заместителем, предпочтительно заместителями в количестве ноль, один или два, независимо выбранными из F, Cl, Br,-CN, ОН, (С 1-С 4)алкила, (С 1-С 4)перфторалкила,(С 1-С 4)перфторалкокси, (С 1-С 4)алкокси и (С 3 С 8)циклоалкилокси. Другие воплощения данного изобретения включают в себя те соединения формулы I, где(С 3-С 8)циклоалкил или (С 3-С 8)циклоалкилокси(С 1-С 4)алкил), где один или два кольцевых атомов углерода указанного (С 3-С 8)циклоалкила возможно могут быть заменены гетероатомами,независимо выбранными из кислорода, серы или NR5, где R5 выбран из водорода, (С 1 С 4)алкила, (С 6-С 10)арила, (С 2-С 10)гетероарила,ОН, -CONH2, -CONHR4, -СОN(R4)2 и (С 3 С 8)циклоалкила. Такие предпочтительные группы включают циклопропил, циклобутил, циклопентил, циклогексил, тетрагидрофуранил, тетрагидропиранил, N-метил-3-азетидинил, пиперазинил, пиперидинил, 1,3-оксазолидин-4-он-5 ил, 1,3-оксазолидин-2,4-дион-5-ил, 4,5-дигидро 1,2-оксазолидин-3-он-4-ил,1,3-тиазолидин-4 он-5-ил, 1,3-тиазолидин-2,4-дион-5-ил, 1,3 имидазолидин-4-он-5-ил, 1,3-имидазолидин-2,4 дион-5-ил, 1,2-пиразолидин-3-он-4-ил, тетрагидро-1,3-оксазин-4-он-5-ил,тетрагидро-1,3 оксазин-2,4-дион-5-ил, морфолинил, морфолин 3-он-2-ил,морфолин-3,5-дион-2-ил,2,3 дигидро-1,4-оксазин-3-он-2-ил, тетрагидро-1,3 тиазин-4-он-5-ил,тетрагидро-1,3-тиазин-2,4 дион-5-ил, тиоморфолинил, тиоморфолин-3-он 2-ил, тиоморфолин-3,5-дион-2-ил, 2,3-дигидро 1,4-тиазин-3-он-2-ил, гексагидро-1,2-диазин-3 он-4-ил, 4,5-дигидро-2 Н-пиридазин-3-он-4-ил,гексагидро-1,3-диазин-2,4-дион-5-ил,пиперазин-2-он-3-ил, пиперазин-2,6-дион-3-ил, тетрагидро-1,3,4-тиадиазин-5-он-6-ил, 5,6-дигидро 1,3,4-тиадиазин-5-он-6-ил, 1,3,4-оксадиазин-5 он-6-ил, 5,6-дигидро-1,2,4-оксадиазин-5-он-6 ил,тетрагидро-1,2,4-оксадиазин-5-он-6-ил,1,2,4-триазин-5-он-6-ил, тетрагидро-1,2,4-оксадиазин-5-он-6-ил, 5,6-дигидро-1,2,4-оксадиазин 5-он-6-ил, 1,2,4-оксадиазин-3,5-дион-6-ил и 1,2,4-триазин-6-он-5-ил, предпочтительно циклопропил, циклобутил, циклопентил, циклогексил, тетрагидрофуранил, тетрагидропиранил, Nметил-3-азетидинил, пиперазинил, пиперидинил, N-метилпиперидинил и морфолинил, более предпочтительно циклопропил, циклобутил,циклопентил, циклогексил, тетрагидрофуранил и тетрагидропиранил, наиболее предпочтительно циклопропил, тетрагидрофуранил и тетрагидропиранил. Другие воплощения данного изобретения включают в себя те соединения формулы I, гдеZ представляет собой (С 3-С 8)циклоалкил(С 1 С 4)алкил; где один или два кольцевых атома углерода указанного (С 3-С 8)циклоалкил(С 1 С 4)алкила возможно могут быть заменены гетероатомами, независимо выбранными из кислорода, серы или NR5, где R5 выбран из водорода,(С 1-С 4)алкила, (С 6-С 10)арила, (С 2-С 10)гетероарила, ОН, -CONH2, -CONHR4, -СОN(R4)2 и (С 3 С 8)циклоалкила. Предпочтительные циклоалкильные и гетероциклоалкильные кольца являются такими, как описано выше. Предпочтительный алкил указанного (С 3-С 8)циклоал 9 кил(С 1-С 4)алкила представляет собой метилен и этилен. Другие воплощения данного изобретения включают в себя те соединения формулы I, гдеZ представляет собой (С 2-С 10)гетероарил; предпочтительно пиридил, фурил, пирроил, тиенил,изотиазолил, имидазолил, бензимидазолил, тетразолил, пиразинил, пиримидил, хинолил, изохинолил, бензофурил, изобензофурил, бензотиенил, пиразолил, индолил, изоиндолил, пуринил, карбазолил, изоксазолил, тиазолил, оксазолил, бензтиазолил или бензоксазолил, более предпочтительно пиридил, пиримидил или пиразинил, наиболее предпочтительно пиридил; где каждый из указанных (С 2-С 10)гетероарилов возможно может быть замещен соответствующими заместителями в количестве от 1 до 3,такими как фторо, хлоро, трифторметил, (С 1 С 6)алкокси, (С 6-С 10)арилокси, трифторметокси,дифторметокси или (С 1-С 6)алкил. Другие предпочтительные соединения по изобретению включают соединения, в которых Аr1 представляет собой фенил или (С 2 С 10)гетероарил, предпочтительно пиридил, фурил, пирроил, тиенил, изотиазолил, имидазолил,бензимидазолил, тетразолил, пиразинил, пиримидил, хинолил, изохинолил, бензофурил, изобензофурил, бензотиенил, пиразолил, индолил,изоиндолил, пуринил, карбазолил, изоксазолил,тиазолил, оксазолил, бензтиазолил или бензоксазолил, более предпочтительно фенил, пиридинил, пиразинил, пиримидил, наиболее предпочтительно пиридил или фенил, возможно замещенный соответствующими заместителями в количестве от 1 до 3, такими как фторо, хлоро,трифторметил, (С 1-С 6)алкокси, (С 6-С 10)арилокси, трифторметокси, дифторметокси или (С 1 С 6)алкил. Другие предпочтительные соединения по изобретению включают соединения, в которых Аr1 и Z замещены по одному из кольцевых атомов углерода, способных образовывать дополнительную связь, одним или более чем одним заместителем, независимо выбранным из F, Cl,Br, -CN, ОН, (С 1-С 4)алкила, (С 1-С 4)перфторалкила, (С 1-С 4)перфторалкокси, (С 1-С 4)алкокси и (С 3-С 8)циклоалкилокси. Наиболее предпочтительные соединения по изобретению включают соединения формулыI, где Х представляет собой кислород, Y представляет собой связь, кислород, серу, -СН 2-,SO2, -ОСН 2- или -CH2O-; R1 представляет собой водород или (С 1-С 4)алкил; где указанный(С 1-С 4)алкил возможно может содержать от одного до двух гетероатомов, независимо выбранных из кислорода и NR5, где указанная (С 1 С 4)алкильная цепь возможно может быть также замещена заместителями в количестве от одного до трех (предпочтительно ноль, один или два заместителя), независимо выбранными из (С 1 С 4)алкила, ОН, NH2, (С 1-С 4)алкиламино, ди[(С 1(С 1-С 4)алкокси,-CONH2,С 4)алкил]амино, 004680-CONHR4 и -CON(R4)2; и R2 и R3 независимо выбраны из водорода или (С 1-С 4)алкила. Другие воплощения данного изобретения включают соединения формулы I, где R1 представляет собой (С 1-С 8)алкил, возможно содержащий от одного до трех гетероатомов (предпочтительно два гетероатома, разделенные по меньшей мере одним атомом углерода, где указанный гетероатом предпочтительно представляет собой -NH- или О, наиболее предпочтительно О), где указанный (С 1-С 8)алкил замещен ОН, NH2, (С 1-С 4)алкиламино, ди[(С 1-С 4)алкил] амино, (С 1-С 4)алкокси или -СОN(R4)2, предпочтительно ди[(С 1-С 4)алкил]амино. Другие воплощения данного изобретения включают соединения формулы I, где по меньшей мере один из R2 или R3 представляет собой(указанный гетероатом предпочтительно представляет собой -NH- или -О-, наиболее предпочтительно -О-), где указанный (С 1-С 4)алкил замещен одной или двумя группами, независимо выбранными из (С 6-С 10)арила или (С 2 С 10)гетероарила. Другие предпочтительные соединения по настоящему изобретению включают соединения, в которыхR1 представляет собой н-бутил; R2 и R3,каждый, представляют собой водород; Х представляет собой кислород; Y представляет собой кислород; и Z представляет собой (С 6-С 10)арил; Конкретные предпочтительные соединения формулы I выбраны из группы, состоящей из 5-метил-5-(4-фенокси-фенокси)пиримидин-2,4,6-триона; 5-метил-5-(4-(4'-фторфенокси)фенокси) пиримидин-2,4,6-триона; 5-н-бутил-5-(4-фенокси-фенокси)пиримидин-2,4,6-триона; 5-н-бутил-5-(4-(4'-фторфенокси)фенокси) пиримидин-2,4,6-триона; 5-метил-5-(4-фенилфенокси)пиримидин 2,4,6-триона; 5-метил-5-(3-фенилфенокси)пиримидин 2,4,6-триона и 5-метил-5-(4-бензилоксифенокси)пиримидин-2,4,6-триона; или их фармацевтически приемлемых солей. 11 Другие соединения по изобретению включают 5-метил-5-(4-(4'-хлорфенокси)фенокси) пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-цианофенокси)фенокси) пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-трифторметилфенокси) фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-метоксифенокси)фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(3'-хлорфенокси)фенокси) пиримидин-2,4,6-трион; 5-метил-5-(4-(3'-фторфенокси)фенокси) пиримидин-2,4,6-трион; 5-метил-5-(4-(3'-трифторфенокси)фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-хлорфенилметокси) фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-фторфенилметокси) фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-фтор-2'-хлорфенилметокси)фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-хлор-2'-фторфенилметокси)фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-фтор-2'-метилфенилметокси)фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-фтор-2'-трифторметилфенилметокси)фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-фтор-2'-циклопропилфенилметокси)фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(пиридин-2-ил)-фенокси) пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-фтор-пиридин-2-ил) фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-хлорпиридин-2-ил) фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(пиридин-4-ил)фенокси) пиримидин-2,4,6-трион; 5-метил-5-(4-(пиридин-3-ил)фенокси) пиримидин-2,4,6-трион; 5-метил-5-(4-(пиримидин-2-ил)фенокси) пиримидин-2,4,6-трион; 5-метил-5-(4-(пиримидин-4-ил)фенокси) пиримидин-2,4,6-трион; 5-метил-5-(4-(пиразин-3-ил)фенокси) пиримидин-2,4,6-трион; 5-метил-5-(4-(пиразин-4-ил)фенокси) пиримидин-2,4,6-трион; 1,5-диметил-5-(4-(4'-фторфенилметокси) фенокси)пиримидин-2,4,6-трион; 1-этил, 5-метил-5-(4-(4'-фторфенилметокси)фенокси)пиримидин-2,4,6-трион; 1-(2-метоксиэтил)-5-метил-5-(4-(4'-фторфенилметокси)фенокси)пиримидин-2,4,6-трион; 1-(2-диметиламиноэтил)-5-метил-5-(4-(4'фторфенилметокси)фенокси)пиримидин-2,4,6 трион; 1-циклопропилметил-5-метил-5-(4-(4'фторфенилметокси)фенокси)пиримидин-2,4,6 трион; 5-диметиламинометил-5-(4-(4'-фторфенилметокси)фенокси)пиримидин-2,4,6-трион; 12 5-(2-диметиламиноэтил)-5-(4-(4'-фторфенилметокси)фенокси)пиримидин-2,4,6-трион; 5-(2-метоксиэтил)-5-(4-(4'-фторфенилметокси)фенокси)пиримидин-2,4,6-трион; 5-циклопропилметил-5-(4-(4'-фторфенилметокси)фенокси)пиримидин-2,4,6-трион; 5-этил-5-(4-(4'-фторфенилметокси) фенокси)пиримидин-2,4,6-трион; 5-трифторметил-5-(4-(4'-фторфенилметокси)фенокси)пиримидин-2,4,6-трион; 5-изопропил-5-(4-(4'-фторфенилметокси) фенокси)пиримидин-2,4,6-трион; 5-изобутирил-5-(4-(4'-фторфенилметокси) фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-фторфенилметокси) фенилтио)пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-фторфенилметокси) фенилсульфонил)пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-фторфенилметокси) фенилсульфокси)пиримидин-2,4,6-трион; 5-метил-5-(N-4-(4'-фторфенилметокси) фениламино)пиримидин-2,4,6-трион; 5-метил-5-(N-метил-N-4-(4'-фторфенилметокси)фениламино)пиримидин-2,4,6-трион; 5-(4-(4'-фторфенокси)фенокси)пиримидин 2,4,6-трион; 5-(4-(4'-хлорфенокси)фенокси)пиримидин 2,4,6-трион; 5-метил-5-(4-(4'-фторфенил)фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-хлорфенил)фенокси)пиримидин-2,4,6-трион; 5-метил-5-(3-(4'-фторфенилфенокси)пиримидин-2,4,6-трион; 5-метил-5-(3-(4'-хлорфенилфенокси)пиримидин-2,4,6-трион; 5-метил-5-(5-(4'-фторфенокси)-2-пиридилокси)пиримидин-2,4,6-трион; 5-метил-5-(2-(4'-фторфенокси)-5-пиридилокси)пиримидин-2,4,6-трион; 5-метил-5-(3-(4'-фторфенокси)-6-пиразинилокси)пиримидин-2,4,6-трион; 5-метил-5-(2-(4'-фторфенокси)-5-пиримидилокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(циклопропилметокси)фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(циклобутилметокси)фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(циклопентилметокси)фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(3'-тетрагидрофуранилметокси)фенокси)пиримидин-2,4,6-трион; 5-метил-5-(4-(4'-тетрагидропиранилметокси)фенокси)пиримидин-2,4,6-трион и 5-метил-5-(4-(N-метил-3-азетидинилметокси)фенокси)пиримидин-2,4,6-трион; или их фармацевтически приемлемые соли. Настоящее изобретение также относится к фармацевтической композиции для лечения состояния, выбранного из группы, состоящей из артрита (включая остеоартрит и ревматоидный артрит), воспалительного кишечного заболева 13 ния, болезни Крона, эмфиземы, острого респираторного дистресс-синдрома, астмы, хронического обструктивного легочного заболевания,болезни Альцгеймера, токсичности органного трансплантата, кахексии, аллергических реакций, аллергической контактной гиперчувствительности, рака (такого как прорастание опухолью, рост опухоли, метастазирование опухоли,солидный рак, включая рак ободочной кишки,рак молочной железы, рак легкого и рак простаты, и гематопоэтические злокачественности,включая лейкемии и лимфомы), изъязвления тканей, рестеноза, периодонтального заболевания, врожденного буллезного эпидермолиза,остеопороза, разбалтывания искусственных суставных имплантатов, атеросклероза (включая отрыв атеросклеротических бляшек), аневризмы аорты (включая аневризму брюшной аорты и аневризму мозговой аорты), застойной сердечной недостаточности, инфаркта миокарда, удара, церебральной ишемии, травмы головы, повреждения спинного мозга, нейродегенеративных расстройств (острых и хронических), аутоиммунных расстройств, болезни Хантингтона,болезни Паркинсона, мигрени, депрессии, периферической невропатии, боли, церебральной амилоидной ангиопатии, ноотропного или когнитивного усиления, бокового амиотрофического склероза, множественного склероза, глазного ангиогенеза, повреждения роговицы, дегенерации желтого пятна, аномального заживления ран, ожогов, диабета, рубцевания роговицы,склерита, СПИДа, сепсиса, септического шока и других заболеваний, характеризующихся активностью металлопротеиназ, и других заболеваний, характеризующихся активностью репролизина млекопитающих, у млекопитающего,включая человека, содержащей количество соединения формулы I или его фармацевтически приемлемой соли, эффективное для такого лечения, и фармацевтически приемлемый носитель. Настоящее изобретение также относится к фармацевтической композиции для ингибирования (а) матриксных металлопротеиназ или других металлопротеиназ, вовлеченных в деградацию матрикса, или (б) репролизина млекопитающих (такого как аггреканаза или ADAM TS1, 10, 12, 15 и 17, наиболее предпочтительно аггреканаза или ADAM-17) у млекопитающего,включая человека, содержащей эффективное количество соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также относится к способу лечения состояния, выбранного из группы, состоящей из артрита (включая остеоартрит и ревматоидный артрит), воспалительного кишечного заболевания, болезни Крона, эмфиземы, острого респираторного дистресссиндрома, астмы, хронического обструктивного легочного заболевания, болезни Альцгеймера,токсичности органного трансплантата, кахек 004680 14 сии, аллергических реакций, аллергической контактной гиперчувствительности, рака (такого как прорастание опухолью, рост опухоли,метастазирование опухоли, солидный рак,включая рак ободочной кишки, рак молочной железы, рак легкого и рак простаты, и гематопоэтические злокачественности, включая лейкемии и лимфомы), изъязвления тканей, рестеноза, периодонтального заболевания, врожденного буллезного эпидермолиза, остеопороза, разбалтывания искусственных суставных имплантатов, атеросклероза (включая отрыв атеросклеротических бляшек), аневризмы аорты (включая аневризму брюшной аорты и аневризму мозговой аорты), застойной сердечной недостаточности, инфаркта миокарда, удара, церебральной ишемии, травмы головы, повреждения спинного мозга, нейродегенеративных расстройств (острых и хронических), аутоиммунных расстройств, болезни Хантингтона, болезни Паркинсона, мигрени, депрессии, периферической невропатии, боли, церебральной амилоидной ангиопатии, ноотропного или когнитивного усиления, бокового амиотрофического склероза,множественного склероза, глазного ангиогенеза,повреждения роговицы, дегенерации желтого пятна, аномального заживления ран, ожогов,диабета, рубцевания роговицы, склерита,СПИДа, сепсиса, септического шока и других заболеваний, характеризующихся активностью металлопротеиназ, и других заболеваний, характеризующихся активностью репролизина млекопитающих, у млекопитающего, включая человека, при котором указанному млекопитающему вводят количество соединения формулы I или его фармацевтически приемлемой соли,эффективное при лечении такого состояния. Используемый здесь термин "лечение" относится к реверсированию, облегчению, торможению развития или предупреждению расстройства или состояния, к которому такой термин применяется, или одного или более чем одного симптома такого расстройства или состояния. Используемый здесь термин "лечение" относится также к акту лечения, которое определено непосредственно выше. Настоящее изобретение также относится к способу ингибирования (а) матриксных металлопротеиназ или других металлопротеиназ, вовлеченных в деградацию матрикса, или (б) репролизина млекопитающих (такого как аггреканаза или ADAM TS-1, 10, 12, 15 и 17, предпочтительно аггреканаза или ADAM-17) у млекопитающего, включая человека, при котором указанному млекопитающему вводят эффективное количество соединения формулы I или его фармацевтически приемлемой соли. Предмет изобретения также включает в себя меченные изотопами соединения, которые идентичны соединениям формулы I, за исключением того, что один или более чем один из атомов заменены атомом, имеющим атомную 15 массу или массовое число, отличное от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, которые можно вводить в соединения по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 13C, 14 С, 15N, 18O, 17O, 31P,32P, 35S, 18F и 36Cl соответственно. Соединения по настоящему изобретению, их пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов, входят в объем данного изобретения. Некоторые меченные изотопами соединения по настоящему изобретению, например соединения, в которые введены радиоактивные изотопы, такие как 3H и 14 С,пригодны для использования в анализах на тканевое распределение лекарственных средств и/или субстратов. Изотопы, содержащие тритий,т.е. 3H, и углерод-14, т.е. 14 С, благодаря легкости их получения и обнаружения, особенно предпочтительны. Далее замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может давать определенные терапевтические преимущества в результате повышенной метаболической стабильности, например увеличение in vivo периода полувыведения или снижение требований к дозировке, и, следовательно, может быть предпочтительным при некоторых обстоятельствах. Меченные изотопами соединения формулы I по данному изобретению и их пролекарства в общем случае могут быть получены по методикам, раскрытым на схемах и/или в примерах и подготовительных примерах ниже, с заменой немеченого реагента легкодоступным меченым реагентом. Данное изобретение также охватывает фармацевтические композиции, содержащие пролекарства соединений формулы I. Данное изобретение также охватывает способы лечения или предупреждения расстройств, которые можно лечить или предупреждать посредством ингибирования матриксных металлопротеиназ или ингибирования репролизина млекопитающих, включающие введение пролекарств соединений формулы I. Соединения формулы I,имеющие свободные амино, амидо, гидрокси,сульфонамидные или карбоксильные группы,могут быть превращены в пролекарства. Пролекарства включают в себя соединения, в которых аминокислотный остаток или полипептидная цепь из двух или более (например двух, трех или четырех) аминокислотных остатков, ковалентно связаны пептидными связями со свободными амидо, амино, гидрокси или карбоксильными кислотными группами соединений формулы I. Аминокислотные остатки включают 20 встречающихся в природе аминокислот, обычно обозначаемых трехбуквенными символами, и включают в себя также 4-гидроксипролин, гидроксилизин, демозин, изодемозин, 3-метил 004680 16 гистидин, норвалин, бета-аланин, гаммааминомасляную кислоту, цитрулин, гомоцистеин, гомосерин, орнитин и метионинсульфон. Пролекаства также включают соединения, в которых карбонаты, карбаматы, амиды и алкиловые сложные эфиры ковалентно связаны с вышеуказанными заместителями соединений формулы I через боковую цепь карбонильного углерода пролекарства. Для специалистов в данной области техники очевидно, что соединения по изобретению полезны в лечении множества разных заболеваний. Для специалиста в данной области техники также очевидно, что при использовании соединений по изобретению в лечении конкретного заболевания, соединения по настоящему изобретению можно комбинировать с различными существующими терапевтическими агентами,применяемыми для лечения этого заболевания. Для лечения ревматоидного артрита соединения по изобретению можно комбинировать с такими агентами, как ингибиторы TNF-,например анти-TNF моноклинальные антитела(такие как Remicade) и иммуноглобулиновые молекулы TNF рецепторов (такие как Enbrel),метотрексат в низкой дозе, лефунимид, гидроксихлороквин, d-пенициламин, ауранофин или парентеральное или пероральное золото. Соединения по настоящему изобретению также можно использовать в комбинации с существующими терапевтическими агентами для лечения остеоартрита. Подходящие агенты для совместного использования включают стандартные нестероидные противовоспалительные агенты (NSAID), такие как пироксикам, диклофенак, пропионовые кислоты, такие как напроксен, флубипрофен, фенопрофен, кетопрофен и ибупрофен, фенаматы, такие как мефенаминовая кислота, индометацин, сулиндак, апазон,пиразолоны, такие как фенилбутазон, салицилаты, такие как аспирин, СОХ-2 ингибиторы, такие как целекоксиб, валдекоксиб и рофекоксиб,анальгетики LTD-4, LTB-4 и 5-LO ингибиторы,ингибиторы киназы р 38 и внутрисуставные терапевтические средства, такие как кортикостероиды и гиалуроновые кислоты, такие как гиалган и синвиск. Соединения по настоящему изобретению также можно применять в комбинации с противораковыми агентами, такими как эндостатин и ангиостатин или цитотоксические лекарственные средства, такие как адриамицин, дауномицин, цис-платина, этопосид, таксол, таксотер и алкалоиды, такие как винкристин, и антиметаболиты, такие как метотрексат. Соединения по настоящему изобретению также можно применять в комбинации с сердечно-сосудистыми агентами, такими как блокираторы кальциевых каналов, снижающие уровень липидов агенты, такие как статины, фибраты, бета-блокаторы, ингибиторы АСЕ (ангиотензин-превращающего фермента), антагонисты 17 рецепторов ангиотензина-2 и ингибиторы агрегации тромбоцитов. Соединения по настоящему изобретению также можно применять в комбинации с агентами ЦНС (центральной нервной системы), такими как антидепрессанты (например сертралин), лекарственные средства против болезни Паркинсона (такие как депренил, L-допа, Requip, Mirapex, ингибиторы МАОВ (моноаминоксидазы В), такие как селегилин и разагилин,ингибиторы соmР, такие как Tasmar, ингибиторы А-2, ингибиторы обратного захвата дофамина, антагонисты NMDA (N-метил-D-аспартата),агонисты никотина, ингибиторы NK-1 (нейрокинина-1), агонисты дофамина и ингибиторы нейрональной синтазы оксида азота) и лекарственные средства против болезни Альцгеймера,такие как донепезил, такрин, ингибиторы СОХ 2 (циклоокигеназы-2), пропентофилин или метрифонат. Соединения по настоящему изобретению также можно применять в комбинации с остеопорозными агентами, такими как ролоксифен,дролоксифен, лазоксифен или фосомакс и иммуносупрессорными агентами, такими как FK506 и рапамицин. Подробное описание изобретения Следующие реакционные схемы иллюстрируют получение соединений по настоящему изобретению. Если не указано иное, X, Y, Ar1,Z, R1, R2 и R3 на реакционных схемах и в последующем обсуждении являются такими, как определено выше. Схема 1 Схема 1 относится к получению соединений формулы I двухстадийным синтезом из соединений формулы V. Согласно схеме 1 соединение формулы I получают из соединения формулы IV, где L1 и L2 являются уходящими группами, такими как метокси, этокси, бензилокси или хлоро, предпочтительно этокси, путем взаимодействия с производным мочевины формулы III в присутствии сильного основания в полярном растворителе. Подходящие основания включают в себя метилат натрия, этилат натрия и метилат магния, предпочтительно этилат натрия. Подходящие растворители включают в себя спирты(такие как этанол) или тетрагидрофуран, предпочтительно абсолютный этанол. Вышеуказанное взаимодействие проводят при температуре от приблизительно 20 до приблизительно 90 С,предпочтительно от приблизительно 50 до приблизительно 65 С в течение промежутка времени между приблизительно 15 мин и приблизительно 16 ч. Соединения формулы IV получают из соединения формулы V, где L3 является уходящей группой,такой как галогено,паратолилсульфонилокси (OTs) или метилсульфонилокси (OMs), предпочтительно галогено, наиболее предпочтительно хлоро или бромо, путем взаимодействия с соединением формулы 20 включают в себя диметилформамид (DMF),спирты (такие как этанол) или тетрагидрофуран,предпочтительно этанол. Вышеуказанное взаимодействие проводят при температуре от приблизительно 20 до приблизительно 90 С, предпочтительно от приблизительно 50 до приблизительно 65C, в течение промежутка времени между приблизительно 15 мин и приблизительно 16 ч. Соединения формулы V могут быть получены способами, общеизвестными в данной области техники, например способами, описанными в WO 98/58925 или рассмотренными в Theand L.A. Mitscher, Volume 1, pages 167-277, и указанных в этой публикации ссылках. Содержание каждой из вышеупомянутых публикаций и заявок во всей своей полноте включено в данное описание изобретения ссылкой. Соединения формулы III имеются в продаже или могут быть получены способами, общеизвестными для специалистов в данной области техники. Соединения формулы HX-Ar1-Y-Z имеются в продаже или могут быть получены способами, общеизвестными для специалистов в данной области техники. Схема 2 относится к получению соединений формулы I трехстадийным синтезом из соединений формулы VI или VII. Согласно схеме 2 соединение формулы I получают из соединения формулы IX путем взаимодействия с подходящим основанием и подходящим алкилирующим агентом формулы R1L4 в присутствии растворителя. Подходящие основания включают в себя гидрид натрия, карбонат калия, карбонат натрия, триэтиламин, пиридин или триэтаноламин; наиболее предпочтительно гидрид натрия. Подходящие алкилирующие агенты включают агенты, в которых L4 представляет собой галогено, паратолилсульфонил (OTs) или метилсульфонилокси (OMs), предпочтительно галогено, наиболее предпочтительно хлоро или бромо; либо алкилирующие агенты включают такие соединения, как соли Эшенмозера, эпоксиды или подходящим образом замещенные электрофильные азиридины. Подходящие растворители зависят от используемого основания, но могут быть выбраны из N,N-диметилформамида, тетрагидрофурана, ацетонитрила и воды. Вышеуказанное взаимодействие проводят при температуре от приблизительно 0 до приблизительно 30 С, предпочтительно от приблизительно 20 до приблизительно 25 С в течение промежутка времени от приблизительно 15 мин до приблизительно 16 ч. Соединение формулы IX можно получить из соединения формулы VIII путем взаимодействия с мочевиной формулы в присутствии сильного основания в полярном растворителе. Подходящие основания включают метилат натрия, этилат натрия и метилат магния; предпочтительно этилат натрия. Подходящие растворители включают спирты (такие как этанол) или тетрагидрофуран, предпочтительно абсолютный этанол. Вышеуказанное взаимодействие проводят при температуре от приблизительно 20 до приблизительно 90 С, предпочтительно от приблизительно 50 до приблизительно 65 С, в течение промежутка времени от приблизительно 15 мин до приблизительно 16 ч. Соединения формулы VIII можно получить из соединения формулы VI, где L3 является уходящей группой, такой как галогено, паратолилсульфонилокси (OTs) или метилсульфонилокси (OMs), предпочтительно галогено, наиболее предпочтительно хлоро, путем взаимодействия с соединением формулы HX-Ar1-Y-Z в присутствии основания в полярном растворителе. Подходящие основания включают метилат натрия, этилат натрия, карбонат калия и гидрид натрия; предпочтительно этилат натрия. Подходящие растворители включают диметилформамид (DMF), спирты (такие как этанол) или тетрагидрофуран, предпочтительно этанол. Вышеуказанное взаимодействие проводят при температуре от приблизительно 20 до приблизительно 90 С, предпочтительно от приблизительно 50 С до приблизительно 70 С, в течение промежутка времени от приблизительно 15 мин до приблизительно 16 ч, предпочтительно приблизительно 3 ч. Реакции этого типа также иллюстрируются способом, описанным в J.В. Niederl and R.Т.Roth, J. Amer. Chem. Soc., 62, 1154 (1940). Альтернативно, соединение формулы VIII можно также получить из соединения формулыJ. Chem., 45, 2061 (1992). Соединения формулы VI и VII имеются в продаже или с легкостью могут быть получены из легкодоступных исходных веществ способами, хорошо известными специалистам в данной области техники. Например, соединения формулы VII можно получить способом, описанным вD.W. Peace et al., Synthesis, 658 (1971). Соединения формулы III имеются в продаже или могут быть получены способами, общеизвестными для специалистов в данной области техники. Схема 3 относится к получению соединений формулы I, в частности тех, где Х представляет собой кислород или -OCH2-. Согласно схеме 3 соединение формулы I можно получить алкилированием соединения формулы XI под 004680 22 ходящим фенолом формулы HOAr1-Y-Z согласно способу, описанному в O.Mitsonubu (Synthesis, 1 (1981, или алкилированием подходящим алкилирующим агентом формулы L3CH2Ar1-Y-Z,где L3 является уходящей группой, такой как галогено, паратолилсульфонилокси (OTs) или метилсульфонилокси (OMs), предпочтительно галогено, наиболее предпочтительно хлоро или бромо, в подходящем растворителе, таком какN,N-диметилформамид, тетрагидрофуран, ацетонитрил, в присутствии подходящего основания, такого как гидрид натрия, карбонат калия,триэтиламин, пиридин или триэтаноламин. Вышеуказанное взаимодействие проводят при температуре от приблизительно 0 до приблизительно 50 С, предпочтительно приблизительно 20 С, в течение промежутка времени от приблизительно 15 мин до приблизительно 16 ч. Соединения формулы XI можно получать из соединений формулы Х способом, описанным в J.A. Vida et.al., J. Med. Chem., 17, 732(1974). Соединения формулы X можно получить из соединения формулы XII путем взаимодействия с подходящим основанием в присутствии подходящего алкилирующего агента Р 1L4 и растворителя так, как описание в Biehl et al., J. Het.Chem., 23, 9 (1986). Подходящие основания включают гидрид натрия, карбонат калия, триэтиламин, пиридин, триэтаноламин; наиболее предпочтительно триэтаноламин. Подходящие алкилирующие агенты включают агенты, в которых L4 представляет собой галогено, паратолилсульфонилокси (OTs) или метилсульфонилокси (OMs), предпочтительно галогено, наиболее предпочтительно хлоро или бромо; либо алкилирующие агенты, такие как соль Эшенмозера; эпоксиды или подходящим образом замещенные электрофильные азиридины. Подходящие растворители зависят от используемого основания, но могут быть выбраны из N,Nдиметилформамида, тетрагидрофурана, ацетонитрила и воды. Вышеуказанное взаимодействие проводят при температуре от приблизительно 0 до приблизительно 30 С, предпочтительно от приблизительно 20 до приблизительно 25 С,в течение промежутка времени от приблизительно 15 мин до приблизительно 16 ч. Соединения формулы XII имеются в продаже или могут быть легко получены специалистами в данной области техники способами,рассмотренными в The Organic Chemistry ofGrug Synthesis, D. Lednicer and L. A. Mitscher,Volume 1, pages 167-222, и в ссылках, приведенных там. Схема 4 относится к получению соединений формулы I, где Х представляет собой серу или -SCH2-, или их окисленные производныеSO2, SO, -SO2CH2-, -SOCH2-. Согласно схеме 4, такое соединение формулы I можно получить алкилированием пиримидин-2,4,6-трионового кольца соединения формулы XIV (где R2 и R3 23 являются водородом) подходящим алкилирующим агентом L3R2 или L3R3, где L3 является уходящей группой, такой как галогено, паратолилсульфонилокси (OTs) или метилсульфонилокси (OMs), предпочтительно галогено, наиболее предпочтительно хлоро или бромо, в подходящем растворителе, таком как N,Nдиметилформамид, тетрагидрофуран, ацетонитрил, в присутствии подходящего основания,такого как гидрид натрия, карбонат калия, карбонат натрия, триэтиламин, пиридин или триэтаноламин. Вышеуказанную реакцию проводят при температуре от приблизительно 20 до приблизительно 70 С, предпочтительно приблизительно 20 С, в течение промежутка времени между приблизительно 15 мин и приблизительно 16 ч. Соединения формулы XIV могут быть получены алкилированием соединения формулы Х подходящим дисульфидом формулы (SAr1-Y-Z)2 или (SCH2Ar1-Y-Z)2 в подходящем растворителе, таком как N,N-диметилформамид, тетрагидрофуран, ацетонитрил, в присутствии подходящего основания, такого как гидрид натрия, карбонат калия, триэтиламин, пиридин или триэтианоламин. Вышеуказанную реакцию проводят при температуре от приблизительно 20 до приблизительно 70 С, предпочтительно приблизительно 20 С, в течение промежутка времени между приблизительно 15 мин и приблизительно 16 ч. Дисульфиды (SAr1-Y-Z)2 или (SCH2Ar1-Y-Z)2 могут быть получены из соответствующих тиолов HSAr1-Y-Z или HSCH2Ar1-Y-Z окислительными методами, общеизвестными для специалистов в данной области техники. Соединения формулы Х имеются в продаже или могут быть получены способами, общеизвестными для специалистов в данной области техники. Соединения формулы I, которые являются основными по природе, способны образовывать множество разных солей с различными неорганическими и органическими кислотами. Хотя для введения животным такие соли должны быть фармацевтически приемлемыми, часто на практике желательно сначала выделить соединение формулы I из реакционной смеси в виде фармацевтически неприемлемой соли, затем просто превратить последнюю обратно в свободное основное соединение путем обработки щелочным реагентом, а затем превратить это свободное основание в фармацевтически приемлемую соль присоединения кислот. Образованные присоединением кислот соли основных соединений по изобретению легко могут быть получены путем обработки основного соединения практически эквивалентным количеством выбранной минеральной или органической кислоты в среде водных растворителей или в подходящем органическом растворителе, таком как метанол или этанол. После осторожного выпа 004680 24 ривания растворителя получают желаемую твердую соль. Кислоты, которые используют для получения фармацевтически приемлемой, образованной присоединением кислоты соли основных соединений по данному изобретению, представляют собой кислоты, которые образуют нетоксичные соли присоединения кислот, т.е. соли,содержащие фармакологически приемлемые анионы, такие как гидрохлоридные, гидробромидные, гидройодидные, нитратные, сульфатные или бисульфатные, фосфатные или кислые фосфатные, ацетатные, лактатные, цитратные или кислые цитратные, тартратные или битартратные, сукцинатные, малеатные, фумаратные,глюконатные, сахаратные, бензоатные, метансульфонатные и памоатные [т.е. 1,1'-метиленбис-(2-гидрокси-3-нафтоат)ные] соли. Те соединения формулы I, которые также кислотные по природе, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают в себя соли щелочных или щелочноземельных металлов и, в частности, натриевые и калиевые соли. Все эти соли получают традиционными способами. Химическими основаниями,которые используют в качестве реагентов для получения фармацевтически приемлемых, образованных присоединением оснований солей по данному изобретению, являются основания,которые образуют нетоксичные основные соли с описанными здесь соединениями формулы I. Эти нетоксичные основные соли включают соли, образованные такими фармакологически приемлемыми катионами, как натрий, калий,кальций и магний и так далее. Эти соли легко можно получить путем обработки соответствующих кислотных соединений водным раствором, содержащим желаемые фармакологически приемлемые катионы, и последующего выпаривания полученного раствора до сухого состояния, предпочтительно при пониженном давлении. Альтернативно, их также можно получить путем смешивания спиртовых растворов кислотных соединений и желаемого алкоголята щелочного металла, и последующего выпаривания полученного раствора до сухого состояния таким же способом, как описано ранее. В любом случае, предпочтительно используют стехиометрические количества реагентов для того,чтобы гарантировать завершенность реакции и максимальные выходы продуктов. Биологические анализы Способность соединений формулы I или их фармацевтически приемлемых солей (ниже также упоминаемых как соединения по настоящему изобретению) ингибировать металлопротеиназы или репролизин млекопитающих и, соответственно, демонстрировать эффективность при лечении заболеваний, характеризующихся активностью металлопротеиназы или репроли 25 зина млекопитающих (такой как продуцирование фактора некроза опухоли), показана результатами следующих in vitro аналитических испытаний. Анализы на ММР Селективные ингибиторы коллагеназы-3(матриксной металлопротеиназы-13), используемые здесь, относятся к агентам, которые обладают по меньшей мере 100-кратной селективностью в отношении ингибирования ферментативной активности коллагеназы-3 по сравнению с ферментативной активностью коллагеназы-1 и активностью менее 100 нМ, как определено по результатам IC50 MMP-13/MMP-1 флуоресцентных анализов, описанных ниже. Селективные ингибиторы коллагеназы-3 можно идентифицировать скринингом ингибиторов по настоящему изобретению в ММР-13/ММР-1 флуоресцентных анализах, описанных ниже, и выбором агентов с соотношением IC50 ингибирования ММР-13/ММР-1, равным 100 или более, и активностью менее чем 100 нМ. Неселективные ингибиторы коллагеназ,используемые здесь, относятся к агентам, которые обладают менее чем 100-кратной селективностью в отношении ингибирования ферментативной активности коллагеназы-3 по сравнению с ингибированием ферментативной активности коллагеназы-1 или активностью более чем 100 нМ, определяемой по результатам IC50 ММР 13/ММР-1 флуоресцентных анализов, описанных ниже. Способность ингибиторов коллагеназ ингибировать коллагеназную активность общеизвестна в данной области техники. Следующие анализы можно использовать для идентификации ингибиторов матриксных металлопротеиназ. Ингибирование человеческой коллагеназы(ММР-1) Человеческую рекомбинантную коллагеназу активируют трипсином. Количество трипсина оптимизируют для каждой партии коллагеназы 1, но в обычной реакции используют следующее соотношение: 5 мкг трипсина на 100 мкг коллагеназы. Трипсин и коллагеназу инкубируют при комнатной температуре в течение 10 мин, затем добавляют пятикратный избыток (50 мг/10 мг трипсина) соевого ингибитора трипсина. Исходные растворы (10 мМ) ингибиторов готовят в диметилсульфоксиде, а затем разводят, используя следующую схему: 10 мМ 120 мкМ 12 мкМ 1,2 мкМ 0,12 мкМ Затем 25 мкл каждой концентрации в трех повторах добавляют в соответствующие лунки 96-луночного планшета для микрофлуоресцентного анализа. После добавления фермента и субстрата конечную концентрацию ингибитора определяет разведение 1:4. Положительные контроли (фермент, без ингибитора) ставят в лунках D7-D12, а отрицательные контроли (без 26 фермента, без ингибитора) ставят в лунках D1D6. Коллагеназу-1 разводят до 240 нг/мл, а затем добавляют по 25 мкл в соответствующие лунки планшета для микрофлуоресцентного анализа. Конечная концентрация коллагеназы в анализе составляет 60 нг/мл. Субстрат (DNP-Pro-Cha-Dly-Cys(Me)-HisAla-Lys(NMA)-NH2) готовят в виде 5 мМ исходного раствора в диметилсульфоксиде, а затем разводят до 20 мкМ в аналитическом буфере. Анализ начинают добавлением 50 мкл субстрата на лунку планшета для микрофлуоресцентного анализа с получением конечной концентрации 10 мкМ. Считывание флуоресценции (360 нМ возбуждение, 460 нм испускание) проводят в момент времени ноль, а затем через 20-минутные интервалы. Анализ проводят при комнатной температуре с обычным временем анализа 3 ч. Затем строят график зависимости флуоресценции от времени как для контрольных, так и для содержащих коллагеназу образцов (данные трех определений усредняют). Для определения значений IC50 выбирают точку времени,которая обеспечивает хороший сигнал (по меньшей мере пятикратный по сравнению с контрольной пробой) и которая находится на линейной части кривой (обычно около 120 мин). Время ноль используют в качестве контроля для каждого соединения в каждой концентрации и эти значения вычитают из 120-минутных данных. Данные наносят на график зависимости концентрации ингибитора от % контроля (флуоресценция ингибитора деленная на флуоресценцию одной коллагеназы х 100). Значения IC50 определяют по концентрации ингибитора, которая дает сигнал, составляющий 50% от контроля. Если установлено, что значения IC50 составляют менее 0,03 мкМ, то ингибиторы анализируют в концентрациях 0,3 мкМ, 0,03 мкМ и 0,003 мкМ. Ингибирование желатиназы (ММР-2) Человеческую рекомбинантную желатиназу с молекулярной массой 72 кДа (ММР-2, желатиназа А) активируют в течение 16-18 ч с 1 мМ парааминофенилртутьацетатом (из свежеприготовленного 100 мМ исходного раствора в 0,2 н. NaOH) при 4 С, осторожно качая. 10 мМ диметилсульфоксидные исходные растворы ингибиторов серийно разбавляют в аналитическом буфере (50 мМ Трис, рН 7,5, 200 мМ NaCl, 5 мМ CaCl2, 20 мкМ ZnCl2 и 0,02% Дополнительные разведения делают при необходимости, следуя той же самой схеме. В каждом анализе представлены минимум четыре концентрации ингибитора для каждого соединения. По 25 мкл каждой концентрации затем 27 добавляют в три лунки черного 96-луночного сU-образным дном планшета для микрофлуоресцентного анализа. Так как конечный объем пробы составляет 100 мкл, конечные концентрации ингибитора являются результатом дополнительного разведения 1:4 (т.е. 30 мкМ 3 мкМ 0,3 мкМ 0,03 мкМ и так далее). Холостую пробу(без фермента, без ингибитора) и положительный ферментный контроль (с ферментом, без ингибитора) также готовят в трех повторах. Активированный фермент разбавляют до 100 нг/мл в аналитическом буфере, добавляют по 25 мкл на лунку в соответствующие лунки микропланшета. Конечная концентрация фермента в пробе составляет 25 нг/мл (0,34 нМ). 5 мМ диметилсульфоксидный исходный раствор субстрата (Mca-Pro-Leu-Gly-Leu-DpaAla-Arg-NH2) разводят в аналитическом буфере до 20 мкМ. Анализ начинают добавлением 50 мкл разведенного субстрата с получением конечной концентрации субстрата в анализе 10 мкМ. Сразу в момент времени ноль производят считывание флуоресценции (320 возбуждение,390 испускание), и последующие считывания производят каждые 15 мин при комнатной температуре при помощи PerSeptive BiosystemsCytoFluor Multi-Well Plate Reader с приростом в 90 единиц. Среднее значение флуоресценции фермента и холостой пробы наносят на график зависимости от времени. Начальную точку времени на линейной части этой кривой выбирают для определения IC50. Нулевую точку времени для каждого соединения для каждого разведения вычитают из последней точки времени, и данные затем выражают в виде процента от ферментного контроля (флуоресценция ингибитора, деленная на флуоресценцию положительного ферментного контроля х 100). Данные наносят на график зависимости концентрации ингибитора от процента от ферментного контроля. ЗначенияIC50 определяют по концентрации ингибитора,которая дает сигнал, составляющий 50% от положительного ферментного контроля. Ингибирование стромелизиновой активности(ММР-3) Человеческий рекомбинантный стромелизин (ММР-3, стромелизин-1) активируют в течение 20-22 ч 2 мМ парааминофенилртутьацетатом (из свежеприготовленного 100 мМ исходного раствора в 0,2 н. NaOH) при 37 С. 10 мМ диметилсульфоксидные исходные растворы ингибиторов серийно разводят в аналитическом буфере (50 мМ Трис, рН 7,5, 150 мМ NaCl, 10 мМ CaCl2 и 0,05% BRIJ-35 об./об.),используя следующую схему: 10 мМ 120 мкМ 12 мкМ 1,2 мкМ 0,12 мкМ Дополнительные разведения делают, при необходимости, следуя той же самой схеме. В каждом анализе представлены минимум четыре концентрации ингибитора для каждого соединения. По 25 мкл каждой концентрации затем 28 добавляют в три лунки черного 96-луночного сU-образным дном планшета для микрофлуоресцентного анализа. Так как конечный объем пробы составляет 100 мкл, конечные концентрации ингибитора являются результатом дополнительного разведения 1:4 (т.е. 30 мкМ 3 мкМ 0,3 мкМ 0,03 мкМ и так далее). Холостая проба(без фермента, без ингибитора) и положительный ферментный контроль (с ферментом, без ингибитора) также готовят в трех повторах. Активированный фермент разводят до 200 нг/мл в аналитическом буфере, добавляют по 25 мкл на ячейку в соответствующие ячейки микропланшета. Конечная концентрация фермента в пробе составляет 50 нг/мл (0,875 нМ). 10 мМ диметилсульфоксидный исходный раствор субстрата (Мса-Аrg-Pro-Lys-Pro-ValGlu-Nva-Trp-Arg-Lys(Dnp)-NH2) разводят в аналитическом буфере до 6 мкМ. Анализ начинают добавлением 50 мкл разведенного субстрата с получением конечной концентрации субстрата в пробе 3 мкМ. Сразу в момент времени ноль производят считывание флуоресценции (320 возбуждение, 390 испускание), и последующие считывания производят каждые пятнадцать минут при комнатной температуре при помощиReader с приростом в 90 единиц. Среднее значение флуоресценции фермента и холостой пробы наносят на график зависимости от времени. Начальную точку времени на линейной части этой кривой выбирают для определения IC50. Нулевую точку времени для каждого соединения в каждом разведении вычитают из последней точки времени, и данные затем выражают как процент от ферментного контроля (флуоресценция ингибитора, деленная на флуоресценцию положительного ферментного контроля х 100). Данные наносят на график зависимости концентрации ингибитора от процента от ферментного контроля. Значения IC50 определяют по концентрации ингибитора, которая дает сигнал, составляющий 50% от положительного ферментного контроля. Ингибирование человеческой желатиназы с молекулярной массой 92 кДа (ММР-9) Ингибирование 92 кДа желатиназной(10 мкМ), в условиях, подобных условиям, описанным выше для ингибирования человеческой коллагеназы (ММР-1). Человеческую рекомбинантную желатиназу с молекулярной массой 92 кДа (ММР-9, желатиназа В) активируют в течение 2 ч 1 мМ парааминофенилмеркуриацетатом (из свежеприготовленного 100 мМ исходного раствора в 0,2 н.NaOH) при 37 С. 10 мМ диметилсульфоксидные исходные растворы ингибиторов серийно разводят в аналитическом буфере (50 мМ Трис, рН 7,5, 200 Дополнительные разведения делают, при необходимости, следуя той же самой схеме. В каждом анализе представлены минимум четыре концентрации ингибитора для каждого соединения. По 25 мкл каждой концентрации затем добавляют в три лунки черного 96-луночного сU-образным дном планшета для микрофлуоресцентного анализа. Так как конечный объем в анализе составляет 100 мкл, конечная концентрация ингибитора является результатом дополнительного разведения 1:4 (т.е. 30 мкМ 3 мкМ 0,3 мкМ 0,03 мкМ и так далее). Холостую пробу (без фермента, без ингибитора) и положительный ферментный контроль (с ферментом, без ингибитора) также готовят в трех повторах. Активированный фермент разводят до 100 нг/мл в аналитическом буфере, добавляют по 25 мкл на лунку в соответствующие лунки микропланшета. Конечная концентрация фермента в пробе составляет 25 нг/мл (0,27 нМ). 5 мМ диметилсульфоксидный исходный раствор субстрата (Mca-Pro-Leu-Gly-Leu-DpaAla-Arg-NH2) разводят в аналитическом буфере до 20 мкМ. Анализ начинают добавлением 50 мкл разведенного субстрата с получением конечной концентрации субстрата в пробе 10 мкМ. Сразу в момент времени ноль производят считывание флуоресценции (320 возбуждение,390 испускание), и последующие считывания производят каждые 15 мин при комнатной температуре при помощи PerSeptive BiosystemsCytoFluor Multi-Well Plate Reader с приростом в 90 единиц. Среднее значение флуоресценции фермента и холостой пробы наносят на график зависимости от времени. Начальную точку времени на линейной части этой кривой выбирают для определения IC50. Нулевую точку времени для каждого соединения в каждом разведении вычитают из последней точки времени и данные затем выражают в виде процента от ферментного контроля (флуоресценция ингибитора, деленная на флуоресценцию положительного ферментного контроля х 100). Данные наносят на график зависимости концентрации ингибитора от процента ферментного контроля. Значения IC50 определяют по концентрации ингибитора, которая дает сигнал, составляющий 50% от положительного ферментного контроля. Ингибирование ММР-13 Человеческую рекомбинантную ММР-13 активируют 2 мМ АРМА (парааминофенилмеркуриацетатом) в течение 1,5 ч при 37 С и разводят до 400 мг/мл в аналитическом буфере (50 мМ Трис, рН 7,5, 200 мМ хлорида натрия, 5 мМ хлорида кальция, 20 мкМ хлорида цинка, 0,02%BRIJ). По 25 мкл разведенного фермента добавляют на лунку 96-луночного планшета для мик 004680 30 рофлуоресцентного анализа. Затем фермент разбавляют в соотношении 1:4 путем добавления ингибитора и субстрата с получением конечной концентрации в пробе 100 мг/мл. 10 мМ исходные растворы ингибиторов готовят в диметилсульфоксиде, а затем разводят в аналитическом буфере аналогично схеме разведения ингибитора для ингибирования человеческой коллагеназы (ММР-1). По 25 мкл каждой концентрации добавляют в трех повторах в планшет для микрофлуоресцентного анализа. Конечные концентрации в пробе составляют 30 мкМ, 3 мкМ, 0,3 мкМ и 0,03 мкМ. Субстрат (Dnp-Pro-Cha-Gly-Cys(Me)-HisAla-Lys(NMA)-NH2) готовят так же, как для ингибирования человеческой коллагеназы (ММР 1), и по 50 мкл добавляют в каждую лунку с получением конечной концентрации в пробе 10 мкМ. Считывание флуоресценции (360 нм возбуждение; 450 испускание) производят в момент времени 0 и каждые 5 мин в течение 1 ч. Положительные контроли состоят из фермента и субстрата без ингибитора, а холостые пробы состоят только из субстрата. Значения IС 50 определяют так же, как для ингибирования человеческой коллагеназы(ММР-1). Если установлено, что значения IC50 составляют менее 0,03 мкМ, то ингибиторы анализируют в концентрациях 0,3, 0,03, 0,003 и 0,0003 мкМ. Анализ ММР-13 на коллагеновой пленке Крысиный коллаген типа I метят изотопами при помощи 14 С уксусного ангидрида (Т.Е.Cawston and A.J. Barrett, Anal. Biochem., 99, 340345 (1979 и используют для приготовления 96 луночных планшетов, содержащих меченные изотопами коллагеновые пленки (Barbara Johnson-Wint, Anal. Biochem., 104, 175-181 (1980. При добавлении раствора, содержащего коллагеназу, в лунку фермент расщепляет нерастворимый коллаген, который раскручивается и,таким образом, солюбилизируется. Коллагеназная активность прямо пропорциональна количеству растворимого коллагена, определяемого по доле радиоактивности, высвобожденной в супернатант, измеренной в стандартном сцинтилляционном счетчике. Ингибиторы коллагеназы,следовательно, представляют собой соединения,которые уменьшают высвобожденные радиоактивные импульсы по сравнению с контролями без ингибитора. Одно конкретное воплощение этого анализа детально описано ниже. Для определения селективности соединений в отношении ММР-13 по сравнению с ММР-1 с использованием в качестве субстрата коллагена используют следующую методику. Рекомбинантную человеческую проММР-13 или проММР-1 активируют по методикам, указанным выше. Активированную ММР-13 или ММР-1 разводят до 0,6 мкг/мл буфером (50 мМZnCl2, 0,05% BRIJ-35, 0,02% азид натрия). Готовят исходные растворы тестируемого соединения (10 мМ) в диметилсульфоксиде. Разведения тестируемых соединений в Трис буфере, выше, готовят до 0,2, 2,0, 20, 200, 2000 и 20000 нМ. 100 мкл соответствующего разведения лекарственного средства и 100 мкл разведенного фермента вносят пипеткой в лунки 96 луночного планшета, содержащего коллагеновые пленки, меченные 14 С-коллагеном. Конечная концентрация фермента составляет 0,3 мкг/мл, а конечная концентрация лекарственного средства составляет 0,1, 1,0, 10, 100, 1000 нМ. Каждую концентрацию лекарственного средства и контроль анализируют трижды. Тройные контроли также выполняют для условий, когда фермент отсутствует, и для фермента в отсутствии какого-либо соединения. Планшеты инкубируют при 37 С в течение промежутка времени, достаточного для того,чтобы растворилось приблизительно 30-50% доступного коллагена - определяют считыванием дополнительных контрольных лунок в различные моменты времени. В большинстве случаев требуется около 9 ч инкубации. Когда анализ достаточно развился, супернатант из каждой клетки удаляют и подсчитывают импульсы в сцинтилляционном счетчике. Фоновые импульсы (определяемые по импульсам в лунках без фермента) вычитают из каждого образца и % высвобождения рассчитывают относительно лунок только с ферментом и без ингибитора. По три значения для каждой точки усредняют и данные наносят на график зависимости процента высвобождения от концентрации лекарственного средства. Значения IC50 определяют по точке, в которой получено 50%-ное ингибирование высвобождения меченного изотопами коллагена. Для определения идентичности активных коллагеназ в хрящевой кондиционированной среде проводили анализы с использованием коллагена в качестве субстрата, хрящевой кондиционированной среды, содержащей коллагеназную активность, и ингибиторов различной селективности. Хрящевую кондиционированную среду собирали в течение промежутка времени, за который происходило расщепление коллагена, и, таким образом, она является репрезентативной с точки зрения коллагеназ, ответственных за расщепление коллагена. Анализы проводили, как описано выше, за исключением того, что вместо рекомбинантной ММР-13 или рекомбинантной ММР-1 в качестве источника ферментов использовали хрящевую кондиционированную среду.IL-1 индуцированное расщепление хрящевого коллагена из бычьего носового хряща В этом анализе используют экспланты бычьих носовых хрящей, которые обычно ис 004680 32 пользуют для тестирования на эффективность ингибирования различными соединениями либоIL-1 (интерлейкин-1) индуцированного расщепления протеогликана, либо IL-1 индуцированного расщепления коллагена. Бычий носовой хрящ представляет собой ткань, которая очень похожа на суставной хрящ, т.е. хондроциты, окруженные матриксом, который представляет собой главным образом коллаген типа II и аггрекан. Эту ткань используют потому, что она (1) очень похожа на суставной хрящ, (2) легкодоступна, (3) относительно однородна и (4) деградирует с предсказуемой кинетикой после стимуляции IL-1. Использовали два варианта анализа соединений. Оба варианта дали схожие результаты. Эти два варианта описаны ниже. Вариант 1. Три кусочка бычьего носового хряща(приблизительно 2 мм диаметром 1,5 мм длиной) помещают в каждую лунку 24-луночного клуьтурального планшета. По 1 мл не содержащей сыворотку среды затем добавляют в каждую лунку. Соединения готовят в виде 10 мМ исходных растворов в ДМСО (диметилсульфоксид), а затем соответствующим образом разводят в не содержащей сыворотку среде до конечной концентрации, например 50, 500 и 5000 нМ. Каждую концентрацию анализируют трижды. Человеческий рекомбинантный IL-1 (5 нг/мл) (IL-1) добавляют в лунки для тройного контроля и в каждую лунку, содержащую лекарственное средство. Также организуют лунки для тройного контроля, в которые не добавляют ни лекарственное средство, ни IL-1. Среду удаляют, и свежую среду, содержащую IL-1 и соответствующие концентрации лекарственного средства, добавляют на день 6, 12, 18 и 24 или каждые 3-4 дня, если необходимо. Среду, удаляемую в каждый момент времени, хранят при-20 С для последующих анализов. Когда хрящ в лунках с одним IL-1 практически полностью резорбируется (около 21 суток), эксперимент заканчивают. Среду удаляют и хранят. Аликвоты (100 мкл) из каждой лунки в каждый момент времени объединяют, переваривают папаином, а затем анализируют на содержание гидроксипролина. Фоновый гидроксипролин (среднее значение по лункам без IL-1 и без лекарственного средства) вычитают из данных в каждой точке и рассчитывают среднее каждых трех значений. Данные затем выражают в виде процента от среднего значения для одного IL-1 и строят график. IC50 определяют из этого графика. Вариант 2. План эксперимента такой же, как описано выше в варианте 1, до дня 12. На день 12 кондиционированную среду из каждой лунки удаляют и замораживают. Затем 1 мл фосфатного буферного раствора (PBS), содержащего 0,5 мкг/мл трипсина, добавляют в каждую лунку, и инку 33 бирование продолжают в течение еще 48 ч при 37 С. После 48 ч инкубации в трипсине PBS раствор удаляют. АликвотыPBS/трипсинового раствора и две предыдущие по времени точки (день 6 и день 12) объединяют, гидролизуют и определяют содержание гидроксипролина. Фоновый гидроксипролин (среднее значение для лунок без IL-1 и без лекарственного средства) вычитают из данных в каждой точке, и для каждых трех значений рассчитывают среднее. Данные затем выражают в виде процента от среднего значения для одного IL-1 и строят график. IC50 определяют из этого графика. В этом варианте течение времени эксперимента значительно сокращается. Добавление трипсина в течение 48 ч после 12 дней IL-1 стимуляции вероятно высвобождает любой коллаген типа II, который был поврежден коллагеназной активностью, но все еще не высвободился из хрящевого матрикса. При отсутствии IL-1 стимуляции обработка трипсином создает только низкие фоновые уровни расщепления коллагена в хрящевых эксплантах. Ингибирование продуцирования TNF Способность соединений или их фармацевтически приемлемых солей ингибировать продуцирование TNF и, соответственно, демонстрировать свою эффективность при лечении заболеваний, в которые вовлечено продуцирование TNF, показана следующими in vitro анализами: Анализ человеческих моноцитов Человеческие мононуклеарные клетки изолировали из человеческой крови с антикоагулянтом, используя одностадийную методику разделения Ficoll-hypaque. (2) Одноядерные клетки промывали три раза в сбалансированном солевом растворе Хенка (HBSS) с двухвалентными катионами и ресуспендировали до плотности 2106/мл в HBSS, содержащем 1%BSA (бычий сывороточный альбумин). Дифференциальные подсчеты, выполненные с использованием анализатора Abbott Cell Dyn 3500 показали, что моноциты колеблются в пределах от 17 до 24% от всех клеток в этих препаратах. 180 мкл клеточной суспензии переносили аликвотами в плоскодонные 96-луночные планшеты (Costar). Добавление соединений иLPS (липополисахариды) (конечная концентрация 100 нг/мл) обеспечивало конечный объем 200 мкл. Все условия выполняли в трех повторах. После четырех часов инкубации при 37 С в увлажненном CO2 инкубаторе планшеты извлекали и центрифугировали (10 мин при приблизительно 250 хg). Супернатанты удаляли и анализировали на TNFa, используя набор RDELISA Kit. Анализ на аггреканазу Первичные свиные хондроциты из суставного хряща выделяют последовательным трипсиновым и коллагеназным расщеплением с последующим расщеплением коллагеназой в тече 004680 34 ние ночи и наносят в количестве 2105 клеток на 48-луночные планшеты с 5 мкКи/мл 35S (1000 Ки/ммоль) серы в покрытых коллагеном типа I планшетах. Клетки оставляют стоять для введения метки в их протеогликановый матрикс(приблизительно 1 неделя) при 37 С в атмосфере 5% СО 2. За ночь до начала анализа монослои хондроцитов промывают два раза в DMEM/1%PSF/G, а затем оставляют инкубироваться в свежем DMEM/1% FBS в течение ночи (DMEMFBS - сыворотка плода коровы). На следующее утро хондроциты промывают один раз в DMEM/1%PSF/G. Последнюю промывку оставляют осесть на планшетах в инкубаторе, в то же время готовя разведения. Среда и разведения могут быть приготовлены, как описано в таблице ниже. Контрольная средаIL-1 среда Разведения лекарственного средстваDMEM + IL-1 (5 нг/мл) Приготовить исходные растворы всех соединений в концентрации 10 мМ вДМСО. Приготовить 100 мкМ исходный раствор каждого соединения в DMEM в 96-луночном планшете. Хранить в холодильнике в течение ночи. На следующий день выполнить серийные разведения в DMEM с IL-1 до 5 мкМ, 500 нМ и 50 нМ. Отсосать последнюю промывку из лунок и добавить 50 мкл соединения из вышеуказанных разведений в 450 мкл IL-1 среды в соответствующих лунках 48-луночных планшетов. Конечные концентрации соединений равны 500, 50 и 5 нМ. Все образцы на каждом планшете завершают в трех повторах контролями и образцами с одним IL-1 Планшеты метят изотопом и используют только внутренние 24 лунки планшета. На одном из планшетов несколько колонок обозначают как IL-1 (без лекарственного средства) и контроль (без IL-1, без лекарственного средства). Эти контрольные колонки периодически считывают для наблюдения за высвобождением 35S-протеогликана. В лунки добавляют контрольную среду и IL-1 среду (450 мкл), а затем соединение (50 мкл), чтобы инициировать анализ. Планшеты инкубируют при 37 С в атмосфере с 5% CO2. При 40-50%-ном высвобождении (когда СРМ (импульсы в минуту) от IL-1 среды в 4-5 раз больше, чем от контрольной среды), которое определяют жидкостным сцинтилляционным счетом (LSC) образцов среды, анализ заканчивают (9-12 ч). Среду удаляют из всех лунок и помещают в сцинтилляционные пробирки. Добавляют сцинтиллят и регистрируют радиоактивные импульсы (LSC). Для солюбилизации клеточных слоев в каждую лунку добавляют 500 мкл папаинового расщепляющего буфера (0,2 М Трис, рН 7,0, 5 мМ EDTA (этилендиаминтетрауксусной кислоты), 5 мМ DTT (дитиотреита) и 1 мг/мл папаина). Планшеты с расщепляющим 35 раствором инкубируют при 60 С в течение ночи. Клеточный слой удаляют из планшетов на следующий день и помещают в сцинтилляционные пробирки. Затем добавляют сцинтиллят и считывают образцы (LSC). Определяют процент высвободившихся импульсов от общего наличия в каждой лунке. Средние значения трех повторов получают с исходным значением для контроля, вычитаемым из значений для каждой лунки. Процент ингибирования соединением базируется на том, чтоIL-1 образцы принимают за ингибирование 0%(100% от общего количества импульсов). Соединения по настоящему изобретению,которые были протестированы, все имели значения IC50 по меньшей мере в одном из вышеуказанных анализов менее 100 мкМ, преимущественно менее 100 нМ. Некоторые предпочтительные группы соединений обладают дифференцированной селективностью по отношению к различным ММР или ADAM. Одна группа предпочтительных соединений обладает селективной активностью по отношению к ММР-13 по сравнению с ММР-1. Другая предпочтительная группа соединений обладает аггреканазной активностью более предпочтительно в дополнение к селективности в отношении ММР-13 по сравнению с ММР-1. Для введения млекопитающим, включая людей, для ингибирования матриксных металлопротеиназ или репролизина млекопитающих можно использовать множество традиционных путей, включая пероральный, парентеральный(например внутривенный, внутримышечный или подкожный), трансбуккальный, анальный и местный. В общем случае, соединения по изобретению (ниже упоминаемые также как активные соединения) вводят в дозировках между приблизительно 0,1 и 25 мг/кг массы тела субъекта, которого лечат, в сутки, предпочтительно от приблизительно 0,3 до 5 мг/кг. Предпочтительно активное соединение вводят перорально или парентерально. Однако некоторое изменение дозировки обязательно будет иметь место в зависимости от состояния субъекта, которого лечат. Персона, отвечающая за введение, в каждом конкретном случае будет определять соответствующую дозу для индивидуального субъекта. Соединения по настоящему изобретению можно вводить в виде разнообразных лекарственных форм. В общем случае, терапевтически эффективные соединения по данному изобретению присутствуют в таких лекарственных формах в концентрациях в пределах от приблизительно 5,0 до приблизительно 70 мас.%. Для перорального введения можно использовать таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, дикальция фосфат и глицин, наряду с различными разрыхлителями, такими как крахмал (и пред 004680 36 почтительно кукурузный, картофельный или тапиоковый крахмал), альгиновая кислота и некоторые сложные силикаты, совместно со связывающими гранулят веществами, такими как поливинилпирролидон, сахароза, желатин и аравийская камедь. Кроме того, смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк очень полезны в целях таблетирования. Твердые композиции подобного типа можно также использовать в качестве наполнителей в желатиновых капсулах; предпочтительные вещества в связи с этим также включают лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Если для перорального введения желательны водные суспензии и/или эликсиры, то активный ингредиент можно комбинировать с различными подслащивающими или ароматизирующими агентами,подкрашивающим веществом или красителями и, если желательно, эмульгирующими и/или суспендирующими агентами, а также с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и различные их комбинации. В случае животных, их предпочтительно вводят в состав корма для животных или в питьевую воду в концентрации 5-5000 м.д. (миллионных долей), предпочтительно от 25 до 500 м.д. Для парентерального введения (внутримышечного, внутрибрюшинного, подкожного и внутривенного) обычно готовят стерильный инъекционный раствор активного ингредиента. Можно применять растворы терапевтического соединения по настоящему изобретению либо в кунжутном, либо в арахисовом масле или в водном пропиленгликоле. Водные растворы, если необходимо, должны быть подходящим образом забуферены и доведены предпочтительно до рН более 8, а жидкий разбавитель сначала сделан изотоническим. Эти водные растворы пригодны для внутривенных инъекций. Масляные растворы пригодны для внутрисуставных, внутримышечных и подкожных инъекций. Приготовление всех этих растворов в стерильных условиях легко можно выполнить по стандартным фармацевтическим методикам, общеизвестным для специалистов в данной области техники. В случае животных соединения можно вводить внутримышечно или подкожно при уровне дозировки от приблизительно 0,1 до 50 мг/кг/сутки,предпочтительно от 0,2 до 10 мг/кг/сутки, давая в однократной дозе или в разделенных дозах в количестве до трех. Активные соединения по изобретению могут быть приготовлены также в виде ректальных композиций, таких как суппозитории или удерживающие клизмы, например содержащие традиционные суппозиторные основы, такие как масло какао или другие глицериды. Для интраназального введения или введения путем ингаляции активные соединения по изобретению лучше доставлять в форме раство 37 ра или суспензии из аэрозольного контейнера с насосом, который сжимает или накачивает пациент, или в виде аэрозольно-спрейной подачи из контейнера под давлением или небулайзера с использованием подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением, единицу дозировки можно установить, обеспечив наличие клапана, выпускающего дозированное количество. Контейнер под давлением или небулайзер может содержать раствор или суспензию активного соединения. Могут быть приготовлены капсулы и картриджи(изготовленные например из желатина) для использования в ингаляторе или инсуффляторе,содержащие порошковую смесь соединения по изобретению и подходящую порошковую основу, такую как лактоза или крахмал. Следующие ниже примеры иллюстрируют получение соединений по настоящему изобретению. Точки плавления не корректировали. Данные ЯМР представлены в миллионных доляхи отнесены к дейтериевому сигналу внутренней стабилизации от растворителя образца (дейтерохлороформ, если не указано иное). Имеющиеся в продаже реагенты использовали без дополнительной очистки. THF обозначает тетрагидрофуран. DMF обозначает N,Nдиметилформамид. Хроматография представляет собой колоночную хроматографию, выполняемую с использованием силикагеля 32-63 мм и осуществляемую в условиях давления азота(флэш-хроматография). Комнатная температура или температура окружающей среды составляет 20-25 С. Все неводные реакции проводили в атмосфере азота для удобства и для максимизации выхода. Концентрирование при пониженном давлении или в вакууме предусматривает использование роторного испарителя. Пример 1. 5-Метил, 5-(4'-фенокси-фенокси)пиримидин-2,4,6-трион. Натрий (190 мг, 8,26 мМ) медленно и осторожно добавляли к абсолютному этанолу (25 мл) и перемешивали до тех пор, пока раствор не становился гомогенным. Добавляли мочевину(620 мг, 10,32 мМ), и эту смесь перемешивали в течение 30 мин. Добавляли по каплям раствор диэтил-2-метил-2-(4'-фенокси-фенокси)малоната (1,48 г, 4,13 мМ) в абсолютном этаноле (25 мл), и полученную смесь нагревали с обратным холодильником (6 ч). Реакционную смесь оставляли охлаждаться до комнатной температуры,выпаривали до сухости и распределяли между этилацетатом (100 мл) и водой (100 мл). Водный слой отделяли, подкисляли до рН 1 водной 1 н.HCl и экстрагировали этилацетатом (3100 мл). Объединенные органические экстракты сушили над сульфатом магния (MgSO4), фильтровали и упаривали до сухости. Полученный белый порошок кристаллизовали из горячего 38 метиленхлорида с получением целевого соединения в виде белого кристаллического вещества(310 мг, данные анализа см. в табл. 1). Примеры 2-9. Соединения примеров 2-9 получали согласно методике, аналогичной описанной выше,за исключением того, что диэтил-2-метил-2-(4'фенокси-фенокси)малонат заменяли соответствующим замещенным малонатом. В следующей ниже таблице Me является метилом, Вu является н-бутилом, Пр.- это номер примера, и m/z представляет собой массу молекулярного иона низкого разрешения. Таблица 1 Натрий (112 мг) медленно и осторожно добавляли к абсолютному этанолу (25 мл) и перемешивали до тех пор, пока раствор не становился гомогенным. Медленно добавляли 4 феноксифенол (910 мг) (Aldrich Chemical Com 39pany), и полученную смесь перемешивали (30 мин, комнатная температура). По каплям добавляли диэтилбромн-бутилмалонат (1,44 мг)(см. подготовительный пример 3) в абсолютном этаноле (25 мл) и полученную смесь нагревали с обратным холодильником (1 ч). Реакционную смесь охлаждали до комнатной температуры,упаривали до сухости и распределяли между этилацетатом (100 мл) и водой (100 мл). Органический слой отделяли, промывали водой(3100 мл), сушили (сульфат магния), фильтровали и упаривали с получением целевого соединения в виде прозрачного масла (1,82 г). 1 Н ЯМР (CDCl3):= 0.85-0.88 (t, 3H); 1.211.25 (t, 6H); 1.31-1.39 (m, 4H); 2.2-2.27 (m, 2H); 4.23-4.28 (q, 4H); 6.80-6.95 (m. 6H); 7.03-7.08 (t,1H); 7.25-7.31 (q, 2 Н); m/z = 401 (M+). Подготовительный пример 2. Диэтил-2 метил, 2-(4'-фенокси-фенокси)малонат. Подготовительный пример 3. Диэтил-бромн-бутилмалонат. Натрий (112 мг) медленно и осторожно добавляли к абсолютному этанолу (25 мл) и перемешивали до тех пор, пока раствор не становился гомогенным. Медленно добавляли 4 феноксифенол (910 мг) (Aldrich Chemical Company), и полученную смесь перемешивали (30 мин, комнатная температура). По каплям добавляли диэтилбромметилмалонат (1,23 г)(Aldrich Chemical Company) в абсолютном этаноле (25 мл) и полученную смесь нагревали с обратным холодильником (1 ч). Реакционную смесь охлаждали до комнатной температуры,упаривали до сухости и распределяли между этилацетатом (100 мл) и водой (100 мл). Органический слой отделяли, промывали водой(3100 мл), сушили (сульфат магния), фильтровали и упаривали с получением целевого соединения в виде прозрачного масла (1,48 г). 1(s, 3H); 4.24-4.30 (q, 4H); 6.88-6.97 (m, 6H); 7.047.08 (t, 1H); 7.25-7.32 (q, 2H); m/z = 359 (M+). Малонаты, в том числе указанные в табл. 2, получали по методикам, аналогичным описанным выше (подготовительные примеры 1 и 2), начиная с соответствующего -бром, алкилмалоната и соответствующего фенола. В следующей ниже таблице Me является метилом,и Et является этилом. Диэтил-н-бутилмалонат (32,2 г) растворяли в метиленхлориде (200 мл) и обрабатывали по каплям раствором брома (24,0 г), растворенного в метиленхлориде (25 мл). Полученную смесь перемешивали (1 ч, комнатная температура), после чего оранжевое окрашивание сохранялось. Растворитель удаляли под вакуумом. Остаток перегоняли под глубоким вакуумом с получением целевого продукта в виде прозрачного масла (температура кипения от 105 до 110 С; 36,0 г). 1 Н ЯМР (CDCl3):= 0.89-0.92 (t, 3H); 1.251.29 (t, 6H); 1.35-1.37 (m, 4H); 2.2-2.26 (m, 2 Н); 4.23-4.29 (q, 4H); m/z = 295 и 297 (М+). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулыR2 и R3 представляют собой водород; Х выбран из группы, состоящей из кислорода и серы;Z представляет собой бензил или (С 6 С 10)арил, возможно замещенный по любому кольцевому атому углерода, способному обра 41 зовывать дополнительную связь, одним заместителем, выбранными из F, Cl и Вr; или его фармацевтически приемлемая соль. 2. Соединение по п.1, где R2 и R3, каждый,представляют собой водород. 3. Соединение по п.2, где Х представляет собой кислород. 4. Соединение по п.2, где Х представляет собой серу. 5. Соединение по п.2, где Y представляет собой связь, кислород или серу. 6. Соединение по п.3, где Y представляет собой связь, кислород или серу. 7. Соединение по п.4, где Y представляет собой связь, кислород или серу. 8. Соединение по п.2, где Y представляет собой кислород. 9. Соединение по п.3, где Y представляет собой кислород. 10. Соединение по п.2, где Х и Y, каждый,представляют собой кислород. 11. Соединение по п.2, где Аr1 представляет собой фенил. 12. Соединение по п.8, где Аr1 представляет собой фенил. 13. Соединение по п.9, где Аr1 представляет собой фенил. 14. Соединение по п.10, где Аr1 представляет собой фенил. 15. Соединение по п.2, где Z представляет собой (С 6-С 10)арил. 16. Соединение по п.3, где Z представляет собой (С 6-С 10)арил. 17. Соединение по п.8, где Z представляет собой (С 6-С 10)арил. 18. Соединение по п.9, где Z представляет собой (С 6-С 10)арил. 19. Соединение по п.13, где Z представляет собой (С 6-С 10)арил. 20. Соединение по п.2, где Z замещен по любому кольцевому атому углерода, способному образовывать дополнительную связь, одним заместителем, выбранным из F, Cl и Вr. 21. Соединение по п.1, где Х представляет собой кислород, Y представляет собой связь,кислород или серу, R1 представляет собой (С 1 С 4 алкил) и R2 и R3 представляют собой водород. 22. Соединение по п.1, где R2 и R3, каждый, представляют собой водород; Х представляет собой кислород; Y представляет собой кислород. 23. Соединение по п.1, где R1 представляет собой метил; R2 и R3, каждый, представляют собой водород; Х представляет собой кислород;Y представляет собой кислород и Z представляет собой (С 6-С 10)арил. 24. Соединение по п.1, где R1 представляет собой н-бутил; R2 и R3, каждый, представляют собой водород; Х представляет собой кислород;Y представляет собой кислород и Z представляет собой (С 6-С 10)арил.Y представляет собой связь и Z представляет собой (С 6-С 10)арил. 26. Соединение по п.1, где R1 представляет собой н-бутил; R2 и R3, каждый, представляют собой водород; Х представляет собой кислород;Y представляет собой связь и Z представляет собой (С 6-С 10)арил. 27. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из 5-метил-5-(4-феноксифенокси)пиримидин 2,4,6-триона; 5-метил-5-(4-(4'-фторфенокси)фенокси) пиримидин-2,4,6-триона; 5-н-бутил-5-(4-феноксифенокси)пиримидин-2,4,6-триона; 5-н-бутил-5-(4-(4'-фторфенокси)фенокси) пиримидин-2,4,6-триона; 5-метил-5-(4-фенилфенокси)пиримидин 2,4,6-триона; 5-метил-5-(3-фенилфенокси)пиримидин 2,4,6-триона и 5-метил-5-(4-бензилоксифенокси)пиримидин-2,4,6-триона; или их фармацевтически приемлемых солей. 28. Фармацевтическая композиция для лечения состояния, выбранного из группы, состоящей из артрита, воспалительного кишечного заболевания, болезни Крона, эмфиземы, острого респираторного дистресс-синдрома, астмы,хронического обструктивного заболевания легких, болезни Альцгеймера, токсичности органного трансплантата, кахексии, аллергических реакций, аллергической контактной гиперчувствительности, рака, изъязвления тканей, рестеноза, периодонтального заболевания, врожденного буллезного эпидермолиза, остеопороза, разбалтывания искусственных суставных имплантатов, атеросклероза, аневризмы аорты, застойной сердечной недостаточности, инфаркта миокарда, удара, церебральной ишемии, травмы головы, повреждения спинного мозга, нейродегенеративных расстройств, аутоиммунных расстройств, болезни Хантингтона, болезни Паркинсона, мигрени, депрессии, периферической невропатии, боли, церебральной амилоидной ангиопатии, ноотропного или когнитивного усиления, бокового амиотрофического склероза,множественного склероза, глазного ангиогенеза,повреждения роговицы, дегенерации желтого пятна, аномального заживления ран, ожогов,диабета, рубцевания роговицы, склерита,СПИДа, сепсиса и септического шока у млекопитающего, включая человека, содержащая количество соединения по п.1, эффективное при таком лечении, и фармацевтически приемлемый носитель. 29. Способ лечения состояния, выбранного из группы, состоящей из артрита, воспалительного кишечного заболевания, болезни Крона, 43 эмфиземы, острого респираторного дистресссиндрома, астмы, хронического обструктивного заболевания легких, болезни Альцгеймера, токсичности органного трансплантата, кахексии,аллергических реакций, аллергической контактной гиперчувствительности, рака, изъязвления тканей, рестеноза, периодонтального заболевания, врожденного буллезного эпидермолиза,остеопороза, разбалтывания искусственных суставных имплантатов, атеросклероза, аневризмы аорты, застойной сердечной недостаточности,инфаркта миокарда, удара, церебральной ишемии, травмы головы, повреждения спинного мозга, нейродегенеративных расстройств, аутоиммунных расстройств, болезни Хантингтона,болезни Паркинсона, мигрени, депрессии, периферической невропатии, боли, церебральной амилоидной ангиопатии, ноотропного или когнитивного усиления, бокового амиотрофического склероза, множественного склероза, глазного ангиогенеза, повреждения роговицы, дегенерации желтого пятна, аномального заживления 44 ран, ожогов, диабета, рубцевания роговицы,склерита, СПИДа, сепсиса и септического шока у млекопитающего, включая человека, при котором указанному млекопитающему вводят количество соединения по п.1, эффективное при лечении такого состояния. 30. Фармацевтическая композиция для лечения состояния, которое можно лечить посредством ингибирования матриксных металлопротеиназ, у млекопитающего, включая человека,содержащая количество соединения по п.1, эффективное при таком лечении, и фармацевтически приемлемый носитель. 31. Фармацевтическая композиция для лечения состояния, которое можно лечить посредством ингибирования репролизина млекопитающих, у млекопитающего, включая человека,содержащая количество соединения по п.1, эффективное при таком лечении, и фармацевтически приемлемый носитель.
МПК / Метки
МПК: C07D 239/60, A61P 43/00, A61K 31/513
Метки: 6-трионовые, металлопротеиназ, пиримидин-2, ингибиторы
Код ссылки
<a href="https://eas.patents.su/23-4680-pirimidin-2-4-6-trionovye-ingibitory-metalloproteinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Пиримидин-2, 4, 6-трионовые ингибиторы металлопротеиназ</a>












