Ингибиторы матриксных металлопротеиназ
Номер патента: 1432
Опубликовано: 26.02.2001
Авторы: Биссолино Пьерлуиджи, Абрате Франческа, Альпеджани Марко, Перроне Этторе, Палладино Массимилиано
Формула / Реферат
1. Соединение, которое является производным сукцинамида формулы (I)
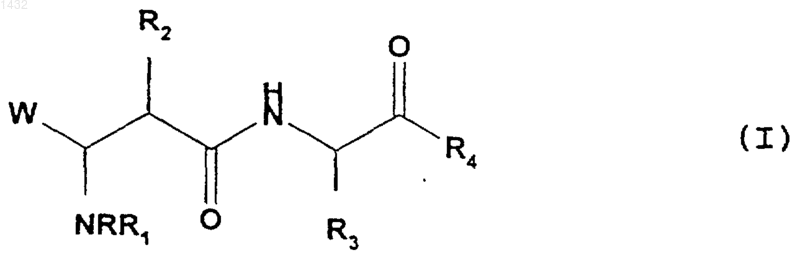
где W обозначает группу -СООН или -CONHOH;
R обозначает водород, C1-C6 алкил, фенил или бензил;
R1 обозначает водород или
низший алкил, в частности метил, этил, пропил, изопропил, изобутил, трет-бутил; арил, в частности фенил и нафтил; и арил(низший алкил), в частности бензил; причем эти группы могут быть не замещены или замещены одним или несколькими заместителями, имеющими одинаковые или разные значения, которые выбирают из группы, включающей метил, этил, изопропил, трет-бутил, фтор, хлор, бром, нитро, амино, диметиламино, гидрокси, метокси, этокси, ацетил, ацетамидо, карбокси, карбоксиметил; либо
-(СН2)m-гетероциклил или -(CH2)m-циклопропил, где m равен нулю или целому числу от одного до трех и гетероциклил является 3-6-членным гетероциклильным кольцом, которое не конденсировано или конденсировано с бензолом или нафталиновым кольцом, имеющим, по крайней мере, один атом азота; такими группами предпочтительно являются сукцинимидо, фталимидо, сахарин, гидантоин, индолил, оксииндолил, 2-оксоизоиндолинил, имидазолил, пиридил, морфолино, пирролидино, 2-оксопирролидино, пиперазино; причем указанная гетероциклильная группа может быть не замещена или замещена одним или несколькими заместителями, выбираемыми из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил, бензил, фенил, гидрокси, оксо, карбокси и нитро; либо
группу -(СH2)nСООН или -(CH2)mCOOR1, где n может быть равен 1, 2 или 3, m может быть равен 0, 1, 2 или 3 и R1 обозначает метил, этил, пропил, изопропил, изобутил, трет-бутил, фенил, бензил, аллил, стирил, 1-нафтил, 2-нафтил, причем указанные группы могут быть не замещены или замещены одним-тремя заместителями, выбираемыми из группы, включающей метил, этил, изопропил, трет-бутил, фтор, хлор, бром, нитро, амино, диметиламино, гидрокси, метокси, этокси, ацетил, ацетамидо, карбокси, карбоксиметил; либо
группу, выбираемую из -(CH2)mSO2R1, -(CH2)mSO2NH2, -(CH2)mSO2-N(Me)2, -(СН2)mSO2NHR1, где m, R1 и возможные заместители группы R1 имеют указанные выше значения, -(СН2)mSО2-(4-морфолино), -(CH2)mSO2-(1-пиперазино) или -(СH2)mSО2-(4-метил-1-пиперазино); либо
группу -(СН2)mSO3Н, где n имеет указанные выше значения;
ацил, в частности ацетил, бензоил или фенацетил, которые могут быть не замещены или замещены одним или несколькими заместителями, выбираемыми из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил, бензил, фенил, гидрокси, оксо, карбокси и нитро; либо
группу -С(О)-RII-C(О)RIII, где -RII- обозначает химическую связь, -СН2-, -СH2(СH2)mСH2-, где m имеет указанные выше значения, -СН=СН-, -СH2СН=СН-, фенилен (т.е. -С6Н4-), -СH2СН=СН-С6Н4-, -СН2СH2CH-, СH2-СС-, -СH2СH2-СС-, -СH2СH2СН=СН-С6Н4-, -СH2-СС-С6Н4-, -СH2СH2-СС-C6Н4, и RIII выбирают из группы, включающей метил, этил, фенил, гидрокси, метокси, этокси, амино, метиламино, диметиламино и морфолино; либо
-С(О)-гетероциклил, где гетероциклил имеет указанные выше значения; причем указанная гетероциклильная группа может быть не замещена или замещена одним или несколькими заместителями, выбираемыми из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил, бензил, фенил, гидрокси, оксо, карбокси и нитро; либо
-С(О)-RII-гетероциклил или -С(О)-RII-арил, где RII, гетероциклил, арил и возможные заместители такого гетероциклила или арила имеют указанные выше значения; либо
R и R1 вместе с атомом азота, к которому они присоединены, обозначают морфолино, пирролидино, пиперазино, N-метилпиперазино, сукцинимидо или фталимидо;
R2 обозначает С3-C15алкил с линейной или разветвленной цепью, который может быть не замещен или замещен С3-С7циклоалкильной группой; либо
R2 обозначает группу -RII-H, где RII имеет указанные выше значения, которая может быть не замещена или замещена одним-тремя заместителями, выбираемыми из группы, включающей метил, этил, С3-С4алкил с линейной или разветвленной цепью, фтор, хлор, C1-C4алкокси, нитро, амино, диметиламино, карбокси, карбоксиметил; либо
R2 является группой -RII-X-RIV, где RII имеет указанные выше значения, RIV обозначает C1-C6 алкил, С3-С7циклоалкил, C2-C6алкенил, фенил, фенил(C1-C6)алкил или фенил(C2-C6)алкенил, причем указанные группы могут быть не замещены или замещены группой, выбираемой из F, Cl, Br, C1-C4алкила, C1-C4алкокси, и Х обозначает прямую связь, атом кислорода, атом серы, сульфинил-S(O)-, сульфонил-S(O)2 или карбамоильную группу -CONH- или -NHCO-;
R3 обозначает характеристическую группу натуральной или ненатуральной альфа-аминокислоты, в которой любая функциональная группа, если она имеется, может быть защищена;
R4 обозначает O-алкил, где алкил является C1-C4алкильной группой с прямой или разветвленной цепью, такой как метил, этил и трет-бутил, или O-фенил и его производные, замещенные одним-тремя заместителями, выбираемыми из C1-C4алкила с прямой или разветвленной цепью, хлора и метокси; либо
R4 обозначает -NH2, -NH(C1-C6алкил), -NH-арил, -NH-гетероциклил; либо
R4 обозначает -NH(C1-C6алкил), замещенный фенилом или гетероциклилом; либо
R4 обозначает -NН(С2-C6алкил), замещенный группой, выбираемой из -CONH2, -NHCONH2, -SO2NH2, -NHSO2NH2 и их производных, в которых концевой атом азота замещен одной или двумя метильными группами, или их производных, в которых концевой атом азота является частью морфолинового, пирролидинового, пиперазинового или N-метилпиперазинового кольца; либо
R4 обозначает -NH(C2-C6алкил), замещенный амино, защищенным амино, моно(C1-C6) алкиламино, ди(C1-C6)алкиламино, гуанидино, морфолино, пиперазино или N-метилпиперазино; либо
R3 и R4, вместе взятые, обозначают группу формулы -(СH2)m-NH-, где m является целым числом от 5 до 12, необязательно прерываемую группой -NR5-, где R5 выбирают из водорода, C1-C6 алкила, C1-C6алкоксикарбонила, арила, арил(С1-C6)алкила или арил(C1-C6)алкоксикарбонила, или прерываемую группой -C6H4-O- или индольным кольцом, присоединенным атомами С-3 и азота;
при этом алкил, алкенил, фенил, циклоалкил, гетероциклил и характеристические группы в любом из приведенных выше определений R1, R2, R3 R4 и А могут быть не замещены или замещены одним или несколькими заместителями;
а также их соли, пролекарства, сольваты и гидраты, при условии, что когда -NRR1 является -NH2, защищенным амино или ациламино, R3 обозначает трет-бутил и R4 обозначает амино или алкиламино, тогда R2 не является изобутилом.
2. Соединение по п.1 формулы (I')

где W обозначает группу -СООН или -CONHOH;
R обозначает водород, метил, этил или бензил;
R1 обозначает водород или
низший алкил, в частности метил, этил, пропил, изопропил, изобутил, трет-бутил; арил, в частности фенил и нафтил; и арил (низший алкил), в частности бензил; причем эти группы могут быть не замещены или замещены одним или несколькими заместителями, имеющими одинаковые или разные значения, которые выбирают из группы, включающей метил, этил, изопропил, трет-бутил, фтор, хлор, бром, нитро, амино, диметиламино, гидрокси, метокси, этокси, ацетил, ацетамидо, карбокси, карбоксиметил; либо
-(СH2)m-гетероциклил или -(CH2)m-циклопропил, где m равен нулю или целому числу от одного до трех, и гетероциклил является 3-6-членным гетероциклильным кольцом, которое не конденсировано или конденсировано с бензолом или нафталиновым кольцом, имеющим, по крайней мере, один атом азота; такими группами предпочтительно являются сукцинимидо, фталимидо, сахарин, гидантоин, индолил, оксииндолил, 2-оксоизоиндолинил, имидазолил, пиридил, морфолино, пирролидино, 2-оксопирролидино, пиперазино; причем указанная гетероциклильная группа может быть не замещена или замещена одним или несколькими заместителями, выбираемыми из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил, бензил, фенил, гидрокси, оксо, карбокси и нитро; либо
группу -(СH2)nСООН или -(СН2)mCOOR1, где n может быть равен 1, 2 или 3, m может быть равен 0, 1, 2 или 3 и R1 обозначает метил, этил, пропил, изопропил, изобутил, трет-бутил, фенил, бензил, аллил, стирил, 1-нафтил, 2-нафтил, причем указанные группы могут быть не замещены или замещены одним-тремя заместителями, выбираемыми из группы, включающей метил, этил, изопропил, трет-бутил, фтор, хлор, бром, нитро, амино, диметиламино, гидрокси, метокси, этокси, ацетил, ацетамидо, карбокси, карбоксиметил; либо
группу, выбираемую из -(СH2)mSO2R1, -(CH2)mSO2NH2, -(CH2)m-SO2N(Me)2, -(CH2)mSO2NHR1, где m, R1 и возможные заместители группы R1 имеют указанные выше значения, -(CH2)mSO2-(4-морфолино), -(CH2)mSO2-(1-пиперазино) или -(CH2)mSO2-(4-метил-1-пиперазино); либо
группу -(СH2)nSО3Н, где n имеет указанные выше значения;
ацил, в частности ацетил, бензоил или фенацетил, которые могут быть не замещены или замещены одним или несколькими заместителями, выбираемыми из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил, бензил, фенил, гидрокси, оксо, карбокси и нитро; либо
группу -С(О)-RII-C(О)RIII, где -RII обозначает химическую связь, -СН2-, -СН2(CH2)mСН2-, где m имеет указанные выше значения, -СН=СН-, -СН2СН=СН-, фенилен (т.е. -C6H4-), -СH2СН=СН-C6Н4-, -СH2СH2СН=СН-, CH2-CC-, -CH2CH2-CC-, -CH2CH2CH=CH-C6H4-, -СH2-СС-C6Н4-, -СH2СH2-СС-C6Н4-, и RIII выбирают из группы, включающей метил, этил, фенил, гидрокси, метокси, этокси, амино, метиламино, диметиламино и морфолино; либо
-С(О)-гетероциклил, где гетероциклил имеет указанные выше значения; причем такая гетероциклильная группа может быть не замещена или замещена одним или несколькими заместителями, выбираемыми из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил, бензил, фенил, гидрокси, оксо, карбокси и нитро; либо
-С(О)-RII-гетероциклил или -С(О)-RII-арил, где RII, гетероциклил, арил и возможные заместители такого гетероциклила или арила имеют указанные выше значения; либо
R и R1 вместе с атомом азота, к которому они присоединены, обозначают морфолино, пирролидино, пиперазино, N-метилпиперазино, сукцинимидо или фталимидо;
R2 обозначает С3-C15алкил с линейной или разветвленной цепью, который может быть не замещен или замещен С3-С7циклоалкильной группой; либо
R2 обозначает группу -RII-H, где RII имеет указанные выше значения, которая может быть не замещена или замещена одним-тремя заместителями, выбираемыми из группы, включающей метил, этил, С3-С4алкил с линейной или разветвленной цепью, фтор, хлор, C1-C4алкокси, нитро, амино, диметиламино, карбокси, карбоксиметил; либо
R2 является группой -RII-X-RIV где RII имеет указанные выше значения, -Х- обозначает прямую связь, -О-, -S-, -SO-, -SO2, -CONH- или -NHCO-, и RIV обозначает C1-C6алкил, С2-C6алкенил, метил, этил, пропил, бутил, фенил или бензил, при этом бензольное кольцо фенильной и бензильной групп может быть не замещено или замещено одним или несколькими заместителями, выбираемыми из группы, включающей метил, этил, пропил, бутил, гидрокси, метокси, этокси, хлор, фтор, трифторметил или нитро;
R3 обозначает фенилметил, циклогексилметил, изобутил, трет-бутил, -С(СН3)2C6Н5, -С(СН3)2OСН3, -С(СН3)2SCH3, -С(СН3)2SOСН3, -С(СН3)2SO2СН3, -СН(C6Н5)2, -СН(СН3)ОН, -СН(СН3)ОМе, -СН(СН3)O-изопропил, -СН(СН3)O-трет-бутил, -СН(СН3)ОРh, -СН(СН3)OCH2Ph, (4-метокси)фенилметил, (4-гидрокси)фенилметил, индолилметил, (N-метил)индолилметил, 1-нафтилметил , 2-нафтилметил, (4-карбоксиметокси)фенилметил, циклогексил, фенил, пиридил, тиазолил, тиенил, пиридилметил, тиазолилметил, тиенилметил и их производные, в которых любая фенильная, пиридильная, тиазолильная и тиенильная группа замещена хлором, фтором, метокси или C1-С3алкилом;
R4 обозначает O-алкил, где алкил является C1-C4алкильной группой с прямой или разветвленной цепью, такой как метил, этил и трет-бутил, или O-фенил и его производные, замещенные одним-тремя заместителями, выбираемыми из C1-C4алкила с прямой или разветвленной цепью, хлора и метокси; либо
R4 обозначает -NH2 или -NH-алкил, где алкил выбирают из метила, этила, пропила, бутила, изопропила, изобутила, втор-бутила и трет-бутила; причем указанные алкильные группы с линейной или разветвленной цепью могут быть не замещены или замещены группой, выбираемой из фенила, бензила, 2-пиридила, 3-пиридила, 1,3,4-тиадиазолил-2-ила, 2-тиазолила; эти группы в свою очередь могут быть не замещены или замещены заместителем, выбираемым из метила, этила, метокси, амино, метиламино, диметиламино, карбокси, метоксикарбонила, этоксикарбонила, -SO2NH2, -SO2NНC6Н5, -SO2-морфолино, -SO2СН3, -CONH2, -СО-морфолино; либо
R4 является группой -NHCH2CH2Y, -NHCH2CH2CH2Y, -NHCH2CH2CH2-CH2Y, -NНСH2СН(СН3)Y или -NHCH2C(СН3)2Y, где Y обозначает амино, метиламмно, диметиламино, морфолино, пирролидино, пиперазино, N-метилпиперазино, гидрокси, метокси, этокси, метилтио, 2-(диметиламино)этилтио, 2-(морфолино)этилтио, Cl, F, Вr, фенокси или фенилтио, где фенильное кольцо может быть замещено гидрокси или метокси; либо
R4 обозначает -NH-арил, -NH-гетероциклил, -NН-СH2-арил, -NH-(CH2)2арил, NН-СН2-гетероарил или -NH-(СН2)2-гетероциклил, где арильную группу выбирают из группы, включающей фенил, 4-фторфенил, 4-метоксифенил, 1,3-бензодиоксолил, 4-толил, 1-инданил, 5-инданил, и гетероциклильную группу выбирают из группы, включающей 2-бензимидазолил, 2-бензотиазолил, 1-бензотриазолил, 2,5-диметил-1-пирролидинил, 2,6-диметилпиперидинил, 2-имидазолил, 1-индолил, 5-индолил, 5-индазолил, 1-изохинолил, 5-изохинолил, 2-метокси-5-пиридил, 1-метил-2-бензимидазолил, 4-метил-7-кумаринил, 3-метил-5-изотиазолил, 5-метил-3-изоксазолил, пиразинил, 3-пиразолил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 3-хинолил, 5-тетразолил, 1-метил-5-тетразолил, 1,3,4-тиадиазол-2-ил, 2-тиазолил, 1,2,4-триазин-3-ил и 1,2,4-триазол-3-ил; либо
R4 обозначает -NH(C2-C6алкил), где алкильная группа замещена заместителем, выбираемым из -CONH2, -CONHMe, -NHCONH2, -NHCO-NMe2, -NHCO-(4-морфолино), -NHCO-(4-метил-1-пиперазино), -NHSO2-NH2, -NHSO2NMe2, -NHSO2-(4-морфолино) и NHSO2-(4-метил-1-пиперазино); либо
R3 и R4, вместе взятые, обозначают группу формулы -(СH2)10-NH- или группу формулы -(СH2)4-NH-(CH2)5-NH; либо
R3 и R4, вместе взятые, обозначают группу нижеследующей формулы (В)
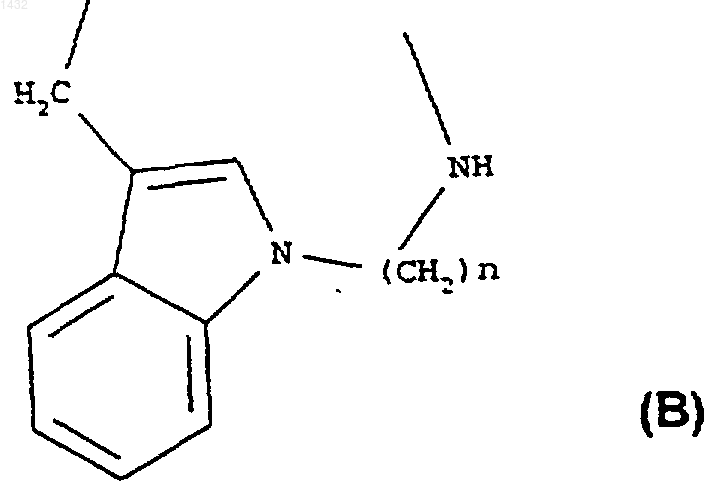
или группу нижеследующей формулы (С)
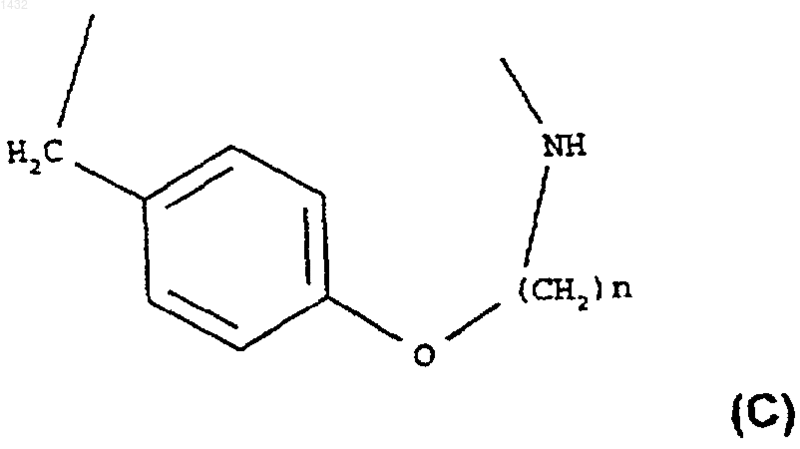
где n является целым числом от 3 до 6;
а также их фармацевтически приемлемые соли, сольваты, гидраты и пролекарства, описанные выше, при условии, что когда -NRR1 является -NH2, защищенным амино или ациламино, R3 обозначает трет-бутил и R4 обозначает амино или алкиламино, тогда R2 не является изобутилом.
3. Соединение по п.2, в котором
R2 обозначает изобутил,
R3 обозначает фенилметил и
W, R, R1 и R4 имеют значения, указанные в п.2.
4. Соединение по п.2, в котором
R2 обозначает изобутил;
R3 обозначает 4-фторфенилметил, 4-гидроксифенилметил, 4-метоксифенилметил; либо
R3 выбирают из группы, включающей фенил, пиридил, тиазолил, тиенил, пиридилметил, тиазолилметил, тиенилметил, хинолилметил, изохинолилметил, 1-нафтилметил, 2-нафтилметил, индолилметил, N-метилендолилметил, имидазолилметил, включая их производные, замещенные в фенильном, пиридильном, тиазолильном, тиенильном, хинолильном или изохинолильном кольце одним или двумя заместителями, выбираемыми из хлора, фтора, гидрокси, метокси, метила, этила, трет-бутила, -ОСН2СООН; либо
R3 является циклогексилом или циклогексилметилом; либо
R3 выбирают из -С(СН3)2OСН3, -С (СН3)2SСН3, -С(СН3)2SOСН3, -С(СН3)2SO2СН3, -СН(СН3)ОН, -СН(СН3)ОМе, -СН(СН3)O-изопропила, -СН(СН3)O-трет-бутила, С(СН3)2СH2OН, -(СH2)3ОН; либо
R3 является группой, выбираемой из -СН(C6Н5)2, -С(СН3)2C6Н5, -СН(СН3)ОРh, -СН(СН3)OCH2Ph, включая их производные, замещенные в фенильном кольце (кольцах) одним или двумя заместителями, выбираемыми из хлора, фтора, гидрокси, метокси, метила, этила, пропила или трет-бутила; либо
R3 и R4, вместе взятые, образуют группу формулы -(CH2)10-NH или группу формулы (В) или (С), где n равен 6; и
W, R, R1 и R4 имеют значения, указанные в п.2.
5. Соединение по п.2, в котором R2 обозначает C7-C15алкил с линейной цепью; либо
R2 обозначает циклопентилметил; либо
R2 обозначает циннамил, бензил, (фенил)этил, (фенил)пропил,(фенил)бутил, 4-фенил-3-бутенил, 4-фенил-3-бутинил, (фенил)пентил, (фенокси)метил, (фенокси)этил, (фенокси)пропил, (фенокси)бутил, (фенокси)пентил, (бензиламинокарбонил)пропил, фенилтио, (фенилтио)метил, (фенилтио)этил, (фенилтио)пропил, фенилсульфонил, (фенилсульфонил)метил, (фенилсульфонил)этил, (фенилсульфонил)пропил, включая их производные, в которых бензольное кольцо замещено предпочтительно в пара-положении метилом, этилом, пропилом, изопропилом, бутилом, изобутилом, гидрокси, метокси, хлором, фтором, трифторметилом, фенилом, фторфенилом, метоксифенилом, метилфенилом, этилфенилом, пропилфенилом, бутилфенилом; и
W, R, R1, R3 и R4 имеют значения, указанные в п.2.
6. Соединение по п.2, в котором R4 обозначает NH-арил или NH-гетероциклил, где арил и гетероциклил имеют значения, указанные в п.2, и могут быть не замещены или замещены одним-тремя заместителями, выбираемыми из метила, этила, фтора, хлора и метокси; либо
R4 обозначает O-алкил, где алкил является C1-C4алкильной группой с прямой или разветвленной цепью, такой как метил, этил и трет-бутил, или O-фенил и его производные, замещенные одним-тремя заместителями, выбираемыми из C1-C4алкила с прямой или разветвленной цепью, хлора и метокси; и
W, R, R1, R2 и R3 имеют значения, указанные в п.2.
7. Фармацевтическая композиция, которая содержит соединение по любому из пп.1-6 и фармацевтически приемлемый разбавитель или носитель.
Текст
1 Настоящее изобретение относится к новым ингибиторам матриксных металлопротеиназ(далее ММР) и к содержащим их фармацевтическим композициям. Указанные соединения могут найти применение для профилактики, контроля и лечения болезней, вызываемых протеолитическим действием ММР. Кроме того, поскольку описываемые здесь соединения ингибируют высвобождение из клеток фактораальфа опухолевого некроза (далее TNF), фармацевтические композиции, содержащие указанные соединения, могут быть также использованы для лечения или профилактики воспалительных, иммунологических или инфекционных болезней, вызываемых таким цитокином. Низкомолекулярные соединения, способные ингибировать одну или несколько матриксных металлопротеиназ, таких как стромелизин-1(ММР-13) и металлопротеиназы мембранного типа (в частности, МТ-ММР-1; ММР-14), в настоящее время считаются перспективными лекарственными средствами для лечения дегенеративных, онкологических и аутоиммунных патологий (например, Р.D. Brown: "Matrix metalloproteinase inhibitors: A new class of anticancerA. Krantz: "Proteinases in Inflammation",Annu.Rep.Med.Chem., 28:187-195, 1993). Многие описываемые здесь соединения являются производными пептидов или псевдопептидами,имеющими сходство с известными пептидными субстратами этих ферментов; помимо этого, они характеризуются наличием функциональной группы, способной связывать атом Zn(II), находящийся в каталитическом сайте указанных ферментов. К известным классам ингибиторов ММР относятся соединения, в которых Znсвязывающая группа является карбоновой или гидроксамовой кислотой, входящей в (замещенную) часть янтарной кислоты, в частности сукцинамид с аминокислотой, который, в свою очередь, получают в виде первичного или вторичного амида, например, соединений общей формулы (А) где W является -СО 2 Н или -CONHOH и Ra, Rb,Rc и Rd являются атомами водорода или соответствующими заместителямиCurrent status", Curr. Med. Chem. 2:743-762,1995; R.P. Beckett et al., "Recent advances in matrix metalloproteinase research", DDT 1:16-26,1996). Кроме того, известно, что соединения общей формулы (А), в которой W является-CONHOH, способны ингибировать высвобождение TNF из предшественника, связанного клеточной мембраной, про-TNF (например, G.M.factor-alpha processing by a metalloproteinase inhibitor", Nature 370:558-561,1994). Хотя уже на протяжении 20 лет известно,что на матриксные металлопротеиназы можно воздействовать лекарственными средствами, и ингибиторы ММР общей формулы (А) были описаны в 1986 г. или раньше (например, см.J.P. Dickens et al., патент США 4599361), такие лекарственные средства до сих пор не поступили на рынок сбыта. Терапевтический потенциал ингибиторов ММР не подлежит сомнению, поэтому сложности, связанные с практическим применением, скорее всего, вызваны недостатками соединений "первого поколения",относящимися к таким показателям, как эффективность, избирательность, водорастворимость,продолжительность действия in vivo, биологическая доступность при пероральном введении и потенциальная токсичность указанных ингибиторов (например, J.R. Porter., см. выше; J.Hodgson, "Remodelling MMMPIs", Biotechnology 13:554-557, 1995). Кроме того, до сих пор не установлена истинная роль каждой отдельной ММР в возникновении многих болезней. Таким образом, существует насущная необходимость в более разнообразных и эффективных соединениях с учетом вышеуказанных свойств. Как указывалось выше, в научной литературе, патентах и опубликованных заявках на патент описано большое количество ингибиторов ММР общей формулы (А), в которой W является -СООН или -CONHOH. При описании каждого соединения общей формулы (А) особое внимание уделяется трудноуловимым различиям в характере заместителей Ra-Rd. Соотношение между уровнем активности, степенью специфичности к отдельным ММР, физикохимическими и фармакокинетическими свойствами указанных соединений может изменяться непредсказуемым образом при изменении заместителей Ra-Rd. Описано много соединений с разными возможными значениями Ra-Rd, но при этом весьма поверхностно исследованы соединения формулы (А), в которой Ra не является водородом. В частности, практически не рассмотрен класс соединений формулы (А), в которой Ra является гетероатомом или его производным, за исключением конкретного препарата, проходящего клинические исследования,который содержит соединение указанного класса, где Ra является гидрокси, British Biotechnology BB-2516 (этот препарат известен также как 3 общей формулы (I), оказывающих сильное биохимическое действие на матриксные металлопротеиназы, такие как стромелизин, желатиназа и коллагеназа, и обладающих физико-химическими и фармакокинетическими свойствами,которые делают эти соединения пригодными для использования в качестве лекарственных средств для лечения разных заболеваний, возникающих вследствие нерегулируемой активности таких ММР; кроме того, обнаружено, что многие подобные соединения эффективно ингибируют высвобождение фактора-альфа опухолевого некроза (TNF) из предшественника клеточной мембраны, про-TNF; также разработан удобный и стереоизбирательный способ получения указанных соединений из выпускаемых промышленностью промежуточных продуктов. Объектом настоящего изобретения являются соединения формулы (I)R1 обозначает водород или низший алкил, в частности метил, этил,пропил, изопропил, изобутил, трет-бутил; арил,в частности фенил и нафтил; и арил(низший алкил), в частности бензил; причем эти группы могут быть не замещены или замещены одним или несколькими заместителями, имеющими одинаковые или разные значения, которые выбирают из группы, включающей метил, этил,изопропил, трет-бутил, фтор, хлор, бром, нитро,амино, диметиламино, гидрокси, метокси, этокси, ацетил, ацетамидо, карбокси, карбоксиметил; либо-(СН 2)m-гетероциклил или -(СН 2)m-циклопропил, где m равен нулю или целому числу от одного до трех, и гетероциклил является 3-6 членным гетероциклильным кольцом, которое не конденсировано или конденсировано с бензолом или нафталиновым кольцом, имеющим,по крайней мере, один атом азота; такими группами, предпочтительно, являются сукцинимидо,фталимидо, сахарин, гидантоин, индолил, оксииндолил, 2-оксоизоиндолинил, имидазолил, пиридил, морфолино, пирролидино, 2-оксопирролидино, пиперазино; причем указанная гетероциклильная группа может быть не замещена или замещена одним или несколькими заместителями, выбранными из группы, включающей бром,хлор, фтор, метокси, этокси, метил, этил, бензил, фенил, гидрокси, оксо, карбокси и нитро; либо группу -(СН 2)nСООН или -(CH2)mCOOR1,где n может быть равен 1, 2 или 3, m может 4 быть равен 0, 1, 2 или 3, и R1 обозначает метил,этил, пропил, изопропил, изобутил, трет-бутил,фенил, бензил, аллил, стирил, 1-нафтил, 2 нафтил, причем указанные группы могут быть не замещены или замещены одним-тремя заместителями, выбранными из группы, включающей метил, этил, изопропил, трет-бутил, фтор, хлор,бром, нитро, амино, диметиламино, гидрокси,метокси, этокси, ацетил, ацетамидо, карбокси,карбоксиметил; либо группу, выбранную из -(СН 2)mSО 2R1,-(CH2)mSO2NH2, -(CH2)mSO2N(Me)2, -(CH2)mSO2NHR1, где m, R1 и возможные заместители группы R1 имеют указанные выше значения, или-(СН 2)mSО 2-(4-морфолино), -(СН 2)mSO2-(1-пиперазино),-(СН 2)mSO2-(4-метил-1-пиперазино); либо группу -(СН 2)nSO3 Н, где n имеет указанные выше значения; ацил, в частности ацетил, бензоил или фенацетил, которые могут быть не замещены или замещены одним или несколькими заместителями, выбранными из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил,бензил, фенил, гидрокси, оксо, карбокси и нитро; либо группу -С(О)-RII-C(О)RIII, где -RII- обозначает химическую связь, -СН 2-, -CH2(CH2)mCH2-,где m имеет указанные выше значения,-СН=СН-, -СН 2 СН=СН-, фенилен (т.е. -С 6H4-),-СН 2 СН=СН-С 6H4-, -CH2CH2CH=CH-, CH2-CC-,-СН 2 СН 2-СС-, -СН 2 СН 2 СН=СН-C6 Н 4-, -СН 2-ССС 6 Н 4-, -СН 2 СН 2-СС-С 6 Н 4, и RIII выбирают из группы, включающей метил, этил, фенил, гидрокси, метокси, этокси, амино, метиламино,диметиламино и морфолино; либо-С(О)-гетероциклил, где гетероциклил имеет указанные выше значения; причем указанная гетероциклильная группа может быть не замещена или замещена одним или несколькими заместителями, выбранными из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил, бензил, фенил, гидрокси, оксо, карбокси и нитро; либо-С(О)-RII-гетероциклил или -С(О)-RII-арил,где RII, гетероциклил, арил и возможные заместители такого гетероциклила или арила имеют указанные выше значения; либоR2 обозначает С 3-C15 алкил с линейной или разветвленной цепью, который может быть не замещен или замещен С 3-С 7 циклоалкильной группой; либоR2 обозначает группу -RII-H, где RII имеет указанные выше значения, которая может быть не замещена или замещена одним-тремя заместителями, выбранными из группы, включающей метил, этил, С 3-С 4 алкил с линейной или разветвленной цепью, фтор, хлор, C1-C4 алкокси, 5 нитро, амино, диметиламино, карбокси, карбоксиметил; либоR2 является группой -RII-X-RIV, где RII имеет указанные выше значения, RIV обозначает C1 С 6 алкил, C2-C6 алкенил, фенил, фенил-(C1C6)алкил или фенил (C2-C6)алкенил, который может быть не замещен или замещен группой,выбранной из F, Cl, Br, C1-C4 алкила, C1C4 алкокси, и Х обозначает прямую связь, атом кислорода, атом серы, сульфинил-S(O)-, сульфонил-S(O)2 или карбамоильную группуR3 обозначает характеристическую группу природной или неприродной альфа-аминокислоты, в которой любая функциональная группа, если она имеется, может быть защищена; в том числе C1-C9 алкил с прямой или разветвленной цепью, С 2-С 6 алкенил, С 3-С 7 циклоалкил, фенил, индолил, нафтил, адамантил; или С 3-С 7 циклоалкил (C1-С 6)алкил, фенил (C1 С 6)алкил, нафтил (C1-С 6)алкил, индолил-(C1C6)алкил, где алкильная, алкенильная, циклоалкильная, фенильная, индолильная и нафтильная группы могут быть замещены этилом, метилом,гидрокси, меркапто, карбокси, C1-C6 алкокси,фенокси, бензилокси, C1-С 6 алкилтио, фенилтио,бензилтио,C1-C6 алкилсульфинилом,C1C6 алкилсульфонилом, фенилсульфонилом, бензилсульфонилом, амино, моно-(C1-C6)алкиламино, ди-(С 1-С 6)алкиламино, гуанидино;R4 обозначает O-алкил, где алкил является С 1-С 4 алкильной группой с прямой или разветвленной цепью, в частности метилом, этилом и трет-бутилом, или O-фенил и его производные,замещенные одним-тремя заместителями, выбранными из C1-C4 алкила с прямой или разветвленной цепью, хлора и метокси; либоR4 обозначает -NH(C1-C6 алкил), замещенный фенилом или гетероциклилом; либо-CONH2,-NHCONH2, -SO2NH2, -NHSO2NH2, ее производными, в которых концевой атом азота замещен одной или двумя метильными группами,или ее производными, в которых концевой атом азота является частью морфолинового, пирролидинового, пиперазинового или N-метилпиперазинового кольца; либоR3 и R4, вместе взятые, обозначают группу формулы -(СН 2)m-NH-, где m является целым числом от 5 до 12, необязательно прерываемую группой -NR5-, в которой R5 выбирают из водорода,C1-C6 алкила, C1-C6 алкоксикарбонила, арила, арил(C1-C6)алкила или арил(C1-C6)алкоксикарбонила, или прерываемую группой -C6H4-O 001432 6 или индольным кольцом, присоединенным атомами С-3 и азота; при этом алкил, алкенил, фенил, бензил,циклоалкил, гетероциклил, фенил(C1-C6)алкил,фенил(C2-C6)алкенил,гетероциклил(C1-C6)алкил, циклоалкил(C1-C6)алкил в любом из приведенных выше определений R, R1, R2, R3, R4 и А могут быть не замещены или замещены одним или несколькими заместителями, указанными ниже; а также их соли, сольваты и гидраты; при условии, что когда -NRR1 является -NH2,защищенным амино или ациламино, R3 обозначает трет-бутил и R4 обозначает амино или алкиламино, тогда R2 не является изобутилом. Термин "алкил" означает алкильную часть с прямой или разветвленной цепью, имеющую 1-9 атомов углерода, например метил, этил,пропил, изопропил, н-бутил, изобутил, вторбутил, трет-бутил, н-пентил, изопентил, нгексил и другие. Термил "алкенил" означает алкенильную часть с прямой или разветвленной цепью,имеющую 2-6 атомов углерода, и, когда это возможно, дополнительно одну двойную связь со стереохимической структурой типа Е или Z. Примерами алкенильных групп являются винил,аллил, 1-пропенил, 1-бутенил, 2-бутенил, металлил, кротил и другие. Термин "арил" означает моноциклическую или бициклическую ароматическую углеводородную группу с 6-10 атомами углерода, такую как фенил, нафтил, инданил. Термин "циклоалкил" означает насыщенную карбоциклическую группу с 3-7 атомами углерода, такую как циклопропил, циклобутил,циклопентил, циклогексил, циклогептил. Термин "гетероциклил" означает 3-7 членное насыщенное или ненасыщенное гетероциклильное кольцо, имеющее, по крайней мере, один гетероатом, выбранный из О, S и N; при этом любой атом азота в кольце может быть окислен как N-оксид, любой атом углерода в кольце может быть окислен как карбонил и любой атом серы в кольце может быть окислен как сульфоксид или сульфон; и указанное гетероциклильное кольцо может быть конденсировано со вторым 5- или 6-членным насыщенным или ненасыщенным гетероциклильным кольцом, с С 3-С 7 циклоалкильным кольцом, с бензольным или нафталиновым кольцом. Примерами гетероциклильных групп являются пирролил, пиразолил, имидазолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, тиадиазолил, тиенил, фурил, азиридинил, оксиранил, азетидинил, сукцинимидо, пиридил, пиразинил, пиримидинил, пиранил, пиридазинил,гидантоинил, морфолинил, тиоморфолинил,диоксанил, дитианил, азепинил и другие. Когда арильная или гетероциклильная группа в приведенном выше определении "арила" и "гетероциклила" конденсирована со вто 7 рым кольцом, то таким кольцом может быть фенил, С 4-С 7 циклоалкил или 3-7-членное насыщенное или ненасыщенное гетероциклильное кольцо, имеющее один-три гетероатома, выбранные из О, S и N; при этом любой атом азота в кольце может быть окислен как N-оксид, любой атом углерода в кольце может быть окислен как карбонил и любой атом серы в кольце может быть окислен как сульфоксид или сульфон. Примерами таких конденсированных арильных или гетероциклильных групп являются бензотиенил, бензотиазолил, бензоксазолил, изобензофуранил, бензофуранил, хроменил, индолил,оксиндолил, фталимидо, хинолил, изохинолил,индолизинил, изоиндолил, 2-оксоизоиндолил,сахаринил, циннолинил, индазолил, пуринил,циклопентилфенил, циклогексилфенил, циклопентилпиридил, 1,3-бензодиоксол и другие. Такие бициклические кольца могут быть присоединены к остальной части молекулы с помощью атомов в одном или другом кольце; например,циклогексилпиридильный заместитель включает как циклогексильную группу, конденсированную с пиридильным кольцом, так и пиридильную группу, конденсированную с циклогексильным кольцом. Термин "боковая цепь природной аминокислоты" означает боковые цепи аланина,аргинина, аспарагина, аспарагиновой кислоты,цистеина, глутамина, глутаминовой кислоты,глицина, гистидина, изолейцина, лейцина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина, валина и пеницилламина. Термин "боковая цепь неприродной аминокислоты" означает боковую цепь известных -аминокислот, не относящихся к категории "природных -аминокислот", таких как амино-н-масляная кислота, -амино-н-пентановая кислота, -амино-н-гексановая кислота,-аминонеогексановая кислота,-аминонеогептановая кислота, S-метилпеницилламин,его сульфоксиды и сульфон, трет-бутилглицин,фенилглицин, (дифенилметил)глицин, циклогексилаланин, гомофенилаланин, гомоцистеин,гомосерин, аллоизолейцин, аллотреонин, 3,4 дигидроксифенилаланил, 5-гидроксилизин, 4 гидроксипролин, орнитин и тому подобные. Алкил, алкенил, фенил, бензил, циклоалкил, гетероциклил, фенил(C1-C6)алкил, фенил(С 2-C6)алкенил, гетероциклил(C1-C6)алкил, циклоалкил(C1-C6)алкил, входящие в объем вышеуказанных определений R, R1, R2, R3, R4 и А,могут иметь следующие заместители:- меркапто (т.е.-SH) и его ацетиловый или фенилацетиловый эфиры (т.е. -SСОСН 3 иR и RVI, которые имеют одинаковые или разные значения, обозначают C1-C6 алкильную группу с прямой или разветвленной цепью, фенил, необязательно замещенный C1-C6 алкильной или фенил(C1-C6 алкильной) группами; или RV и RVI вместе с атомом азота образуют кольцо, такое как пиперидино, морфолино,пирролидино или пиперазино, и могут быть замещены любыми указанными здесь заместителями);- карбокси (т.е. -СООН), его сложные эфиры (т.е. -COORV) или амиды (т.е. -CONRVRVI),где RV и RVI имеют указанные выше значения,включая морфолиноамиды, пирролидиноамиды и карбоксиметиламиды -CONHCH2COOH;- ацил, т.е. -С(O)RV, где RV имеет указанные выше значения, включая монофторацетил,дифторацетил, трифторацетил;- ацилокси, т.е. -OC(O)RV, где RV имеет указанные выше значения, или формилокси;-NHC(O)ORV, где RV имеет указанные выше значения или является группой -(СН 2)tСООН,где t равен 1, 2 или 3;- уреидо, т.е. -NH(CO)NH2, -NH(CO)NHRV,-NH(CO)NRVRVI, где RV и RVI имеют указанные выше значения, включая -NH(CO)-(4-морфолино), -NH(СО)-(1-пирролидино), -NH(СО)-(1 пиперазино),-NH(СО)-(4-метил-1-пиперазино);- сульфонамидо, т.е. -NHSO2RV, где RV имеет указанные выше значения;- группу -(CH2)tCOOH, ее сложные эфиры и амиды, т.е. -(CH2)tCOORV и -(CH2)tCONH2,-(СН 2)tCONHRV, -(СН 2)tCONRVRVI, где t, RV иRVI имеют указанные выше значения;- группу -NH(SO2)NH2, -NH(SO2)NHRV,-NH(SO2)NRVRVI, где RV и RVI имеют указанные выше значения, включая -NН(SО 2)-(4-морфолино), -NH(SO2)-(1-пирролидино), -NH(SO2)-(1 пиперазино), -NH(SO2)-(4-метил-1-пиперазино);- группу -OC(O)ORV, где RV имеет указанные выше значения;- группу -ОRV, где RV имеет указанные выше значения, включая -ОСН 2 СООН;- группу -SRV, где RV имеет указанные выше значения, включая -SCH2COOH;- группу -S(O)RV, где RV имеет указанные выше значения;- группу -S(O2)RV, где RV имеет указанные выше значения;-SO2NRVRVI, где RV и RVI имеют указанные выше значения;- замещенный метил, выбранный из группы, включающей хлорметил, фторметил, дифторметил, трифторметил, аминометил, N,Nдиметиламинометил, азидометил, цианометил,карбоксиметил, сульфометил, карбамоилметил,карбамоилоксиметил, гидроксиметил, алкоксикарбонилметил, гуанидинометил. Карбоксильные, гидроксильные, тиольные и аминогруппы можно использовать в свободной или защищенной форме. Защищенными формами указанных групп являются любые группы, хорошо известные в этой области и описанные, например, Т.В. Грином (T.W.Greene, "Protective Groups in Organic Chemistry",Wiley Interscience). Карбоксильные группы предпочтительно защищают в виде их сложных эфиров, таких как метиловый, этиловый, третбутиловый, бензиловый и 4-нитробензиловый эфиры. Защищенные гидроксильные, тиольные и аминогруппы предпочтительно имеют форму сложных эфиров, тиоэфиров и производных амида и соответственно являются ацетатами,тиоацетатами и ацетамидами. В объем настоящего изобретения входят соли соединений формулы (I), имеющих солеобразующие группы, в частности соли соединений, имеющих карбоксильную группу, Nгидроксикарбамоильную группу и сульфогруппу, или соли соединений, имеющих основную группу, например амино- или гуанидиногруппу. К указанным солям относятся физиологически приемлемые соли, например соли щелочных металлов или соли щелочно-земельных металлов (например, соли натрия, калия, лития, кальция и магния), соли аммония и соли, получаемые при взаимодействии с соответствующим органическим амином или аминокислотой (например, соли аргинина и прокаина) и соли присоединения, получаемые при взаимодействии с приемлемыми органическими или неорганическими кислотами (например, гидрохлориды,гидробромиды, сульфаты, фосфаты) либо с карбоновыми и сульфоновыми органическими кислотами (например, ацетаты, цитраты, сукцинаты, малонаты, лактаты, тартраты, фумараты,малеаты, метансульфонаты, паратолуолсульфонаты). Некоторые соединения формулы (I),которые содержат карбоксилат и аммониевую группу, могут существовать в виде цвиттерионов; такие соли также входят в объем настоящего изобретения. Кроме того, в объем настоящего изобретения входят гидраты, сольваты соединений формулы (I) и физиологически гидролизуемые производные (т.е. пролекарства) соединений формулы (I). Особенно предпочтительными пролекарствами соединений формулы (I) являются сложноэфирные производные. К ним относятся сложные эфиры соединений формулы (I), где W обозначает -СООН или любой из заместителей 10 получают путем конденсации такой карбоксильной группы с фармацевтически приемлемым спиртом, например этанолом; или сложные эфиры соединений формулы (I), где любой из заместителей R, R1-R4 имеет гидроксильную группу, которые получают путем конденсации такой гидроксильной группы с фармацевтически приемлемой карбоновой кислотой, например уксусной, пивалиновой, бензойной и подобными кислотами. Другими особенно предпочтительными пролекарствами по настоящему изобретению являются продукты циклоконденсации соединений формулы (I), где W обозначает -CONHOH и R обозначает водород, с фармацевтически приемлемым альдегидом общей формулы Т-СНО или кетоном общей формулыTT'CO, где Т и Т' являются углеродными радикалами, такими как низший алкил, фенил, бензил. Приведенные ниже продукты конденсации получают, смешивая два компонента и выпаривая воду. В объем настоящего изобретения входят также фармацевтические композиции, содержащие одно или несколько соединений (I) в качестве активных ингредиентов в сочетании с используемыми по желанию фармацевтически приемлемыми носителями, наполнителями и другими добавками. Предпочтительные соединения по настоящему изобретению имеют формулу (I')R1 обозначает водород или: низший алкил, в частности, метил, этил,пропил, изопропил, изобутил, трет-бутил; арил,в частности, фенил и нафтил; и арил(низший алкил), в частности бензил; причем эти группы могут быть не замещены или замещены одним или несколькими заместителями, имеющими одинаковые или разные значения, которые выбирают из группы, включающей метил, этил,изопропил, трет-бутил, фтор, хлор, бром, нитро,амино, диметиламино, гидрокси, метокси, этокси, ацетил, ацетамидо, карбокси, карбоксиметил; либо- (СН 2)m-гетероциклил или -(СН 2)mциклопропил, где m равен нулю или целому числу от одного до трех, и гетероциклил являет 11 ся 3-6-членным гетероциклильным кольцом,которое не конденсировано или конденсировано с бензолом или нафталиновым кольцом, имеющим, по крайней мере, один атом азота; такими группами предпочтительно являются сукцинимидо, фталимидо, сахарин, гидантоин, индолил,оксииндолил, 2-оксоизоиндолинил, имидазолил,пиридил,морфолино,пирролидино,2 оксопирролидино, пиперазино; причем указанная гетероциклильная группа может быть не замещена или замещена одним или несколькими заместителями, выбранными из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил, бензил, фенил, гидрокси, оксо, карбокси и нитро; либо группу -(СН 2)nСООН или -(CH2)mCOOR1,где n может быть равен 1, 2 или 3, m может быть равен 0, 1, 2 или 3 и R1 обозначает метил,этил, пропил, изопропил, изобутил, трет-бутил,фенил, бензил, аллил, стирил, 1-нафтил, 2 нафтил, причем указанные группы могут быть не замещены или замещены одним-тремя заместителями, выбранными из группы, включающей метил, этил, изопропил, трет-бутил, фтор, хлор,бром, нитро, амино, диметиламино, гидрокси,метокси, этокси, ацетил, ацетамидо, карбокси,карбоксиметил; либо группу-(CH2)mCONHR1, где m, R1 и возможные заместители группы R1 имеют указанные выше значения, -(СН 2)m-СО-(4-морфолино), -(СН 2)m-СО(1-пиперазино) и-(СН 2)m-СО-(4-метил-1 пиперазино); либо группу, выбранную из -(CH2)m, SO2R1,-(CH2)mSO2NH2, -(CH2)mSO2N(Me)2, -(CH2)mSO2NHR1, где m, R1 и возможные заместители группы R1 имеют указанные выше значения,-(CH2)mSO2(4-морфолино), -(СH2)mSO2(1-пиперазино) и -(СH2)mSO2(4-метил-1-пиперазино); либо группу -(СH2)nSО 3 Н, где n имеет указанные выше значения; ацил, в частности ацетил, бензоил или фенацетил, которые могут быть не замещены или замещены одним или несколькими заместителями, выбранными из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил,бензил, фенил, гидрокси, оксо, карбокси и нитро; либо группу -C(O)-RII-C(O)RIlI, где -RIIобозначает химическую связь,-CH2-,-СH2(CH2)mCH2-, где m имеет указанные выше значения, -СН=СН-, -СH2 СН=СН-, фенилен (т.е.-С(О)-гетероциклил, где гетероциклил имеет указанные выше значения; причем указанная гетероциклильная группа может быть не замещена или замещена одним или несколькими-С(О)-RII-гетероциклил или -С(О)-RII-арил,где RII, гетероциклил, арил и возможные заместители указанного гетероциклила или арила имеют указанные выше значения; либоR2 обозначает С 3-C15 алкил с линейной или разветвленной цепью, который может быть не замещен или замещен С 3-С 7 циклоалкильной группой; либоR2 обозначает группу -RII-H, где RII имеет указанные выше значения, которая может быть не замещена или замещена одним-тремя заместителями, выбранными из группы, включающей метил, этил, С 3-С 4 алкил с линейной или разветвленной цепью, фтор, хлор, C1-C4 алкокси,нитро, амино, диметиламино, карбокси, карбоксиметил; либоR2 является группой -RII-X-RIV, где RII имеет указанные выше значения, -Х- обозначает прямую связь, -О-, -S-, -SO-, SO2, -CONH- или-NHCO-; RIV обозначает C1-C6 алкил, C2C6 алкенил, метил, этил, пропил, бутил, фенил или бензил, при этом бензольное кольцо фенильной и бензильной групп быть не замещено или замещено одним или несколькими заместителями, выбранными из группы, включающей метил, этил, пропил, бутил, гидрокси, метокси,этокси, хлор, фтор, трифторметил или нитро;R3 обозначает фенилметил, циклогексилметил, изобутил, трет-бутил, -С(СН 3)2C6 Н 5,-С(СН 3)2OСН 3, -С(СН 3)2SСН 3, -С(СН 3)2SОСН 3,-С(СН 3)2SO2 СН 3, -СН(C6 Н 5)2, -СН(СН 3)ОН,-СН(СН 3)ОМе, -СН(СН 3)O-изопропил,-СН(СН 3)O-трет-бутил, -СН(СН 3)ОРh,-СН(СН 3)OCH2Ph, (4-метокси)фенилметил, (4 гидрокси)фенилметил,индолилметил,(Nметил) индолилметил, 1-нафтилметил, 2-нафтилметил,(4-карбоксиметокси)фенилметил, циклогексил,фенил, пиридил, тиазолил, тиенил, пиридилметил, тиазолилметил, тиенилметил и их производные, в которых любая фенильная, пиридильная, тиазолильная и тиенильная группа замещена хлором, фтором, метокси или C1-С 3 алкилом;C1-C4 алкильной группой с прямой или разветвленной цепью, такой как метил, этил и третбутил, или O-фенил и его производные, замещенные одним-тремя заместителями, выбранными из C1-C4 алкила с прямой или разветвленной цепью, хлора и метокси; либоR4 обозначает -NH2 или -NH-алкил, где алкил выбирают из метила, этила, пропила, бутила, изопропила, изобутила, втор-бутила, третбутила; причем указанные алкильные группы с 13 линейной или разветвленной цепью могут быть не замещены или замещены группой, выбираемой из фенила, бензила, 2-пиридила, 3 пиридила, 1,3,4-тиадиазолил-2-ила, 2-тиазолила; эти группы в свою очередь могут быть не замещены или замещены заместителем, выбранным из метила, этила, метокси, амино, метиламино,диметиламино, карбокси, метоксикарбонила,этоксикарбонила, -SO2NH2, -SO2NHC6H5, -SO2 морфолино, -SO2CH3, -CONH2, -СО-морфолино; либоR4 является группой -NHCH2CH2Y,-NHCH2CH2CH2Y,-NHCH2CH2CH2CH2Y,-NНСH2 СН(СН 3)Y или -NHCH2C(СН 3)2Y, где Y обозначает амино, метиламино, диметиламино,морфолино, пирролидино, пиперазино, Nметилпиперазино, гидрокси, метокси, этокси,метилтио, 2-(диметиламино)этилтио, 2-(морфолино)этилтио, Cl, F, Вr, фенокси или фенилтио,где фенильное кольцо может быть замещено гидрокси или метокси; либоR4 обозначает -NН-арил, -NH-гетероциклил, -NН-СН 2-арил, -NH-(СН 2)2-арил, -NНСН 2-гетероарил или NH-(СН 2)2-гетероциклил,где арильную группу выбирают из группы,включающей фенил,4-фторфенил,4 метоксифенил, 1,3-бензодиоксолил, 4-толил, 1 инданил, 5-инданил, и гетероциклильную группу выбирают из группы, включающей 2 бензимидазолил, 2-бензотиазолил, 1-бензотриазолил, 2,5-диметил-1-пирролидинил, 2,6-диметилпиперидинил, 2-имидазолил, 1-индолил, 5 индолил, 5-индазолил, 1-изохинолил, 5-изохинолил,2-метокси-5-пиридил,1-метил-2 бензимидазолил,4-метил-7-кумаринил,3 метил-5-изотиазолил,5-метил-3-изоксазолил,пиразинил, 3-пиразолил, 2-пиридил, 3-пиридил,4-пиридил, 2-пиримидинил, 3-хинолил, 5-тетразолил, 1-метил-5-тетразолил, 1,3,4-тиадиазол-2 ил, 2-тиазолил, 1,2,4-триазин-3-ил и 1,2,4 триазол-3-ил; либоR4 обозначает -NН(С 2-C6 алкил), где алкильная группа замещена заместителем, выбранным из -CONH2, -CONHMe, -NHCONH2,-NHCONMe2, NHCO-(4-морфолино), -NHCO-(4 метил-1-пиперазино), -NHSO2NH2, -NHSO2R3 и R4, взятые вместе, обозначают группу формулы -(СH2)10-NH- или группу формулыR3 и R4, взятые вместе, обозначают группу нижеследующей формулы (В) 14 или группу нижеследующей формулы (С): где n является целым числом от 3 до 6; а также их фармацевтически приемлемые соли,сольваты, гидраты и пролекарства, описанные выше; при условии, что когда -NRR1 является-NH2, защищенным амино или ациламино, R3 обозначает трет-бутил и R4 обозначает амино или алкиламино, тогда R2 не является изобутилом. Предпочтительную группу соединений по настоящему изобретению составляют соединения формулы (I'), в которойR3 обозначает фенилметил; и W, R, R1 и R4 имеют указанные выше значения. Конкретные примеры соединений, входящих в указанную предпочтительную группу,представлены в нижеследующей таблице I: Таблица I Другую предпочтительную группу соединений по настоящему изобретению составляют соединения формулы (I'), в которойR3 выбирают из группы, включающей фенил, пиридил, тиазолил, тиенил, пиридилметил,тиазолилметил, тиенилметил, хинолилметил,изохинолилметил, 1-нафтилметил, 2-нафтилметил, индолилметил, N-метилиндолилметил,имидазолилметил, а также их производные, замещенные в фенильном, пиридильном, тиазолильном, тиенильном, хинолильном или изохинолильном кольце одним или двумя заместителями, выбранными из хлора, фтора, гидрокси,метокси,метила,этила,трет-бутила,-ОСН 2 СООН; либоR3 обозначает циклогексил или циклогексилметил; либо R3 выбирают из -С(СН 3)2OСН 3,-С(СН 3)2SСН 3, -С(СН 3)2SОСН 3, -С(СН 3)2SO2 СН 3, -СН(СН 3)ОН, -СН(СН 3)ОМе, -СН(СН 3)Oизопропила, -СН(СН 3)O-трет-бутила, -С(СН 3)СН 2 ОН, -(СH2)3 ОН; либо-С(СН 3)2-C6 Н 5,-СН(СН 3)ОРh,-CH(C6H5)2,-СН(СН 3)OCH2Ph, включая их производные,замещенные в фенильном кольце(кольцах) одним или двумя заместителями, выбранными из хлора, фтора, гидрокси, метокси, метила, этила,пропила или трет-бутила; либоR3 и R4, вместе взятые, образуют группу формулы -(CH2)10-NH- или группу вышеуказанной формулы (В) или (С), где n равен 6; и W, R, R1 и R4 имеют указанные выше значения. Конкретные примеры соединений, входящих в указанную предпочтительную группу,представлены в нижеследующей таблице II: Другую предпочтительную группу соединений по настоящему изобретению составляют соединения вышеуказанной формулы (I'), в которойR2 обозначает циннамил, бензил, (фенил)этил, (фенил)пропил, (фенил)бутил, 4 фенил-3-бутенил,4-фенил-3-бутинил,(фенил)пентил, (фенокси)метил, (фенокси)этил,(фенокси)пропил, (фенокси)бутил, (фенокси) пентил, (бензиламинокарбонил)пропил, фенилтио, (фенилтио)метил, (фенилтио)этил, (фенилтио)пропил, фенилсульфонил, (фенилсульфонил)метил, (фенилсульфонил)этил, (фенилсульфонил)пропил и их производные, в которых бензольное кольцо замещено, предпочтительно в пара-положении, метилом, этилом, пропилом,изопропилом, бутилом, изобутилом, гидрокси,метокси, хлором, фтором, трифторметилом, фенилом, фторфенилом, метоксифенилом, метилфенилом, этилфенилом, пропилфенилом, бутилфенилом; и W, R, R1, R3 и R4 имеют указанные выше значения. Конкретные примеры соединений,входящих в указанную предпочтительную группу, представлены в нижеследующей таблице III: Таблица III Еще одну предпочтительную группу соединений по настоящему изобретению составляют соединения вышеуказанной формулы (I'),в которойR4 обозначает NН-арил или NHгетероциклил, где арил и гетероциклил имеют указанные выше значения и могут быть не замещены или замещены одним-тремя заместителями, выбираемыми из метила, этила, фтора,хлора и метокси; либоC1-C4 алкильной группой с прямой или разветвленной цепью, такой как метил, этил и третбутил, или O-фенил и его производные, замещенные одним-тремя заместителями, выбираемыми из C1-C4 алкила с прямой или разветвленной цепью, хлора и метокси; и W, R, R1, R2 и R3 имеют указанные выше значения. Конкретные примеры соединений, входящих в указанную предпочтительную группу,представлены в нижеследующей таблице IV: Таблица IV 23 Соединения общей формулы (I) можно получить любым приемлемым способом, известным в этой области, и/или в соответствии со способом, приведенным в данном изобретении. В приводимом ниже описании и формулах группы W, R, R1, R2, R3 и R4 имеют указанные выше значения. Очевидно, что в описываемых ниже способах любая функциональная группа(например, карбоксил, гидроксил или амино),при желании или в случае необходимости, может быть защищена известными методами, причем эта защита может быть снята с данной группы в конце процесса или тогда, когда это удобно. Приемлемые защитные группы для таких функциональных групп хорошо известны специалистам в этой области и всесторонне описаны в химической литературе (см., например, T.W. Greene, "Protective Groups in OrganicSynthesis", Wiley Interscience). Кроме того, очевидно, что в конце процесса или на любой его стадии любые группы W, R, R1, R2, R3 и R4 можно превратить известными методами в другие группы W, R, R1, R2, R3 и R4, имеющие любые указанные выше значения. Подобные превращения известны специалистам в этой области и подробно описаны в химической литературеOrganic Transformations", VCH Publishers). Способ получения соединения формулы (I) заключается в том, что(а) осуществляют взаимодействие соединения бета-лактама общей формулы (II) где R1 и R2 имеют указанные выше значения иW обозначает СООН, CONHOH или их защищенные производные, с амином формулы (III) где R3 и R4 имеют указанные выше значения; и(b) полученное таким образом соединение формулы (IV) где W, R1, R2, R3 и R4 имеют указанные выше значения, превращают в соединение формулы где W, R, R1, R2, R3 и R4 имеют указанные выше значения. Очевидно, что соединения требуемой конфигурации можно получить, используя в качестве исходных веществ соединения (II) и (III),имеющие соответствующую конфигурацию. Таким образом, способ получения предпочтительных соединений формулы (I') заключается в том, что(а) осуществляют взаимодействие соединения бета-лактама общей формулы (II') где R1 и R2 имеют указанные выше значения иW обозначает СООН, CONHOH или их защищенные производные, с амином формулы (III') где R3 и R4 имеют указанные выше значения; и(b) полученное таким образом соединение формулы (IV) где W, R1, R2, R3 и R4 имеют указанные выше значения, превращают в соединение формулы где W, R, R1, R2, R3 и R4 имеют указанные выше значения. Реакцию между бета-лактамом формулы(II) и амином формулы (III) на стадии (а) можно осуществлять в органических растворителях,таких как диметилформамид (далее ДМФ), тетрагидрофуран (далее ТГФ), ацетонитрил и толуол, или в водных растворах органических растворителей, таких как водный раствор ТГФ,водный раствор ДМФ и водный раствор ацетонитрила, при температуре от 0 до 120 С в присутствии или без внешних оснований, нуклеофилов (NuH или их солей, где Nu имеет указанные ниже значения), которые гораздо легче 25 расщепляют бета-лактам формулы (II), чем амин формулы (III), что дает активированные производные карбоновой кислоты формулы где W, R1 и R2 имеют указанные выше значения и Nu выбирают из группы, включающей азидо,имидазол, циано, низший алкилтио, пиридилтио, фенилтио и бензилтио; указанное активированное производное карбоновой кислоты формулы (IIа) в тех же условиях реакции подвергают взаимодействию с амином формулы(III), что дает продукт формулы (IV). Наиболее предпочтительными внешними нуклеофилами являются азид натрия, имидазол, цианид натрия и калия. Предпочтительным растворителем является ДМФ. Когда в соединениях формулы (II),(IIа) и (IV) W' обозначает защищенное производное СООН, он предпочтительно является такой группой, как бензилоксикарбонил, паранитробензилоксикарбонил,пара-метоксибензилоксикарбонил, трет-бутоксикарбонил, бензгидрилоксикарбонил, тритилоксикарбонил, триметилсилилоксикарбонил, трет-бутилдиметилсилилоксикарбонил, фенилдиметилсилилоксикарбонил, аллилоксикарбонил, метоксикарбонил и этоксикарбонил. Когда в соединениях формулы (II), (IIа) и (IV) W' обозначает защищенное производное CONHOH, он предпочтительно является группой формулы CONHOR10 или CON (R11)OR10, где R10 и R11, соответственно, являются известными гидрокси- и аминозащитными группами, которые удаляют гидрогенолизом или гидролизом. К предпочтительным группам R10 и R11, которые могут иметь одинаковые или разные значения, относятся бензил,пара-метоксибензил, пара-нитробензил, триметилсилил, трет-бутоксикарбонил, тетрагидропиранил и тритил. Соединение формулы (IV),можно превратить в соединение формулы (I) на стадии (b), выполняя некоторые или все нижеследующие стадии в любом порядке:(b') превращение группы W, которая является защищенным производным W, в группу СООН или CONHOH. Такое превращение осуществляют хорошо известными указанными выше методами. Предпочтительным методом такого превращения является гидрогенолиз,предпочтительно осуществляемый в присутствии палладиевого катализатора в инертном органическом растворителе, таком как этанол,ДМФ или тому подобный, при комнатной температуре и атмосферном или среднем давлении,который позволяет превратить бензиловый и пара-нитробензиловый эфиры в исходные карбоновые кислоты или O-бензиловый и О,N-бисбензиловый гидроксаматы в исходные гидро 001432 26 ксамовые кислоты. Другим предпочтительным методом превращения подобного типа является кислотный гидролиз, выполняемый, предпочтительно, трифторуксусной кислотой или трихлоридом алюминия в присутствии анизола или без него в инертных органических растворителях,таких как ТГФ, ацетонитрил и тому подобные,при температуре от -20 до +30 С, который позволяет превратить трет-бутиловые эфиры и пара-метоксибензиловые эфиры в исходные карбоновые кислоты или О-(пара-метоксибензиловые) и О,N-бис(пара-метоксибензиловые) гидроксаматы в исходные гидроксамовые кислоты;(b") превращение группы W, которая является СООН или его активированным производным, в группу W, которая является CONHOH. Подобное превращение осуществляют путем конденсации таких соединений формулы(IV) с гидроксиламином или его солью, Oзащищенным гидроксиламином формулы R10ONH2 или N,O-дизащищенным гидроксиламином формулы R10O-NHR11, где R10 и R11 имеют указанные выше значения, или его солью, с последующим удалением указанных имеющихся защитных групп R10 и R11. Такую конденсацию осуществляют в соответствии с общими методами превращения карбоновых кислот или их активированных производных в гидроксамовые кислоты, которые хорошо известны в этой области. Активированными производными группы СООН являются, в частности, хлор-ангидрид,смешанные ангидриды и сложные эфиры. Конкретно, хлор-ангидрид получают в результате взаимодействия кислоты или ее соли с такими реагентами, как оксалилхлорид или тионилхлорид; смешанные ангидриды получают в результате взаимодействия кислоты или ее соли с хлоркарбонатами, такими как этилхлоркарбонат, или с галогенангидридами, такими как пивалоилхлорид; сложный эфир, который предпочтительно является метиловым, этиловым,пентафторфениловым, гидроксисукциниловым или гидроксибензотриазолиловым эфиром, получают в результате взаимодействия кислоты с соответствующими спиртами в присутствии обезвоживающего агента, например, дициклогексилкарбодиимида (далее DCC), N,N-диметиламинопропил-N'-этилкарбодиимида (EDC) и 2-этокси-1-этоксикарбонил-1,2-дигидрохинолина (EEDQ). O-Защищенным гидроксиламином предпочтительно является O-бензилгидроксиламин, О-(4-метоксибензил)гидроксиламин, Oтриметилсилилгидроксиламин и О-(трет-бутоксикарбонил)гидроксиламин.N,O-Дизамещенным гидроксиламином предпочтительно является N,O-бис(бензил)гидроксиламин, N,O-бис(4 метоксибензил)гидроксиламин, N,O-бис(третбутоксикарбонил)гидроксиламин,N-(третбутоксикарбонил)-О-(трет-бутилдиметилсилил) гидроксиламин и N-(трет-бутоксикарбонил)-О(тетрагидропиранил)гидроксиламин. Реакцию 27 конденсации с гидроксиламином, О-защищенными гидроксиламинами, N,О-дизащищенными гидроксиламинами и их солями предпочтительно осуществляют в инертном органическом растворителе, таком как ДМФ, ТГФ, ацетонитрил,дихлорметан, толуол и тому подобные, при температуре от -20 до +60 С в присутствии третичного органического основания. При использовании защищенных гидроксиламинов защитные группы удаляют после конденсации хорошо известными методами. Например,бензильные и 4-метоксибензильные группы предпочтительно удаляют путем каталитической гидрогенизации, описанной на стадии (b); тетрагидропиранильные и третбутоксикарбонильные группы предпочтительно удаляют мягким кислотным гидролизом; триметилсилильные и трет-бутилдиметилсилильные группы отщепляют во время реакции либо путем водной или мягкой кислотной обработки;(b'") превращение группы NHR1, где R1 не является водородом, в группу NH2. Эту реакцию осуществляют в отношении соединений формулы (I) или промежуточных соединений формулы (IV), где R1 является аминозащитной группой, в соответствии с хорошо известными методами удаления аминозащитных групп, которые широко применяются в химии пептидов. Группами R1, наиболее пригодными для осуществления подобного превращения, являются электроноакцепторные группы, в частности, алкоксиили бензилоксикарбонильные группы, такие как трет-бутоксикарбонил, бензилоксикарбонил и их 4-нитро- или 4-метоксипроизводные, так как указанные группы R1 эффективно способствуют осуществлению вышеописанной реакции расщепления бета-лактама между соединением формулы (II) и соединением формулы (III), что дает соединение формулы (IV). В соответствии с предпочтительным вариантом осуществления настоящего изобретения R1 является третбутоксикарбонилом, который можно удалить путем обработки три-фторуксусной кислотой,при желании в присутствии анизола, в инертном органическом растворителе; в соответствии с другим предпочтительным вариантом осуществления изобретения R1 является бензилоксикарбонилом или 4-нитробензилоксикарбонилом,который можно удалить путем каталитической гидрогенизации;(biV) превращение группы NHR1, в том числе конкретной группы, где R1 является водородом, в группу NRR1, которая также входит в объем настоящего изобретения. Предпочтительные группы R и R1 аналогичны группам,описанным для предпочтительных соединений формулы (I). Такое преобразование включает превращение аминогруппы в функциональные группы общеизвестными методами, как алкилирование, ацилирование, сульфонилирование и тому подобные. В предпочтительном воплощении данного изобретения подобное превраще 001432 28 ние осуществляют в отношении соединений формулы (IV), в которой W является защищенным карбоксилом, по методу, описанному в пункте (b'), с последующим удалением защитной группы, что дает соединение формулы (I), в которой W обозначает СООН, и полученное таким образом соединение формулы (I), в которой W обозначает СООН, необязательно превращают в соответствующее соединение, где W обозначает CONHOH, по методу, описанному в пункте (b");(bV) превращение любой группы R, R1, R2,R3 и R4 в любую другую группу R1, R2, R3 и R4,которая также входит в объем настоящего изобретения, в соответствии с известными методами. Полученные соединения формулы (I) можно превратить в их соли, пролекарства, гидраты или сольваты с помощью хорошо известных реакций, которые включают получение солей путем взаимодействия с фармацевтически приемлемой кислотой или получение сложных эфиров путем конденсации с фармацевтически приемлемым спиртом или фармацевтически приемлемой карбоновой кислотой, смешивание с альдегидом общей формулы Т-СНО или кетоном общей формулы TT'CO, где Т и Т' имеют указанные выше значения, и выпаривание воды. Амины формулы (III) являются известными соединениями, либо их получают из известных соединений известными методами. Бета-лактамы формулы (II) являются известными соединениями, либо их получают из известных соединений известными методами или аналогично нижеследующим препаративным примерам. В частности, предпочтительный способ получения соединений формулы (II) включает следующие стадии:(i) циклизацию производного аспарагиновой кислоты с получением соединения формулы(ii) превращение соединения формулы (II),в которой R2 является водородом, в соединение формулы (II), где R2 имеет указанные выше значения, путем депротонирования сильным основанием и алкилирования полученного енолята бета-лактама с помощью агента формулы R2-X,где Х обозначает галоген, например хлор, бром или иод, или сульфонилокси, такого как трифлат, мезилат или тому подобный. Общие условия осуществления стадии (i) описаны в научной литературе, и предпочтительным производным аспарагиновой кислоты обычно является дибензиласпартат или ди(4 нитро)бензиласпартат. Кроме того, некоторые азетидиноны (II) можно приобрести коммерческим путем. На стадии (ii) предпочтительно используют соединение формулы (II), в которой 29 такое соединение получают из продукта, полученного на стадии (i), в котором R1 является водородом и W является бензилоксикарбонилом или 4-нитробензилоксикарбонилом, в соответствии с известными методами, такими как каталитический гидрогенолиз и силилирование трет-бутилдиметилхлорсиланом. Очевидно, что условия, описанные выше для взаимодействия бета-лактама формулы (II) с амином формулы (III), превращения соединения формулы (IV) в соединение формулы (I) и превращения полученных соединений формулы (I) в их соли, пролекарства или сольваты, относятся также к предпочтительным хиральным аналогам, т.е. для осуществления взаимодействия бета-лактама формулы (II') с амином формулы(III'), превращения соединения формулы (IV) в соединение формулы (I') и превращения полученных соединений формулы (I') в их соли, пролекарства или сольваты, так как в указанных условиях не происходит эпимеризация или рацемизация. Аналогичным образом, условия,описанные выше для получения бета-лактамов формулы (II), подходят также для получения предпочтительных хиральных аналогов формулы (II'), когда производное аспарагиновой кислоты на стадии (i) является производным Lаспарагиновой кислоты. Фактически на стадии(i), при осуществлении которой происходит внутримолекулярная конденсация -карбоксильной группы производного аспарагиновой кислоты или его производного, т.е. галогенангидрида, сложного эфира или ангидрида, с аминогруппой того же соединения или с его триметилсилильным производным, атом углерода сохраняет свою хиральность. На стадии (ii) указанная хиральность определяет конфигурацию смежного стереоцентра, т.е. атома углерода, к которому присоединена группа R2. Как хорошо известно в химии азетидинонов, алкилирование 3-незамещенных, 4-замещенных азетидинонов дает продукты, в которых заместители в положениях С-3 и С-4 находятся между собой в трансоидной зависимости. Таким образом, азетидиноны формулы (II'), в которой R2 является атомом водорода, получаемым из производных L-аспарагиновой кислоты, подвергают алкилированию реагентами формулы R2-X,что дает азетидиноны (II) с указанными конфигурациями в двух хиральных центрах. Наиболее предпочтительными являются конфигурации двух хиральных центров, которые аналогичны конфигурациям в соединениях формулы (I'). Поэтому можно особо отметить, что стадии (i) и(ii) являются обязательной частью нового, полностью стереорегулируемого способа получения соединений формулы (I'), которые имеют 30 Соединения формулы (I) по настоящему изобретению оказывают сильное ингибирующее действие на матриксные металлопротеиназы(ММР), такие как коллагеназы, желатиназы и стромелизины. Для оценки биохимического действия соединений формулы (I) на ММР-1,ММР-2 и ММР-3 (соответственно коллагеназа кишечника человека, желатиназа А и стромелизин-1) были выполнены следующие испытания. Биохимические испытания (протокол А) Ингибирующее действие in vitro соединений по настоящему изобретению на отобранные матриксные металлопротеиназы определяли в соответствии с приводимым ниже описанием. Коллагеназа человека (ММР-1) была получена в виде усеченного рекомбинантного фермента, содержащего остатки 101-269, и не требовала активации. Желатиназа-А человека(ММР-2) была получена в виде профермента (72 кДа) и ее активировали ацетатом 4 аминофенилртути (1 ммоль) в течение 30 мин при температуре 37 С непосредственно перед использованием. Стромелизин-1 человека 1-255(ММР-3) был получен в виде рекомбинантного профермента, выделенного из E.coli и его активировали нагреванием (1 ч, 55 С). Некоторые измерения выполняли, используя рекомбинантный профермент человека ММР-3, выделенный из клеток насекомых типа Sf9, зараженных бакуловирусом Sf9, который активировали 5 мг/л трипсина (30 мин, 37 С, после активации трипсин удаляли агароза-соевым ингибитором трипсина). Все анализы по определению значений констант диссоциации ингибиторов ферментов выполняли, используя пептидный субстрат (7 метоксикумарин-4-ил)ацетил-Pro-Leu-Gly-Leu(3-[2,4-динитрофенил]-L-2,3-диаминопропионил)-Ala-Arg-NH2Murphy. FEBS Lett. (1992) 296, 263-266]. Эти ферменты расщепляются по связи Gly-Leu с удалением группы Dpa, гасящей флуоресценцию внутри фермента. Высвобождение пептидаMca-Pro-Leu с сильной флуоресценцией контролировали посредством флуориметрии при помощи флуоресцентного спектрофотометраLS-50 Перкина Элмера, оснащенного четырехпозиционным устройством для перемешивания клеток с термостатом. Длина волны возбуждения была равна 326 нм (ширина полосы 5 нм), и эмиссию производили при 392 нм (ширина полосы 20 нм). Остальные установки были выбраны с учетом достижения оптимального отношения сигнал-шум. Все эксперименты выполняли при температуре 37 С. Концентрация субстрата составляла 2 микромоля во всех испытаниях, поэтому значение(1+[субтрат]/Km) во всех вычислениях, где Km равно 70 микромолям или больше, было примерно одинаковым для трех ММР (Knight, Willenbrock and Murphy). Субстрат сохранял ста 31 бильность в условиях испытания в течение более 60 мин, не вызывая значительного увеличения флуоресценции. Полная реакция достигалась при 200 нМ Mca-Pro-Leu-OH (выделенный флуоресцирующий пептид), при этом прибор был калиброван в диапазоне 0-100 нМ Mca-ProLeu-OH, что соответствует 0-5% гидролизу субстрата с концентрацией 2 микромоля. В качестве водного буфера использовали 50 мМ трис/HCl, рH=7,4, содержащего 0,15 МNaCl, 10 мМ CaCl2, 0,01 мМ ZnCl2 и 0,05% Brij 35. Ингибиторы обычно растворяли в ДМСО и добавляли в отношении 1:100. Ту же самую процедуру выполняли для субстрата, поэтому действительная концентрация в ДМСО, используемая в испытаниях, составляла 2% (в объемном отношении). Ферменты обычно использовали в следующих концентрациях: 1,0 нМ коллагеназы,0,04 нМ желатиназы-А и 3,0 нМ стромелизина. При выполнении анализа в созданных условиях для ММР-1, ММР-2 и ММР-3 были получены отношения k cat/Km, соответственно равные 26900, 669000 и 9749 1/(Ms). Все три фермента сохраняли стабильность в условиях анализа в течение более 3 ч. Предварительные исследования выполняли с использованием типичных ингибиторов при постоянной флуоресценции. В частности,1,94 мл буфера предварительно нагревали при температуре 37 С и добавляли 0,02 мл раствора ингибитора в ДМСО (или только ДМСО), 0,02 мл 0,2 мМ субстрата и 0,02 мл 100 нМ ММР-1 или 4 нМ ММР-2 или 300 нМ ММР-3. Увеличение флуоресценции обычно контролировали в течение более 30 мин. Ферменты сохраняли стабильность в течение более 30 мин предварительной инкубации в одинаковых условиях. Концентрации ингибиторов составляли 0,0150000 нМ в зависимости от фермента и активности. Степень гидролиза субстрата находилась в пределах 5% от общей концентрации. Было установлено, что типичные ингибиторы являются обратимо действующими конкурентными ингибиторами, и простейшая конкурентная модель ингибирования медленно образующейся сильной связи, которая соответствовала наблюдениям, представляла собой двухстадийный механизм Е+1=ЕI=ЕI, где стадией, определяющей скорость процесса, является превращение исходного комплекса ферментингибитор EI в более стабильный комплекс EI. Константы диссоциации и скорости образования комплексов фермент-ингибитор были получены путем анализа данных кривой прогрессии для ингибирования медленно образующейся сильной связи по методу, описанному Моррисоном и Волшем [J.F. Morrison and C.T. Walsh,Adv. Enzymol. Relat. Areas Mol. Biol. (1988) 61,201-301]. Кроме того, поставив перед собой цель быстро обследовать большое количество инги 001432 32 биторов, основное внимание в экспериментах уделяли определению общей константы диссоциации Ki = [Е] свободный[I] свободный/[ЕI+ЕI] (Morrison and Walsh), т.е. значениеKi измеряли в устойчивом состоянии во время предварительной инкубации. Все концентрации и условия были аналогичны вышеуказанным, но в этом случае измеряли только Vo, начальную скорость при отсутствии ингибитора, и Vs, скорость в устойчивом состоянии, при разных концентрациях ингибиторов в области их констант диссоциации комплекса фермент-ингибитор. Буфер (1,94 мл) предварительно нагревали в пробирке при температуре 37 С, добавляли 0,02 мл раствора ингибитора в ДМСО (или только ДМСО) и 0,02 мл 100 нМ ММР-1, 4 нМ ММР-2 или 300 нМ ММР-3, смешивали и выдерживали пробирку при температуре 37 С в течение 5-180 мин. Затем добавляли 0,02 мл 0,2 мМ субстрата, смешивали и переносили в предварительно нагретую камеру. Образец оставляли в кювете на 3-5 мин при температуре 37 С для уравновешивания вследствие небольших изменений температуры и нарушения баланса при образовании комплекса ферментингибитор, возникающих при добавлении субстрата. Угол наклона кривой (Vo или Vs) определяли после того, как линейное увеличение флуоресценции наблюдали в течение более 3-5 мин. Концентрации ингибиторов изменяли с тем, чтобы получить данные для отношенияVs/Vo в диапазоне 0,05-0,95. Значения Ki высчитывали из уравнения нелинейной взвешенной регрессии для сильной связи (Morrison andVs/Vo=[1/(2Et)SQR[(Кi+It-Еt) 2+4KiEt](Ki+It-Et), где Et и It означают общие концентрации фермента и ингибитора. Самые низкие пределы определения Ki диктовались концентрациями фермента: даже когда в уравнении регрессии для сильной связи учитывалось значение Et, полученное в результате предварительного титрования, невозможно произвести надежную оценку значений Ki ниже 1/2-1/4 величины Et. В данном случае это предполагает примерно 200-500 пМ Ki для коллагеназы, 10-20 пМ Ki для желатиназы А или 0,8-1,5 пМ Ki для стромелизина. Условия выполнения экспериментов требуют, чтобы измерения были произведены в устойчивом состоянии. Когда значение Ki является очень низким, приближаясь к Et, и It изменяется в области своего значения Ki, тогда достижение равновесия между ферментом, ингибитором и комплексами фермент-ингибитор может занять больше времени (Morrison andWalsh). По этой причине эксперименты повторяли, увеличивая время предварительной инкубации фермента и ингибитора (5 мин по умолчанию) до 3 ч при каждом измерении значенийKi в наномолярном или более низком диапазоне. Однако при использовании ингибиторов по настоящему изобретению редко обнаруживали какие-либо различия, увеличивая время предварительной инкубации с 5 мин до 3 или более часов, даже в тех случаях, когда ингибиторы показывали очень низкие значения Ki. В таблице V приведены константы ингибирования Ki, полученные в устойчивом состоянии в соответствии с вышеуказанным протоколом (А) для 14 соединений по настоящему изобретению. Таблица V Константы ингибирования Ki, полученные в устойчивом состоянии Кроме того, установлено, что соединения формулы (I) эффективно ингибируют высвобождение фактора-альфа опухолевого некроза(TNF) нескольких разных линий клеток в разных условиях стимулирования. Для оценки указанной активности выполняли следующий клеточный анализ. Клеточный анализ (протокол В) Действие соединений по настоящему изобретению in vitro в качестве ингибиторов высвобождения фактора-альфа опухолевого некроза определяли в соответствии с приводимым ниже описанием. Клетки ТНР-1, выращиваемые в среде RPMI 1640, дополненной 10% околоплодной сыворотки теленка, помещали на 24 луночные планшеты, вводя в каждую лунку 1 мл суспензии 1106 клеток/мл, и добавляли испытуемые соединения, растворенные в ДМСО и разбавленные культуральной средой (1% конечная концентрация в ДМСО). Планшеты инкубировали в течение 30 мин при температуре 37 С в 5% СО 2 и в качестве стимулирующего агента добавляли липополисахарид (LPS 0111:В 4, 5 мкг/мл). Инкубацию продолжали еще 4 ч, после чего клетки собирали и центрифугировали (2000 об/мин, 7 мин), супернатант собирали и замораживали (-20 С) до выполнения анализа. Выполняли классический твердофазный иммуноферментный анализ (моноклональное антитело против THF-, иммобилизованное поликлональное антитело кролика и перекис 001432 34 ленное антитело против антитела кролика). В качестве стандарта добавляли дихлоризокумарин. В таблице VI приведены значения IC50(микромолярные концентрации), измеренные в соответствии с вышеописанным протоколом (В) для 7 соединений по настоящему изобретению. Таблица VI Ингибирование высвобождения фактора-альфа опухолевого некроза (TMF-)примера Соединение Использование функциональных аминоили замещенных аминогрупп альфааминокислоты вместо карбоксильных или гидроксамовых функциональных групп, что отличает соединения по настоящему изобретению,не только способствует усилению биохимического действия, но во многих случаях улучшает растворимость в воде и фармакокинетические свойства. Плохая растворимость в воде является главным ограничивающим фактором ранее известных наиболее сильных ингибиторов ММР на основе гидроксамата. Соединения формулы(I), в которой группа -NRR1 является первичной,вторичной или третичной аминогруппой, имеют протонированную форму при физиологическом значении рН, поэтому для них характерна высокая (5 ммоль) или средняя (1 ммоль) растворимость в воде, даже когда одна или несколько групп R, R1-R4 имеют ярко выраженный липофильный характер. Это значительно улучшает всасывание соединений по настоящему изобретению через стенки желудочно-кишечного тракта. В таблице VII приведены значения растворимости для 12 соединений по настоящему изобретению в физиологическом растворе при температуре 25 С. Таблица VII Растворимость в физиологическом растворе при температуре 25 Спримера Соединение Растворимость (мг/мл) 4 Соединения формулы (I) можно использовать для лечения людей и животных в виде фармацевтических препаратов, в состав которых они входят вместе с совместимыми фармацевтическими носителями. Таким образом, еще одним объектом настоящего изобретения является получение фармацевтических композиций,содержащих соединение формулы (I) в качестве активного ингредиента, и способ лечения (т.е. лечение или профилактика) болезней, опосредованных ММР и/или ТАСЕ, у людей и теплокровных животных, который заключается в том,что млекопитающим, в частности людям и животным, вводят эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли. Соединения формулы (I) можно применять следующим образом:(А) перорально в виде таблеток, пастилок,лепешек, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий,твердых или мягких капсул, сиропов или эликсиров. Композиции, предназначенные для перорального введения, можно получить любыми методами, широко применяемыми для изготовления фармацевтических композиций. Такие композиции могут содержать один или несколько агентов, выбираемых из группы, включающей подсластители, ароматизаторы, красители и консерванты, которые используют для получения фармацевтически приемлемых, приятных и вкусных препаратов. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми наполнителями,которые пригодны для изготовления таблеток. Указанными наполнителями могут быть, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие вещества, например кукурузный крахмал или альгиновая кислота; связывающие вещества, например крахмал, желатин или аравийская камедь; и смазывающие вещества, например стеарат магния, стеариновая кислота или тальк. Таблетки могут быть изготовлены без покрытия, либо на них может быть нанесено покрытие известными методами во избежание дезинтеграции и поглощения в желудочно-кишечном тракте, благодаря чему увеличивается продолжительность действия препарата. С этой целью можно использовать,например, такое замедляющее вещество, как моностеарат глицерина или дистеарат глицерина. Препараты для перорального введения могут также представлять собой твердые желатиновые капсулы, в которых активный ингредиент находится в смеси с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, либо мягкие желатиновые капсулы, в которых активный ингредиент смешан с водой или масляной средой, такой как арахисовое масло, жидкий парафин или оливко 001432 36 вое масло. Водные суспензии содержат активные вещества в смеси с наполнителями, пригодными для получения указанных суспензий. Такими наполнителями являются суспендирующие агенты, например натрийкарбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидоновый трагант и аравийская камедь; диспергирующими или смачивающими веществами могут быть натуральные фосфатиды, например лецитин, продукты конденсации алкиленоксида с жирными кислотами, например полиоксиэтиленстеарат, продукты конденсации этиленоксида с алифатическими спиртами с длинной цепью, например гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными эфирами, полученными из жирных кислот и гексита, такие как моноолеат полиоксиэтиленсорбита, или продукты конденсации этиленоксида с неполными эфирами, полученными из жирных кислот и ангидридов гексита, например моноолеат полиоксиэтиленсорбитана. Указанные водные суспензии могут также содержать один или несколько консервантов, таких как этил- или н-пропил парагидроксибензоата, один или несколько красителей, один или несколько ароматизаторов либо один или несколько подсластителей, таких как сахароза или сахарин. Масляную суспензию получают, суспендируя активный ингредиент в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, либо в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например пчелиный воск, твердый парафин или цетиловый спирт. Подсластители, аналогичные указанным выше, и ароматизаторы добавляют для получения пероральных препаратов с приятным вкусом. Чтобы продлить срок хранения этих композиций, в них добавляют анти-оксидант, такой как аскорбиновая кислота. Диспергируемые порошки и гранулы, пригодные для получения водных суспензий при добавлении к ним воды,содержат активный ингредиент в смеси с диспергирующим или смачивающим веществом,суспендирующим веществом и одним или несколькими консервантами. К приемлемым диспергирующим или смачивающим веществам и суспендирующим веществам относятся указанные выше агенты. Лекарственные препараты по настоящему изобретению могут содержать дополнительные наполнители, например подсластители, ароматизаторы и красители. Фармацевтические композиции по данному изобретению могут также представлять собой эмульсии "масло в воде". Масляную фазу образует растительное масло, например оливковое или арахисовое масло, или минеральное масло, например жидкий парафин, или их смеси. Пригодными эмульгаторами могут быть натуральные камеди, например аравийская камедь или трагакант, нату 37 ральные фосфатиды, например соя, лецитин, а также сложные эфиры или неполные эфиры,полученные из жирных кислот и ангидридов гексита, например моноолеат сорбитана, и продукты конденсации указанных неполных эфиров с этиленоксидом, например моноолеат полиоксиэтиленсорбитана. Такая эмульсия может также содержать подсластители и ароматизаторы. Сиропы и эликсиры получают, используя подсластители, например глицерин, сорбит или сахарозу. Такие препараты могут также содержать средство, уменьшающее раздражение, консервант, ароматизатор и краситель;(B) парентерально, например подкожно,внутривенно, внутримышечно, внутригрудинно или путем вливаний, в виде стерильных водных или масляных суспензий для инъекций. Эти суспензии можно получить известными методами, используя приемлемые диспергирующие или смачивающие вещества и суспендирующие агенты, указанные выше. Стерильный препарат для инъекций может также представлять собой стерильный раствор или суспензию для инъекций в нетоксичном, приемлемом для парентерального введения разбавителе или растворителе, например раствор в 1,3-бутандиоле. К приемлемым носителям и растворителям относятся вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителей и суспендирующей среды обычно используют стерильные нелетучие масла. Для этой цели можно использовать любое нелетучее масло, включая синтетические моно- или диглице-риды. Помимо этого, для получения составов для инъекций можно использовать жирные кислоты, такие как олеиновая кислота;(C) путем ингаляции в виде аэрозолей или растворов для ингаляторов;(D) ректально, в виде суппозиториев, получаемых путем смешивания лекарственного средства с приемлемым нераздражающим наполнителем, который является твердым при обычной температуре и становится жидким при температуре в прямой кишке, где он тает и высвобождает лекарственное средство. Такими веществами являются масло какао и полиэтиленгликоли;(Е) наружно, в виде кремов, мазей, желе,растворов или суспензий. Суточные дозы составляют от около 0,1 до около 50 мг/кг массы тела в зависимости от активности конкретного соединения, возраста,веса и состояния здоровья нуждающегося субъекта, характера и серьезности заболевания, частоты и способа введения лекарственного средства; суточные дозы для людей обычно составляют от 10 мг до 2 г. Количество активного ингредиента, вводимого с носителями в виде однократной лекарственной формы, зависит от нуждающегося субъекта и способа введения. Например, препарат, предназначенный для перорального введения людям, может содержать 38 от 5 мг до 2 г активного вещества в смеси с приемлемым количеством носителя, которое может составлять около 5-95% от общей массы композиции. Лекарственные формы обычно содержат примерно 5-500 мг активного ингредиента. Фармацевтические композиции, содержащие соединение формулы (I), можно использовать для лечения болезней, возникающих из-за нарушения равновесия между активными ММР и их природными ингибиторами, в частности тканевыми ингибиторами металлопротеиназTIMP является недостаточным или секретированные неактивные зимогены (про-ММР) экспрессируют или активируют избыточное количество ММР, происходит разрушение внеклеточного матрикса. Подобное разрушение может происходить медленно и постепенно прогрессировать, как это имеет место, например, в случае утраты хрящевого матрикса при ревматоидном артрите (L.A. Walakovits et al., Arthritis Rheum.,35:35-42, 1992) и остеоартрите (D.D. Dean et al.,J. Clin. Invest., 84:678-685, 1989), и разрушения костного матрикса при остеопорозе (Р.A. Hill etal., Biochem. J., 308:167-175, 1995). В других случаях, таких как застойная сердечная недостаточность, происходит быстрое разрушение внеклеточного матрикса сердца (P.W. Armstronget al., Canadian J. Cardiol., 10:214-220, 1990). Раковые клетки используют матриксные металлопротеиназы, экспрессированные ими самими или окружающими тканями, для быстрого изменения внеклеточного матрикса. Существуют многочисленные данные, свидетельствующие о том, что ММР имеют непосредственное отношение, по крайней мере, к трем аспектам роста и распространения опухолей (например, см. А.Н. Davidson et al., ChemistryIndustry, 258261, 1997, и приведенную там справочную литературу). В процессе развития метастаз ММР используются для разрушения внеклеточного матрикса, вследствие чего первичные раковые клетки внедряются в окружающие кровеносные сосуды, откуда они переносятся в разные органы и образуют вторичные опухоли. Для инвазивного роста опухолей на вторичных участках также необходимы матриксные металлопротеиназы, которые ускоряют разрушение ткани. Кроме того, активность ММР способствует инвазивному прорастанию внутрь новых кровеносных сосудов (ангиогенез), которое необходимо опухолям для увеличения своего размера. Необходимость применения ингибиторов ММР в медицине логически обоснована в последних научных публикациях; см., например,D.E. LevyA.M. Ezrin, "Matrix Metalloproteinase Inhibitor Drugs", Emerging Drugs: TheProspects for Improved Medicines, глава 10 (с. 205-230), Ashley Publications Ltd., 1997. С учетом этого научного обоснования и доказательств данной концепции, полученных для других ингибиторов ММР, соединения по на 39 стоящему изобретению можно использовать для лечения нижеследующих болезней:- рака, включая растущие опухоли и метастазы, в частности рака молочной железы, мелкоклеточного рака легкого, немелкоклеточного рака легкого, опухолей мозга, рака предстательной железы, опухолей прямой кишки и саркомы Капоши;- других ангиогенных нарушений, в частности диабетической ретинопатии и пигментных пятен;- сердечно-сосудистых заболеваний, в частности застойной сердечной недостаточности и рестеноза сосудов;- заживления ран, включая воспаления глаз, язвы роговицы или тканей, поражения мягких и костных тканей;- других нарушений, связанных с ММР или высвобождением фактора-альфа опухолевого некроза (TNF-), в частности, псориаза, шоковых синдромов и отторжения трансплантатов. В объем настоящего изобретения входит также использование соединений формулы (I) для лечения вышеуказанных заболеваний в качестве вспомогательных средств при применении других известных методов; например, в сочетании с противовоспалительными или иммунодепрессивными лекарственными средствами для лечения ревматоидного артрита и рассеянного склероза и вместе с цитотоксическими или цитостатическими лекарственными средствами для лечения онкологических заболеваний. Условные обозначения: 40 каплям добавляют 2 М раствор лаурилдиэтаноламида (LDA) (28,4 мл) в таком же растворителе и получают оранжевый раствор дианиона. Этот раствор выдерживают в течение 15 мин при 0 С,добавляют, перемешивая, раствор изобутилиодида (6,8 мл) в ТГФ и полученный зеленый раствор оставляют на ночь при указанной температуре. Реакционную смесь гасят 1 М водным раствором KHSO4 (300 мл) и экстрагируют этилацетатом, что дает неочищенный 1-третбутилдиметилсилил-4S-карбокси-3R-изобутилазетидинон в виде оранжевого сиропа (7 г). Полученное вещество растворяют в сухом ДМФ (20 мл) и в указанном порядке по каплям добавляют триэтиламин (5,85 мл) и бензилбромид (4,8 мл). Смесь выдерживают в течение 4 ч при комнатной температуре и распределяют между водой и этилацетатом. Органическую фазу промывают насыщенным водным раствором NaCl, сушат и упаривают с получением сырого 4S-бензилоксикарбонил-1-трет-бутилдиметилсилил-3R-изобутилазетидинона в виде оранжевого масла, которое растворяют в ТГФ (10 мл) и выдерживают в течение ночи в присутствии фторида тетрабутиламмония (2,6 г) и уксусной кислоты (1,7 мл). Смесь распределяют между насыщенным водным раствором NаНСО 3 и этилацетатом, после чего органическую фазу сушат и упаривают. Флэш-хроматография на силикагеле (смесь н-гексан - этилацетат) дает 4S-бензилоксикарбонил-3Rизобутилазетидинон (4,7 г) в виде белых игл.FT-IR (КВr) 3229 (NH), 1744-1750 br (CO) см-1. ЯМР (200 МГц, СDСl3) 0.94 (d, 3 Н, J=6.5),0.87 (d, 3H, J=6.5), 1.57-1.82 (m, 3 Н), 3.32 (m,1H), 3.90 (d, 1H, J=2,4), 5.22 (Abq, 2H), 5.96 (br.s,1H), 7.36 (m, 5H) ppm. Стадия (b). Раствор 4S-бензилоксикарбонил-3R-изобутилазетидинона (1 г), полученного на стадии (а), в MeCN (15 мл) обрабатывают 4-диметиламинопиридином (DMAP) (46 мг) и ди-трет-бутилдикарбонатом (BOC2O) (1,67 г) в течение 30 мин при температуре 40 С, а затем в течение ночи при комнатной температуре. Растворитель удаляют в вакууме, остаток растворяют в этилацетате и последовательно промывают 1 М водным раствором KHSO4, насыщенным раствором NаНСО 3 и насыщенным раствором соли. Полученную смесь сушат надNa2SO4 и упаривают, что дает сырой 4Sбензилоксикарбонил-1-трет-бутоксикарбонил 3R-изобутилазетидинон (0,83 г) в виде желтого масла.(сложный эфир СО), 1728 (карбамат СО) см-1. Стадия (с). 4S-Бензилоксикарбонил-1-третбутоксикарбонил-3R-изобутилазетидинон, полученный на стадии (b), (145 мг) растворяют в сухом ДМФ (4 мл). К полученному раствору последовательно добавляют L-фенилаланин-Nметиламид (пара-толуолсульфонат соль, 280(25 мг). Смесь перемешивают в течение ночи при комнатной температуре и растворитель частично удаляют в вакууме. Остаток поглощают этилацетатом и последовательно промывают водой и насыщенным раствором соли, сушат над Na2SO4 и упаривают. Флэш-хроматография на силикагеле дает (4-бензилокси-3S-третбутоксикарбониламино-2R-изобутил)сукцинилL-фенилаланин-N-метиламид в виде белого порошка (150 мг).Pd/C (50 мг) в смеси этанол-ТГФ 1:1 (20 мл) помещают на 3 ч в атмосферу водорода. Катализатор отфильтровывают (через целит), промывая смесь дополнительным количеством этанола, и растворитель удаляют в вакууме с получением целевого соединения (100 мг) в виде белого твердого вещества.ppm. Пример 2. (3S-Трет-бутоксикарбониламино-4-гидроксиамино-2R-изобутил)сукцинил-Lфенилаланин-N-метиламид (соединение I-25). Стадия (а). (3S-Трет-бутоксикарбониламино-4-гидрокси-2R-изобутил)сукцинил-L-фенилаланин-N-метиламид (300 мг), полученный аналогично примеру 1, суспендируют в сухомO-бензилгидроксиламина (117 мг) и Nметилморфолином (0,16 мл) в атмосфере азота. Через 10 мин к полученному светлому раствору добавляют тетрафторборат О-1 Н-бензотриазол 1-ил-N,N,N',N'-тетраметилурония (TBTU) (258 мг) и перемешивают смесь в течение 3 ч. Растворитель удаляют в вакууме и остаток распределяют между дихлорметаном и водой. Органическую фазу промывают несколько раз водой,сушат и упаривают с получением белого твердого вещества. Полученное вещество растирают в порошок с диизопропиловым эфиром и собирают, что дает (4-бензилоксиамино-3S-третбутоксикарбониламино-2R-изобутил)сукцинилL-фенилаланин-N-метиламид (320 мг). Стадия (b). Вещество, полученное на стадии (а), (85 мг) растворяют в ДМФ (5 мл) и на 30 мин помещают в атмосферу водорода в присутствии 10%Pd/C (60 мг). Катализатор отфильтровывают (через целит), большую часть растворителя удаляют в вакууме и остаток рас 001432 42 тирают в порошок с этиловым эфиром, что дает целевое соединение в виде белого порошка (56 мг).(3S-Трет-бутоксикарбониламино-4-гидрокси-2R-изобутил)сукцинил-L-фенилаланин-Nметиламид (20 мг), полученный аналогично примеру 1, растворяют в 95% водном растворе трифторуксусной кислоты (2 мл) и выдерживают раствор в течение ночи при 0 С. К полученному раствору добавляют толуол и выпаривают его в вакууме, повторяя эту процедуру несколько раз. Остаток растирают в порошок в этиловом эфире и собирают целевое соединение,трифторацетат (соль), в виде бледно-желтого порошка.(3S-Трет-бутоксикарбониламино-4-гидроксиамино-2R-изобутил)сукцинил-L-фенилаланин-N-метиламид (30 мг), полученный аналогично примеру 2, выливают в 95% водный раствор трифторуксусной кислоты (3 мл) и перемешивают в течение 2 ч при температуре 4 С. Раствор фильтруют (через целит), промывают свежей трифторуксусной кислотой и несколько раз упаривают в вакууме, добавляя толуол, что дает целевое соединение, трифторацетат (соль),в виде порошка. 43 Стадия (а). Раствор 4S-бензилоксикарбонил-3R-изобутилазетидинона (400 мг), полученный аналогично примеру 1, стадия (а), в дихлорметане (10 мл) в течение ночи при комнатной температуре обрабатывают 4-диметиламинопиридином (DMAP) (25 мг) и паратолуолсульфонилхлоридом (219 мг) в атмосфере азота. Реакционную смесь гасят насыщенным водным раствором NаНСО 3, органический слой собирают, промывают 1 М водным растворомNH4Cl, насыщенным раствором соли и сушат над Na2SO4. Полученный продукт упаривают и фракционируют посредством флэшхроматографии на силикагеле (смесь н-гексан этилацетат), что сначала дает непрореагировавшую часть исходного вещества (50 мг), а затем чистый 4S-бензилоксикарбонил-3R-изобутил-1(пара-толуолсульфонил)азетидинон (100 мг) в виде масла.(сложный эфир СО) см-1. ЯМР (400 МГц, CDCl3) 0.79 (d, 3 Н, J=6.4),0.88 (d, 3 Н, J= 6.4), 1.54-1.72 (m, 3 Н), 2.44 (s,3 Н), 3.20 (m, 1H), 4.32 (d, 1H, J=3.2), 5.19 (s, 2H),7.31(d, 2H, J=8.5), 7.33 (m, 5H), 7.87 (d, 2H,J=8.5) ppm. Стадия (b). 4S-Бензилоксикарбонил-3Rизобутил-1-(пара-толуолсульфонил)азетидинон,полученный на стадии (а), (290 мг) растворяют в сухом ДМФ (15 мл). К полученному раствору последовательно добавляют L-фенилаланин-Nметиламид(пара-толуолсульфонат (соль), 486 мг), N-метилморфолин (0,17 мл) и азид натрия(30 мг). Смесь перемешивают в течение ночи при комнатной температуре, растворитель частично удаляют в вакууме, остаток поглощают этилацетатом и последовательно промывают насыщенным водным раствором NaHSO4 и насыщенным раствором соли. Полученный продукт сушат над Na2SO4, упаривают, флэшхроматографируют на силикагеле и растирают в порошок с этиловым эфиром, что дает (4 бензилокси-2R-изобутил-3S-(пара-толуолсульфонил)амино)сукцинил-L-фенилаланин-N-метиламид в виде белого порошка (200 мг).FT-IR (КВr) 3330, 3255, 1750, 1721, 1650 см-1. Стадия (с). (4-Бензилокси-2R-изобутил-3S(пара-толуолсульфонил)амино)сукцинил-Lфенилаланин-N-метиламид (140 мг), полученный на стадии (b), растворяют в смеси ТГФ (20 мл) и ДМФ (2 мл). Полученный раствор обрабатывают 10% Pd/C (100 мг) и помещают в атмосферу водорода на 5 ч. Катализатор отфильтровывают (через целит), промывая смесь дополнительным количеством ТГФ, и растворитель удаляют в вакууме с получением целевого соединения (110 мг) в виде белого твердого вещества. ЯМР (400 МГц, DMSO-d6) 0.60 (d, 3 Н,J=6.8), 0.64 (d, 3 Н, J=6.8), 0.86 (m, 1H), 1.07 (m,1H), 1.34 (m, 1H), 2.28 (s, 3H), 2.46 (d, 3H, J=4.7),2.53 (m, 1H), 2.70 (dd, 1H, J=13.7 и 8.1), 2.88 (dd, 001432ppm. Пример 6. (4-Гидроксиамино-2R-изобутил 3S-(пара-толуолсульфонил)амино)сукцинил-Lфенилаланин-N-метиламид (соединение I-44). Стадия (а). (4-Гидрокси-2R-изобутил-3S(пара-толуолсульфонил)амино)сукцинил-Lфенилаланин-N-метиламин (170 мг), полученный аналогично примеру 5, суспендируют в сухом MeCN (15 мл) и обрабатывают гидрохлоридом O-бензилгидроксиламина (64,7 мг) и Nметилморфолином (0,1 мл) в атмосфере азота. Через 10 мин к полученному светлому раствору добавляют тетрафторборат O-1 Н-бензотриазол 1-ил-N,N,N',N'-тетраметилурония (TBTU) (131 мг) и перемешивают смесь в течение 5 ч. Растворитель удаляют в вакууме и остаток распределяют между дихлорметаном и водой. Органическую фазу последовательно промывают водным раствором NH4Cl, водой и насыщенным раствором соли, сушат, фильтруют и упаривают с получением сырого (4-бензилоксиамино-2Rизобутил-3S-(пара-толуолсульфонил)амино) сукцинил-L-фенилаланин-N-метиламида. Стадия (b). Вещество, полученное на стадии (а), растворяют в ТГФ (15 мл) и на 5 ч помещают в атмосферу водорода в присутствии 10% Pd/C (100 мг). Катализатор отфильтровывают (через целит), растворитель удаляют в вакууме и остаток растирают в порошок со смесью этилового эфира и дихлорметана, что дает целевое соединение в виде белого порошка (50 мг).(m, 7H), 7.55 (d, 2H, J=8.2) ppm. Пример 7. (4-Гидрокси-2R-изобутил-3S-(4 морфолинокарбонил)амино)сукцинил-L-фенилаланин-N-метиламид (соединение I-60). Стадия (а). Раствор 4S-бензилоксикарбонил-3R-изобутилазетидинона (200 мг), полученного аналогично примеру 1, стадия (а), в дихлорметане (10 мл) в течение ночи при комнатной температуре обрабатывают триэтиламином (0,44 мл), 4-диметиламинопиридином(10 мг) и 4 морфолинокарбонилхлоридом (0,26 мл) в атмосфере азота. Реакционную смесь гасят насыщенным водным раствором NаНСО 3, органический слой собирают, промывают 1 М водным раствором KHSO4, насыщенным раствором соли и сушат над Na2SO4. Полученный продукт упаривают и фракционируют посредством флэшхроматографии на силикагеле (смесь н-гексан этилацетат), что дает 4S-бензилоксикарбонил 3R-изобутил-1-(4 45 морфолинокарбонил)азетидинон (170 мг) в виде воскообразного твердого вещества.(сложный эфир СО), 1678 (мочевина СО) см-1. ЯМР (400 МГц, СDСl3) 0.85 (d, 3 Н, J=6.4),0.93 (d, 3H, J= 6.4), 1.60-1.83 (m, 3H), 3.19 (m,1H), 3.53 (m, 2H), 3.67 (m, 6H), 4.36 (d, 1H,J=3.2), 5.16 (d, 1H, J=12.1), 5.28 (d, 1H, J=12.1),7.35 (m, 5H) ppm. Стадия (b). 4S-Бензилоксикарбонил-3Rизобутил-1-(4-морфолинокарбонил)азетидинон,полученный на стадии (а), (170 мг) растворяют в сухом ДМФ (10 мл). В атмосфере азота к полученному раствору последовательно добавляютL-фенилаланин-N-метиламид (пара-толуолсульфонат (соль), 317 мг), N-метилморфолин (0,11 мл) и азид натрия (20 мг). Реакционную смесь выдерживают в течение 6 ч при комнатной температуре, а затем помещают на ночь в холодильник, после чего растворитель частично удаляют в вакууме, остаток поглощают этилацетатом и последовательно промывают водой и насыщенным раствором соли. Полученный продукт сушат над Na2SO4 и упаривают, что дает неочищенный(4-бензилокси-2R-изобутил-3S(4-морфолинокарбонил)амино)сукцинил-L-фенилаланин-N-метиламид в виде желтоватой пены (207 мг).FT-IR (КВr) 3312 широкий, 1743, 1641 см-1. Стадия (с). (4-Бензилокси-2R-изобутил-3S(4-морфолинокарбонил)амино)сукцинил-L-фенилаланин-N-метиламид (200 мг), полученный на стадии (b), растворяют в этаноле (10 мл). Полученный раствор обрабатывают 10% Pd/C (100 мг) и помещают в атмосферу водорода на 6 ч. Катализатор отфильтровывают (через целит),промывая смесь дополнительным количеством этанола и растворитель удаляют в вакууме, что дает целевое соединение (170 мг) в виде белого твердого вещества. ЯМР (200 МГц, DMSO-d6) 0.72 (два d, 6 Н,J=6.2), 1.00-1.60 (m, 3 Н), 2.44 (d, 3 Н, J=3.9),2.60-2.95 (m, 3 Н), 3.16 (m, 4H), 3.48 (m, 4 Н), 4.02ppm. Пример 8. (4-Гидроксиамино-2R-изобутил 3S-(4-морфолинокарбонил)амино)сукцинил-Lфенилаланин-N-метиламид (соединение I-61). Стадия (а). (4-Гидрокси-2R-изобутил-3S(4-морфолинокарбонил)амино)сукцинил-L-фенилаланин-N-метиламид (120 мг), полученный аналогично примеру 7, суспендируют в сухомO-бензилгидроксиамина (41 мг) и N-метилморфолином (0,06 мл) в атмосфере азота. Через 10 мин к полученному светлому раствору добавляют тетрафторборат O-1 Н-бензотриазол-1 ил-N,N,N',N'-тетраметилурония (TBTU) (100 мг) и перемешивают смесь в течение 5 ч. Растворитель удаляют в вакууме и остаток распределяют между дихлорметаном и водой. Органическую 46 фазу последовательно промывают водным раствором NH4Cl, водой и насыщенным раствором соли, сушат, фильтруют и упаривают, что дает сырой (4-бензилоксиамино-2R-изобутил-3S-(4 морфолинокарбонил)амино)сукцинил-L-фенилаланин-N-метиламид (130 мг) в виде белого твердого вещества. Стадия (b). Вещество, полученное на стадии (а), растворяют в этаноле (15 мл) и ТГФ (5 мл) и на 3 ч помещают в атмосферу водорода в присутствии 10% Pd/C (100 мг). Катализатор отфильтровывают (через целит), растворитель удаляют в вакууме и остаток растирают в порошок с этиловым эфиром, что дает сырое целевое соединение в виде розового твердого вещества(92 мг), которое очищают хроматографией на силикагеле (смесь дихлорметан - метанол, 9:1).ppm. Пример 9. (3S-Бензамидо-4-гидрокси-2Rизобутил)сукцинил-L-фенилаланин-N-метиламид (соединение I-71). Стадия (а). Раствор 4S-бензилоксикарбонил-3R-изобутилазетидинона (300 мг), полученного аналогично примеру 1, стадия (а), в дихлорметане (10 мл) в течение ночи обрабатывают триэтиламином (0,5 мл) и бензоилхлоридом (0,4 мл) при 0 С и при комнатной температуре в атмосфере азота. Реакционную смесь разбавляют дихлорметаном, несколько раз промывают водным раствором NаНСО 3, затем 1 М раствором KHSO4 и насыщенным раствором соли. Полученный продукт сушат над Na2SO4,упаривают и фракционируют посредством флэш-хроматографии на силикагеле (смесь нгексан - этилацетат), что дает 1-бензоил-4Sбензилоксикарбонил-3R-изобутилазетидинон (235 мг) в виде порошка.FT-IR (КВr) 1801, 1749, 1678 см-1. ЯМР (200 МГц, CDCl3) 0.86 (d, 3 Н, J=6.0),0.94 (d, 3H, J=6.0), 1.60-1.90 (m, 3H), 3.30 (m,1H), 4.37 (d, 1H), 5.22-5.31 (Abq, 2H, J=12.0),7.35-7.64 (m, 8H), 8.05 (m, 2H) ppm. Стадия (b). 1-Бензоил-4S-бензилоксикарбонил-3R-изобутилазетидинон, полученный на стадии (а), (235 мг) растворяют в сухом ДМФ(10 мл). К полученному раствору последовательно добавляют L-фенилаланин-N-метиламид(пара-толуолсульфонат (соль), 450 мг), Nметилморфолин (0,16 мл) и азид натрия (20 мг) в атмосфере азота. Полученную смесь выдерживают в течение 6 ч при комнатной темпера 47 туре, растворитель частично удаляют в вакууме,остаток поглощают этилацетатом и последовательно промывают 1H водным раствором NH4Cl и насыщенным раствором соли. Полученный продукт сушат над Na2SO4, растворитель выпаривают и остаток очищают флэшхроматографией на силикагеле (смесь н-гексан этилацетат),что дает(3S-бензамидо-4 бензилокси-2R-изобутил) сукцинил-L-фенилаланин-N-метиламид в виде белого порошка (330 мг).FT-IR (КВr) 3299, 1734, 1655-1639 широкий см-1. Стадия (с). (3S-Бензамидо-4-бензилокси 2R-изобутил)сукцинил-L-фенилаланин-N-метиламид (330 мг), полученный на стадии (b),растворяют в смеси этанол - ТГФ (1:1) (10 мл). Полученный раствор обрабатывают 10% Pd/C(150 мг) и помещают в атмосферу водорода на 4 ч. Катализатор отфильтровывают (через целит),промывая смесь дополнительным количеством этанола, и растворитель удаляют в вакууме, что дает целевое соединение (250 мг) в виде белого твердого вещества.(m, 2H), 8.10 (d, 1H, J=5.9), 8.27 (m, 1H), 8.76 (d,1H, J=8.3) ppm. Пример 10. (3S-Бензамидо-4-гидроксиамино-2R-изобутил)сукцинил-L-фенилаланинN-метиламид (соединение I-72). Целевое соединение получают в соответствии со способом, описанным в примере 2,стадии (а) и (b), используя в качестве исходного вещества (3S-бензамидо-4-гидрокси-2R-изобутил)сукцинил-L-фенилаланин-N-метиламидFAB-MS 469 (27, (МН)+), 436 (20, (МНМН 2 ОН)+), 179 (45, (PheNHMe+H+), 105 (100,(PhCO)+) m/z. Пример 11. (3S-Трет-бутоксикарбониламино-4-гидроксиамино-2Rфенилпропил)сукцинил-L-фенилаланин-N-2-(4 морфолино)этиламид (соединение III-86). Стадия (а). К раствору 1-трет-бутилдиметилсилил-4S-карбоксиазетидинона (0,7 г) в сухом ТГФ (20 мл) при температуре 0-5 С по каплям добавляют 2 М раствор LDA (3,2 мл) в таком же растворителе и получают оранжевый раствор дианиона. Через 10 мин при 0 С добавляют, перемешивая, раствор циннамилбромида(1,4 г) в ТГФ (2 мл) и полученный раствор оставляют на ночь при той же температуре. Реакционную смесь гасят 1 М водным раствором 48 Полученное вещество растворяют в сухом ДМФ (5 мл) и в указанном порядке по каплям добавляют триэтиламин (0,5 мл) и бензилбромид (0,46 мл). Смесь выдерживают в течение 4 ч при комнатной температуре и распределяют между водой и этилацетатом. Органическую фазу промывают насыщенным водным раствором NaCl, сушат и упаривают с получением сырого 4S-бензилоксикарбонил-1-трет-бутилдиметилсилил-3R-циннамилазетидинона,который растворяют в ТГФ (5 мл) и оставляют на 3 ч в присутствии тригидрата фтористого тетрабутиламмония (1,16 г) и уксусной кислоты (0,84 мл). Смесь распределяют между насыщенным водным раствором NaHCO3 и этилацетатом, органическую фазу собирают, промывают насыщенным раствором соли, сушат над Na2S04 и упаривают. Флэш-хроматография на силикагеле(m, 2H), 3.30 (m, 1 Н), 4.22 (d, 1H, J=3.1), 5.15 и 5.25 (два d, 2H, J=12.1), 6.20 (m, 1 Н), 6.60 (m,1 Н), 7.2-7.3 (m, 10 Н) ррm. Стадия (b). Раствор 4S-бензилоксикарбонил-3R-цмннамилазетидинона (0,44 г), полученного на стадии (а), в MeCN (10 мл) обрабатывают 4-диметиламинопиридином (DMAP)(0,75 г) в течение 1 ч при температуре 40 С. К смеси добавляют вторую порцию ВОС 2 О (0,35 г), выдерживают еще 10 мин при температуре 40 С, разбавляют этилацетатом и последовательно промывают 1 М водным растворомKHSO4, насыщенным раствором NаНСО 3 и насыщенным раствором соли. Полученный продукт сушат над Na2SO4 и упаривают, что дает сырой 4S-бензилоксикарбонил-1-трет-бутоксикарбонил-3R-циннамилазетидинон (0,7 г) в виде сиропа. Стадия (с). Сырой 4S-бензилоксикарбонил-1-трет-бутоксикарбонил-3R-циннамилазетидинон, полученный на стадии (b), (0,28 г) растворяют в сухом ДМФ (3 мл). К полученному раствору последовательно добавляют Lфенилаланин-N-2-(4-морфолино)этиламид (425 мг), N-метилморфолин (0,19 мл) и азид натрия(35 мг). Смесь перемешивают в течение ночи при комнатной температуре, растворитель частично удаляют в вакууме, остаток поглощают этилацетатом и последовательно промывают водой и насыщенным раствором соли. Полученный продукт сушат над Na2SO4, упаривают и флэш-хроматографируют на силикагеле, что дает(4-бензилокси-3S-трет-бутоксикарбониламино-2R-циннамил)сукцинил-L-фенилаланинN-2-(4-морфолино)этиламид (300 мг). ЯМР (400 МГц, DMSO-d6) 1.36 (5, 9 Н),2.15 (m, 2H), 2.25 (m, 4 Н), 2.30 (m, 2H), 2.75 и 2.90 (два m, 2H), 2.90-3.1 (m, 3H), 3.50 (m, 4 Н),4.20 (m, 1H), 4.45 (m, 1H), 4.95 (m, 2H), 6.10 (m, 49 1H), 6.30 (m, 1H), 6.70 (d, 1H, J=7.5), 7.0-7.4 (m,15H), 7.76 (broad s, 1H), 8.40 (broad s, 1H) ppm. Стадия (d). Смесь (4-бензилокси-3S-третбутоксикарбониламино-2Rциннамил)сукцинил-L-фенилаланин-N-2-(4 морфолино)этиламида (300 мг) и 10% Pd/C (100 мг) в смеси этанол - ТГФ (1:1) (40 мл) помещают в атмосферу водорода на 3 ч. Катализатор отфильтровывают (через целит), промывая смесь дополнительным количеством этанола, и растворитель удаляют в вакууме, что дает сырой(3S-трет-бутоксикарбониламино-4 гидрокси-2R-фенилпропил)сукцинил-L-фенилаланин-N-2-(4-морфолино)этиламид в виде белого твердого вещества. Стадия (е). Сырое вещество, полученное на стадии (d), обрабатывают гидрохлоридом Oбензилгидроксиламина, N-метилморфолином и тетрафторборатомO-1 Н-бензотриазол-1-илN,N,N',N'-тетраметилурония (TBTU), как это описано в примере 2, стадия (а). Хроматография дает (4-бензилоксиамино-3S-трет-бутоксикарбониламино-2R-фенилпропил)сукцинил-Lфенилаланин-N-2-(4-морфолино)этиламид (220 мг). Стадия (f). Вещество, полученное на стадии (е), (145 мг) растворяют в ДМФ (5 мл) и помещают на 30 мин в атмосферу водорода в присутствии 10% Pd/C (60 мг). Катализатор отфильтровывают (через целит), большую часть растворителя удаляют в вакууме и остаток растирают в порошок с этиловым эфиром, что дает целевое соединение в виде белого порошка (90 мг).FT-IR (КВr) 3315 (NHOH), 1685, 1660 и 1640 (СО) см-1. Пример 12. Метиловый эфир (3S-третбутоксикарбониламино-4-гидроксиамино-2Rизобутил)сукцинил-(S)-трет-бугилглицина (соединение IV-64). Стадия (а). 4S-Бензилоксикарбонил-1-третбутоксикарбонил-3R-изобутилазетидинон (200 мг), полученный аналогично примеру 1, стадия(b), растворяют в сухом ДМФ (4 мл). К полученному раствору последовательно добавляют метиловый эфир (S)-трет-бутилглицина (160 мг), N-метилморфолин (0,05 мл) и азид натрия(25 мг). Смесь перемешивают в течение ночи при комнатной температуре, растворитель частично удаляют в вакууме, остаток поглощают этилацетатом и последовательно промывают водой и насыщенным раствором соли. Полученный продукт сушат над Na2SO4, упаривают и флэш-хроматографируют на силикагеле, что дает метиловый эфир (4-бензилокси-3S-третбутоксикарбониламино-2R-изобутил)сукцинил(S)-трет-бутилглицина в виде белого порошка 50 Стадия (b). Смесь метилового эфира (4 бензилокси-3S-трет-бутоксикарбониламино-2Rизобутил)сукцинил-(S)-трет-бутилглицина (260 мг) и 10% Pd/C (100 мл) в смеси этанол - ТГФ(1:2) (10 мл) помещают в атмосферу водорода на 5 ч. Катализатор отфильтровывают (через целит), промывая смесь дополнительным количеством этанола, и растворитель удаляют в вакууме, что дает метиловый эфир (3S-третбутоксикарбониламино-4-гидрокси-2R-изобутил)сукцинил-(S)-трет-бутилглицина (210 мг) в виде желтоватого воскообразного твердого вещества.(d, 1H, J=8.8), 8.13 (broad s, 1H), 12.67 (broad s,1H) ppm. Стадия (с). Вещество, полученное на стадии (b) (195 мг), растворяют в сухом MeCN (5 мл) и обрабатывают гидрохлоридом Oбензилгидроксиамина (90 мг) и N-метилморфолином (0,13 мл) в атмосфере азота. Через 10 мин добавляют тетрафторборат O-1 Нбензотриазол-1-ил-N,N,N',N'-тетраметилурония(TBTU) (180 мг) и перемешивают смесь в течение 6 ч. Растворитель удаляют в вакууме и остаток распределяют между дихлорметаном и 0,2 Н водным раствором НСl. Органическую фазу промывают насыщенным раствором соли, сушат и упаривают с получением остатка, который очищают хроматографией на силикагеле,что дает метиловый эфир (4-бензилоксиамино 3S-трет-бутоксикарбониламино-2Rизобутил)сукцинил-(S)-трет-бутилглицина (170 мг) в виде белого твердого вещества. Стадия (d). Вещество, полученное на стадии (с), (170 мг) растворяют в этаноле (5 мл) и помещают на 2 ч в атмосферу водорода в присутствии 10% Pd/C (100 мг). Катализатор отфильтровывают (через целит), промывая смесь дополнительным количеством этанола, и объединенный раствор упаривают до сухого состояния, что дает целевой продукт в виде белого порошка (90 мг). ЯМР (200 МГц, DMSO-d6) 0.76 (d, 6 Н,J=6.4), 0.92 (s, 9 Н), 1.29 (s, 9 Н), 1.20-1.60 (m,3 Н), 2.80 (m, 1H), 3.58 (s, 3H), 3.72 (dd, 1H, J=8.8 и 8.8), 4.14 (d, 1H, J=8.6), 6.47 (d, 1H, J=8.8), 7.73(d, 1H, J=8.6), 8.89 (broad s, 1H), 10.70 (broad s,1H) ppm. Пример 13. Метиловый эфир (3S-амино-4 гидроксиамино-2R-изобутил)сукцинил-(S)-третбутилглицина (соединение IV-65). Метиловый эфир (3S-трет-бутоксикарбониламино-4-гидроксиамино-2R-изобутил)сукцинил-(S)-глицина (40 мг), полученного аналогично примеру 12, растворяют в 95% водном рас 51 творе трифторуксусной кислоты (3 мл). Через 20 мин смесь упаривают, добавляют толуол и упаривают еще два раза. Остаток растирают в порошок с этиловым эфиром, что дает целевое соединение, трифторацетат (соль), в виде бледно-розового порошка (40 мг).s, второстепенный; 1H), 10.70 и 11.03 (соответственно, второстепенный и главный; каждый s,1H) ppm. Примечание: это соединение находится в растворе ДМСО в виде смеси двух ротамеров; в данных анализа указаны сигналы второстепенного и основного ротамеров. В нижеследующих примерах представлены другие соединения, полученные аналогичным образом. Пример 14. (3S-Трет-бутоксикарбониламино-4-гидрокси-2R-фенилпропил)сукцинилL-фенилаланин-N-метиламид. Белый порошок. ЯМР (200 МГц, DMSO-d6) 1.46 (s, 9H),1.60 (m, 4H), 2.58 (t, 2H, J=6.7), 2.64 (d, 3H,J=4.8), 2.93 (m, 2H), 3.14 (dd, 1H, J=13.4 и 5.4),4.34 (dd, 1H, J=2.5 и 6.1), 4.44 (m, 1H), 5.30 (m,1H), 5.98 (d, 1H, J=6.1), 7.1-7.3 (m, 10H) ppm. Пример 15. (3S-Амино-4-гидрокси-2Rфенилпропил)сукцинил-L-фенилаланин-Nметиламид. Целевое соединение получено в виде трифторацетата (соль); белый порошок. ЯМР (200 МГц, DMSO-d6) 1.2-1.5 (m, 4H),2.39 (t, 2H, J=7.9), 2.50 (d, 3H, J=4.4), 2.52 (m,1H), 2.79 (dd, 1H, J=13.4 и 10.8), 3.09 (dd, 1H,J=3.5 и 13.4), 3.46 (d, 1H, J=2.6), 4.26 (m, 1H),7.1-7.3 (m, 10H), 8.46 (broad s, 1H), 9.00 (d, 1H,J=8.4) ppm. Пример 16. (3S-Трет-бутоксикарбониламино-4-гидроксиамино-2Rфенилпропил)сукцинил-L-фенилаланин-Nметиламид (соединение III-87). Белый порошок. ЯМР (400 МГц, DMSO-d6) 1.28 (s, 9H), 1.11.5 (m, 4H), 2.35 (m, 2H), 2.38 (d, 3H, J=4.3), 2.57(m, 1H), 2.82 (m, 2H), 3.83 (dd, 1H, J=8.7 и 8.7),4.34 (m, 1H), 6.52 (d, 1H, J=8.7), 7.1-7.2 (m, 10H),7.72 (q, 1H, J=4.3), 8.01 (d, 1H, J=8.1), 8.85 (s,1H), 10.71 (s, 1H) ppm. Пример 17. (3S-Амино-4-гидроксиамино 2R-фенилпропил)сукцинил-L-фенилаланин-Nметиламид (соединение III-88). Целевое соединение получено в виде трифторацетата (соль); белый порошок. ЯМР (400 МГц, DMSO-d6) 1.40 (m, 4H),2.4-2.5 (m, 3H), 2.44 (s, 3H), 4.34 (m, 1H), 7.20ppm. Пример 18. (3S-Амино-4-гидроксиамино 2R-изобутил)сукцинил-L-фенилаланин-N-третбутиламид (соединение I-21). Целевое соединение получено в виде трифторацетата (соль); белый порошок. ЯМР (400 МГц, DMSO-d6) 0.78 и 0.80 (каждый d, 6H, J=6.8), 1.10 и 1.5 (каждый m, 2H),1.11 (s, 9H), 1.40 (m, 1H), 2.70 (m, 1H), 2.89 (d,2H, J=7.3), 3.50 (m, 1H), 4.47 (dt, 1H, J=7.3, 7.3 и 8.6), 7.20 (m, 5H), 7.40 (s, 1H), 8.20 (broad s, 1H),8.23 (d, 1H, J=8.6), 9.37 и 9.53 (соответственно,broad s, основной, и s, второстепенный; 1H),10.76 и 11.09 (соответственно, второстепенный и основной; каждый s, 1H) ррm. Примечание: это соединение находится в растворе ДМСО в виде смеси двух ротамеров(примерно 5:1); в данных анализа указаны сигналы второстепенного и основного ротамеров. Пример 19. (3S-Амино-4-гидроксиамино 2R-изобутил)сукцинил-L-фенилаланин-N-метиламид, циклический ацетон -диаминал Целевое соединение в виде трифторацетата (соль) получено из соединения по примеру 18 путем перемешивания с чистым ацетоном и упаривания до сухого состояния в вакууме. Белый порошок. ЯМР (400 МГц, DMSO-d6) 0.75 и 0.80 (каждый d, 6H, J=6.8), 1.13 и 1.19 (каждый s, 6H),1.14 (s, 9H), 1.2-1.6 (m, 3 Н), 2.55 (m, 1H), 2.78(dd, 1H, J=8.1 и 13.7), 2.88 (dd, 1H, J=6.0 и 13.7),2.99 (d, J=8.5), 3.30 (m, 1H, перекрывается водой), 4.40 (ddd, 1H, J=6.0, 8.1 и 8.1), 7.21 (m,6H), 8.13 (d, 1H, J=8.1), 9.53 (3, 1H) ppm. Пример 20. (3S-Диметиламино-4-гидроксиамино-2R-изобутил)сукцинил-(S)-трет-бутилглицин-N-метиламид (соединение II-122). Целевое соединение получено в виде свободного основания; белый порошок. ЯМР (400 МГц, DMSO-d6) 0.73 и 0.81 (каждый d, 6H, J=6.5), 0.88 (s, 9H), 0.9-1.4 (m, 3 Н),2.18 (s, 6H), 2.53 (d, 3 Н, J=4.4), 2.80 (m, 2H), 4.22(d, 1H, J=9.4), 7.26 (d, 1H, J=9.4), 7.79 (q, 1H,J=4.4), 8.78 (s, 1H), 10.41 (s, 1H) ppm. Пример 21. (3S-Амино-4-гидроксиамино 2R-изобутил)сукцинил-(S)-трет-бутилглицин-N(4-пиридил)амид (соединение IV-2). Целевое соединение получено в виде трифторацетата (двойная соль); белый порошок. ЯМР (400 МГц, DMSO-d6) 0.76 и 0.83 (каждый d, 6 Н, J=6.5), 0.96 и 0.99 (соответственно,второстепенный и основной; каждый s, 9H), 1.11.5 (m, 3 Н), 3.03 и 3.30 (соответственно, основной и второстепенный; каждый m, 1 Н), 3.58 и 4.20 (соответственно, основной, d, J=6.4, и вто 53 ростепенный, broad s; 1H), 4.27 и 4.30 (соответственно, основной и второстепенный; каждый d,J=7.3), 7.88 (d, 2H, J=6.8), 8.15 (broad s, 3 Н), 8.60(d, 2H, J=6.8), 9.32 и 9.55 (соответственно, основной, broad s, и второстепенный, s; 1H), 10.77 и 11.03 (соответственно, основной и второстепенный; каждый s, 1H), 11.12 (s, 1H) ppm. Примечание: это соединение находится в растворе ДМСО в виде смеси двух ротамеров(примерно 4:1); в данных анализа указаны сигналы второстепенного и основного ротамеров. Пример 22. (3S-Амино-2R-циклопентилметил-4-гидроксиамино)сукцинил-(S)-трет-бутилглицин-N-(3,4-метилендиоксифенил)амид(соединение IV-41). Целевое соединение получено в виде трифторацетата (соль); белый порошок. ЯМР (400 МГц, DMSO-d6) 0.89 и 0,92 (соответственно, второстепенный и основной; каждый s, 9H), 1.2-1.8 (m, 11H), 2.93 (m, 1H), 3.58(m, 1H), 4.28 (d, J=9.4), 5.92 (m, 2H), 6.80 (d, 1H,J=8.2), 6.88 (dd, 1H, J=2.0 и 8.2), 7.20 (d, 1H,J=2.0), 7.85 и 8.10 (соответственно, второстепенный и основной; каждый broad s, 3 Н NH3+),7.90 и 7.97 (соответственно, второстепенный, d,J=9.0, и основной, d, J=9.4; 1H CONHCH), 9.26 и 9.35 (соответственно, основной и второстепенный; каждый s, 1H CONHOH), 9.93 и 10.01 (соответственно, основной и второстепенный, каждый s, 1H CONHAr), 10.72 и 10.96 (соответственно, второстепенный и основной; каждый s,1H CONHOH) ppm. Примечание: это соединение находится в растворе ДМСО в виде смеси двух ротамеров(примерно 4:1); в данных анализа указаны сигналы второстепенного и основного ротамеров. Пример 23. 10(S)-[(3S)-Амино-4-гидроксиамино-2R-изобутил)сукцинил]амино-1,8-диазатрицикло[10,6,1,013,18]нонадека-12(19),13(18),14,16-тетраен-9-он (соединение II-102). Целевое соединение получено в виде трифторацетата (соль); белый порошок. ЯМР (400 МГц, DMSO-d6)-0.03 и 0.49 (каждый m, 2H N-(СH2)3-CH2-(CH2)2-NHCO), 0.81 и 0.83 (каждый d, J=6.8, 6 Н), 1.0-1.4 (m, 4 Н N(СH2)2-СH2-СH2-СH2-СH2-NНСО), 1.10 и 1.50(соответственно, второстепенный и основной; каждый broad s, 3 Н NН 3+), 8.37 (d, J=8.1), 9.37 и 9.50 (соответственно, основной и второстепенный, каждый s, 1H CONHOH), 10.84 и 11.09 (соответственно, второстепенный и основной, каждый s, 1H CONHOH) ppm. Примечание: это соединение находится в растворе ДМСО в виде смеси двух ротамеров(примерно 84:16); в данных анализа указаны сигналы второстепенного и основного ротамеров. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, которое является производным сукцинамида формулы (I)R1 обозначает водород или низший алкил, в частности метил, этил,пропил, изопропил, изобутил, трет-бутил; арил,в частности фенил и нафтил; и арил(низший алкил), в частности бензил; причем эти группы могут быть не замещены или замещены одним или несколькими заместителями, имеющими одинаковые или разные значения, которые выбирают из группы, включающей метил, этил,изопропил, трет-бутил, фтор, хлор, бром, нитро,амино, диметиламино, гидрокси, метокси, этокси, ацетил, ацетамидо, карбокси, карбоксиметил; либо-(CH2)mциклопропил, где m равен нулю или целому числу от одного до трех и гетероциклил является 3-6-членным гетероциклильным кольцом,которое не конденсировано или конденсировано с бензолом или нафталиновым кольцом, имеющим, по крайней мере, один атом азота; такими группами предпочтительно являются сукцинимидо, фталимидо, сахарин, гидантоин, индолил,оксииндолил, 2-оксоизоиндолинил, имидазолил,пиридил,морфолино,пирролидино,2 оксопирролидино, пиперазино; причем указанная гетероциклильная группа может быть не замещена или замещена одним или несколькими заместителями, выбираемыми из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил, бензил, фенил, гидрокси, оксо, карбокси и нитро; либо 55 группу -(СH2)nСООН или -(CH2)mCOOR1,где n может быть равен 1, 2 или 3, m может быть равен 0, 1, 2 или 3 и R1 обозначает метил,этил, пропил, изопропил, изобутил, трет-бутил,фенил, бензил, аллил, стирил, 1-нафтил, 2 нафтил, причем указанные группы могут быть не замещены или замещены одним-тремя заместителями, выбираемыми из группы, включающей метил, этил, изопропил, трет-бутил, фтор,хлор, бром, нитро, амино, диметиламино, гидрокси, метокси, этокси, ацетил, ацетамидо, карбокси, карбоксиметил; либо группу, выбираемую из -(CH2)mSO2R1,-(CH2)mSO2NH2, -(CH2)mSO2-N(Me)2, -(СН 2)mSO2NHR1, где m, R1 и возможные заместители группы R1 имеют указанные выше значения,-(СН 2)mSО 2-(4-морфолино),-(CH2)mSO2-(1 пиперазино) или-(СH2)mSО 2-(4-метил-1 пиперазино); либо группу -(СН 2)mSO3 Н, где n имеет указанные выше значения; ацил, в частности ацетил, бензоил или фенацетил, которые могут быть не замещены или замещены одним или несколькими заместителями, выбираемыми из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил,бензил, фенил, гидрокси, оксо, карбокси и нитро; либо группу -С(О)-RII-C(О)RIII, где -RII- обозначает химическую связь, -СН 2-, -СH2(СH2)mСH2-,где m имеет указанные выше значения,-СН=СН-, -СH2 СН=СН-, фенилен (т.е. -С 6 Н 4-),-СH2 СН=СН-С 6 Н 4-, -СН 2 СH2CH=СH-, СH2-СС-,-СH2 СH2-СС-, -СH2 СH2 СН=СН-С 6 Н 4-, -СH2-ССС 6 Н 4-, -СH2 СH2-СС-C6 Н 4, и RIII выбирают из группы, включающей метил, этил, фенил, гидрокси, метокси, этокси, амино, метиламино,диметиламино и морфолино; либо-С(О)-гетероциклил, где гетероциклил имеет указанные выше значения; причем указанная гетероциклильная группа может быть не замещена или замещена одним или несколькими заместителями, выбираемыми из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил, бензил, фенил, гидрокси, оксо, карбокси и нитро; либо-С(О)-RII-гетероциклил или -С(О)-RII-арил,где RII, гетероциклил, арил и возможные заместители такого гетероциклила или арила имеют указанные выше значения; либоR2 обозначает С 3-C15 алкил с линейной или разветвленной цепью, который может быть не замещен или замещен С 3-С 7 циклоалкильной группой; либоR2 обозначает группу -RII-H, где RII имеет указанные выше значения, которая может быть не замещена или замещена одним-тремя заместителями, выбираемыми из группы, включаю 001432 56 щей метил, этил, С 3-С 4 алкил с линейной или разветвленной цепью, фтор, хлор, C1-C4 алкокси,нитро, амино, диметиламино, карбокси, карбоксиметил; либоR2 является группой -RII-X-RIV, где RII имеет указанные выше значения, RIV обозначает C1C6 алкил, С 3-С 7 циклоалкил, C2-C6 алкенил, фенил,фенил(C1-C6)алкил или фенил(C2C6)алкенил, причем указанные группы могут быть не замещены или замещены группой, выбираемой из F, Cl, Br, C1-C4 алкила, C1C4 алкокси, и Х обозначает прямую связь, атом кислорода, атом серы, сульфинил-S(O)-, сульфонил-S(O)2 или карбамоильную группуR3 обозначает характеристическую группу натуральной или ненатуральной альфааминокислоты, в которой любая функциональная группа, если она имеется, может быть защищена;C1-C4 алкильной группой с прямой или разветвленной цепью, такой как метил, этил и трет-бутил, или O-фенил и его производные,замещенные одним-тремя заместителями,выбираемыми из C1-C4 алкила с прямой или разветвленной цепью, хлора и метокси; либоR4 обозначает -NH(C1-C6 алкил), замещенный фенилом или гетероциклилом; либоR4 обозначает -NН(С 2-C6 алкил), замещенный группой, выбираемой из -CONH2,-NHCONH2, -SO2NH2, -NHSO2NH2 и их производных, в которых концевой атом азота замещен одной или двумя метильными группами,или их производных, в которых концевой атом азота является частью морфолинового, пирролидинового, пиперазинового или N-метилпиперазинового кольца; либоR3 и R4, вместе взятые, обозначают группу формулы -(СH2)m-NH-, где m является целым числом от 5 до 12, необязательно прерываемую группой -NR5-, где R5 выбирают из водорода,C1-C6 алкила, C1-C6 алкоксикарбонила, арила,арил(С 1-C6)алкила или арил(C1-C6)алкоксикарбонила, или прерываемую группой -C6H4-O- или индольным кольцом, присоединенным атомами С-3 и азота; при этом алкил, алкенил, фенил, циклоалкил, гетероциклил и характеристические группы в любом из приведенных выше определений R1,R2, R3 R4 и А могут быть не замещены или замещены одним или несколькими заместителями; а также их соли, пролекарства, сольваты и гидраты, при условии, что когда -NRR1 является 57NH2, защищенным амино или ациламино, R3 обозначает трет-бутил и R4 обозначает амино или алкиламино, тогда R2 не является изобутилом. 2. Соединение по п.1 формулы (I')R1 обозначает водород или низший алкил, в частности метил, этил,пропил, изопропил, изобутил, трет-бутил; арил,в частности фенил и нафтил; и арил (низший алкил), в частности бензил; причем эти группы могут быть не замещены или замещены одним или несколькими заместителями, имеющими одинаковые или разные значения, которые выбирают из группы, включающей метил, этил,изопропил, трет-бутил, фтор, хлор, бром, нитро,амино, диметиламино, гидрокси, метокси, этокси, ацетил, ацетамидо, карбокси, карбоксиметил; либо-(CH2)mциклопропил, где m равен нулю или целому числу от одного до трех, и гетероциклил является 3-6-членным гетероциклильным кольцом,которое не конденсировано или конденсировано с бензолом или нафталиновым кольцом, имеющим, по крайней мере, один атом азота; такими группами, предпочтительно, являются сукцинимидо, фталимидо, сахарин, гидантоин, индолил, оксииндолил, 2-оксоизоиндолинил, имидазолил, пиридил, морфолино, пирролидино, 2 оксопирролидино, пиперазино; причем указанная гетероциклильная группа может быть не замещена или замещена одним или несколькими заместителями, выбираемыми из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил, бензил, фенил, гидрокси, оксо, карбокси и нитро; либо группу -(СH2)nСООН или -(СН 2)mCOOR1,где n может быть равен 1, 2 или 3, m может быть равен 0, 1, 2 или 3 и R1 обозначает метил,этил, пропил, изопропил, изобутил, трет-бутил,фенил, бензил, аллил, стирил, 1-нафтил, 2 нафтил, причем указанные группы могут быть не замещены или замещены одним-тремя заместителями, выбираемыми из группы, включающей метил, этил, изопропил, трет-бутил, фтор,хлор, бром, нитро, амино, диметиламино, гидрокси, метокси, этокси, ацетил, ацетамидо, карбокси, карбоксиметил; либо группу, выбираемую из -(СH2)mSO2R1,-(CH2)mSO2NH2, -(CH2)m-SO2N(Me)2, - (CH2)mSO2NHR1, где m, R1 и возможные заместители группы R1 имеют указанные выше значения,-(CH2)mSO2-(4-морфолино), -(CH2)mSO2-(1-пипе 001432 58 разино) или -(CH2)mSO2-(4-метил-1-пиперазино); либо группу -(СH2)nSО 3 Н, где n имеет указанные выше значения; ацил, в частности ацетил, бензоил или фенацетил, которые могут быть не замещены или замещены одним или несколькими заместителями, выбираемыми из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил,бензил, фенил, гидрокси, оксо, карбокси и нитро; либо группу -С(О)-RII-C(О)RIII, где -RII обозначает химическую связь, -СН 2-, -СН 2(CH2)mСН 2-,где m имеет указанные выше значения,-СН=СН-, -СН 2 СН=СН-, фенилен (т.е. -C6H4-),-СH2 СН=СН-C6 Н 4-, -СH2 СH2 СН=СН-, CH2-CC-,-CH2CH2-CC-, -CH2CH2CH=CH-C6H4-, -СH2-ССC6 Н 4-, -СH2 СH2-СС-C6 Н 4-, и RIII выбирают из группы, включающей метил, этил, фенил, гидрокси, метокси, этокси, амино, метиламино,диметиламино и морфолино; либо-С(О)-гетероциклил, где гетероциклил имеет указанные выше значения; причем такая гетероциклильная группа может быть не замещена или замещена одним или несколькими заместителями, выбираемыми из группы, включающей бром, хлор, фтор, метокси, этокси, метил, этил, бензил, фенил, гидрокси, оксо, карбокси и нитро; либо-С(О)-RII-гетероциклил или -С(О)-RII-арил,где RII, гетероциклил, арил и возможные заместители такого гетероциклила или арила имеют указанные выше значения; либоR2 обозначает С 3-C15 алкил с линейной или разветвленной цепью, который может быть не замещен или замещен С 3-С 7 циклоалкильной группой; либоR2 обозначает группу -RII-H, где RII имеет указанные выше значения, которая может быть не замещена или замещена одним-тремя заместителями, выбираемыми из группы, включающей метил, этил, С 3-С 4 алкил с линейной или разветвленной цепью, фтор, хлор, C1-C4 алкокси,нитро, амино, диметиламино, карбокси, карбоксиметил; либоR2 является группой -RII-X-RIV, где RII имеет указанные выше значения, -Х- обозначает прямую связь, -О-, -S-, -SO-, -SO2, -CONH- или-NHCO-, и RIV обозначает C1-C6 алкил, С 2C6 алкенил, метил, этил, пропил, бутил, фенил или бензил, при этом бензольное кольцо фенильной и бензильной групп может быть не замещено или замещено одним или несколькими заместителями, выбираемыми из группы, включающей метил, этил, пропил, бутил, гидрокси,метокси, этокси, хлор, фтор, трифторметил или нитро;OCH2Ph, (4-метокси)фенилметил, (4-гидрокси) фенилметил, индолилметил, (N-метил)индолилметил, 1-нафтилметил, 2-нафтилметил, (4 карбоксиметокси)фенилметил,циклогексил,фенил, пиридил, тиазолил, тиенил, пиридилметил, тиазолилметил, тиенилметил и их производные, в которых любая фенильная, пиридильная, тиазолильная и тиенильная группа замещена хлором, фтором, метокси или C1-С 3 алкилом;C1-C4 алкильной группой с прямой или разветвленной цепью, такой как метил, этил и трет-бутил, или O-фенил и его производные,замещенные одним-тремя заместителями,выбираемыми из C1-C4 алкила с прямой или разветвленной цепью, хлора и метокси; либоR4 обозначает -NH2 или -NH-алкил, где алкил выбирают из метила, этила, пропила, бутила, изопропила, изобутила, втор-бутила и третбутила; причем указанные алкильные группы с линейной или разветвленной цепью могут быть не замещены или замещены группой, выбираемой из фенила, бензила, 2-пиридила, 3 пиридила, 1,3,4-тиадиазолил-2-ила, 2-тиазолила; эти группы в свою очередь могут быть не замещены или замещены заместителем, выбираемым из метила, этила, метокси, амино, метиламино, диметиламино, карбокси, метоксикарбонила, этоксикарбонила, -SO2NH2, -SO2NНC6 Н 5, SO2-морфолино, -SO2 СН 3, -CONH2, -СОморфолино; либоR4 является группой -NHCH2CH2Y,-NHCH2CH2CH2Y,-NHCH2CH2CH2-CH2Y,-NНСH2 СН(СН 3)Y или -NHCH2C(СН 3)2Y, где Y обозначает амино, метиламмно, диметиламино,морфолино, пирролидино, пиперазино, Nметилпиперазино, гидрокси, метокси, этокси,метилтио, 2-(диметиламино)этилтио, 2-(морфолино)этилтио, Cl, F, Вr, фенокси или фенилтио,где фенильное кольцо может быть замещено гидрокси или метокси; либоR4 обозначает -NH-арил, -NH-гетероциклил, -NН-СH2-арил, -NH-(CH2)2 арил, NНСН 2-гетероарил или -NH-(СН 2)2-гетероциклил,где арильную группу выбирают из группы,включающей фенил,4-фторфенил,4 метоксифенил, 1,3-бензодиоксолил, 4-толил, 1 инданил, 5-инданил, и гетероциклильную группу выбирают из группы, включающей 2 бензимидазолил, 2-бензотиазолил, 1-бензотриазолил, 2,5-диметил-1-пирролидинил, 2,6-диметилпиперидинил, 2-имидазолил, 1-индолил, 5 индолил,5-индазолил,1-изохинолил,5 изохинолил, 2-метокси-5-пиридил, 1-метил-2 бензимидазолил,4-метил-7-кумаринил,3 метил-5-изотиазолил,5-метил-3-изоксазолил, 001432R4 обозначает -NH(C2-C6 алкил), где алкильная группа замещена заместителем, выбираемым из -CONH2, -CONHMe, -NHCONH2,-NHCO-NMe2, -NHCO-(4-морфолино), -NHCO(4-метил-1-пиперазино), -NHSO2-NH2, -NHSO2R3 и R4, вместе взятые, обозначают группу формулы -(СH2)10-NH- или группу формулыR3 и R4, вместе взятые, обозначают группу нижеследующей формулы (В): или группу нижеследующей формулы (С): где n является целым числом от 3 до 6; а также их фармацевтически приемлемые соли,сольваты, гидраты и пролекарства, описанные выше, при условии, что когда -NRR1 является-NH2, защищенным амино или ациламино, R3 обозначает трет-бутил и R4 обозначает амино или алкиламино, тогда R2 не является изобутилом. 3. Соединение по п.2, в которомR3 выбирают из группы, включающей фенил, пиридил, тиазолил, тиенил, пиридилметил,тиазолилметил, тиенилметил, хинолилметил,изохинолилметил, 1-нафтилметил, 2-нафтилметил, индолилметил, N-метилендолилметил,имидазолилметил, включая их производные,замещенные в фенильном, пиридильном, тиазолильном, тиенильном, хинолильном или изохинолильном кольце одним или двумя заместителями, выбираемыми из хлора, фтора, гидрокси,
МПК / Метки
МПК: C07C 259/06, C07D 213/40, A61P 35/00, C07D 487/08, A61K 31/16
Метки: металлопротеиназ, ингибиторы, матриксных
Код ссылки
<a href="https://eas.patents.su/30-1432-ingibitory-matriksnyh-metalloproteinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы матриксных металлопротеиназ</a>
Предыдущий патент: Роторный двигатель внутреннего сгорания “горник-2м”
Следующий патент: Способ получения биологически активного препарата “оксидат торфа”
Случайный патент: Способ получения 3-фенилурацилов












