Кристаллический терапевтический агент
Номер патента: 4681
Опубликовано: 24.06.2004
Авторы: Харрис Лоренс Джеймс, Вуд Альберт Шо, Стори Ричард Энтони
Формула / Реферат
Полиморф 1-{6-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2H-пиразоло[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил}-4-этилпиперазина, имеющий имитированный тип порошковой рентгенограммы с главными пиками, преимущественно как определено ниже
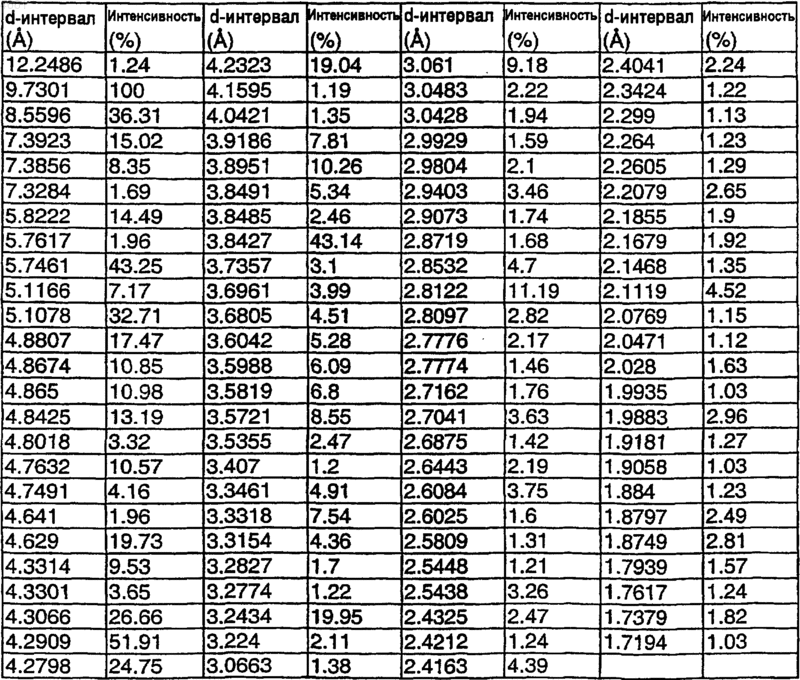
где указанный тип порошковой рентгенограммы получен с использованием рентгеновских лучей меди K-a 1, имеющих длину волны 1,54178 Е.
Текст
1 Настоящее изобретение относится к полиморфу 1-6-этокси-5-[3-этил-6,7-дигидро-2-(2 метоксиэтил)-7-оксо-2 Н-пиразоло[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазина, имеющему формулу (I) имеющему тип PXRD (порошковой рентгеновской дифракции), главным образом, как определено далее в настоящем документе. Как описано в WO 01/27113, 1-6-этокси 5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо 2 Н-пиразоло[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазин представляет собой мощный и селективный ингибитор цГМФ ФДЭ 5 и является особенно пригодным для лечения, inter alia, эректильной дисфункции у мужчин. Для успешного использования в условиях фармацевтического производства важно, чтобы физико-химические свойства активного материала были известны или предсказуемы во время процессов его производства и фармацевтической обработки, а также во время перевозки,хранения и, в конечном итоге, терапевтического использования. В некоторых случаях соединения могут обладать необходимыми медицинскими свойствами, которые не могут быть непосредственно распространены на подходящую фармацевтическую композицию, поскольку само активное соединение имеет неудовлетворительные физические свойства, такие как, например, плохие химические свойства или свойства при переработке. Стабильные кристаллические материалы являются весьма желательными для использования в фармацевтической промышленности, поскольку кристаллические материалы обычно более стабильны, чем их аморфные аналоги, они имеют ограниченную структуру,которую воспроизводимым образом можно охарактеризовать по дифракции рентгеновских лучей, которую можно использовать для идентификации присутствия специфической полиморфной формы. Настоящее изобретение относится к кристаллической структуре 1-6-этокси-5-[3-этил 6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазина. Кристаллический материал 1-6-этокси-5[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо 2 Н-пиразоло[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазина, определенный в настоящем документе, можно называть также несольватированным продуктом 1-6 этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил) 004681 2 7-оксо-2 Н-пиразоло[4,3-d]пиримидин-5-ил]-3 пиридилсульфонил-4-этилпиперазина; указанный несольватированный продукт, определенный в настоящем документе, означает продукт,который практически не содержит удерживаемого растворителя, связанного внутри кристаллической решетки или каким-либо другим образом заключенного или соединенного с кристаллами. Растворитель, удерживаемый на поверхности кристаллической решетки, не входит в определение удерживаемого растворителя, хотя предпочтительно, чтобы кристаллический материал по настоящему изобретению не удерживал растворитель на поверхности. Практически, отсутствие удерживаемого растворителя, как определено в настоящем документе, означает, что общее количество удерживаемого внутри структуры кристаллической решетки или задержанного в кристаллах растворителя составляет менее 1%, предпочтительно менее приблизительно 0,85%, более предпочтительно менее приблизительно 0,3%, и, особенно от 0 до 0,25%. Кристаллы 1-6-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3d]пиримидин-5-ил]-3-пиридилсульфонил-4 этилпиперазина, имеющие тип XRD, как определено в настоящем документе, имеют высокую температуру плавления, и недавние исследования показали, что они являются негигроскопичными, стабильными и обладают хорошими свойствами для изготовления композиций. Получение 1-6-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3d]пиримидин-5-ил]-3-пиридилсульфонил-4 этилпиперазина, имеющего формулу (I), по настоящему изобретению, можно осуществлять,как показано в разделах "Пример" и "Препараты" далее в настоящем документе. Тип XRD (рентгеновской дифракции) 1-6 этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)7-оксо-2 Н-пиразоло[4,3-d]пиримидин-5-ил]-3 пиридилсульфонил-4-этилпиперазина, имеющего формулу (I), можно охарактеризовать в соответствии с методикой, описанной далее в настоящем документе. Рентгеновский дифракционный анализ Тип рентгеновской дифракции (XRD) единичного кристалла для 1-6-этокси-5-[3-этил 6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазина, имеющего т.пл. 162165 С (полученного в соответствии со способом примера 1), определяли посредством рентгеновского дифракционного анализа единичного кристалла. Изучали типичный кристалл и собирали данные по ряду 1 (максимум sin /=0,5) с использованием дифрактометра Siemens R4RA/v. Факторы рассеяния атомов брали из таблиц для рентгеновской кристаллографии (InternationalTables for X-Ray Crystallography, Vol. IV, стр. 55,99, 149, Birmingham: Kynoch Press, 1974). Все кристаллографические расчеты были произве 3Sheldrick, SHELXTL, User Manual, Nicolet Instruments Co., 1981). Все данные с дифрактометра снимали при комнатной температуре. Имитированный тип порошковой рентгенограммы (PXRD) (как представлено в табл. 1 для интенсивностей свыше 1%) был выведен из данных по единичному кристаллу, с использованием модуля Cerius2 Diffraction-Crystal с излучением = 1,54178 с фактором поляризации 0,5 и без монохроматора. Размер кристалла был принят за 500 х 500 х 500 3 с формой пика Lorentzian. Пики дифракции имитировали свыше угла два-тета 255. Кристаллографические расчеты (расчеты интенсивностей) облегчались использованием системы SHELXTL (G.M. Sheldrick, SHELXTL,User Manual, Nicolet Instruments Co., 1981). Конечный R-индекс составлял 4,60%. Главные пики (в градусах ) имитированного типа PXRD представлены в табл. 1. Главные пики, как определено в настоящем документе, представляют собой пики, имеющие интенсивность более 1%. Таблица 1 Таким образом, настоящее изобретение относится к материалу 1-6-этокси-5-[3-этил 6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазину,имеющему типPXRD, преимущественно, как определено в табл. 1, при измерении согласно описанному в настоящем описании способу. Специалист в области кристаллографии примет во внимание тот факт, что в то время как относительные интенсивности различных пиков в пределах табл. 1 могут варьировать вследствие ряда факторов, таких как, например, ориентационные эффекты кристаллов в рентгеновском луче или чистота анализируемого материала,или степень кристалличности образца, позиции пиков будут оставаться практически теми же,которые определены в таблице. Специалист в области кристаллографии примет во внимание также тот факт, что измерения с использованием другой длины волны 4 будут давать другие сдвиги, согласно уравнению Брегга -n = 2d sin . Указанные дополнительные типы PXRD 16-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3-d]пиримидин-5 ил]-3-пиридилсульфонил-4-этилпиперазина,полученные при использовании альтернативных длин волн, рассматриваются как альтернативные варианты типа PXRD кристаллического материала по настоящему изобретению и в качестве таковых входят в объем настоящего изобретения. То же соединение, как определено по типуXRD, описанному в табл. 1, полученное альтернативными способами (как подробно описано в разделе "Примеры", далее), может иметь температуру плавления в пределах от 155-165 С (измерено с использованием Perkin ElmerDSC7/TGA7 при скорости нагревания 20 С в минуту). Эксперименты показывают, что кристаллическое соединение, как определено в настоящем документе, имеет тенденцию существования в одной полиморфной форме, как описано выше в настоящем документе и как указано в примерах ниже. Мономорфные соединения являются особенно желательными для фармацевтических целей. Кристаллическое соединение по настоящему изобретению, далее упоминаемое как "соединение", можно вводить в отдельности, но при лечении людей обычно его вводят в смеси с подходящим фармацевтическим наполнителем,разбавителем или носителем, выбранным с учетом предполагаемого пути введения и стандартной фармацевтической практики. Например, соединение можно вводить перорально, буккально или сублингвально, в форме таблеток, капсул (включая мягкие гелевые капсулы), лекарственных форм овальной формы, эликсиров, растворов или суспензий, которые могут содержать корригенты или красители, для немедленного, отсроченного, модифицированного или контролируемого высвобождения, такого как замедленная, двойственная или прерывистая доставка. Соединение можно также вводить посредством быстродиспергируемых или быстрорастворимых лекарственных форм или в форме высокоэнергетической дисперсии или в виде частиц с покрытием. Подходящие фармацевтические композиции соединения могут, по желанию, иметь или не иметь покрытие. Указанные таблетки могут содержать наполнители, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, вторичный кислит фосфата кальция,глицин и крахмал (предпочтительно, кукурузный, картофельный крахмал или крахмал из тапиоки), дезинтегрирующие агенты, такие как гликолят натрийкрахмала, натрийкроскармеллоза и некоторые сложные силикаты, а также 5 связывающие агенты для гранулирования, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (ГПМЦ), гидроксипропилцеллюлоза (ГПЦ), сахароза, желатин и аравийская камедь. Кроме того, могут быть включены смазывающие агенты, такие как стеарат магния, стеариновая кислота, эфир глицерина и бегеновой кислоты и тальк. Твердые композиции подобного типа можно использовать также в качестве наполнителей для желатиновых капсул. Предпочтительные наполнители для этих целей включают лактозу, крахмал, целлюлозу, молочный сахар или высокомолекулярные полиэтиленгликоли. Для водных суспензий и/или эликсиров соединение можно объединять с различными подсластителями или корригентами, окрашивающими веществами или красителями, с эмульгирующими и/или суспендирующими агентами, а также с разбавителями, такими как вода, этанол, пропиленгликоль и глицерин и их комбинации. Лекарственные формы с модифицированным высвобождением и прерывистым высвобождением могут содержать наполнители, такие,которые подробно описаны для лекарственных форм с немедленным высвобождением, вместе с дополнительными наполнителями, которые действуют как модификаторы скорости высвобождения, будучи нанесенными в качестве покрытия и/или включенными в состав препарата. Модификаторы скорости высвобождения включают, без ограничения, гидроксипропилметилцеллюлозу, метилцеллюлозу, натрийкарбоксиметилцеллюлозу, этилцеллюлозу, ацетат целлюлозы, оксид полиэтилена, ксантановую камедь,карбомер, сополимер аммиака и метакрилата,гидрогенизированное касторовое масло, карнаубский воск, парафиновый воск, фталат ацетата целлюлозы, фталат гидроксипропилметилцеллюлозы, сополимер метакриловой кислоты и их смеси. Лекарственные формы с модифицированным высвобождением и прерывистым высвобождением могут содержать один из или комбинацию из модифицирующих скорость высвобождения наполнителей. Модифицирующие скорость высвобождения наполнители могут быть представлены как внутри лекарственной формы, т.е. внутри матрикса, так и/или на лекарственной форме, т.е. на поверхности или покрытии. Быстродиспергируемые или быстрорастворимые лекарственные формы (FDDF) могут содержать следующие ингредиенты: аспартам,ацесульфам калия, лимонную кислоту, натрийкроскармеллозу, кросповидон, диаскорбиновую кислоту, этилакрилат, этилцеллюлозу, желатин,гидроксипропилметилцеллюлозу, стеарат магния, маннит, метилметакрилат, мятный корригент, полиэтиленгликоль, коллоидный диоксид кремния, диоксид кремния, гликолят натрийкрахмала, стеарилфумарат натрия, сорбит, ксилит. Термины "диспергирование" или "раство 004681 6 рение", используемые в настоящем документе для описания FDDF, зависят от растворимости используемого лекарственного вещества, т.е.,если лекарственное вещество является нерастворимым, можно изготовить быстродиспергируемую лекарственную форму, а если лекарственное вещество является растворимым, можно изготовить быстрорастворимую лекарственную форму. Соединение можно также вводить парентерально, например, интракавернозно, внутривенно, внутриартериально, интраперитонеально,интратекально, интравентрикулярно, интрауретрально, интрастернально, интракраниально,внутримышечно или подкожно, или их можно вводить инфузией или безыгольной инъекцией. Для парентерального введения их лучше всего применять в форме стерильного водного раствора, который может содержать другие вещества, например соли или глюкозу, в количестве,достаточном для придания раствору изотоничности по отношению к крови. Водные растворы следует дополнить подходящим количеством буфера (предпочтительно, до рН от 3 до 9), если это необходимо. Изготовление подходящих композиций для парентерального введения в стерильных условиях легко осуществляется с помощью стандартных фармацевтических методик, хорошо известных специалистам в данной области. Для перорального и парентерального введения пациентам-людям уровень суточных доз соединения будет обычно составлять от 10 до 500 мг (однократной или разделенными дозами). Таким образом, например, таблетки или капсулы могут содержать от 5 до 250 мг активного соединения для введения одной или двух или более за один раз, как потребуется. В любом случае лечащий врач будет определять конкретную дозировку, которая будет наиболее подходящей для любого отдельного пациента, и она будет варьировать в зависимости от возраста, массы тела и реакции конкретного пациента. Приведенные выше дозы представляют собой пример для среднего случая. Разумеется, могут иметь место отдельные случаи, когда благоприятными будут более высокие или более низкие пределы доз, и они также входят в объем настоящего изобретения. Специалист оценит также тот факт, что при лечении определенных состояний (включая MED и FSD) соединение можно вводить в виде однократной дозы на основе "по потребности" (т.е. сколько необходимо или желательно). Пример композиции для таблеток Обычно композиция для таблеток может содержать приблизительно от 0,01 до 500 мг соединения, в то время как масса таблетки может варьировать от 50 до 1000 мг. Приводится пример композиции для 10 мг таблетки:% мас./мас. Свободная кислота, свободное основание или 10,000 Соль соединения Лактоза 64,125 Крахмал 21,375 Натрий-кроскармеллоза 3,000 Стеарат магния 1,500 Данное количество обычно подбирают в соответствии с активностью лекарственного средства. Таблетки изготавливают с помощью стандартных технологий, например, прямого прессования или влажного или сухого гранулирования. На ядра таблеток можно наносить покрытие с использованием подходящих материалов. Соединение можно также вводить интраназально или с помощью ингаляции, и его удобно доставлять ингалятором в форме сухого порошка или аэрозольного распыления из контейнера под давлением, помпы, спрея или небулайзера, с использованием подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан(HFA 134A [товарный знак] или 1,1,1,2,3,3,3 гептафторпропан (HFA 227EA [товарный знак],диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением стандартную дозу можно обеспечивать с помощью клапана для доставки отмеренного количества. Контейнер под давлением, помпа, спрей или небулайзер могут содержать раствор или суспензию активного соединения, например, с использованием смеси этанола и пропеллента в качестве растворителя, который может дополнительно содержать смазывающий агент, например, триолеат сорбитана. Капсулы и картриджи (изготовленные, например, из желатина) для использования в ингаляторе или инсуффляторе могут содержать порошкообразную смесь соединения по настоящему изобретению и подходящую порошкообразную основу, такую как лактоза или крахмал. Аэрозольные или сухие порошкообразные композиции предпочтительно изготавливают таким образом, чтобы каждая отмеренная доза или "впрыскивание" содержала от 1 до 50 мг соединения по настоящему изобретению для доставки пациенту. Суммарная суточная доза при использовании аэрозоля будет находиться в пределах от 1 до 50 мг, которую можно вводить однократной дозой или, более обычно, разделенными дозами в течение дня. Соединение можно также изготавливать для доставки с помощью распылителя. Композиции для распылительных устройств могут содержать следующие ингредиенты в качестве солюбилизаторов, эмульгаторов или суспендирующих агентов: воду, этанол, глицерин, пропиленгликоль, низкомолекулярные полиэтиленгликоли, хлорид натрия, фторуглероды, эфиры полиэтиленгликоля, триолеат сорбитана,олеиновую кислоту. 8 Альтернативно, соединение можно вводить в форме суппозитория или пессария, или его можно наносить местно в форме геля, гидрогеля, лосьона, раствора, крема, мази или пылевидного порошка. Соединение можно также вводить дермально. Соединение можно также вводить трансдермально, например, с использованием накожного пластыря. Соединение можно также вводить главным, легочным или ректальным путями. Для офтальмологического применения соединение можно изготавливать в форме микронизированных суспензий в изотоническом, с подобранным значением рН, стерильном физиологическом растворе, или, предпочтительно,в форме растворов в изотоническом, с подобранным значением рН, стерильном физиологическом растворе, необязательно, в комбинации с консервантом, таким как хлорид бензалкония. Альтернативно, соединение можно изготавливать в форме мази, такой как вазелин. Для местного нанесения на кожу соединение по настоящему изобретению можно изготавливать в форме подходящей мази, содержащей активное соединение, суспендированное или растворенное, например, в смеси с одним или более из следующих агентов: минеральным маслом, жидким вазелином, белым вазелином,пропиленгликолем, полиоксиэтиленполиоксипропиленовым соединением, эмульгирующим воском и водой. Альтернативно, его можно изготавливать в форме подходящего лосьона или крема, суспендированным или растворенным,например, в смеси с одним или более из следующих агентов: минеральным маслом, моностеаратом сорбитана, полиэтиленгликолем,жидким парафином, полисорбатом 60, воском цетиловых сложных эфиров, цетеариловым спиртом, 2-октилдодеканолом, бензиловым спиртом и водой. Соединение можно использовать также в комбинации с циклодекстрином. Известно, что циклодекстрины образуют комплексы, включающие и не включающие молекулы лекарственного средства. Образование комплекса лекарственное средство - циклодекстрин может изменить растворимость, скорость растворения,биодоступность и/или стабильность молекулы лекарственного средства. Комплексы лекарственное средство - циклодекстрин обычно пригодны для большинства лекарственных форм и путей введения. В качестве альтернативы, прямому комплексообразованию с лекарственным средством циклодекстрин можно использовать в качестве вспомогательной добавки, например, в качестве носителя, разбавителя или солюбилизатора. Наиболее часто используют альфа-, бета- и гамма-циклодекстрины, а подходящие примеры описаны в WO-A-91/11172, WO-A94/02518 и WO-A-98/55148. Обычно для пациента-человека пероральное введение соединения является предпочти 9 тельным путем введения, будучи наиболее удобным и, например, при MED, не имеющим хорошо известных недостатков, связанных с интракавернозным (и/к) введением. Предпочтительной схемой перорального введения приMED для среднего мужчины является введение от 25 до 250 мг соединения, когда это требуется. В тех условиях, когда реципиент страдает нарушениями глотания или нарушением всасывания лекарственного средства после перорального введения, лекарственное средство можно вводить парентерально, сублингвально или буккально. Для ветеринарного применения соединение или его приемлемую для ветеринарных целей соль, или его приемлемый для ветеринарных целей сольват, или его пролекарство вводят в форме удобной подходящей композиции в соответствии с обычной ветеринарной практикой, и ветеринарный врач определит схему введения и путь введения, который будет наиболее подходящим для конкретного животного. Таким образом, настоящее изобретение относится к фармацевтической композиции,включающей кристаллическое соединение по настоящему изобретению вместе с фармацевтически приемлемым разбавителем или носителем. Оно относится также к ветеринарной композиции, включающей кристаллическое соединение по настоящему изобретению вместе с приемлемым для ветеринарных целей разбавителем или носителем. Кристаллический материал, определенный в настоящем описании, можно получить в соответствии с разделами "препараты" и "примеры",представленными ниже. Получение исходных материалов для примера 1 Препарат 1. N-[3-карбамоил-5-этил-1-(2 метоксиэтил)-1 Н-пиразол-4-ил]-2-этокси-5-(4 этил-1-пиперазинилсульфонил)никотинамид(а) 2-гидрокси-5-сульфоникотиновая кислота 2-гидроксиникотиновую (27 кг, 194,2 моль) добавляли частями к 30% олеуму (58,1 кг) при 50 С в течение 1 ч. Это вызывало экзотермическую реакцию с повышением температуры до 82 С. Реакционную смесь далее нагревали до 140 С. После поддержания указанной температуры в течение 12 ч содержимое реактора охлаждали до 15 С и фильтровали. Отфильтрованную массу затем ресуспендировали в ацетоне(33 кг) при комнатной температуре, фильтровали и высушивали, с получением указанного в заголовке соединения (35,3 кг, 83%) в виде твердого вещества белого цвета.(500 г, 2,28 моль) растворяли в этаноле (2,5 л) при перемешивании и нагревали до 80 С. Спустя 30 мин 0,5 л растворителя выпаривалось, затем его заменяли свежим этанолом (0,5 л) и вновь доводили температуру до 80 С. Еще через 60 мин 1,0 л растворителя выпаривалось, затем его заменяли свежим этанолом (1,0 л) и вновь доводили температуру до 80 С. Еще через 60 мин 1,0 л растворителя выпаривалось, реакционную смесь охлаждали до 22 С и перемешивали в течение 16 ч. Выпавший в осадок продукт фильтровали, промывали этанолом (0,5 л) и высушивали при 50 С в вакууме, с получением указанного в заголовке соединения (416 г, 74%) в виде твердого вещества белого цвета. Температура разложения 237 С.(DMSOd6) : 1,25(c) Этил-2-хлор-5-хлорсульфоникотиноат Этил-2-гидрокси-5-сульфоникотиноат (24,7 г, 0,1 моль) суспендировали в тионилхлориде (238 г, 2,0 моль) и диметилформамиде (1,0 мл) при перемешивании. Реакционную смесь затем нагревали с обратным холодильником в течение 2,5 ч. Массу тионилхлорида удаляли в вакууме, а остаточный тионилхлорид удаляли с использованием толуолового азеотропа, с получением неочищенного указанного в заголовке соединения(30,7 г, 108%) в виде масла желтого цвета, d(CDCl3) : 1,46 (3 Н, т), 4,50 (2 Н, кв), 8,72 (1 Н, д),9,09 (1 Н, д). Указанный продукт переносили непосредственно на следующую стадию.(d) Этил-2-хлор-5-(4-этил-1-пиперазинилсульфонил)никотиноат Неочищенный этил-2-хлор-5-хлорсульфоникотиноат (30,7 г, предположительно 0,1 моль) растворяли в этилацетате (150 мл) при перемешивании, затем охлаждали во льду. Добавляли раствор N-этилпиперазина (11,4 г, 0,1 моль) и триэтиламина (22,5 г, 0,22 моль) в этилацетате(50 мл), тщательно перемешивали в течение 30 мин, поддерживая внутреннюю температуру ниже 10 С. По окончании добавления реакционной смеси позволяли нагреться до 22 С и перемешивали в течение 1 ч. Твердое вещество отфильтровывали, а оставшийся фильтрат концентрировали в вакууме, с получением неочищенного указанного в заголовке соединения(37,1 г, 103%) в виде неочищенной смолы желтого цвета.(CDCl3): 1,10 (3 Н, т), 1,42 (3 Н, м),2,50 (2 Н, м), 2,60 (4 Н, м), 3,19 (4 Н, м), 4,43 (2 Н,кв), 8,40 (1 Н, д), 8,80 (1 Н, д). m/z (Найдено: 362(e) Этил-2-этокси-5-(4-этил-1-пиперазинилсульфонил)никотиноат Раствор этил-2-хлор-5-(4-этил-1-пиперазинилсульфонил)никотиноата (36,1 г, 0,1 моль) в этаноле (180 мл) охлаждали до 10 С при перемешивании. Добавляли этоксид натрия (10,2 г,0,15 моль) порциями, поддерживая температуру ниже 20 С. Реакционную смесь затем перемешивали при комнатной температуре в течение 18 ч. Осадок отфильтровывали и к фильтрату добавляли воду (180 мл). Затем фильтрат нагревали до 40 С в течение 1 ч. Затем этанол (180 мл) выпаривали при атмосферном давлении, а оставшемуся водному раствору позволяли остыть до комнатной температуры. Выпавший в осадок продукт затем отфильтровывали, промывали водой и высушивали в вакууме при 50 С, с получением указанного в заголовке соединения(12,6 г, 34%) в виде твердого вещества светлокоричневого цвета. Т.пл. 66-68C.(CDCl3): 1,04 (3H, т), 1,39 (3H, т), 1,45 (3H, т), 2,41 (2 Н,кв), 2,52 (4 Н, м), 3,08 (4 Н, м), 4,38 (2 Н, кв), 2,57(f) 2-этокси-5-(4-этил-1-пиперазинилсульфонил)никотиновая кислота Этил-2-этокси-5-(4-этил-1-пиперазинилсульфонил)никотиноат (10,2 г, 0,0275 моль) растворяли в толуоле (50 мл) и к нему добавляли раствор гидроксида натрия (1,1 г, 0,0275 моль) в воде (20 мл). Полученную двухфазную смесь затем интенсивно перемешивали при комнатной температуре в течение ночи. Водная фаза отделялась, и ее рН доводили до 5,6 добавлением концентрированной хлористо-водородной кислоты. Выпавший в осадок продукт суспендировали при охлаждении льдом в течение 15 мин, фильтровали, промывали водой и высушивали в вакууме при 50 С, с получением указанного в заголовке соединения (4,1 г, 43%) в виде твердого вещества не совсем белого цвета. Т.пл. 206-207 С.(СDСl3): 1,25 (3 Н, т), 1,39 К перемешиваемому раствору 2,2 диметоксибутана (10 г, 84,7 ммоль) в СН 2 Сl2 (50 мл) в атмосфере азота при 0 С добавляли пиридин (13,7 мл, 169,5 ммоль). Температуру реакционной смеси поддерживали на уровне 0 С и добавляли раствор трихлорацетилхлорида (18,9 мл, 169,5 ммоль) в СН 2 Сl2 (35 мл) в течение 1 ч при постоянном перемешивании. По мере прогрессирования реакции из желто-оранжевого раствора начинал выпадать осадок в виде твер 004681 12 дого вещества белого цвета. Реакционной смеси позволяли нагреться до комнатной температуры в течение 20 ч. Реакционную смесь разбавляли этанолом (150 мл) и вновь охлаждали до 0 С перед действием гидратом гидразина (8,2 мл,169,5 ммоль) в виде раствора в этаноле (35 мл) в течение 30 мин. Реакционную смесь нагревали до 50 С и растворитель выпаривали при атмосферном давлении. Температуру повышали до тех пор, пока температура верхних слоев не достигала 78 С. Нагревание с обратным холодильником осуществляли в течение еще 2 ч,перед охлаждением до комнатной температуры. Реакционную смесь разбавляли водой (250 мл) и этанол удаляли выпариванием при пониженном давлении. Полученную смесь экстрагировали СН 2 Сl2 (3 х 200 мл). Объединенные органические слои высушивали (MgSO4), фильтровали и выпаривали при пониженном давлении, с получением указанного в заголовке соединения в виде масла коричневого цвета, 12,05 г, 85%. 1 Водный раствор гидроксида натрия (10 М; 100 мл, 1,0 моль) по каплям добавляли к перемешиваемой суспензии указанного в заголовке соединения "препарата 1" (g) (66,0 г, 0,39 моль) в метаноле и полученный раствор нагревали с обратным холодильником в течение 4 ч. Охлажденную реакционную смесь концентрировали при пониженном давлении приблизительно до 200 мл, разбавляли водой (200 мл) и указанную смесь промывали толуолом (3 х 100 мл). Полученную водную фазу подкисляли концентрированной хлористо-водородной кислотой до рН 4 и выпавший осадок белого цвета собирали и высушивали с помощью отсоса, с получением указанного в заголовке соединения (34,1 г).(DMSOd6): 1,13 (3 Н, т), 2,56 (2 Н, кв), 6,42(i) 4-нитро-3-н-пропил-1 Н-пиразол-5-карбоновая кислота Дымящую серную кислоту (17,8 мл) по каплям добавляли к перемешиваемой, охлажденной на льду дымящей азотной кислоте (16,0 мл),полученный раствор нагревали до 50 С, затем порциями добавляли 3-н-пропил-1 Н-пиразол-5 карбоновую кислоту (Chem. Pharm. Bull., 1984,32, 1568; 16,4 г, 0,106 моль) в течение 30 мин,поддерживая температуру реакционной смеси ниже 60 С. Полученный раствор нагревали в течение 18 ч при 60 С, позволяли ему остыть,затем выливали на лед. Выпавший осадок белого цвета собирали, промывали водой и высуши 13 вали с помощью отсоса, с получением указанного в заголовке соединения (15,4 г). Т.пл. 170172 С. Найдено: С, 42,35; H, 4,56; N, 21,07. С 7 Н 9N3O4 рассчитано С, 42,21; H, 4,55; N,21,10%.(DМSОd6): 0,90 (3 Н, т), 1,64 (2 Н, м),2,83 (2 Н, м), 14,00 (1 Н, с). Получено из указанного в заголовке соединения "препарата 1" (h) по аналогии с процессом "препарата 1" (i) в виде твердого вещества коричневого цвета (64%).(DМSОd6): 1,18(k) 4-нитро-3-н-пропил-1 Н-пиразол-5-карбоксамид Раствор указанного в заголовке соединения "препарата 1" (i) (15,4 г, 0,077 моль) в тионилхлориде (75 мл) нагревали с обратным холодильником в течение 3 ч, а затем охлажденную реакционную смесь выпаривали при пониженном давлении. Остаток подвергали азеотропной перегонке с тетрагидрофураном (2 х 50 мл), а затем суспендировали в тетрагидрофуране (50 мл), перемешиваемую суспензию охлаждали льдом и действовали на нее газообразным аммиаком в течение 1 ч. Добавляли воду (50 мл) и полученную смесь выпаривали при пониженном давлении, с получением твердого вещества, которое после растирания с водой и сушки с помощью отсоса представляло собой указанное в заголовке соединение (14,3 г). Т.пл. 197-199 С. Найдено: С, 42,35; H, 5,07; N, 28,38. С 7 Н 10N4O3 рассчитано С, 42,42; H, 5,09; N, 28,27%. Получено из указанного в заголовке соединения "препарата 1" (j) по аналогии с процессом "препарата 1" (k) в виде твердого вещества белого цвета (90%).(DMSOd6): 1,17 (3 Н,т), 2,87 (2 Н, м), 7,40 (1H, с), 7,60 (1 Н, с), 7,90 14 20 ч. Смесь охлаждали до комнатной температуры и добавляли СН 2 Сl2 (67,5 л) и воду (22,5 л). Полученные органический и водный слои разделялись. Водную фазу экстрагировали СН 2 Сl2 (22,5 л) и объединенный органический раствор выпаривали при атмосферном давлении и замещали этилацетатом (33 л) до конечного объема 17 л. Охлажденную смесь гранулировали при комнатной температуре в течение 2 ч,фильтровали и промывали этилацетатом (2,5 л). Получали 5-этил-1-(2-метоксиэтил)-4-нитро-1 Нпиразол-3-карбоксамид в виде кристаллического твердого вещества белого цвета, 2,10 кг, 57%. Т.пл. 140 С. Найдено: С, 44,46; Н, 5,79; N, 23,01. С 9 Н 14N4O4 рассчитано С, 44,63; Н, 5,79; N,23,14%.(CDCl3): 1,18 (3 Н, т), 2,98 (2 Н, кв), 3,22(m)(ii) 5-этил-1-(2-метоксиэтил)-4-нитро 1 Н-пиразол-3-карбоксамид Смесь 3-этил-4-нитро-1 Н-пиразол-5-карбоксамида (25 г, 0,136 моль), карбоната натрия (18 г, 0,17 моль) и иодида натрия (20,4 г, 0,136 моль) суспендировали в этилметилкетоне (125 мл) при комнатной температуре. Добавляли 2 бромэтилметиловый эфир (12,8 мл, 0,142 моль) и смесь нагревали с обратным холодильником и перемешивали в течение 70 ч. Смесь охлаждали до комнатной температуры и добавляли воду(250 мл). Полученную смесь нагревали до температуры обратного холодильника и поддерживали указанную температуру в течение 30 мин перед тем, как охладить до комнатной температуры. Полученный осадок гранулировали при комнатной температуре в течение 3 ч, фильтровали и высушивали в вакууме, с получением 5 этил-1-(2-метоксиэтил)-4-нитро-1H-пиразол-3 карбоксамида в виде кристаллического твердого вещества желтого цвета, 24,3 г, 74%. Данные такие же, как представлено в "препарате 1" Смесь 5-этил-1-(2-метоксиэтил)-4-нитро 1 Н-пиразол-3-карбоксамида (20 г, 82,6 ммоль) и 5% Pd/C (1 г) в метаноле (200 мл) подвергали давлению 50 фунтов/дюйм 2/25 С в герметично закрытом сосуде и перемешивали в течение 15 ч. По окончании реакции смесь фильтровали через arbocel, а осадок, оставшийся на фильтре,промывали метанолом. Метаноловый раствор выпаривали при атмосферном давлении и замещали этилацетатом до конечного объема 100 мл. Охлажденную смесь гранулировали при комнатной температуре в течение 2 ч, фильтровали 15 и промывали этилацетатом (20 мл), с получением 4-амино-5-этил-1-(2-метоксиэтил)-1 Н-пиразол-3-карбоксамида в виде кристаллического твердого вещества белого цвета, 15 г, 88%. Т.пл. 131 С. Найдено: С, 50,75; Н, 7,62; N, 26,38. Путь (а) 2-этокси-5-(4-этил-1-пиперазинилсульфонил)никотиновую кислоту (2,31 кг, 6,73 моль) суспендировали в этилацетате (16,2 л) и добавляли 1,1-карбонилдиимидазол (1,09 кг, 6,73 моль) при комнатной температуре. Реакционную смесь нагревали до 45 С в течение 40 мин,а затем реакционную смесь перемешивали в течение еще 40 мин при температуре кипения с обратным холодильником. После охлаждения до температуры окружающей среды к охлажденной смеси добавляли 4-амино-5-этил-1-(2 метоксиэтил)-1H-пиразол-3-карбоксамид (1,5 кг,7,06 моль) и реакционную смесь перемешивали в течение еще 15 ч при температуре кипения с обратным холодильником. Смесь охлаждали,фильтровали и осадок, оставшийся на фильтре,промывали смесью 90% воды/10% этилацетата(2 мл/г), с получением N-[3-карбамоил-5-этил-1(2-метоксиэтил)-1 Н-пиразол-4-ил]-2-этокси-5-(4-этил-1-пиперазинилсульфонил) никотинамида в виде кристаллического твердого вещества не совсем белого цвета,3,16 кг, 88%. Т.пл. = 156 С. Найдено: С, 51,33; Н, 6,56; N, 18,36. С 23 Н 35N7O6S рассчитано С,51,40; Н, 6,53; N, 18,25%.(CDCl3) : 1,04 (3 Н, т), 1,22 (3 Н, т), 1,60LRMS: m/z = 539 (М+1)+. Путь (b) 2-этокси-5-(4-этил-1-пиперазинилсульфонил)никотиновую кислоту (27,5 г, 0,08 моль) суспендировали в этилацетате (0,193 л) и добавляли 1,1-карбонилдиимидазол (13,3 г, 0,082 моль) при комнатной температуре. Реакционную смесь нагревали до 45 С в течение 15 мин,а затем реакционную смесь перемешивали в течение еще 60 мин при температуре кипения с обратным холодильником. После охлаждения 16 до температуры окружающей среды к охлажденной смеси добавляли 4-амино-5-этил-1-(2 метоксиэтил)-1H-пиразол-3-карбоксамид (16,5 г, 0,078 моль) и реакционную смесь перемешивали в течение еще 17 ч при температуре кипения с обратным холодильником. Раствор охлаждали и добавляли воду (0,07 л) и этилацетат(0,17 л). Суспензию нагревали до 40 С и органический слой отделяли. Органический слой концентрировали выпариванием 0,23 л растворителя. Суспензию охлаждали, гранулировали при 0 - -10 С, фильтровали и осадок, оставшийся на фильтре, промывали смесью 90% воды/10% этилацетата (2 мл/г), с получением N[3-карбамоил-5-этил-1-(2-метоксиэтил)-1 Н-пиразол-4-ил]-2-этокси-5-(4-этил-1-пиперазинилсульфонил) никотинамида в виде кристаллического твердого вещества не совсем белого цвета,38,7 г, 89%. Т.пл. = 159-161 С.(CDCl3): 1,04 (3 Н, т), 1,22 (3 Н, т), 1,61LRMS: m/z = 538 (М+1)+. Получение исходных материалов для примера 2 а) Пиридин-2-амино-5-сульфоновая кислота 2-аминопиридин (80 г, 0,85 моль) добавляли по частям в течение 30 мин к олеуму (320 г) и полученный раствор нагревали до 140 С в течение 4 ч. После охлаждения реакционную смесь выливали на лед (200 г) и смесь перемешивали на бане со льдом/солью в течение еще 2 ч. Полученную суспензию фильтровали, твердое вещество промывали ледяной водой (200 мл) и холодным IMS (200 мл) и высушивали с использованием отсоса, с получением указанного в заголовке соединения в виде твердого вещества,111,3 г; LRMS: m/z 175 (М+1)+. Бром (99 г, 0,62 моль) добавляли по каплям в течение часа к горячему раствору продукта со стадии а) (108 г, 0,62 моль) в воде (600 мл) так, чтобы поддерживать устойчивое нагревание с обратным холодильником. По завершении добавления реакционную смесь охлаждали и полученную смесь фильтровали. Твердое вещество промывали водой и высушивали с использованием отсоса, с получением указанного в заголовке соединения, 53,4 г;(DMSOd6, 300 Раствор нитрита натрия (7,6 г, 110,0 ммоль) в воде (30 мл) добавляли по каплям к ледяному раствору продукта со стадии b) (25,3 г, 100,0 ммоль) в водной хлористо-водородной кислоте (115 мл, 20%) таким образом, чтобы поддерживать температуру ниже 6 С. Реакционную смесь перемешивали в течение 30 мин при 0 С и в течение еще одного часа при комнатной температуре. Реакционную смесь выпаривали при пониженном давлении и остаток высушивали в вакууме при 70 С в течение 72 ч. Смесь полученного твердого вещества, пентахлорида фосфора (30,0 г, 144 ммоль) и оксихлорида фосфора (1 мл, 10,8 ммоль) нагревали до 125 С в течение 3 ч, а затем охлаждали. Реакционную смесь выливали на лед (100 г) и полученное твердое вещество фильтровали и промывали водой. Продукт растворяли в дихлорметане, высушивали (МgSO4) и выпаривали при пониженном давлении, с получением указанного в заголовке соединения в виде твердого вещества желтого цвета, 26,58 г;(СDСl3, 300 МГц): 8,46 Раствор 1-этилпиперазина (11,3 мл, 89,0 ммоль) и триэтиламина (12,5 мл, 89,0 ммоль) в дихлорметане (150 мл) добавляли по каплям к ледяному раствору продукта со стадии с) (23,0 г, 79,0 ммоль) в дихлорметане (150 мл) и реакционную смесь перемешивали при 0 С в течение часа. Реакционную смесь концентрировали при пониженном давлении и остаточное масло коричневого цвета очищали колоночной хроматографией на силикагеле, с использованием градиента элюции дихлорметан:метанол (от 99:1 до 97:3), с получением указанного в заголовке соединения в виде твердого вещества оранжевого цвета, 14,5 г;(CDCl3, 300 МГц); 1,05 (3 Н, т),2,42 (2 Н, кв), 2,55 (4 Н, м), 3,12 (4 Н, м), 8,24 (1 Н,с), 8,67 (1 Н, с). е) 3-бром-2-этокси-5-(4-этилпиперазин-1 илсульфонил)пиридин Смесь продукта со стадии d) (6,60 г, 17,9 ммоль) и этоксида натрия (6,09 г, 89,55 ммоль) в этаноле (100 мл) нагревали с обратным холодильником в течение 18 ч, затем охлаждали. Реакционную смесь концентрировали при пониженном давлении, остаток распределяли между водой (100 мл) и этилацетатом (100 мл), и слои разделялись. Водную фазу экстрагировали этилацетатом (2 х 100 мл), объединенные органические растворы высушивали (МgSO4) и выпаривали при пониженном давлении, с получением указанного в заголовке соединения в виде твердого вещества коричневого цвета, 6,41 г; Найдено: С, 41,27; Н, 5,33; N, 11,11. С 13 Н 20 ВrN3 О 3S рассчитано С, 41,35; Н, 5,28; N,10,99%.(СDСl3, 300 МГц): 1,06 (3 Н, т), 1,48 Смесь продукта со стадии е) (6,40 г, 16,92 ммоль), триэтиламина (12 мл, 86,1 ммоль) и трис(трифенилфосфина) палладия (0) в этаноле(60 мл) нагревали до 100 С при давлении 200 ПСИ в атмосфере моноксида углерода в течение 18 ч, затем охлаждали. Реакционную смесь выпаривали при пониженном давлении, а остаток очищали колоночной хроматографией на силикагеле, с использованием градиента элюции дихлорметан:метанол (от 100:0 до 97:3), с получением указанного в заголовке соединения в виде масла оранжевого цвета, 6,2 г;(СDСl3,300 МГц): 1,02 (3H, т), 1,39 (3H, т), 1,45 (3H, т),2,40 (2 Н, кв), 2,54 (4 Н, м), 3,08 (4 Н, м), 4,38 (2 Н,кв), 4,55 (2 Н, кв), 8,37 (1 Н, с), 8,62 (1 Н, с); 19 Смесь продукта со стадии f) (4,96 г, 13,35 ммоль) и водного раствора гидроксида натрия(25 мл, 2 н, 50,0 ммоль) в этаноле (25 мл) перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении до половины объема,промывали эфиром и подкисляли до рН 5 с помощью 4 н хлористо-водородной кислоты. Водный раствор экстрагировали дихлорметаном (3 х 30 мл), объединенные органические экстракты высушивали (MgSO4) и выпаривали при пониженном давлении, с получением указанного в заголовке соединения в виде твердого вещества желтовато-коричневого цвета, 4,02 г; Раствор 4-амино-3-этил-1 Н-пиразол-5 карбоксамида (WO 9849166, препарат 8) (9,2 г,59,8 ммоль) в N,N-диметилформамиде (60 мл) добавляли к раствору продукта со стадии g)(13,15 мл, 94,3 ммоль) в дихлорметане (240 мл). Добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (13,26 г, 69,2 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Дихлорметан удаляли при пониженном давлении, оставшийся раствор выливали в этилацетат (400 мл) и указанную смесь промывали водным раствором бикарбоната натрия (400 мл). Полученный кристаллический осадок фильтровали, промывали этилацетатом и высушивали в вакууме,с получением указанного в заголовке соединения в виде порошка белого цвета, 22 г;(CDCl3 20 суспендировали в этилацетате (16,2 л) и добавляли 1,1-карбонилдиимидазол (1,09 кг, 6,73 моль) при комнатной температуре. Реакционную смесь нагревали до 45 С в течение 40 мин,а затем реакционную смесь перемешивали в течение еще 40 мин при температуре кипения с обратным холодильником. После охлаждения до температуры окружающей среды к охлажденной смеси добавляли 4-амино-5-этил-1-(2 метоксиэтил)-1H-пиразол-3-карбоксамид (1,5 кг,7,06 моль) и реакционную смесь перемешивали в течение еще 15 ч при температуре кипения с обратным холодильником. Смесь охлаждали,фильтровали и осадок, оставшийся на фильтре,промывали смесью 90% воды/10% этилацетата(2 мл/г), с получением N-[3-карбамоил-5-этил-1(2-метоксиэтил)-1H-пиразол-4-ил]-2-этокси-5-(4-этил-1-пиперазинилсульфонил)никотинамида в виде кристаллического твердого вещества не совсем белого цвета,3,16 кг, 88%. Т.пл. = 156 С. Найдено: С, 51,33; Н, 6,56; N, 18,36. C23H35N7O6S рассчитано С,51,40; Н, 6,53; N, 18,25%.(СDСl3): 1,04 (3H, т), 1,22 (3H, т), 1,60 Путь (а) Для получения соединения препарата 3 смесь указанного в заголовке соединения препарата 1, N-[3-карбамоил-5-этил-1-(2-метоксиэтил)-1 Н-пиразол-4-ил]-2-этокси-5-(4-этил-1 пиперазинилсульфонил)никотинамида (1,18 кг,2,2 моль), трет-бутоксида калия (500 г, 4,4 моль) и этилацетата (193 г) в этаноле (11,8 л) нагревали до 120 С в течение 20 ч. Реакционную смесь затем концентрировали при пониженном давлении, в целом выпаривалось около 10 л растворителя. К остатку добавляли воду (2,9 л) и смесь перемешивали при комнатной температуре, добавляя водную НСl до получения рН 7,5. Добавляли этилацетат (7,5 л) и двухфазную смесь нагревали до 55 С. Органическая фаза отделялась,а водную фазу экстрагировали этилацетатом(3,0 л). Объединенные органические фазы перегоняли при атмосферном давлении до конечного объема 4 л. Выпавшие в осадок твердые вещества гранулировали при 5 С в течение 1 ч, фильтровали и промывали этилацетатом (1,2 л) и высушивали в вакууме. Получали 1-(6-этокси-5-[3 21 этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразол[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил)-4-этилпиперазин в виде кристаллического твердого вещества светложелтого цвета, 877 г, 78%. Т.пл. = 157 С. Найдено: С, 52,65; Н, 6,46; N, 17,76. C23H33N7O5S. 0,2 С 2 Н 5 СO2 СН 3 рассчитано С, 53,21; Н, 6,49; N,18,25%.(СDСl3): 1,07 (3H, т), 1,42 (3H, т), 1,61(3H, т), 2,44 (2 Н, кв), 2,57 (4 Н, м), 3,08 (2 Н, кв),3,15 (4 Н, м), 3,32 (3H, с), 3,92 (2 Н, кв), 4,48 (2 Н,кв), 4,77 (2 Н, кв), 8,65 (1 Н, д), 9,06 (1 Н, д). Данный спектр также имеет сигналы, которые соответствуют сольвату с этилацетатом.LRMS: m/z = 520 (M+1)+. Путь (b) Для получения соединения препарата 3 смесь указанного в заголовке соединения препарата 1, N-[3-карбамоил-5-этил-1-(2-метоксиэтил)-1 Н-пиразол-4-ил]-2-этокси-5-(4-этил-1 пиперазинилсульфонил)никотинамида, 34,6 г,0,064 моль), трет-бутоксида калия (14,8 г, 0,132 моль) и этилацетата (8,5 г, 0,096 моль) в этаноле(0,26 л) нагревали до 105-107 С в течение 17 ч. Реакционную смесь затем концентрировали при пониженном давлении, в целом выпаривалось около 0,16 л растворителя. К оставшемуся маслу добавляли воду (0,28 л) и смесь перемешивали при комнатной температуре, добавляя водную НСl до получения рН 7,5. Выпавшие в осадок твердые вещества гранулировали при -10 С 0 С в течение 1 ч, фильтровали и промывали этанолом (0,4 л) и высушивали в вакууме. Получали 1-(6-этокси-5-[3-этил-6,7-дигидро-2-(2 метоксиэтил)-7-оксо-2 Н-пиразол[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил)-4-этилпиперазин в виде кристаллического твердого вещества светло-желтого цвета, 23,3 г, 69,7%. Т.пл. = 168-170 С.(CDCl3): 1,07 (3H, т), 1,42 (3H, т), 1,61 22 перазина, загружали с последующим добавлением 12 мл/г (120 мл) 16% воды в этиловом спирте. Суспензию нагревали с обратным холодильником с получением раствора, и 6 мл/г (60 мл) отгоняли при атмосферном давлении. Раствор затем охлаждали до комнатной температуры; кристаллизация наблюдалась при 40 С. Суспензию затем охлаждали до 5-10 С и гранулировали в течение 30 мин, после чего ее фильтровали и промывали этиловым спиртом 2 мл/г (20 мл). Влажное твердое вещество высушивали в вакууме в течение ночи при 55-60 С, с получением кристаллического твердого вещества белого цвета. (Выход 7,6 г, 76%). Температура плавления 162-165 С.(СDСl3): 1,05 (3H, т), 1,42 (3H, т), 1,58(60 мл) отгоняли при атмосферном давлении. Раствор затем охлаждали до комнатной температуры; кристаллизация наблюдалась при 40 С. Суспензию затем охлаждали до 0 - -10 С и гранулировали в течение 30 мин, после чего ее фильтровали и промывали этиловым спиртом 2 мл/г (20 мл). Влажное твердое вещество высушивали в вакууме в течение ночи при 55-60 С, с получением кристаллического твердого вещества белого цвета. (Выход 9,4 г, 94%). Температура плавления 158-160 С.(СDСl3): 1,05 (3H, т), 1,42 (3H, т), 1,58(1 Н, с). В способах, описанных в примерах, можно использовать воду и фармацевтически приемлемые спирты, такие как метанол, этанол, про 23 панол, предпочтительно, этанол или изопропанол и их смеси. Указанные процессы можно использовать также для перекристаллизации указанного в заголовке соединения. Специалисту в области химии понятно, что сольваты можно получить с помощью различных стандартных методик, известных в данной области. Другие сольваты 1-6-этокси-5-[3-этил-6,7 дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразол[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазина можно получить или из сольвата с этилацетатом (соединение "препарата 3") или из соединений примеров 1 или 2. Указанные другие сольваты можно получить, например, путем:(a) суспендирования исходного соединения в течение продолжительного периода времени(такого как, например, приблизительно 2 недели) с растворителем, который изучается, (например, ацетонитрилом), с последующим фильтрованием твердого материала и анализом(b) растворения исходного материала в растворителе, который изучается, (например,ацетонитриле), с последующей перекристаллизацией желаемого сольвата из указанного раствора любыми подходящими способами, такими как, например, методика охлаждения или выпаривания с последующим анализом (с использованием стандартной методики PXRD или инфракрасного анализа, известных специалистам) указанного "влажного", т.е. невысушенного,твердого (сольватированного) материала. Кристаллическое соединение, как определено в настоящем документе, можно получать из его сольватов посредством десольватирования с использованием стандартных методик,например, тепловой обработкой (предпочтительно при температуре приблизительно от 100 до 150 С) или с использованием вакуумной методики (при температуре окружающей среды и выше) или суспендированием в несольватирующем растворителе (например, как описано в примерах 1 и 2). Специалист в области химии может использовать альтернативные методики сушки для получения кристаллического соединения, описанного выше в настоящем документе. Другие сольваты 1-6-этокси-5-[3-этил-6,7 дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразол[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазина, которые были получены, включают: н-бутанол, метилэтилкетон(МЕК), ацетонитрил, тетрагидрофуран, толуол. Наличие сольватированного материала можно определить с помощью PXRD. Например, сольваты 1-6-этокси-5-[3-этил 6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пира 004681 24 зол[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазина с ацетонитрилом получали сначала путем растворения материала в горячем ацетонитриле с последующим медленным охлаждением и гранулированием при комнатной температуре в течение ночи. Раствор затем фильтровали в вакууме и полученный твердый материал (сольват) оставляли сушиться при комнатной температуре и атмосферном давлении. Наличие сольвата определяли с помощью PXRD. Альтернативный способ обнаружения сольвата представляет собой мониторинг уменьшения массы с помощью TGA. Сольват с ацетонитрилом представляет собой полусольват, хотя возможны и другие сольваты. Было показано, что из указанных сольватированных материалов получается аморфное свободное основание 1-6-этокси-5-[3-этил-6,7 дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразол[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазина, если их высушивать приблизительно при 150 С, что проиллюстрировано с помощью дифференциальной сканирующей калориметрии (ДСК). Эксперименты с ДСК, упомянутые в настоящем документе, осуществляли с использованием Perkin Elmer DSC7/TGA7, при скорости нагревания 20 С в минуту. Фиг. 1, представленная далее в настоящем документе, показывает: след ДСК кристаллического материала, имеющего тип PXRD, представленный в табл. 1 (соединение примера 1); след ДСК сольвата с этилацетатом (соединение"препарата 3"); след ДСК сольвата с ацетонитрилом (соединение примера 1; указанный сольват получали, как было подробно описано ранее в настоящем документе). ФОРМУЛА ИЗОБРЕТЕНИЯ Полиморф 1-6-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3d]пиримидин-5-ил]-3-пиридилсульфонил-4 этилпиперазина, имеющий имитированный тип порошковой рентгенограммы с главными пиками, преимущественно, как определено ниже где указанный тип порошковой рентгенограммы получен с использованием рентгеновских лучей меди К-1, имеющих длину волны 1,54178 .
МПК / Метки
МПК: C07D 487/04
Метки: кристаллический, терапевтический, агент
Код ссылки
<a href="https://eas.patents.su/14-4681-kristallicheskijj-terapevticheskijj-agent.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллический терапевтический агент</a>
Предыдущий патент: Пиримидин-2, 4, 6-трионовые ингибиторы металлопротеиназ
Следующий патент: Бензотиадиазиновые соединения, способ их получения и содержащие их фармацевтические композиции
Случайный патент: Способ и система для хранения и транспортировки молока и емкость для хранения и транспортировки молока












