Оксабициклогептаны и оксабициклогептены, их получение и применение
Формула / Реферат
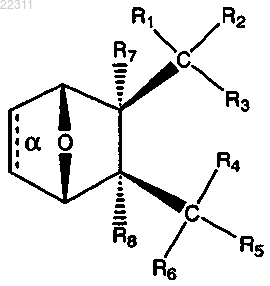
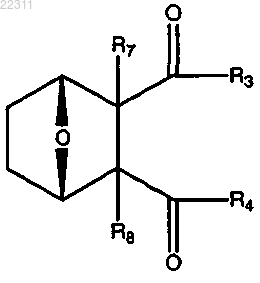
1. Соединение, имеющее структуру
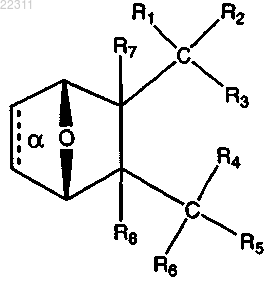
где связь α отсутствует;
R1 и R2 вместе представляют собой =O;
R3 представляет собой О(СН2)1-6R9 или OR10, где R9 представляет собой С5-С6 арил и где R10 представляет собой C2-C12 алкил, замещенный С1-С12 алкил, C2-C12 алкенил, С2-С12 алкинил, замещенный С5-С6 арил,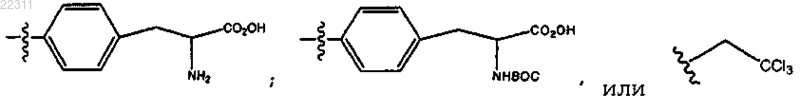
R4 представляет собой
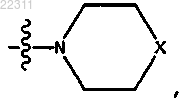
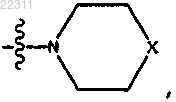
где X представляет собой NR11,
где каждый R11 представляет собой C1-C12 алкил, C1-C12 гидроксиалкил, C2-C12 алкенил или C2-C12 алкинил;
или R3 и R4 являются отличными друг от друга и каждый представляет собой ОН или
R5 и R6 вместе представляют собой =O;
R7 и R8, каждый, представляет собой Н;
или соль, энантиомер или цвиттер-ион соединения.
2. Соединение по п.1,
где R3 представляет собой O(CH2)2-6R9 или OR10,
где R9 представляет собой С6 арил,
R10 представляет собой C2-C12 алкил, замещенный С6 арил,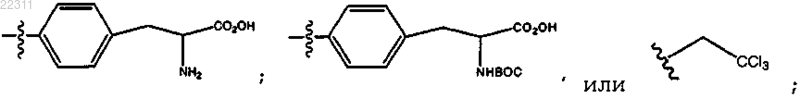
или соль, энантиомер или цвиттер-ион соединения.
3. Соединение по п.1,
где R3 представляет собой ОН и R4 представляет собой
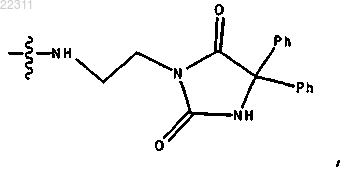
или соль, энантиомер или цвиттер-ион соединения.
4. Соединение по п.1, где соединение имеет структуру
5. Соединение по п.1, 2 или 4, где R3 представляет собой OR10, где R10 представляет собой замещенный фенил, где заместитель находится в пара-положении.
6. Соединение по любому из пп.1, 2 или 4,
где R3 представляет собой О(СН2)1-2R9 или OR10,
где R9 представляет собой С6 арил;
R10 представляет собой замещенный фенил, где заместитель находится в пара-положении;
R4 представляет собой
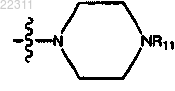
где R11 представляет собой C1-C12 алкил или С1-С12 гидроксилалкил.
7. Соединение по любому из пп.1, 2 или 4,
где R3 представляет собой O(CH2)R9 или OR10,
где R9 представляет собой фенил;
R10 представляет собой CH2CCl3,
 или
или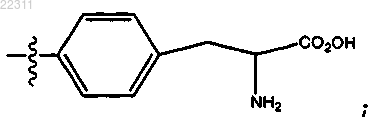
R4 представляет собой
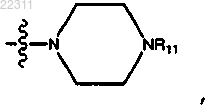
где R11 представляет собой СН3 или СН3СН2ОН.
8. Соединение по п.1,
где R3 представляет собой OR10,
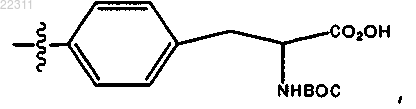
где R10 представляет собой (СН2)1-6(CHNHBoc)CO2H, (CH2)1-6(CHNH2)CO2H или (CH2)1-6CCl3, или
R10 представляет собой СН2(CHNHBoc)СО2Н; или
R10 представляет собой СН2(CHNH2)СО2Н; или
R10 представляет собой CH2CCl3.
9. Соединение по любому из пп.1, 2 или 4, где
R3 представляет собой O(CH2)1-6R9, где R9 представляет собой фенил, или
R3 представляет собой O(CH2)R9, где R9 представляет собой фенил.
10. Соединение по любому из пп.1, 2 или 4-9,
где R4 представляет собой
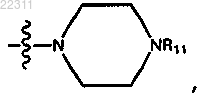
где R11 представляет собой -СН2СН2ОН или -СН3.
11. Соединение по п.1, имеющее структуру
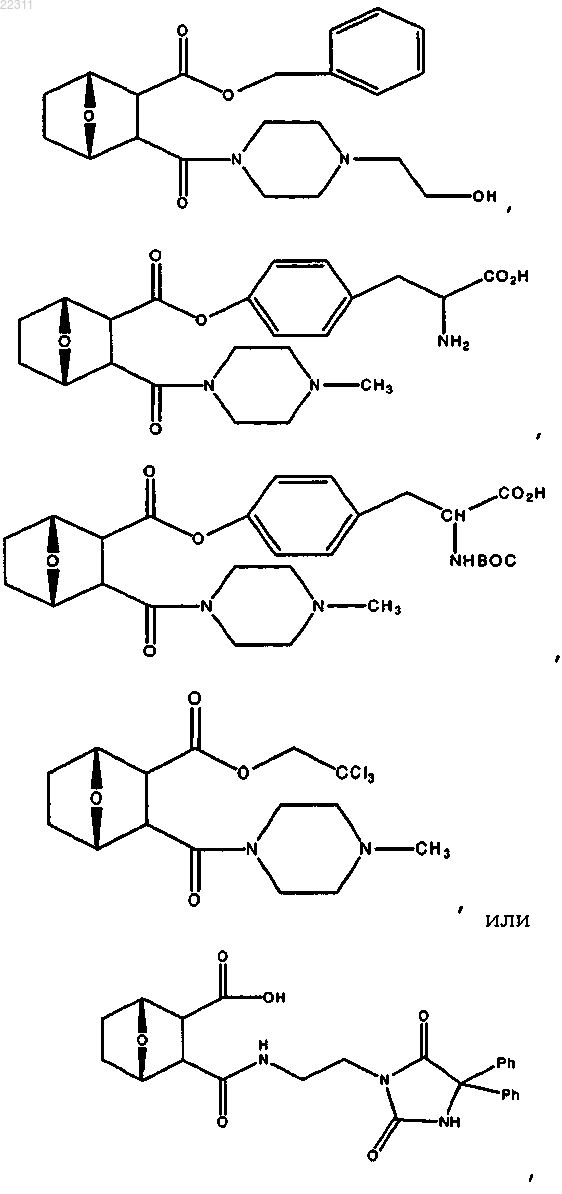
или соль, энантиомер или цвиттер-ион соединения.
12. Фармацевтическая композиция, содержащая соединение по любому из пп.1-11 и фармацевтически приемлемый носитель.
13. Способ получения соединений по любому из пп.1-11, включающий
(а) взаимодействие ангидрида, имеющего указанную структуру
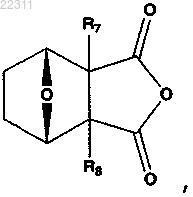
где R7 и R8, каждый, представляет собой Н,
по меньшей мере с одним нуклеофилом с образованием соединений, имеющих структуру

где R3 представляет собой O(CH2)1-6R9 или OR10,
где R9 представляет собой С5-С6 арил;
R10 представляет собой С2-С12 алкил, замещенный C1-C12 алкил, C2-C12 алкенил, C2-C12 алкинил, замещенный С5-С6 арил,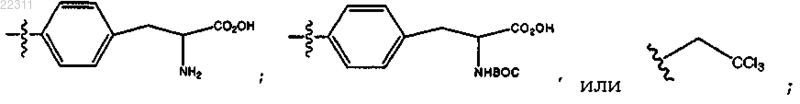
R4 представляет собой ОН или
R3 представляет собой ОН и
R4 представляет собой
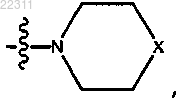
где X представляет собой NR11,
где каждый R11 представляет собой C1-C12 алкил, C1-C12 гидроксиалкил, C2-C12 алкенил или C2-C12 алкинил;
или R3 и R4 являются отличными друг от друга и каждый представляет собой ОН или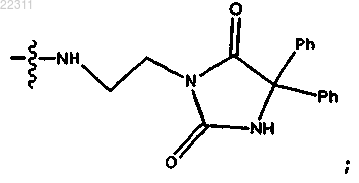
R7 и R8, каждый, представляет собой Н;
и/или
(b) взаимодействие продукта стадии (а) с нуклеофилом в присутствии 1-этил-3-(3-диметиламинопропил)карбодиимида или сульфонилхлорида с образованием соединения со структурой
где R3 представляет собой O(CH2)1-6R9 или OR10, где R9 представляет собой С5-С6 арил,
где R10 представляет собой C2-C12 алкил, замещенный С1-С12 алкил, C2-C12 алкенил, C2-C12 алкинил, замещенный С5-С6 арил,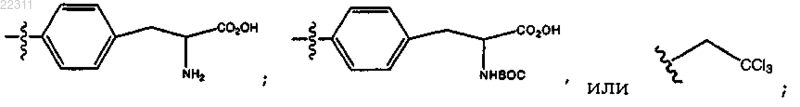
R4 представляет собой
где X представляет собой NR11,
где каждый R11 независимо представляет собой C1-C12 алкил, C1-С12 гидроксиалкил, C2-C12 алкенил или С2-С12 алкинил;
R7 и R8, каждый, представляет собой Н; и
где нуклеофил на стадии (а) или (b) содержит по меньшей мере одну гидроксильную группу; или
нуклеофил содержит по меньшей мере одну свободную аминогруппу; или
нуклеофил представляет собой О(СН2)1-6R9 или OR10; или
нуклеофил представляет собой
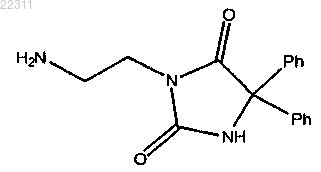
или
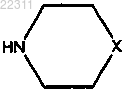
где X такой, как определено выше.
14. Применение соединения по любому из пп.1-11 для лечения рака молочной железы, рака толстой кишки, крупноклеточного рака легкого, рака легкого, мелкоклеточного рака легкого, рака желудка, рака печени, рака яичника, рака поджелудочной железы, рака предстательной железы, промиелоцитарного лейкоза, хронического миелоцитарного лейкоза и острого лимфоцитарного лейкоза.
Текст
Данное изобретение относится к соединению структуры, указанной ниже, или его соли,энантиомеру или цвиттер-иону, где связьотсутствует; R1 и R2 вместе представляют собой собой где X представляет собой NR11, где каждый R11 представляет собой С 1-С 12 алкил,C1-C12 гидроксиалкил, С 2-С 12 алкенил или С 2-С 12 алкинил; или R3 и R4 являются отличными друг от друга и каждый представляет собой ОН или=O; и R7 и R8 каждый представляет собой Н. Изобретение также относится к способу его получения,фармацевтической композиции, содержащей его, и к применению соединения для лечения рака. Данная заявка претендует на преимущество приоритета предварительной заявки США под номером 61/137691, поданной 1 августа 2008 г., содержание которой включено сюда посредством ссылки. По тексту данной заявки даны ссылки на некоторые публикации. Подробные ссылки на данные публикации могут быть найдены непосредственно перед формулой изобретения. Описания данных публикаций, таким образом, в полном объеме включены посредством ссылки в данную заявку для более полного описания существующего уровня техники, к которому относится данное изобретение. Уровень техники Ретиноиды, метаболиты витамина А, были исследованы на их терапевтическую эффективность в отношении различных опухолей, включая глиомы (Yung et al. (1996. Корепрессор ядерного рецептора(N-CoR) тесно связан с рецептором ретиноида и высвобождается при связывании лиганда с рецептором(Bastien et al. (2004. В результате предотвращения действия протеинфосфатазы-1 и протеинфосфатазы 2 А ингибиторы фосфатазы приводят к тому, что повышается количество фосфорилированной формы NCoR и промотируется его последующая цитоплазматическая транслокация (Hermanson et al. (2002. Ингибитор фосфатазы кантаридин обладает противоопухолевой активностью в отношении злокачественных новообразований печени (гепатом) и верхних отделов желудочно-кишечного тракта человека,но является токсичным в отношении мочевыводящих путей (Wang, 1989). Публикация сообщения, что кантаридин действует в качестве ингибитора протеинфосфатазы, возбудила общий интерес к соединениям с химической структурой данного типа (Li and Casida, 1992). Ранее было обнаружено, что менее сложное родственное соединение и его продукт гидролиза (коммерчески доступный в качестве гербицида эндотал) являются гепатотоксичными (Graziani and Casida, 1997). Исследования по связыванию показали, что действие некоторых гомологов кантаридина является прямым в отношении протеинфосфатазы-2 А и опосредованным в отношении протеинфосфатазы-1 (Honkanen et al.,1993; Li et al., 1993). Несмотря на данные положительные результаты несколько соединений данного типа были протестированы на противоопухолевую или цитотоксическую активность. В настоящий момент существует острая необходимость в разработке ингибиторов протеинфосфатаз, которые являются более активными,менее токсичными и обладающими более избирательным действием, чем известные субстанции, упомянутые выше. Сущность изобретения В данном изобретении обеспечивается соединение со структурой где связьприсутствует или отсутствует; R1 и R2 каждый независимо представляет собой Н, О- илиOR9, где R9 представляет собой Н, алкил, замещенный алкил, алкенил, алкинил или арил, или R1 и R2 вместе представляют собой =O; R3 и R4 являются каждый различными, и каждый представляет собой где X представляет собой О, S, NR11 или N+R11R11, где каждый R11 независимо представляет собой Н, алкил, гидроксиалкил, замещенный С 2-С 12 алкил, алкенил, замещенный С 4-С 12 алкенил, алкинил, замещенный алкинил, арил, замещенный арил, где заместитель является отличным от хлора, когда R1 и R2 представляют собой =O,-CH2CN, -CH2CO2R12, -CH2COR12, -NHR12 или -NH+(R12)2, где каждый R12 независимо представляет собой алкил, алкенил или алкинил, каждый из которых является замещенным или незамещенным, или Н; где R10 представляет собой замещенный алкил, замещенный алкенил, замещенный алкинил или замещенный арил, или R3 и R4 являются отличными друг от друга и каждый представляет собой ОН илиR5 и R6 каждый независимо представляет собой Н, ОН, или R5 и R6 вместе представляют собой =O; и R7 и R8 каждый независимо представляет собой Н, F, Cl, Br, SO2Ph, СО 2 СН 3 или SR13, где R13 представ-1 022311 ляет собой Н, арил или замещенный или незамещенный алкил, алкенил или алкинил, или соль, энантиомер или цвиттер-ион соединения. Данное изобретение обеспечивает способ получения упомянутого выше соединения, включающий(а) взаимодействие соединений со структурой с образованием ангидрида со структурой(b) взаимодействие ангидрида, имеющего указанную выше структуру, по меньшей мере с одним нуклеофилом с образованием соединений, имеющих структуру где R3 и R4 являются отличными друг от друга и каждый представляет собой O(CH2)1-6R9 или OR10 или где X представляет собой О, S, NR11 или N+R11R11, где каждый R11 независимо представляет собой Н, алкил, гидроксиалкил, замещенный C2-C12 алкил, алкенил, замещенный C4-C12 алкенил, алкинил, замещенный алкинил, арил, замещенный арил, где заместитель является отличным от хлора, когда R1 и R2 представляют собой =O,-CH2CN, -CH2CO2R12, -CH2COR12, -NHR12 или -NH+(R12)2, где каждый R12 независимо представляет собой алкил, алкенил или алкинил, каждый из которых является замещенным или незамещенным, или Н; где R10 представляет собой замещенный алкил, замещенный алкенил, замещенный алкинил или замещенный арил, или R3 и R4 являются отличными друг от друга и каждый представляет собой ОН илиR7 и R8 каждый независимо представляет собой Н, F, Cl, Br, SO2Ph, СО 2 СН 3 или SR13, где R13 представляет собой Н, арил или замещенный или незамещенный алкил, алкенил или алкинил. Данное изобретение обеспечивает способ контролирования нежелательной растительности, включающий контактирование растительности или ее окружения с гербицидно-эффективным количеством соединений по данному изобретению. Данное изобретение обеспечивает способ ингибирования активности фосфатазы растения, включающий контактирование растения или его окружения с гербицидно-эффективным количеством соединений по данному изобретению. Изобретение обеспечивает способ предотвращения или лечения грибковой инфекции у субъекта,включающий введение субъекту эффективного количества соединений по данному изобретению. Данное изобретение обеспечивает способ лечения субъекта с нейродегенеративным заболеванием,включающий введение субъекту эффективного количества любого из соединений по изобретению, посредством этого осуществляя лечение субъекта. Данное изобретение обеспечивает способ снижения количества GSK-3 (киназа 3 гликогенсинтазы) в клетке, включающий контактирование клетки с эффективным количеством любого из соединений по изобретению, для того чтобы посредством этого снизить количество GSK-3 в клетке. Данное изобретение обеспечивает способ увеличения количества фосфорилированного Akt в клетке, включающий контактирование нервной клетки с эффективным количеством любого из соединений по изобретению, для того чтобы посредством этого увеличить количество фосфорилированного Akt в клетке. Данное изобретение обеспечивает способ снижения фосфорилирования Tau в клетке, включающий контактирование клетки с эффективным количеством любого из соединений по изобретению, для того чтобы посредством этого снизить фосфорилирование Tau в клетке. Данное изобретение обеспечивает способ снижения агрегации Tau в клетке, включающий контактирование клетки с эффективным количеством любого из соединений по изобретению, для того чтобы посредством этого снизить фосфорилирование Tau в клетке. Краткое описание чертежей Фиг. 1. Ингибирование соединением 110 ксенотрансплантатов DAOY. Клетки DAOY медуллобластомы имплантировали подкожно в бок мышей SCID. Через 7 дней, когда имплантированные клетки опухоли достигали опухоли со средним диаметром 6 мм, 6 животных получали 0,12 мг соединения 110, 6 животных получали 0,18 мг соединения 110 и 6 животных получали только инертный носитель (ФСБ). После двух недель лечения всех животных умерщвляли, вырезали подкожные опухолевые образования и определяли их объем. Обе дозы лекарственного вещества приводили к значительному ингибированию роста опухоли. Фиг. 2. Активность соединения 109 in vitro. Ингибирование роста линии клеток мультиформной глиобластомы U373 при воздействии в течение 7 дней возрастающими концентрациями соединения 109 в сравнении с 10 мкМ соединения 100. Фиг. 3. Активность соединения 110 in vitro. Ингибирование роста линии клеток мультиформной глиобластомы U373 при воздействии в течение 7 дней возрастающими концентрациями соединения 110 в сравнении с 10 мкМ соединения 100. Фиг. 4. Активность соединения 112 in vitro. Ингибирование роста линии клеток мультиформной глиобластомы U373 при воздействии в течение 7 дней возрастающими концентрациями соединения 112 в сравнении с соединением 205 - соединением,известным как ингибирующее данную линию клеток. Фиг. 5. Активность соединения 113 in vitro. Ингибирование роста линии клеток мультиформной глиобластомы U373 при воздействии в течение 7 дней возрастающими концентрациями соединения 113 в сравнении с 10 мкМ соединения 100. Подробное описание изобретения Данное соединение обеспечивает соединение со структуройR1 и R2 каждый независимо представляет собой Н, О- или OR9, где R9 представляет собой Н, алкил,замещенный алкил, алкенил, алкинил или арил,или R1 и R2 вместе представляют собой =O;R3 и R4 являются отличными друг от друга и каждый представляет собой O(CH2)1-6R9 или OR10 или где X представляет собой О, S, NR11 или N+R11R11, где каждый R11 независимо представляет собой Н, алкил, гидроксиалкил, замещенный C2-C12 алкил, алкенил, замещенный C4-C12 алкенил, алкинил, замещенный алкинил, арил, замещенный арил, где заместитель является отличным от хлора, когда R1 и R2 представляют собой =O,-CH2CN, -CH2CO2R12, -CH2COR12, -NHR12 или -NH+(R12)2, где каждый R12 независимо представляет собой алкил, алкенил или алкинил, каждый из которых является замещенным или незамещенным, или Н; где R10 представляет собой замещенный алкил, замещенный алкенил, замещенный алкинил или замещенный арил,или R3 и R4 являются отличными друг от друга и каждый представляет собой ОН илиR5 и R6 каждый независимо представляет собой Н, ОН, или R5 и R6 вместе представляют собой =O;R7 и R8 каждый независимо представляет собой Н, F, Cl, Br, SO2Ph, CO2CH3 или SR13,где R13 представляет собой Н, арил или замещенный или незамещенный алкил, алкенил или алкинил,или соль, энантиомер или цвиттер-ион соединения. В одном примере осуществления указанное выше соединение имеет структуру В одном примере осуществления присутствует связь . В другом примере осуществления связьотсутствует. В одном примере указанного выше соединенияR3 представляет собой OR9 или O(СН 2)1-6R10,где R9 представляет собой арил или замещенный этил; где R10 представляет собой замещенный фенил, где заместитель находится в пара-положении; где X представляет собой О, S, NR11 или N+R11R11,где каждый R11 независимо представляет собой Н, алкил, гидроксиалкил, замещенный С 2-С 12 алкил,алкенил, замещенный С 4-С 12 алкенил, алкинил, замещенный алкинил, арил, замещенный арил, где заместитель является отличным от хлора,-CH2CN, -CH2CO2R12, -CH2COR12, -NHR12 или -NH+(R12)2, где R12 представляет собой алкил, алкенил или алкинил, каждый из которых является замещенным или незамещенным, или Н; или где R3 представляет собой ОН и R4 представляет собой В другом примере осуществления указанного выше изобретения R4 где R11 представляет собой алкил или гидроксилалкил; или R4 представляет собой когда R3 представляет собой ОН. В другом примере указанного выше соединенияR1 и R2 вместе представляют собой =O;R3 представляет собой OR9 или OR10 или O(CH2)1-2R9,где R9 представляет собой арил или замещенный этил; где R10 представляет собой замещенный фенил, где заместитель находится в пара-положении; или R3 представляет собой ОН и R4 представляет собой где R11 представляет собой алкил или гидроксилалкил;R5 и R6 вместе представляют собой =O; иR7 и R8 независимо представляют собой Н. В другом примере указанных выше соединенийR1 и R2 вместе представляют собой =O; где R11 представляет собой СН 3 или СН 3 СН 2 ОН;R5 и R6 вместе представляют собой =O; иR7 и R8 независимо представляют собой Н. В одном примере осуществления R3 представляет собой OR10, где R10 представляет собой(СН 2)1-6(CHNHBOC)CO2H, (CH2)1-6(CHNH2)CO2H или (CH2)1-6CCl3. В другом примере осуществления R10 представляет собой СН 2(CHNHBOC)СО 2 Н. В дополнительном примере осуществления R10 представляет собой CH2CCl3. В одном примере указанных выше соединений R3 представляет собой O(CH2)1-6R9, где R9 представляет собой фенил. В другом примере указанных выше соединений R3 представляет собой O(CH2)R9, где R9 представляет собой фенил. В другом примере указанных выше соединений R3 представляет собой ОН и R4 представляет собой В другом примере указанных выше соединений R4 представляет собой где R11 представляет собой гидроксиалкил. В другом примере указанного выше соединения R11 представляет собой -СН 2 СН 2 ОН. В другом примере указанного выше соединения R4 представляет собой где R11 представляет собой алкил. В дополнительном примере R11 представляет собой -СН 3. В другом примере указанных выше соединений R4 представляет собой В примере осуществления соединение имеет структуру Данное изобретение обеспечивает фармацевтическую композицию, содержащую любое из описанных выше соединений и фармацевтически приемлемый носитель. Данное изобретение обеспечивает способ получения любого из указанных выше соединений, включающий с образованием ангидрида со структурой(b) взаимодействие ангидрида, имеющего указанную выше структуру, по меньшей мере с одним нуклеофилом с образованием соединений, имеющих структуру где R3 и R4 являются отличными друг от друга и каждый представляет собой O(CH2)1-6R9 или OR10 или где X представляет собой О, S, NR11 или N+R11R11,где каждый R11 независимо представляет собой Н, алкил, гидроксиалкил, замещенный С 2-С 12 алкил,алкенил, замещенный С 4-C12 алкенил, алкинил, замещенный алкинил, арил, замещенный арил, где заместитель является отличным от хлора, когда R1 и R2 представляют собой =O,-CH2CN, -CH2CO2R12, -CH2COR12, -NHR12 или -NH+(R12)2,где каждый R12 независимо представляет собой алкил, алкенил или алкинил, каждый из которых является замещенным или незамещенным, или Н; где R10 представляет собой замещенный алкил, замещенный алкенил, замещенный алкинил или замещенный арил,или R3 и R4 являются отличными друг от друга и каждый представляет собой ОН илиR7 и R8 каждый независимо представляет собой Н, F, Cl, Br, SO2Ph, СО 2 СН 3 или SR13,где R13 представляет собой Н, арил или замещенный или незамещенный алкил, алкенил или алкинил. В одном примере осуществления указанного выше способа нуклеофил включает по меньшей мере одну гидроксильную группу. В другом примере осуществления нуклеофил представляет собойO(CH2)1-6R9 или OR10, где R9 и R10 описаны выше. В другом примере осуществления нуклеофил включает по меньшей мере одну свободную аминогруппу. В дополнительном примере осуществления нуклеофил представляет собой где X такой, как описано здесь. В другом примере осуществления указанный выше способ дополнительно включает (с) взаимодействие продукта стадии (b) с водородом в присутствии катализатора с образованием соединения со структурой Раскрываемые здесь выше соединения могут применяться в способе контролирования нежелательной растительности, включающем контактирование растительности или ее окружения с гербицидноэффективным количеством соединений, выбранных из соединений по изобретению. Раскрываемые здесь выше соединения могут также применяться в способе ингибирования активности фосфатазы растения, включающем контактирование растения или его окружения с гербицидноэффективным количеством соединений, выбранных из соединений по изобретению. Раскрываемые здесь выше соединения могут также применяться в способе предотвращения или лечения грибковой инфекции у субъекта, включающем введение субъекту эффективного количества соединений по изобретению для лечения грибковой инфекции, таким образом, осуществляя лечение грибковой инфекции. Раскрываемые здесь выше соединения могут также применяться в способе лечения субъекта, пораженного раком молочной железы, раком толстой кишки, крупноклеточным раком легкого, раком легкого, мелкоклеточным раком легкого, раком желудка, раком печени, раком яичника, раком поджелудочной железы, раком предстательной железы, промиелоцитарным лейкозом, хроническим миелоцитарным лейкозом или острым лимфоцитарным лейкозом, включающем введение субъекту терапевтически эффективного количества соединений по изобретению, посредством этого осуществляя лечение субъекта. Раскрываемые здесь выше соединения могут применяться в способе лечения субъекта с нейродегенеративным заболеванием, включающем введение субъекту эффективного количества любого из соединений по изобретению, посредством этого осуществляя лечение субъекта. Раскрываемые здесь выше соединения могут применяться в способе снижения количества GSK-3 в клетке, включающем контактирование клетки с эффективным количеством любого из соединений по изобретению, для того чтобы посредством этого снизить количество GSK-3 в клетке. Раскрываемые здесь выше соединения могут применяться в способе увеличения количества фосфорилированного Akt в клетке, включающем контактирование нервной клетки с эффективным количеством любого из соединений по изобретению, для того чтобы посредством этого увеличить количество фосфорилированного Akt в клетке. Раскрываемые здесь выше соединения могут применяться в способе снижения фосфорилированияTau в клетке, включающем контактирование клетки с эффективным количеством любого из соединений по изобретению, для того чтобы посредством этого снизить фосфорилирование Tau в клетке. Раскрываемые здесь выше соединения могут применяться в способе снижения агрегации Tau в клетке, включающем контактирование клетки с эффективным количеством любого из соединений по изобретению, для того чтобы посредством этого снизить фосфорилирование Tau в клетке. Соединения по изобретению могут также применяться в способе ингибирования пролиферации раковой клетки, которая не сверхэкспрессирует N-CoR, включающем введение субъекту любого из соединений по изобретению в количестве, ингибирующем пролиферацию раковой клетки. Соединения по изобретению могут также применяться в способе ингибирования пролиферации раковой клетки, которая сверхэкспрессирует ТСТР, включающем введение субъекту любого соединения по изобретению в количестве, эффективном для ингибирования пролиферации раковой клетки. В указанных выше способах злокачественным новообразованием может быть злокачественное новообразование надпочечников, злокачественное новообразование мочевого пузыря, остеогенная саркома,цервикальное злокачественное новообразование, злокачественное новообразование пищевода, желчного пузыря, головы и шеи, лимфома Ходжкина, неходжкинская лимфома, злокачественное новообразование почки, меланома, злокачественное новообразование поджелудочной железы, злокачественное новообра-8 022311 зование прямой кишки, злокачественное новообразование щитовидной железы и злокачественное новообразование горла. В способе по изобретению лиганд гистондеацетилазы может быть ингибитором, например ингибитором гистондеацетилазы HDAC-3 (гистондеацетилаза-3). Лиганд гистондеацетилазы может также быть выбран из группы, состоящей из 2-амино-8-оксо-9,10-эпоксидеканоила, 3-(4-ароил-1 Н-пиррол-2-ил)-Nгидрокси-2-пропенамида, соединения 8 АРНА, апицидина, бутироиларгинина, масляной кислоты, депсипептида, депудецина, HDAC-3, бисгидроксамида м-карбоксикоричной кислоты, N-(2-аминофенил)-4-[N(пиридин-3-илметоксикарбонил)аминометил]бензамида, MS 275, оксамфиатина, фенилбутирата, пироксамида, скриптаида, сиртинола, бутирата натрия, суберобисгидроксамовой кислоты, анилида суберогидроксамовой кислоты, трихостатина А, трапоксина А, трапоксина В и вальпроевой кислоты. Соединения по изобретению могут также применяться в комбинации с соединениями, которые ингибируют фермент гистондеацетилазу (HDAC). Данные ферменты HDAC осуществляют посттрансляционную модификацию гистонов (публикация патента США под номером 2004/0197888, Armour et al.). Гистоны представляют собой группу белков, которые связываются с ДНК в эукариотических клетках для формирования компактных структур, называемых хроматином. Данная плотная упаковка позволяет большому количеству ДНК помещаться в ядре эукариотической клетки, но компактная структура хроматина ограничивает доступ факторов транскрипции к ДНК. Ацетилирование гистонов уменьшает компактность хроматина, позволяя факторам транскрипции связываться с ДНК. Деацетилирование, катализируемое гистондеацетилазами (HDAC), повышает компактность хроматина, уменьшая, таким образом,доступ фактора транскрипции к ДНК. Поэтому ингибиторы гистондеацетилаз препятствуют плотной упаковке хроматина, позволяя факторам транскрипции связываться с ДНК и повышая экспрессию генов. Изобретение дополнительно предполагает применение пролекарств, которые in vivo превращаются в соединения по изобретению (см., например, Silverman R.B., 1992, The Organic Chemistry of Drug Designand Drug Action, Academic Press, Chapter 8, содержание которой включено сюда посредством ссылки в полном объеме). Такие пролекарства могут применяться для изменения биораспределения (например,чтобы давать возможность соединениям, которые обычно не могут, достигать места действия) или фармакокинетики соединения. Соединения, описанные в настоящем изобретении, находятся в рацемической форме или в виде индивидуальных энантиомеров. Энантиомеры могут быть разделены с помощью известных методов, таких как описанные, например, в Pure and Applied Chemistry (vol. 69, 1469-1474, 1997, IUPAC). Используемый здесь термин цвиттер-ион означает соединение, которое является электронейтральным, но несет формальный положительный и отрицательный заряды на разных атомах. Цвиттерионы являются полярными, обладают высокой растворимостью в воде и плохо растворяются в органических растворителях. Раскрываемые здесь выше соединения могут также формировать цвиттер-ионы. Например, соединения со структурой могут также формировать следующую цвиттер-ионную структуру где X определен здесь в описании. Используемый здесь термин растворитель охватывает соединения, такие как гексаны, бензол, толуол, диэтиловый эфир, хлороформ, метиленхлорид, этилацетат, 1,4-диоксан, вода, ТГФ, ацетон, ацетонитрил, ДМФА, ДМСО, уксусная кислота, н-бутанол, изопропанол, н-пропанол, этанол, метанол, муравьиная кислота, тетрахлорид углерода, тиофенол, хлорбензол, циклогексантиол, 1-диэтиламиноэтанол,этилендихлорид, этиленгликоль, ксилол, 1,1,2,2-тетрахлорэтан, фенол, уксусная кислота, 1-бутанол, 2 бутанол, 2-бутанон, диглим, диметиловый эфир, диоксан, петролейный эфир, (NMP) N-метил-2-пирролидинон, гептан, глицерин, ГМФТА (НМРА, гексаметилфосфортриамид), МТБЭ (МТВЕ, метил-третбутиловый эфир), нитрометан, пиридин, 1-пропанол, 2-пропанол и триэтиламин. В некоторых примерах осуществления раскрываемые соединения могут содержать основную функциональную группу, такую как амино или алкиламино, и таким образом способны образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми кислотами или содержать кислотную функциональную группу и таким образом способны образовывать фармацевтически приемлемые соли с основаниями. Поэтому настоящие соединения могут в виде солей. Используемый здесь термин соль означает соль настоящих соединений, которые были модифицированы путем получения солей соединений с кислотой или основанием. Соль может быть фармацевтически приемлемой. Примеры фармацевтически приемлемых солей включают в качестве неограничивающих примеров соли с минеральными или органическими кислотами основных групп, таких как амины; соли со щелочами или органическими основаниями кислотных групп, таких как фенолы. Соли могут быть получены с применением органических или неорганических кислот. Такими солями с кислотами являются хлориды, бромиды, сульфаты, нитраты, фосфаты, сульфонаты, формиаты, тартраты, малеаты, малаты, цитраты, бензоаты, салицилаты, аскорбаты и тому подобное. Фенолятами являются соли щелочно-земельных металлов, натрия, калия или лития. В связи с этим термин фармацевтически приемлемая соль относится к относительно нетоксичным солям присоединения кислоты или основания соединений по настоящему изобретению. Данные соли могут быть получены in situ в течение конечного выделения и очистки соединений по изобретению или путем отдельного взаимодействия очищенного соединения по изобретению в форме свободного основания или свободной кислоты с подходящей органической или неорганической кислотой или основанием и выделения полученной таким образом соли. Типичные соли включают гидробромидные, гидрохлоридные, сульфатные, бисульфатные, фосфатные, нитратные, ацетатные, валератные, олеатные, пальмитатные, стеаратные, лауратные, бензоатные, лактатные, фосфатные, тозилатные, цитратные, малеатные, фумаратные, сукцинатные, тартратные, нафталатные, мезилатные, глюкогептонатные, лактобионатные и лаурилсульфонатные соли и тому подобное (для описания возможных солей см., например, Bergeet al., 1977, Pharmaceutical Salts, J. Pharm. Sci., 66:1-19). Используемый здесь термин терапевтически эффективное количество означает количество, достаточное для лечения субъекта, пораженного заболеванием (например, злокачественным новообразованием или нейродегенеративным заболеванием) или для смягчения симптома или осложнения, связанного с заболеванием. Используемый здесь термин гербицидно-эффективное означает количество, достаточное для негативного воздействия на рост растения, в частности, посредством ингибирования активности фосфатазы 2 А растения. Используемый здесь термин лечение означает замедление, остановку или реверсирование заболевания, в частности злокачественного новообразования или нейродегенеративного заболевания. Используемый здесь термин нейродегенеративное заболевание относится к заболеванию, при котором происходит дегенерация серого вещества или белого вещества нервной системы или их обоих. Так, например, таким заболеванием может быть диабетическая невропатия, старческое слабоумие, болезнь Альцгеймера, умеренные когнитивные нарушения (MCI), слабоумие, деменция с тельцами Леви,лобно-височная деменция, болезнь Паркинсона, неврит лицевого нерва (паралич Белла), глаукома, Болезнь Хантингтона, боковой амиотрофический склероз (БАС), эпилептический статус, нейропатия зрительного нерва, не связанная с артериитом, образование грыжи межпозвоночного диска, авитаминоз,прионные болезни, такие как болезнь Крейтцфельда-Якоба, синдром запястного канала, периферическая нейропатия, связанная с различными заболеваниями, включая в качестве неограничивающих примеров уремию, порфирию, гипогликемию, синдром Шегрена-Лассона, острая сенсорная невропатия, хроническая атактическая невропатия, билиарный цирроз печени, первичный амилоидоз, обструктивная болезнь легких, акромегалия, синдром мальабсорбции, истинная полицитемия, IgA и IgG гаммапатии, осложнения после различных лекарственных средств (например, метронидазола) и токсинов (например, алкоголя или органофосфатов), болезнь Шарко-Мари-Тута, атаксия-телеангиэктазия, атаксия Фридрейха, амилоидная полиневропатия, адреномиелоневропатия, гигантская аксональная невропатия, болезнь Рефсума,болезнь Фабри и липопротеинемия. Используемый здесь термин таупатии относится к классу нейродегенеративных заболеваний, которые развиваются в результате слипания тау-белка в нейрофибриллярные клубки. Примеры таупатии включают в качестве неограничивающих примеров болезнь Альцгеймера, лобно-височную деменцию(болезнь Пика), прогрессирующий надъядерный паралич и кортикобазальную дегенерацию. Используемый здесь термин алкил охватывает как разветвленные, так и неразветвленные насыщенные алифатические углеводородные группы с указанным количеством атомов углерода. Таким образом, C1-Cn, например, в C1-Cn алкил определяется, чтобы включать группы, имеющие 1, 2,, n-1 или n атомов углерода при линейном или разветвленном расположении, в частности включает метил, этил,пропил, бутил, пентил, гексил и тому подобное. Примером может быть C1-C12 алкил. Алкокси означает алкильную группу, такую, как описано выше, присоединенную через кислородный мостик. Гидроксиалкил означает алкильную группу, такую, как описано выше, несущую гидроксильную группу. Гидроксиалкильные группы включают, например, (CH2)1-10OH и включают СН 2 ОН, СН 2 СН 2 ОН,СН 2 СН 2 СН 2 ОН и тому подобное. Термин алкенил относится к неароматическому углеводородному радикалу, неразветвленному или разветвленному, содержащему по меньшей мере 1 углерод-углеродную двойную связь, и может при- 10022311 сутствовать вплоть до максимально возможного количества неароматических двойных углеродуглеродных связей. Таким образом, C2-Cn алкенил определяется, чтобы включать группы, имеющие 1, 2, , n-1 или n атомов углерода. Например, С 2-С 6 алкенил подразумевает алкенильный радикал с 2, 3, 4, 5 или 6 атомами углерода и по меньшей мере 1 углерод-углеродной двойной связью и вплоть до, например, 3 углерод-углеродных двойных связей в случае С 6 алкенила соответственно. Алкенильные группы включают этенил, пропенил, бутенил и циклогексенил. Как описано выше в отношении алкила, неразветвленная, разветвленная или циклическая часть алкенильной группы может содержать двойные связи и может быть замещенной, если указывается замещенная алкенильная группа. Примером может являтьсяC2-C12 алкенил. Термин алкинил относится к углеводородному радикалу, неразветвленному или разветвленному,содержащему по меньшей мере 1 углерод-углеродную тройную связь, и может присутствовать вплоть до максимально возможного количества неароматических углерод-углеродных тройных связей. Таким образом, C2-Cn алкинил определяется, чтобы включать группы, имеющие 1, 2,, n-1 или n атомов углерода. Например, С 2-С 6 алкинил означает алкинильный радикал, имеющий 2 или 3 атома углерода и 1 углерод-углеродную тройную связь или имеющий 4 или 5 атомов углерода и вплоть до 2 углеродуглеродных тройных связей или имеющий 6 атомов углерода и вплоть до 3 углерод-углеродных тройных связей. Алкинильные группы включают этинил, пропинил и бутинил. Как описано выше в отношении алкила, неразветвленная или разветвленная часть алкинильной группы может содержать тройные связи и может быть замещенной, если указывается замещенная алкинильная группа. Примером может являтьсяC2-Cn алкинил. Используемый здесь термин арил означает любое стабильное моноциклическое или бициклическое углеродное кольцо с вплоть до 10 атомов в каждом кольце, где по меньшей мере одно кольцо является ароматическим. Примеры таких арильных компонентов включают фенил, нафтил, тетрагидронафтил, инданил, бифенил, фенантрил, антрил или аценафтил. В случаях, когда арильный заместитель является бициклическим и одно кольцо является неароматическим, следует понимать, что присоединение происходит через ароматическое кольцо. Замещенные арилы, охватываемые данным изобретением,включают замещенные по любому положению аминами, замещенными аминами, алкиламинами, гидрокси и алкилгидрокси, где часть алкила в алкиламинах и алкилгидрокси представляет собой C2-Cn алкил,такой, как определен здесь выше. Замещенные амины могут быть замещены алкильной, алкенильной,алкинильной или арильной группами, такими, как определено здесь выше. Алкильные, алкенильные, алкинильные и арильные заместители могут быть замещенными или незамещенными, если специально не указано иное. Например, (C1-C6) алкил может быть замещенным одним или несколькими заместителями, выбранными из ОН, оксо, галогена, который включает F, Cl, Br и I,алкокси, диалкиламино или гетероциклила, такого как морфолинил, пиперидинил и тому подобное. В соединениях по настоящему изобретению алкильная, алкенильная и алкинильная группы могут быть дополнительно замещены путем замены одного или нескольких атомов водорода в возможной степени на отличные от водорода группы, определенные здесь. Данные группы включают в качестве неограничивающих примеров галоген, гидрокси, меркапто, амино, карбокси, циано и карбамоил. Используемый здесь термин замещенный означает, что данная структура имеет заместитель, который может представлять собой алкильную, алкенильную или арильную группу, такую, как определено выше. Считается, что термин включает множественные степени замещения под названием заместитель. Когда описываются или заявляются множественные группы заместителей, замещенное соединение может быть независимо замещено одним или несколькими описанными или заявляемыми группами заместителей, однократно или многократно. Под независимо замещенный подразумевается, что два или несколько заместителей могут быть одинаковыми или различными. Как используется здесь, введение агента может осуществляться с помощью различных способов или систем доставки, хорошо известных специалистам в данной области техники. Введение может осуществляться, например, перорально, парентерально, внутрибрюшинно, внутривенно, внутриартериально,трансдермально, сублингвально, внутримышечно, ректально, буккально, интраназально, с помощью липосом, посредством ингаляции, вагинально, внутрь глаза, посредством местного введения, подкожно,внутрь жировой ткани, внутрь сустава, интратекально, в желудочек мозга, интравентикулярно, внутрь опухоли, в паренхиму мозга или интрапаренхиматозно. Следующие системы доставки, в которых применяется ряд обычно используемых фармацевтических носителей, могут использоваться, но являются только иллюстративными системами из многих возможных систем, предполагаемых для введения композиций по данному изобретению. Инъецируемые системы доставки включают инъецируемые растворы, суспензии, гели, микросферы и полимеры и могут содержать вспомогательные вещества, такие как изменяющие растворимость агенты(например, этанол, пропиленгликоль и сахараза) и полимеры (например, поликаприлактоны и PLGA (сополимер молочной и гликолевой кислот. Имплантируемые системы включают стержни и диски и могут содержать вспомогательные вещества, такие как PLGA и поликаприлактон. Системы для перорального введения включают таблетки и капсулы. Они могут содержать вспомогательные вещества, такие как связующие (например, гидроксипропилметилцеллюлоза, поливинилпирролидон, другие материалы на основе целлюлозы и крахмал), разбавители (например, лактоза и другие сахара, крахмал, дикальций фосфат и материалы на основе целлюлозы), дезинтегрирующие агенты (например, полимеры крахмала и материалы на основе целлюлозы) и смазывающие агенты (например, стеараты и тальк). Системы доставки через слизистую включают пластыри, таблетки, суппозитории, пессарии, гели и кремы и могут содержать такие вспомогательные вещества, как солюбилизаторы и усилители (например,пропиленгликоль, соли желчных кислот и аминокислоты) и другие наполнители (например, полиэтиленгликоль, сложные эфиры и производные жирных кислот и гидрофильные полимеры, такие как гидроксипропилметилцеллюлоза и гиалуроновая кислота). Дермальные системы доставки включают, например, водные и неводные гели, кремы, гетерогенные эмульсии, микроэмульсии, липосомы, мази, водные и неводные растворы, лосьоны, аэрозоли, углеводородные основы и порошки и могут содержать вспомогательные вещества, такие как солюбилизаторы,усилители проникновения (например, жирные кислоты, сложные эфиры жирных кислот, жирные спирты и аминокислоты) и гидрофильные полимеры (например, поликарбофил и поливинилпирролидон). В одном примере осуществления фармацевтически приемлемый носитель представляет собой липосому или усилитель трансдермального проникновения. Растворы, суспензии и порошки для восстанавливаемых систем доставки включают такие среды,как суспензирующие агенты (например, камеди, ксантаны, целлюлозные полимеры и сахара), увлажнители (например, сорбит), солюбилизаторы (например, этанол, вода, ПЭГ и пропиленгликоль), ПАВы (например, натрия лаурилсульфат, Спаны, Твины и цетилпиридин), консерванты и антиоксиданты (например, парабены, витамины Е и С и аскорбиновая кислота), предотвращающие слеживание агенты,обеспечивающие покрытие агенты и хелатирующий агенты (например, ЭДТА). Следует понимать, что заместители и типы замещения у соединений по настоящему изобретению могут быть выбраны обычным специалистом в данной области для обеспечения соединений, которые являются стабильными и которые могут быть легко получены способами, известными в данной области,а также представленными ниже способами из легкодоступных исходных веществ. Если заместитель является замещенным более одной группой, следует понимать, что данные несколько групп могут быть при том же самом атоме углерода или при различных атомах углерода, пока это приводит к стабильной структуре. Обсуждение Каетаридин обладает противоопухолевой активностью в отношении злокачественных новообразований печени (гепатом) и верхних отделов желудочно-кишечного тракта человека, но является токсичным для мочевыводящих путей (Wang, 1989). Норкантаридин, деметилированный кантаридин, сохраняет противоопухолевую активность кантаридина в отношении гепатом и злокачественных новообразований желудка и пищевода, но не имеет токсичность или имеет небольшую токсичность в отношении мочевыводящих путей. Норкантаридин также стимулирует продукцию лейкоцитов у пациентов и мышей, механизм явления не известен, но фармакологический эффект делает его потенциально выгодным в качестве противоопухолевого агента (Wang et al., 1986; Wang, 1989). Публикация сообщения, что кантаридин действует в качестве ингибитора протеинфосфатазы, возбудила общий интерес к соединениям с химической структурой данного типа (Li и Casida, 1992). Ранее было обнаружено, что менее сложное родственное соединение и его продукт гидролиза (коммерчески доступный в качестве гербицида, Эндотал) являются гепатотоксичными (Graziani и Casida, 1997). Оказалось, что первичными мишенями в печени являются протеинфосфатазы РР 2 А и РР 1, все соединения демонстрируют значения ЭД 50 на микромолярном уровне. Исследования по связыванию показали, что действие некоторых гомологов кантаридина является прямым в отношении РР 2 А и опосредованным в отношении РР 1 (Honkanen et al., 1993; Li et al., 1993). Воздействие на фосфатазу РР 1 В происходит только в случае микромолярных уровней данных соединений, в то время как влияние на фермент РР 2 С не происходит совсем. Ранее было синтезировано несколько аналогов кантаридина и произведена оценка фосфатазингибирующей активности и их способности ингибировать рост злокачественных клеток в культуре (Sakoff и McClusky, 2004; Hart et al., 2004). Некоторые из ранее тестируемых модифицированных молекул кантаридина ингибировали рост нескольких линий опухолевых клеток человека. Активность аналогов норкантаридина в отношении клеток опухолей, сверхэкспрессирующих N-CoR, или активность норкантаридинов в комбинации с другими возможными противоопухолевыми агентами не исследовалась. В других исследованиях, охватывающих 16 модифицированных норкантаридинов, оценивали активность в отношении линий клеток опухолей человека, включая яичника, почки, толстой кишки и легкого, а также линии лейкоза мыши. Ни один из них не оказался активным в качестве единственного агента, как кантаридин или норкантаридин, и ни один не был тестирован на активность в комбинации с другим противоопухолевым агентом (McCluskey et al., публикация заявки на патент США под номером 2006/0030616, 2006). Ранее были синтезированы различные серии аналогов кантаридина и тестированы в качестве пестицидов и на противоопухолевую активность в отношении линий клеток злокачественных новообразований. Были разработаны и тестированы на активность в качестве гербицидов и летального действия у мышей сорок три аналога эндотала и кантаридина (Matsuzawa et al., 1987). Было показано, что тиоангидрид эндотала являлся более активным гербицидом, чем эндотал, но был токсичным в отношении печени мышей (Matsuzawa et al., 1987; Kawamura et al., 1990). Недавно было показано, что тиоангидрид эндотала является активным агентом в отношении РР 2 А и РР 1 in vivo (Erdodi et al., 1995). Эндотал и тиоангидрид эндотала подобно кантаридину ингибируют активность РР 2 А и, до некоторой степени, активность РР 1 (Erdodi et al., 1995). Оказалось, что основной мишенью в печени является РР 1. В случае фибробластов только тиоангидрид эндотала вызывал значительные морфологические изменения, в то время как кантаридин и эндотал действия не оказывали (Erdodi et al., 1995). Предполагают, что повышенная активность in vivo тиоангидрида эндотала связана с его более высокой липофильностью, приводящей к усилению диффузии через плазматическую мембрану(Essers et al., 2001). В более поздней публикации описан синтез моно-, дифторсодержащих аналогов Эндотала, а также соответствующих ангидридов, однако данная синтетическая работа не сопровождалась фармакологическими данными (Essers et al., 2001). Продолжая разработку новых лекарственных веществ в данной области, мы обнаружили, что необходимо разработать ингибиторы, которые обладают большей специфичностью, особенно в отношении ферментов, которые демонстрируют высокую активность в отношении процессов репликации в клетках злокачественного новообразования. Высокая специфичность дает возможность избежать мишеней, важных для функционирования нормальной клетки. С точки зрения физических характеристик любой вновь созданной лекарственной субстанции она должна преимущественно иметь хорошую проницаемость через мембрану (например, иметь значение logP между 2 и 4 единицами). Описанные здесь соединения обладают действием антагонистов в отношении фосфатазы-2 А и фосфатазы 1. Кроме того, соединения 110, 112, 113 и 114 каждое обладает свойствами, которые повышают их проникновение в мозг. Эндотал также известен как активный дефолиант и сильный контактный гербицид, используемый во многих случаях в сельском хозяйстве. Его считают эффективным десикантом перед уборкой, а также селективным довсходовым гербицидом (Crafts, 1953). Эндотал, норкантаридины и кантаридин все известны как ингибиторы протеинфосфатаз млекопитающих, а также как сильные гербициды (Matsuzawa et al., 1987). Механизм, посредством которого эндотал и другие гомологи проявляют их сильную гербицидную активность, широко не исследовался, несмотря на повсеместное применение эндотала в международном масштабе в сельском хозяйстве. Следует заметить, что эндотал является водорастворимым, в то время как кантаридин и норкантаридин нет. Предполагалось, что активность эндотала в качестве контактного гербицида и дефолианта связана с известной токсичностью раздражающего действия родственного ему соединения - норкантаридина. Однако недавние исследования показали, что гербицидная активность эндотала может являться функцией в первую очередь его активности против протеинфосфатаз (РР 2 А) растений. Ли с соавторами (Li et al.,1993) показали, что кантаридин и эндотал действуют ингибирующе на листья шпината РР 2 А и РР 1 и ингибируют активацию нитратредуктазы на свету в интактных листьях шпината, процесс опосредованный РР 2 А. Смит с соавторами (Smith et al., 1994) демонстрируют, что структурно не связанные ингибиторы протеинфосфатаз окадаиковая кислота и каликулин-А являются сильными ингибиторами при наномолярных концентрациях роста некоторых растений. Активность окадаиковой кислоты и каликулина-А убедительно указывает на то, что активность эндотала в качестве гербицида наблюдается благодаря его фосфатаз-ингибирующей активности. Баскин и Вилсон (Baskin и Wilson, 1997) показали, что ингибиторы серин-треониновых протеинфосфатаз, включая кантаридин, ингибируют формирование микротрубочек растений. В работе (Ayaydinet al., 2000) было показано, что эндотал ингибировал активность РР 2 А, вызывая изменение деления клеток в культивируемых клетках люцерны. Было замечено, что эндотал проникал в клетки. Поэтому соединения здесь являются полезными, коммерчески осуществимыми и безопасными гербицидами как в отношении воздействия на человека, так и окружающей среды. Раскрываемые здесь выше соединения также являются полезными для лечения злокачественных заболеваний. В одном примере осуществления соединения являются полезными для лечения опухолей,которые сверхэкспрессируют N-CoR, TCTP или их оба. Раскрываемые здесь выше соединения также полезны для лечения грибковых инфекций. В одном примере осуществления соединения являются полезными для лечения грибковых инфекций Т. rubrum. Раскрываемые здесь выше соединения могут быть получены способами, описанными здесь или описанными в международной заявке PCT/US 08/01549. Линия клеток медуллобластомы человека DAOY получена от Американской коллекции типовых культур (АТСС), P.O. Box 1549, Manassa, Virginia, 20108, номер в АТСС НТВ-186. Экспериментальная часть Материалы и методы 4. Бензиловый эфир 3-[4-(2-гидроксиэтил)пиперазин-1-карбонил]-7-оксабицикло[2.2.1]гептан-2-карбоновой кислоты (12, соединение 109) Стадия 1. Синтез монобензилового эфира 7-оксабицикло[2.2.1]гептан-2,3-дикарбоновой кислоты(9) (4,5 мл, 44,0 ммоль) в диоксане нагревали при 80 С в течение 16 ч. Охлаждали до комнатной температуры и упаривали для удаления растворителя. Полученный осадок затирали с диизопропиловым эфиром (20 мл) с получением белого твердого вещества 10, которое отфильтровывали, промывали диизопропиловым эфиром (10 мл) и сушили. Выход: 3,6 г (59%). 1 К раствору соединения 10 (3,00 г, 11,6 ммоль) в CH2Cl2 при 0 С (60 мл) добавляли пиперазин-1 этанол (11) (1,82 г, 14,0 ммоль), EDC (3,12 г, 16,3 ммоль), HOBt (0,20 г) и DIPEA (5,8 мл, 34,9 ммоль). Смесь оставляли нагреваться до Ткомн в течение 16 ч. ТСХ (5% MeOH/CH2Cl2) демонстрировало отсутствие исходного вещества. Реакционную смесь разбавляли CH2Cl2 (50 мл), промывали водой (240 мл) и сушили. Упаривание органического растворителя давало остаток. Остаток затирали с диизопропиловым эфиром (20 мл) с получением бензилового эфира 3-[4-(2-гидроксиэтил)пиперазин-1-карбонил]-7-оксабицикло[2.2.1]гептан-2-карбоновой кислоты (12) в виде белого твердого вещества. Выход: 3,24 г (72%). Тпл: 72-75 С. 1 К охлаждаемому льдом раствору 3-(4-метилпиперазин-1-карбонил)-7-оксабицикло[2.2.1]гептан-2 карбоновой кислоты (938 мг, 3,5 ммоль) в метиленхлориде (30 мл) добавляли тионилхлорид (1 мл), затем несколько капель ДМФА. После перемешивания при температуре льда в течение 30 мин ледяную баню убирали и продолжали перемешивание при комнатной температуре в течение ночи. Удаляли избыток тионилхлорида с помощью безмасляного вакуумного насоса при -50 С и к остатку добавляли метиленхлорид (10 мл). Полученную жидкую суспензию соединения 1 использовали на следующей реакции. Стадия 2. 4-(2-Бензилоксикарбонил-2-трет-бутоксикарбониламино-2-карбоксиэтил)фениловый эфир 3-(4-метилпиперазин-1-карбонил)-7-оксабицикло[2.2.1]гептан-2-карбоновой кислоты (3) К охлаждаемому льдом раствору бензилового эфира Boc-L-тирозина (2, 780 мг, 2,1 ммоль) и ДМАП(100 мг) в метиленхлориде (10 мл) и ТЭА (2,9 ммоль, 21 ммоль) добавляли полученную ранее суспензию хлорангидрида кислоты (1, 1,0 г, 3,5 ммоль) в метиленхлориде (10 мл). После перемешивания в течение 10 мин при температуре ледяной бани ледяную баню убирали и перемешивали при комнатной температуре в течение 1 ч. На этой стадии ТСХ (CH2Cl2:MeOH 95:5) показывала исчезновение исходного вещества 2. Реакционную смесь разбавляли метиленхлоридом (30 мл) и промывали водой (30 мл), затем насыщенным раствором соли, сушили над безводным сульфатом натрия, фильтровали и концентрировали. Технический остаток очищали с помощью колоночной хроматографии, используя 5% метанола в метиленхлориде, с получением чистого требуемого соединения 3 (1,040 г, 76%). 1 Раствор полученного ранее продукта конденсации 3 (600 мг, 0,965 ммоль) в метаноле (40 мл) гидрировали, используя барон с водородом и Pd(OH)2 (100 мг, 20% Pd/C) в качестве катализатора, в течение ночи. Катализатор отфильтровывали через целит, фильтрат концентрировали досуха и остаток затирали с этилацетатом (15 мл). Осадок отделяли фильтрованием с получением чистого указанного в заголовке соединения 4 в виде белого твердого вещества (460 мг, 89%). Тпл: 165 С (разложение). 1(м, 1 Н), 3,32 (м, 1 Н), 3,32 (м, 1 Н), 3,35 (м, 1 Н), 3,68 (м, 4 Н), 4,41 (м, 1 Н), 4,79 (д, 1 Н), 5,07 (д, 1 Н), 5,32 (м,1 Н), 6,96 (д, J=7,00 Гц, 2 Н), 7,16 (д, J=7,00 Гц, 2 Н). EST: 530 (М+-Н). 2. 4-(2-Амино-2-карбоксиэтил)фенилового эфира 3-(4-метилпиперазин-1-карбонил)-7-оксабицикло[2.2.1]гептан-2-карбоновой кислоты гидрохлоридная соль (5, соединение 110) К охлаждаемому льдом раствору Вос-производного (4,150 мг, 0,28 ммоль) в метиленхлориде (10 мл) добавляли раствор 2 М HCl в эфире (1 мл). Когда начали добавление к реакционной смеси, начал выпадать осадок. Суспензию перемешивали в течение ночи при комнатной температуре. Реакционную смесь концентрировали досуха и упаривали совместно с гексаном. Затирали его с гексаном с получением осадка, который отфильтровывали с получением чистого, указанного в заголовке соединения 5 в виде грязно-белого твердого вещества (5,130 мг, 99%). Тпл: 110 С (разложение). 1 К суспензии кислоты (6, 536 мг, 2 ммоль) в метиленхлориде (15 мл) добавляли SOCl2 (1 мл), затем 2 капли ДМФА. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционная смесь все еще оставалась суспензией. К данной суспензии добавляли трихлорэтанол (6 мл). После добавления трихлорэтанола реакционная смесь становилась гомогенной. Перемешивание продолжали в течение 1,5 ч с последующим упариванием растворителя. К остатку добавляли этилацетат (30 мл) и экстрагировали водой (225 мл). Слой воды нейтрализовали с помощью NaHCO3 до рН 5-6 и упаривали досуха. Остаток растворяли в ацетонитриле (30 мл) при нагревании и выпавший осадок NaCl удаляли фильтрованием. Фильтрат очищали с помощью угля, упаривали досуха, затирали с горячим этилацетатом и отфильтровывали осадок с получением чистого указанного в заголовке сложного эфира 7 в виде бесцветных кристаллов. (416 мг, 52%). Тпл: 229-232 С. 1N3-(2-аминоэтил)-5,5-дифенилгидантоина (2,0 г, 6,8 ммоль) (полученный в соответствии с методикой,описанной у Shaffer et al., J. Med. Cham. 1967, W, 739) добавляли сухой толуол (10 мл) и смесь нагревали при 100 С в течение 5 ч. Растворитель упаривали на роторно-вакуумном испарителе и к остатку добавляли воду (10 мл) и этилацетат (20 мл). Раствор подкисляли до рН 2 с помощью водного раствора лимонной кислоты (10%) и органический слой отделяли. Водный слой повторно экстрагировали EtOAc (230 мл). Объединенные органические слои промывали водой (10 мл), сушили (Na2SO4) и упаривали. Остаток перекристаллизовывали из EtOAc с получением желаемого бесцветного кристаллического продукта. Выход: 700 мг (50%). Тпл: 208-210 С; 1 Н ЯМР (CDCl3, 300 МГц):1,43-1,48 (м, 2 Н), 1,66-1,77 (м, 2 Н), 2,48 (с, 2 Н), 3,72-3,82 (м, 4 Н), 4,694,71 (м, 2 Н), 6,47 (ушир.с, 1 Н), 7,34-7,39 (м, 10 Н); ESI-MS (электроспрей масс-спектрометрия): (m/z) 445(М+-18). Пример 1. Действие соединения 110 и родственных аналогов на клетки медуллобластомы DAOY Эксперименты in vivo Клетки DAOY медуллобластомы имплантировали подкожно в бок мышей SCID. Через 7 дней, когда имплантированные клетки опухоли достигали опухоли со средним диаметром 6 мм, 6 животных получали 0,12 мг соединения 110, 6 животных получали 0,18 мг соединения 110 и 6 животных получали только инертный носитель (ФСБ). После двух недель лечения всех животных умерщвляли, вырезали подкожные опухолевые образования и определяли их объем. Как показано на фиг. 1, обе дозы соединения 110 приводили к значительному ингибированию роста опухоли. Пример 2. Ингибирование роста линии клеток мультиформной глиобластомы U373 при воздействии в течение 7 дней возрастающими концентрациями соединения 109, 110, 112 и 113 При самых высоких концентрациях соединения 109 наблюдается незначительное ингибирование роста клеток через 3 дня. При более низких концентрациях соединение 109 обладает незначительной стимулирующей активностью, повышающейся в течение 7 дней (фиг. 1). Другие соединения серий соединений 100 при очень низких концентрациях обладают легкой - умеренной стимулирующей активностью в отношении клеток в культуре, которая пропадает при более высоких концентрациях, когда лекарственные вещества являются ингибиторами в зависимости от дозы (см. фиг. 2-4). Соединения 110, 112 и 113 ингибируют рост клетки дозозависимым образом. Обсуждение Описанные здесь соединения повышают фосфорилирование нескольких регуляторных белков,включая Akt. При низких дозах, которые являются нетоксичными у мышей, данные соединения незначительно стимулируют пролиферацию клетки и повышают фосфорилирование Akt у тестируемых линий клеток злокачественных новообразований человека, включая SH-SY5Y. При введении внутрибрюшинно здоровым мышам соединений 110, 113 и 114 также повышалось фосфорилирование Akt в тестирумых линиях клеток, что установлено в примерах здесь. Поскольку соединения повышают внутриклеточный Akt при низких нетоксичных дозах, а также повышают ацетилирование гистонов в нейронах интактных животных, данные соединения являются полезными для лечения нейродегенеративных заболеваний, в частности болезни Альцгеймера и других таупатий. Наряду с тем, что каждое из соединений повышает фосфорилирование Akt у различных линий клеток опухолей, они также повышают фосфорилирование Akt у линии клеток нейробластомы SH-SY5Y. Результаты с соединениями 110, 113 и 114 показывают, что каждое из них обладает свойствами, которые повышают их проникновение в мозг. Механизм, посредством которого описанные здесь соединения оказывают нейропротективное действие, может быть связан с тем, что повышается активность Akt-1 в клетке нейрона и повышается ацетилирование гистонов нейронов. Каждое из соединений при внутрибрюшинной инъекции повышает фосфорилирование Akt в нейронах мышей. Данное повышение фосфорилирования Akt связывают с повышением фосфорилирования GSK-3. Поскольку, как известно, повышение фосфорилирования GSK-3 уменьшает его активность, хроническое угнетение GSK-3 посредством описанных здесь соединений может снижать фосфорилирование Tau. Снижение фосфорилирования Tau уменьшает образование парно-скрученных филаментов, воздействие, которое может замедлять прогрессирование таупатий, включая болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз и другие более редкие нейродегенеративные заболевания, отличающиеся аномальными отложениями молекул Tau. ЛитератураYi S.N. et al., Bulletin of Hunan Medical University, (1988), 30 13:327-330. Патент США под номером 6949624, Liu et al. Публикация патента США под номером 2004/0197888, Armour et al. Публикация патента США под номером 2004/0253637, Buechler et al. Публикация патента США под номером 2005/0203082, Hsu et al. Публикация патента США под номером 2006/0030616 А 1, filed February 9, 2006 (McCluskey et al.).R1 и R2 вместе представляют собой =O; где X представляет собой NR11,где каждый R11 представляет собой C1-C12 алкил, C1-C12 гидроксиалкил, C2-C12 алкенил или C2-C12 алкинил; или R3 и R4 являются отличными друг от друга и каждый представляет собой ОН илиR5 и R6 вместе представляют собой =O;R3 представляет собой ОН и или соль, энантиомер или цвиттер-ион соединения. 4. Соединение по п.1, где соединение имеет структуру 5. Соединение по п.1, 2 или 4, где R3 представляет собой OR10, где R10 представляет собой замещенный фенил, где заместитель находится в пара-положении. 6. Соединение по любому из пп.1, 2 или 4,где R3 представляет собой О(СН 2)1-2R9 или OR10, где R9 представляет собой С 6 арил, R10 представляет собой замещенный фенил,где заместитель находится в пара-положении; где R11 представляет собой C1-C12 алкил или С 1-С 12 гидроксилалкил. 7. Соединение по любому из пп.1, 2 или 4,где R3 представляет собой O(CH2)R9 или OR10, где R9 представляет собой фенил, R10 представляет собой CH2CCl3,R4 представляет собой где R11 представляет собой СН 3 или СН 3 СН 2 ОН. 8. Соединение по п.1, гдеR10 представляет собой СН 2(CHNHBoc)СО 2 Н; илиR10 представляет собой СН 2(CHNH2)СО 2 Н; илиR10 представляет собой CH2CCl3. 9. Соединение по любому из пп.1, 2 или 4, где R3 представляет собой O(CH2)1-6R9, где R9 представляет собой фенил или R3 представляет собой O(CH2)R9, где R9 представляет собой фенил. 10. Соединение по любому из пп.1, 2 или 4-9,где R4 представляет собой или соль, энантиомер или цвиттер-ион соединения. 12. Фармацевтическая композиция, содержащая соединение по любому из пп.1-11 и фармацевтически приемлемый носитель. 13. Способ получения соединений по любому из пп.1-11, включающийR3 представляет собой ОН и где X представляет собой NR11, где каждый R11 представляет собой C1-C12 алкил, C1-C12 гидроксиалкил, C2-C12 алкенил или C2-C12 алкинил; или R3 и R4 являются отличными друг от друга и каждый представляет собой ОН или(b) взаимодействие продукта стадии (а) с нуклеофилом в присутствии 1-этил-3-(3-диметиламинопропил)карбодиимида или сульфонилхлорида с образованием соединения со структурой где X представляет собой NR11, где каждый R11 независимо представляет собой C1-C12 алкил, C1-С 12 гидроксиалкил, C2-C12 алкенил, или С 2-С 12 алкинил;R7 и R8, каждый, представляет собой Н; и где нуклеофил на стадии (а) или (b) содержит по меньшей мере одну гидроксильную группу; или нуклеофил содержит по меньшей мере одну свободную аминогруппу; или нуклеофил представляет собой О(СН 2)1-6R9 или OR10; или нуклеофил представляет собой где X такой, как определено выше. 14. Применение соединения по любому из пп.1-11 для лечения рака молочной железы, рака толстой кишки, крупноклеточного рака легкого, рака легкого, мелкоклеточного рака легкого, рака желудка, рака печени, рака яичника, рака поджелудочной железы, рака предстательной железы, промиелоцитарного лейкоза, хронического миелоцитарного лейкоза и острого лимфоцитарного лейкоза.
МПК / Метки
МПК: C07C 49/00, C07C 49/613
Метки: оксабициклогептаны, оксабициклогептены, применение, получение
Код ссылки
<a href="https://eas.patents.su/23-22311-oksabiciklogeptany-i-oksabiciklogepteny-ih-poluchenie-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Оксабициклогептаны и оксабициклогептены, их получение и применение</a>
Предыдущий патент: Солевые формы органического соединения
Следующий патент: Монотерпены для лечения заболеваний дыхательных путей, в частности бронхолегочных заболеваний
Случайный патент: Способ намотки высоковольтной обмотки катушки зажигания












