Фармацевтическая композиция и пероральная фармацевтическая дозированная форма (варианты), проявляющие активность в отношении вич-инфекций, лечебный набор и таблетка и способ лечения или предотвращения симптомов или эффектов вич-инфекции
Формула / Реферат
1. Фармацевтическая композиция, проявляющая активность в отношении ВИЧ-инфекций, содержащая фумарат диизопропоксикарбонилоксиметилового эфира [2-(6-аминопурин-9-ил)-1-метилэтоксиметил]фосфоновой кислоты (тенофовир дизопроксил фумарат) и (2R,5S,цис)-4-амино-5-фтор-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-он (эмтрицитабин).
2. Композиция по п.1, дополнительно содержащая один или несколько фармацевтически подходящих носителей или наполнителей.
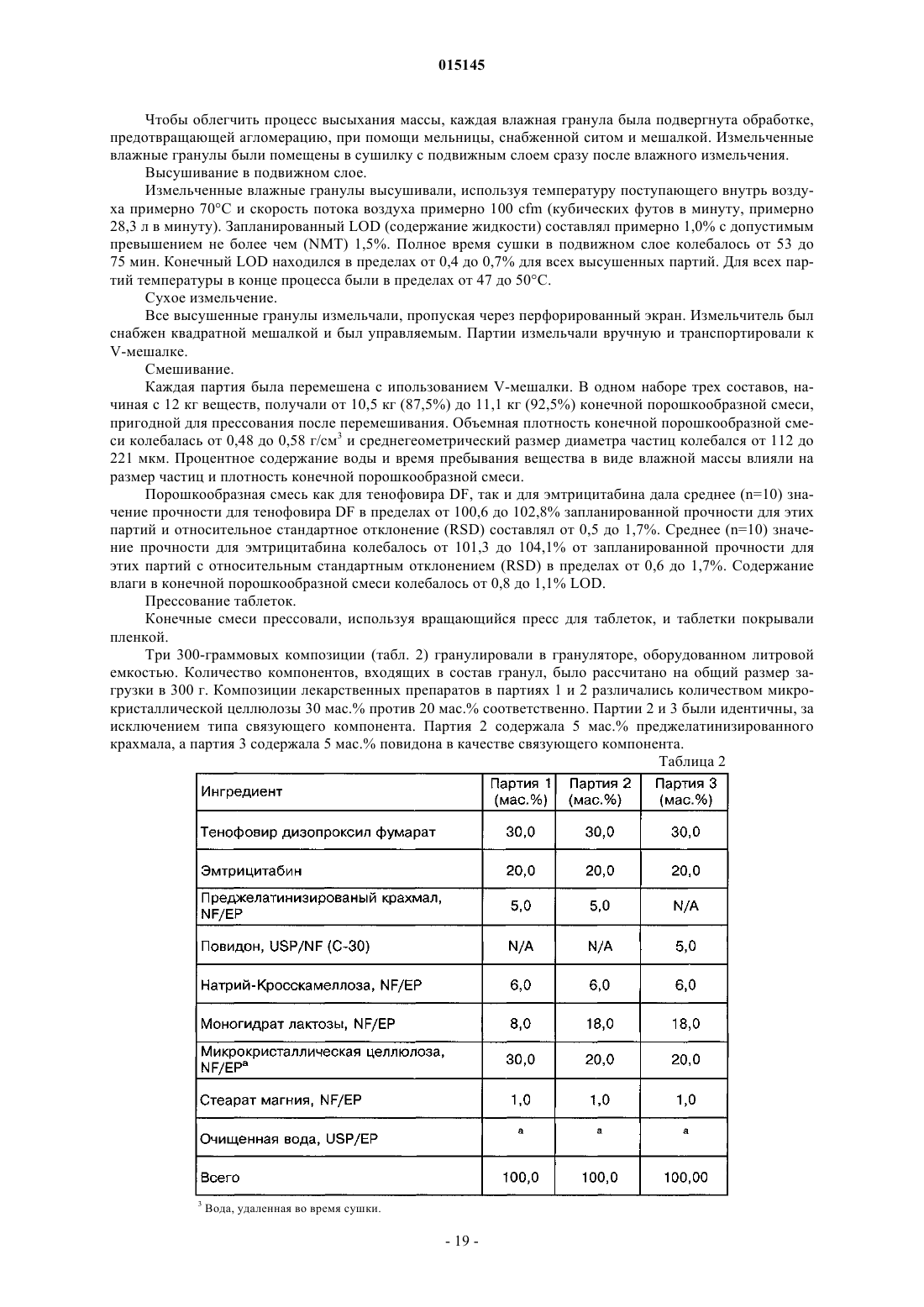
3. Композиция по п.2, в которой фармацевтически подходящие носители или наполнители выбраны из предварительно желатинизированного крахмала, натрийкроскармеллозы, повидона, моногидрата лактозы, микрокристаллической целлюлозы или стеарата магния, а также их комбинаций.
4. Композиция по любому из пп.1-3, выполненная в форме, пригодной для перорального применения.
5. Композиция по п.4, в которой общее количество тенофовир дизопроксил фумарата и эмтрицитабина составляет 1-1000 мг, а носитель составляет примерно 5-95 мас.% от общего веса композиции.
6. Композиция по п.4, выполненная в форме, пригодной для введения инфицированному человеку один раз в сутки.
7. Композиция по любому из пп.4-6, выполненная в форме таблетки.
8. Композиция по любому из пп.4-6, выполненная в форме капсулы.
9. Композиция по любому из пп.1-8, в которой тенофовир дизопроксил фумарат и эмтрицитабин присутствуют в соотношении 1,5:1.
10. Композиция по п.9, содержащая примерно 300 мг тенофовир дизопроксил фумарата и примерно 200 мг эмтрицитабина.
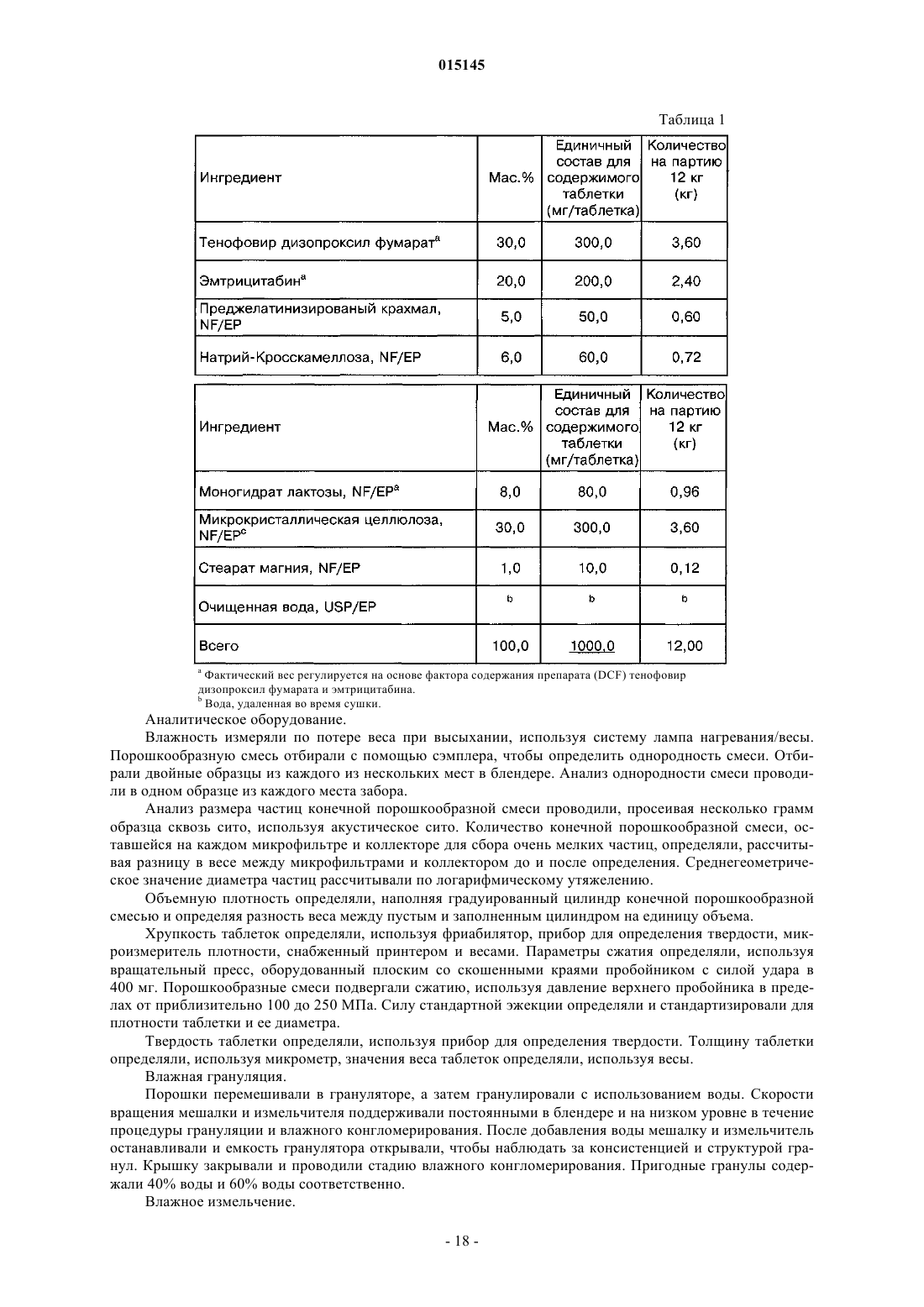
11. Композиция по п.7, содержащая 30 мас.% тенофовир дизопроксил фумарата, 20 мас.% эмтрицитабина, 5 мас.% предварительно желатинизированного крахмала, 6 мас.% натрийкроскармеллозы, 8 мас.% моногидрат лактозы, 30 мас.% микрокристаллической целлюлозы, 1 мас.% стеарата магния.
12. Композиция по любому из пп.1-11, выполненная в форме единичной дозы.
13. Композиция по любому из пп.1-12, которая дополнительно содержит третий антивирусный агент.
14. Композиция по п.13, в которой третий антивирусный агент выбран из ингибитора протеазы ВИЧ (PI), нуклеозидного ингибитора обратной транскриптазы ВИЧ (NRTI), ненуклеозидного ингибитора обратной транскриптазы ВИЧ (NNRTI) и ингибитора интегразы ВИЧ.
15. Композиция по п.14, в которой третьим антивирусным агентом является PI.
16. Композиция по п.14, в которой третьим антивирусным агентом является NNRTI.
17. Композиция по п.14, в которой третьим антивирусным агентом является агент, выбранный из агентов против ВИЧ, представляющих собой атазанивир сульфат, лопинавир/ретиновир или эфавиренз.
18. Композиция по любому из пп.1-17, дополнительно содержащая фармацевтически подходящий глидант.
19. Композиция по п.18, в которой глидант выбран из группы веществ, включающей двуокись кремния, порошкообразную целлюлозу, микрокристаллическую целлюлозу, стеараты металлов, алюмосиликат натрия, бензоат натрия, карбонат кальция, силикат кальция, маисовый крахмал, карбонат магния, тальк, не содержащий асбест, крахмал, крахмал 1500, лаурилсульфат магния, окись магния и их комбинации.
20. Композиция по п.19, в которой стеараты металлов выбраны из стеарата кальция, стеарата магния, стеарата цинка и их комбинаций.
21. Пероральная фармацевтическая дозированная форма, проявляющая активность в отношении ВИЧ-инфекций, содержащая тенофовир дизопроксил фумарат, эмтрицитабин и атазанивир сульфат.
22. Пероральная фармацевтическая дозированная форма, проявляющая активность в отношении ВИЧ-инфекций, содержащая тенофовир дизопроксил фумарат, эмтрицитабин и лопинавир/ретиновир.
23. Пероральная фармацевтическая дозированная форма, проявляющая активность в отношении ВИЧ-инфекций, содержащая тенофовир дизопроксил фумарат, эмтрицитабин и эфавиренз.
24. Таблетка, содержащая 300 мг тенофовир дизопроксил фумарата, 200 мг эмтрицитабина и носители и/или наполнители, достаточные для того, чтобы кислотная деградация тенофовир дизопроксил фумарата или эмтрицитабина составляла менее 5% после шести месяцев хранения с поглотителем влаги при 40°С/75% относительной влажности.
25. Лечебный набор, включающий (а) фармацевтическую композицию, содержащую фумарат диизопропоксикарбонилоксиметилового эфира [2-(6-аминопурин-9-ил)-1-метил-этоксиметил]фосфоновой кислоты (тенофовир дизопроксил фумарат) и (2R,5S,цис)-4-амино-5-фтор-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1H)-пиримидин-2-она (эмтрицитабина), и (b) информационный вкладыш, содержащий указания по применению композиции тенофовир дизопроксил фумарата и эмтрицитабина для лечения пациента, нуждающегося в антивирусной терапии, представляющей собой анти-ВИЧ-терапию.
26. Лечебный набор по п.25, в котором фармацевтическая композиция представляет собой таблетку, таблетку в виде капсулы или капсулу, содержащую 300 мг тенофовир дизопроксил фумарата и 200 мг эмтрицитабина.
27. Применение фумарат диизопропоксикарбонилоксиметилового эфира [2-(6-аминопурин-9-ил)-1-метилэтоксиметил]фосфоновой кислоты (тенофовир дизопроксил фумарат) в комбинации с (2R,5S,цис)-4-амино-5-фтор-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-оном (эмтрицитабин) для производства объединенной в один препарат композиции для лечения или предотвращения симптомов или эффектов ВИЧ-инфекции.
28. Применение по п.27, при котором композиция находится в форме таблетки.
29. Применение по п.27, при котором композиция содержит 300 мг тенофовир дизопроксил фумарата и 200 мг эмтрицитабина.
30. Применение по любому из пп.27-29, при котором общее количество тенофовир дизопроксил фумарата и эмтрицитабина в композиции составляет 1-1000 мг, а носитель, дополнительно включенный в композицию, составляет примерно 5-95 мас.% от общего веса композиции.
31. Применение по п.30, при котором соотношение общего веса тенофовир дизопроксил фумарата и эмтрицитабина в композиции к весу ингредиентов, отличных от тенофовир дизопроксил фумарата и эмтрицитабина, составляет 1:1.
32. Применение по п.31, при котором композиция выполнена в форме таблетки и содержит 30 мас.% тенофовир дизопроксил фумарата, 20 мас.% эмтрицитабина, 5 мас.% предварительно желатинизированного крахмала, 6 мас.% натрийкроскармеллозы, 8 мас.% моногидрат лактозы, 30 мас.% микрокристаллической целлюлозы, 1 мас.% стеарата магния.
33. Применение по любому из пп.27-32, при котором композиция дополнительно содержит третий активный ингредиент, выбранный из ингибитора протеазы ВИЧ (PI), нуклеозидного ингибитора обратной транскриптазы ВИЧ (NRTI), ненуклеозидного ингибитора обратной транскриптазы ВИЧ (NNRTI) и ингибитора интегразы ВИЧ.
34. Применение по п.33, при котором третий активный ингредиент выбран из агентов против ВИЧ, представляющих собой атазанивир сульфат, лопинавир/ретиновир или эфавиренз.
35. Применение по любому из пп.27-34, при котором композиция дополнительно содержит фармацевтически подходящий глидант.
36. Применение по п.35, при котором глидант выбран из группы, включающей двуокись кремния, порошкообразную целлюлозу, микрокристаллическую целлюлозу, стеараты металлов, алюмосиликат натрия, бензоат натрия, карбонат кальция, силикат кальция, маисовый крахмал, карбонат магния, тальк, не содержащий асбест, крахмал, крахмал 1500, лаурилсульфат магния, окись магния и их комбинации.
37. Применение по п.36, при котором стеараты металлов выбраны из стеарата кальция, стеарата магния, стеарата цинка и их комбинаций.
Текст
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПЕРОРАЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ ДОЗИРОВАННАЯ ФОРМА (ВАРИАНТЫ), ПРОЯВЛЯЮЩИЕ АКТИВНОСТЬ В ОТНОШЕНИИ ВИЧ-ИНФЕКЦИЙ, ЛЕЧЕБНЫЙ НАБОР И ТАБЛЕТКА И СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ СИМПТОМОВ ИЛИ ЭФФЕКТОВ ВИЧ-ИНФЕКЦИИ Настоящее изобретение относится к фармацевтической композиции, пероральной фармацевтической дозированной форме, таблетке и лечебному набору на основе фумарата диизопропоксикарбонилоксиметилового эфира [2-(6-аминопурин-9-ил)-1-метилэтоксиметил]фосфоновой кислоты (тенофовир дизопроксил фумарат,тенофовир DF, TDF, Viread) и (2R,5S,цис)-4-амино-5-фтор-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1 Н)пиримидин-2-она (эмтрицитабин, Emtriva, (-)-цис FTC). Фармацевтическая композиция, дозированная форма, таблетка и лечебный набор могут использоваться при лечении ВИЧ-инфекций, в том числе инфекций, вызванных мутантами ВИЧ, выработавшими устойчивость к нуклеозидным и ненуклеозидным ингибиторам. Представленное изобретение также касается технологий приготовления вышеупомянутых смесей тенофовира дизопроксил фумарата и эмтрицитабина и лекарственного средства на их основе. 015145 Область техники, к которой относится изобретение Изобретение относится в основном к созданию комбинаций веществ с антивирусной активностью и действующих более избирательно в отношении вируса иммунодефицита человека. В частности, оно имеет отношение к химически стабильным сочетаниям разнообразных по структуре антивирусных агентов. Сведения о предшествующем уровне техники Заражение человека вирусом иммунодефицита и связанные с ним заболевания - главная проблема общественного здоровья во всем мире. Вирус иммунодефицита типа 1 (ВИЧ-1) кодирует по крайней мере три фермента, которые необходимы для репликации вируса: обратную транскриптазу (ревертазу)(RT), протеазу (Prt) и интегразу (Int). Хотя лекарства, воздействующие на обратную транскриптазу и протеазу, широко используются и продемонстрировали эффективность, особенно когда применяются в сочетании, токсичность и развитие устойчивых штаммов ограничивало их применение (Palella et al. N.Engl. J. Med (1998) 338:853-860; Richman D.D. Nature (2001) 410:995-1001). Протеаза (Prt) вируса иммунодефицита человека типа 1 (ВИЧ-1) незаменима для вирусной репликации и является эффективной мишенью для уже одобренных антивирусных лекарственных препаратов. Prt ВИЧ расщепляет вирусныеGag и Gag-Pol полипротеины для образования вирусных структурных белков (р 17, р 24 и р 6) и трех вирусных ферментов. Доказано, что комбинированная терапия ингибиторами RT является высокоэффективной в отношении подавления вирусной репликации до количественно неопределимых уровней в течение длительного времени. Также комбинированная терапия ингибиторами RT и Prt (PI) продемонстрировала синергетические эффекты в отношении подавления репликации ВИЧ. К сожалению, комбинированная терапия не является успешной для высокого процента больных (как правило, от 30 до 50%) ввиду развития лекарственной резистентности, несоблюдения сложной схемы применения, фармакокинетического взаимодействия, токсичности, отсутствия эффекта. Вот почему существует потребность в новых ингибиторах ВИЧ-1, которые активны против мутантных штаммов ВИЧ, имеют четкие профили резистентности, меньше побочных эффектов, менее сложную схему дозирования и являются активными при пероральном введении. В частности, существует потребность в менее обременительной схеме дозирования, например один раз в день перорально как можно с меньшим числом таблеток. Использование комбинаций химических соединений может дать эквивалентный эффект на фоне более низкой токсичности или повышения лекарственной эффективности. Более низкие предельные дозы лекарства могут снизить частоту появления лекарственно-устойчивых вариантов ВИЧ. Было использовано много разных способов, чтобы исследовать эффекты сочетаний химических соединений, действующих совместно в разных вариантах (Furman WO 02/068058). Более низкие дозы предопределяют лучшие соблюдения режима пациентом, когда снижается нагрузка таблетками, упрощается схема дозирования и,по возможности, если существует синергизм между соединениями (Loveday С. "Nucleoside reverse transcriptase inhibitor resistance" (2001) JAIDS Journal of Acquired Immune Deficiency Syndromes 26:S10-S24).AZT (зидовудин, 3'-азидо,3'-дезокситимидин) демонстрирует синергетическое лекарственное воздействие in vitro в сочетании со средствами, которые влияют на стадии репликации ВИЧ-1, но не на стадии обратной транскрипции, включая рекомбинантный растворимый CD4 кастаноспермин и рекомбинантный интерферон-. Однако следует отметить, что комбинации соединений могут дать повышение цитотоксичности. Например, AZT и рекомбинантный интерферон- имеют повышенный цитотоксический эффект на нормальные клетки-предшественники костного мозга человека. Химическая стабильность комбинаций антивирусных средств - это важный аспект успешного создания объединенного состава и настоящее изобретение предоставляет примеры таких комбинаций. Существует потребность в новых комбинациях лекарств, активных при пероральном приеме для лечения больных, инфицированных определенными вирусами, например ВИЧ, которые бы обеспечивали повышенную терапевтическую безопасность и эффективность, давали более низкую резистентность и предопределяли более терпимое отношение больного к режиму и схеме лечения. Сущность изобретения Настоящее изобретение предлагает комбинации антивирусных соединений в виде фармацевтических композиций, дозированных лекарственных форм или в составе лечебного набора. В качестве примера данное изобретение включает фармацевтическую композицию, содержащую тенофовир дизопроксил фумарат и эмтрицитабин, который имеет противо-ВИЧ активность. Комбинация тенофовира DF и эмтрицитабина является не только химически стабильной, но и синергетичной и/или снижает побочные эффекты одного или обоих веществ: тенофовира DF и эмтрицитабина. Весьма вероятно, что ввиду снижения нагрузки таблетками и более простой схемы приема препарата может быть достигнута большая лояльность больных к процессу лечения. Настоящее изобретение определяет терапевтические комбинации фумаратадиизопропоксикарбонилоксиметилового эфира[2-(6-аминопурин-9-ил)-1-метилэтоксиметил]фосфоновой кислоты, (тенофовир дизопроксил фумарат, тенофовир DF, TDF, Viread) и (2R,5S,цис)-4-амино-5-фтор-1-(2 гидроксиметил-1,3-оксатиолан-5-ил)-(1 Н)-пиримидин-2-она (эмтрицитабин, Emtriva, (-)-цис FTC) и их использование в лечении ВИЧ-инфекций, в том числе инфекций, вызванных мутантами ВИЧ, выработавшими устойчивость к нуклеозидным и ненуклеозидным ингибиторам. Представленное изобретение-1 015145 относится к фармацевтической композиции, пероральным дозированным лекарственным формам, лечебному набору, а также к технологии приготовления вышеупомянутых смесей тенофовира дизопроксил фумарата и эмтрицитабина и лекарственного средства на их основе. Одним из аспектов изобретения является применение фумарата диизопропоксикарбонилоксиметилового эфира [2-(6-аминопурин-9-ил)-1-метилэтоксиметил]фосфоновой кислоты (тенофовир DF, TDF) и(2R,5S,цис)-4-амино-5-фтор-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1H)-пиримидин-2-она (эмтрицитабин) для производства объединенной в один препарат композиции для лечения или предотвращения симптомов или эффектов ВИЧ-инфекции. Другим аспектом настоящего изобретения является единичная дозированная форма, содержащая тенофовир дизопроксил фумарат и эмтрицитабин. Единичная дозированная форма может быть разработана для перорального и других способов применения и оказывается химически стабильной, если принять во внимание свойства структурно различных компонентов. Другим аспектом изобретения является пероральная фармацевтическая дозированная форма, проявляющая активность в отношении ВИЧ-инфекций, содержащая тенофовир дизопроксил фумарат, эмтрицитабин и атазанивир сульфат или пероральная фармацевтическая дозированная форма, проявляющая активность в отношении ВИЧ-инфекций, содержащая тенофовир дизопроксил фумарат, эмтрицитабин и лопинавир/ретиновир, а также пероральная фармацевтическая дозированная форма, проявляющая активность в отношении ВИЧ-инфекций, содержащая тенофовир дизопроксил фумарат, эмтрицитабин и эфавиренз. Еще один аспект данного изобретения направлен на создание химически стабильной комбинации антивирусных агентов в виде фармацевтической дозированной формы, содержащих тенофовир дизопроксил фумарат и эмтрицитабин. В дальнейшем рассматриваются химически стабильные дозированные формы тенофовир дизопроксил фумарата и эмтрицитабина, которые содержат, кроме того, третий антивирусный фактор. В этой трехкомпонентной смеси уникальная химическая стабильность тенофовир дизопроксил фумарата и эмтрицитабина способствует созданию комбинаций с третьим антивирусным фактором. Ниже представлен перечень, но не исчерпывающий, веществ, которые весьма успешно могут быть использованы в качестве третьего компонента смеси. Предпочтительно, чтобы третьим компонентом являлось вещество, проявившее антивирусную активность при применении на людях, причем более предпочтительны ненуклеозидные ингибиторы обратной транскриптазы (NNRTI) или ингибитор протеазы (PI), но все же предпочтительнее NNRTI. Приоритетным направлением данного изобретения является создание химически стабильной комбинации тенофовир дизопроксил фумарата и эмтрицитабина с эфавирензом. Еще одним аспектом настоящего изобретения является создание лечебного набора для больных(пациентов), включающего (а) фармацевтическую композицию, содержащую фумарат диизопропоксикарбонилоксиметиловый эфир [2-(6-аминопурин-9-ил)-1-метилэтоксиметил]фосфоновой кислоты (тенофовир дизопроксил фумарат) и (2R,5S,цис)-4-амино-5-фтор-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)(1H)-пиримидин-2-он (эмтрицитабин), а также (b) информационный вкладыш, содержащий инструкции(указания) по применению композиции тенофовир дизопроксил фумарата и эмтрицитабина для лечения больного, нуждающегося в антивирусной терапии, представляющей собой анти-ВИЧ-терапию. Другим аспектом данного изобретения является лечебный набор, в котором фармацевтическая композиция представляет собой таблетку, таблетку в виде капсулы или капсулу, содержащую 300 мг тенофовир дизопроксил фумарата и 200 мг эмтрицитабина. Еще одним аспектом данного изобретения является процесс изготовления комбинированных лекарственных препаратов, описанных выше, который состоит в том, чтобы соединить тенофовир DF и эмтрицитабин в одном препарате с целью получения противовирусного эффекта. Как будет рассмотрено далее,был обеспечен способ производства комбинированного лекарственного средства для лечения любой из вышеупомянутых вирусных инфекций или состояний. Варианты осуществления изобретения Фармацевтическая композиция, содержащая фармацевтически эффективное количество фумарат диизопропоксикарбонилоксиметилового эфира [2-(6-аминопурин-9-ил)-1-метилэтоксиметил]фосфоновой кислоты (тенофовир дизопроксил фумарата) и фармацевтически эффективное количество (2R,5S,)-4 амино-5-фтор-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1H)-пиримидин-2-она (эмтрицитабина); и фармацевтически приемлемый носитель. Фармацевтическая композиция, дополнительно содержащая третий активный ингредиент, выбираемый из группы, состоящей из ингибитора протеазы, нуклеозидного и нуклеотидного ингибитора обратной транскриптазы и ненуклеозидного инигибитора обратной транскриптазы и ингибитора интегразы. Фармацевтическая композиция в форме единичной дозы. Еще одним воплощением изобретения является таблетка, содержащая 300 мг тенофовир дизопроксил фумарата, 200 мг эмтрицитабина и носители и/или наполнители, достаточные для того, чтобы кислотная деградация тенофовир дизопроксил фумарата или эмтрицитабина составляла менее 5% после шести месяцев хранения с поглотителем влаги при 40 С/75% относительной влажности.-2 015145 Сведения, подтверждающие возможность осуществления изобретения По ходу описания изобретения, в свете приведенных пунктов формулы, станет ясно, что авторы не намерены ограничить рамки изобретения этими притязаниями. Наоборот, данное изобретение рассчитано на то, чтобы охватить все альтернативы, модификации и эквиваленты, которые могут быть включены в сферу его рассмотрения, как определено в формуле изобретения. Определения Кроме специально оговариваемых случаев, следующие термины и выражения, используемые в настоящем контексте, имеют следующие значения. Когда в этой работе используются торговые названия, заявители намерены независимо включать продукт с торговым названием и активный(е) ингредиент(ы) продукта с торговым названием. Термин "химическая стабильность" означает, что два исходных антивирусных фактора в сочетании являются в достаточной степени стабильными в отношении химической деградации. Лучше, чтобы они были достаточно стабильными в физической смеси, обеспечивая коммерчески выгодные сроки хранения комбинированного препарата. Характерной особенностью является то, что "химическая стабильность" подразумевает, что первый компонент смеси не вызывает деградацию второго компонента, когда они оба находятся в физической смеси, образуя фармацевтическую лекарственную форму. Более конкретно, "химическая стабильность" означает, что кислотность первого компонента не катализирует или, иными словами, не ускоряет кислотный распад второго компонента. В качестве примера, но не ограничения, в одном из аспектов изобретения "химическая стабильность" означает, что тенофовир дизопроксил фумарат не подвергается существенной деградации под влиянием кислотности эмтрицитабина. "Существенно" в данном контексте означает, что менее чем 10%, лучше менее 1%, еще лучше менее 0,1%, но гораздо лучше меньше 0,01% тенофовир дизопроксил фумарата подвергается кислотной деградации за 24 ч, когда продукты находятся в фармацевтической лекарственной форме. Термины "синергия" и "синергетический" означают, что эффект, получаемый при совместном использовании соединений, больше суммы эффектов, получаемых при использовании каждого соединения в отдельности, т.е. больше, чем можно было бы ожидать, основываясь на действии двух активных ингредиентов при их раздельном применении. Синергетический эффект может быть получен в том случае,если компоненты (1) совмещены в одном препарате и вводятся или даются одновременно в виде комбинированного лекарственного средства; (2) даются по очереди или параллельно в виде отдельных препаратов или (3) по какой-то другой схеме. Когда применяется альтернативная терапия, синергетический эффект может быть достигнут, если компоненты вводят или дают последовательно, т.е. в отдельных таблетках, драже или капсулах, или в виде разных инъекций в отдельных шприцах. Вообще, в процессе альтернативной терапии эффективная доза каждого активного ингредиента вводится последовательно, т.е. по порядку, в то время как в комбинированной терапии эффективные дозы двух или более активных ингредиентов вводятся вместе. Синергетический антивирусный эффект оказывается выше, чем антивирусный эффект, ожидаемый при простом суммировании эффектов индивидуальных компонентов смеси."Биологическая доступность" - это степень доступности фармацевтически активного вещества для ткани-мишени после его поступления в организм. Повышение биодоступности фармацевтически активного вещества может обеспечить более рациональное и эффективное воздействие на больных, так как большая доля данной дозы фармацевтически активного вещества будет доступна для рецепторов тканимишени. Компоненты комбинированных препаратов данного изобретения можно отнести как к "активным ингредиентам", так и к "фармацевтически активным веществам". Стереохимические определения и принятые здесь термины в основном соответствуют изложенным в работе Parker S.P. Td., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company,New York и Eliel E. and Wilen S. Stereochemistry of Organic Compounds (1994) John WileySons, Inc.,New York. Многие органические соединения существуют в оптически активных формах, т.е. они обладают способностью вращать плоскость поляризации света. При описании оптически активного соединения префиксы D и L или R и S используются для того, чтобы показать абсолютную конфигурацию молекулы относительно ее хирального центра(ов). Префиксы d и 1 или (+) и (-) служат для того, чтобы различить знак направления вращения плоскости поляризации света химическим соединением, при этом с помощью (-) или 1 обозначают, что соединение является левовращающим. Соединения, обозначенные префиксами (+) или (d), являются правовращающими. Для данной химической структуры соединения, называемые стереоизомерами, являются идентичными, за исключением того, что они являются зеркальными отражениями друг друга. Особый стереоизомер определяют также как энантиомер, а смесь таких изомеров часто называют энантиомерной смесью. Смесь с соотношением энантиомеров 50:50 называется рацемической или рацематом. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомеров, не обладающей оптической активностью. Термин "хиральный" применяется в отношении молекул, обладающих свойством не совмещаться с зеркальным изображением партнера, в то время как термин "ахиральный" относится к молекулам, которые могут совпадать с зеркальным отражением своей пары. Термин "стереоизомеры" применяется в отношении соединений, которые имеют одинаковое хими-3 015145 ческое строение, но различаются расположением атомов или групп в пространстве."Диастереомеры" - термин, относящийся к стереоизомерам с двумя или более центрами хиральности и молекулы которых не являются зеркальным отражением друг друга. Диастереомеры имеют разные физические свойства, например точки плавления, точки кипения, спектральные свойства и реакционную способность. Смеси диастереомеров можно разделить с помощью высокоразрешающих аналитических методов, таких как электрофорез и хроматография. Термин "энантиомеры" относится к двум стереоизомерам одного и того же соединения, чьи зеркальные отражения несовместимы друг с другом. Активные ингредиенты комбинированных препаратов Настоящее изобретение представляет новые сочетания двух или более активных ингредиентов,применяемых совместно в виде фармацевтических композиций, фармацевтических дозированных форм или в составе лечебного набора. В некоторых вариантах сочетаний достигается синергетический эффект. В других сочетаниях получают химически стабильную комбинацию. Комбинированные препараты содержат (1) тенофовир дизопроксил фумарат и (2) эмтрицитабин. Термин "синергетический противовирусный эффект" употребляют в этой работе, чтобы обратить внимание на противовирусный эффект, который оказывается выше, чем ожидаемый чисто суммарный эффект отдельных компонентов (а) и (б) этой смеси. Тенофовир дизопроксил фумарат (также известный как Viread, Тенофовир DF, Тенофовир дизопроксил, TDF, Bis-POC-PMPA (патенты США 5935946, 5922695, 5977089, 6043230, 6069249 является пролекарством тенофовира и имеет следующую структуру: включая соль фумаровой кислоты (НО 2 ССН 2 СН 2 СО 2-). Химические названия для тенофовир дизопроксила следующие: диизопропоксикарбонилоксиметиловый эфир[2-(6-аминопурин-9-ил)-1-метилэтоксиметил]фосфоновой кислоты; 9-[(R)-2 бис(изопропоксикарбонил)окси]метокси]фосфинил]метокси]пропил]аденин и 2,4,6,8-тетраокса-5 фосфанонанедиоевая кислота, 5-(1R)-2-(6-амино)-9 Н-пурин-9-ил)-1-метилэтокси]метил]-, бис(1-метилэтил) эфир,5-оксид. Они имеют следующие номера в CAS реестре: 201341-05-1; 202138-50-9; 206184-498. Следует заметить, что этоксиметильная составляющая тенофовира имеет хиральный центр. ВыявленR-энантиомер (правовращающий). Однако данное изобретение рассматривает также S-изомер. Изобретение охватывает все энантиомеры, диастереомеры, рацематы и обогащенные смеси стереоизомеров тенофовира (РМРА). РМРА или тенофовир (патенты США 4808716, 5733788, 6057305) имеет следующую структуру:(1R)-2-(6-амино-9 Н-пурин-9-ил)метилэтокси]метил]фосфоновая кислота. Номер в CAS Реестре 147127-20-6. Тенофовир дизопроксил фумарат (DF) является нуклеотидным ингибитором обратной транскриптазы, одобренным в Соединенных Штатах в 2001 году для лечения ВИЧ-1 инфекций в сочетании с другими противовирусными агентами. Тенофовир дизопроксил фумарат или Viread (Gilead Science, Inc.) является фумаровой солью тенофовир дизопроксила. Viread может быть назван как 9-[(R)-2-бис(изопропоксикарбонил)окси]метокси]фосфинил]метокси]пропил]аденин фумарат (1:1) или 5-(R)-2-(6-амино 9 Н-пурин-9-ил)-1-метилэтокси]метил]-, бис(1-метилэтил)эфир 2,4,6,8-тетраокса-5-фосфанонанедиоевой кислоты, 5-оксид, (2 Е)-2-бутендиоат (1:1). Номер в CAS реестре: 202138-50-9.-4 015145 Физиологически функциональными производными тенофовир дизопроксил фумарата являются РМЕА (адефовир, 9-R)-2-(фосфонометокси)этил)аденин) и РМРА соединения. Приводимые комбинированные препараты содержат соединение РМЕА или РМРА в сочетании с эмтрицитабином. Изобретение охватывает все энантиомеры, диастереомеры и рацематы. Эмтрицитабин -)-цис-FTC, Emtriva), синглетный энантиомер FTC, является мощным нуклеозидным ингибитором обратной транскриптазы, одобренным для лечения ВИЧ (патенты США 5047407,5179104, 5204466, 5210085, 5486520, 5538975, 5587480, 5618820, 5763606, 5814639, 5914331, 6114343,6180639, 6215004; WO 02/070518). Этот энантиомер имеет следующую структуру: Химические названия эмтрицитабина следующие:(-)-цис-FTC; -L-гидроксиметил-5-(5 фторцитозин-1-ил)-1,3-оксатиолан; (2R,5S)-5-фтор-1-[2-(гидроксиметил)-1,3-оксатиолан-5-ил]цитозин и 4-амино-5-фтор-1-(2-гидроксиметил-[1,3]-(2R,5S)-оксатиолан-5-ил)-1 Н-пиримидин-2-он. Номера в CAS реестре: 143491-57-0; 143491-54-7. Следует отметить, что FTC содержит два хиральных центра в положениях 2 и 5 оксатиоланового кольца и поэтому может существовать в форме двух пар оптических изомеров (т.е. энантиомеров) и их смесей, включая рацемические смеси. Таким образом, FTC может являться либо цис- либо транс-изомером или их смесью. Смеси цис- и транс-изомеров являются диастереомерами с разными физическими свойствами. Каждый цис- и транс-изомер может существовать как один из энантиомеров или их смесей, в том числе рацемических. Изобретение охватывает все энантиомеры, диастереомеры, рацематы и обогащенные смеси стереоизомеров эмтрицитабина и его физиологически функциональных производных. Например, настоящее изобретение включает такие физиологически функциональные производные, как рацемическая смесь энантиомеров (2R,5S,цис)-4-амино-5-фтор-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)(1H)-пиримидин-2-он (эмтрицитабин) и его зеркального отражения (2S,5R,цис)-4-амино-5-фтор-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1H)-пиримидин-2-он, в соотношении 1:1, или смесь двух энантиомеров в разных количественных соотношениях. Изобретение включает также смеси цис- и транс-форм FTC. Химическая стабильность фармацевтической композиции Химическая стабильность активных ингредиентов в фармацевтической композиции очень важна,чтобы свести до минимума образование примесей и гарантировать срок годности. Активные ингредиенты, тенофовир дизопроксил фумарат и эмтрицитабин, в фармацевтических композициях по настоящему изобретению имеют сравнительно низкие величины pKa, являющиеся показателем способности вызывать кислотный гидролиз активных ингредиентов. Эмтрицитабин с pKa 2,65 (Emtriva Product Insert, GileadSciences, Inc., 2003, доступен с сайта gilead.com) является объектом гидролитического дезаминирования нуклеинового основания 5-фторцитозина с образованием нуклеинового основания 5-фторуридина. Тенофовир дизопроксил фумарат с pKa 3,75 (Yuan L. et al. "Degradation Kinetics of Oxycarbonyloxymethyl Prodrugs of Phosphonates in Solution", Pharmaceutical Research (2001), vol. 18, No. 2, 234-237) является также объектом гидролитического дезаминирования экзоциклического амина нуклеинового основания аденина и гидролиза одной или обеих эфирных групп РОС (см. патент США 5922695). Желательно составить фармацевтическую композицию, лекарственные дозированные формы или лечебный набор на их основе,включающие тенофовир дизопроксил фумарат и эмтрицитабин с минимальным количеством примесей и достаточной стабильностью. Комбинированные препараты предлагаемого изобретения представляют собой смесь фармацевтических лекарственных средств, которые химически стабильны к кислотному расщеплению: (1) первого компонента (такого как тенофовир дизопроксил фумарат); (2) второго компонента (такого как эмтрицитабин); (3) по выбору третьего компонента, обладающего противовирусной активностью. Третий компонент представлен веществами, действие которых направлено против вируса иммунодефицита человека: ингибиторы протеаз (PI), нуклеозидные ингибиторы обратной транскриптазы (NRTI), ненуклеозидные ингибиторы обратной транскриптазы и ингибиторы интегразы (NNRTI). Примеры активных ингредиентов, выступающих в роли третьего активного компонента, вводимого в сочетании с первым и вторым компонентами, приводятся ниже в перечне примеров дополнительного компонента. Первый и второй компоненты по определению, данному в предыдущем разделе, обозначены как активные ингредиенты комбинированных препаратов.-5 015145 Соли Любое упоминание о любом из компонентов комбинированных препаратов данного изобретения подразумевает его физиологически переносимую соль. Примеры физиологически переносимых солей тенофовира DF и эмтрицитабина включают соли, полученные из соответствующего основания, например щелочного металла (например, натрия), щелочно-земельного металла (например, магния), аммония иNX4+ (где X - С 1-С 4-алкил) или органической кислоты, такой как фумаровая кислота, уксусная кислота,янтарная кислота. Физиологически переносимые соли, образованные при замещении атома водорода или аминогруппы, включают соли таких органических кислот, как уксусная, бензойная, молочная, фумаровая, винная, малеиновая, малоновая, изотионовая, лактобионовая и янтарная кислоты; органических сульфокислот, таких как метансульфокислота, этансульфокислота, бензолсульфокислота и паратолуолсульфокислота; и неорганических кислот, таких как соляная, серная, фосфорная и сульфаминовая кислоты. Физиологически переносимые соли соединения с гидроксильной группой включают анион этого соединения, связанный с соответствующим катионом, таким как Na+ и NX4+ (где X независимо выбран из Н или C1-C4 алкильной группы). Для терапевтического применения соли активных ингредиентов комбинированных препаратов, предложенных в настоящем изобретении, будут физиологически переносимыми,т.е. это будут соли, полученные из физиологически переносимой кислоты или основания. Однако соли кислот или оснований, которые физиологически не переносимы, могут также найти применение, например, в процессе приготовления или очистки физиологически переносимого соединения. Все соли, независимо от того, получены они из физиологически переносимой кислоты или основания или нет, находятся в сфере рассмотрения представленного изобретения. Применение лечебных препаратов Несмотря на то что активные ингредиенты комбинированного препарата применяют по одному и каждый отдельно в качестве монотерапии, предпочтительно применять их в виде объединенной в один препарат фармацевтической композиции. Двухкомпонентную или трехкомпонентную смесь можно применять одновременно или последовательно. При последовательном применении эту смесь можно ввести за один, два или три приема. Надо будет принять во внимание, что компоненты смеси можно применять одновременно путем соединения компонентов в комбинированном препарате. Для некоторых ВИЧ-положительных пациентов может быть приемлем режим применения комбинированного препарата по одной таблетке один раз в день. Эффективный максимум концентрации активных ингредиентов смеси в плазме крови будет приблизительно в пределах 0,001-100 мкМ. Оптимальный максимум плазматических концентраций активных ингредиентов комбинированного препарата может быть достигнут при прописывании схемы приема индивидуально для конкретного больного. Будет также понятно, что тенофовир DF и эмтрицитабин,принимаемые одновременно или последовательно, могут применяться индивидуально, многократно и в любом их сочетании. Вообще, при сочетанной терапии (1) эффективные дозы двух или более компонентов вводятся вместе. Составление комбинированных препаратов Возможность применения комбинированного препарата, представленного в этом изобретении, в виде единого лечебного набора с листовкой-вкладышем, содержащей инструкцию о том, как правильно использовать данное изобретение, является дополнительным преимуществом изобретения. Лечение комбинированными препаратами данного изобретения включает комбинированный препарат тенофовира и эмтрицитабина. Смесь может быть составлена в виде единицы лекарственного средства, содержащего фиксированное количество каждого активного фармацевтического ингредиента, т.е. дозы или поддозы, для определенного периода времени (например, ежедневно). Фармацевтические композиции содержат сочетание активных ингредиентов согласно представленному изобретению, вместе с одним или более фармацевтически приемлемым носителем или инертными наполнителями и произвольно выбранными другими терапевтическими агентами. Фармацевтические композиции, содержащие активный ингредиент, могут существовать в любой подходящей форме в зависимости от предназначенного способа применения. Для перорального применения можно изготавливать,например, таблетки, драже, пастилки, водные или масляные суспензии, порошки или гранулы, эмульсии,твердые или мягкие капсулы, сиропы или эликсиры (Remington's Pharmaceutical Sciences (Mack PublishingCo., Easton, PA. Фармацевтические дозированные формы, предназначенные для перорального использования, могут изготавливаться в соответствии с любым методом по известной технологии для производства фармацевтических дозированных форм, и такие формы могут содержать одно или более веществ, включая антиоксиданты, подслащающие агенты, вкусовые добавки, красители и консерванты,чтобы обеспечить вкусовые качества препарата. Допускается производство таблеток, содержащих активный ингредиент с примесью нетоксичного фармацевтически приемлемого инертного наполнителя. Эти инертные наполнители могут быть, например, инертными разбавителями, такими как карбонат кальция или натрия, лактоза, моногидрат лактозы, натриевая соль кроскармеллозы, повидон, фосфат кальция или натрия; гранулирующие и дезинтегрирующие агенты, такие как маисовый крахмал или альгиновая кислота; связующие вещества, такие как целлюлоза, крахмал, желатин или аравийская камедь; смазочные-6 015145 вещества, такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут быть без оболочки или с оболочкой, нанесенной по известным методам, включая микрокапсулирование, для того чтобы воспрепятствовать разложению и всасыванию в желудочно-кишечном тракте и, таким образом, обеспечить более длительное действие препарата. Например, в качестве пролонгирующих веществ могут служить глицерил моностеарат или глицерил дистеарат в отдельности или с воском. Пероральные фармацевтические дозированные формы для приема внутрь (перорально) могут быть также представлены в виде твердых желатиновых капсул, где активный ингредиент смешан с инертным разбавителем, например предварительно желатинизированным крахмалом, фосфатом кальция или калия или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или маслом, таким как арахисовое масло, медицинское парафиновое масло или оливковое масло. Водные суспензии, представленные в данном изобретении, содержат активные вещества в примеси с инертными наполнителями, пригодными для производства водных суспензий. Такие инертные наполнители содержат суспендирующий агент типа карбоксиметилцеллюлозы натрия, метилцеллюлозы, оксипропилметилцеллюлозы, альгината натрия, поливиниллпирролидона, смолы астрагала и аравийской камеди, диспергирующие и смачивающие вещества, такие как фосфатид естественного происхождения(например, лецитин), продукт конденсации эпоксида и жирной кислоты (например, полиоксиэтилен стеарат), продукт конденсации окисиэтилена и длинноцепочечного алифатического спирта (например,гептодекаэтиленоксицетанол), продукт конденсации окисиэтилена и неполного эфира жирной кислоты и ангидрида гекситола (например, полиоксиэтилен сорбитан моноолеат). Водная суспензия может также содержать один и более консервантов, таких как этил- или н-пропил параоксибензоат, один или более красителей, одну или более вкусовых добавок и один или более подсластителей, таких как сахароза, сахарулоза или сахарин. Масляные суспензии могут быть изготовлены путем суспендирования активного ингредиента в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, например медицинском парафиновом масле. Суспензии для перорального применения могут содержать загуститель, такой как пчелиный воск, твердый парафин или цетиловый спирт. Чтобы обеспечить вкусовые качества препарата, принимаемого внутрь, в препарат можно вводить подсластители, например, приведенные выше, и вкусовые добавки. Эти составы могут быть законсервированы путем добавления антиоксиданта, такого как аскорбиновая кислота, ВНТ и т.д. Дисперсные порошки и гранулы по изобретению, пригодные для приготовления водной суспензии при добавлении воды, дают активный ингредиент с примесью диспергирующего или смачивающего агента, суспендирующего агента и одного или более консервантов. Пригодные для употребления диспергирующие или смачивающие, а также суспендирующие вещества перечислены выше. Кроме того, могут присутствовать дополнительные инертные добавки: подсластители, а также вещества, придающие вкус и цвет. Фармацевтические дозированные формы или композиции по изобретению могут быть также в форме липосом или водно-масляных эмульсий. Жирная фаза может быть растительным маслом, таким как оливковое масло или арахисовое масло, или минеральным маслом, таким как медицинское парафиновое масло, или их смесью. Подходящие эмульгаторы включают смолы естественного происхождения (акации и астрагала), фосфатиды естественного происхождения (например, лецитин сои), сложные эфиры или неполные эфиры многоатомного спирта, производные жирных кислот и ангидридов гекситола (например, сорбитан моноолеат) и продукты конденсации этих неполных эфиров многоатомного спирта с окисью этилена (например, полиоксиэтилен сорбитан моноолеат). Эмульсия может также содержать подсластители или вкусовые добавки. Сиропы и эликсиры могут быть составлены с использованием подсластителей, таких как глицерин, сорбит или сахароза. Такие составы могут также содержать мягчитель, консервант, вкусовую или красящую добавку. Фармацевтические композиции по настоящему изобретению могут быть представлены в форме стерильного препарата для инъекций (например, стерильная водная или масляная суспензия для инъекций). Эта суспензия может быть составлена в соответствии с известной методикой с использованием тех диспергирующих или смачивающих веществ, а также суспендирующих веществ, которые были перечислены выше. Стерильный препарат для инъекций должен быть раствором или суспензией, приготовленными в нетоксичном для парентерального введения разбавителе или растворителе, таком как 1,3-бутандиол, или должен быть приготовлен в виде лиофилизированного порошка. Среди подходящих растворителей, которые можно использовать, - вода, раствор Рингера и изотонический раствор хлористого натрия. Кроме того, стерильные нелетучие масла могут, как принято, применяться в качестве растворителя или суспендирующей среды. Для этой цели можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, в подготовке инъекций аналогично могут использоваться жирные кислоты, такие как олеиновая кислота. Фармацевтические композиции по настоящему изобретению можно вводить парентерально, например внутривенно, внутрибрюшинно, интратекально, интравентрикулярно, интрастемально, интракраниально, внутримышечно или подкожно, или они могут быть введены путем инфузии. Лучше всего использовать их в форме стерильного водного раствора, который может содержать другие вещества, например-7 015145 достаточное количество солей или глюкозы, чтобы сделать раствор изотоническим с кровью. В случае необходимости, водные растворы должны быть буферными (предпочтительно с рН от 3 до 9). Приготовление композиций, пригодных для парентерального введения в стерильных условиях, легко осуществить с помощью стандартных фармацевтических методов, хорошо известных специалистам в данной области техники. Фармацевтические композиции по настоящему изобретению можно также вводить интраназально или путем ингаляций, и они легко могут быть получены в виде сухого порошка для ингаляций или в виде распыляемого раствора аэрозоля, поступающего из герметичного баллончика или распылителя с использованием подходящей сжатой жидкости, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFC 134 а), двуокиси углерода или другого подходящего газа. В случае находящегося под давлением аэрозоля единица дозы может быть определена с помощью клапана, обеспечивающего подачу отмеренного количества. Аэрозольный баллончик или распылитель могут содержать раствор или суспензию смеси, например, используя смесь этанола и сжатой жидкости в качестве растворителя, которая может содержать дополнительно смазывающее вещество, например сорбитан триолеат. Капсулы и гильзы (сделанные, например, из желатина) для использования в ингаляторе или порошковдувателе могут в своем составе иметь в виде порошка смесь компонента формулы (1) и подходящего порошка-основы, как, например, лактозы или крахмала. Желательно, чтобы аэрозоли или сухие порошковые составы были составлены так, чтобы каждая отмеренная доза или вдувание содержало от 20 мкг до 20 мг состава для введения пациенту. Предельная дневная доза, вносимая с аэрозолем, будет в пределах 20 мкг-20 мг, она может быть введена в одной дозе или, что более принято, поделена на дозы, которые будут вводиться в течение дня. Количество активного ингредиента, который может быть смешан с переносчиком, чтобы образовать одноразовую форму, будет изменяться в зависимости от реципиента, подвергающегося лечению,способа введения. Например, предназначенный для перорального введения людям высвобождаемый в течение времени препарат может содержать примерно 1-1000 мг активного вещества, соединенного с соответствующим и подходящим количеством вещества носителя, которое может варьировать примерно от 5 до 95 мас.% от общего содержания веществ. Фармацевтические смеси должны быть приготовлены так, чтобы обеспечить для введения легко измеряемые количества. Например, водный раствор, предназначенный для внутривенной инфузии, может содержать примерно от 3 до 500 мкг активного ингредиента на миллилитр раствора для того, чтобы инфузия соответствующего объема могла производиться со скоростью 30 мл/ч. Как отмечалось выше, лекарственные препараты предлагаемого изобретения, пригодные для перорального применения, могут быть представлены как отдельные единицы в виде капсул,облаток или таблеток, причем каждая содержит заранее определенное количество активного ингредиента; как порошок или гранулы; как раствор или суспензия в водной или неводной среде или как масляноводная эмульсия или водно-масляная эмульсия. Активный ингредиент можно также вводить в виде болюса, лекарственной кашки или пасты. Комбинированные препараты данного изобретения могут быть удобно представлены как фармацевтическая композиция в единичной дозированной форме. Удобная единичная дозированная форма содержит активные ингредиенты в любом количестве от 1 мг до 1 г каждая, например, но без ограничения,от 10 до 300 мг. Синергетические эффекты тенофовира DF в комбинации с эмтрицитабином могут быть достигнуты в широком диапазоне соотношений, например, от 1:50 до 50:1 (тенофовир DF:эмтрицитабин). В одном варианте осуществления соотношение может колебаться примерно от 1:10 до 10:1. В другом варианте сочетания весовое соотношение тенофовира и эмтрицитабина в такой форме единичной дозы совмещенного комбинированного препарата, как пилюля, таблетка, таблетка в виде капсулы или капсула, составит примерно 1, т.е. примерно равное количество тенофовира DF и эмтрицитабина. В других приводимых комбинированных составах может быть больше или меньше тенофовира, чем FTC. Например, 300 мг тенофовира DF и 200 мг эмтрицитабина могут быть совмещены в одном препарате в соотношении 1,5:1 (тенофовир DF:эмтрицитабин). В одном варианте смешивания каждый компонент будет представлен в комбинированном препарате в том количестве, в котором он демонстрирует противовирусную активность, в том случае, когда он применяется в отдельности. Приводимые составы А, В, С, D,Е и F (примеры) имеют соотношения от 12:1 до 1:1 (тенофовир DF:эмтрицитабин). Приводимые составы А, В, С, D, Е и F используют количества тенофовира и эмтрицитабина в пределах от 25 до 300 мг. Другие соотношения и количества компонентов упомянутых ранее комбинированных препаратов также находятся в пределах рассмотрения данного изобретения. Разовая доза лекарственной формы может содержать тенофовир и эмтрицитабин или их физиологически функциональные производные и фармацевтически приемлемый носитель. Для специалиста в данной области техники очевидно, что количество активных ингредиентов в комбинированных препаратах по настоящему изобретению, которое требуется применять для лечения,будет варьировать в соответствии с целым рядом факторов, включая природу заболевания, на которое направлено лечение, и возраст и состояние больного, и, в конечном счете, будет находиться на усмотрении больничного врача или практикующего врача медико-санитарной помощи. Факторы, которые надо рассмотреть, включают способ применения лекарственного средства и его природу, вес тела животного,-8 015145 возраст и общее состояние и природу, и тяжесть заболевания, которое подвергается лечению. Например,при исследовании применения эмтрицитабина в фазе I/II монотерапии пациенты получали дозы в пределах от 25 до 200 мг два раза в день в течение двух недель. При каждой схеме дозирования при применении больших и равных 200 мг доз наблюдалось 98-процентная (1,75 log10) и выше вирусная супрессия. Ежедневная доза эмтрицитабина 200 мг подавляла вирусную нагрузку в среднем на 99% (1,92 log10).Viread (тенофовир DF) был одобрен FDA для лечения и профилактики ВИЧ-инфекции в форме 300-мг таблеток для перорального применения. Emtriva (эмтрицитабин) был одобрен FDA для лечения ВИЧ в форме 200-мг таблеток для приема перорально. Возможно также объединять любые два активных ингредиента в единой лекарственной форме для одновременного или последовательного применения с третьим активным ингредиентом. Трехкомпонентную смесь можно вводить одновременно или последовательно. При последовательном введении комбинированный препарат можно вводить за два или три приема. Третий активный ингредиент обладает противовирусной активностью и содержит ингибиторы протеазы (PI), нуклеозидные ингибиторы обратной транскриптазы (NRTI), ненуклеозидные ингибиторы обратной транскриптазы (NNRTI) и ингибиторы интегразы. Примеры третьего компонента, который может быть введен в сочетании с тенофовиромDF, эмтрицитабином, приведены ниже. Перечень возможных веществ для дополнительного компонента 5,6-Дигидроазацитидин,5-аза-2'-дезоксицитидин,5-азацитидин,5-илкарбоциклический 2'-дезоксигуанозин (BMS200,475),9-(арабинофуранозил)гуанин,9-(2'-дезоксирибофуранозил)гуанин,9-(2'-дезокси-2'-фторрибофуранозил)-2,6-диаминопурин,9-(2'-дезокси-2'-фторрибофуранозил)гуанин,9-(2'-дезоксирибофуранозил)-2,6-диаминопурин,9-(арабинофуранозил)-2,6-диаминопурин,абакавир, Ziagen,ацикловир, ACV; 9-(2-гидроксиэтоксиметил)гуанин,адефовир дипроксил, Hepsera,амдоксивир, DAPD,ампренавир, Agenerase,араА; 9D-арабинофуранозиладенин (видарабин),атазанивир сульфат (Reyataz),AZT; 3'-азидо-2',3'-дидезокситимидин, зидовудин (Retrovir),BHCG; (+)-(1 а,2b,3 а)-9-[2,3-бис(гидроксиметил)циклобутил]гуанин,BMS200,475; 5-илкарбоксициклический 2'-дезоксигуанозин,буцикловир; (R)-9-(3,4-диоксибутил)гуанин,BvaraU; 1D-арабинофуранозил-Е-5-(2-бромвинил)урацил (соривудин),каланолид А,каправирин,CDG; карбоциклический 2'-дезоксигуанозин,цидофовир; НРМРС; (S)-9-(3-гидрокси-2-фосфонилметоксипропил)цитозин,клевудин, L-FMAU;2'-фтор-5-метилL-арабинофуранозилурацил,Combivir (ламивудин/зидовудин),циталлен; [1-(4'-гидрокси-1',2'-бутадиенил)цитозин],d4C; 3'-дезокси-2',3'-дидегидроцитидин,DAPD; (-)D-2,6-диаминопурин диоксолан,ddA; 2',3'-дидезоксиаденозин,ddAPR; 2,6-диаминопурин-2',3'-дидезоксирибозид,ddC; 2',3'-дидезоксицитидин (залцитабин),ddl; 2',3'-дидезоксиинозин, диданозин, (Videx, Videx EC),делавирдин, Rescriptor,диданозин, ddl, Videx; 2',3'-дидезоксиинозин,DXG; диоксолан гуанозин,Е-5-(2-бромвинил)-2'-дезоксиуридин,эфавиренз, Sustiva,энфувиртид, Fuzeon,F-apa-A; фторарабинозиладенозин (флударабин),FDOC; (-)D-5-фтор-1-[2-(гидроксиметил)-1,3-диоксолан]цитозин,-9 015145(S)-9-(3-гидрокси-2-фосфанилметоксипропил)цитозин (цидофовир),оксимочевина, Droxia,индинавир, Crixivan,Kaletra (лопинавир/ретиновир),ламивудин, 3 ТС, Epivir,(2R,5S,цис)-4-амино-1-(2-гидроксиметил-1,3-оксатеолан-5-ил)-(1H)-пиримидин-2-он,L-d4C; L-3'-дезокси-2',3'-дидегидроцитидин,L-ddC; L-2',3'-дидезоксицитидин,L-Fd4C; L-3'-дезокси-2',3'-дидегидро-5-фторцитидин,L-FddC; L-2',3'-дидезокси-5-фторцитидин,лопинавир,нельфинавир, Viracept,невирапин, Viramune,оксетаноцин А; 9-(2-дезокси-2-гидроксиметилD-эритрооксетанозил)аденин,оксетаноцин G; 9-(2-дезокси-2-гидроксиметилD-эритрооксетанозил)гуанин,пенцикловир,PMEDAP; 9-(2-фосфонилметоксиметил)-2,6-диаминопурин,РМРА, тенофовир, (R)-9-(2-фосфонилметоксипропил)аденин,РРА; фосфоноуксусная кислота рибавирин; 1D-рибофуранозил-1,2,4-триазол-3-карбоксамид,ритонавир, Norvir,сахинавир, Invirase, Fortovase,соривудин, BvaraU; 1D-арабинофуранозил-Е-5-(2-бромвенил)урацил,ставудин, d4T, Zerit; 2',3'-дидегидро-3'-дезокситимидин,тифтортимидин, TFT; трифтортимидин,Trizivir (абакавир сульфат/ламивудин/зидовудин),видарабин, араА; 9D-арабинофуранозиладенин,залцитабин, Hivid, ddC; 2',3'-дидезоксицитидин,зидовудин, AZT, Retrovir; 3'-азидо-2',3'-дидезокситимидин,зонавир; 5-пропинил-1-арабинозилурацил. Еще одним аспектом данного изобретения является трехкомпонентный комбинированный препарат, содержащий тенофовир DF, FTC и 9-[R-2-(S)-(S)-1-(изопропоксикарбонил)этил]амино]феноксифосфинил]метокси]пропил]аденин, также обозначенный здесь как GS-7340, который имеет следующую структуру:GS-7340 является пролекарством тенофовира и предметом находящейся на рассмотрении заявки совместного владения США 09/909560, зарегистрированной 20 июля 2001 года, Becker et al. WO 02/08241. Например, триединая доза может содержать от 1 до 1000 мг тенофовир дизопроксил фумарата, от 1 до 1000 мг эмтрицитабина и от 1 до 1000 мг третьего активного ингредиента. Еще одной особенностью настоящего изобретения является то, что единая лекарственная форма может содержать в дальнейшем тенофовир DF, эмтрицитабин, третий активный ингредиент и фармацевтически приемлемый носитель. Комбинированные препараты данного изобретения предоставляют пациентам большую свободу от многократных приемов лекарства и облегчают запоминание и процедуру выполнения схемы приема лекарственного препарата. При объединении тенофовир дизопроксил фумарата и эмтрицитабина в единой лекарственной форме задавались целью, чтобы ежедневная схема приема лекарства сводилась к одной дозе или двум и более поддозам в сутки. Комбинированный препарат, объединяющий тенофовир и эмтрицитабин, можно вводить в виде одной пилюли раз в день. Дальнейший объект изобретения - лечебный набор для больного, включающий тенофовир дизопроксил фумарат, эмтрицитабин и пакет с инструкциями или листовку-вкладыш изделия, содержащие указания по использованию комбинированного препарата по настоящему изобретению. Разделение активных ингредиентов в фармацевтических порошках и гранулах - широко признанная проблема, оно приводит к образованию несмешивающихся дисперсий активных ингредиентов в конечных лекарственных формах. Некоторыми из основных факторов, способствующих разделению, являются размер, форма и плотность частиц. Разделение причиняет особые трудности при попытках создать единую однородную таблетку, содержащую несколько активных ингредиентов, имеющих разную плотность и разные размеры частиц. Глиданты - это вещества, которые традиционно использовались, чтобы улучшить реологические свойства гранул и порошков, уменьшая трение между частицами. См. работу Lieberman,LachmanSchwartz, Pharmaceutical Dosage Forms, Tablets., vol. 1, p. 177-178 (1989), включенную в настоящее описание посредством ссылки. Глиданты обычно добавляют к фармацевтическим композициям непосредственно перед прессованием таблеток, чтобы облегчить поступление гранулированного материала в полости матриц таблеточных прессов. Глиданты включают коллоидный диоксид кремния, свободный от асбеста тальк, алюмосиликат натрия, силикат кальция, измельченную целлюлозу, микрокристаллическую целлюлозу, кукурузный крахмал, бензоат натрия, карбонат кальция, карбонат магния,стеараты металла, стеарат кальция, стеарат магния, стеарат цинка, стеаровет С, крахмал, крахмал 1500,лаурилсульфат магния (сульфоцеллюлоза) и окись магния. Приводимый состав А в виде таблетки содержит коллоидный диоксид кремния (см. примеры). Глиданты могут быть использованы для того, чтобы повысить и поддерживать гомогенность смеси составных частей в формулах противо-ВИЧ лекарств (патент США 6113920). Новые композиции настоящего изобретения могут содержать глиданты, чтобы влиять и поддерживать гомогенность активных ингредиентов в процессе формования таблеток. Настоящее изобретение предоставляет фармацевтические композиции, объединяющие активные ингредиенты тенофовир и эмтрицитабин в достаточно гомогенизированной форме, и способ применения этой фармацевтической композиции. Предмет данного изобретения - использовать глиданты, чтобы снизить разделение активных ингредиентов в фармацевтических композициях в процессе предкомпрессионного формования материала. Другой предмет настоящего изобретения - обеспечить фармацевтическую композицию объединенных активных ингредиентов тенофовира и эмтрицитабина с фармацевтически приемлемым глидантом, в результате чего получается смесь, характеризующаяся фармацевтически приемлемой мерой гомогенности. Фармацевтические композиции подходят для перорального, ректального, местного (включая трансдермальное, защечное и подъязычное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и внутридермальное) введения. Фармацевтические композиции могут быть также удобно представлены в форме одноразовой дозы и могут быть легко приготовлены по любому методу, хорошо известному в фармации. Такие методы - это еще одна особенность данного изобретения,они включают стадию, на которой обеспечивается соединение активных ингредиентов с носителем,представляющим собой один или более вспомогательных ингредиентов, и поддержание химической стабильности. В общем, композиции готовят, достигая прочного и гомогенного соединения активных ингредиентов с жидкими носителями, или тонко измельченными твердыми носителями, или теми и другими вместе, а потом, если необходимо, формуя продукт. Фармацевтические композиции по настоящему изобретению, предназначенные для перорального применения, могут быть представлены в форме капсул, таблеток в виде капсул, крахмальных облаток или таблеток, причем каждая содержит заранее определенное количество активных ингредиентов; в форме порошков или гранул; в виде раствора или суспензии в водной или неводной среде или в виде масляно-водной жидкой эмульсии или водно-масляной жидкой эмульсии. Активный ингредиент может также быть представлен в форме болюса, лекарственной кашки или пасты. Таблетка может быть изготовлена путем прессования или формования, произвольно с одним или более вспомогательных ингредиентов. Прессованные таблетки можно изготавливать путем прессования в специальном аппарате активных ингредиентов в сыпучей форме, как порошок или гранулы, произволь- 11015145 но смешанные со связующим компонентом (например, повидоном, желатином, оксипропил метилцеллюлозой), смазывающим веществом, инертным разбавителем, консервантом, дезинтегрантом (например,натриевой солью L-2-гидрокислот крахмала, поперечно-сшитым повидоном, поперечно-сшитой натриевой солью карбоксиметилцеллюлозы), поверхностно-активным или диспергирующим агентом. Формованные таблетки можно изготавливать путем формования смеси порошкообразного компонента, смоченного инертным жидким разбавителем, в специальном аппарате. Таблетки могут быть произвольно покрыты или помечены и могут быть составлены таким образом, чтобы обеспечить медленное и контролируемое высвобождение их активных ингредиентов, используя, например, производные простого эфира целлюлозы (например, оксипропил метилцеллюлозы) или производные метакрилата в варьируемых соотношениях, чтобы обеспечить желаемый профиль высвобождения активного компонента. Таблетки могут быть произвольно покрыты энтеросолюбильной оболочкой, чтобы обеспечить высвобождение активного ингредиента в определенных отделах кишечника, но не в желудке. Препараты, предназначенные для местного применения в ротовой полости, включают лепешки, содержащие активные ингредиенты в основе, содержащей вкусовую добавку, обычно сахарозу, акацию или астрагал; пастилки, содержащие активный ингредиент в инертной основе типа желатина и глицерина или сахарозы и акации; жидкости для полоскания рта, содержащие активный ингредиент в составе с подходящим жидким носителем. Составы для ректального введения могут представлять собой свечи, содержащие подходящую основу, например масло какао или салицилаты. Местное применение может также осуществляться с помощью прибора для трансдермального ионофореза. Препараты, предназначенные для вагинального применения, могут представлять собой вагинальные суппозитории, тампоны, кремы, пены или распыляемые составы, содержащие дополнительно к активному ингредиенту соответствующие носители, которые известны в технологии. Препараты, предназначенные для применения в отношении мужского полового члена, в целях профилактики или терапии могут представлять собой кондомы, кремы, гели, пасты, пены или распыляемые составы, содержащие дополнительно к активному ингредиенту соответствующие носители, известные в технологии. Фармацевтические композиции, предназначенные для ректального применения с твердым носителем, представлены наиболее предпочтительно в форме суппозиториев. Подходящие носители включают масло какао или другие материалы, обычно используемые в технологии. Суппозитории могут быть легко получены добавлением к активному составу размягченного или расплавленного носителя (носителей) с последующим охлаждением и формованием в пресс-формах. Фармацевтические композиции, предназначенные для парентерального введения, представлены водными и неводными изотоническими стерильными растворами для инъекций, которые могут содержать антиоксиданты, буферы, антимикробные добавки и растворенные вещества, которые воспроизводят состав, изотонический с кровью данного реципиента; водными и неводными стерильными суспензиями,которые могут содержать суспендирующие агенты и загустители; липосомами или другими системами микрочастиц, которые созданы с целью доставить соединение к элементам крови или к одному или более органу. Композиции могут быть представлены в герметичных контейнерах, содержащих единичную дозу или множественную дозу, например в ампулах или пробирках, и могут храниться в условиях замораживания-высушивания (лиофилизирования), при этом требуется только добавление стерильного жидкого носителя, например воды для инъекции, непосредственно перед использованием. Растворы и суспензии для незапланированных инъекций могут быть приготовлены из стерильных порошков, гранул и таблеток так, как это было описано выше. Типичная одноразовая доза лекарственного препарата - это суточная доза или суточная поддоза активных ингредиентов, как было сообщено ранее, следует понимать, что в дополнение к ингредиентам,особо упомянутым выше, лекарственные составы по настоящему изобретению могут содержать другие агенты, применяемые в технологии, имеющие отношение к типу рассматриваемого препарата, например те, которые предназначены для перорального введения, могут содержать такие дополнительные агенты,как подсластители, загустители и пищевые добавки. Компоненты лекарственного препарата по изобретению могут быть получены обычным способом,известным специалистам в данной области техники. Тенофовир дизопроксил фумарат можно изготавливать, например, как описано в патенте США 5977089. Методы изготовления FTC описаны вWO 92/14743, включенной сюда в виде ссылки. Применение композиции Композиции по настоящему изобретению вводятся человеку или другому млекопитающему в безвредном и эффективном количестве, как описано выше. Эти безвредные и эффективные количества будут варьировать в зависимости от типа и размера млекопитающего, которое подвергается лечению, и желательных результатов лечения. Любой из разнообразных методов, известных квалифицированным специалистам, занимающимся упаковкой таблеток, таблеток в виде капсул или других твердых форм лекарственных препаратов, применяемых для перорального введения, который не будет приводить к деградации компонентов данного изобретения, является приемлемым для изготовления упаковки. Лекарственные препараты могут быть упакованы в стеклянные или пластиковые бутылки. Таблетки в виде кап- 12015145 сул или другие твердые лекарственные формы, пригодные для перорального введения, могут быть упакованы и содержаться в разных упаковочных материалах, необязательно содержащих поглотитель влаги,например силикагель. Упаковка может быть в форме облатки, содержащей одноразовую дозу, например упаковка может содержать одну облатку с таблетками, пилюлями, таблетками в виде капсул или капсулами тенофовира DF и другую облатку с перечисленными твердыми формами эмтрицитабина. Пациенту следует принимать одну дозу, например пилюлю, из одной облатки и одну из другой. Альтернативно,упаковка может содержать облатку с объединенными в один лекарственный препарат тенофовиром и эмтрицитабином в одной пилюле, таблетке, таблетке в виде капсулы или капсулы. Как и в других комбинированных препаратах и их упаковках, препараты этого изобретения включают физиологические функциональные производные тенофовира DF и FTC. Упаковочный материал может также иметь маркировку и информацию, относящуюся к фармацевтической композиции, напечатанную на нем. Дополнительно изделие может содержать брошюру, сообщение, заметку, короткое описание или листовку, содержащую информацию о продукте. Эта форма фармацевтической информации называется в фармацевтической промышленности упаковочным вкладышем. Упаковочный вкладыш может быть присоединен или включен в фармацевтическое изделие. Упаковочный вкладыш и любая маркировка изделия предоставляют информацию, относящуюся к фармацевтическому препарату. Информация и маркировка предоставляют различные формы информации, используемой профессионалами медико-санитарной службы и пациентами, описывая состав, дозу и различные другие параметры, требуемые регулирующими агентствами, такими как Агентство по контролю за продуктами питания и лекарствами США. Исследования комбинированных препаратов Комбинированные препараты по настоящему изобретению могут быть протестированы на активность против ВИЧ и чувствительность in vitro и на цитотоксичность в отношении лабораторно адаптированных клеточных линий, например МТ 2, и в отношении мононуклеарных клеток периферической крови(РВМС) согласно стандартным аналитическим методам, разработанным для тестирования противо-ВИЧ соединений (см. WO 02/068058 и патент США 6475491). Анализы комбинированных препаратов можно проводить при изменяющихся концентрациях компонентов в составе препаратов, чтобы определить ЕС 50 путем серийных разведений. Примеры фармацевтических композиций Следующие примеры в дальнейшем описывают и представляют конкретные варианты осуществления в пределах рассмотрения данного изобретения. Методы и составы обычно можно найти в Remington's Pharmaceutical Sciences (Mack Publishing Co., Easton, PA). Примеры даны исключительно для иллюстрации и не должны рассматриваться как ограничения, так как возможно множество вариаций без отступления от сути и сферы рассмотрения настоящего изобретения. Следующие примеры предназначены только для иллюстрации и не предназначены для того, чтобы ограничить область изобретения в любом случае. "Активный ингредиент" означает тенофовир дизопроксил фумарат или эмтрицитабин. Фармацевтические композиции таблеток Следующие примеры композиций А, В, С, D, Е и F готовят путем влажной грануляции ингредиентов с водным раствором добавлением экстрагранулярных компонентов с последующим добавлением стеарата магния и прессованием. Композиция G (контролируемое высвобождение композиции). Эта композиция готовится путем влажного гранулирования ингредиентов водным раствором с по- 15015145 следующим добавлением стеарата магния и прессованием. Высвобождение лекарства происходит в течение периода времени примерно 6-8 ч и завершается через 12 ч. Композиции капсул. Композиция Н. Композицию для капсулы готовят, перемешивая ингредиенты и наполняя состоящие из двух частей капсулы из твердого желатина или оксипропилметилцеллюлозы. Композиция I (капсула с контролируемым высвобождением). Следующая форма в виде капсулы с контролируемым высвобождением готовится способом экструдирования ингредиентов а, б и в с использованием экструдера с последующей сферонизацией экструдата и высушиванием. Высушенные шарики в дальнейшем покрывают контролирующей высвобождение мембраной (г) и закладывают в состоящие из двух частей капсулы из твердого желатина или оксипропилметилцеллюлозы. Композиция J (суспензия для перорального приема). Активные ингредиенты перемешивают с наполнителями и закладывают в виде сухого порошка. Добавляют очищенную воду и хорошо перемешивают перед применением. Композиция K (суппозиторий). Одну пятую часть витепсола Н 15 растворяют на паровой бане максимум при 45 С. Активные ингредиенты просеивают сквозь сито с размером пор 200 мкм и добавляют к расплавленной основе при перемешивании, используя гомогенизатор Silverson, снабженный режущей головкой, пока не образуется однородная дисперсия. Поддерживая температуру смеси 45 С, оставшийся витепсол добавляют к суспензии и перемешивают, чтобы гарантировать гомогенную смесь. Всю суспензию пропускают через экран из нержавеющей стали с отверстиями диаметром 250 мкм с последующим перемешиванием и позволяют ей охладиться до 40 С. При температуре от 38 до 40 С 2,02 г смеси закладывают в подходящие пластмассовые формы на 2 мл. Суппозиториям дают остыть до комнатной температуры. Таблетка с фиксированной дозой комбинированного препарата. Таблетку, содержащую фиксированную дозу комбинированного препарата, 300 мг тенофовир дизопроксил фумарата на 200 мг эмтрицитабина, изготовили путем влажного гранулирования с последующей процедурой высушивания на подвижной ленте, используя обычные методы. См. патент США 5935946; L.Pharmacopea 24-National Formulary 19, "Tablet Friability", Chapter 1216, page 2148 (2000). Было изучено влияние содержания грануляционной воды (изменяющегося от 40 до 50 мас.%) и времени пребывания в виде влажной массы на физиологические свойства конечной порошкообразной смеси и его действие в зависимости от того, сформована или спрессована смесь (компактность таблетки). Кроме того, для таблеток, содержащих фиксированную дозу комбинированного препаратаTDF/эмтрицитобина, оценивали степень однородности, количественный состав, стабильность и растворимость. Оборудование для изготовления лекарственных форм. Оборудование включает миксер с высокой размельчающей способностью, оборудованный автоклавом и форсункой с распылителем, чтобы добавлять грануляционную воду, сушилку в подвижном слое,дробилку, вращающуюся мешалку, вращающийся пресс для таблеток и пылеуловитель. Процесс изготовления. Высушенный и измельченный порошок смешивали с гранулированной микрокристалической целлюлозой и натрийкроскамеллозой, а потом смешивали со стеаратом магния. Образцы порошка отбирали после смешивания со стеаратом магния. В образцах смеси определяли объемную плотность, ситовый анализ и сжимаемость. Измельченный порошок, смешанный со стеаратом магния, прессовали в таблетки на прессе. Материалы. В следующей таблице перечислены количественные составы комбинированного препарата а Фактический вес регулируется на основе фактора содержания препарата (DCF) тенофовир дизопроксил фумарата и эмтрицитабина.b Вода, удаленная во время сушки. Аналитическое оборудование. Влажность измеряли по потере веса при высыхании, используя систему лампа нагревания/весы. Порошкообразную смесь отбирали с помощью сэмплера, чтобы определить однородность смеси. Отбирали двойные образцы из каждого из нескольких мест в блендере. Анализ однородности смеси проводили в одном образце из каждого места забора. Анализ размера частиц конечной порошкообразной смеси проводили, просеивая несколько грамм образца сквозь сито, используя акустическое сито. Количество конечной порошкообразной смеси, оставшейся на каждом микрофильтре и коллекторе для сбора очень мелких частиц, определяли, рассчитывая разницу в весе между микрофильтрами и коллектором до и после определения. Среднегеометрическое значение диаметра частиц рассчитывали по логарифмическому утяжелению. Объемную плотность определяли, наполняя градуированный цилиндр конечной порошкообразной смесью и определяя разность веса между пустым и заполненным цилиндром на единицу объема. Хрупкость таблеток определяли, используя фриабилятор, прибор для определения твердости, микроизмеритель плотности, снабженный принтером и весами. Параметры сжатия определяли, используя вращательный пресс, оборудованный плоским со скошенными краями пробойником с силой удара в 400 мг. Порошкообразные смеси подвергали сжатию, используя давление верхнего пробойника в пределах от приблизительно 100 до 250 МПа. Силу стандартной эжекции определяли и стандартизировали для плотности таблетки и ее диаметра. Твердость таблетки определяли, используя прибор для определения твердости. Толщину таблетки определяли, используя микрометр, значения веса таблеток определяли, используя весы. Влажная грануляция. Порошки перемешивали в грануляторе, а затем гранулировали с использованием воды. Скорости вращения мешалки и измельчителя поддерживали постоянными в блендере и на низком уровне в течение процедуры грануляции и влажного конгломерирования. После добавления воды мешалку и измельчитель останавливали и емкость гранулятора открывали, чтобы наблюдать за консистенцией и структурой гранул. Крышку закрывали и проводили стадию влажного конгломерирования. Пригодные гранулы содержали 40% воды и 60% воды соответственно. Влажное измельчение.- 18015145 Чтобы облегчить процесс высыхания массы, каждая влажная гранула была подвергнута обработке,предотвращающей агломерацию, при помощи мельницы, снабженной ситом и мешалкой. Измельченные влажные гранулы были помещены в сушилку с подвижным слоем сразу после влажного измельчения. Высушивание в подвижном слое. Измельченные влажные гранулы высушивали, используя температуру поступающего внутрь воздуха примерно 70 С и скорость потока воздуха примерно 100 cfm (кубических футов в минуту, примерно 28,3 л в минуту). Запланированный LOD (содержание жидкости) составлял примерно 1,0% с допустимым превышением не более чем (NMT) 1,5%. Полное время сушки в подвижном слое колебалось от 53 до 75 мин. Конечный LOD находился в пределах от 0,4 до 0,7% для всех высушенных партий. Для всех партий температуры в конце процесса были в пределах от 47 до 50 С. Сухое измельчение. Все высушенные гранулы измельчали, пропуская через перфорированный экран. Измельчитель был снабжен квадратной мешалкой и был управляемым. Партии измельчали вручную и транспортировали кV-мешалке. Смешивание. Каждая партия была перемешена с ипользованием V-мешалки. В одном наборе трех составов, начиная с 12 кг веществ, получали от 10,5 кг (87,5%) до 11,1 кг (92,5%) конечной порошкообразной смеси,пригодной для прессования после перемешивания. Объемная плотность конечной порошкообразной смеси колебалась от 0,48 до 0,58 г/см 3 и среднегеометрический размер диаметра частиц колебался от 112 до 221 мкм. Процентное содержание воды и время пребывания вещества в виде влажной массы влияли на размер частиц и плотность конечной порошкообразной смеси. Порошкообразная смесь как для тенофовира DF, так и для эмтрицитабина дала среднее (n=10) значение прочности для тенофовира DF в пределах от 100,6 до 102,8% запланированной прочности для этих партий и относительное стандартное отклонение (RSD) составлял от 0,5 до 1,7%. Среднее (n=10) значение прочности для эмтрицитабина колебалось от 101,3 до 104,1% от запланированной прочности для этих партий с относительным стандартным отклонением (RSD) в пределах от 0,6 до 1,7%. Содержание влаги в конечной порошкообразной смеси колебалось от 0,8 до 1,1% LOD. Прессование таблеток. Конечные смеси прессовали, используя вращающийся пресс для таблеток, и таблетки покрывали пленкой. Три 300-граммовых композиции (табл. 2) гранулировали в грануляторе, оборудованном литровой емкостью. Количество компонентов, входящих в состав гранул, было рассчитано на общий размер загрузки в 300 г. Композиции лекарственных препаратов в партиях 1 и 2 различались количеством микрокристаллической целлюлозы 30 мас.% против 20 мас.% соответственно. Партии 2 и 3 были идентичны, за исключением типа связующего компонента. Партия 2 содержала 5 мас.% преджелатинизированного крахмала, а партия 3 содержала 5 мас.% повидона в качестве связующего компонента. Таблица 2 Вода, удаленная во время сушки.- 19015145 После добавления воды мешалку и измельчитель останавливали и емкость гранулятора открывали,чтобы исследовать консистенцию и состав гранул. Чтобы достичь одинаковой консистенции гранул, партии 1, 2, и 3 гранулировали с содержанием воды 45, 40 и 30 мас.% соответственно. Крышку закрывали и проводили стадию влажного конгломерирования. Все партии подвергались 30-секундному влажному конгломерированию, в результате чего образовывались гранулы приемлемого качества. Влажные гранулы из всех закладок были вручную пропущены через микрофильтр, чтобы предотвратить агломерацию. Полученные в результате гранулы были высушены слоями в конвекционной сушильной камере с поддержанием температуры 60 С в течение примерно 20 ч до уровня LOD 1,0%. Высушенные гранулы из всех закладок были вручную просеяны через микрофильтр. Для того чтобы приспособить процесс грануляции к V-мешалке малой емкости (300 мл), объем закладки конечной смеси подгоняли к порции 100 г. Порция 81 г полученной смеси из партии 1 была смешана с 15 г микрокристаллической целлюлозы, 3 г натрийкроскармеллозы и 1 г стеарата магния. Порции по 86 г полученного гранулированного препарата из партии 2 и партии 3 были, каждая, смешаны с 10 г микрокристаллической целлюлозы, 3 г натрийкроскармеллозы и 1 г стеарата магния. Порции по 81 г полученной гранулированной смеси из партии 2 и партии 3 были смешаны с 10 г микрокристаллической целлюлозы, 3 г натрийкроскармеллозы и 1 г стеарата магния. Анализ чистоты проводили с помощью ВРЖХ-хроматографии на обращенной фазе (высокоразрешающая жидкостная хроматография). Примеси к тенофовир дизопроксил фумарату и эмтрицитабину охарактеризовали и количественно определили в полученных таблетках общий АФИ (активный фармацевтический ингредиент) до и после приготовления композиций в трех партиях табл. 2. Примеси включали побочные продукты гидролиза экзоциклических аминогрупп тенофовир дизопроксил фумарата и эмтрицитабина и гидролиза дизопроксиловых (РОС) эфиров тенофовир дизопроксил фумарата. После изготовления композиций и таблеток в каждой партии суммарное количество примесей, связанных с тенофовир дизопроксил фумаратом и эмтрицитабином было менее 1%. Физико-химические свойства таблеток тенофовир дизопроксил фумарата и эмтрицитабина оценивали по внешнему виду, содержанию воды, величине прочности, содержанию примесей и продуктов деградации и растворимости таблеток. Анализ стабильности осуществляли на лекарственных изделиях,упакованных в герметично закрытых системах, которые идентичны с той системой герметичной упаковки, которая предназначена для клинического и коммерческого использования. В процессе анализа стабильности не наблюдалось признаков обесцвечивания или растрескивания таблеток. Покрытые пленкой таблетки тенофовир дизопроксил фумарата и эмтрицитабина продемонстрировали удовлетворительную стабильность при 40 С/75% RH (относительная влажность) в течение шести месяцев, будучи упакованными и при хранении с силикагелем в качестве поглотителя влаги. Не наблюдалось заметного снижения(определяли как 5% деградации) значения прочности тенофовира DF или эмтрицитабина после шести месяцев при 40 С/75% RH, после упаковывания и хранения с поглотителем влаги. Повышение содержания продуктов деградации составляло 1,5% для тенофовира DF и 0,6-0,7% для эмтрицитабина после шести месяцев при 40 С/75% RH, после упаковывания и хранения с 3 г поглотителя влаги. Все публикации и патентные заявки, которые цитируются в настоящем контексте, включены в настоящее описание посредством ссылки, все равно как если бы каждая отдельная публикация или патентная заявка была специально и отдельно указана для того, чтобы быть включенной в виде ссылки. Хотя некоторые варианты воплощения описаны подробно выше, специалисту в данной области техники очевидно, что в означенных требованиях возможны модификации без изменения их сущности. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, проявляющая активность в отношении ВИЧ-инфекций, содержащая фумарат диизопропоксикарбонилоксиметилового эфира[2-(6-аминопурин-9-ил)-1 метилэтоксиметил]фосфоновой кислоты (тенофовир дизопроксил фумарат) и (2R,5S,цис)-4-амино-5 фтор-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1 Н)-пиримидин-2-он (эмтрицитабин). 2. Композиция по п.1, дополнительно содержащая один или несколько фармацевтически подходящих носителей или наполнителей. 3. Композиция по п.2, в которой фармацевтически подходящие носители или наполнители выбраны из предварительно желатинизированного крахмала, натрийкроскармеллозы, повидона, моногидрата лактозы, микрокристаллической целлюлозы или стеарата магния, а также их комбинаций. 4. Композиция по любому из пп.1-3, выполненная в форме, пригодной для перорального применения. 5. Композиция по п.4, в которой общее количество тенофовир дизопроксил фумарата и эмтрицитабина составляет 1-1000 мг, а носитель составляет примерно 5-95 мас.% от общего веса композиции. 6. Композиция по п.4, выполненная в форме, пригодной для введения инфицированному человеку один раз в сутки. 7. Композиция по любому из пп.4-6, выполненная в форме таблетки. 8. Композиция по любому из пп.4-6, выполненная в форме капсулы.- 20015145 9. Композиция по любому из пп.1-8, в которой тенофовир дизопроксил фумарат и эмтрицитабин присутствуют в соотношении 1,5:1. 10. Композиция по п.9, содержащая примерно 300 мг тенофовир дизопроксил фумарата и примерно 200 мг эмтрицитабина. 11. Композиция по п.7, содержащая 30 мас.% тенофовир дизопроксил фумарата, 20 мас.% эмтрицитабина, 5 мас.% предварительно желатинизированного крахмала, 6 мас.% натрийкроскармеллозы, 8 мас.% моногидрат лактозы, 30 мас.% микрокристаллической целлюлозы, 1 мас.% стеарата магния. 12. Композиция по любому из пп.1-11, выполненная в форме единичной дозы. 13. Композиция по любому из пп.1-12, которая дополнительно содержит третий антивирусный агент. 14. Композиция по п.13, в которой третий антивирусный агент выбран из ингибитора протеазы ВИЧ(PI), нуклеозидного ингибитора обратной транскриптазы ВИЧ (NRTI), ненуклеозидного ингибитора обратной транскриптазы ВИЧ (NNRTI) и ингибитора интегразы ВИЧ. 15. Композиция по п.14, в которой третьим антивирусным агентом является PI. 16. Композиция по п.14, в которой третьим антивирусным агентом является NNRTI. 17. Композиция по п.14, в которой третьим антивирусным агентом является агент, выбранный из агентов против ВИЧ, представляющих собой атазанивир сульфат, лопинавир/ретиновир или эфавиренз. 18. Композиция по любому из пп.1-17, дополнительно содержащая фармацевтически подходящий глидант. 19. Композиция по п.18, в которой глидант выбран из группы веществ, включающей двуокись кремния, порошкообразную целлюлозу, микрокристаллическую целлюлозу, стеараты металлов, алюмосиликат натрия, бензоат натрия, карбонат кальция, силикат кальция, маисовый крахмал, карбонат магния, тальк, не содержащий асбест, крахмал, крахмал 1500, лаурилсульфат магния, окись магния и их комбинации. 20. Композиция по п.19, в которой стеараты металлов выбраны из стеарата кальция, стеарата магния, стеарата цинка и их комбинаций. 21. Пероральная фармацевтическая дозированная форма, проявляющая активность в отношении ВИЧ-инфекций, содержащая тенофовир дизопроксил фумарат, эмтрицитабин и атазанивир сульфат. 22. Пероральная фармацевтическая дозированная форма, проявляющая активность в отношении ВИЧ-инфекций, содержащая тенофовир дизопроксил фумарат, эмтрицитабин и лопинавир/ретиновир. 23. Пероральная фармацевтическая дозированная форма, проявляющая активность в отношении ВИЧ-инфекций, содержащая тенофовир дизопроксил фумарат, эмтрицитабин и эфавиренз. 24. Таблетка, содержащая 300 мг тенофовир дизопроксил фумарата, 200 мг эмтрицитабина и носители и/или наполнители, достаточные для того, чтобы кислотная деградация тенофовир дизопроксил фумарата или эмтрицитабина составляла менее 5% после шести месяцев хранения с поглотителем влаги при 40 С/75% относительной влажности. 25. Лечебный набор, включающий (а) фармацевтическую композицию, содержащую фумарат диизопропоксикарбонилоксиметилового эфира [2-(6-аминопурин-9-ил)-1-метилэтоксиметил]фосфоновой кислоты (тенофовир дизопроксил фумарат) и (2R,5S,цис)-4-амино-5-фтор-1-(2-гидроксиметил-1,3 оксатиолан-5-ил)-(1H)-пиримидин-2-она (эмтрицитабина), и (b) информационный вкладыш, содержащий указания по применению композиции тенофовир дизопроксил фумарата и эмтрицитабина для лечения пациента, нуждающегося в антивирусной терапии, представляющей собой анти-ВИЧ-терапию. 26. Лечебный набор по п.25, в котором фармацевтическая композиция представляет собой таблетку,таблетку в виде капсулы или капсулу, содержащую 300 мг тенофовир дизопроксил фумарата и 200 мг эмтрицитабина. 27. Применение фумарат диизопропоксикарбонилоксиметилового эфира [2-(6-аминопурин-9-ил)-1 метилэтоксиметил]фосфоновой кислоты (тенофовир дизопроксил фумарат) в комбинации с (2R,5S,цис)4-амино-5-фтор-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1 Н)-пиримидин-2-оном (эмтрицитабин) для производства объединенной в один препарат композиции для лечения или предотвращения симптомов или эффектов ВИЧ-инфекции. 28. Применение по п.27, при котором композиция находится в форме таблетки. 29. Применение по п.27, при котором композиция содержит 300 мг тенофовир дизопроксил фумарата и 200 мг эмтрицитабина. 30. Применение по любому из пп.27-29, при котором общее количество тенофовир дизопроксил фумарата и эмтрицитабина в композиции составляет 1-1000 мг, а носитель, дополнительно включенный в композицию, составляет примерно 5-95 мас.% от общего веса композиции. 31. Применение по п.30, при котором соотношение общего веса тенофовир дизопроксил фумарата и эмтрицитабина в композиции к весу ингредиентов, отличных от тенофовир дизопроксил фумарата и эмтрицитабина, составляет 1:1. 32. Применение по п.31, при котором композиция выполнена в форме таблетки и содержит 30 мас.% тенофовир дизопроксил фумарата, 20 мас.% эмтрицитабина, 5 мас.% предварительно желатинизированного крахмала, 6 мас.% натрийкроскармеллозы, 8 мас.% моногидрат лактозы, 30 мас.% микрокри- 21015145 сталлической целлюлозы, 1 мас.% стеарата магния. 33. Применение по любому из пп.27-32, при котором композиция дополнительно содержит третий активный ингредиент, выбранный из ингибитора протеазы ВИЧ (PI), нуклеозидного ингибитора обратной транскриптазы ВИЧ (NRTI), ненуклеозидного ингибитора обратной транскриптазы ВИЧ (NNRTI) и ингибитора интегразы ВИЧ. 34. Применение по п.33, при котором третий активный ингредиент выбран из агентов против ВИЧ,представляющих собой атазанивир сульфат, лопинавир/ретиновир или эфавиренз. 35. Применение по любому из пп.27-34, при котором композиция дополнительно содержит фармацевтически подходящий глидант. 36. Применение по п.35, при котором глидант выбран из группы, включающей двуокись кремния,порошкообразную целлюлозу, микрокристаллическую целлюлозу, стеараты металлов, алюмосиликат натрия, бензоат натрия, карбонат кальция, силикат кальция, маисовый крахмал, карбонат магния, тальк,не содержащий асбест, крахмал, крахмал 1500, лаурилсульфат магния, окись магния и их комбинации. 37. Применение по п.36, при котором стеараты металлов выбраны из стеарата кальция, стеарата магния, стеарата цинка и их комбинаций.
МПК / Метки
МПК: A61K 31/513, A61P 31/18, A61K 31/675, A61K 45/06
Метки: дозированная, форма, эффектов, вич-инфекций, таблетка, лечения, проявляющие, пероральная, способ, варианты, предотвращения, композиция, симптомов, вич-инфекции, набор, лечебный, отношении, фармацевтическая, активность
Код ссылки
<a href="https://eas.patents.su/23-15145-farmacevticheskaya-kompoziciya-i-peroralnaya-farmacevticheskaya-dozirovannaya-forma-varianty-proyavlyayushhie-aktivnost-v-otnoshenii-vich-infekcijj-lechebnyjj-nabor-i-tabletka-i-sp.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция и пероральная фармацевтическая дозированная форма (варианты), проявляющие активность в отношении вич-инфекций, лечебный набор и таблетка и способ лечения или предотвращения симптомов или эффектов вич-инфекции</a>
Предыдущий патент: Резьбовое соединение для стальных труб
Следующий патент: Композиции, содержащие антитела против рецептора igf-1, и способы получения антител
Случайный патент: Способ и устройство для получения монокристалла