Соединение пиперидинила в качестве модулятора активности хемокинового рецептора
Номер патента: 22395
Опубликовано: 30.12.2015
Авторы: Черней Роберт Дж., Дунсиа Джон В., Сантелла Джосеф Б., Ван Чжунюй, Гарднер Даниел С.
Формула / Реферат
1. Соединение формулы (I)
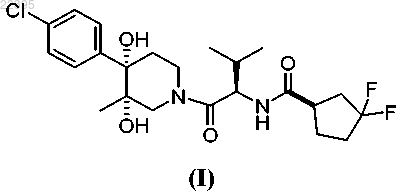
или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция для ингибирования активности хемокина или хемокинового рецептора, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по п.1.
3. Способ ингибирования активности хемокина или хемокинового рецептора, включающий введение пациенту терапевтически эффективного количества соединения по п.1.
4. Способ по п.3, отличающийся тем, что хемокин представляет собой хемокин СС-1, а хемокиновый рецептор представляет собой хемокиновый рецептор CCR-1.
5. Способ лечения воспалительного заболевания, включающий введение пациенту терапевтически эффективного количества соединения по п.1.
6. Способ лечения или предотвращения воспалительных заболеваний у пациента, где воспалительное заболевание выбрано из остеоартрита, лихорадки, болезни Крона, идиопатического легочного фиброза, воспалительных заболеваний кишечника, альвеолита, неспецифического язвенного колита, нефротоксического сывороточного нефрита, гломерулонефрита, астмы, ревматоидного артрита, рестеноза и кожного воспалительного заболевания, включающий введение указанному пациенту терапевтически эффективного количества соединения по п.1.
7. Способ ингибирования активности хемокина или хемокинового рецептора, включающий введение пациенту терапевтически эффективного количества композиции по п.2.
8. Способ ингибирования активности рецептора CCR-1, включающий введение пациенту терапевтически эффективного количества композиции по п.2.
9. Способ лечения воспалительного заболевания, включающий введение пациенту терапевтически эффективного количества композиции по п.2.
10. Способ лечения или предотвращения воспалительных заболеваний у пациента, где воспалительное заболевание выбрано из остеоартрита, лихорадки, болезни Крона, идиопатического легочного фиброза, воспалительных заболеваний кишечника, альвеолита, неспецифического язвенного колита, нефротоксического сывороточного нефрита, гломерулонефрита, астмы, ревматоидного артрита, рестеноза и кожного воспалительного заболевания, включающий введение указанному пациенту терапевтически эффективного количества композиции по п.2 для лечения.
Текст
СОЕДИНЕНИЕ ПИПЕРИДИНИЛА В КАЧЕСТВЕ МОДУЛЯТОРА АКТИВНОСТИ ХЕМОКИНОВОГО РЕЦЕПТОРА Описано соединение формулы (I) или его фармацевтически приемлемые соли. Кроме того, описаны способы лечения и предотвращения воспалительного заболевания, такого как астма и аллергическое заболевание, а также аутоиммунные патологии, такие как ревматоидный артрит и артросклероз с применением соединения согласно изобретению. По данной заявке испрашивается приоритет по предварительной заявке США, имеющей серийный номер 61/355225, поданной 16 июня 2010 г., которая включена в настоящее описание посредством ссылки в полном объеме. Область техники Настоящее изобретение относится, в общем, к соединению пиперидинила, которое представляет собой модулятор активности хемокинового рецептора, фармацевтической композиции, содержащей указанное соединение, и способам применения соединения в качестве агента для лечения и профилактики воспалительных заболеваний, аллергических и аутоиммунных заболеваний и, в частности, ревматоидного артрита и отторжения трансплантата. Уровень техники Хемокины представляют собой хемотаксические цитокины с молекулярной массой 6-15 кДа, которые высвобождаются большим разнообразием клеток, чтобы привлекать и активировать наряду с другими типами клеток, моноциты, макрофаги, Т и В лимфоциты, эозинофилы, базофилы и нейтрофилы. Существуют два основных класса хемокинов, СХС и СС, в зависимости от того, разделены первые два цистеина в аминокислотной последовательности отдельной аминокислотой (СХС) или прилегают друг к другу (СС). СХС хемокины, такие как интерлейкин-8 (IL-8), нейтрофил-активирующий белок (NAP-2) и белок-стимулятор активности роста меланомы (MGSA), являются хемотаксическими, прежде всего, по отношению к нейтрофилам и Т лимфоцитам, тогда как СС хемокины, такие как RANTES, MIP-1, MIP1, моноцитарные хемотаксические белки (МСР-1, МСР-2, МСР-3, МСР-4 и МСР-5) и эотаксины (-1 и-2), являются хемотаксическими наряду с другими типами клеток по отношению к макрофагам, Т лимфоцитам, эозинофилам, дендритным клеткам и базофилам. Хемокины связываются со специфическими клеточно-поверхностными рецепторами, принадлежащими к семейству связанных с G-белком белков с семью трансмембранными доменами, которые называются "хемокиновыми рецепторами". При связывании их родственных лигандов хемокиновые рецепторы преобразовывают внутриклеточный сигнал через ассоциированные трехмерные G белки, что приводит наряду с другими ответами к быстрому повышению внутриклеточной концентрации кальция, изменению формы клеток, повышенной экспрессии молекул клеточной адгезии, дегрануляции и стимулированию клеточной миграции. Насчитывается по меньшей мере десять человеческих хемокиновых рецепторов, которые связываются с СС хемокинами или реагируют на них, со следующими характеристическими паттернами: CCR-1 (или "CKR-1" или "CC-CKR-1") [MIP-1, МСР-3, МСР-4, RANTES] CCR-2A и[МСР-1, МСР-3]; и CCR-11 [МСР-1, МСР-2 и МСР-4]. Помимо хемокиновых рецепторов млекопитающих цитомегаловирусы млекопитающих, герпесвирусы и поксвирусы, как было показано, экспрессируют в инфицированных клетках белки со связывающими свойствами хемокиновых рецепторов. Человеческие СС хемокины, такие как RANTES и МСР-3,могут вызывать быструю мобилизацию кальция посредством этих закодированных вирусами рецепторов. Экспрессия рецепторов может быть пермиссивной для инфекции за счет нарушения нормального контроля иммунной системы и реакции на инфекцию. Кроме того, человеческие хемокиновые рецепторы, такие как CXCR4, CCR2, CCR3, CCR5 и CCR8, могут действовать как корецепторы в случае инфицирования клеток млекопитающих микробами, как, например, в случае вирусов иммунодефицита человека (ВИЧ). Хемокины и их родственные рецепторы применяли в качестве важных медиаторов воспалительных,инфекционных и иммунорегуляторных расстройств и заболеваний, включая астму и аллергические заболевания, а также аутоиммунных патологий, таких как ревматоидный артрит и артросклероз (обзор представлен в: Carter, P.H., Current Opinion in Chemical Biology 2002, 6, 510; Trivedi и др., Ann. Reports Med.Chem. 2000, 35, 191; Saunders и др., Drug Disc. Today 1999, 4, 80; Premack и др., Nature Medicine 1996, 2,1174). Например, хемокин воспалительного белка макрофагов-1 (MIP-1) и его рецептор СС хемокиновый рецептор 1 (CCR-1) играют основополагающую роль в привлечении лейкоцитов к сайтам воспаления и в последующей активации этих клеток. Когда хемокин MIP-1 связывается с CCR-1, он вызывает быстрое повышение внутриклеточной концентрации кальция, повышенную экспрессию молекул клеточной адгезии, клеточную дегрануляцию и стимулирование миграции лейкоцитов. Кроме того, проявление хемотаксических свойств MIP-1 у человека было определено экспериментально. Пациенты, при введении внутрикожно MIP-1, испытывали быстрый и значительный приток лейкоцитов к месту инъекции (Brummet, M.E., J. Immun. 2000, 164, 3392-3401). Известно, что MIP-1 повышается в синовиальной жидкости и крови пациентов с ревматоидным артритом. Более того, различные исследования показали потенциальное терапевтическое значение антагонизма взаимодействия MIP-1/CCR-1 при лечении ревматоидного артрита. Следует также отметить, что CCR-1 также является рецептором для хемокинов RANTES, МСР-3,НСС-1, Lkn-1/HCC-2, НСС-4 и MPIF-1 (Carter, P.H., Curr. Opin Chem. Bio. 2002, 6, 510-525). Поскольку предполагается, что новое соединение формулы (I), описанное в настоящей заявке, вызывает антагонизмMIP-1, связываясь с CCR-1 рецептором, возможно, что это соединение является также эффективным антагонистом воздействия вышеупомянутого лиганда, который опосредован CCR-1. Соответственно, когда в настоящей заявке делается ссылка на "антагонизм MIP-1", следует предположить, что это выражение эквивалентно "антагонизму стимуляции CCR-1 хемокином". В последнее время многочисленными группами уже была описана разработка низкомолекулярных антагонистов MIP-1 (обзор представлен в: Carson, K.G. и др., Ann. Reports Med. Chem. 2004, 39, 149-158). Сущность изобретения Таким образом, настоящее изобретение обеспечивает соединение пиперидинила, которое представляет собой антагонист или частичный агонист/антагонист MIP-1 или CCR-1 рецепторной активности,или его фармацевтически приемлемую соль. Настоящее изобретение обеспечивает фармацевтические композиции, содержащие фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли. Настоящее изобретение обеспечивает способ лечения ревматоидного артрита и отторжения трансплантата, включающий введение хозяину, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли. Настоящее изобретение обеспечивает способ лечения воспалительных заболеваний, включающий введение хозяину, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли. Настоящее изобретение обеспечивает соединение для применения в терапии. Настоящее изобретение обеспечивает применение соединения для изготовления лекарственного средства для лечения воспалительных заболеваний. Подробное описание изобретения В одном из вариантов осуществления настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли. Настоящее изобретение обеспечивает соединение, которое обладает неожиданным благоприятным профилем по сравнению с известными ингибиторами активности CCR-1, например соединениями, описанными в патенте США 7601844, права на которые принадлежат заявителю. Более предпочтительно соединение проявляет лучший фармакокинетический профиль и другие свойства, которые делают его интересным претендентом на клинические исследования. Соответственно, именно эти неожиданные свойства в отдельности и/или в сочетании делают соединение формулы (I) желательным для применения в качестве фармацевтического вещества. В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы (I). В другом варианте осуществления настоящее изобретение относится к способу ингибирования активности хемокина или хемокинового рецептора, включающему введение пациенту,нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу ингибирования активности CCR-1 рецептора, включающему введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу ингибирования активности MIP-1,МСР-3, МСР-4, RANTES, предпочтительно ингибирования активности MIP-1, которая опосредованаCCR-1 рецептором, включающему введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения и предотвращения воспалительных заболеваний, выбранных из остеоартрита, лихорадки, болезни Крона, идиопатического легочного фиброза, воспалительных заболеваний кишечника, альвеолита, неспецифического язвенного колита,нефротоксического сывороточного нефрита, гломерулонефрита, астмы, ревматоидного артрита, рестеноза и кожного воспалительного заболевания, включающему введение пациенту, нуждающемуся в этом,терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения воспалительных заболеваний, включающему введение пациенту,нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения воспалительных заболева-2 022395 ний, например воспалительных заболеваний, которые, по меньшей мере частично, опосредованы CCR-1,включающему введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу ингибирования активности CCR-1,включающему введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к применению соединения формулы (I) в изготовлении лекарственного средства для лечения и предотвращения воспалительного заболевания, выбранного из остеоартрита, лихорадки, болезни Крона, идиопатического легочного фиброза, воспалительных заболеваний кишечника, альвеолита, неспецифического язвенного колита, нефротоксического сывороточного нефрита, гломерулонефрита, астмы, ревматоидного артрита, рестеноза и кожного воспалительного заболевания. В другом варианте настоящее изобретение относится к соединению формулы (I) для применения в терапии. В другом варианте настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) и одно или несколько активных ингредиентов. В другом варианте настоящее изобретение относится к способу ингибирования активности хемокина или хемокинового рецептора, включающему введение пациенту, нуждающемуся в этом, соединения формулы (I) и одного или несколько активных ингредиентов. В другом варианте настоящее изобретение относится к способу ингибирования активности CCR-1 рецептора, включающему введение пациенту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической композиции, содержащей соединение формулы (I) и один или несколько активных ингредиентов. В еще одном варианте осуществления настоящее изобретение относится к способу ингибирования активности MIP-1, МСР-3, МСР-4 или RANTES, предпочтительно модуляции активности MIP-1, которая опосредована CCR-1 рецептором, включающему введение пациенту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической композиции, содержащей соединение формулы (I) и один или несколько активных ингредиентов. В другом варианте настоящее изобретение относится к способу лечения или предотвращения воспалительных заболеваний у пациента, включающему введение пациенту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической композиции, содержащей соединение формулы(I) и один или несколько активных ингредиентов, отличающийся тем, что указанное воспалительное заболевание выбрано из остеоартрита, лихорадки, болезни Крона, идиопатического легочного фиброза,воспалительных заболеваний кишечника, альвеолита, неспецифического язвенного колита, нефротоксического сывороточного нефрита, гломерулонефрита, астмы, ревматоидного артрита, рестеноза и кожного воспалительного заболевания. В еще одном варианте осуществления настоящее изобретение относится к способу лечения воспалительных заболеваний, предпочтительно воспалительных заболеваний, которые,по меньшей мере частично, опосредованы CCR-1, включающему введение пациенту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической композиции, содержащей соединение формулы (I) и один или несколько активных ингредиентов. В другом варианте настоящее изобретение относится к способу ингибирования активности CCR-1, включающему введение пациенту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической композиции, содержащей соединение формулы (I) и один или несколько активных ингредиентов. В другом варианте настоящее изобретение относится к применению фармацевтической композиции, содержащей соединение формулы (I) и одно или несколько активных ингредиентов, в изготовлении лекарственного средства для лечения воспалительного заболевания, при этом указанное воспалительное заболевание выбрано из остеоартрита,лихорадки, болезни Крона, идиопатического легочного фиброза, воспалительных заболеваний кишечника, альвеолита, неспецифического язвенного колита, нефротоксического сывороточного нефрита, гломерулонефрита, астмы, ревматоидного артрита, рестеноза и кожного воспалительного заболевания. В еще одном варианте настоящее изобретение относится к применению фармацевтической композиции, содержащей соединение формулы (I) и одно или несколько активных ингредиентов, в терапии. Изобретение может быть воплощено в других конкретных формах в пределах объема изобретения или его существенных признаков. Данное изобретение также включает все сочетания альтернативных особенностей изобретения, указанных в данной заявке. Известно, что любые варианты осуществления настоящего изобретения могут быть приняты в сочетании с любым другим вариантом осуществления для описания дополнительных вариантов осуществления настоящего изобретения. Кроме того, любые элементы варианта осуществления могут быть в сочетании с любыми другими элементами из любых вариантов осуществления для описания дополнительных вариантов осуществления. Определения Соединение, описанное в настоящей заявке, может иметь центры асимметрии. Соединение по настоящему изобретению, содержащее асимметрически замещенный атом, может быть выделено в оптически активной или рацемической формах. В уровне техники хорошо известно, как получать оптически активные формы, например, путем разделения рацемических форм или путем синтеза из оптически ак-3 022395 тивных исходных материалов. Многие геометрические изомеры олефинов, соединений с C=N двойными связями и подобные могут также могут присутствовать в соединениях, описанных в настоящей заявке, и все такого рода стабильные изомеры рассматриваются в настоящем изобретении. Цис- и трансгеометрические изомеры соединений по настоящему изобретению описаны и могут быть выделены в виде смеси изомеров или в виде отдельных изомерных форм. Все хиральные, диастериоизомерные, рацемические формы и все геометрические изомерные формы структуры предполагаются для применения,если конкретная стереохимия или изомерная форма специально не указана. Один энантиомер соединения формулы (I) может проявлять повышенную активность по сравнению с другим. Таким образом, вся стереохимия считается частью настоящего изобретения. При необходимости, разделение рацемического материала может быть достигнуто с помощью ВЭЖХ с использованием хиральной колонки или с помощью разделения с использованием агента для разделения, что известно специалисту в данной области техники. Выражение "фармацевтически приемлемый" используется в настоящей заявке для обозначения тех соединений и/или готовых лекарственных форм, которые в рамках обоснованного медицинского заключения пригодны для применения в контакте с тканями человека и животных, не вызывая чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, соразмерных с разумным соотношением пользы/риска. В данном контексте "фармацевтически приемлемые соли" относятся к производным заявленного соединения, причем исходное соединение модифицируется превращением в его кислую или основную соль. Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими, минеральные или органические соли основных остатков, таких как амины; щелочные или органические соли кислых остатков, таких как карбоновые кислоты; и подобное. Фармацевтически приемлемые соли включают общепринятые нетоксические соли или четвертичные аммониевые соли исходного соединения, образующиеся, например, из нетоксичных неорганических или органических кислот. Например, такие общепринятые нетоксичные соли включают в себя соли, полученные из неорганических кислот, таких как хлористо-водородная, бромисто-водородная, серная, сульфаминовая, фосфорная, азотная и подобное; и соли,полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памовая, малеиновая, гидроксималеиновая,фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изэтиновая и тому подобное. Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы из исходного соединения, которое содержит основной или кислый фрагмент, с помощью общепринятых химических способов. Обычно такие соли могут быть получены путем взаимодействия свободных кислых или основных форм этого соединения со стехиометрическим количеством соответствующего основания или кислоты в воде или органическом растворителе или в их смеси; обычно безводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил, являются предпочтительными. Перечни подходящих солей могут быть найдены в Remington's Pharmaceutical Sciences, 17th ed, Mack Publishing Company, Easton, PA, 1985, p. 1418, раскрытие которого включено в настоящую заявку посредством ссылки. Кроме того, соединение формулы (I) является в связи с его получением предпочтительно выделенным и очищенным до получения композиции, содержащей количество по весу, равное или более чем 99% соединения формулы I ("по существу, чистое" соединение I), которое затем применяется или изготавливается, как описано в настоящей заявке. Такого рода "по существу, чистое" соединение формулы I также рассматривается в настоящей заявке как часть настоящего изобретения. Все стереоизомеры соединения по настоящему изобретению предусмотрены либо в смеси, или в чистой или, по существу, чистой форме. Соединение по настоящему изобретению может иметь центры асимметрии в любом из атомов углерода, включающих любой из R заместителей, и/или проявляет полиморфизм. Соответственно, соединение формулы I может находиться в энантиомерной или диастериоизомерной формах или в их смеси. Способ получения может включать использование рацемических смесей, энантиомеров или диастериоизомеров в качестве исходных материалов. Когда диастериоизомерные или энантиомерные продукты готовы, они могут быть разделены с помощью общепринятых способов,например, хроматографической или фракционной кристаллизацией."Стабильное соединение" и "стабильная структура" предназначены для обозначения соединения,которое является достаточно устойчивым для того, чтобы его можно быть подвергать выделению из реакционной смеси с достаточной степенью чистоты и получать эффективное лекарственное средство. Настоящее изобретение предназначено, чтобы воплотить стабильные соединения."Терапевтически эффективное количество" предназначено для включения количества соединения по настоящему изобретению отдельно или количество сочетаний заявленных соединений или количество соединения по настоящему изобретению в сочетании с другими действующими ингредиентами, эффективными для ингибирования MIP-1 или эффективными для лечения или профилактики воспалительных заболеваний. В данном контексте "лечение" или "излечение" включает в себя лечение болезненного состояния у млекопитающего, в частности у человека, и включают: (а) профилактику болезненного состояния, возни-4 022395 кающего у млекопитающего, в частности, когда такое млекопитающее является предрасположенным к возникновению такого болезненного состояния, но еще не установлен его диагноз; (б) ингибирование болезненного состояния, то есть прекращение его развития; и/или (в) облегчение болезненного состояния, то есть регрессия болезненного состояния. Синтез Соединение формулы I было получено, как показано в следующем примере, схеме реакции и ее описании, а также соответствующими литературными способами, которые могут применяться специалистом в данной области техники. Примерные реагенты и способы для этих реакций представлены ниже. Стадия 1. трет-Бутил 3-метил-4-оксопиперидин-1-карбоксилат Смесь 1-бензил-3-метилпиперидин-4-она (11,4 г, 56,1 ммоль), Вос-ангидрида (14,32 мл, 61,7 ммоль) и 10% палладия на угле (0,597 г, 5,61 ммоль) в этаноле (100 мл) дегазировали под действием вакуума и азота, затем гидрогенизировали при 50 psi в течение 4 ч при комнатной температуре. Катализатор удаляли фильтрованием, промывали метанолом и объединенный фильтрат и промывки концентрировали под вакуумом. Остаток очищали через колонку с силикагелем 330 г, элюируя со скоростью 100 мл/мин с градиентом этилацетат/гексан с получением на выходе трет-бутил 3-метил-4-оксопиперидин-1-карбоксилата(11,66 г, 54,7 ммоль, выход 97%) в виде масла, которое затвердевает при стоянии. 1 Н ЯМР (CDCl3, 400 МГц)4.15 (m, 2 Н), 3.22 (m, 1H), 2.79 (br m, 1H), 2.52-2.38 (m, 3H), 1.46 (s,9H), 1.01 (d, J=6.8 Гц, 3H); m/z =158.2 (M-tBu)+. Стадия 2. трет-Бутил 4-(4-хлорфенил)-3-метил-5,6-дигидропиридин-1(2 Н)-карбоксилат Раствор 1-бром-4-хлорбензола (21,87 г, 114 ммоль) в безводном ТГФ (250 мл) охлаждали до -78 С и обрабатывали по капле н-бутиллитием (43,5 мл, 109 ммоль, 1,6 М в гексане). Смесь перемешивали при-78 С в течение 45 мин, во время которых наблюдался осадок, затем суспензию обрабатывали по капле раствором трет-бутил 3-метил-4-оксопиперидин-1-карбоксилата (11,6 г, 54,4 ммоль) в безводном ТГФ(50 мл). Реакционную смесь перемешивали при -78 С в течение 2 ч, затем позволяли медленно нагреться до -20 С и останавливали реакцию насыщенным раствором хлорида аммония. Слои разделяли и органическую фазу концентрировали под вакуумом. Водную фазу экстрагировали один раз этилацетатом (300 мл) и органическую фазу объединяли с остатком от исходной органической фазы. Смесь промывали 3 раза водой и один раз солевым раствором, затем сушили над сульфатом натрия и концентрировали под вакуумом. Остаток выпаривали в кипящем гексане (200 мл) в течение 1 ч и затем смесь охлаждали до комнатной температуры. Твердые вещества собирали путем фильтрации, промывали небольшим количеством горячего гексана и сушили под вакуумом до получения трет-бутил 4-(4-хлорфенил)-4-гидрокси-3 метилпиперидин-1-карбоксилата (13,96 г, 42,8 ммоль, выход 79%) в виде порошка, m/z = 252,2 (MtBuO)+. В 250 мл круглодонной колбе трет-бутил 4-(4-хлорфенил)-4-гидрокси-3-метилпиперидин-1 карбоксилат (4,3 г, 13,2 ммоль) обрабатывали концентрированной HCl (25 мл, 300 ммоль). Смесь перемешивали при комнатной температуре до прекращения сильного пенообразования и наблюдали гетерогенное свободное перемешивание смеси. Смесь нагревали с обратным холодильником в течение 19 ч, во время которых наблюдался чистый раствор. Реакционную смесь концентрировали под вакуумом, а остаток концентрировали дважды толуолом для удаления оставшегося HCl. Остаток суспендировали в ТГФ (50 мл) и добавляли Вос-ангидрид (3,00 мл, 12,9 ммоль), а затем триэтаноламин (5,52 мл, 40 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Смесь затем концентрировали под вакуумом, а остаток помещали в этилацетат (150 мл). Гетерогенную смесь промывали 1N HCl (3), один раз водой и один раз солевым раствором, затем сушили под сульфатом натрия и концентрировали под вакуумом с получением на выходе трет-бутил 4-(4-хлорфенил)-3-метил-5,6-дигидропиридин-1(2 Н)-карбоксилата (4,3 г) в виде масла. 1 Н ЯМР (400 МГц, MeOD4)7.34 (m, 2 Н), 7.14 (d, J=8.3 Гц, 2 Н), 3.87 (br s, 2H), 3.58 (br s, 2H), 2.33 Раствор трет-бутил 4-(4-хлорфенил)-3-метил-5,6-дигидропиридин-1(2 Н)-карбоксилата (2,2 г, 7,15 ммоль) в 50% трет-бутанол/вода (50 мл) охлаждали до 5 С и обрабатывали метансульфонамидом (0,680 г, 7,15 ммоль) и AD-Mix альфа (11 г, 7,15 ммоль). Полученную суспензию перемешивали при 5 С в течение 4 ч, затем позволяли медленно достичь комнатной температуры и перемешивали в течение 3 дней. Смесь охлаждали до 5 С и обрабатывали твердым сульфитом натрия и смесь перемешивали в течение 1 ч, во время которого наблюдали чистый раствор. Смесь экстрагировали этилацетатом (3), затем объединенные органические фазы промывали дважды водой и один раз солевым раствором, сушили над сульфатом натрия и концентрировали под вакуумом. Остаток очищали с помощью ЖХ среднего давления через колонку с силикагелем 120 г, элюируя со скоростью 85 мл/мин с 25%, затем 30%, затем 35% этилацетатом/гексаном с получением на выходе (3S,4S)-трет-бутил 4-(4-хлорфенил)-3,4-дигидрокси-3 метилпиперидин-1-карбоксилата (2,1 г, 5,53 ммоль, выход 77%) в виде масла. 1 Н ЯМР (400 МГц, MeOD4)7.53 (d, J=8.8 Гц, 2 Н), 7.30 (d, J=8.8 Гц, 2 Н),.4.05 (br d, 1H), 3.73 (m,1H), 3.26 (m, 2H), 2.48 (ddd, J=12.7, 4.8 Гц, 1H), 1.65 (d, J=14.1 Гц, 1H), 1.47 (s, 9 Н), 0.92 (s, 3H); m/z(2,08 г, 6,08 ммоль) в 4 М HCl в диоксане (30,4 мл, 122 ммоль) перемешивали при комнатной температуре в течение 45 мин. Смесь концентрировали под вакуумом, затем концентрировали с хлористым метиленом (3) для удаления HCl с получением на выходе гидрохлорида (3S,4S)-4-(4-хлорфенил)-3 метилпиперидин-3,4-диола (1,7 г, 6,11 ммоль, выход 100%) в виде порошка. 1 Н ЯМР (400 МГц, MeOD4)7.55 (d, J=8.8 Гц, 2 Н), 7.36 (d, J=8.8 Гц, 2 Н), 3.42 (m, 1H), 3.29 (m, 1H),3.05 (d, J=13.2 Гц, 1H), 2.71 (ddd, J=13.2 , 4.8 Гц, 1H), 1.97 (dt, J=14.5, 3.1 Гц, 1H), 1.08 (s, 3H); m/z (ES+) = 242.1 (М+Н)+. Стадия 5. трет-Бутил (R)-1-3S,4S)-4-(4-хлорфенил)-3,4-дигидрокси-3-метилпиперидин-1-ил)-3 метил-1-оксобутан-2-илкарбамат(83,1 г, 382 ммоль), HOBt (69,2 г, 452 ммоль), EDS (87 г, 452 ммоль) в CH2Cl2 (800 мл) и DMF (80 мл) добавили DIPEA (132 мл, 753 ммоль) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали и остаток распределяли между EtOAc и водой. Слой EtOAc промывали 1N HCl, насыщенным водным раствором NaHCO3 и солевым раствором с получением неочищенного продукта (180 г, 80% чистоты), который применяли непосредственно в следующем превращении. Стадия 6. (3S,4S)-4-(4-Хлорфенил)-3-метил-1-D-валил-3,4-пиперидиндиолEtOAc (1 л), воду (1 л) и TEA (2 моль). Эти два слоя раствора перемешивали при комнатной температуре в течение 2 ч и продукт осаждали в виде твердого вещества (70 г, 98% чистоты). Дополнительная рекристаллизация из МеОН повышала чистоту до 99,8%. Дополнительные 11 г были извлечены из исходного раствора для обеспечения (3S,4S)-4-(4-хлорфенил)-3-метил-1-D-валил-3,4-пиперидиндиола (81 г, выход 70%) в виде твердого вещества. 1 Н ЯМР (400 МГц, MeOD4, ротамерный)7.54 (n, 2H), 7.31 (m, 2 Н), 4.53 (m, 0.5 Н), 4.27 (dd, J=12.4,1.2 Гц, 0.5 Н), 3.93 (br d, 0.5H), 3.70 (t, J=5.2 Гц, 1H), 3.69 (m, 1.5 Н), 3.14 (m, 1H), 2.49 (ddd, J=13.9, 4.8 Гц,1H), 1.96-1.71 (m, 2 Н), 1.07-0.89 (m, 9 Н); m/z = 341.12 (М+Н)+. Стадия 7. (R)-Бензил 3,3-дифторциклопентанкарбоксилат(R)-Бензил 3-оксоциклопентанкарбоксилат (62,8 г, 288 ммоль) растворяли в дихлорэтане (220 мл) и охлаждали до 10 С на ледяной бане. К этой смеси добавляли трифторид (диэтиламино)серы (86 мл, 647 ммоль) и температуру реакции поддерживали ниже комнатной температуры в течение добавления. После нагревания до комнатной температуры раствор нагревали при 40 С в течение 12 ч, а затем перемешивали при комнатной температуре в течение 12 ч для получения черного раствора. Полученный раствор охлаждали сухим льдом/МеОН и останавливали реакцию МеОН (30 мл). Смесь затем выливали в 4 л охлажденный стакан с сухим льдом/МеОН и медленно добавляли водный раствор NaHCO3 + Na2CO3, чтобы довести до уровня рН 5-7. Продукт экстрагировали с DCM и органический слой концентрировали для получения жидкости (80 г). Неочищенный продукт очищали посредством колоночной хроматографии(R)-Бензил 3,3-дифторциклопентанкарбоксилат (13 г, 54,1 ммоль) растворяли в МеОН (200 мл) при комнатной температуре при перемешивании, затем добавляли 0,5 М LiOH (216 мл, 108 ммоль). После перемешивания в течение 2 ч добавляли воду к реакционной смеси и концентрировали для удаления летучих растворителей. Водный слой промывали Et2O (2), затем подкисляли до рН 3 с помощью 1N HCl. Водный слой экстрагировали хлористым метиленом (2) и органические слои объединяли, сушили(Na2SO4) и концентрировали для получения (R)-3,3-дифторциклопентан карбоновой кислоты (6,58 г, 43,8 ммоль, выход 81%) в виде масла. 1 Н ЯМР (MeOD3, 400 МГц)3.03 (m, 1H), 2.33 (m, 2 Н), 1.95-2.20 (m, 4 Н); m/z = 149.2 (М-Н). Стадия 9. (R)-N-R)-1-3S,4S)-4-(4-хлорфенил)-3,4-дигидрокси-3-метилпиперидин-1-ил)-3-метил 1-оксобутан-2-ил)-3,3-дифторциклопентан карбоксамид К смеси (R)-2-амино-1-3S,4S)-4-(4-хлорфенил)-3,4-дигидрокси-3-метилпиперидин-1-ил)-3-метилбутан-1-она (22,49 г, 66,0 ммоль), (R)-3,3-дифторциклопентана карбоновой кислоты (10,21 г, 68,0 ммоль) в CH2Cl2 (300 мл) и DMF (75 мл) добавили НОВТ (12,50 г, 82 ммоль), EDC (15,65 г, 82 ммоль) и основание Хунинга (23,76 мл, 136 ммоль). Реакционную смесь перемешивали в течение 20 ч при комнатной температуре, затем концентрировали для удаления CH2Cl2. Этилацетат добавляли и органический слой промывали дважды 1N HCl, дважды насыщенным раствором карбоната натрия и трижды водой. Органический слой сушили над сульфатом натрия и концентрировали для получения стеклянного твердого вещества, который кристаллизовали из CH3CN для получения (R)-N-R)-1-3S,4S)-4-(4-хлорфенила)-3,4 дигидрокси-3-метилпиперидина-1-ил)-3-метил-1-оксобутан-2-ил)-3,3-дифторциулопентанкарбоксамида(31,03 г, 65,6 ммоль, выход 99%). 1 Н ЯМР (500 МГц, DMSO-d6, ротамерный)8.11 (m 1H), 7.55 (m, 2 Н), 7.34 (арр t, 2 Н), 5.29 (d, J=6.9 Гц, 1H), 4.76 (m, 0.5H), 4.68-4.58 (m, 1.5H), 4.43 (br m, 0.5H), 4.09 (br d, 0.5 Н), 3.97 (br d, 0.5 Н), 3.50 (m,1H), 3.35 (m, 3H), 3.00 (m, 2H), 2.31 (m, 0.5H), 2.32-1.94 (m, 6.5H), 1.77 (m, 1H), 1.65 (m, 1H), 0.92-0.83 (m,6H), 0.74 (m, 3H); m/z = 473.2 (M+H). Полезность В общем было показано, что соединение формулы (I) является модулятором активности хемокинового рецептора. При проявлении активности в качестве модулятора, соединение формулы (I), как ожидается, можно применять при лечении заболеваний человека, связанных с хемокинами и их родственными рецепторами. Сравнительные фармакологические характеристики Анализ и данные сравнения физиологических и физико-химических характеристик соединения I и соединений из US 2007/0208056 A1 (соответствует WO 2007/092681) представлены ниже. Соединение по настоящему изобретению (соединение I) сравнивали с другими соединениями, ко-7 022395 торые оказались пригодными для ингибирования активности CCR-1 и оказались особенно подходящими. Например, неожиданные преимущества по сравнению с другими соединениями показаны ниже в табл. 1 и 2. Анализ связывания человеческого CCR-1 THP-1. Для конкурентных радиолигандных исследований клетки моноцитарного лейкоза ТНР-1 в конечной концентраций 1105 объединяли с 100 мкг гранул LS WGA PS (Amersham, Cat. : RPNQ 0260) в 40 мкл аналитического буфера (RPMI 1640 без фенолового красного, 50 мМ HEPES, 5 мМ MgCl2, 1 мМ CaCl2,0,1% BSA). Смесь клеток ТНР-1/гранул добавляли в каждую лунку 384-луночного аналитического планшета (PerkinElmer, Cat. :6007899), содержащего исследуемое соединение в 3-кратном последовательном разведении с конечной концентрацией в диапазоне от 8 мкМ до 0.14 нМ. [125I]-MIP-1 (PerkinElmer, Cat.NEX298) в конечной концентрации 0,1 нМ в 20 мкл аналитического буфера добавляли к реакционной смеси. Немеченый MIP-1 добавляли в избытке в некоторые лунки для определения неспецифического связывания. Герметически закрытые аналитические планшеты инкубировали при комнатной температуре в течение 12 ч, затем анализировали с помощью LEADseeker. Конкурентные данные исследуемого соединения в диапазоне концентраций отражались на графике в виде процентного ингибирования специфического связывания радиолиганда при отсутствии исследуемого соединения (процент общего импульса). После введения поправок для неспецифического связывания определяли значения IC50. Значение IC50 определяли как концентрацию исследуемого соединения,необходимую для снижения специфического связывания [125I]-MIP-1 на 50%, и рассчитывали с использованием четырех параметров логистическим уравнением для соответствия нормализированным данным. Значения K1 определяли с помощью применения уравнения Ченга-Пруссофа для значений IC50, где K1 =IC50/концентрация лиганда/Kd. Kd [125I]-MIP-1 в клетках ТНР-1 составляет 0,1 нМ. Каждый эксперимент проводили в двух повторах. Анализ локальной фиксации потенциала hERG. Метод локальной фиксации потенциала цельных клеток применялся для непосредственного измерения хвостовых токов hERG в клетках HEK-293, устойчиво экспрессирующихсубъединицу калиевого клонированного hERG канала. Воздействия соединений подсчитывались путем измерения ингибирования пикового хвостового тока. Эксперименты проводились с использованием водного буферного раствора с рН 7,4 при комнатной температуре. Буферный раствор не содержал белка. Описанные исследуемые концентрации представляют собой номинальные уровни свободного лекарственного средства. Данные сообщались как процент ингибирования при постоянной концентрации. Анализ L-типа натриевого и кальциевого канала. Метод локальной фиксации потенциала цельных клеток применяли для непосредственного измерения внутреннего натриевого тока в клетках HEK-293, экспрессирующих ген SCN5A, кодирующий сердечный натриевый канал человека. После достижения устойчивого воздействия в присутствии лекарственного средства зависимость влияния частоты оценивали путем стимуляции при частоте 1 и 4 Гц. Эксперименты проводились с использованием водного буферного раствора при рН 7,4 и при комнатной температуре. Буферный раствор не содержал белка, а описанные концентрации лекарственного средства являлись номинальными уровнями свободного лекарственного средства. Испытуемый образец оценивали до 10 мкМ (безбелковый буферный раствор). Зависимость влияния частоты ингибирования оценивали путем стимуляции при частоте 1 и 4 Гц. Данные сообщались как процент ингибирования при постоянной концентрации. В дополнение к возможному взаимодействию с L-типом кальциевых каналов метод локальной фиксации потенциала цельных клеток применяли для непосредственного измерения внутренних кальциевых токов в клетках HEK-293, устойчиво экспрессирующих клонированный L-тип сердечного Са канала человека (1 С) и егосубъединицу. Воздействия соединений подсчитывали путем измерения ингибирования пикового значения тока. Эксперименты проводились с использованием водного буферного раствора при рН 7,4 и при комнатной температуре. Буферный раствор не содержал белка, а описанные концентрации лекарственного средства являлись номинальными уровнями свободного лекарственного средства. Данные сообщались как процент ингибирования при постоянной концентрации. Электрокардиографическое исследование на анестезированных кроликах. Исследование зависимости влияния дозы исследуемого соединения проводилось на анестезированных кроликах для оценки сердечного электрофизиологического профиля, основанного на исследовании клеточных ионных каналов. Эксперименты проводились на грудной клетке самцов кроликов, анестезированных пропофолфентанилом. Электрокардиограмма поверхности тела (ЭКГ) и внутрисердечная электрокардиограмма пучка Гиса непрерывно контролировались и регистрировались в ходе исследований с использованием системы PoNeMah и электрофизиологической системы регистрации Prucka соответственно. Исследуемое соединение получали в день исследования в носителе ПЭГ 400:этанол:вода в дозированной концентрации 30 мг/мл. Исследуемое соединение (n=3) или носитель (n=3) вводили внутривенно в течение 5 мин посредством насоса для вливаний в нарастающей дозе 3, 10 и 30 мг/кг. Интервал между дозами был 10 мин,-8 022395 принимая во внимание 5-минутное вливание исследуемого вещества и 5-минутный период покоя. Кровь отбирали в исходном состоянии (до вливания лекарственного средства) и непосредственно в конце каждого вливания. Для дозы 30 мг/кг дополнительные образцы крови брали на 10, 20 и 30 минутах после последнего вливания. Интервал PR, продолжительность QRS и интервал QT были в среднем от 1 мин периода регистрации ЭКГ до забора крови. Интервал QT были скорректирован в отношении воздействий на частоту сердечных сокращений с использованием как формулы Фридерика (QTcf), так и формулы Water (QTcv). Интервалы АН и HV, отображающие A-V проводимость узлов и проводимость Гиса-Пуркинье, соответственно, оценивали путем измерений вручную от электрограммы пучка Гиса. Данные были выражены как процентное изменение от основных данных до вливания лекарственного средства (среднее значениеSEM) для интервалов PR, QRS и HV, a также как дельта изменение от основных данных до вливания лекарственного средства (среднее значениеSEM) для интервалов QT. Изменения 10% в интервалах PR, QRS и АН и 20% в интервале HV, а также 10 мс в интервале QTc являются значительными на основании опыта с моделью. Как показано ниже в табл. 1, данные in vivo показывают превосходные показатели безопасности соединения I. В частности, при показании нижнего Ki CCR-1 in vitro по сравнению с другими соединениями соединение I также имело максимальную дозу препарата, не приводящую к развитию наблюдаемых эффектов (NOEL) у кроликов с 30 мг/кг. Хотя соединение примера 491 обладало подобным NOEL, оно обладало более высокой абсолютной пролонгацией QT, а также более низкой свободной фракцией циркулирующего лекарственного средства по сравнению с соединением I. Таблица 1 Сердечно-сосудистый профиль безопасность in vitro и in vivo Анализ трансактивации PXR. Применяли клеточную культуральную среду DMEM. Липофектамин 2000, PBS, термоинактивированная фетальная бычья сыворотка (FBS), трипсин-ЭДТА (0,25%) и пенициллин-стрептомицин были приобретены у GIBCO/Invitrogen (Carlsbad, CA). Древесный уголь/декстран, обработанные фетальной бычьей сывороткой (FBS), были приобретены у Hyclone (Logan, UT). Клетки HepG2 были получены от АТСС (Manassas, VA). Человеческий PXR-pcDNA3 и репортер люциферазы, содержащий промотерCYP3A4, CYP3A-Luc, были произведены Bristol-Myers Squibb. Белые 384-луночные планшеты для тканевых культур с (ТС)-поверхностью были приобретены у Perkin Elmer (Boston, MA). Субстрат люциферазы (Steady-Glo) был приобретен у Promega (Madison, WI). Контрольные соединения рифампицина, мифепристона и сульфинпиразона были приобретены у Sigma (St. Louis, МО). Культивирование клеток HepG2 осуществлялось в Т 175 колбах с применением DMEM, содержащей 10% FBS. Трансфекционная смесь содержала 1 мкг/мл плазмиды ДНК PXR-pcDNA3, 20 мкг/мл плазмиды ДНК Сур 3 А-Luc, 90 мкл/мл Лепофектамина 2000 и бессывороточную среду. После инкубации при комнатной температуре в течение 20 мин трансфекционную смесь (1 мл на колбу) применяли к клеткам в свежей среде (20 мл на колбу) и колбы инкубировали при 37 С (5% СО 2) в течение ночи. Клетки из каждой колбы промывали PBS и добавляли 2 мл трипсин-ЭДТА (0.25%) и инкубировали в течение 5 мин при 37 С, 5% CO2. Колбы затем сильно встряхивали для разрушения клеточных агрегатов. После добавляли 8 мл DMEM, содержащего 5% древесный уголь/декстран-обработанную FBS, всю смесь переносили в конические пробирки. Клетки затем центрифугировали при 1000 об/мин в течение 5 мин. Клеточный осадок ресуспендировали до конечного подсчета 7106 клеток/мл в охлажденной среде(DMEM, содержащая 20% сыворотки и 10% DMSO). Суспензию клеток делили на аликвоты в 15-мл полипропиленовые пробирки, 5 мл на пробирку. Клетки медленно замораживали путем размещения в пенополистирол-изолированный контейнер при -80 С в течение ночи. Флаконы переносили в ультрахолодный (-140 С) морозильник после 24 ч для длительного хранения. Флаконы криосохраненных клеток быстро оттаивали в теплой водяной бане в течение 5 мин. Клетки объединяли и разводили до 50 мл в 50-мл конической колбе. Оттаявшие клетки центрифугировали при 1500 об/мин в течение 5 мин для сбора клеток и отбрасывали супернатант. Клетки затем ресуспендировали в свежей среде II (DMEM, содержащая 5% древесный уголь/декстран-обработанный FBS, 1% пенициллин/стрептомицин, 100 мкМ неосновных аминокислот, 1 мМ пирувата натрия и 2 мМ Lглутамина), подсчитывались с использованием устройства для подсчета клеток Guava и разводили до 1,6105 клеток/мл в той же среде. 50 мкл клеточной смеси добавляли в лунки в колонках 1-23 обработанного белого 384-луночного планшета для тканевых культур с (ТС)-поверхностью, содержащего 0,25 мкл исследуемого соединения, растворенного в 100% DMSO. 50 мкл среды II добавляли в лунки в колонке 24. Планшеты инкубировали при 37 С (5% CO2) в течение 24 ч, затем 5 мкл реагента Alamar Blue (TrekDiagnostics, Cat 00-100) добавляли в каждую лунку. Планшеты затем инкубировали дополнительно 2 ч при 37 С, 5% CO2, а затем 1 ч при комнатной температуре. Флюоресценцию считывали при Ех 525/Em598. После того как флюоресценцию измерили, 25 мкл субстрата люциферазы (Steady-Glo,Promega) добавляли в каждую лунку. Планшеты инкубировали в течение 15 мин при комнатной температуре, затем каждую считывали на планшет-ридере PheraStar (BMG Labtech). Рифампицин (10 мкМ), известный агонист PXR, входил в каждую планшету в качестве внутреннего стандарта и положительного контроля. Данные затем выражали как процент контроля (% CTRL), где контрольный импульс представляет собой импульс от 10 мкМ рифампицина, а импульс пустой пробы представляет собой импульс от носителя DMSO.% CTRL = (импульс соединения - импульс пустой пробы)/(контрольный импульс-импульс пустой пробы)100. Соединения исследовали при десяти концентрациях (2,5 нМ-50 мкМ, 1:3 последовательные разведения). Результаты анализа представлены как ЕС 50, концентрация соединения, при которой наблюдается 50% максимального ответа, и как YMAXOBS, максимальный ответ (высокий процент CTRL) наблюдался для этого соединения. ЕС 50 определяют как концентрацию, соответствующую половине возможного максимального ответа, полученную от аппроксимированной 20-точечной кривой, как определено с использованием регрессионной логистической модели с четырьмя параметрами. Кроме того, соединения могут также быть представлены как ЕС 20 или ЕС 60. Анализ данных по реакции цитотоксичности HepG2. Соединения исследовали при десяти концентрациях (2,5 нМ - 50 мкМ, 1:3 последовательные разведения). Результаты анализа представлены как IC50, определяемое как концентрация, соответствующая 50% ингибирования, полученная от аппроксимированной 20-точечной кривой, как определено с использованием регрессионной логистической модели с четырьмя параметрами. Исследование метаболизма in vitro. Анализ условий А. Исследуемое соединение получали как 3,5 мМ исходный раствор в 100% DMSO. Соединение разводили для создания 50 мкМ раствора ацетонитрила (CAN), содержащего 1,4% DMSO, который затем использовали как 100 исходный раствор для инкубации с микросомами. Каждое соединение тестировали в двух повторах по отдельности в каждом из трех видов в аналитическом наборе метаболической стабильности человека, крысы и мыши или как индивидуальные виды в наборах метаболической стабильности собаки или метаболической стабильности обезьян. Растворы соединения, NADPH и микросом печени объединяли для инкубации в три стадии: 152 мкл суспензии микросом печени, белок концентрацией 1,1 мг/мл в 100 мМ NaP1, рН 7,4, 6,6 мМMgCl2 буфера, предварительно нагретого при 37 С. 1) 1,7 мкл из 50 мкл соединения (98,6% ACN, 1,4% DMSO) добавляли в ту же пробирку и предварительно инкубировали при 37 С в течение 5 мин. 2) Реакцию инициировали путем добавления 17 мкл предварительно нагретого 10 мМ раствораNADPH в 100 мМ NaP1, рН 7,4. 3) Компоненты реакции хорошо перемешивали и 75 мкл незамедлительно перемещали в 150 мкл раствора для остановки реакции/стоп раствора (нулевой момент времени, Т 0). Реакции инкубировали при 37 С в течение 10 мин и затем дополнительно 75 мкл аликвоты переносили в 150 мкл раствора для остановки реакции. Ацетонитрил, содержащий 100 мкМ DMN (УФ стандартный для инъекций контроля качества), применяли в качестве раствора остановки реакции для завершения метаболических реакций. 4) Остановленные смеси центрифугировали при 1500 об/мин (500g) в центрифуге Allegra Х-12,SX4750 ротор (Beckman Coulter Inc., Fullerton,CA) в течение 15 мин для осадка денатурированных микросом. Супернатант экстракта объемом 90 мкл, содержащий смесь исходного соединения и его метаболиты, затем переносили в отдельный 96-луночный планшет для анализа UV-LC/MS-MS для определения процентного содержания исходного соединения, которое осталось в смеси. Анализ условий В. Исследуемое соединение получали как 20 мМ в DMSO. Соединение разводили для образования 300 мкМ раствора ацетонитрила (ACN), содержащего 1,5% DMSO, который затем применяли как 100 исходный раствор для инкубации с микросомами. Каждое соединение тестировали в двух повторах по отдельности в каждом из трех видов в аналитическом наборе метаболической стабильности человека, кры- 11022395 сы и мыши, или как индивидуальные виды в наборах метаболической стабильности собаки или метаболической стабильности обезьян. Растворы соединения, NADPH и микросом печени объединяли для инкубации в три стадии: 1. 450 мкл суспензии микросом печени, белок концентрацией 1 мг/мл в 100 мМ NaP1, рН 7,4, 6,6 мМ MgCl2 буфер, предварительно нагревали при 37 С. 2. 5 мкл из 300 мкМ соединения (98,5% CAN, 1,5% DMSO) добавляли в ту же пробирку. 3. Реакцию начинали путем добавления 50 мкл предварительно нагретого 5 мМ раствора NADPH в 100 мМ NaP1, рН 7,4. Компоненты реакции хорошо смешивали и 150 мкл удаляли, чтобы раствором остановить реакцию/стоп раствором на нулевом моменте времени. Реакционные смеси инкубировали при 37 С в течение 10 мин и затем добавляли 150 мкл раствора, удаленного из инкубационной смеси. Удаленные аликвоты объединяли с 300 мкл ACN, который содержал 100 мкл DMN в качестве УФ стандарта для обнаружения. Остановленные смеси центрифугировали при 1500 об/мин (500g) в центрифуге Allegra Х-12,SX4750 ротор (Beckman Coulter Inc., Fullerton,CA) в течение 15 мин для осадка денатурированных микросом. Экстракт супернатанта объемом 110 мкл, содержащий смесь исходного соединения и его метаболиты, затем переносят в отдельный 96-луночный планшет для анализа UV-LC/MS-MS для определения процентного содержания исходного соединения, которое осталось в смеси. Как показано ниже в табл. 2,соединение I может также быть положительно дифференцировано по 2 основным параметрам, PXR трансактивации и устойчивости микросом печени человека.PXR трансактивация определяет возможное межлекарственное взаимодействие. Если соединение активирует эти рецепторы, другие лекарственные средства могут быть метаболизированы быстрее, чем обычно, что приводит к снижению содержания уровня лекарственного средства и снижению эффективности. Это явно нежелательная характеристика у соединения, которая в настоящее время рассматривается для развития. Скрининг in vitro показывает, что соединение I не является значительным активатором этого рецептора по сравнению с теми, кроме одного из перечисленных соединений. В результате, соединения исследованы в анализе устойчивости микросомы печени человека, которая является хорошим показателем invivo клиренса соединения. С целью развития соединения с менее чем 70% отпадали из дальнейшего рассмотрения. Таким образом, сочетание незначительного риска PXR трансактивации вместе с 100% соединением, оставшиеся в анализе метаболизма микросомы печени человека, показывают, что соединение I обладает превосходящими фармакологическими характеристиками, по сравнению с другими известными и структурно аналогичными антагонистами CCR-1. Фармакокинетика одноразовой дозы у крыс. Самцы крыс линии Спраг Доули давали определенную дозу соединения (N = 3 животных) в растворе перорально или путем внутривенного вливания. Серийные образцы крови собирали для всех исследований из яремной вены в различные моменты времени после введения дозы (0,17 (или 0,25 для перорального введения), 0,5, 0,75, 1, 2, 4, 6, 8 и 24 ч, например). Образцы плазмы анализировали с помощью LCMS/MS. Дополнительные исследования оценки суспензий кристаллической лекарственного вещества в водной среде осуществляли как указано выше. Фармакокинетика одноразовой дозы у собак. Кобелям породы бигль давали определенную дозу соединения (N = 3 животных) в растворе перо- 13022395 рально или путем внутривенного вливания. Серийные образцы крови собирали для всех исследований в различные моменты времени после введения определенной дозы (0,17 (или 0,25 для перорального введения), 0,5, 0,75, 1, 2, 4, 6, 8 и 24 ч, например). Образцы плазмы анализировали с помощью LC-MS/MS. Как показано ниже в табл. 3, фармакокинетический профиль in vivo показывает преимущество соединения I в двух различных видах. В частности, в виде раствора или водной кристаллической суспензии у крыс показывало более высокий уровень воздействия по сравнению с другими соединениями в таблице. Преимуществом этого профиля является ожидаемые превосходные характеристики твердых дозированных лекарственных форм в клинике. Кроме того, у собак соединение I показывает превосходный профиль относительно клиренса in vivo (CL). Относительно сравниваемых соединений показывало 8-13-кратное снижение. Объединенные превосходные характеристики суспензионных композиций и снижение клиренса положительно отличает соединение I. Таблица 3 Фармакокинетический профиль соединения I Хемокиновые рецепторы млекопитающих обеспечивают мишень для вмешательства или стимуляции функции иммунных клеток у млекопитающих, таких как человек. Соединения, которые ингибируют или стимулируют функцию рецептора хемокина, являются особенно эффективными для модуляции функции иммунных клеток в терапевтических целях. Соответственно, настоящее изобретение относится к соединению формулы (I), которое, как полагают, полезно в профилактике и/или лечении большого количества воспалительных, инфекционных и иммунорегуляторных расстройств и заболеваний, включающих астму и аллергические заболевания, заражение патогенными микробами (которые, по существу, включают вирусы), а также аутоиммунные патологии, такие как ревматоидный артрит и артросклероз. Например, соединение по настоящему изобретению, которое ингибирует одну или несколько функций хемокинового рецептора млекопитающего (например, хемокинового рецептора человека), может быть введено для ингибирования (т.е. уменьшения или предотвращения) воспалительного или инфекционного заболевания. В результате чего один или несколько воспалительных процессов, таких как эмиграция лейкоцитов, адгезия, хемотаксис, экзоцитоз (например, ферментов, гистамина) или высвобождение медиатора воспаления ингибируется. Аналогичным образом, соединение по настоящему изобретению,которое стимулирует одну или несколько функций хемокинового рецептора млекопитающего (например,хемокина человека), вводят для стимуляции (индуцирование или усиление) иммунного или воспалительного ответа, такого как эмиграции лейкоцитов, адгезии, хемотаксиса, экзоцитоза (например, ферментов,гистамина) или высвобождения медиатора воспаления, в результате чего благоприятно стимулирует воспалительный процесс. Например, эозинофилы могут участвовать в борьбе с паразитарными инфекциями. Кроме того, лечение вышеупомянутых воспалительных, аллергических и аутоиммунных заболеваний также может рассматриваться для соединения по настоящему изобретению, которое стимулирует одну или несколько функций хемокинового рецептора млекопитающего, если предусматривается доставка достаточного количества соединения, чтобы вызвать утрату экспрессии рецептора на клетках путем индукции интернализации хемокинового рецептора или доставка соединения таким способом, который в результате приводит к дезориентации миграции клеток. В дополнение к приматам, таким как люди, различные другие млекопитающие можно лечить согласно способу по настоящему изобретению. К примеру, можно лечить млекопитающих, включая, но не ограничивающиеся ими, коров, овец, коз, лошадей, собак, кошек, морских свинок, крыс или другие виды рогатого скота, овечьих, лошадиных, собачьих, кошачьих, грызунов или мышиных. Однако способ можно применять для других видов, таких как птицы. Субъектом, которого лечат вышеуказанным способом,является млекопитающее, самец или самка, у которого модуляция активности хемокинового рецептора является желательной. Предполагается, что "модуляция" в данном контексте охватывает антагонизм,агонизм, неполный антагонизм и/или неполный агонизм. Заболевания или состояния человека или других видов, которые могут быть вылечены ингибиторами функции хемокинового рецептора, но не ограничиваясь ими, воспалительные или аллергические заболевания или состояния, включающие респираторные аллергические реакции, такие как астма, аллергический ринит, болезнь гиперчувствительности легких, гиперчувствительный пневмонит, эозинофильный панникулит (например, синдром Велла), эозинофильная пневмония (например, эндокардит Леффлера,хронический эозинофильный пневмонит), эозинофильный фасцит (например, синдром Шульмана), гиперчувствительность замедленного типа, интерстициальное заболевание легких (ILD) (например, идио- 15022395 патический легочный фиброз или ILD, связанный с ревматоидным артритом, системной красной волчанкой, анкилозирующим спондилоартритом, системным склерозом, синдромом Шегрена, полимиозитом или дерматомиозитом); общая анафилаксическая реакция или гиперчувствительная реакция, лекарственная аллергия (например, на пенициллин, цефалоспорин), синдром эозинофилии-миалгии в связи с приемом пищи загрязненного триптофана, аллергическая реакция на укус насекомого; аутоиммунные заболевания, такие как ревматоидный артрит, псориатический артрит, рассеянный склероз, системная красная волчанка, миастения гравис, ювенильный диабет; гломерулонефрит, аутоиммунный тиреоидит, болезнь Бехчета; отторжение трансплантата (например, при трансплантации), включая отторжение аллотрансплантата или реакция трансплантат против хозяина; воспалительные заболевания кишечника, такие как болезнь Крона и неспецифический язвенный колит; спондилоартропатия; склеродермия; псориаз (включающий псориаз, опосредованный Т-клетками) воспалительный дерматоз, такой как дерматит, экзема,атопический дерматит, аллергический контактный дерматит, аллергическая сыпь; васкулит (например,некротический, кожный и лейкоцитокластический васкулит); эозинофильный миозит, эозинофильный фасциит; раковые опухоли с лейкоцитарной инфильтрацией кожи или органов. Другие заболевания или состояния, в которых нежелательные воспалительные реакции должны быть ингибированы, могут быть вылечены, включая, но не ограничиваясь ими, реперфузионное повреждение, артросклероз, некоторые гемобластозы, цитокин-индуцированная токсичность (например, септический шок, эндотоксиновый шок), полимиозит, дерматомиозит. Инфекционные заболевания или состояния человека или других видов, которые можно лечить ингибиторами функции хемокинового рецептора, включают, но не ограничиваются ими, ВИЧ-инфекцию. Заболевания или состояния людей или других видов, которые можно лечить стимуляцией функции хемокинового рецептора, включают, но не ограничиваются ими, иммуносупрессию, такую как у лиц с синдромом иммунодефицита, такого как СПИД или другие вирусные инфекции, лица, подвергшиеся радиотерапии, химиотерапии, терапии для аутоиммунных заболеваний или лекарственной терапии (например, кортикостероидная терапия), что вызывает иммуносупрессию; иммуносупрессию в связи с врожденным отсутствием функции рецептора или другими причинами; и инфекционные заболевания, такие как паразитарные заболевания, включающие, но не ограничиваясь ими, гельминтные инфекции, такие как нематоды (круглые черви); (Трихофацелез (Trichuriasis), Энтеробиоз (Enterobiasis), Аскаридоз (Ascariasis), Анкилостомоз (Hookworm), Стронгилоидоз (Strongyloidiasis), Трихинеллез (Trichinosis), Филяриоз (filariasis); трематоды (сосальщики) (Бильгарциоз (Schistosomiasis), Клонорхоз (Clonorchiasis), цестоды (ленточные черви) (Эхинококкоз (Echinococcosis), Тениаринхоз (Taeniasis saginata), Цистицеркоз(Cysticercosis; висцеральные черви, висцеральная блуждающая личинка (например, Токсокара(Toxocara, эозинофильный гастроэнтерит (например, Anisaki sp., Phocanema sp.), кожные блуждающие личинки (Ancylostona braziliense, Ancylostoma caninum). Соединения по настоящему изобретению, соответственно, полезны в профилактике и лечении большого количества воспалительных, инфекционных и иммунорегуляторных расстройств и заболеваний. Кроме того, лечение вышеупомянутых воспалительных, аллергических и аутоиммунных заболеваний также может рассматриваться для стимуляции функции хемокинового рецептора, если предусматривается доставка достаточного количества соединения, чтобы вызвать утрату экспрессии рецептора на клетках путем индукции интернализации хемокинового рецептора или доставка соединения таким способом, который в результате приводит к дезориентации миграции клеток. В другом аспекте данное изобретение может применяться для оценки предполагаемых специфических агонистов и/или антагонистов сопряженных с G-белком рецепторов. Настоящее изобретение относится к применению соединения формулы (I) в подготовке и осуществлению анализа скрининга для соединений, которые модулируют активность хемокиновых рецепторов. Кроме того, соединение по настоящему изобретению является полезным в установлении или определении места связывания других соединений с хемокиновыми рецепторами, например путем конкурентного ингибирования или как эталон в анализе для сравнения его известной активности с неизвестной активностью. При разработке новых анализов и протоколов соединение согласно настоящему изобретению может применяться для изучения их эффективности. В частности,такого рода соединение может быть обеспечено в коммерческом наборе, например, для применения в фармацевтическом исследовании, относящемся к вышеупомянутым заболеваниям. Соединение по данному изобретению является также полезным для оценки предполагаемых специфических модуляторов хемокиновых рецепторов. Кроме того, можно применять соединение по настоящему изобретению для изучения специфичности сопряженных с G-белком рецепторов, которые не считаются хемокиновыми рецепторами, либо выступая в качестве примеров соединений, которые не связываются, либо как структурные варианты соединений, активных в отношении тех рецепторов, которые могут помочь установить специфические сайты взаимодействия. Соединение формулы (I) применяют для лечения или профилактики расстройств, выбранных из ревматоидного артрита, остеоартрита, септического шока, артросклероза, аневризмы, лихорадки, сердечно-сосудистых эффектов, гемодинамического шока, сепсиса, пост ишемического реперфузонного повреждения, малярии, болезни Крона, воспалительной болезни кишечника, микобактериальной инфекции,менингита, псориаза, острой сердечной недостаточности, фиброзной болезни, кахексии, отторжения трансплантата, аутоиммунного заболевания, кожного воспалительного заболевания, рассеянного склероза, радиационного повреждения, гипертоксического альвеолярного повреждения, ВИЧ-инфекции, ВИЧдеменции, инсулиннезависимого сахарного диабета, астмы, аллергического ринита, атопического дерматита, идиопатического легочного фиброза, буллезного пемфигоида, глистной паразитарной инфекции,аллергического колита, экземы, конъюнктивита, трансплантации, наследственной эозинофилии, эозинофильного панникудита, эозинофильной пневмонии, эозинофильного фасциита, эозинофильного гастроэнтерита, эозинофилии, обусловленной лекарствами, кистозного фиброза, синдрома Черджа-Стросса,лимфомы, болезни Ходжкина, карциномы толстой кишки, синдрома Фелти, саркоидоза, увеита, Альцгеймера, гломерулонефрита и красной системной волчанки. В другом аспекте соединение формулы (I) применяли для лечения или профилактики воспалительных состояний, выбранных из ревматоидного артрита, остеоартрита, артросклероза, аневризмы, лихорадки, сердечно-сосудистых эффектов, болезни Крона, воспалительного заболевания кишечника, псориаза, острой сердечной недостаточности, рассеянного склероза, аутоиммунного заболевания, кожного воспалительного заболевания. В другом аспекте соединение применяют для лечения или профилактики воспалительных состояний, выбранных из ревматоидного артрита, остеоартрита, артросклероза, болезни Крона, воспалительного заболевания кишечника и рассеянного склероза. Комплексная терапия для профилактики или лечения воспалительных, инфекционных или иммунорегуляторных расстройств или заболеваний, включающих астму и аллергические заболевания, а также аутоиммунные патологии, такие как ревматоидный артрит и артросклероз, и патологий, указанных выше,иллюстрируются с помощью сочетаний соединения настоящего изобретения и других соединений, которые приняты для такого применения. Например, для лечения или профилактики воспаления, настоящее соединение может применяться в сочетании с противовоспалительными или анальгезирующими веществами, такими как агонисты опиатов, ингибитор липоксигеназы, ингибитор циклооксигеназы-2, ингибитор интерлейкина, такого как ингибитор интерлейкина-1, ингибитор фактора некроза опухоли, антагонист NMDA, ингибитор или окись азота или ингибитор синтеза окиси азота, нестероидные противовоспалительные вещества, ингибитор фосфодиэстеразы или цитокин-супрессирующее противовоспалительное вещество, например, с соединением, таким как ацетаминофен, аспирин, кодеин, фентанил, ибупрофен, индометацин, кеторолак, морфин, напроксен, фенацетин, пироксикам, стероидное анальгезирующее средство, суфентанил, сунлиндак, интерферон альфа и подобное. Подобным образом соединение по настоящему изобретению может быть введено с анальгезирующим средством, потенцирующем средством,таким как кофеин, Н 2-антагонист, симетикон, гидроксид алюминия или магния; противоотечным средством, таким как фенилэфрин, фенилпропаноламин, псевдофедрин, оксиметазолин, эпинефрин, нафазолин,ксилометазолин, пропилгекседрин или леводезокси-эфедрин; и противокашлевыми средствами, такими как кодеин, гидрокодон, карамифен, карбетапентан или декстрометорфан; диуретиками; и седативными или не седативными антигистаминными средствами. Кроме того, соединение формулы (I) может применяться в сочетании с другими лекарственными средствами, которые применяются в лечении/профилактики/супрессии или улучшении заболеваний или состояний, для которых применяется соединение по настоящему изобретению. Такого рода другие лекарственные средства могут быть введены способом и в количестве, которые применяются обычно, одновременно или последовательно с соединением по настоящему изобретению. Когда соединение формулы (I) применяют одновременно с одним или несколькими другими лекарственными средствами, может применяться фармацевтическая композиция,содержащая такого рода другие лекарственные средства в дополнении к соединению формулы (I). Соответственно, фармацевтические композиции по настоящему изобретению включают такие композиции,которые также содержат один или несколько активных ингредиентов в дополнении к соединению формулы (I). Примерами других активных ингредиентов могут быть сочетания с соединением по настоящему изобретению, либо вводимые отдельно, либо в той же фармацевтической композиции, включая, но не ограничиваясь ими: (а) антагонист интегрина, такие как антагонисты селектинов, ICAMs и VLA-4; (б) стероиды, такие как беклометазон, метилпреднизолон, бетаметазон, преднизон, дексаметазон и гидрокортизон; (в) иммунодепрессанты, такие как циклоспорин, такролимус, рапамицин и другие иммунодепрессанты типа FK-506; (г) антигистаминные средства (антагонисты Н 1-гистамина), такие как бромофенирамин, хлорфенирамин, дексхлорфенирамин, трипролидин, клемастин, дифенгидрамин, дифенилпиралин, трипелленнамин, гидроксизин, метдилазин, прометазин, тримепразин, азатадин, ципрогептадин,антазолин, фенирамин пириламин, астемизол, терфенадин, лоратадин, цетиризин, фексофеадин, дескарбоэтоксилоратадин и тому подобное; (д) нестероидные противоастматические средства, такие как b2 агонист (тербуталин, метапротеренол, фенотерол, изоэтарин, альбутерал, битолтерол и пирбутерол), теофиллин, кромолин натрия, атропин, ипатропия бромид, антагонисты лейкотриена (зафирлукаст, монтелукаст, пранлукаст, иралукаст, побилукаст, SKB-102.203), ингибиторы биосинтеза лейкотриенов (зилейтон, BAY-1005); (е) нестероидные противовоспалительные вещества (NSAIDs), такие как производные пропионовой кислоты (алминопрофен, бенкапрофен, буклоксовая кислота, карпрофен, фенбуфен, фенопрофен, флупрофен, флурбипрофен, ибупрофен, индопрофен, кетопрофен, миропрофен, напроксен, ок- 17022395 сапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновая кислота и тиоксапрофен), производные уксусной кислоты (индометацин, ацеметацин, алклофенак, клиданак, диклофенак, фенклофенак, фенклозиновая кислота, фентиазак, фурофенак, ибуфенак, изоксепак, окспинак, сулиндак, тиопинак, тольметин,зидометацин и зомепирак), производные фенамовой кислоты (флуфенамовая кислота, меклофенамовая кислота, мефенамовая кислота, нифлумовая кислота и толфенамовая кислота), производные бифенилкарбоновой кислоты (дифлунизал и флуфенизал), оксикамы (изоксикам, пироксикам, судоксикам и теноксикам), салицилаты (ацетилсалициловая кислота, сульфасалазин) и пиразолоны (апазон, безпиперилон, фепразон, мофебутазон, оксифенбутазон, фенилбутазон); (ж) ингибиторы циклооксигеназы-2 (СОХ 2); (з) ингибиторы фосфодиэстеразы IV типа (PDE-IV); (и) другие антагонисты хемокиновых рецепторов;(к) снижающие холестерин вещества, такие как ингибиторы HMG-CoA-редуктазы (ловастатин, симвастатин и правастатин, флувастатин, аторвастатин и другие статины), усилители экскреции (холестирамин и колестипол), никотиновая кислота, производные фенофибриновой кислоты (гемфиброзил, клофибрат,фенофибрат и бензафибрат) и пробукол; (л) противодиабетические средства, такие как инсулин, сульфонилмочевины, бигуаниды (метформин), инигибиторы а-глюкозидазы (акарбоза) и глитазоны (троглитазон и пиоглитазон); (м) препараты интерферонов (интерферон альфа-2 а, интерферон-2 В, интерферон альфа-N3, интерферон бета-1 а, интерферон бета-1b, интерферон гамма-1b); (н) противовирусные соединения, такие как эфавиренз, невирапин, индинавир, ганцикловир, ламивудин, фамцикловир и залцитабин; (о) другие соединения, такие как 5-аминосалициловая кислота и ее производные, антиметаболиты,такие как азатриоприн и 6-меркаптопурин и цитотоксические химиопрепараты для лечения рака. Весовое отношение соединения формулы (I) к второму действующему ингредиенту может быть различным и зависеть от эффективной дозы каждого ингредиента. Обычно применяют эффективную дозу каждого ингредиента. Таким образом, например, когда соединение формулы (I) в сочетании с NSAID, весовое отношение соединения по настоящему изобретению к NSAID, обычно находится в диапазоне от приблизительно 1000:1 до приблизительно 1:1000 или же от приблизительно 200:1 до приблизительно 1:200. Сочетания соединения формулы (I) и других активных ингредиентов обычно также находятся в вышеупомянутом диапазоне, но в каждом отдельном случае должна применяться эффективная доза каждого действующего ингредиента. Соединение вводят млекопитающему в терапевтически эффективном количестве. "Терапевтически эффективное количество" означает количество соединения формулы I, которое при введение в отдельности или в сочетании с дополнительным терапевтическим средством млекопитающему, является эффективным для профилактики или улучшения тромбоэмболических заболеваний или прогрессирование заболевания. Дозировка и лекарственная форма. Соединение по настоящему изобретению может быть введено в таких лекарственных формах для перорального введения как таблетки, капсулы (каждая из которых включает препараты с замедленным высвобождением или с регулируемым по времени высвобождением), пилюли, порошки, гранулы, эликсиры, настойки, суспензии, сиропы и эмульсии. Возможно также вводить в виде внутривенной (болюс или вливание), внутрибрюшинной, подкожной или внутримышечной форме, причем все используемые дозированные лекарственные формы хорошо известны специалистам в области фармацевтики. Возможно также вводить отдельно, но обычно их вводят с фармацевтическим носителем, выбранным на основе способа введения и стандартной фармацевтической практики. Режим дозирования для соединения по настоящему изобретению будет, конечно, изменяться в зависимости от известных факторов, таких как фармакодинамические характеристики конкретного вещества и его способа и пути введения; вида, возраста, пола, состояния здоровья, медицинский показаний и массы пациента, получающего лечение; природы и степени симптомов; разновидности сопутствующего лечения; частоты лечения; способа введения, функции почек и печени пациента, и желаемый эффект. Врач или ветеринар могут определить и назначить эффективное количество лекарственного средства,необходимое для профилактики, противодействия и остановки прогрессирования тромбоэмболического расстройства. В качестве общего рекомендации, ежедневная пероральная доза каждого действующего ингредиента, при применении для указанных эффектов, будет составлять между приблизительно 0,001 до 1000 мг/кг массы тела, или между приблизительно 0,01 до 100 мг/кг массы тела в день, или, альтернативно, между приблизительно 1,0 до 20 мг/кг/день. При внутривенном введении доза будет составлять приблизительно 1 до приблизительно 10 мг/кг/мин при вливании с постоянной скоростью. Соединение по настоящему изобретению может быть введено в виде однократной суточной дозы или общая суточная доза может вводиться раздельными дозами два, три или четыре раза в день. Соединение по настоящему изобретению может быть введено в интраназальной форме с использованием локального применения интраназальных носителей или с использованием трансдермального способа применения с помощью трансдермальных пластырей. При введении в форме трансдермальной системы доставки, вводимая дозировка будет скорее непрерывной, нежели меняющейся. Соединение, обычно, вводят в смеси с подходящими фармацевтическими растворителями, наполнителями или носителями (все вместе называемые в настоящей заявке как фармацевтические носители) соответственно выбираемые относительно предполагаемой формы введения, включая таблетки для пе- 18022395 рорального приема, капсулы, эликсиры, сиропы и тому подобное, и в соответствии с общепринятой фармацевтической практикой. Например, для перорального введения в форме таблетки или капсулы, действующий компонент препарата может быть в сочетании с пероральным, нетоксичным, фармацевтически приемлемым, инертным носителем, таким как лактоза, крахмал, сахароза, глюкоза, метилцеллюлоза, стеарат магния, дикальцийфосфат, сульфат кальция, маннитол, сорбитол и тому подобное; для перорального введения в жидкой форме компоненты перорального препарата могут быть в сочетании с любым пероральным, нетоксичным, фармацевтически приемлемым инертным носителем, таким как этанол, глицерол, вода и тому подобное. Кроме того, по желанию или при необходимости, в смесь можно добавлять подходящие связующие вещества, скользящие вещества, вещества для улучшения распадаемости таблеток и красящие вещества. Подходящие связующие вещества включают крахмал, желатин, натуральные сахара, такие как глюкоза или бета-лактоза, кукурузные подсластители, натуральные и синтетические смолы, такие как аравийская камедь, трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, парафины и тому подобное. Скользящие вещества, применяемые в этих готовых лекарственных формах,включают олеиновокислый натрий, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и тому подобное. Вещества, способствующие расщеплению включают, без ограничения,крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и тому подобное. Соединение по настоящему изобретению может также быть введено в форме липосомной системы доставки, такой как небольшие однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Липосомы могут быть получены из различных фосфолипидов, таких как холестерин, стеариламин, или фосфатидилхолинов. Соединение по настоящему изобретению может также быть в сочетании с растворимыми полимерами как наводимыми лекарственными носителями. Такие полимеры могут включать поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенные остатками пальмитоила. Кроме того, соединения по настоящему изобретению могут быть в сочетании с классом биоразлагаемых полимеров, используемые для достижения контролируемого высвобождения лекарственного средства, например полимолочная кислота, полигликолевая кислота, сополимеры на основе полимолочной и полигликолевой кислот, полиэпсилон капролактон, полигидрокси масляная кислота, полиортоэфиры, полиацетали, полидигиропираны,полицианоацилаты и сшитые или алифатические блок-сополимеры гидрогелей. Лекарственные формы (фармацевтические композиции), пригодные для введения могут содержать от приблизительно 1 до приблизительно 100 мг действующего ингредиента на единицу дозирования. В этих фармацевтических композициях действующий ингредиент обычно присутствует в количестве приблизительно 0,5-95 мас.% исходя из общего веса композиции. Желатиновые капсулы могут содержать действующий ингредиент и порошкообразные носители, такие как лактоза, крахмал, производные целлюлозы, стеарат магния, стеариновая кислота и тому подобное. Аналогичные растворители могут применяться для получения прессованных таблеток. Как таблетки, так и капсулы могут быть получены как продукты с замедленным высвобождением для обеспечения непрерывного высвобождения лекарства в течение нескольких часов. Прессованные таблетки могут быть покрыты сахарной оболочкой или пленочной оболочкой для маскировки любого неприятного вкуса и защита таблетки от воздуха или покрыты энтеросолюбильной оболочкой для селективного расщепления в желудочно-кишечном тракте. Жидкие лекарственные формы для перорального введения могут содержать красители и ароматизаторы, чтобы быть более приемлемыми для пациента. Обычно вода, подходящее масло, солевой раствор, водный раствор декстрозы (глюкозы) и другие растворы сахаров и гликолей, таких как пропиленгликоль или полиэтиленгликоли, являются подходящими носителями для растворов для парентального введения. Растворы для парентального введения могут содержать водорастворимые соли действующего ингредиента, подходящие стабилизирующие вещества и, при необходимости, буферные вещества. Антиоксиданты, такие как бисульфит натрия, сульфит натрия или аскорбиновая кислота, либо в отдельности или в сочетании, являются подходящими стабилизирующими веществами. Также применяют лимонную кислоту и ее соли и ЭДТА натрия. Кроме того,растворы для парентального введения могут содержать консерванты, такие как бензалконий хлорид, метил- или пропилпарабен и хлорбутанол. Подходящие фармацевтические носители описаны в Remington's Pharmaceutical Sciences, Mack Publishing Company, стандартном руководстве в этой области. Представители пригодных лекарственных форм для введения соединений по настоящему изобретению указаны ниже. Капсулы. Большое количество унифицированных капсул можно приготовить путем заполнения стандартных двух частей твердых желатиновых капсул, каждая по 100 мг порошкообразного действующего ингредиента, 150 мг лактозы, 50 мг целлюлозы и 6 мг стеарата магния. Мягкие желатиновые капсулы. Смесь действующего ингредиента в легкоусвояемом масле, таком как соевое масло, хлопковое мас- 19022395 ло и оливковое масло, могут быть получено и введено с помощью поршневого насоса в желатин для формирования мягких желатиновых капсул, содержащих 100 мг действующего ингредиента. Капсулы следует промыть и высушить. Таблетки. Таблетки можно приготовить с помощью общеизвестных способов так, что единичная доза будет содержать 100 мг действующего ингредиента, 0.2 мг коллоидного диоксида кремния, 5 мг стеарата магния, 275 мг микрокристаллической целлюлозы, 11 мг крахмала и 98,8 мг лактозы. Соответствующие оболочки могут применяться для увеличения вкусовых качеств или замедления всасывания. Лекарственная форма для инъекций. Композиция для парентального введения, подходящая для введения путем инъекции, может быть получена перемешиванием 1,5 вес.% действующего ингредиента в 10 об.% пропиленгликоля и воды. Раствор следует сделать изотоническим с помощью хлорида натрия и стерилизовать. Суспензия. Водный раствор суспензии для перорального введения можно приготовить так, что в каждых 5 мл такой суспензии содержится 100 мг мелкодисперсного действующего ингредиента, 200 мг натриевой карбоксиметилцеллюлозы, 5 мг бензоата натрия, 1,0 г раствора сорбитола, U.S.Р. и 0,025 мл ванилина. Если соединение по настоящему изобретению в сочетании с другими антикоагулянтами, например,ежедневная доза может быть от приблизительно 0,1 до 100 мг соединения формулы I и приблизительно 7,5 мг второго антикоагулянта на 1 кг массы тела пациента. Для лекарственной формы в виде таблеток соединение по настоящему изобретению обычно может присутствовать в количестве от приблизительно 5 до 10 мг на единицу дозы, а второй антикоагулянт в количестве от приблизительно 1 до 5 мг на единицу дозы. Когда два или более вышеупомянутых вторых терапевтических вещества вводят с соединением формулы I, как правило, количество каждого компонента в обычной ежедневной дозе и обычной готовой лекарственной форме может быть снижено по сравнению с обычной дозой вещества при введении его отдельно с учетом дополнительного или синергетического эффекта терапевтических веществ при введении в сочетании. Особенно, когда предусмотрена в виде однократной лекарственной формы, существует потенциальная возможность для химического взаимодействия между объединенными действующими ингредиентами. Поэтому, когда соединение формулы I и второе терапевтическое вещество объединяют в однократную лекарственную форму, их готовят так, что, хотя действующие ингредиенты смешаны в единой лекарственной форме, физический контакт между действующими ингредиентами сведен к минимуму (то есть уменьшен). Например, один действующий ингредиент может быть покрыт энтеросолюбильной оболочкой. С помощью энтеросолюбильной оболочки одного действующего ингредиента можно не только свести к минимуму контакт между объединенными действующими веществами, но также можно контролировать высвобождение одного из этих компонентов в желудочно-кишечном тракте, так что один из этих компонентов не высвобождается в желудке, а высвобождается в кишечнике. Один из активных ингредиентов может также быть покрыт материалом, который влияет на пролонгированное высвобождение по всему желудочно-кишечному тракту, а также позволяет свести к минимуму физический контакт между объединенными действующими ингредиентами. Кроме того, компонент с пролонгированным высвобождением может быть дополнительно покрыт энтеросолюбильной оболочкой с тем,чтобы высвобождение этого компонента происходило только в кишечнике. Еще один подход включает получение композиции комбинированного лекарственного средства, в котором один компонент покрыт полимером для пролонгированного высвобождения и/или высвобождения в кишечнике, а другой компонент также покрыт полимером, таким как гидроксипропилметилцеллюлоза низкой степени вязкости(НРМС), или другими подходящими материалами, известными в данной области техники, с целью дальнейшего разделения активных компонентов. Полимерные покрытия предназначены для формирования дополнительного барьера для взаимодействия с другим компонентом. Эти способы, а также другие пути минимизации контакта между компонентами комбинированных лекарственных средств по настоящему изобретению, которые вводят в единой лекарственной форме или вводят в виде раздельных форм, но одновременно и одинаковым способом, будут очевидны для специалиста в данной области техники. Хотя изобретение было описано подробно и в отношении конкретных вариантов его осуществления, для специалиста в данной области техники будет очевидно, что различные варианты и модификации могут быть произведены без отступления от существа и объема настоящего изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его фармацевтически приемлемая соль. 2. Фармацевтическая композиция для ингибирования активности хемокина или хемокинового рецептора, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по п.1. 3. Способ ингибирования активности хемокина или хемокинового рецептора, включающий введение пациенту терапевтически эффективного количества соединения по п.1. 4. Способ по п.3, отличающийся тем, что хемокин представляет собой хемокин СС-1, а хемокиновый рецептор представляет собой хемокиновый рецептор CCR-1. 5. Способ лечения воспалительного заболевания, включающий введение пациенту терапевтически эффективного количества соединения по п.1. 6. Способ лечения или предотвращения воспалительных заболеваний у пациента, где воспалительное заболевание выбрано из остеоартрита, лихорадки, болезни Крона, идиопатического легочного фиброза, воспалительных заболеваний кишечника, альвеолита, неспецифического язвенного колита, нефротоксического сывороточного нефрита, гломерулонефрита, астмы, ревматоидного артрита, рестеноза и кожного воспалительного заболевания, включающий введение указанному пациенту терапевтически эффективного количества соединения по п.1. 7. Способ ингибирования активности хемокина или хемокинового рецептора, включающий введение пациенту терапевтически эффективного количества композиции по п.2. 8. Способ ингибирования активности рецептора CCR-1, включающий введение пациенту терапевтически эффективного количества композиции по п.2. 9. Способ лечения воспалительного заболевания, включающий введение пациенту терапевтически эффективного количества композиции по п.2. 10. Способ лечения или предотвращения воспалительных заболеваний у пациента, где воспалительное заболевание выбрано из остеоартрита, лихорадки, болезни Крона, идиопатического легочного фиброза, воспалительных заболеваний кишечника, альвеолита, неспецифического язвенного колита,нефротоксического сывороточного нефрита, гломерулонефрита, астмы, ревматоидного артрита, рестеноза и кожного воспалительного заболевания, включающий введение указанному пациенту терапевтически эффективного количества композиции по п.2 для лечения.
МПК / Метки
МПК: C07D 211/52
Метки: рецептора, пиперидинила, соединение, хемокинового, качестве, активности, модулятора
Код ссылки
<a href="https://eas.patents.su/22-22395-soedinenie-piperidinila-v-kachestve-modulyatora-aktivnosti-hemokinovogo-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Соединение пиперидинила в качестве модулятора активности хемокинового рецептора</a>
Предыдущий патент: Устройство впрыска маслорастворимых присадок
Следующий патент: Способ очистки рекомбинантного эритропоэтина человека (epo), эритропоэтин, очищенный данным способом, и фармацевтические композиции, содержащие такой эритропоэтин
Случайный патент: Способ изменения тягового усилия подъемных механизмов и устройство для его осуществления (его варианты)