Селективные модуляторы рецептора, активируемого пролифератором пероксисом
Номер патента: 9023
Опубликовано: 26.10.2007
Авторы: Мартин-Ортега Фингер Мария Делорес, Ферритто-Креспо Рафаэль
Формула / Реферат
1. Соединение структурной формулы I
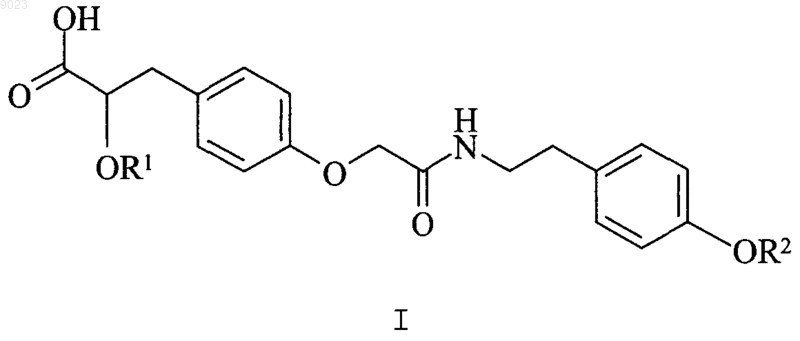
или его фармацевтически приемлемая соль, сольват, гидрат или стереоизомер, где R1 и R2 независимо друг от друга представляют собой метил или этил.
2. Соединение по п.1, где структурная формула представлена формулой II
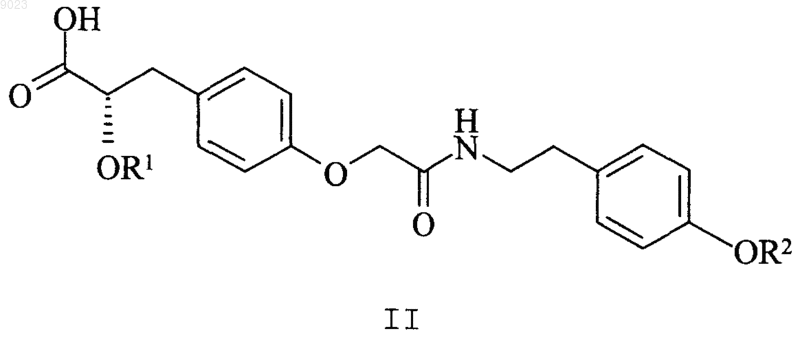
или его фармацевтически приемлемая соль, сольват, гидрат или стереоизомер, где R1 и R2 независимо друг от друга представляют собой метил или этил.
3. Соединение по п.2, представляющее собой (2S)-3-(4-{[2-(4-метоксифенил)этилкарбамоил]метокси}фенил)-2-метоксипропионовую кислоту структурной формулы III
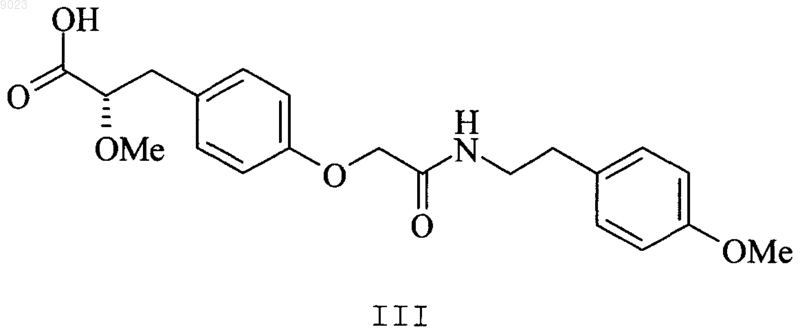
или ее фармацевтически приемлемую соль, сольват или гидрат.
4. Соединение по п.1, представляющее собой 3-(4-{[2-(4-этоксифенил)этилкарбамоил]метокси}фенил)-2-метоксипропионовую кислоту структурной формулы IV
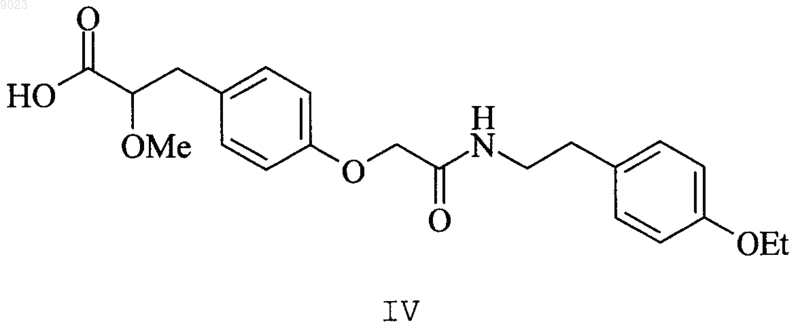
или ее фармацевтически приемлемую соль, сольват или гидрат.
5. Соединение по п.4, представляющее собой (S)-3-(4-{[2-(4-этоксифенил)этилкарбамоил]метокси}фенил)-2-метоксипропионовую кислоту структурной формулы V
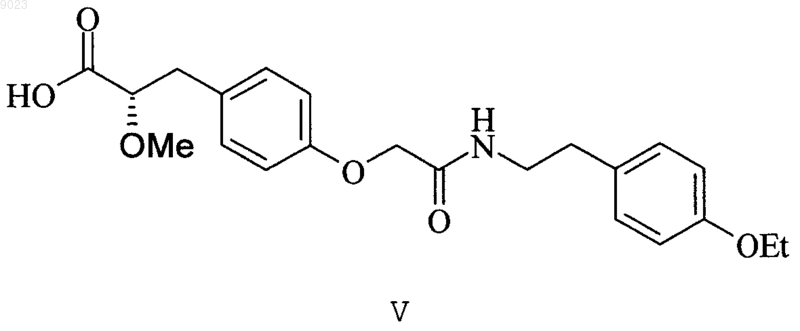
или ее фармацевтически приемлемую соль, сольват или гидрат.
6. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и соединение по любому из пп.1-5 или его фармацевтически приемлемую соль, сольват или гидрат.
7. Фармацевтическая композиция, включающая:
(1) соединение по любому из пп.1-5 или его фармацевтически приемлемую соль, сольват, гидрат или стереоизомер,
(2) второй терапевтический агент, выбранный из инсулиносенсибилизаторов, производных сульфонилмочевины, бигуанидов, меглитинидов, тиазолидиндионов, ингибиторов a-глюкозидазы, стимуляторов секреции инсулина, инсулина, антигиперлипидемических агентов, средств для повышения уровня ЛПВП в плазме, ингибиторов ГМГ-КоА редуктазы, статинов, ингибиторов акрил-КоА:холестеринацил-трансферазы, соединений против ожирения, антигиперхолестеринемических средств, фибратов, витаминов и аспирина (ацетилсалициловой кислоты), и
(3) необязательно, фармацевтически приемлемый носитель.
8. Композиция для применения для лечения заболевания или состояния у млекопитающего, выбранного из гипергликемии, дислипидемии, диабета II типа, диабета I типа, гипертриглицеридемии, синдрома X, инсулинорезистентности, сердечной недостаточности, диабетической дислипидемии, гиперлипидемии, гиперхолестеринемии, гипертензии, ожирения, нейрогенной булимии, нервной анорексии, сердечно-сосудистых заболеваний и других заболеваний, составляющей которых является инсулинорезистентность, включающего введение эффективного количества соединения по любому из пп.1-5; и эффективного количества второго терапевтического агента, выбранного из инсулиносенсибилизаторов, производных сульфонилмочевины, бигуанидов, меглитинидов, тиазолидиндионов, ингибиторов a-глюкозидазы, стимуляторов секреции инсулина, инсулина, антигиперлипидемических агентов, средств для повышения уровня ЛПВП в плазме, ингибиторов ГМГ-КоА редуктазы, статинов, ингибиторов акрил-КоА:холестеринацилтрансферазы, соединений против ожирения, антигиперхолестеринемических средств, фибратов, витаминов и аспирина (ацетилсалициловой кислоты).
9. Применение соединения по любому из пп.1-5 или его фармацевтически приемлемой соли, сольвата или гидрата для получения лекарственного средства для лечения состояния, модулированного PPAR.
10. Применение соединения по любому из пп.1-5 или его фармацевтически приемлемой соли, сольвата или гидрата для получения лекарственного средства для лечения диабета.
11. Применение соединения по любому из пп.1-5 или его фармацевтически приемлемой соли, сольвата или гидрата для получения лекарственного средства для лечения заболевания, выбранного из гипергликемии, дислипидемии, диабета II типа, диабета I типа, гипертриглицеридемии, синдрома X, инсулинорезистентности, сердечной недостаточности, диабетической дислипидемии, гиперлипидемии, гиперхолестеринемии, гипертензии, ожирения, нейрогенной булимии, нервной анорексии, сердечно-сосудистого заболевания и других заболеваний, составляющей которых является инсулинорезистентность.
Текст
009023 Область изобретения Данное изобретение к соединению, которое является селективным модулятором рецепторов, активируемых пролифератором пероксисом (SPPARM), более специфически к соединению, которое является частичным агонистом PPAR гамма, полезным для лечения и/или профилактики расстройств, модулируемых PPAR. Уровень техники Рецепторы, активируемые пролифератором пероксисом (PPAR), являются членами семейства генов ядерных рецепторов, которые активируются жирными кислотами и метаболитами жирных кислот. PPAR принадлежат к подгруппе ядерных рецепторов, которые функционируют в виде гетеродимеров с рецептором 9-цис-ретиноевой кислоты (RXR). У большого количества видов, от Xenopus до человека, найдены три подтипа таких рецепторов, названные PPAR, PPAR и PPAR.PPAR представляет собой преобладающий подтип в печени, что облегчает понимание механизма,по которому пролифераторы пероксисом оказывают свое плейотропное действие. PPAR активируется многими жирными кислотами со средней и длинной цепью и принимает участие в стимуляции -окисления жирных кислот. PPAR также связывают с действием фибратов и жирных кислот у грызунов и человека. Производные фибриновой кислоты, такие как клофибрат, фенофибрат, безафибрат, ципрофибрат,беклофибрат и этофибрат, как и гемфиброзил, вызывают значительное снижение содержания триглицеридов в плазме вместе с умеренным снижением холестерина липопротеинов низкой плотности (ЛПНП) и особенно применяются для лечения гипертриглицеридемии.PPAR представляет собой преобладающий подтип в жировой ткани, который принимает участие в активации программы дифференциации адипоцитов. PPAR не участвует в стимуляции пролиферации пероксисом в печени. Существуют два изомера PPAR: PPAR1 и PPAR2, которые различаются только тем, что PPAR2 содержит дополнительные 28 аминокислот, представленные на аминоконце. ДНК последовательность рецепторов PPAR описана в работе Elbrecht, et al., BBRC 224; 431-437 (1996). Хотя пролифераторы пероксисом, в том числе фибраты и жирные кислоты, активируют транскрипционное действие PPAR, только производные простагландина J2 были идентифицированы как природные лиганды для PPAR, которые также связываются с антидиабетическими агентами тиазолидиндионами с высокой степенью сродства. Физиологические функции PPAR и PPAR в метаболизме липидов и углеводов оставались неясными до тех пор, пока не было выяснено, что они представляют собой рецепторы для лекарственных средств-производных фибрата и глитазона, соответственно. Рецепторы PPAR и PPAR вовлечены в механизм сахарного диабета, сердечно-сосудистых заболеваний, ожирения и желудочно-кишечных заболеваний, таких как воспалительное заболевание кишечника и другие заболевания, связанные с воспалением. Такие заболевания, связанные с воспалением,включают, не ограничиваясь ими, болезнь Альцгеймера, болезнь Крона, ревматоидный артрит, псориаз и ишемическое реперфузионное повреждение. Наоборот, не сообщалось о том, что PPAR (которые также называют PPAR и NUC1) являются рецепторами для какого-нибудь из известных классов молекул лекарственных средств, и их роль в физиологии млекопитающих остается неясной. Ген человеческого ядерного рецептора PPAR (hPPAR) был клонирован из библиотеки кДНК клеток остеосаркомы человека и полностью описан в работе A. Schmidt et al., Molecular Endocrinology, 6: 1634-1641 (1992). Диабет представляет собой заболевание, при котором нарушается способность млекопитающих регулировать уровень глюкозы в крови вследствие того, что у млекопитающего снижается способность превращать глюкозу в гликоген для хранения в клетках мышц и печени. При диабете I типа снижение способности запасать глюкозу вызвано сниженной выработкой инсулина. Диабет II типа или инсулиннезависимый сахарный диабет (ИНЗСД) представляет собой форму диабета, которая возникает в результате выраженной/полной резистентности к стимуляции инсулином или его регулирующему действию на метаболизм глюкозы и липидов в основных тканях, чувствительных к действию инсулина, - мышечной, печеночной и жировой ткани. Такая резистентность к действию инсулина приводит к недостаточной активации инсулином захвата глюкозы, ее окисления и хранения в мышцах и к неадекватности подавления инсулином расщепления жиров в жировой ткани, а также выработки и выделения глюкозы печенью. Когда эти клетки становятся нечувствительными к инсулину, организм пытается компенсировать это выработкой аномально высоких количеств инсулина с возникновением гиперинсулинемии. Гиперинсулинемия ассоциируется с гипертензией и повышенной массой тела. Поскольку инсулин участвует в стимуляции захвата глюкозы, аминокислот и триглицеридов из крови чувствительными к инсулину клетками, нечувствительность к действию инсулина может приводить к повышению уровней триглицеридов и ЛПНП (известных как плохой холестерин), что является факторами риска сердечнососудистых заболеваний. Созвездие симптомов, которое включает гиперинсулинемию в сочетании с гипертензией, повышенную массу тела, повышенный уровень триглицеридов и повышенный уровень ЛПНП, известно как синдром X. Гиперлипидемия представляет собой состояние, которое характеризуется аномальным повышением липидов сыворотки, таких как холестерин, триглицериды и фосфолипиды. Эти липиды не циркулируют свободно растворенными в плазме, но находятся в связанном состоянии с белками плазмы и транспортируются в виде макромолекулярных комплексов, которые называют липопротеинами. Одной из форм ги-1 009023 перлипидемии является гиперхолестеринемия, которая характеризуется наличием повышенных уровней холестерина ЛПНП. Начальное лечение гиперхолестеринемии часто представляет собой диету с низким содержанием жиров и холестерина в сочетании с надлежащей физической нагрузкой. Если целевые значения снижения ЛПНП не достигаются с помощью диеты и физических упражнений, применяется медикаментозное лечение. Желательным является снизить повышенные уровни холестерина ЛПНП и повысить уровни холестерина липопротеинов высокой плотности (ЛПВП). В целом, было обнаружено, что повышенные уровни ЛПВП ассоциировались с более низким риском коронарного заболевания сердца(1991); и Kannel, et al., Ann. Internal. Med., 90, 85-91 (1979). Примером агента, повышающего уровень ЛПВП, является никотиновая кислота, но прием ее в необходимых количествах для повышения ЛПВП ассоциировался с нежелательными эффектами, такими как приливы. В настоящее время существуют различные способы и средства для лечения сахарного диабета, но они все еще остаются неудовлетворительными и имеют ограничения. Хотя физические упражнения и уменьшение потребляемого количества калорий будут улучшать состояние больных диабетом, выполнение предписаний врача при этой методике может быть недостаточным вследствие сидячего образа жизни и избыточного потребления пищи, особенно продуктов с высоким содержанием жиров. Таким образом,назначение гипогликемических средств, таких как производные сульфонилмочевины (например, хлорпропамид, толбутамид, толазамид и ацетогексамид) и бигуаниды (например, фенформин и метформин) часто становится необходимым по мере прогресса заболевания. Производные сульфонилмочевины стимулируют -клетки поджелудочной железы вырабатывать больше инсулина по мере прогресса заболевания. Однако ответ -клеток практически всегда прекращается со временем и возникает необходимость в инъекциях инсулина. Кроме того, лечение как производными сульфонилмочевины, так и инъекциями инсулина может вызывать опасный для жизни побочный эффект в виде гипогликемической комы,поэтому пациенты, получающие такое лечение, должны тщательно контролировать дозы препаратов. Хорошо показано, что улучшение контроля гликемии у пациентов с диабетом (I и II типа) сопровождается уменьшением микрососудистых осложнений (DCCT и UKPDS). Из-за трудности обеспечения адекватного контроля гликемии на протяжении длительного времени в лечении больных диабетом II типа все чаще применяются инсулиносенсибилизаторы. Существуют также все большие доказательства того, что агонист PPAR - инсулиносенсибилизатор - может давать дополнительные преимущества в лечении диабета II типа, помимо улучшения контроля гликемии. В последнее десятилетие соединения класса тиазолидиндионов (TZD) (например, патенты США 5089514; 4342771; 4367234; 4340605; и 5306726) выходят на первый план как эффективные антидиабетические агенты, которые показали способность повышать чувствительность инсулинчувствительных тканей, таких как скелетные мышцы, печень и жировая ткань, к инсулину. Повышение чувствительности к инсулину скорее, чем количество инсулина в крови, снижает вероятность гипогликемической комы. Хотя тиазолидиндионы показали способность повышать чувствительность к инсулину путем связывания с рецепторами PPAR, лечение ими также вызывает нежелательные побочные эффекты, такие как увеличение массы тела и отеки, а в случае троглитазона - токсическое действие на печень. Действие частичного агониста PPAR может стать отчетливым преимуществом, поскольку множество исследований показали, что частичные агонисты PPAR, включая селективные модуляторы PPAR(SPPARM) обладают улучшенным профилем побочного действия в сравнении с полными агонистами,особенно с точки зрения увеличения массы тела и отеков. См. Rocchi S. et al., Molecular Cell, 8: 737-747(2000); Chakrabarti R., et al., Diabetes 52 (Suppl. 1), p. 601 (Abstract) (2003); Kawai T., et al., Metabolism, 48: 1102-1107 (1999); and Wulff E., et al., Diabetes 52 (Suppl. 1), p. 594 (abstract) (2003). Сообщалось, что соединения нетиазолидиндионовой структуры также могут выступать в качестве модуляторов PPAR. Adams et al. (WO 97/28115, WO 97/28135 и патент США 5895051) раскрывает ацетилфенолы, полезные в качестве соединений против ожирения и антидиабетических агентов. Leibowitz etal. (WO 97/28149) раскрывает соединения, которые являются агонистами PPAR и полезны для лечения сердечно-сосудистых заболеваний и родственных состояний. Brooks et al. (WO 02/100813) раскрывает соединения модуляторы PPAR, полезные в лечении диабета II типа и других PPAR-опосредованных заболеваний и состояний. Ferritto Crespo et al. (WO 2004/000789) раскрывает соединение амидный линкер модуляторов PPAR. С учетом вышеизложенного, целью данного изобретения является создание новых фармацевтических агентов, которые модулируют PPAR рецепторы, для профилактики лечения и/или облегчения этих заболеваний или состояний при уменьшении одного или более нежелательных побочных эффектов, ассоциированных с существующими способами и средствами лечения. Краткое описание изобретения Воплощение данного изобретения представляет собой соединение селективный модулятор рецепторов, активируемых пролифератором пероксисом (SPPARM) или соединение, оказывающее действие частичного агониста PPAR структурной формулы I или его фармацевтически приемлемую соль, сольват, гидрат или стереоизомер, где R1 и R2 независимо друг от друга представляют собой метил или этил. Соединения по данному изобретению являются полезными при лечении и/или профилактике заболеваний или состояний, связанных с гипергликемией, дислипидемией, диабетом II типа, диабетом I типа,гипертриглицеридемией, синдромом X, инсулинорезистентностью, сердечной недостаточностью, диабетической дислипидемией, гиперлипидемией, гиперхолестеринемией, гипертензией, ожирением, нейрогенной булимией, нервной анорексией, сердечно-сосудистыми заболеваниями и другими заболеваниями,компонентом которых является инсулинорезистентность. В одном воплощении данное изобретение также относится к фармацевтической композиции, включающей соединение по данному изобретению или его фармацевтически приемлемую соль, сольват или гидрат и фармацевтически приемлемый носитель. В границах данного изобретения также находится фармацевтическая композиция, содержащая дополнительный терапевтический агент, а также соединение по данному изобретению или его фармацевтически приемлемую соль, сольват или гидрат и необязательно фармацевтически приемлемый носитель. В другом воплощении данное изобретение относится к способу модулирования PPAR путем контакта рецептора с соединением по данному изобретению и его фармацевтически приемлемой солью,сольватом или гидратом. Подробное описание изобретения Соединения по данному изобретению относятся к агонистам рецепторов, активируемых пролифератором пероксисом (PPAR). Соединения по данному изобретению более специфически относятся к соединению селективному модуляторы рецепторов, активируемых пролифератором пероксисом (SPPARM),или к соединению, которое обладает активностью частичного агониста PPAR, полезного в лечении и/или профилактике расстройств, модулируемых PPAR, таких как диабет II типа, гипергликемия, дислипидемия,диабет I типа, гипертриглицеридемия, синдром X, инсулинорезистентность, сердечная недостаточность,диабетическая дислипидемия, гиперлипидемия, гиперхолестеринемия, гипертензия, ожирение, нейрогенная булимия, нервная анорексия, сердечно-сосудистые заболевания и другие родственные заболевания. Воплощение данного изобретения представляет собой соединение селективный модулятор рецепторов, активируемых пролифератором пероксисом (SPPARM), или соединение, которое обладает активностью частичного агониста PPAR структурной формулы I или его фармацевтически приемлемую соль, сольват или гидрат, где R1 и R2 независимо друг от друга представляют собой метил или этил. Предпочтительным воплощение данного изобретения является соединение структурной формулы II или его фармацевтически приемлемая соль, сольват, гидрат или стереоизомер, где R1 и R2 независимо друг от друга представляют собой метил или этил. Другим предпочтительным воплощением данного изобретения является соединение (2S)-3-(4-[2(4-метоксифенил)этилкарбамоил]метоксифенил)-2-метоксипропионовая кислота структурной формулы III-3 009023 или ее фармацевтически приемлемая соль, сольват или гидрат. Более предпочтительным воплощением данного изобретения является соединение 3-(4-[2-(4-этоксифенил)этилкарбамоил]метоксифенил)-2-метоксипропионовая кислота структурной формулы IV или ее фармацевтически приемлемая соль, сольват или гидрат. Еще более предпочтительным воплощением данного изобретения является соединение (S)-3-(4-[2(4-этоксифенил)этилкарбамоил]метоксифенил)-2-метоксипропионовая кислота структурной формулы V или ее фармацевтически приемлемая соль, сольват или гидрат. Данное изобретение также включает фармацевтическую композицию, которая содержит фармацевтически приемлемый носитель и соединение по данному изобретению или его фармацевтически приемлемую соль, сольват или гидрат. Данное изобретение также включает фармацевтическую композицию, которая содержит: соединение по данному изобретению или его фармацевтически приемлемую соль, сольват, гидрат или стереоизомер; второй терапевтический агент, выбранный из группы, состоящей из: инсулиносенсибилизаторов,производных сульфонилмочевины, бигуанидов, меглитинидов, тиазолидиндионов, ингибиторов -глюкозидазы, стимуляторов выработки инсулина, инсулина, антигиперлипидемических агентов, средств для повышения уровня ЛПВП в плазме, ингибиторов ГМГ-КоА редуктазы, статинов, ингибиторов акрилКоА:холестерилацилтрансферазы, соединений против ожирения, антигиперхолестеринемических средств,фибратов, витаминов и аспирина (ацетилсалициловой кислоты); и необязательно, фармацевтически приемлемый носитель. Данное изобретение также включает способ модулирования рецептора, активируемого пролифератором пероксисом (PPAR), который включает шаг контакта рецептора с соединением по данному изобретению или его фармацевтически приемлемой солью, сольватом или гидратом. Данное изобретение также включает способ, изложенный выше, где PPAR представляет собой альфа -рецептор. Данное изобретение также включает способ, изложенный выше, где PPAR представляет собой гамма -рецептор. Данное изобретение также включает способ, изложенный выше, где PPAR представляет собой альфа/гамма (/)-рецептор. Данное изобретение также включает способ лечения и/или профилактики PPAR-опосредованного заболевания или состояния у млекопитающего, который включает шаг введения эффективного количества соединения по данному изобретению. Данное изобретение также включает способ лечения и/или профилактики PPAR-опосредованного заболевания или состояния у млекопитающего, который включает шаг введения эффективного количества соединения по данному изобретению. Данное изобретение также включает способ лечения и/или профилактики PPAR/-опосредованного заболевания или состояния у млекопитающего, который включает шаг введения эффективного количества соединения по данному изобретению. Данное изобретение также включает способ лечения и/или профилактики заболевания или состояния, опосредованного частичным агонистом PPAR, у млекопитающего, который включает шаг введения эффективного количества соединения по данному изобретению. Данное изобретение также включает способ снижения глюкозы крови у млекопитающего, который включает шаг введения эффективного количества соединения по данному изобретению. Данное изобретение также включает способ лечения и/или профилактики у млекопитающего заболевания или состояния, выбранного из группы, состоящей из гипергликемии, дислипидемии, диабета II типа, диабета I типа, гипертриглицеридемии, синдрома X, инсулинорезистентности, сердечной недостаточности, диабетической дислипидемии, гиперлипидемии, гиперхолестеринемии, гипертензии, ожирения, нейрогенной булимии, нервной анорексии, сердечно-сосудистых заболеваний и других родственных-4 009023 заболеваний, компонентом которых является инсулинорезистентность, который включает шаг введения эффективного количества соединения по данному изобретению. Данное изобретение также включает способ лечения и/или профилактики сахарного диабета у млекопитающего, который включает шаг введения млекопитающему терапевтически эффективного количества соединения по данному изобретению. Данное изобретение также включает способ лечения и/или профилактики сердечно-сосудистого заболевания у млекопитающего, который включает шаг введения млекопитающему терапевтически эффективного количества соединения по данному изобретению или его фармацевтически приемлемой соли,сольвата или гидрата. Данное изобретение также включает способ лечения и/или профилактики синдрома X у млекопитающего, который включает шаг введения млекопитающему терапевтически эффективного количества соединения по данному изобретению или его фармацевтически приемлемой соли, сольвата или гидрата. Данное изобретение также включает способ лечения и/или профилактики у млекопитающего заболевания или состояния, выбранного из группы, состоящей из гипергликемии, дислипидемии, диабета II типа, диабета I типа, гипертриглицеридемии, синдрома X, инсулинорезистентности, сердечной недостаточности, диабетической дислипидемии, гиперлипидемии, гиперхолестеринемии, гипертензии, ожирения, нейрогенной булимии, нервной анорексии, сердечно-сосудистых заболеваний и других заболеваний,компонентом которых является инсулинорезистентность, который включает шаг введения эффективного количества соединения по данному изобретению; и эффективного количества второго терапевтического агента, выбранного из группы, состоящей из инсулиносенсибилизаторов, производных сульфонилмочевины, бигуанидов, меглитинидов, тиазолидиндионов, ингибиторов -глюкозидазы, стимуляторов выработки инсулина, инсулина, антигиперлипидемических агентов, средств для повышения уровня ЛПВП в плазме, ингибиторов ГМГ-КоА редуктазы, статинов, ингибиторов акрил-КоА:холестерилацилтрансферазы, соединений против ожирения, антигиперхолестеринемических средств, фибратов, витаминов и аспирина (ацетилсалициловой кислоты). Данное изобретение также включает применение соединения по данному изобретению или его фармацевтически приемлемой соли, сольвата или гидрата для производства лекарственного средства для лечения состояния, модулированного PPAR. Данное изобретение также включает применение соединения по данному изобретению или его фармацевтически приемлемой соли, сольвата или гидрата для производства лекарственного средства для лечения диабета. Термины, используемые для описания данного изобретения, имеют следующие значения, если не указано иное. Термин галоген означает F, Cl, Br или I. Термин активный ингредиент означает соединения, в общем виде описанные формулой I, а также соли, сольваты и пролекарства этих соединений. Термин фармацевтически приемлемый означает, что носитель, разбавители, вспомогательные вещества и соль должны быть совместимыми с другими ингредиентами композиции и не быть вредоносными для реципиента данной композиции. Фармацевтические композиции по данному изобретению готовят по методам, известным из уровня техники, с использованием хорошо известных и доступных в готовом виде ингредиентов. Профилактический означает снижение вероятности того, что реципиент будет подвержен или у него разовьется любое из описанных здесь патологических состояний. Лечащий означает контролирующий заболевание или состояние и предупреждающий или уменьшающий его дальнейшее прогрессирование или уменьшающий ассоциированные с заболеванием или состоянием симптомы. Фармацевтически эффективное количество означает количество соединения по данному изобретению или его соли, сольвата, гидрата или пролекарства, которое будет вызывать биологический или медицинский ответ ткани, системы или млекопитающего. Такое количество может быть введено профилактически пациенту, который считается уязвимым к развитию заболевания или состояния. При профилактическом введении пациенту такое количество может также быть эффективным для предупреждения или уменьшения выраженности опосредованного состояния. Подразумевается, что такое количество включает количество, достаточное для модулирования рецептора PPAR, такого как PPAR, PPAR илиPPAR/ рецептора, опосредующего заболевание или состояние. Состояния, опосредуемые рецепторамиPPAR, включают, например, сахарный диабет, сердечно-сосудистое заболевание, синдром X, ожирение и желудочно-кишечное заболевание. Дополнительные состояния, ассоциированные с модулированием рецептора PPAR, включают состояния, связанные с воспалением, которые включают, например, воспалительное заболевание кишечника, ревматоидный артрит, псориаз, болезнь Альцгеймера, болезнь Крона и ишемическое реперфузионное повреждение (инсульт и инфаркт миокарда). Млекопитающее означает индивидуальное животное, которое является членом таксономического класса млекопитающих. Класс млекопитающих включает людей, обезьян, шимпанзе, горилл, крупный рогатый скот, свиней, лошадей, овец, собак, мышей, крыс и т.п.-5 009023 Введение человеку является наиболее предпочтительным. Человек, которому вводятся соединения и композиции по данному изобретению, имеет заболевание или состояние, при котором уровень глюкозы в крови не контролируется адекватно без медицинского лечения, но где в крови человека присутствует эндогенный инсулин. Инсулиннезависимый сахарный диабет (ИНЗСД) представляет собой хроническое заболевание или состояние, которое характеризуется присутствием инсулина в крови, даже в концентрациях выше нормальной, при наличии резистентности или сниженной чувствительности к действию инсулина на ткани. Специалисты в данной области будут понимать, что в соединении по данному изобретению присутствуют стереоцентры. Соответственно, данное изобретение включает все возможные стереоизомеры и геометрические изомеры заявляемых здесь соединений, в том числе рацемические соединения и оптически активные изомеры. Соединения по данному изобретению содержат один или больше хиральных центров и существуют в различных оптически активных формах. Если соединения по данному изобретению содержат один хиральный центр, соединения существуют в двух энантиомерных формах и данное изобретение включает оба энантиомера и смеси энантиомеров, такие как рацемические смеси. Разделение окончательного продукта, промежуточного продукта или исходного материала может быть осуществлено с помощью любого подходящего способа, известного из уровня техники, например образованием диастереомерных солей,которые могут быть разделены кристаллизацией; образованием диастереомерных производных или комплексов, которые могут быть разделены кристаллизацией и газожидкостной или жидкостной хроматографией; селективной реакцией одного энантиомера с энантиомерспецифическим реагентом, такой как ферментная этерификация; и газожидкостной или жидкостной хроматографией в хиральной среде, например при хиральной поддержке, такой как кремний со связанным хиральным лигандом, или в присутствии хирального растворителя. См. также Sterochemistry of Carbon Compounds by E.L. Eliel (Mcgraw Hill,1962) и Tables of Resolving Agents by S.H. Wilen. Следует понимать, что, если желательный энантиомер превращают в другое химическое соединение с помощью одной из описанных выше процедур разделения, необходим дальнейший шаг для высвобождения желательной энантиомерной формы. Альтернативно, отдельные энантиомеры могут быть синтезированы путем асимметричного синтеза с использованием оптически активных реактивов, субстратов, катализаторов или растворителей или путем превращения одного энантиомера в другой путем асимметричной трансформации. Если соединение по данному изобретению содержит более чем один хиральный заместитель, оно может существовать в диастереомерных формах. Диастереомерные пары могут быть разделены с помощью способов, известных опытным специалистам в данной области, например хроматографии или кристаллизации, а индивидуальные энантиомеры из каждой пары могут быть выделены, как описано выше. Данное изобретение включает каждый из диастереомеров соединений формулы I и их смеси. Некоторые соединения по данному изобретению могут существовать в различных стабильных конформационных формах, которые могут поддаваться разделению. Торсионная асимметрия вследствие ограниченного вращения около асимметричной одинарной связи, например вследствие стерического препятствия или напряжения в кольце, может позволять разделение разных конформеров. Данное изобретение включает каждый из конформационных изомеров соединений формулы I и их смеси. Некоторые соединения по данному изобретению могут существовать в цвиттерионных формах, и данное изобретение включает каждую из цвиттерионных форм соединений формулы I и их смеси. Некоторые соединения по данному изобретению и их соли могут существовать в больше чем одной кристаллической форме. Полиморфы соединений формулы I составляют часть данного изобретения и могут быть приготовлены путем кристаллизации соединений формулы I при различных условиях, таких как использование разных растворителей или разных смесей растворителей для перекристаллизации; кристаллизация при различных температурах; и различные режимы охлаждения, от очень быстрого до очень медленного охлаждения во время кристаллизации. Полиморфы также могут быть получены путем нагревания или плавления соединения формулы I с последующим постепенным или быстрым охлаждением. Присутствие полиморфов может быть определено с помощью твердой пробы ЯМР-спектроскопии,ИК-спектроскопии, дифференциальной сканирующей калориметрии, порошковой дифракции Х-лучей или других существующих техник. Некоторые соединения по данному изобретению и их соли могут существовать в больше чем одной кристаллической форме, что включает каждую из кристаллических форм и их смеси. Некоторые соединения по данному изобретению и их соли могут также существовать в форме сольватов, например гидратов, и, таким образом, данное изобретение включает каждый сольват и их смеси. Фармацевтически приемлемая соль означает соли соединений формулы I, которые в существенной мере являются нетоксичными для млекопитающих. Типичные фармацевтически приемлемые соли включают соли, приготовленные путем реакции соединений по данному изобретению с минеральной,органической кислотой, органическим основанием или неорганическим основанием. Следует понимать,что природа конкретного иона с противоположным зарядом, образующего часть любой соли по данному изобретению, не является критической, если соль, в целом, является фармацевтически приемлемой и ион с противоположным зарядом не привносит нежелательных качеств в соль, в целом.-6 009023 Обладая кислотными свойствами, соединение по данному изобретению образуют соли с фармацевтически приемлемыми основаниями. Некоторые примеры солей включают соли металлов, таких как алюминий; соли щелочных металлов, таких как литий, натрий или калий; и соли щелочно-земельных металлов, таких как кальций, магний; соли аммония или замещенные соли аммония. Примеры замещенных солей аммония включают, например, соли с низшими алкиламинами, такими как триметиламин и триэтиламин; гидроксиалкиламинами, такими как 2-гидроксиэтиламин, бис-(2-гидроксиэтил)амин или три-(2-гидроксиэтил)амин; циклоалкиламинами, такими как бициклогексиламин или дибензилпиперидин, N-бензилфенэтиламин, дегидроабиэтиламин, N,N'-бисдегидроабиэтиламин, глюкамин, N-пиперазинметилглюкамин; основания пиридинового типа, такие как пиридин, коллидин, хинин или хинолин; и соли основных аминокислот, таких как лизин и аргинин. Примеры неорганических оснований включают, не ограничиваясь ими, натрия гидроксид, калия гидроксид, калия карбонат, натрия карбонат, натрия бикарбонат, калия бикарбонат, кальций гидроксид,кальция карбонат и т.п. Соединения по данному изобретению, замещенные основной группой, могут существовать в виде солей с фармацевтически приемлемыми солями. Данное изобретение включает такие соли. Примеры таких солей включают гидрохлориды, гидробромиды, сульфаты, метансульфонаты, нитраты, малеаты, ацетаты, цитраты, фумараты, тартраты (например, (+)-тартраты, (-)-тартраты или их смеси, включая рацемические смеси), сукцинаты, бензоаты и соли с аминокислотами, такими как глутаминовая кислота. Эти соли могут быть приготовлены с помощью способов, известных специалисту в данной области. Некоторые соединения по данному изобретению и их соли могут также существовать в форме сольватов, например гидратов, и, таким образом, данное изобретение включает каждый сольват и их смеси. Соединения по данному изобретению, которые связываются с рецепторами PPAR и активируют их,снижают уровень одного или больше из следующего: глюкоза, инсулин, триглицериды, жирные кислоты и/или холестерин, и, таким образом, являются полезными для лечения и/или профилактики гипергликемии, дислипидемии и особенно диабета II типа, а также других заболеваний, включая синдром X, диабетI типа, гипертриглицеридемию, инсулинорезистентность, диабетическую дислипидемию, гиперлипидемию, гиперхолестеринемию, сердечную недостаточность, коагулопатию, гипертензию и сердечно-сосудистые заболевания, особенно атеросклероз. Кроме того, показана полезность этих соединений для регулирования аппетита и потребления пищи у особей, страдающих от расстройств, таких как ожирение,нейрогенная булимия, нервная анорексия. Соединения и композиции по данному изобретению также полезны для лечения острых или транзиторных (преходящих) нарушений чувствительности к инсулину, которые иногда возникают после хирургического вмешательства, травмы, инфаркта миокарда и т.п. Соединения и композиции по данному изобретению полезны также для снижения уровня триглицеридов в сыворотке. Повышенный уровень триглицеридов, вызванный генетической предрасположенностью или диетой с высоким содержанием жиров, является фактором риска развития заболевания сердца, инсульта, а также расстройств и заболеваний системы кровообращения. Средний врач будет знать, как идентифицировать людей, которые могут получить пользу от введения соединений и композиций по данному изобретению. Данное изобретение также обеспечивает способ лечения и/или профилактики гипергликемии у людей или не принадлежащих к человеческому роду млекопитающих, который включает введение эффективного, нетоксичного количества соединения формулы I, или его таутомерной формы, и/или его фармацевтически приемлемой соли, и/или его фармацевтически приемлемого сольвата человеку или не принадлежащему к человеческому роду млекопитающему, который в этом нуждается. Соединения по данному изобретению полезны в качестве терапевтических субстанций для профилактики или лечения синдрома X, сахарного диабета и родственных эндокринных и сердечно-сосудистых нарушений и заболеваний у людей или не принадлежащих к человеческому роду млекопитающих. Данное изобретение также относится к применению соединения формулы I, описанной выше, для производства лекарственного средства для лечения состояния или заболевания, опосредованного PPAR,PPAR, частичным агонистом PPAR или двойным агонистом PPAR/ у млекопитающего. Терапевтически эффективное количество соединения по данному изобретению может быть использовано для приготовления лекарственного средства, полезного для лечения синдрома X, диабета, лечения ожирения, снижения уровней триглицеридов, повышения уровней липопротеинов высокой плотности в плазме, а также для лечения, профилактики или снижения риска развития атеросклероза и для профилактики или снижения риска возникновения первого или последующих эпизодов атеросклеротического заболевания у млекопитающих, особенно у людей. Кроме того, эффективное количество соединения по данному изобретению и терапевтически эффективное количество одного или более активных агентов, выбранных из антигиперлипидемических агентов, агентов для повышения ЛПВП в плазме, антигиперхолестеринемических агентов, фибратов,витаминов, аспирина (ацетилсалициловой кислоты), средств для повышения секреции инсулина, инсулина и т.п. средств, могут быть использованы совместно для получения лекарства, полезного для лечения перечисленных выше заболеваний и состояний. Предпочтительно композиции, содержащие соединения по настоящему изобретению или их соли,-7 009023 могут быть изготовлены в виде готовой лекарственной формы; предпочтительно каждая единица лекарственной формы содержит от приблизительно 1 до приблизительно 500 мг. Следует понимать, что количество соединений по данному изобретению, которое будет вводиться, определяется врачом с учетом всех соответствующих обстоятельств. Синдром X включает синдром предиабетической инсулинорезистентности и вытекающие из него осложнения, инсулинорезистентность, инсулиннезависимый диабет, дислипидемию, гипергликемию,ожирение, коагулопатию, гипертензию и другие осложнения, связанные с диабетом. Перечисленные в данном описании способы и средства лечения включают описанные выше и охватывают лечение и/или профилактику любого состояния или любой комбинации состояний из следующего: синдром предиабетической инсулинорезистентности, вытекающие из него осложнения, инсулинорезистентность, диабет II типа или инсулиннезависимый диабет, дислипидемия, гипергликемия, ожирение и осложнения, связанные с диабетом, включая сердечно-сосудистое заболевание, особенно артериосклероз. Соединения по данному изобретению могут эффективно использоваться в отдельности или в комбинации с одним или более дополнительных активных агентов, в зависимости от желательной цели лечения. Комбинированная терапия включает введение единой фармацевтической дозированной композиции, которая содержат соединение по данному изобретению и один или больше активных агентов, а также введение соединения по настоящему изобретению и каждого активного агента в его собственной отдельной фармацевтической дозированной форме. Например, соединение по данному изобретению или такое же соединение и стимулятор секреции инсулина, такой как бигуаниды, меглитиниды, тиазолидиндионы, производные сульфонилмочевины, инсулин или ингибиторы -глюкозидазы, могут вводиться пациенту совместно в единой композиции для перорального применения, такой как таблетка или капсула, или каждый агент может вводиться в виде отдельной лекарственной формы для перорального применения. При использовании отдельных лекарственных форм соединение по данному изобретению и один или больше дополнительных активных агентов могут вводиться практически в одно и то же время, то есть одновременно, или в разное время по расписанию, то есть последовательно; подразумевается, что комбинированная терапия включает все эти режимы. Пример комбинированного лечения для профилактики артериосклероза может включать введение соединения по данному изобретению или его солей в комбинации с одним или больше других терапевтических агентов: антигиперлипидемических агентов, агентов для повышения ЛПВП в плазме, антигиперхолестеринемических агентов, фибратов, витаминов, аспирина (ацетилсалициловой кислоты) и т.п. Как было отмечено выше, соединения по данному изобретению могут вводиться в комбинации с более чем одним дополнительным активным агентом. Другой пример комбинированной терапии можно наблюдать в лечении диабета и родственных нарушений, когда соединения по данному изобретению или их соли могут эффективно применяться в комбинации с другими активными терапевтическими агентами, такими как производные сульфонилмочевины, бигуаниды, меглитиниды, тиазолидиндионы, инсулин или ингибиторы -глюкозидазы, другие стимуляторы секреции инсулина, инсулин, а также с активными агентами, которые обсуждались выше для лечения артериосклероза. Примерами других терапевтических агентов являются инсулиносенсибилизаторы, агонисты PPAR,глитазоны, троглитазон, пиоглитазон, энглитазон, МСС-555, BRL 49653, бигуаниды, метформин, фенформин, инсулин, инсулиномиметики, производные сульфонилмочевины, толбутамид, глипизид, ингибиторы альфа-глюкозидазы, акарбоза, холестерин снижающий агент, ингибиторы ГМГ-КоА редуктазы,ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, ривастатин, другие сатины, секвестранты, холестирамин, колестипол, диалкиламиноалкильные производные поперечно-сшитого декстрана,никотиниловый спирт, никотиновая кислота:соль никотиновой кислоты, агонисты PPAR, производные фенофибриновой кислоты, гемфиброзил, клофибрат, фенофибрат, бензафибрат, ингибиторы абсорбции холестерина, бета-ситостерол, акрил КоА:ингибиторы холестерин ацилтрансферазы, мелинамид, пробукол, агонисты PPARS, соединения против ожирения, фенфлурамин, дексфенфлурамин, фентирамин,сульбитрамин, орлистат, ингибиторы нейропептида Y5, агонисты 3-адренергических рецепторов, а также ингибиторы переносчика желчных кислот в подвздошной кишке. Соединения по данному изобретению и их фармацевтически приемлемые соли, сольваты и гидраты обладают ценными фармакологическими свойствами и могут применяться в фармацевтических композициях, содержащих терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемых солей, эфиров или пролекарств, в сочетании с одним или больше фармацевтически приемлемых вспомогательных веществ. Вспомогательные вещества представляют собой инертные субстанции, которые включают, не ограничиваясь ими, носители, разбавители, наполнители, ароматизаторы, подсластители, лубриканты, солюбилизаторы, суспендирующие агенты, увлажняющие агенты, связующие агенты, агенты для повышения распадаемости, инкапсулирующие материалы и другие традиционные вспомогательные вещества. Выбор подходящего вспомогательного вещества зависит от выбранного способа введения. Фармацевтические композиции типично содержат от приблизительно 1 до приблизительно 99 мас.% активного ингредиента, который представляет собой соединение-8 009023 по настоящему изобретению. Предпочтительно фармацевтическая рецептура представляет собой единицу лекарственной формы. Единица лекарственной формы представляет собою физически отдельную дискретную единицу, которая содержит единицу дозы, пригодную для введения человеку или другим млекопитающим. Например,единицей лекарственной формы может быть капсула, или таблетка, или некоторое количество капсул или таблеток. Единица дозы представляет собой предварительно определенное количество активного соединения по данному изобретению, рассчитанное для получения желательного терапевтического эффекта, в сочетании с одним или больше фармацевтически приемлемых вспомогательных веществ. Количество активного ингредиента в единице дозы может варьировать или корректироваться от приблизительно 0,1 до приблизительно 1000 мг или больше в соответствии с конкретной схемой лечения. Режим дозирования с использованием соединений по данному изобретению выбирается с помощью одного из обычных навыков медицинского или ветеринарного работника с учетом различных факторов,например (не ограничиваясь ими): вид, возраст, масса, пол, медицинское состояние реципиента, выраженность подлежащего лечению состояния, способ введения, уровень метаболической и экскреторной функции реципиента, используемая лекарственная форма, используемое конкретное соединение и его соль и т.п. Предпочтительно соединения по настоящему изобретению вводятся 1 раз в сутки, или же суточная доза может быть разделена на 2, 3 и более приемов в сутки. Если препарат вводится в виде трансдермальных форм, введение производится непрерывно. Подходящие пути введения фармацевтических композиций по настоящему изобретению включают,например, пероральное, глазные капли, ректальное, трансмукозальное, местное или кишечное введение; парентеральное введение (болюс или инфузия), в том числе внутримышечные, подкожные, интрамедуллярные инъекции, а также интратекальные, прямые интравентрикулярные, внутривенные, внутрибрюшинные, интраназальные или внутриглазные инъекции. Соединения по настоящему изобретению также могут вводиться в системах целевой доставки лекарств, таких как липосома, покрытая эндотелиальными клеточно-специфическими антителами. Для перорального введения соединения по настоящему изобретению могут быть введены в рецептуры путем сочетания активных соединений с фармацевтически приемлемыми носителями, хорошо известными из уровня техники. Такие носители дают возможность ввести соединения по настоящему изобретению в таблетки, пилюли, порошки, саше, гранулы, драже, капсулы, жидкости, эликсиры, настойки,гели, эмульсии, сиропы, кашицы, суспензии и т.п. для перорального приема пациентом, который подлежит лечению. Фармацевтические препараты для перорального применения могут быть получены путем сочетания активного соединения с твердым вспомогательным веществом, с необязательным размалыванием полученной смеси, и переработкой смеси в гранулы, после добавления подходящих вспомогательных веществ, для получения при желании ядер таблеток или драже. Для перорального введения в форме таблетки или капсулы активный ингредиент может сочетаться с нетоксичным фармацевтически приемлемым носителем для перорального применения, таким как, не ограничиваясь ими, лактоза, крахмал, сахароза, глюкоза, метилцеллюлоза, кальция карбонат, кальция фосфат, кальция сульфат, натрия карбонат, маннит, сорбит и т.п.; необязательно вместе с агентами для повышения распадаемости, такими как, не ограничиваясь ими, поперечно-сшитый поливинилпирролидон, кукурузный крахмал, метилцеллюлоза, агар, бентонит, ксантановая камедь, альгиновая кислота или ее соль натрия альгинат; и, необязательно, связующие агенты, например, не ограничиваясь ими, желатин,акациевая камедь, природные сахара, бета-лактоза, кукурузные подсластители, природные и синтетические камеди, акациевая камедь, трагакантовая камедь, натрия альгинат, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п.; и, необязательно, лубриканты, например, не ограничиваясь приведенным,магния стеарат, натрия стеарат, стеариновая кислота, натрия олеат, натрия бензоат, натрия ацетат, натрия хлорид, тальк и т.п. Если единица лекарственной формы представляет собой капсулу, кроме перечисленных выше типов материалов она может содержать жидкий носитель, такой как жирное масло. Твердые формы включают порошки, таблетки и капсулы. Твердый носитель может представлять собой одну или больше субстанций, которые могут также действоватькак ароматизаторы, лубриканты,солюбилизаторы, суспендирующие агенты, связующие агенты, агенты для повышения распадаемости и инкапсулирующий материал. В порошках носителем является тонкоизмельченное твердое вещество, которое представляет собой премикс с тщательно распределенным активным ингредиентом. В таблетках активный ингредиент смешан с носителем, который обязательно обладает связующими свойствами, в подходящих пропорциях, и спрессован в единицу желательной формы и размера. Различные другие материалы могут присутствовать в качестве покрытий или для модификации физической формы единицы лекарственной формы. Например, таблетки могут быть покрыты шеллаком,сахаром, или их смесью. Сироп или эликсир может содержать кроме активного ингредиента сахарозу как подсластитель, метил- и пропилпарабены как консерванты, краситель и ароматизатор, такие как вишневый или апельсиновый ароматизатор. Стерильные жидкости включают суспензии, эмульсии, сиропы и эликсиры. Активный ингредиент-9 009023 может быть растворен или суспендирован в фармацевтически приемлемом носителе, таком как стерильная вода, стерильный органический растворитель или смесь стерильной воды и стерильного органического растворителя. Активный ингредиент также может быть растворен в подходящем органическом растворителе, например водном пропиленгликоле. Другие композиции могут быть получены путем диспергирования тонкоизмельченного активного ингредиента в водном крахмале, или растворе натрийкарбоксиметилцеллюлозы, или в подходящем масле. Ядра драже покрывают подходящими покрытиями. Для этой цели могут применяться концентрированные растворы сахара, которые необязательно содержат аравийскую камедь, тальк, поливинилпирролидон, гель карбопола, полиэтиленгликоль и/или титана диоксид, растворы лаков и подходящие органические растворители или смеси растворителей. Красители или пигменты могут добавляться к таблеткам или покрытиям драже для идентификации или для различения лекарственных форм с различными комбинациями активных ингредиентов. Фармацевтические препараты, которые могут приниматься перорально, включают твердые сборные капсулы, изготовленные из желатина, а также мягкие, запаянные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. Сборные капсулы могут содержать активные ингредиенты в виде премикса с наполнителем, таким как лактоза, связующими веществами, такими как крахмалы, и/или лубрикантами, такими как тальк или магния стеарат, и, необязательно, стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут добавляться стабилизаторы. Все рецептуры для перорального применения должны изготавливаться в виде лекарственных форм,пригодных для такого способа введения. Особенно подходящие композиции для перорального введения представляют собой единицы лекарственных форм, такие как таблетки и капсулы. Для парентерального введения соединения по настоящему изобретению или их соли могут сочетаться со стерильными водными или органическими средами для образования инъекционных растворов или суспензий. Рецептуры для инъекций могут быть представлены в виде единиц лекарственной формы,таких как в ампулах или в многодозовых контейнерах, с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, которые могут содержать агенты для поддержания лекарственной формы, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Фармацевтические формы, подходящие для инъекционного введения, включают стерильные водные растворы или дисперсии и стерильные порошки для экстемпорального приготовления стерильных инъекционных растворов или дисперсий. Во всех случаях форма должна быть стерильной и должна быть достаточно жидкой для того, чтобы ее можно было ввести с помощью шприца. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязнения. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, предпочтительно в виде физиологически совместимых буферных растворов, таких как раствор Ханкса, раствор Рингера или физиологический солевой буфер, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), подходящие смеси этих компонентов и растительные масла. При обычных условиях хранения и применения эти препараты содержат консервант для предупреждения роста микроорганизмов. Приготовленные таким образом инъекционные растворы далее могут вводиться внутривенно, внутрибрюшинно, подкожно или внутримышечно, причем у людей предпочтительным является внутримышечное введение. Для трансмукозального введения в рецептуру вводятся пенетранты, соответствующие барьеру, через который должно проникать лекарственное средство. Такие пенетранты, в целом, известны из уровня техники. Активные соединения также могут вводиться интраназально, например в виде жидких капель или спрея. Для буккального введения композиции могут изготавливаться в форме таблеток или леденцов с традиционной рецептурой. Для введения путем ингаляции соединения для применения по настоящему изобретению традиционно вводятся в форме сухого порошка для ингалятора или аэрозольного спрея из упаковок, содержащих препарат под давлением, или небулайзера, с применением подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае использования аэрозоля под давлением единица лекарственной формы может определяться с помощью клапана для доставки отмеренного количества. Капсулы и картриджи из желатина для использования в ингаляторе или инсуфляторе могут быть изготовлены содержащими смесь соединения и подходящей порошковой основы, такой как лактоза или крахмал. Фармацевтические композиции по настоящему изобретению могут быть произведены по способу,который сам по себе известен, например с помощью процессов традиционного смешивания, растворения,грануляции, дражирования, растирания в порошок, эмульгации, инкапсулирования, улавливания или лиофилизации.- 10009023 При изготовлении композиций по настоящему изобретению активный ингредиент обычно будет предварительно смешан с носителем, или разбавлен носителем, или заключен в носитель, который может быть в форме капсулы, саше, бумажного или другого контейнера. Если носитель служит разбавителем,он может быть твердым веществом, лиофилизированным твердым веществом или пастой, полутвердым или жидким материалом, который служит носителем, или может быть в форме таблеток, пилюль, порошков, леденцов, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (в виде твердой или жидкой среды) или мази, и содержать, например, до 10 мас.% активного соединения. Соединения по настоящему изобретению предпочтительно вводятся в лекарственные формы перед введением пациенту. Биологические пробы Пробы конкурентного вытеснения связыванием Пробы связывания проводят с использованием технологии пробы связывания сцинтиллятора вблизи активного центра (SPA), рецепторов PPAR и соответствующих радиомеченных лигандов. PPAR иPPAR вместе с их гетеродимерным партнером, ретиноид X рецептором , каждый получают с использованием системы экспрессии бакуловируса. Биотинилированные олигонуклеотиды, содержащие элементы ответа PPAR (PPRE), используются для сцепления соответствующих рецепторных димеров с иттрийсиликатными бусинками SPA, покрытыми стрептавидином. PPAR и PPAR-специфические лиганды метят тритием и используют в соответствующих пробах. Значения IC50 (концентрация вещества, которая вызывает 50% ингибирование) для каждого конкурирующего соединения рассчитывают после вычитания неспецифического связывания (измеряется в присутствии 10 мкМ немеченого лиганда). Соединения оценивают с использованием 11-пунктовой кривой доза-реакция с интервалом концентраций от 0,169 нМ до 10 мкМ. Приведенные значения представляют собой среднее значение серии от 1 до 7 отдельных экспериментов. Пробы сотрансфекции (CTF)PPAR и PPAR конструктивно экспрессируют с использованием плазмид, содержащих цитомегаловирусный промотор. Репортерные плазмиды для проб CTF PPAR содержат PPRE из следующих генов: ацил-КоА оксидаза (АОХ); аполипопротеин Al (ApoAl); липопротеин липаза (LPL); или еноил-КоА гидратаза/3-гидроксиацил-КоА дегидрогеназа (HD) плюс тимидинкиназный (ТK) промотор) выше репортера кДНК люциферазы. Также использовали химерную систему PPAR бактериальной галактозидазы(GAL4). Для PPAR химерная система GAL4 является стандартной выполняемой CTF пробой. Все анализы проводили на клетках CV-1. Соединения тестировали при полном логарифмическом разведении от 0,1 нМ до 10 мкМ с двукратным повторением. Процентную эффективность определяли в связи с молекулами стандартов со значениями эффективности, отражающими наибольшее значение активности агониста, достигнутое в пробе CTF для каждого соединения. Значения средней эффективной концентрации(ЕС 50) определяли путем компьютерного отнесения на кривой концентрация-ответ. Значение ЕС 50 не рассчитывали, если эффективность соединения составляла 20%. Приведенные значения представляют собой среднее из серии от 2 до 9 отдельных экспериментов. Пробы восстановления кофактора Система пробы млекопитающих-2-гибрида в формате CTF проводилась на клетках CV-1. Использовались следующие плазмиды: вектор экспрессии млекопитающих, кодирующий слияние GAL4 ДНК-связывающего домена с PPAR лигандсвязывающим доменом; вектор экспрессии млекопитающих, кодирующий слияние домена трансактивации VP16 с доменом взаимодействия ядерного рецептора соответствующих соактиваторов: CREB-связывающий белок (СВР), гамма соактиватор-1 рецептора, активируемого пролифератором пероксисом (PGC-1), активирующий сигнальный соинтегратор-2 (ASC-2), рецепторактивирующий протеиновый комплекс тиреоидного гормона (TRAP220) и пептид С 33; и репортерная плазмида (мультимеризованые GAL4 связывающие участки/минимальный ТК промотор, ведущий кДНК люциферзы). Клетки были трансфицированы в серийном формате и обработаны соединением (полное логарифмическое разведение от 0,1 нМ до 10 мкМ) или носителем на протяжении 24 ч. После этого клетки были лизированы и измерена активность люциферазы. Активность люциферазы служит конечной точкой взаимодействия между соактиватором и рецептором. Данные представлены как % эффективности относительно полного агониста PPAR и представляют собой средние значения серии от 4 до 6 отдельных экспериментов. Оценка уровней глюкозы, триглицеридов и гематокрита,а также увеличения массы тела у мышей с диабетом Диабетических мышей-самцов (db/db) в возрасте 5 недель (Harlan Laboratories, Indianapolis, IN) содержали в пластиковых клетках (n=6/клетку; размер клетки приблизительно 10X20X8" с подстилкой из осиновой стружки) со свободным доступом к воде (система водоснабжения - городская питьевая вода) и пище (Purina 5008). После 2 недель акклиматизации животные (в возрасте 7 недель) были отобраны на день 0 в 10.00-12.00 ч (светало в 6.00 ч) и распределены на группы лечения (n=5 или 6), на базе начальных значения уровня глюкозы. Соединение или носитель были единственными лекарственными средствами, которые вводили ежедневно через желудочный зонд приблизительно в 7.30 ч. Массу тела измеряли в начале (день 0) и в конце (день 7 и день 14) исследования. В гепаринизированные пробирки собирали- 11009023 кровь из хвоста неголодных животных через 2-3 ч после введения последней дозы. После этого определяли уровни гематокрита, глюкозы и триглицеридов. Приведенные значения для уровней глюкозы и триглицеридов представляют собой % нормализации в сравнении со значениями тощих однопометных животных, установленными при 100% нормализации глюкозы, рассчитанной на базе нормального уровня глюкозы 250 мг/дл. Статистически значимые различия между двумя экспериментальными группами оценивали с использованием двустороннего теста Стьюдента. Следующие таблицы показывают данные in vitro для соединения по настоящему изобретению (2S)3-(4-[2-(4-метоксифенил)этилкарбамоил]метоксифенил)-2-метоксипропионовой кислоты структурной формулы IIIIС 50 и ЕС 50 в нМ; CTF (Eff) в % эффективности. Как показано в приведенных выше таблицах, соединение формулы III обладает неожиданно высоким сродством частичного агониста PPAR с активностью PPAR. Как показано в табл. 1, это соединение связывается с PPAR с высоким сродством (IС 50=52 нМ) и с PPAR с относительно низким сродством (IС 50=113). Соединение формулы III обладает активностью частичного агониста PPAR, что продемонстрировано в пробах сотрансфекции и восстановления кофактора. Как показано в табл. 1 и 3, эффективность PPAR (% эффективности в сравнении с эффективностью полного антагониста PPAR, принятой за 100%), достигнутая с данным соединением, находится в интервале от 30 до 86%. Кроме того, способность этого соединения восстанавливать специфические кофакторы к PPAR варьирует в интервале от 7 до 24% в сравнении с полным агонистом PPAR (принято за 100% восстановление, табл. 2), что делает соединение формулы III частичным агонистом PPAR. Соединение также демонстрирует активность агониста PPAR, как показано в табл. 1 (43% эффективность, 1305 нМ EC50). Чтобы достичь понимания антидиабетической эффективности и профиля побочного действия соединения формулы III, мышам с диабетом (db/db) вводили соединение формулы III в дозах 1, 3, 10, и 30 мг/кг/день на протяжении 14 дней через желудочный зонд. Уровни глюкозы и гематокрита в плазме, а также массу тела измеряли перед началом исследования (день 0) и в конце исследования (день 14). Соединение формулы III продемонстрировало превосходную антидиабетическую эффективность в снижении уровней глюкозы в плазме во всех изученных дозах (нормализация 42,7, 68,3, 96,1, и 109,3%). Неожиданным было отсутствие зависимости между дозой и снижением уровней гематокрита, показательным для увеличения объема плазмы, после введения соединения формулы III от дозы. Поскольку антидиабетическая эффективность вместе со способностью увеличивать объем плазмы является распространенной чертой полных агонистов PPAR [Armstrong and King (2004), Mudaliar, et al. (2003), Nesto et al.,(2004)], наши данные указывают на то, что соединение формулы III может представлять собой усовер- 12009023 шенствованное средство для лечения диабета II типа в сравнении с присутствующими в настоящее время на рынке агонистами PPAR. В следующих таблицах приведены данные in vitro для соединения по настоящему изобретению (S)3-(4-[2-(4-этоксифенил)этилкарбамоил]метоксифенил)-2-метоксипропионовой кислоты структурной формулы VIС 50 и ЕС 50 в нМ; CTF (Eff) в % эффективности. Как показано в приведенных выше таблицах, соединение формулы V обладает неожиданно высоким сродством частичного агониста PPAR с активностью PPAR. Как показано в табл. 1, это соединения связывается с PPAR с высоким сродством (IС 50=30 нМ) и с PPAR с относительно низким сродством (IС 50=360). Соединение формулы V обладает активностью частичного агониста PPAR, что продемонстрировано в пробах сотрансфекции и восстановления кофактора. Как показано в табл. 1 и 3, эффективность PPAR (% эффективности в сравнении с эффективностью полного антагониста PPAR, принятой за 100%), достигнутая с данным соединением, находится в интервале от 39 до 80%. Кроме того, способность этого соединения восстанавливать специфические кофакторы к PPAR варьирует в интервале от 16 до 43% в сравнении с полным агонистом PPAR (принята за 100% восстановление, табл. 2), что делает соединение формулы V частичным агонистом PPAR. Соединение также демонстрирует активность агониста PPAR, как показано в табл. 1 (39% эффективность, 1814 нМ EC50). Чтобы достичь понимания антидиабетической эффективности и профиля побочного действия соединения формулы V, мышам с диабетом (db/db) и их тощим однопометным животным (db/+) вводили соединение формулы V в концентрации 3, 10, 30 и 100 мг/кг/день на протяжении 7 дней через желудочный зонд. Уровни глюкозы и гематокрита в плазме, а также массу тела измеряли перед началом исследования (день 0) и в конце исследования (день 7). Соединение формулы V продемонстрировало превосходную антидиабетическую эффективность в снижении уровней глюкозы и триглицеридов в плазме во всех изученных дозах (нормализация глюкозы 61,2, 87,5, 105,6, и 110,3%; нормализация триглицеридов 108,1,108,1, 121,1, и 130,6%). Неожиданным было отсутствие статистически значимых изменений массы тела или уровней гематокрита для всех доз. Поскольку известно, что антидиабетическая эффективность полных агонистов PPAR сопровождается значительным увеличением массы тела и увеличением объема плазмы, наши данные указывают на то, что соединение формулы V может представлять собой усовершенствованное средство для лечения диабета II типа в сравнении с присутствующими в настоящее время на рынке агонистами PPAR. Приведенная ниже схема реакции иллюстрирует в общих чертах синтетический путь получения соединений по настоящему изобретению. Подробные примеры изложены ниже.- 14009023 Шаг 1. Синтез соединения (b). Соединение (а) растворяют в ацетонитриле (0,1 М) и обрабатывают 2 экв. трет-бутилового эфира 2 бром-2-метилпропионовой кислоты и 2,5 экв. карбоната цезия. Реакционную смесь перемешивают при 80 С в течение приблизительно 24 ч, фильтруют и концентрируют. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле (10% этилацетат/гексан). Шаг 2. Синтез соединения (с). Соединение (b), полученное на шаге 1, растворяют в трифторуксусной кислоте (ТФУ) и СН 2 Сl2 (1:1; 0,5 М). Реакционную смесь перемешивают на протяжении приблизительно 2 ч и концентрируют. Сырой продукт используют на следующем шаге. Шаг 3. Синтез соединения (d). Соединение (с), полученное на шаге 2, растворяют в дихлорметане (ДХМ) и обрабатывают 2 экв.PS-карбодимида и 1 экв. НОВТ с последующим добавлением 1,1 экв. 2-(4-этоксифенил)этиламина. Реакционную смесь перемешивают при комнатной температуре с использованием кругового перемешивания на протяжении приблизительно 10 ч. Выдержанный реактив отфильтровывают и дважды промывают ДХМ. Сырой продукт растворяют в ДХМ и добавляют PS-трисамин (2 экв.) и PS-изоцианат (1 экв.). Реакционную смесь перемешивают при комнатной температуре на протяжении 2 ч с использованием кругового перемешивания. Выдержанный материал отфильтровывают и дважды промывают ДХМ. Растворитель удаляют и сырой продукт используют на шаге гидролиза. Шаг 4. Синтез соединения (е). Соединение (d), полученное на шаге 3, растворяют в МеОН и обрабатывают 10 экв. 1 М водного раствора NaOH. Реакционную смесь перемешивают при комнатной температуре до завершения гидролиза,которое определяют по данным анализа ВЭЖХ. Добавляют 1 М НСl (1 М раствор в воде) до pH 3 и растворитель удаляют под вакуумом. Остаток разводят в CH2Cl2/H2O и фильтруют через картридж ChemElute. Элюат концентрируют и очищают с помощью ВЭЖХ-MS с получением названного соединения в виде белого твердого вещества. MS (ES) для C21H25NO6 [М-Н]+: 386; т.пл. 97-98 С. Пример 2. (R)- и (S)-3-(4-Гидроксифенил)-2-метоксипропионовой кислоты натриевая соль.(+/-)-3-(4-Гидроксифенил)-2-метоксипропионовой кислоты метиловый эфир. трет-Бутоксид калия (1,6 М в тетрагидрофуране, 1163 мл, 1,86 моль) охлаждают в ванне с сухим льдом/ацетоном до -40 С в атмосфере азота. На протяжении 30-60 мин добавляют смесь 4-бензилоксибензальдегида (358,9 г, 1,69 моль) и метилметоксиацетата (184,3 мл, 1,86 моль) в тетрагидрофуране (1076 мл). Реакционную смесь перемешивают при -40 С в течение приблизительно 1-2 ч до получения интермедиата(b). К интермедиату (b) медленно на протяжении 25 мин добавляют раствор трифторуксусного альдегида(710,3 г, 3,38 моль) в тетрагидрофуране (1600 мл) и реакционной смеси позволяют нагреваться до температуры не выше 15 С. Реакционную смесь перемешивают на протяжении ночи с получением соединения (с). Палладий на угле (5%, 125,4 г) суспендируют в тетрагидрофуране (500 мл). Добавляют реакционную смесь, содержащую соединение (с) (около 4500 мл), и промывают тетрагидрофураном (1000 мл). Реакционную смесь помещают в атмосферу водорода на шейкере Парра при 25 фунтов/дюйм 2 и комнатной температуре. Реакционную смесь гидрогенизируют на протяжении 26 ч при температуре приблизительно 19-32 С. Смесь фильтруют через Hyflo Supercel и шейкер Парра промывают тетрагидрофураном(2000 мл). Органический раствор концентрируют под вакуумом до минимального возможного объема. Добавляют толуол (2500 мл) и раствор тщательно промывают 10% NaHCO3 (280 г в 2800 мл воды). Слои разделяют и органический слой промывают водой (2800 мл). Органическую фазу концентрируют под вакуумом до получения около 271,8 г (76%) соединения (d), (+/-)-3-(4-гидроксифенил)-2-метоксипропионовой кислоты метилового эфира в виде масла. Шаг 4. Синтез соединения (f).(S)-3-(4-Гидроксифенил)-2-метоксипропионовой кислоты натриевая соль. Раствор 0,75 М KН 2 РО 4 доводят до pH 7,4-7,8 с помощью 5 М NaOH. Фермент Chiro CLEC CR добавляют при умеренном перемешивании с последующим добавлением соединения (d) (10,0 г, 47,6 ммоль) в толуоле (100 мл). Ферментный гидролиз проводят при комнатной температуре и при необходимости добавляют 1 М NaOH для поддержания рН выше 6,5. Гидролиз останавливают, когда концентрация водного слоя показывает превращение 35-42%, обычно в течение приблизительно 4-36 ч, в зависимости от активности фермента (см. условия ВЭЖХ ниже). Фермент отфильтровывают из раствора и промывают буферным раствором KН 2 РО 4 (1-2 мл). Органический и водный слои разделяют. Водную фазу доводят до рН 1,9-2,1 с помощью 4 М НСl, поддерживая температуру на уровне 20-25 С. Водную фазу экстрагируют изопропилацетатом. Слои разделяют. Измеряют объем фракции изопропилацетата и рассчитывают концентрацию соединения (е). Фазу изопропилацетата концентрируют под вакуумом до 70-80 мг/мл. Измеряют объем и рассчитывают количество молей соединения (е) до кристаллизации. При комнатной температуре и умеренном перемешивании натрия ацетат растворяют в метаноле (11% мас./об.) и добавляют к раствору соединения (е) в изопропилацетате таким образом, чтобы достичь молярного соотношения натрия ацетата и соединения (е) 1,3. На протяжении 5-10 мин наблюдаются мутность и образование кристаллов. Если этого не происходит, в раствор добавляют соединение (f). Когда мутность и образование кристаллов становятся явными, скорость перемешивания снижают и перемешивание продолжают в течение 12 ч при комнатной температуре. Кристаллы отфильтровывают, промывают при комнатной температуре изопропилацетатом (15 мл) и высушивают под вакуумом при 45 С до получения соединения (f) (3,13,6 г), (S)-3-(4-гидроксифенил)-2-метоксипропионовой кислоты натриевой соли. Если хиральная проба ее показывает ее 97%, материал ресуспендируют/перекристаллизовывают с 15 объемами 99% об./об. раствора изопропанол/вода с обратным холодильником. Условия ВЭЖХ: колонка: Zorbax RX С-8, 4,6 мм 25 см; подвижная фаза: 70% 0,1% Н 3 РО 4/30% ацетонитрил; скорость потока: 1 мл/мин; длина волны: 230 нм; температура: комнатная; время удерживания: соединение (е)=4,3-4,6 мин, соединение (d)=9,3-9,7 мин, изопропил ацетат=9,9-10,3, толуол: приблизительно 50 мин. Шаг 5. Синтез соединения (h).(R)-3-(4-Гидроксифенил)-2-метоксипропионовой кислоты натриевая соль. Органический слой со стадии ферментного гидролиза (шаг 4), содержащий соединение (g), концентрируют до состояния масла. По методу ВЭЖХ определяют концентрацию (R)-3-(4-гидроксифенил)-2 метоксипропионовой кислоты метилового эфира, содержащегося в масле, которая составляет 0,40 г/г масла, и рассчитывают общее количество субстрата. Масло, содержащее (R)-3-(4-гидроксифенил)-2 метоксипропионовой кислоты метиловый эфир (1399 г, 6,65 моль, скорректировано на концентрацию),промывают комбинацией трет-бутилметилового эфира (11520 мл, 8,2 об.), воды (5120 мл, 3,6 об.) и 0,75 М буфера KН 2 РО 4 (2560 мл, 1,8 об.), рН которой было доведено до 7,5 с помощью 5 н. NaOH. Полученный органический слой потом вводят в реакцию гидролиза добавлением 0,75 М буфера KН 2 РО 4(11560 мл, 8,3 об.), рН которого было доведено до 7,5 с помощью 5 н. NaOH, и химотрипсина (25,6 г,1,8 мас.%). Затем реакционную смесь перемешивают при 20-25 С на протяжении 49 ч с быстрым взбалтыванием, при этом не допускается никакой контакт между лезвием мешалки и стенками колбы для минимизации разрушения фермента. Раствор продукта фильтруют через Hyflo Supercel и осадок на фильтре промывают 0,75 М буфером KН 2 РО 4 (1280 мл, 0,9 об.), рН которого было доведено до 7,5 с помощью 5 н. NaOH. Дополнительно к раствору продукта добавляют трет-бутиловый эфир (1280 мл, 0,9 об.) для лучшего разделения органической и водной фазы. Водную фазу отделяют от органической фазы и далее доводят до pH 2,0 с помощью 4 н. НСl (3000 мл, 2,1 об.). Водную фазу фильтруют через Hyflo Supercel для удаления механических включений из фермента и осадок на фильтре промывают 0,75 М буфераKН 2 РО 4 (1280 мл, 0,9 об.), рН которого было доведено до 7,5 с помощью 5 н. NaOH. Продукт экстрагируют из водной фазы изопропилацетатом (46800 мл, 33,4 об.) и далее объем изопропилацетата концентрируют до 4,65 об. (6500 мл) путем вакуумной дистилляции (45 С/25 мм рт.ст.). Смесь натрия ацетата(258,5 г, 3,1 моль) в метаноле (2176 мл, 1,6 об.) добавляют к раствору продукта на протяжении 15 мин при 20-25 С. В мутный раствор добавляют соединение (h), перемешивают при 20-25 С на протяжении 9-10 ч и фильтруют. Твердое вещество промывают изопропилацетатом (1280 мл, 0,9 об.), собирают и высушивают в вакуумной печи при 45 С в течение ночи с получением соединения (h) (521,69 г), (R)-3-(4-гидроксифенил)2-метоксипропионовой кислоты натриевой соли, в виде белого твердого вещества с ее=97,8%. Пример 3. (R)-3-(4-[2-(4-Этоксифенил)этилкарбамоил]метоксифенил)-2-метоксипропионовая кислота.(R)-3-(4-Гидроксифенил)-2-метоксипропионовой кислоты метиловый эфир. Соединение (a), (R)-3-(4-гидроксифенил)-2-метоксипропионовой кислоты натриевую соль (пример 2, шаг 5) (5,00 г, 22,9 ммоль), растворяют в метаноле (125 мл) и обрабатывают метансульфоновой кислотой (7,44 мл, 114,6 ммоль). Реакционную смесь перемешивают при комнатной температуре на протяжении 1 ч. Реакционную смесь концентрируют под вакуумом и полученный остаток растирают с диэтиловым эфиром. Органическую фазу промывают водой (2) и насыщенным раствором NaHCO3, высушивают (Na2SO4), фильтруют и концентрируют под вакуумом с получением 4,00 г (83%) в виде практически белого твердого вещества. Материал используют без дальнейшей очистки. 1 Н-ЯМР (400 МГц, CDCl3)7,06 (дд, J=2,2, 6,4 Гц, 2 Н), 6,72 (дд, J=2,2, 6,4 Гц, 2 Н), 5,38 (шир.д с, 1 Н), 3,95 (дд, J=5,3, 7,1 Гц, 1 Н), 3,71(R)-3-(4-трет-Бутоксикарбонилметоксифенил)-2-метоксипропионовой кислоты метиловый эфир. Соединение (b) (5,4 г, 25,69 ммоль), полученное на шаге 1, растворяют в ацетонитриле (50 мл), и обрабатывают трет-бутилбромацетатом (5,01 г, 25,69 ммоль), K2 СО 3 (7,10 г, 51,37 ммоль) и тетрабутиламмоний йодидом (0,95 г, 2,57 ммоль), и нагревают до 70 С при быстром перемешивании на протяжении 3 ч. Реакционную смесь фильтруют, промывают ацетонитрилом и концентрируют под вакуумом. Полученный остаток растирают с этилацетатом и промывают последовательно водой, насыщенным раствором NaHCO3, водой и рассолом. Органическую фазу высушивают (Na2SO4), фильтруют и концентрируют под вакуумом с получением 8,5 г продукта, который используют без дальнейшей очистки. 1 Н-ЯМР(R)-3-(4-Карбоксиметоксифенил)-2-метоксипропионовой кислоты метиловый эфир. Соединение (с) (8,5 г, 26,20 ммоль), полученное на шаге 2, растворяют в дихлорметане (190 мл)/три- 17009023 фторуксусной кислоте (45 мл) и перемешивают при комнатной температуре на протяжении 4 ч. Реакционную смесь концентрируют под вакуумом и полученный остаток растворяют в этилацетате. Органическую фазу промывают водой (3). Продукт экстрагируют в насыщенный раствор NaHCO3 (3). Слои разделяют и водную фазу тщательно подкисляют 5 н. НСl до рН приблизительно 3-4. Водную фазу экстрагируют этилацетатом (3), убеждаясь, что рН водного слоя все еще остается около 3-4, и добавляя при необходимости 5 н. НСl. Комбинированные органические порции высушивают над Na2SO4, фильтруют и концентрируют под вакуумом с получением 6,75 г (96%) белого твердого вещества, которое используют без дальнейшей очистки. 1 Н-ЯМР (400 МГц, CDCl3)9,5 (шир.д с, 1 Н), 7,15 (д, J=8,7 Гц, 2 Н), 6,85 (д, J=8,8 Гц, 2 Н), 4,65(R)-3-(4-[2-(4-Этоксифенил)этилкарбамоил]метоксифенил)-2-метоксипропионовой кислоты метиловый эфир. Способ 1. Соединение (d) (6,4 г, 23,85 ммоль), полученное на шаге 3, растворяют в дихлорметане (150 мл) и обрабатывают бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфатом (ВОР) (15,83 г,35,78 ммоль), гидроксибензотриазолом (4,84 г, 35,78 ммоль), и триэтиламином (6,66 мл, 47,71 ммоль). Реакционную смесь охлаждают на ледяной бане и добавляют 2-(4-метоксифенил)этиламин (4,34 г, 26,24 ммоль). Ледяную баню удаляют и смесь перемешивают при комнатной температуре на протяжении приблизительно 18 ч. Реакционную смесь разбавляют дихлорметаном и последовательно промывают водой (2),1 н. НСl (2), насыщенным раствором NaHCO3 и рассолом. Органическую фазу высушивают (Na2SO4),отфильтровывают и концентрируют под вакуумом с получением 17 г оранжевого масла. Сырой продукт очищают хроматографией на силикагеле с элюацией смесью этилацетата/гексана 1:1 с получением 9,0 г(кв, J=6,5 Гц, 2 Н), 3,34 (с, 3H), 2,99-2,95 (м, 2 Н), 2,76 (т, J=7,0 Гц, 2 Н), 1,41 (т, J=7,0 Гц, 3H). Способ 2. Соединение (d) (1,0 экв.) растворяют в этилацетате в атмосфере азота. Добавляют 1,1'-карбонилдиимидазол (1,27 экв.) и реакционную смесь перемешивают при комнатной температуре на протяжении 1 ч. Реакционную смесь охлаждают на ледяной бане и медленно добавляют 2-(4-метоксифенил)этиламин(1,21 экв.). Реакционной смеси позволяют нагреться до комнатной температуры при перемешивании на протяжении ночи. Реакционную смесь промывают последовательно 1 н. НСl, насыщенным растворомNaHCO3 и водой. Органическую фазу концентрируют под вакуумом. Полученный остаток повторно растворяют в тетрагидрофуране. Раствор концентрируют под вакуумом для удаления этилацетата с получением твердого вещества (93%). При необходимости материал очищают, как описано в способе 1. Шаг 5. Синтез соединения (f).(R)-3-(4-[2-(4-Этоксифенил)этилкарбамоил]метоксифенил)-2-метоксипропионовая кислота. Соединение (е) (14,0 г, 33,70 ммоль), полученное на шаге 4, растворяют в тетрагидрофуране (240 мл) и охлаждают на ледяной бане. Добавляют гидроксид лития (1,61 г, 67,39 ммоль) в воде (95 мл) и реакционную смесь перемешивают при комнатной температуре на протяжении приблизительно 2 ч. Тетрагидрофуран удаляют под вакуумом, добавляют диэтиловый эфир и экстрагируют водную фазу. Слои разделяют и водный слой экстрагируют дополнительным количеством диэтилового эфира. Водный слой отделяют и тщательно подкисляют 1 н. НСl. Полученный белый осадок отфильтровывают и растирают с дихлорметаном. Раствор высушивают (Na2SO4), фильтруют и концентрируют под вакуумом с получением 12,4 г (92%). 1 Н-ЯМР (400 МГц, CDCl3)7,18 (дд, J=1,7, 6,5 Гц, 2 Н), 7,04 (дд, J=1,7, 6,5 Гц, 2 Н), 6,81 (м,4 Н), 6,66 (шир.д м, 1 Н), 4,42 (с, 2 Н), 4,0 (м, 3H), 3,55 (кв, J=7,0 Гц, 2 Н), 3,40 (с, 3H), 3,10 (м, 1 Н), 3,01 (м,1 Н), 2,76 (т, J=7,0 Гц, 2 Н), 1,40 (т, J=7,0 Гц, 3H). 1H-ЯМР (400 МГц, DMSO-d6)12,68 (с, 1 Н), 8,04 (шир.д т, J=5,7 Гц, 1 Н), 7,11 (дд, J=1,7, 6,5 Гц, 2 Н), 7,07 (дд, J=1,7, 6,5 Гц, 2 Н), 6,81 (м, 4 Н), 4,38 (с, 2 Н), 3,95 (кв,J=7,0 Гц, 2 Н), 3,87 (кв, J=4,8 Гц, 1 Н), 3,30 (м, 3H), 3,20 (с, 3H), 2,88 (м, 1 Н), 2,81 (м, 1 Н), 2,65 (т, J=7,0 Гц,2 Н), 1,31 (т, J=7,0 Гц, 3H). LCMS - 100% чистота. Масс-ион 400,6 (ES-), и 402,5 (ES+). ее=97,8%, время удержания=6,71 мин, что определено по данным хиральной ВЭЖХ при следующих условиях: колонка: 4615 см Chiralpak AD-H; элюент: 50:50:0,1 изопропиловый спирт/гептан/трифторуксусная кислота; скорость потока: 0,6 мл/мин; УФ: 270 нм. Пример 4. (S)-3-(4-[2-(4-Этоксифенил)этилкарбамоил]метоксифенил)-2-метоксипропионовая кислота. Названное соединение получают, в основном, следуя процедурам, описанным в примере 3 из (S)-3(4-гидроксифенил)-2-метоксипропионовой кислоты натриевой соли. Следующие модификации используются, как показано в схеме реакции ниже: толуол используют на шаге 3 и способ 2 (пример 3, шаг 4) используют на шаге 4 с 1,1'-карбонилдиимидазолом в этилацетате. ее=98,0%, время удержания=5,59 мин, как определено по данным хиральной ВЭЖХ при следующих условиях: колонка: 4615 см Chiralpak AD-H; элюент: 50:50:0,1 изопропиловый спирт/гептан/трифторуксусная кислота; скорость потока: 0,6 мл/мин; УФ: 270 нм. Масс-ион 400,5 (ES-) и 402,4 (ES+); 1 НЯМР (400 МГц, CDCl3)7,17 (д, J=8,6 Гц, 2 Н), 7,04 (д. J=8,6 Гц, 2 Н), 6,79 (м, 4 Н), 6,61 (шир.д м, 1 Н),4,42 (с, 2 Н), 4,01 (м, 3H), 3,55 (кв, J=6,6 Гц, 2 Н), 3,41 (с, 3H), 3,10 (дд, J=14,2, 4,6 Гц, 1 Н), 2,99 (дд, J=14,2,6,9 Гц, 1 Н), 2,76 (т, J=6,9 Гц, 2 Н), 1,41 (т, J=6,9 Гц, 3H). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение структурной формулы I или его фармацевтически приемлемая соль, сольват, гидрат или стереоизомер, где R1 и R2 независимо друг от друга представляют собой метил или этил. 2. Соединение по п.1, где структурная формула представлена формулой II или его фармацевтически приемлемая соль, сольват, гидрат или стереоизомер, где R1 и R2 независимо друг от друга представляют собой метил или этил. 3. Соединение по п.2, представляющее собой (2S)-3-(4-[2-(4-метоксифенил)этилкарбамоил]метоксифенил)-2-метоксипропионовую кислоту структурной формулы III- 19009023 или ее фармацевтически приемлемую соль, сольват или гидрат. 4. Соединение по п.1, представляющее собой 3-(4-[2-(4-этоксифенил)этилкарбамоил]метоксифенил)-2-метоксипропионовую кислоту структурной формулы IV или ее фармацевтически приемлемую соль, сольват или гидрат. 5. Соединение по п.4, представляющее собой (S)-3-(4-[2-(4-этоксифенил)этилкарбамоил]метокси фенил)-2-метоксипропионовую кислоту структурной формулы V или ее фармацевтически приемлемую соль, сольват или гидрат. 6. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и соединение по любому из пп.1-5 или его фармацевтически приемлемую соль, сольват или гидрат. 7. Фармацевтическая композиция, включающая:(1) соединение по любому из пп.1-5 или его фармацевтически приемлемую соль, сольват, гидрат или стереоизомер,(2) второй терапевтический агент, выбранный из инсулиносенсибилизаторов, производных сульфонилмочевины, бигуанидов, меглитинидов, тиазолидиндионов, ингибиторов -глюкозидазы, стимуляторов секреции инсулина, инсулина, антигиперлипидемических агентов, средств для повышения уровня ЛПВП в плазме, ингибиторов ГМГ-КоА редуктазы, статинов, ингибиторов акрил-КоА:холестеринацилтрансферазы, соединений против ожирения, антигиперхолестеринемических средств, фибратов, витаминов и аспирина (ацетилсалициловой кислоты), и(3) необязательно, фармацевтически приемлемый носитель. 8. Композиция для применения для лечения заболевания или состояния у млекопитающего, выбранного из гипергликемии, дислипидемии, диабета II типа, диабета I типа, гипертриглицеридемии, синдрома X, инсулинорезистентности, сердечной недостаточности, диабетической дислипидемии, гиперлипидемии, гиперхолестеринемии, гипертензии, ожирения, нейрогенной булимии, нервной анорексии, сердечно-сосудистых заболеваний и других заболеваний, составляющей которых является инсулинорезистентность, включающего введение эффективного количества соединения по любому из пп.1-5; и эффективного количества второго терапевтического агента, выбранного из инсулиносенсибилизаторов, производных сульфонилмочевины, бигуанидов, меглитинидов, тиазолидиндионов, ингибиторов -глюкозидазы, стимуляторов секреции инсулина, инсулина, антигиперлипидемических агентов, средств для повышения уровня ЛПВП в плазме, ингибиторов ГМГ-КоА редуктазы, статинов, ингибиторов акрил-КоА:холестеринацилтрансферазы, соединений против ожирения, антигиперхолестеринемических средств, фибратов, витаминов и аспирина (ацетилсалициловой кислоты). 9. Применение соединения по любому из пп.1-5 или его фармацевтически приемлемой соли, сольвата или гидрата для получения лекарственного средства для лечения состояния, модулированного PPAR. 10. Применение соединения по любому из пп.1-5 или его фармацевтически приемлемой соли, сольвата или гидрата для получения лекарственного средства для лечения диабета. 11. Применение соединения по любому из пп.1-5 или его фармацевтически приемлемой соли, сольвата или гидрата для получения лекарственного средства для лечения заболевания, выбранного из гипергликемии, дислипидемии, диабета II типа, диабета I типа, гипертриглицеридемии, синдрома X, инсулинорезистентности, сердечной недостаточности, диабетической дислипидемии, гиперлипидемии, гиперхолестеринемии, гипертензии, ожирения, нейрогенной булимии, нервной анорексии, сердечно-сосудистого заболевания и других заболеваний, составляющей которых является инсулинорезистентность.
МПК / Метки
МПК: C07C 235/20, A61P 3/10, A61K 31/192
Метки: рецептора, селективные, модуляторы, пероксисом, активируемого, пролифератором
Код ссылки
<a href="https://eas.patents.su/21-9023-selektivnye-modulyatory-receptora-aktiviruemogo-proliferatorom-peroksisom.html" rel="bookmark" title="База патентов Евразийского Союза">Селективные модуляторы рецептора, активируемого пролифератором пероксисом</a>
Предыдущий патент: Производные (тио) карбамоилциклогексана в качестве антагонистов d3/d2 рецептора
Следующий патент: Фармацевтическая композиция для чрескожной доставки активного агента (варианты)
Случайный патент: Мусоровоз












